Настоящее изобретение относится к белку (протеину), специфически связывающемуся с EDb-доменом фибронектина.
Фибронектины представляют собой важный класс матриксных гликопротеинов. Их основная роль заключается в обеспечении прилипания клеток к многочисленным различным внеклеточным матриксам. Тот факт, что фибронектины присутствуют на поверхности нетрансформированных клеток в культуре и отсутствуют в трансформированных клетках, позволил идентифицировать фибронектины как имеющие важное значение адгезионные белки. Фибронектины взаимодействуют с большим числом различных других молекул, например с коллагеном, гепаринсульфатпротеогликанами и фибрином, и тем самым регулируют форму клетки и формирование цитоскелета. Кроме того, фибронектины ответственны за миграцию и дифференцировку клеток в процессе эмбриогенеза. Помимо этого фибронектины играют важную роль в процессе заживления ран, обеспечивая перемещение макрофагов и других иммунных клеток в пораженную область, а также в образовании сгустков крови, обеспечивая прилипание тромбоцитов к поврежденным участкам кровеносных сосудов.
Фибронектины представляют собой димеры двух сходных пептидов, при этом длина каждой цепи составляет приблизительно 60-70 нм. В настоящее время идентифицировано по меньшей мере 20 различных фибронектиновых цепей, при этом все они могут быть получены путем альтернативного сплайсинга РНК-транскрипта одного единственного гена фибронектина. Анализ протеолитического расщепления фибронектина позволил установить, что полипептиды состоят из шести характеризующихся большой степенью складчатости доменов, каждый из которых в свою очередь содержит так называемые повторные последовательности ("повторы"), которые на основе сходства их аминокислотных последовательностей можно классифицировать на три типа (тип I, II, III). Центральная область обеих цепей димера представляет собой участок, состоящий из так называемых повторов типа III, которые содержат в среднем по 90 аминокислот (Kornblihtt A.R., Vibe-Pedersen К. и Baralle F.E., Isolation and characterization of cDNA clones for human and bovine fibronectins, Proc. Natl. Acad. Sci. USA, 80 (1983), cc.3218-3222). По результатам структурных исследований было установлено, что каждый повтор типа III состоит из семи бета-цепей, уложенных в двух антипараллельных плоскостях, при этом короткие петлевые области представляют собой потенциальные места взаимодействия типа белок-белок (Leahy D.J., Hendrickson W.A., Aukhil I. и Erickson H.P., Structure of fibronectin type III domain from tenascin phased by MAD analysis of the selenomethionyl protein. Science, 258 (1992), cc.987-991). Благодаря подобным повторам типа III фибронектины выполняют функцию адгезионных молекул, которые взаимодействуют с присутствующими на поверхности клеток молекулами, так называемыми "интегринами". Термин "интегрин" впервые был использован в 1987 г. в обзорной статье (Hynes R.O., Cell 48 (1987), cc.549-550) для обозначения группы родственных гетеродимерных присутствующих на поверхности клеток молекул, которые выполняют функцию посредников между внеклеточным матриксом и внутриклеточным цитоскелетом и таким путем индуцируют адгезию и миграцию клеток. Таким образом, подобные гетеродимерные рецепторы "интегрируют" или передают сигналы от окружающей клетку внешней среды, оказывающие специфические воздействия на клетку. В настоящее время известны 17 бета-субъединиц, которые способны специфически и нековалентно взаимодействовать с более чем 20 альфа-субъединицами, образуя тем самым более 20 различных семейств (Plow E.F. и др., J. Biol. Chem., 275 (2000), cc.21785-21788). Взаимодействие фибронектина по меньшей мере с 8-ю различными интегринами опосредуется прежде всего последовательностью RGDS, присутствующей в десятом повторе типа III фибронектина (III-10). Помимо этого было установлено, что по меньшей мере четыре интегрина могут взаимодействовать с фибронектином независимым от RGDS образом (Plow E.F. и др., J. Biol. Chem., 275 (2000), cc.21785-21788). К группе повторных последовательностей типа III помимо III7-, III8-, III9- и III10-последовательностей относятся также повторы EIIIB и EIIIA (EDb и EDa). Функции обеих этих повторных последовательностей до настоящего времени не выяснены или выявлены лишь в незначительной степени. Результаты исследований, проводившихся Jarnagin W. и др. (Jarnagin W., Rockey D., Koteliansky V., Wang S. и Bissell D., Expression of variant fibronectins in wound healing: cellular source and biological activity of the EIIIA segment in rat hepatic fibrogenesis, J. Cell Biol., 127 (1994), cc.2037-2048), свидетельствуют о том, что EDa-домен участвует в ранней реакции печени на повреждение и помимо этого EDa-домен вероятно участвует в опосредовании процессов клеточной адгезии. Хотя та изоформа фибронектина, которая содержит последовательность EDb (EDb-FN или ED-B или EDB), и не поддается обнаружению в здоровой ткани взрослых индивидуумов, тем не менее она проявляет сильную экспрессию в фетальной ткани, а также в опухолевой ткани, равно как и в процессе заживления ран.
В процессе развития опухоли происходит обусловленное протеолитическим разложением уже существующих компонентов матрикса перестроение внеклеточного матрикса ткани, в которой происходит рост опухоли. При этом образуется индуцируемый опухолью внеклеточный матрикс, который отличается от матрикса здоровых тканей, создает более благоприятную для роста опухоли окружающую среду и способствует ангиогенезу. Ангиогенез представляет собой один из наиважнейших процессов при росте опухоли, и этим понятием обозначается процесс, в ходе которого из существующих, покрытых эндотелием сосудов образуются новые сосуды. Ангиогенез представляет собой инвазивный процесс, необходимыми условиями для протекания которого являются протеолиз внеклеточного матрикса, пролиферация, направленная миграция и дифференцировка эндотелиальных клеток с образованием новых капилляров, способствующих разрастанию опухоли сверх определенных размеров.
В настоящее время была установлена связь между EDb-доменом фибронектина (EDb-FN) и ростом опухоли. Кроме того, EDb-FN накапливается в процессе ангиогенеза в новых кровеносных сосудах, что тем самым является показательным признаком ангиогенеза (Castellani P., Viale G., Dorcaratto A., Nicolo G., Kaczmarek J., Querze G., Zardi L. Int. J. Cancer, 59 (1994), cc.612-618).
EDb-домен представляет собой состоящую из 91 аминокислоты повторную последовательность типа III, которая обладает исключительно высокой степенью гомологии с последовательностями фибронектина крыс и кур, составляющей от 96 до 100%. В этом домене отсутствуют RGDS-последовательности или другие аминокислотные последовательности, в отношении которых известно, что они опосредуют взаимодействие с интегринами. Точная функция ED-B-домена до настоящего времени окончательно не установлена. В трех опубликованных по этой тематике работах, которые указаны ниже, были высказаны предположения об общей стимулирующей функции касательно адгезии/пролиферации различных типов клеток.
В работе Chen и Culp, опубликованной в Exp. Cells Res. 223 (1996), cc.9-19, говорится, что клеточные фибронектины содержат EDb-домен и смежные повторные последовательности типа III в качестве стимулирующих при определенных условиях адгезию последовательностей, которые можно регулировать с помощью клеток путем альтернативного сплайсинга первичного транскрипта фибронектина. По результатам более позднего исследования (Chen и Culp, Clin. Exp. Metast., 16, 1 (1998), cc.30-42) было установлено, что EDb-домен индуцирует сигнал активации клеток, который приводит к фосфорилированию тирозина фокальных адгезионных белков, а именно: по механизму, который отличается от механизма, опосредуемого повторными последовательностями типа III8-9-10, распознающими интегрины. При этом среди все большего числа специалистов преобладает мнение, что адгезия клеток к внеклеточному матриксу, соответственно к другим клеткам, является важным источником сигналов активации клеток и тем самым ответственна за регуляцию многих процессов, таких, например, как рост, дифференцировка и трансформация клеток. Индуцируемая адгезией подача сигнала заключается в активации протеин-тирозинкиназ и включает каскад фосфорилирования тирозина различных сигнальных молекул. Авторы вышеуказанного исследования отмечают тот факт, что в этом процессе передачи сигнала основную роль играет фокальная адгезионная киназа (ФАК) с молекулярной массой 125 кДа, которая позволяет установить связь между взаимодействием клеток с матриксными белками и активацией внутриклеточных сигнальных молекул, таких, например, как Src (Xing Z., Chen H.C., Nowlen J.K., Taylor S.J., Shalloway D. и Guan J.L., Direct interaction of v-Src with the focal adhesion kinase mediated by the Src SH2 domain, Mol. Biol. Cell, 5 (1994), cc.413-21), Grb2 (Schlaepfer D.D., Hanks S.K., Hunter T. и van der Geer P., Integrin-mediated signal transduction linked to Ras pathway by GRB2 binding to focal adhesion kinase, Nature, 372 (1994), cc.786-791) и PI-3-киназа (Chen H.C. и Guan J.L., Association of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase, Proc, Natl. Acad. Sci. USA, 91 (1994), cc.10148-10152). В отношении другого фокального адгезионного белка p130cas также предполагается, что он участвует в опосредуемой адгезией передаче сигналов и специфической онкогенной активности, хотя точная его функция в настоящее время полностью и не выявлена (Sakai R., Iwamatsu A., Hirano N. и др., A novel signaling molecule, p130, forms stable complexes in vivo with v-Crk and c-Src in a tyrosine phosphorylation-dependent manner, EMBO J., 13 (1994), cc.3748-3756; Petch L.A., Bockholt S.M., Bouton A., Parsons J.T. и Burridge K., Adhesion-induced tyrosine phosphorylation of the p130 SRC substrate, J. Cell. Sci., 108 (1995), cc.1371-1379; Polte T.R. и Hanks S.K., Interaction between focal adhesion kinase and Crk-associated tyrosine kinase substrate p 130Cas, Proc. Natl. Acad. Sci USA, 92 (1995), cc.10678-10682).
По результатам исследований, проведенных Chen и Culp (1998, см. выше) было установлено, что имеющий один повтор белок EDb стимулировал пролиферацию клеток Balb/c 3T3, а также фосфорилирование тирозина при участии ФАК более интенсивно, чем смежные повторы III8 и т.д. Было высказано предположение, что при физиологических концентрациях клеточного фибронектина связывание тетрапептида RGDS, входящего в III 10, с интегринами вероятно индуцирует недостаточно интенсивный для клеточной адгезии сигнал, и поэтому механизм, опосредуемый взаимодействием III10 с интегрином, не приводит к реакции фосфорилирования тирозина. Далее предполагается, что различие в реакциях на различным образом опосредуемую различными факторами клеточную адгезию обусловлены различной активацией разнообразных небольших ГТФ-связывающих белков. Три таких белка (cdc42, rac и rho), являющиеся представителями суперсемейства ras, играют важную роль в морфологических изменениях клеток. Ген cdc42 располагается в последовательности против хода транскрипции относительно rac и непосредственно индуцирует образование филоподий (Nobes C.D. и Hall A., Rho, гас, and cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia, Cell, 81 (1995), сс.53-62). В этом случае активация rac ответственна за образование ламеллиподий и сети актиновых филаментов между филоподиями. Расположенный ниже по ходу транскрипции ген rho может активироваться под воздействием rac и индуцирует фокальную адгезию и образование актиновых филаментов. Все эти явления зависят от активации тирозинкиназы, а в отношении ФАК предполагается, что она участвует в этих процессах. В работе Chen и Culp высказано предположение о том, что морфологические различия между клетками, которые обладают адгезией, обусловленной 7-EDb-8, и клетками, которые обладают адгезией, обусловленной 8-9-10, основано на различной активации небольших ГТФ-связывающих белков. Из этого следует, что адгезия, обусловленная 8-9-10, с помощью опосредуемого интегрином пути передачи сигнала в итоге приводит к активации rho, вызывая фокальную адгезию и образование актиновых филаментов, тогда как адгезия клеток линии Balb/c 3T3, обусловленная 7-EDb-8, приводит только к активации cdc42- и rac-белков, но не к активации гена rho. Однако ни в одной из указанных двух работ не приведены данные, подтверждающие указанные выше предположения.
По результатам другого исследования (Hashimoto-Uoshima и др., J. Cell Sci. 110 (1997), сс.2271-2280) было установлено, что клеточная адгезия культивируемых фибробластов усиливается в присутствии фрагментов фибронектина, включающих EDb-домен фибронектина. Из этого следует, что подвергнутый сплайсингу EDb-домен может обладать важной биологической функцией касательно усиления адгезии и пролиферации клеток. В отличие от этого включение EDa-домена в указанные фрагменты в отсутствие EDb-домена препятствует возникновению нормальной фокальной адгезии клеток. На основе этого авторы указанного исследования делают вывод о том, что включение обоих доменов в молекулу фибронектина может представлять собой механизм, благодаря которому адгезия клеток достигает такого уровня, который облегчает процесс их перемещения, для которого необходима как адгезия, так и прекращение адгезии клеток.
Исследования, проведенные на куриных эмбрионах и на взрослых мышах, позволили установить, что опосредуемый EDb-доменом ангиогенез можно блокировать путем ингибирования интегрина α3β1 эндотелиальных клеток (Renato и др., AACR, LB-60 (2001)).
Ни в одном из описанных выше исследований не дается четкий ответ касательно функции EDb-домена и не приведено никаких данных об идентификации возможного(-ых) рецептора(-ов) EDb-домена.
Исходя из вышеизложенного, в основу настоящего изобретения была положена задача дальнейшего выявления функции EDb-домена. Еще одна задача изобретения состояла в идентификации специфического рецептора EDb-домена. Следующая задача изобретения заключалась в выявлении специфического, характерного для EDb механизма адгезии и взаимодействия с рецепторными молекулами, которые могут участвовать в процессе ангиогенеза. Еще одна задача изобретения состояла в выявлении области EDb, ответственной за специфическое связывание.
Указанная задача решается с помощью белка,
а) который обладает способностью специфически связываться с EDb-доменом фибронектина,
б) который специфически экспрессируется или активируется в эндотелиальных клетках,
в) который специфически экспрессируется или активируется в стромальных клетках опухоли,
г) который специфически экспрессируется или активируется в опухолевых клетках,
д) связывание которого с EDb-доменом поддается ингибированию с помощью полипептида и
е) кажущаяся молекулярная масса которого, определенная электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (ПААГ-ДСН-электрофорезом), составляет от 120 до 130 кДа для легкой цепи и от 150 до 160 кДа для тяжелой цепи.
Предпочтительным является прежде всего белок,
а) который обладает способностью специфически связываться с EDb-доменом фибронектина, при этом область связывания характеризуется наличием по меньшей мере одной последовательности, выбранной из группы, включающей SEQ ID NO: 1-3,
б) который специфически экспрессируется или активируется в эндотелиальных клетках,
в) который специфически экспрессируется или активируется в стромальных клетках опухоли,
г) который специфически экспрессируется или активируется в опухолевых клетках,
д) связывание которого с EDb-доменом фибронектина поддается ингибированию с помощью полипептида, который содержит последовательность, выбранную из группы, включающей SEQ ID NO: 1-3, и
е) кажущаяся молекулярная масса которого, определенная путем электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, составляет от 120 до 130 кДа для легкой цепи и от 150 до 160 кДа для тяжелой цепи.
Наиболее предпочтительным является белок,
а) который обладает способностью специфически связываться с EDb-доменом фибронектина и содержит α2β1-цепь интегрина,
б) который специфически экспрессируется или активируется в эндотелиальных клетках,
в) который специфически экспрессируется или активируется в стромальных клетках опухоли,
г) который специфически экспрессируется или активируется в опухолевых клетках,
д) связывание которого с EDb-доменом фибронектина поддается ингибированию с помощью полипептида и который содержит α-цепь интегрина и
е) кажущаяся молекулярная масса которого, определенная путем электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, составляет от 120 до 130 кДа для легкой цепи и от 150 до 160 кДа для тяжелой цепи.
Согласно одному из предпочтительных вариантов эндотелиальные клетки представляют собой пролиферирующие эндотелиальные клетки.
Согласно еще одному предпочтительному варианту стромальные клетки представляют собой стромальные клетки опухоли.
Поставленная в изобретении задача решается также с помощью белка, специфическое связывание которого с EDb-доменом фибронектина опосредует адгезию эндотелиальных клеток, стромальных клеток опухоли и опухолевых клеток. В этом случае область связывания может характеризоваться наличием по меньшей мере одной последовательности, выбранной из группы, включающей SEQ ID NO: 1-3, и прежде всего содержит α2β1-цепь интегрина.
Поставленная в изобретении задача решается далее с помощью белка, специфическое связывание которого с EDb-доменом фибронектина индуцирует пролиферацию эндотелиальных клеток. В этом случае область связывания может характеризоваться наличием по меньшей мере одной последовательности, выбранной из группы, включающей SEQ ID NO: 1-3, и прежде всего содержит α2β1-цепь интегрина.
Поставленная в изобретении задача решается, кроме того, с помощью белка, специфическое связывание которого с EDb-доменом фибронектина индуцирует пролиферацию эндотелиальных клеток в коллагеновом матриксе, их миграцию в коллагеновый матрикс и их дифференцировку в коллагеновом матриксе. В этом случае область связывания может характеризоваться наличием по меньшей мере одной последовательности, выбранной из группы, включающей SEQ ID NO: 1-3, и прежде всего содержит α2β1-цепь интегрина.
Поставленная в изобретении задача решается также с помощью белка, который связывается с EDb-доменом фибронектина и индуцирует специфические пути трансдукции сигнала, при этом индуцируется по меньшей мере один ген, кодирующий белок, выбранный из группы, включающей
- фокальную адгезионную киназу,
- СD6-лиганд (ALCAM),
- α-цепь рецептора витронектина,
- интегрированную альфа-8-субъединицу и
- предшественник родственного фоллистатину белка.
Область связывания в этом случае может характеризоваться наличием по меньшей мере одной последовательности, выбранной из группы, включающей SEQ ID NO: 1-3, и прежде всего содержит α2β1-цепь интегрина.
Предпочтительно, чтобы при индукции специфических путей трансдукции сигнала по меньшей мере один из указанных генов индуцировался по меньшей мере однократно. Предпочтительно при этом, чтобы по меньшей мере один из указанных генов индуцировался дважды.
Поставленная в изобретении задача решается далее с помощью антитела, обладающего способностью связываться с предлагаемым в изобретении белком.
Поставленная в изобретении задача решается, кроме того, с помощью антитела, обладающего способностью связываться с белком, имеющим аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В одном из предпочтительных вариантов антитело обладает способностью ингибировать воздействия, которые являются специфическими для EDb-домена.
Предпочтительно, чтобы такое связывание и ингибирование происходило in vitro и/или in vivo.
Согласно еще одному предпочтительному варианту антитело является моноклональным или рекомбинантным.
В следующем предпочтительном варианте антитело представляет собой scFv-фрагмент.
Поставленная в изобретении задача решается также с помощью клетки, экспрессирующей предлагаемый в изобретении белок.
Помимо этого поставленная в изобретении задача решается с помощью клетки, экспрессирующей предлагаемое в изобретении антитело.
Поставленная в изобретении задача решается далее с помощью фага, экспрессирующего предлагаемое в изобретении антитело.
Поставленная в изобретении задача решается, кроме того, с помощью способа отбора соединений, связывающихся с рецептором EDb-домена фибронектина, заключающегося в том, что сравнивают реакцию клеток в присутствии одного или нескольких указанных соединений с контрольной реакцией этих же клеток в отсутствие этих соединений, при этом такие клетки экспрессируют предлагаемый в изобретении белок или содержат нуклеиновую кислоту, кодирующую этот белок, а реакция, соответственно контрольная реакция опосредуются рецептором EDb-домена фибронектина.
Согласно одному из предпочтительных вариантов реакция, соответственно контрольная реакция представляет собой прилипание клеток к поверхностям, которые покрыты EDb-доменом фибронектина или его фрагментами.
В соответствии еще с одним предпочтительным вариантом область связывания EDb-домена фибронектина содержит последовательности SEQ ID NO: 1-4 или их фрагменты.
Предпочтительно, чтобы реакция, соответственно контрольная реакция клеток представляла собой их пролиферацию на поверхностях, покрытых EDb-доменом фибронектина или его фрагментами.
Согласно еще одному из предпочтительных вариантов реакция, соответственно контрольная реакция клеток представляет собой пролиферацию эндотелиальных клеток в коллагеновом матриксе, их миграцию в коллагеновый матрикс и их дифференцировку в коллагеновом матриксе, при этом такой коллагеновый матрикс содержит EDb-домен фибронектина или его фрагменты.
Соединения в предлагаемом в изобретении способе предпочтительно выбирать из группы, включающей антитела, фрагменты антител, искусственные антитела, пептиды, низкомолекулярные соединения, аптамеры и оптические изомеры.
Согласно еще одному предпочтительному варианту антитела представляют собой рекомбинантные антитела.
Антитела предпочтительно выбирать из группы, включающей scFv и его фрагменты.
Поставленная в изобретении задача решается также с помощью способа отбора соединений, связывающихся с EDb-доменом фибронектина, заключающегося в том, что
а) клетки приводят в контакт в присутствии различных концентраций одного или нескольких соединений с присутствующим в заданной концентрации белком, который содержит EDb-домен фибронектина или белок с одной из представленных в SEQ ID NO: 1-4 последовательностей, и
б) выявляют различия между наблюдаемой в присутствии указанных соединений реакцией клеток на белок, который содержит EDb-домен фибронектина или белок с одной из представленных в SEQ ID NO: 1-4 последовательностей, и наблюдаемой в отсутствие этих соединений контрольной реакцией клеток на белок, который содержит EDb-домен фибронектина или белок с одной из представленных в SEQ ID NO: 1-4 последовательностей, при этом такие клетки экспрессируют предлагаемый в изобретении белок или содержат нуклеиновую кислоту, кодирующую указанный белок, а реакция, соответственно контрольная реакция клеток опосредуется рецептором EDb-домена фибронектина.
При этом предпочтительно, чтобы реакция, соответственно контрольная реакция клеток представляла собой их прилипание к поверхностям, покрытым EDb-доменом фибронектина или его фрагментами.
Моноклональные антитела создавали стандартными методами по технологии гибридом и их характеристики определяли путем иммуногистологического анализа на полученных после глубокого охлаждения срезах человеческой опухоли (см. фиг.13).
Примером является антитело (Ат) AM-EDBr-2 (мышиный IgG 1/каппа).
Согласно одному из предпочтительных вариантов реакция, соответственно контрольная реакция клеток представляет собой их пролиферацию на поверхностях, покрытых EDb-доменом фибронектина или его фрагментами.
Согласно еще одному предпочтительному варианту реакция, соответственно контрольная реакция клеток представляет собой пролиферацию эндотелиальных клеток в коллагеновом матриксе, их миграцию в коллагеновый матрикс и их дифференцировку в коллагеновом матриксе, при этом такой коллагеновый матрикс содержит EDb-домен фибронектина или его фрагменты.
В предлагаемом в изобретении способе соединения предпочтительно выбирать из группы, включающей антитела, искусственные антитела, фрагменты антител, пептиды, низкомолекулярные соединения, аптамеры и оптические изомеры.
Поставленная в изобретении задача решается далее за счет применения нуклеиновой кислоты, кодирующей белок, который содержит последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, для отбора соединений, которые связываются с рецептором EDb-домена фибронектина или с EDb-доменом фибронектина.
Поставленная в изобретении задача решается также за счет применения предлагаемого в изобретении белка, соответственно предлагаемого в изобретении антитела для отбора соединений, которые связываются с рецептором EDb-домена фибронектина или с EDb-доменом фибронектина.
Поставленная в изобретении задача решается помимо этого за счет применения предлагаемой в изобретении клетки для отбора соединений, которые связываются с рецептором EDb-домена фибронектина или EDb-доменом фибронектина.
Поставленная в изобретении задача решается, кроме того, за счет применения нуклеиновой кислоты, кодирующей белок, который содержит последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, для создания антител или слитых scFv-белков, предназначенных для использования в диагностических или терапевтических целях.
Поставленная в изобретении задача решается далее за счет применения предлагаемого в изобретении белка для создания антител или слитых scFv-белков, предназначенных для использования в диагностических или терапевтических целях. Под понятием "использование в терапевтических целях" подразумевается среди прочего направленное против ангиогенеза лечение с использованием соединений, которые ингибируют специфическое взаимодействие между EDb и его рецептором. В данном случае рассматриваются антитела и к рецептору, и к EDb, при этом применяют пептиды с последовательностью SEQ ID NO: 1-3 и их стабилизированные производные, а также низкомолекулярные соединения.
Поставленная в изобретении задача решается также за счет применения предлагаемой в изобретении клетки для создания антител или слитых scFv-белков, предназначенных для использования в диагностических или терапевтических целях.
Поставленная в изобретении задача решается помимо этого за счет применения предлагаемого в изобретении фага для создания антител или слитых scFv-белков, предназначенных для использования в диагностических или терапевтических целях.
Поставленная в изобретении задача решается далее за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, для проангиогенной терапии.
Поставленная в изобретении задача решается также за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, в диагностических целях.
Поставленная в изобретении задача решается также за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, для генной терапии.
Поставленная в изобретении задача решается, кроме того, за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, для покрытия поверхностей, с которыми связываются эндотелиальные клетки.
При этом предпочтительно, чтобы такое покрытие происходило in vitro или in vivo.
Поставленная в изобретении задача решается также за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, в клеточных культурах.
Поставленная в изобретении задача решается далее за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, совместно по меньшей мере с одним трансплантатом.
Подобный трансплантат предпочтительно выбирают из группы, включающей сосуд(-ы), кожу, роговицу, почки, печень, костный мозг, сердце, легкие, костную ткань, тимус, тонкий кишечник, поджелудочную железу, другие внутренние органы, а также их части и клетки.
Поставленная в изобретении задача решается также за счет применения белка, содержащего последовательность, выбранную из группы, включающей SEQ ID NO: 1-4, совместно по меньшей мере с одним имплантатом.
Такой имплантат предпочтительно выбирают из группы, включающей имплантаты легкого, кардиостимуляторы, искусственные сердечные клапаны, имплантаты сосуда, эндопротезы, винты, шины, пластины, проволоки, гвозди, стержни, искусственные суставы, имплантаты молочной железы, искусственные черепные пластинки, искусственные зубы, зубные пломбы и зубные мосты.
Под понятием "воздействия, специфические для EDb-домена фибронектина", подразумеваются все те воздействия, которые обусловлены EDb-доменом фибронектина, но не EIII7, EIII8 и т.д. Одно из таких воздействий описано, например, у Chen и др., 1998 (см. выше), т.е. оно заключается в быстром фосфорилировании тирозина большого числа внутриклеточных белков в отличие от более медленного фосфорилирования при адгезии, опосредуемой доменами EIII8-9-10. Под "низкомолекулярными соединениями" имеются в виду все те соединения, относительная молекулярная масса которых составляет менее приблизительно 1000-1200. Под "аптамерами" подразумеваются состоящие из нуклеиновых кислот молекулы, которые способны выполнять функцию высокоспецифических лигандов для большого числа биомолекул. Под понятием "проангиогенная терапия" имеется в виду любая форма терапии, при которой требуется стимулировать ангиогенез. Под понятием "направленное/направленная против ангиогенеза лечение/терапия" подразумевается любая форма лечения/терапии, целью которого/которой является ингибирование ангиогенеза. Под "генной терапией" подразумевается любая форма терапии, целью которой является выключение обусловленной геном дефектной функции, соответственно восстановление нормальной функции гена при заболеваниях, на которые можно влиять устранением или, наоборот, введением определенного белка. Такая терапия может предусматривать, но не ограничиваясь только этим, введение чужеродной ДНК в соматические клетки. Понятие "клеточная культура" относится к средам для клеточных культур, а также к сосудам для клеточных культур. К таким сосудам для клеточных культур предпочтительно относятся колбы, чашки, лунки и пластины для клеточных культур, титрационные микропланшеты, 96-луночные планшеты, колбы для клеточных культур и биореакторы.
Под понятием "использование в диагностических целях" имеются в виду все цели, которые служат для выявления состояния организма/органа/клетки, соответственно для отнесения фактического состояния организма/органа/клетки к определенной категории состояний (например, к определенному заболеванию), что, например, подразумевает использование (но не ограничиваясь только ими) определенного набора/химических реактивов/измерительного устройства для определения некоторой физической величины, такой как температура и т.д., либо химического параметра, такого как концентрация и т.д.
Под понятием "использование в терапевтических целях" имеются в виду все цели, которые служат для облегчения, соответственно излечения болезненного состояния организма/органа/клетки. Под понятием "применение белка совместно с имплантатом" подразумевается совмещенное либо во времени, либо в пространстве применение. Так, например, белковые молекулы можно иммобилизовать на имплантате и вместе с ним "вживлять" в организм либо их можно вводить в организм пространственно отдельно от имплантата, но одновременно с его "вживлением" (инъекции и т.д.).
Ниже изобретение более подробно рассмотрено на примерах со ссылкой на прилагаемые чертежи, на которых показано:
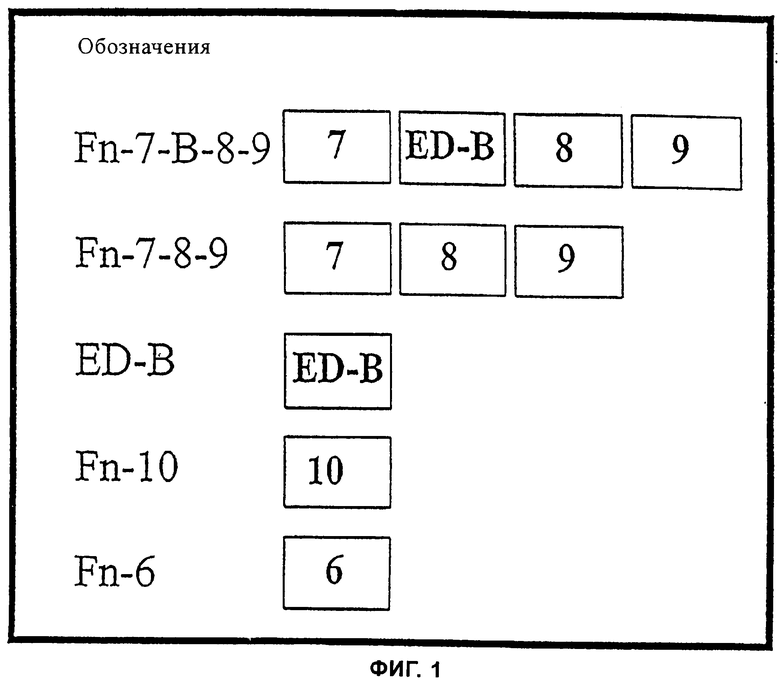
на фиг.1 - схематичное изображение повторяющихся последовательностей типа III, которые использовали при проведении исследований согласно изобретению,
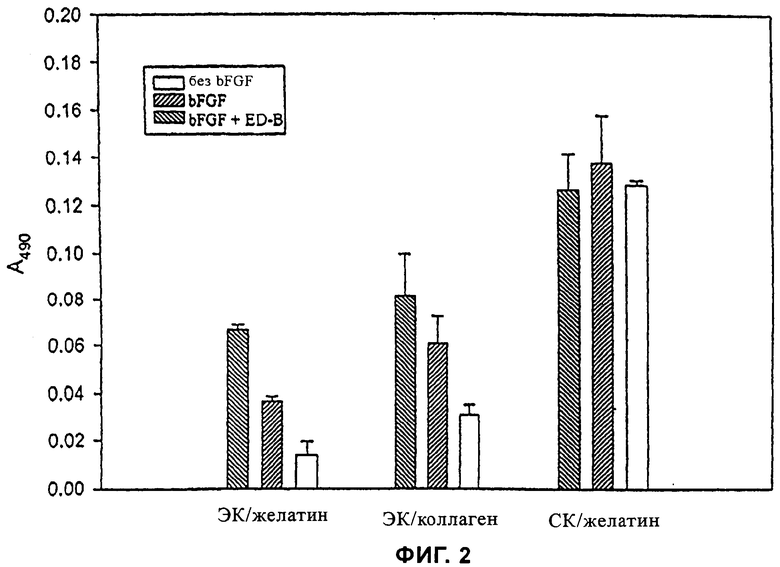
на фиг.2 - результаты анализа пролиферации под влиянием EDb-домена фибронектина (ED-B) на эндотелиальные клетки, соответственно на человеческие стромальные клетки при использовании различных субстратов,
на фиг.3 - результаты теста на разрастание (тест на формирование "трубочек") эндотелиальных клеток под влиянием ED-B,
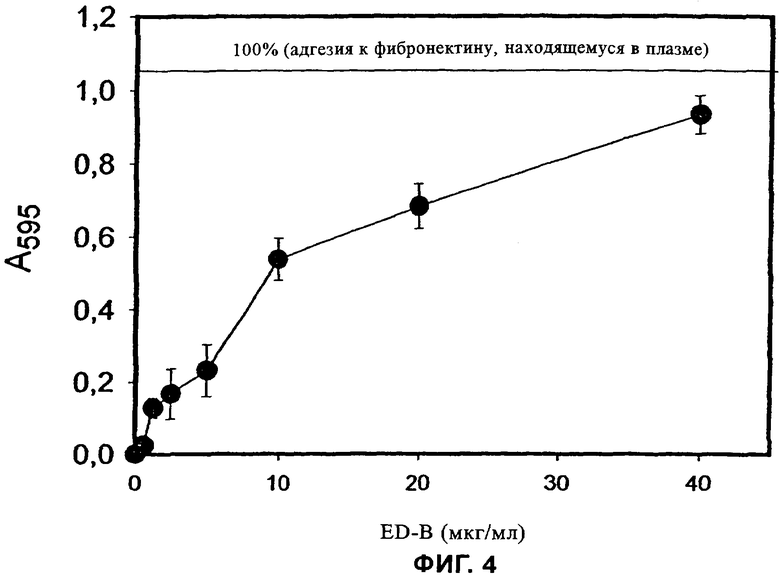
на фиг.4 - результаты теста на прилипание (адгезию), в котором исследовали прилипание эндотелиальных клеток к поверхностям, покрытым ED-B,
на фиг.5 - результаты теста, аналогичного тесту, результаты которого представлены на фиг.4, за исключением того, что клетки подвергали предварительной инкубации с различными синтетическими пептидами, последовательности которых представляли собой частичные последовательности EDb-домена фибронектина,
на фиг.6 - частичные последовательности синтетических пептидов EDb-домена фибронектина, использовавшиеся в тесте, результаты которого представлены на фиг.5,
на фиг.7 - результаты теста по прилипанию эндотелиальных клеток к различным синтетическим ED-B-пептидам,
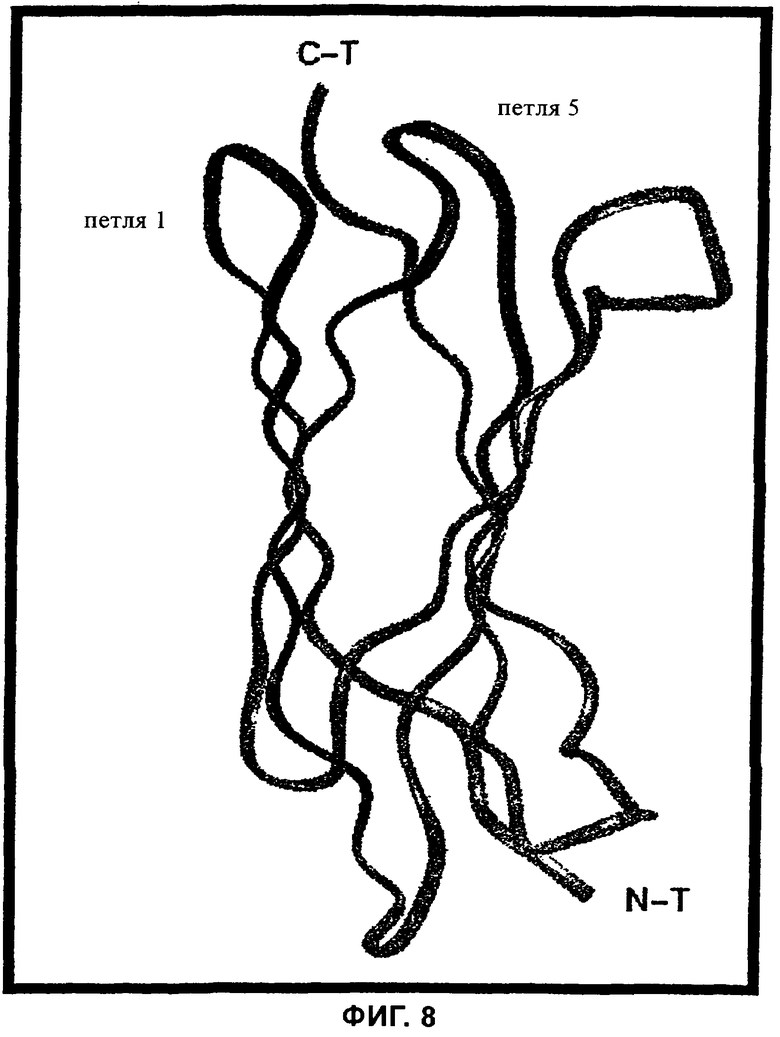
на фиг.8 - расположение синтетических пептидов, указанных на фиг.6-7, на модели структуры основной пептидной цепи ED-B,
на фиг.9 - воздействие EDb-домена фибронектина и расположенного на петле 5 пептида (SEQ ID NO: 2) на формирование капилляроподобных структур, выявленное в тесте на разрастание клеток (тест на формирование "трубочек"),
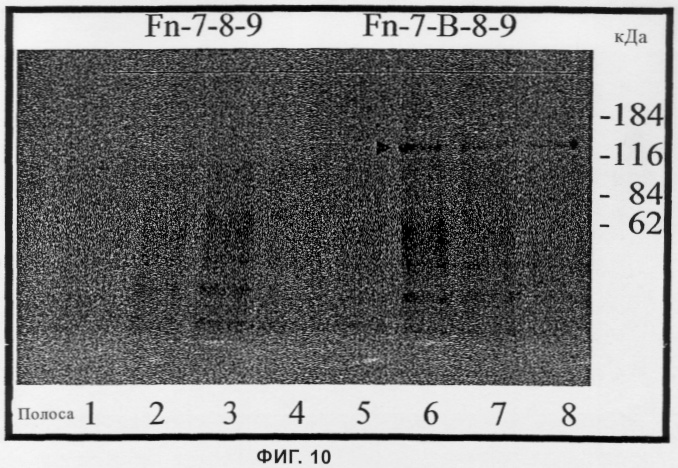
на фиг.10 - результаты двух анализов, проводившихся с помощью аффинной хроматографии с использованием Fn-7-8-9, соответственно Fn-7-B-8-9, которые получены из клеточных лизатов эндотелиальных клеток кожи человека, несущих метку на внешней поверхности,
на фиг.11 - результаты двух анализов, проводившихся с помощью аффинной хроматографии с использованием Fn-7-8-9, соответственно Fn-7-B-8-9, которые получены из клеточных лизатов стромальных клеток кожи человека, несущих метку на внешней поверхности,
на фиг.12 - результаты очистки EDbB-рецептора с помощью аффинной хроматографии и
на фиг.13 - изображения полученных после глубокого охлаждения срезов человеческой опухоли, характеристики которых определяли путем иммуногистологического анализа.
На фиг.1 представлены различные, использованные в проводившемся согласно настоящему изобретению исследовании рекомбинантные фрагменты фибронектина, которые имеют домены различных структур с различными повторными последовательностями типа III. При этом Fn-7-B-8-9 включает домены 7, EDb, 8 и 9, Fn-7-8-9 включает домены 7, 8 и 9, ED-B включает домены EDb, Fn-10 включает домен 10, a Fn-6 включает домен 6 фибронектина. Эти белки экспрессировали в E.coli в виде меченных с помощью His-Tag белков и очищали на никель-хелат-сефарозной колонке. Использованные в этом исследовании числовые обозначения соответствуют тем, которые применяются в научной литературе. При этом каждое из сокращенных обозначений FN-B, ED-B, EDB и EDb относится к EDb-домену фибронектина и их следует рассматривать как синонимичные.
На фиг.2 представлены результаты анализа пролиферации, в котором исследовали воздействие EDb-домена фибронектина (ED-B) на пролиферацию эндотелиальных клеток (ЭК), соответственно стромальных клеток (СК). В каждую лунку 96-луночного планшета вносили по 1000 клеток и инкубировали. В процессе анализа пролиферации в среду добавляли растворимый ED-B (10 мкг/л). Через три дня количество клеток определяли с помощью MTS-анализа. Пролиферацию клеток индуцировали с помощью основного фактора роста фибронектина (bFGF). Было установлено, что ED-B не оказывал никакого воздействия на клетки в отсутствие bFGF, а также не было выявлено никакого воздействия на клетки относящегося к типу III домена 10 фибронектина в присутствии bFGF (данные не приведены). Воздействие ED-B на пролиферацию человеческих эндотелиальных клеток было выявлено для клеток, высеянных на желатин (ЭК/желатин), а также для клеток, высеянных на коллаген (ЭК/коллаген), однако в последнем случае эффект был не столь выраженным, как для клеток, высеянных на желатин. В случае человеческих стромальных клеток, высеянных на желатин (СК/желатин), их пролиферация происходила даже в отсутствие bFGF, а ее уровень заметно превосходил уровень пролиферации человеческих эндотелиальных клеток. Добавление bFGF, соответственно bFGF+ED-B не приводило к увеличению пролиферации. В качестве меры, на основе которой определяли количество клеток, измеряли оптическую плотность при длине волны 490 нм.
Для анализа пролиферации использовали следующий экспериментальный метод.
Материал:
96-луночный планшет (с плоским дном), фирма Nunc.
Среда:
MCDB 131, дополненная пенициллином/стрептомицином (Pen/Strep), амфотерицином (0,25 мкг/мл), гепарином (20 мкг/мл), инактивированным нагреванием ФТС (фетальная телячья сыворотка) (5%).
Методика:
Клетки из расчета 500-1000 клеток на лунку (96-луночные планшеты) в течение 3 дней культивируют в 100 мкл среды с bFGF (1-3 нг/мл) или VEGF (30-50 нг/мл). Точное количество для каждой порции следует определять титрованием: оптимальной является минимальная концентрация, при которой обеспечивается максимальная стимуляция пролиферации. Синхронизация клеток перед экспериментом не требуется, однако допустима. Через 3 дня количество клеток определяют с помощью набора для MTS-анализа (фирма Promega), следуя инструкциям производителя. Для выявления максимального поглощения в линейной области поглощение рекомендуется измерять в несколько моментов времени (через 0, 5, 1, 2, 4 ч).
Контроли:
отрицательный контроль - без митогена (пролиферация отсутствует) (-bFGF/VEGF);
положительный контроль - в присутствии митогена (максимальная стимуляция) (+bFGF/VEGF).
На фиг.3 представлены данные, характеризующие воздействие ED-B на разрастание эндотелиальных клеток из сфероидов. В этом опыте HUVEC-сфероиды (от англ. "Human Umbilical Vein Endothelial Cells", эндотелиальные клетки вены человеческой пуповины) помещали ("внедряли") в коллаген и добавлением 10 мкг/мл bFGF (основной фактор роста фибробластов) индуцировали их разрастание в присутствии 6 мкг/мл ED-B или без него. Было установлено, что добавление только одного bFGF индуцирует разрастание, которое затем дополнительно можно стимулировать добавлением ED-B (+bFGF+ED-B).
В тесте на разрастание (тест на формирование "трубочек") использовали следующий экспериментальный метод.
Материал:
метилцеллюлоза с максимальной вязкостью (фирма Sigma);
трипсин/ЭДТК для клеточной культуры (фирма Gibco);
круглодонные 96-луночные планшеты (фирма Greiner, кат. №650185)
рекомбинантный bFGF (фирма Gibco, кат. №13256-029);
рекомбинантный VEGF (фирма R & D System);
антикрысиный CD31 (фирма RDI, кат. №RDI-CD31TLD);
гепарин (фирма Gibco, кат. №15077-027).
Растворы:
ЗФР/антибиотики: клеточная культура-ЗФР, 10-кратный пенициллин/стрептавидин (Pen/Strep), 2,5 мкг/мл амфотерицина;
1%-ный желатин (фирма Difco), автоклавируют и после охлаждения смешивают с пенициллином/стрептавидином (Pen/Strep) и амфотерицином (0,25 мкг/мл).
Среда:
MCDB 131, глутамин, пенициллин/стрептавидин (Pen/Strep), амфотерицин (0,25 мкг/мл), гепарин (20 мкг/мл), инактивированная нагреванием ФТС (10%).
Среда для роста:
среда с 2 нг/мл bFGF и 10 нг/мл VEGF.
Клетки:
HUVEC;
MVEC кожи (количество пассажей >4).
Методика:
Эндотелиальные клетки отделяют с помощью трипсина/ЭДТК и разбавляют в содержащей 0,24% метилцеллюлозы среде до концентрации 5000 клеток/мл. В каждую лунку планшета Грейнера вносят по 200 мкл (1000 клеток) и инкубируют в течение ночи. Круглые скопления клеток (сфероиды) собирают с помощью 1-миллилитровой пипетки с отрезанным кончиком и отделяют центрифугированием. Сфероиды ресуспендируют в 1,2%-ной смеси метилцеллюлозы в ФТС и смешивают с нейтрализованным коллагеновым гелем. При этом происходит сополимеризация EDb и bFGF.
Представленные на чертеже данные свидетельствуют о том, что при добавлении ED-B разрастание эндотелиальных клеток заметно интенсифицируется и превосходит уровень, индуцируемый bFGF.
На фиг.4 приведены результаты теста на прилипание эндотелиальных клеток к титрационным микропланшетам, покрытым ED-B. В этом опыте эндотелиальные клетки, находившиеся в исходном сосуде для их культивирования, отделяли от их субстрата путем обработки трипсином (трипсин/ЭДТК) и затем инкубировали в титрационных микропланшетах, покрытых ED-B в различных концентрациях (0, 1, 2, 3, 5, 10, 20, 40 мкг/мл), и оставляли на один час для прилипания. В качестве отрицательного контроля использовали лунки, покрытые БСА (бычий сывороточный альбумин) в концентрации 1 мг/мл; из данных, полученных в эксперименте, вычитали уровень адгезии к БСА (<10%).
Степень прилипания количественно оценивали путем окрашивания кристаллическим фиолетовым, после чего вызывали лизис с помощью ДСН. Количественную оценку проводили путем измерения оптической плотности при длине волны 595 нм. Горизонтальная линия, проведенная на графике при значении А595 нм≈1,06, соответствует 100%-ной адгезии к находящемуся в плазме фибронектину.
Результаты этого опыта свидетельствует о том, что прилипание клеток к покрытым ED-B поверхностям обусловлено наличием на поверхности клеток рецептора ED-B-домена.
Для проведения теста на прилипание/адгезию использовали следующий экспериментальный метод.
Растворы:
1%-ный БСА (фирма Sigma, осажденный этанолом);
2%-ный раствор сыворотки в ЗФР (или нейтрализующий трипсин раствор).
Среда:
MCDB 131, пенициллин/стрептавидин (Pen/Strep), амфотерицин (2,5 мкг/мл), гепарин (20 мкг/мл), 0,1%-ный БСА (фирма Sigma, осажденный этанолом);
0,1%-ный кристаллический фиолетовый, 2%-ный глутаровый альдегид в ЗФР, стерилизованный фильтрацией;
2%-ный ДСН.
Методика:
В лунки 96-луночного планшета (фирма Nunc) при 37°С вносят на один час белок. При применении низкомолекулярных белков (<20 кДа) или пептидов рекомендуется давать им высохнуть на планшетах (в течение ночи без крышки в стерильных условиях). После этого лунки в течение 1 ч при 37°С насыщают 1%-ным БСА. Клетки отделяют с помощью однократного трипсина, промывают 2%-ным раствором сыворотки для инактивации трипсина и ресуспендируют в среде. При необходимости протестировать антитела или пептиды клетки предварительно инкубируют с ними в суспензии в течение 30 мин при 37°С. В каждой лунке инкубируют по 104 клеток (используя 96-луночный планшет) в объеме 50-100 мкл в течение 1 ч при 37°С. Надосадочную жидкость осторожно сливают, планшеты для отекания из них остатков жидкости в перевернутом положении устанавливают на 1 мин на бумажное полотенце и затем прилипшие клетки в течение 15 мин окрашивают кристаллическим фиолетовым/глутаровым альдегидом и фиксируют. Лунки трижды промывают ЗФР и затем клетки лизируют добавлением 2%-ного ДСН (в течение 15 мин с использованием шюттль-аппарата). Поглощение измеряют при длине волны 595 нм. При необходимости клетки после их трехкратной промывки водой можно окрашивать повторно.
Контроли:
отрицательный контроль - пустые лунки (БСА-контроль);
положительный контроль - находящийся в плазме фибронектин (2,5 мкг/мл).
Адгезию рассчитывают следующим образом:
% адгезии=A595 (образец): 100×А595 (фибронектин).
На фиг.5 представлены результаты теста, который аналогичен тому, результаты которого представлены на фиг.4, за исключением того, что перед связыванием с покрытыми ED-B титрационными микропланшетами эндотелиальные клетки предварительно инкубировали с различными синтетическими пептидами в концентрации 250 мкМ, последовательность которых представляла собой частичную последовательность EDb-домена фибронектина. Связывание определяли измерением оптической плотности при длине волны 595 нм (А595). Обозначения пептидов, указанные на чертеже, поясняются на фиг.6. При этом пептидная последовательность №043 соответствует последовательности, представленной в SEQ ID NO: 1, пептидная последовательность №553, соответствует последовательности SEQ ID NO: 2, а пептидная последовательность №038 соответствует последовательности SEQ ID NO: 3. Более высокое значение А595 соответствует неингибируемому прилипанию клеток, тогда как более низкое значение А595 соответствует ингибирующему воздействию соответствующего пептида на прилипание.
Исследование проводили по методу, описанному для фиг.4.
На фиг.6 представлены выделенные из полной последовательности EDb-домена фибронектина частичные последовательности синтетических ED-B-пептидов наряду с выбранными для них обозначениями последовательностей. Для обозначения аминокислот используется однобуквенный код.
На фиг.7 представлены результаты теста, который аналогичен тому, результаты которого приведены на фиг.5, за исключением того, что в данном случае лунки титрационных микропланшетов покрывали не EDb-доменом фибронектина, а предварительно инкубировали с пептидами, которые по результатам опыта, представленным на фиг.5, зарекомендовали себя как обладающие, соответственно не обладающие ингибирующей активностью, и таким путем покрывали лунки планшета этими пептидами. При этом по измеренному значению А595 было установлено, что прилипание клеток в этом опыте происходило при покрытии лунок одним из обладающих ингибирующей активностью пептидов, тогда как при использовании пептида, который по результатам опыта, представленным на фиг.5, зарекомендовал себя как не обладающий ингибирующей активностью, прилипания клеток не происходило.
Исследование проводили по методу, описанному для фиг.4.
На фиг.8 представлена модель структуры EDb-домена фибронектина (ED-В), на основе которой можно определить расположение обладающих ингибирующей активностью пептидов №1 (= SEQ ID NO: 1), №2 (= SEQ ID NO: 2) и №3 (=SEQ ID NO: 3). Очевидно, что эти обладающие ингибирующей активностью пептиды расположены на петле 1, соответственно на петле 5 структуры ED-B и тем самым соответствуют тем областям доменов, с помощью которых происходит связывание с клеткой, соответственно с расположенным на клетке рецептором. Представленная на фиг.8 модель структуры ED-B-домена основана на уже выявленной структуре фибронектинового домена 7 типа III. N-T и С-Т обозначают N- и С-конец соответственно.
На фиг.9 представлены результаты опыта, в котором исследовали воздействие, оказываемое в результате добавления ED-B-домена и предварительно идентифицированного как обладающий ингибирующей активностью пептида №2, а также добавления фибронектинового домена 6 типа III на индукцию капилляроподобных структур (формирование "трубочек") в тесте на разрастание. При этом было установлено, что по сравнению с базовым, индуцируемым bFGF уровнем проникновения клеток в коллагеновый гель наибольшее воздействие на это проникновение оказывал ингибирующий прилипание пептид, который имел последовательность SEQ ID NO: 2. Этот пептид оказывал также стимулирующее действие на проникновение эндотелиальных клеток в коллагеновый гель. Таким образом, данный пептид соответствует связывающей области EDb-домена и аналогично самому EDb-домену стимулирует проникновение эндотелиальных клеток в коллаген.
Исследование проводили по методу, описанному для фиг.3.
На фиг.10 представлены результаты аффинной хроматографии лизата меченных на поверхности эндотелиальных клеток кожи человека. С этой целью пролиферирующие, эндотелиальные клетки с обработанной биотином поверхностью лизировали с помощью детергента и подвергали аффинной хроматографии, при которой короткие фрагменты фибронектина, содержащие или не содержащие введенный в них EDb-домен фибронектина, связывали с сефарозой (вариант с EDb-доменом фибронектина обозначен как Fn-7-B-8-9, a вариант без EDb-домена фибронектина обозначен как Fn-7-8-9). По результатам хроматографии было установлено, что биотинилированный белок с кажущейся молекулярной массой 120-130 кДа специфически связывается с содержащим ED-В фрагментом (обозначено стрелкой). Элюирование осуществляли с помощью ЭДТК. При этом собирали несколько фракций, которые описаны ниже. Затем эти фракции подвергали ДСН-ПААГ-электрофорезу и анализировали с помощью вестерн-блоттинга с использованием стрептавидин-пероксидазной и хемилюминисценции (ECL). Полосы 1 и 5 соответствуют предварительно элюированным фракциям, а полосы 2, 3, 4, соответственно 6, 7, 8 соответствуют элюированным фракциям 1, 2 и 3. Полосы 1-4 получены хроматографированием с использованием Fn-7-8-9, а полосы 5-8 получены хроматографированием с использованием Fn-7-B-8-9. Представленные на чертеже результаты хроматографии убедительно свидетельствуют о том, что наиболее выраженная полоса, приходящаяся на молекулярную массу 120-130 кДа, соответствует белку, который специфически связывается с содержащим EDb фрагментом фибронектина и тем самым представляет собой рецептор EDb-домена фибронектина.
Для биотинилирования и лизиса эндотелиальных клеток использовали следующий экспериментальный метод.
Материал:
3-сульфо-N-гидроксисукцинимидный эфир биотинамидогексановой кислоты, фирма Sigma,
ЗФР с/без Mg/Ca (фирма Dulbecco),
буфер HEPES: 20мМ HEPES (2-N-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) с рН 7,6, 1мМ CaCl2, 1мкМ MgCl2, 0,1%-ный NaN3,
1%-ный CHAPS (об./об.) и
входящий в набор Mini-prep фирмы Boehringer полный ингибитор протеазы, не содержащий ЭДТК, коктейль-таблетки.
Методика:
Чашки для культивирования клеток перед биотинилированием и после него каждый раз трижды промывают ЗФР без Ca+Mg. Перед последней промывкой добавляют биотиновый буфер (1 мг на 15 мл ЗФР). В центр каждой чашки медленно с помощью пипетки добавляют буфер в количестве 5 мл (для чашек с площадью дна 225 см2) или 12,5 мл (для чашек с площадью дна 500 см2), что позволяет за счет покачивания чашек из стороны в сторону равномерно распределить по всему их дну внесенный в них материал. Затем содержимое первой чашки обрабатывают половиной от всего объема буфера для лизиса. Этот буфер также с помощью пипетки вносят в центральную часть дна чашки и распределяют по всей его поверхности. После этого клетки соскабливают с помощью соответствующего ножа. Затем все содержимое 1-й чашки для культивирования с помощью пипетки переносят во 2-ю чашку, в которой повторяют весь описанный выше процесс. Из последней чашки все ее содержимое переносят в 50-миллилитровую коническую центрифужную пробирку. Весь описанный выше процесс повторяют во всех чашках для культивирования с использованием второй половины буфера для лизиса (без соскабливания клеток) и конечный объем также переносят в центрифужную пробирку. Далее содержимое 50-миллилитровых конических центрифужных пробирок центрифугируют при комнатной температуре (КТ) в течение 5 мин при 3000 об/мин (настольная лабораторная центрифуга фирмы Heraeus). Лизат собирают с помощью пипетки и в идеальном случае сразу же используют в аффинной хроматографии (при необходимости, однако, его можно также хранить в замороженном состоянии при -80°С).
Для ковалентного связывания белков с сефарозой использовали следующий метод.
Материал:
активированная сефароза СН Sepharose 4B фирмы Pharmacia Biotech, код №17-0490-01,
1 ммоль HCl, 2,2%-ный NaHCO3.
Методика:
HCl охлаждают на ледяной бане, а сефарозе дают нагреться до комнатной температуры. Затем сефарозу промывают 1 ммолем HCl. На 1 мл сефарозы требуется использовать 10 мл HCl. Сефарозе дают осторожно стечь в предварительно охлажденную пробирку, где она затем набухает в течение приблизительно 15 мин (1 г сефарозы соответствует 3 мл набухшей сефарозы). После этого пробирку центрифугируют в течение 1 мин при 800 об/мин. Надосадочную жидкость собирают пипеткой и отбрасывают.
Этот процесс повторяют трижды.
После 3-й промывки вновь добавляют HCl, пробирку встряхивают и центрифугируют в течение 3-5 мин при 800 об/мин. Надосадочную жидкость собирают пипеткой, а полученный после центрифугирования осадок в пробирке растворяют в 20 мл профильтрованной через миллипоровый фильтр воды и переносят в две новые центрифужные пробирки (в каждом случае по одной пробирке используют для 7-EDB-8-9-сефарозы и для 7-8-9-сефарозы, т.е. сефарозы, которая связывается с полипептидом, имеющим повторы III7, EDb, III8 и III9, соответственно III7, III8 и III9). Сразу после этого пробирки вновь центрифугируют и надосадочную жидкость собирают с помощью пипетки, связывая таким путем 1-5 мг белка/мл сефарозы (т.е. 2 мг белка/мл 7-8-9-сефарозы;
2 мг белка/мл 7-EDB-8-9-сефарозы)
Содержимое пробирок перемешивают путем их переворачивания. Затем непрерывно добавляют 2,2%-ный NaHC3 (50 мкл/мл геля). В результате этого происходит нейтрализация остаточного количества HCl. Пробирки переворачивают и их содержимое с максимальной интенсивностью перемешивают в течение 1-5 ч на "качающемся столе".
После этого содержимое пробирок вновь центрифугируют.
Для определения концентрации белка, в которой его необходимо использовать для ковалентного связывания с сефарозой, проводили тест Брэдфорда.
Материал:
маточный раствор БСА в концентрации 2 мг/мл,
реактив Брэдфорда.
Методика:
Раствор БСА наносят на планшет для иммуноанализа (типа Maxi Sorp фирмы Nunc) следующим образом: 5 мкг-4 мкг-3 мкг-2 мкг-1 мкг (объем 80 мкл+20 мкл анализируемого материала).
Предварительное разведение БСА: 5 мкг/50 мкл=0,1 мг/мл.
Маточный раствор с концентрацией 2 мг/мл разбавляют путем разведения в соотношении 1:20 до концентрации 0,1 мг/мл.
Аффинную хроматографию, соответственно элюирование проводили следующим образом.
а) Аффинная хроматография
Материал:
активированная сефароза СН Sepharose 4B фирмы Pharmacia Biotech, код №17-0490-01,
буфер А (20мМ HEPES с рН 7,6, 1мМ CaCl2, 1мМ MgCl2 0,1%-ный NaN3),
буфер Б (буфер А+150мМ NaCl+0,1%-ный CHAPS),
буфер В (буфер А+0,1%-ный CHAPS),
буфер с рН 4 (профильтрованная через миллипоровый фильтр вода+0,1%-ная ледяная уксусная кислота+0,1%-ный CHAPS),
ЭДТК-буфер (буфер А+200мМ ЭДТК с рН 8,5+0,1%-ный CHAPS).
Методика:
Лизат сначала трижды пропускают через колонку.
Под колонкой располагают пробирку для сбора жидкости. Первые 2 мл лизата осторожно с помощью пипетки Эппендорфа переносят на гель. Для других порций лизата используют мерную пипетку. Следует особо обращать внимание на тот факт, что колонка должна занимать строго вертикальное положение. При первом использовании колонки перед рабочим прогоном проводят "холостой прогон" с использованием всех не содержащих белков буферов. Набивку колонки следует использовать максимум 5 раз.
Если используют замороженный лизат (-80°С), то его сначала нагревают с помощью водяной бани и затем центрифугируют (в течение 5 мин при 3000 об/мин).
Однако в любом случае предпочтительно использовать свежеприготовленный, а не замороженный лизат.
Из лизата с помощью пипетки отбирают образец объемом 500 мкл и вносят его в колбу Эппендорфа. Этот образец служит для исследования лизата до и после хроматографии.
При использовании 2-х колонок (одной для 7-8-9-сефарозы, а другой для 7-В-8-9-сефарозы) через каждую из них пропускают по половине от всего объема лизата. Скорость потока через обе колонки должна быть одинаковой. При невозможности соблюсти это условие более "медленную" колонку держат закрытой в течение соответствующего промежутка времени. Оптимальная скорость потока составляет 0,2-0,5 мл/мин.
После трехкратного пропускания лизата через колонку из полученного погона после его перемешивания с помощью пипетки и в этом случае также отбирают образец объемом 500 мкл, который помещают в колбу Эппендорфа для соответствующего исследования лизата до и после хроматографии.
В завершение через колонку пропускают буфер Б и буфер В в объеме, который в каждом случае соответствует 10-кратному объему колонки. На этом процесс промывки завершается.
б) Элюирование
Предварительное элюирование: Через колонку пропускают буфер В с целью установить, остались ли в колонке несмотря на ее промывку какие-либо белки. 500 мкл вышедшей из колонки фракции собирают в колбу Эппендорфа. (При использовании 2-х колонок соответственно собирают 2×500 мкл).
Элюирование с помощью ЭДТК: ЭДТК образует комплекс с ионами Са и Mg. Благодаря этому происходит элюирование белков эндотелиальных клеток, для связывания которых (белков) необходимы Са и Mg. По 4 мл ЭДТК-буфера дважды пропускают через колонку (соответственно через обе колонки) и собирают двумя фракциями (Е1 и Е2/ВЕ1 и ВЕ2) в пробирки "Falcon". Затем содержимое пробирок перемешивают и с помощью пипетки 5000 мкл переносят в одну (соответственно две) колбу(-ы) Эппендорфа.
Элюирование при рН 4: Собственное значение рН буфера составляет 3,7. Вне нейтрального диапазона значений рН (рН 6-8) связывание рецептора с его соответствующим белком можно ингибировать. В этом случае, как и при элюировании с помощью ЭДТК, через колонку также дважды пропускают по 4 мл буфера с рН 4, вышедший из колонки материал собирают двумя фракциями и с помощью пипетки отбирают по 500 мкл каждой из них (4,1 и 4,2/В 4,1 и В 4,2).
В завершение через колонку пропускают буфер А в объеме, соответствующем 3-м объемам колонки, вымывая таким путем из колонки кислоту. Последнюю порцию буфера в объеме, соответствующем объему колонки, оставляют в колонке. Колонку закрывают и помещают на хранение в холодильник.
Фракции объемом по 500 мкл замораживают в колбах Эппендорфа, выдерживая в течение по меньшей мере 15 мин при -80°С, и затем подвергают сублимационной сушке в устройстве типа "Speed vac".
Полученные таким образом фракции, соответственно предварительно элюированные фракции, разделяют с помощью ДСН-ПААГ-электрофореза и анализируют с помощью вестерн-блоттинга в восстановительных условиях.
На фиг.11 представлены результаты эксперимента, который аналогичен эксперименту, результаты которого показаны на фиг.10, за исключением того, что в этом случае использовали не лизированные эндотелиальные клетки, а лизированные стромальные клетки. На фиг.11, где изображены результаты анализа методом вестерн-блоттинга, полосы 1-3 соответствуют продуктам, элюированным из колонки для аффинной хроматографии с использованием Fn-7-8-9, а полосы 4-6 соответствуют продуктам, элюированным из колонки для аффинной хроматографии с использованием Fn-7-B-8-9. Полосы 1 и 4 соответствуют предварительно элюированным фракциям, а полосы 2, 3, соответственно 5, 6 соответствуют фракциям 1 и 2 соответствующих элюированных погонов. У этого клеточного лизата, полученного из человеческих стромальных клеток, отсутствует наиболее выраженная полоса, которая приходится на молекулярную массу 120-130 кДа и которую можно обнаружить на фиг.10.
Рассмотренные в предшествующем описании, в формуле изобретения и представленные на чертежах отличительные особенности изобретения в различных их вариантах могут иметь существенное для осуществления изобретения значение и индивидуально, и в любых их сочетаниях.
На фиг.12 представлены данные для связывающего ED-B-домен белка, который очищали аффинной хроматографией по описанной выше методике и выделяли с помощью градиентного гель-электрофореза в присутствии ДСН (от 4 до 12%). Участки со специфическим накоплением, которым соответствуют двойные полосы (указаны стрелками), вырезали и анализировали с помощью масс-спектроскопии.
В результате секвенирования выделенный белок удалось однозначно идентифицировать как альфа2-бета1-интегрин, в котором доминирующая тяжелая цепь соответствует бета1-, а легкая цепь соответствует альфа2-субъединице.
Полученные результаты свидетельствуют о том, что связывание с EDb-доменом в основном опосредуется бета1-субъединицей интегрина. В зависимости от исследуемого типа клеток другие альфа-субъединицы (например, альфа2) в сочетании с бета1-субъединицами также могут опосредовать связывание с EDB-FN.
На фиг.13 представлены результаты иммуногистологического анализа полученных при глубоком замораживании срезов человеческих опухолей, где используются следующие обозначения:
А: почечно-клеточный рак, стрелками обозначено специфическое окрашивание с помощью At AM-EDBr-2;
Б: увеличенное изображение того же самого препарата;
В: печеночно-клеточный рак;
Г: меланома (в данном случае не обнаружено специфического окрашивания).
Анализ EDB-рецептора
Полосы вырезали из 1D-геля, промывали раствором NH4HCO3 и ацетонитрилом, сушили и для протеолиза белков в геле смешивали с раствором трипсина. Элюированные из геля в раствор для разложения ("переваривания") пептиды концентрировали на μC18-колонках, обессоливали и анализировали с помощью MALDI-масс-спектрометрии (с получением списка с перечнем масс пептидов "переваренного" белка).
На основе выявленных масс пептидов из каждой вырезанной из геля полосы проводили поиск в банке данных. В том случае, если при поиске получали неоднозначные результаты, для отдельного пептида дополнительно измеряли MALDI-PSD-спектры (фрагментные спектры). Эти спектры либо непосредственно использовали для подтверждения предполагаемой пептидной последовательности (интерпретация спектра), либо на основе этого спектра проводили поиск в банке данных.
Исследованные полосы:
Полоса А=полоса 1 из препарата 6
полоса 4 из препарата 5
полоса 6, полученная при элюировании кислотой
Результат: интегрин α2
- см. результаты поиска в банке данных для полосы 4
- спектры, полученные для полос 1 и 6, свидетельствуют о наличии пептидов, дающих одинаковую интенсивность
- PSD-спектр пептида из полосы 1 свидетельствует о том, что частичная последовательность соответствует интегрину α2
Полоса Б= полоса 2 из препарата 6
полоса 5 из препарата 5
полоса 7, полученная при элюировании кислотой
Результат: интегрин β1
- см. результаты поиска в банке данных для полос 5 и 7
- спектр, полученный для полосы 2, свидетельствует о присутствии пептидов, дающих одинаковую интенсивность
- результаты поиска в базе данных с использованием PSD-спектра полосы 2 подтвердили ее соответствие интегрину β 1
БСА
- присутствует во всех трех полосах
- присутствие подтверждено по результатам поиска в базе данных с использованием PSD-спектра и масс многочисленных пептидов.



















Изобретение относится к биотехнологии и может быть использовано в медицине. Клетки приводят в контакт с белком, содержащим EDb-домен фибронектина, в присутствии одного или нескольких химических соединений. В качестве контроля наблюдают реакцию таких же клеток с указанным белком в отсутствие упомянутых соединений. Эспрессия определенного белка или наличие кодирующей этот белок нуклеиновой кислоты в клетках позволяет отобрать соединения, связывающиеся с EDb-доменом фибронектина. 1 табл.
а) клетки приводят в контакт в присутствии различных концентраций одного или нескольких соединений с присутствующим в заданной концентрации белком, который содержит EDb-домен фибронектина, и б) выявляют различия между наблюдаемой в присутствии указанных соединений реакцией клеток на белок, который содержит EDb-домен фибронектина, и наблюдаемой в отсутствие этих соединений контрольной реакцией клеток на белок, который содержит EDb-домен фибронектина,
при этом такие клетки экспрессируют белок с одной из представленных в SEQ ID NO:1-4 последовательностей или с цепью α2β1 интегрина, или содержат нуклеиновую кислоту, кодирующую указанный белок, а реакция, соответственно контрольная реакция, клеток опосредуется рецептором EDb-домена фибронектина.
Приоритет по пунктам:
| JOURNAL OF CELL SCIENCE, vol | |||
| Прибор, автоматически записывающий пройденный путь | 1920 |
|
SU110A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2006-07-20—Публикация
2001-08-30—Подача