ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 61/474,370 (поданной 12 апреля 2011 г.), озаглавленной "COMPOSITIONS AND METHODS FOR TREATING OR PREVENTING AIRWAY OR LUNG TISSUE DISEASES", полное содержание которой включено в настоящее описание путем ссылки.
ЗАЯВЛЕНИЕ О ФИНАНСИРОВАНИИ ИЗ ПРАВИТЕЛЬСТВЕННЫХ ИСТОЧНИКОВ
[002] Описанное изобретение было создано с правительственной поддержкой грантом на Инновационные исследования в малом бизнесе (SBIR), предоставленным компании Moerae Matrix, LLC. Правительство США обладает определенными правами на изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[003] Изобретение относится к областям клеточной и молекулярной биологии, полипептидам и терапевтическим способам применения.
УРОВЕНЬ ТЕХНИКИ
1. Механизмы заживления ран и фиброза
[004] Термин «заживление ран» относится к процессу, посредством которого организм восстанавливает повреждение любых тканей, особенно то, которое вызвано физическими средствами и нарушением целостности.
[005] Реакция в виде заживления ран часто описывается как имеющая три отчетливые фазы - повреждение, воспаление и восстановление. В целом, организм реагирует на повреждение воспалительной реакцией, которая играет ключевую роль в поддержании здоровья и целостности организма. Однако если она протекает не должным образом, то может привести к разрушению ткани.
I фаза: Повреждение
[006] Повреждение, вызванное факторами, включающими без ограничения аутоиммунные или аллергические реакции, вещества в виде твердых частиц, находящиеся в окружающей среде, инфекцию или механическое повреждение, часто приводит к разрушению нормальной архитектуры ткани, инициирующему реакцию заживления. Поврежденные эпителиальные и эндотелиальные клетки должны быть замещены для поддержания, соответственно, барьерной функции и целостности и предотвращения кровопотери. Острое повреждение эндотелиальных клеток ведет к высвобождению воспалительных медиаторов и инициации антифибринолитического каскада свертывания, временно закупоривающего поврежденный сосуд обогащенным тромбоцитами и фибрином сгустком. Например, легочные гомогенаты, эпителиальные клетки или жидкость бронхоальвеолярного лаважа пациентов с идиопатическим легочным фиброзом (IPF) содержат более высокие уровни фактора дифференциации тромбоцитов, связывающего X-блок белка-1, по сравнению с хроническим обструктивным легочным заболеванием (COPD) и контрольными пациентами, свидетельствуя о том, что тромбообразующие реакции непрерывно активируются. Кроме того, тромбин (серинпротеаза, требуемая для превращения фибриногена в фибрин) также легко выявляется внутри легких и внутриальвеолярных пространств при нескольких легочных фиброзных состояниях, дополнительно подтверждая активацию пути свертывания. Тромбин также может непосредственно активировать фибробласты, увеличивая пролиферацию и способствуя дифференциации фибробластов в продуцирующие коллаген миофибробласты. Повреждение эпителия дыхательных путей, в частности, альвеолярных пневмоцитов, может вызвать аналогичный антифибринолитический каскад и привести к интерстициальному отеку, областям острого воспаления и отделению эпителия от основной мембраны.
[007] Вовлечение тромбоцитов, дегрануляция и образование сгустка быстро прогрессируют в фазу сужения сосудов с увеличенной проницаемостью, обеспечивая возможность экстравазации (перемещения лейкоцитов из капилляров в ткани, окружающие их) и прямого вовлечения лейкоцитов в поврежденный участок. Основная мембрана, которая образует внеклеточный матрикс, лежащая под эпителием и эндотелием паренхиматозной ткани, предотвращает непосредственный доступ к поврежденной ткани. Для разрушения этого физического барьера цинк-зависимые эндопептидазы, также называемые матриксными металлопротеиназами (MMP), расщепляют одну или несколько составляющих внеклеточного матрикса, обеспечивая возможность экстравазации клеток в поврежденные участки и из них. В частности, MMP-2 (желатиназа A, коллагеназа типа N) и MMP-9 (желатиназа B, коллагеназа IV типа) расщепляют коллагены типа N и желатин, две важных составляющих основной мембраны. В недавно проведенных исследованиях было обнаружено, что MMP-2 и MMP-9 активируются, демонстрируя, что при фибротических состояниях обычно происходят процессы деструкции и регенерации тканей. Уровни активности MMP регулируются несколькими механизмами, включая транскрипционную регуляцию, проферментную регуляцию и специфические тканевые ингибиторы MMP. Баланс между MMP и различными ингибиторными механизмами может регулировать воспаление и определять точное количество коллагена, откладываемого во время реакции заживления.
[008] Предыдущие исследования с использованием модели аллергического воспаления дыхательных путей и ремоделирования MMP-2-/-, MMP-9-/- и мышей с двойным нокаутом MMP-2-/-MMP-9-/-показали, что MMP-2 и MMP-9 требовались для успешного выхода и клиренса воспалительных клеток из воспалительной ткани и в воздушные пространства. В отсутствие этих MMP, клетки захватывались внутрь паренхимы легких и были неспособны передвигаться в воздушные пространства, что приводило к фатальной асфиксии.
II фаза: Воспаление
[009] После достижения доступа к участку повреждения ткани, градиенты хемокинов вовлекают воспалительные клетки. Нейтрофилы, эозинофилы, лимфоциты и макрофаги наблюдаются в участках острого повреждения с клеточными осколками и зонами некроза, очищаемыми фагоцитами.
[0010] Раннее вовлечение эозинофилов, нейтрофилов, лимфоцитов и макрофагов, обеспечивающее воспалительные цитокины, и хемокины, может способствовать местному накоплению TGF-β (трансформирующего фактора роста бета) и IL-13 (интерлейкина-13). После первоначального повреждения и волны воспалительных клеток, поздняя стадия вовлечения воспалительных клеток может содействовать фагоцитозу, удалению клеточных осколков и борьбе с избыточной клеточной пролиферацией, которые вместе могут способствовать нормальному заживлению. Поздняя стадия воспаления может играть антифибротическую роль и может требоваться для успешного разрешения реакций заживления ран. Например, профиль поздней фазы воспаления, богатой фагоцитарными макрофагами, содействующими клиренсу фибробластов, в дополнение к секретирующим IL-10 T-клеткам, подавляющим местную продукцию хемокинов и TGF-β, может предотвратить избыточную активацию фибробластов.
[0011] Природа повреждения или возбудителя частот определяет характер полученной в результате воспалительной реакции. Например, подобные экзогенным раздражителям связанные с патогеном молекулярные типы (PAMP) распознаются рецепторами распознавания патогенов, такими как толл-подобные рецепторы и NOD-подобные рецепторы (цитоплазматические белки, которые выполняют разнообразные функции в регуляции воспалительных и апоптозных реакций), и влияют на реакцию природных клеток на внедряющиеся патогены. Эндогенные сигналы опасности также могут влиять на местные природные клетки и координировать воспалительный каскад.
[0012] Природа воспалительной реакции оказывает выраженное влияние на резидентные клетки ткани и полученные в результате воспалительные клетки. Сами воспалительные клетки также осуществляют дальнейшее распространение воспаления посредством секреции хемокинов, цитокинов и факторов роста. Многие цитокины вовлечены на всем протяжении заживления ран и фибротической реакции при активации различных групп генов при различных состояниях. Например, хроническое аллергическое заболевание дыхательных путей у пациентов с астмой обычно связано с повышенными профилями связанных с хелперными T-клетками 2 типа (Th2) цитокинов (включая без ограничения интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-13 (IL-13) и интерлейкин-9 (IL-9)), тогда как у пациентов с хроническим обструктивным легочным заболеванием (таким как идиопатический легочный фиброз) чаще проявляются профили провоспалительных цитокинов (включая без ограничения интерлейкин-1альфа (IL-1α), интерлейкин-1 бета (IL-1β), интерлейкин-6 (IL-6), фактор некроза опухоли альфа (TNF-α), трансформирующий фактор роста бета (TGF-β) и тромбоцитарные факторы роста (PDGF)). Было показано, что каждый из этих цитокинов проявляет значительную профибротическую активность, действуя посредством вовлечения, активации и пролиферации фибробластов, макрофагов и миофибробластов.
III фаза: Восстановление и сокращение тканей
[0013] Фаза закрытия заживления ран состоит из координированного клеточной организацией, управляемого образования богатого фибрином (волокнистым белком, который полимеризируется для образования «сетки», которая формирует сгусток по раневому участку) каркаса, сокращения, закрытия и реэпителизации ран. Огромное большинство исследований, выясняющих процессы, вовлеченные в эту фазу репарации ран, инициировались исследованиями дермальных ран и систем in vitro.
[0014] Происходящие из миофибробластов коллагены и гладкомышечный актин (α-SMA) образуют временный внеклеточный матрикс, причем фибронектин, происходящий из макрофагов, тромбоцитов и фибробластов, образует фибриновый каркас. Совместно, эти структуры обычно именуются грануляционными тканями. Первичные фибробласты или альвеолярные макрофаги, выделенные у пациентов с идиопатическим легочным фиброзом, продуцируют значительно больше фибронектина и α-SMA, чем контрольные фибробласты, что указывает на состояние повышенной активации фибробластов. Сообщалось, что у пациентов с IPF, получавших лечение стероидами, были аналогичные повышенные уровни происходящего из макрофагов фибронектина, как у пациентов с IPF без лечения. Таким образом, представляется, что аналогично устойчивой к стероидам опосредованной IL-13 дифференциации фибробластов, происходящий из фибробластов фибронектин также устойчив к лечению стероидами, выявляя еще одну причину того, почему лечение стероидами может быть неэффективным. На основании экспериментальных исследований у животных, представляется, что фибронектин требуется для развития легочного фиброза, поскольку у мышей со специфической делецией дополнительного домена III типа фибронектина (EDA) значительно меньше развивался фиброз после введения блеомицина, по сравнению с их контролями дикого типа.
[0015] В дополнение к фибронектину, временный внеклеточный матрикс состоит из гликопротеинов (таких как PDGF), гликозаминогликанов (таких как гиалуроновая кислота), протеогликанов и эластина. Фактор роста и активированные TGF-β фибробласты мигрируют по сети внеклеточного матрикса и вызывают репарацию раны. Внутри ран кожи, TGF-β также вызывает сократительную реакцию, регулируя ориентацию коллагеновых волокон. Как обсуждалось выше, дифференциация фибробластов в миофибробласты также создает стрессовые волокна и нео-экспрессию α-SMA (гладкомышечного альфа-актина), и оба эти фактора обеспечивают высокую сократительную активность внутри миофибробластов. Прикрепление миофибробластов к внеклеточному матриксу в специализированных участках, называемых «фибронексус» или «сверхзрелые очаговые адгезии», сближает края раны, уменьшая размер повреждения во время фазы сокращения. Степень покрытия внеклеточным матриксом и количество активированных миофибробластов определяет количество осаждаемого коллагена. В связи с этим, баланс между матриксными металллопротеиназами (MMP) и тканевыми ингибиторами металлопротеиназ (TIMP) и коллагенами и коллагеназами варьируется в ходе реакции, смещаясь от просинтеза и увеличенного отложения коллагена к регулируемому балансу без чистого увеличения количества коллагена. Для успешного заживления ран этот баланс частот возникает, когда фибробласты подвергаются апоптозу, воспаление начинает уменьшаться и количество грануляционной ткани идет на убыль, оставляя богатое коллагеном повреждение. Удаление воспалительных клеток, и в частности, α-SMA-положительных миофибробластов, существенно для прекращения отложения коллагена. Представляет интерес, что у пациентов с идиопатическим легочным фиброзом удаление фибробластов может быть отсроченным, при клетках, устойчивых к апоптозным сигналам, несмотря на наблюдение повышенных уровней проапоптозных и передающих сигналы FAS (стимулирующего апоптоз фрагмента) молекул. Эта относительная устойчивость к апоптозу может потенциально лежать в основе этого фибротического заболевания. Однако в нескольких исследованиях также наблюдались повышенные частоты секретирующих коллаген фибробластов и апоптоза эпителиальных клеток при идиопатическом легочном фиброзе, свидетельствуя о том, что еще один баланс требует мониторинга апоптоза фибробластов и пролиферации фибробластов. По данным исследований кожи, реэпителизация раневого участка восстанавливает барьерную функцию и обеспечивает возможность реорганизации инкапсулированных клеток. Несколько моделей in vitro и in vivo, использующих человеческие или крысиные эпителиальные клетки, выращенные на коллагеновой матрице, или трахеальные раны in vivo, использовали для идентификации характерных стадий клеточной миграции, пролиферации и распространения клеток. Быстрая и динамичная подвижность и пролиферация при восстановлении эпителия с краев лишенной эпителия зоны происходят в пределах часов от возникновения раны. Кроме того, скользящие листы эпителиальных клеток могут мигрировать по поврежденной области, содействуя покрытию раны. Было показано, что несколько факторов регулируют реэпителизацию, включая сывороточный трансформирующий фактор роста альфа (TGF-α) и матриксную металлопротеиназу-7 (MMP-7) (которая в свою очередь регулируется TIMP-1).
[0016] Совместно, все факторы, такие как степень воспаления, ангиогенез и количество отложенного внеклеточного матрикса, содействуют развитию в конечном счете фибротического поражения. Таким образом, терапевтическое вмешательство, которое препятствует активации, пролиферации или апоптозу фибробластов, требует глубокого понимания и оценки всех фаз репарации ран. Хотя эти три фазы часто представлены последовательно, во время хронического или повторного повреждения, эти процессы функционируют параллельно, предъявляя требования к регуляторным механизмам (Wilson and Wynn, Mucosal Immunol, 2009, 3(2): 103-121).
2. Фиброз как патология
[0017] Фиброз представляет собой образование или развитие избыточной фиброзной соединительной ткани в органе или ткани, которая образуется как следствие нормального или аномального/реактивного ответа в виде заживления ран, ведущего к образованию рубца. Фиброз характеризуется, например, без ограничения, аберрантным отложением белка внеклеточного матрикса, аберрантной стимуляцией пролиферации фибробластов, аберрантной индукцией дифференциации популяции фибробластов в популяцию миофибробластов, аберрантной стимуляцией прикрепления миофибробластов к внеклеточному матриксу или их комбинацией.
Провоспалительные медиаторы
[0018] Все больше данных свидетельствуют о том, что полипептидные медиаторы, известные как цитокины, включая различные лимфокины и хемокины, представляют собой важные стимулы для отложения коллагена в фиброз. Считают, что цитокины, высвобождаемые резидентными тканевыми клетками и вовлеченными воспалительными клетками, стимулируют пролиферацию фибробластов и увеличенный синтез белков внеклеточного матрикса, включая коллаген. Например, ранним признаком в патогенезе идиопатического легочного фиброза является повреждение альвеолярных эпителиальных и/или капиллярных клеток. Это стимулирует вовлечение в легкие циркулирующих иммунных клеток, таких как моноциты, нейтрофилы, лимфоциты и эозинофилы. Эти эффекторные клетки, вместе с резидентными легочными клетками, такими как макрофаги, альвеолярные эпителиальные и эндотелиальные клетки, затем высвобождают цитокины, которые стимулируют клетки-мишени, обычно, фибробласты, для репликации и синтеза увеличенных количеств коллагена. Разрушение белка внеклеточного матрикса также может ингибироваться, посредством этого способствуя фибротическому процессу (Coker and Laurent, Eur Respir J, 1998,; 11:1218-1221).
[0019] Многочисленные цитокины считали участвующими в патогенезе фиброза, включая без ограничения трансформирующий фактор роста-β (TGF-β), фактор некроза опухоли-α (TNF-α), тромбоцитарный фактор роста (PDGF), инсулиноподобный фактор роста-1 (IGF-1), эндотелин-1 (ET-1) и интерлейкины, интерлейкин-1 (IL-1), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8) и интерлейкин-17 (IL-17). Считают, что лейкоцитарные хемоаттрактанты хемокины, включая экспрессируемый и секретируемый фактор, регулируемый после активации в нормальных T-клетках (RANTES), также играют важную роль. Было обнаружено, что повышенные уровни провоспалительных цитокинов, таких как интерлейкин 8 (IL-8), а также связанные находящиеся ниже по ходу транскрипции молекулы клеточной адгезии (CAM), такие как молекула межклеточной адгезии-1 (ICAM-1) и молекула адгезии сосудистых клеток-1 (VCAM-1), матриксные металлопротеиназы, такие как матриксная металлопротеиназа-7 (MMP-7), и передающие сигналы молекулы, такие как S100 связывающий кальций белок A12 (S100A12, также известный как калгранулин C), в периферической крови связаны со смертностью, выживанием без трансплантации легких и прогрессирования заболевания у пациентов с идиопатическим легочным фиброзом (Richards et al., Am J Respir Crit Care Med, 2012, 185: 67-76).
[0020] Семейство белков TGF-β оказывает мощный стимулирующий эффект на отложение внеклеточного матрикса и в действительности использовалось в конструировании индуцированных моделей фиброза у животных посредством передачи генов. Исследования in vitro показывают, что TGF-β1, секретируемый как латентный предшественник, стимулирует экспрессию гена проколлагена фибробластов и синтез белка. Эти данные свидетельствуют о том, что другие изоформы млекопитающих, TGFβ2 и TGF-β3, также стимулируют синтез коллагена фибробластами легких человека и уменьшают его разрушение in vitro. На моделях легочного фиброза у животных повышенная экспрессия гена TGF-β1 по времени и пространству связана с повышенной экспрессией гена коллагена и отложением белка. Антитела к TGF-β1 уменьшают отложение коллагена при вызванном блеомицином фиброзе у мышей, и человеческая фибротическая легочная ткань проявляет повышенную экспрессию гена TGF-β1 и белка.
[0021] TNF-α может стимулировать репликацию фибробластов и синтез коллагена in vitro, и экспрессия гена TNF-α в легких возрастает после введения мышам блеомицина. Растворимые рецепторы TNF-α уменьшают фиброз легких на мышиных моделях, и легочная сверхэкспрессия TNF-α у трансгенных мышей характеризуется фиброзом легких. У пациентов с IPF или асбестозом (хроническим воспалительным и фибротическим медицинским состоянием, поражающим паренхиматозную ткань легких, вызванным вдыханием и задержкой асбестовых волокон), макрофаги, полученные из жидкости бронхоальвеолярного лаважа, высвобождают увеличенные количества TNF-α, по сравнению с контролем.
[0022] Эндотелин (ET-1) также соответствует критериям профибротического цитокина. Эта молекула способствует пролиферации фибробластов и хемотаксису и стимулирует продукцию проколлагена. Он присутствует в легких пациентов с легочным фиброзом, и недавнее сообщение свидетельствует о том, что антагонист рецепторов ET-1, босентан, облегчает течение легочного фиброза при введении экспериментальным животным.
Неконтролируемая пролиферация/активация миофибробластов и образование фибротических очагов
[0023] В течение длительного времени считалось, что дифференциация фибробластов в миофибробласты является важным явлением при многих состояниях, включая заживление ран и фиброз. Например, сообщалось, что миофибробласты встречаются в зонах активного фиброза и ответственны за продукцию и отложение белков внеклеточного матрикса (ECM) при легочном фиброзе (Liu, T. et al., Am J Respir Cell Mol Biol, 2007, 37:507-517).
[0024] Одна гипотеза этиологии идиопатического легочного фиброза свидетельствует о том, что еще не идентифицированный стимул вызывает повторные эпизоды острого повреждения легких. Заживление ран на этих стадиях повреждения, в конечном счете, ведет к фиброзу с утратой легочной функции. Фибробластные очаги, характерные поражения идиопатического легочного фиброза, представляют собой активную репликацию мезенхимальных клеток и избыточное отложение свежего внеклеточного матрикса. Такие очаги типичны для повреждения альвеолярных эпителиальных клеток, с внутрипросветной экссудацией плазмы и коллапсом дистального воздушного пространства. Медиаторы, обычно связанные с заживлением ран, такие как трансформирующий фактор роста-β1 (TGF-β1) и фактор роста соединительной ткани, также экспрессированы в этих участках. Движущая сила для этого очагового острого легочного повреждения и заживления ран неизвестна.
3. Заболевания или состояния, при которых играет роль фиброз
[0025] Считалось, что фиброз вовлечен в развитие ряда гетерогенных заболеваний или состояний, включая без ограничения интерстициальное легочное заболевание, такое как идиопатический легочный фиброз, острое легочное повреждение (ALI), вызванный излучением фиброз и отторжение трансплантата.
3.1. Идиопатический легочный фиброз (IPF)
[0026] Идиопатический легочный фиброз (IPF, также известный как криптогенный фиброзирующий альвеолит, CFA, или идиопатическая фиброзирующая интерстициальная пневмония) определяется как специфическая форма хронической, прогрессирующей фиброзирующей интерстициальной пневмонии неопределенной этиологии, которая возникает в первую очередь у взрослых людей старшего возраста, ограничивается легкими и связана с рентгенологическим и гистологическим типом обычной интерстициальной пневмонии (UIP) (Raghu G. et al., Am J Respir Crit Care Med., 183(6):788-824, 2011; Thannickal, V. et al., Proc Am Thorac Soc, 3(4):350-356, 2006). Он может характеризоваться аномальным и избыточным отложением фибротической ткани в легочном интерстиции. На изображениях, полученных компьютерной томографией с высоким разрешением (HRCT), UIP характеризуется присутствием ретикулярных затемнений, часто связанных с тракционной бронхоэктазией. По мере прогрессирования IPF, образование ячеистых очагов становится более выраженным (Neininger A. et al., J Biol Chem., 277(5):3065-8, 2002). Тесты легочной функции часто выявляют рестриктивное нарушение и сниженную диффундирующую способность в отношении монооксида углерода (Thomas, T. et al., J Neurochem., 105(5): 2039-52, 2008). По результатам проведенных исследований сообщалось о значительном увеличении высвобождения TNF-α и IL-6 у пациентов с идиопатическим легочным фиброзом (IPF) (Zhang, Y, et al. J. Immunol. 150(9):4188-4196, 1993), которые связывали с уровнем экспрессии IL-1β (Kolb, M., et al., J. Clin. Invest, 107(12): 1529-1536, 2001). Появление симптомов IPF, одышка и кашель, обычно слабо выражены, но постепенно прогрессируют при смерти, наступающей у 70% пациентов в пределах пяти лет после диагностики. Этот мрачный прогноз аналогичен ряду ежегодных случаев смерти, относящихся к раку молочных желез (Raghu G. et al., Am J Respir Crit Care Med., 183(6):788-824, 2011).
[0027] IPF поражает около 130000 пациентов в США, причем во всем мире ежегодно появляются приблизительно 50000 новых пациентов, и число случаев смерти составляет около 40000 (Raghu G. et al., Am J Respir Crit Care Med., 183(6):788-824, 2011). Хотя эти данные значительны, в недавнем исследовании сообщалось о том, что распространенность IPF может быть в 5-10 раз больше, чем считалось ранее, возможно, вследствие увеличивающейся распространенности или улучшенных диагностических возможностей (Thannickal, V. et al., Proc Am Thorac Soc, 3(4):350-356, 2006). Трансплантация легких считается радикальным способом лечения по поводу IPF, но пятилетняя выживаемость после трансплантации легких составляет менее чем 50%. Соответственно, даже трансплантация легких не может считаться «излечением» от IPF. В дополнение к физической и эмоциональной нагрузке на пациента, лечение и уход за пациентами с IPF является крайне дорогим при затратах национального здравоохранения, составляющих примерно 2,8 миллиарда долларов США на каждых 100000 пациентов в год.
[0028] Кроме того, предыдущие исследования свидетельствовали о том, что накладывающиеся воздействия окружающей среды могут быть важны в патогенезе идиопатического легочного фиброза. В большинстве описанных сериях случаев, вплоть до 75% указанных пациентов с идиопатическим легочным фиброзом курят в настоящее время или курили ранее. В крупных эпидемиологических исследованиях курение было значимо связано с идиопатическим легочным фиброзом. Кроме того, многие из воспалительных признаков идиопатического легочного фиброза значительнее связаны со статусом курения, чем с основным заболеванием. Таким образом, курение может быть независимым фактором риска идиопатического легочного фиброза. Сообщалось также, что латентные вирусные инфекции, в частности, инфекции вирусами из семейства вирусов герпеса, связаны с идиопатическим легочным фиброзом.
[0029] Поскольку не существует известного эффективного лечения по поводу IPF, включая трансплантацию легких, то сохраняется крайняя потребность в новых терапевтических средствах. Существуют разнообразные исследуемые в настоящее время терапевтические подходы, включая антифибротические способы лечения, которые могут замедлить или ингибировать способность организма продуцировать рубцовую или фибротическую ткань, и средства, расширяющие легочные сосуды, для увеличения площади ткани для газообмена в легких. Кроме трансплантации легких, возможные способы лечения IPF включали кортикостероиды, азатиоприн, циклофосфамид, антикоагулянты и N-ацетилцистеин (Raghu G. et al., Am J Respir Crit Care Med., 183(6):788-824, 2011). Кроме того, обычно используются способы поддерживающего лечения, такие как кислородная терапия и легочная реабилитация. Однако ни один из них определенно не воздействовал на длительное выживание пациентов с IPF, что дополнительно подчеркивает неудовлетворенную медицинскую потребность в возможных методах лечения при IPF. В качестве примера, несмотря на результаты смешанной клинической программы, производимый компанией InterMune пероральный мелкомолекулярный препарат Esbriet® (пирфенадон), получил регистрацию в Европе и Японии для применения у пациентов с IPF. Таким образом, Esbriet® стал первым медикаментозным средством, специально показанным для лечения IPF; вследствие неоднозначных исходов испытания и побочных эффектов препарата, возможность его применения рассматривается в США со скептицизмом, и он не был утвержден FDA (Федеральное управление США по контролю качества продуктов питания, напитков и лекарственных средств) на основании данных, представленных на то время. Соответственно, в настоящее время проводится 3 фаза крупного клинического испытания для определения его эффективности с целью подтверждения возможности применения нового препарата в США.
[0030] Патогистологически, IPF может быть описан как накопление активированных миофибробластов (или мезенхимальных клеток) в фибробластных очагах (Thannickal, V. et al., Proc Am Thorac Soc, 3(4):350-356, 2006). Нарушенный апоптоз миофибробластов может привести к стойкому и разрегулированному процессу репарации, который достигает кульминации при фиброзе ткани. Есть мнение, что воспаление также играет ключевую роль при IPF, возможно, посредством циклической острой стимуляции фибробластов. Эти данные указывают на потенциальные мишени для терапевтического вмешательства.
3.1.1. Патогенез идиопатического легочного фиброза (IPF)
[0031] Хотя патогенные механизмы полностью не выяснены, принятая в настоящее время система понятий предполагает, что за повреждением альвеолярного эпителия следует выброс провоспалительных и фибропролиферативных медиаторов, которые вызывают ответы, связанные с нормальным восстановлением ткани. По непонятным причинам эти процессы восстановления никогда не разрешаются, и в результате развивается прогрессирующий фиброз. (Selman M, et al., Ann Intern Med, 134(2): 136-151, 2001; Noble, P. and Homer R., Clin Chest Med, 25(4):749-58, 2004; Strieter, R., Chest, 128 (5 Suppl 1):526S-532S, 2005).
3.1.2. Модель вызванного блеомицином легочного фиброза у мышей
[0032] Хотя существует и может использоваться ряд экспериментальных моделей на животных (например, модель аденовирусной трансдукции TGF-β или модель вызванного излучением фиброза), блеомициновая модель является хорошо документированной и наилучшим образом охарактеризованной мышиной моделью, используемой в настоящее время для демонстрации эффективности конкретного лекарственного средства или ингибитора протеинкиназы на поствоспалительной/префибротической/фибропрофилактической стадиях (Vittal, R. et al., J Pharmacol Exp Ther., 321(l):35-44, 2007; Vittal, R. et al., Am J Pathol, 166(2):367-75, 2005; Hecker L. et al., Nat Med., 15(9): 1077-81, 2009).
[0033] Антибиотик блеомицин был первоначально выделен из Streptomyces verticillatus (Umezawa, H. et al., Cancer 20: 891-895, 1967). В последующем было обнаружено, что этот антибиотик эффективен против плоскоклеточных карцином и кожных опухолей (Umezawa, H., Fed Proc, 33: 2296-2302, 1974); однако его применение в качестве антинеопластического средства ограничивалась дозозависимой легочной токсичностью, приводящей к фиброзу (Muggia, F. et al., Cancer Treat Rev, 10: 221-243, 1983). Доставка блеомицина путем интратрахеального введения (в целом, 1,25-4 ЕД/кг, в зависимости от источника) имеет то преимущество, что одна инъекция лекарственного средства вызывает у грызунов повреждение легких и возникающий в результате фиброз (Phan, S. et al., Am Rev Respir Dis 121:501-506, 1980; Snider, G. et al., Am Rev Respir Dis. 117:289-297, 1978; Thrall, R. et al., Am J Pathol, 95: 117-130, 1979). Интратрахеальная подача препарата грызунам приводит к непосредственному первоначальному повреждению альвеолярных эпителиальных клеток. За этим явлением следует развитие нейтрофильного и лимфоцитарного панальвеолита в пределах первой недели (Janick-Buckner, D. et al., Toxicol Appl Pharmacol., 100(3):465-73, 1989). В последующем, альвеолярные воспалительные клетки удаляются, отмечается пролиферация фибробластов и синтезируется внеклеточный матрикс (Schrier D. et al., Am Rev Respir Dis., 127(1):63-6,1983). Развитие фиброза на этой модели может наблюдаться биохимически и гистологически к 14 дню с максимальными реакциями, в целом наблюдаемыми примерно на 21-28 день (Izbicki G. et al., Int J Exp Pathol, 83(3): 111-9, 2002; Phan, S. et al., Chest., 83(5 Suppl):44S-45S, 1983). Однако после 28 дней реакция на блеомицин более разнообразна. Первоначальные сообщения свидетельствуют о том, что интратрахеальная доставка блеомицина может вызвать фиброз, который прогрессирует или продолжается в течение 60-90 дней (Thrall R. et al., Am J Pathol, 95(1): 117-30, 1979; Goldstein R., et al., Am Rev Respir Dis., 120(l):67-73, 1979; Starcher B. et al., Am Rev Respir Dis., 117(2):299-305, 1978); однако другие сообщения демонстрируют самоограничивающуюся реакцию, которая начинает разрешаться после этого периода (Thrall R. et al., Am J Pathol, 95(1): 117-30, 1979; Phan, S. et al., Chest, 83(5 Suppl): 44S-45S, 1983; Lawson W. et al., Am J Pathol 2005;167(5): 1267-1277). Хотя разрешающаяся природа этой модели не имитирует заболевание человека, этот аспект модели предоставляет возможность изучения разрешения фиброза в эти более поздние точки времени.
3.2. Острое повреждение легких (ALI)
[0034] Острое повреждение легких (ALI) и его более тяжелая форма, острый респираторный дистресс синдром (ARDS), представляют собой синдромы острой респираторной недостаточности, которая возникает в результате острого легочного отека и воспаления. ALI/ARDS является причиной острой респираторной недостаточности, которая развивается у пациентов всех возрастов в результате разнообразных клинических расстройств, включая сепсис (легочный и нелегочный), пневмонию (бактериальную, вирусную и грибковую), аспирацию желудочного и ротоглоточного содержимого, тяжелую травму и несколько клинических расстройств, включая тяжелый острый панкреатит, передозировку лекарственных средств и продуктов крови (Ware, L. and Matthay, M., N Engl J Med, 342: 1334-1349, 2000). У многих пациентов требуется вспомогательная искусственная вентиляция легких под положительным давлением. Легочные физиологические аномальные явления представляют собой тяжелую артериальную гипоксемию, а также выраженное увеличение минутной вентиляции, вызванное резким увеличением фракции легочного мертвого пространства. У пациентов с ALI/ARDS развивается богатый белком легочный отек, возникающий в результате экссудации жидкости в интерстициальный и воздушно-пространственный компартменты легких, вызванный повышенной проницаемостью барьера. Дополнительные патологические изменения указывают на то, что механизмы, вовлеченные в отек легких, являются сложными, и что отек представляет собой только одно из патогистологических явлений при ALI/ARDS. Одним физиологическим последствием является значительное уменьшение растяжимости легочной ткани, которое приводит к увеличению рабочей нагрузки при дыхании (Nuckton T. et al., N Engl J Med, 346:1281-1286, 2002), одной из причин потребности во вспомогательной искусственной вентиляции легких у большинства пациентов.
[0035] Предполагалось, что искусственная вентиляция легких (MV), основной способ лечения ALI, потенциально способствует повышению и усугубляет проницаемость созданием механического напряжения различных компонентов дыхательной системы, вызывая связанное с аппаратом искусственной вентиляции легких повреждение легких (VALI) (Fan, E. et al., JAMA, 294:2889-2896, 2005; Maclntyre N., Chest, 128:561S-567, 2005). Недавно проведенное испытание продемонстрировало значительное повышение выживания пациентов, вентилируемых при низком дыхательном объеме (LVT), по сравнению с высоким дыхательным объемом (HVT) (The Acute Respiratory Distress Syndrome N. Ventilation with Lower Tidal Volumes as Compared with Traditional Tidal Volumes for Acute Lung Injury and the Acute Respiratory Distress Syndrome. N Engl J Med; 342:1301-1308, 2000). Кроме искусственной вентиляции легких при более низких дыхательных объемах, которая предположительно создает меньшее механическое напряжение, имеется мало механистических понятий патофизиологии VALI, и нет направленных способов лечения по поводу него.
[0036] Предполагалось, что искусственная вентиляция легких (MV) с высокими дыхательными объемами (HVT) приводит к фосфорилированию p38 MAP (митоген-активируемой протеинкиназы), активации киназы MK2 и фосфорилированию HSPB1, процессу, который вызывает диссоциацию актина от HSPB1, и полимеризацию для образования стрессовых волокон, что, в конечном счете, ведет к околоклеточным разрывам и повышенной сосудистой проницаемости. Кроме того, было показано, что ингибирование p38 MAP киназы или ее находящегося ниже по ходу транскрипции эффектора MK2 предотвращает фосфорилирование HSPB1 и защищает от сосудистой проницаемости, устраняя образования актиновых стрессовых волокон и перестройку цитоскелета, свидетельствуя о том, что нацеленное ингибирование MK2 может быть потенциальной терапевтической стратегией для лечения острого повреждения легких (Damarla, M. et al., PLoS ONE, 4(2): E4600, 2009).
[0037] Кроме того, проведенные исследования свидетельствовали о том, что легочный фиброз может возникать в результате ALI. ALI может полностью разрешаться или прогрессировать в фиброзирующий альвеолит, сопровождающийся стойким низким уровнем кислорода в крови (гипоксемией) и сниженной способностью легких расправляться при каждом вдохе (сниженной легочной растяжимостью). Предполагалось, что хотя вызванный повреждением легочный фиброз отличается от идиопатического легочного фиброза, оба заболевания разделяют общий патоморфологический механизм, т.е. инфильтрацию фибробластов в воздушные пространства легких (Tager et al., Nat. Med. 14: 45-54, 2008; Ley, K. and Zarbock, A., Nat. Med. 14: 20-21; 2008).
3.3. Фиброз, вызванный излучением
[0038] Фиброз представляет собой обычное последствие как лечения рака лучевой терапией, так и случайного облучения. Фибротические повреждения после лучевой терапии были описаны для многих тканях, включая кожу (Bentzen, S. et al., Radiother. Oncol. 15: 261-214, 1989; Brocheriou, C, et al., Br. J. Radiol. Suppl. 19: 101-108, 1986), легкие (Lopez Cardozo, B. et al., Int. J. Radiat. Oncol. Biol. Phys., 11: 907-914, 1985), сердце (Fajardo, L. and Stewart, J., Lab. Invest., 29: 244-257, 1973) и печень (Ingold, J. et al., Am. J. Roentgenol., 93: 200-208, 1965).
[0039] В легких (поздно реагирующей ткани) могут возникать два синдрома радиационной токсичности, радиационный пневмонит и легочный фиброз. Пневмонит проявляется через 2-3 месяца после завершения лучевой терапии. Патоморфологически пневмонит характеризуется интерстициальным отеком, присутствием интерстициальных и альвеолярных воспалительных клеток и увеличением числа пневмоцитов II типа (Gross, N. et al., Radiat. Res., III: 143-50, 1981; Guerry-Force, M. et al., Radiat. Res. 114: 138-53, 1988). При пневмоните первичное поражение ткани вероятнее всего вызвано истощением запасов паренхиматозных клеток (Hendry, J., Radiat. Oncol. Vol. 4,2: 123-132, 1994; Rosiello, R. et al., Am. Rev. Respir. Dis., 148: 1671-1676, 1993; Travis, E. and Terry, N., Front. Radiat. Ther. Oncol, 23: 41-59, 1989).
[0040] Фибротическая реакция характеризуется увеличенным интерстициальным отложением коллагена, утолщением сосудистых стенок и сосудистыми окклюзиями (Vergava, J. et al., Int. J. Radiat. Oncol. Biol. Phys. 2: 723-732, 1987). Гистологические исследования фибротических поражений выявили, что фибротическая ткань содержит инфильтрирующие воспалительные клетки, фибробласты и бόльшие количества различных компонентов внеклеточного матрикса. В фибротических тканях были описаны повышенный синтез и отложение интерстициальных коллагенов, фибронектина и протеогликанов (Maasiha, P. et al., Int. J. Radiat. Oncol. Biol. Phys. 20: 973-980, 1991), и это трактовалось как результат вызванного облучением модулирования системы фибробластов (Remy, J. et al., Radiat. Res. 125: 14- 19, 1991).
[0041] Предполагалось, что вызванный облучением фиброз, в частности, легких, вызван взаимодействием клеточных и молекулярных явлений между несколькими клеточными системами, задействованными в фибротической реакции. Одно излучение способно вызвать преждевременный процесс терминальной дифференциации клеточной системы фибробластов/фиброцитов, приводящий к усиленному накоплению постмиотических фиброцитов, которые характеризуются многократным увеличением синтеза интерстициальных коллагенов. Одновременно, облучение сопутствующих типов паренхиматозных клеток, таких как альвеолярные макрофаги и альвеолярные пневмоциты II типа, вызывает немедленный синтез специфических цитокинов, подобных TGF-β, которые затем изменяют взаимодействие паренхиматозных клеток с фибробластной клеточной системой. TGF-β1, как один из основных цитокинов, ответственных за фибротическую реакцию, вызывает пролиферацию фибробластов посредством распространения клеточных типов предшественников фибробластов, а также преждевременную терминальную дифференциацию предшественников фибробластов в постмитотические фиброциты. Это ведет к накоплению постмитотических фиброцитов вследствие нарушения достаточно сбалансированного соотношения клеточных типов предшественников фибробластов и постмитотических фиброцитов. Предполагалось, что патофизиологическая реакция ткани после облучения вызвана измененным опосредованным цитокинами и факторами роста взаимодействием многоклеточных систем, что приводит к нарушению хорошо сбалансированного соотношения клеточных типов интерстициальных фибробластов/фиброцитарной клеточной системы (Rodemann, H. and Bamberg, M., Radiotherapy and Oncology, 35, 83-90, 1995).
3.4. Отторжение трансплантата
[0042] Трансплантация представляет собой акт переноса клеток, тканей или органов из одного участка в другой. Нарушение функции органной системы может корригироваться трансплантацией органа (например, почки, печени, сердца, легких или поджелудочной железы) от донора. Однако иммунная система остается наиболее труднопреодолимым барьером для трансплантации как обычному медицинскому лечению, и отторжение такого органа часто соответствует фибротическому фенотипу в пересаженном органе. Иммунная система имеет развитые совершенные и эффективные механизмы борьбы с инородными агентами. Эти механизмы также вовлечены в отторжение трансплантированных органов, которые распознаются как чужеродные иммунной системой организма хозяина.
[0043] Степень иммунного ответа на трансплантат частично зависит от степени генетического несоответствия между пересаженным органом и хозяином. Ксенотрансплантаты, которые представляют собой трансплантаты между членами различных видов, имеют наибольшее несоответствие и вызывают максимальный иммунный ответ, подвергаясь быстрому отторжению. Аутотрансплантаты, которые представляют собой трансплантаты из одной части тела в другую (например, кожные трансплантаты), не являются чужеродной тканью, и поэтому не вызывают отторжение. Изотрансплантаты, которые представляют собой трансплантаты между генетически идентичными индивидами (например, монозиготными близнецами), также не подвергаются отторжению.
[0044] Аллотрансплантаты представляют собой трансплантаты между членами одного и того же вида, которые отличаются генетически. Это наиболее распространенная форма трансплантации. Степень, в которой аллотрансплантаты подвергаются отторжению, частично зависит от степени подобия или гистосовместимости между донором и хозяином.
[0045] Степень и тип ответа также варьируются в зависимости от типа трансплантата. Некоторые участки, такие как глаз и мозг, являются иммунологически привилегированными (т.е. они имеют минимальное количество или отсутствующие клетки иммунной системы и могут переносить даже неправильно подобранные трансплантаты). Кожные трансплантаты первоначально не васкуляризированы и поэтому не проявляют отторжение до тех пор, пока ни развивается кровоснабжение. Легкие, сердце, почки и печень представляют собой высокососудистые органы и часто приводят к бурному клеточно-опосредованному ответу у хозяина, требующему применения иммуносуппрессивной терапии.
[0046] Констриктивный бронхиолит (CB), также именуемый у пациентов после трансплантации легких «облитерирующим бронхиолитом», представляет собой воспаление и фиброз, возникающий преимущественно в стенках и прилегающих тканях мембранозных и респираторных бронхиол с итоговым сужением их просветов. CB обнаруживается при разнообразных состояниях, чаще всего в виде осложнения легочной и сердечно-легочной трансплантации (поражая от 34% до 39% пациентов, обычно в первые 2 года после трансплантации) и трансплантации костного мозга, но также при ревматоидном артрите, после вдыхания токсичных агентов, таких как диоксид азота, после приема внутрь определенных лекарственных средств, таких как пеницилламин, и поедания восточноазиатского растения Sauropus androgynous, и в виде редкого осложнения инфекций аденовирусом, гриппом типа A, корью и Mycoplasma pneumoniae у детей. В легочных трансплантатах, CB представляет собой единственный самый важный фактор, в последующем приводящий к смерти. В одном исследовании, общая смертность составила 25%. Однако в то же самое время 87% пациентов, у которых не было симптомов заболевания, и диагноз был установлен только трансбронхиальной биопсией, имелось разрешение или стабилизация течения заболевания. Уменьшения FEV1 (показателя переднеконцевой летучести) относительно исходного уровня можно использовать для клинического подтверждения CB у пациентов после трансплантации; термин синдром облитерирующего бронхиолита используется для обозначения этой клинической дисфункции, и для него была установлена система градации, которая в настоящее время широко используется в литературе. Значимые факторы риска развития CB в трансплантатах легких включают антиген-зависимые и антиген-независимые механизмы. В первую группу входят позднее острое отторжение и ошибочные подборы по HLA (человеческому лейкоцитарному антигену) в очагах A; в последнюю группу входят ишемические/реперфузионные повреждения дыхательных путей, которые возникают в результате хирургического вмешательства при трансплантации и цитомегаловирусной инфекции (Schlesinger C. et al., Curr Opin Pulm. Med., 4(5): 288-93, 1998).
[0047] Механизмы отторжения
[0048] Иммунный ответ на трансплантированный орган состоит и из клеточных (опосредованных лимфоцитами), и из гуморальных (опосредованных антителами) механизмов. Хотя другие типы клеток также вовлечены в процесс, T-клетки играют центральную роль в отторжении трансплантатов. Реакция отторжения состоит из стадии сенсибилизации и эффекторной стадии.
[0049] Стадия сенсибилизации
[0050] На этой стадии CD4 и CD8 T-клетки через T-клеточные рецепторы распознают аллоантигены, экспрессированные на клетках чужеродного трансплантата. Для распознания антигена требуются два сигнала: первый обеспечивается взаимодействием T-клеточного рецептора с антигеном, представленным молекулами MHC (главного комплекса гистосовместимости), второй обеспечивается костимулирующим взаимодействием рецепторов/лигандов на поверхности T-клеток/APC (антигенпрезентирующих клеток). Из многочисленных костимулирующих путей, больше всего было исследовано взаимодействие CD28 на поверхности T-клетки с ее APC поверхностными лигандами, B7-1 или B7-2 (общеизвестными как, соответственно, CD80 или CD86) (Clarkson, M. and Sayegh, M., Transplantation; 80(5): 555-563, 2005). Кроме того, связанный с цитотоксическим T-лимфоцитом антиген-4 (CTLA4) также связывается с этими лигандами и обеспечивает ингибиторный сигнал. Другие костимуляторные молекулы включают CD40 и ее лиганд CD40L (CD154). Обычно спирали молекул MHC образуют связывающую пептиды бороздку, и ее занимают пептиды, происходящие из нормальных клеточных белков. Тимусные или центральные механизмы устойчивости (клональная делеция) и периферические механизмы устойчивости (например, анергия) обеспечивают то, что эти комплексы аутопептидов MHC не распознаются T-клетками, посредством этого предотвращая аутоиммунные ответы.
[0051] Эффекторная стадия
[0052] Аллоантиген-зависимые и независимые факторы вносят вклад в эффекторные механизмы. Первоначально, неиммунологические «реакции на повреждение» (ишемию) вызывают неспецифическую воспалительную реакцию. Вследствие этого, презентация антигенов T-клеткам увеличивается, поскольку стимулируется экспрессия адгезионных молекул, MHC II класса, хемокинов и цитокинов. Это также способствует выделению интактных растворимых молекул MHC, которые могут активировать путь непрямого аллораспознавания. После активации CD4-положительные T-клетки инициируют опосредованные макрофагами реакции гиперчувствительности замедленного типа (DTH) и обеспечивают содействие B-клеткам для продукции антител.
[0053] Различные T-клетки и цитокины T-клеточного происхождения, такие как IL-2 и IFN-γ (интерферон γ), стимулируются на ранних сроках после трансплантации. Позднее экспрессируются β-хемокины, подобные RANTES (регулируемым при активации, нормальным Т-клеточным экспрессированным и секретированным хемокинам), IP-10 и MCP-1, и это способствует интенсивной инфильтрации макрофагами аллотрансплантата. IL-6, TNF-α, индуцируемая синтаза оксида азота (iNOS) и факторы роста также играют роль в этом процессе. Факторы роста, включая TGF-β и эндотелин, вызывают пролиферацию гладких мышц, утолщение интимы, интерстициальный фиброз и, в случае почки, гломерулосклероз.
[0054] Эндотелиальные клетки, активированные цитокинами T-клеточного происхождения и макрофагами, экспрессируют MHC II класса, адгезионные молекулы и костимуляторные молекулы. Они могут представлять антиген и, посредством этого, вовлекают больше T-клеток, усиливая процесс отторжения. CD8-положительные T-клетки опосредуют клеточно-опосредованные реакции цитотоксичности или нанесением «летального удара» или, альтернативно, индукцией апоптоза.
[0055] Кроме того, появляющиеся исследования свидетельствуют о вовлечении фибротических процессов в хроническое отторжение трансплантата. Например, было показано, что хроническое отторжение аллотрансплантата легких опосредуется относительной недостаточностью происходящего из эндотелиальных клеток HIF-1α (индуцируемого гипоксией фактора-1α) аллотрансплантата, ведущей к фибротической перестройке трансплантированного органа (Wilkes, D., J Clin Invest., 121(6): 2155-2157, 2011; Jiang, X. et al., J Clin Invest., 121(6): 2336-2349, 2011).
3.5. Хроническое обструктивное легочное заболевание (COPD)
[0056] Хроническое обструктивное легочное заболевание (COPD) представляет собой коллективное описание для легочных заболеваний, представленных хронической и относительно необратимой дисфункцией в виде ограничения экспираторного воздушного потока вследствие некоторой комбинации хронического обструктивного бронхита, эмфиземы и/или хронической астмы. COPD вызывается набором экологических и генетических факторов риска, включая курение, которое способствует возникновению заболевания.
[0057] Распространенность COPD возрастает во всем мире, и COPD стало четвертой по частоте причиной смерти в США. В США, несмотря на уменьшение курения за последние десятилетия, и распространенность COPD, и смертность, связанная с ним, увеличились, и предполагается продолжение их увеличения еще в течение некоторого числа лет. Кроме того, COPD связано с затратами, и обострения, которые у пациентов с COPD средней или большей тяжести возникают грубо один раз в год, составляют наиболее затратный компонент.
[0058] При COPD обструкция воздушного потока может возникнуть на основе любого из двух очень отличающихся патофизиологических процессов в легких: 1) воспаления паренхимы, приводящего в результате к протеолизу легочной паренхимы и утрате эластичности легочной ткани (эмфиземе); и 2) воспаления, рубцевания и сужения малых дыхательных путей («заболевания малых дыхательных путей»). У отдельного пациента может преобладать один из этих процессов, которые могут регулироваться различными генетическими факторами, хотя обычно сосуществуют оба процесса. В конечном счете, оба эти процесса вызывают одинаковые типы функционального нарушения: сниженный экспираторный поток, перераздувание легких и нарушения газообмена.
[0059] На ранней стадии COPD в легких пациентов с COPD обнаруживаются следующие симптомы: 1) разрывы эпителия воздушных путей, вызванные повреждающими аэрозолями, 2) накопление воспалительных слизистых экссудатов, 3) инфильтрация стенок дыхательных путей воспалительными иммунными клетками, 4) ремодулирование дыхательных путей/утолщение стенки дыхательных путей и занятие пространства просвета, и 5) повышенное сопротивление воздушному потоку. В течение этой ранней стадии, сокращение и гиперреактивность мелких мышц также увеличивают сопротивление, но увеличенное сопротивление снимается бронхолитическими средствами.
[0060] На поздних стадиях, у пациентов с COPD характерно развитие отложения фиброзной соединительной ткани в субэпителиальном и адвентициальном компартментах, окружающих стенки дыхательных путей. Такой перибронхиальный фиброз способствует фиксированной обструкции дыхательных путей ограничением увеличения калибра дыхательных путей, которое возникает при раздувании легких.
3.5.1. Хронический бронхит
[0061] Хронический бронхит определяется как присутствие хронического кашля и продукции мокроты в течение по меньшей мере трех месяцев двух следующих друг за другом лет в отсутствие других заболеваний, установленных в качестве вызывающих продукцию мокроты. При хроническом бронхите, эпидемиологически, бронхиальный эпителий становится хронически воспаленным с гипертрофией продуцирующих слизь желез и увеличенным числом бокаловидных клеток. Реснички также разрушаются, и в значительной степени нарушается эффективность мукоцилиарного эскалатора. Вязкость слизи и продукция слизи увеличиваются, приводя к трудности отхаркивания. Скопление слизи ведет к возрастанию восприимчивости к инфекции.
[0062] Микроскопически, имеется инфильтрация стенок дыхательных путей воспалительными клетками. За воспалением следует рубцевание и ремоделирование, что утолщает стенки, а также приводит к сужению дыхательных путей. По мере прогрессирования хронического бронхита развивается плоскоклеточная метаплазия (аномальное изменение тканевой выстилки внутри дыхательного пути) и фиброз (дальнейшее утолщение и рубцевание стенки дыхательных путей). Последствием этих изменений является ограничение воздушного потока. Повторные инфекции и воспаление с течением времени приводит к необратимому структурному повреждению стенок дыхательных путей и рубцеванию с сужением и деформацией более малых периферических дыхательных путей.
3.5.2. Эмфизема
[0063] Эмфизема, определяемая с точки зрения ее патоморфологических признаков, характеризуется аномальным расширением терминальных воздушных пространств дистальнее концевых бронхиол с разрушением их стенок и потерей эластичности легких. Буллы (пузыри шириной более 1 см) могут развиться в результате перерастяжения, если зоны эмфиземы имеют диаметр больше 1 см. Распределение аномальных воздушных пространств обеспечивает возможность классификации двух основных типов эмфиземы: панацинарная (панлобулярная) эмфизема, которая приводит к растяжению и разрушению всего ацинуса, в частности, нижней половины легких. Центриацинарная (центрилобулярная) эмфизема включает поражение вокруг дыхательных бронхиол, захватывающее верхние доли и верхние части легкого. Кроме того, известно, что определенные формы эмфиземы связаны с фиброзом.
[0064] Деструктивный процесс эмфиземы преимущественно связан с курением. Курение является раздражителем и приводит к неспецифическому воспалению дыхательных путей и альвеол. Известно, что сигареты содержат более 4000 токсических химических веществ, которые воздействуют на баланс между антипротеазой и протеазами внутри легких, вызывая постоянное повреждение. Воспалительные клетки (макрофаги и нейтрофилы) продуцируют протеолитический фермент, известный как эластаза, которая разрушает эластин, важный компонент легочной ткани.
[0065] Альвеолы и воздушные мешочки легких содержат эластическую ткань, которая поддерживает и сохраняет проходимость внутрилегочных дыхательных путей. Разрушение альвеолярных стенок обеспечивает возможность сужения малых дыхательных путей утратой растяжек, которые помогают удерживать дыхательные пути открытыми. Во время нормального вдоха диафрагма сдвигается вниз, тогда как реберный каркас грудной клетки движется кнаружи. И воздух засасывается в легкие создающимся отрицательным давлением. При выдохе, по мере расслабления каркаса грудной клетки и диафрагмы, эластическая тяга легочной паренхимы проталкивает воздух кверху и кнаружи. При разрушении легочной паренхимы, которое приводит к дряблости легких и потере альвеолярных растяжек, малые дыхательные пути спадаются, и происходит захват воздуха, приводящий к перераздуванию легких. Перераздувание уплощает диафрагму, что приводит к менее эффективному сокращению и сниженной альвеолярной эффективности, что в свою очередь ведет к дополнительному захвату воздуха. С течением времени, описанный механизм ведет к тяжелой обструкции дыхательных путей, приводящей к недостаточному выдыханию для обеспечения возможности полного спадения легких перед следующим вдохом.
3.5.3 Хроническая астма
[0066] Астма определяется как хроническое воспалительное состояние дыхательных путей, приводящее к широко распространенной и вариабельной обструкции дыхательных путей, которая обратима спонтанно или при лечении. У некоторых пациентов с хронической астмой заболевание прогрессирует, приводя к необратимой обструкции дыхательных путей, в частности, если не проводится лечение астмы или потому, что она не была диагностирована или лечилась неправильно, или если она имеет особенно тяжелую форму течения. У детей, страдающих астмой, вероятность развития необратимой астмы составляет один из десяти случаев, в то время как риск развития необратимой астмы у лиц, страдающих астмой, начавшейся во взрослом возрасте, составляет один из четырех случаев. В исследованиях также было обнаружено, что и у детей, и у взрослых астма может привести к необратимому нарушению легочной функции, если не проводилось ее соответствующее лечение, в частности, кортикостероидной терапией.
[0067] Воспаление дыхательных путей при астме с течением времени может привести к ремоделированию дыхательных путей посредством увеличения гладкомышечной ткани, разрыва поверхностного эпителии, отложения коллагена и утолщения основной мембраны.
3.6 Другие типы фиброза
[0068] Другие типы фиброза включают без ограничения фиброзно-кистозную дегенерацию поджелудочной железы и легких, постинъекционный фиброз, фиброз эндомиокарда, фиброз средостения, миелофиброз, забрюшинный фиброз и нефрогенный системный фиброз.
[0069] Фиброзно-кистозная дегенерация (CF, муковидоз, муковисцидоз) представляет собой наследственное аутосомальное рецессивное расстройство. Оно представляет собой одно из наиболее распространенных фатальных генетических расстройств в США, поражающее примерно 30000 индивидов, и чаще всего распространено среди европеоидной популяции, встречаясь в одном случае из каждых 3300 живорожденных. Ген, вовлеченный при муковисцидозе, который был идентифицирован в 1989 г., кодирует белок, называемый регулятором трансмембранной проводимости при муковисцидозе (CFTR). CFTR обычно экспрессируется экзокринным эпителием по всему организму и регулирует движение ионов хлорида, ионов бикарбоната и глутатиона в клетки и из клеток. У пациентов с муковисцидозом мутации в гене CFTR ведут к изменениям или полной потере функции белка CFTR, приводя к дефектам осмоляльности, pH и окислительно-восстановительных свойств экзокринных секреций. В легких, CF проявляется присутствием секреции густой слизи, которая окклюдирует дыхательные пути. В других экзокринных органах, таких как потовые железы, CF может не проявляться обструктивным фенотипом, но скорее аномальным солевым составом секреции (следовательно, для выявления пациентов с CF нужно проводить клиническое исследование осмолярности потовой жидкости). Преобладающей причиной заболевания и смерти при муковисцидозе является прогрессирующее легочное заболевание. Считают, что густота слизи при CF, которая блокирует каналы дыхательных путей, вызвана отклонениями от нормы осмоляльности секреций, а также присутствием массивных количеств ДНК, актина, протеаз и проокислительных ферментов, происходящих из субпопуляции воспалительных клеток, называемых нейтрофилами. В действительности, заболевание легких при CF характеризуется ранними, опосредованными гиперактивными нейтрофилами воспалительными реакциями и на вирусные, и на бактериальные патогены. Гипервоспалительный синдром легких при CF имеет несколько лежащих в основе факторов, среди которых сообщалось о дисбалансе между провоспалительными хемокинами, главным образом IL-8, и противовоспалительными цитокинами, главным образом, IL-10, как играющим основную роль. См. Chmiel et al., Clin Rev Allergy Immunol. 3(1):5-27 (2002). По данным исследований, уровни TNF-α, IL-6 и IL-1β были выше в жидкости бронхоальвеолярного лаважа пациентов с муковисцидозом, чем в жидкости бронхоальвеолярного лаважа у здоровых контрольных индивидов (Bondfield, T. L., et al. Am. J. Resp. Crit. Care Med. 152(1):2111-2118, 1995).
[0070] Постинъекционный фиброз (IF) представляет собой осложнение внутримышечной инъекции, часто возникающее в четырехглавой, трехглавой и ягодичной мышцах детей грудного и более старшего возраста, при котором индивиды неспособны производить полное сгибание с участием пораженных мышц. Он обычно протекает безболезненно, но имеет прогрессирующий характер течения. По данным проведенных исследований сообщалось, что гликопротеин остеопонтин (OPN) играет роль в ремоделировании ткани (Liaw, L., et al. J. Clin. Invest, 101(7): 1469-1478, 1998), и что этот провоспалительный медиатор вызывает стимуляцию IL-1β в человеческих моноцитах и сопутствующее усиление продукции TNF-α и IL-6 (Naldini, A., et al., J. Immunol. 177:4267-4270, 2006; Weber, G. F., and Cantor, H. Cytokine Gowth Factor Reviews. 7(3):241-248, 1996).
[0071] Эндомиокардиальное заболевание (гиперэозинофильный синдром (HS)) представляет собой патологический процесс, характеризуемый стойко увеличенным количеством эозинофилов (1500 эозинофилов/мм3) в крови. HS одновременно поражает многие органы. По результатам исследования сообщалось, что IL-1β, IL-6 и TNF-α экспрессированы на высоких уровнях у пациентов с вызванным вирусами миокардитом (Satoh, M., et al., Virchows Archiv. 427(5):503-509, 1996). Симптомы могут включать кардиомиопатию, кожные поражения, тромбоэмболическое заболевание, легочное заболевание, нейропатию, гепатоспленомегалию (одновременное увеличение печени и селезенки), и уменьшенный размер желудочков. Лечение может включать использование кортикостероидов для снижения уровней эозинофилов.
[0072] Фиброз средостения (MF) характеризуется инвазивным, обызвествленным фиброзом, концентрируемым в лимфоузлах, который блокирует крупные сосуды и дыхательные пути. MF представляет собой позднее осложнение гистоплазмоза. По результатам исследований на мышиных моделях сообщалось, что уровни IL-10 и TNF-α значительно повышены (Ebrahimi, B, et al., Am. J. Pathol. 158:2117-2125, 2001).
[0073] Миелофиброз (миелоидная метаплазия, хронический идиопатический миелофиброз, первичный миелофиброз) представляет собой расстройство костного мозга, при котором костный мозг подвергается фиброзу. Миелофиброз ведет к прогрессирующей недостаточности костного мозга. Среднее выживание составляет пять лет, и причины смерти включают инфекцию, кровотечение, органную недостаточность, портальную гипертензию и лейкозную трансформацию. Сообщалось, что уровни TNF-α и IL-6 повышены в экспериментальных моделях вирусного миелофиброза (Bousse-Kerdiles, M., et al., Ann. Hematol. 78:434-444, 1999).
[0074] Забрюшинный фиброз (болезнь Ормонда) представляет собой заболевание, характеризующееся пролиферацией фиброзной ткани в забрюшинном пространстве. Забрюшинное пространство представляет собой компартмент тела, содержащий почки, аорту, почечный тракт и другие структуры. Сообщалось, что IL-1, IL-6 и TNF-α играют ключевые роли в патогенезе забрюшинного фиброза (Demko, T., et al., J. Am. Soc. Nephrol. 8:684-688, 1997). Симптомы забрюшинного фиброза могут включать без ограничения боль в поясничной области, почечную недостаточность, гипертензию и тромбоз глубоких вен.
[0075] Нефрогенный системный фиброз (NSF, нефрогенная фиброзирующая дермопатия) включает фиброз кожи, суставов, глаз и внутренних органов. NSF может быть связан с воздействием гадолиния. У пациентов развиваются большие зоны уплотненной кожи с фибротическими узлами и бляшками. Могут также возникнуть сгибательные контрактуры с сопровождающим ограничением диапазона движений. NSF проявляет пролиферацию дермальных фибробластов и дендритных клеток, утолщенные коллагеновые пучки, увеличенное количество эластических волокон и отложения муцина. Некоторые сообщения свидетельствовали о том, что провоспалительное состояние является предрасполагающим фактором для вызова нефрогенного системного фиброза (Saxena, S., et al, Int. Urol. Nephrol. 40:715-724, 2008), и что уровень TNF-α повышен в экспериментальных моделях нефрогенного системного фиброза (Steger-Hartmann, T., et al., Exper. Tox. Pathol. 61(6): 537-552, 2009).
4. Факторы риска
4.1. Первичные факторы риска
4.1.1. Курение
[0076] Хотя был идентифицирован ряд факторов риска фибротических заболеваний дыхательных путей (некоторые из которых играют роль в их этиологии), курение остается основной и самой важной причиной COPD. Чем больше число выкуренных сигарет, тем выше риск развития фибротических заболеваний дыхательных путей. Подавляющее большинство людей, у которых развиваются фибротические заболевания дыхательных путей, являются курильщиками, и их легочная функция снижается быстрее, чем у некурящих индивидов.
[0077] Самым эффективным вмешательством является прекращение курения, предпочтительно на ранней стадии. У курильщиков, которые бросают курение, утраченная легочная функция не восстановится, но скорость ее снижения может уменьшаться, возвращаясь к таковой у некурящих индивидов. Прекращение курения на ранней стадии улучшает прогноз, независимо от того, сколько попыток требуется для того, чтобы бросить курение. Индивидуальная восприимчивость к развитию фибротических заболеваний дыхательных путей в связи с курением варьируется. Приблизительно у 15% курильщиков разовьется клинически значимое COPD, в то время как приблизительно у 50% никогда не разовьются никакие симптомы. Снижение легочной функции происходит постепенно, и заболевание обычно диагностируется поздно, потому что пациенты могут адаптироваться к симптомам одышки или могут не замечать симптомы. Исследования показали, что в зависимости от числа выкуренных в день сигарет, у 24-47% курильщиков разовьется обструкция дыхательных путей. Подверженность воздействию пассивного курения увеличивает восприимчивость к заболеванию.
4.1.2. Недостаточность альфа-1 антитрипсина
[0078] Это редкое наследственное состояние приводит к полному отсутствию одной из ключевых систем противопротеазной защиты в легких. Это рецессивное расстройство, поражающее одного индивида из популяции численностью 4000 человек. У пациентов с недостаточностью альфа-1 антитрипсина имеется риск развития эмфиземы в раннем возрасте от 20 до 40 лет, и у них часто выявляется четкий семейный анамнез этого заболевания. Пациенты с недостаточностью альфа-1 антитрипсина и эмфиземой наследуют один аномальный ген от каждого родителя; иными словами, родители являются носителями гена. У таких пациентов будет половина нормальных уровней антитрипсина в крови, что может быть достаточно для защиты от развития эмфиземы. Аналогичным образом, все дети пациента с недостаточностью альфа-1 антитрипсина будут носителями одного аномального гена, но не заболеют. Две распространенные формы недостаточности альфа-1 антитрипсина возникают в результате точечных мутаций в гене, который кодирует альфа-1 антитрипсин.
4.2. Связанные факторы риска
4.2.1. Загрязнение окружающей среды
[0079] Существует четкое свидетельство того, что фибротические заболевания дыхательных путей могут усугубляться загрязнением воздуха, но роль загрязнения в этиологии фибротических заболеваний дыхательных путей невелика, по сравнению с ролью курения. Загрязнение воздуха веществом в виде тяжелых частиц, углеродом и диоксидом серы, которые продуцируются сжиганием угля и нефтяных ископаемых топлив, являются важными причинами или кофакторами в развитии фибротических заболеваний дыхательных путей. Они главным образом возникают в результате воздействия эмиссии выхлопных газов транспортных средств, и ответственными за них следует считать фотохимические загрязнители, такие как, в частности, озон. Загрязнение воздуха в помещениях от сжигания топлива, получаемого из биомассы, для готовки пищи и отопления в недостаточно вентилируемых домах, может представлять собой важный фактор риска фибротических заболеваний дыхательных путей, таких как COPD, в развивающихся странах, в частности, у женщин.
4.2.2. Профессиональные факторы
[0080] Некоторые профессии, при которых работники подвергаются воздействию угля, диоксида кремния и катионов, такие как шахтеры, работники текстильной промышленности и цементной промышленности, связаны с повышенным риском фибротических заболеваний дыхательных путей. Подверженность воздействию кадмия, тяжелого металла и сварочных газов была признана как причина эмфиземы с 1950-х годов.
[0081] Многие профессии, связанные с воздействием пыли, более рискованны, чем воздействие газа или дымов, и связаны с развитием хронического бронхита и различных форм обструктивных заболеваний дыхательных путей. Известно, что у сварщиков на верфях и чеканщиков и конопатчиков также имеется повышенный риск развития фибротических заболеваний дыхательных путей, как и у работников строительной промышленности, которые подвержены воздействию цементной пыли.
4.2.3. Респираторные инфекции у детей
[0082] Инфекции органов грудной полости в первый год жизни, такие как пневмония и бронхиолит, могут предрасполагать к развитию COPD в более позднем возрасте. Это может быть результатом неполного развития дыхательной системы при рождении до окончания роста легких в старшем подростковом возрасте. Если развивающиеся легкие повреждаются, то максимальная потенциальная легочная функция не будет достигнута, вызывая симптомы COPD в раннем возрасте.
4.3. Другие факторы риска
[0083] Другие факторы риска, которые могут играть роль в этиологии и/или служат в качестве ранних симптомов фибротических заболеваний дыхательных путей, включают связанный с гиперчувствительностью пневмонит (чаще всего возникающий в результате вдыхания пыли, загрязненной бактериальными, грибковыми или животными продуктами), некоторые типичные заболевания соединительной ткани (такие как ревматоидный артрит, системная красная волчанка (SLE) и склеродермия), другие заболевания, которые поражают соединительную ткань (такие как саркоидоз и грануломатоз Вегенера), инфекции, определенные лекарственные средства (например, амиодарон, блеомицин, бусальфан, метотрексат и нитрофурантоин) и лучевую терапию грудной клетки.
5. Современные и появляющиеся терапевтические подходы к лечению фибротических заболеваний или состояний
[0084] Терапевтические средства, применяемые в настоящее время для лечения фибротических заболеваний, описаны в публикации Datta et al., British Journal of Pharmacology, 163: 141-172, 2011; включенной в настоящее описание путем ссылки. Неограничивающие примеры таких терапевтических средств включают без ограничения очищенные бычьи коллагены V типа (например, IW-001; Immune Works; United Therapeutics), антагонисты рецепторов IL-13 (например, QAX576; Novartis), ингибиторы протеинтирозинкиназы (например, иматиниб (Gleevec®); Craig Daniels/Novartis), антагонисты эндотелиальных рецепторов (например, ACT-064992 (мацитентан); Actelion), антагонисты рецепторов эндотелина двойного действия (например, босентан (траклир®); Actelion), аналоги простациклина (ингаляционный илопрост (например, вентавис®); Actelion), моноклональные антитела к CTGF (например, FG-3019), антагонисты рецепторов эндотелина (A-селективные) (например, амбрисентан (Letairis®), Gilead), AB0024 (Arresto), подобные лизилоксидазе 2 (LOXL2) моноклональные антитела (например, GS-6624 (ранее AB0024); Gilead), ингибиторы c-Jun-N-концевой киназы (JNK) (например, CC-930; Celgene), пирфенидон (например, Esbriet® (InterMune), Pirespa® (Shionogi)), IFN-γ1b (например, Actimmune®; InterMune), пан-нейтрализующие IgG4 человеческие антитела против всех трех изоформ TGF-β (например, GC1008; Genzyme), ингибиторы активации TGF-β (например, стромедикс (STX-100)), рекомбинантный человеческий белок пентраксин-2 (rhPTX-2) (например, PRM151; промедиор), биспецифические антитела IL4/IL13 (например, SAR156597; Sanofi), гуманизированные моноклональные антитела, нацеленные на интегрин αvβ6 (BIBF 1120; Boehringer Ingelheim), N-ацетилцистеин (Zambon SpA), силденафил (Viagra®;), антагонисты TNF (например, этанерцепт (Enbrel®); Pfizer), глюкокортикоиды (например, преднизон, будезонид, мометазон фуроат, флутиказон пропионат и флутиказон фуроат), бронхолитические средства (например, модификаторы лейкотриена (например, монтелукаст (SINGUAIR®)), антихолинергические бронхолитики (например, ипратропий бромид и тиотропий), β2-агонисты короткого действия (например, изоэтарин месилат (Bronkometer®), адреналин, сальбутанол/альбутерол и тербуталин), длительно действующие β2-агонисты (например, сальметерол, формотерол, индекатерол (Onbrez®) и комбинированные бронхолитики, включая без ограничения SYMBICORT® (содержащий и будезонид, и формотерол), кортикостероиды (например, преднизон, будезонид, мометазон фуроат), метилированный ксантин и его производные (например, кофеин, аминофиллин, IBMX (изобутилметилксантин), параксантин, пентоксифиллин, теобромин и теофиллин), ингибиторы эластазы нейтрофилов (например, ONO-5046, MR-889, L-694,458, CE-1037, GW-311616 и TEI-8362 и ингибиторы переходного состояния, такие как ONO-6818, AE-3763, FK-706, ICI-200,880, ZD-0892 и ZD-8321), ингибиторы фосфодиэстеразы (например, рофиумиласт (DAXAS®; Daliresp®) и циломиласт (Ariflo®, SB-207499)).
5.1. Киназы и фосфорилирование
[0085] Киназы представляют собой повсеместно распространенную группу ферментов, которые катализируют реакцию переноса фосфорила от донора фосфата (обычно аденозин-5'-трифосфата (АТФ)) к субстрату рецептора. Хотя все киназы катализируют по существу одну и ту же реакцию переноса фосфорила, они проявляют выраженное разнообразие субстратной специфичности, структуры и путей, в которых они принимают участие. Последняя классификация всех доступных киназных последовательностей (приблизительно 60000 последовательностей) указывает на то, что киназы могут быть сгруппированы в 25 семейств гомологичных (что значит происходящих из общего предшественника) белков. Эти семейства киназ формируются в 12 групп укладки на основании подобия структурной укладки. Кроме того, 22 из 25 семейств (приблизительно 98,8% всех последовательностей) относятся к 10 группам укладки, для которых известна структурная укладка. Из других 3 семейств, полифосфаткиназа образует отдельную группу укладки, и 2 остающихся семейства представляют собой и интегральные мембранные киназы, и содержат группу окончательной укладки цепи. Эти группы укладки не только включают некоторые из наиболее широко распространенных укладок белковых цепей, таких как укладка, подобная укладке Россманна (три или более параллельных β нитей, связанных двумя спиралями в топологическом порядке β-α-β-α-β), укладка, подобная ферредоксину (общая α+β укладка белка с сигнатурой βαββαβ вторичной структурой вдоль ее основной цепи), укладка TIM-бочонка (означающая сохранившуюся укладку белка, состоящую из восьми α-спиралей и восьми параллельных β-нитей, которые чередуются вдоль пептидной основной цепи), и антипараллельную укладку типа α-бочонка (бета-бочонок представляет собой крупный бета-листок, который извивается и скручивается в спираль для образования закрытой структуры, в которой первая нить связана водородом с последней), но также все основные классы (полностью α, полностью β, α+β, α/β) белковых структур. Внутри группы укладки, ядро связывающего нуклеотид домена каждого семейства имеет одинаковую архитектуру, и топология ядра белка или идентична, или связана с круговой пермутацией. Гомология между семействами внутри группы укладки не предполагается.
[0086] Киназы I группы (23124 последовательности) включают протеин S/T-Y киназу, атипичную протеинкиназу, липидную киназу и ферменты захвата АТФ и дополнительно включают протеин S/T-Y киназу, семейство атипичных протеинкиназ (22074 последовательности). Эти киназы включают: холинкиназу (EC 2.7.1.32); протеинкиназу (EC 2.7.137); киназу фосфорилазу (EC 2.7.1.38); гомосеринкиназу (EC 2.7.1.39); I-фосфатидилинозитол-4-киназу (EC 2.7.1.67); стрептомицин-6-киназу (EC 2.7.1.72); этаноламинкиназу (EC 2.7.1.82); стрептомицин-3'-киназу (EC 2.7.1.87); канамицинкиназу (EC 2.7.1.95); 5-метилтиорибоза киназу (EC 2.7.1.100); виомицинкиназу (EC 2.7.1.103); [гидроксиметилглутарил-CoA редуктазу (NADPH2)] киназу (EC 2.7.1.109); протеинтирозинкиназу (EC 2.7.1.112); [изоцитратдегидрогеназу (NADP+)] киназу (EC 2.7.1.116); киназу легкой цепи миозина (EC 2.7.1.117); гигромицин-B киназу (EC 2.7.1.119); кальций/кальмодулин-зависимую протеинкиназу (EC 2.7.1.123); родопсинкиназу (EC 2.7.1.125); киназу[бета-адренергических рецепторов] (EC 2.7.1.126); киназу тяжелой цепи миозина (EC 2.7.1.129); киназу тау белка (EC 2.7.1.135); макролид-2'-киназу (EC 2.7.1.136); I-фосфатидилинозитол-3-киназу (EC 2.7.1.137); киназу субъединицы [РНК-полимеразы] (EC 2.7.1.141); фосфатидилинозитол-4,5-бисфосфат-3-киназу (EC 2.7.1.153); и фосфатидилинозитол-4-фосфат-3-киназу (EC 2.7.1.154). I группа дополнительно включает семейство липидных киназ (321 последовательность). Эти киназы включают: I-фосфатидилинозитол-4-фосфат-5-киназу (EC 2.7.1.68); I D-мио-инозитол-трифосфат-3-киназу (EC 2.7.1.127); инозитол-тетракисфосфат-5-киназу (EC 2.7.1.140); I-фосфатидилинозитол-5-фосфат-4-киназу (EC 2.7.1.149); I-фосфатидилинозитол-3-фосфат-5-киназу (EC 2.7.1.150); мультикиназу инозитолполифосфата (EC 2.7.1.151) и инозитол-гексакисфосфат-киназу (EC 2.7.4.21). I группа дополнительно включает киназы захвата АТФ (729 последовательностей), которые включают инозитол-тетракисфосфат-I-киназу (EC 2.7.1.134); пируват, фосфатдикиназу (EC 2.7.9.1) и пируват, водную дикиназу (EC 2.7.9.2).
[0087] Киназы II группы (17071 последовательность) включают киназы цепей укладки, подобной укладке Россманна. II группа включает семейство киназ P-петли (7732 последовательности). Они включают глюконокиназу (EC 2.7.1.12); фосфорибулокиназу (EC 2.7.1.19); тимидинкиназу (EC 2.7.1.21); рибозилникотинамидкиназу (EC 2.7.1.22); дефосфо-CoA-киназу (EC 2.7.1.24); аденилилсульфаткиназу (EC 2.7.1.25); пантотенаткиназу (EC 2.7.1.33); протеинкиназу (бактериальную) (EC 2.7.1.37); уридинкиназу (EC 2.7.1.48); шикиматкиназу (EC 2.7.1.71); деоксицитидинкиназу (EC 2.7.1.74); деоксиадензинкиназу (EC 2.7.1.76); полинуклеотид-5'-гидроксилкиназу (EC 2.7.1.78); 6-фосфофрукто-2-киназу (EC 2.7.1.105); деоксигуанозинкиназу (EC 2.7.1.113); тетраацилдисахарид-4'-киназу (EC 2.7.1.130); деоксинуклеозидкиназу (EC 2.7.1.145); аденозилкобинамидкиназу (EC 2.7.1.156); полифосфаткиназу (EC 2.7.4.1); фосфомевалонаткиназу (EC 2.7.4.2); аденилаткиназу (EC 2.7.4.3); нуклеозидфосфаткиназу (EC 2.7.4.4); гуанилаткиназу (EC 2.7.4.8); тимидилаткиназу (EC 2.7.4.9); нуклеозид-трифосфат-аденилаткиназу (EC 2.7.4.10); (деокси)нуклеозидфосфаткиназу (EC 2.7.4.13); цитидилаткиназу (EC 2.7.4.14) и уридилаткиназу (EC 2.7.4.22). II группа дополнительно включает семейство фосфоенолпируваткарбоксикиназы (815 последовательностей). Эти ферменты включают протеинкиназу (HPr киназу/фосфатазу) (EC 2.7.1.37); фосфоенолпируваткарбоксикиназу (GTP) (EC 4.1.1.32) и фосфоенолпируваткарбоксикиназу (АТФ) (EC 4.1.1.49). II группа дополнительно включает семейство фосфоглицераткиназ (1351 последовательность). Эти ферменты включают фосфоглицераткиназу (EC 2.7.2.3) и фосфоглицераткиназу (GTP) (EC 2.7.2.10). II группа дополнительно включает семейство аспартокиназ (2171 последовательность). Эти ферменты включают карбаматкиназу (EC 2.7.2.2); аспартаткиназу (EC 2.7.2.4); ацетилглутаматкиназу (EC 2.7.2.8 1); глутамат-5-киназу (EC 2.7.2.1) и уридилаткиназу (EC 2.7.4.). II группа дополнительно включает семейство киназ, подобных фосфофруктокиназам (1998 последовательностей). Эти ферменты включают 6-фосфофруктокиназу (EC 2.7.1.1 1); NAD (+) киназу (EC 2.7.1.23); 1-фосфофруктокиназу (EC 2.7.1.56); дифосфат-фруктоза-6-фосфат-1-фосфотрансферазу (EC 2.7.1.90); сфинганинкиназу (EC 2.7.1.91); диацилглицеролкиназу (EC 2.7.1.107) и церамидкиназу (EC 2.7.1.138). II группа дополнительно включает семейство, подобное рибокиназам (2722 последовательности). Эти ферменты включают: глюкокиназу (EC 2.7.1.2); кетогексокиназу (EC 2.7.1.3); фруктокиназу (EC 2.7.1.4); 6-фосфофруктокиназу (EC 2.7.1. 11); рибокиназу (EC 2.7.1.15); аденозинкиназу (EC 2.7.1.20); пиридоксалкиназу (EC 2.7.1.35); 2-дегидро-3-деоксиглюконокиназу (EC 2.7.1.45); гидроксиметилпиримидинкиназу (EC 2.7.1.49); гидроксиэтилтиазолкиназу (EC 2.7.1.50); 1-фосфофруктокиназу (EC 2.7.1.56); инозинкиназу (EC 2.7.1.73); 5-дегидро-2-деоксиглюконокиназу (EC 2.7.1.92); тагатоза-6-фосфаткиназу (EC 2.7.1.144); АДФ-зависимую фосфофруктокиназу (EC 2.7.1.146); АДФ-зависимую глюкокиназу (EC 2.7.1.147) и фосфометилпиримидинкиназу (EC 2.7.4.7). II группа дополнительно включает семейство тиаминпирофосфокиназ (175 последовательностей), которое включает тиаминпирофосфокиназу (EC 2.7.6.2). II группа дополнительно включает семейство глицераткиназ (107 последовательностей), которое включает глицераткиназу (EC 2.7.1.31).
[0088] III группа киназ (10973 последовательности) включает киназы ферредоксин-подобной укладки. III группа дополнительно включает семейство нуклеозиддифосфаткиназ (923 последовательности). Эти ферменты включают нуклеозиддифосфат-киназу (EC 2.7.4.6). III группа дополнительно включает семейство HPPK-киназ (609 последовательностей). Эти ферменты включают 2-амино-4-гидрокси-6-гидроксиметилдигидроптеридин-пирофосфокиназу (EC 2.7.6.3). III группа дополнительно включает семейство гуанидокиназ (324 последовательности). Эти ферменты включают гуанидоацетат-киназу (EC 2.7.3.1); креатинкиназу (EC 2.7.3.2); аргининкиназу (EC 2.7.3.3) и ломбрицинкиназу (EC 2.7.3.5). III группа дополнительно включает семейство гистидинкиназ (9117 последовательностей). Эти ферменты включают протеинкиназу (гистидинкиназу) (EC 2.7.1.37); [пируватдегидрогеназу (липоамид)] киназу (EC 2.7.1.99) и [3-метил-2-оксибутаноат дегидрогеназу (липоамид)] киназу (EC 2.7.1.115).
[0089] IV группа киназ (2768 последовательностей) включает киназы, подобные рибонуклеазе H. Эти ферменты включают гексокиназу (EC 2.7.1.1); глюкокиназу (EC 2.7.1.2); фруктокиназу (EC 2.7.1.4); рамнулокиназу (EC 2.7.1.5); маннокиназу (EC 2.7.1.7); глюкокиназу (EC 2.7.1.12); L-рибулокиназу (EC 2.7.1.16); ксилулокиназу (EC 2.7.1.17); эритриолкиназу (EC 2.7.1.27); глицеролкиназу (EC 2.7.1.30); пантотенат-киназу (EC 2.7.1.33); D-рибулокиназу (EC 2.7.1.47); L-фуколокиназу (EC 2.7.1.51); L-ксилулокиназу (EC 2.7.1.53); аллозакиназу (EC 2.7.1.55); 2-дегидро-3-деоксигалактонокиназу (EC 2.7.1.58); N-ацетилглюкозаминкиназу (EC 2.7.1.59); N-ацилманнозаминкиназу (EC 2.7.1.60); полифосфат глюкозофосфотрансферазу (EC 2.7.1.63); бета-глюкозидкиназу (EC 2.7.1.85); ацетаткиназу (EC 2.7.2.1); бутираткиназу (EC 2.7.2.7); развтвленноцепочечную жирнокислотную киназу (EC 2.7.2.14) и пропионаткиназу (EC 2.7.2.15).
[0090] V группа киназ (1119 последовательностей) включает киназы TIM β-бочонка. Эти ферменты включают пируваткиназу (EC 2.7.1.40).
[0091] VI группа киназ (885 последовательностей) включает GHMP киназы. Эти ферменты включают галактокиназу (EC 2.7.1.6); мевалонат-киназу (EC 2.7.1.36); гомосеринкиназу (EC 2.7.1.39); L-арабинокиназу (EC 2.7.1.46); фукокиназу (EC 2.7.1.52); шикимат-киназу (EC 2.7.1.71); 4-(цитидин-5'-дифосфо)-2-C-метил-D-эритриолкиназу (EC 2.7.1.148) и фосфомевалонаткиназу (EC 2.7.4.2).
[0092] VII группа киназ (1843 последовательности) включает киназы, подобные AIR синтетазе. Эти ферменты включают тиаминфосфат-киназу (EC 2.7.4.16) и селенид, водную дикиназу (EC 2.7.9.3).
[0093] VIII группа киназ (565 последовательностей) включает рибофлавинкиназы (565 последовательностей). Эти ферменты включают рибофлавинкиназу (EC 2.7.1.26).
[0094] IX группа киназ (197 последовательностей) включает дигидроксиацетонкиназы. Эти ферменты включают глицеронкиназу (EC 2.7.1.29).
[0095] X группа киназ (148 последовательностей) включает предполагаемые глицерат-киназы. Эти ферменты включают глицераткиназу (EC 2.7.1.31).
[0096] XI группа киназ (446 последовательностей) включает полифосфаткиназы. Эти ферменты включают полифосфаткиназы (EC 2.7.4.1).
[0097] XII группа киназ (263 последовательности) включает интегральные мембранные киназы. XII группа включает семейство долихолкиназы. Эти ферменты включают долихолкиназы (EC 2.7.1.108). Группа XII дополнительно включает семейство ундекапренолкиназы. Эти ферменты включают ундекапренолкиназы (EC 2.7.1.66).
[0098] Киназы играют незаменимые роли в многочисленных путях клеточного метаболизма и передачи сигналов, и они входят в число наилучшим образом изученных ферментов на структурном уровне, биохимическом уровне и клеточном уровне. Несмотря на то что все киназы используют одного и того же донора фосфата (в большинстве случаев АТФ) и катализируют по-видимому ту же реакцию переноса фосфорила, они проявляют выраженное разнообразие структурных укладок и механизмов распознавания субстрата. Это, вероятно, в значительной степени связано с необычайно разнообразной природой структур и свойств их субстратов.
5.1.1 Протеинкиназы, активированные митоген-активированными протеинкиназами (MK2 и MK3)
[0099] Различные группы MAPK-активированных протеинкиназ (MAP-KAPK) были определены ниже по ходу транскрипции от митоген-активированных протеинкиназ (MAPK). Эти ферменты передают сигналы на белки-мишени, которые не являются прямыми субстратами MAPK и поэтому служат для передачи зависимых от фосфорилирования сигналов каскадами MAPK к разнообразным клеточным функциям. Одна из этих групп образована тремя MAPKAPK: MK2, MK3 (также известными как 3pK) и MK5 (также обозначенной PRAK). Протеинкиназа 2, активированная митоген-активированной протеинкиназой (также именуемая «MAPKAPK2», «MAPKAP-K2» или «MK2»), представляет собой киназу серина/треонина (Ser/Thr) семейства протинкиназ. MK2 высоко гомологична MK3 (аминокислотная идентичность приблизительно 75%). Киназные домены MK2 и MK3 имеют наибольшую аналогию (идентичность приблизительно от 35% до 40%) с кальций/кальмодулин-зависимой протеинкиназой (CaMK), киназой фосфорилазы b и C-концевым доменом киназы (CTKD) изоформ рибосомальной S6 киназы (RSK). Ген mk2 кодирует два альтернативно сплайсированных транскрипта из 370 аминокислот (MK2A) и 400 аминокислот (MK2B). Ген mk3 кодирует один транскрипт из 382 аминокислот. Белки MK2 и MK3 являются высоко гомологичными, при этом MK2A имеет более короткую C-концевую область. C-конец MK2B содержит функциональную состоящую из двух частей локализующую в ядре последовательность (NLS) (Lys-Lys-Xaa10-Lys-Arg-Arg-Lys-Lys; SEQ ID NO: 23), которая не присутствует в более короткой изоформе MK2A, указывая на то, что альтернативный сплайсинг определяет клеточную локализацию изоформ MK2. MK3 имеет сходную последовательность ядерной локализации. Последовательность ядерной локализации, обнаруживаемая и в MK2B, и в MK3, охватывает домен D (Leu-Leu-Lys-Arg-Arg-Lys-Lys; SEQ ID NO: 24), который, как было показано исследованиями, опосредует специфическое взаимодействие MK2B и MK3 с p38a и p38β. MK2B и MK3 также имеют функциональный ядерный экспортный сигнал (NES), локализующийся ближе к N-концу NLS домена D. NES в MK2B достаточен для запуска ядерного экспорта после стимуляции, процесса, который может ингибироваться лептомицином B. Последовательность, расположенная ближе к N-концу от каталитического домена в MK2 и MK3, богата пролином и содержит один (MK3) или два (MK2) предполагаемых пируват Src гомологичных 3 (SH3) домен-связывающих сайта, причем в исследованиях было показано для MK2, что она опосредует связывание с доменом SH3 c-Abl in vitro. Последние исследования свидетельствуют о том, что этот домен вовлечен в опосредованную MK2 миграцию клеток.
[00100] MK2B и MK3 локализуются преимущественно в ядре покоящихся клеток, тогда как MK2A присутствует в цитоплазме. И MK2B, и MK3 быстро экспортируются в цитоплазму через белок поддержания области хромосомы (CRM1)-зависимый механизм после стрессовой стимуляции. Представляется, что ядерный экспорт MK2B опосредуется активацией киназы, поскольку фосфомиметическая мутация Thr334 внутри петли активации киназы усиливает цитоплазматическую локализацию MK2B. Без ограничения теорией, считается, что MK2B и MK3 могут содержать конститутивно активную NLS и регулируемый фосфорилированием NES.
[00101] Представляется, что MK2 и MK3 экспрессируются повсеместно с преобладающей экспрессией в сердце, в скелетных мышцах и в почечных тканях.
5.1.2. Активация
[00102] Различные активаторы p38α и p38β мощно стимулируют активность MK2 и MK3. p38 опосредует фосфорилирование MK2 in vitro и in vivo на четырех пролин-направляемых сайтах: Thr25, Thr222, Ser272 и Thr334. Из этих сайтов только Thr25 не сохранен в MK3. Без ограничения теорией, хотя функция фосфорилированного Thr25 неизвестна, его локализация между двумя связывающими домен SH3 сайтами свидетельствует о том, что он может регулировать межбелковые взаимодействия. Thr222 в MK2 (Thr201 в MK3) локализуется в петле активации домена киназы, и было показано, что он существен для активности киназ MK2 и MK3. Thr334 в MK2 (Thr313 в MK3) локализуется ближе к C-концу от каталитического домена и существен для активности киназы. Кристаллическая структура MK2 была проанализирована, и без ограничения теорией свидетельствует о том, что фосфорилирование Thr334 может служить в качестве включателя для ядерного импорта и экспорта MK2. Фосфорилирование Thr334 также может ослабить или прервать связывание C конца MK2 с каталитическим доменом, обнажая NES и содействуя ядерному экспорту.
[00103] Исследования показали, что хотя p38 способен активировать MK2 и MK3 в ядре, экспериментальные доказательства свидетельствуют о том, что активация и ядерный экспорт MK2 и MK3 соединяются зависимым от фосфорилирования конформационным включением, которое также определяет стабилизацию и локализацию p38, и клеточная локализация самого p38 регулируется MK2 и, возможно, MK3. Дополнительные исследования показали, что ядерный p38 экспортируется в цитоплазму в комплексе с MK2 после фосфорилирования и активации MK2. Взаимодействие между p38 и MK2 могут быть важны для стабилизации p38, поскольку исследования указывают на то, что уровни p38 являются низкими в клетках с дефицитом MK2, и экспрессия каталитически неактивного белка MK2 восстанавливает уровни p38.
5.1.3. Субстраты и функции
[00104] Дальнейшие исследования показали, что малый белок теплового шока HSPB1 (также известный как белок теплового шока 27 или Hsp27), специфический для лимфоцитов белок LSP-1 и виментин фосфорилируются MK2. HSPB1 представляет особый интерес, потому что он образует крупные олигомеры, которые могут действовать в качестве молекулярных шаперонов и защищают клетки от теплового шока и окислительного стресса. После фосфорилирования HSPB1 утрачивает свою способность образовывать крупные олигомеры и неспособен блокировать полимеризацию актина, свидетельствуя о том, что опосредованное MK2 фосфорилирование HSPB1 служит в качестве гомеостатической функции, нацеленной на регуляцию динамики актина, которая в противном случае была бы дестабилизирующей во время стресса.
[00105] Было также показано, что MK3 фосфорилирует HSPB1 in vitro и in vivo, но его роль во время стрессовых состояний еще не выяснена. MK2 разделяет много субстратов с MK3. Оба фермента имеют сравнимые субстратные предпочтения и фосфорилируют пептидные субстраты при сходных кинетических константах. Было обнаружено, что минимальная последовательность, требуемая для эффективного фосфорилирования MK2, представляет собой Hyd-Xaa-Arg-Xaa-Xaa-pSer/Thr (SEQ ID NO: 25), где Hyd обозначает объемный гидрофобный остаток.
[00106] Экспериментальное доказательство подтверждает роль p38 в регуляции биосинтеза цитокинов и клеточной миграции. Нацеленная делеция гена mk2 у мышей свидетельствовала о том, что хотя p38 опосредует активацию многих подобных киназ, представляется, что MK2 является ключевой киназой, ответственной за эти зависимые от p38 биологические процессы. Потеря MK2 приводит (i) к дефекту вызванного липополисахаридом (LPS) синтеза цитокинов, таких как фактор некроза опухоли альфа (TNF-α), интерлейкин-6 (IL-6) и гамма-интерферон (IFN-γ) и (ii) к изменениям миграции мышиных эмбриональных фибробластов, гладкомышечных клеток и нейтрофилов.
[00107] Согласованно с ролью MK2 в воспалительных реакциях, у мышей с дефицитом MK2 проявилась повышенная восприимчивость к инфекции Listeria monocytogenes и сниженная опосредованная воспалением гибель нейронов после очаговой ишемии. Поскольку уровни белка p38 тоже значительно снижены в клетках с дефицитом MK2, то было необходимо различить, были ли эти фенотипы вызваны только потерей MK2. Для достижения этого MK2 мутанты были экспрессированы в клетках с дефицитом MK2, и результаты указывают на то, что не было необходимости в каталитической активности MK2 для восстановления уровней p38, но она требовалась для регуляции биосинтеза цитокинов.
[00108] Исследования с нокаутом или нокдауном MK2 обеспечили веское подтверждение того, активированная MK2 повышает устойчивость мРНК IL-6 посредством фосфорилирования белков, взаимодействующих с богатой AU (аденилат уридилатом) 3'-нетранслируемой областью мРНК IL-6. В частности, было показано, что MK2 главным образом ответствен за фосфорилирование hnRNPAO, связывающий мРНК белок, который стабилизирует РНК IL-6. Кроме того, в нескольких дополнительных исследованиях, изучавших разнообразные воспалительные заболевания, было обнаружено, что уровни провоспалительных цитокинов, таких как IL-6, IL 1β, TNFα и IL-8, повышены в индуцированной мокроте от пациентов со стойким хроническим обструктивным легочным заболеванием (COPD) или из альвеолярных макрофагов курильщиков (Keatings V. et al., Am J Resp Crit Care Med, 1996, 153:530-534; Lim, S. et al., J Respir Crit Care Med, 2000, 162: 1355-1360). Было обнаружено, что повышенные уровни провоспалительных цитокинов, таких как интерлейкин-8 (IL-8) и интерлейкин-6 (IL-6), а также связанных находящихся ниже по ходу транскрипции адгезионные молекулы (CAM), такие как молекула-1 межклеточной адгезии (ICAM-1) и молекула-1 адгезии сосудистых клеток (VCAM-1), матриксных металлопротеиназ, таких как матриксная металлопротеиназа-7 (MMP-7), и молекул передачи сигналов, таких как S100, связывающий кальций белок A12 (S100A12, также известный как калгранулин C), в периферической крови связаны со смертностью, выживанием без трансплантации легких и прогрессирования заболевания у пациентов с идиопатическим легочным фиброзом (Richards et al., Am J Respir Crit Care Med, 2012, 185: 67-76; Richards, T. et al., Am J Respir Crit Care Med, 181: A1120, 2010; Moodley, Y. et al., Am J Respir Cell Mol Biol, 29(4): 490-498, 2003). Взятые вместе, эти исследования означают, что повышенные уровни воспалительных цитокинов, индуцированные активацией MK2, могут быть вовлечены в патогенез заболеваний дыхательных путей или легких и свидетельствуют о возможности применения анти-цитокиновой терапии для лечения заболеваний дыхательных путей или легких, таких как идиопатический легочный фиброз и хроническое обструктивное легочное заболевание (COPD) (Chung, K., Eur Respir J, 2001, 18: Suppl. 34: 50-59).
5.1.4. Регуляция трансляции мРНК
[00109] Предыдущие исследования с использованием мышей с нокаутом MK2 или клеток с дефицитом MK2 показали, что MK2 увеличивает продукцию воспалительных цитокинов, включая TNF-α, IL-1 и IL-6, путем увеличения скорости трансляции его мРНК. У мышей с дефицитом MK2 невозможно было выявить значимого снижения транскрипции, процессинга и шеддинга TNF-α. Известно, что путь p38 играет важную роль в регуляции стабильности мРНК, и MK2 представляет вероятную мишень, которой p38 опосредует эту функцию. Исследования с использованием мышей с дефицитом MK2 указали на то, что каталитическая активность MK2 необходима для его эффектов на продукцию и миграцию цитокинов, свидетельствуя о том, что без ограничения теорией, MK2 фосфорилирует мишени, вовлеченные в обеспечение стабильности мРНК. Согласуясь с этим, было показано, что MK2 связывает и/или фосфорилирует гетерогенный ядерный рибонуклеопротеин (hnRNP) AO, тристетрапролин, связывающий поли(A) белок PABP1 и HuR, повсеместно экспрессированный член семейства elav (эмбрионального летального аномального визуального у Drosophila melanogaster) РНК-связывающего белка. Известно, что эти субстраты связываются или совместно очищаются с мРНК, которые содержат богатые AU элементы в 3'-нетранслируемой области, свидетельствуя о том, что MK2 может регулировать стабильность богатых AU мРНК, такие как TNF-α. В настоящее время неизвестно, выполняет ли MK3 аналогичные функции, но обработка LPS фибробластов с дефицитом MK2 полностью устраняет фосфорилирование hnRNP AO, свидетельствуя о том, что MK3 не способна компенсировать потерю MK2.
[00110] MK3 осаждается с MK2 при фосфорилировании киназы эукариотического фактора удлинения 2 (eEF2). Киназа eEF2 фосфорилирует и инактивирует eEF2. Активность eEF2 имеет решающее значение для удлинения мРНК во время трансляции, и фосфорилирование eEF2 на Thr56 приводит к прекращению трансляции мРНК. Фосфорилирование MK2 и MK3 киназы eEF2 на Ser377 свидетельствует о том, что эти ферменты могут модулировать активность киназы eEF2 и, посредством этого, регулировать удлинение трансляции мРНК.
5.1.5. Транскрипционная регуляция MK2 и MK3
[00111] Ядерная MK2, подобно многим MK, вносит вклад в фосфорилирование связывания цАМФ-ответного элемента активирующего белка (CREB), сывороточного ответного фактора (SRF) и транскрипционного фактора ER81. Сравнение клеток дикого типа и клеток с дефицитом MK2 выявило, что MK2 представляет собой основную киназу SRF, индуцированную стрессом, свидетельствуя о роли MK2 в опосредованном стрессом немедленном-раннем ответе. И MK2, и MK3 взаимодействуют с основным спирально-петельно-спиральным транскрипционным фактором E47 in vivo и фосфорилируют E47 in vitro. Было обнаружено, что опосредованное MK2 фосфорилирование E47 подавляет транскрипционную активность E47 и посредством этого ингибирует E47-зависимую генную экспрессию, свидетельствуя о том, что MK2 и MK3 могут регулировать тканеспецифическую генную экспрессию и клеточную дифференциацию.
5.1.6. Другие мишени MK2 и MK3.
[00112] Были также идентифицированы несколько других субстратов MK2 и MK3, отражающих разнообразные функции MK2 и MK3 при нескольких биологических процессах. Поддерживающий белок 14-3-3ζ представляет собой физиологический субстрат MK2. Исследования указывают на то, что 14-3-3ζ взаимодействует с рядом компонентов путей передачи клеточных сигналов, включая протеинкиназы, фосфатазы и транскрипционные факторы. Дополнительные исследования показали, что опосредованное MK2 фосфорилирование 14-3-3ζ на Ser58 нарушает ее активность связывания, свидетельствуя о том, что MK2 может воздействовать на регуляцию нескольких передающих сигналы молекул, обычно регулируемых 14-3-3ζ.
[00113] Дополнительные исследования показали, что MK2 также взаимодействует с субъединицей p16 семичленного комплекса Arp2 и Arp3 (p16-Arc) на Ser77 и фосфорилирует ее. p16-Arc выполняет роли в регуляции цитоскелета актина, свидетельствуя о том, что MK2 может быть вовлечена в этот процесс.
[00114] MK2 и MK3 также могут фосфорилировать 5-липоксигеназу. 5-Липоксигеназа катализирует первоначальные стадии при образовании воспалительных медиаторных лейкотриенов. Было также показано, что тирозингидроксилаза, гликогенсинтаза и Akt фосфорилируются MK2. Наконец, MK2 фосфорилирует белок-супрессор опухолей туберин на Ser1210, создавая сайт стыковки для 14-3-3ζ. Туберин и гамартин в норме образуют функциональный комплекс, который негативно регулирует клеточный рост, противодействуя mTOR-зависимой передаче сигналов, свидетельствуя о том, что опосредованная p38 активация MK2 может регулировать клеточный рост увеличением связывания 14-3-3ζ с туберином.
5.2. Ингибирование киназы
[00115] Эукариотические протеинкиназы составляют одно из самых больших суперсемейств гомологичных белков, которые связаны посредством их каталитических доменов. Большинство родственных протеинкиназ специфичны для фосфорилирования или серина/треонина, или тирозина. Протеинкиназы играют ключевую роль в клеточном ответе на внеклеточные стимулы. Таким образом, стимуляция протеинкиназ считается одним из наиболее распространенных механизмов активации в системах передачи сигналов. Известно, что многие субстраты подвергаются фосфорилированию множеством протеинкиназ, и было опубликовано значительное количество информации о первичной последовательности каталитических доменов различных протеинкиназ. Эти последовательности разделяют большое число остатков, вовлеченных в связывание АТФ, катализ и поддержание структурной целостности. Большинство протеинкиназ обладают высококонсервативным 30-32 кДа каталитическим доменом.
[00116] В исследованиях предпринимались попытки идентификации и использования регуляторных элементов протеинкиназ. Эти регуляторные элементы включают ингибиторы, антитела и блокирующие пептиды.
5.2.1. Ингибиторы
[00117] Ингибиторы ферментов представляют собой молекулы, которые связываются с ферментами, посредством этого снижая активность ферментов. Связывание ингибитора может остановить поступление субстрата в активный сайт фермента и/или препятствовать катализу реакции фермента. Связывание ингибитора является или обратимым, или необратимым. Необратимые ингибиторы обычно взаимодействуют с ферментом и изменяют его химически (например, модификацией ключевых аминокислотных остатков, необходимых для ферментной активности) с тем, чтобы он больше не был способен катализировать реакцию. Напротив, обратимые ингибиторы связываются не ковалентно, и продуцируются различные типы ингибирования, в зависимости от того, связывают ли эти ингибиторы фермент, комплекс фермент-субстрат или оба.
[00118] Ингибиторы ферментов часто оцениваются по их специфичности и активности. Термин «специфичность», используемый в этом контексте, относится к селективному прикреплению ингибитора или отсутствию его связывания с другими белками. Термин «активность», используемый в настоящем описании, относится к константе диссоциации ингибитора, которая указывает концентрацию ингибитора, необходимую для ингибирования фермента.
[00119] Ингибиторы протеинкиназ изучали для использования в качестве инструмента при регуляции активности протеинкиназ. Ингибиторы изучали для использования, например, с циклин-зависимой (Cdk) киназой, MAP киназой, серин/треонинкиназой, протеинтирозинкиназой семейства Src, тирозинкиназой, кальмодулин (CaM) киназой, казеинкиназой, киназой контрольной точки (Chkl), киназой 3 гликогенсинтазы (GSK-3), c-Jun N-концевой киназой (INK), митоген-активированной протеинкиназой 1 (MEK), киназой легкой цепи миозина (MLCK), протеинкиназой A, Akt (протеинкиназой B), протеинкиназой C, протеинкиназой G, протеинтирозинкиназой, Raf киназой и Rho киназой.
5.2.2. Блокирующие пептиды
[00120] Пептид представляет собой химическое соединение, которое составлено из цепи из двух или более аминокислот, посредством чего группа одной аминокислоты в цепи связана с аминогруппой другой посредством пептидной связи. Пептиды, наряду с другими аспектами, использовались в исследовании структуры и функции белков. Синтетические пептиды, наряду с другими видами применения, могут использоваться в клинических исследованиях для изучения воздействий пептидов на ингибирование протеинкиназ, раковые белки и другие расстройства.
[00121] Было исследовано использование нескольких блокирующих пептидов. Например, внеклеточная регулируемая сигналами киназа (ERK), протеинкиназа MAPK, существенна для клеточной пролиферации и дифференциации. Активация MAPK требует каскада механизмов, посредством чего MAPK фосфорилируется находящейся выше по ходу транскрипции MAPKK (MEK), которая затем, в свою очередь, фосфорилируется третьей киназой MAPKKK (MEKK). Ингибиторный пептид ERK функционирует в качестве приманки MEK связыванием с ERK.
[00122] Другие блокирующие пептиды включают связанный с аутокамтидом-2 ингибиторный пептид (AIP). Этот синтетический пептид представляет собой высокоспецифичный и мощный ингибитор Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII). AIP представляет собой нефософрилируемый аналог аутокамтида-2, высокоселективного пептидного субстрата для CaMKII. AIP ингибирует CaMKII при IC50 100 нМ (IC50 представляет собой концентрацию ингибитора, требуемую для получения 50% ингибирования). Ингибирование AIP является неконкурентным в отношении синтида-2 (пептидного субстрата CaMKII) и АТФ, но конкурентным в отношении аутокамтида-2. На ингибирование не воздействует присутствие или отсутствие Ca2+/кальмодулина. Активность CaMKII полностью ингибируется AIP (1 мкМ), тогда как на PKA, PKC и CaMKIV нет воздействия.
[00123] Другие блокирующие пептиды включают ингибиторный пептид (CIP) протеинкиназы 5 клеточного деления (Cdk5). Cdk5 фосфорилирует тау белок микротрубочек в специфичных для болезни Альцгеймера фосфо-эпитопах, когда она ассоциируется с p25. p25 представляет собой усеченный активатор, который продуцируется из физиологического активатора Cdk5 p35 после воздействия амилоидных β пептидов. После нейронной инфекции CIP, CIP селективно ингибируют активность p25/Cdk5 и подавляют аберрантное фосфорилирование тау в корковых нейронах. Причины специфичности, демонстрируемые CIP, полностью не выяснены.
[00124] Дополнительные блокирующие пептиды были изучены для внеклеточно регулируемых 2 (ERK2), ERK3, p38/HOGl, протеинкиназы C, казеинкиназы II, Ca2+/кальмодулинкиназы IV, казеинкиназы II, Cdk4, Cdk5, ДНК-зависимой протеинкиназы (DNA-PK), серин/треонин-протеинкиназы PAK3, фосфоинозитид (PI)-3 киназы, PI-5 киназы, PSTAIRE (высококонсервативной последовательности cdk), рибосомальной S6 киназы, GSK-4, киназы зародышевого центра (GCK), SAPK (активируемой стрессом протеинкиназы), SEK1 (киназы стрессовой сигнализации) и киназы очаговой адгезии (FAK).
5.3. Проникающие в клетки пептиды (CPP)
[00125] Проникающие в клетки пептиды (CPP) представляют собой класс пептидов, способных проникать через плазматическую мембрану клеток млекопитающих, и транспортировать соединения многих типов и молекулярные массы через мембрану. Эти соединения включают эффекторные молекулы, такие как белки, ДНК, конъюгированные пептиды, олигонуклеотиды и малые частицы, такие как липосомы. Когда CPP химически связываются или сливаются с другими белками, полученные слитые белки еще способны поступать в клетки. Хотя точный механизм трансдукции неизвестен, не считают, что интернализация этих белков опосредуется рецепторами или опосредуется транспортером. CPP в целом имеют длину 10-16 аминокислот и могут группироваться в соответствии с их композицией, такие как, например, пептиды, богатые аргинином и/или лизином.
[00126] Использование CPP, способных транспортировать эффекторные молекулы в клетки, стало все более привлекательным при разработке лекарственных средств, поскольку они содействуют клеточному захвату карго-молекул. Эти проникающие в клетки пептиды, в целом относящиеся к группе амфипатических (что значит, имеющих и полярный, и неполярный конец) или катионных (что значит, относящихся к содержанию чистых положительно заряженных атомов). В зависимости от их последовательности обеспечивают технологию неинвазивной доставки для макромолекул. CPP часто именуются «троянскими пептидами», «мембранными транслоцирующими последовательностями», «белковыми трансдукционными доменами (PTD)» или «проницаемыми в клетки белками (CPP)». CPP также могут использоваться для содействия проникновению через клеточные мембраны новых ингибиторов HSPB1 киназы (см. заявки на патенты США под серийным № 11/972,459, озаглавленную «Полипептидные ингибиторы HSPB1 киназы и способы их применения», поданную 10 января 2008 г, и под серийным № 12/188,109, озаглавленную «Ингибиторы киназы и способы их применения», поданной 7 августа 2008 г.; содержания каждой заявки полностью включены в настоящее описание путем ссылки).
5.3.1. Белки, содержащие вирусный CPP
[00127] Первые белки, подлежащие описанию как имеющие трансдукционные свойства, были вирусного происхождения. Эти белки представляют собой наиболее широко принятые модели для действия CPP. Среди проникающих в клетки пептидов, шире всех были исследованы богатые аргинином проникающие в клетки пептиды, включая без ограничения пептид TAT (El-Sayed, A. et al., AAPSJ. 11, 13-22, 2009; Wender, P. et al., Adv. Drug Deliv. Rev. 60, 452-472, 2008).
[00128] TAT (транс-активаторный генный продукт ВИЧ-1) представляет собой полипептид, состоящий из 86 аминокислот, который действует в качестве мощного транскрипционного фактора интегрированного генома ВИЧ-1. TAT действует на вирусный геном, стимулируя вирусную репликацию в латентно инфицированных клетках. Транслокационные свойства белка TAT позволяют ему активировать покоящиеся инфицированные клетки, и он может быть вовлечен в примирование неинфицированных клеток для последующей инфекции регуляцией многих клеточных генов, включая цитокины. Минимальный CPP TAT представляет собой белковую последовательность из 9 аминокислот RKKRRQRRR (TAT49-57; SEQ ID NO: 20). Исследования с использованием более длинного фрагмента TAT продемонстрировали успешную трансдукцию слитых белков до 120 кДа. Было продемонстрировано, что добавление множественных TAT-CPP, а также синтетических производных TAT опосредуют мембранную транслокацию. TAT CPP, содержащие слитые белки, использовались в качестве терапевтических составных частей в экспериментах, включая модели рака, транспортировки белка клеточной смерти в клетки и модели заболеваний в виде нейродегенеративных расстройств.
[00129] VP22 представляет собой покровный белок HSV-1 (вируса простого герпеса), структурную часть вириона HSV. VP22 способен к рецептор-независимой транслокации и накапливается в ядре. Это свойство VP22 классифицирует белок как пептид, содержащий CPP. Слитые белки, содержащие VP22 полной длины, были эффективно транслоцированы через плазматическую мембрану.
5.3.2. Гомеопротеины со свойствами внутриклеточной транслокации
[00130] Гомеопротеины представляют собой высококонсервативные, трансактивированные транскрипционные факторы, вовлеченные в морфологические процессы. Они связываются с ДНК посредством специфической последовательности из 60 аминокислот. Связывающий ДНК гомеодомен представляет собой наиболее высококонсервативную последовательность гомеопротеина. Были описаны несколько гомеопротеинов, проявляющих активность, подобную CPP; они способны к эффективной транслокации через клеточные мембраны независимым от энергии и независимым от эндоцитоза образом без специфичности клеточного типа.
[00131] Белок Antennapedia (Antp) представляет собой транс-активирующий фактор, способный к транслокации через клеточные мембраны; минимальная последовательность, способная к транслокации, представляет собой пептид из 16 аминокислот, соответствующий третьей спирали гомеодомена белка (HD). Интернализация этой спирали происходит при 4°C, свидетельствуя о том, что этот процесс не является эндоцитоз-зависимым. Пептиды длиной до 100 аминокислот, продуцируемые в виде слитых белков с AntpHD, проникают через клеточные мембраны.
[00132] Другие гомеодомены, способные к транслокации, включают гомеодомены гена Fushi tarazu (Ftz) и гена Engrailed (En). Многие гомеодомены разделяют высококонсервированную третью спираль.
5.3.3. Человеческие CPP
[00133] Человеческие CPP могут обходить потенциальные проблемы иммуногенности после введения в организм пациента. Пептиды с последовательностями CPP включают: Hoxa-5, Hox-A4, Hox-B5, Hox-B6, Hox-B7, HOX-D3, GAX, MOX-2 и FtzCPP. Все эти белки разделяют последовательность, обнаруженную в AntpCPP. Другие CPP включают Islet-1, интерлейкин-1, фактор некроза опухоли и гидрофобную последовательность из сигнального пептида фактора роста фибробластов Капоши или FGF-4, который способен к транслокации, независимой от энергии, рецепторов и эндоцитоза. Неподтвержденные CPP включают членов семейства фактора роста фибробластов (FGF).
6. Ингибиторы MK2 и лечение фибротических заболеваний или состояний
[00134] Протеинкиназа 2, активированная митоген-активированной протеинкиназой (MAPKAPK2 или MK2), субстрат серин/треонинкиназы ниже по ходу транскрипции от p38MAPK, вовлечена в патологический процесс при многих воспалительных заболеваниях, которые осложняются рубцеванием и фиброзом (Lopes, L. et al., Biochem Biophys Res Commun., 382(3):535-9, 2009). Они включают без ограничения рак, гиперплазию интимы, органный фиброз, спаечные процессы в брюшной полости, воспалительные кишечные заболевания и ревматоидный артрит. В дополнение к идиопатическому легочному фиброзу (IPF), другие расстройства, которые вовлекают воспаление и фиброз и воздействуют на легкие, включают острое легочное повреждение (ALI), отторжение органных трансплантатов (при легочном трансплантате также лечение на поздней стадии по поводу IPF), органную недостаточность, вызванную сепсисом, острую легочную недостаточность, аутоиммунные заболевания, такие как склеродермия, и хроническое обструктивное легочное заболевание (COPD).
[00135] Известно, что развитие фиброза требует воспаления, пролиферации и вовлечения фибробластов, что приводит к развитию клеток миофибробластного фенотипа (Horowitz J. et al., Semin Respir Crit Care Med., 27(6):600-612, 2006). Было показано, что MK2 регулирует генную экспрессию на транскрипционном и посттранскрипционном уровнях (Neininger A. et al., J Biol Chem. 2002;277(5):3065-8, Thomas T. et al., J Neurochem., 105(5): 2039-52, 2008; Johansen C. et al., J Immunol., 176(3): 1431-8, 2006; Rousseau S. et al., EMBO J. 21(23):6505-14, 2002), а также архитектуру цитоскелета (Lopes, L. et al., Biochem Biophys Res Commun., 382(3):535-9, 2009). Кроме того, было показано, что активированная MK2 увеличивает трансляцию и стабильность мРНК воспалительных цитокинов и вызывает реорганизацию актина; и что ингибирование MK2 связано со сниженным воспалением (Ward, B. et al., J Surg Res., 169(1):e27-36, 2011) и дифференциацией миофибробластов (Lopes, L. et al., Biochem Biophys Res Commun., 382(3):535-9, 2009).
[00136] Вместе, эти данные свидетельствуют о том, что ингибирование MK2 может обеспечить терапевтические преимущества для пациентов с фибротическими расстройствами или состояниями, например, идиопатическим легочным фиброзом (IPF), острым повреждением легких (ALI) и отторжением трансплантата. В этом отношении, описанное изобретение предлагает подход к вмешательству в процесс воспаления и фиброза с использованием проникающих в клетки ингибиторов MK2 на пептидной основе.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[00137] В соответствии с одним аспектом описанное изобретение относится к способу лечения заболевания, состояния или патологического процесса, характеризуемого аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в ткани индивида, причем способ включает введение индивиду фармацевтической композиции, содержащей терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента и его фармацевтически приемлемый носитель, где терапевтическое количество эффективно для уменьшения пролиферации фибробластов и отложения внеклеточного матрикса в ткани индивида.
[00138] В соответствии с одним вариантом осуществления способа, заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс сидром (ARDS). В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой вызванный излучением фиброз. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой отторжение трансплантата. В соответствии с еще одним вариантом осуществления, ткань представляет собой легочную ткань. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой интерстициальное легочное заболевание. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой легочный фиброз. В соответствии с еще одним вариантом осуществления, легочный фиброз представляет собой идиопатический легочный фиброз. В соответствии с еще одним вариантом осуществления, легочный фиброз вызван введением блеомицина. В соответствии с еще одним вариантом осуществления, легочный фиброз возникает в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легкого индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации. В соответствии с еще одним вариантом осуществления, заболевание или состояние дополнительно характеризуется воспалением в ткани. В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое или хроническое воспаление. В соответствии с еще одним вариантом осуществления, воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β). В соответствии с еще одним вариантом осуществления, аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани характеризуется аберрантной активностью Протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью Протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида. В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукцией дифференциации миофибробластов и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым индивидом. В соответствии с еще одним вариантом осуществления, стадия введения происходит интратрахеально (включая введение путем легочной ингаляции), парентерально, внутривенно или внутрибрюшинно. В соответствии с еще одним вариантом осуществления, стадия введения происходит интратрахеально (включая введение путем легочной ингаляции). В соответствии с еще одним вариантом осуществления, стадия введения происходит в одно время в виде одной дозы. В соответствии с еще одним вариантом осуществления, стадия введения выполняется в виде множества доз в течение периода времени. В соответствии с еще одним вариантом осуществления, период времени составляет один день, одну неделю, один месяц, один год или их кратные количества. В соответствии с еще одним вариантом осуществления, стадия введения выполняется по меньшей мере один раз в месяц, по меньшей мере один раз в неделю или по меньшей мере один раз в день. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство выбрано из группы, состоящей из очищенного бычьего коллагена V типа, антагониста рецепторов IL-13, ингибитора протеинтирозинкиназы, антагониста эндотелиальных рецепторов, двойного антагониста рецепторов эндотелина, аналога простациклина, моноклонального антитела к CTGF, антагониста рецепторов эндотелина (A-селективного), AB0024, моноклонального антитела, подобного лизилоксидазе 2 (LOXL2), ингибитора c-Jun-N-концевой киназы (JNK), пирфенидона, IFN-γ1b, пан-нейтрализующего IgG4 человеческого антитела ко всем трем изоформам TGF-β, ингибитора активации TGF-β, рекомбинантного человеческого белка пентраксин-2 (rhPTX-2), биспецифического антитела к IL-4/IL-13, гуманизированного моноклонального антитела, нацеленного на интегрин αvβ6, N-ацетилцистеина, силденафила, антагониста фактора некроза опухоли (TNF) (этанерцепта) и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой глюкокортикоид, выбранный из группы, состоящей из преднизона, будезонида, мометазона фуроата, флутиказона пропионата, флутиказона фуроата и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой бронхолитик, выбранный из группы, состоящей из модификатора лейкотриена, антихолинергического бронхолитика, p2-агониста короткого действия и β2-агониста длительного действия и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой анальгетическое средство. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противоинфекционное средство. В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 85% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLAVA (SEQ ID NO: 5). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLGVA (SEQ ID NO: 6). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид имеет аминокислотную последовательность YARAAARQARA (SEQ ID NO: 11), а второй полипептид содержит терапевтический домен, чья последовательность имеет существенную идентичность с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид содержит проникающий в клетки пептид, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), а второй полипептид имеет аминокислотную последовательность KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLK I (SEQ ID NO: 18). В соответствии с еще одним вариантом осуществления, носитель выбран из группы, состоящей из носителя контролируемого высвобождения, носителя отсроченного высвобождения, носителя замедленного высвобождения и носителя длительного высвобождения. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция представлена в форме сухого порошка. В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) от 1 до 5 мкм. В соответствии с еще одним вариантом осуществления, терапевтическое количество фармацевтической композиции вводится через ингаляционное устройство. В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер. В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой дозирующий ингалятор (MDI). В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой ингалятор сухого порошка (DPI). В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер сухого порошка.
[00139] В соответствии с другим аспектом, описанное изобретение относится к фармацевтической композиции для применения в лечении заболевания, состояния или патологического процесса, характеризуемых аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в ткани индивида, причем фармацевтическая композиция содержит терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента, и его фармацевтически приемлемый носитель, и где терапевтическое количество эффективно для уменьшения пролиферации фибробластов и отложения внеклеточного матрикса в ткани индивида.
[00140] В соответствии с одним вариантом осуществления, заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS). В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой фиброз, вызванный излучением. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой отторжение трансплантата. В соответствии с еще одним вариантом осуществления, ткань представляет собой легочную ткань. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой интерстициальное легочное заболевание. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой легочный фиброз. В соответствии с еще одним вариантом осуществления, легочный фиброз представляет собой идиопатический легочный фиброз. В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате введения блеомицина. В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легкого индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации. В соответствии с еще одним вариантом осуществления, заболевание или состояние дополнительно характеризуется воспалением в ткани. В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое или хроническое воспаление. В соответствии с еще одним вариантом осуществления, воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β). В соответствии с еще одним вариантом осуществления, аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида. В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению интратрахеально (включая введение путем легочной ингаляции), парентерально, внутривенно или внутрибрюшинно. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению интратрахеально (включая введение путем легочной ингаляции). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению в одно время в виде одной дозы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению в виде множества доз в течение некоторого периода времени. В соответствии с еще одним вариантом осуществления, период времени составляет один день, одну неделю, один месяц, один год или их кратные количества. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению по меньшей мере один раз в месяц, по меньшей мере один раз в неделю или по меньшей мере один раз в день. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство выбрано из группы, состоящей из очищенного бычьего коллагена V типа, антагониста рецепторов IL-13, ингибитора протеинтирозинкиназы, антагониста эндотелиальных рецепторов, двойного антагониста рецепторов эндотелина, аналога простациклина, моноклонального антитела к CTGF, антагониста рецепторов эндотелина (A-селективного), AB0024, моноклонального антитела, подобного лизилоксидазе 2 (LOXL2), ингибитора c-Jun-N-концевой киназы (JNK), пирфенидона, IFN-γ1b, пан-нейтрализующего IgG4 человеческого антитела ко всем трем изоформам TGF-β, ингибитора активации TGF-β, рекомбинантного человеческого белка пентраксин-2 (rhPTX-2), биспецифического антитела к IL-4/IL-13, гуманизированного моноклонального антитела, нацеленного на интегрин αvβ6, N-ацетилцистеина, силденафила, антагониста фактора некроза опухоли (TNF) (этанерцепта) и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой глюкокортикоид, выбранный из группы, состоящей из преднизона, будезонида, мометазона фуроата, флутиказона пропионата, флутиказона фуроата и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой бронхолитик, выбранный из группы, состоящей из модификатора лейкотриена, антихолинергического бронхолитика, β2-агониста короткого действия и β2-агониста длительного действия и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой анальгетическое средство. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противоинфекционное средство. В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 85% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLAVA (SEQ ID NO: 5). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLGVA (SEQ ID NO: 6). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид имеет аминокислотную последовательность YARAAARQARA (SEQ ID NO: 11), а второй полипептид содержит терапевтический домен, чья последовательность имеет существенную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид содержит проникающий в клетки пептид, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), а второй полипептид имеет аминокислотную последовательность KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18). В соответствии с еще одним вариантом осуществления, носитель выбран из группы, состоящей из носителя контролируемого высвобождения, носителя отсроченного высвобождения, носителя замедленного высвобождения и носителя длительного высвобождения. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция представлена в форме сухого порошка. В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) 1-5 мкм. В соответствии с еще одним вариантом осуществления, терапевтическое количество фармацевтической композиции вводится через ингаляционное устройство. В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер. В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой дозирующий ингалятор (MDI). В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой ингалятор сухого порошка (DPI).
[00141] В соответствии с другим аспектом, описанное изобретение относится к применению фармацевтической композиции для изготовления лекарственного средства для лечения заболевания, состояния или патологического процесса, характеризуемых аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в ткани индивида, где фармацевтическая композиция содержит терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента и его фармацевтически приемлемый носитель, и где терапевтическое количество эффективно для снижения пролиферации фибробластов и отложения внеклеточного матрикса в ткани индивида.
[00142] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS). В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой фиброз, вызванный излучением. Применение по п.58 формулы изобретения, где заболевание или состояние представляет собой отторжение трансплантата. В соответствии с еще одним вариантом осуществления, ткань представлят собой легочную ткань. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой интерстициальное легочное заболевание. В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой легочный фиброз. В соответствии с еще одним вариантом осуществления, легочный фиброз представляет собой идиопатический легочный фиброз. В соответствии с еще одним вариантом осуществления, легочный фиброз вызван введением блеомицина. В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легкого индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации. В соответствии с еще одним вариантом осуществления, заболевание или состояние дополнительно характеризуется воспалением в ткани. В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое или хроническое воспаление. В соответствии с еще одним вариантом осуществления, воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β). В соответствии с еще одним вариантом осуществления, аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида. В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов в легких, и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению интратрахеально (включая введение путем легочной ингаляции), парентерально, внутривенно или внутрибрюшинно. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению интратрахеально (включая введение путем легочной ингаляции). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению в одно время в виде одной дозы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению в виде множества доз в течение некоторого периода времени. В соответствии с еще одним вариантом осуществления, период времени составляет один день, одну неделю, один месяц, один год или их кратные количества. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция подлежит введению по меньшей мере один раз в месяц, по меньшей мере один раз в неделю или по меньшей мере один раз в день. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство выбрано из группы, состоящей из очищенного бычьего коллагена V типа, антагониста рецепторов IL-13, ингибитора протеинтирозинкиназы, антагониста эндотелиальных рецепторов, двойного антагониста рецепторов эндотелина, аналога простациклина, моноклонального антитела к CTGF, антагониста рецепторов эндотелина (A-селективного), AB0024, моноклонального антитела, подобного лизилоксидазе 2 (LOXL2), ингибитора c-Jun-N-концевой киназы (JNK), пирфенидона, IFN-γ1b, пан-нейтрализующего IgG4 человеческого антитела ко всем трем изоформам TGF-β, ингибитора активации TGF-β, рекомбинантного человеческого белка пентраксин-2 (rhPTX-2), биспецифического антитела к IL-4/IL-13, гуманизированного моноклонального антитела, нацеленного на интегрин αvβ6, N-ацетилцистеина, силденафила, антагониста фактора некроза опухоли (TNF) (этанерцепта) и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой глюкокортикоид, выбранный из группы, состоящей из преднизона, будезонида, мометазона фуроата, флутиказона пропионата, флутиказона фуроата и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой бронхолитик, выбранный из группы, состоящей из модификатора лейкотриена, антихолинергического бронхолитика, β2-агониста короткого действия и β2-агониста длительного действия и их комбинации. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой анальгетическое средство. В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противоинфекционное средство. В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 85% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLAVA (SEQ ID NO: 5). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLGVA (SEQ ID NO: 6). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид имеет аминокислотную последовательность YARAAARQARA (SEQ ID NO: 11), а второй полипептид содержит терапевтический домен, чья последовательность имеет существенную идентичность с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9). В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид содержит проникающий в клетки пептид, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), а второй полипептид имеет аминокислотную последовательность KALARQLGVAA (SEQ ID NO: 2). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18). В соответствии с еще одним вариантом осуществления, носитель выбран из группы, состоящей из носителя контролируемого высвобождения, носителя отсроченного высвобождения, носителя замедленного высвобождения и носителя длительного высвобождения. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция представлена в форме сухого порошка. В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) 1-5 мкм. В соответствии с еще одним вариантом осуществления, терапевтическое количество фармацевтической композиции вводится через ингаляционное устройство. В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер. В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой дозирующий ингалятор (MDI). В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой ингалятор сухого порошка (DPI). В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер сухого порошка.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00143] На фиг.1 показано выполнение подачи беспримесного полученного распылительной сушкой инсулина.
[00144] На фиг.2 показано распределение размера частиц полученного распылительной сушкой инсулина, которое определяется каскадным соударением по Андерсону (ACI).
[00145] На фиг.3 показано сравнение эффективности и скорости потока микродозового ингалятора сухого порошка (DPI) и двух имеющихся в продаже «пассивных» ингаляторов сухого порошка (DPI).
[00146] На фиг.4 показана независимость от скорости потока полученного распылительной сушкой беспримесного пептида.
[00147] На фиг.5 показана репрезентативная микрофотография полученного распылительной сушкой пептида (не инсулина).
[00148] На фиг.6 показано распределение размера частиц полученного распылительной сушкой пептида (не инсулина).
[00149] На фиг.7 показано распределение размера частиц комбинации микронизированной/лактозной смеси, которое определяется импактором следующего поколения (NGI).
[00150] На фиг.8 показано выполнение подачи микронизированной мелкомолекулярной (смеси длительно действующих мускариновых средств (LAMA)/лактозы).
[00151] На фиг.9 иллюстрируется иммуногистохимический анализ залитых в парафин легких человека, пораженных идиопатическим легочным фиброзом (IPF), показывающий ядерную локализацию активированной MK2 (т.е., Фосфо-Thr334-MAPKAPK2) в фибробластном очаге. Нормальные легкие (левая панель); срез биоптата ткани легкого с IPF (правая панель). На вставке показан разрыв эпителиальной выстилки в очагах с клетками, положительно окрашиваемыми (темно-серое окрашивание) на активированную MK2. На фиг.9 показаны следующие аббревиатуры: NL (архитектура нормального легкого с альвеолярными мешочками); AW (дыхательный путь); FF (фибробластные очаги из эксплантатов легочной ткани с IPF)
[00152] На фиг.10 показан схематический график для тестирования способности соединения ингибировать развитие фиброза на мышиной модели легочного фиброза, вызванного блеомицином (модель профилактики идиопатического легочного фиброза (IPF)). Забуференный фосфатом солевой раствор (PBS) или MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) вводят один раз в день, или посредством распыления, или внутрибрюшинно, начиная с 7 дня после введения блеомицина, когда воспаление затихает, и фибротические механизмы активируются, до 21 дня после введения блеомицина, когда наблюдается значительный фиброз.
[00153] На фиг.11 показано, что ингаляционная терапия и системное введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) защищает против вызванного блеомицином легочного фиброза у мышей. Верхняя панель: Окрашивание гематоксилином и эозином (H&E) репрезентативных мышиных легочных тканей на 21 день. Нижняя панель: окрашивание трихромным синим красителем по Массону тех же полей выявляет обширное отложение коллагена (стрелки) при повреждении блеомицином. Аббревиатуры: AW: дыхательный путь; NL: нормальная легочная архитектура; FF: фибротические очаги; V: вена.
[00154] На фиг.12 показано, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) предотвращает значительное отложение коллагена вследствие повреждения блеомицином. Величины представляют среднее ± SEM (стандартная ошибка среднего). n=5 животных на группу. '*' p<0,05; '**' p<0,01; '***' p<0,001. Коллагеновый индекс = постоянный фактор для коллагена 7,5× концентрации гидроксипролина.
[00155] На фиг.13 показано, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) предотвращает фиброз вследствие повреждения блеомицином дозозависимым образом. Окрашивание трихромным синим красителем по Массону срезов ткани легкого мышей, получавших блеомицин. (A) MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1); (B) MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19).
[00156] На фиг.14 показано, что системное введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) устраняет системную активацию T-клеток вследствие повреждения блеомицином. Величины представляют среднее±SEM. Величина 'p' <0,01. n=4 животных/группу. На фиг.14 показаны следующие аббревиатуры: (i) мыши дикого типа, которым вводили PBS (PBS); (ii) получавшие блеомицин мыши после введения PBS (BLEO); (iii) получавшие блеомицин мыши после лечения распыленным MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) (BLEO + MMI-0100 (NEB)) и (iv) получавшие блеомицин мыши после лечения внутрибрюшинным введением MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) (BLEO + MMI-0100 (IP)).
[00157] На фиг.15 показан схематический график для тестирования способности MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) устранять прогрессирование фиброза на модели вызванного блеомицином идиопатического легочного фиброза (модель лечения IPF). PBS или MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) вводят посредством распыления или внутрибрюшинно в дозах 50 мкг/кг один раз в день, начиная с 14 дня после введения блеомицина, до 28 дня после введения блеомицина.
[00158] На фиг.16 показано, что системное (IP) или ингаляционное (NEB) введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) облегчает течение вызванного блеомицином легочного фиброза у мышей. Верхняя панель: Окрашивание гематоксилином и эозином (H&E); Нижняя панель: Окрашивание трихромным синим красителем по Массону тех же полей. На фиг.16 показаны следующие аббревиатуры: PBS (мыши дикого типа, которым вводили PBS); BLEO (получавшие блеомицин мыши после введения PBS); MMI-0100 (NEB) (получавшие блеомицин мыши после лечения ингаляцией MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)); MMI-0100 (IP) (получавшие блеомицин мыши после лечения внутрибрюшинным введением MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)); NL (нормальная легочная архитектура с альвеолярными мешочками); AW (дыхательный путь); FF (фибробластные очаги из эксплантатов легочной ткани с IPF)
[00159] На фиг.17 показано, что MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) останавливает значительное отложение коллагена вследствие повреждения блеомицином. На фиг.17 показаны следующие аббревиатуры: PBS (мыши дикого типа, которым вводили PBS); BLEO (получавшие блеомицин мыши после введения PBS); BLEO+MMI-0100 (NEB) (получавшие блеомицин мыши после ингаляционного лечения MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)); BLEO+MMI-0100 (IP) (получавшие блеомицин мыши после лечения внутрибрюшинным введением MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)). Величины представляют среднее±SEM. n=5 животных на группу. Коллагеновый индекс = постоянный фактор для коллагена 7,5× концентрации гидроксипролина.
[00160] На фиг.18 показаны репрезентативные микрофотографии окрашивания анти-фосфо-Thr334-MAPKAPK2 (активированной формы MK2) легочных срезов (на 28 день после повреждения блеомицином) от (i) мышей дикого типа, которым вводили PBS (PBS); (ii) получавших блеомицин мышей после лечения PBS (BLEO); (iii) получавших блеомицин мышей после ингаляционного лечения MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) (BLEO + MMI-0100 (NEB)) и (iv) получавших блеомицин мышей после лечения внутрибрюшинным введением MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) (BLEO + MMI-0100 (IP)). Мышей C57-BL/6 подвергали легочному повреждению блеомицином в 0 день. На 14 день мышам вводили 50 мкг/кг MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) один раз в день внутрибрюшинной (IP) инъекцией или небулайзером (NEB) до 28 дня после повреждения легких блеомицином. Первоначальные увеличения: 20×.
[00161] На фиг.19 показаны ключевые молекулы передачи сигналов, участвующих в TGF-β-опосредованных воспалительных и фибротических путях.
[00162] На фиг.20 показано, что через 24 часа после последнего введения MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) снижает уровни циркулирующих воспалительных цитокинов на мышиной модели идиопатического легочного фиброза, вызванного блеомицином (модель лечения).
[00163] На фиг.21 показано, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) ингибирует активацию гладкомышечного альфа-актина (α-SMA) на модели лечения идиопатического легочного фиброза. Мышей C57-BL/6 подвергали повреждению блеомицином в 0 день. С 14 по 28 день мышам вводили 50 мкг/кг/день MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) внутрибрюшинной (IP) инъекцией или ингаляцией небулайзером (NEB). Проводили иммуноокрашивание для выявления α-SMA фиксированных формалином срезов легочной ткани. Контрольное окрашивание проводили биотинилированным вторичным IgG антителом. Конъюгированную со стрептавидином пероксидазу хрена использовали с 3,3'-диаминобензиденом в качестве субстрата, и ядра докрашивали гематоксилином. Первоначальные увеличения: 20×
[00164] На фиг.22 показана модуляция вызванной TGF-β активации миофибробластов ингибиторами пептида MK2 в фибробластах нормального человеческого фетального легкого (IMR-90). Клетки IMR-90 предварительно обрабатывали MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) в указанных дозах в течение 1 часа и затем культивировали в присутствии или в отсутствие TGF-β1 (2 нг/мл) в течение 48 часов. Проводили иммуноблоттинг клеточных лизатов с применением антител к α-SMA (маркера активации миофибробластов) и GAPDH (контроль загрузки).
[00165] На фиг.23 показана модуляция опосредованной TGF-β экспрессии фибронектина в фибробластах человеческого фетального легкого (IMR-90). Клетки IMR90 предварительно обрабатывали MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) в указанных дозах в течение 1 часа и затем культивировали в присутствии или отсутствие TGF-β1 (2 нг/мл) в течение 72 часов. Содержание фибронектина измеряли в виде секретируемых фрагментов в кондиционированной среде. Равные количества (14 мкг) общих белков из кондиционированной среды загружали на каждую полосу.
[00166] На фиг.24 показаны ключевые молекулы передачи сигналов, вовлеченные в регуляцию миграции мезенхимальных стволовых клеток, фибронектином посредством опосредованной α5β1-интегрином активации PDGFR-β (Veevers-Lowe J et al., J Cell Sci, 124: 1288-1300, 2011).
[00167] На фиг.25 показано увеличение уровня активированной формы киназы MK2 у пациентов с IPF. (A) количественный анализ уровней фосфо-Thr в нормальной и IPF тканях; (C) корреляция между легочной функцией и активацией MK2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00168] Описанное изобретение относится к композиции и способу лечения легочного фиброза у наждающегося в этом индивида, причем способ включает введение терапевтического количества композиции, содержащей полипептид, имеющий аминокислотную последовательность YARAAARQARAKALARQLGVAA (MMI-0100; SEQ ID NO: 1) или его функциональный эквивалент.
Глоссарий
[00169] Термин «дыхательный путь», используемый в настоящем описании, относится к каналам, через которые воздух поступает в организм и выходит из него. Легочные дыхательные пути включают те каналы респираторного тракта, через которые воздух проходит во время дыхания.
[00170] Термин «обстукция дыхательных путей», используемый в настоящем описании, относится к любому аномальному уменьшению воздушного потока. Сопротивление воздушному потоку может возникнуть в любом участке в дыхательных путях от верхних дыхательных путей до терминальных бронхов.
[00171] Термин «заболевание дыхательных путей», используемый в настоящем описании, относится к заболеванию, которое поражает трубки (дыхательные пути), которые несут кислород и другие газы в легкие и из легких. Заболевания дыхательных путей включают без ограничения хроническое обструктивное легочное заболевание (COPD), включая астму, эмфизему и хронический бронхит.
[00172] Термин «заболевание легочной ткани», используемый в настоящем описании, относится к заболеванию, которое поражает структуру легочной ткани, например, легочный интерстиций. Рубцевание или воспаление легочной ткани делает легкие неспособными к полному расправлению («рестриктивное легочное заболевание»). Оно также делает легкие менее способными к захвату кислорода (оксигенации) и выведению диоксида углерода. Примеры заболеваний легочной ткани включают без ограничения, идиопатический легочный фиброз (IPF), острое повреждение легких (ALI), вызванный излучением фиброз в легких и фибротическое состояние, связанное с трансплантацией легких. Саркоидоз представляет собой заболевание, при котором отек (воспаление) происходит в лимфоузлах, легких, глазах, коже или других тканях.
[00173] Термины «интерстиций легкого» или «легочный интерстиций» используются в настоящем описании взаимозаменяемо для ссылки на область, локализующуюся между эпителием дыхательных путей и плевральным мезотелием в легком. Волокна матриксных белков, коллаген и эластин представляют собой основные компоненты легочного интерстиция. Первичной функцией этих волокон является образование механического каркаса, который поддерживает структурную целостность во время дыхания.
[00174] Термин «доступная площадь поверхности» или «ASA», используемый в настоящем описании, относится к площади поверхности биомолекулы, которая подвергается воздействию растворителя. Термин «поверхность, доступная для растворителя» или «SAS», используемый в настоящем описании, относится к процентной доле площади поверхности данного остатка, которая доступна для растворителя. Она также рассчитывается как отношение между ASA остатка в трехмерной структуре и максимальной ASA его удлиненного пептидного подтверждения.
[00175] Термины «аминокислотный остаток» или «аминокислота» или «остаток» используются взаимозаменяемо для ссылки на аминокислоту, которая включена в белок, полипептид или пептид, включая без ограничения встречающуюся в природе аминокислоту и известные аналоги природных аминокислот, которые могут функционировать образом, аналогичным встречающимся в природе аминокислотам. Аминокислоты могут представлять собой L- или D-аминокислоты. Аминокислота может быть заменена синтетической аминокислотой, которая изменена с тем, чтобы увеличить период полувыведения пептида, увеличить активность пептида или увеличить биодоступность пептида.
[00176] В настоящем описании преимущественно используется однобуквенное обозначение аминокислот. Как хорошо известно специалисту в данной области, такие однобуквенные обозначения представляют собой следующие:
[00177] A обозначает аланин; C обозначает цистеин; D обозначает аспарагиновую кислоту; E обозначает глутаминовую кислоту; F обозначает фенилаланин; G обозначает глицин; H обозначает гистидин; I обозначает изолейцин; K обозначает лизин; L обозначает лейцин; M обозначает метионин; N обозначает аспарагин; P обозначает пролин; Q обозначает глутамин; R обозначает аргинин; S обозначает серин; T обозначает треонин; V обозначает валин; W обозначает триптофан; и Y обозначает тирозин.
[00178] Ниже представлены группы аминокислот, которые представляют собой консервативные замещения одной другую: 1) Аланин (A), Серин (S), Треонин (T); 2) Аспарагиновая кислота (D), Глутаминовая кислота (E); 3) Аспарагин (N), Глутамин (Q); 4) Аргинин (R), Лизин (K); 5) Изолейцин (I), Лейцин (L), Метионин (M), Валин (V); и 6) Фенилаланин (F), Тирозин (Y), Триптофан (W).
[00179] Пока контекст ясно не требует иного, используемые в настоящем описании формы единственного числа с неопределенными и определенным артиклями включают их соответствующие формы множественного числа. Например, ссылка на «полипептид» означает один или несколько «полипептидов».
[00180] Термин «добавление», используемый в настоящем описании, относится к вставке одного или нескольких оснований или одной или нескольких аминокислот в последовательность.
[00181] Термин «вводить», используемый в настоящем описании, относится к подаче, доставке, нанесению, отпуску, распределению или совместному введению. Термины «вводимый» или «введение» используются взаимозаменяемо и включают введение in vivo, а также введение непосредственно в ткань ex vivo. В целом, композиции могут вводиться системно или перорально, буккально, парентерально, топически, путем ингаляции или инсуффляции (т.е., через ротовую или носовую полость), или ректально в дозированных стандартных препаративных формах, содержащих по желанию обычные нетоксичные фармацевтически приемлемые носители, адъюванты и основы, или могут местно вводиться такими средствами как без ограничения инъекция, имплантация, трансплантация, топическое нанесение или парентерально. Дополнительное введение может выполняться, например, внутривенно, перикардиально, перорально, через имплантат, через слизистые оболочки, трансдермально, топически, внутримышечно, подкожно, внутрибрюшинно, подоболочечно, внутрилимфатически, в очаг поражения, или эпидурально. Введение может выполняться, например, один или множество раз и/или в течение одного или нескольких продолжительных периодов.
[00182] Термин «аллергическая реакция», используемый в настоящем описании, относится к реакции гиперчувствительности иммунной системы. Аллергические реакции возникают на в норме безвредные содержащиеся в окружающей среде вещества, известные как аллергены; эти реакции являются приобретенными, прогнозируемыми и быстрыми. Аллергическая реакция характеризуется избыточной активацией определенных лейкоцитов, называемых тучными клетками и базофилами, типом антитела, известного как IgE, приводя к крайней воспалительной реакции. Обычные аллергические реакции включают экзему, сыпь, сенную лихорадку, приступы астмы, пищевые аллергии и реакции на яд жалящих насекомых, таких как осы и пчелы.
[00183] Термин «α-гладкомышечный актин» или «α-SMA», используемый в настоящем описании, относится к белку актину, альфа-актину-2 (ACTA2; также известному как актин или аортальный гладкомышечный актин), впервые выделенному в сосудистых гладкомышечных клетках. Актины представляют собой высококонсервативные белки, экспрессированные во всех эукаротических клетках. Актиновые волокна образуют часть цитоскелета и играют существенные роли в регуляции клеточной формы и движения. Шесть различных изотипов актина были идентифицированы в клетках млекопитающих. Каждый кодируется выделенным геном и экспрессируется эволюционно регулируемым и тканеспецифическим образом. Альфа и бета цитоплазматические актины экспрессированы в широком разнообразии клеток, в то время как экспрессия альфа скелетного, альфа сердечного, альфа сосудистого и гамма кишечного актинов более ограничена специализированным типом мышечных клеток. Ген для альфа-гладкомышечного актина представляет собой один из нескольких генов, чья экспрессия относительно ограничена сосудистыми гладкомышечными клетками, но он в настоящее время обычнее всего используется в качестве маркера образования миофибробластов. Экспрессия альфа-гладкомышечного актина регулируется гормонами и клеточной пролиферацией и изменяется патологическими условиями, включая онкогенную трансформацию и атеросклероз.
[00184] Термин «альвеола» или «альвеолы», используемый в настоящем описании, относится к анатомической структуре, которая имеет форму пустой полости. Обнаруживаемые в легких легочные альвеолы представляют собой сферические выпячивания респираторных участков газообмена с кровью. Альвеолы содержат некоторое количество коллагена и эластичных волокон. Эластичные волокна обеспечивают возможность альвеолам растягиваться, по мере того как они заполняются воздухом при вдыхании. Они затем пружиняще сжимаются во время выдоха для изгнания воздуха, обогащенного диоксидом углерода.
[00185] Термин «блеомицин», используемый в настоящем описании, относится к гликопептидному антибиотику, продуцируемому бактерией Streptomyces verticillus. Он действует посредством индукции разрывов нитей ДНК и ингибированием включения тимидина в нить ДНК. Самым тяжелым осложнением применения блеомицина является легочный фиброз и нарушенная легочная функция.
[00186] Термин «бронхоальвеолярный лаваж» или «BAL», используемый в настоящем описании, относится к медицинской процедуре, при которой бронхоскоп проводится через ротовую или носовую полоть в легкие, и жидкость инфильтрируют в небольшую часть легкого и затем снова собирают для исследования. BAL обычно выполняют для диагностики легочных заболеваний. BAL обычно используют для диагностики инфекций у людей с проблемами иммунной системы, пневмонии у людей, находящихся на искусственной вентиляции легких, некоторых типов рака легкого и рубцевания легочной ткани (интерстициального легочного заболевания). BAL представляет собой наиболее распространенный прием взятия проб компонентов жидкости эпителиальной выстилки (ELF) и определения белкового состава легочных дыхательных путей, и часто используется в иммунологических исследованиях в качестве средства взятия проб клеток или уровней патогенов в легких.
[00187] Термины «носитель» и «фармацевтический носитель», используемые в настоящем описании, относятся к фармацевтически приемлемому инертному агенту или основе для доставки одного или нескольких активных средств индивиду, и часто именуется «эксципиентом». Фармацевтический носитель должен иметь достаточно высокую чистоту и достаточно низкую токсичность для того, чтобы он подходил для введения индивиду, получающему лечение. (Фармацевтический) носитель должен дополнительно поддерживать устойчивость и биодоступность активного средства, например, полипептида по описываемому изобретению. (Фармацевтический) носитель может быть жидким или твердым и выбирается, с учетом планируемого режима введения, для обеспечения желательного объема, консистенции и т.д. при комбинировании с активным средством и другими компонентами данной композиции. (Фармацевтический) носитель может представлять собой без ограничения связывающий агент (например, прежелатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу, и т.д.), наполнитель (например, лактозу или другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты, гидрофосфат кальция и т.д.), смазывающее вещество (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия, и т.д.), разрыхлитель (например, крахмал, гликоляткрахмал натрия и т.д.), или смачивающий агент (например, лаурилсульфат натрия, и т.д.). Другие подходящие (фармацевтические) носители для композиций по описываемому изобретению включают без ограничения воду, солевые растворы, спирты, полиэтиленгликоли, желатины, амилозы, стеараты магния, тальки, кремневые кислоты, вязкие парафины, гидроксиметилцеллюлозы, поливинилпирролидоны и тому подобные. Композиции, которые предназначены для парентерального введения полипептида по описываемому изобретению, могут включать (фармацевтические) носители, такие как стерильные водные растворы, неводные растворы в обычных растворителях, таких как спирты или растворы полипептида в жидкой масляной основе.
[00188] Термин «коллаген», используемый в настоящем описании, относится к группе встречающихся в природе белков, обнаруживаемых в плоти и в соединительных тканях млекопитающих. Он представляет собой основной компонент соединительной ткани и является самым распространенным белком у млекопитающих, составляя до примерно от 25% до 35% всего белка, содержащегося в организме. Коллаген в форме удлиненных волокон преимущественно обнаруживается в фиброзных тканях, таких как сухожилие, связка и кожа, и также имеется в изобилии в роговице, хряще, костях, кровеносных сосудах, кишечнике и межпозвонковом диске. До настоящего времени были идентифицированы 29 типов коллагена, и более 90% коллагена в организме относится к I типу (кожный, сухожильный, сосудистый, связочный, органный, костный), II типу (хрящевой), III типу (сетчатый (основной компонент ретикулярных волокон) и IV типу (которые образуют основы клеточной основной мембраны).
[00189] Термин «состояние», используемый в настоящем описании, относится к разнообразным состояниям здоровья и предназначен для включения расстройств или заболеваний, вызванных любым лежащим в его основе механизмом, расстройством или повреждением.
[00190] Термин «цитокин», который относится к малым растворимым секретируемым клетками белковым веществам, оказывающим разнообразные эффекты на другие клетки, в целом используется для обозначения многих передающих сигналы молекул, включая без ограничения лимфокины, интерлейкины и хемокины. Цитокины опосредуют важные физиологические функции, включая рост, развитие, заживление ран и иммунный ответ. Они действуют связыванием с их специфическими клеточными рецепторами, локализующимися в клеточной мембране, что обеспечивает возможность начала в клетке определенного каскада передачи сигналов, которые, в конечном счете, приведут к биохимическим и фенотипическим изменениям в клетках-мишенях. В целом, цитокины действуют локально, хотя было обнаружено, что некоторые оказывают системные иммуномодуляторные эффекты, при плейотропных, аутокринных и эндокринных эффектах, аналогичных гормонам. Они включают цитокины I типа, которые охватывают многие из интерлейкинов, а также несколько гематопоэтических факторов роста; цитокины II типа, включая интерфероны и интерлейкин-10; молекулы, связанные с фактором некроза опухоли («TNF»), включая TNF-α и лимфотоксин; суперсемейство иммуноглобулинов, включая интерлейкин 1 («IL-1») и хемокины, семейство молекул, которые играют решающую роль при широком разнообразии иммунных и воспалительных функций. Один и тот же цитокин может оказывать различные эффекты на клетку в зависимости от состояния клетки. Цитокины часто регулируют экспрессию других цитокинов и запускают их каскады.
[00191] Термины «заболевание» или «расстройство», используемые в настоящем описании, относятся к нарушению здоровья или к состоянию аномального функционирования, независимо от причины (либо наследственной, или экологической, диетологической, инфекционной, связанной с травмой или иных причин). Расстройства могут включать, например, без ограничения воспалительные и фибротические заболевания, фиброз, острое повреждение легких, фиброз, вызванный излучением, отторжение трансплантата, хроническое обструктивное легочное заболевание (COPD), эндотоксический шок, локализованное воспалительное заболевание, атеросклеротическое сердечно-сосудистое заболевание, Болезнь Альцгеймера, онкологические заболевания, нейронную ишемию, заболевания соединительной ткани и системные аутоиммунные заболевания, ревматоидный артрит, болезнь Крона, воспалительное заболевание кишечника, системную красную волчанку (SLE), синдром Шегрена, склеродермию, васкулит, гиперплазию интимы, стеноз, рестеноз, атеросклероз, опухоли из гладкомышечных клеток и их метастазы, спазм гладких мышц, стенокардию, стенокардию Принцметала, ишемию, инсульт, брадикардию, гипертонию, гипертрофию миокарда, почечную недостаточность, легочную гипертензию, астму, токсемию беременности, преждевременные роды, преэклампсию, эклампсию, болезнь или феномен Рейно, гемолитическую уремию, анальные трещины, ахалазию, импотенцию, мигрень, ишемическое мышечное повреждение, связанное со спазмом глазких мышц, васкулопатию, брадиаритмию, застойную сердечную недостаточность, ишемизированный миокард, диастолическую дисфункцию, глиоз (пролиферацию астроцитов, и может включать отложение внеклеточного матрикса (ECM) в поврежденных зонах центральной нервной системы), хроническое обструктивное легочное заболевание (т.е. заболевание дыхательных путей, характеризуемое обструкцией или ограничением воздушного потока, включает без ограничения хронический бронхит, эмфизему и хроническую астму), остеопению, эндотелиальную дисфункцию, воспаление, дегенеративный артрит, анкилозирующий спондилит, болезнь Гийена-Барре, инфекционные заболевания, сепсис, эндотоксемический шок, псориаз, радиационный энтерит, цирроз, интерстициальный фиброз, легочный фиброз (включая идиопатический легочный фиброз), колит, аппендицит, гастрит, ларингит, менингит, панкреатит, отит, реперфузионное повреждение, травматическое повреждение мозга, повреждение спинного мозга, периферическую нейропатию, рассеянный склероз, аллергию, кардиометаболические заболевания, ожирение, сахарный диабет II типа, сахарный диабет I типа и NASH (неалкогольный стеатогепатит)/цирроз.
[00192] Термин «домен», используемый в настоящем описании, относится к области белка с характерной третичной структурой и функцией и к любой из трехмерных субъединиц белка, которые вместе составляют его третичную структуру, образованную фолдингом его линейной пептидной цепи.
[00193] Термин «терапевтический домен» (также именуемый «TD»), используемый в настоящем описании, относится к пептиду, сегменту или варианта пептида или его производному с существенной идентичностью с пептидом KALARQLGVAA (SEQ ID NO: 2) или его сегментом. Сами терапевтические домены в целом не способны проникать через плазматическую мембрану клеток млекопитающих. После проникновения внутрь клетки, терапевтические домены могут ингибировать киназную активность определенной группы киназ.
[00194] Термин «проникающий в клетку пептид» (также именуемый «CPP», «трансдукционный домен белка», «PTD», «Троянский пептид», «мембранной транслоцирующейся последовательностью» и «проникающий в клетку белок»), используемый в настоящем описании, относится к классу пептидов, в целом способному проникать через плазматическую мембрану клеток млекопитающих. Он также относится к пептиду, сегменту пептида или его варианту или производному, с существенной идентичностью пептиду YARAAARQARA (SEQ ID NO: 11) или его функциональному сегменту, и к пептиду, сегменту пептида или его варианту или производному, который функционально эквивалентен SEQ ID NO: 11. CPP в целом имеют длину 10-16 аминокислот и способны транспортировать соединения многих типов и молекулярных масс через клетки млекопитающих. Такие соединения включают без ограничения эффекторные молекулы, такие как белки, ДНК, конъюгированные пептиды, олигонуклеотиды и малые частицы, такие как липосомы. CPP, химически связанные или слитые с другими белками («слитые белки») все же способны проникать через плазматическую мембрану и поступать в клетки.
[00195] Термин «внеклеточный матрикс», используемый в настоящем описании, относится к структуре внешнего окружения клетки, с которой клетка взаимодействует через специфические рецепторы клеточной поверхности. Внеклеточный матрикс составлен из переплетающейся сети волокнистых белков и гликозаминогликанов (GAG). Примеры волокнистых белков, обнаруживаемых во внеклеточном матриксе, включают без ограничения коллаген, эластин, фибронектин и ламинин. Примеры GAG, обнаруживаемых во внеклеточном матриксе, включают без ограничения протеогликаны (например, гепарин сульфат), хондроитин сульфат, куратин сульфат и непротеогликановый полисахарид (например, гиалуроновую кислоту). Термин «протеогликан» относится к группе гликопротеинов, которые содержат коровый белок, к которому прикрепляются один или несколько гликозаминогликанов. Внеклеточный матрикс выполняет многие функции, включая без ограничения обеспечение опоры и крепления для клеток, отделяя одну ткань от другой ткани и регулируя внутриклеточное сообщение.
[00196] Термины «функциональный эквивалент» или «функционально эквивалентные» используются взаимозаменяемо для обозначения веществ, молекул, полинуклеотидов, белков, пептидов или полипептидов, имеющих одинаковые или идентичные эффекты или использование. Полипептид, функционально эквивалентный полипептиду YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), например, может иметь биологическую активность, например, ингибиторную активность, кинетические параметры, солевое ингибирование, кофактор-зависимую активность и/или размер функциональной единицы, который по существу аналогичен или идентичен экспрессированному полипептиду SEQ ID NO: 1.
[00197] Примеры полипептидов, функционально эквивалентные YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), включают без ограничения полипептид аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептид аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), полипептид аминокислотной последовательности YARAAARQARAKALARQLAVA (SEQ ID NO: 5), полипептид аминокислотной последовательности YARAAARQARAKALARQLGVA (SEQ ID NO: 6) и полипептид аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
[00198] MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) пептид аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), описанный в настоящем изобретении, содержит слитый белок, в котором проникающий в клетку пептид (CPP; YARAAARQARA; SEQ ID NO: 11) функционально связан с терапевтическим доменом (KALARQLGVAA; SEQ ID NO: 2) для повышения терапевтической эффективности.
[00199] Примеры полипептидов, функционально эквивалентных терапевтическому домену (TD; KALARQLGVAA; SEQ ID NO: 2) полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) включают без ограничения полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8), полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9), и полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10).
[00200] Примеры полипептидов, функционально эквивалентных проникающему в клетку пептиду (CPP; YARAAARQARA; SEQ ID NO: 11) полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), включают без ограничения полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12), полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13), полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14), полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15), полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16), полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17) и полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18).
[00201] Термин «эндогенный», используемый в настоящем описании, относится к растущему или происходящему изнутри или полученному изнутри.
[00202] Термин «эндотелий», используемый в настоящем описании, относится к тонкому слою клеток, который выстилает внутреннюю поверхность кровеносных сосудов, образуя поверхность раздела между циркулирующей кровью и просветом и остальной сосудистой стенкой. Эндотелиальные клетки выстилают всю систему кровообращения от сердца до самых мелких капилляров. Эти клетки уменьшают турбулентность потока крови, обеспечивая возможность дальнейшей прокачки жидкости.
[00203] Термин «эозинофилы» или «эозинофильные гранулоциты», используемый в настоящем описании, относится к лейкоцитам, ответственным за борьбу с многоклеточными паразитами и определенными инфекциями у позвоночных. Они представляют собой гранулоциты, которые развиваются во время гематопоэза в костном мозге, перед миграцией в кровь. Наряду с тучными клетками, они также контролируют механизмы, связанные с аллергией и астмой. После активации, эозинофилы выполняют разнообразные функции, включая (1) продукцию катионных гранулярных белков и их высвобождение дегранулированием, (2) продукцию реактивных видов кислорода, таких как супероксид, пероксид и гипобромит (гипобромную кислоту, которая преимущественно продуцируется пероксидазой эозинофилов), (3) продукцию липидных медиаторов, таких как эйкозаноиды, из семейств лейкотриенов и простагландинов, (4) продукцию факторов роста, таких как трансформирующий фактор роста (TGF-β), сосудистый эндотелиальный фактор роста (VEGF) и тромбоцитарный фактор роста (PDGF), и (5) продукцию цитокинов, таких как IL-1, IL-2, IL-4, IL-5, IL-6, IL-8, IL-13 и TNF-α.
[00204] Термин «эпителий», используемый в настоящем описании, относится к ткани, составленной из клеток, которые выстилают полости и поверхности структур по всему организму. Базальная поверхность эпителия обращена к подлежащей соединительной ткани, и два слоя разделены основной мембраной.
[00205] Термин «экстравазация», используемый в настоящем описании, относится к перемещению компонентов клеток крови из капилляров в ткани, окружающие их (диапедез). В случае метастазирования злокачественных новообразований, он относится к раковым клеткам, выходящим из капилляров и поступающим в органы.
[00206] Термин «экссудация», используемый в настоящем описании, относится к процессу, посредством которого жидкость из системы кровообращения проходит через стенки кровеносных сосудов в поражения или зоны воспаления. Эксудаты крови содержат некоторые или все плазменные белки, тромбоциты и эритроциты.
[00207] Термин «фибрин», используемый в настоящем описании, относится к волокнистому белку, вовлеченному в свертывание крови. Он представляет собой фибриллярный белок, который полимеризируется для образования «сетки», которая образует гемостатическую пробку или сгусток (в сочетании с тромбоцитами) по раневому участку. Фибрин вовлечен в передачу сигналов, свертывание крови, активацию тромбоцитов и полимеризацию белка.
[00208] Термин «фибробласт», используемый в настоящем описании, относится к клетке соединительной ткани, которая производит и секретирует внеклеточные матриксные белки, включая без ограничения коллаген. Фибробласты, наиболее распространенный тип клеток, обнаруживаемых в соединительных тканях, играют важную роль в заживлении ран. Как и другие клетки соединительной ткани, фибробласты происходят из примитивной мезенхимы (типа рыхлой соединительной ткани, происходящей из всех трех зародышевых слоев и локализующейся в эмбрионах). В определенных ситуациях, эпителиальные клетки могут дать толчок развитию фибробластов, процессу, называемому эпителиально-мезенхимальным переходом. Фибробласты и фиброциты представляют собой два состояния одних и тех же клеток, причем первое представляет собой активированное состояние, а последнее - менее активное состояние, связанное с поддержанием и тканевым метаболизмом, причем оба термина иногда используются взаимозаменяемо.
[00209] Термин «миофибробласты», используемый в настоящем описании, относится к фибробластам в раневых зонах, которые имеют некоторые характеристики гладких мышц, такие как сократительные свойства и волокна, и, как считают, временно продуцируют коллаген III типа. Хотя существует много возможных путей развития миофибробластов, миофибробласты представляют собой клетки, которые по своей дифференциации находятся между фибробластами и гладкомышечными клетками. Во многих органах, подобных печени, легким и почкам, они в первую очередь вовлечены при фиброзе. В раневой ткани они участвуют в укреплении раны (путем внеклеточного отложения коллагеновых волокон) и затем сокращении ран (путем внутриклеточного сокращения и сопутствующего совмещения коллагеновых волокон опосредованным интегрином вытягиванием в пучки коллагеновых волокон).
[00210] Термин «фибронектин», используемый в настоящем описании, относится к гликопротеину внеклеточного матрикса с высокой молекулярной массой (~440 кДа), который связывается с покрывающими мембрану белками рецепторов матрикса клеточной поверхности («интегринами») и с компонентами внеклеточного матрикса, такими как коллаген, фибрин и гепарансульфат-протеогликаны (например, синдеканы). Фибронектин существует в виде димера, состоящего из двух почти идентичных мономеров, связанных парой дисульфидных мостиков. Существуют множественные изоформы фибронектина. Плазменный фибронектин является растворимым и циркулирует в крови и других биологических жидкостях, где, как считают, он усиливает свертывание крови, заживление ран и фагоцитоз. Другие изоформы собираются на поверхности клеток и откладываются во внеклеточном матриксе в виде высоконерастворимых волокон фибронектина. Волокна фибронектина, образующиеся на поверхности фибробластов или около нее, совмещаются с соседними внутриклеточными актиновыми стрессовыми волокнами, которые содействуют сборке секретируемых молекул фибронектина в фибриллы и влияют на ориентацию фибрилл. Фибронектин играет основную роль в клеточной адгезии, клеточной миграции и клеточной дифференциации, и он важен для таких процессов как заживление ран и эмбриональное развитие.
[00211] Термин «фиброз», используемый в настоящем описании, относится к образованию избыточной фиброзной соединительной ткани в органе или ткани как результату повреждения или воспаления их части или препятствия кровоснабжению. Он может представлять собой последствие нормальной реакции заживления, приводящей к образованию рубца, аномальному реактивному процессу или без известной или понятной этиологии.
[00212] Термин «ингаляция», используемый в настоящем описании, относится к акту всасывания содержащего медикаментозное средство пара с дыханием.
[00213] Термин «инсуффляция», используемый в настоящем описании, относится к акту доставки воздуха, газа или порошка под давлением в полость или камеру организма. Например, интраназальная инсуффляция относится к акту доставки воздуха, газа или порошка под давлением через нос.
[00214] Термин «устройство для ингаляционной подачи», используемый в настоящем описании, относится к прибору/аппарату или компоненту, который продуцирует мелкие капельки или аэрозоль из препаративной формы в виде жидкости или сухого порошка и используется для введения через ротовую полость для достижения легочного введения лекарственного средства, например, в растворе, порошке и тому подобных. Примеры устройства для ингаляционной подачи включают без ограничения небулайзер, дозирующий ингалятор и ингалятор сухого порошка (DPI).
[00215] Термин «небулайзер», используемый в настоящем описании, относится к устройству, используемому для введения жидкого лекарственного средства в форме тумана, ингалируемого в легкие.
[00216] Термин «дозирующий ингалятор», «MDI» или «вдуватель», используемый в настоящем описании, относится к находящемуся под избыточным давлением портативному устройству, в котором используются пропелленты для подачи определенного количества лекарственного препарата («отмеренной дозы») в легкие пациента. Термин «пропеллент», используемый в настоящем описании, относится к веществу, которое используется для выталкивания вещества, обычно, давлением газа, через суживающееся-расширяющееся сопло. Давление может создаваться сжатым газом или газом, продуцируемым химической реакцией. Вещество, выходящее из сопла, может представлять собой газ, жидкость, плазму или, перед химической реакцией, твердое вещество, жидкость или гель. Пропелленты, используемые в находящихся под избыточным давлением дозирующих ингаляторах, представляют собой сжиженные газы, традиционно хлорфторуглероды (CFC) и все больше гидрофторалканы (HFA). Подходящие пропелленты включают, например, хлорфторуглерод (CFC), такой как трихлорфторметан (также именуемый пропеллентом 11), дихлордифторметан (также именуемый пропеллентом 12) и 1,2-дихлор-1,1,2,2-тетрафторэтан (также именуемый пропеллентом 114), гидрохлорфторуглерод, гидрофторуглерод (HFC), такой как 1,1,1,2-тетрафторэтан (также именуемый пропеллентом 134a, HFC-134a или HFA-134a) и 1,1,1,2,3,3,3-гептафторпропан (также именуемый пропеллентом 227, HFC-227 или HFA-227), диоксид углерода, простой диметиловый эфир, бутан, пропан или их смеси. В других вариантах осуществления пропеллент включает хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод или их смеси. В других вариантах осуществления, гидрофторуглерод используется в качестве пропеллента. В других вариантах осуществления, HFC-227 и/или HFC-134a используются в качестве пропеллента.
[00217] Термин «ингалятор сухого порошка» или «DPI», используемый в настоящем описании, относится к устройству, аналогичному дозирующему ингалятору, но в котором лекарственное средство представлено в форме порошка. Пациент делает полный выдох, охватывает губами мундштук и затем быстро вдыхает порошок. Ингаляторы сухого порошка не требуют регулирования по времени и координации, которые необходимы при использовании MDI.
[00218] Термин «частицы», используемый в настоящем описании, относится к крайне малому ингредиенту (например, наночастицам, микрочастицам или в некоторых случаях к более крупным), в которых или на которых содержится композиция, как описано в настоящем документе.
[00219] Термины «легочный фиброз», «идиопатический легочный фиброз» и «криптогенный фиброзирующий альвеолит», используемые в настоящем описании, относятся к основному компоненту интерстициального легочного заболевания, характеризуемого аномальной пролиферацией фибробластов и отложением белков внеклеточного матрикса, которые ремоделируют нормальную структуру легочной ткани и нарушают ее функцию. Характерными поражениями для идиопатического легочного фиброза являются фибробластные очаги. Эти участки проявляются бурной репликацией мезенхимальных клеток и обильным отложением свежего внеклеточного матрикса.
[00220] Термины «фибротические участки» или «фибротические очаги», взаимозаменяемо используемые в настоящем описании, относятся к определенной локализации в ткани, образованные или развившиеся посредством избыточной фиброзной ткани.
[00221] Термин «слитый белок», используемый в настоящем описании, относится к белку или полипептиду, сконструированному объединением множественных белковых доменов или полипептидов с целью создания одного полипептида или белка с функциональными свойствами, происходящими из каждого из первоначальных белков или полипептидов. Создание слитого белка может осуществляться функциональным лигированием или связыванием двух различных нуклеотидных последовательностей, которые кодируют каждый белковый домен или полипептид, технологией рекомбинантной ДНК, посредством этого создавая новые полинуклеотидные последовательности, которые кодируют желательный слитый белок. Альтернативно, слитый белок может быть создан химическим соединением желательных белковых доменов.
[00222] Термин «идиопатические», используемый в настоящем описании, означает возникающие спонтанно или по неясной или неизвестной причине.
[00223] Термин «воспаление», используемый в настоящем описании, относится к физиологическому процессу, которым васкуляризированные ткани реагируют на повреждение. См., например, руководство FUNDAMENTAL IMMUNOLOGY, 4th Ed., William E. Paul, ed. Lippincott-Raven Publishers, Philadelphia (1999) at 1051-1053, включенное в настоящее описание путем ссылки. Во время воспалительного процесса клетки, вовлеченные в детоксификацию и репарацию, мобилизуются в поврежденный участок воспалительными медиаторами. Воспаление часто характеризуется сильной инфильтрацией лейкоцитов в участке воспаления, в частности, нейтрофилов (полиморфоядерных клеток). Эти клетки способствуют повреждению ткани путем высвобождения токсических веществ в сосудистой стенке или в поврежденной ткани. Традиционно, воспаление подразделяли на острые и хронические реакции.
[00224] Термин «острое воспаление», используемый в настоящем описании, относится к быстрой, кратковременной (в течение периода от минут до дней), относительно однородной реакции на острое повреждение, характеризуемой накоплениями жидкости, плазменных белков и нейтрофильных лейкоцитов. Примеры повреждающих агентов, которые вызывают острое воспаление, включают без ограничения патогены (например, бактерии, вирусы, паразиты), инородные тела из экзогенных (например, асбест) или эндогенных (например, кристаллы уратов, иммунные комплексы) источников и физические (например, ожоги) или химические (например, едкие вещества) агенты.
[00225] Термин «хроническое воспаление», используемый в настоящем описании, относится к воспалению, которое имеет более длительное течение и которое имеет неясный и неопределенный исход. Хроническое воспаление развивается, когда стойко продолжается хроническое воспаление, или вследствие неполного устранения воспалительного агента (например, курения), или в результате множественных острых явлений, возникающих в одном и том же участке. Хроническое воспаление, которое включает приток лимфоцитов и макрофагов и рост фибробластов, может привести к рубцеванию ткани в участках длительной или повторной воспалительной активности.
[00226] Термин «воспалительные медиаторы», используемый в настоящем описании, относится к молекулярным медиаторам воспалительных и иммунных процессов. Эти растворимые, диффузные молекулы действуют и местно в участке повреждения ткани и инфекции, и в более отдаленных участках. Некоторые воспалительные медиаторы активируются воспалительным процессом, тогда как другие синтезируются и/или высвобождаются из клеточных источников в ответ на острое воспаление или другими растворимыми воспалительными медиаторами; а еще одни проявляют противовоспалительные свойства. Примеры воспалительных медиаторов воспалительной реакции включают без ограничения плазменные протеазы, комплемент, кинины, белки свертывания и фибринолитические белки, липидные медиаторы, простагландины, лейкотриены, активирующий тромбоциты фактор (PAF), пептиды, гормоны (включая стероидные гормоны, такие как глюкокортикоиды) и амины, включая без ограничения гистамин, серотонин и нейропептиды, и провоспалительные цитокины, включая без ограничения интерлейкин-1-бета (IL-1β), интерлейкин-4 (IL-4), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли-альфа (TNF-α), интерферон-гамма (IF-γ), интерлейкин-12 (IL-12) и интерлейкин-17 (IL-17).
[00227] Известно, что среди провоспалительных медиаторов, IL-1, IL-6 и TNF-α активируют гепатоциты в острой фазе реакции для синтеза белков острой фазы, которые активируют комплемент. Комплемент представляет собой систему плазменных белков, которые взаимодействуют с патогенами для их маркировки для разрушения фагоцитами. Комплементарные белки могут активироваться непосредственно патогенами или опосредованно связанным с патогеном антителом, приводя к каскаду реакций, которые происходят на поверхности патогенов и генерируют активные компоненты с различными эффекторными функциями. IL-1, IL-6 и TNF-α также активируют эндотелий костного мозга для мобилизации нейтрофилов и функционируют в качестве эндогенных пирогенов, повышая температуру тела, что помогает устранению инфекций из организма. Основным эффектом цитокинов является действие на гипоталамус, изменяя регуляцию температуры тела, и на мышечные и жировые клетки, стимулируя катаболизм мышечных и жировых клеток для повышения температуры тела. При повышенных температурах бактериальные и вирусные репликации уменьшаются, в то время как адаптивная иммунная система работает более эффективно.
[00228] Термин «фактор некроза опухоли» используемый в настоящем описании, относится к цитокину, продуцируемому лейкоцитами, в ответ на антиген или инфекцию, которые вызывают некроз (гибель) опухолевых клеток и обладают широким диапазоном провоспалительных действий. Фактор некроза опухоли также представляет собой многофункциональный цитокин с воздействиями на липидный метаболизм, свертывание, устойчивость к инсулину и функцию эндотелиальных клеток, выстилающих кровеносные сосуды.
[00229] Термин «интерлейкин (IL)», используемый в настоящем описании, относится к цитокину из класса гомологично связанных белков, секреция которых сначала наблюдалась лейкоцитами, как и действие на них. С тех пор было обнаружено, что интерлейкины продуцируются широким разнообразием клеток организма. Интерлейкины регулируют клеточный рост, дифференциацию и подвижность и стимулируют иммунные ответы, такие как воспаление. Примеры интерлейкинов включают интерлейкин-1 (IL-1), интерлейкин-1β (IL-1β), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), интерлейкин-12 (IL-12) и интерлейкин-17 (IL-17).
[00230] Термины «ингибирующие», «ингибируют» или «ингибирование» используются вы настоящем описании для обозначения снижения количества или скорости процесса, к полной остановке процесса или к уменьшению, ограничению или блокировке его действия или функции. Ингибирование может включать снижение или уменьшение количества, скорости, функции, действия или процесса вещества по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%.
[00231] Термин «ингибитор», используемый в настоящем описании, относится ко второй молекуле, которая связывается с первой молекулой, посредством этого уменьшая активность первой молекулы. Ингибиторы ферментов представляют собой молекулы, которые связываются с ферментами, посредством этого уменьшая активность ферментов. Связывание ингибитора может остановить поступление субстрата в активный участок фермента и/или препятствовать катализу ферментом его реакции. Связывание ингибитора является или обратимым, или необратимым. Необратимые ингибиторы обычно взаимодействуют с ферментом и изменяют его химически, например, модификации ключевых аминокислотных остатков, необходимых для ферментативной активности. Напротив, обратимые ингибиторы связываются не ковалентно и продуцируют различные типы ингибирования, в зависимости от того, связывают ли эти ингибиторы фермент, комплекс фермент-субстрат или оба. Ферментные ингибиторы часто оценивают их специфичностью и активностью.
[00232] Термин «повреждение», используемый в настоящем описании, относится к травме или нанесению вреда структуре или функции организма, вызванному внешним агентом или силой, которые могут быть физическими или химическими.
[00233] Термин «выделенный» используется в настоящем описании для обозначения материала, такого как без ограничения нуклеиновая кислота, пептид, полипептид или белок, который: (1) по существу или в сущности не содержит компонентов, которые обычно сопровождают или взаимодействуют с, как обнаруживается в его естественном окружении. Термины «по существу не содержит» или «в сущности не содержит» используются в настоящем описании для обозначения существенного или значимого отсутствия или отсутствия более чем примерно на 95% или более чем примерно на 99% таких компонентов. Выделенный материал необязательно содержит материал, не обнаруживаемый с материалом в его естественном окружении; или (2) если материал находится в естественном окружении, материал был синтетически (не природным образом) изменен преднамеренным вмешательством человека в состав и/или помещен в участок в клетке (например, геном или субклеточную органеллу), не нативный материалу, обнаруживаемому в его окружении. Изменение выхода синтетического материала может выполняться на материале, находящемся внутри, или удаленном из его природного состояния. Например, встречающаяся в природе нуклеиновая кислота становится выделенной нуклеиновой кислотой, если она изменена, или если она транскрибирована из ДНК, которая была изменена посредством вмешательства человека, выполненного внутри клетки, из которой она происходит. См., например, документы Compounds and Methods for Site Directed Mutagenesis in Eukaryotic Cells, Kmiec, патент США № 5565350; In Vivo Homologous Sequence Targeting in Eukaryotic Cells; Zarling et al., PCT/US93/03868, каждый из которых полностью включен в настоящее описание путем ссылки. Аналогичным образом, встречающаяся в природе нуклеиновая кислота (например, промотор) становится выделенной, если она вводится не встречающимся в естественных условиях средством в локус генома, не нативного для этой нуклеиновой кислоты. Нуклеиновые кислоты, которые являются «выделенными», как определено в настоящем описании, именуются «гетерологичными» нуклеиновыми кислотами.
[00234] Термин «киназа», используемый в настоящем описании, относится к типу фермента, который переносит фосфатные группы из высокоэнергетических донорских молекул в специфические молекулы-мишени или субстраты. Высокоэнергетические донорские группы могут включать без ограничения АТФ.
[00235] Термин "лейкоцит" или «белая клетка крови (WBC)», используемый в настоящем описании, относится к типу иммунной клетки. Большинство лейкоцитов продуцируются в костном мозге и обнаруживаются в крови и лимфатической ткани. Лейкоциты помогают организму бороться с инфекциями и другими заболеваниями. Гранулоциты, моноциты и лимфоциты представляют собой лейкоциты.
[00236] Термин «лимфоциты», используемый в настоящем описании, относится к малой белой клетке крови (лейкоциту), которая играет большую роль в защите организма против заболеваний. Существуют два основных типа лимфоцитов: B-клетки и T-клетки. B клетки продуцируют антитела, которые атакуют бактерии и токсины, тогда как сами T-клетки атакуют клетки организма, когда они поражаются вирусами или становятся злокачественными. Лимфоциты секретируют продукты (лимфокины), которые модулируют функциональную активность многих других типов клеток, и часто присутствуют в участках хронического воспаления.
[00237] Термин «макрофаг», используемый в настоящем описании, относится к типу лейкоцита, который окружает и уничтожает микроорганизмы, удаляет мертвые клетки и стимулирует действие других клеток иммунной системы. После расщепления патогена, макрофаг презентирует антиген (молекулу, чаще всего белок, обнаруживаемый на поверхности патогена, используемый иммунной системой для идентификации) патогена соответствующей T-хелперной клетке. Презентация осуществляется интегрированием его в клеточную мембрану и демонстрацией его прикрепленным к молекуле II класса MHC (главного комплекса гистосовместимости), указывая другим лейкоцитам, что макрофаг не является патогеном, несмотря на наличие антигенов на его поверхности. В конечном счете, презентация антигена приводит к продукции антител, которые прикрепляются к антигенам патогенов, облегчая прилипание к ним макрофагов их клеточными мембранами и фагоцитоз.
[00238] Термин «мезенхимальная клетка» или «мезенхима», используемый в настоящем описании, относится к клетке, происходящей из всех трех зародышевых слоев, которые могут развиться в соединительную ткань, кость, хрящ, лимфатическую систему и систему кровообращения.
[00239] Термин «киназа MK2» или «MK2», используемый в настоящем описании, относится к протеинкиназе 2, активированной митоген-активированной протеинкиназой (также именуемой «MAPKAPK2», «MAPKAP-K2», «MK2»), которая является членом семейства серин/треонин (Ser/Thr) протеинкиназы.
[00240] Термин «масс-медианный аэродинамический диаметром» или «MMAD», используемый в настоящем описании, относится к медиане распределения массы содержащихся в воздухе частиц относительно аэродинамического диаметра. Величины MMAD обычно сопровождаются геометрическим стандартным отклонением (g или сигма g), которое характеризует вариабельность распределения размера частиц.
[00241] Термин «модулировать», используемый в настоящем описании, означает регулировать, изменять, адаптировать или подбирать к определенной мере или пропорции.
[00242] Термин «моноцит», используемый в настоящем описании, относится к типу иммунной клетки, которая продуцируется в костном мозге и перемещается через кровь в ткани в организме, где она становится макрофагом. Моноцит представляет собой тип лейкоцита и тип фагоцита.
[00243] Термин «нейтрофилы» или «полиморфоядерные нейтрофилы (PMN)», используемый в настоящем описании, относится к самому многочисленному типу лейкоцитов у млекопитающих, которые образуют существенную часть врожденной иммунной системы. Они образуют часть семейства полиморфоядерных клеток (PMN) вместе с базофилами и эозинофилами. Нейтрофилы обычно обнаруживаются в кровотоке. В течение начинающейся (острой) фазы воспаления, в частности, в результате бактериальной инфекции и некоторых форм рака, нейтрофилы являются одними из первых реагентов из воспалительных клеток, мигрирующих по направлению к участку воспаления. Они мигрируют по кровеносным сосудам, затем через интерстициальную ткань, следуя за химическими сигналами, такими как интерлейкин-8 (IL-8) и C5a, в процессе, называемом хемотаксисом, направленном движении подвижной клетки или части по градиенту химической концентрации в направлении условий среды, которые она считает привлекательными, и/или прочь от окружающих условий, которые она находит отпугивающими.
[00244] Термин «нормальный здоровый контрольный индивид», используемый в настоящем описании, относится к индивиду, у которого нет симптомов или другого клинического свидетельства заболевания ткани дыхательных путей или легких.
[00245] Термин «нуклеиновая кислота» используется в настоящем описании для ссылки на деоксирибонуклеотидный или рибонуклеотидный полимер в одиночно- или двухнитевой форме и, пока нет иных ограничений, охватывает известные аналоги, имеющие эссенциальную природу естественных нуклеотидов в том, что они гибридизуются с однонитевыми нуклеиновыми кислотами образом, который аналогичен встречающимся в природе нуклеотидам (например, пептидным нуклеиновым кислотам).
[00246] Термин «нуклеотид» используется в настоящем описании для ссылки на химическое соединение, которое состоит из гетероциклического основания, сахара и одной или нескольких фосфатных групп. В самых распространенных нуклеотидах основание представляет собой производное пурина или пиримидина, и сахар представляет собой пентозу, деоксирибозу или рибозу. Нуклеотиды представляют собой мономеры нуклеиновых кислот с тремя или более связанными вместе для образования нуклеиновой кислоты. Нуклеотиды представляют собой структурные единицы РНК, ДНК и нескольких кофакторов, включая без ограничения CoA (кофермент А), FAD (кофермент флавин аденин нуклеотид), DMN (диметилнитрозамин), NAD (никотинамид аденин динуклеотид), и NADP (никотинамид аденин динуклеотид фосфат). Пурины включают аденин (A) и гуанин (G); пиримидины включают цитозин (C), тимин (T) и урацил (U).
[00247] Следующие термины используются в настоящей заявке для описания взаимосвязей последовательностей между двумя или более нуклеиновыми кислотами или полинуклеотидами: (a) «контрольная последовательность», (b) «окно сравнения», (c) «идентичность последовательностей», (d) «процент идентичности последовательностей» и (e) «существенная идентичность».
[00248] (a) Термин «контрольная последовательность» относится к последовательности, используемой в качестве основы для сравнения последовательностей. Контрольная последовательность может представлять собой субпопуляцию или полную конкретную последовательность; например, в виде сегмента полноразмерной кДНК или генной последовательности, или полной кДНК или генной последовательности.
[00249] (b) Термин «окно сравнения» относится к смежному и определенному сегменту полинуклеотидной последовательности, где полинуклеотидная последовательность может сравниваться с контрольной последовательностью, и где часть полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е. пропуски), по сравнению с контрольной последовательностью (которая не содержит добавлении и делеции), для оптимального выравнивания двух последовательностей. В целом, окно сравнения имеет длину по меньшей мере 20 смежных нуклеотидов, и необязательно может иметь длину по меньшей мере 30 смежных нуклеотидов, длину по меньшей мере 40 смежных нуклеотидов, длину по меньшей мере 50 смежных нуклеотидов, длину по меньшей мере 100 смежных нуклеотидов или длиннее. Специалистам в данной области понятно, что во избежание высокого сходства с контрольной последовательностью вследствие включения пропусков в полинуклеотидную последовательность, обычно вводится штраф за пропуск в последовательности и вычитается из числа подборок.
[00250] Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения может проводиться алгоритмом локальной гомологии Смита и Уотермана, Adv. Appl. Math. 2:482 (1981); алгоритмом варавнивания и гомологии Нидлмана и Вунча, J. Mol. Biol. 48:443 (1970); способом поиска сходства Пирсона и Липмана, Proc. Natl. Acad. Sci. 85:2444 (1988); компьютеризированными осуществлениями этих алгоритмов без ограничения: CLUSTAL в программе PC/Gene компании Intelligenetics, Mountain View, Calif; GAP, BESTFIT, BLAST, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group (GCG), 575 Science Dr., Madison, Wis., USA; программа CLUSTAL подробно описана в публикациях Higgins and Sharp, Gene 73:237-244 (1988); Higgins and Sharp, CABIOS 5: 151-153 (1989); Corpet, et al., Nucleic Acids Research 16: 10881-90 (1988); Huang, et al., Computer Applications in the Biosciences, 8:155-65 (1992), and Pearson, et al., Methods in Molecular Biology, 24:307-331 (1994). Семейство программ BLAST, которые могут использоваться для поисков в базе данных сходства, включает: BLASTN для запроса нуклеотидной последовательности по базе данных нуклеотидных последовательностей; BLASTX для запроса нуклеотидной последовательности по базе данных белковых последовательностей; BLASTP для запроса белковой последовательности по базе данных белковых последовательностей; TBLASTN для запроса белковой последовательности по базе данных нуклеотидных последовательностей и TBLASTX для запроса нуклеотидной последовательности по базе данных нуклеотидных последовательностей. См., Current Protocols in Molecular Biology, Chapter 19, Ausubel, et al., Eds., Greene Publishing and Wiley-Interscience, New York (1995).
[00251] Если не указано иначе, величины идентичности/сходства, представленные в настоящем описании, относятся к величине, полученной с использованием набора программ BLAST 2.0 с использованием параметров по умолчанию. Altschul et al., Nucleic Acids Res. 25:3389-3402 (1997). Программное обеспечение для выполнения анализов BLAST общедоступно, например, через Национальный Центр биотехнологической информации (National Center for Biotechnology-Information). Этот алгоритм включает, во-первых, идентификацию пар последовательностей с высокими балльными оценками (HSP) путем идентификации коротких слов длины W в запрос на поиск последовательности, которая или совпадает, или удовлетворяет некоторой позитивно оцененной пороговой балльной оценке T при выравнивании со словом такой же длины в последовательности базы данных. T именуется пороговой балльной оценкой соседнего слова (Altschul et al., см. ссылку выше). Эти первоначальные совпадения соседнего слова действуют в качестве источников для инициации поисков для обнаружения более длинных HSP, содержащих их. Затем совпадения слова распространяются в обоих направлениях по каждой последовательности до тех пор, пока может увеличиваться кумулятивная балльная оценка выравнивания. Кумулятивные балльные оценки рассчитываются с использованием для нуклеотидных последовательностей параметров M (поощрительная балльная оценка для пары совпадающих остатков; всегда>0) и N (штрафная балльная оценка для неправильно подобранных остатков; всегда<0). Для аминокислотных последовательностей используется матрица балльной оценки для расчета кумулятивной балльной оценки. Удлинение совпадений слова в каждом направлении останавливаются, когда: кумулятивная балльная оценка выравнивания выпадает количеством X из ее максимальной достигнутой величины; кумулятивная балльная оценка снижается до нуля или ниже, вследствие накопления одного или нескольких оцениваемых негативной балльной оценкой выравниваний остатков; или достигается конец любой последовательности. Параметры алгоритма BLAST W, T и X определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) используется в качестве параметров по умолчанию длину слова (W) из 11, ожидание (E) из 10, отсечку из 100, M=5, N=-4, и сравнение обеих нитей. Для аминокислотных последовательностей, в программе BLASTP используются в качестве параметров по умолчанию длина слова (W) из 3, ожидание (E) из 10, и матрица подсчета балльной оценки BLOSUM62 (см. Henikoff & Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915).
[00252] В дополнение к расчету процента идентичности последовательностей, алгоритм BLAST также выполняет статистический анализ сходства между двумя последовательностями (см., например, публикацию Karlin & Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787 (1993)). Один показатель сходства, обеспечиваемый алгоритмом BLAST, представляет собой минимальную суммарную вероятность (P(N)), обеспечивающую показатель вероятности, с которой может случайно произойти совпадение двух нуклеотидных или аминокислотных последовательностей. BLAST осуществляет поиск с допущением, что белки могут моделироваться в виде случайных последовательностей. Однако многие реальные белки включают области неслучайных последовательностей, которые могут представлять собой гомополимерные тракты, короткопериодные повторы или области, обогащенные одной или несколькими аминокислотами. Такие несложные области могут быть выравнены между несвязанными белками, даже хотя другие области белка являются полностью различными. Для уменьшения таких несложных выравниваний, может использоваться ряд программ для того, чтобы отфильтровать несложные области. Например, могут отдельно или в комбинации использоваться фильтры несложных областей SEG (Wooten and Federhen, Comput. Chem., 17:149-163 (1993)) и XNU (Claverie and States, Comput. Chem., 17: 191-201 (1993)).
[00253] (c) Термин «идентичность последовательностей» или «идентичность» в контексте двух нуклеиновокислотных или полипептидных последовательностей используется в настоящем описании для ссылки на остатки в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия по определенному окну сравнения. Когда процент идентичности последовательностей используется в отношении белков, то признано, что положения остатков, которые не идентичны, часто отличаются консервативными аминокислотными замещениями, т.е. где аминокислотными остатками замещаются другие аминокислотные остатки со сходными химическими свойствами (например, зарядом или гидрофобностью), и поэтому не изменяют функциональные свойства молекулы. Когда последовательности отличаются консервативными замещениями, то процент идентичности последовательностей может регулироваться вверх для коррекции на консервативную природу замещения. Считают, что последовательности, которые отличаются такими консервативными замещениями, имеют «сходство последовательностей» или «сходство». Средства для осуществления такой регулировки хорошо известны специалистам в данной области. Обычно это включает оценку консервативного замещения скорее как частичную, а не полную ошибочную подборку, посредством этого увеличивая процент идентичности последовательностей. Так, например, когда идентичной аминокислоте дается балльная оценка 1, а не консервативному замещению дается балльная оценка ноль, то консервативному замещению дается балльная оценка между нулем и 1. Балльная оценка консервативных замещений рассчитывается, например, в соответствии с алгоритмом Meyers and Miller, Computer Applic. Biol. Sci., 4: 11-17 (1988), например, как осуществлено в программе PC/GENE (Intelligenetics, Mountain View, Calif, USA).
[00254] (d) Термин «процент идентичности последовательностей» используется в настоящем описании для обозначения величины, определяемой сравнением двух оптимально выровненных последовательностей по окну сравнения, где часть полинуклеотидной последовательности в окне сравнения может включать добавления или делеции (т.е. пропуски), по сравнению с контрольной последовательностью (которая не содержит добавления и делеции), для оптимального выравнивания двух последовательностей. Процент рассчитывается определением числа положений, в которых идентичное нуклеиновокислотное основание или аминокислотный остаток встречается в обеих последовательностях, для получения числа совпадающих положений, делением числа совпадающих положений на общее число положений в окне сравнения, и умножением результата на 100 для получения процентной доли идентичности последовательностей.
[00255] (e) Термин «существенная идентичность» полинуклеотидной последовательности означает, что полинуклеотид содержит последовательность, которая имеет идентичность последовательности по меньшей мере 70%, идентичность последовательности по меньшей мере 80%, идентичность последовательности по меньшей мере 90% и идентичность последовательности по меньшей мере 95% по сравнению с контрольной последовательностью, с использованием одной из описанных программ выравнивания, с использованием стандартных параметров. Специалисту в данной области понятно, что эти величины могут должным образом регулироваться для определения соответствующей идентичности белков, кодируемых двумя нуклеотидными последовательностями с учетом дегенерации кодона, сходства аминокислот, расположения рамки считывания и тому подобного. Существенная идентичность аминокислотных последовательностей в этих целях обычно означает идентичность последовательности по меньшей мере 60% или по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. Другим указанием на то, что нуклеотидные последовательности являются по существу идентичными, является условие, когда две молекулы гибридизуются друг с другом в жестких условиях. Однако нуклеиновые кислоты, которые не гибридизуются друг с другом в жестких условиях, все же являются по существу идентичными, если полипептиды, которые они кодируют, являются по существу идентичными. Это может возникать, например, когда копия нуклеиновой кислоты создается с использованием максимальной дегенерации кодона, допускаемой генетическим кодом. Одним указанием на то, что две нуклеиновокислотные последовательности являются по существу идентичными, является то, что полипептид, который кодирует первая нуклеиновая кислота, является иммунологически перекрестно реактивным с полипептидом, кодируемым второй нуклеиновой кислотой.
[00256] Фраза «функционально связанные», используемая в настоящем описании, относится к связи, при которой два или более белковых домена или полипептида лигируются или комбинируются посредством технологии рекомбинантной ДНК или химической реакции, так что каждый белковый домен или полипептид полученного слитого белка сохраняет его первоначальную функцию. Например, SEQ ID NO: 1 конструируется функциональным связыванием проникающего в клетку пептида (SEQ ID NO: 11) с терапевтическим доменом (SEQ ID NO: 2), посредством этого создавая слитый пептид, который обладает и функцией проникновения в клетку SEQ ID NO: 11, и функцией ингибитора киназы SEQ ID NO: 2.
[00257] Термин «паренхима», используемый в настоящем описании, относится к животной ткани, которая составляет существенную часть органа, в отличие от соединительной ткани или кровеносных сосудов. Термин «паренхиматозный» обозначает относящийся к паренхиме органа.
[00258] Термин «парентеральное», используемый в настоящем описании, относится к введению в организм путем инъекции (т.е. введение инъекцией), включая, например, подкожно (т.е. инъекцией под кожу), внутримышечную (т.е. инъекцию в мышцу), внутривенную (т.е. инъекцию в вену), подоболочечную (т.е. инъекцию в пространство вокруг спинного мозга или под сосудистую оболочку головного мозга), внутристернальную инъекцию или инфузионные методики, и включая внутрибрюшинную инъекцию или инфузию в полость тела (например, брюшную полость). Парентерально вводимая композиция доставляется с использованием иглы, например, хирургической иглы или другого устройства для корпорального доступа. Термин «хирургическая игла», используемый в настоящем описании, относится к любому устройству для доступа, приспособленному для подачи жидких (т.е. способных течь) композиций в выбранную анатомическую структуру. Инъецируемые препараты, такие как стерильные инъецируемые водные или масляные суспензии, могут быть составлены в соответствии с известными технологиями, используя диспергирующие или смачивающие агенты и суспендирующие агенты.
[00259] Термин «в форме частиц», используемый в настоящем описании, относится к тонкоизмельченным частицам твердого или жидкого вещества, суспендированным в газе или жидкости.
[00260] Используемый в настоящем описании термин «фармацевтически приемлемый носитель» относится к любому по существу нетоксичному носителю, обычно используемому для введения фармацевтических средств, в котором выделенный полипептид по настоящему изобретению останется устойчивым и биодоступным. Фармацевтически приемлемый носитель должен иметь достаточно высокую чистоту и достаточно низкую токсичность для обеспечения его пригодности для введения получающему лечение млекопитающему. Он должен дополнительно поддерживать устойчивость и биодоступность активного средства. Фармацевтически приемлемый носитель может быть жидким или твердым и выбирается с учетом планируемого пути введения, для обеспечения желательного объема, консистенции и т.д. при объединении с активным средством и другими компонентами данной композиции.
[00261] Термин «фармацевтически приемлемая соль» обозначает такие соли, которые, в пределах здравого медицинского суждения, пригодны для применения в контакте с тканями людей и низших животных без неприемлемой токсичности, раздражения, аллергической реакции и тому подобного, и соизмеримы с целесообразным отношением польза/риск.
[00262] Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо в настоящем описании для ссылки на полимер аминокислотных остатков. Термины относятся к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляет собой искусственный химический аналог соответственной встречающейся в природе аминокислоты, а также к встречающимся в природе аминокислотным полимерам. Существенная природа таких аналогов встречающихся в природе аминокислот состоит в том, что при включении в белок, этот белок специфически реагирует на антитела, вырабатываемые к тому же белку, но полностью состоящему из встречающихся в природе аминокислот.
[00263] Термины «полипептид» и «белок» также используются в настоящем описании в их самом широком смысле для ссылки на последовательность субъединичных аминокислот, аналогов аминокислот или пептидомиметиков. Субъединицы связаны пептидными связями, кроме указанных случаев. Полипептиды, описанные в настоящем документе, могут быть химически синтезированы или рекомбинантно экспрессированы. Полипептиды описанного изобретения также могут быть синтезированы химически. Синтетические полипептиды, полученные с использованием хорошо известных технологий твердой фазы, жидкой фазы или технологий конденсации пептидов, или любой их комбинации, могут включать природные и неприродные аминокислоты. Аминокислоты, используемые для синтеза пептидов, могут представлять собой стандартную Boc (N-α-амино защищенную N-α-трет-бутоксикарбонил) аминокислотную смолу со стандартными протоколами снятия защиты, нейтрализации, соединения и промывания оригинальной твердофазной процедуры Merrifield (1963, J. Am. Chem. Soc. 85:2149-2154), или основно-лабильные N-α-амино защищенные 9-флуоренилметоксикарбонил (Fmoc) аминокислоты, впервые описанные Carpino and Han (1972, J. Org. Chem. 37:3403-3409). И Fmoc, и Boc N-α-амино защищенные аминокислоты могут быть получены от компании Sigma, Cambridge Research Biochemical или других химических компаний, известным специалистам в данной области. Кроме того, полипептиды могут быть синтезированы с другими N-α-защитными группами, которые известны специалистам в данной области. Твердофазный пептидный синтез может быть осуществлен технологиями, известными специалистам в данной области и описанными, например, в руководствах Stewart and Young, 1984, Solid Phase Synthesis, Second Edition, Pierce Chemical Co., Rockford, III; Fields and Noble, 1990, Int. J. Pept. Белок Res. 35:161-214, или с использованием автоматизированных синтезаторов. Полипептиды по изобретению могут включать D-аминокислоты (которые устойчивы к протеазам, специфичным для L-аминокислот, in vivo), комбинацию D- и L-аминокислот и различные «конструирующие» аминокислоты (например, β-метиламинокислоты, C-α-метил-аминокислоты и N-α-метил-аминокислоты и т.д.) для передачи определенных свойств. Синтетические аминокислоты включают орнитин вместо лизина и норлейцин вместо лейцина или изолейцина. Кроме того, полипептиды могут иметь пептидомиметические связи, такие как сложноэфирные связи, для получения пептидов с новыми свойствами. Например, может быть генерирован пептид, который включает редуцированную пептидную связь, т.е. R1-CH2-NH-R2, где R1 и R2 обозначают аминокислотные остатки или последовательности. Редуцированная пептидная связь может быть введена в виде дипептидной субъединицы. Такой полипептид должен быть устойчивым к активности протеаз и должен иметь продолжительный период полувыведения in vivo. Соответственно, эти термины также относятся к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляет собой искусственный химический аналог соответствующей встречающейся в природе аминокислоты, а также к встречающимся в природе аминокислотным полимерам. Существенная природа таких аналогов встречающихся в природе аминокислот состоит в том, что при включении в белок белок специфически реагируют на антитела, вырабатываемые к тому же белку, но состоящему полностью из встречающихся в природе аминокислот.
[00264] Термины «полипептид», «пептид» и «белок» также включают модификации, такие как без ограничения гликозилирование, присоединение липидов, сульфатация, гамма-карбоксилирование остатков глутаминовой кислоты, гидроксилирование и АДФ-рибозилирование. Следует понимать, что, как хорошо известно и отмечено выше, полипептиды могут быть не только полностью линейными. Например, полипептиды могут быть разветвленными в результате убиквитинации, и они могут быть кольцевыми с разветвлением или без него, в целом, в результате посттрансляционных событий, включая событие естественного процессинга и события, осуществляемого манипуляцией человека, которое не происходит в естественных условиях. Кольцевые, разветвленные и разветвленные кольцевые полипептиды могут быть также синтезированы не трансляционным, естественным процессом и полностью синтетическими способами. В некоторых вариантах осуществления, пептид имеет любую длину или размер.
[00265] Термин «проэнзим» или «зимоген», используемый в настоящем описании, относится к неактивному предшественнику фермента. Зимоген требует биохимического изменения (такого как реакция гидролиза, выявляющая активный участок, или изменения конфигурации для выявления активного участка) для того, чтобы он стал активным ферментом. Биохимическое изменение обычно происходит в лизосоме, где специфическая часть предшественника фермента расщепляется для ее активации. Аминокислотная цепь, высвобождаемая после активации, называется активационным пептидом.
[00266] Термин «пролиферация», используемый в настоящем описании, относится к распространению популяции клеток путем непрерывного деления одиночных клеток на идентичные дочерние клетки.
[00267] Термин «легочный интерстиций», используемый в настоящем описании, относится к ткани и пространству вокруг воздушных мешочков легких.
[00268] Термин «легочная альвеола», используемый в настоящем описании, относится к анатомической структуре, которая имеет форму пустой полости. Альвеолы локализуются в дыхательной зоне легких, на дистальном окончании альвеолярных протоков и преддверий, образую точку окончания дыхательных путей. Легочные альвеолы представляют собой сферические выпячивания дыхательных участков газообмена с кровью в легких млекопитающих. Альвеолярная мембрана представляет собой поверхность газообмена. Кровь приносит диоксид углерода из остального тела для высвобождения в альвеолы, а кислород в альвеолах захватывается кровью в альвеолярные кровеносные сосуды для транспортировки во все клетки тела. Альвеолы содержат некоторое количество коллагена и эластических волокон. Эластические волокна обеспечивают возможность растяжения альвеол по мере их заполнения воздухом при вдохе. Они затем пружиняще возвращаются в исходное состояние во время выдоха для выталкивания обогащенного диоксидом углерода воздуха. Существуют три основных типа альвеолярных клеток в стенках альвеол (1) плоские альвеолярные клетки, которые образуют структуру альвеолярной стенки, (2) большие альвеолярные клетки, которые секретируют легочное поверхностно-активное вещество для снижения поверхностного натяжения воды и обеспечения возможности отделения мембраны, посредством этого увеличивая способность осуществления газообмена, (3) макрофаги, которые разрушают инородные патогены, такие как бактерии.
[00269] Термин «сходные» используется взаимозаменяемо с терминами аналогичные, сравнимые или напоминающие, что значит имеющие общие признаки или характеристики.
[00270] Термин «раствор», используемый в настоящем описании, относится к однородной смеси двух или более веществ. Он часто, но необязательно, представляет собой жидкость. В растворе молекулы солюта (или растворенного вещества) равномерно распределяются среди молекул растворителя.
[00271] Термины «растворимый» и «растворимость» относятся к свойству восприимчивости к растворении в конкретной текучей среде (растворителе). Термин «нерастворимый» относится к свойству материала, который имеет минимальную или ограниченную растворимость в определенном растворителе. В растворе молекулы солюта (или растворенного вещества) равномерно распределяются среди молекул растворителя.
[00272] Термин «стрессовое волокно», используемый в настоящем описании, относится к высокоупорядоченным структурам в клетках, состоящих из актиновых филаментов, поперечно сшивающих белков (белков, которые связывают вместе два или более филаментов) и двигательные единицы миозина II типа (мышечного миозина). Актин представляет собой глобулярный белок (~43 кДа), который полимеризируется и формируется в упорядоченную волоконнную структуру, которая имеет две протофибриллы, оборачивающиеся друг вокруг друга, для образования одного «актинового филамента», также известного как «микрофиламент». Миозиновые двигательные единицы в стрессовых волокнах движутся за счет скольжения актиновых филаментов друг по другу с тем, чтобы волокно могло сокращаться. Для того чтобы сокращение генерировало силы, волокна должны быть прикреплены к чему-нибудь. Стрессовые волокна могут прикрепляться к клеточной мембране, и часто участки, где происходит прикрепление, также соединены со структурами снаружи клетки (матрицей или неким другим субстратом). Эти участки соединения называются фокальными адгезиями. Для продукции и поддержания должной фокальной адгезии требуется много белков. Сокращение относительно этих фиксированных наружных субстратов представляет собой то, что обеспечивает возможность силе, генерированной миозиновыми двигательными единицами, и росту и перестройке волокон для движения и восстановления первоначальной формы клетки.
[00273] Термин «суспензия», используемый в настоящем описании, относится к дисперсии (смеси), в которой тонкоизмельченное вещество объединяется с другим веществом, причем первое настолько тонко измельчено и смешано, что оно быстро не выпадает в осадок. В повседневной жизни, наиболее распространенными суспензиями являются суспензии твердых веществ в жидкости.
[00274] Термины «субъект» или «индивид» или «пациент» используются взаимозаменяемо для ссылки на члена вида животных, относящихся к млекопитающим, включая без ограничения мышь, крысу, кошку, козу, овцу, лошадь, хомяка, хорька, утконоса, свинью, собаку, морскую свинку, кролика и примата, такого как, например, нечеловекообразная и человекообразная обезьяна или человек.
[00275] Фраза «индивид, нуждающийся в таком лечении», используемая в настоящем описании, относится к пациенту, который страдает заболеванием, расстройством, состоянием или аномальным процессом. В некоторых вариантах осуществления, термин «индивид, нуждающийся в таком лечении» также используется для ссылки на пациента, которому (i) будет введен по меньшей мере один пептид по изобретению; (ii) получает по меньшей мере один полипептид по изобретению или (iii) получал по меньшей мере один полипептид по изобретению, пока контекст и использование фразы не указывает на иное.
[00276] Термин «замещение» используется в настоящем описании для ссылки на ситуацию, при которой основание или основания заменяется другим основанием или основаниями в последовательности ДНК. Замещения могут представлять собой синонимические замещения или несинонимические замещения. Используемый в настоящем описании термин «синонимические замещения» относится к замещениям одного основания на другое в экзоне гена, кодирующего белок, так, чтобы полученная аминокислотная последовательность не модифицировалась. Термин «несинонимические замещения», используемый в настоящем описании, относится к замещениям одного основания на другое в экзоне гена, кодирующего белок, с тем, чтобы полученная аминокислотная последовательность была модифицирована.
[00277] Термины «терапевтическое количество», «эффективное количество» или «фармацевтически эффективное количество» активного средства используются взаимозаменяемо для ссылки на количество, которое достаточно для обеспечения предполагаемого благоприятного эффекта лечения. Например, «терапевтическое количество» ингибирующей киназу композиции по описанному изобретению включает без ограничения количество, достаточное: (1) для удаления или уменьшения размера по меньшей мере одного фибротического очага или (2) для снижения частоты отложения внеклеточного матрикса, включающего коллаген и фибронектин, в интерстиции в легких пациента с легочным фиброзом. Термин также охватывает количество, достаточное для подавления или облегчения по меньшей мере одного симптома легочного фиброза, причем симптом включает без ограничения насыщение кислородом, одышку (затруднение дыхания), кашель без отделения мокроты (что значит внезапное, шумное изгнание воздуха из легких, которое может быть вызвано раздражением или воспалением, и не удаляет мокроты из дыхательных путей), утолщение концевых фаланг пальцев (деформация пальцев, придающая им вид барабанных палочек) и влажные хрипы (хрипящий звук в легких во время вдоха, иногда именуемый хрипами или крепитацией).
[00278] Эффективное количество активного средства, которое может использоваться в соответствии с описанным изобретением, в целом находится в диапазоне от примерно 0,001 мг/кг массы тела до примерно 10 г/кг массы тела. Однако уровни дозировки основаны на разнообразных факторах, включая тип повреждения, возраст, массу тела, пол, медицинское состояние пациента, тяжесть состояния, путь и частоту введения и конкретное применяемое активное средство. Таким образом, схема введения может варьироваться в широком диапазоне, но может обычно определяться врачом с использованием стандартных способов.
[00279] Термин «лечить» или «лечение» включает устранение, существенное ингибирование, замедление или обратное развитие прогрессирования заболевания, состояния или расстройства, существенное облегчение клинических или эстетических симптомов состояния, существенное предотвращение появления клинических или эстетических симптомов заболевания, состояния или расстройства и защиту от вредных или досаждающих симптомов. Лечение дополнительно относится к осуществлению одного или нескольких из следующих эффектов: (a) уменьшение тяжести расстройства; (b) ограничение развития симптомов, характерных для подвергаемого лечению расстройств(-а); (c) ограничение усугубления симптомов, характерных для подвергаемого лечению расстройств(-а); (d) ограничение рецидива расстройств(-а) у пациентов, у которых ранее было расстройство(-а); и (e) ограничение рецидива симптомов у пациентов, у которых ранее не было симптомов расстройств(-а).
[00280] Термины «варианты», «мутанты» и «производные» используются в настоящем описании для ссылки на нуклеотидные или полипептидные последовательности с существенной идентичностью с контрольной нуклеотидной или полипептидной последовательностью. Различия последовательностей могут быть результатом изменений последовательности или структуры либо в природе, либо конструированием. Естественные изменения могут возникать во время хода нормальной репликации или дупликации природы конкретной последовательности нуклеиновой кислоты. Планируемые изменения могут специально проектироваться и вводиться в последовательность для определенных целей. Такие специфические изменения могут осуществляться in vitro с использованием разнообразных технологий мутагенеза. Такие специально генерированные варианты последовательностей могут именоваться «мутантами» или «производными» первоначальной последовательности.
[00281] Специалист в данной области может аналогичным образом получить варианты полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеющие одно или множество замещений, делеций, добавлений или замен аминокислот, но функционально эквивалентные SEQ ID NO: 1. Эти варианты, наряду с другими. Могут включать: (a) варианты, в которых один или несколько аминокислотных остатков замещены консервативными или неконсервативными аминокислотами; (b) варианты, в которых добавлены одна или несколько аминокислот; (c) варианты, в которых по меньшей мере одна аминокислота включает замещающую группу; (d) варианты, в которых аминокислотными остатками от одного вида замещены соответствующие остатки у другого вида, или в консервативных, или в неконсервативных положениях; и (d) варианты, в которых белок-мишень слит с другим пептидом или полипептидом, таким как сливающаяся клетка, белковая метка или другая химическая составляющая часть, которая может придать полезные свойства белку-мишени, например, эпитоп для антитела. Технологии для получения таких вариантов, включая без ограничения генетические (суппрессии, делеции, мутации и т.д.), химические и ферментативные технологии, известны специалисту в данной области. Используемый в настоящем описании термин «мутация» относится к изменению последовательности ДНК внутри гена или хромосомы организма, приводящему к созданию новой характерной особенности или признака, не обнаруживаемого в родительском типе, или процессу, которым такое изменение происходит в хромосоме, или посредством изменения в нуклеотидной последовательности ДНК, кодирующей ген, или посредством изменения физического расположения хромосомы. Три механизма мутации включают замещение (обмен одной пары оснований на другую), добавление (вставку одного или нескольких оснований в последовательность) и делецию (потерю одной или нескольких пар оснований).
[00282] Термин «носитель», используемый в настоящем описании, относится к веществу, которое способствует применению лекарственного средства или другого материала, который смешан с ним.
[00283] Термин «заживление ран» или «репарация ран», используемый в настоящем описании, относится в целом к естественному процессу репарации ткани организма после травмы. Когда у индивида происходит ранение, происходит набор сложных биохимических процессов для восстановления повреждения, включая гемостаз, воспаление, пролиферацию и ремоделирование.
I. Композиции: Терапевтические пептиды для профилактики или лечения заболеваний, характеризуемых аберрантной пролиферацией фибробластов и отложением коллагена
[00284] В соответствии с одним аспектом, описанное изобретение относится к фармацевтической композиции для применения в лечении заболевания, состояния или процесса, характеризуемого аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в ткани индивида,
[00285] где фармацевтическая композиция содержит терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента, и его фармацевтически приемлемый носитель, и
[00286] где терапевтическое количество эффективно для уменьшения пролиферации фибробластов и отложения внеклеточного матрикса в ткани индивида.
[00287] В соответствии с одним вариантом осуществления, заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS).
[00288] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой фиброз, вызванный излучением.
[00289] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой отторжение трансплантата.
[00290] В соответствии с еще одним вариантом осуществления, ткань представляет собой легочную ткань.
[00291] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой интерстициальное легочное заболевание.
[00292] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой легочный фиброз.
[00293] В соответствии с еще одним вариантом осуществления, легочный фиброз представляет собой идиопатический легочный фиброз.
[00294] В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате введения блеомицина.
[00295] В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легких индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации.
[00296] В соответствии с еще одним вариантом осуществления, заболевание или состояние дополнительно характеризуется воспалением в ткани.
[00297] В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое или хроническое воспаление.
[00298] В соответствии с еще одним вариантом осуществления, воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β).
[00299] В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00300] В соответствии с еще одним вариантом осуществления, аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00301] В соответствии с еще одним вариантом осуществления, об аберрантной пролиферации фибробластов и отложении внеклеточного матрикса в ткани свидетельствует аберрантное количество или распределение активированной (фосфорилированной) протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с количеством или распределением активированной протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00302] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность киназы, выбранной из группы, перечисленной в таблице 1 в настоящем описании.
[00303] В соответствии с еще одним вариантом осуществления, это ингибирование может, например, быть эффективным для снижения пролиферации фибробластов, отложения внеклеточного матрикса или их комбинации в ткани индивида.
[00304] В соответствии с еще одним вариантом осуществления, это ингибирование может, например, быть эффективным для уменьшения по меньшей мере одной патологии, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00305] В соответствии с некоторыми вариантами осуществления, ингибиторные профили ингибиторов MMI in vivo зависят от дозировок, путей введения и типов клеток, реагирующих на ингибиторы.
[00306] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая активность ингибирует по меньшей мере 65% киназной активности киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности этой киназы.
[00307] В соответствии с некоторыми вариантами осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (киназы MK2). В соответствии с некоторыми другими вариантами осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы MK2. В соответствии с некоторыми другими вариантами осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности киназы MK2.
[00308] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 3, активированной митоген-активированной протеинкиназой (киназы MK3). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 70% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности киназы MK3.
[00309] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00310] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00311] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3).
[00312] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00313] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00314] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), киназную активность протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3), киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00315] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00316] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2).
[00317] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3).
[00318] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00319] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00320] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3).
[00321] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00322] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00323] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), по меньшей мере 65% киназной активности протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3), по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00324] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность по меньшей мере одной киназы, выбранной из группы MK2, MK3, CaMKI, TrkB, без существенного ингибирования активности одной или нескольких других выбранных киназ из остающейся группы, перечисленной в настоящем описании в таблице 1.
[00325] В соответствии с некоторыми вариантами осуществления, ингибиторные профили ингибиторов MMI in vivo зависят от дозировок, путей введения и типов клеток, реагирующих на ингибиторы.
[00326] В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 50% киназной активности другой выбранной киназы (киназ). В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 65% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 50% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 40% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 20% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 15% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 10% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 5% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция увеличивает киназную активность других выбранных киназ.
[00327] В соответствии с вариантами осуществления, представленными непосредственно в предшествующем абзаце, одна или несколько других выбранных киназ, которые по существу не ингибируются, выбраны из группы Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII, включая ее субъединицу CaMKIIδ), серин/треонин-протеинкиназы прото-онкогена (PIM-1), клеточной-саркомы (c-SRC), селезеночной тирозинкиназы (SYK), C-src тирозинкиназы (CSK) и рецептора инсулиноподобного фактора роста 1 (IGF-1R).
[00328] В соответствии с некоторыми вариантами осуществления, фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство.
[00329] В соответствии с некоторыми такими вариантами осуществления, дополнительное терапевтическое средство выбрано из группы, состоящей из очищенных бычьих коллагенов V типа (например, IW-001; Immune Works; United Therapeutics), антагонистов рецепторов IL-13 (например, QAX576; Novartis), ингибиторов протеинтирозинкиназы (например, иматиниба (Gleevec®); Craig Daniels/Novartis), антагонистов эндотелиальных рецепторов (например, ACT-064992 (мацитентана); Actelion), антагонистов рецепторов эндотелина двойного действия (например, босентана (траклир®); Actelion), аналогов простациклина (ингаляционного илопроста (например, вентависа®); Actelion), моноклональных антител к CTGF (например, FG-3019), антагонистов рецепторов эндотелина (A-селективных) (например, амбрисентана (Letairis®), Gilead), AB0024 (Arresto), подобных лизилоксидазе 2 (LOXL2) моноклональных антител (например, GS-6624 (ранее AB0024); Gilead), ингибиторов c-Jun-N-концевой киназы (JNK) (например, CC-930; Celgene), пирфенидона (например, Esbriet® (InterMune), Pirespa® (Shionogi)), IFN-γ1b (например, Actimmune®; InterMune), пан-нейтрализующих IgG4 человеческих антител против всех трех изоформ TGF-β (например, GC1008; Genzyme), ингибиторов активации TGF-β (например, стромедикса (STX-100)), рекомбинантного человеческого белка пентраксина-2 (rhPTX-2) (например, PRM151; промедиора), биспецифических антител IL4/IL13 (например, SAR156597; Sanofi), гуманизированных моноклональных антител, нацеленных на интегрин αvβ6 (BIBF 1120; Boehringer Ingelheim), N-ацетилцистеина (Zambon SpA), силденафила (Viagra®;), антагонистов TNF (например, этанерцепта (Enbrel®); Pfizer), глюкокортикоидов (например, преднизона, будезонида, мометазона фуроата, флутиказона пропионата и флутиказона фуроата), бронхолитических средств (например, модификаторов лейкотриена (например, монтелукаста (SINGUAIR®)), антихолинергических бронхолитиков (например, ипратропия бромида и тиотропия), β2-агонистов короткого действия (например, изоэтарина месилата (Bronkometer®), адреналина, сальбутанол/альбутерола и тербуталина), длительно действующих β2-агонистов (например, сальметерола, формотерола, индекатерола (Onbrez®) и их комбинации.
[00330] В соответствии с некоторыми другими вариантами осуществления, дополнительное терапевтическое средство содержит бронхолитическое средство, включая без ограничения модификатор лейкотриена, антихолинергический бронхолитик, β2-агонист или их комбинацию.
[00331] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит кортикостероид, включая без ограничения преднизон, будезонид, мометазон, беклеметазон или их комбинации.
[00332] В соответствии с некоторыми другими вариантами осуществления, дополнительное терапевтическое средство представляет собой противовоспалительное средство.
[00333] В соответствии с некоторыми такими вариантами осуществления, противовоспалительное средство представляет собой нестероидное противовоспалительное средство. Термин «нестероидное противовоспалительное средство», используемый в настоящем описании, относится к большой группе средств, которые по их действию подобны аспирину, включая без ограничения ибупрофен (Advil®), напроксен натрия (Aleve®) и ацетаминофен (Tylenol®). Дополнительные примеры нестероидных противовоспалительных средств, которые применимы в контексте описанного изобретения, включают без ограничения оксикамы, такие как пироксикам, изоксикам, теноксикам, судоксикам и CP-14,304; дизалцид, бенорилат, трилисат, сафаприн, солприн, дифлунизал и фендозал; производные уксусной кислоты, такие как диклофенак, фенклофенак, индометацин, сулиндак, толметин, изоксепак, фурофенак, тиопинак, зидометацин, ацематацин, фентиазак, зомепирак, клинданак, оксепинак, фелбинак и кеторолак; фенаматы, такие как мефенамовая, меклофенамовая, флуфенамовая, нифлумовая и толфенамовая кислоты; производные пропионовой кислоты, такие как беноксапрофен, флурбипрофен, кетопрофен, фенопрофен, фенбуфен, индопрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен, миропрофен, тиоксапрофен, супрофен, алминопрофен и тиапрофеновая кислота; пиразолы, такие как фенилбутазон, оксифенбутазон, фепразон, азапропазон и триметазон. Могут также использоваться смеси этих нестероидных противовоспалительных средств, а также дерматологически приемлемые соли и сложные эфиры этих средств. Например, этофенамат, производное флуфенамовой кислоты, особенно полезно для топического нанесения.
[00334] В соответствии с еще одним вариантом осуществления, нестероидное противовоспалительное средство содержит трансформирующий фактор роста-β3 (TGF-β3), средство против фактора некроза опухоли-альфа (TNF-α) или их комбинацию.
[00335] В соответствии с еще одним вариантом осуществления, противовоспалительное средство представляет собой стероидное противовоспалительное средство. Термин «стероидное противовоспалительное средство», используемый в настоящем описании, относится к любому из многочисленных соединений, содержащих систему из 4 колец и 17 атомов углерода, и включает стерины, различные гормоны (в качестве анаболических стероидов) и гликозиды. Репрезентативные примеры стероидных противовоспалительных лекарственных средств включают без ограничения кортикостероиды, такие как гидрокортизон, гидроксилтриамсинолон, альфа-метилдексаметазон, дексаметазон фосфат, беклометазон дипропионат, клобетазол валерат, дезонид, дезоксиметазон, дезоксикортикостерон ацетат, дексаметазон, дихлоризон, дифлукортолон валерат, флуадренолон, флуклоролон ацетонид, флуметазон пивалат, флуозинолон ацетонид, флуоцинонид, сложные бутиловые эфиры флукортина, флуокортолон, флупредниден (флупреднилиден) ацетат, флурандренолон, галцинонид, гидрокортизон ацетат, гидрокортизон бутират, метилпреднизолон, триамсинолон ацетонид, кортизон, кортодоксон, флуцетонид, флудрокортизон, дифлуорозон диацетат, флурадренолон, флудокортизон, дифлорозон диацетат, флурадренолон, флудрокортизон, дифлорозон диацетат, флурадренолон ацетонид, медризон, амцинафел, амцинафид, бетаметазон и остальная часть его сложных эфиров, хлорпреднизон, хлорпреднизон ацетат, клокортелон, клесцинолон, дихлоризон, дифлурпреднат, флуклоронид, флунизолид, фторметалон, флуперолон, флупреднизолон, гидрокортизон валерат, гидрокортизон циклопентилпропионат, гидрокортамат, мепреднизон, параметазон, преднизолон, преднизон, бекламетазон дипропионат, триамцинолон и их смеси.
[00336] В соответствии с еще одним вариантом осуществления, стероидное противовоспалительное средство включает по меньшей мере один кортикостероид, выбранный из группы, состоящей из преднизона, будезонида, мометазона, беклеметазона и их комбинации.
[00337] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство включает ксантин или производное ксантина, такое как метилксантин.
[00338] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство включает ингибитор эластазы нейтрофилов.
[00339] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой по меньшей мере один ингибитор эластазы нейтрофилов, включая без ограничения ICI 200355, ONO-5046, MR-889, L-694,458, CE-1037, GW-311616, TEI-8362, ONO-6818, AE-3763, FK-706, ICI-200,880, ZD-0892, ZD-8321 и их комбинацию.
[00340] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство включает по меньшей мере один ингибитор фосфодиэстеразы, включая без ограничения ингибитор фосфодиэстеразы 4. Примеры ингибиторов фосфодиэстеразы 4 включают без ограничения рофлумиласт, циломиласт или их комбинации.
[00341] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой анальгетическое средство. В соответствии с некоторыми вариантами осуществления, анальгетическое средство облегчает боль подъемом болевого порога без нарушения сознания или изменения других сенсорных восприятий. В соответствии с некоторыми такими вариантами осуществления, анальгетическое средство представляет собой неопиоидный анальгетик. «Неопиоидные анальгетики» представляют собой натуральные или синтетические вещества, которые уменьшают боль, но не являются опиоидными анальгетиками. Примеры неопиоидных анальгетиков включают без ограничения этодолак, индометацин, сулиндак, толметин, набуметон, пироксикам, ацетаминофен, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрия, оксапрозин, аспирин, холин-магний трисалицилат, дифлунизал, меклофенамовую кислоту, мефенамовую кислоту и фенилбутазон. В соответствии с некоторыми другими вариантами осуществления, анальгетик представляет собой опиоидный анальгетик. «Опиоидные анальгетики», «опиоиды» или «наркотические анальгетики» представляют собой натуральные или синтетические вещества, которые связываются с опиоидными рецепторами в центральной нервной системе, обеспечивая агонистическое действие. Примеры опиоидных анальгетиков включают без ограничения кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, пропоксифен, бупренорфин, буторфанол, дезоцин, налбуфин и пентазоцин.
[00342] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противоинфекционное средство. В соответствии с еще одним вариантом осуществления, противоинфекционное средство представляет собой антибиотическое средство. Термин «антибиотическое средство», используемый в настоящем описании, обозначает любую группу химических веществ, способных ингибировать рост или разрушать бактерии и другие микроорганизмы и используемых при лечении инфекционных заболеваний. Примеры антибиотических средств включают без ограничения пенициллин G; метициллин; нафциллин; оксациллин; клоксациллин; диклоксациллин; ампициллин; амоксициллин; тикарциллин; карбенициллин; мезлоциллин; азлоциллин; пиперациллин; имипенем; азтреонам; цефалотин; цефаклор; цефокситин; цефуроксим; цефоницид; цефметазол; цефотетан; цефпрозил; лоракарбет; цефетамет; цефоперазон; цефотаксим; цефтизоксим; цефтриаксон; цефтазидим; цефепим; цефиксим; цефподоксим; цефзулодин; флероксацин; налидиксовую кислоту; норфлоксацин; ципрофлоксацин; офлоксацин; эноксацин; ломефлоксацин; циноксацин; доксициклин; миноциклин; тетрациклин; амикацин; гентамицин; канамицин; нетилмицин; тобрамицин; стрептомицин; азитромицин; кларитромицин; эритромицин; эритромицин эстолат; эритромицин этилсукцинат; эритромицин глюкогептонат; эритромицин лактобионат; эритромицин стеарат; ванкомицин; тейкопланин; хлорамфеникол; клиндамицин; триметоприм; сульфаметоксазол; нитрофурантоин; рифампин; мупироцин; метронидазол; цефалексин; рокситромицин; ко-амоксиклавуанат; комбинации пиперациллина и тазобактама и их различные соли, кислоты, основания и другие производные. Антибактериальные антибиотические средства включают без ограничения пенициллины, цефалоспорины, карбацефемы, цефамицины, карбапенемы, монобактамы, аминогликозиды, гликопептиды, хинолоны, тетрациклины, макролиды и фторхинолоны.
[00343] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует воспаление, возникающее в легких индивида. В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое воспаление. В соответствии с еще одним вариантом осуществления, воспаление представляет собой хроническое воспаление. В соответствии с еще одним вариантом осуществления, воспаление опосредуется фактором некроза опухоли-альфа (TNF-α). В соответствии с еще одним вариантом осуществления, воспаление опосредуется интерлейкином-6 (IL-6). В соответствии с еще одним вариантом осуществления, воспаление опосредуется интерлейкином-1β (IL-1β).
[00344] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует некоторое количество фактора некроза опухоли-альфа (TNF-α) в легких по сравнению с контролем. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует некоторое количество интерлейкина-6 (IL-6) в легких по сравнению с контролем. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует некоторое количество интерлейкина-1β (IL-1β) в легких по сравнению с контролем.
[00345] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует активность белка 1 теплового шока 27 кДа (HSPB1). В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой аберрантную индукцию пролиферации фибробластов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой аберрантную индукцию дифференциации миофибробластов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой отложение белка внеклеточного матрикса в легочный интерстиций. В соответствии с еще одним вариантом осуществления, белок внеклеточного матрикса представляет собой коллаген. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой стимуляцию образования фибротических очагов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой увеличение сократительной активности миофибробластов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой стимуляцию прикрепления миофибробластов к внеклеточному матриксу.
[00346] В соответствии с некоторыми вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет существенную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00347] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00348] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
[00349] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
[00350] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLAVA (SEQ ID NO: 5).
[00351] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLGVA (SEQ ID NO: 6).
[00352] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
[00353] В соответствии с некоторыми другими вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид имеет аминокислотную последовательность YARAAARQARA (SEQ ID NO: 11), а второй полипептид содержит терапевтический домен, чья последовательность имеет существенную идентичность с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
[00354] В соответствии с некоторыми такими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми такими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
[00355] В соответствии с некоторыми вариантами осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8).
[00356] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9).
[00357] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10).
[00358] В соответствии с некоторыми другими вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид содержит проникающий в клетки пептид, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), а второй полипептид имеет аминокислотную последовательность KALARQLGVAA (SEQ ID NO: 2).
[00359] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17). В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18).
[00360] В соответствии с другим аспектом, описанное изобретение также относится к выделенной нуклеиновой кислоте, которая кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 70% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота, которая кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 80% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми другими вариантами осуществления, выделенная нуклеиновая кислота, которая кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 90% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми другими вариантами осуществления, выделенная нуклеиновая кислота, которая кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 95% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00361] В соответствии с некоторыми другими вариантами осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,00001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,0001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,001 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,01 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,1 мг/кг (или 100 мкг/кг) массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 1 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 10 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 2 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 3 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 4 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 5 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 60 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 70 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 80 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 90 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 90 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 80 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 70 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 60 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 50 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 40 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида составляет от примерно 0,000001 мг/кг массы тела до примерно 30 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 20 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,01 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,001 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,0001 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,00001 мг/кг массы тела.
[00362] В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 25 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 2 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 2 мкг/кг/день до 3 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 3 мкг/кг/день до 4 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 4 мкг/кг/день до 5 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 5 мкг/кг/день до 6 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 6 мкг/кг/день до 7 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 7 мкг/кг/день до 8 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 8 мкг/кг/день до 9 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 9 мкг/кг/день до 10 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 5 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 5 мкг/кг/день до 10 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 10 мкг/кг/день до 15 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 15 мкг/кг/день до 20 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 25 мкг/кг/день до 30 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 30 мкг/кг/день до 35 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 35 мкг/кг/день до 40 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 40 мкг/кг/день до 45 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 45 мкг/кг/день до 50 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 50 мкг/кг/день до 55 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 55 мкг/кг/день до 60 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 60 мкг/кг/день до 65 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 65 мкг/кг/день до 70 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 70 мкг/кг/день до 75 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 80 мкг/кг/день до 85 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 85 мкг/кг/день до 90 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 90 мкг/кг/день до 95 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 95 мкг/кг/день до 100 мкг/кг/день.
[00363] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 1 мкг/кг/день.
[00364] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 2 мкг/кг/день.
[00365] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 5 мкг/кг/день.
[00366] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 10 мкг/кг/день.
[00367] В соответствии с некоторыми вариантами осуществления, полипептид по изобретению содержит D-аминокислоты (которые устойчивы к специфичным к L-аминокислотам протеазам in vivo), комбинацию D- и L-аминокислот и различные «сконструированные» аминокислоты (например, β-метиламинокислоты, C-α-метиламинокислоты и N-α-метиламинокислоты и т.д.) для передачи особых свойств. Примеры синтетических заместителей аминокислот включают замещение орнитином лизина и норлейцином лейцина или изолейцина.
[00368] В соответствии с некоторыми вариантами осуществления, полипептид может быть связан с другими соединениями для содействия увеличению периода полувыведения in vivo, такими как полиэтиленгликоль или декстран. Такая связь может быть ковалентной или нековалентной, как понятно специалистам в данной области. В соответствии с некоторыми другими вариантами осуществления, полипептид может быть инкапсулирован в мицеллу, такую как мицелла, полученная из поли(этиленгликоль)-блок-поли(этиленгликоля) или поли(этиленгликоль)-блок-полилактида. В соответствии с некоторыми другими вариантами осуществления, полипептид может быть инкапсулирован в разлагаемые нано- или микрочастицы, состоящие из разлагаемых сложных полиэфиров, включая без ограничения полимолочную кислоту, полигликолид и поликапролактон.
[00369] В соответствии с еще одним вариантом осуществления, полипептид может быть получен в твердой форме (включая гранулы, порошки или суппозитории) или в жидкой форме (например, растворах, суспензиях или эмульсиях).
[00370] В соответствии с еще одним вариантом осуществления, композиции по описываемому изобретению могут быть представлены в форме диспергируемого сухого порошка для подачи путем ингаляции или инсуффляции (соответственно либо через ротовую, либо через носовую полость). Композиции в виде сухого порошка могут быть получены способами, известными в данной области, такими как лиофилизация и размол на струйной мельнице, как описано в опубликованной международный патентной заявке WO 91/16038, и как описано в патенте США № 6921527, описания которых включены в настоящую заявку путем ссылки. Композиция по описываемому изобретению помещают внутрь подходящего приемника дозы в количестве, достаточном для обеспечения индивида единицей дозы для лечения. Приемник дозы представляет собой приспособление, которое помещается внутрь подходящего ингаляционного устройства для обеспечения возможности аэрозолизации композиции в виде сухого порошка дисперсией в газовый поток для образования аэрозоля и затем захвата полученного таким образом аэрозоля в камеру, имеющую мундштук, прикрепленный для последующей ингаляции нуждающимся в лечении индивидом. Такой приемник дозировки включает любой содержащий композицию контейнер, известный в данной области, такой как желатиновые или пластиковые капсулы со съемной частью, которая обеспечивает возможность направления газового потока (например, воздуха) в контейнер для диспергирования композиции в форме сухого порошка. Такие контейнеры иллюстрируются контейнерами, описанными в патентах США №№ 4227522; 4192309 и 4105027. Подходящие контейнеры также включают те, которые используются в сочетании с порошковым ингалятором марки Glaxo's Ventolin® Rotohaler или порошковым ингалятором марки Fison's Spinhaler®. Другой подходящий контейнер единиц дозы, который обеспечивает более эффективную гидроизолирующую прокладку, сформирован слоистым материалом из алюминиевой фольги и пластика. Порошки на основе фармацевтического средства засыпают по массе или по объему в углубление в формуемой фольге и герметически запаивают покрывающим слоистым материалом из алюминиевой фольги и пластика. Такой контейнер для использования с устройством для ингаляции порошка описан в патенте США № 4778054 и используется с порошковым ингалятором марки Glaxo's Diskhaler® (патенты США №№ 4627432; 4811731 и 5035237). Все эти ссылки полностью включены в настоящее описание путем ссылки.
[00371] В соответствии с еще одним вариантом осуществления, носитель композиции по описываемому изобретению включает агент, регулирующий высвобождение, такой как носитель замедленного высвобождения или отсроченного высвобождения. В таких вариантах осуществления, носитель может представлять собой любой материал, способный длительно или с задержкой высвобождать полипептид для обеспечения более эффективного введения, например, приводящего к менее частому введению и/или уменьшенной дозировке полипептида, облегчая манипулирование и расширяя или задерживая воздействия на заболевания, расстройства, состояния, синдромы и тому подобные подвергаемые лечению, профилактике или ускорению процессы. Неограничивающие примеры таких носителей включают липосомы, микрогубки, микросферы или микрокапсулы природных и синтетических полимеров и тому подобные. Липосомы могут быть сформированы из разнообразных фосфолипидов, включая без ограничения холестерин, стеариламины или фосфатидилхолины.
[00372] Способы синтеза и получения малых пептидов хорошо известны в данной области и описаны, например, в патентах США №№ 5352461; 5503852; 6071497; 6331318; 6428771 и в опубликованной заявке на патент США № 20060040953. В патентах США №№ 6444226 и 6652885 описано получение и предоставление микрочастиц дикетопиперазинов в водной суспензии, к которой добавляют раствор активного средства для связывания активного средства с частицей. В этих патентах дополнительно описан способ удаления жидкой среды лиофилизацией для выхода микрочастиц, содержащих активное средство. Изменение состояний растворителя таких суспензий для содействия связыванию активного средства с частицей описано в заявках на патенты США №№ 60/717,524; 11/532,063 и 11/532,065; в патенте США № 6440463 и в заявках на патенты США №№ 11/210,709 и 11/208,087. Каждый их этих патентов и патентных заявок включен в настоящее описание путем ссылки.
[00373] В некоторых вариантах осуществления, MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональные эквиваленты по настоящему изобретению могут сушиться способом распылительной сушки, как описано, например, в заявке на патент США № 11/678,046 (включенной в настоящее описание путем ссылки).
[00374] В еще одном варианте осуществления, полипептид по изобретению может применяться в разнообразных растворах. Подходящая препаративная форма является стерильной, растворяет достаточные количества полипептидов и безвредна для предлагаемого применения. Например, композиции по описанному изобретению могут составляться в виде водных суспензий, где активный ингредиент(-ы) находится в смеси с эксципиентами, подходящими для получения водных суспензий.
[00375] Такие эксципиенты включают без ограничения суспендирующие агенты (например, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, камедь трагаканта и камедь акации), диспергирующие или смачивающие агенты, включая встречающийся в природе фосфатид (например, лецитин), или продукты конденсации алкиленоксида с жирными кислотами (например, полиоксиэтилена стеарата) или продуктов конденсации этиленоксида с длинноцепочечными алифатическими спиртами (например, гептадекаэтилен-оксицетанола), или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гекситола (например полиоксиэтиленсорбиол моноолеат), или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридами гекситола (например, полиоксиэтиленсорбитан моноолеат).
[00376] Композиции по описываемому изобретению также могут составляться в виде масляных суспензий суспендированием активного ингредиента в растительном масле (например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле) или в минеральном масле (например, жидком парафине). Масляные суспензии могут содержать загуститель (например, пчелиный воск, твердый парафин или цетиловый спирт).
[00377] Композиции по описываемому изобретению могут составляться в форме диспергируемых порошков и гранул, подходящих для получения водной суспензии добавлением воды. Активный ингредиент в таких порошках и гранулах представлен в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты иллюстрируются теми, которые уже упоминались выше. Могут также присутствовать дополнительные эксципиенты.
[00378] В соответствии с некоторыми вариантами осуществления, сухой порошок получают способом распылительной сушки.
[00379] В соответствии с некоторыми другими вариантами осуществления, сухой порошок получают микронизацией.
[00380] В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) от 1 до 5 мкм.
[00381] В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) примерно 2 мкм.
[00382] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция упакована в ингаляционное устройство, включая, например, без ограничения небулайзер, дозирующий ингалятор (MDI) и ингалятор сухого порошка (DPI).
[00383] В соответствии с некоторыми другими вариантами осуществления, фармацевтическая композиция представляет собой жидкость для аэрозолизированой подачи с использованием небулайзера. В соответствии с некоторыми такими вариантами осуществления, скорость потока фармацевтической композиции составляет по меньшей мере 0,3 мл/мин, и фармацевтическая композиция подается в виде частиц по 2 мм с распределением в самые глубокие альвеолы.
[00384] Композиции по описываемому изобретению также могут быть представлены в форме эмульсии. Эмульсия представляет собой двухфазную систему, полученную объединением двух смешиваемых жидких носителей, один из которых равномерно распределен в другом и состоит из шариков, которые имеют диаметры, равные или бόльшие, чем диаметры самых крупных коллоидных частиц. Размер шарика имеет решающее значение и должен быть таким, чтобы система достигала максимальной устойчивости. Обычно разделение двух фаз не произойдет, пока не будет включено третье вещество, эмульгирующий агент. Таким образом, основная эмульсия содержит по меньшей мере три компонента, два несмешиваемых жидких носителя и эмульгирующий агент, а также активный ингредиент. Большинство эмульсий включают водную фазу в неводную фазу (или наоборот). Однако возможно получение эмульсий, которые являются в основном неводными, например, анионные и катионные поверхностно-активные вещества неводной несмешиваемой системы глицерина и оливкового масла. Таким образом, композиции по изобретению могут быть представлены в форме эмульсии масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или их смесь. Подходящие эмульгирующие агенты могут представлять собой встречающиеся в природе смолы, например, камедь акации или камедь трагаканта, встречающиеся в природе фосфатиды, например, сою, лецитин, и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гекситола, например, сорбитан моноолеата, и продукты конденсации частичных сложных эфиров с этиленоксидом, например, полиоксиэтиленсорбитан моноолеат.
[00385] В соответствии с некоторыми вариантами осуществления, полипептид по описываемому изобретению синтезирован химически. Такой синтетический полипептид, полученный с использованием хорошо известных технологий твердофазного, жидкофазного пептидного синтеза или пептидного синтеза конденсационным методом, или любой их комбинации, может включать природные и неприродные аминокислоты. Аминокислоты, используемые для пептидного синтеза, могут представлять собой стандартную смолу с Boc (N-α-аминозащищенной N-α-трет-бутоксикарбонил) аминокислотой со стандартными протоколами снятия защиты, нейтрализации, соединения и промывания оригинальной твердофазной процедуры Merrifield (1963, J. Am. Chem. Soc. 85:2149-2154), или основно-лабильные N-α-аминозащищенные 9-фторенилметоксикарбонил (Fmoc) аминокислоты, впервые описанные Carpino and Han (1972, J. Org. Chem. 37:3403-3409). И Fmoc, и Boc Ν-α-аминозащищенные аминокислоты могут быть получены от компании Sigma, Cambridge Research Biochemical или других химических компаний, известных специалистам в данной области. Кроме того, полипептид может быть синтезирован с другими N-α-защитными группами, которые знакомы специалистам в данной области. Твердофазный пептидный синтез может осуществляться технологиями, знакомыми специалистам в данной области, и описанными, например, в документах Stewart and Young, 1984, Solid Phase Synthesis, Second Edition, Pierce Chemical Co., Rockford, III; Fields and Noble, 1990, Int. J. Pept. Protein Res. 35: 161-214, каждый из которых полностью включен в настоящее описание путем ссылки, или с использованием автоматизированных синтезаторов.
II. Способы профилактики или лечения заболеваний, характеризуемых аберрантной пролиферацией фибробластов и отложением коллагена
[00386] В соответствии с другим аспектом, описанное изобретение относится к способу лечения заболевания, состояния или процесса, характеризуемого аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в ткани индивида, причем способ включает:
[00387] введение индивиду фармацевтической композиции, содержащей терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента и его фармацевтически приемлемый носитель,
[00388] где терапевтическое количество эффективно для уменьшения пролиферации фибробластов и отложения внеклеточного матрикса в ткани индивида.
[00389] В соответствии с одним вариантом осуществления способа, заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS).
[00390] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой фиброз, вызванный излучением.
[00391] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой отторжение трансплантата.
[00392] В соответствии с еще одним вариантом осуществления, ткань представляет собой легочную ткань.
[00393] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой интерстициальное легочное заболевание.
[00394] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой легочный фиброз.
[00395] В соответствии с еще одним вариантом осуществления, легочный фиброз представляет собой идиопатический легочный фиброз.
[00396] В соответствии с еще одним вариантом осуществления, легочный фиброз вызван введением блеомицина.
[00397] В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легких индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации.
[00398] В соответствии с еще одним вариантом осуществления, заболевание или состояние дополнительно характеризуется воспалением в ткани.
[00399] В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое или хроническое воспаление.
[00400] В соответствии с еще одним вариантом осуществления, воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β).
[00401] В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00402] В соответствии с еще одним вариантом осуществления, аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00403] В соответствии с еще одним вариантом осуществления, об аберрантной пролиферации фибробластов и отложении внеклеточного матрикса в ткани свидетельствует аберрантное количество или распределение активированной (фосфорилированной) протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с количеством или распределением активированной протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00404] В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции популяции фибробластов в популяцию миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00405] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой хроническое обструктивное легочное заболевание (COPD). В соответствии с еще одним вариантом осуществления, хроническое обструктивное легочное заболевание (COPD) вызвано курением. В соответствии с другим вариантом осуществления, хроническое обструктивное легочное заболевание (COPD) вызвано содержащимися в окружающей среде веществами в виде частиц. В соответствии с еще одним вариантом осуществления, хроническое обструктивное легочное заболевание (COPD) вызвано недостаточностью альфа-1 антитрипсина. В соответствии с еще одним вариантом осуществления, хроническое обструктивное легочное заболевание (COPD) вызвано детской респираторной инфекцией.
[00406] В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется аномальной активностью белка 1 теплового шока 27 кДа (HSPB1) в легком индивида, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантное отложение белка внеклеточного матрикса в легочном интерстиции индивида, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, белок внеклеточного матрикса представляет собой коллаген. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную стимуляцию пролиферации фибробластов в легких, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную индукцию дифференциации миофибробластов в легких, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой стимуляцию образования фибротических очагов в легких по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой увеличение сократительной активности миофибробластов в легких по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную стимуляцию прикрепления миофибробластов к внеклеточному матриксу в легких по сравнению с нормальным здоровым контрольным индивидом.
[00407] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует воспаление, возникающее в легком индивида. В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое воспаление. В соответствии с еще одним вариантом осуществления, воспаление представляет собой хроническое воспаление. В соответствии с еще одним вариантом осуществления, воспаление опосредуется фактором некроза опухоли-альфа (TNF-α). В соответствии с еще одним вариантом осуществления, воспаление опосредуется интерлейкином-1β (IL-1β). В соответствии с еще одним вариантом осуществления, воспаление опосредуется интерлейкином-6 (IL-6).
[00408] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует количество фактора некроза опухоли-альфа (TNF-α) в легких индивида, по сравнению с нелеченым контролем. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует количество интерлейкина-1β (IL-1β) в легких индивида по сравнению с контролем. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует количество интерлейкина-6 (IL-6) в легких индивида по сравнению с контролем.
[00409] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует аномальную активность HSPBl, по сравнению с нормальным здоровым контрольным индивидом, в легком индивида. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантное отложение белка внеклеточного матрикса в легочном интерстиции индивида по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, белок внеклеточного матрикса представляет собой коллаген. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную стимуляцию пролиферации фибробластов в легких по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную индукцию дифференциации фибробластов в миофибробласты в легких по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную стимуляцию образования фибротических очагов по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантное увеличение сократительной активности миофибробластов, по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, сократительная активность миофибробластов характеризуется повышенным уровнем альфа-актина гладких мышц (α-SMA), по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, сократительная активность миофибробластов характеризуется увеличением образования стрессовых волокон по сравнению с нормальным здоровым контрольным индивидом. В соответствии с еще одним вариантом осуществления, аномальная активность HSPB1 представляет собой аберрантную стимуляцию прикрепления миофибробластов к внеклеточному матриксу по сравнению с нормальным здоровым контрольным индивидом.
[00410] В соответствии с одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (киназы MK2). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности киназы MK2.
[00411] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 3, активированной митоген-активированной протеинкиназой (киназы MK3). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 80% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 85% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 90% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 95% киназной активности киназы MK3.
[00412] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00413] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00414] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность протеинкиназы, активированной митоген-активированной протеинкиназой 3 (MK3).
[00415] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00416] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00417] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), киназную активность протеинкиназы, активированной митоген-активированной протеинкиназой 3 (MK3), киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00418] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00419] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2).
[00420] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы, активированной митоген-активированной протеинкиназой 3 (MK3).
[00421] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00422] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00423] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3).
[00424] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00425] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00426] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), по меньшей мере 65% киназной активности протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3), по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00427] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность по меньшей мере одной киназы, выбранной из группы MK2, MK3, CaMKI, TrkB, без существенного ингибирования активности одной или нескольких других выбранных киназ из остающейся группы, перечисленной в таблице 1 в настоящем описании.
[00428] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность киназы, выбранной из группы, перечисленной в таблице 1 в настоящем описании.
[00429] В соответствии с еще одним вариантом осуществления, это ингибирование может, например, быть эффективным для снижения пролиферации фибробластов, отложения внеклеточного матрикса или их комбинации в ткани индивида.
[00430] В соответствии с еще одним вариантом осуществления, это ингибирование может, например, быть эффективным для уменьшения по меньшей мере одной патологии, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00431] В соответствии с некоторыми вариантами осуществления, ингибиторные профили ингибиторов MMI in vivo зависят от дозировок, путей введения и типов клеток, реагирующих на ингибиторы.
[00432] В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 50% киназной активности другой выбранной киназы (киназ). В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 65% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 50% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 40% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 20% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 15% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 10% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 5% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция увеличивает киназную активность других выбранных киназ.
[00433] В соответствии с вариантами осуществления, представленными непосредственно в предшествующем абзаце, одна или несколько других выбранных киназ, которая по существу не инргибируется, выбрана из группы Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII, включая ее субъединицу CaMKIIδ), серин/треонин-протеинкиназы прото-онкогена (PIM-1), клеточной-саркомы (c-SRC), селезеночной тирозинкиназы (SYK), C-src тирозинкиназы (CSK) и рецептора инсулиноподобного фактора роста 1 (IGF-1R).
[00434] В соответствии с некоторыми вариантами осуществления, фармацевтическая композиция дополнительно содержит дополнительное терапевтическое средство.
[00435] В соответствии с некоторыми такими вариантами осуществления, дополнительное терапевтическое средство выбрано из группы, состоящей из очищенных бычьих коллагенов V типа (например, IW-001; Immune Works; United Therapeutics), антагонистов рецепторов IL-13 (например, QAX576; Novartis), ингибиторов протеинтирозинкиназы (например, иматиниба (Gleevec®); Craig Daniels/Novartis), антагонистов эндотелиальных рецепторов (например, ACT-064992 (мацитентана); Actelion), антагонистов рецепторов эндотелина двойного действия (например, босентана (траклир®); Actelion), аналогов простациклина (ингаляционного илопроста (например, вентавис®); Actelion), моноклональных антител к CTGF (например, FG-3019), антагонистов рецепторов эндотелина (A-селективных) (например, амбрисентана (Letairis®), Gilead), AB0024 (Arresto), подобных лизилоксидазе 2 (LOXL2) моноклональных антител (например, GS-6624 (ранее AB0024); Gilead), ингибиторов c-Jun-N-концевой киназы (JNK) (например, CC-930; Celgene), пирфенидона (например, Esbriet® (InterMune), Pirespa® (Shionogi)), IFN-γ1b (например, Actimmune®; InterMune), пан-нейтрализующих IgG4 человеческих антител против всех трех изоформ TGF-β (например, GC1008; Genzyme), ингибиторов активации TGF-β (например, стромедикса (STX-100)), рекомбинантного человеческого белка пентраксина-2 (rhPTX-2) (например, PRM151; промедиора), биспецифических антител IL4/IL13 (например, SAR156597; Sanofi), гуманизированных моноклональных антител, нацеленных на интегрин αvβ6 (BIBF 1120; Boehringer Ingelheim), N-ацетилцистеина (Zambon SpA), силденафила (Viagra®; ), антагонистов TNF (например, этанерцепта (Enbrel®); Pfizer), глюкокортикоидов (например, преднизона, будезонида, мометазона фуроата, флутиказона пропионата и флутиказона фуроата), бронхолитических средств (например, модификаторов лейкотриена (например, монтелукаста (SINGUAIR®)), антихолинергических бронхолитиков (например, ипратропия бромида и тиотропия), β2-агонистов короткого действия (например, изоэтарина месилата (Bronkometer®), адреналина, сальбутанол/альбутерола и тербуталина), длительно действующих β2-агонистов (например, сальметерола, форметерола, индекатерола (Onbrez®)) и их комбинации.
[00436] В соответствии с некоторыми другими вариантами осуществления, дополнительное терапевтическое средство содержит бронхолитическое средство, включая без ограничения модификатор лейкотриена, антихолинергический бронхолитик, β2-агонист или их комбинацию.
[00437] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит кортикостероид, включая без ограничения преднизон, будезонид, мометазон, беклеметазон или их комбинацию.
[00438] В соответствии с некоторыми другими вариантами осуществления, дополнительное терапевтическое средство содержит бронхолитическое средство, включая без ограничения модификатор лейкотриена, антихолинергический бронхолитик, β2-агонист, или их комбинацию.
[00439] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит кортикостероид, включая без ограничения преднизон, будезонид, мометазон, беклеметазон или их комбинацию.
[00440] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противовоспалительное средство.
[00441] В соответствии с еще одним вариантом осуществления, противовоспалительное средство представляет собой нестероидное противовоспалительное средство. Могут также использоваться смеси нестероидных противовоспалительных средств, а также дерматологически приемлемые соли и сложные эфиры этих средств. Например, для топического нанесения особенно полезен этофенамат, производное флуфенамовой кислоты.
[00442] В соответствии с еще одним вариантом осуществления, нестероидное противовоспалительное средство включает трансформирующий фактор роста-β3 (TGF-β3), средство против фактора некроза опухоли-альфа (TNF-α) или их комбинацию.
[00443] В соответствии с еще одним вариантом осуществления, противовоспалительное средство представляет собой стероидное противовоспалительное средство. В соответствии с еще одним вариантом осуществления, стероидное противовоспалительное средство включает по меньшей мере один кортикостероид, выбранный из группы, состоящей из преднизона, будезонида, мометазона, беклеметазона и их комбинации.
[00444] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство включает метилксантин.
[00445] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство включает ингибитор эластазы нейтрофилов.
[00446] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой по меньшей мере один ингибитор эластазы нейтрофилов, включая без ограничения ICI 200355, ONO-5046, MR-889, L-694,458, CE-1037, GW-311616, TEI-8362, ONO-6818, AE-3763, FK-706, ICI-200,880, ZD- 0892, ZD-8321 и их комбинацию.
[00447] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство включает по меньшей мере один ингибитор фосфодиэстеразы, включая без ограничения ингибитор фосфодиэстеразы 4. Примеры ингибиторов фосфодиэстеразы 4 включают без ограничения рофлумиласт, циломиласт или их комбинацию.
[00448] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой анальгетическое средство. В соответствии с некоторыми такими вариантами осуществления, анальгетическое средство представляет собой неопиоидный анальгетик. В соответствии с некоторыми другими вариантами осуществления, анальгетическое средство представляет собой опиоидный анальгетик.
[00449] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противоинфекционное средство. В соответствии с еще одним вариантом осуществления, противоинфекционное средство представляет собой антибиотическое средство.
[00450] В соответствии с некоторыми вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет существенную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00451] В соответствии с некоторыми такими вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00452] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
[00453] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
[00454] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLAVA (SEQ ID NO: 5).
[00455] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLGVA (SEQ ID NO: 6).
[00456] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
[00457] В соответствии с некоторыми другими вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, причем первый полипептид имеет аминокислотную последовательность YARAAARQARA (SEQ ID NO: 11), а второй полипептид содержит терапевтический домен, чья последовательность имеет существенную иднтичность с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
[00458] В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
[00459] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8).
[00460] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9).
[00461] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10).
[00462] В соответствии с некоторыми вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид содержит проникающий в клетки пептид, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), а второй полипептид имеет аминокислотную последовательность KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2).
[00463] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12).
[00464] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13).
[00465] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14).
[00466] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15).
[00467] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16). В соответствии с некоторыми такими вариантами осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17). В соответствии с некоторыми такими вариантами осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18).
[00468] В соответствии с другим аспектом, описанное изобретение также относится к выделенной нуклеиновой кислоте, которая кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 70% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00469] В соответствии с некоторыми такими вариантами осуществления, выделенная нуклеиновая кислота кодирует белковую последовательность с идентичностью аминокислотной последовательности по меньшей мере 80% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми другими вариантами осуществления, выделенная нуклеиновая кислота кодирует белковую последовательность с идентичностью аминокислотной последовательности по меньшей мере 90% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми другими вариантами осуществления, выделенная нуклеиновая кислота кодирует белковую последовательность с идентичностью аминокислотной последовательности по меньшей мере 95% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00470] В соответствии с еще одним вариантом осуществления, стадия введения может происходить системно или перорально, буккально, парентерально, топически, путем ингаляции, путем инсуффляции, или ректально, или может происходить локально такими средствами, как, без ограничения, инъекция, имплантация, трансплантация, топическое нанесение или парентерально. Дополнительное введение может выполняться, например, внутривенно, через слизистые оболочки, трансдермально, внутримышечно, подкожно, интратрахеально (включая введение путем легочной ингаляции), внутрибрюшинно, подоболочечно, в лимфатические пути, в очаги поражения или эпидурально. Введение может выполняться, например, один раз, множество раз и/или в течение одного или нескольких продолжительных периодов, или в виде отдельных стандартных доз, или в форме схемы лечения, включающей несколько стандартных доз лекарственного средства и/или веществ.
[00471] В соответствии с некоторыми другими вариантами осуществления, стадия введения происходит в одно время в виде одной дозы. В соответствии с некоторыми другими вариантами осуществления, стадия введения выполняется в виде множества доз в течение периода времени. В соответствии с некоторыми такими вариантами осуществления, период времени составляет один день, одну неделю, один месяц, один год или их кратные количества. В соответствии с некоторыми вариантами осуществления, стадия введения выполняется один раз в день в течение периода одной недели. В соответствии с некоторыми вариантами осуществления, стадия введения выполняется один раз в неделю в течение периода по меньшей мере один месяц. В соответствии с некоторыми вариантами осуществления, стадия введения выполняется один раз в месяц в течение периода по меньшей мере два месяца. В соответствии с еще одним вариантом осуществления, стадия введения выполняется повторно в течение периода по меньшей мере один год. В соответствии с еще одним вариантом осуществления, стадия введения выполняется по меньшей мере один раз в месяц. В соответствии с еще одним вариантом осуществления, стадия введения выполняется по меньшей мере один раз в неделю. В соответствии с еще одним вариантом осуществления, стадия введения выполняется по меньшей мере один раз в день.
[00472] В соответствии с некоторыми другими вариантами осуществления, терапевтическое количество фармацевтической композиции вводится через ингаляционное устройство. Примеры ингаляционного устройства, которое может применяться для введения фармацевтической композиции, включают без ограничения небулайзер, дозирующий ингалятор (MDI), ингалятор сухого порошка (DPI) и небулайзер сухого порошка.
[00473] В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) от 1 до 5 мкм. В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) примерно 2 мкм.
[00474] В соответствии с некоторыми другими вариантами осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,00001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,0001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,001 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,01 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,1 мг/кг (или 100 мкг/кг) массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 1 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 10 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 2 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 3 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 4 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 5 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 60 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 70 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 80 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 90 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 90 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 80 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 70 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 60 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 50 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 40 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида составляет от примерно 0,000001 мг/кг массы тела до примерно 30 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 20 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,01 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,001 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,0001 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,00001 мг/кг массы тела.
[00475] В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 25 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 2 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 2 мкг/кг/день до 3 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 3 мкг/кг/день до 4 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 4 мкг/кг/день до 5 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 5 мкг/кг/день до 6 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 6 мкг/кг/день до 7 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 7 мкг/кг/день до 8 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 8 мкг/кг/день до 9 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 9 мкг/кг/день до 10 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 5 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 5 мкг/кг/день до 10 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 10 мкг/кг/день до 15 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 15 мкг/кг/день до 20 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 25 мкг/кг/день до 30 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 30 мкг/кг/день до 35 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 35 мкг/кг/день до 40 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 40 мкг/кг/день до 45 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 45 мкг/кг/день до 50 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 50 мкг/кг/день до 55 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 55 мкг/кг/день до 60 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 60 мкг/кг/день до 65 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 65 мкг/кг/день до 70 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 70 мкг/кг/день до 75 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 80 мкг/кг/день до 85 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 85 мкг/кг/день до 90 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 90 мкг/кг/день до 95 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 95 мкг/кг/день до 100 мкг/кг/день.
[00476] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 1 мкг/кг/день.
[00477] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 2 мкг/кг/день.
[00478] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 5 мкг/кг/день.
[00479] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 10 мкг/кг/день.
III. Системы для профилактики или лечения заболеваний, характеризуемых аберрантной пролиферацией фибробластов и отложением коллагена
[00480] В соответствии с другим аспектом, описанное изобретение относится к системе для лечения заболевания, состояния или процесса, характеризуемого аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в ткани индивида,
[00481] где фармацевтическая композиция содержит терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента и его фармацевтически приемлемый носитель, и
[00482] где терапевтическое количество эффективно для уменьшения пролиферации фибробластов и отложения внеклеточного матрикса в ткани индивида.
[00483] В соответствии с одним вариантом осуществления способа, заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS).
[00484] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой фиброз, вызванный излучением.
[00485] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой отторжение трансплантата.
[00486] В соответствии с еще одним вариантом осуществления, ткань представляет собой легочную ткань.
[00487] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой интерстициальное легочное заболевание.
[00488] В соответствии с еще одним вариантом осуществления, заболевание или состояние представляет собой легочный фиброз.
[00489] В соответствии с еще одним вариантом осуществления, легочный фиброз представляет собой идиопатический легочный фиброз.
[00490] В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате введения блеомицина.
[00491] В соответствии с еще одним вариантом осуществления, легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, бактериальной инфекции, вирусной инфекции, механического повреждения легких индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации.
[00492] В соответствии с еще одним вариантом осуществления, заболевание или состояние дополнительно характеризуется воспалением в ткани.
[00493] В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое или хроническое воспаление.
[00494] В соответствии с еще одним вариантом осуществления, воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β).
[00495] В соответствии с еще одним вариантом осуществления, аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00496] В соответствии с еще одним вариантом осуществления, об аберрантной пролиферации фибробластов и отложении внеклеточного матрикса в ткани свидетельствует аберрантное количество или распределение (фосфорилированной) протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с количеством или распределением активированной протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00497] В соответствии с еще одним вариантом осуществления, легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации популяции фибробластов в популяцию миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00498] В соответствии с еще одним вариантом осуществления, фармацевтически приемлемый носитель включает без ограничения носитель контролируемого высвобождения, носитель отсроченного высвобождения, носитель замедленного высвобождения и носитель длительного высвобождения.
[00499] В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер.
[00500] В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой дозирующий ингалятор (MDI).
[00501] В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой ингалятор сухого порошка (DPI).
[00502] В соответствии с еще одним вариантом осуществления, ингаляционное устройство представляет собой небулайзер сухого порошка.
[00503] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция представлена в форме сухого порошка.
[00504] В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) от 1 до 5 мкм.
[00505] В соответствии с еще одним вариантом осуществления, сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) примерно 2 мкм.
[00506] В соответствии с некоторыми вариантами осуществления, фармацевтическая композиция дополнительно содержит дополнительное терапевтическое средство.
[00507] В соответствии с некоторыми такими вариантами осуществления, дополнительное терапевтическое средство выбрано из группы, состоящей из очищенных бычьих коллагенов V типа (например, IW-001; Immune Works; United Therapeutics), антагонистов рецепторов IL-13 (например, QAX576; Novartis), ингибиторов протеинтирозинкиназы (например, иматиниба (Gleevec®); Craig Daniels/Novartis), антагонистов эндотелиальных рецепторов (например, ACT-064992 (мацитентана); Actelion), антагонистов рецепторов эндотелина двойного действия (например, босентана (траклир®); Actelion), аналогов простациклина (ингаляционного илопроста (например, вентавис®); Actelion), моноклональных антител к CTGF (например, FG-3019), антагонистов рецепторов эндотелина (A-селективных) (например, амбрисентана (Letairis®), Gilead), AB0024 (Arresto), подобных лизилоксидазе 2 (LOXL2) моноклональных антител (например, GS-6624 (ранее AB0024); Gilead), ингибиторов c-Jun-N-концевой киназы (JNK) (например, CC-930; Celgene), пирфенидона (например, Esbriet® (InterMune), Pirespa® (Shionogi)), IFN-γ1b (например, Actimmune®; InterMune), пан-нейтрализующих IgG4 человеческих антител против всех трех изоформ TGF-β (например, GC1008; Genzyme), ингибиторов активации TGF-β (например, стромедикса (STX-100)), рекомбинантного человеческого белка пентраксина-2 (rhPTX-2) (например, PRM151; промедиора), биспецифических антител IL4/IL13 (например, SAR156597; Sanofi), гуманизированных моноклональных антител, нацеленных на интегрин αvβ6 (BIBF 1120; Boehringer Ingelheim), N-ацетилцистеина (Zambon SpA), силденафила (Viagra®;), антагонистов TNF (например, этанерцепта (Enbrel®); Pfizer), глюкокортикоидов (например, преднизона, будезонида, мометазона фуроата, флутиказона пропионата и флутиказона фуроата), бронхолитических средств (например, модификаторов лейкотриена (например, монтелукаста (SINGUAIR®)), антихолинергических бронхолитиков (например, ипратропия бромида и тиотропия), β2-агонистов короткого действия (например, изоэтарина месилата (Bronkometer®), адреналина, сальбутанол/альбутерола и тербуталина), длительно действующих β2-агонистов (например, сальметерола, форметерола, индекатерола (Onbrez®) и их комбинации.
[00508] В соответствии с некоторыми другими вариантами осуществления, дополнительное терапевтическое средство содержит бронхолитическое средство, включая без ограничения модификатор лейкотриена, антихолинергический бронхолитик, β2-агонист или их комбинации.
[00509] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит кортикостероид, включая без ограничения преднизон, будезонид, мометазон, беклеметазон или их комбинацию.
[00510] В соответствии с некоторыми такими вариантами осуществления, дополнительное терапевтическое средство содержит бронхолитическое средство, включая без ограничения модификатор лейкотриена, антихолинергический бронхолитик, β2-агонист, или их комбинацию.
[00511] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит кортикостероид, включая без ограничения преднизон, будезонид, мометазон, беклеметазон или их комбинацию.
[00512] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противовоспалительное средство.
[00513] В соответствии с еще одним вариантом осуществления, противовоспалительное средство представляет собой нестероидное противовоспалительное средство. Могут также использоваться смеси этих нестероидных противовоспалительных средств, а также дерматологически приемлемые соли и сложные эфиры этих средств. Например, этофенамат, производное флуфенамовой кислоты, особенно полезно для топического нанесения.
[00514] В соответствии с еще одним вариантом осуществления, где нестероидное противовоспалительное средство содержит трансформирующий фактор роста-β3 (TGF-β3), средство против фактора некроза опухоли-альфа (TNF-α) или их комбинацию.
[00515] В соответствии с еще одним вариантом осуществления, противовоспалительное средство представляет собой стероидное противовоспалительное средство. В соответствии с еще одним вариантом осуществления, стероидное противовоспалительное средство содержит по меньшей мере один кортикостероид, выбранный из группы, состоящей из преднизона, будезонида, мометазона, беклеметазона и их комбинации.
[00516] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит метилксантин.
[00517] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит ингибитор эластазы нейтрофилов.
[00518] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой по меньшей мере один ингибитор эластазы нейтрофилов, включая без ограничения ICI 200355, ONO-5046, MR-889, L-694,458, CE-1037, GW-311616, TEI-8362, ONO-6818, AE-3763, FK-706, ICI-200,880, ZD- 0892, ZD-8321 и их комбинацию.
[00519] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство содержит по меньшей мере один ингибитор фосфодиэстеразы, включая без ограничения ингибитор фосфодиэстеразы 4. Примеры ингибиторов фосфодиэстеразы 4 включают без ограничения рофлумиласт, циломиласт или их комбинацию.
[00520] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой анальгетическое средство. В соответствии с некоторыми такими вариантами осуществления, анальгетическое средство представляет собой неопиоидный анальгетик. В соответствии с некоторыми другими вариантами осуществления, анальгетик представляет собой опиоидный анальгетик.
[00521] В соответствии с еще одним вариантом осуществления, дополнительное терапевтическое средство представляет собой противоинфекционное средство. В соответствии с еще одним вариантом осуществления, противоинфекционное средство представляет собой антибиотическое средство.
[00522] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует воспаление, возникающее в легком индивида. В соответствии с еще одним вариантом осуществления, воспаление представляет собой острое воспаление. В соответствии с еще одним вариантом осуществления, воспаление представляет собой хроническое воспаление. В соответствии с еще одним вариантом осуществления, воспаление опосредуется повышенным уровнем фактора некроза опухоли-альфа (TNF-α). В соответствии с еще одним вариантом осуществления, воспаление опосредуется повышенным уровнем интерлейкина-6 (IL-6). В соответствии с еще одним вариантом осуществления, воспаление опосредуется повышенным уровнем интерлейкина-1β (IL-1β).
[00523] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует количество фактора некроза опухоли-альфа (TNF-α) в легких по сравнению с контролем. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует количество интерлейкина-6 (IL-6) в легких по сравнению с контролем. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция модулирует количество интерлейкина-1β (IL-1β) в легких по сравнению с контролем.
[00524] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует активность HSPB1. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой аберрантную индукцию пролиферации фибробластов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой аберрантную индукцию дифференциации популяции фибробластов в популяцию миофибробластов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой отложение белка внеклеточного матрикса в легочный интерстиций. В соответствии с еще одним вариантом осуществления, белок внеклеточного матрикса представляет собой коллаген. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой стимуляцию образования фибротических очагов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой увеличение сократительной активности миофибробластов. В соответствии с еще одним вариантом осуществления, активность HSPB1, ингибируемая фармацевтической композицией, представляет собой стимуляцию прикрепления миофибробластов к внеклеточному матриксу.
[00525] В соответствии с еще одним вариантом осуществления, об аберрантной пролиферации фибробластов и отложении внеклеточного матрикса в ткани свидетельствует аберрантное количество или распределение активированной (фосфорилированной) протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с количеством или распределением активированной протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
[00526] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность киназы, выбранной из группы, перечисленной в таблице 1 в настоящем описании.
[00527] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности этой киназы.
[00528] В соответствии с некоторыми вариантами осуществления, ингибиторные профили ингибиторов MMI in vivo зависят от дозировок, путей введения и типов клеток, реагирующих на ингибиторы.
[00529] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности этой киназы. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности этой киназы.
[00530] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (киназы MK2). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 50% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 75% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 80% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 85% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 90% киназной активности киназы MK2. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 95% киназной активности киназы MK2.
[00531] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы, активированной митоген-активированной протеинкиназой 3 (киназы MK3). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 80% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 85% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 90% киназной активности киназы MK3. В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 95% киназной активности киназы MK3.
[00532] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00533] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 50% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 70% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция дополнительно ингибирует по меньшей мере 75% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00534] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность протеинкиназы, активированной митоген-активированной протеинкиназой 3 (MK3).
[00535] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00536] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00537] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), киназную активность протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3), киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00538] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), киназную активность кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и киназную активность рецепторов фактора роста BDNF/NT-3 (TrkB).
[00539] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2).
[00540] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы, активированной митоген-активированной протеинкиназой 3 (MK3).
[00541] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00542] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00543] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3).
[00544] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
[00545] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), и по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00546] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует по меньшей мере 65% киназной активности протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), по меньшей мере 65% киназной активности протеинкиназы, активированной митоген-активированной протеинкиназой 3 (MK3), по меньшей мере 65% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI) и по меньшей мере 65% киназной активности рецепторов фактора роста BDNF/NT-3 (TrkB).
[00547] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность по меньшей мере одной киназы, выбранной из группы MK2, MK3, CaMKI, TrkB, по существу без ингибирования активности одной или нескольких других выбранных киназ из остающейся группы, перечисленной в таблице 1 в настоящем описании.
[00548] В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует киназную активность киназы, выбранной из группы, перечисленной в таблице 1 в настоящем описании.
[00549] В соответствии с еще одним вариантом осуществления, это ингибирование может, например, быть эффективным для снижения пролиферации фибробластов, отложения внеклеточного матрикса или их комбинации в ткани индивида.
[00550] В соответствии с еще одним вариантом осуществления, это ингибирование может, например, быть эффективным для уменьшения по меньшей мере одной патологии, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
[00551] В соответствии с некоторыми вариантами осуществления, ингибиторные профили ингибиторов MMI in vivo зависят от дозировок, путей введения и типов клеток, реагирующих на ингибиторы.
[00552] В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 50% киназной активности другой выбранной киназы (киназ). В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 65% киназной активности другой выбранной киназы (киназ). В соответствии с таким вариантом осуществления, фармацевтическая композиция ингибирует менее чем 50% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 40% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 20% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 15% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 10% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция ингибирует менее чем 5% киназной активности другой выбранной киназы (киназ). В соответствии с еще одним вариантом осуществления, фармацевтическая композиция увеличивает киназную активность других выбранных киназ.
[00553] В соответствии с вариантами осуществления, представленными непосредственно в предшествующем абзаце, одна или несколько других выбранных киназ, которая по существу не ингибируется, выбрана из группы Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII, включая ее субъединицу CaMKIIδ), серин/треонин-протеинкиназы прото-онкогена (PIM-1), клеточной-саркомы (c-SRC), селезеночной тирозинкиназы (SYK), C-src тирозинкиназы (CSK) и рецептора инсулиноподобного фактора роста 1 (IGF-1R).
[00554] В соответствии с некоторыми вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет существенную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00555] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00556] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
[00557] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
[00558] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLAVA (SEQ ID NO: 5).
[00559] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность YARAAARQARAKALARQLGVA (SEQ ID NO: 6).
[00560] В соответствии с еще одним вариантом осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
[00561] В соответствии с некоторыми другими вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид имеет аминокислотную последовательность YARAAARQARA (SEQ ID NO: 11), а второй полипептид содержит терапевтический домен, чья последовательность имеет существенную иднтичность с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
[00562] В соответствии с еще одним вариантом осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 70% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 80% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 90% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2). В соответствии с некоторыми другими вариантами осуществления, второй полипептид имеет идентичность последовательности по меньшей мере 95% с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
[00563] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8).
[00564] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9).
[00565] В соответствии с еще одним вариантом осуществления, второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10).
[00566] В соответствии с некоторыми другими вариантами осуществления, функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый белок, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид содержит проникающий в клетки пептид, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), а второй полипептид имеет аминокислотную последовательность KALARQLGVAA (SEQ ID NO: 2).
[00567] В соответствии с дополнительным вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12).
[00568] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13).
[00569] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14).
[00570] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA WLRRI (SEQ ID NO: 15).
[00571] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16).
[00572] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17).
[00573] В соответствии с еще одним вариантом осуществления, первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18).
[00574] В соответствии с другим аспектом, описанное изобретение также относится к выделенной нуклеиновой кислоте, которая кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 70% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми такими вариантами осуществления, выделенная нуклеиновая кислота кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 80% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми такими вариантами осуществления, выделенная нуклеиновая кислота кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 90% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с некоторыми такими вариантами осуществления, выделенная нуклеиновая кислота кодирует последовательность белка с идентичностью аминокислотной последовательности по меньшей мере 95% с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
[00575] В соответствии с некоторыми другими вариантами осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,00001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,0001 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,001 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,01 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,1 мг/кг (100 мкг/кг) массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 1 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 10 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 2 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 3 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 4 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 5 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 60 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 70 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 80 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 90 мг/кг массы тела до примерно 100 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 90 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 80 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 70 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 60 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 50 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 40 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида составляет от примерно 0,000001 мг/кг массы тела до примерно 30 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 20 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 10 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,1 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,01 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,001 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,0001 мг/кг массы тела. В соответствии с еще одним вариантом осуществления, терапевтическое количество терапевтического ингибиторного пептида фармацевтической композиции составляет от примерно 0,000001 мг/кг массы тела до примерно 0,00001 мг/кг массы тела.
[00576] В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 25 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 2 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 2 мкг/кг/день до 3 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 3 мкг/кг/день до 4 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 4 мкг/кг/день до 5 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 5 мкг/кг/день до 6 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 6 мкг/кг/день до 7 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 7 мкг/кг/день до 8 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 8 мкг/кг/день до 9 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 9 мкг/кг/день до 10 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 1 мкг/кг/день до 5 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 5 мкг/кг/день до 10 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 10 мкг/кг/день до 15 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 15 мкг/кг/день до 20 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 25 мкг/кг/день до 30 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 30 мкг/кг/день до 35 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 35 мкг/кг/день до 40 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 40 мкг/кг/день до 45 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 45 мкг/кг/день до 50 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 50 мкг/кг/день до 55 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 55 мкг/кг/день до 60 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 60 мкг/кг/день до 65 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 65 мкг/кг/день до 70 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 70 мкг/кг/день до 75 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 80 мкг/кг/день до 85 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 85 мкг/кг/день до 90 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 90 мкг/кг/день до 95 мкг/кг/день. В соответствии с некоторыми другими вариантами осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции находится в диапазоне от 95 мкг/кг/день до 100 мкг/кг/день.
[00577] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 1 мкг/кг/день.
[00578] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 2 мкг/кг/день.
[00579] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 5 мкг/кг/день.
[00580] В соответствии с еще одним вариантом осуществления, терапевтическая доза терапевтического ингибиторного пептида фармацевтической композиции составляет 10 мкг/кг/день.
[00581] В рамках настоящей заявки, если не указано иначе, используемые технологии можно найти в любой из нескольких хорошо известных ссылок, таких как: Molecular Cloning: A Laboratory Manual (Sambrook, et al., 1989, Cold Spring Harbor Laboratory Press), Gene Expression Technology (Methods in Enzymology, Vol. 185, edited by D. Goeddel, 1991. Academic Press, San Diego, CA), "Guide to Protein Purification" in Methods in Enzymology (M.P. Deutshcer, ed., (1990) Academic Press, Inc.); PCR Protocols: A Guide to Methods and Applications (Innis, et al., 1990. Academic Press, San Diego, CA), Culture of Animal Cells: A Manual of Basic Technique, 2nd Ed. (R.I. Freshney. 1987. Liss, Inc. New York, NY), и Gene Transfer and Expression Protocols, pp. 109-128, ed. E.J. Murray, The Humana Press Inc., Clifton, N.J.), все из которых включены в настоящее описание путем ссылки.
[00582] Если не определено иначе, все технические и научные термины, используемые в настоящем описании, имеют значение, общепонятное среднему специалисту в данной области, которому предназначено настоящее изобретение. Хотя при осуществлении или тестировании описываемого изобретения также могут использоваться любые способы и материалы, сходные или эквивалентные тем, которые описаны в настоящем документе, здесь описаны предпочтительные способы и материалы. Все публикации, указанные в настоящем описании, включены в него путем ссылки для раскрытия и описания способов и/или материалов в связи приведенными в качестве ссылки публикациями.
[00583] Следует понимать, что пока контекст ясно не требует иного, при указании диапазона величин, в пределы изобретения включается каждая промежуточная величина до десятой доли единицы нижнего предела между верхним и нижним пределом этого диапазона и другая указанная или промежуточная величина в этом указанном диапазоне. Верхний и нижний пределы этих меньших диапазонов, которые могут быть независимо включены в меньшие пределы, также включены в изобретение, при условии, что любой определенно исключенный предел находится в указанном диапазоне. Когда указанный диапазон включает один или несколько из пределов, диапазонов, исключающих оба из включенных пределов, то они также включены в изобретение.
[00584] Следует отметить, что пока контекст ясно не требует иного, используемые в настоящем описании и в прилагаемой формуле изобретения формы единственного числа с неопределенными и определенным артиклями, включают соответствующие формы множественного числа. Все технические и научные термины, используемые в настоящем описании, имеют то же определение.
[00585] Обсужденные в настоящем описании публикации полностью включены в него путем ссылки и представлены исключительно для их раскрытия перед датой подачи настоящей заявки. Ничего в настоящем описании не следует рассматривать как допущение того, что описанное изобретение не имеет права предвосхищать такую публикацию ввиду предшествующего изобретения. Кроме того, представленные даты публикации могут отличаться от действительных дат публикации, которые могут потребовать независимого подтверждения.
[00586] Специалистам в данной области должно быть понятно, что могут быть внесены различные изменения и эквиваленты могут заменяться без отхода от истинной сущности и объема изобретения. Кроме того, множество модификаций может осуществляться для приспособления к конкретной ситуации, материалу, композиции вещества, способу, стадии или стадиям способа, цели, сущности и объему описываемого изобретения. Предполагается, что все такие модификации включены в объем прилагаемой к описанию формулы изобретения.
ПРИМЕРЫ
[00587] Следующие примеры приведены с тем, чтобы полностью раскрыть и описать для специалистов в данной области возможности использования описываемого изобретения, и они не предназначены ни для ограничения объема того, что заявители рассматривают как свое изобретение, ни для представления того, что описанные ниже эксперименты являются исчерпывающими и охватывают все проведенные эксперименты. Были предприняты усилия для обеспечения точности в отношении использованных чисел (например, количеств, температуры и т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иначе, части представляют собой части по массе, молекулярная масса представляет собой средневзвешенную молекулярную массу, температура представлена в градусах по Цельсию, и давление является атмосферным или близким к нему.
I. Материалы и методы
Разработка лекарственного средства MMI-0100
[00588] Для получения лекарственного средства MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) в соответствии с принципами надлежащей производственной практики (GMP), приблизительно 1 кг смолы Fmoc-Ala-Wang переносят в стеклянный реакционный сосуд емкостью 50 л для твердофазного синтеза, оборудованный механической мешалкой. Смоле дают возможность набухнуть в диметилформиде (DMF) в течение не менее чем (NLT) 2 часов перед сливом DMF. Затем смоляные шарики промывают последовательными циклами споласкивания с использованием DMF. N-концевую защитную группу (т.е. Fmoc) удаляют (стадия деблокировки) обработкой 20% пиперидином в DMF, и смолу промывают DMF. Следующую аминокислоту в последовательности соединяют в присутствии 1-гидроксибензотриазола (HOBt) и диизопропилкарбодиимида (DIC). В целом, в масштабе синтеза для соединения используют 2,5-3,5 молярных эквивалентов Fmoc-аминокислоты (Fmoc-AA). Fmoc-AA растворяют в DMF и активируют добавлением HOBt и DIC. Завершение каждого соединения контролируют нингидриновым тестом. Если соединение неполное, то выполняют второе соединение с той же аминокислотой с использованием симметричного ангидридного способа. В целом, в масштабе синтеза для соединения используют 3,0-6,0 молярных эквивалентов Fmoc-AA. Fmoc-AA растворяют в дихлорметане (DCM) и минимальном объеме DMF и активируют посредством добавления DIC в молярном отношении Fmoc-AA/DIC=1,0/0,5. Когда завершается полная пептидная последовательность, то смолу с пептидом тщательно промывают последовательными промываниями DMF и MeOH. Затем смолу сушат в вакууме в течение не менее чем 3 часов. Обычное извлечение общего количества высушенной смолы с пептидом составляет приблизительно 2800 граммов, представляя выход смолы с пептидом ~65%.
[00589] Затем приблизительно 370-500 граммов смолы с пептидом переносят в стеклянный флакон подходящего размера, оборудованный магнитным бруском для перемешивания. Колбу, содержащую смолу с пептидом, охлаждают на ледяной/водной бане или в холодильнике в течение не более чем 30 минут. Смесь трифторуксусной кислоты (TFA) (смесь TFA, TIS и воды в соотношении 95 мл: 2,5 мл: 2,5 мл) предварительно охлаждают на ледяной/водной бане в течение не более чем 30 минут. В этот сосуд добавляют приблизительно 8-12 мл смеси расщепления TFA на грамм смолы. Сразу после объединения смолы с пептидом и смеси TFA, ледяную/водную баню удаляют, и реакционную смесь перемешивают при комнатной температуре в течение 2-3 часов. Затем реакционную смесь фильтруют через стеклянный фильтр грубой очистки, и смолу промывают два раза 0,5-1,0 мл TFA на грамм смолы на промывание. Объединенный фильтрат собирают, и смолу удаляют. Затем фильтрат добавляют к простому эфиру, который предварительно охлажден в холодильнике в течение менее чем 30 минут, в соотношении 1 мл фильтрата на 10 мл простого эфира для осаждения расщепленного пептида. Температуру смеси пептид-простой эфир уравновешивают до комнатной температуры в течение не более чем 30 минут. Осажденный пептид собирают на стеклянный фильтр с порами среднего размера. Осадок тщательно промывают три раза холодным простым эфиром, используя количество эфира, достаточное по меньшей мере для покрытия всего осадка на фильтре. Эфир затем элюируют через тот же стеклянный фильтр с порами среднего размера. Неочищенный пептид переносят в пластиковый флакон и помещают в сушильный шкаф, соединенный с механическим вакуумным насосом, для сушки в течение не более чем 12 часов. После сушки неочищенный пептид хранят при 5±3°C. Процедуру расщепления повторяют много раз до тех пор, пока ни будет расщеплен весь пептид. Обычное общее полученное количество партии сушеного неочищенного пептида составляет приблизительно 1250 граммов, представляющее выход расщепления приблизительно 110%.
[00590] Неочищенный пептид после расщепления готовят для очистки высокоэффективной жидкостной хроматографией (ВЭЖХ) растворением пептида в буфере ВЭЖХ при конечной концентрации неочищенного пептида 20 мг/мл. Раствор пептида фильтруют через мембрану стеклянного фильтра с размером пор 1 мкм и загружают на колонку для обращеннофазовой ВЭЖХ C18, которая работает под управлением системы препаративной ВЭЖХ. Колонку промывают и уравновешивают. Линейный градиент используют для элюирования неочищенного пептида из колонки. После каждой очистки неочищенного продукта, фракции анализируют системой аналитической ВЭЖХ, используя колонку Kromasil C18, 5 мкм, 100 Å 4,6×250 мм. Фракции, полученные после первоначальной очистки, объединяют на основании ВЭЖХ чистоты и профиля примесей каждой фракции. Пептидные пулы хранят при 2-8°C до дополнительного процессинга. Этот процесс повторяют до тех пор, пока весь неочищенный пептид ни будет очищен через колонку ВЭЖХ, и ни будет удовлетворять основным критериям чистоты пула. Обмен соли на ацетат выполняют ВЭЖХ. Конечный раствор пептида фильтруют через фильтр с размером пор 0,22 мкм и загружают на полочный лиофилизатор. Пептид предварительно замораживают при 40°C в течении не более чем 720 минут перед началом цикла лиофилизации. Лиофилизация занимает приблизительно 5 дней. В результате стадий очистки и лиофилизации, конечный выход составляет приблизительно 50-55%.
Радиометрическое определение IC50
[00591] Величину IC50 оценивали по 10-точечной кривой полулогарифмических разведений. Пептид подавали в диметилсульфоксиде (DMSO). Конкретнее, человеческую рекомбинантную MK2 (h) (5-10 мЕд) инкубировали с 50 мМ 3-глицерофосфата натрия (pH=7,5), 0,1 мМ EGTA (этиленгликольтетрауксусной кислоты), 30 мкМ субстратного пептида (KKLNRTLSVA; SEQ ID NO: 21), 10 мМ ацетат магния и 90 мкМ γ-33P-АТФ (конечный объем 25 мкл) в течение 40 минут при комнатной температуре. Затем, реакцию останавливали 3% фосфорной кислотой. 10 мкл этой смеси каплями наносили на фильтровальный материал P30 и промывали три раза в течение пяти минут 75 мМ фосфорной кислоты и один раз метанолом. Наконец, мембрану сушили и использовали сцинтилляционный счетчик. Выбирали концентрацию АТФ в пределах 15 мкМ видимой Km (константы Михаэлиса) для АТФ, потому что Hayess and Benndorf (Biochem Pharmacol, 1997, 53(9): 1239-47) показали, что механизм их первоначального ингибиторного пептида (т.е. пептида KKKALNRQLGVAA; SEQ ID NO: 22) не конкурировали со связыванием АТФ.
[00592] В дополнение к определению величины IC50 для MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), ингибиторную активность против 266 человеческих киназ тестировали, используя прибор для экспресс-анализа Millipore's IC50 Profiler Express service (Millipore, Billerica, MA).
[00593] Для анализа специфичности использовали 100 мкМ каждого MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19), MMI-0300 (FAKLAARLYRKALARQLGVAA; SEQ ID NO: 3), MMI-0400 (KAFAKLAARLYRKALARQLGVAA; SEQ ID NO: 4) и MMI-0500 (HRRIKAWLKKIKALARQLGVAA; SEQ ID NO: 7), растворенного в диметилсульфоксиде (DMSO). Выбирали концентрацию 100 мкМ, потому что эта концентрация ингибировала образование адгезии в исследовании in vivo (как описано в заявке на патент США № 12/582,516, поданной 20 октября 2009 г., содержание которой полностью включено в настоящее описание путем ссылки). Каждое измерение киназной активности проводили в двух повторах.
Гистохимия и иммуногистохимия
[00594] Мышиную модель легочного фиброза создавали внутритрахеальным введением 0,025 ЕД блеомицина/PBS мышам C57BL/6. MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) (в дозировках 50 мкг/кг, 75 мкг/кг и 100 мкг/кг в день) вводили один раз в день, начиная с 7 дня после вызванного блеомицином повреждения (для анализа поствоспалительной/префибротической фазы; модель профилактики) или с 14 дня после вызванного блеомицином повреждения (для анализа постфибротической фазы; модель лечения), или внутрибрюшинно или посредством распыления, до 21 или 28 дня после подачи блеомицина. В 21 день после подачи блеомицина (для модели профилактики) или 28 день после подачи блеомицина (для модели лечения), группы мышей умерщвляли инъекцией пентобарбитала натрия (120 мг/кг) и вскрывали грудную полость. Правый главный стволовой бронх перевязывали, и правое легкое удаляли. Трахею канюлировали и левое легкое перфузировали 4% формальдегидом при давлении 21 см H2O. Затем блоки ткани заливали в парафин и получали 4 мм срезы для окрашивания. Срезы, полученные у каждого животного, окрашивали гематоксилином и эозином (H&E) для визуализации клеток или проводили трехцветное окрашивание по Массону для выявления отложения коллагена. После инкубации, срезы промывали 0,2% уксусной кислотой, дегидратировали погружением в 95% спирт и осветляли ксилолом (3-4 раза) в сосуде для окрашивания. Окрашенные срезы помещали на меченое предметное стекло с органической средой для гистологического препарата.
II. Результаты
Пример 1. IC50 и специфичность MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1).
[00595] Величину IC50 (половина максимальных ингибиторных концентраций) для пептида, ингибирующего MK2 (MMI-0100; YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)), определяли, используя прибор для экспресс-анализа Millipore's IC50 Profiler Express service. Этот количественный анализ измеряет, сколько ингибитора требуется для ингибирования 50% данного биологического процесса или компонента процесса (т.е. фермента, клетки или клеточного рецептора) [IC50]. Конкретнее, в этих анализах положительно заряженный субстрат фосфорилируется меченой радиоактивной меткой фосфатной группой из АТФ, если киназа не ингибируется ингибиторным пептидом. Затем положительно заряженный субстрат, притягиваемый к отрицательно заряженной фильтровальной мембране, количественно анализируют сцинтилляционным счетчиком и сравнивают с контролем с активностью 100%.
[00596] Выбирали концентрации АТФ в пределах 15 мкМ видимой Km для АТФ, поскольку концентрация АТФ, близкая к Km, может обеспечить возможность киназам иметь такое же относительное количество активности фосфорилирования. Определили, что IC50 MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) составляет 22 мкМ.
[00597] В дополнение к определению IC50 соединения, специфичность ингибиторных пептидов MK2 оценивали исследованием величин активности всех 266 человеческих киназ, доступных для тестирования в приборе для определения киназного профиля Millipore (Таблица 1). Для анализа, определяли киназы, которые ингибировались более чем на 65% MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1); MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19); MMI-0300 (FAKLAARLYRKALARQLGVAA; SEQ ID NO: 3); MMI-0400 (KAFAKLAARLYRKALARQLGVAA; SEQ ID NO: 4) и MMI-0500 (HRRIKAWLKKIKALARQLGVAA; SEQ ID NO: 7).
[00598] Как показано в таблице 1, в концентрации 100 мкМ, ингибиторные пептиды MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4) и MMI-0500 (SEQ ID NO: 5) ингибировали специфическую группу киназ и проявили очень ограниченное нецелевое ингибирование киназ. Конкретнее, ингибиторные пептиды MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4) и MMI-0500 (SEQ ID NO: 5) ингибировали более чем на 65% киназную активность in vitro протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), протеинкиназы 3, активированной митоген-активированной протеинкиназой (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI, серин/треонин-специфической протеинкиназы) и рецепторов фактора роста BDNF/NT-3 (TrkB, тирозинкиназы).
[00599] 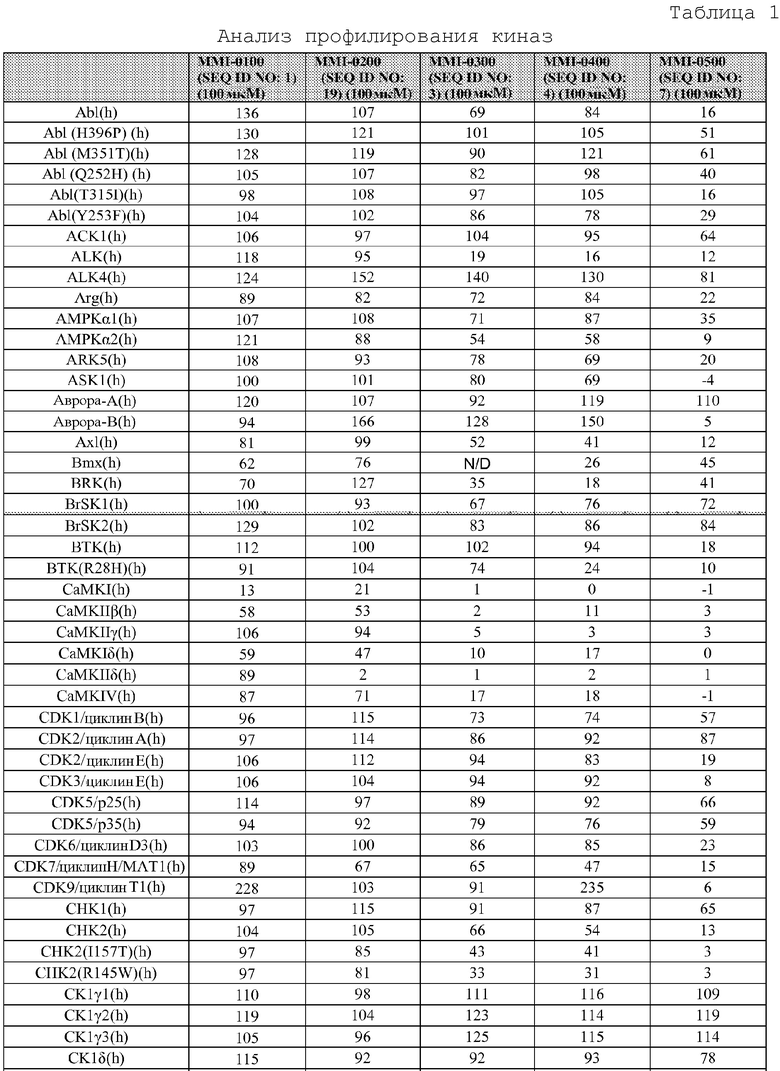
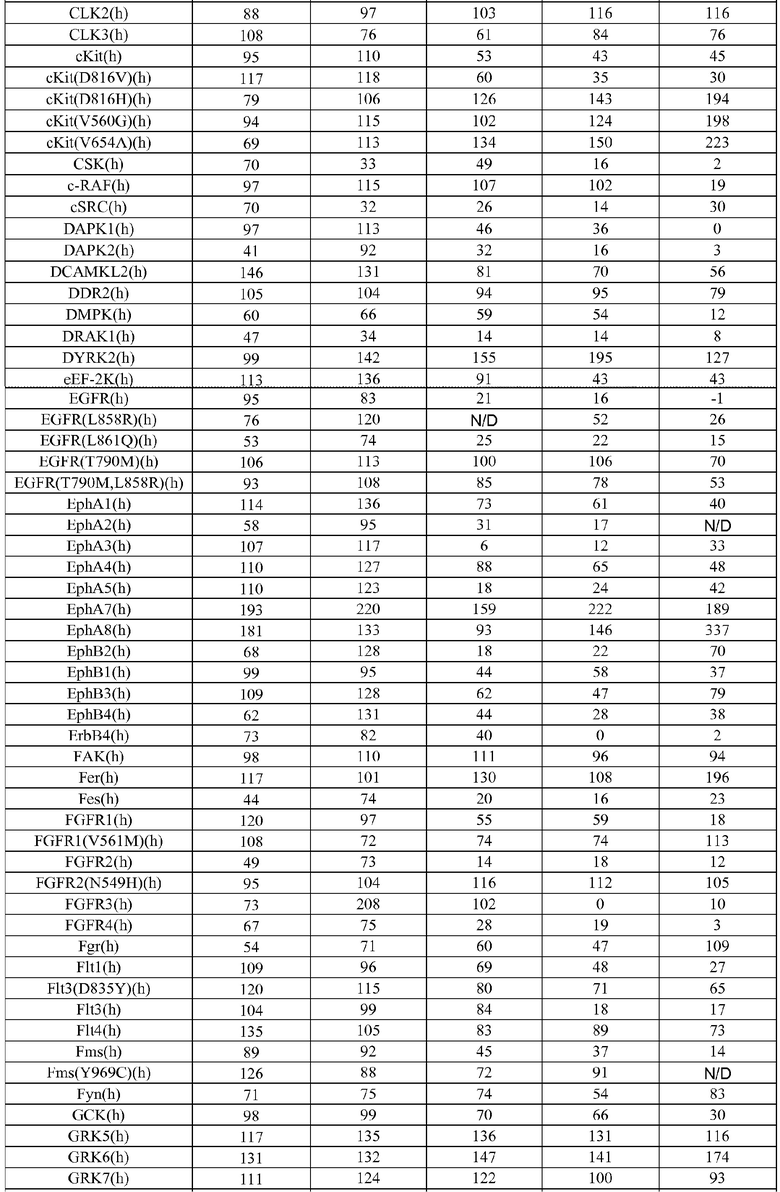

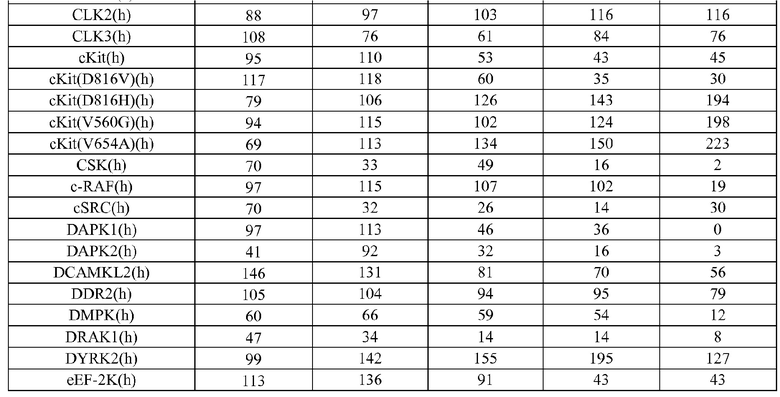
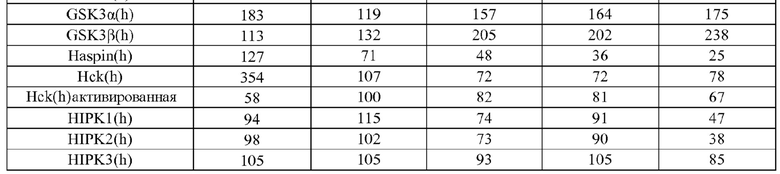
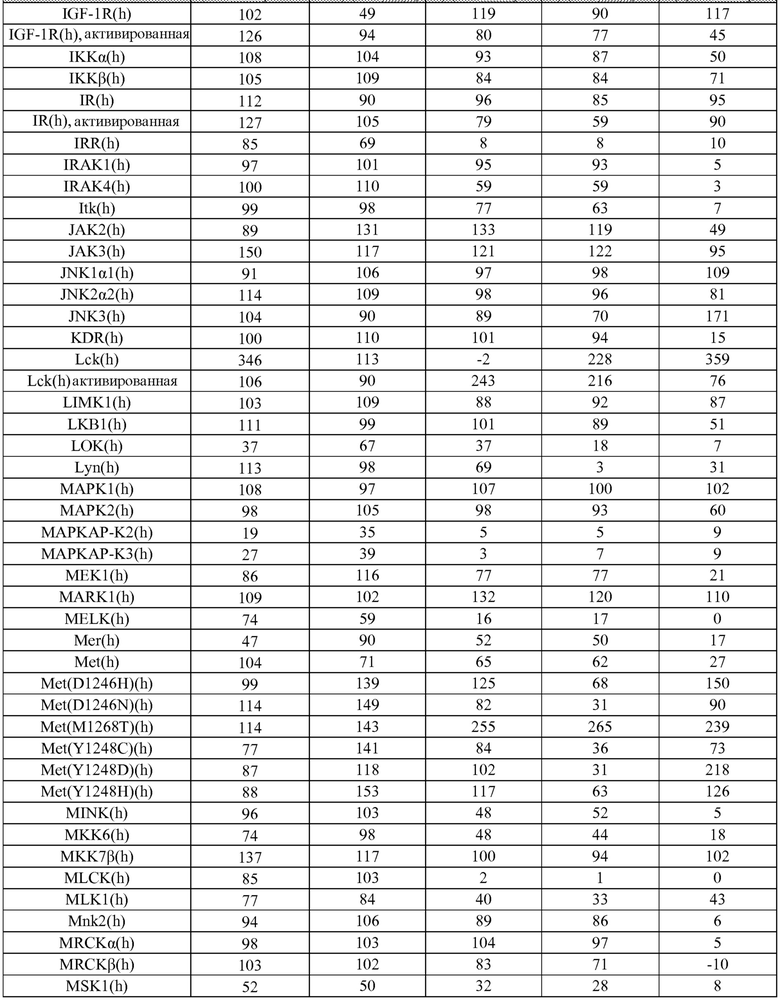
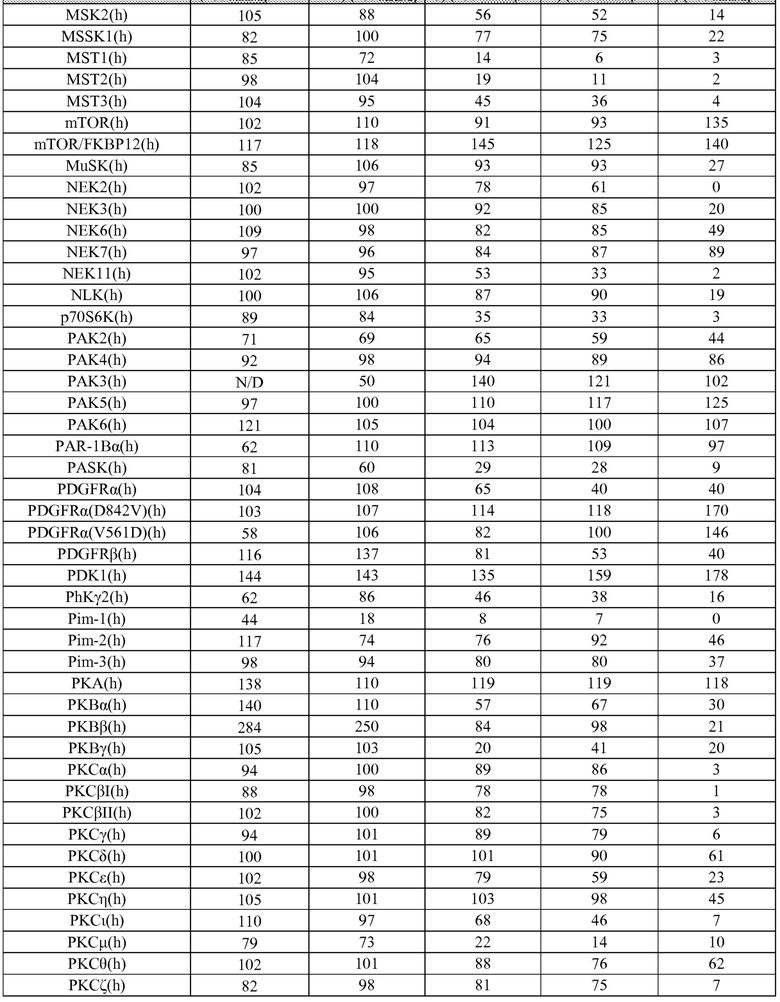
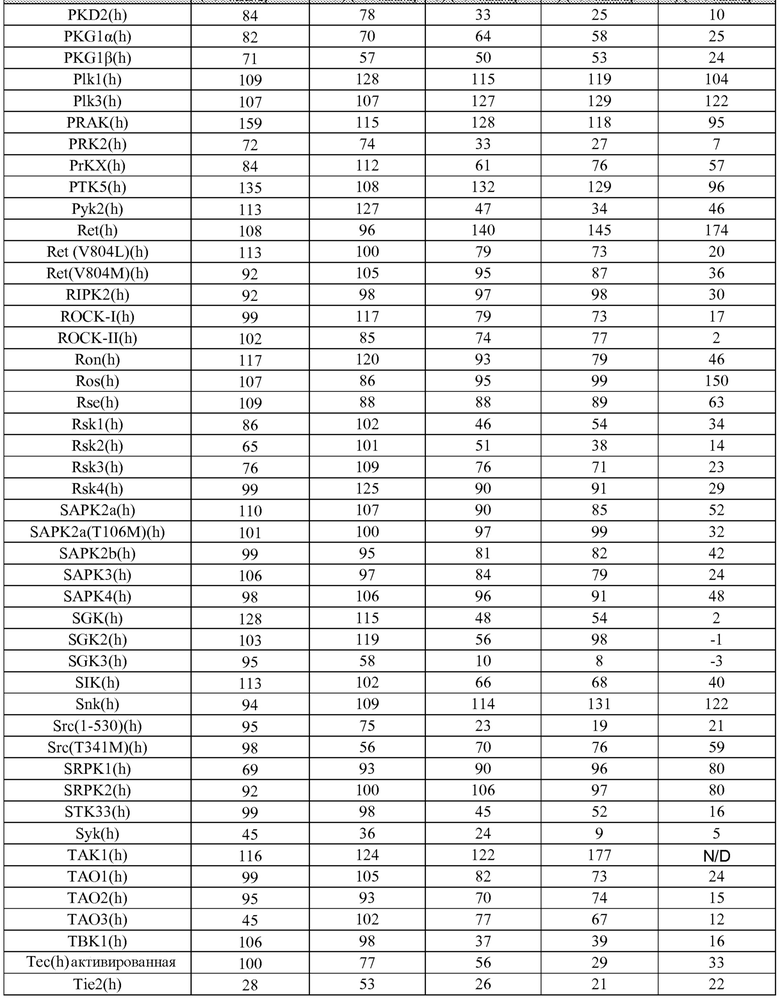
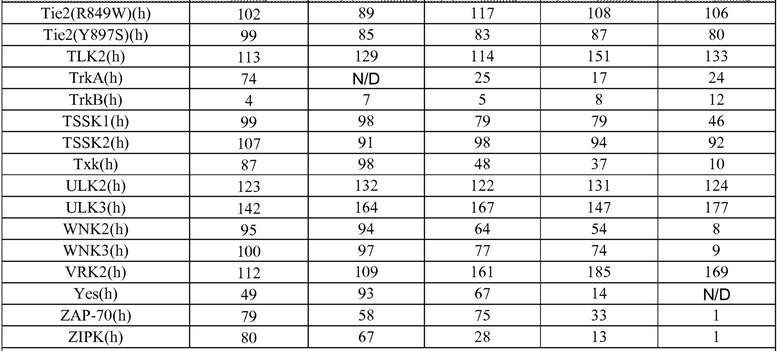

Пример 2. Препаративная форма MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональные эквиваленты
[00600] В соответствии с некоторыми вариантами осуществления, MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональные эквиваленты составляются в виде лиофилизированного порошка посредством распылительной сушки, микронизации (например, размола на струйной мельнице) или в виде жидкой препаративной формы для распыления.
Распылительная сушка
[00601] В некоторых вариантах осуществления, распылительная сушка используется для получения MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональных эквивалентов с учетом следующих факторов:
[00602] (a) белки и пептиды склонны к денатурации - то есть, разрыву на третичные и иногда вторичные структуры;
[00603] (b) денатурация может быть обратимой или необратимой и может быть вызвана разнообразными условиями, такими как увеличение температуры, уменьшение температуры, крайние значения pH, добавление растворителей, давление и денатурация вследствие сдвига (это относится к микронизации);
[00604] (c) денатурированные белки менее активны и не оказывают терапевтического эффекта, иногда полностью неактивны;
[00605] (d) распылительная сушка способна превратить эти аморфные, крупные молекулы в дискретные сферические частицы с определенным распределением размера частиц, регулируемым параметрами процессинга; полученные распылительной сушкой частицы могут быть абсолютно сферическими, иметь тороидальную форму и обычно являются полыми, и это значит, что частицы размером >5 мкм еще могут вдыхаться, но могут быть устойчивыми к механизмам выведения в легких; и
[00606] (e) Распылительная сушка с эксципиентами или без них в целом повышает стабильность белков.
[00607] Лиофилизированную препаративную форму MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональных эквивалентов оценивают в отношении потенциальной синергии со способом распылительной сушки (например, подбора оптимальных уровней концентраций буфера/pH во влаге, выбора эксципиента и тому подобного) для обеспечения защиты стабильности.
[00608] Первоначальные процедуры распылительной сушки нацелены на взаимносогласованные критерии приемлемости с целью определения параметров процесса для операции распылительной сушки. Для ингаляционного продукта важным критерием считается размер частиц. Для альвеолярного отложения в представляющей интерес области (типа II), масс-медианные аэродинамические диаметры (MMAD) 1-5 мкм в целом приняты как являющиеся подходящими для периферического отложения в альвеолярных пространствах (см. публикацию Heyder, J. Proc Am Thorac Soc, 1(4): 315-320, 2004, включенную в настоящее описание путем ссылки). Другие исследования свидетельствовали о том, что MMAD 1-3 мкм представляют собой желательные начальные целевые размеры частиц для способа распылительной сушки. Поскольку вероятным биопространством-мишенью для MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) является альвеолярная область, исходной целью является MMAD в диапазоне примерно 2 мкм для обеспечения отложения в альвеолярном пространстве.
[00609] Критерии приемлемости включают без ограничения (1) размер частиц (т.е., D90 примерно 2 мкм); (2) уровни влаги (т.е. влажность менее чем 3% масс./масс.); (3) плотность порошка; и (4) вид поверхности (сферическая, шероховатая, тороидальная).
[00610] Затем проводят эксперимент по структурированию процесса для оптимизации параметров способа распылительной сушки, включая, например, без ограничения (1) давление на входе и температуру сушки; (2) концентрацию и объединение сырьевого материала; и (3) соотношение пептида/эксципиента (эксципиенты представляют собой, например, соли и моносахарид буфера).
Пример 3. Продукция партий MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) для длительной оценки функциональных характеристик аэрозоля
[00611] Выполняют 2-3 процедуры распылительной сушки при определенных описанных выше параметрах процесса для создания материалы для оценки функциональных характеристик аэрозоля.
[00612] Полученные распылительной сушкой порошки вполне подходят для подачи из ингалятора, например, без ограничения ингалятора MicroDose. Ингалятор MicroDose обычно достигает и высокой подаваемой дозы, и высокой фракции тонкоизмельченных частиц и дозы при этом подходе к получению препаративной формы и для беспримесных форм, а также для смесей, высушенных совместным распылением. Иллюстративные функциональные характеристики для полученного распылительной сушкой инсулина показаны на фиг.1 и 2.
[00613] Хотя сухая микронизация представляет собой предпочтительный способ получения порошка с обеспечением малых молекул для легочной доставки, в отличие от распылительной сушки, она представляет собой способ, связанный с созданием напряжения, в котором используются высокие силы сдвига. Поскольку использование высоких сил сдвига может привести к разрыву белков и пептидов, сухая микронизация широко не используется для крупных молекул. Кроме того, если размеры доз малы, то требуются придающие объем агенты для улучшения текучести и обеспечения возможности точного отмеривания порошков при операциях заполнения. Первичный эксципиент и один из единственных эксципиентов, допущенных уполномоченными органами для легочной доставки по этому назначению, является лактоза, и может потребоваться проведение тестирования для определения ее химической совместимости с MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или его функциональными эквивалентами, поскольку лактоза не совместима с определенными пептидами.
[00614] Способ микронизации достаточно прост и хорошо известен в данной области. Вкратце, лиофилизированный сухой порошок MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональные эквиваленты пропускают через стадии помола до тех пор, пока ни достигается предписанное целевое распределение размера частиц (т.е., MMAD, D10, D50, D90). Этот беспримесный порошок тестируют на силу действия для обеспечения его активности после микронизации, оптимизируют для подачи из ингалятора и его химическую и физическую устойчивость тестируют в первичной (термически запаянной блистерной) упаковке. Затем беспримесный порошок смешивают с приоритетно выбранными утвержденными для целевой доставки сортами лактозы, тестируют для определения однородности смеси и проводят такие же тесты оптимизации ингалятора и устойчивости.
Ингалятор сухого порошка (DPI) MicroDose
[00615] В соответствии с некоторыми вариантами осуществления, MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональные эквиваленты могут быть введены с использованием ингалятора сухого порошка (DPI). Например, ингалятор сухого порошка (DPI) MicroDose имеет «активный» аэрозольный генератор с пьезоприводом, который приводится в действие дыханием и достигает высокой эффективности легочной доставки, независимо от скорости потока и объема вдоха пациента. В отличие от «пассивных» DPI, которые требуют сильного и принудительного вдыхания с потоком порядка 40-60 литров в минуту (л/мин) для доставки в легкие, для DPI MicroDose не требуются дыхательные усилия, поскольку он может обеспечивать эффективную подачу в очень широком диапазоне скоростей потока уже от 10 л/мин до 90 л/мин, при эквивалентном функционировании (см. примеры функциональной эффективности на фиг.3 и 4).
[00616] В соответствии с некоторыми другими вариантами осуществления, MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональные эквиваленты могут быть введены с применением вдоха и выдоха дыхательного цикла, таким, которое обеспечивается «небулайзером сухого порошка» (DPN). DPN подает дозы сухого порошка, синхронизированные со вдохом состоящего из вдоха и выдоха дыхательного цикла при запуске дыхательным объемом уже 2 литра в минуту (л/мин), ожидаемом максимальном потоке от 5 до 15 л/мин и дыхательном объеме уже 30 мл, которые представляют собой гораздо более многообещающие условия, чем те, которые ожидаются у взрослых пациентов с IPF. Этот новый DPN успешно прошел второе клиническое испытание у взрослых после его первого исследования в ноябре 2011 г. Эти результаты доступны через интернет на сайте www URL "clinicaltrials.gov/ct2/show/NCT01489306?spons=Microdose&rank=1".
[00617] Электронное устройство ингалятора MicroDose представляет собой крайне гибкое технологическое решение, способное точно и эффективно подавать обе описанные выше препаративные формы с особенно высокой эффективностью с лекарственными продуктами, подвергнутыми распылительной сушке, и и проявило эту функциональную способность более чем с 30 малыми и крупными молекулами. Высушенный распылением инсулин в первичной упаковке может сохраняться, например, по меньшей мере 18 месяцев. Примеры эффективности подачи и для высушенных распылением пептидов, и для микронизированных малых молекул показаны на фиг.5-8.
[00618] Что касается воздействия препаративной формы в виде сухого порошка на легочные мембраны, например, сенсибилизацию, то подача сухого порошка, особенно при низких загрузках порошка (<4-5 мг) навряд ли окажет воздействие на легочные мембраны или вызовет сенсибилизацию (кашель и т.д.), кроме случаев, когда это является эндогенным свойством активной молекулы (что заявители наблюдали в исследованиях на животных). Выбирают эксципиенты, которые уже были утверждены для внутрилегочного введения с превосходной легочной биосовместимостью, и они присутствуют в очень низких количествах (т.е. в низком миллиграммовом диапазоне). Например, маннит в низких количествах навряд ли окажет эффект.
Распыление жидкости
[00619] Альтернативно, MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или его функциональные эквиваленты могут доставляться посредством распыления жидкости. Предыдущие преклинические исследования показали, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) может доставляться грызунам посредством небулайзера AeroGen®, приспособленного для применения у животных.
[00620] Для специального изучения возможности доставки MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) для положительного воздействия на пораженное легкое в экспериментах по изучению его эффективности на модели вызванного блеомицином поражения легких у животных, эффективно аэрозолизируют раствор MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1). Локальное введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) в легкое достигается посредством небулайзера для грызунов, сконструированного и произведенного компанией Aerogen® (www.aerogen.com). В небулайзере Aeroneb® Lab Micropump Nebulizer используется высокоэффективная технология аэрозолизации для использования в преклинических исследованиях аэрозолей и изучениях ингаляционной доставки лекарственных средств, обеспечивающая полезную связь между преклинической и клинической стадиями разработки продукта. Скорость потока составляет >0,3 мл/мин и предназначена для доставки частиц размером 2 мм с распределением в самые глубокие альвеолы. Эффективность распыленного MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его клеточный захват по всему легкому были продемонстрированы на мышиной модели легочного фиброза, вызванного блеомицином (см. фиг.16). Локализованное, клинически релевантное ингаляционное введение так же эффективно, как обычные системные инъекции в ослаблении активации MK2.
Пример 4. Уровень активированного MK2 возрастает в фибротических поражениях легких пациента с идиопатическим легочным фиброзом (IPF)
[00621] Протеинкиназа 2, активированная митоген-активированной протеинкиназой (MAPK) (MK2), активируется после сресса p38MAPK-α и β. Эти две изоформы p38MAPK связываются с базовым мотивом докинга в карбокси конце MK2, которые в последующем фосфорилируют ее регуляторные сайты. В результате активации, MK2 экспортируется из ядра в цитоплазму и совместно транспортирует активную p38 MAPK в этот компартмент. MK2 стабилизирует локализацию p38MAPK и существенна для дифференциации, миграции и продукции цитокинов (Kotlyarov, A., Mol Cell Biol. 22(13): 4827-4835, 2002).
[00622] Поэтому для исследования того, активируется ли путь передачи сигналов p38MAPK-MK2 в легких, пораженных IPF, срезы легочной ткани, полученной у здоровых лиц и пациентов с IPF, окрашивали фосфо-специфическим антителом к активированной форме MK2 (анти-фосфо-Thr334-MAPKAPK2). Проводили иммуноокрашивание тканей здоровых и пораженных IPF легких с использованием DAB (диаминобензидина), и ядро противоокрашивали гематоксилином. Как показано на фиг.9, повышенная экспрессия активированной MK2 наблюдалась в клетках в фибротиических очагах из эксплантатов легочной ткани, полученной у пациентов с IPF, по сравнению с биоптатом нормальной легочной ткани (слева). Эти результаты свидетельствуют о том, что образование фиброза в легких пациентов с IPF характеризуется аберрантной активацией пути передачи сигналов p38MAPK-MK2.
Пример 5. Введение распылением и системно MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) защищает против вызванного блеомицином легочного фиброза у мышей
[00623] Одним из отличительных признаков идиопатического легочного фиброза (IPF) является активация мезенхимальных клеток и избыточное отложение матрикса, в частности, коллагена. Итоговое накопление коллагена в легких может быть измерено и гистологическими, и биохимическими методиками, наиболее демонстративно, посредством накопления гидроксипролина, который почти полностью происходит из коллагена в легких, и, таким образом, служит в качестве заместителя общего содержания коллагена в легких (Umezawa H. et al., Cancer, 20(5): 891-895, 1967).
[00624] Поэтому терапевтическую эффективность пептида MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) при лечении легочного фиброза оценивали с использованием мышиной модели вызванного блеомицином легочного фиброза системной (внутрибрюшинной) или локальной (посредством введения распыленного препарата) доставкой пептида MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) во время профилактики или префибротической стадии (т.е. введения лекарственного средства, начиная с 7 дня после повреждения блеомицином; см. фиг.10) и измерением уровней коллагена, как показателей фиброза у мышей после введения блеомицина.
[00625] Вкратце, образование фибротических очагов в легких мышей вызывали внутритрахеальной подачей примерно 0,025 Ед блеомицина (растворенного в PBS) мышам C57BL/6 mice. Для исследования эффективности MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) при лечении легких, поврежденных блеомицином, на профилактической/префибротической фазе, контроль (PBS) или MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) вводили один раз в день или внутрибрюшинно, или посредством распыления, начиная с 7 дня после после подачи блеомицина (когда воспаление стихает, и активируются фибротические механизмы), до 21 дня после подачи блеомицина (когда наблюдается значительный фиброз) (фиг.10). На 21-й день после подачи блеомицина, легочные ткани от мышей с вызванным беломицином повреждением, получавших лечение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или контролем (PBS), выделяли, фиксировали, заливали в парафин, и готовили срезы для окрашивания. Вкратце, мышей умерщвляли инъекцией пентобарбитала натрия (120 мг/кг), и вскрывали грудную полость. Правый главный стволовой бронх перевязывали, и правое легкое удаляли. Трахею канюлировали, и левое легкое перфузировали 4% формальдегидом при давлении 21 см H2O. Затем блоки ткани заливали в парафин, и готовили 4 мм срезы и окрашивали гематоксилином и эозином (H&E; для патогистологического исследования) или трехцветного окрашивания по Массону (для окрашивания коллагена).
[00626] Как показано на фиг.11, срезы легких от мышей, получавших обработку PBS, проявляли нормальные структуры легочной ткани (NL) и дыхательных путей (AW). Напротив, в срезах легких от мышей, получавших блеомицин (в 21 день), в тканях легких выявлена структура суженных дыхательных путей (AW) с образованием фибротических очагов (FF) (верхняя панель; окрашивание гематоксилином и эозином (H&E)) и увеличенное накопление коллагена (стрелки на нижней панели; трехцветное окрашивание по Массону), которые напоминают признаки, обнаруживаемые у пациентов с IPF. Однако введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), или посредством распыления, или внутрибрюшинно значительно снижало развитие образования фибротических очагов (верхняя панель, MMI-0100 (NEB) и MMI-0100 (IP)) и снижало накопление коллагена (нижняя панель, MMI-0100 (NEB) и MMI-0100 (IP)) в легких мышей, получавших блеомицин.
[00627] Затем проводили количественный анализ общего содержания коллагена в легких мышей с вызванным блеомицином повреждением легких (фиг.12) путем расчета фактора постоянного превращения (7,5) для коллагена по концентрациям гидроксипролина (см. Neuman R. and Logan M, J Biol Chem., 186(2):549-56, 1950, включенную в настоящее описание путем ссылки). Как показано на фиг.12, и введение путем распыления (BLEO+NEBULIZED), и системное введение (BLEO+IP) MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) во время поствоспалительной/префибротической стадии значительно уменьшало отложение коллагена по сравнению с блеомициновым контролем.
Пример 6. Данные зависимости реакции от дозы пептидных ингибиторов MK2 на модели профилактики идиопатического легочного фиброза
[00628] Затем воздействие возрастающих доз пептидных ингибиторов MK2 на отложение коллагена исследовали in vivo, используя мышиную модель идиопатического легочного фиброза, вызванного введением беломицина (модель профилактики). Вкратце, мышей C57-BL/6 подвергали вызванному блеомицином повреждению легких в 0 день. Начиная с 7 дня и продолжая до 21 дня включительно, мышам вводили 25, 50 или 75 мкг/кг MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) один раз в день посредством внутрибрюшинной (IP) инъекции. Как показано на фиг.13, синее окрашивание при трехцветной окраске по Массону выявило снижение уровней коллагена в легких мышей с повреждением легких, вызванным блеомицином, получавших лечение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), свидетельствуя о том, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) может дозозависимым образом защитить от фиброза в легких, вызванного повреждением блеомицином. Эти данные свидетельствуют о том, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) сохраняет свой потенциал в качестве фибропротективного соединения даже в более высоких дозах.
[00629] Напротив, лечение мышей с вызванным блеомицином повреждением легких MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) не снижало, а скорее увеличивало отложение коллагена в легких в тестированных дозах. Однако этот результат согласуется с предыдущим исследованием с использованием мышей с нокаутом MK2 и MK2 -/- мышиных эмбриональных фибробластов (MEF), у которых вся активность MK2 была устранена, которые проявляли фенотип усиленного фиброза (Liu et al., Am J Respir Cell Mol Biol, 37: 507-517, 2007).
[00630] Без ограничения теорией, эти результаты свидетельствуют о том, (1) что ингибиторные пептиды MK2 по описываемому изобретению могут проявлять спектр ингибиторных активностей в отношении определенной группы киназ; (2) что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) могут дифференциально ингибировать MK2 и другие киназы, которые, в зависимости от применяемой дозы, вносят вклад в этот спектр ингибиторных активностей; (3) что образование и/или миграция миофибробластов могут также представлять собой скорее часть фазы репарации фиброза, чем активного повреждения; и (4) что поэтому, определенный уровень активности MK2 необходим для того, чтобы происходил этот процесс (Liu et al., Am J Respir Cell Mol Biol, 37: 507-517, 2007).
[00631] Кроме того, ингибиторные пептиды MK2 по описываемому изобретению были получены из связывающего субстрат сайта MK2 от находящейся ниже по ходу транскрипции мишени HSPB1. Поэтому, они могут полностью ингибировать киназную активность MK2 в отношении HSPBl. Без ограничения теорией, дифференциальные воздействия MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) на фиброз могут быть отнесены на счет различий его последовательности, его гомологии к участкам связывания HSPB1, его дифференциального ингибирования киназной активности MK2 в отношении определенного участка связывания белка или их комбинации.
Пример 7. Введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) эффективно блокирует системную T-клеточную активацию на модели профилактики идиопатического легочного фиброза
[00632] Недавно проведенные исследования выявили ключевую роль T лимфоцитов при фиброзе, вызванном блеомицином (Wilson, M. et al., The Journal of Experimental Medicine, 207(3): 535-552, 2010). Поэтому для исследования функциональной роли селезеночных (пан)-T-клеток у мышей с вызванным блеомицином повреждением легких, леченных MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), выполняли реакцию аутологичных смешанных лимфоцитов (MLR), как описано ранее (см. Wilkes, D. et al., Journal of Leukocyte Biology, 64(5):578-586, 1998, включенную в настоящее описание путем ссылки). В частности, исследовали способность очищенных антиген-презентирующих клеток мышей C57BL/6 вызывать пролиферацию T-лимфоцитов C57BL/6 в анализе.
[00633] Мышей C57-BL/6 подвергали повреждению легких введением блеомицина в 0-й день. С 7 по 21 день включительно мышам вводили 50 мкг/кг/день MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) один раз в день внутрибрюшинной (IP) инъекцией или небулайзером (NEB). Селезеночные T-клетки выделяли и культивировали отдельно или в присутствии аутологичных антиген-презентирующих клеток (APC от мышей C57-BL/6) или стимулировали антителами к CD3 (α-CD3) в течение 48 часов. Затем клетки метили радиоактивным изотопом с использованием тритиевого тимидина в течение 16 часов и оценивали скорость пролиферации.
[00634] Как показано на фиг.14, только T-клетки, независимо от лечения, проявляли очень низкую пролиферативную способность. Однако, когда T-клетки совместно культивировали с аутологичными антиген-презентирующими клетками (т.е. APC, выделенными у мышей C57-BL/6), пролиферативная способность была значительно выше для мышей с вызванным блеомицином повреждением, чем для контрольных мышей. Представляет интерес, что пролиферация T-клеток от получавших блеомицин мышей, наблюдавшаяся в присутствии антиген-презентирующих клеток, была значительно снижена системным введением MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), но, как ожидалось, не методом ингаляции. Эти данные свидетельствуют о подавлении под действием MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) активации селезеночных T-клеток и указывают на то, что пептидный ингибитор MK2 оказывает протективное действие в отношении фиброза.
[00635] Жизнеспособность T-клеток также подтвердилась стимуляцией клеток антителами к α-CD3, поликлональному активатору T-клеток. α-CD3 вызывал активную пролиферацию клеток независимо от группы лечения. Пролиферативная реакция на поликлональный активатор свидетельствует о том, что пептидный ингибитор MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) не воздействует на функциональные свойства селезеночных T-клеток, и что введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) в этой конкретной дозе не оказывает токсического действия. Кроме того, отсутствие реакции селезеночных T-клеток на распыленный MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) свидетельствует о том, при этом способе доставки пептида происходит небольшое системное распределение.
Пример 8. Лечение системным введением или введением распылением MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) защищает поврежденные блеомицином легкие на пост-фибротической фазе
[00636] Классическую блеомициновую модель, как изображено на фиг.10, широко использовали по данным литературы на префибротической стадии для тестирования эффективности любого вмешательства. Поскольку и введение распылением, и системное введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) значительно защищало легкие от вызванного беломицином фиброза, эффект системного (внутрибрюшинного) или локального (введения распылением) MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) при лечении поврежденных блеомицином легких дополнительно исследовали на постфибротической стадии, причем медикаментозное вмешательство начинали на 14 день, в точку времени, когда легкие значительно фиброзированы (фиг.15) (см. Pottier, N. et al., American Journal of Respiratory and Critical Care Medicine, 176(11): 1098-1107, 2007, включенную в настоящее описание путем ссылки). Излечение рубцовых поражений легких, которое показано на этой модели, клинически обосновано при условии, что в легких пациентов с IPF во время диагностики имеются рубцовые поражения.
[00637] Конкретнее, фибротические очаги в легких были вызваны внутритрахеальной подачей примерно 0,025 Ед блеомицина (растворенного в PBS) мышам C57BL/6. Для исследования эффективности MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) при лечении вызванных блеомицином поражений легких на постфибротической фазе, PBS (контроль) или MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) вводили мышам или внутрибрюшинно, или посредством распыления один раз в день, начиная с 14 дня после введения блеомицина до 28 дня после введения беломицина. В 28 день после введения блеомицина легочные ткани получавших блеомицин мышей, леченных MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) или контрольных (PBS), выделяли, фиксировали, заливали в парафин и делали срезы для окрашивания. Мышей умерщвляли инъекцией пентобарбитала натрия (120 мг/кг) и грудную полость вскрывали. Правый главный стволовой бронх перевязывали, и правое легкое удаляли. Трахею канюлировали, и левое легкое перфузировали 4% формальдегидом под давлением 21 см H2O. Затем блоки ткани заливали в парафин, и получали 4 мм срезы и окрашивали гематоксилином и эозином (H&E; для патоморфологического исследования) или трехцветным окрашиванием по Массону (для окрашивания коллагена).
[00638] Как показано на фиг.16, независимо от способа введения лекарственного средства, т.е. либо внутрибрюшинного введения, либо локального нанесения на легкие, лечение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) «излечивало» легкие с тяжелыми рубцовыми поражениями. Гистологическую оценку использовали для исследования легочной архитектуры (окрашивание гематоксилином и эозином (H&E), верхняя панель) и распределения коллагена (синее окрашивание при трехцветной окраске по Массону, нижняя панель). Результаты гистохимического исследования показывают, что хотя пораженные блеомицином легкие характеризуются тяжелыми рубцовыми изменениями, мыши, леченные MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: l), имеют более прозрачную легочную паренхиму.
[00639] Затем отложение коллагена количественно определяли с использованием стандартного гидроксипролинового анализа во всем левом легком. Общее отложение коллагена (растворимого и нерастворимого) оценивали анализом концентраций гидроксипролина в легких мышей в 28 день после повреждения блеомицином. MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) вводили в дозе 50 мкг/кг/день внутрибрюшинной инъекцией (IP) или небулайзером (NEB), начиная с 14 дня после повреждения блеомицином.
[00640] Как показано на фиг.17, лечение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) в значительной степени останавливало дальнейшее прогрессирование отложения коллагена, по сравнению с исходным уровнем, через 28 дней после повреждения блеомицином, и началом лечения MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1). Это существенно, потому что хотя текущая литература показывает эффективную профилактику при разработке лекарственных средств, когда производится диагностика у пациентов с IPF, имеется ранее существующий фиброз. Эти результаты также свидетельствуют о том, что MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) способен эффективно останавливать или замедлять дальнейшее прогрессирование заболевания и улучшать качество жизни; и что пептид MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), при использовании в более высокой дозе и/или в течение более длительного периода лечения, может привести к еще большему улучшению гистологии и физиологии легких и уменьшению фиброза.
Пример 9. Либо системное, либо локальное введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) коррелируется со сниженным уровнем активированной MK2 на мышиной модели вызванного блеомицином идиопатического легочного фиброза
[00641] Как обсуждалось выше, одной из основных мишеней MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональных эквивалентов в легких является киназа MK2, которая вызывает воспалительные и фибротические реакции в пораженных легких. Поэтому, для дополнительного подтверждения эффектов MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) in vivo, исследовали уровни активированной MK2 (фосфо-Thr334-MAPKAPK2) у нелеченых мышей с вызванным блеомицином поражением, а также у мышей, леченных MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: l).
[00642] Вкратце, мышей C57-BL/6 подвергали повреждению блеомицином в 0 день. В 14 день мышам вводили 50 мкг/кг MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) один раз в день внтурибрюшинной (IP) инъекцией или небулайзером (NEB) вплоть до 28 дня после повреждения блеомицином. Проводили иммуноокрашивание фиксированных формалином срезов легочной ткани в отношении фосфо-Thr334-MAPKAPK2. Контрольное окрашивание проводили биотинилированным вторичным IgG антителом. Конъюгированную со стрептавидином пероксидазу хрена использовали с 3,3'-диаминобензиденом в качестве субстрата, и ядра противоокрашивали гематоксилином. В то время как без лечения у получавших блеомицин мышей проявлялось видимое увеличение присутствия активированной MK2 (темные узелки), чаще всего в зонах значительного отложения коллагена, у мышей, леченных MMI-0100, проявлялось присутствие активированной MK2, сходное с нормальной тканью, причем такое распределение концентрировалось в областях около дыхательных путей и кровеносных сосудов.
[00643] Как показано на фиг.18, независимо от типа доставки, т.е. либо системное, либо местное введение, в отличие от контроля, введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) распылением или внутрибрюшинной инъекцией было связано с уменьшенным окрашиванием фосфо-Thr334-MAPKAPK2 (активированной формы MK2) на мышиной модели с использованием блеомицина.
Пример 10. MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) подавляет воспалительные цитокины на модели лечения идиопатического легочного фиброза
[00644] Одним возможным механизмом, посредством которого MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) может ингибировать образование фиброза в легких, является уменьшение локальных концентраций провоспалительных цитокинов и, посредством этого, сдерживание вовлечения моноцитов и аберрантного внеклеточного ремоделирования макрофагами в легких (например, увеличения отложения коллагена, увеличения клеточной адгезии, уменьшения разрушения матрикса). Для исследования этой возможности, изучали способность пептида MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) ингибировать продукцию провоспалительных цитокинов измерением изменений уровней интерлейкина-6 (IL-6) и фактора некроза опухоли-альфа (TNF-α) после лечения MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) внутрибрюшинной инъекцией или посредством распыления.
[00645] Интерлейкин-6 (IL-6) представляет собой многофункциональный цитокин, чьи основные воздействия включают усиление синтеза иммуноглобулинов, активацию T-клеток и модуляцию синтеза острофазных белков. Известно, что многие различные типы клеток, включая моноциты, макрофаги, эндотелиальные клетки и фибробласты, продуцируют IL-6, и экспрессия гена IL-6 в этих клетках регулируется разнообразными индукторами. Интерлейкин-1β (IL-1β) и фактор некроза опухоли (TNF-α) представляют собой два ключевых известных индуктора экспрессии гена IL-6. Другие индукторы включают активаторы протеинкиназы C, кальциевый ионофор A23187 и различные агенты, вызывающие повышение уровней внутриклеточного циклического АМФ (цАМФ).
[00646] Фактор некроза опухоли (TNF, также именуемый TNF-α) представляет собой цитокин, вовлеченный в системное воспаление, и являющийся членом группы цитокинов, которые стимулируют острофазную реакцию. Исследования показали, что TNF-α индуцирует экспрессию IL-6 посредством трех специфических путей передачи сигналов внутри клетки, т.е.: 1) пути NF-κΒ, 2) пути MAPK и 3) пути передачи суицидных сигналов.
[00647] Как показано на фиг.20, введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) либо внутрибрюшинно (BLEO+MMI-0100 (IP)), или ингаляционно (BLEO+MMI-0100 (NEB)) значительно снижало уровень в плазме и TNF-α (A, верхняя панель), и IL-6 (B, нижняя панель) на мышиной модели идиопатического легочного фиброза, вызванного блеомицином.
Пример 11. Как системное, так и локальное введение MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) эффективно блокирует активацию и накопление миофибробластов в мышином легком, которое подвергнуто значительным рубцовым изменениям вследствие повреждения, вызванного блеомицином
[00648] Характерным признаком идиопатического легочного фиброза (IPF) является накопление миофибробластов в фибротических поражениях и экспрессия многочисленного альфа-гладкомышечного актина (α-SMA), маркера активации миофибробластов. Кроме того, активированные миофибробласты частично ответственны за ригидность легочной паренхимы и ухудшение легочной функции.
[00649] Таким образом, оценивали уровень экспрессии α-SMA в поврежденных блеомицином легких получавших блеомицин мышей, леченных MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), либо системно (путем внутрибрюшинного введения), либо местно (посредством распыления). Как показано на фиг.21, уровень α-SMA был значительно снижен в легких после лечения MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1), по сравнению с уровнем α-SMA в поврежденных блеомицином легких без лечения.
Пример 12. Исследования дозозависимого эффекта MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) при модулировании вызванной TGF-β1 активации миофибробластов in vitro
[00650] Основными характерными признаками идиопатического легочного фиброза (IPF) являются присутствие атипичных и апоптозных эпителиальных клеток наряду с активированными миофибробластами, которые секретируют избыточные количества матриксных белков, включая коллагены, фибронектин и матриксные металлопротеиназы (Horowitz, J. and Thannickal, V., Treatments in Respiratory Medicine, 5(5):325-42, 2006). При нормальных процессах заживления ран, предварительный матрикс образуется миофибробластами в качестве временного каркаса. Сокращение предварительного матрикса приводит к последующей реэпителизации и конечному заживлению раны. Однако при активации миофибробласты устойчивы к апоптозу, и итоговое избыточное отложение коллагена приводит к стабилизации матрикса (Tomasek, J. et al., Nature Reviews Molecular Cell Biology, 3(5): 349-63, 2002). Итогом неконтролируемой пролиферации, активации и устойчивости миофибробластов к апоптозу являются фибротические поражения со стабилизированным матриксом ввиду отложения коллагена и, таким образом, конечная деформация легочной архитектуры (Yamashita, C. et al., The American Journal of Pathology, 179(4): 1733-45, 2011).
[00651] Поэтому, поскольку фибробласты являются ключевыми клетками, участвующими в образовании рубцовой ткани, эффект MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) на активацию миофибробластов оценивали исследованием уровней белков α-гладкомышечного актина (α-SMA) и фибронектина в культивированных человеческих фетальных легочных фибробластах (клетках IMR-90), обработанных TGF-β. Как показано на фиг.22 и 23, MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) эффективно предотвращал активацию миофибробластов, вызванную TGF-β, дозозависимым образом, как показано снижением уровней и α-гладкомышечного актина (α-SMA) (фиг.22), и фибронектина (фиг.23).
[00652] Напротив, MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19) в тестированных дозах не оказывал воздействия на активацию миофибробластов, опосредованную TGF-β, на что указывает отсутствие изменений уровня белков маркеров активации миофибробластов α-гладкомышечного актина (фиг.21) и фибронектина (фиг.23). Без ограничения теорией, эти результаты свидетельствуют о том, (1) что ингибирующие MK2 пептиды по описываемому изобретению могут проявлять спектр ингибиторной активности в отношении определенной группы киназ; (2) что MMI-0100 (SEQ ID NO: 1) и MMI-0200 (SEQ ID NO: 19) могут дифференциально ингибировать MK2 и другие киназы, что, в зависимости от применяемой дозы, способствует этому спектру ингибиторной активности; (3) что могут быть компенсаторные пути, которые регулируют α-гладкомышечный актин; (4) что образование и/или миграция миофибробластов также может быть скорее частью фазы репарации фиброза, а не активного повреждения; и (5) что поэтому определенный уровень активности MK2 необходим для того, чтобы происходил этот процесс (Liu et al., Am J Respir Cell Mol Biol, 37: 507-517, 2007).
[00653] Кроме того, пептиды, ингибирующие MK2, по описываемому изобретению были получены из сайта связывания субстрата MK2 ниже по ходу транскрипции от целевого HSPB1. Поэтому, они могут конкурентно ингибировать киназную активность MK2 в отношении HSPB1. Без ограничения теорией, дифференциальные эффекты MMI-0200 (SEQ ID NO: 19) на фиброз могут быть отнесены на счет его отличий последовательности, его гомологии с сайтами связывания HSPB1 и его дифференциальным ингибированием киназной активности MK2 в отношении определенного сайта связывания целевого белка.
[00654] Хотя описанное изобретение было представлено со ссылкой на его определенные варианты осуществления, специалистам в данной области следует понимать, что в него могут быть внесены различные изменения и замещения эквивалентов без отхода от сущности и объема изобретения. Кроме того, может быть внесено множество модификаций для приспособления к конкретной ситуации, материала, композиции вещества, способа, стадии или стадий способа к объективной сущности и объему описываемого изобретения. Предполагается, что все такие модификации включены в объем прилагаемой к описанию формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ КОЖНЫХ РУБЦОВ | 2013 |
|
RU2705211C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРНЫЕ ПЕПТИДЫ NOX-1 И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2699726C2 |
| НОВЫЙ ПЕПТИД-ИНГИБИТОР PI3Kγ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ОРГАНОВ ДЫХАНИЯ | 2015 |
|
RU2704826C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ОСТРОГО ПОВРЕЖДЕНИЯ ЛЕГКИХ | 2019 |
|
RU2817906C2 |
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из растворимого внеклеточного фрагмента человеческого PDGFRa и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2821574C1 |
| ИНГИБИТОР RET | 2013 |
|
RU2648818C2 |
| КЛЕТКА | 2016 |
|
RU2729158C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ИНТЕГРИН ανβ8 | 2011 |
|
RU2565539C2 |
| ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ ИНГИБИТОРНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ АГРЕГАЦИИ ТРОМБОЦИТОВ И/ИЛИ ИНГИБИТОРНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ АДГЕЗИИ ТРОМБОЦИТОВ, ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ЕГО, КОМПОЗИЦИЯ И НАБОР, СОДЕРЖАЩИЕ ДАННЫЙ ПОЛИПЕПТИД | 2006 |
|
RU2434941C2 |
| КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2006 |
|
RU2557296C2 |







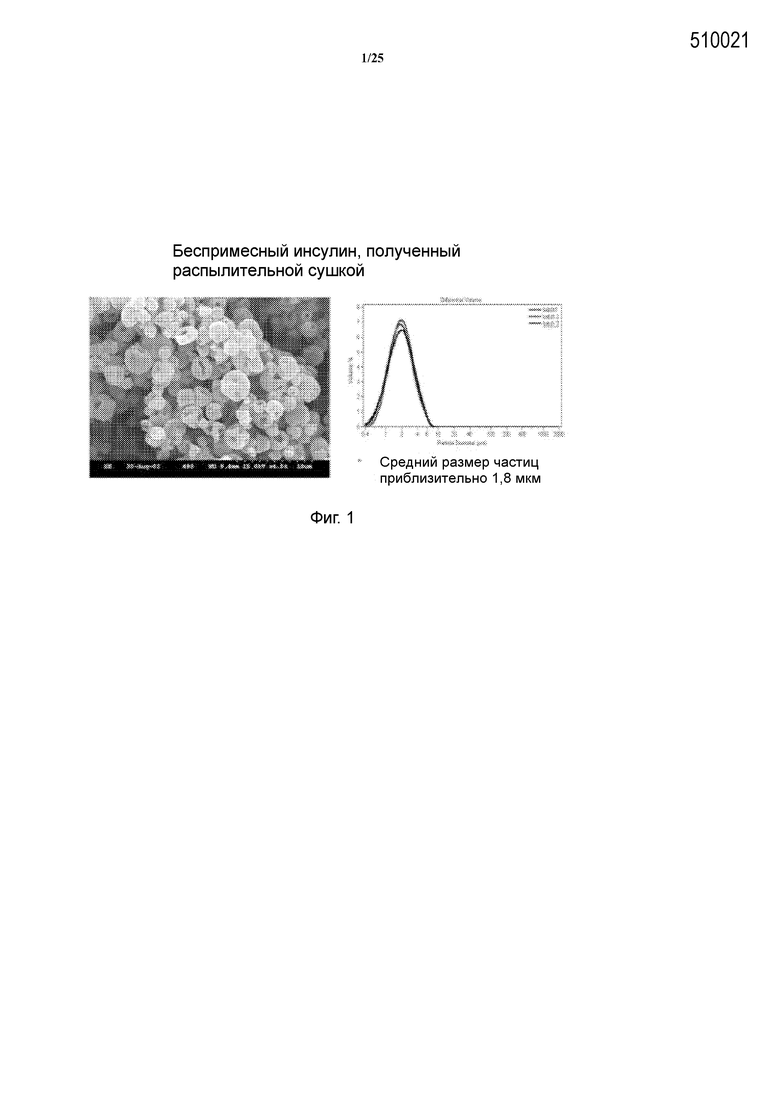










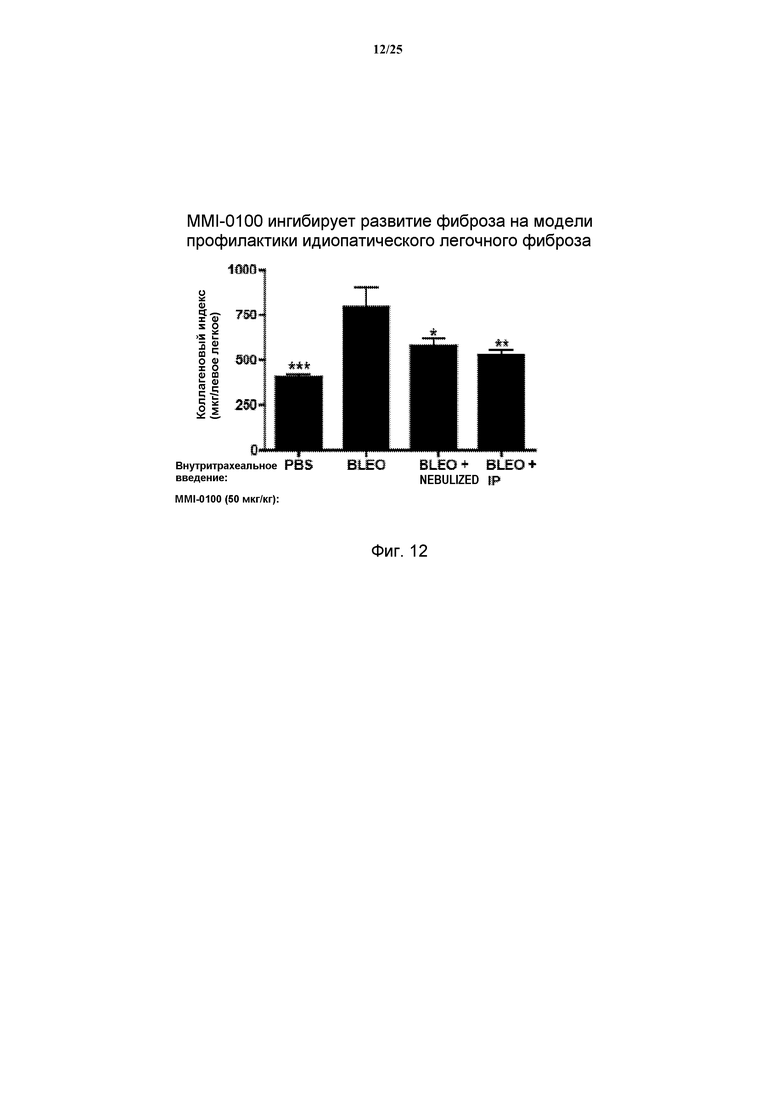




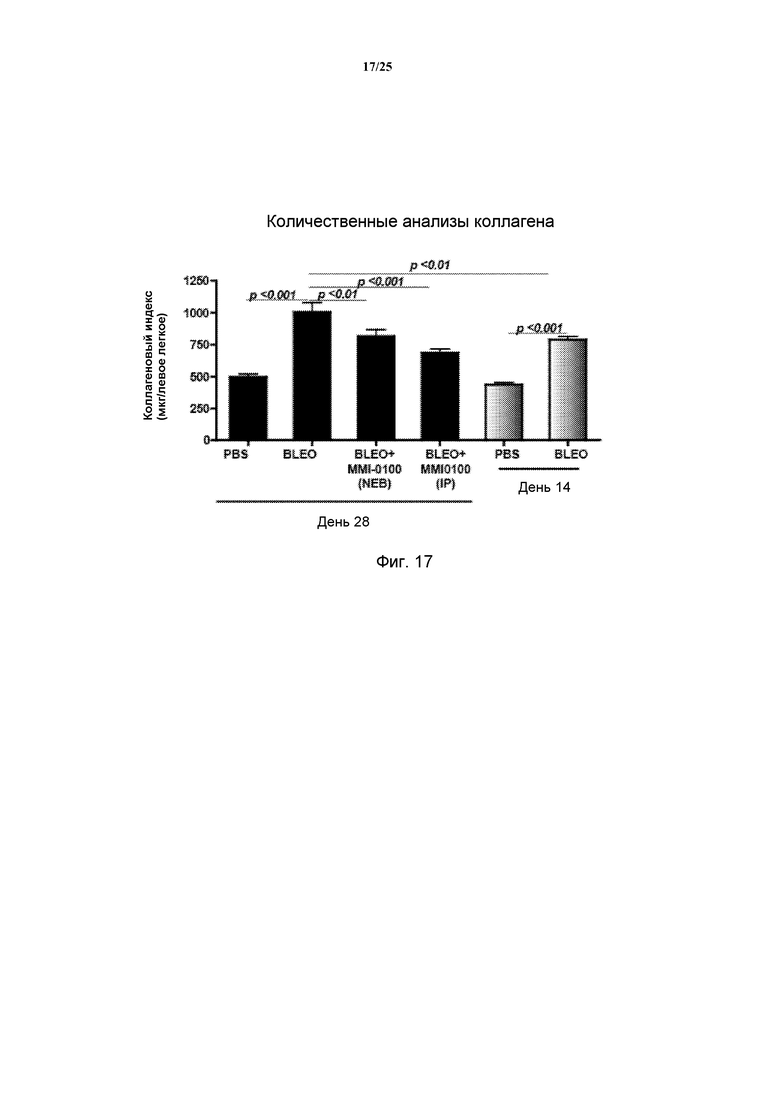

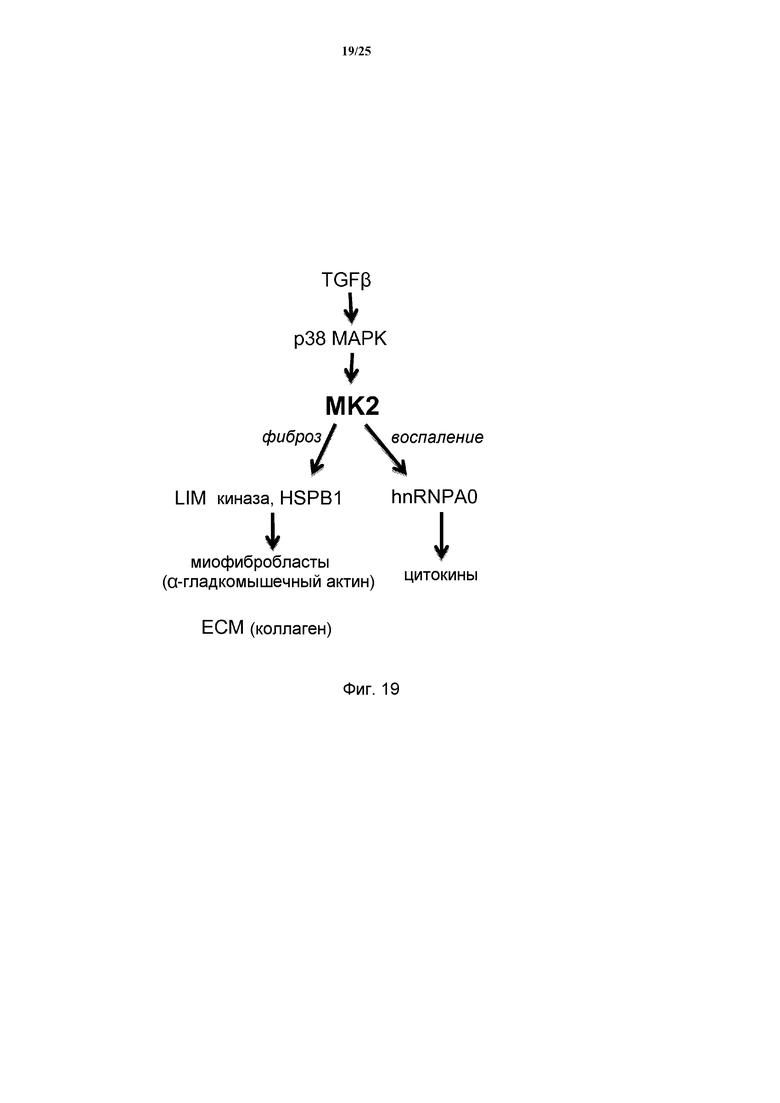
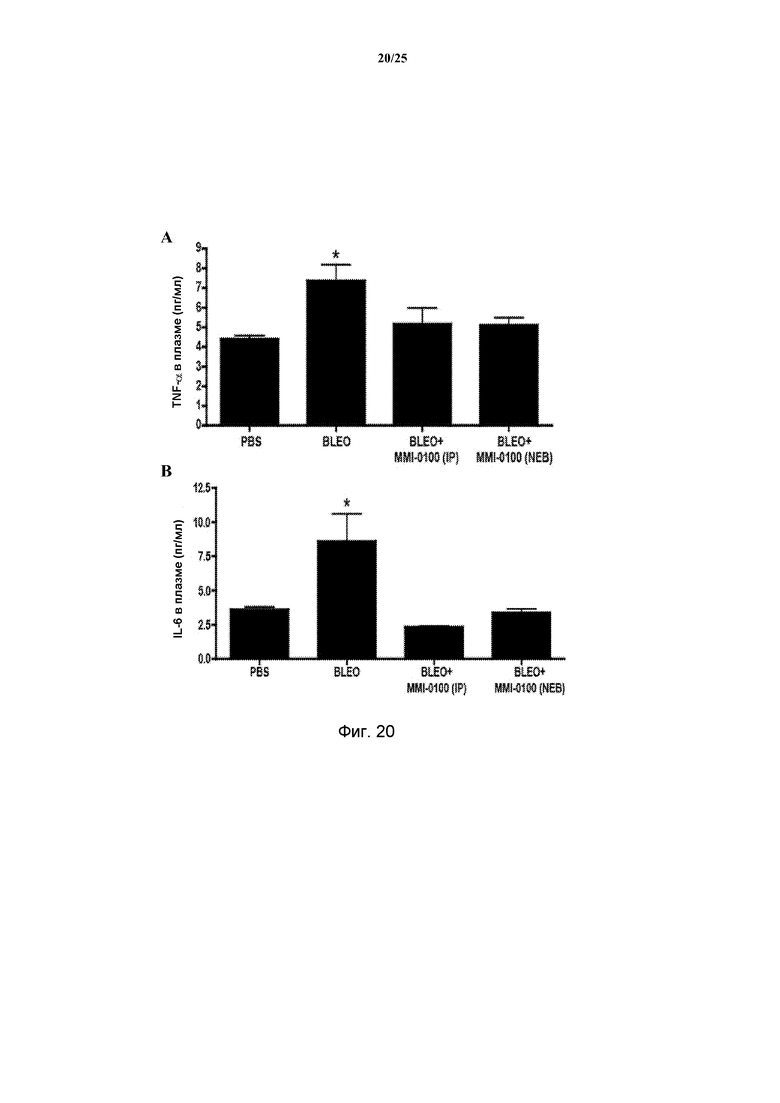

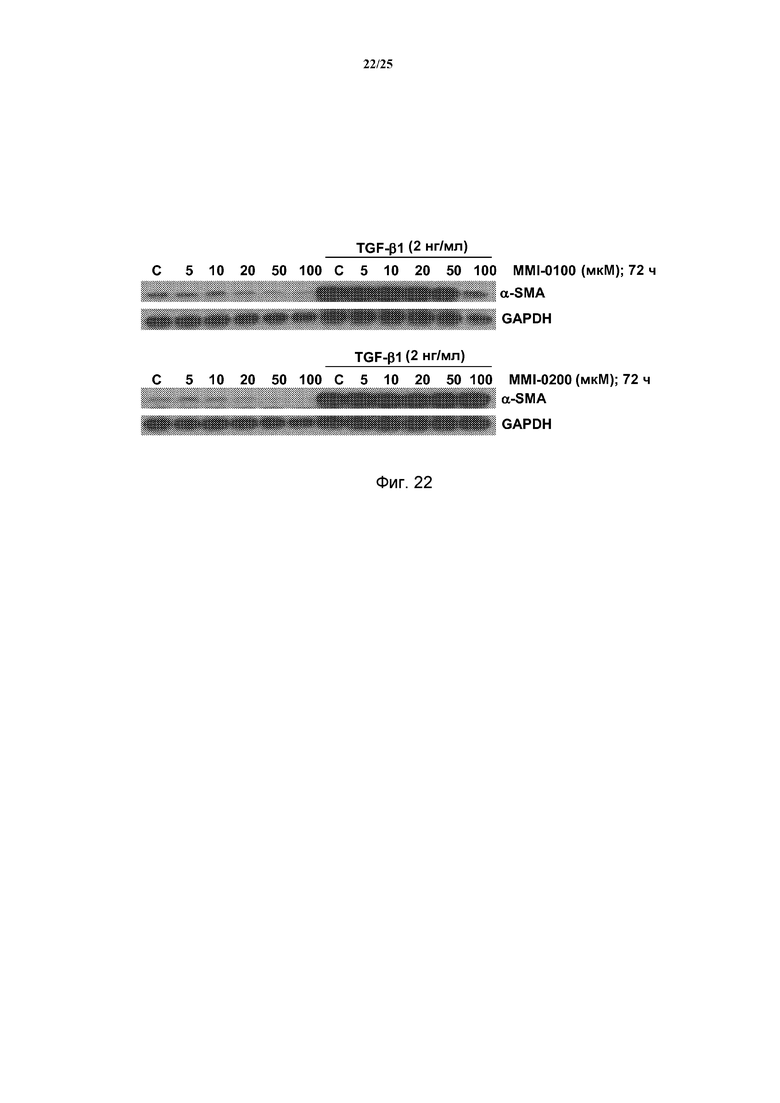
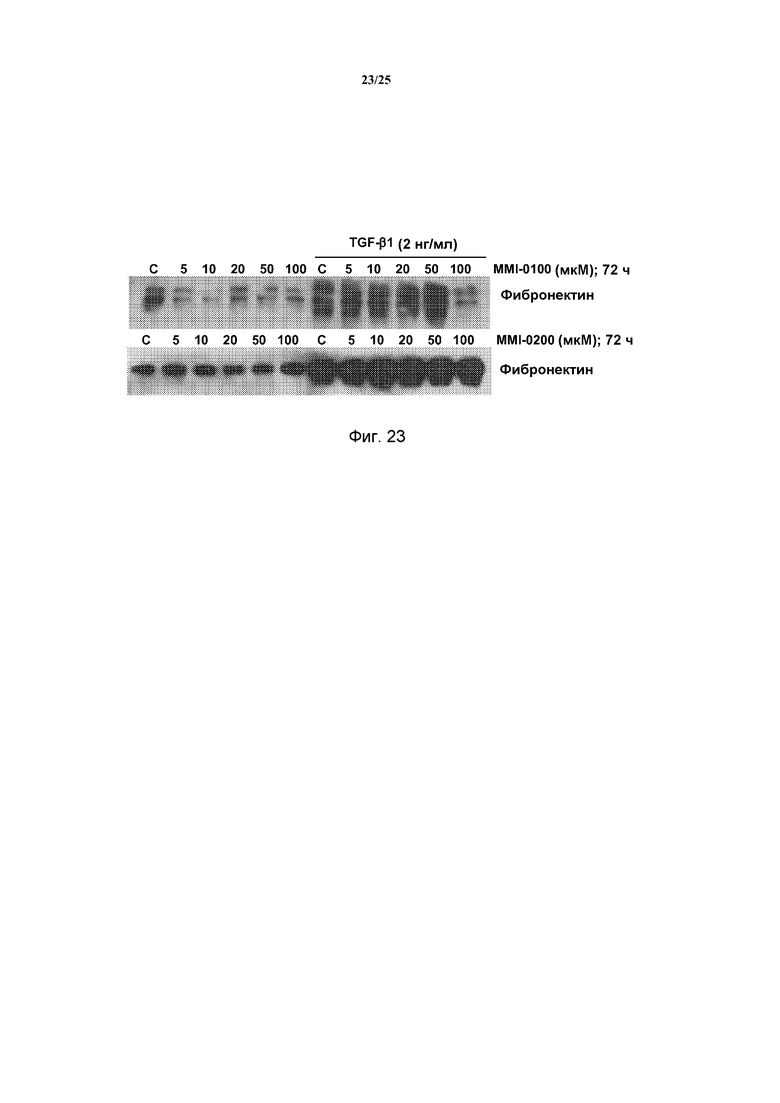
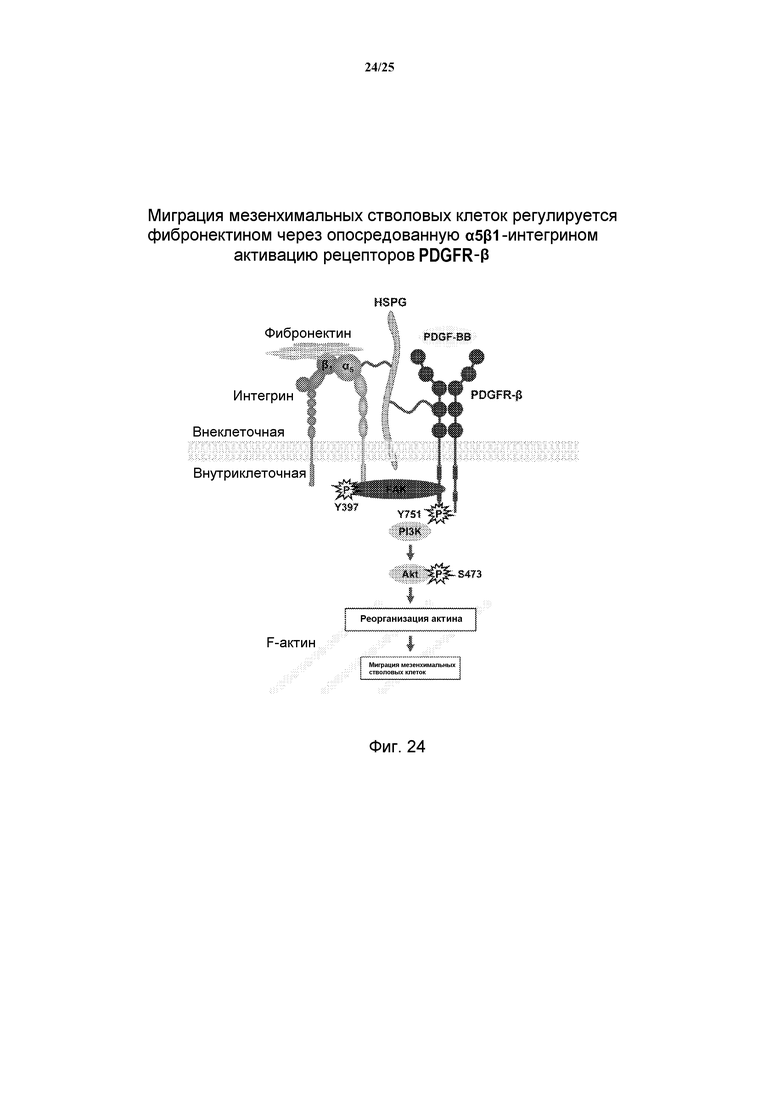
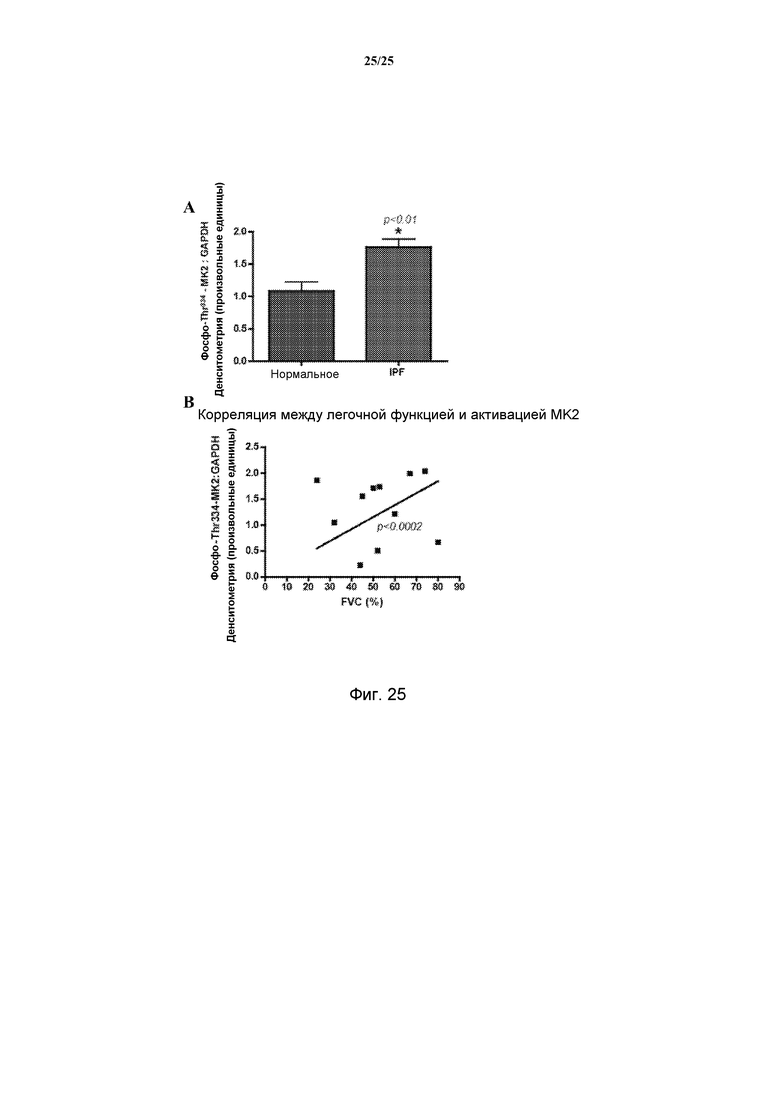
Изобретение относится к области биотехнологии, конкретно к композициям для применения в лечении фиброза легочной ткани, и может быть использовано в медицине. Композиции содержат полученный полипептид, имеющий аминокислотную последовательность YARAAARQARAKALARQLGVAA или его функциональный эквивалент, выбранный из группы FAKLAARLYRKALARQLGVAA, KAFAKLAARLYRKALARQLGVAA и HRRIKAWLKKIKALARQLGVAA. Изобретение позволяет эффективно снижать количество накопленного коллагена в легочной ткани. 2 н. и 54 з.п. ф-лы, 25 ил., 1 табл., 12 пр.
1. Фармацевтическая композиция для применения в лечении заболевания, состояния или патологического процесса, характеризуемого аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в легочной ткани индивида,
где фармацевтическая композиция содержит терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента, выбранного из группы, состоящей из полипептида с аминокислотной последовательностью FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида с аминокислотной последовательностью KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4) и полипептида с аминокислотной последовательностью HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7), и его фармацевтически приемлемый носитель, и
где терапевтическое количество эффективно для уменьшения одного или более из
(i) развития фибротических очагов в легочной ткани;
(ii) накопления коллагена в легочной ткани или
(iii) прогрессирования отложения коллагена по сравнению с контрольным носителем.
2. Фармацевтическая композиция по п. 1, где заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS).
3. Фармацевтическая композиция по п. 1, где заболевание или состояние представляет собой фиброз, вызванный излучением.
4. Фармацевтическая композиция по п. 1, где заболевание или состояние представляет собой интерстициальное легочное заболевание.
5. Фармацевтическая композиция по п. 1, где заболевание или состояние представляет собой легочный фиброз.
6. Фармацевтическая композиция по п. 5, где легочный фиброз представляет собой идиопатический легочный фиброз.
7. Фармацевтическая композиция по п. 5, где легочный фиброз развивается в результате введения блеомицина.
8. Фармацевтическая композиция по п. 5, где легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легких индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации.
9. Фармацевтическая композиция по п. 1, где заболевание или состояние дополнительно характеризуется воспалением в ткани.
10. Фармацевтическая композиция по п. 9, где воспаление представляет собой острое или хроническое воспаление.
11. Фармацевтическая композиция по п. 9, где воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β).
12. Фармацевтическая композиция по п. 1, где аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в легочной ткани характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
13. Фармацевтическая композиция по п. 5, где легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
14. Фармацевтическая композиция по п. 1, где фармацевтическая композиция предназначена для интратрахеального, парентерального, внутривенного или внутрибрюшинного введения.
15. Фармацевтическая композиция по п. 1, где фармацевтическая композиция предназначена для интратрахеального введения.
16. Фармацевтическая композиция по п. 1, где фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство, где
(а) дополнительное терапевтическое средство выбрано из группы, состоящей из очищенного бычьего коллагена V типа, антагониста рецепторов IL-13, ингибитора протеинтирозинкиназы, антагониста эндотелиальных рецепторов, двойного антагониста рецепторов эндотелина, аналога простациклина, моноклонального антитела к CTGF, антагониста рецепторов эндотелина (А-селективного), АВ0024, моноклонального антитела, подобного лизилоксидазе 2 (LOXL2), ингибитора с-Jun-N-концевой киназы (JNK), пирфенидона, IFN-γ1b, пан-нейтрализующего IgG4 человеческого антитела ко всем трем изоформам TGF-β, ингибитора активации TGF-β, рекомбинантного человеческого белка пентраксина-2 (rhPTX-2), биспецифического антитела к IL-4/IL-13, гуманизированного моноклонального антитела, нацеленного на интегрин αvβ6, N-ацетилцистеина, силденафила, антагониста фактора некроза опухолей (TNF) (этанерцепта) и их комбинации;
(b) дополнительное терапевтическое средство представляет собой глюкокортикоид, выбранный из группы, состоящей из преднизона, будезонида, мометазона фуроата, флутиказона пропионата, флутиказона фуроата и их комбинации; или
(c) дополнительное терапевтическое средство представляет собой бронхолитик, выбранный из группы, состоящей из модификатора лейкотриена, антихолинергического бронхолитика, β2-агониста короткого действия и β2-агониста длительного действия и их комбинации; или
(d) дополнительное терапевтическое средство представляет собой анальгетическое средство; или
(e) дополнительное терапевтическое средство представляет собой противоинфекционное средство.
17. Фармацевтическая композиция по п. 1, где функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
18. Фармацевтическая композиция по п. 1, где функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
19. Фармацевтическая композиция по п. 1, где функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
20. Фармацевтическая композиция по п. 1, где носитель выбран из группы, состоящей из носителя контролируемого высвобождения, носителя отсроченного высвобождения, носителя замедленного высвобождения и носителя длительного высвобождения.
21. Фармацевтическая композиция по п. 1, где фармацевтическая композиция представлена в форме сухого порошка.
22. Фармацевтическая композиция по п. 21, где сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) от 1 до 5 мкм.
23. Фармацевтическая композиция по п. 1, где терапевтическое количество фармацевтической композиции вводится через ингаляционное устройство.
24. Фармацевтическая композиция по п. 23, где ингаляционное устройство представляет собой небулайзер.
25. Фармацевтическая композиция по п. 23, где ингаляционное устройство представляет собой дозирующий ингалятор (MDI).
26. Фармацевтическая композиция по п. 23, где ингаляционное устройство представляет собой ингалятор сухого порошка (DPI).
27. Фармацевтическая композиция по п. 23, где ингаляционное устройство представляет собой небулайзер сухого порошка.
28. Применение фармацевтической композиции для изготовления лекарственного средства для лечения заболевания, состояния или патологического процесса, характеризуемого аберрантной пролиферацией фибробластов и отложением внеклеточного матрикса в легочной ткани индивида,
где фармацевтическая композиция содержит терапевтическое количество полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента, выбранного из группы, состоящей из полипептида с аминокислотной последовательностью FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида с аминокислотной последовательностью KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4) и полипептида с аминокислотной последовательностью HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7), и его фармацевтически приемлемый носитель, и
где терапевтическое количество эффективно для уменьшения одного или более из
(i) развития фибротических очагов в легочной ткани;
(ii) накопления коллагена в легочной ткани или
(iii) прогрессирования отложения коллагена по сравнению с контрольным носителем.
29. Применение по п. 28, где заболевание или состояние представляет собой острое повреждение легких (ALI) или острый респираторный дистресс синдром (ARDS).
30. Применение по п. 28, где заболевание или состояние представляет собой фиброз, вызванный излучением.
31. Применение по п. 28, где заболевание или состояние представляет собой интерстициальное легочное заболевание.
32. Применение по п. 28, где заболевание или состояние представляет собой легочный фиброз.
33. Применение по п. 32, где легочный фиброз представляет собой идиопатический легочный фиброз.
34. Применение по п. 32, где легочный фиброз вызван введением блеомицина.
35. Применение по п. 32, где легочный фиброз развивается в результате аллергической реакции, вдыхания веществ в виде частиц, содержащихся в окружающей среде, курения, бактериальной инфекции, вирусной инфекции, механического повреждения легких индивида, отторжения легочного трансплантата, аутоиммунного расстройства, генетического расстройства или их комбинации.
36. Применение по п. 28, где заболевание или состояние дополнительно характеризуется воспалением в ткани.
37. Применение по п. 36, где воспаление представляет собой острое или хроническое воспаление.
38. Применение по п. 36, где воспаление опосредуется по меньшей мере одним цитокином, выбранным из группы, состоящей из фактора некроза опухоли-альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β).
39. Применение по п. 28, где аберрантная пролиферация фибробластов и отложение внеклеточного матрикса в ткани лёгкого характеризуется аберрантной активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой, (MK2), в ткани по сравнению с активностью протеинкиназы 2, активированной митоген-активированной протеинкиназой (MK2), в ткани нормального здорового контрольного индивида.
40. Применение по п. 32, где легочный фиброз характеризуется по меньшей мере одной патологией, выбранной из группы, состоящей из аберрантного отложения белка внеклеточного матрикса в легочном интерстиции, аберрантной стимуляции пролиферации фибробластов в легких, аберрантной индукции дифференциации миофибробластов в легких и аберрантной стимуляции прикрепления миофибробластов к внеклеточному матриксу, по сравнению с нормальным здоровым контрольным индивидом.
41. Применение по п. 28, где фармацевтическая композиция подлежит интратрахеальному, парентеральному, внутривенному или внутрибрюшинному введению.
42. Применение по п. 28, где фармацевтическая композиция подлежит интратрахеальному введению.
43. Применение по п. 28, где фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство, где
(а) дополнительное терапевтическое средство выбрано из очищенного бычьего коллагена V типа, антагониста рецепторов IL-13, ингибитора протеинтирозинкиназы, антагониста эндотелиальных рецепторов, двойного антагониста рецепторов эндотелина, аналога простациклина, моноклонального антитела к CTGF, антагониста рецепторов эндотелина (А-селективного), АВ0024, моноклонального антитела, подобного лизилоксидазе 2 (LOXL2), ингибитора c-Jun-N-концевой киназы (JNK), пирфенидона, IFN-γ1b, пан-нейтрализующего IgG4 человеческого антитела ко всем трем изоформам TGF-β, ингибитора активации TGF-β, рекомбинантного человеческого белка пентраксина-2 (rhPTX-2), биспецифического антитела к IL-4/IL-13, гуманизированного моноклонального антитела, нацеленного на интегрин αvβ6, N-ацетилцистеина, силденафила, антагониста фактора некроза опухолей (TNF) (этанерцепта) и их комбинации;
(b) дополнительное терапевтическое средство представляет собой глюкокортикоид, выбранный из группы, состоящей из преднизона, будезонида, мометазона фуроата, флутиказона пропионата, флутиказона фуроата и их комбинации; или
(c) дополнительное терапевтическое средство представляет собой бронхолитик, выбранный из группы, состоящей из модификатора лейкотриена, антихолинергического бронхолитика, β2-агониста короткого действия и β2-агониста длительного действия и их комбинации; или
(d) дополнительное терапевтическое средство представляет собой анальгетическое средство; или
(e) дополнительное терапевтическое средство представляет собой противоинфекционное средство.
44. Применение по п. 28, где функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
45. Применение по п. 28, где функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
46. Применение п. 28, где функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет аминокислотную последовательность HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
47. Применение п. 28, где носитель выбран из группы, состоящей из носителя контролируемого высвобождения, носителя отсроченного высвобождения, носителя замедленного высвобождения и носителя длительного высвобождения.
48. Применение п. 28, где фармацевтическая композиция представлена в форме сухого порошка.
49. Применение п. 48, где сухой порошок содержит микрочастицы с масс-медианным аэродинамическим диаметром (MMAD) от 1 до 5 мкм.
50. Применение п. 34, где терапевтическое количество фармацевтической композиции вводится через ингаляционное устройство.
51. Применение п. 50, где ингаляционное устройство представляет собой небулайзер.
52. Применение п. 50, где ингаляционное устройство представляет собой дозирующий ингалятор (MDI).
53. Применение п. 50, где ингаляционное устройство представляет собой ингалятор сухого порошка (DPI).
54. Применение п. 50, где ингаляционное устройство представляет собой небулайзер сухого порошка.
| SOUSA A.M., Smooth Muscle α-Actin Expression and Myofibroblast Differentiation by TGFβ are Dependent Upon MK2, J | |||
| Cell Biochem., 2007, v.100, is.6, p.1581-1592 | |||
| LAUREN M.K., Inhibition of Lipopolysaccharide-Stimulated Chronic Obstructive Pulmonary Disease Macrophage Inflammatory Gene Expression by Dexamethasone and the p38 Mitogen-Activated Protein Kinase Inhibitor N-cyano-N-(2-{ [8-(2,6-difluorophenyl)-4- (4-fluoro-2-methylphenyl)-7-oxo-7,8-dihydropyrido[2,3-d] pyrimidin-2-yl]amino} ethyl)guanidine (SB706504), The J | |||
| of pharm | |||
| and exp | |||
| therapeutics, 2009, v.328, is.2, p.458-468 | |||
| КОМПОЗИЦИЯ ДЛЯ ПОТРЕБЛЕНИЯ ЖИВОТНЫМИ И СПОСОБ СНИЖЕНИЯ АКТИВНОСТИ МАР-КИНАЗЫ | 2004 |
|
RU2387281C2 |
| PAKULA A.A | |||
| et al., Genetic analysis of protein stability and function, Ann | |||
| Rev | |||
| Genet., 1989, v.23, p.289-310 | |||
| FRANKEL A.E | |||
| et al., Characterization of diphtheria fusion proteins targeted to the human interleukin-3 receptor, Protein Eng., 2000, v.13, is.8, p.575-581. | |||
Авторы
Даты
2017-05-22—Публикация
2012-04-12—Подача