Настоящее изобретение относится к некоторым производным 1,2-диаминопентана, которые являются антагонистами рецептора CCR-3 и, следовательно, могут применяться для лечения млекопитающих, страдающих от заболеваний, опосредованных рецептором CCR-3. Кроме того, настоящее изобретение относится к лекарственным средствам, содержащим указанные соединения, к их применению, а также к способам получения и промежуточным соединениям, которые используются для их получения.
Тканевая эозинофилия (ацидоцитоз) является признаком ряда патологических состояний, таких как астма, ринит, экзема и паразитарные инфекции (см. Bousquet J. и др., N. Eng. J. Med., 323, 1033-1039 (1990) и Кау А.В. и Corrigan C.J., Br. Med. Bull., 48, 51-64 (1992)). При астме накопление эозинофилов и активация связаны с повреждением бронхиального эпителия и сверхчувствительностью к медиаторам констриктора. Установлено, что хемокины, такие как RANTES, эотаксин и МСР-3, активируют эозинофилы (см. Baggiolini M. и Dahinden C.A., Immunol. Today, 15, 127-133 (1994), Rot A.M. и др., J. Exp. Med., 176, 1489-1495 (1992) и Ponath P.D. и др., J.Clin. Invest., 97, №3, 604-612 (1996)). Однако в отличие от RANTES и МСР-3, которые индуцируют также миграцию других типов лейкоцитов, эотаксин является селективным хемотактическим агентом для эозинофилов (см. Griffith-Johnson D.A. и др., Biochem. Biophys. Res. Commun., 197, 1167 (1993) и Jose P.J. и др., Biochem. Biophys. Res. Commun., 207, 788 (1994)). Специфическое накопление эозинофилов наблюдали в участках введения эотаксина при внутрикожной или внутрибрюшинной инъекции или аэрозольной ингаляции (см. Griffith-Johnson D.A. и др., Biochem. Biophys. Res. Commun., 197, 1167 (1993), Jose P.J. и др., J. Exp. Med, 179, 881-887 (1994), Rothenberg M.E. и др., J. Exp. Med., 181, 1211 (1995) и Ponath P.D. и др., J. Clin. Invest., 97, №3, 604-612 (1996)).
Для лечения многих эозинзависимых заболеваний, включая бронхиальную астму, использовали глюкокортикоиды, такие как дексаметазон, метпреднизолон и гидрокортизон (R.P. Schleimer и др. Am. Rev. Respir. Dis., 141, 559 (1990)). Предполагается, что при таких заболеваниях глюкортикоиды ингибируют выживание эозинофилов, опосредованное IL-5 и IL-3. Однако продолжительное применение глюкокортикоидов может вызвать у пациентов побочные действия, такие как глаукому, остеопороз и замедление роста (см. Hanania N.A. и др., J. Allergy and Clin. Immunol, 96, 571-579 (1995) и Saha M.T. и др., Acta Pediatrica, 86, №2, 138-142 (1997)). Следовательно, существует необходимость в других (альтернативных) средствах для лечения эозинофилзависимых заболеваний, не оказывающих отрицательного побочного действия.
В последнее время рецептор CCR-3 идентифицирован в качестве главного рецептора хемокинов, который используется эозинофилами для ответа на действие эотаксина, RANTES и МСР-3. При трансфекции в клетки линии пре-β-лимфомы мыши рецептор CCR-3 связывает эотаксин, RANTES и МСР-3, вызывая хемотактические ответы в этих клетках на эотаксин, RANTES и МСР-3 (см. Ponath P.D. и др., J. Exp. Med., 183, 2437-2448 (1996)). Рецептор CCR-3, экспрессированный на поверхности эозинофилов, Т-клеток (подвид Th-2), базофилов и тучных клеток, обладает высокой селективностью к эотаксину. Установлено, что предварительная обработка эозинофилов моноклональными антителами против CCR-3 mAb полностью ингибирует хемотаксис эозинофилов к эотаксину, RANTES и МСР-3 (см. Heath H. и др., J. Clin. Invest., 99, №2, 178-184 (1997)).
В патентах US 6140344 и 6166015 и в заявке ЕР 903349, опубликованной 24 марта 1999 г., заявлены антагонисты CCR-3, которые ингибируют накопление эозинофилов под действием хемокинов, таких как эотаксин.
Следовательно, блокирование способности рецептора CCR-3 связывать RANTES, МСР-3 и эотаксина и таким образом предотвращение накопления эозинофилов можно использовать для лечения эозинофилопосредованных воспалительных заболеваний.
Настоящее изобретение относится к новым производным 1,2-диаминоциклопентана, которые способны ингибировать связывание эотаксина с рецептором CCR-3 и благодаря этому могут использоваться для получения средств для лечения заболеваний, индуцированных эозинофилами, таких как астма.
Первым объектом настоящего изобретения является соединение формулы (I)
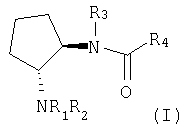
где
R1 означает водород или алкил,
R2 означает арилалкил,
R3 означает водород, алкил, ацил, арил или арилалкил,
R4 означает -W-X-Y-Z,
W отсутствует или означает алкилен,
X отсутствует или означает карбонил, оксигруппу, -S(O)n- или -N(Ra)-,
Y означает арилен или гетероарилен, а
Z означает водород, арил, гетероарил, арилокси, гетероарилокси, арилалкил или гетероарилалкил,
Ra означает водород, алкил, ацил, арил, арилалкил, алкоксикарбонил или бензилоксикарбонил, а
n равно 0, 1 или 2, или его соль.
Кроме того, среди соединений, указанных выше (далее по тексту соединение (I)), предпочтительными являются следующие соединения:
(II) соединение (I), где R1 означает водород или R3 означает водород или метил,
(III) соединение (II), где R1 означает водород,
(IV) соединение (III), где R2 означает фенилалкил, где фенил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из группы, включающей алкил, галоген, циано, нитро, алкокси, галогеналкокси, гидрокси, амино, ациламино, алкиламино и диалкиламино,
(V) соединение (IV), где R2 означает фенилалкил, где фенил замещен одним, двумя или тремя галогенами,
(VI) соединение (V), где R2 означает фенилалкил, где фенил замещен одним галогеном,
(VII) соединение (VI), где R2 означает (4-хлорфенил)алкил,
(VIII) соединение (VII), где R2 означает 2-(4-хлорфенил)этил или 3-(4-хлорфенил)пропил,
(IX) соединение (I), где R3 означает водород или метил,
(X) соединение (IX), где W и Х отсутствуют,
(XI) соединение (X), где Y означает арилен, a Z означает водород,
(XII) соединение (XI), где Y-Z означает 4-метансульфонилфенил,
(XIII) соединение (IX), где W означает алкилен,
(XIV) соединение (XIII), где Х означает карбонил, оксигруппу, -S(O)n- или -N(Ra)-,
(XV) соединение (XIV), где Х означает -S-,
(XVI) соединение (XV), где Y означает гетероарилен,
(XVII) соединение (XVI), где Z означает арил,
(XVIII) соединение (XVII), где Y-Z означает 5-арилпиримидин-2-ил,
(XIX) соединение (IX), где W отсутствует, а Х означает -NH-,
(XX) соединение (XIX), где Y означает арилен, а Z означает водород,
(XXI) соединение (XX), где Y-Z означает 3,4,5-триметоксифенил,
(XXII) соединение (I), где Y-Z означает 4-метансульфонилфенил, 3,4,5-триметоксифенил или 5-(3,4-диметоксифенил)пиримидин-2-ил,
(XXIII) соединение (I), где R4 означает 4-метансульфонилфенил, 3,4,5-триметоксифенил или 5-(3,4-диметоксифенил)пиримидин-2-илтиометил,
(XXIV) соединение (I), где Y-Z означает 5-арилпиримидин-2-ил,
(XXV) соединение (I), которое означает
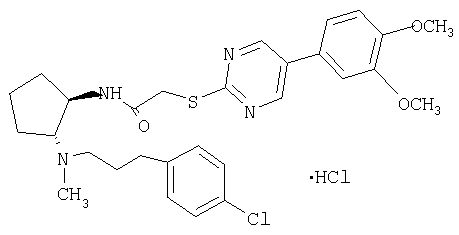
(±)-транс-N-{2-[2-(4-хлорфенил)пропиламино]циклопентил}-2-[5-(3,4-иметоксифенил)пиримидин-2-илсульфанил]ацетамид,
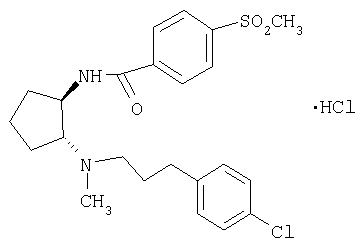
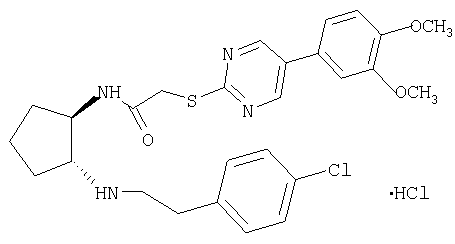
(±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-метансульфонилбензамид,
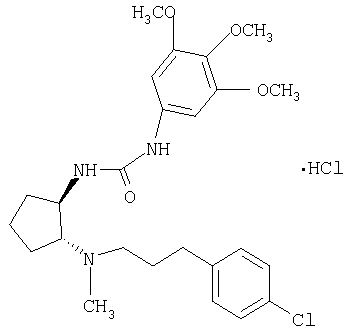
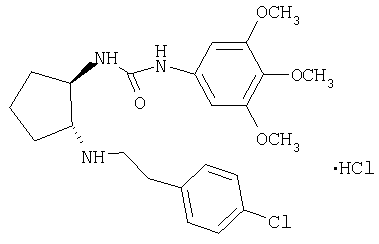
(±)-транс-1-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевина,
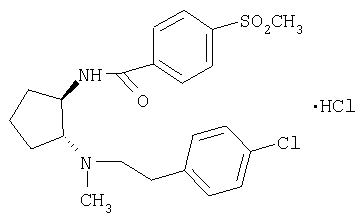
(±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-4-метансульфонилбензамид,
(±)-транс-1-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевина,
(±)-транс-1-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевина,
(±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-4-метансульфонилбензамид,
(±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-4-метансульфонилбензамид,
(±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
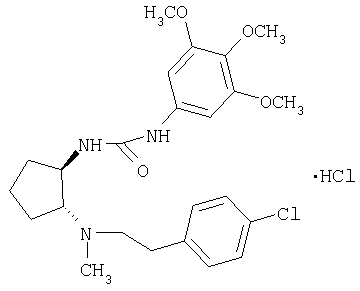
(±)-транс-1-{2-[2-(4-хлорфенил)этиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевина или
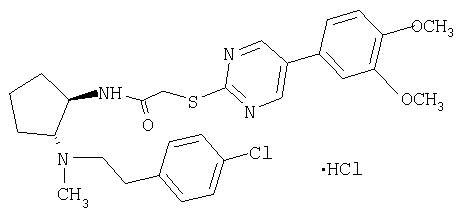
(±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
или его фармацевтически приемлемую соль.
Вторым объектом настоящего изобретения является лекарственное средство, содержащее терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемый эксципиент.
Третьим объектом настоящего изобретения является применение соединения формулы (I) для получения лекарственных средств, включающих одно или более соединений формулы (I), для лечения заболевания, такого как респираторные заболевания, включая астму, излечиваемого антагонистом рецептора CCR-3.
Четвертым объектом настоящего изобретения являются способы получения соединений формулы (I).
Пятым объектом настоящего изобретения являются новые промежуточные соединения, которые применяются для получения соединений формулы (I).
Шестым объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии или диагностике (например, для лечения астмы).
Если не указано иное, термины, используемые в описании заявки, имеют следующие значения.
"Ацил" означает радикал -C(O)R, где R означает водород, алкил, циклоалкил, циклоалкилалкил, фенил или фенилалкил, где алкил, циклоалкил, циклоалкилалкил и фенилалкил имеют значения, указанные в тексте заявки. Типичные примеры включают, без ограничения перечисленным, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, бензилкарбонил.
"Ациламино" означает радикал -NR'C(O)R, где R' означает водород или алкил, а R означает водород, алкил, циклоалкил, циклоалкилалкил, фенил или фенилалкил, где алкил, циклоалкил, циклоалкилалкил и фенилалкил имеют значения, указанные в тексте заявки. Типичные примеры включают, без ограничения перечисленным, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметилкарбониламино, бензоиламино, бензилкарбониламино.
"Алкокси" означает радикал -OR, где R означает алкил, имеющий значения, указанные в тексте заявки, например метокси, этокси, пропокси, бутокси.
"Алкоксикарбонил" означает радикал -C(O)R, где R означает алкокси, имеющий значения, указанные выше.
"Алкенил" означает линейный одновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный одновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, и содержащий по меньшей мере одну двойную связь, например этенил, пропенил.
"Алкил" означает линейный насыщенный одновалентный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или разветвленный одновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например метил, этил, пропил, 2-пропил, н-бутил, изобутил, трет-бутил, пентил.
"Алкиламино" означает радикал -NHR, где R означает алкил, циклоалкил или циклоалкилалкил, имеющие значения, указанные в тексте заявки. Типичные примеры включают, без ограничения перечисленным, диметиламино, метилэтиламино, ди(1-метилэтил)амино, (циклогексил)(метил)амино, (циклогексил)(этил)амино, (циклогексил)(пропил)амино, (циклогексилметил)(метил)амино, (циклогексилметил)(этил)амино.
"Алкилен" означает линейный насыщенный двухвалентный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или разветвленный насыщенный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен, бутилен, пентилен.
"Алкилсульфонил" означает радикал -S(O)2R, где R означает алкил, циклоалкил или циклоалкилалкил, имеющие значения, указанные в тексте заявки, например метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, циклогексилсульфонил.
"Алкилсульфинил" означает радикал -S(O)R, где R означает алкил, циклоалкил или циклоалкилалкил, имеющие значения, указанные в тексте заявки, например метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил, циклогексилсульфинил.
"Алкилтио" означает радикал -SR, где R означает алкил, имеющий значения, указанные выше, например метилтио, этилтио, пропилтио, бутилтио.
"Арил" означает моноциклический или бициклический ароматический углеводородный радикал, содержащий от 6 до 10 атомов углерода в цикле, который необязательно замещен одним или более заместителями, предпочтительно одним, двумя или тремя заместителями, предпочтительно выбранными из группы, включающей алкил, галогеналкил, гидроксиалкил, гетероалкил, ацил, ациламино, амино, алкиламино, диалкиламино, алкилтио, алкилсульфинил, алкилсульфонил, -SO2NR'R'' (где R' и R'' независимо означают водород или алкил), алкокси, галогеналкокси, алкоксикарбонил, карбамоил, гидрокси, галоген, нитро, циано, меркапто, метилендиокси или этилендиокси. Более конкретно термин арил включает, без ограничения перечисленным, фенил, хлорфенил, фторфенил, метоксифенил, 1-нафтил, 2-нафтил и их производные.
"Арилен" означает двухвалентную арильную группу, имеющую значения, указанные выше.
"Арилалкил" означает алкильный радикал, указанный выше, в котором один из атомов водорода заменен на арильную группу. Типичные арилалкильные группы включают, без ограничения перечисленным, бензил, 2-фенилэтан-1-ил, нафтилметил, 2-нафтилэтан-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил.
"Арилокси" означает радикал -O-R, где R означает арил, имеющий значения, указанные выше.
"Карбамоил" означает радикал -C(=O)NH2.
"Циклоалкил" означает насыщенный одновалентный циклический углеводородный радикал, содержащий от 3 до 7 атомов углерода в цикле, например циклопропил, циклобутил, циклогексил, 4-метилциклогексил.
"Циклоалкилалкил" означает радикал -RXRY, где RX означает алкиленовую группу, а RY означает циклоалкильную группу, имеющие значения, указанные выше, например циклогексилметил.
"Диалкиламино" означает радикал -NRR′, где R и R′ независимо означают алкил, циклоалкил или циклоалкилалкил, указанные выше. Типичные примеры включают, без ограничения перечисленным, диметиламино, метилэтиламино, ди(1-метилэтил)амино, (циклогексил)(метил)амино, (циклогексил)(этил)амино, (циклогексил)(пропил)амино, (циклогексилметил)(метил)амино, (циклогексилметил)(этил)амино.
"Галоген" означает фтор, хлор, бром или иод, предпочтительно фтор и хлор.
"Галогеналкил" означает алкил, указанный выше, замещенный одним или более одинаковыми или различными галогенами, например -СН2Cl, -CF3, -СН2CF3, -СН2CCl3.
"Галогеналкокси" означает алкоксигруппу, указанную выше, замещенную одним или более одинаковыми или различными галогенами, например -OCH2Cl, -OCF3, -ОСН2CF3, -ОСН3CCl3.
"Гетероарил" означает моноциклический или бициклический радикал, содержащий от 5 до 12 атомов в цикле и по меньшей мере один ароматический цикл, содержащий один, два или три гетероатома, выбранных из ряда N, О или S, а остальные атомы в цикле означают атомы углерода, причем подразумевается, что свободная связь в гетероарильном радикале находится в ароматическом цикле. Гетероарильный цикл необязательно и независимо замещен одним или более заместителями, предпочтительно одним или двумя заместителями, выбранными из ряда алкил, галогеналкил, гидроксиалкил, гетероалкил, ацил, ациламино, амино, алкиламино, диалкиламино, алкилтио, алкилсульфинил, алкилсульфонил, -SO2NR'R'' (где R' и R'' независимо означают водород или алкил), алкокси, галогеналкокси, алкоксикарбонил, карбамоил, гидрокси, галоген, нитро, циано, меркапто, метилендиокси или этилендиокси. Более конкретно термин гетероарил включает, без ограничения перечисленным, пиридил, фуранил, тиенил, тиазолил, изотиазолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиримидинил, бензофуранил, тетрагидробензофуранил, изобензофуранил, бензотиазолил, бензоизотиазолил, бензотриазолил, индолил, изоиндолил, бензоксазолил, хинолил, тетрагидрохинолинил, изохинолил, бензимидазолил, бензизоксазолил или бензотиенил и их производные.
"Гетероарилен" означает двухвалентную гетероарильную группу, имеющую значения, указанные выше.
"Гетероарилалкил" означает алкильный радикал, указанный выше, в котором один из атомов водорода заменен на гетероарильную группу, указанную выше.
"Гетероарилокси" означает радикал -O-R, где R означает гетероарильную группу, указанную выше.
"Гетероалкил" означает алкильный радикал, указанный выше, содержащий один, два или три заместителя, независимо выбранных из ряда -ORa -NRbRc и -S(O)nRd (где n означает целое число от 0 до 2), причем подразумевается, что свободная связь в гетероалкильном радикале находится у атома углерода гетероалкильного радикала. Ra означает водород, ацил, алкил, циклоалкил или циклоалкилалкил. Rb и Rc независимо друг от друга означают водород, ацил, алкил, циклоалкил или циклоалкилалкил. Rd означает водород (при условии, что n равно 0), алкил, циклоалкил, циклоалкилалкил, амино, ациламино, моноалкиламино или диалкиламино. Типичные примеры включают, например, 2-гидроксиэтил, 2,3-дигидроксипропил, 2-метоксиэтил, бензилоксиметил, 2-метансульфонилэтил.
"Гидроксиалкил" означает алкильный радикал, указанный выше, замещенный одной или более, предпочтительно одной, двумя или тремя гидроксигруппами, при условии, что один углеродный атом замещен только одной гидроксигруппой. Типичные примеры включают, без ограничения перечисленным, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил, предпочтительно 2-гидроксиэтил, 2,3-дигидроксипропил и 1-(гидроксиметил)-2-гидроксиэтил. Соответственно, в описании заявки термин "гидроксиалкил" используется для обозначения подвида гетероалкильных групп. Типичные примеры включают 2-гидроксиэтил, 2,3-дигидроксипропил, 2-метоксиэтил, бензилоксиметил, 2-метансульфонилэтил.
"Уходящая группа" означает группу, которая обычно используется в синтетической органической химии, т.е. означает атом или группу, которая замещается нуклеофилом. Примеры уходящей группы включают галоген (такой, как хлор, бром и иод), алкансульфонилокси, аренсульфонилокси, алкилкарбонилокси (например, ацетокси), арилкарбонилокси, мезилокси, тозилокси, трифторметансульфонилокси, арилокси (например, 2,4-динитрофенокси), метокси, N,O-диметилгидроксиламино.
"Необязательный" или "необязательно" означает, что последующее событие или обстоятельство может произойти, но необязательно произойдет, и что описание включает примеры, когда это событие или обстоятельство происходит, и варианты, когда оно не происходит. Например, "арильная группа необязательно является моно- или дизамещенной алкильной группой" означает, что алкильная группа может присутствовать, но не обязательно присутствует, и что описание включает примеры, когда арильная группа является моно- или дизамещенной алкильной группой, и варианты, когда арильная группа не замещена алкильной группой.
"Фармацевтически приемлемый эксципиент" означает носитель, который используют при получении фармацевтической композиции и который обычно является безвредным, нетоксичным, безопасным в биологическом или ином отношении, и включает носитель, приемлемый как в ветеринарии, так и в фармацевтике. "Фармацевтически приемлемый эксципиент", используемый в описании и пунктах формулы изобретения, включает один или более одного таких носителей.
"Фармацевтически приемлемая соль" соединения означает соль, которая является фармацевтически приемлемой и которая обладает необходимой фармакологической активностью исходного соединения. Такие соли включают:
(1) кислотно-аддитивные соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органических кислот, таких как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-метилбицикло-[2.2.2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтоевая кислота, салициловая кислота, стеариновая кислота, муконовая кислота; или
(2) соли, образующиеся при замене кислотного протона, присутствующего в исходном соединении, на ион металла, например ион щелочного металла, ион щелочноземельного металла, ион алюминия, или при образовании протоном координационного соединения с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин.
"Защитная группа" означает группу атомов, которая в случае присоединения к реакционноспособной группе блокирует ее, снижает ее реакционноспособность или препятствует ее вступлению в реакцию. Примеры защитных групп можно найти в монографиях T.W.Green и P.G.Futs., Protective Groups in Organic Chemistry (J.Wiley, 2 ed.(1991), и Harrison и Harrison и др., Compendium of Synthetic Organic Methods, т.1-8, J.Wiley и Sons (1971-1996). Типичные аминозащитные группы включают формил, ацетил, трифторацетил, бензил, бензилоксикарбонил (CBZ), трет-бутоксикарбонил (ВОС), триметилсилил (TMS), 2-триметилсилилэтансульфонил (SES), тритил и замещенные тритильные группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил (FMOC), нитровератрилоксикарбонил (NVOC). Типичные гидроксизащитные группы включают ацилированные или алкилированные гидроксигруппы, такие как бензильные или тритильные простые эфиры или алкильные простые эфиры, тетрагидропиранильные простые эфиры, триалкилсилильные и аллильные простые эфиры.
"Терапия" или "лечение" заболевания включает: (1) профилактику заболевания, т.е. подавление клинических симптомов заболевания у млекопитающего, которое подвержено или предрасположено к заболеванию, но у которого не обнаруживаются или не проявляются симптомы заболевания; (2) подавление заболевания, т.е. остановку или подавление развития заболевания или его клинических симптомов и (3) ослабление интенсивности заболевания, например стимуляцию регрессии заболевания или его клинических симптомов.
"Терапевтически эффективное количество" означает количество соединения, которое при введении млекопитающему для лечения заболевания является достаточным, чтобы обеспечить такое лечение заболевания. Терапевтически эффективное количество изменяется в зависимости от типа соединения, типа и тяжести заболевания, возраста, массы и т.п. млекопитающего, подлежащего лечению.
Соединения, которые имеют одинаковую молекулярную формулу, но отличаются природой или последовательностью химических связей или пространственным расположением атомов называются "изомерами". Изомеры, которые различаются пространственным расположением атомов, называются "стереоизомерами". Стереоизомеры, которые не являются зеркальными изображениями, называются "диастереомерами", а стереоизомеры, которые являются несовместимыми зеркальными изображениями друг друга, называются "энантиомерами". Если в соединении имеется асимметрический центр, например если атом углерода связан с четырьмя различными группами, возможно образование пары энантиомеров. Энантиомер можно охарактеризовать абсолютной конфигурацией асимметричесого центра, например R- или S-конфигурацией, которая определяется по правилу Кана и Прелога, или по направлению вращения плоскости поляризованного света как право- или левовращающий изомеры (т.е. как (+) или (-)-изомер, соответственно). Хиральные соединения могут существовать в виде индивидуального энантиомера или в виде смеси энантиомеров. Смесь, содержащая равные количества каждого энантиомера, называется рацемической смесью.
Соединения по настоящему изобретению могут включать один или более асимметрических центров, следовательно, такие соединения можно получать в виде индивидуальных (R)- или (S)-стереоизомеров или в виде их смесей. Если не указано иное, предполагается, что описание или наименование конкретного соединения в описании заявки и пунктах формулы изобретения включает как индивидуальные стереоизомеры, так и их рацемические и иные смеси. Способы определения стереохимии и разделения стереоизомеров известны в данной области техники (см. Advanced Organic Chemistry, 4th edition J.March, John Wiley и Sons, New York, гл.4 (1992).
Номенклатура, используемая в описании, основана на рекомендациях IUPAC. Например, соединение формулы (I), где R1 означает водород, R2 означает 2-(4-хлорфенил)этил, R3 означает водород, a R4 означает 4-метилсульфонилфенил, называется (±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-4-метансульфонилбензамид.
Типичные соединения формулы (I) приводятся в таблице 1.
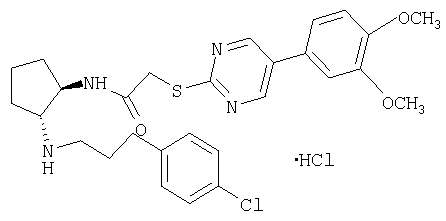
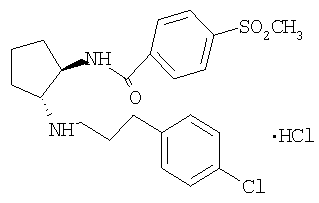

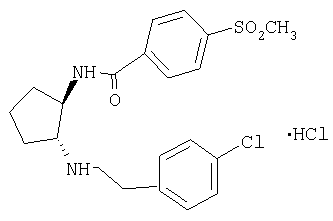
В то время, как наиболее широкое определение соединений по настоящему изобретению приведено выше, некоторые соединения формулы (I) являются предпочтительными.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R1 означает водород или метил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает фенилалкил, где фенил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из группы, включающей алкил, галоген, циано, нитро, алкокси, галогеналкокси, гидрокси, амино, ациламино, алкиламино и диалкиламино.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает фенилалкил, где фенил замещен одним, двумя или тремя заместителями, независимо выбранными из группы, включающей алкил, галоген, циано, нитро, алкокси, галогеналкокси, гидрокси, амино, ациламино, алкиламино и диалкиламино.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает фенилалкил, где фенил замещен одним, двумя или тремя галогенами.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает фенилалкил, где фенил замещен одним или двумя галогенами.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает фенилалкил, где фенил замещен одним галогеном.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает (4-хлорфенил)алкил.
Более предпочтительным соединением по изобретению является соединение формулы (I), в котором R2 означает 2-(4-хлорфенил)этил или 3-(4-хлорфенил)пропил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R3 означает водород или метил, предпочтительно водород.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R3 означает алкил, ацил, арил или арилалкил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором W отсутствует.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором W означает алкилен.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Х отсутствует.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Х означает карбонил (-С(=O)-), окси(-O-), -S(O)n- или -N(Ra)-.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Х означает тио.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Y означает арил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Y означает гетероарил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором -Y-Z- означает 4-метилсульфонилфенил или 3,4,5-триметоксифенил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором R4 означает 4-метилсульфонилфенил, 3,4,5-триметоксифениламино или 5-(3,4-диметоксифенил)пиримидин-2-илтиометил.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Z означает водород.
Предпочтительным соединением по изобретению является соединение формулы (I), в котором Z означает арил, гетероарил, арилокси, гетероарилокси или арилалкил или гетероарилалкилен.
Прежде всего предпочтительным соединением по изобретению является
(±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-метансульфонилбензамид,
(±)-транс-1-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевина,
(±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-4-метансульфонилбензамид,
(±)-транс-1-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевина,
(±)-транс-1-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевина,
(±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-4-метансульфонилбензамид,
(±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-4-метансульфонилбензамид,
(±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-1-{2-[2-(4-хлорфенил)этиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевина или
(±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
или его фармацевтически приемлемая соль.
Соединения по настоящему изобретению можно получить различными способами, известными специалисту в данной области. Предпочтительные способы включают, без ограничения перечисленным, общие методы синтеза, описанные ниже.
Исходные материалы и реагенты, которые используются при получении указанных соединений, являются коммерческими препаратами, поставляемыми фирмами Aldrich Chemical Co. (Milwaukee, Wis., США), Bachem (Torrance, Calif., США), Enika-Chemie или Sigma (St. Louis, Mo., США), Maybridge (Dist: Ryan Scientific, P.O.Rox 6496, Columbia, S.C. 92960), Bionet Research Ltd. (Cornwall PL32 9QZ, UK), Menai Organics Ltd. (Gwynedd, N. Wales, UK), Butt Park Ltd. (Dist. Interchim, Montlucon Cedex, Франция), или их можно получить методами, известными специалисту в данной области, по методикам, описаным в литературе, такой как Fiser и Fiser's Reagents for Organic Synthesis, т.т.1-17 (John Wiley and Sons) (1991); Rodd's Chemistry of Carbon Compounds, т.т.1-5 and Supplements (Elsevier Science Publishers) (1989); Organic Reactions, т.т.1-40 (John Wiley and Sons) (1991); March's Advanced Organic Chemistry (John Wiley and Sons) (1992) и Larock's Comprehensive Organic Transformations (VCH Publishers Inc.) (1989). Следующие схемы реакций лишь иллюстрируют некоторые методы синтеза соединений по настоящему изобретению, а различные модификации этих схем реакций могут быть разработаны и предложены специалистом в данной области со ссылкой на материалы настоящей заявки.
Исходные материалы и промежуточные соединения в указанных схемах реакций можно получить и при необходимости очистить соответствующими способами, включая, без ограничения перечисленным, фильтрование, перегонку, кристаллизацию, хроматографию и т.п. Такие материалы можно охарактеризовать соответствующими методами, включая физические константы и спектральные данные.
В общем случае соединения формулы (I), в которых R1 означает Н, a R2 означает 2-(4-хлорфенил)этил или 3-(4-хлорфенил) пропил, получают, как показано на следующей схеме.
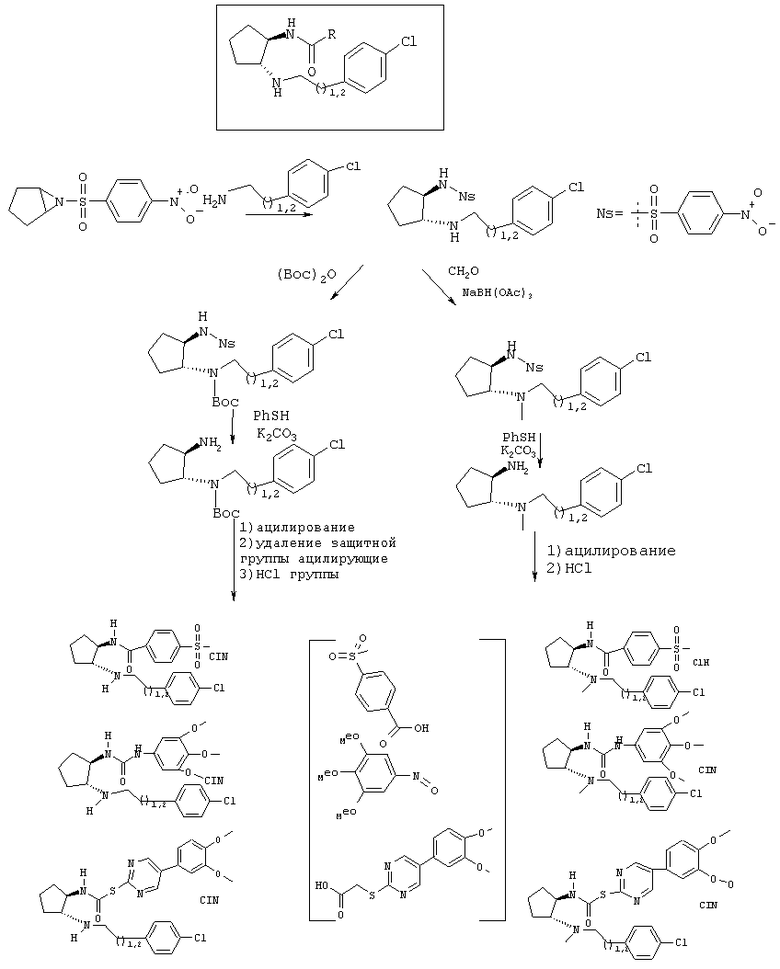
Таким образом, изобретение также относится к способу получения соединения формулы (I), в котором R1 означает водород, причем способ включает удаление защитной группы в соответствующем соединении формулы (III)
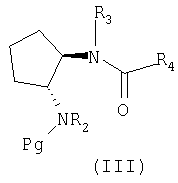
где Pg означает защитную группу по атому азота.
Изобретение также относится к способу получения соединения формулы (I), в котором R1 означает алкил, причем способ включает ацилирование соответствующего соединения формулы (V)

требуемым производным карбоновой кислоты, R-C(=O)-L, где L означает уходящую группу. Производные карбоновой кислоты, которые можно использовать в способе по изобретению, включают карбоновую кислоту, активированные производные карбоновой кислоты (например, хлор- и бромангидриды или ангидриды карбоновой кислоты). Пригодные условия и реагенты для ацилирования аминов известны в данной области. Например, см. Advanced Organic Chemistry, Reactions, Mechanisms and Structure, Jerry March, 4th ed., John Wiley and Sons, New York (1992).
Изобретение также относится к способу получения соединения формулы (III)

в котором Pg означает защитную группу по атому азота, R2 означает арилалкил, R3 означает водород, алкил, ацил, арил или арилалкил, R4 означает -W-X-Y-Z, W отсутствует или означает алкилен, Х отсутствует, или означает карбонил, окси, -S(O)n- или -N(Ra)-, Y означает арилен или гетероарилен, Z означает 5 водород, арил, гетероарил, арилокси, гетероарилокси, арилалкил или гетероарилалкилен, Ra означает водород, алкил, ацил, арил, арилалкил, алкоксикарбонил или бензилоксикарбонил, причем способ включает ацилирование соответствующего соединения формулы (IV)

требуемым производным карбоновой кислоты, R-C(=O)-L, где L означает уходящую группу.
Промежуточным соединением, которое прежде всего используется для получения соединения формулы (I), является соединение формулы (II)
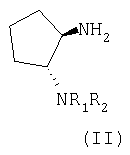
где R1 и R2 имеют любое или предпочтительное значение, указанное в тексте заявки.
Другим промежуточным соединением, которое прежде всего используется для получения соединения формулы (I), является соединение формулы (III)
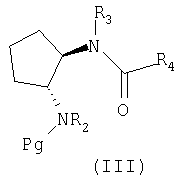
где R2-R4 имеют любое или предпочтительное значение, указанное в тексте заявки, а Pg означает защитную группу по атому азота (например, третбутоксикарбонил).
Еще одним промежуточным соединением, которое прежде всего используется для получения соединения формулы (I), является соединение формулы (IV)

где R2 и R3 имеют любое или предпочтительное значение, указанное в тексте заявки, a Pg означает защитную группу по атому азота (например, третбутоксикарбонил).
Еще одним промежуточным соединением, которое прежде всего используется для получения соединения формулы (I), является соединение формулы (V)

где R2 и R3 имеют любое или предпочтительное значение, указанное в тексте заявки, a R1 означает алкил.
Примечание
Если не указано иное, все реакции в неводных растворителях проводят в атмосфере азота, а для обезвоживания всех органических растворителей используют Na2SO4. Для очистки полученных соединений обычно используют экспресс-хроматографию на силикагеле (230-400 меш) или препаративную ТСХ на пластинках Uniplate Silica Gel GF PLC (20×20 см, 1000 мкм) (фирма Analtech, Inc., Newark, DE). Кроме того, используют также основный оксид алюминия, содержащий 6 мас.% воды (Brockmann III). Величины температуры плавления, которую определяли при плавлении в капиллярах, приводятся без поправки. ИК-спекты определяли с использованием таблеток KBr. Если не указано иное, спектры ЯМР снимали при растворении образцов в CDCl3. Спектры 1Н ЯМР снимали при 300 МГц, а спектры 13С ЯМР снимали при 75,5 МГц. Масс-спектры снимали с использованием ионизации электрораспылением. Аналитическую обращенно-фазовую ЖХВР проводили с использованием системы фирмы Shimadzu, снабженной спектрометром с диодной матрицей (диапазон 190-300 нм, фирма Hewlett Packard). В колонке для высокого разрешения (4,6×50 мм, фирма Hewlett Packard) в качестве неподвижной фазы использовали Zorbax SB-Phenyl, в качестве подвижной фазы А использовали 0,1% раствор трифторуксуной кислоты, а в качестве фазы Б использовали СН3CN. Элюирование проводили со скоростью 2,5 мл/мин в линейном градиенте А-Б (от 20% до 55%, а затем от 55% до 20%) в течение 5 мин.
Соединения по изобретению являются антагонистами рецептора CCR-3 и ингибируют накопление эозинофилов при действии на CCR-3 хемокинов, таких как RANTES, эотаксин, МСР-2, МСР-3 и МСР-4. Соединения по настоящему изобретению и содержащие их композиции применяются для лечения заболеваний, индуцированных эозинофилами, таких как воспалительные процессы или аллергические заболевания, включая респираторные аллергические заболевания такие, как астма, аллергический ринит, аллергическое заболевание легких, аллергический пневмонит, эозинофльная пневмония (например, хроническая эозинофильная пневмония), воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), псориаз и воспалительные дерматозы, такие как дерматит и экзема.
Антагонистическую активность (в отношении рецептора CCR-3) соединений по настоящему изобретению определяют анализом in vitro, например, с использованием связывания лиганда и измерения хемотаксиса, как подробно описано в примерах 14, 15 и 16. Активность in vivo можно определить на модели животных (мыши Balb/c) по воздействию на астму, индуцированную овальбумином, как подробно описано в примере 17.
В общем случае соединения по настоящему изобретению вводят в терапевтически эффективном количестве любыми приемлемыми способами введения, принятыми для агентов аналогичного назначения. Фактическое количество соединения по настоящему изобретению, т.е. активного ингредиента, зависит от множества факторов, таких как тяжесть излечиваемого заболевания, возраст и относительное состояние здоровья субъекта, активность используемого соединения, способ и форма введения и другие факторы.
Терапевтически эффективные количества соединений формулы (I) составляют приблизительно 0,01-20 мг на кг массы тела пациента в сутки, предпочтительно приблизительно 0,1-10 мг/кг/сут. Таким образом, при введении пациенту массой 70 кг доза предпочтительно составляет приблизительно от 7 мл до 0,7 г в сутки.
В общем случае соединения по настоящему изобретению вводят в виде фармацевтических композиций одним из следующих способов: пероральным способом, ингаляцией (например, интраназальной или пероральной ингаляцией) или парентеральным способом (например, внутримышечным, внутривенным или подкожным способом). Предпочтительным способом введения является пероральный при соответствующей суточной схеме приема лекарственного средства, которая назначается в соответствии с тяжестью заболевания.
Композиции могут иметь форму таблеток, пилюль, капсул, полутвердых капсул, порошков, составов для замедленного высвобождения, растворов, суспензий, липосом, эликсиров или любых других пригодных композиций. Другим предпочтительным способом введения соединений по настоящему изобретению является ингаляция. Ингаляция является эффективным способом доставки терапевтического агента непосредственно в дыхательные пути при лечении заболеваний, таких как астма и другие аналогичные заболевания дыхательных путей (см. US 5607915).
Выбор состава зависит от ряда факторов, таких как способ введения и биодоступность лекарственного средства. Для доставки ингаляцией соединение получают в виде растворов или суспензий, аэрозоля с газом-вытеснителем или сухого порошка и помещают в соответствующее дозирующее устройство. Существует три типа фармацевтических дозаторов для ингаляции: пульверизаторы, дозирующие ингаляторы (MDI) и ингаляторы для введения порошка (распылители) (DPI). Пульверизаторы генерируют выброс воздуха с высокой скоростью, который распыляет терапевтические агенты (находящиеся в жидком состоянии) в виде тумана, попадающего в дыхательные пути пациента. В дозирующих ингаляторах (MDI) составы находятся в контакте с сжатым газом. После запуска ингалятор выпускает отмеренное количество терапевтического агента под давлением сжатого газа, что является надежным методом введения заданного количества агента. Распылитель (DPI) позволяет вводить терапевтический агент в форме свободно текущего порошка, который вдувается в поток воздуха во время вдоха. Свободно текущие порошки получают смешиванием терапевтического агента с эксципиентом, таким как лактоза. Отмеренное количество лекарственного средства находится в капсуле и вводится пациенту при каждом запуске ингалятора. В последнее время получены фармацевтические составы прежде всего для лекарственных средств с низкой биодоступностью. Биодоступность лекарственного средства повышают за счет увеличения поверхности частиц агента, т.е. уменьшения размеров частиц. Например, в US 4107288 описан фармацевтический состав с размерами частиц от 10 до 1000 нм, в которых активный материал нанесен на сшитую полимерную матрицу. В US 5145684 описано получение фармацевтического состава, в котором лекарственное средство измельчено до наночастиц (среднего размера 400 нм) в присутствии модификатора поверхности, а затем диспергировано в жидкой среде с образованием фармацевтического состава, который обладает существенно более высокой биодоступностью.
Композиции обычно представляют собой комбинацию соединения формулы (I) по меньшей мере с одним фармацевтически пригодным эксципиентом. Пригодные эксципиенты являются нетоксичными, способствуют введению и не оказывают отрицательного воздействия на лечебные свойства соединения формулы (I). Такие эксципиенты могут быть твердыми, жидкими, полутвердыми или в случае аэрозольной композиции газообразными наполнителями, которые обычно известны специалисту в данной области техники.
Твердые фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, сухое снятое молоко и т.п. Жидкие и полужидкие эксципиенты выбирают из ряда глицерин, пропиленгликоль, вода, этанол и различные масла, включая минеральное масло, масла животного и растительного происхождения или синтетические масла, например арахисовое масло, соевое масло, вазелиновое масло, кунжутное масло и т.п. Предпочтительные жидкие носители, прежде всего для инъекционных растворов, включает воду, солевой раствор, водный раствор декстрозы и гликоли.
Для распыления соединений по настоящему времени в форме аэрозоля можно использовать сжатые газы. Пригодными для этого инертными газами являются азот, диоксид углерода и т.п.
При получении липосомных составов лекарственного средства для парентеральной или пероральной доставки лекарственное средство и липиды растворяют в соответствующем органическом растворителе, например трет-бутаноле, циклогексане (+1% этанола). Раствор высушивают лиофильно и смесь липидов суспендируют в водном буферном растворе с образованием липосом. При необходимости более мелкие липомосомы получают при обработке ультразвуком (см. Frank Szoka Jr. и Demetrios Papahadjopoulos, Comparative Properties and Methods of Preparation of Lipid Vesicles (Liposomes), Ann. Rev. Biophys. Bioeng., 9, 467-508 (1980), и D.D.Lasic, Novel Applications of Liposomes, Trends in Biotech., 16, 467-608 (1998).
Прочие фармацевтически приемлемые носители и их составы описаны в книге Remington's Pharmaceutical Sciences, ed. by E.W.Martin, Mack Publishing Company, 18th ed.(1990).
Содержание соединения в составе может изменяться в полном диапазоне, используемом в данной области техники. Обычно состав содержит приблизительно 0,01-99,99 мас.% соединения формулы (I) от массы состава в смеси с одним или более фармацевтически приемлемыми эксципиентами. Предпочтительно соединение содержится на уровне приблизительно 1-80 мас.%. Типичные фармацевтические составы, содержащие соединения формулы (I), описаны в примере 13.
Примеры
Примеры синтеза
Общая методика А (образование мочевины с использованием изоцианатов)
0,1-0,6 М раствор амина (1 экв.) в СН2Cl2 или СН2Cl2 и ДМФА при 0-20°С обрабатывали соответствующим изоцианатом (1,1-2 экв.), перемешивали в течение 0,5-1,5 ч и распределяли между CH2Cl2 и насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты сушили и концентрировали. Неочищенную мочевину очищали хроматографией на колонке или препаративной ТСХ или использовали на следующей стадии без дополнительной очистки.
Общая методика Б (получение мочевины с использованием изоцианатов и с последующим образованием гидрохлорида)
0,1-0,6 М раствор амина (1 экв.) в CH2Cl2 или CH2Cl2 и ДМФА при 0-20°С обрабатывали соответствующим изоцианатом (1,1-2 экв.), перемешивали в течение 0,5-1,5 ч и распределяли между СН2Cl2 и насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты сушили и концентрировали. Неочищенную мочевину очищали хроматографией на колонке или препаративной ТСХ или использовали на следующей стадии без дополнительной очистки. Раствор свободного основания в CH2Cl2 обрабатывали 1 н. HCl в Et2O и концентрировали, при этом получали гидрохлорид мочевины.
Общая методика В (образование амида с использованием 1-10 гидроксибензотриазола и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида)
0,1-0,4 М раствор амина (1 экв.) и соответствующей карбоновой кислоты (1,2-1,5 экв.) в CH2Cl2 при 0°С последовательно обрабатывали гидратом 1-гидроксибензотриазола (HOBt) (0,2-0,5 экв.) и гидрохлоридом 1-[3-15 (диметиламино)пропил]-3-этилкарбодиимида (ДЕС) (1,3-2 экв.), перемешивали при 0-20°С в течение 2-72 ч и распределяли между CH2Cl2 и насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты сушили и концентрировали. Неочищенный амид очищали хроматографией на колонке и/или препаративной ТСХ.
Общая методика Г (образование амида с использованием 1-гидроксибензотриазола и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида с последующим образованием гидрохлорида)
0,1-0,4 М раствор амина (1 экв.) и соответствующей карбоновой кислоты (1,2-1,5 экв.) в CH2Cl2 при 0°С последовательно обрабатывали гидратом 1-гидроксибензотриазола (HOBt) (0,2-0,5 экв.) и гидрохлоридом 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (ДЕС) (1,3-2 экв.), перемешивали при 0-20°С в течение 2-72 ч и распределяли между CH2Cl2, насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты сушили и концентрировали. Неочищенный амид очищали хроматографией на колонке и/или препаративной ТСХ. Раствор свободного основания в CH2Cl2 обрабатывали 1 н. HCl в Et2O и концентрировали, при этом получали гидрохлорид мочевины.
Пример 1
Гидрохлорид (±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил)-2-[5-(3,4-диметоксифенил) пиримидин-2-илсульфанил]ацетамида
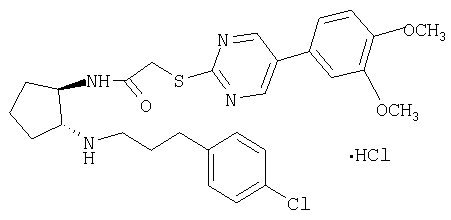
Раствор трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил(2-{2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетиоамино}циклопентилкарбаминовой кислоты (185 мг, чистота 80%, ˜0,23 ммоля) в смеси 10% HCl/MeOH (30 мл) перемешивали при комнатной температуре в течение ночи. МеОН упаривали, остаток распределяли между СН2Cl2 и насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты промывали солевым раствором, сушили и концентрировали. Остаток очищали препаративной ТСХ (элюент: CH2Cl2/MeOH/NH4OH, 10:0,95:0,05), при этом получали свободное основание (98 мг, 0,18 ммоля) в виде бесцветного масла. Раствор свободного основания в СН2Cl2 обрабатывали 1 н. HCl в Et2O (0,3 мл, 0,3 ммоля) и концентрировали, при этом получали продукт (104 мг, 67% в расчете на трет-бутиловый эфир (±)-транс-(2-аминоцинклопентил)-[3-(4-хлорфенил)пропил]карбаминовой кислоты) в виде твердого вещества желтого цвета. tпл. 95,3-111,3°С. МС: m/z 541 (М+1)+.
Промежуточное соединение трет-бутиловый эфир (±)-транс-[3-(4-хлорфенил)пропил](2-{2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетиламино}циклопентил)карбаминовой кислоты получали как описано ниже.
Стадия А
Получение 6-(4-нитробензолсульфонил)-6-азабицикло[3.1.0]гексана
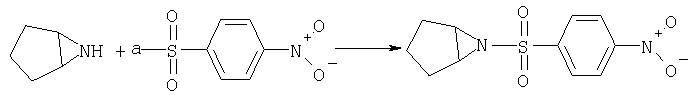
К раствору 4-нитробензолсульфонилхлорида (10,2 г, 46,0 ммоля) в CH2Cl2 (15 мл) при -20°С в течение 20 мин добавляли по каплям раствор 6-азабицикло[3.1.0]гексана (3,8 г, 45,8 ммоля) (см. Zhang Z., Scheffold R., Helv. Chim. Acta, 76, 2602 (1993)) и Et3N (7,0 мл, 50,4 ммоля) в CH2Cl2 (35 мл), нагревали до 10°С в течение 30 мин, распределяли между СН2Cl2 и 1 н. NaH2PO4. Водную фазу экстрагировали CH2Cl2, экстракты промывали Н2О, 5% раствором NaHCO3 и солевым раствором, сушили (MgSO4) и концентрировали. Остаток кристаллизовали из смеси гексан/СН2Cl2/метил-трет-бутиловый эфир (12:4:3), при этом получали продукт (10,1 г, 82%) в виде твердого вещества светло-коричневого цвета. МС: m/z 269,1 (М+1)+.
Стадия Б
Получение (±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-нитробензолсульфонамида
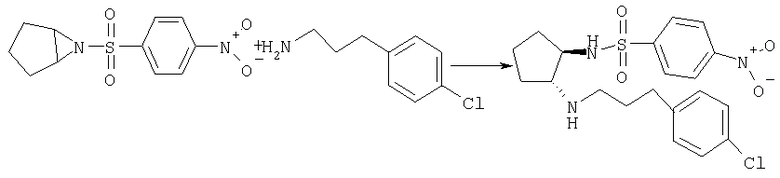
Раствор 6-(4-нитробензолсульфонил)-6-азабицикло[3.1.0]гексана (2,7 г, 10 ммолей), 3-(4-хлорфенил)пропиламина (1,7 г, 10 ммолей) (см. Fujimura K.-I., Matsumoto J., Niwa M., Kobayashi Т., Kawashima Y., Ishida Т., Bioorg. Med. Chem., 5, 1675 (1997)) и Et3N (0,27 мл, 2 ммоля) в ТГФ (10 мл) кипятили с обратным холодильником в течение 15 ч, охлаждали до комнатной температуры и концентрировали. Остаток очищали хроматографией (элюент: CH2Cl2/MeOH/NH4OH от 100:0,95:0,05 до 50:0,95:0,05), при этом получали продукт (1,88 г, 43%) в виде пены коричневого цвета. МС: m/z 438,1 (М+1)+.
Стадия В
Получение трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил][2-(4-нитробензолсульфониламино)циклопентил]карбамаиновой кислоты
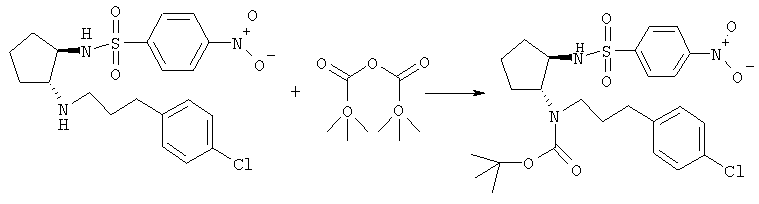
Раствор (±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-нитробензолсульфонамида (920 мг, 2,1 ммоля) и Et3N (0,35 мл, 2,5 ммоля) в СН2Cl2 (15 мл) обрабатывали ди-трет-бутилкарбонатом (458 мг, 2,1 ммоля) и перемешивали при комнатной температуре в течение 23 ч, добавляя дополнительные количества Et3N (0,2 мл, 1,43 ммоля) и ди-трет-бутилкарбоната (200 мг, 0,92 ммоля). Реакционную смесь распределяли между CH2Cl2 и насыщенным раствором NaHCO3, водную фазу экстрагировали СН2Cl2, экстракты промывали солевым раствором, сушили (MgSO4) и концентрировали, при этом получали 1,34 г продукта в виде масла коричневого цвета, который использовали на следующей стадии без дополнительной очистки. МС: m/z 538,1 (M+1)+.
Стадия Г
Получение трет-бутилового эфира (±)-транс-(2-аминоциклопентил)-[3-(4-хлорфенил)пропил]карбаминовой кислоты
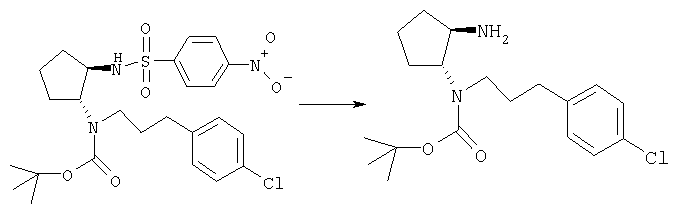
Смесь трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил][2-(4-нитробензолсульфониламино)циклопентил]карбаминовой кислоты (1,34 г, приблизительно 2,1 ммоля), PhSH (0,86 мл, 8,4 ммоля), К2СО3 (1,5 г, 10,9 ммоля) и СН3CN/ДМСО (40:1, 40 мл) перемешивали при 80°С в течение ночи и охлаждали до комнатной температуры. Твердое вещество белого цвета отделяли фильтрованием и фильтрат концентрировали. Остаток распределяли между CH2Cl2 и Н2О, органическую фазу промывали Н2О и солевым раствором, сушили и концентрировали. Остаток очищали хроматографией (элюент: CH2Cl2, затем CH2Cl2/MeOH/NH4OH от 100:0,95:0,05 до 5:0,95:0,05), при этом получали продукт (571 мг, 77%) в виде масла желтого цвета. МС: m/z 353,2 (М+1)+.
Стадия Д
Получение трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил](2-{2-[5-(3,4-диметоксифенил)пиримидин-2-
илсульфанил]ацетиламино}циклопентил)карбаминовой кислоты
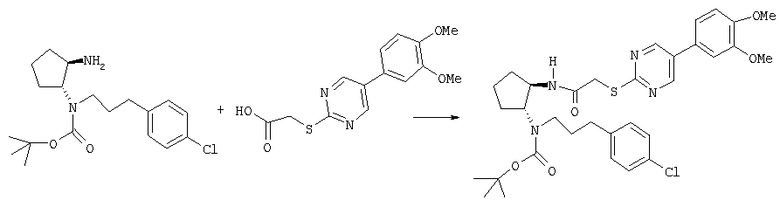
Трет-бутиловый эфир (±)-транс-(2-аминоциклопентил)[3-(4-хлорфенил)пропил]карбаминовой кислоты (95 мг, 0,27 ммоля) и [5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]уксусную кислоту (90 мг, 0,30 ммоля) (полученную по методике, описанной в статье Rogers D.H., Saunders J. and Williams J.P., Preparation of N-Pyrrolidinylmethylalkanoamides and analogs as CCR-3 receptor antagonises, DE 19955794 A1 20000531) в CH2Cl2 (3 мл) конденсировали в присутствии HOBt (8 мг, 0,06 ммоля) и ДЕС (77 мг, 0,40 ммоля) при 0°С в течение 2 ч, как описано в общей методике В. Неочищенный продукт очищали препаративной ТСХ (элюент: CH2Cl2/MeOH/NH4OH 100:0,95:0,05), при этом получали 185 мг продукта (приблизительно 80% чистоты) в виде бесцветного масла. МС: m/z 641 (М+1)+.
Пример 2
Гидрохлорид (±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-метансульфонилбензамида
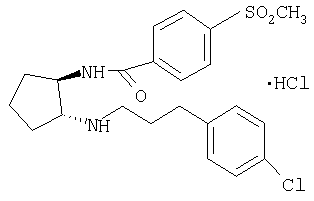
Раствор трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил][2-(4-метансульфонилбензоиламино)
циклопентил]карбаминовой кислоты в 10% 25 HCl/MeOH (25 мл) перемешивали при комнатной температуре в течение ночи. Затем МеОН упаривали и остаток распределяли между CH2Cl2 и насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты промывали солевым раствором, сушили и концентрировали. Остаток очищали препаративной ТСХ (элюент: CH2Cl2/MeOH/NH4OH 10:0,95:0,05), при этом получали свободное основание (116 мг, 0,27 ммоля) в виде бесцветного масла.
Раствор свободного основания в CH2Cl2 обрабатывали 1 н. HCl в Et2O (0,3 мл, 0,3 ммоля) и концентрировали, при этом получали продукт (123 мг, 61%) в виде твердого вещества белого цвета, tпл. 192,3-196,8°С. МС: m/z 435 (М+1)+.
Промежуточное соединение трет-бутиловый эфир (±)-транс-[3-(4-хлорфенил)пропил][2-(4-метансульфонилбензоиламино)
циклопентил]карбаминовой кислоты получали как описано ниже.
Стадия А
Получение трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил]-[2-(4-метансульфонилбензоиламино)циклопентил]карбамаиновой кислоты
Трет-бутиловый эфир (±)-транс-(2-аминоциклопентил)[3-(4-хлорфенил)пропил]карбаминовой кислоты (155 мг, 0,44 ммоля) и 4-метансульфонилбензойную кислоту (105 мг, 0,53 ммоля) в СН2Cl2 (3 мл) конденсировали в присутствии HOBt (12 мг, 0,09 ммоля) и ДЕС (106 мг, 0,66 ммоля) при 0°С в течение 2,5 ч, как описано в общей методике В, при этом получали 250 мг трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил][2-(4-метансульфонилбензоиламино)циклопентил]
карбаминовой кислоты в виде бесцветного масла.
Пример 3
Гидрохлорид (±)-транс-1-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевины
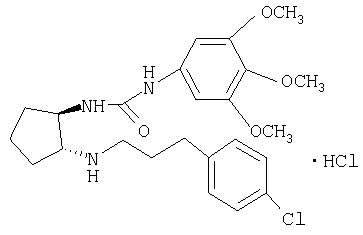
Раствор трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил]{2-[3-(3,4,5-триметоксифенил)уреидо]циклопентил}
карбаминовой кислоты (165 мг, 0,29 ммоля) в 10% HCl/MeOH (25 мл) перемешивали при комнатной температуре в течение ночи. Затем МеОН упаривали и остаток распределяли между CH2Cl2 и насыщенным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2, экстракты промывали солевым раствором, сушили и концентрировали. Остаток очищали препаративной ТСХ (элюент: CH2Cl2/MeOH/NH4OH 10:0,95:0,05), при этом получали свободное основание в виде бесцветного масла. Раствор свободного основания в CH2Cl2 обрабатывали 1 н. HCl в Et2O (0,4 мл, 0,4 ммоля) 10 и концентрировали, при этом получали продукт (104 мг, 72%) в виде твердого вещества желто-коричневого цвета. tпл. 91,3-96,0°C. MC: m/z 462 (М+1)+.
Промежуточное соединение трет-бутиловый эфир (±)-транс-[3-(4-хлорфенил)пропил]{2-[3-(3,4,5-триметоксифенил)уреидо]
циклопентил}карбаминовой кислоты получали как описано ниже.
Стадия А
Получение трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил]{2-[3-(3,4,5-триметоксифенил)уреидо]циклопентил}карбаминовой кислоты.
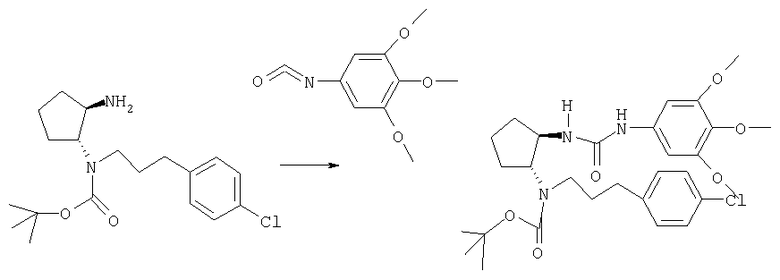
Трет-бутиловый эфир (±)-транс-(2-аминоциклопентил)[3-(4-хлорфенил)пропил]карбаминовой кислоты (152 мг, 0,43 ммоля) и 5-изоцианато-1,2,3-триметоксибензол (108 мг, 0,52 ммоля) в СН2Cl2 (2 мл) конденсировали при 0°С в течение 1,5 ч, как описано в общей методике А. Неочищенный продукт очищали препаративной ТСХ (элюент: CH2Cl2/MeOH/NH4OH 10:0,95:0,05), при этом получали продукт (168 мг, 70%) в виде бесцветного масла. MC: m/z 562,2 (М+1)+.
Пример 4
Гидрохлорид (±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-4-метансульфонилбензамида

Указанное в заголовке соединение получали по методикам, описанным в примере 3, при замене трет-бутилового эфира (±)-транс-[3-(4-хлорфенил)пропил]{2-[3-(3,4,5-триметоксифенил)уреидо]циклопентил}карбаминовой кислоты на трет-бутиловый эфир (±)-транс[2-(4-хлорфенил)этил]-[2-(4-метансульфонилбензоиламино)циклопентил]
карбаминовой кислоты. МС: m/z 421 (М+1)+.
Промежуточное соединение трет-бутиловый эфир (±)-транс-[2-(4-хлорфенил)этил][2-(4-метансульфонилбензоиламино)циклопентил]
карбаминовой кислоты получали по методикам, описанным в примере 1, при замене 3-(4-хлорфенил)пропиламина, использованного на стадии Б, на 2-(4-хлорфенил)этиламин и при замене кислоты, использованной на стадии Д, на требуемую кислоту.
Пример 5
Гидрохлорид (±)-транс-1-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевины
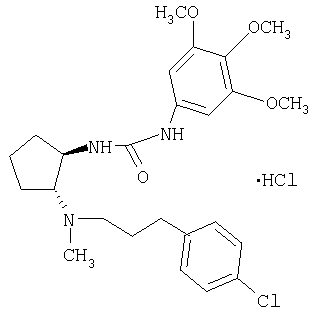
Указанное в заголовке соединение получали из (±)-транс-N-[3-(4-хлорфенил)пропил]-N-метилциклопентан-1,2-диамина и 5-изоцианато-1,2,3-триметоксибензола по общей методике Б. МС: m/z 476 (М+1)+.
Промежуточное соединение (±)-транс-N-[3-(4-хлорфенил)пропил]-N-метилциклопентан-1,2-диамин получали как описано ниже.
Стадия А
Получение (±)-транс-N-(2-{[3-(4-хлорфенил)пропил]
метиламино}циклопентил)-4-нитробензолсульфонамида
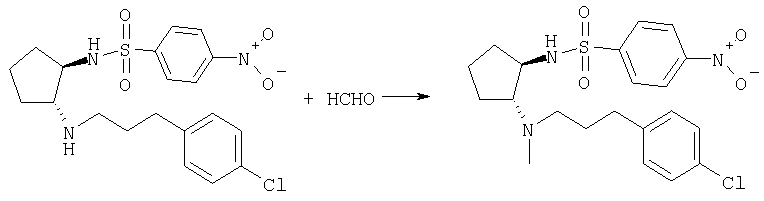
Раствор (+)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-нитробензолсульфонамида (940 мг, 2,15 ммоля) и 37% водный раствор НСНО (0,16 мл, 2,15 ммоля) в 1,2-дихлорэтане (10 мл) обрабатывали NaBH(OAc)3 (456 мг, 86 ммоля) и перемешивали при комнатной температуре в течение 24 ч, добавляя дополнительное количество 37% водного раствора НСНО (0,05 мл, 0,67 ммоля). Реакционную смесь распределяли между 1,2-дихлорэтаном и насыщенным раствором NaHCO3, водную фазу экстрагировали EtOAc, экстракты промывали солевым раствором, сушили и концентрировали. Остаток очищали хроматографией (элюент: СН2Cl2/МеОН/NH4OH 25:0,95:0,05), при этом получали продукт (965 мг, 100%) в виде масла желтого цвета. МС: m/z 452,1 (М+1)+.
Стадия Б
Получение (±)-транс-N-[3-(4-хлорфенил)пропил]-N-метилциклопентан-1,2-диамина
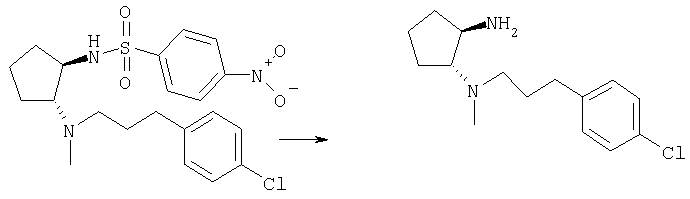
Смесь (±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-4-нитробензолсульфонамида (960 мг, 2,12 ммоля), PhSH (1,09 мл, 10,6 ммоля), К2СО3 (1,9 г, 13,8 ммоля) и СН3CN/ДМСО 40:1 (40 мл) перемешивали при 80°С в течение ночи, а затем охлаждали до комнатной температуры. Твердое вещество белого цвета отделяли фильтрованием, фильтрат концентрировали. Остаток распределяли между CH2Cl2 и Н2О, органическую фазу промывали Н2О и солевым раствором, сушили и концентрировали. Остаток очищали хроматографией (элюент: 100% CH2Cl2, затем CH2Cl2/MeOH/NH4OH от 40:0,95:0,05 до 5:0,95:0,05), при этом получали продукт (300 мг, 53%) в виде масла коричневого цвета. МС: m/z 267,1 (М+1)+.
Пример 6
Гидрохлорид (±)-транс-1-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевины
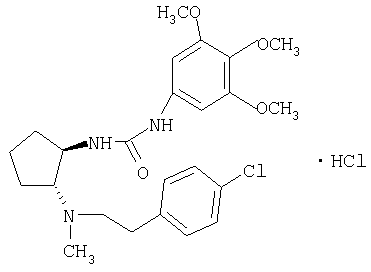
Указанное в заголовке соединение получали по общей методике Б из (±)-транс-N-[2-(4-хлорфенил)этил]-N-метилциклопентан-1,2-диамина и 5-изоцианато-1,2,3-триметоксибензола. МС: m/z 462 (М+1)+.
Промежуточное соединение (±)-транс-N-[2-(4-хлорфенил)этил]-N-метилциклопентан-1,2-диамин получали как описано в примере 5 при замене (±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-нитробензолсульфонамида, использованного на стадии А, на (±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-4-нитробензолсульфонамид, который получали по методике, описанной в примере 1, стадия Б.
Пример 7
Гидрохлорид (±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-4-метансульфонилбензамида
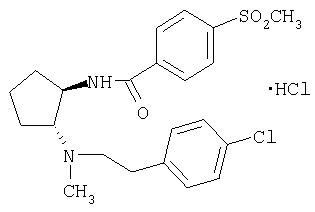
Указанное в заголовке соединение получали из (±)-транс-N-[2-(4-хлорфенил)этил]-N-метилциклопентан-1,2-диамина и 4-метилсульфонилбензойной кислоты по общей методике Г, как описано в примере 2, стадия А. МС: m/z 435 (М+1)+.
Примеры 8-9
Приведенные ниже соединения получали по общей методике Г из (±)-транс-N-[2-(4-хлорфенил)пропил]-N-метилциклопентан-1,2-диамина и требуемой карбоновой кислоты.
Пример 8
Гидрохлорид (±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-4-метансульфонилбензамида
МС: m/z 449 (М+1)+.
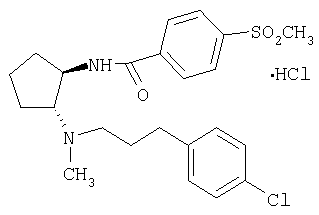
Пример 9
Гидрохлорид (±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамида
МС: m/z 555 (М+1)+.

Пример 10
Гидрохлорид (±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамида
МС: m/z 541 (M+1)+.
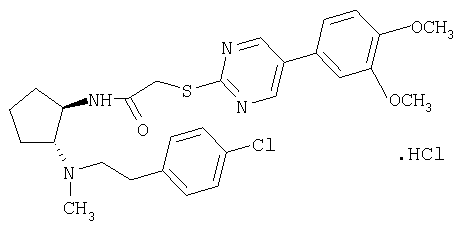
Указанное в заголовке соединение получали по общей методике Г из (±)-транс-N-[2-(4-хлорфенил)этил]-N-метилциклопентан-1,2-диамина и требуемой карбоновой кислоты.
Пример 11
Гидрохлорид (±)-транс-1-{2-[2-(4-хлорфенил)этиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевины
МС: m/z 448 (М+1)+.

Указанное в заголовке соединение получали по методике, описанной в примере 1, из трет-бутилового эфира (±)-транс-[2-(4-хлорфенил)этил]{2-[3-(3,4,5-триметоксифенил)уреидо]циклопентил}карбаминовой кислоты.
Промежуточное соединение трет-бутиловый эфир (±)-транс-[2-(4-хлорфенил)этил] {2-[3-(3,4,5-триметоксифенил)уреидо]циклопентил}карбаминовой кислоты получали как описано в примере 3 при замене трет-бутилового эфира (±)-транс-(2-аминоциклопентил)[3-(4-хлорфенил)пропил]карбаминовой кислоты на трет-бутиловый эфир (±)-транс-(2-аминоциклопентил)[2-(4-хлорфенил)этил]карбаминовой кислоты.
Пример 12
Гидрохлорид (±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамида
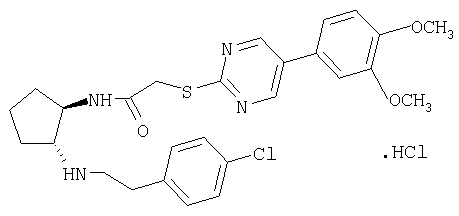
Указанное в заголовке соединение получали по методике, описанной в примере 1, из трет-бутилового эфира (±)-транс-[2-(4-хлорфенил)этил](2-{2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]
ацетиламино}циклопентил)карбаминовой кислоты. МС: m/z 527 (М+1)+.
Промежуточное соединение трет-бутиловый эфир (±)-транс-[2-(4-хлорфенил)этил](2-{2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетиламино}циклопентил)карбаминовой кислоты получали как описано в примере 1 при замене 3-(4-хлорфенил)пропиламина, использованного на стадии Б, на 2-(4-хлорфенил)этиламин.
Пример 13
Примеры составов
Приведенные ниже составы являются примерами фармацевтических композиций, содержащих соединения формулы I.
Состав таблеток
Приведенные ниже компоненты тщательно перемешивали и прессовали в отдельные таблетки с насечкой.
Состав капсул.
Приведенные ниже компоненты тщательно перемешивали и помещали в желатиновую капсулу с твердой оболочкой.
Состав суспензии
Приведенные ниже компоненты перешивали, при этом получали суспензию для перорального введения.
Состав для инъекций
Приведенные ниже компоненты перемешивали, при этом получали составы для инъекций.
Состав для липосом.
Приведенные ниже компоненты перемешивали, при этом получали состав для липосом.
Образец высушивали лиофильно в течение ночи и растворяли в 1 мл 0,9% солевого раствора. Размер липосом можно уменьшить при обработке ультразвуком.
Пример 14
Анализ связывания рецептора CCR-3 in vitro
Антагонистическую активность соединений по изобретению в отношении рецептора CCR-3 определяли по их способности ингибировать связывание 125I-эотаксина с трансфектированными клетками CCR-3 L1.2 (см. статью Ponath P.D. и др., J. Exp. Med., 183, 2437-2448 (1996)).
Анализ проводили в 96-луночных полипропиленовых круглодонных планшетах фирмы Costar. Исследуемые соединения растворяли с ДМСО и затем разбавляли буферным раствором для связывания (50 мМ HEPES, 1 мМ CaCl2, 5 мМ MgCl2, 0,5% бычий сывороточный альбумин (БСА), 0,02% азид натрия, рН 7,24) до конечной концентрации ДМСО 2%. В каждую лунку добавляли по 25 мкл раствора анализируемого соединения или буферного раствора, содержащего ДМСО (контрольные образцы), затем добавляли по 25 мкл 125I-эотаксина (100 пмолей) (NEX314, фирма New England Nuclear, Boston, Mass.) и по 1,5×105 трансфектированных клеток CCR-3 L1.2 в 25 мкл буферного раствора для связывания. Конечный объем реакционной смеси составлял 75 мкл.
Реакционную смесь инкубировали при комнатной температуре в течение 1 ч, затем реакцию останавливали фильтрованием реакционной смеси через планшеты Packard Unifilter GF/C (фирмы Packard, Chicago, III), обработанные полиэтиленимином. Фильтры четырехкратно промывали ледяным буферным раствором для промывки, содержащим 10 мМ HEPES и 0,5 М хлорид натрия (рН 7,2), затем сушили при 65°С приблизительно в течение 10 мин, в каждую лунку добавляли по 25 мкл сцинтилляционной жидкости Microscint-20 (фирма Packard) и связанную с фильтрами радиоактивность определяли на сцинтилляционном счетчике Packard TopCount.
Результаты данного анализа свидетельствуют об активности соединений по настоящему изобретению. Полученные данные приведены в табл.2.
Пример 15
Анализ ингибирования хемотаксиса трансфектированных клеток CCR-3 L1.2 in vitro, опосредованного эотаксином
Антагонистическую активность соединений по изобретению в отношении CCR-3 определяли по ингибированию хемотаксиса трансфектированных клеток CCR-3 L1.2, опосредованного эотаксином, по модифицированному методу, описанному в статье Ponath P.D. и др., J. Clin. Invest., 97, 604-612 (1996). Анализ проводили в 24-луночных планшетах для хемотаксиса (фирма Costar Corp., Cambridge, Mass.). Трансфектированные клетки CCR-3 L1.2 культивировали в питательной среде, содержащей RPMI 1640, 10% фетальной телячьей сыворотки (Hyclone®), 55 мМ 2-меркаптоэтанола и генетицин 418 (0,8 мг/мл). За 18-24 ч до анализа трансфектированные клетки обрабатывали н-масляной кислотой при конечной концентрации 5 мМ/1×106 клеток/мл, собирали и ресуспендировали при концентрации 1×107 клеток/мл в среде для анализа, содержащей равные объемы среды RPMI 1640 и среды 199 (М 199), содержащей 0,5% БСА.
В нижнюю полость добавляли эотаксин человека, суспендированный в фосфатно-солевом буферном растворе при концентрации 1 мг/мл, до конечной концентрации 100 нМ. В каждую лунку вставляли двухполостную камеру с полупроницаемой перегородкой с диаметром пор 3 мкм (фирма Costar Corp., Cambridge, Mass.) и в верхнюю полость добавляли клетки L1.2 (1×106) в конечном объеме 100 мкл. В нижнюю и верхнюю полости добавляли исследуемые соединения в ДМСО таким образом, чтобы конечное содержание ДМСО составляло 0,5%. Анализ проводили с использованием двух видов контрольных образцов. В положительном контрольном образце в верхней полости содержались клетки в отсутствии исследуемого соединения, а в нижней полости содержался только эотаксин. В отрицательном контрольном образце в верхней полости содержались клетки в отсутствии эотаксина, а в нижней полости не содержались ни исследуемое соединение, ни эотаксин. Планшет инкубировали при 37°С. Через 4 ч перегородки удаляли и рассчитывали число клеток, мигрировавших в нижнюю полость. Для этого из нижних полостей отбирали пипеткой по 500 мкл клеточной суспензии, помещали в пробирки Cluster (фирма Costar) объемом 1,2 мл и клеточную суспензию анализировали методом проточной цитофлуориметрии на анализаторе клеток FACS в течение 30 сек.
Пример 16
Анализ ингибирования хемотаксиса эозинофилов человека in vitro, опосредованного эотаксином
Способность соединений по изобретению ингибировать хемотаксис эозинофилов человека, опосредованный эотаксином, определяли по модифицированной методике, описанной в статье Carr M.W. и др., Proc. Natl. Acad. Sci. USA, 91, 3652-3656 (1994). Эксперименты проводили в 24-луночных планшетах для хемотаксиса (фирма Costar Corp., Cambridge, Mass.). Эозинофилы выделяли из крови по методике, описанной в заявке РСТ WO 96/22371. В качестве эндотелиальных клеток использовали эндотелиальную линию клеток ECV 304, полученную из Европейской коллекции культур клеток животных (Porton Down, Salisbury, UK). Эндотелиальные клетки культивировали в двухполостной камере с полупроницаемой перегородкой диаметром 6,5 мм с размером 3 мкм (фирма Costar Corp., Cambridge, Mass.), пропитанных средой Biocoat RTM. Питательная среда для клеток ECV 304 содержала среду M199, 10% фетальную телячью сыворотку, L-глутамин и антибиотики. Среда для анализа содержала равные объемы RTMI1640 и M199, содержащих 0,5% БСА. За 24 ч до анализа в каждую насадку 24-луночного планшета для хемотаксиса добавляли по 2×105 клеток ECV 304 и инкубировали при 37°С. В нижнюю полость добавляли 20 нМ раствор эотаксина в среде для анализа. Конечный объем в нижней полости составлял 600 мкл. В каждую лунку вставляли насадки, покрытые культурой эндотелиальных клеток. В верхнюю полость добавляли 106 эозинофилов, суспендированных в 100 мкл буферного раствора для анализа. В верхнюю и нижнюю полости добавляли исследуемые соединения, растворенные в ДМСО таким образом, чтобы конечное содержание ДМСО составляло 0,5%. Анализ проводили с использованием двух видов контрольных образцов. В положительном контрольном образце в верхней полости содержались клетки, а в нижней полости - эотаксин. В отрицательном контрольном образце в верхней полости содержались клетки, а в нижней полости - только буферный раствор для анализа. Планшет инкубировали при 37°С в атмосфере 5% CO3/95% воздух в течение 1-1,5 ч.
Число клеток, мигрировавших в нижнюю полость, определяли методом проточной цитофлуориметрии. В пробирки добавляли по 500 мкл клеточной суспензии из нижней полости и рассчитывали относительное число клеток по наблюдаемым событиям в течение 30 сек.
Пример 17
Анализ ингибирования притока эозинофилов в легкие, сенсибилизированных овальбумином мышей Balb/c, in vivo антагонистом CCR-3
Способность соединений по изобретению ингибировать инфильтрацию лейкоцитов в легкие определяли по ингибированию накопления эозинофилов в смывной бронхоальвеолярной жидкости (BAL) у сенсибилизированных овальбумином (ОА) мышей Balb/c после введения ударной дозы аэрозоля. Краткое описание анализа: самцов мышей Balb/c весом 20-25 г сенсибилизировали ОА (10 мкг в 0,2 мл раствора гидроксида алюминия) внутрибрюшинно в день 1 и день 14. Через неделю мышей делили на 10 групп.
Затем вводили исследуемое соединение или один носитель (контрольная группа) или антитела против эотаксина (положительная контрольная группа) внутрибрюшинным, подкожным или пероральным способом. Через 1 ч мышей помещали в ящик из оргстекла и подвергали действию аэрозоля ОА из распылителя Paristar TM (фирма Pari, Richmond, Va.) в течение 10 мин. Мышей, которых не сенсибилизировали ОА или не подвергали воздействию ударной дозы, включали в группу отрицательного контроля. Через 24 ч или 72 ч мышей анестезировали (уретан, приблизительно 1 г/кг, внутрибрюшинно), вставляли трахеальную канюлю (шланг РЕ 60) и легкие промывали фосфатно-солевым буферным раствором (4×0,3 мл). Жидкость BAL переносили в пластиковые пробирки и хранили во льду. Общее число лейкоцитов определяли в образцах жидкости BAL объемом 20 мкл с использованием анализатора частиц Coulter Counter. TM (фирма Coulter, Miami, Fla.). Число дифференциальных лейкоцитов определяли с использованием препаратов Cytospin. TM, которые затем окрашивали модифицированным красителем Wright (фирма DiffQuick TM) и регистрировали в световом микроскопе по стандартным морфологическим признакам.
Настоящее изобретение описано подробно со ссылкой на конкретные иллюстрации и примеры с целью иллюстрации и пояснения сущности изобретения. Для специалиста в данной области представляется очевидным, что в пределах объема изобретения и пунктов формулы изобретения возможны различные изменения и модификации. Следовательно, предполагается, что указанное описание представлено для иллюстрации и не ограничивает объем изобретения. Таким образом, объем изобретения определяется не описанием изобретения, а прилагаемыми пунктами формулы изобретения в совокупности с полным объемом эквивалентов, которые также заявлены в этих пунктах.
Все патенты, заявки на выдачу патентов и публикации, цитированные в данной заявке, полностью включены в описание в качестве ссылок в каждом случае в таком объеме, в каком каждый документ цитируется отдельно.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕНЗОТИАЗОЛЬНЫЕ ИНГИБИТОРЫ ПРОТЕИНТИРОЗИНКИНАЗ | 1998 |
|
RU2212407C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛЗАМЕЩЕННОГО АМИНОЦИКЛОГЕКСАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2002 |
|
RU2286987C2 |
| ПРОИЗВОДНЫЕ АЛКИЛПИПЕРАЗИН- И АЛКИЛГОМОПИПЕРАЗИНКАРБОКСИЛАТОВ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH | 2005 |
|
RU2331637C2 |
| ЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНТИРОЗИНКИНАЗ | 2000 |
|
RU2312860C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНДУКЦИИ АПОПТОЗА РАКОВЫХ КЛЕТОК | 2003 |
|
RU2379056C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2581367C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНОМОЧЕВИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2005 |
|
RU2430093C2 |
| ПРОИЗВОДНЫЕ НИТРИЛОВ β-АМИНОКИСЛОТ | 2001 |
|
RU2245871C2 |
| ПРОИЗВОДНЫЕ 4-АМИНОПИПЕРИДИНА | 2005 |
|
RU2396257C2 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2269527C2 |
Производные 1,2-диаминопентана формулы (I)

где R1 означает водород или C1-С6алкил, R2 означает фенилС1-С6алкил, где фенил замещен галогеном, R3 означает водород, R4 означает -W-X-Y-Z, W отсутствует или означает C1-С6алкилен, Х отсутствует или означает -S(O)n- или -N(Ra)-, Y означает арилен или гетероарилен, Z означает водород, арил, Ra означает водород, n равен 0, при условии, что перечень не включает транс-3,4-дихлор-N-[2-(диметиламино)циклопентил]бензамид и транс-N-метил-3,4-дихлор-N-[2-(диметиламино)циклопентил]бензамид, или его фармацевтически приемлемая соль. Также предложена фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора CCR-3, содержащая терапевтически эффективное количество соединения формулы (I) или его соль или эксципиент. Технический результат - производные 1,2-диаминопентана, ингибирующие связывание эотаксина с рецептором CCR-3. 2 н. и 24 з.п. ф-лы, 2 табл.

где R1 означает водород или C1-С6алкил,
R2 означает арилС1-С6алкил,
R3 означает водород,
R4 означает -W-X-Y-Z,
W отсутствует или означает C1-С6алкилен,
X отсутствует или означает -S(O)n- или -N(Ra)-,
Y означает арилен или гетероарилен, а
Z означает водород или арил,
Ra означает водород, а
каждый n равен 0, 1 или 2,
при условии, что перечень не включает транс-3,4-дихлор-N-[2-(диметиламино)циклопентил]бензамид и транс-N-метил-3,4-дихлор-N-[2-(диметиламино)циклопентил]бензамид,
или его фармацевтически приемлемая соль, где
"арил" означает моноциклический ароматический углеводородный радикал, содержащий шесть атомов углерода в цикле, который необязательно замещен одним или более заместителями, выбранными из группы, включающей C1-С6алкилсульфонил, C1-С6алкокси и галоген,
"арилен" означает двухвалентную арильную группу,
"гетероарилен" означает двухвалентную гетероарильную группу,
представляющую собой моноциклический ароматический радикал, содержащий шесть атомов в цикле, из которых два представляют собой атомы азота, а остальные являются атомами углерода.
(±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-N-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-4-метансульфонилбензамид,
(±)-транс-1-{2-[3-(4-хлорфенил)пропиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевину,
(±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-4-метансульфонилбензамид,
(±)-транс-1-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевину,
(±)-транс-1-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-3-(3,4,5-триметоксифенил)мочевину,
(±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-4-метансульфонилбензамид,
(±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-4-метансульфонилбензамид,
(±)-транс-N-(2-{[3-(4-хлорфенил)пропил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-N-(2-{[2-(4-хлорфенил)этил]метиламино}циклопентил)-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
(±)-транс-1-{2-[2-(4-хлорфенил)этиламино]циклопентил}-3-(3,4,5-триметоксифенил)мочевину или
(±)-транс-N-{2-[2-(4-хлорфенил)этиламино]циклопентил}-2-[5-(3,4-диметоксифенил)пиримидин-2-илсульфанил]ацетамид,
или его фармацевтически приемлемую соль.
Авторы
Даты
2006-10-27—Публикация
2002-09-05—Подача