Изобретение относится к производным алкилпиперазин- и алкилгомопиперазинкарбоксилатов, их получению и терапевтическому применению.
К настоящему времени известны производные фенилалкилкарбаматов, диоксан-2-алкилкарбаматов и 1-пиперазин- и 1-гомопиперазинкарбоксилатов, описанные в публикациях WO2004/067498 A, WO2004/020430 A и PCT/FR2004/00328 соответственно, как ингибиторы фермента FAAH (гидролазы амидов жирных кислот).
Однако все еще существует необходимость в нахождении и разработке соединений-ингибиторов фермента FAAH. Соединения по настоящему изобретению отвечают данной цели.
Соединения по настоящему изобретению соответствуют общей формуле (I)
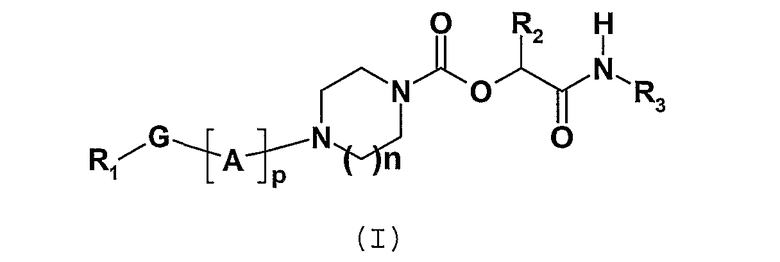
где n представляет собой целое число, равное 1 или 2;
p представляет собой целое число, изменяемое от 1 до 7;
A выбран из одного или нескольких радикалов X, Y и/или Z;
X представляет собой метиленовый радикал, замещенный при необходимости одним или двумя радикалами С1-6-алкил, С3-7-циклоалкил или С3-7-циклоалкил-С1-3-алкилен;
Y представляет собой как радикал С2-алкенилен, замещенный при необходимости одним или двумя радикалами С1-6-алкил, С3-7-циклоалкил или С3-7-циклоалкил-С1-3-алкилен, так и радикал С2-алкинилен;
Z представляет собой радикал формулы:

o представляет собой целое число, изменяемое от 1 до 5;
r и s представляют собой целые числа и определяются так, что r+s является целым числом, изменяемым от 1 до 5;
G представляет собой простую связь, атом кислорода или серы, группу SO, SO2, C=O или CH(OH);
R1 представляет собой радикал R4, замещенный при необходимости одним или несколькими радикалами R5 и/или R6;
R4 представляет собой радикал, выбранный из радикалов фенил, пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил, пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, нафтил, дифенилметил, хинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, хиноксалинил, фталазинил, циннолинил, нафтиридинил, бензофуранил, дигидробензофуранил, бензотиенил, дигидробензотиенил, индолил, индолинил, инданил, индазолил, изоиндолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензотриазолил, бензоксадиазолил, бензотиадиазолил, пирролопиридинил, фуропиридинил, тиенопиридинил, имидазопиридинил, оксазолопиридинил, тиазолопиридинил, пиразолопиридинил, изооксазолопиридинил, изотиазолопиридинил;
R5 представляет собой атом галогена или цианогруппу, нитрогруппу, радикал С1-6-алкил, С1-6-алкокси, гидроксил, С1-6-тиоалкил, С1-6-фторалкил, С1-6-фторалкокси, С1-6-фтортиоалкил, NR7R8, NR7COR8, NR7CO2R8, NR7SO2R8, COR7, CO2R7, CONR7R8, SO2R7, SO2NR7R8 или -О-(С1-3-алкилен)-О;
R6 представляет собой радикал фенил, фенилокси, бензилокси, нафтил, пиридинил, пиримидинил, пиридазинил или пиразинил; радикал или радикалы R6 при необходимости имеют заместители из одного или нескольких одинаковых или отличающихся один от другого радикалов R5;
R7 и R8 представляют собой независимо один от другого атом водорода или радикал С1-6-алкил или образуют с атомом или атомами, к которым они присоединены, цикл, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина, азепина, пиперазина; данный цикл при необходимости имеет заместители из радикалов С1-6-алкил или бензил;
R2 представляют собой атом водорода или радикал С1-6-алкил;
R3 представляет собой атом водорода или радикал С1-6-алкил, С3-7-циклоалкил или С3-7-циклоалкил-С1-3-алкил.
В пределах данного изобретения соединения общей формулы (I) могут, следовательно, иметь несколько одинаковых или различающихся между собой радикалов А.
Среди соединений общей формулы (I) первая подгруппа соединений состоит из соединений, в которых:
n представляет собой целое число, равное 1 или 2;
p представляет собой целое число, изменяемое от 1 до 7;
A выбран из одного или нескольких радикалов X и/или Y;
X представляет собой метиленовую группу, замещенную при необходимости одним или двумя радикалами С1-6-алкил, в частности метильной группой;
Y представляет собой как радикал С2-алкенилен, так и радикал С2-алкинилен;
G представляет собой простую связь, атом кислорода или группу С=О;
R1 представляет собой радикал R4, замещенный при необходимости одним или несколькими радикалами R5 и/или R6;
R4 представляет собой радикал, выбранный из радикалов фенил, нафтил, дифенилметил, хинолинил, индолил, пиразолил, изоксазолил, пиримидинил, тиазолил;
R5 представляет собой атом галогена, в частности хлор, фтор, бром или иод, или цианогруппу, радикал С1-6-алкил, в частности метил, изопропил или трет-бутил, С1-6-алкокси, в частности метокси, С1-6-фторалкил, в частности трифторметил, С1-6-фторалкокси, в частности фторметокси, или -О-(С1-3-алкилен)-О, в частности -ОСН2О-;
R6 представляет собой радикал фенил, нафтил или бензилокси;
R2 представляет собой атом водорода или радикал С1-6-алкил;
R3 представляют собой атом водорода или радикал С1-6-алкил, С3-7-циклоалкил, С3-7-циклоалкил-С1-3-алкил.
Среди соединений общей формулы (I) вторая подгруппа соединений состоит из соединений, в которых:
n представляет собой целое число, равное 1;
p представляет собой целое число, изменяемое от 1 до 4;
A выбран из одного или нескольких радикалов X и/или Y;
X представляет собой метиленовую группу, замещенную при необходимости одним или двумя радикалами С1-6-алкил, в частности метильной группой;
Y представляет собой радикал С2-алкинилен;
G представляет собой простую связь или атом кислорода;
R1 представляет собой радикал R4, замещенный при необходимости одним или несколькими радикалами R5 и/или R6;
R4 представляет собой радикал, выбранный из радикалов фенил, нафтил, изоксазолил;
R5 представляет собой атом галогена, в частности хлор или фтор, или цианогруппу, радикал С1-6-алкокси, в частности метокси, радикал С1-6-фторалкил, в частности трифторметил;
R6 представляет собой фенильную группу;
R2 представляют собой атом водорода или радикал С1-6-алкил;
R3 представляют собой атом водорода или радикал С1-6-алкил, С3-7-циклоалкил, С3-7-циклоалкил-С1-3-алкил.
Среди соединений общей формулы (I) третья подгруппа соединений состоит из соединений, в которых:
n, p, A, X, Y, Z,o, r, s, G, R1, R4, R5, R6, R7 и R8 такие же, как и указанные для общей формулы (I) или для подгрупп, представленных ранее;
R2 представляет собой атом водорода;
R3 представляет собой атом водорода или радикал С1-6-алкил, в частности, метил, радикал С3-7-циклоалкил, в частности циклопропил, или радикал С3-7-циклоалкил-С1-3-алкил, в частности -СН2-циклопропил.
В ряду соединений общей формулы (I) могут быть приведены следующие соединения:
- 2-(метиламино)-2-оксоэтил-4-(2-дифенил-3-илэтил)пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-(2-дифенил-4-илэтил)пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[2-(1-нафтил)этил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{2-[3-(4-хлорфенил)изоксазол-5-ил]этил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{2-[5-(4-хлорфенил)изоксазол-3-ил]этил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-(3-дифенил-3-илпропил)пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-(3-дифенил-4-илпропил)пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-(3-дифенил-3-ил-1,1-диметилпропил)пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(3'-хлордифенил-3-ил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(4'-хлордифенил-3-ил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(3'-метоксидифенил-3-ил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(4'-метоксидифенил-3-ил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(3'-хлордифенил-4-ил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(4'-хлордифенил-4-ил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(2-нафтил)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{3-[5-(4-хлорфенил)изоксазол-3-ил]пропил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{3-[3-(4-хлорфенил)изоксазол-5-ил]пропил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[4-(3-хлорфенил)бутил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[4-(4-хлорфенил)бутил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{4-[3-трифторметил)фенил]бутил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{4-[4-трифторметил)фенил]бутил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-{4-[4-трифторметил)фенил]бут-3-ин-1-ил}пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[5-(3-хлорфенил)пент-4-ин-1-ил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[5-(2,4-дихлорфенил)пент-4-ин-1-ил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[5-(2,5-дихлорфенил)пент-4-ин-1-ил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[5-(3,4-дихлорфенил)пент-4-ин-1-ил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[5-(3-хлор-4-фторфенил)пент-4-ин-1-ил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(2-хлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(3-хлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(4-хлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(2,3-дихлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(2,4-дихлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(2,5-дихлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(2,6-дихлорфенокси)пропил]пиперазин-1-карбоксилат;
- 2-(метиламино)-2-оксоэтил-4-[3-(3,5-дихлорфенокси)пропил]пиперазин-1-карбоксилат.
Соединения общей формулы (I) могут содержать один или несколько асимметричных атомов углерода. Они могут существовать в форме энантиомеров или диастереоизомеров. Соединения общей формулы (I) могут равным образом существовать в форме цис-(Z)- или транс-(E)-стереоизомеров. Данные стереоизомеры, энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть изобретения.
Соединения общей формулы (I) могут равным образом существовать в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть изобретения.
Как данные соли, соответствующим образом полученные с фармацевтически приемлемыми кислотами, так и соли других применяемых кислот, например, для очистки или выделения соединений формулы (I) в равной мере составляют часть изобретения.
Соединения общей формулы (I) могут находиться в форме гидратов или сольватов, а именно в форме ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты составляют в равной мере часть изобретения.
В пределах настоящего изобретения принято, что:
- Ct-z, где t и z могут принимать значения от 1 до 7, означает углеродную цепочку, в которую могут входить от t до z атомов углерода, например С1-3 является углеродной цепочкой, в которую могут входить от 1 до 3 атомов углерода;
- алкил означает алифатический насыщенный линейный или разветвленный радикал, например радикал С1-6-алкил представляет собой линейную или разветвленную углеродную цепочку, содержащую от 1 до 6 атомов углерода, в частности метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил;
- алкилен означает насыщенный линейный или разветвленный двухвалентный радикал, например радикал С1-3-алкилен представляет собой линейную или разветвленную двухвалентную углеродную цепочку, содержащую от 1 до 3 атомов углерода, в частности метилен, этилен, 1-метилэтилен, пропилен;
- циклоалкил означает циклический алкильный радикал, например радикал С3-7-циклоалкил представляет собой углеродный цикл, содержащий от 3 до 7 атомов углерода, в частности циклопропил, циклобутил, циклопентил, циклогексил, циклогептил;
- алкенилен означает алифатический ненасыщенный двухвалентный радикал с 2 атомами углерода, в частности этилен;
- C2-алкинилен означает радикал -С≡С-;
- алкокси означает радикал -О-алкил с алифатической насыщенной линейной или разветвленной цепочкой;
- тиоалкил означает радикал -S-алкил с алифатической насыщенной линейной или разветвленной цепочкой;
- фторалкил означает алкильный радикал, в котором один или несколько атомов водорода замещены атомом фтора;
- фторалкокси означает алкоксильный радикал, в котором один или несколько атомов водорода замещены атомом фтора;
- фтортиоалкил означает тиоалкильный радикал, в котором один или несколько атомов водорода замещены атомом фтора;
- атом галогена означает фтор, хлор, бром или иод.
Соединения по настоящему изобретению могут быть получены различными способами, проиллюстрированными приведенными далее схемами.
Так, по первому способу (схема 1) соединения общей формулы (I) могут быть получены приведением во взаимодействие амина общей формулы (IV), в котором R1, G, A, p и n такие же, как и указанные в общей формуле (I), с карбонатом общей формулы (IIIa), в которой V представляет собой атом водорода или нитрогруппу, R такой же, как и указанный в общей формуле (I), и R представляет собой метильную или этильную группу. Сложный эфир карбаминовой кислоты общей формулы (II), полученный так же, в последствие превращают в соединение общей формулы (I), аминолизом амином общей формулы R3NH2, в которой R3 такой же, как и указанный в общей формуле (I). Реакция аминолиза может быть проведена в растворителе, таком как метанол или этанол, или в смеси растворителей, таких как метанол и тетрагидрофуран.
Схема 1

Другой способ (схема 2) получения соединения общей формулы (I) состоит в приведении во взаимодействие производного пиперазина или гомопиперазина общей формулы (VII), в которой PG представляет собой защитную группу, такую как трет-бутилоксикарбонил (Boc), с карбонатом общей формулы (IIIb), в которой V представляет собой атом водорода или нитрогруппу, и R2 и R3 такие же, как и указанные в общей формуле (I), с последующим удалением защитной группы из полученного соединения, например, в присутствии раствора соляной кислоты в растворителе, таком как изопропанол. Амид карбаминовой кислоты общей формулы (V), полученный так же, превращают впоследствие в соединение общей формулы (I) взаимодействием с производным общей формулы (VI), в которой R1, G, p и A такие же, как и указанные в общей формуле (I), и W представляет собой атом хлора, брома или иода, или мезилат, или тозилат. Реакция N-алкилирования может быть осуществлена в растворителе, таком как ацетонитрил или толуол, в присутствии основания, такого как карбонат калия или диизопропилэтиламин.
Схема 2

Соединения общей формулы (I), (II) и (IV), в которой R1 представляет собой радикал типа арил-арил, арил-гетероарил, гетероарил-арил или гетероарил-гетероарил, могут быть получены равным образом взаимодействием соответствующих соединений общей формулы (I), (II) и (IV), в которых R4 замещен атомом хлора, брома, иода или трифторментансульфонилом в позиции, в которой должен быть введен радикал R6, с производным арил- или гетероарилбороновой кислоты в соответствии с условиями реакции Suzuki (Chem. Rev. 1995, 95, 2457-2483) или с производным арил- или гетероарил-триалкилстаннана в соответствии с условиями реакции Stille (Angew. Chem. Int. Ed. 1986, 25, 504-524).
Карбонаты общей формулы (IIIa) и (IIIb) могут быть получены по любому описанному в литературе способу, например, взаимодействием соответствующего спирта общей формулы HOCHR2COOR, в которой R представляет собой метильную или этильную группу, или HOCHR2CONHR3, в которой R3 такой же, как и указанный в общей формуле (I), с фенил- или 4-нитрофенилхлорформиатом в присутствии основания, такого как триэтиламин или диизопропилэтиламин.
Соединения общей формулы (IV), (VI) и (VII) так же, как и амины общей формулы R3NH2, для которых не приведен способ получения, имеются в продаже, или описаны в литературе, или могут быть получены по разным способам, описанным в литературе или известным специалисту в данной области техники.
Объектом настоящего изобретения в одном из других его аспектов являются в равной мере соединения формулы (II) и (V). Данные соединения применяют в качестве промежуточных в синтезе соединений формулы (I).
Следующие примеры приведены для иллюстрации получения некоторых соединений по настоящему изобретению. Примеры не являются исчерпывающими и приведены только для иллюстрации настоящего изобретения. Результаты микроанализа, спектры ИК и ЯМР и/или ЖХ-МС (жидкостная хроматография с масс-спектрометрическим окончанием) подтверждают структуры и чистоту полученных соединений.
PF (°C) означает температуру плавления в градусах Цельсия. Номера, указанные в скобках в названиях примеров, соответствуют номерам первой колонки приведенной далее таблицы.
Пример 1 (соединение № 85)
2-(метиламино)-2-оксоэтил-транс-4-(3-фенилпроп-2-ен-1-ил)пиперазин-1-карбоксилат
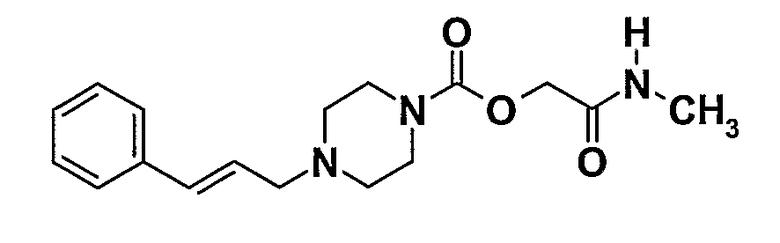
1.1. 2-(Этокси)-2-оксоэтил-транс-4-(3-фенилпроп-2-ен-1-ил)пиперазин-1-карбоксилат
Нагревают при 80°C в течение ночи раствор 1,40 г (6,93 ммоль) транс-1-циннамилпиперазина и 1,74 г (7,76 ммоль) этил{[(фенокси)карбонил]окси}ацетата (J. Med. Chem., 1999, 42, 277-290) в 15 мл толуола. Выпаривают досуха и обрабатывают 50 мл этилацетата. Промывают водой 2 раза по 20 мл и 1 раз 10 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и выпаривают досуха. Остаток очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 50/50, затем этилацетатом и получают 0,814 г продукта в виде бледно-желтого масла.
1.2. 2-(Метиламино)-2-оксоэтил-транс-4-(3-фенилпроп-2-ен-1-ил)пиперазин-1-карбоксилат
Растворяют 0,8 г (2,4 ммоль) 2-(этокси)-2-оксоэтил-транс-4-(3-фенилпроп-2-ен-1-ил)пиперазин-1-карбоксилата, полученного на стадии 1.1, в 10 мл 2 М раствора метиламина (20 ммоль) в метаноле. Выдерживают в течение полутора часов при комнатной температуре и выпаривают досуха. Остаток очищают хроматографией на силикагеле элюированием сначала этилацетатом, затем смесью этилацетата и метанола в соотношении 90/10. Получают 0,548 г белого порошка.
Температура плавления (°C): 109-111
ЖХ-МС: M+H = 318
1Н ЯМР (ДМСО-d6): δ (м.д.): 7,80 (с широкий, 1H); 7,50-7,15 (м, 5H); 6,55 (д, 1H); 6,25 (тд, 1H); 4,40 (с, 2H); 3,40 (м, 4H); 3,10 (д, 2H); 2,60 (д, 3H); 2,40 (м, 4H).
Пример 2 (соединение № 99)
2-(метиламино)-2-оксоэтил-4-{3-[3-(трифторметил)фенил]проп-2-ин-1-ил}диазепан-1-карбоксилат
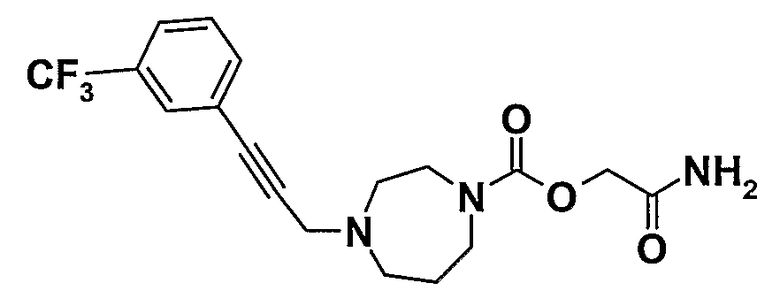
2.1. 4-{3-[3-(Трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепан-1-карбальдегид
Нагревают при 80°C смесь 1,28 г (10 ммоль) 1,4-диазепан-1-карбальдегида и 0,33 г (11 ммоль) параформальдегида в 13 мл диоксана до получения гомогенного раствора. Прибавляют раствор 1,70 г (10 ммоль) 3-трифторметилфенилацетилена в 7 мл диоксана и 1,81 г (10 ммоль) диацетата меди. Нагревают при 80°C в течение 4 часов. Охлаждают до комнатной температуры и растворяют в 75 мл этилацетата. Промывают органическую фазу 25 мл 30%-ного раствора аммиака, затем насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия и выпаривают досуха. Остаток очищают хроматографией на силикагеле элюированием смесью дихлорметана, метанола и 30%-ного раствора аммиака в соотношении 98/2/0,2, затем в соотношении 96/4/0,4 и 94/6/0,6 и получают 2,67 г продукта в виде желтого масла.
2.2. 4-{3-[3-(Трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепан
Растворяют 2,63 г (8,48 ммоль) 4-{3-[3-(трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепан-1-карбальдегида, полученного на стадии 2.1, в 7,5 мл метанола. Прибавляют 3,5 мл 35%-ного водного раствора гидроксида натрия (30 ммоль) и кипятят с обратным холодильником в течение 3 часов. Охлаждают до комнатной температуры. Растворяют в 20 мл воды и 75 мл дихлорметана. Декантируют, затем экстрагируют из водной фазы дихлорметаном 2 раза по 25 мл. Промывают органическую фазу 25 мл воды, затем 25 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и выпаривают досуха с получением 2,25 г продукта в виде красного масла, которое используют в таком виде на следующей стадии.
2.3. 2-(Этилокси)-2-оксоэтил-4-{3-[3-(трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепан-1-карбоксилат
Нагревают при 60°C в течение ночи раствор 2,25 г (7,95 ммоль) 4-{3-[3-(трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепана, полученного на стадии 2.2, и 2,68 г (11,9 ммоль) этил{[(фенилокси)карбонил]окси}ацетата в 10 мл толуола. Прибавляют 5 г диоксида кремния и выпаривают досуха. Остаток очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 60/40, затем в соотношении 40/60, затем этилацетатом и получают 2,42 г продукта в виде оранжевого масла.
2.4. 2-(Амино)-2-оксоэтил-4-{3-[3-(трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепан-1-карбоксилат
Растворяют 0,77 г (1,87 ммоль) 2-(этилокси)-2-оксоэтил-4-{3-[3-(трифторметил)фенил]проп-2-ин-1-ил}-1,4-диазепан-1-карбоксилата, полученного на стадии 2.3, в 14 мл 7 М раствора аммиака (98 ммоль) в метаноле. Выдерживают в течение ночи при комнатной температуре, затем прибавляют 2 г диоксида кремния и выпаривают досуха. Остаток очищают хроматографией на силикагеле элюированием смесью дихлорметана, метанола и 30%-ного раствора аммиака в соотношении 97/3/0,3, затем в соотношении 95/5/0,5 и 93/7/0,7. Далее перекристаллизовывают из смеси этилацетата и диизопропилового эфира и получают 0,57 г белых кристаллов.
Температура плавления (°C): 102-104
ЖХ-МС: M + H = 384
1Н ЯМР (CDCl3) δ (м.д.): 7,70 (с, 1H); 7,55 (м, 2H); 7,45 (д, 1H); 6,15 (м широкий, 1H); 5,50 (м широкий, 1H); 4,65 (с, 2H); 3,65 (м+с, 6H); 2,85 (м, 4H); 1,95 (м, 2H).
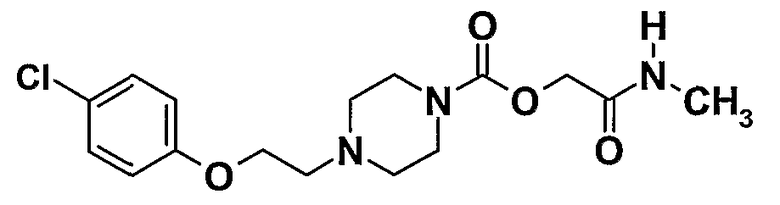
Пример 3 (соединение № 130)
2-(метиламино)-2-оксоэтил-4-{2[(4-хлорфенил)окси]этил}пиперазин-1-карбоксилат
3.1. 2-(метиламино)-2-оксоэтил-4-нитрофенилкарбонат
К суспензии 2,62 г (29,4 ммоль) 2-гидрокси-N-метилацетамида и 16,5 г (58,7 ммоль) диизопропилэтиламина на носителе (Ps-DIEA d'Argonaut, удельная емкость = 3,56 ммоль/г) в 250 мл дихлорметана прибавляют малыми порциями при комнатной температуре 5,93 г (29,4 ммоль) 4-нитрофенилхлорформиата. Затем перемешивают на аппарате с орбитальным вращением при комнатной температуре в течение 16 часов. Отфильтровывают осмол, промывают 150 мл дихлорметана и концентрируют фильтрат при пониженном давлении. Получают 6 г продукта в виде светло-желтого твердого вещества, которое используют в таком виде на следующей стадии.
3.2. 1,1-Диметилэтил-2-(метиламино)-2-оксоэтилпиперазин-1,4-дикарбоксилат
К охлажденному до 0°C раствору 1,1 г (3 ммоль) 2-(метиламино)-2-оксоэтил-4-нитрофенилкарбоната, полученного на стадии 3.1, в 10 мл 1,2-дихлорэтана прибавляют по каплям при температуре около 0°C раствор 0,53 г (2,85 ммоль) 1,1-диметилэтилпиперазин-1-карбоксилата в 5 мл дихлорэтана. Далее перемешивают при температуре 0°C в течение 1 часа, затем при комнатной температуре в течение 3 часов.
Концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 20/80, увеличивая постепенно долю этилацетата для того, чтобы закончить элюирование только этилацетатом. Затем растирают в диизопропиловом эфире и получают 0,61 г продукта в виде белого твердого вещества, которое используют в таком виде на следующей стадии.
3.3. Хлоргидрат 2-(метиламино)-2-оксоэтилпиперазин-1-карбоксилата
К раствору 2,68 г (8,9 ммоль) 1,1-диметилэтил-2-(метиламино)-2-оксоэтилпиперазин-1,4-дикарбоксилата, полученного на стадии 3.2, в 25 мл дихлорметана прибавляют 25 мл 6 н. раствора соляной кислоты в изопропаноле. Затем перемешивают при комнатной температуре в течение 1 часа. Отделяют органическую фазу фильтрованием через гидрофобный патрон и концентрируют при пониженном давлении. После растирания в изопропаноле получают 2,05 г продукта.
Температура плавления (°C): 167 -169°C
3.4. 2-(Метиламино)-2-оксоэтил-4-{2[(4-хлорфенил)окси]этил}пиперазин-1-карбоксилат
Нагревают при 85°C в течение 16 часов раствор 0,073 г (0,3 ммоль) хлоргидрата 2-(метиламино)-2-оксоэтилпиперазин-1-карбоксилата, полученного на стадии 3.3, 0,13 г (0,9 ммоль) карбоната калия и 0,069 г (0,29 ммоль) 1-(2-бромэтокси)-4-хлорбензола в 3 мл ацетонитрила.
После охлаждения до комнатной температуры фильтруют твердую фазу через патрон, снабженный пористой стеклянной пластиной и содержащий целит. Промывают ацетоном и концентрируют при пониженном давлении. После хроматографирования на силикагеле элюированием смесью дихлорметана и метанола в соотношении 95/5 последующей кристаллизацией из диизопропилового эфира получают 0,089 г продукта в виде белого твердого вещества.
ЖХ-МС: M+H = 356
Температура плавления (°C): 159-161°C
1Н ЯМР (CDCl3) δ (м.д.): 7,25 (дд, 2H); 6,85 (дд, 2H); 6,05 (с широкий, 1H); 4,60 (с, 2H); 4,10 (т, 2H); 3,55 (м, 4H); 2,90 (д, 3H); 2,85 (т, 2H); 2,60 (м, 4H).
Пример 4 (соединение № 25)
2-(Метиламино)-2-оксоэтил-4-(2-нафталин-2-илэтил)пиперазин-1-карбоксилат

К охлажденному до 0°C раствору 0,13 г (0,75 ммоль) 2-нафталин-2-илэтанола и 0,19 мл (1,13 ммоль) диизопропилэтиламина в 7,5 мл дихлорметана прибавляют 0,07 мл (0,9 ммоль) хлористого метансульфонила. Далее перемешивают на холоду в течение 0,5 часа, затем при комнатной температуре в течение 2 часов. Концентрируют при пониженном давлении.
Обрабатывают остаток 5 мл ацетонитрила, прибавляют 0,12 г (0,5 ммоль) хлоргидрата 2-(метиламино)-2-оксоэтилпиперазин-1-карбоксилата, полученного по примеру 3.3, и 0,20 г (1,5 ммоль) карбоната калия. Нагревают при 70°C в течение 16 часов. После охлаждения до комнатной температуры концентрируют при пониженном давлении. Остаток суспендируют в дихлорметане и промывают насыщенным раствором бикарбоната натрия, затем водой. Отделяют органическую фазу фильтрованием через гидрофобную мембрану и концентрируют при пониженном давлении. После хроматографирования на силикагеле элюированием смесью дихлорметана и метанола в соотношении 95/5 последующей кристаллизацией из диизопропилового эфира получают 0,069 г продукта в виде белого твердого вещества.
ЖХ-МС: M+H = 356
Температура плавления: 133-135°C
1Н ЯМР (CDCl3) δ (м.д.): 7,85 (м, 3H); 7,65 (с, 1H); 7,55-7,30 (м, 3H); 6,05 (с широкий, 1H); 4,60 (с, 2H); 3,55 (м, 4H); 3,05-2,65 (м, 7H); 2,55 (м, 4H).
Пример 5 (соединение № 50)
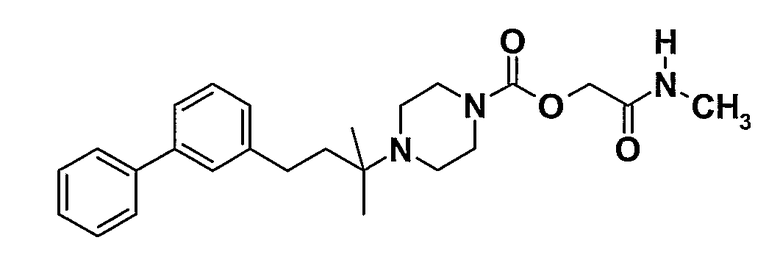
Хлоргидрат 2-(метиламино)-2-оксоэтил-4-(3-дифенил-3-ил-1,1-диметилпропил)пиперазин-1-карбоксилат
5.1. 1-(2,2-Диметилпропаноил)-4-(1,1-диметилпроп-2-ин-1-ил)пиперазин
Растворяют 0,756 г (6 ммоль) 1,1-диметилпроп-2-ин-1-илацетата (J. Org. Chem. 1994, 59, 2282-2284) и 2,235 г (12 ммоль) 1,1-диметилэтилпиперазин-1-карбоксилата в 9 мл тетрагидрофурана, затем прибавляют 0,059 г (0,6 ммоль) хлористой меди. Кипятят с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры прибавляют 100 мл этилацетата, 10 мл 1 н. водного раствора гидроксида натрия и 2 мл 30%-ного раствора аммиака. Декантируют органическую фазу, промывают водой 2 раза 10 мл, затем 10 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и выпаривают. Остаток очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 85/15, затем в соотношении 75/25 и 65/35 и получают 1,19 г (4,71 ммоль) продукта в виде бледно-желтого твердого вещества.
Температура плавления: 106-109°C
5.2. 1-(3-Дифенил-3-ил-1,1-диметилпроп-2-ин-1-ил)-4-(2,2-диметилпропаноил)пиперазин
Растворяют 1,05 г (4,5 ммоль) 3-бромдифенила и 0,9 г (3,6 ммоль) 1-(2,2-диметилпропаноил)-4-(1,1-диметилпроп-2-ин-1-ил)пиперазина, полученного на стадии 5.1, 0,75 мл (5,38 ммоль) триэтиламина и 0,028 г (0,11 ммоль) трифенилфосфина в 8 мл тетрагидрофурана. В атмосфере аргона прибавляют 0,126 г (0,18 ммоль) комплекса дихлорида бис(трифенилфосфин)палладия. Перемешивают в течение 15 мин, затем прибавляют 0,014 г (0,07 ммоль) иодистой меди. Далее перемешивают при комнатной температуре в течение 4 часов, затем при 60°C в течение ночи. После охлаждения до комнатной температуры растворяют в 25 мл этилацетата и фильтруют через бумажный фильтр. Промывают твердое вещество этилацетатом 4 раза по 10 мл. Прибавляют к фильтрату 4 г диоксида кремния и выпаривают досуха. Очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 90/10, затем в соотношении 80/20 и 70/30 и получают 0,90 г (2,22 ммоль) продукта в виде оранжевого масла.
5.3. 1,1-Диметилэтил-4-(3-дифенил-3-ил-1,1-диметилпропил)пиперазин-1-карбоксилат
Растворяют 0,87 г (2,15 ммоль) 1-(3-дифенил-3-ил-1,1-диметилпроп-2-ин-1-ил)-4-(2,2-диметилпропаноил)пиперазина, полученного на стадии 5.2, в смеси 5 мл метанола и 15 мл этилацетата. Прибавляют 0,2 г оксида платины и перемешивают в атмосфере водорода под давлением 40 фунт/кв. дюйм в течение 6 часов. Фильтруют через бумажный фильтр и промывают этилацетатом 3 раза по 10 мл. Прибавляют к фильтрату 2 г диоксида кремния и выпаривают досуха. Очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 90/10, затем в соотношении 85/15 и 80/20 и получают 0,36 г (0,88 ммоль) продукта в виде бесцветного масла.
5.4. 1-(3-Дифенил-3-ил-1,1-диметилпропил)пиперазин
Прибавляют 0,65 мл (8,4 ммоль) трифторуксусной кислоты к раствору 0,35 г (0,86 ммоль) 1,1-диметилэтил-4-(3-дифенил-3-ил-1,1-диметилпропил)пиперазин-1-карбоксилата, полученного на стадии 5.3, в 5 мл дихлорметана. Перемешивают в течение 2 часов, затем прибавляют еще 0,65 мл трифторуксусной кислоты. Дополнительно перемешивают в течение 2 часов, затем растворяют в 10 мл 1,2-дихлорэтана и выпаривают досуха. Обрабатывают остаток смесью 50 мл дихлорметана и 20 мл 15%-ного водного раствора гидроксида натрия. Декантируют и экстрагируют из водной фазы дихлорметаном 2 раза по 20 мл.
Органическую фазу промывают 10 мл воды, затем 20 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия, выпаривают и получают 0,25 г (0,81 ммоль) продукта в виде желтого масла.
5.5. Хлоргидрат 2-(метиламино)-2-оксоэтил-4-(3-дифенил-3-ил-1,1-диметилпропил)пиперазин-1-карбоксилат
Нагревают при 60°C в течение ночи раствор 0,25 г (0,81 ммоль) 1-(3-дифенил-3-ил-1,1-диметилпропил)пиперазина, полученного на стадии 5.4, и 1,5 г (1,22 ммоль) этил{[(фенилокси)карбонил]окси}ацетата, затем выпаривают досуха. Растворяют остаток смесью 4 мл 2 М раствора диметиламина (8 ммоль) в тетрагидрофуране и 2 мл метанола. Выдерживают в течение ночи, затем прибавляют 1 г диоксида кремния и выпаривают. Продукт очищают хроматографией на силикагеле элюированием смесью дихлорметана и метанола в соотношении 98/2, затем в соотношении 96/4 и 94/6 и получают 0,23 г (0,54 ммоль) продукта в виде бесцветной камеди.
Растворяют продукт в 5 мл этилацетата и прибавляют 1 мл 5 н. раствора соляной кислоты в изопропаноле. Выпаривают досуха. Обрабатывают остаток 15 мл горячего этилацетата. Отфильтровывают твердое вещество, промывают этилацетатом 2 раза по 3 мл, высушивают и получают 0,215 г (0,46 ммоль) продукта в виде белого порошка.
ЖХ-МС: M+H = 424
Температура плавления: 212-216°C (с разложением)
1Н ЯМР (CDCl3) δ (м.д.): 12,50 (с широкий, 1H); 7,55 (д, 2H); 7,40 (м, 6H); 7,20 (д, 1H); 6,05 (с широкий, 1H); 4,60 (с, 2H); 4,30-4,10 (м, 4H); 3,55 (д широкий, 2H); 3,05-2,75 (м+д, 5H); 2,15 (м, 2H); 1,70 (с, 8H).
Пример 6 (соединение № 29)
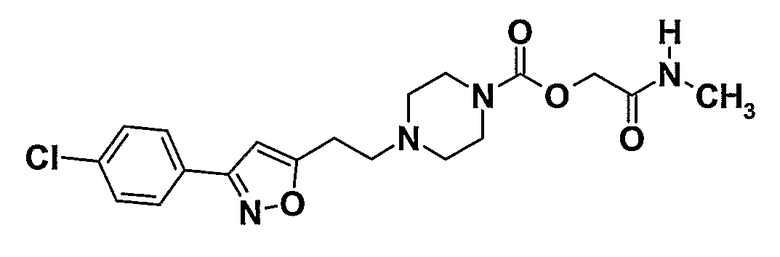
2-(Метиламино)-2-оксоэтил-4-{2-[3-(4-хлорфенил)изоксазол-5-ил]этил}пиперазин-1-карбоксилат
6.1. 2-[3-(4-Хлорфенил)изоксазол-5-ил]этанол
Прибавляют по каплям 1,63 мл (11,58 ммоль) триэтиламина к раствору 1,18 мл (15,57 ммоль) бут-4-ин-1-ола и 2,0 г (10,52 ммоль) хлористого 4-хлор-N-гидроксибензолкарбоксимидоила (J. Med. Chem. 1998, 41, 4556-4566) в 30 мл дихлорметана, охлажденного на бане со льдом. Выдерживают в течение ночи при комнатной температуре. Прибавляют 50 мл дихлорметана и промывают водой 2 раза по 50 мл, затем 50 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и выпаривают. Остаток очищают хроматографией на силикагеле элюированием смесью циклогексана и этилацетата в соотношении 80/20, затем в соотношении 70/30 и получают 1,1 г (4,91 ммоль) продукта в белого твердого вещества.
Температура плавления: 65-67°C
6.2. 2-(Метиламино)-2-оксоэтил-4-{2-[3-(4-хлорфенил)изоксазол-5-ил]этил}пиперазин-1-карбоксилат
К раствору 0,100 г (0,447 ммоль) 2-[3-(4-хлорфенил)изоксазол-5-ил]этанола, полученного на стадии 6.1, и 0,082 мл (0,47 ммоль) диизопропилэтиламина в 5 мл дихлорметана прибавляют 0,036 мл (0,469 ммоль) хлористого метансульфонила. Перемешивают при комнатной температуре в течение 4 часов, затем промывают насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия. Концентрируют при пониженном давлении. Обрабатывают остаток 5 мл ацетонитрила, прибавляют 0,107 г (0,45 ммоль) хлоргидрата 2-(метиламино)-2-оксоэтилпиперазин-1-карбоксилата, полученного по примеру 3.3, и 0,186 г (1,35 ммоль) карбоната калия. Нагревают при 75°C в течение 16 часов. После охлаждения до комнатной температуры концентрируют при пониженном давлении. Обрабатывают остаток этилацетатом и промывают водой, затем насыщенным водным раствором хлорида натрия. Выпаривают и остаток очищают хроматографией на силикагеле элюированием дихлорметаном, затем смесью дихлорметана и метанола в соотношении 90/10. Получают 0,054 г (0,132 ммоль) продукта в виде белого твердого вещества.
ЖХ-МС: M+H = 407
Температура плавления: 130-132°C
1Н ЯМР (ДМСО-d6) δ (м.д.): 7,85 (д, 2H); 7,75 (массив, 1H); 7,55 (д, 2H); 6,85 (с, 1H); 4,40 (с, 2H); 3,40 (м, 4H); 2,95 (т, 2H); 2,70 (т, 2H); 2,55 (д, 3H); 2,40 (м, 4H).
Пример 7 (соединение № 52)
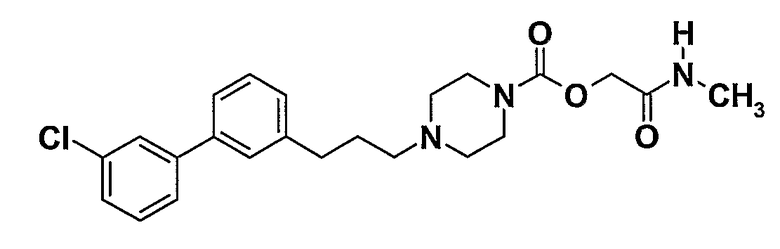
2-(Метиламино)-2-оксоэтил-4-[3-(3'-хлордифенил-3-ил)пропил]пиперазин-1-карбоксилат
7.1. 3-(3-Бромфенил)пропан-1-ол
К суспензии 1,84 г (8 ммоль) 3-(3-бромфенил)пропионовой кислоты и 0,91 г (24 ммоль) боргидрида натрия в 20 мл ТГФ, охлажденной до 0°С, прибавляют малыми порциями 3,2 мл (25 ммоль) комплекса трифторборандиэтилового эфира. Далее перемешивают на холоду в течение 1 часа, затем при комнатной температуре в течение 16 часов. Охлаждают реакционную массу до 0°C и нейтрализуют до рН=7˜8 добавлением 1 н. водного раствора гидроксида натрия. Концентрируют при пониженном давлении, затем остаток обрабатывают водой. Экстрагируют дихлорметаном и сушат над сульфатом натрия. После фильтрования органическую фазу концентрируют при пониженном давлении. Получают 1,62 г (7,53 ммоль) продукта в виде масла, которое используют в таком виде на следующей стадии.
7.2. 2-(Метиламино)-2-оксоэтил-4-[3-(3-бромфенил)пропил]пиперазин-1-карбоксилат
К раствору 0,157 г (6,7 ммоль) 3-(3-бромфенил)пропан-1-ола, полученного на стадии 7.1, и 1,73 мл (10,1 ммоль) диизопропилэтиламина в 38 мл дихлорметана, охлажденного до 0°C, прибавляют 0,63 мл (8,14 ммоль) хлористого метансульфонила. Далее перемешивают на холоду в течение 0,5 часа, затем при комнатной температуре в течение 2 часов. Концентрируют при пониженном давлении, затем остаток суспендируют в 35 мл ацетонитрила. Прибавляют 1,34 г (5,35 ммоль) хлоргидрата 2-(метиламино)-2-оксоэтилпиперазин-1-карбоксилата, полученного по примеру 3.3, и 2,2 г (16 ммоль) карбоната калия. Нагревают при 75°С в течение 16 часов. После охлаждения до комнатной температуры концентрируют при пониженном давлении, затем остаток обрабатывают водой. Экстрагируют этилацетатом и сушат над сульфатом натрия. После фильтрования органическую фазу концентрируют при пониженном давлении. Очищают хроматографией на силикагеле элюированием смесью дихлорметана и метанола в соотношении 98/2. После кристаллизации из диизопропилового эфира получают 0,84 г (2,10 ммоль) белых кристаллов.
7.3. 2-(Метиламино)-2-оксоэтил-4-[3-(3'-хлордифенил-3-ил)пропил]пиперазин-1-карбоксилат
К суспензии 0,14 г (0,35 ммоль) 2-(метиламино)-2-оксоэтил-4-[3-(3-бромфенил)пропил]пиперазин-1-карбоксилата, полученного на стадии 7.2, в смеси 4 мл толуола и 0,6 мл этанола прибавляют 0,08 г (0,07 ммоль) комплекса тетракис(трифенилфосфин)палладия, 1,05 мл (2,1 ммоль) водного 2 М раствора карбоната натрия и 0,22 г (1,4 ммоль) 3-хлорбензолбороновой кислоты. Нагревают при 150°C микроволновым излучением в течение 5 мин и выделяют органическую фазу фильтрованием через патрон, снабженный пористой стеклянной пластиной и содержащий целит и сульфат натрия. Промывают толуолом и концентрируют фильтрат при пониженном давлении. Продукт очищают хроматографией на силикагеле элюированием смесью этилацетата и метанола в соотношении 90/10. Затем обрабатывают н-гептаном и получают 0,086 г (0,18 ммоль) продукта в виде белых кристаллов.
ЖХ-МС: M+H = 430
Температура плавления: 82-85°C
1Н ЯМР δ (м.д.): 7,35 (м, 8H); 6,05 (с широкий, 1H); 4,6 (с, 2H); 3,55 (м, 4H); 2,85 (д, 3H); 2,75 (т, 2H); 2,45 (м, 6H); 1,9 (м, 2H).
Таблица 1, приведенная далее, дана для иллюстрации химической структуры и физических свойств некоторых соединений по настоящему изобретению. В колонке "основание или соль" "основание" обозначает соединение в виде свободного основания, тогда как "HCl" обозначает соединение в виде хлоргидрата.
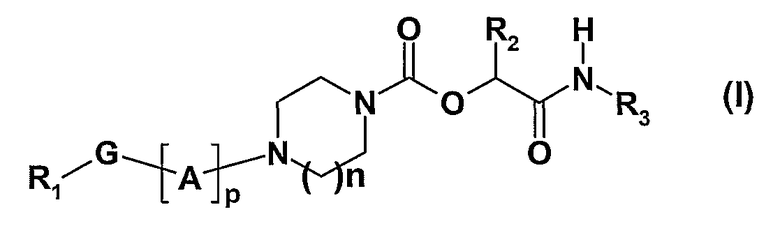
Соединения по настоящему изобретению были объектом фармакологических испытаний, позволивших определить их эффект ингибирования фермента FAAH (гидролазы амидов жирных кислот).
Ингибирующую активность устанавливали по радиоферментативному тесту, основанному на измерении продуктов гидролиза (этаноламин [1-3H]) анандамида [этаноламин 1-3H] ферментом FAAH (Life Sciences (1995), 56, 1999-2005 и Journal of Pharmacology and Experimental Therapeutics (1997), 283, 729-734). Так, головной мозг мышей (без мозжечка) извлекали и консервировали при -80°C. Мембранные гомогенаты готовили перед использованием гомогенизацией тканей Polytron в буферном растворе Tris-HCl 10 ммоль (pH=8), содержавшем 150 ммоль NaCl и 1 ммоль ЭДТА. Далее проводили ферментативную реакцию в 70 мкл буферного раствора, содержавшего альбумин бычьей сыворотки без жирных кислот (1 мг/мл). Последовательно добавляли испытуемые соединения различных концентраций, анандамид [этаноламин 1-3H] (удельная активность 15-20 Ки/ммоль), разбавленного 10 мкл охлажденного анандамида, и мембранный препарат (400 мкг замороженной для испытаний ткани). После выдержки в течение 15 мин при 25°C ферментативную реакцию останавливали добавлением 140 мкл смеси хлороформ/метанол (2:1). Смесь перемешивали в течение 10 мин, затем центрифугировали в течение 15 мин при 3500 g. Для аликвоты (30 мкл) водной фазы, содержавшей этаноламин [1-3H], проводили жидкостную сцинтилляцию.
В этих условиях наиболее активные соединения по настоящему изобретению показывают CI50 (концентрация, ингибирующая на 50% ферментативную активность FAAH) от 0,001 до 1 мкмоль включительно.
В таблице 2, приведенной далее, даны значения CI50 для некоторых соединений по настоящему изобретению.
Таким образом, представляется, что соединения по настоящему изобретению обладают ингибирующим действием на фермент FAAH.
Активность in vivo соединений по настоящему изобретению оценивали по тесту на аналгетическое действие.
Так, интраперитонеальное введение (i.p.) PBQ (фенилбензохинон, 2 мг/кг в 0,9%-ном растворе хлорида натрия, содержащего 5% этанола) самцам мышей OF1 массой от 25 до 30 г вызывало брюшинное растягивание, в среднем 30 скручиваний или сокращений в течение периода от 5 до 15 мин после инъекции. Испытуемые соединения вводили перорально (p.o.) или интраперитонеально (i.p.) в виде суспензии Tween 80 с концентрацией 0,5% за 60 или 120 мин до введения PBQ. В этих условиях наиболее действующие соединения по настоящему изобретению уменьшают от 35 до 70% число сокращений, вызываемых введением PBQ, в интервале доз от 1 до 30 мг/кг включительно. Например, соединения № 49 и № 69 таблицы уменьшают на 43 и 47% соответственно число сокращений, вызываемых PBQ, при дозе 10 мг/кг при пероральном введении за 120 мин.
Фермент FAAH (Chemistry and Physics of Lipids, (2000), 108, 107-121) катализирует гидролиз эндогенных производных амидов и эфиров различных жирных кислот, таких как N-арахидоноилэтаноламин (анандамид), N-пальмитоилэтаноламин, N-олеоилэтаноламин, олеамид или 2-арахидоноилглицерин. Данные соединения проявляют различную фармакологическую активность, взаимодействуя также с рецепторами каннабиноидов и ванилоидов. Соединения по настоящему изобретению блокируют такой путь деградации и увеличивают уровень содержания в тканях данных эндогенных субстанций. Они могут быть применены в этом аспекте для предупреждения и лечения патологий, при которых показано применение эндогенных каннабиноидов и/или любых других субстратов, метаболизируемых ферментом FAAH. В качестве примеров можно указать следующие заболевания и болезненные состояния: боль, особенно острые или хронические боли неврогенного типа: мигрень, невропатические боли, включая формы, ассоциированные с вирусом герпеса и диабетом, острые или хронические боли, ассоциированные с воспалительными заболеваниями: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулит, болезнь Крона, синдром раздраженной толстой кишки, периферические острые или хронические боли, головокружение, рвота, тошнота, в частности являющиеся следствием химиотерапии, затруднения при приеме пищи, в частности анорексия и кахексия различной природы, неврологические и психиатрические патологии: дрожание, дискинезия, дистония, спастичность, компульсивное и навязчивое поведение, синдром Туретта, любые формы депрессии и психические расстройства любой природы и происхождения, нарушение самочувствия, психозы, острые и хронические невродегенеративные заболевания: болезнь Паркинсона, болезнь Альцгеймера, старческое слабоумие, хорея Гетчинсона, повреждения, связанные с церебральной ишемией и черепными и костно-мозговыми травмами, эпилепсия, нарушения сна, включая приступы апноэ во сне, сердечно-сосудистые заболевания, в частности гипертензия, сердечная аритмия, артериосклероз, сердечный приступ, ишемия сердца, почечная ишемия, раковые заболевания: доброкачественные опухоли кожи, папилломы и опухоли мозга, опухоли простаты, опухоли мозга (глиобластомы, медуллоэпителиомы, нейробластомы, опухоли эмбрионального происхождения, астроцитомы, астробластомы, эпендимомы, олигодендроглиомы, опухоль сплетения, нейроэпителиомы, опухоль эпифиза, эпендимобластомы, злокачественные менингиомы, саркоматозы, злокачественные меланомы, шванномы), нарушения иммунной системы, особенно аутоимунные заболевания: псориаз, эритематозный люпус, заболевания соединительной ткани или диффузные болезни соединительной ткани, синдром Съергера, анкилозирующий спондилоартрит, недифференцированный спондилоартрит, болезнь Бехчета, аутоиммунные гемолитические анемии, рассеянный склероз, боковой амиотрофический склероз, реакция отторжения трансплантанта, заболевания, поражающие плазмоцитарную систему, аллергические заболевания: гиперчувствительность немедленного или замедленного типа, аллергические риниты или конъюнктивиты, контактные дерматиты, паразитарные, вирусные или бактериальные инфекционные заболевания: СПИД, менингиты, воспалительные заболевания, особенно болезни суставов: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулит, болезнь Крона, синдром раздраженной толстой кишки, остеопороз, заболевания глаз: гипертензия глаз, глаукома, легочные заболевания: заболевания дыхательных путей, бронхоспазмы, кашель, астма, хронический бронхит, хроническая обструкция дыхательных путей, эмфизема, желудочно-кишечные заболевания: синдром раздраженной толстой кишки, воспалительные кишечные заболевания, язвы, диарея, недержание мочи и воспаление мочевого пузыря.
Применение соединений по настоящему изобретению в виде фармацевтически приемлемых основания, кислотно-аддитивной соли, гидрата или сольвата для получения лекарственного средства, предназначенного для лечения ранее упомянутых патологий, в равной мере составляет часть изобретения.
Объектом изобретения в равной мере являются лекарственные средства, включающие в себя соединение формулы (I) или фармацевтически приемлемые кислотно-аддитивную соль, или также гидрат, или сольват соединения формулы (I). Данные лекарственные средсва находят применение в терапии, особенно при лечении ранее упомянутых патологий.
Настоящее изобретение в одном из других его аспектов относится к фармацевтическим композициям, включающим в себя в качестве активного вещества, по меньшей мере, соединение формулы (I) по настоящему изобретению. Данные фармацевтические композиции содержат эффективную дозу соединения по настоящему изобретению или фармацевтически приемлемых кислотно-аддитивной соли, или гидрата, или сольвата упомянутого соединения и при необходимости один или несколько фармацевтически приемлемых наполнителей.
Данные наполнители выбраны из традиционных наполнителей, известных специалисту в данной области техники, в соответствии с требуемыми фармацевтической формой и способом введения.
В фармацевтических композициях по настоящему изобретению, предназначенных для введения перорально, сублингвально, подкожно, внутримышечно, внутривенно, наружно, местно, интратекально, интраназально, чрезкожно, внутрилегочно, интраокулярно или ректально, ранее упомянутое активное вещество формулы (I) или его кислотно-аддитивной соли, возможного сольвата или гидрата, может вводиться в лекарственной форме стандартной дозы в смеси с традиционными фармацевтическими наполнителями животным и людям для профилактики или лечения ранее упомянутых нарушений или заболеваний.
Соответствующие лекарственные формы стандартной дозы для введения включают в себя формы для перорального приема, такие как таблетки, капсулы с мягкой или твердой желатиновой оболочкой, порошки, гранулы, жевательные резинки и растворы или суспензии для приема внутрь, формы для приема сублингвально, трансбуккально, внутритрахеально, интраокулярно, интраназально, внутрилегочно, формы для введения подкожно, внутримышечно или внутривенно и формы для введения ректально или вагинально. Для наружного применения соединения по настоящему изобретению можно применять в виде кремов, помад и лосьонов.
В качестве примера лекарственная форма стандартной дозы соединения по настоящему изобретению в форме таблеток может включать в себя следующие соединения:
Упомянутые лекарственные формы стандартной дозы дозируются для получения суточной дозы приема в интервале от 0,01 до 20 мг действующего вещества на кг массы в соответствии с галеновой формой.
Могут иметь место особые случаи, в которых дозы устанавливают увеличенными или уменьшенными, такие дозы в равной мере составляют часть настоящего изобретения. По принятой практике соответствующие дозы для каждого больного определяются врачом согласно со способом введения, массой и реакцией больного.
Настоящее изобретение в одном из других его аспектов в равной мере относится к способу лечения ранее упомянутых патологий, который включает в себя введение эффективной дозы соединения по настоящему изобретению, одной из его фармацевтически приемлемых кислотно-аддитивных солей, сольвата или гидрата упомянутого соединения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛПИПЕРИДИНКАРБОКСИЛАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH | 2005 |
|
RU2376305C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНАЛКИЛКАРБАМАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH | 2005 |
|
RU2384569C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛАЛКИЛКАРБАМАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH | 2005 |
|
RU2364586C2 |
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СООТВЕТСТВУЮЩИЕ СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2805511C2 |
| 5-СУЛЬФАНИЛ-4Н-1,2,4-ТРИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА | 2002 |
|
RU2367655C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2294326C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗО-ПИРИДИНА, ОБЛАДАЮЩИЕ СРОДСТВОМ К РЕЦЕПТОРУ МЕЛАНОКОРТИНА | 2004 |
|
RU2358974C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛИРОВАННЫХ ЦИКЛОПЕНТИЛПИРИМИДИНОВЫХ СОЕДИНЕНИЙ | 2013 |
|
RU2643811C2 |
| СОЕДИНЕНИЯ, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩИЕ НА BRM, И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2797832C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИМИДАЗОПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2004 |
|
RU2330023C2 |
Настоящее изобретение относится к соединениям формулы I
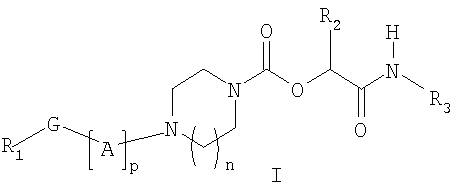
где n представляет собой целое число, равное 1 или 2; р представляет собой целое число, изменяемое от 1 до 7; А выбран из одного или нескольких радикалов X и/или Y; X представляет собой метиленовую группу, замещенную при необходимости одним или двумя C1-6-алкильными группами; Y представляет собой С2-алкенилен, С2-алкинилен; G представляет собой простую связь, кислород или С=O. Соединения могут найти применение в качестве ингибиторов фермента FAAH для лечения боли, воспаления или невродегенеративных заболеваний. Описаны также способы получения соединений, фармацевтическая композиция на их основе и применение. 8 н. и 3 з.п. ф-лы, 2 табл.

где n представляет собой целое число, равное 1 или 2;
р представляет собой целое число, варьирующееся от 1 до 7;
А выбран из одного или нескольких радикалов X и/или Y;
X представляет собой метиленовую группу, замещенную при необходимости одним или двумя С1-6-алкильными группами;
Y представляет собой либо С2-алкенилен, либо С2-алкинилен;
G представляет собой простую связь, атом кислорода или группу С=О;
R1 представляет собой радикал R4, замещенный при необходимости одним или несколькими радикалами R5 и/или R6;
R4 представляет собой радикал, выбранный из фенила, пиримидинила, тиазолила, пиразолила, изоксазолила, нафталинила, дифенилметила, хинолинила, индолила;
R5 представляет собой атом галогена или цианогруппу, С1-6-алкил, C1-6-алкокси, С1-6-фторалкил, С1-6-фторалкокси или -O-(С1-3-алкилен)-O;
R6 представляет собой фенил, бензилокси, нафталинил, радикал или радикалы R6, при необходимости, имеют заместители из одного или нескольких одинаковых или отличающихся один от другого радикалов R5;
R2 представляют собой атом водорода;
R3 представляют собой атом водорода или радикал С1-6-алкил, С3-7-циклоалкил, С3-7-циклоалкил-С1-3-алкил,
в форме основания, кислотно-аддитивной соли, гидрата или сольвата.
n представляет собой целое число, равное 1 или 2;
р представляет собой целое число, изменяемое от 1 до 7;
А выбран из одного или нескольких радикалов X и/или Y;
X представляет собой метиленовую группу, замещенную при необходимости одним или двумя радикалами C1-6-алкил;
Y представляет собой как радикал С2-алкенилен, так и радикал С2-алкинилен;
G представляет собой простую связь, атом кислорода или группу С=0;
R1 представляет собой радикал R4, замещенный при необходимости одним или несколькими радикалами R5 и/или R6;
R4 представляет собой радикал, выбранный из радикалов фенил, нафтил, дифенилметил, хинолинил, индолил, пиразолил, изоксазолил, пиримидинил, тиазолил;
R5 представляет собой атом галогена или цианогруппу, радикал C1-6-алкил, С1-6-алкокси, С1-6-фторалкил, С1-6-фторалкокси или -O-(С1-3-алкилен)-О;
R6 представляет собой радикал фенил, нафтил или бензилокси;
R2 представляют собой атом водорода;
R3 представляют собой атом водорода или радикал С1-6-алкил, С3-7-циклоалкил, С3-7-циклоалкил-С1-3-алкил,
в виде основания, кислотно-аддитивной соли, гидрата или сольвата.
n представляет собой целое число, равное 1;
р представляет собой целое число, изменяемое от 1 до 4;
А выбран из одного или нескольких радикалов X и/или Y;
X представляет собой метиленовую группу, замещенную при необходимости одним или двумя радикалами С1-6-алкил;
Y представляет собой радикал С2-алкинилен;
G представляет собой простую связь или атом кислорода;
R1 представляет собой радикал R4, замещенный при необходимости одним или несколькими радикалами R5 и/или R6;
R4 представляет собой радикал, выбранный из радикалов фенил, нафтил, изоксазолил;
R5 представляет собой атом галогена или цианогруппу, радикал C1-6-алкокси, С1-6-фторалкил;
R6 представляет собой фенильную группу;
R2 представляет собой атом водорода;
R3 представляет собой атом водорода или радикал С1-6-алкил, С3-7-циклоалкил, С3-7-циклоалкил-С1-3-алкил;
в виде основания, кислотно-аддитивной соли, гидрата или сольвата.
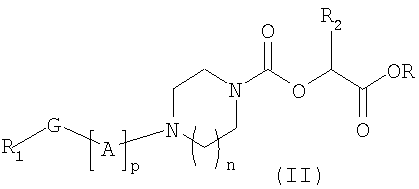
где R1, R2, G, A, p и n такие же, как и указанные в общей формуле (I) по п.1, и R представляет собой метильную или этильную группу, амином общей формулы R3NH2, в которой радикал R3 такой же, как и указанный в общей формуле (I).

где R2, R3 и n такие же, как и указанные в общей формуле (I) по п.1, взаимодействием с производным общей формулы R1-G-[A]p-W (VI), в которой R1, G, р и А такие же, как и указанные в общей формуле (I) по п.1, и W представляет собой атом хлора, брома или иода, или мезилат или тозилат.
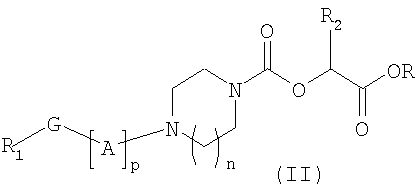
где R1, R2, G, А, р и n такие же, как и указанные в общей формуле (I) по п.1, и R представляет собой метильную или этильную группу.

где R2, R3 и n такие же, как и указанные в общей формуле (I) по п.1.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| DE 19816889, 21.10.1999. | |||
Авторы
Даты
2008-08-20—Публикация
2005-02-25—Подача