Перекрестные ссылки на родственные заявки
Данная заявка притязает на приоритет четырех предварительных заявок на патент США: 60/504901, поданной 22 сентября, 2003 г.; 60/494714, поданной 12 августа 2003 г.; 60/448,960, поданной 21 февраля 2003 г.; и 60/429,842, поданной 27 ноября 2002 г., каждая из которых для всех целей полностью включена в настоящее описание в качестве ссылки.
Предпосылки создания изобретения
Апоптоз представляет собой высококонсервативный процесс запрограммированной гибели клеток, важный для развития и тканевого гомеостаза всех многоклеточных организмов. Изменения апоптозного пути, препятствующие или замедляющие нормальное обновление клеток, могут быть столь же важны для патогенеза болезней, как и аномалии в регуляции клеточного цикла. Аналогично клеточному делению, которое контролируется комплексом взаимосвязей между регуляторными белками клеточного цикла, апоптоз в нормальных условиях регулируется путем взаимодействия продуктов генов, которые либо препятствуют, либо индуцируют гибель клеток.
Связанный с TNF апоптоз-индуцирующий лиганд (TNF-related apoptosis-inducing ligand, TRAIL, также называемый Apo2L) является представителем семейства цитокинов TNF. При связывании с DR4 или DR5, двумя представителями суперсемейства TNF-рецепторов, TRAIL индуцирует гибель клеток в результате апоптоза (см., например Pan и др. Science 277, 1997, cc.815-818; Sheridan и др., Science 277, 1997, cc.818-821 3; Walczak и др., ЕМВО J. 16, 1997, cc.5386-5397 4). Установлено, что in vitro TRAIL уничтожает опухолевые клетки, но является относительно нетоксичным для здоровых клеток.
Для лечения рака необходимо разработка новых терапевтических методов лечения. Задачей настоящего изобретения является решение этой и других проблем.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам индукции апоптоза раковых клеток. В некоторых вариантах осуществления изобретения способ заключается в том, что клетку приводят в контакт с (I.) агонистом, представляющим собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5 (агент-агонист); и (II.) апоптоз-индуцирующим агентом. В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А. В других вариантах осуществления изобретения агонист представляет собой антитело к DR4.
В некоторых вариантах осуществления изобретения клетку приводят в контакт с агонистом, представляющим собой антитело к DR4 (агонистическое антитело к DR4, антитело-агонист к DR4), и агонистом, представляющим собой антитело к DR5 (агонистическое антитело к DR5, антитело-агонист к DR5).
В некоторых вариантах осуществления изобретения агонист представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения агонист представляет собой одноцепочечное антитело.
В некоторых вариантах осуществления изобретения агент предотвращает или снижает экспрессию BCL-2 или UbcH10. В других вариантах осуществления изобретения агент препятствует активации NFκB. В некоторых вариантах осуществления изобретения агент препятствует расщеплению IkВ. В некоторых вариантах осуществления изобретения агент представляет собой ингибитор протеосомы. В некоторых вариантах осуществления изобретения ингибитор протеосомы выбран из группы, включающей PS-341, MG-262 и MG-132.
В некоторых вариантах осуществления изобретения агент представляет собой ингибитор белка-ингибитора апоптоза (IAP). В других вариантах осуществления изобретения этот ингибитор представляет собой SMAC или миметик SMAC.
В других вариантах осуществления изобретения агент представляет собой ингибитор полипептида, выбранного из группы, включающей плексин В1 (PLXNB1); несущий SET-домен белок 7 (SET7); киназу 5 киназы активируемой митогеном протеинкиназы (МАР3К5); SТЕ20-подобную киназу (JIК); сериновую/треониновую киназу 1, связывающую МАР-киназу (MKNK1); предполагаемый трансмембранный белок эндоплазматического ретикулума с несколькими связями (RFT1); 5-киназу типа I, гамма (PIP5K1C); активируемую протеинкиназой, активируемой митогеном, протеинкиназу 2 (МАРКАРК2); киназу 5 активируемой митогеном протеинкиназы (МАР2К5); зависящую от циклина киназу 6 (CDK6); рецептор 1 активина А, подобный рецептору типа II (ACVRL1); гомолог онкогена вируса Гарднера-Рашида саркомы кошачьих (v-fgr) (FGR); гипотетический белок FLJ21802 (FLJ21802); тирозинкиназу мышечно-скелетных рецепторов (MUSK); открытую рамку считывания 88 хромосомы 20 (C20orf88); при почковании не ингибируемый бензимидазолами гомолог 1 (гомолог дрожжей) (BUB1); полипептид 5 рибосомной протеин-S6-киназы, 90 кДа (RPS6KA5); связанный с вирусом саркомы Ямагучи гомолог онкогена v-yes-1 (LYN); активируемую митогеном протеинкиназу 7 (МАРК7) и гомолог 1 онкогена вируса мышиной тимомы v-akt (AKT1).
В некоторых вариантах осуществления изобретения агент представляет собой активатор полипептида, выбранного из группы, включающей: распознающую сигнал частицу с молекулярной массой 72 кДа (SRP72); каспазу-8; Bid; В-лимфоидную тирозинкиназу (BLK); генный продукт, аналогичный пируваткиназе, изозим М2 (LOC148283); киназу 3 альфа гликогенсинтазы (GSK3A); гипотетический белок FLJ32312 (FLJ32312); активируемую митогеном протеинкиназу 10 (МАРК10); TCF4 (фактор транскрипции 4), гомолог 2 онкогена вируса мышиного лейкоза Абелсона (Abelson) v-ab1 (arg, Abelson-родственный ген) (ABL2); гомолог 1 онкогена вируса саркомы птиц v-ros UR2 (ROS1) и гомолог онкогена вируса миелоцитоматоза птиц v-myc.
В некоторых вариантах осуществления изобретения раковая клетка представляет собой клетку рака ободочной кишки или клетку рака поджелудочной железы.
В других вариантах осуществления изобретения агент представляет собой антагонист РАК1. В некоторых вариантах осуществления изобретения агент представляет собой антагонист полипептида, выбранного из группы, включающей UbcH10, nsurf, stk12, Ask1 и JIIK. В других вариантах осуществления изобретения агент представляет собой молекулу siPHK (малая обладающая способностью к интерференции РНК).
Настоящее изобретение относится также к способам индукции апоптоза раковых клеток у индивидуума, который нуждается в этом. В некоторых вариантах осуществления изобретения способ заключается в том, что индивидууму вводят терапевтически эффективное количество (I.) агониста, представляющего собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5, и (II.) апоптоз-индуцирующего агента.
В некоторых вариантах осуществления изобретения агонист и агент вводят раздельно. В других вариантах осуществления изобретения агонист и агент вводят в смеси. В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR-5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А. В других вариантах осуществления изобретения агонист представляет собой антитело к DR4. В некоторых вариантах осуществления изобретения клетку приводят в контакт с агонистом, представляющим собой антитело к DR4, и агонистом, представляющим собой антитело к DR5.
В некоторых вариантах осуществления изобретения агонист представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения агонист представляет собой одноцепочечное антитело.
В некоторых вариантах осуществления изобретения агент предотвращает или снижает экспрессию BCL-2 или UbcH10. В других вариантах осуществления изобретения агент препятствует активации NFκB. В других вариантах осуществления изобретения агент препятствует расщеплению IkВ. В некоторых вариантах осуществления изобретения агент представляет собой ингибитор протеосомы. В некоторых вариантах осуществления изобретения ингибитор протеосомы выбран из группы, включающей PS-341, MG-262 и MG-132.
В некоторых вариантах осуществления изобретения агент представляет собой ингибитор белка-ингибитора апоптоза (IAP). В некоторых вариантах осуществления изобретения этот ингибитор представляет собой SMAC или миметик SMAC.
В некоторых вариантах осуществления изобретения раковая клетка представляет собой клетку рака ободочной кишки или клетку рака поджелудочной железы. В других вариантах осуществления изобретения агент представляет собой антагонист РАК1. В некоторых вариантах осуществления изобретения агент представляет собой антагонист полипептида, выбранного из группы, включающей UbcH10, nsurf, stk12, Ask1 и JIK. В других вариантах осуществления изобретения агент представляет собой молекулу siPHK.
Настоящее изобретение относится также к физиологической композиции, содержащей терапевтически эффективное количество (I.) агониста, представляющего собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5; и (II.) апоптоз-индуцирующего агента.
В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR-5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А. В других вариантах осуществления изобретения агонист представляет собой антитело к DR4. В некоторых вариантах осуществления изобретения клетку приводят в контакт с антителом-агонистом к DR4 и антителом-агонистом к DR5.
В некоторых вариантах осуществления изобретения агонист представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения агонист представляет собой одноцепочечное антитело.
В некоторых вариантах осуществления изобретения агент предотвращает или снижает экспрессию BCL-2 или UbcH10. В других вариантах осуществления изобретения агент препятствует активации NFκB. В других вариантах осуществления изобретения агент препятствует расщеплению IκВ. В некоторых вариантах осуществления изобретения агент представляет собой ингибитор протеосомы. В некоторых вариантах осуществления изобретения ингибитор протеосомы выбран из группы, включающей PS-341, МО-262 и MG-132.
В некоторых вариантах осуществления изобретения агент представляет собой ингибитор белка-ингибитора апоптоза (IAP). В некоторых вариантах осуществления изобретения этот ингибитор представляет собой SMAC или миметик SMAC.
В других вариантах осуществления изобретения агент представляет собой антагонист РАК1. В некоторых вариантах осуществления изобретения агент представляет собой антагонист полипептида, выбранного из группы, включающей UbcH10, nsurf, stk12, Ask1 и JIK. В других вариантах осуществления изобретения агент представляет собой молекулу siPHK.
Настоящее изобретение относится также к обладающим аффинностью агентам со специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения обладающие аффинностью агенты представляют собой антитела, несущие вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35.
Настоящее изобретение относится также к клеткам, экспрессирующим антитело, которое несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35.
Настоящее изобретение относится также к способам индукции апоптоза раковых клеток, заключающимся в том, что клетку приводят в контакт с обладающим аффинностью агентом со специфичностью связывания, характерной для антитела, которое несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR-5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А.
Определения
Понятие «антитело» относится к полипептиду, который содержит каркасный участок, кодируемый геном иммуноглобулина или его фрагмента, который специфически связывается с антигеном и распознает его. Известные гены иммуноглобулинов включают гены константных областей каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов вариабельных областей иммуноглобулинов. Легкие цепи классифицируются как каппа- или лямбда-цепи. Тяжелые цепи классифицируются как гамма-, мю-, альфа-, дельта- или эпсилон-цепи, что в свою очередь определяет классы иммуноглобулинов IgG, IgM, IgA, IgD и IgE соответственно.
Встречающиеся в естественных условиях иммуноглобулины имеют общую основную структуру, в которой две идентичные легкие цепи (с молекулярной массой примерно 24 кДа) и две идентичные тяжелые цепи (с молекулярной массой примерно 55 или 70 кДа) формируют тетрамер. N-концевую область каждой цепи называют вариабельной (V) областью, и она отличается от остальных более консервативных константных (С) областей каждой цепи. В вариабельной области легкой цепи присутствует С-концевой участок, который называют J-участком. В вариабельной области тяжелой цепи помимо J-участка присутствует D-участок. Большинство вариаций аминокислотной последовательности иммуноглобулинов затрагивает три отделенных друг от друга участка в V-областях, которые называют гипервариабельные участки (CDR), они непосредственно участвуют в связывании антигена. Эти три участка, начиная с N-конца, обозначают CDR1, CDR2 и CDR3 соответственно. CDR сохраняют свое положение с помощью более консервативных каркасных участков (FR). Эти участки, начиная с N-конца, обозначают FR1, FR2, FR3 и FR4 соответственно. Локализация CDR- и FR-участков и система их нумерации предложена Кэботом с соавторами (Kabat и др.. Sequences of Proteins of Immunological Interest, 5-ое изд., U.S. Department of Health and Human Services, U.S. Government Printing Office (1991)).
Приведенная в качестве примера структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара несет одну «легкую» (с молекулярной массой примерно 25 кДа) и одну «тяжелую» цепь (с молекулярной массой примерно 50-70 кДа). N-конец каждой цепи содержит вариабельную область, состоящую примерно из 100-110 или большее количество аминокислот, которая прежде всего ответственна за распознавание антигена. Понятия вариабельная область легкой цепи (VL) и вариабельная область тяжелой цепи (VH) относятся к указанным участкам легкой и тяжелой цепей соответственно.
Антитела существуют, например, в форме интактных иммуноглобулинов или в виде нескольких их фрагментов с хорошо известными характеристиками, которые получают расщеплением различными пептидазами. Так, например, пепсин расщепляет антитело за дисульфидными мостиками в шарнирной области, приводя к образованию F(аb)'2 - фрагмента, димера Fab, который сам представляет собой легкую цепь, связанную с vh-ch1 дисульфидной связью. F(ab)'2 может восстанавливаться в мягких условиях, при которых происходит расщепление дисульфидного мостика в шарнирной области, что приводит к превращению димера F(ab)'2 в мономер Fab'. Мономер Fab' представляет собой в основном Fab-фрагмент с частью шарнирной области (см. fundamental immunology (под ред. Paul, 3-е изд., 1993). Хотя обозначение различных фрагментов антитела определяется с точки зрения расщепления интактного антитела, специалисту в данной области должно быть очевидно, что такие фрагменты можно синтезировать de novo либо химически, либо с помощью рекомбинантной ДНК. Так, понятие антитело в контексте настоящего описания включает также фрагменты антитела, полученные либо путем модификации полных антител, либо синтезированные de novo с использованием методов рекомбинантной ДНК (например, одноцепочечный Fv), либо фрагменты, идентифицированные с помощью фаговых дисплейных библиотек (см., например, McCafferty и др., Nature 348, 1990, cc.552-554).
Для получения моноклональных или поликлональных антител можно использовать любой метод, известный в данной области (см., например, Kohler и Milstein, Nature 256, 1975, cc.495-497; Kozbor и др.. Immunology Today 4, 1983, с.72 (1983); Cole и др., в: Monoclonal Antibodies and Cancer Therapy, 1985, cc.77-96). Понятие «моноклональные» антитела относится к антителам, полученным из индивидуального клона. Методики получения одноцепочечных антител (US 4946778) можно адаптировать для получения антител к полипептидам, предлагаемых в настоящем изобретении. Кроме того, для экспрессии гуманизированных антител можно использовать трансгенных мышей или другие организмы, такие как другие млекопитающие. В другом варианте можно применять методики, основанные на использовании фаговых дисплейных библиотек, для идентификации антител и гетеромерных Fab-фрагментов, которые специфически связываются с выбранными антигенами (см., например, McCafferty и др. Nature 348, 1990, cc.552-554; Marks и др., Biotechnology 10, 1992, cc.779-783).
«Химерное антитело» представляет собой молекулу антитела, в которой (а) константная область или ее часть изменена, заменена или рекомбинирована так, что антигенсвязывающий центр (вариабельная область) связан с константной областью другого или измененного класса, эффекторной функцией и/или разновидностями, или с полностью отличной молекулой, которая придает новые свойства химерному антителу, например, с ферментом, токсином, гормоном, фактором роста, лекарственным средством и т.д.; или (б) вариабельная область или ее часть изменена, рекомбинирована или заменена вариабельной областью, имеющей другую или измененную антигенную специфичность.
«Гуманизированное» антитело представляет собой антитело, которое сохраняет реактивность антитела организма кроме человека, но которое обладает слабой имунногенностью для человека. Для достижения этого, например, можно сохранять CDR-участки организма кроме человека и заменять оставшиеся части антитела человеческими копиями (см., например, Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, cc.6851-6855; Morrison и Oi, Adv. Immunol., 44, 1988, cc.65-92; Verhoeyen и др., Science, 239, 1988, cc.1534-1536; Padlan, Molec. Immun., 28, 1991, cc.489-498; Padlan, Molec. Immun., 31(3), 1994, cc. 169-217).
Фраза «специфически (или избирательно) связывается» с антителом или «обладает специфической (или избирательной) иммунореактивностью с антителом» применительно к белку или пептиду относится к реакции связывания, которая позволяет выявлять присутствие белка в гетерологичной популяции белков и других биологических субстанций. Так, в определенных условиях иммунологического анализа связывание специфических антител с конкретным белком по меньшей мере в 2 раза превышает фоновое связывание, и они практически не связываются в значительной степени с другими белками, присутствующими в образце. Для специфического связывания с антителом в таких условиях может потребоваться антитело, отобранное на основе его специфичности к конкретному белку. Этот отбор можно осуществлять, отделяя антитела, которые дают перекрестную реакцию, например, с молекулами DR5, от других разновидностей. Целый ряд форматов иммунологического анализа можно применять для отбора антител, обладающих специфической иммунореактивностью с конкретным белком. Например, для отбора антител, обладающих специфической иммунореактивностью с конкретным белком, обычно применяют твердофазные иммуноферментные анализы (ELISA) (см., например, у Harlow и Lane, Antibodies A Laboratory Manual (1988) описание форматов иммунологических анализов и условия, которые можно применять для определения специфической иммунореактивности). Как правило, специфическая или избирательная реакция должна по меньшей мере в 2 раза превышать фоновый сигнал или шум и более предпочтительно превышать фоновый уровень более чем в 10-100 раз.
Понятия «пептидомиметик» и «миметик» относятся к синтетическому химическому соединению, которое имеет практически такие же структурные и функциональные характеристики, что и встречающийся в естественных условиях или не встречающийся в естественных условиях полипептид (например, SMAC). Пептидные аналоги, как правило, применяют в фармацевтической промышленности в качестве непептидных лекарственных средств, которые обладают свойствами, аналогичными свойствам основного пептида. Эти типы непептидных соединений обозначают как «пептидные миметики» или «пептидомиметики» (Fauchere J. Adv. Drug Res. 15, 1986, с.29; Veber и Freidinger TINS, 1985, с.392; и Evans и др. J. Med. Chem. 30, 1987, с.1229, публикации включены в настоящее описание в качестве ссылки). Пептидные миметики, которые структурно аналогичны применяемым в терапии пептидам, можно использовать для достижения эквивалентного или усиленного терапевтического или профилактического действия. Как правило, пептидомиметики структурно аналогичны полипептиду-образцу (т.е. полипептиду, который обладает биологической или фармакологической активностью), т.е. представляющему интерес полипептиду, но они несут одну или несколько пептидных связей, необязательно замененных связью, выбранной из группы, которая включает, например -CH2NH-, -CH2S-, -CH2-CH2-, -CH=CH- (цис- и транс), -COCH2-, -СН(ОН)СН2- и -CH2SO-. Миметик может либо полностью состоять из синтетических не встречающихся в естественных условиях аналогов аминокислот, либо представлять собой химерную молекулу, состоящую частично из аминокислот, которые входят в состав встречающихся в естественных условиях пептидов, и частично из не встречающихся в естественных условиях аналогов аминокислот. Миметик может включать также любое количество консервативных замен встречающихся в естественных условиях аминокислот, если такие замены не могут также в значительной степени изменять структуру/или активность миметика. Например, композиция миметика подпадает под объем изобретения, если он обладает по меньшей мере одним из видов связывающей или ферментативной активности представляющего интерес полипептида.
Понятие «siPHK» относится к малым способным к интерференции РНК, которые обладают способностью вызывать интерференцию и посттрансляционное молчание определенных генов в клетках, например клетках млекопитающих (включая человеческие клетки), и в организме, например организме млекопитающих (включая человека). Феномен интерференции РНК описан и его обсуждение проведено у Bass, Nature 411, 2001, cc.428-429; Elbahir и др., Nature 411, 2001, cc.494-498; и Fire и др., Nature 391, 1998, cc.806-811); и в WO 01/75164, где описаны также методы получения обладающих способностью к интерференции РНК. Основой siPHK являются последовательности и нуклеиновые кислоты, кодирующие генные продукты, представленные в настоящем описании, которые, как правило, состоят менее чем из 100 пар оснований и которые могут состоять, например, из 30 или менее пар оснований, и которые можно получать с использованием известных в данной области подходов, включая применение комплементарных цепей ДНК или методов синтеза. SiPHK могут вызывать интерференцию и посттрансляционное молчание определенных генов в клетках, например в клетках млекопитающих (включая человеческие клетки), и в организме, например организме млекопитающих (включая человека). Репрезентативные siPHK, предлагаемые в изобретении, могут иметь вплоть до 29, 25, 22, 21, 20, 15, 10, 5 пар оснований или любое целое число пар оснований примерно в этих пределах. Инструменты для создания оптимальных ингибирующих siPHK включают наборы, поставляемые фирмой DNAengine Inc. (Сиэтл, шт.Вашингтон) и фирмой Ambion, Inc. (Аустин, шт.Техас).
Один из методов создания ингибирующей РНК (PHKi) основан на применении генетических конструкций, в которых смысловые и антисмысловые последовательности помещают в область, фланкирующую интронную последовательность, в правильной сплайсинговой ориентации относительно сайтов сплайсинга донора и акцептора. В альтернативном варианте для разделения самокомплементарных областей последовательности в конструкции можно применять спейсерные последовательности различной длины. При процессинге транскрипта генной конструкции интронные последовательности удаляются сплайсингом, что дает возможность смысловым и антисмысловым последовательностям, а также последовательностям границы сплейсинга связываться с образованием двухцепочечной РНК. Затем определенные рибонуклеазы связываются с двухцепочечной РНК и расщепляют ее, инициируя тем самым каскад событий, приводящий к расщеплению специфических генных последовательностей мРНК и молчанию определенных генов.
Понятие «нуклеиновая кислота» относится к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам либо в одноцепочечной, либо в двухцепочечной форме. Под понятие подпадают нуклеиновые кислоты, содержащие известные нуклеотидные аналоги или модифицированные каркасные остатки или связи, которые могут быть синтетическими, встречающимися в естественных условиях и не встречающимися в естественных условиях, могут обладать такой же способностью к связыванию, что и нуклеиновая кислота, с которой проводится сравнение, и метаболизируются аналогично нуклеотидам, с которыми проводится сравнение. Примеры таких аналогов включают (но, не ограничиваясь ими) фосфортиоаты, фосфорамидаты, метилфосфонаты, хиральные метилфосфонаты, 2-О-метилрибонуклеотиды, пептидонуклеиновые кислоты (ПНК).
Если не указано иное, то подразумевается, что конкретная нуклеотидная последовательность включает также ее консервативно модифицированные варианты (например, замены, связанные с вырожденностью генетического кода) и комплементарные последовательности, а также специально указанную последовательность. Так, замены, связанные с вырожденностью генетического кода, можно осуществлять, получая последовательности, в которых третье положение одного или нескольких (или всех) кодонов заменено смешанным основанием и/или дезоксиинозиновыми остатками (Batzer и др.. Nucleic Acid Res. 1991, с.15081; Ohtsuka и др., J. ВЫ. Chem. 260, 1985, cc.2605-2608; Rossolini и др., Mol. Cell. Probes 8, 1994, cc.91-98). Под понятие «нуклеиновая кислота» подпадают понятия ген, кДНК, мРНК, олигонуклеотид и полинуклеотид.
Понятия «полипептид», «пептид» и «белок» в контексте настоящего описания используют взаимозаменяемо для обозначения полимера, состоящего из аминокислотных остатков. Понятие применимо к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляют собой искусственный полученный химическим путем миметик соответствующей встречающейся в естественных условиях аминокислоты, а также к встречающимся в естественных условиях аминокислотным полимерам и не встречающимся в естественных условиях аминокислотным полимерам.
Понятие «аминокислота» относится к встречающимся в естественных условиях и синтетическим аминокислотам, а также к аминокислотным аналогам и аминокислотным миметикам, которые функционируют аналогично встречающимся в естественных условиях аминокислотам. Встречающиеся в естественных условиях аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также аминокислоты, которые впоследствии модифицируются, например, гидроксипролин, гамма-карбоксиглутамин и O-фосфосерин. Понятие «аминокислотные аналоги» относится к соединениям, которые имеют такую же основную химическую структуру, что и встречающаяся в естественных условиях аминокислота, т.е. имеют атом углерода в альфа-положении, который связан с водородом, карбоксильной группой, аминогруппой и R-группой, например гомосерин, норлейцин, метионинсульфоксид и метионинметилсульфоний. Такие аналоги несут модифицированные R-группы (например, норлейцин) или модифицированный пептидный каркас, но сохраняют такую же химическую структуру, что и встречающаяся в естественных условиях аминокислота. Понятие «аминокислотные миметики» относится к химическим соединениям, которые имеют структуру, отличную от общей химической структуры аминокислоты, но которые функционируют аналогично встречающейся в естественных условиях аминокислоте.
Понятие «консервативно модифицированные варианты» относится как к аминокислотным, так и к нуклеотидным последовательностям. Касательно конкретных нуклеотидных последовательностей консервативно модифицированные варианты относятся к таким нуклеиновым кислотам, которые кодируют идентичные или практически идентичные аминокислотные последовательности, или в случае, когда нуклеиновая кислота не кодирует аминокислотную последовательность, к практически идентичным последовательностям. Из-за вырожденности генетического кода любой конкретный белок кодирует большое количество функционально идентичных нуклеиновых кислот. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждом положении, в котором аланин кодируется кодоном, кодон можно заменять на любые соответствующие известные кодоны без изменения кодируемого полипептида. Такие варианты нуклеиновой кислоты являются «молчащими вариациями», которые представляют собой один из видов консервативно модифицированных вариантов. В контексте настоящего описания подразумевается, что каждая нуклеотидная последовательность, которая кодирует полипептид, включает также все возможные молчащие вариации нуклеиновой кислоты. Специалисту в данной области должно быть очевидно, что каждый кодон нуклеиновой кислоты (за исключением AUG, который, как правило, является единственным кодоном метионина, и TGG, который, как правило, является единственным кодоном триптофана) можно модифицировать с получением функционально идентичной молекулы. Таким образом, для каждой описанной последовательности подразумевается каждая молчащая вариация нуклеиновой кислоты, которая кодирует полипептид.
Касательно аминокислотных последовательностей специалисту в данной области должно быть очевидно, что индивидуальные замены, делеции или добавления в последовательности нуклеиновой кислоты, пептида, полипептида или белка, которые изменяют, добавляют или изымают одну аминокислоту или небольшой процент аминокислот в кодируемой последовательности, приводят к получению консервативно модифицированного варианта, в котором изменение приводит к замене аминокислоты на химически сходную аминокислоту. Перечень консервативных замен, обеспечивающий получение функционально аналогичных аминокислот, хорошо известен в данной области. Такие консервативно модифицированные варианты (и дополнительные варианты) не исключают полиморфные варианты, межвидовые гомологи и аллели, предлагаемые в изобретении.
Каждая из приведенных ниже 8 групп содержит аминокислоты, которые являются консервативными заменами друг друга:
1) аланин (А), глицин (G);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (К);
5) изолейцин (I), лейцин (L), метионин (М), валин (V);
6) фенилаланин (F), тирозин (Y), триптофан (W);
7) серин (S), треонин (Т) и
8) цистеин (С), метионин (М) (см., например, Creighton, Proteins (1984)).
В контексте настоящего описания понятие «процент идентичности последовательностей» означает величину, определяемую путем сравнения двух оптимальным образом сравниваемых последовательностей в окне сравнения, где фрагмент полинуклеотидной последовательности в окне сравнения может иметь вставки или делеции (т.е. бреши) по отношению к последовательности, с которой производится сравнение (например, последовательности полипептида, предлагаемого в изобретении), которая не имеет вставок или делеций, при оптимальном сравнении двух последовательностей. Процент рассчитывают путем определения количества положений, в которых в обеих последовательностях встречается идентичный нуклеотид или аминокислотный остаток, в результате чего получают количество совпадающих положений, деления количества совпавших положений на общее количество положений в окне сравнения и умножения результата на 100 для получения процента идентичности последовательностей.
Понятия «идентичный» или процент «идентичности» в отношении двух или более нуклеотидных или полипептидных последовательностей относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми. Две последовательности являются «практически идентичными», если две последовательности имеют определенный процент одинаковых аминокислотных остатков или нуклеотидов (т.е. идентичность на 60, необязательно идентичность на 65, 70, 75, 80, 85, 90 или 95% в определенной области или, если она не определена, в полной последовательности) при сопоставлении и сравнении с целью выявления максимального соответствия в окне сравнения или в предназначенной для этого области, что устанавливают с использованием одного из перечисленных ниже алгоритмов или путем сравнения вручную и визуального анализа. Изобретение относится к полипептидам или полинуклеотидам, которые являются практически идентичными полипептидам или полинуклеотидам, соответственно, приведенным в настоящем описании в качестве примеров (например, CDR, приведенным в качестве примеров на фиг.23-25). Необязательно идентичность имеет место в области длиной примерно 50 нуклеотидов или более предпочтительно в области длиной от 100 до 500 или 1000 или более нуклеотидов.
При сравнении последовательностей, как правило, одна последовательность представляет собой последовательность, с которой проводят сравнение (референс-последовательность), с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения тестируемую последовательность и референс-последовательность вводят в компьютер, при необходимости задают координаты подпоследовательности и параметры алгоритмической программы сравнения последовательностей. Можно использовать параметры программы, задаваемые по умолчанию, или альтернативные параметры. После этого алгоритм сравнения последовательностей рассчитывает на основе параметров программы процент идентичности для тестируемых последовательностей и референс-последовательности.
В контексте настоящего описания понятие «окно сравнения» относится к фрагменту, содержащему любое количество следующих непрерывно друг за другом положений, выбранных из группы, содержащей от 20 до 600, предпочтительно от примерно 50 до примерно 200, более предпочтительно от примерно 100 до примерно 150 положений, в которых можно сравнивать последовательность с референс-последовательностью, имеющей такое же количество непрерывных положений, при оптимальном сравнении двух последовательностей. Методы сравнительного анализа последовательностей, пригодные для сравнения, хорошо известны в данной области. Оптимальный сравнительный анализ последовательностей для сравнения можно осуществлять, например, с использованием алгоритма локальной гомологии Smith и Waterman, Adv. Appl. Math. 2, 1970, с.482, алгоритма сравнительного анализа гомологии Needleman и Wunsch., J. Mol. Biol. 48, 1970, с.443, метода поиска сходства Pearson и Lipman, Proc. Nat'1. Acad. Sci. USA 85, 1988, с.2444, с использованием компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA, входящих в пакет программ фирмы Wisconsin Genetics, фирма Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин, США) или путем сравнения вручную и визуального анализа (см., например, Ausubel и др.. Current Protocols in Molecular Biology (1995 приложение).
Двумя примерами алгоритмов, которые можно применять для определения процента идентичности последовательностей и сходства последовательностей, могут служить алгоритмы BLAST и BLAST 2.0, описанные у Altschul и др., Nuc. Acid Res. 25, 1977, cc.3389-3402 и у Altschul и др., J. Mol. Biol. 215, 1990, cc.403-410, соответственно. Программное обеспечение для осуществления анализов с помощью BLAST может быть предоставлено Национальным центром биотехнологической информации (National Center for Biotechnology Information). В этом алгоритме сначала производится идентификация пар последовательности с высокими баллами (HSP) путем идентификации коротких «слов» длины W в рассматриваемой последовательности, которые или совпадают или удовлетворяют определенной положительной пороговой оценке (баллу) Т при сравнении со «словом» такой же длины в последовательности из базы данных. Т называется пороговой оценкой (баллом) близкого «слова» (Altschul и др., 1990). Эти исходные выборки близкого «слова» используются в качестве «затравки» для инициации поиска, предназначенного для нахождения включающих их более длинных HSP. Затем выборки «слова» удлиняются в обоих направлениях вдоль каждой последовательности до тех пор, пока происходит увеличение кумулятивного (накопительного) балла при сравнительном анализе. Кумулятивные баллы для нуклеотидных последовательностей вычисляют с использованием параметров М (призовой балл за пару совпадающих остатков; всегда>0) и N (штрафной балл за несовпадающие остатки; всегда<0). Для аминокислотных последовательностей для вычисления кумулятивного балла используют матрицу баллов. Удлинение выборки «слова» в каждом направлении прекращается в том случае, если кумулятивный балл при сравнительном анализе снижается на величину Х от своего максимального достигнутого значения, если кумулятивный балл снижается до нуля или ниже из-за накопления одного или нескольких отрицательных баллов при сравнительном анализе остатков, или если достигается конец какой-либо последовательности. Параметры W, Т и Х алгоритма BLAST определяют чувствительность и скорость сравнительного анализа. В программе BLASTN (для нуклеотидных последовательностей) в качестве задаваемых по умолчанию параметров используются длина «слова» (W), равная 11, ожидание (Е), равное 10, М=5, N=-4, при этом производится сравнение обеих цепочек. Для аминокислотных последовательностей в программе BLASTP используются в качестве задаваемых по умолчанию параметров длина «слова» (W), равная 3, ожидание (Е), равное 10, и матрица баллов BLOSUM62 (см. Henikoff Henikoff, Proc. Natl. Acad. Sci. USA 89, 1989, с.10915) для сравнительного анализа (В) 50, ожидание (Е), равное 10, М=5, N=-4, при этом производится сравнение обеих цепочек.
Алгоритм BLAST производит также статистический анализ сходства двух последовательностей (см., например, Karlin и Altschul, Proc. Natl. Acad. Sci. USA 90, 1993, cc.5873-5787). Одним из критериев степени сходства, который позволяет получить алгоритм BLAST, является наименьшая суммарная вероятность (P(N)), которая дает оценку вероятности, с которой может произойти случайным образом совпадение между двумя нуклеотидными или аминокислотными последовательностями. Например, считается, что тестируемая нуклеотидная последовательность является сходной с последовательностью, с которой производится сравнение, если наименьшая суммарная вероятность при сравнении тестируемой нуклеотидной последовательности с нуклеотидной последовательностью, с которой производится сравнение, меньше приблизительно 0,2, более предпочтительно меньше приблизительно 0,01 и наиболее предпочтительно меньше приблизительно 0,001.
Свидетельством того, что две нуклеотидные последовательности или два полипептида являются практически идентичными, служит то, что полипептид, кодируемый первой нуклеиновой кислотой, обладает перекрестной иммунологической реактивностью с антителами, образованными в ответ на полипептид, кодируемый второй нуклеиновой кислотой, как это писано ниже. Так, полипептид, как правило, является практически идентичным второму полипептиду, например, в том случае, когда два полипептида различаются только консервативными заменами. Другим свидетельством того, что две нуклеотидные последовательности являются практически идентичными, служит то, что две молекулы или их комплементы гибридизуются друг с другом в строгих условиях, как это описано ниже. Еще одним свидетельством того, что две нуклеотидные последовательности являются практически идентичными, служит то, что для амплификации последовательностей можно использовать одни и те же праймеры.
Понятие «агонист, представляющий собой обладающий аффинностью агент (агент-агонист)» относится к обладающему аффинностью агенту (т.е. к молекуле, которая специфически связывается с молекулой-мишенью), который обладает способностью активировать рецептор для индукции полного или частичного опосредуемого рецептором ответа. Например, агонист DR4 или DR5 связывается с DR4 или DR5 и индуцирует опосредуемые DR4 или DR5 сигналы. В некоторых вариантах осуществления изобретения агент-агонист, обладающий аффинностью к DR4 или DR5, можно идентифицировать по его способности связываться с DR4 или DR5 и индуцировать апоптоз при контакте с клетками линии Jurkat. Понятие «антитело-агонист, агонистическое антитело» относится к ситуации, когда обладающий аффинностью агент представляет собой антитело.
Понятие «апоптоз-индуцирующий агент» относится к соединению, которое индуцирует или усиливает апоптоз по меньшей мере одного типа клеток при контакте с этим типом клеток. Примеры апоптоз-индуцирующих агентов включают, например агонисты или миметики следующих субстанций: SMAC, Bax, Bik, Bok, Bim, Bak, Bid, Noxa, Puma, Hrk или Bad; ВН3, р53, лиганд TRAIL, Fadd, Мус и Mekkl, частица распознавания сигнала с молекулярной массой 72 кДа (SRP72), каспаза-8. Bid, В-лимфоидная тирозинкиназа (BLK), генный продукт, аналогичный пируваткиназе, изозим М2 (LOCI 48283), киназа 3 альфа гликогенсинтазы (GSK3A), гипотетический белок FLJ32312 (FLJ32312), активируемая митогеном протеинкиназа 10 (МАРК 10), TCF4 (фактор транскрипции 4), гомолог 2 онкогена вируса мышиного лейкоза Абелсона v-ab1 (arg, Abelson-родственный ген) (ABL2), гомолог 1 онкогена вируса саркомы птиц v-ros UR2 (ROS1) и гомолог онкогена вируса миелоцитоматоза птиц v-myc, a также антагонисты или ингибиторы следующих субстанций и процессов: ингибиторы протеосомы 26S, c-flip, NFκB-каскад, представители семейства IAP (например, XIAP, сIАР1, сIАР2, NAIP, MLIAP/Livin, сурвивин), представители протеосомного каскада (например, E1, E2 и Е3); киназы PI3, Akt1, 2 и 3, Rip, Nik; CD40; представители семейства Вс12 (например, Вс12, Bc1-x1, A1, Mc11), убикитин-конъюгаза UbcH10, остеопротегрин, плексин B1 (PLXNB1), несущий SET-домен белок 7 (SET7), киназа 5 киназы активируемой митогеном протеинкиназы (МАР3К5), SТЕ20-подобная киназа (JIK), сериновая/треониновая киназа 1, связывающая МАР-киназу (MKNK1), предполагаемый трансмембранный белок эндоплазматического ретикулума с несколькими связями (RFT1), 5-киназа типа I, гамма (PIP5K1C), активируемая протеинкиназой, активируемой митогеном, протеинкиназа 2 (МАРКАРК2), киназа 5 активируемой митогеном протеинкиназы (МАР2К5), зависящая от циклина киназа 6 (CDK6), рецептор 1 активина А, подобный рецептору типа II (ACVRL1), гомолог онкогена вируса Гарднера-Рашида саркомы кошачьих (v-fgr) (FGR), гипотетический белок FLJ21802 (FLJ21802), тирозинкиназа мышечно-скелетных рецепторов (MUSK), открытая рамка считывания 88 хромосомы 20 (C20orf88), при почковании не ингибируемый бензимидазолами гомолог 1 (гомолог дрожжей) (BUB1), полипептид 5 рибосомной протеин-86-киназы, 90 кДа (RPS6KA5), связанный с вирусом саркомы Ямагучи гомолог онкогена v-yes-1 (LYN), активируемая митогеном протеинкиназа 7 (МАРК7) и гомолог 1 онкогена вируса мышиной тимомы v-akt (AKT1), РАК1 (включая, например, любые из следующих субстанций: Р21(СОКМ1А)-активируемая киназа 1, РАКА, Р65-РАК, Р68-РАК, альфа-РАК, MUK2, РАК 1 В (р21-активируемая киназа 1 В), Р21/Сdс42/Рас1-активируемая киназа 1 (родственная дрожжевой Ste20), Cdc42/Rac-эффeктopнaя киназа РАК-А, протеинкиназа MUK2), nsurf, stk12 (включая, например, сериновую/треониновую киназу 12, aurora-родственную киназу 2, aurora/IPL1-родственную киназу 2, AIK2, ARK2, AIM-1 и AIM1), регулирующая сигнал апоптоза киназа 1 (Ask1), TLK1 (например с регистрационным номером NM_012290), NLK (например, с регистрационным номером. NM_016231), GRAF (например, с регистрационным номером NM_015071), GCK (например, с регистрационным номером NM_000162), ERK5 (например, с регистрационным номером NM_002749), FGR (например, с регистрационным номером NM_005248), ACVRL1 например с регистрационным номером NM_000020), MEKK5 (например, с регистрационным номером NM_002757), PIP5K1C (например, с регистрационным номером ХМ_047620), МАРКАРК2 (например, с регистрационным номером NM_004759), RFT1 (например, с регистрационным номером NM_052859), MKNK1 (например, с регистрационным номером NM_003684), PLXNB1 (например, с регистрационным номером NM_002673). Дополнительные примеры апоптоз-индуцирующих агентов включают, например агенты, которые усиливают экспрессию и/или стабильность DR5 и DR4, агенты, которые усиливают активность или стабильность каспаз, и агенты, которые индуцируют или усиливают реакцию, связанную с повреждением ДНК. Агонисты или миметики в вышеуказанном перечне включают сами генные продукты, например р53 представляет собой агонист р53. Антагонисты включают агенты, которые непосредственно ингибируют активность, и агенты, которые опосредованно ингибируют активность, снижая экспрессию или стабильность молекулы мРНК-мишени (например, siPHK) или белка.
Понятие агент, который «предотвращает или снижает экспрессию» белка, относится к соединению, которое, например связывается, частично или полностью блокирует стимуляцию, снижает, предотвращает, замедляет экспрессию. Экспрессия белка может снижаться, например, по меньшей мере на 5, 10, 25, 50, 75, 90, 95 или 100%.
Понятие «активация NFκB» относится к индукции ядерной локализации NFκB, связыванию ДНК с NFκB или транскрипции в результате связывания ДНК с NFκB.
Понятие «предотвращает расщепление IkВ» относится к расщеплению IkВ протеосомой, что приводит к облегчению проникновения NFκB в клеточное ядро.
Понятие «ингибитор протеосомы» относится к агенту, который ингибирует каскад протеосома-убикитин, предотвращая тем самым расщепление IκВ и последующую ядерную локализацию партнера IκВ, т.е. NFκB. Протеосома представляет собой, например протеосомный комплекс 26S.
Понятие «белок-ингибитор апоптоза (IAP)» относится к полипептиду из семейства белков, которые ингибируют каспазную активность. Практически все известные IAP-белки несут двукратный или трехкратный повтор характерной последовательности-мотива, такой как бакуловирусный ингибирующий повтор (BIR; -70 остатков; сурвивин представляет собой недавно открытый человеческий IAP, который содержит одну BIR-область). Эта BIR-область содержит несколько консервативных остатков с консенсусной последовательностью: R-X(20-23)-G-X(11)-С-Х(2)-С-Х(16)-Н-Х(б)-С. Примеры IAP включают, например, связанный с Х хромосомой ингибитор апоптоза (XIAP; регистрационный номер в Genbank U32974), клеточные IAP-белки (с-1АР-1/HIAP-2/hMIHB и c-IAP-2/HIAP-1/hMIHC; Liston и др. Nature 379, 1996, cc.349-353; Rothe и др. Cell 83, 1995, cc.1243-1252); белок-ингибитор апоптоза нейронов (NAIP; Roy и др. Cell 80, 1995, cc.167-178) и сурвивин (Ambrosini и др. Nature Med. 3, 1997, cc.917-921; см., например, заявки на патент США № 2002/0132786 и 2002/0009757, а также US 6187557).
«SMAC» обозначает митохондриальный полипептид, который высвобождается вместе с цитохромом с из митохондрий в ответ на связанные с апоптозом стимулы. SMAC усиливает активацию каспаз путем связывания и нейтрализации IAP (см., например, Du и др. Cell 102, 2000, cc.33-42; Verhagen и др. Cell 102, 2000, cc.43-53).
Понятие «модуляторы» в контексте настоящего описания относится к молекулам, которые ингибируют или усиливают активность экспрессии продукта гена. «Антагонисты» или «ингибиторы» представляют собой соединения, которые, например, ингибируют экспрессию продукта гена или связываются с ним, частично или полностью блокируют стимуляцию, снижают, предупреждают, замедляют активацию, инактивируют, десенсибилизируют или осуществляют понижающую регуляцию активности продукта гена, или соединения, которые связываются или осуществляют понижающую регуляцию рецептора, с которым связывается продукт гена. «Агонисты» или «активаторы» представляют собой соединения, которые, например, индуцируют или активируют экспрессию продукта гена или связываются с ним, стимулируют, повышают, открывают, активируют, облегчают, усиливают активацию, сенсибилизируют или осуществляют повышающую регуляцию активности продукта гена, или соединения, которые связываются или осуществляют повышающую регуляцию рецептора, с которым продукт гена связывается. Агонисты или антагонисты могут включать, например, антитела, органические небольшие молекулы (например, менее 1500 Да), генетически модифицированные версии самих продуктов генов и т.д. Антагонисты включают, например, молекулы siPHK, предназначенные для снижения экспрессии транскрипта, кодирующего продукт гена.
Краткое описание чертежей
На чертежах показано:
на фиг.1 - данные о том, что TRAIL индуцирует апоптоз клеток линии Jurkat;
на фиг.2 - данные о специфичности функциональных антител к DR5;
на фиг.3 - данные о воздействии трех различных антител-агонистов к DR5 на клетки линии Jurkat;
на фиг.4 - данные об активности каспазы-3 в обработанных клетках линии Jurkat;
на фиг.5 - данные о воздействии функциональных антител к DR4/DR5 на линии клеток рака ободочной кишки и меланомы;
на фиг.6 - данные о воздействии функциональных антител к DR4/DR5 на линии клеток рака молочной железы;
на фиг.7 - данные о реакции в зависимости от дозы на обработку антителами-агонистами к DR5 здоровых и опухолевых клеток;
на фиг.8 - данные о воздействии агонистического антитела «А» к DR5 на активацию каспазы-3;
на фиг.9 - данные о воздействии антитела-агониста к DR5 на объем опухоли, вызываемой линией клеток Colo 205;
на фиг.10 - данные о реакции в зависимости от дозы на обработку антителом к DR5 при использовании подкожной модели COL0205;
на фиг.11 - данные о противоопухолевой активности моноклональных антител к DR5 in vivo;
на фиг.12 - каскады активации каспазы и апоптоза;
на фиг.13 - данные о индуцируемом антителами к DR4 или антителами к DR5 апоптозе клеток линии А2058 в присутствии миметика SMAC;
на фиг.14 - данные о воздействии миметика SMAC на здоровые и опухолевые клетки;
на фиг.15 - данные фармакокинетических (ФК) и фармакодинамических (ФД) исследований миметика SMAC;
на фиг.16 - каскад NFκB и его взаимосвязь с протеосомой;
на фиг.17 - данные, свидетельствующие о том, что ингибитор протеосомы MG132 усиливает индуцируемый антителом к DR5 апоптоз;
на фиг.18 - различные ингибиторы протеосом;
на фиг.19 - данные о воздействие ингибиторов протеосом на клетки линии А2058;
на фиг.20 - данные о воздействии ингибиторов протеосом на клетки линии гепатокарциномы;
на фиг.21 - данные о воздействии ингибиторов протеосом на здоровые клетки млекопитающих;
на фиг.22 - данные о экспрессии функционально активных мышиных-человеческих химерных антител к DR5;
на фиг.23 - нуклеотидные последовательности вариабельных областей тяжелых и легких цепей антитела А;
на фиг.24 - вариабельная область тяжелой цепи антитела А;
на фиг.25 - вариабельная область легкой цепи антитела А;
на фиг.26 - схематическое изображение процесса скрининга для идентификации продуктов генов, которые опосредуют индуцируемый TRAIL апоптоз, путем интродукции siPHK для «выключения» специфической генной экспрессии в опытах на клетках;
на фиг.27 - также схематическое изображение процесса скрининга для идентификации продуктов генов, которые опосредуют индуцируемый TRAIL апоптоз, путем интродукции siPHK для «выключения» специфической генной экспрессии в опытах на клетках;
на фиг.28 - перечень обладающих активностью продуктов, выявленных с помощью вышеописанного скрининга на основе siPHK. «Соотношение» обозначает отношение жизнеспособных клеток (т.е. не подверженных апоптозу) после введения TRAIL в сравнении с вариантом без добавления TRAIL. Низкие соотношения (ниже 50) свидетельствуют о том, что продукты генов препятствуют апоптозу. Более высокие соотношения (выше 50) свидетельствуют о том, что продукты генов содействуют апоптозу;
на фиг.29 - полученные с помощью siPHK данные для Gsk3 α и Gsk3β. В верхней части чертежа представлены данные, иллюстрирующие, что siPHK являются специфическими для Gsk3 α или Gsk3β. На гистограмме внизу чертежа представлены данные об активности каспазы после интродукции siPHK в присутствии TRAIL и без него;
на фиг.30 - схема регуляции индуцируемого TRAIL апоптоза. Следует особенно отметить, что mуc обладает проапоптозным действием. Таким образом, ингибирование туе ингибирует индуцируемый TRAIL апоптоз, а активация mуc синергетически активирует индуцируемый TRAIL или антителом к DR4 или антителом к DR5 апоптоз;
на фиг.31 - данные об аддитивном действии siUbcH10 и классических цитотоксических противораковых агентов в отношении уничтожения опухолевых клеток. На чертеже показано также, что предварительная обработка опухолевых клеток siUbcH10 значительно повышает апоптоз, индуцируемый антителами к DR5;
на фиг.32 - данные о понижающей регуляции UbcH10, где siUbcH10 повышает чувствительность (сенсибилизирует) опухолевых клеток к опосредуемому TRAIL/DR5 уничтожению клеток;
на фиг.33 - данные о повышении чувствительности клеток линии НСТ116 или их клона Вах - к лиганду TRAIL, объединенному с ингибиторами протеосомы 26S, таким как MG-132, MG-262 или лактацистин (LC);
на фиг.34 - данные о воздействии ингибитора протеосом MG-262 на экспрессию различных белков митохондриального пути апоптоза;
на фиг.35 - альтернативные последовательности вариабельных областей тяжелой и легкой цепей антитела А.
Подробное описание изобретения
I. Введение
При создании настоящего изобретения неожиданно было установлено, что антитела-агонисты к DR4 или DR5 при их введении в сочетании с апоптоз-индуцирующим агентом синергетически индуцируют апоптоз раковых клеток. Раковые клетки, устойчивые к обработке одним из указанных компонентов при его индивидуальном введении, вероятно, должны уничтожаться при контакте с антителом-агонистом к DR4 или DR5 и вторым апоптоз-индуцирующим агентом. Кроме того, у клеток, у которых происходит апоптоз при контакте с одним из вышеуказанных компонентов, контакт с антителами-агонистами к DR4 или DR5 должен приводить к более быстрой индукции апоптоза.
В настоящем изобретении предложены также обладающие высокой эффективностью антитела-агонисты к DR5 и их применение для индукции апоптоза раковых клеток.
II. Антитела к DR4 или DR5
1. Введение
Согласно способам, предлагаемым в изобретении, можно применять любое антитело-агонист к DR4 или DR5. DR4 (известный также как рецептор некроза 4, Death Receptor 4) и DR5 (известный также как рецептор некроза 5) представляют собой два рецептора лиганда TRAIL (см., например. Pan и др., Science 277, 1997, cc.815-818; Sheridan и др.. Science 277, 1997, cc.818-821 3; Walczak и др, ЕМВО J., 6, 1997, cc.5386-5397 4). Антитела к DR5 описаны ранее, например в РСТ WO 01/83560 (антитело TRA-8; АТСС РТА-1428) и РСТ WO 02/079377. Кроме того, в настоящем описании представлены антитела-агонисты к DR5. Вариабельные области тяжелых и легких цепей приведенного в качестве примера антитела-агониста к DR5 представлены на фиг.23-25. В некоторых вариантах осуществления изобретения антитела к DR5 конкурируют с приведенным в качестве примера антителом за связывание с DR5. В других вариантах осуществления изобретения антитела-агонисты к DR5 имеют CDR, практически аналогичные CDR, которые приведены в качестве примера на фиг.24 или 25 или на обоих чертежах.
Согласно способам, предлагаемым в изобретении, можно использовать любой тип антитела-агониста. Как правило, применяемые антитела представляют собой моноклональные антитела. Моноклональные антитела можно получать с помощью любого метода, известного в данной области (например, с использованием гибридом, рекомбинантной экспрессии и/или фаговой презентации).
Не требуется, чтобы антитела, предлагаемые в изобретении, были перекрестно сшиты или иным образом обработаны перед введением. Однако в некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, являются перекрестно сшитыми. Введение перекрестных сшивок (например, с использованием гетеро- или гомобифункциональных химических перекрестносшивающих агентов) хорошо известно в данной области. В альтернативном варианте можно вводить стабильные поливалентные Fab-фрагменты (например, тримеры или тетрамеры и т.д.) (см, например, РСТ WO 99/27964).
Приведенные в качества примера антитела к DR5 включают антитела со специфичностью, характерной для антитела, которое содержит последовательности вариабельный областей легких и тяжелых цепей, представленные на фиг.24 и 25. В некоторых вариантах осуществления изобретения антитело представляет собой антитело А.
Согласно целому ряду вариантов осуществления изобретения антитела к DR5, предлагаемые в изобретении, не связываются с другими полипептидами. В некоторых вариантах осуществления изобретения антитела к DR5 не связываются с другим рецептором из семейства рецепторов TNF (например, TNFR2, TNFR3, OХ40, CD40, FAS, DcR3, CD27, CD30, CD137, DR4, DcR1, DcR2, RANK, OPG, DR3, TR2, NGFR, TNFR1 и ТАС1). В некоторых вариантах осуществления изобретения антитела к DR5 не связываются с DR4, DTR1, DTR2 или OPG.
Антитела к DR4 или к DR5, предлагаемые в изобретении, могут обладать очень высокой эффективностью. Например, в некоторых вариантах осуществления изобретения в стандартном анализе по оценке абляции подкожной опухоли антитела, предлагаемые в изобретении, могут снижать размер опухоли на 50% при применении в концентрации 1 мг/кг веса тела или менее (а в некоторых вариантах осуществления изобретения в концентрации 0,50, 0,05 или 0,01 мг/кг или менее) при введении животным 3 раза в неделю в течение двух недель и приводить к полной абляции опухолей при введении 10 раз в указанной концентрации.
В некоторых случаях антитела к DR4 или к DR5, предлагаемые в изобретении, создают так, чтобы они не обладали совсем или обладали пониженной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC). Например, в некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, содержат Fc-область IgG-1, IgG-2, IgG-2А, IgG 3 или IgG-4.
Для презентации последовательностей вариабельных областей легкой и тяжелой цепей, которые представлены на фиг.24 и 25, можно применять целый ряд различных синтетических молекулярных носителей. Описано применение домена фибронектина типа III (FN3) в качестве специфического молекулярного носителя для презентации пептидов, включая их CDR (Koide А. и др. J. Mol. Biol 284, 1988, cc. 1141-1151). Другие применяемые в качестве альтернативных носителей субстанции включают, например, «минитела» (Pessi А. и др.. Nature 362, 1993, cc.367-369), «тендамистаты» (tendamistat) (McConnell S. J. и Hoess R. H. J. Mol. Biol. 250, 1995, cc.460-470) и «камелизированный» VH-домен (Davies J. и Riechmann L. BiolTechnology 13, 1995, cc.475-479). Данные о других носителях, основой которых не является иммуноглобулинподобная складчатая структура, обобщены у Nygren P. А. и Uhlen M. Curr. Opin. Struct. Biol. 7, 1997, cc.463-469. В US 6153380 описаны другие носители.
Понятие «обладающие аффинностью агенты» относится к молекулам, представляющим собой синтетические молекулярные носители, например описанные выше, которые предназначены для презентации связывающих доменов, обладающих способностью к специфическому связыванию с DR4 или DR5, включая специфичности (антигенные детерминанты), характерные для антител, представленных в настоящем описании.
2. Гуманизированные антитела
В некоторых вариантах осуществления изобретения антитело, применяемое согласно настоящему изобретению, представляет собой химерное (например, мышиное/человеческое) антитело, созданное из областей антитела-агониста к DR4 или к DR5 из организма кроме человека в сочетании с областями человеческих антител. Например, химерная Н-цепь может содержать антигенсвязывающий центр вариабельной области тяжелой цепи (например, последовательность, представленную на фиг.24 и фиг.25) антитела из организма кроме человека, связанную по меньшей мере с одной константной областью человеческой тяжелой цепи. Эту гуманизированную или химерную тяжелую цепь можно объединять с химерной L-цепью, которая содержит антигенсвязывающий центр вариабельной области легкой цепи (например последовательность, представленную на фиг.25 или фиг.35) антитела из организма кроме человека, связанную по меньшей мере с частью константной области человеческой легкой цепи. В некоторых вариантах осуществления изобретения константная область тяжелой цепи можно получать из антитела в виде IgM или IgA.
Химерные антитела, предлагаемые в изобретении, могут представлять собой моновалентные, двухвалентные или поливалентные иммуноглобулины. Например, моновалентное химерное антитело представляет собой димер (HL), сформированный из химерной Н, которая связана через дисульфидные мостики с химерной L-цепью, указанной выше. Двухвалентное химерное антитело представляет собой тетрамер (Н2 L2), сформированной из двух HL-димеров, которые связаны по меньшей мере одним дисульфидным мостиком. Основой создания поливалентного химерного антитела является агрегация цепей.
Нуклеотидные и аминокислотные последовательности вариабельной области приведенного в качестве примера агониста антитела к DR5 представлены на фиг.22-24. Последовательности ДНК антител, предлагаемых в изобретении, можно идентифицировать, выделять, клонировать и переносить в прокариотическую или эукариотическую клетку для экспрессии с помощью методик, хорошо известных в данной области. Такие методики описаны в целом у Sambrook и др., выше, а также в: Current Protocols in Molecular Biology (под ред. Ausubel и др., 1989). Экспрессионные векторы и клетки-хозяева, которые можно применять для экспрессии рекомбинантных антител и, в частности гуманизированных антител, хорошо известны в данной области. В приведенных ниже ссылках представлены репрезентативные методы и векторы, пригодные для экспрессии рекомбинантных иммуноглобулинов, которые можно применять при осуществлении настоящего изобретения: Weidle и др., Gene, 51, 1987, cc.21-29; Dorai и др., J. Immunol., 13(12), 1987, cc.4232-4241; De Waele и др., Eur. J. Biochem., 176, 1988, cc.287-295; Colcher и др., Cancer Res., 49, 1989, cc.1738-1745; Wood и др., J. Immunol., 145(a), 1990, cc.3011-3016; Bulens и др., Eur. J. Biochem., 195, 1991, cc.235-242; Beggington и др., Biol. Technology, 10, 1992, c.169; King и др., Biochem. J., 281, 1992, cc.317-323; Page и др., Biol. Technology, 2, 1991, с.64; King и др., Biochem. J., 290, 1993, cc.723-729; Chaudary и др., Nature, 339, 1989, cc.394-397; Jones и др.. Nature, 321, 1986, cc.522-525; Morrison и Oi, Adv. Immunol., 44, 1988, cc.65-92; Benhar и др., Proc. Natl. Acad. Sci. USA, 91, 1994, cc.12051-12055; Singer и др., J. Immunol. 150, 1993, cc.:2844-2857; Cooto и др., Hybridoma, 13(3), 1994, cc.215-219; Queen и др., Proc. Natl. Acad. Sci. USA, 86, 1989, cc.10029-10033; Caron и др., Cancer Res., 32, 1992, cc.6761-6767; Cotoma и др., J. Immunol. Meth., 152, 1992, cc.89-109. Кроме того, векторы, которые можно применять для экспрессии рекомбинантных антител, поступают в продажу.
Клетки-хозяева, обладающие способностью экспрессировать функциональные иммуноглобулины, включают клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО); COS-клетки; клетки миеломы, например NSO- и SP2/O - клетки; клетки бактерий, таких как Escherichia coli; клетки дрожжей, таких как Saccharomyces cerevisiae, и другие клетки-хозяева.
3. Одноцепочечные антитела
В некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, представляют собой одноцепочечные антитела. Примеры методов, которые можно использовать для получения одноцепочечных Fv-фрагментов и антител, описаны в US 4946778 и 5258498; у Huston и др., Methods in Enzymology 203, 1991, cc.46-88; Shu и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc.7995-7999 и Skerra и др. Science 240, 1988, cc.1038-1040.
4. Человеческие антитела
В некоторых вариантах осуществления изобретения можно использовать человеческие антитела, предлагаемые в настоящем изобретении. Человеческие антитела можно получать с помощью разнообразных методов, известных в данной области, в том числе методов, основанных на фаговой презентации с использованием библиотек антител, полученных из человеческих последовательностей иммуноглобулинов (см., например, Lonberg и Huszar, Int. Rev. Immunol. 13, 1995, cc.65-93, US 4444887 и 4716111; публикации РСТ WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741; каждая из которых полностью включена в настоящее описание в качестве ссылки).
В некоторых вариантах осуществления изобретения антитела, предлагаемые в настоящем изобретении, получают с помощью фаговой презентации. Например, домены функционального антитела презентируют на поверхности фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие их. Такой фаг можно применять для презентации антигенсвязывающих центров, экспрессируемых из популяции или комбинаторной библиотеки антител (например, мышиных или человеческих). Фаг, экспрессирующий антигенсвязывающий центр, который связывается с DR4 или DR5, можно отбирать или идентифицировать с помощью DR4 или DR5, например, используя меченые DR4 или DR5. Фаг, применяемый в этих методах, как правило, представляет собой нитчатый фаг, содержащий fd- и М13-связывающие домены, экспрессируемые из фага, несущего Fab-, Fv-фрагменты, или стабилизированные с помощью дисульфиного мостика Fv-домены антитела, рекомбинантно слитые либо с фаговым геном III, либо с белком гена VIII. Примеры методов, основанных на фаговой презентации, которые можно применять для создания антител, предлагаемых в настоящем изобретении, включают методы, описанные у Brinkman и др., J. Immunol. Methods 182, 1995, cc.41-50; Ames и др., J. Immunol. Methods 184, 1995, cc.177-186; Kettleborough и др., Eur. J. Immunol. 24, 1994, cc.952-958; Persic и др. Gene 187, 1997, cc.9-18; Burton и др. Advances in Immunology 57, 1994, cc.191-280; заявка РСТ № PCT/GB91/01134; публикации РСТ WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401 и US 5698426; 5223409; 5403484;5580717; 5427908;5750753;5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108, каждая из которых полностью включена в настоящее описание в качестве ссылки.
5. Создание антител-агонистов
Антитела-агонисты можно идентифицировать, создавая антитела к DR4 или DR5, а затем, тестируя каждое антитело в отношении его способности инициировать опосредуемые DR4 или DR5 процессы, например, индукцию апоптоза раковых клеток. В данной области известен ряд анализов, которые можно применять для выявления индукции апоптоза.
В одном из анализов клетки линий DOHH-2 или Jurkat приводят в контакт с предполагаемым (кандидатом) антителом-агонистом и затем оценивают жизнеспособность как функцию концентрации антитела. Пониженная жизнеспособность клеток (например, вызываемая повышенным апоптозом) при использовании возрастающих концентраций антитела свидетельствует о том, что антитело является агонистом. Жизнеспособность клеток можно оценивать, добавляя аламаровый синий, флуоресценция которого происходит в присутствии живых, но не происходит в присутствии погибших клеток. Как описано в примерах, антитела-агонисты можно идентифицировать путем скрининга гибридом, полученных в ответ на иммунизацию DR4 или DR5, и последующего скрининга супернатанта гибридом на способность индуцировать апоптоз клеток линий DOHH-2 или Jurkat. Для подтверждения результатов можно использовать соответствующие позитивные и негативные контроли. Например, в клеточной линии, в которой не происходит опосредуемый DR4 или DR5 индуцируемый TRAIL апоптоз, не должен происходить апоптоз в ответ на обработку предполагаемым антителом-агонистом к DR4 или к DR5.
III. Апоптоз-индуцирующие агенты
При создании настоящего изобретения выявлено синергетическое действие агониста, представляющего собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5, при применении в сочетании с вторым апоптоз-индуцирующим агентом. К апоптоз-индуцирующим агентам относится любой агент, который индуцирует апоптоз клеток. В некоторых вариантах осуществления изобретения апоптоз-индуцирующий агент индуцирует апоптоз преимущественно раковых клеток по сравнению с нераковыми клетками. Как правило, апоптоз-индуцирующие агенты являются агонистами или активаторами апоптоза или антагонистами ингибиторов апоптоза.
Примеры апоптоз-индуцирующих агентов включают, например, агонисты или миметики следующих субстанций: SMAC, Bax, Bik, Bok, Bim, Bak, Bid, Noxa, Puma, Hrk ли Bad; ВH3, р53, лиганд TRAIL, Fadd, Мус и Mekkl, частица распознавания сигнала с молекулярной массой 72 кДа (SRP72), каспаза-8. Bid, В-лимфоидная тирозинкиназа (BLK), генный продукт, аналогичный пируваткиназе, изозим М2 (LOC148283), киназа 3 альфа гликогенсинтазы (GSK3A), гипотетический белок FLJ32312 (FLJ32312), активируемая митогеном протеинкиназа 10 (МАРК 10), TCF4: фактор транскрипции 4, гомолог 2 онкогена вируса мышиного лейкоза Абелсона v-abi (arg, Abelson-родственный ген) (ABL2), гомолог 1 онкогена вируса саркомы птиц v-ros UR2 (ROS1) и гомолог онкогена вируса миелоцитоматоза птиц v-myc, а также антагонисты или ингибиторы следующих субстанций и процессов: ингибиторы протеосомы 26S, c-flip, NFκB-каскад, представители семейства IAP (например, XIAP, cIAP1, сIАР2, NAIP, MLIAP/Livin, сурвивин), представители протеосомного каскада (например, E1, E2 и Е3); киназы PI3, Akt1, 2 и 3, Rip, Nik; CD40; представители семейства Вс12 (например, Вс12, Bc1-x1, A1, Mc11), убикитин-конъюгаза UbcH10 (полинуклеотидные последовательности, кодирующие варианты человеческой UbcH10, включая, например, зарегистрированные под номерами NM_181803, NM_181802, NM_181801, NM_181799, NM_007019 и ВС050736), остеопротегрин, плексин В1 (PLXNB1), несущий SET-домен белок 7 (SET7), киназа 5 киназы активируемой митогеном протеинкиназы (МАР3К5), SТЕ20-подобная киназа (JIK), сериновая/треониновая киназа 1, связывающая МАР-киназу (MKNK1), предполагаемый трансмембранный белок эндоплазматического ретикулума с несколькими связями (RFT1), 5-киназа типа I, гамма (PIP5K1C), активируемая протеинкиназой, активируемой митогеном, протеинкиназа 2 (МАРКАРК2), киназа 5 активируемой митогеном протеинкиназы (МАР2К5), зависящая от циклина киназа 6 (CDK6), рецептор 1 активина А, подобный рецептору типа II (ACVRL1), гомолог онкогена вируса Гарднера-Рашида саркомы кошачьих (v-fgr) (FGR), гипотетический белок FLJ21802 (FLJ21802), тирозинкиназа мышечно-скелетных рецепторов (MUSK), открытая рамка считывания 88 хромосомы 20 (C20orf88), при почковании не ингибируемый бензимидазолами гомолог 1 (гомолог дрожжей) (BUB1), полипептид 5 рибосомной протеин-86-киназы, 90 кДа (RPS6KA5), связанный с вирусом саркомы Ямагучи гомолог онкогена v-yes-1 (LYN), активируемая митогеном протеинкиназа 7 (МАРК7) и гомолог 1 онкогена вируса мышиной тимомы v-akt (AKT1), РАК1 (включая, например, любые из следующих субстанций: Р21(СВКК1А)-активируемая киназа 1, РАКА, Р65-РАК, Р68-РАК, альфа-РАК, MUK2, РАК1 В (р21-активируемая киназа 1 В), P21/Cdc42/Rac1-активируемая киназа 1 (родственная дрожжевой Ste20), Сdс42/Rас-эффекторная киназа РАК-А, протеинкиназа MUK2), nsurf, stkl2 (включая, например, сериновую/треониновую киназу 12, aurora-родственную киназу 2, aurora/IPL1-родственную киназу 2, AIK2, ARK2, AIM-1 и AIM1), регулирующая сигнал апоптоза киназа 1 (Ask1), TLK1 (например, с регистрационным номером NM_012290), NLK (например, с регистрационным номером. NM_016231), GRAF (например, с регистрационным номером NM_015071), GCK (например, с регистрационным номером NM_000162), ERK5 (например, с регистрационным номером NM_002749), FGR (например, с регистрационным номером NM_005248), ACVRL1 (например, с регистрационным номером NM_000020), MEKK5 (например, с регистрационным номером NM_002757), PIP5K1C (например, с регистрационным номером ХМ_047620), МАРКАРК2 (например, с регистрационным номером NM_004759), RFT1 (например, с регистрационным номером NM_052859), MKNK1 (например, с регистрационным номером NM_003684), PLXNB1 (например, с регистрационным номером NM_002673). Дополнительные примеры апоптоз-индуцирующих агентов включают, например агенты, которые усиливают экспрессию и/или стабильность DR5 и DR4, агенты, которые усиливают активность или стабильность каспаз, и агенты, которые индуцируют или усиливают реакцию, связанную с повреждением ДНК. Агонисты или миметики в вышеуказанном перечне включают сами генные продукты, например, р53 представляет собой агонист р53. Антагонисты включают агенты, которые непосредственно ингибируют активность, и агенты, которые опосредованно ингибируют активность, снижая экспрессию или стабильность молекулы мРНК-мишени (например, siPHK) или белка.
Апоптоз-индуцирующие агенты, которые можно идентифицировать по целевому воздействию этих генных продуктов, включают соединения различной химической природы. Например, модуляторы этих генных продуктов можно подвергать скринингу с использованием библиотек полипептидов, миметиков с бета-витком, полисахаридов, фосфолипидов, гормонов, простагландинов, стероидов, ароматических соединений, гетероциклических соединений, бензодиазепинов, олигомерных N-замещенных глицинов, олигокарбаматов, полипептидов, сахаридов, жирных кислот, стероидов, пуринов, пиримидинов, их производных, структурных аналогов или их комбинаций.
В некоторых вариантах осуществления изобретения апоптоз-индуцирующий агент представляет собой полинуклеотид. Например, он может представлять собой siPHK, оказывающую воздействие на ген, который ингибирует индуцируемый TRAIL апоптоз (например, UbcH10 или молекулы, перечисленные в верхней части фиг.28). В других вариантах осуществления изобретения апоптоз-индуцирующий агент представляет собой низкомолекулярное соединение (например, молекулу с молекулярной массой менее 1500 Да и в некоторых случаях менее 1000 Да). Например, апоптоз-индуцирующий агент может представлять собой низкомолекулярное соединение, которое ингибирует экспрессию или активность генного продукта, который ингибирует индуцируемый TRAIL апоптоз (например, UbcH10 или молекулы, перечисленные в верхней части фиг.28). Апоптоз-индуцирующий агент может представлять собой также низкомолекулярное соединение, которое усиливает экспрессию или активность генного продукта, увеличивающего индуцируемый TRAIL апоптоз (например, UbcH10 или молекулы, перечисленные в нижней части фиг.28). Методы скрининга модуляторов (включая низкомолекулярные модуляторы) генов и кодируемых ими полипептидов и методы получения siPHK или других полипептидов-ингибиторов известных генов хорошо известны в данной области (см., US 6573099 и 6506559; Principles and Practice of High Throughput Screening, под ред. К. Murray, изд-во CRC Press (2003); High Throughput Screening: Methods and Protocols, под ред. W. Janzen, изд-во Humana Press (2002); публикации РСТ WO 95/35503, WO 95/30642 и WO 91/18980; Schultz и др., Bioorg Med Chem Lett 8, 1998, cc.2409-2414; и Weller и др., Mol Divers. 3, 1997, cc.61-70). Другие методы, которые можно применять для скрининга модуляторов этих генов и их продуктов, описаны, например у Sambrook и др., Molecular Cloning: A Laboratory Manual, изд-во Cold Spring Harbor Press, N.Y., 3-е изд. (2000); и у Ausubel и др. Current Protocols in Molecular Biology, изд-во John Wiley & Sons, Inc., New York (1999).
В некоторых вариантах осуществления изобретения апоптоз-индуцирующий агент конъюгируют с антителом-агонистом к DR4 или к DR5. В других вариантах осуществления изобретения апоптоз-индуцирующий агент не конъюгируют с антителом-агонистом к DR4 или к DR5.
В некоторых вариантах осуществления изобретения апоптоз-индуцирующий агент не представляет собой TNF-альфа, TNF-бета, AIM I, AIM II, лиганд Fas или VEGI.
1. SMAC
В некоторых вариантах осуществления изобретения апоптоз-индуцирующий агент представляет собой SMAC/Diablo или миметик или агонист SMAC. SMAC/Diablo усиливает каспазную активность путем связывания белков-ингибиторов апоптоза (IAP) (см., например, Du и др. Cell 102, 2000, cc.33-42; Verhagen и др., Cell 102, 2000, cc.43-53; заявка на US № 2002/0110851). Введение в клетки или экспрессия SMAC в клетках подпадают под объем настоящего изобретения. Можно также экспрессировать или вводить фрагменты SMAC, такие как N-концевые пептиды SMAC (например, N-концевые тетра- или гептапептиды (Guo и др., Blood 99(9), 2002, cc.3419-3426; Srinivasula и др., J. Biol. Chem. 275, 2000, cc.36152-36157) (см. также заявку US 2002/0132786).
Кроме того, согласно настоящему изобретению можно использовать соединения-миметики SMAC. Эти соединения могут обладать ценными фармацевтическими свойствами и обладать более высокой эффективностью при введении с антителами к DR4 или к DR5. Примеры миметиков SMAC включают, например пептиды, в том числе тетрапептиды, которые связывают поверхностные желобки в BIR-домене IAP, включая тетрапептиды формулы X1X2X3X4, в которой X1 обозначает А, Х2 обозначает V, Т или I, Х3 обозначает Р или А и Х4 обозначает F, Y, I или V, или другие пептиды, агонисты или пептидомиметики SMAC, которые описаны в РСТ WO 02/26775. Другие примеры миметиков SMAC включают LBP672 (см., например, фиг.15 и пример 54).
2. Ингибиторы протеосомы 26S
В некоторых вариантах осуществления изобретения апоптоз-индуцирующий агент представляет собой ингибитор протеосомы 26S. Ингибиторы протеосом представляют собой агенты, которые ингибируют путь метаболизма протеосома-убикитин, препятствуя тем самым расщеплению 1кВ и последующей ядерной локализации партнера IkВ - NFκB. Протеосома имеет два функциональных компонента: коровая каталитическая субъединица 20S и регуляторная субъединица 19S. Субъединицы 20S и 19S формируют 26S-комплекс, расщепляющий белки, которые могут расщепляться при добавлении убикитина. Примеры ингибиторов протеосом включают, например PS-341 (NSC.№ 681239, называемый также бортезомиб) и его аналоги (см., например, Adams, Cur. Opin. Chem Biol. 6, 2002, cc.493-500). PS-341 и другие ингибиторы протеосом, которые можно применять в способах, предлагаемых в настоящем изобретении, описаны в US 5780454, который включен в настоящее описание в качестве ссылки.
Другие примеры ингибиторов протеосом включают, например лактацистин, PS-273 (NSC № 681226); PS-293 (NSC № 681227); PS-296 (NSC № 681228); PS-303 (NSC № 681229); PS-305 (NSC № 681231); PS-313 (NSC № 681234); PS-321 (NSC № 681236); PS-334 (NSC № 681237); PS-364 (NSC № 681242); PS-325 (NSC № 683086); PS-352 (NSC № 683094); PS-383 (NSC«№ 683098), YU101 (ac-hFLFL-эпоксид (см., например, Elofsson и др.,Chem. Biol. 6, 1999, cc.811-822), MG262, MG132, MG115, PSI (протеосомный ингибитор N-бензилоксикарбонил-IIе-Glu(O-/трет-бутил)-Аlа-лейцинал). Наборы для осуществления анализов с целью идентификации ингибиторов протеосом, поступают в продажу, например от фирмы Discoverx (Фремонт, шт.Калифорния).
Хотя применение комбинации ингибиторов протеосомы 26S с агонистами DR4 или DR5 (например, антителами к DR4 или к DR5, предлагаемыми в настоящем изобретении) может обеспечивать эффективное лечение широкого спектра гиперпролиферативных заболеваний, эта комбинация может быть наиболее эффективной в отношении раковых клеток с дефектами Вах или других компонентов митохондриального пути апоптоза (например, Bc1-x1 или Вс1-2). Например, у пациентов, страдающих раком ободочной кишки, часто присутствуют опухолевые клетки с дефектом Вах. Таким образом, ингибитор протеосомы, объединенный с антагонистом DR4 или DR5, особенно эффективен при лечении таких типов рака ободочной кишки, которые несут дефекты Вах или другие дефекты связанного с митохондриями апоптоза.
В некоторых вариантах осуществления изобретения ингибитор протеосом представляет собой соединение формулы I
в которой
R1 обозначает незамещенный или замещенный арил; арилалкилкарбонил, в котором арильный остаток может быть незамещенным или замещенным; незамещенный или замещенный гетероциклил; или гетероциклилалкилкарбонил, в котором гетероциклильный остаток может быть незамещенным или замещенным;
R2 обозначает незамещенный или замещенный арил или незамещенный или замещенный гетероарил;
R3 обозначает водород, незамещенный или замещенный арил или алкил, который является незамещенным или может быть замещен незамещенным или замещенным циклоалкилом, незамещенным или замещенным арилом или незамещенным или замещенным гетероарилом, содержащим по меньшей мере один атом азота;
R4 обозначает радикал формулы IA,
в которой A1 и A2 обозначают гидроксигруппу или замещенную гидроксигруппу или вместе с атомом бора, с которым он связан, и двумя связанными атомами кислорода образует кольцо формулы IA*,
в котором W обозначает алкилен, замещенный алкилен, незамещенный или замещенный циклоалкилен, незамещенный или замещенный бициклоалкилен или незамещенный или замещенный трициклоалкилен; и
R5 обозначает незамещенный или замещенный алкил, незамещенный или замещенный арил, незамещенный или замещенный гетероциклил или незамещенный или замещенный циклоалкил; или их соли.
В контексте формулы I общие применяемые понятия имеют следующие значения:
Арил предпочтительно имеет кольцевую систему, состоящую не более чем из 20 атомов углерода, прежде всего не более чем из 12 атомов углерода, предпочтительно является моно-, би- или трициклическим и является незамещенным или может быть замещен предпочтительно в каждом случае незамещенным или замещенным фенилом или (прежде всего 1- или 2-)нафтилом, одним или несколькими заместителями, предпочтительно независимо друг от друга выбранными из группы, включающей алифатический радикал; свободную, этерифизированную до простого или сложного эфира гидроксигруппу; свободную или этерифицированную до сложного эфира карбоксигруппу; формил; алканоил; незамещенную, моно- или дизамещенную аминогруппу; меркаптогруппу; сульфогруппу; алкилтиогруппу; карбамоил; N-алкилкарбамоил; N-диалкилкарбамоил; фенил; нафтил; гетероциклил, прежде всегоу пиридил; цианогруппу и нитрогруппу, более предпочтительно выбранными из ряда, включающего алкил, например метил, этил или пропил; алкоксигруппу, например метоксигруппу или этоксигруппу; дизамещенную аминогруппу, например диметиламиногруппу; галоген, например хлор или бром; галоалкил, например трифторметил; и фенил, (прежде всего 1- или 2-)нафтил и гетероциклил, прежде всего имеющий указанные ниже значения, предпочтительно пиридил, например 3-, 4- или прежде всего 2-пиридил, который в каждом случае является незамещенным или может иметь один или несколько, прежде всего вплоть до 3, заместителей, которые предпочтительно независимо друг от друга выбраны из других уже упомянутых арильных заместителей. Арил в качестве R1 более предпочтительно обозначает бифенилил, прежде всего 2-, 4- или предпочтительно 3-бифенилил, пиридилфенил, прежде всего 4-, 3- или наиболее предпочтительно 2-пиридил(2-, 4- или предпочтительно 3-)фенил, или (низш.)алкилфенил, прежде всего пропилфенил, например 2-, 4- или прежде всего 3-изопропилфенил. Арилалкилкарбонил в качестве R1 (незамещенный или предпочтительно замещенный арилом) предпочтительно обозначает арил(низш.)алкилкарбонил, в котором арил имеет указанные выше значения, более предпочтительно фенил(низш.)алкилоксифенил(низш.)алкилкарбонил, прежде всего 2-, 4- или предпочтительно 3-бензилоксифенил-ацетил или -пропионил, пиридил(низш.)алкилоксифенил(низш.)алкилкарбонил, прежде всего 2-, 4- или предпочтительно 3-(пиридин-2-, -4- или предпочтительно -3-)ацетил или -пропионил, или фенил(низш.)алкилкарбонил, прежде всего фенил-2- или предпочтительно 3-фенилпропионил или фенилацетил, где фенил является незамещенным или может иметь вплоть до 3 заместителей, независимо друг от друга выбранных из ряда, включающего (низш.)алкоксигруппу, прежде всего метоксигруппу, галоген, прежде всего фтор или хлор, или гало(низш.)алкил, такой как трифторметил. Незамещенный или замещенный арил в качестве R2 или (независимо) R3 предпочтительно обозначает моно-, ди- или тризамещенный фенил, который прежде всего может иметь вплоть до 4 заместителей, независимо друг от друга выбранных из заместителей, которые указаны выше для арила, прежде выбранных всего из ряда, включающего гидроксигруппу, (низш.)алкоксигруппу (наиболее предпочтительно), предпочтительно метоксигруппу, галоген, предпочтительно фтор или хлор, и гало(низш.)алкил, предпочтительно трифторметил, прежде всего фенил, который может иметь в качестве заместителей вплоть до 3 (низш.)алкоксигрупп, предпочтительно метоксигрупп, или в случае R3 обозначает незамещенный фенил или в дополнение к этому незамещенный или замещенный нафтил, прежде всего 1- или 2-нафтил, который является незамещенным или может иметь вплоть до 4 заместителей, независимо друг от друга выбранных из заместителей, которые указаны выше для арила, прежде всего выбранных из ряда, включающего гидроксигруппу, (низш.)алкоксигруппу (наиболее предпочтительно), предпочтительно метоксигруппу, галоген, предпочтительно фтор или хлор, и гало(низш.)алкил, предпочтительно трифторметил.
Незамещенный гетероциклил предпочтительно обозначает гетероциклический радикал, который может быть ненасыщенным, насыщенным или частично насыщенными в присоединенном кольце и предпочтительно обозначает моноциклическое или в более широком смысле бициклическое или трициклическое кольцо; имеет 3-24, более предпочтительно 4-16 кольцевых атомов; при этом по меньшей мере в кольце, присоединенном к радикалу молекулы формулы I, один или несколько, предпочтительно 1-4, прежде всего 1 или 2 атома углерода соответствующего арильного радикала, замещены гетероатомом, выбранным из группы, включающей азот, кислород и серу, присоединенное кольцо предпочтительно имеет 4-12, прежде всего 5-7 кольцевых атомов; гетероарил является незамещенным или может быть замещен одним или несколькими, прежде всего 1-3, заместителями, независимо друг от друга выбранными из группы, которая включает заместители, указанные выше в качестве заместителей замещенного арила; и прежде всего обозначает гетероарильный радикал, выбранный из группы, включающей имидазолил, тиенил, фурил, тетрагидрофурил, пиранил, тиантренил, изобензофуранил, бензофуранил, хроменил, 2H-пирролил, пирролил, пирролинил, пирролидинил, имидазолил, имидазолидинил, бензимидазолил, пиразолил, пиразолидинил, пираноил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиперидил, пиперазинил, пиридазинил, морфолинил, тиоморфолинил, индолизинил, изоиндолил, 3H-индолил, индолил, индазолил, триазолил, тетразолил, пуринил, 4H-xинoлизинил, изохинолил, хинолил, тетрагидрохинолил, тетрагидроизохинолил, декагидрохинолил, октагидроизохинолил, бензофуранил, бензотиофенил, фталазинил, нафтиридинил, хиноксалил, хиназолинил, циннолинил, птеридинил, карбазолил, β-карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, фуразанил, феназинил, фенотиазинил, феноксазинил, изохроманил и хроманил, при этом каждый из указанных радикалов является незамещенным или может быть замещен 1-2 радикалами, выбранными из группы, включающей (низш.)алкил, прежде всего метил или третбутил, (низш.)алкоксигруппу, прежде всего метоксигруппу, и галоген, прежде всего бром или хлор; пиридил, прежде всего 2- или 3-пиридил, или индолил, наиболее предпочтительно в более широком смысле (низш.)алкилпиридил, пиримидинил или (низш.)алкилпиримидинил, гало(низш.)алкилпиридил, (низш.)алкоксипиридил, ди(низш.)алкилпиридил или галопиридил. Гетероциклил является незамещенным или может иметь один или несколько, предпочтительно вплоть до 3 заместителей, независимо друг от друга выбранных из заместителей, которые указаны выше для арила (где гетероциклил в качестве заместителя гетероциклила не имеет другого гетероциклильного заместителя, отличного от пиридила или индолила), и из арила, как он определен выше, прежде всего фенила, предпочтительно из заместителей, указанных в качестве предпочтительных. Предпочтительным является незамещенный гетероциклил.
В гетероциклилалкилкарбониле в качестве R1 гетероциклильный остаток предпочтительно обозначает замещенный или прежде всего незамещенный гетероциклил, как он определен выше; предпочтительно обозначает замещенный или предпочтительно незамещенный гетероциклил(низш.)алкил, прежде всего замещенный на конце или предпочтительно незамещенный гетероциклил, где гетероциклил имеет указанные выше значения; предпочтительно обозначает пиридил(низш.)алкилкарбонил, такой как -ацетил или -пропионил.
В качестве R1 предпочтительным является незамещенный или замещенный арил или замещенный арил(низш.)алкилкарбонил.
Гетероарил в качестве R2 предпочтительно обозначает незамещенный или замещенный гетероарил, как он определен выше, прежде всего индолил, который является незамещенным или может иметь один или несколько, прежде всего вплоть до 3, заместителей, независимо друг от друга выбранных из указанных выше для замещенного арила, прежде всего выбранных из группы, включающей гидроксигруппу, (низш.)алкоксигруппу (наиболее предпочтительно), предпочтительно метоксигруппу, галоген, предпочтительно фтор или хлор, и гало(низш.)алкил, предпочтительно трифторметил.
R2 предпочтительно обозначает замещенный арил.
Алифатический радикал предпочтительно имеет вплоть до 12 атомов углерода, предпочтительно вплоть до 7 атомов углерода, наиболее предпочтительно вплоть до 4 атомов углерода, и обозначает алифатический углеводородный радикал, такой как незамещенный или замещенный алкинильный, алкенильный или предпочтительно алкильный радикал, более предпочтительно (низш.)алкил, прежде всего метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил или трет-бутил.
Алкил, который может быть разветвленным или линейным, предпочтительно имеет вплоть до 12 атомов углерода и более предпочтительно обозначает (низш.)алкил. Алкил в качестве R3 предпочтительно обозначает (низш.)алкил, прежде всего изобутил.
Приставка «(низш.)» обозначает радикал, имеющий вплоть до и включительно 7, предпочтительно вплоть до и включительно 4 атома углерода.
(Низш.)алкил предпочтительно обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил или н-гептил, предпочтительно изобутил, втор-бутил, трет-бутл, изопропил, этил или метил, наиболее предпочтительно изопропил, этил или метил.
Этерифицированная до простого эфира гидроксигруппа обозначает, например алкоксигруппу, прежде всего (низш.)алкоксигруппу, например этоксигруппу или метоксигруппу, арилоксигруппу, прежде всего фенилоксигруппу, арил(низш.)алкоксигруппу, прежде всего фенил(низш.)алкоксигруппу, гетероциклилоксигруппу, прежде всего пиридилоксигруппу, или гетероциклил(низш.)алкоксигруппу, прежде всего пиридил(низш.)алкоксигруппу (где арил и гетероциклил предпочтительно имеют указанные выше значения).
Этерифицированная до сложного эфира гидроксигруппа предпочтительно обозначает гидроксигруппу, этерифицированную органической карбоновой кислотой, такой как алкановая кислота, например (низш.)алканоилоксигруппу.
Этерифицированная до сложного эфира карбоксигруппа обозначает, например алкоксикарбонил, прежде всего (низш.)алкоксикарбонил, такой, например, как метоксикарбонил.
Моно- или дизамещенная аминогруппа обозначает предпочтительно N-алкиламиногруппу или N,N-диалкиламиногруппу, прежде всего N-(низш.)алкиламиногруппу или (низш.)-N,N-ди(низш.)алкиламиногруппу, такую как N-метиламиногруппа или N,N-диметиламиногруппа.
Галоген обозначает фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром.
Незамещенный или замещенный циклоалкил предпочтительно имеет вплоть до 12, более предпочтительно 3-8 кольцевых карбонильных атомов и может иметь один или несколько, прежде всего вплоть до 3, заместителей, независимо друг от друга выбранных из указанных выше для замещенного арила, или предпочтительно является незамещенным. Предпочтительно обозначает циклопентил, циклогексил или циклогептил.
В алкильном остатке R3, который замещен незамещенным или замещенным циклоалкилом, алкил предпочтительно имеет указанные выше значения, более предпочтительно обозначает (низш.)алкил, прежде всего изопропил, и (предпочтительно на конце) замещен циклоалкилом, как указано выше.
В алкильном остатке R3, который замещен незамещенным или замещенным арилом, алкил предпочтительно имеет значения, указанные в последнем абзаце, а арил имеет указанные выше значения и имеет один или несколько, предпочтительно вплоть до 3 заместителей, независимо друг от друга выбранных из указанных для замещенного арила, или является незамещенным; прежде всего арил обозначает фенил, который имеет один или несколько, предпочтительно вплоть до 3 заместителей, независимо друг от друга выбранных из галогена, прежде всего фтора, гидроксигруппы или (низш.)алкоксигруппы, прежде всего метоксигруппы, или обозначает незамещенный фенил.
В алкильном остатке R3, который замещен незамещенным или замещенным гетероциклилом, алкил предпочтительно имеет значения, указанные для алкильного остатка R3, который замещен циклоалкилом, а гетероциклил имеет указанные выше значения и имеет один или несколько, предпочтительно вплоть до 3 заместителей, независимо друг от друга выбранных из указанных для замещенного гетероциклила, или является незамещенным.
Если A1 и A2 каждый обозначает замещенную гидроксигруппу, то замещенная гидроксигруппа предпочтительно обозначает алкилоксигруппу, прежде всего (низш.)алкилоксигруппу, арилоксигруппу, прежде всего незамещенную или замещенную арилом, как он определен выше, или циклоалкилоксигруппу, незамещенную или замещенную циклоалкилом, как он определен выше.
Если A1 и A2 вместе с присоединенным атомом бора и атомами кислорода образуют кольцо или указанный выше фрагмент формулы IA*, то W предпочтительно несет два атома кислорода, связанных с атомами бора на двух различных атомах углерода, которые пространственно близко расположены или являются соседними атомами углерода, прежде всего в соседнем («1,2-») или в «1,3»-положении (относительно друг друга).
Алкилен предпочтительно обозначает неразветвленный С2-С12-, предпочтительно С2-С7алкиленовый остаток, например этилен или пропилен, в более широком аспекте бутилен, пентилен или гексилен, связанный через два различных атома углерода, как описано выше, предпочтительно в соседнем или в «1,3»-положении. Один или несколько, прежде всего один атом углерода, не связанный с атомами кислорода, которые присоединены к атому бора, можно заменять гетероатомом, выбранным из О, S или предпочтительно N (который несет требуемое количество атомов Н соответственно), например в 1,5-(3-азапентилене).
Замещенный алкилен предпочтительно обозначает неразветвленный (низш.)алкиленовый остаток, имеющий указанные выше значения, который является незамещенным или может иметь один или несколько, прежде всего вплоть до 3 заместителей, предпочтительно независимо друг от друга выбранных из (низш.)алкила, такого как метил или этил, например в 1-метилэтилене, 1,2-диметилэтилене, гидроксигруппы, например в 2-гидроксипропилене, или гидрокси(низш.)алкила, такого как гидроксиметил, например в 1-гидроксиметилэтилене.
Незамещенный или замещенный циклоалкилен предпочтительно обозначает C3-C12-, более предпочтительно С3-С8циклоалкилен, связанный через два различных атома углерода, как описано для W, предпочтительно в соседнем или в «1,3»-положении, такой как циклогексилен или циклопентилен, в котором один или несколько, прежде всего один атом углерода, не связанный с атомами кислорода, которые присоединены к атому бора, можно заменять гетероатомом, выбранным из О, S или предпочтительно N (который несет требуемое количество атомов Н соответственно), например в тетрагидрофурилене или тетрагидропиранилене, и он может являться незамещенным или может иметь один или несколько, прежде всего вплоть до 3 заместителей, независимо друг от друга выбранных из (низш.)алкила, такого как метил или этил, гидроксигруппы, гидрокси(низш.)алкила, например метоксигруппы, или моно- или олигосахаридил, связанный через атом кислорода («олигосахаридил» предпочтительно имеет вплоть до 5 остатков сахаридила).
Незамещенный или замещенный бициклоалкилен предпочтительно обозначает С5-С12бициклоалкилен, связанный через два различных атома углерода, как описано для W, предпочтительно в соседнем или в «1,3»-положении, в котором один или несколько, прежде всего один атом углерода, не связанный с атомами кислорода, которые присоединены к атому бора, можно заменять гетероатомом, выбранным из О, S или предпочтительно N (который несет требуемое количество атомов Н соответственно), и он может являться незамещенным или может иметь один или несколько, прежде всего вплоть до 3 заместителей, независимо друг от друга выбранных из (низш.)алкила, такого как метил или этил, гидроксигруппы и гидрокси(низш.)алкила, например метоксигруппы. Предпочтительным является пинанилен (2,3-(2,6,6-триметилбицикло[3.1.1]гептан)).
Незамещенный или замещенный трициклоалкилен предпочтительно обозначает С8-С12 трициклоалкилен, связанный через два различных атома углерода, как описано для W, предпочтительно в соседнем или в «1,3»-положении, в котором один или несколько, прежде всего один атом углерода, не связанный с атомами кислорода, которые присоединены к атому бора, можно заменять гетероатомом, выбранным из О, S или предпочтительно N (который несет требуемое количество атомов Н соответственно), и он может являться незамещенным или может иметь один или несколько, прежде всего вплоть до 3 заместителей, независимо друг от друга выбранных из (низш.)алкила, такого как метил или этил, гидроксигруппы, гидрокси(низш.)алкила, например метоксигруппы.
Наиболее предпочтительно R4 обозначает -В(ОН)2 или 2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил, прежде всего (1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил.
В незамещенном или замещенном алкильном остатке R5 алкил, который может быть разветвленным или линейным, предпочтительно имеет вплоть до 12 атомов углерода и более предпочтительно обозначает (низш.)алкил. Алкил в качестве R5 предпочтительно обозначает (низш.)алкил, прежде всего изопропил. Могут присутствовать заместители, которых может быть один или несколько, прежде всего вплоть до 2, независимо друг от друга выбранные из группы, включающей незамещенный или замещенный арил (прежде всего фенил или гидроксифенил), незамещенный или замещенный гетероциклил (прежде всего имидазолил или индолил), незамещенный или замещенный циклоалкил, который имеет указанные выше значения; гидроксигруппу (предпочтительно), карбоксигруппу (предпочтительно), карбамоил, меркаптогруппу, (низш.)алкилтиогруппу, например метилтиогруппу, фенил, гидроксифенил, индолил, имидазолил, аминогруппу, три(низш.)алкиламиногруппу, например триметиламиногруппу, (низш.)алканоиламиногруппу, например ацетиламиногруппу, гуанидиногруппу, N-(низш.)алкилгуанидиногруппу, например N-метилгуанидиногруппу, или любой иной заместитель, находящийся на конце аминокислоты, которая содержит R5. Предпочтительно R5 может обозначать метил, изопропил, изобутил, втор-бутил, меркаптометил, 2-метилтиоэтил, фенилметил, гидроксифенилметил, индол-3-илметил, гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, карбамоилметил, 2-карбамоилэтил, 4-аминобутил, 3-гуанидинопропил, 5-имидазолилметил, карбоксиметил или 2-карбоксиэтил.
Асимметричные атомы углерода, которые присутствуют в соединении формулы I, могут находиться в (R)-, (S)- или (R,S)-конфигурации, предпочтительно в (R)- или (S)-конфигурации, наиболее предпочтительно в конфигурации, указанной в формуле I* ниже. Заместители на двойной связи или на кольце могут присутствовать в цис- (=Z-) или транс- (=Е-) форме. Таким образом, соединения могут присутствовать в виде смесей изомеров или предпочтительно в виде чистых изомеров.
Солеобразующие группы в соединении формулы I представляют собой группы или радикалы, обладающие основными или кислотными свойствами. Соединения, имеющие по меньшей мере одну основную группу, или по меньшей мере один основный радикал, например аминогруппу, вторичную аминогруппу, которая не образует пептидную связь или а пиридильный радикал, могут образовывать кислотно-аддитивные соли, например с неорганическими кислотами, такими как соляная кислота, серная кислота или фосфорная кислота, или с приемлемыми органическими карбоновыми или сульфоновыми кислотами, например с алифатическими моно- или дикарбоновыми кислотами, такими как трифторуксусная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, гидроксималеиновая кислота, яблочная кислота, винная кислота, лимонная кислота или щавелевая кислота, или с аминокислотами, такими как аргинин или лизин, с ароматическими карбоновыми кислотами, такими как бензойная кислота, 2-феноксибензойная кислота, 2-ацетоксибензойная кислота, салициловая кислота, 4-аминосалициловая кислота, с ароматическими-алифатическими карбоновыми кислотами, такими как миндальная кислота или коричная кислота, с гетероароматическими карбоновыми кислотами, такими как никотиновая кислота или изоникотиновая кислота, с алифатическими сульфоновыми кислотами, такими как метан-, этан- или 2-гидроксиэтансульфоновая кислота, или с ароматическими сульфоновыми кислотами, такими как бензол-, пара-толуол- или нафталин-2-сульфоновая кислота. Если присутствует несколько основных групп, то могут образовываться моно- или поликислотно-аддитивные соли.
Соединения формулы I, которые имеют кислотные группы, например свободную бороновую кислотную группу (-В(ОН)2, т.е. в формуле IA* ai и А; каждый обозначают гидроксигруппу) или карбоксигруппу, могут образовывать соли металлов или аммония, такие как соли щелочных или щелочно-земельных металлов, например соли натрия, калия, магния или кальция, или аммониевые соли, образованные с аммиаком или с приемлемыми органическими аминами, такими как третичные моноамины, например триэтиламин или три(2-гидроксиэтил)амин, или с гетероциклическими основаниями, например N-этилпиперидином или N,N'-диметилпиперазином. Могут присутствовать смеси солей.
Соединения формулы I, которые имеют как кислотные, так и основные группы, могут образовывать внутренние соли.
Примерами соединений формулы I являются соединения, в которых
R1 обозначает либо замещенный арил(низш.)алкилкарбонил, либо незамещенный или замещенный арил,
R2 обозначает замещенный арил или незамещенный или замещенный гетероциклил,
R3 обозначает (низш.)алкил, незамещенный или замещенный арил или (низш.)алкил, который замещен незамещенным или замещенным арилом,
R4 обозначает фрагмент приведенной выше формулы IA, в которой A1 и А2 обозначают гидроксигруппу, (низш.)алкилоксигруппу, арилоксигруппу, в который арил может быть незамещенным или замещенным, или циклоалкилоксигруппу, в которой циклоалкил может быть незамещенным или замещенным, или в которой A1 и А2, вместе со связывающим атомом бора и двумя связывающими атомами кислорода образует кольцо указанной выше формулы IA*, в которой W обозначает незамещенный или замещенный (низш.)алкилен, связанный посредством двух различных атомов углерода, которые являются пространственно близкими или соседними, прежде всего соседними друг относительно друга, в «1,3»-положении, и
R5 обозначает (низш.)алкил, или их соли.
Примерами соединений формулы I являются соединения, в которых
R1 обозначает фенилоксифенил(низш.)алкилкарбонил; фенил(низш.)алкоксифенил(низш.)алкилкарбонил; пиридилоксифенил(низш.)алкилкарбонил; фенил(низш.)алкилкарбонил, замещенный (низш.)алкоксигруппой, прежде всего метоксигруппой, галогеном, прежде всего фтором или хлором, или гало(низш.)алкилом, прежде всего трифторметилом; или предпочтительно незамещенный или замещенный фенил или нафтил, в которых в обоих случаях, если присутствуют заместители, то один или несколько, прежде всего 1-3 заместителя независимо друг от друга выбраны из группы, включающей (низш.)алкил, гидроксигруппу, (низш.)алкоксигруппу, (низш.)алканоилоксигруппу, карбоксигруппу, (низш.)алкоксикарбонил, формил, (низш.)алканоил, аминогруппу, N-(низш.)алкиламиногруппу, N,N-ди(низш.)алкиламиногруппу, меркаптогруппу, сульфогруппу, (низш.)алкилтиогруппу, карбамоил, N-(низш.)алкилкарбамоил; N,N-ди(низш.)алкилкарбамоил, фенил, нафтил, пиридил, цианогруппу и нитрогруппу, более предпочтительно (низш.)алкоксиалкоксигруппу, прежде всего метоксигруппу или этоксигруппу;
R2 обозначает фенил, замещенный одним или несколькими, прежде всего 1-3 остатками, независимо друг от друга выбранными из группы, включающей гидроксигруппу, (низш.)алкоксигруппу, прежде всего метоксигруппу, галоген, прежде всего фтор или хлор, и гало-(низш.)алкил, прежде всего трифторметил;
R3 обозначает (низш.)алкил, прежде всего изобутил, фенил или фенил, который имеет один или несколько, прежде всего вплоть до 3 заместителей, независимо друг от друга выбранных из группы, включающей гидроксигруппу, (низш.)алкоксигруппу, прежде всего метоксигруппу, галоген, прежде всего фтор или хлор, и гало(низш.)алкил, прежде всего трифторметил;
R4 обозначает-В(ОН)2 (наиболее предпочтительно) или 2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил, прежде всего (1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил; и
R5 обозначает (низш.)алкил, прежде всего изопропил; или их соли. Примерами соединений формулы I являются соединения, в которых R1 обозначает фенилоксифенилацетил, бензилоксифенилацетил, пиридилоксифенилацетил, бифенилил, пиридилфенил, (низш.)алкилфенил или замещенную фенилпропионилоксигруппу, в которой фенил имеет вплоть до 3 заместителей, независимо друг от друга выбранных из группы, включающей метоксигруппу, фтор, хлор и трифторметил;
R2 обозначает фенил, имеющий в качестве заместителей вплоть до 3 метоксигрупп, прежде всего 2,3,4-триметоксифенил или 3,4,5-триметоксифенил;
R3 обозначает изобутил или фенил, который является незамещенным или имеет вплоть до 3 заместителей, независимо друг от друга выбранных из гидроксигруппы, фтора и метоксигруппы;
R4 обозначает (1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил или прежде всего -B(OH)2; и
R5 обозначает изопропил; или их соли.
Примерами соединений формулы I являются соединения, в которых
R1 обозначает бифенилил, (низш.)алкилфенил, фенил(низш.)алкилкарбонил, феноксифенил(низш.)алкилкарбонил, фенил(низш.)алкоксифенил(низш.)алкилкарбонил или пиридилфенил;
R2 обозначает либо фенил, замещенный 1-3 (низш.)алкоксигруппами, либо фенил(низш.)алкоксифенил;
R3 обозначает (низш.)алкил или фенил(низш.)алкил;
R4 обозначает 4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил, (1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил или -В(ОН)2; и
R5 обозначает (низш.)алкил; или их соли.
Другими примерами соединений формулы I или их солей являются соединения, стереохимическое строение которых представлено в формуле I*
в которой указанная конфигурация представляет собой абсолютную конфигурацию и в которой R1, R2, R3, R4 и R5 имеют значения, указанные для соединения формулы I, прежде всего значения, указанные выше в качестве предпочтительных.
Другими примерами соединений формулы I или их солей являются соединения, стереохимическое строение которых представлено в формуле I**
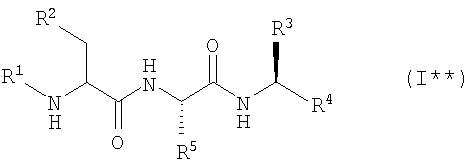
в которой указанная конфигурация представляет собой абсолютную конфигурацию и в которой R1, R2, R3, R4 и R5 имеют значения, указанные для соединения формулы I, прежде всего значения, указанные выше в качестве предпочтительных.
Другими примерами соединений формулы I или их солей являются соединения, стереохимическое строение которых представлено в формуле I***
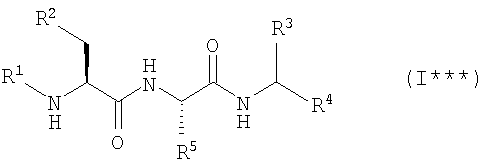
в которой указанная конфигурация представляет собой абсолютную конфигурацию и в которой R1, R2, R3, R4 и R5 имеют значения, указанные для соединения формулы I, прежде всего значения, указанные выше в качестве предпочтительных.
Наиболее предпочтительными являются соединения формулы I, приведенные в примерах, или их фармацевтически приемлемые соли.
Соединения формулы I или их соли получают с помощью известных методов. Предпочтительно методы заключаются в том, что
а) подвергают взаимодействию дипептидный аналог формулы II,
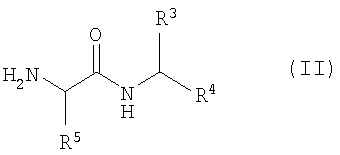
в которой R3, R4 и R5 имеют значения, указанные для формулы I, с аминокислотой формулы III,
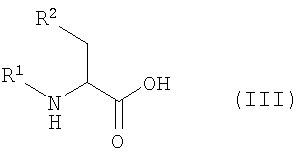
или ее реакционноспособным производным, где R1 и R2 имеют значения, указанные для формулы I, функциональные группы, присутствующие в соединении формулы II и/или III, за исключением участвующих в реакции групп, могут быть защищены при необходимости легко удаляемыми защитными группами, и удаляют любые присутствующие защитные группы, или
б) для получения соединения формулы I, в которой R1 обозначает арилалкилкарбонил или гетероциклилалкилкарбонил, а другие остатки R2-R5 имеют значения, указанные для формулы I, подвергают взаимодействию амин формулы IV,
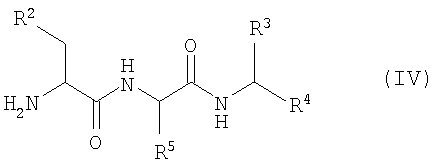
в которой R2, R3, R4 и R5 имеют значения, указанные для формулы I, с угольной кислотой формулы V,
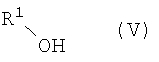
или ее реакционноспособным производным, в котором R1 обозначает арилалкилкарбонил или гетероциклилалкилкарбонил, функциональные группы, присутствующие в соединении формулы IV и/или V, за исключением участвующих в реакции групп, могут быть защищены при необходимости легко удаляемыми защитными группами, и удаляют любые присутствующие защитные группы, и
при необходимости превращают соединение формулы I, полученное с помощью варианта а) или б) способа, в другое соединение формулы I, превращают полученное свободное соединение формулы I в соль, превращают полученную соль соединения формулы I в другую соль или в ее свободную форму и/или разделяют смесь изомерных соединений формулы I с получением индивидуальных изомеров.
Различные возможные стереоизомеры соединений формулы I можно получать, используя выделенные вещества с соответствующей конфигурацией. Например, соединения формулы I* или их соли можно получать способом, заключающимся в том, что
а) подвергают взаимодействию дипептидный аналог формулы II*,
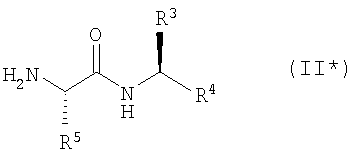
в которой R2, R4 и R5 имеют значения, указанные для формулы I, с аминокислотой формулы III*,
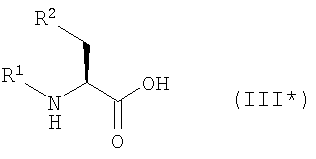
или ее реакционноспособным производным, в котором R1 и R2 имеют значения, указанные для формулы I,
функциональные группы, присутствующие в соединении формулы II* и/или III*, за исключением участвующих в реакции групп, могут быть защищены при необходимости легко удаляемыми защитными группами, и удаляют любые присутствующие защитные группы, или
б) для получения соединения формулы I*, в которой R1 обозначает арилалкилкарбонил или гетероциклилалкилкарбонил, а другие остатки R2-R5 имеют значения, указанные для формулы I, подвергают взаимодействию амин формулы IV*,
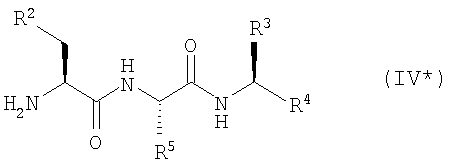
в которой R2, R3, R4 и R5 имеют значения, указанные для формулы I, с угольной кислотой формулы V,
или ее реакционноспособным производным, в котором R1 обозначает арилалкилкарбонил или гетероциклилалкилкарбонил,
функциональные группы, присутствующие в соединении формулы IV* и/или V, за исключением участвующих в реакции групп, могут быть защищены при необходимости легко удаляемыми защитными группами, и удаляют любые присутствующие защитные группы, и
при необходимости превращают соединение формулы I*, полученное с помощью варианта а) или б) способа, в другое соединение формулы I*, превращают полученное свободное соединение формулы I* в соль, превращают полученную соль соединения формулы I* в другую соль или в ее свободную форму.
Конечные продукты формулы I могут содержать заместители, которые можно также использовать в качестве защитных групп в исходных продуктах для получения других конечных продуктов формулы I, например в случае, когда R4 не обозначает -В(ОН)2. Таким образом, в контексте настоящего описания, если не указано иное, только те легко удаляемые группы, которые не являются компонентом конкретного требуемого конечного продукта формулы I, обозначают как «защитная группа».
Защита функциональных групп с помощью таких защитных групп, сами защитные группы и реакции их отщепления описаны, например, в стандартных руководствах, таких как J. F. W. McOmie, «Protective Groups in Organic Chemistry», изд-во Plenum Press, London and New York 1973, у Т. W. Greene и Р. G. M. Wuts, «Protective Groups in Organic Synthesis», 3-е изд., изд-во Wiley, New York 1999, в: «The Peptides»; т.3, под ред.: Е. Gross и J. Meienhofer, изд-во Academic Press, London and New York 1981, в: «Methoden der organischen Chemie» (Методы органической химии), Houben Weyl, 4-ое изд., т.15/1, изд-во Georg Thieme Verlag, Stuttgart 1974, у H.-D. Jakubke и H. Jescheit, «Aminosauren, Peptide, Proteine» (Аминокислоты, пептиды, белки), изд-во Verlag Chemie, Weinheim, Deerfield Beach, and Basel 1982, и у Jochen Lehmann, «Chemie der Kohlenhydrate: Monosaccharide und Derivate» (Химия углеводов.- Моносахариды и производные), изд-во Georg Thieme Verlag, Stuttgart 1974.
Характерной особенностью защитных групп является то, что их можно легко удалять (т.е. без нежелательных вторичных реакций), например путем сольволиза, восстановления, фотолиза или в физиологических условиях (например, путем ферментативного расщепления).
Удаление защитной -В(ОН)2-группы (для получения соединения формулы I, в которой R4 обозначает -В(ОН)2), предпочтительно осуществляют с помощью кислоты, например хлористого водорода, в соответствующем растворителе, например (низш.)алканоле, таком как метанол, или (низш.)алкане, таком как гексан, или в их смеси, при температуре от 0 до 50°С, например при комнатной температуре.
По меньшей мере два варианта способа можно использовать для синтеза ингибиторов протеосом формулы I. В варианте «а» способа реакцию осуществляют путем растворения соединений формул II и III в приемлемом растворителе, например в N,N-диметилформамиде, N,N-диметилацетамиде, N-метил-2-пирролидоне, метиленхлориде, или смеси двух или большего количества указанных растворителей, и путем добавления приемлемого основания, например триэтиламина, диизопропилэтиламина (ДИЭА) или N-метилморфолина, и приемлемого связывающего агента, который образует предпочтительное реакционное производное угольной кислоты формулы III in situ, например дициклогексилкарбодиимида/1-гидроксибензотриазола (ДЦК/ГОБТ); тетрафторбората О-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N',N'-тетраметилурония (ТФТУ); тетрафторбората O-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (ТБТУ); или гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЭДК). Обзор данных о других связывающих агентах см., например у Klauser; Bodansky, Synthesis 1972, cc.453-463. Реакционную смесь предпочтительно перемешивают при температуре от примерно -20 до 50°С, прежде всего при температуре от 0°С до комнатной температуры, получая соединение формулы I. Реакцию предпочтительно осуществляют в атмосфере инертного газа, например азота или аргона.
В варианте «б» способа реакцию предпочтительно осуществляют в условиях, описанных выше для варианта «а» способа.
Соли соединения формулы I, которое несет солеобразующую группу, можно получать хорошо известными методами. Так, кислотно-аддитивные соли соединений формулы I можно получать обработкой кислотой или приемлемым анионообменным реагентом.
Как правило, соли можно превращать в свободные соединения, например обработкой приемлемыми основными агентами, например карбонатами, бикарбонатами или гидроксидами щелочных металлов, как правило, карбонатом калия или гидроксидом натрия.
Стереоизомерные смеси, например смеси диастереомеров, можно разделять на соответствующие изомеры хорошо известными путями с помощью приемлемых методов разделения. Диастереомерные смеси, например, можно разделять на индивидуальные диастереомеры с помощью фракционированной кристаллизации, распределения в растворителях и аналогичными методами. Такому разделению можно подвергать либо один из исходных продуктов, либо само соединение формулы I. Энантиомеры можно разделять посредством образования диастереомерных солей, например путем образования соли с помощью энантиомерно чистой хиральной кислоты, или с помощью хроматографии, например ЖХВР, с использованием хроматографических субстратов с хиральными лигандами.
Соединения формулы I, в которой R4 не обозначает -В(ОН)2, можно превращать в соединения формулы I, в которой R4 обозначает -В(ОН)2, с помощью стандартных методов, например с использованием изобутилбороновой кислоты (i-BuB(OH)2 в присутствии кислоты, прежде всего галогенводородной кислоты, в смеси вода /метанол/гексан при температуре, предпочтительно находящейся в диапазоне от 0 до 50°С, например при комнатной температуре.
В обоих вариантах а) и б) способа для превращения или для синтеза промежуточных или исходных продуктов растворители, из которых можно выбирать растворители, пригодные для рассматриваемой реакции, включают, например воду, сложные эфиры, как правило, (низш.)алкил(низш.)алканоат, например диэтилацетат, простые эфиры, как правило, алифатические простые эфиры, например диэтиловый эфир, или циклические простые эфиры, например тетрагидрофуран, жидкие ароматические углеводороды, как правило, бензол и толуол, спирты, как правило, метанол, этанол или 1- или 2-пропанол, нитрилы, как правило, ацетонитрил, галогенированные углеводороды, как правило, дихлорметан, кислые амиды, как правило, диметилформамид, основания, как правило, гетероциклические азотные основания, например пиридин, карбоновые кислоты, как правило, (низш.)алканкарбоновые кислоты, например уксусную кислоту, ангидриды карбоновых кислот, как правило, ангидриды (низш.)алканкарбоновых кислот, например уксусный ангидрид, циклические, линейные или разветвленные углеводороды, как правило, циклогексан, гексан или изопентан, или смеси указанных растворителей, например водные растворы, если для процесса не указано иное. Такие смеси растворителей можно применять также для обработки, например для хроматографии или распределения.
Новые исходные и/или промежуточные продукты, а также способы их получения являются также объектом настоящего изобретения. В предпочтительном варианте осуществления изобретения применяют такие исходные продукты и выбирают такие реакционные условия, чтобы получать предпочтительные соединения.
Исходные продукты формул II - V или их предшественники являются известными, их можно получать известными методами, или они поступают в продажу; в частности, их можно получать с помощью процессов, идентичных или аналогичных описанным в примерах.
Соединение формулы II, в которой заместители имеют значения, указанные для формулы I, можно получать с помощью следующих реакций:
Прежде всего, бороново-кислотный аналог аминокислоты формулы VI,
который, например, имеет конфигурацию, указанную в формуле VI*,
в которой R3 имеет значения, указанные выше для соединений формулы I, и R4 имеет значения, указанные выше для соединений формулы I кроме -В(ОН)2, предпочтительно обозначает (1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил, или его ее кислотно-аддитивную соль, прежде всего ее соль с трифторуксусной кислотой, конденсируют с аминокислотой формулы VII,
которая, например, имеет конфигурацию, указанную в формуле VII*,
или с ее реакционноспособным производным, в котором R5 имеет значения, указанные выше для соединений формулы I, и Pr1 обозначает защищенную аминогруппу, предпочтительно трет-бутоксикарбониламиногруппу, в реакционных условиях, аналогичных для описанных выше для реакции а) (которая представляет собой также реакцию конденсации, предпочтительно также с образованием in situ активных производных угольной кислоты), получая соединение формулы II в N-защищенной форме, у которого удаляют затем защиту N-группы, например в условиях, описанных в упомянутых выше стандартных руководствах, в случае, например трет-бутоксикарбониламиногруппы, с помощью соляной кислоты в соответствующем растворителе, например диоксане и/или метиленхлориде, получая соединение формулы II, которое можно непосредственно применять в варианте а) способа.
Бороновые кислоты формулы VI являются известными, поступают в продажу и/или их можно синтезировать с помощью известных методов. Например, соединения формулы VI, в которой R3 обозначает (низш.)алкил, прежде всего изобутил, и R4 имеет значения, указанные для соединений формулы VI, предпочтительно (1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил, можно получать взаимодействием соединения формулы VIII,
в которой R4 имеет указанные выше значения, в соответствующем растворителе, например метиленхлориде, с н-(низш.)алкилом лития, прежде всего с н-бутиллитием, и с последующим взаимодействием с хлоридом цинка с получением соединения формулы IX,
в которой R4 имеет значения, указанные выше для формулы VI. Это соединение затем подвергают взаимодействию с LiN(SiСН3)2 и образовавшееся соединение затем подвергают взаимодействию в присутствии трифторуксусной кислоты с получением соли формулы X,
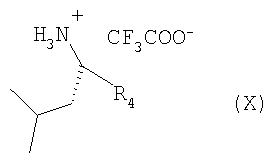
в которой R4 имеет значения, указанные выше для формулы VI, представляющее собой соединение формулы VI, которое затем можно использовать для взаимодействия с соединением формулы VII, как указано выше.
Соединение формулы III является известным, поступает в продажу и/или его можно получать с помощью стандартных методов.
Например, соединение формулы III, в которой R1 обозначает арил, прежде всего бифенилил, можно получать взаимодействием соединения формулы XI,
которое, например, имеет конфигурацию, указанную в формуле XI*,
где R2 имеет значения, указанные для соединения формулы I, которое является известным, поступает в продажу или которое можно получать стандартными методами, с соединением формулы XII,
R1-X (XII)
где R1 обозначает арил и Х обозначает галоген, прежде всего бром, в соответствующем растворителе, например в диметилформамиде, в присутствии основания, прежде всего карбоната щелочного металла, например карбоната калия, при температуре от 50 до 100°С, например при 90°С, предпочтительно в атмосфере инертного газа, например азота или аргона. Этот процесс позволяет непосредственно получать соответствующее соединение формулы III.
Аминокислотные производные формулы VII являются известными, поступают в продажу и/или их можно получать с помощью стандартных методов. Их предпочтительно используют в аминозащищенной форме, например в виде соединений, несущих трет-бутоксикарбониламиногруппу вместо свободной аминогруппы.
Соединения формулы IV можно получать, например путем взаимодействия соединения формулы II, которое имеет, например, конфигурацию, указанную в формуле II*, как указано выше в варианте а) способа, с N-защищенной аминокислотой формулы XIII,
которая имеет, например, конфигурацию, указанную в формуле XIII*,
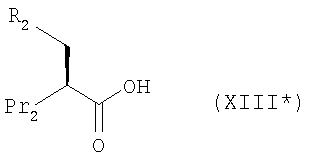
или с ее реакцинноспособным производным, в котором R2 имеет значения, указанные выше для формулы I, и Pr2 обозначает защищенную аминогруппу, прежде всего трет-бутоксикарбониламиногруппу, в предпочтительных условиях реакции конденсации, описанных выше для варианта а) способа. Затем из образовавшегося соединения, т.е. соединения формулы IV, в котором N-концевая аминогруппа присутствует в защищенной форме, удаляют N-концевую защитную группу, например в случае трет-бутоксикарбониламиногруппы с помощью хлористого водорода в диоксане.
В других вариантах осуществления изобретения апоптоз-индуцирующий агент представляет собой ингибитор протеосомы из семейства производных 2,4-диамино-3-гидроксикарбоновых кислот (см. РСТ WO 00/64863). Например, в некоторых вариантах осуществления изобретения ингибитор протеосомы представляет собой производное 2,4-диамино-3-гидроксикарбоновой кислоты формулы XIV,
в которой
А и В независимо друг от друга обозначают связь или незамещенный или замещенный аминоацильный остаток;
R1 обозначает водород; аминозащитную группу; или группу формулы P5Y-, в которой
R5 обозначает водород или незамещенную или замещенную алкильную, алкенильную, алкинильную, арильную, арилалкильную, гетероарильную, гетероарилалкильную, гетероциклильную или гетероциклилалкильную группу; и
Y обозначает -СО-; -NH-CO-; -NH-CS-; -SO2-; -O-CO- или -O-CS-;
R2 обозначает боковую цепь встречающихся в естественных условиях аминокислот; алкильную, арилалкильную, гетероарилалкильную или циклоалкилалкильную группу; или триметилсилилметил, 2-тиенилметил или стирилметил;
R3 обозначает галоген, алкил, алкоксигруппу или гидроксиалкоксигруппу; и
R4 обозначает 2(R)-гидроксииндан-1(S)-ил; (S)-2-гидрокси-1-фенилэтил; или 2-гидроксибензил, незамещенный или замещенный в положении 4 метоксигруппой; при этом, 2,4-диамино-3-гидроксикарбоновая кислота находится в свободной форме, в форме ее фармацевтически приемлемой соли или в форме фармацевтической композиции.
Незамещенный или замещенный алкил предпочтительно представляет собой алкил, имеющий 1-5 атомов углерода, предпочтительно 1-4 атома углерода; например метил, этил, изопропил или трет-бутил; прежде всего имеет 1 или 4 атома углерода. Заместитель представляет собой, например феноксигруппу, гидроксигруппу или незащищенную или защищенную аминогруппу.
Незамещенный или замещенный арилалкил представляет собой, например фенилалкил, содержащий в целом 7-10 атомов углерода, такой как бензил или 2-фенилэтил. Он может быть незамещенным или может быть замещен в арильном или алкильном фрагменте, например гидроксигруппой, такой как бензил-СН(ОН)- или фенил -СH(СН2ОН)-, алкилом, аминогруппой или алкиламиногруппой, или представляет собой, например нафтилалкил, содержащий 1-4 атома углерода в алкиленовом фрагменте, прежде всего нафтилметил.
Аминозащитная группа предпочтительно представляет собой бензилоксикарбонил, циклоалкилалкоксикарбонил, прежде всего циклогексилметоксикарбонил, или трет-бутоксикарбонил. Незамещенный или замещенный гетероарилалкил предпочтительно представляет собой пиридилалкил, прежде всего 2-пиридилметил и 4-пиридилметил.
Арил, гетероарил и арильные фрагменты арилалкила и гетероарилалкила могут быть моно- или полициклическими и представлять собой, например пиридил, нафтил, 9-флуоренилметоксикарбонил (ФМОК) или бензимидазолил. Алкиленовый фрагмент арилалкила или гетероарилалкила может быть замещен, например гидроксигруппой.
Гетероциклильная группа и гетероциклильный фрагмент гетероциклилалкильной группы представляет собой насыщенную гетероциклическую группу, которая содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы. Она предпочтительно содержит 5 или 6 кольцевых структурных атомов и предпочтительно вплоть до 3 гетероатомов.
Циклоалкилалкил предпочтительно представляет собой циклогексилалкил; он предпочтительно содержит 1-4 атома углерода в алкиленовом фрагменте.
Галоген представляет собой фтор, хлор, бром или йод, предпочтительно хлор или бром.
Алкил и алкоксигруппа предпочтительно содержат 1-4 атома углерода, прежде всего 1 или 2 атома углерода, более предпочтительно представляют собой метил или метоксигруппу.
Гидроксиалкоксигруппа предпочтительно представляет собой со-гидроксиалкоксигруппу, содержащую 2-4 атома углерода, прежде всего 2-гидроксиэтоксигруппу.
Соль представляет собой, например кислотно-аддитивную соль, такую как гидрохлорид.
Соединения формулы I имеют несколько хиральных центров и поэтому могут присутствовать в виде различных стереоизомеров. Под объем изобретения, если не указано иное, подпадают все стереоизомеры, а также рацемические смеси. Изомеры можно расщеплять или разделять с помощью общепринятых методов, например хроматографически. Как видно из формулы I, конфигурация на атоме углерода в положении 2 представляет собой R-конфигурацию, в положениях 3 и 4 - S-конфигурацию.
R1 предпочтительно обозначает водород, пиридилалкоксикарбонил, нафтилалкоксикарбонил, нафтилалкилкарбонил, бензил-СН(ОН)-карбонил, феноксиметилкарбонил, фенилалкилкарбонил или аминозащитную группу, такую как трет-бутоксикарбонил, циклоалкилалкоксикарбонил, прежде всего циклогексилметоксикарбонил или бензилоксикарбонил, который является незамещенным или замещен алкилом или аминогруппой; прежде всего обозначает нафтилметоксикарбонил, нафтилметилкарбонил, пиридилметоксикарбонил, фенилпропионил, аминофенилпропионил, трет-бутоксикарбонил, аминобензилоксикарбонил, алкилбензилоксикарбонил, диалкилбензилоксикарбонил или бензилоксикарбонил, более предпочтительно бензилоксикарбонил.
Когда радикал А обозначает незамещенный или замещенный аминоацильный остаток, то он предпочтительно представляет собой незамещенный или замещенный α-аминоацильный остаток, такой как аланин, лейцин, изолейцин, аспарагин, валин, трет-бутилглицин, трет-лейцин или гистидин. Предпочтительно он представляет собой защищенный или незащищенный остаток встречающихся в естественных условиях α-аминокислот, предпочтительно аминокислот, которые представляют собой обычный компонент белков, или трет-лейцин. Предпочтительно он имеет L-конфигурацию. Радикал А прежде всего представляет собой глицин, L-валин, L-трет-лейцин или связь, еще более предпочтительно L-трет-лейцин.
R2 предпочтительно обозначает боковую цепь встречающихся в естественных условиях аминокислот, предпочтительно α-аминокислот, предпочтительно аминокислот, которые представляют собой обычный компонент белков. Он представляет собой, например изопропил, аминокарбонилметил, метил, 1-метилпропил, бензил, 4-гидроксибензил или изобутил, предпочтительно бензил.
Когда радикал В обозначает незамещенный или замещенный аминоацильный остаток, то он предпочтительно представляет собой незамещенный или замещенный α-аминоацильный остаток, такой как фенилаланин, валин, лейцин, изолейцин, аланин или аспарагин. Он предпочтительно представляет собой незамещенный или замещенный остаток встречающихся в естественных условиях α-аминокислот, предпочтительно аминокислот, которые представляют собой обычный компонент белков, α-Аминокислоты, несущие вторую карбоксильную группу, например глутаминовая кислота, предпочтительно этерифицируют C1-С3 спиртом, прежде всего метанолом. Предпочтительно они имеют L-конфигурацию. Радикал В предпочтительно обозначает L-валин, метиловый эфир L-глутаминовой кислоты или связь, еще более предпочтительно L-валин.
R3 предпочтительно обозначает галоген, метил или метоксигруппу, прежде всего метоксигруппу.
R4 предпочтительно обозначает 2(R)-гидроксииндан-1(S)-ил или 2-гидроксибензил, незамещенный или замещенный, как указано выше, прежде всего 2-гидрокси-4-метоксибензил.
Y предпочтительно обозначает -СО- или -O-СО-, прежде всего -O-СО-.
R5 предпочтительно обозначает незамещенную или замещенную алкильную, арилалкильную или гетероарилалкильную группу, прежде всего алкил; когда R5 обозначает незамещенный или замещенный гетероарилалкил, то он предпочтительно представляет собой пиридилалкил, прежде всего 2-пиридилметил; когда R5 обозначает незамещенный или замещенный арилалкил, то он предпочтительно представляет собой бензил-СН(ОН)-; когда R5 обозначает замещенный алкил, то он предпочтительно представляет собой феноксиметил.
В некоторых вариантах осуществления изобретения ингибитор протеосомы представляет собой амидное производное 2-амино-3-гидрокси-4-трет-лейциламино-5-фенилпентановой кислоты (см., например, РСТ 01/89282).
Например, в некоторых вариантах осуществления изобретения ингибиторы протеосом, предлагаемые в изобретении, представляют собой соединения формулы XV
в которой n обозначает 0 или 1;
R1 и R2 независимо друг от друга обозначают алифатический радикал или ароматический, ароматический-алифатический, циклоалифатический, циклоалифатический-алифатический, гетероциклический или гетероциклический-алифатический радикал, при этом каждый радикал имеет не более 20 атомов углерода;
R3 обозначает водород, оксаалкил, алифатический радикал или радикал, имеющий вплоть до 20 атомов углерода, формулы -(Y)m-R6, в которой Y обозначает алкил, m обозначает 0 или 1 и R6 обозначает незамещенный или замещенный моноциклический радикал с 5 или 6 кольцевыми членами, который содержит вплоть до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу, где моноциклический радикал может также быть слит с бензольным кольцом;
R4 и R5 независимо друг от друга выбраны из группы, включающей водород; алифатический радикал; свободную, этерифицированную до простого эфира или этерифицированную до сложного эфира гидроксигруппу; свободную или этерифицированную до сложного эфира карбоксигруппу; формил; алканол; незамещенную, моно- или дизамещенную аминогруппу; меркаптогруппу; сульфогруппу; алкилтиогруппу; карбамоил; N-алкилкарбамоил; N,N-диалкилкарбамоил; цианогруппу и нитрогруппу; при этом углеродсодержащие радикалы R4 и R5 имеют вплоть до 12 атомов углерода, при условии, что R4 и R5 оба не обозначают водород, если n обозначает 1, R1 обозначает бензил или трет-бутил, R2 обозначает бензил или 4-метоксибензил, R3 обозначает изопропил и Х обозначает кислород, и что R4 не обозначает метоксигруппу, если n обозначает 0 или 1, R2 обозначает 4-метоксибензил, R3 обозначает водород и Х обозначает кислород; и
Х обозначает азот, кислород или серу;
или их соли.
Касательно амидных производных 2-амино-3-гидрокси-4-трет-лейциламино-5-фенилпентановой кислоты, то общие понятия, применяемые выше и ниже, предпочтительно имеют следующие значения: n обозначает 0 или 1, предпочтительно 0.
Алифатический радикал несет вплоть до 12 атомов углерода, предпочтительно вплоть до 7 атомов углерода, наиболее предпочтительно вплоть до 4 атомов углерода, и представляет собой незамещенный или замещенный алифатический углеводородный радикал, в том числе, такой как незамещенный или замещенный алкинильный, алкенильный или предпочтительно алкильный радикал, один или несколько заместителей которого предпочтительно независимо друг от друга выбраны из группы, включающей свободную, этерифицированную до простого эфира или этерифицированную до сложного эфира гидроксигруппу; свободную или этерифицированную до сложного эфира карбоксигруппу; формил; алканол; незамещенную, моно- или дизамещенную аминогруппу; гуанидиногруппу; меркаптогруппу; сульфогруппу; алкилтиогруппу; карбамоил; N-алкилкарбамоил; N, N-диалкилкарбамоил; цианогруппу и нитрогруппу.
Алифатический радикал R1 предпочтительно представляет собой (низш.)алкил, предпочтительно, такой как трет-бутил.
Алифатический радикал R3 предпочтительно представляет собой незамещенный (низш.)алкил или (низш.)алкил, замещенный гидроксигруппой, карбоксигруппой, аминогруппой, карбамоилом, гуанидиногруппой, меркаптогруппой или алкилтиогруппой, наиболее предпочтительно боковой цепью аминокислот аланина, лейцина, изолейцина, серина, треонина, цистеина, метионина, аспарагина, глутамина, аспартата, глутамата, лизина или аргинина, прежде всего валина.
Алифатический радикал R4 предпочтительно представляет собой метоксигруппу.
Ароматический радикал R1 или R2 содержит не более 20 атомов углерода, прежде всего не более 12 атомов углерода, и представляет собой незамещенный или замещенный, предпочтительно в каждом случае незамещенный или замещенный фенил или нафтил, прежде всего 1-нафтил, один или несколько заместителей которого независимо друг от друга выбраны из группы, включающей алифатический радикал; свободную, этерифицированную до простого эфира или этерифицированную до сложного эфира гидроксигруппу; свободную или этерифицированную до сложного эфира карбоксигруппу; формил; алканол; незамещенную, моно- или дизамещенную аминогруппу; меркаптогруппу; сульфогруппу; алкилтиогруппу; карбамоил; N-алкилкарбамоил; N,N-диалкилкарбамоил; цианогруппу и нитрогруппу, более предпочтительно выбран из алкила, например метила, этила или пропила; алкоксигруппы, например метоксигруппы или этоксигруппы; дизамещенной аминогруппы, например диметиламиногруппы; галогена, например хлора или брома; и галоалкила, например трифторметила.
В ароматическом-алифатическом радикале R1 или R2, которые имеют не более 20 атомов углерода, ароматический фрагмент имеет указанные выше значения, а алифатический фрагмент предпочтительно обозначает (низш.)алкил, предпочтительно, такой как C1-С2алкил, предпочтительно замещенный заместителями, указанными для ароматического радикала, или предпочтительно является незамещенным. Ароматический-алифатический радикал R1 предпочтительно обозначает бензил или нафталин-1-илметил. Ароматический-алифатический радикал R2 предпочтительно обозначает бензил, замещенный в бензольном остатке 1-5, предпочтительно 1-3 метоксигруппами; бензил, замещенный в бензольном остатке, предпочтительно в положении 4, диметиламиногруппой; или нафталин-1-илметил. Наиболее предпочтительно ароматический-алифатический радикал R2 обозначает 2,3,4- или 3,4,5-триметоксибензил.
Циклоалифатический радикал R1 или R2, содержащий не более 20, прежде всего вплоть до 10 атомов углерода, представляет собой моно- или полициклический радикал с заместителями, указанными для ароматического радикала, циклоалкильный радикал, прежде всего, такой как 5- или 6-членный циклоалкильный радикал, такой как предпочтительно циклогексил.
В циклоалифатическом-алифатическом радикале R1 или R2, который содержит не более 20 атомов углерода, циклоалифатический фрагмент имеет значения, указанные выше для алифатического фрагмента, предпочтительно обозначает (низш.)алкил, предпочтительно, такой как С1-С2алкил, замещенный заместителями, указанными для ароматического радикала, или предпочтительно является незамещенным, например обозначает циклогексилметил.
Гетероциклический радикал R1 или R2 содержит вплоть до 20 атомов углерода, как правило, вплоть до 12 атомов углерода, и замещен предпочтительно заместителями, указанными для ароматического радикала, или является незамещенным и предпочтительно обозначает насыщенный или ненасыщенный моноциклический радикал, содержащий 5 или 6 кольцевых членов и 1-3 гетероатома, которые предпочтительно выбраны из группы, включающей азот, кислород и серу, например тиенил или пиридил, или би- или трициклический радикал, в котором, например бензольный радикал слит с указанным моноциклическим радикалом, прежде всего, например индолил, такой как 5-индолил, или хинолил, такой как 8-хинолил.
В гетероциклическом-алифатическом радикале R1 или R2, который содержит не более 20 атомов углерода, гетероциклический фрагмент имеет значения, указанные выше для алифатического фрагмента, предпочтительно обозначает (низш.)алкил, предпочтительно, такой как С1-С2алкил, замещенный заместителями, указанными для ароматического радикала, или предпочтительно является незамещенным. Гетероциклический-алифатический радикал R1 или R2 обозначает, например, индолилметил, прежде всего 5-индолилметил, или хинолилметил, прежде всего 8-хинолилметил.
Оксаалкильный радикал R3 обозначает радикал формулы -G(O-СН2-СН2)t-R7, в которой G и R7 обозначают алкил, предпочтительно (низш.)алкил, и t обозначает 1-3, предпочтительно 2, и предпочтительно обозначает 2-(1,4-диоксагексил)этил.
В радикале формулы -(Y)m-R6, который содержит вплоть до 20 атомов углерода, Y обозначает алкил, предпочтительно (низш.)алкил, m обозначает О или 1 и радикал R6 обозначает насыщенный или ненасыщенный моноциклический радикал, который содержит 5 или 6 кольцевых членов и вплоть до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу, и в альтернативном варианте содержит слитое бензольное кольцо, такой радикал может быть замещен предпочтительно заместителями, указанными для ароматического радикала, или предпочтительно является незамещенным.
Радикал R6 предпочтительно связан с Y через кольцевой атом углерода и представляет собой, например, незамещенный или замещенный радикал, выбранный из группы, включающей циклопентил, циклогексил, циклопентадиенил, фенил, пирролидил, пиразолил, имидазолидил, тетрагидрофурил, пиперидил, пиперазинил, морфолинил, пирролил, пиразолил, имидазолил, фурил, тиенил, пиридил, пиразинил, пиридазинил, пиримидинил, инденил, нафтил, индолил и хинолил.
Наиболее предпочтительно радикал формулы -(Y)m-R6 представляет собой пиперидил, прежде всего 4-пиперидил, пиперазинэтил, прежде всего пиперазин-1-илэтил, морфолинилэтил, прежде всего морфолин-4-илэтил, пиридилметил, такой как 2-, 3- или 4-пиридилметил, или боковую цепь аминокислот фенилаланина, тирозина, триптофана или гистидина.
Х предпочтительно обозначает кислород (-O-).
Алкил предпочтительно обозначает (низш.)алкил.
Приставка «(низш.)» обозначает радикал, имеющий вплоть до и включительно 7, предпочтительно вплоть до и включительно 4 атома углерода.
(Низш.)алкил предпочтительно обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил или н-гептил, предпочтительно изобутил, втор-бутил, трет-бутил, изопропил, этил или метил, наиболее предпочтительно изопропил, этил или метил.
Этерифицированная до простого эфира гидроксигруппа обозначает, например алкоксигруппу, прежде всего (низш.)алкоксигруппу, например этоксигруппу или метоксигруппу. Этерифицированная до сложного эфира гидроксигруппа предпочтительно обозначает гидроксигруппу, этерифицированную органической карбоновой кислотой, такой как алкановая кислота, или минеральной кислотой, такой как галогенводородная кислота, например обозначает (низш.)алканоилоксигруппу, или прежде всего галогеном, таким как йод или предпочтительно фтор, хлор или бром.
Этерифицированная до сложного эфира карбоксигруппа обозначает, например алкоксикарбонил, прежде всего (низш.)алкоксикарбонил, такой, например, как метоксикарбонил.
Моно- или дизамещенная аминогруппа обозначает предпочтительно N-алкиламиногруппу или N,N-диалкиламиногруппу, прежде всего N-(низш.)алкиламиногруппу или (низш.)-N,N-ди(низш.)алкиламиногруппу, такую, например как N-метиламиногруппа или N,N-диметиламиногруппа.
Галоген обозначает фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром.
Приведенная выше структурная формула XV характеризует абсолютную конфигурацию.
Солеобразующие группы в соединении формулы XV представляют собой группы или радикалы, которые обладают основными или кислотными свойствами. Соединения, которые имеют по меньшей мере одну основную группу или по меньшей мере один основный радикал, например свободную аминогруппу, пиразинильный радикал или пиридильный радикал, могут образовывать кислотно-аддитивные соли, например с неорганическими кислотами, такими как соляная кислота, серная кислота или фосфорная кислота, или с приемлемыми органическими карбоновыми или сульфоновыми кислотами, например с алифатическими моно- или дикарбоновыми кислотами, такими как трифторуксусная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, гидроксималеиновая кислота, яблочная кислота, винная кислота, лимонная кислота или щавелевая кислота, или с аминокислотами, такими как аргинин или лизин, с ароматическими карбоновыми кислотами, такими как бензойная кислота, 2-феноксибензойная кислота, 2-ацетоксибензойная кислота, салициловая кислота, 4-аминосалициловая кислота, с ароматическими-алифатическими карбоновыми кислотами, такими как миндальная кислота или коричная кислота, с гетероароматическими карбоновыми кислотами, такими как никотиновая кислота или изоникотиновая кислота, с алифатическими сульфоновыми кислотами, такими как метан-, этан- или 2-гидроксиэтанульфоновая кислота, или с ароматическими сульфоновыми кислотами, такими как бензол-, пара-толуол- или нафталин-2-сульфоновая кислота. Если присутствует несколько основных групп, то могут образовываться моно- или поликислотно-аддитивные соли.
Соединения формулы XV, которые имеют кислотные группы, например свободную карбоксильную группу в радикале Rio, могут образовывать соли металлов или аммония, такие как соли щелочных или щелочно-земельных металлов, например соли натрия, калия, магния или кальция, или аммониевые соли, образованные с аммиаком или с приемлемыми органическими аминами, такими как третичные моноамины, например триэтиламин или три(2-гидроксиэтил)амин, или с гетероциклическими основаниями, например N-этилпиперидином или N,N'-диметилпиперазином.
Соединения формулы XV, несущие как кислотные, так и основные группы, могут образовывать внутренние соли.
Для целей выделения или очистки, а также в случае соединений, которые дополнительно используются в качестве промежуточных продуктов, можно также применять не приемлемые с фармацевтической точки зрения соли.
Однако в терапевтических целях можно применять только фармацевтически приемлемые нетоксические соли и, следовательно, эти соли являются предпочтительными.
С учетом близкого сходства между новыми соединениями в свободной форме и в форме их солей, включая те соли, которые можно использовать в качестве промежуточных продуктов, например для очистки новых соединений или для их идентификации, при любой ссылке выше и ниже на свободные соединения следует понимать, что они включают соответствующие соли, если это возможно и целесообразно.
VII. Введение и фармацевтические композиции
Антитела и агенты, предлагаемые в изобретении, можно вводить непосредственно млекопитающему для лечения, например гиперпролиферативных заболеваний, таких как (но, не ограничиваясь ими):
карциномы, глиомы, мезотелиомы, меланомы, лимфомы, лейкозы, аденокарциномы, рак молочной железы, рак яичника, рак шейки матки, глиобластома, лимфома, рак предстательной железы и лимфома Беркитта, рак головы и шеи, рак ободочной кишки, колоректальный рак, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак пищевода, рак желудка, рак поджелудочной железы, гепатобилиарный рак, рак желчного пузыря, рак тонкого кишечника, рак прямой кишки, рак почки, рак мочевого пузыря, рак предстательной железы, рак, относящийся к половому члену, рак мочеиспускательного канала, рак яичка, рак шейки матки, рак влагалища, рак матки, рак яичника, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, поджелудочный эндокринный рак, карциноидный рак, рак кости, рак кожи, ретинобластомы, множественные миеломы, лимфома Ходжкина и неходжкинская лимфома (см. другие типы рака в: Cancer:Principles and Practice (под ред. DeVita V.T., 1997).
Введение композиций, предлагаемых в настоящем изобретении, осуществляют любым из путей, обычно применяемых для приведения химиотерапевтического соединения в непосредственный контакт с тканью, подлежащей обработке. Антитела и агенты вводят любым приемлемым образом, необязательно в сочетании с фармацевтически приемлемыми носителями. Приемлемые методы введения таких антител и агентов являются доступными и хорошо известны специалистам в данной области, хотя для введения конкретной композиции можно применять более одного пути и конкретный путь введения может обеспечивать более быструю и более эффективную реакцию по сравнению с другим путем.
Выбор фармацевтически приемлемых носителей зависит, в частности от конкретной, подлежащей введению композиции, а также от конкретного метода, применяемого для введения композиции. Таким образом, существует широкое разнообразие приемлемых форм фармацевтических композиций, предлагаемых в настоящем изобретении (см., например, Remington's Pharmaceutical Sciences, 17-oe изд. 1985)).
Антитела и агенты, индивидуально или в сочетании с другими приемлемыми компонентами, можно включать в состав аэрозольных препаратов (т.е. их можно «распылять») для введения путем ингаляции. Аэрозольные препараты могут включать находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан, пропан, азот и т.п.
Пригодные для введения композиции включают водные и неводные растворы, изотонические стерильные растворы, которые могут содержать антиоксиданты буферы, бактериостатические вещества и растворенные вещества, которые придают композиции изотоничность, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. При практическом воплощении настоящего изобретения композиции можно вводить, например орально, местно, внутривенно, внутрибрюшинно, внутривезикулярно или внутритрахеально. Композиции можно вводить назально. Композиции соединений могут находиться в рассчитанных на одну дозу или на несколько доз запечатанных контейнерах, таких как ампулы и пузырьки. Растворы и суспензии можно приготавливать из стерильных порошков, гранул и таблеток описанного ранее типа. Модуляторы можно вводить также в качестве компонента приготовленной пищи или лекарственного средства. Соединения, предлагаемые в настоящем изобретении, можно также эффективно применять в сочетании с одним или несколькими дополнительными активными агентами (например, химиотерапевтическими агентами) в зависимости от требуемой терапии или действия.
В контексте настоящего описания доза, вводимая пациенту, должна быть достаточной для того, чтобы в течение определенного времени вызывать у пациента положительную реакцию. Доза должна зависеть от эффективности конкретного применяемого модулятора и состояния пациента, а также от веса тела или площади подлежащей обработке поверхности. Размер дозы должен также зависеть от наличия, природы и степени любых побочных воздействий, которыми сопровождается введение конкретного соединения или вектора конкретному пациенту. Введение можно осуществлять с помощью одной дозы или разделенных доз.
Антитело-агонист и апоптоз-индуцирующий агент можно вводить в виде смеси или каждый можно вводить индивидуально. Антитело-агент и апоптоз-ингибирующий агент можно, но не обязательно, вводить одновременно.
VIII. Ингибиторы апоптоза
Как указано в контексте настоящего описания, различные продукты генов либо ингибируют (например, молекулы, перечисленные в верхней части фиг.28; и UbcH10) либо усиливают (например, молекулы, перечисленные в нижней части фиг.28) индуцируемый TRAIL (и индуцируемый антителами к DR4 или к DR5) апоптоз. Те продукты генов, которые ингибируют индуцируемый TRAIL апоптоз, могут являться мишенью для ингибиторов с целью синергетического повышения апоптоза, индуцируемого TRAIL, антителами к DR4 или к DR5. Аналогично этому те продукты генов, которые усиливают индуцируемый TRAIL апоптоз, могут являться мишенями для активаторов с целью синергетического повышения апоптоза, индуцируемого TRAIL, антителами к DR4 или к DR5.
В альтернативном варианте активаторы продуктов генов, которые ингибируют индуцируемый TRAIL апоптоз, можно применять для снижения апоптоза, если и когда он является нежелательным (вредным). Аналогично этому ингибиторы тех продуктов генов, которые усиливают индуцируемый TRAIL апоптоз, можно применять также для снижения апоптоза, если и когда он является нежелательным. Одно из таких заболеваний представляет собой тромбоцитопеническую пурпуру (ТТР) (Kwaan Н. С., Semin. HematoL, 24, 1987, с.71); Thompson и др.. Blood, 80, 1992, с.1890). Увеличение связанной с ТТР смертности зарегистрировано Центрами США по контролю заболеваемости (U.S. Centers for Disease Control) (Torok и др.. Am. J. Hematol. 50, 1995, c.84).
Плазма пациентов, пораженных ТТР (включая ВИЧ - и ВИЧ'- пациентов), индуцирует апоптоз человеческих эндотелиальных клеток из кожных микрососудов, но не индуцирует апоптоз эпителиальных клеток из крупных сосудов (Laurence и др., Blood, 87, 1996, с.3245). Таким образом, можно предположить, что плазма страдающих ТТР пациентов должна содержать один или несколько факторов, которые непосредственно или косвенно индуцируют апоптоз. Как описано в заявке РСТ WO 97/01633 (которая включена в настоящее описание в качестве ссылки), TRAIL присутствует в сыворотке страдающих ТТР пациентов и может играть роль в индукции апоптоза микрососудистых эндотелиальных клеток.
К другим тромботическим микроангиопатиям относится гемолитико-уремический синдром (ГУ С) (Moake J. L., Lancet, 343, 1994, с.393; Melnyk и др., Arch. Intern. Med. 155, 1995, с.2077). Одним из вариантов осуществления изобретения является лечение состояния, которое часто называют как «ГУС взрослых» (хотя он может поражать также и детей). Болезнь, называемая детский/связанный с диареей ГУС, отличается по этиологии от ГУС взрослых.
Другие состояния характеризуются образованием сгустков в небольших кровеносных сосудах. Такие состояния включают (но, не ограничиваясь ими): проблемы, связанные с сосудами сердца, которые обнаружены примерно у 5-10% страдающих СПИДом детей, и, вероятно, связаны с образованием сгустков в небольших кровеносных сосудах. Нарушение микрососудистой сети сердца обнаружено у многих страдающих рассеянным склерозом пациентов. В качестве другого примера, подпадающего под объем изобретения, является лечение системной красной волчанки (СКВ).
IX. Предсказанная эффективность противоракового лечения с использованием антител-агонистов к DR5
При создании изобретения было обнаружено, что экспрессия генного продукта Мус является необходимой, но недостаточной для проявления эффективности антител к DR5 в отношении индукции апоптоза опухолевых клеток. Таким образом экспрессия Мус в опухолевых клетках (например, полученных путем биопсии) является маркером для идентификации клеток (и следовательно пациентов), которые скорее всего не будут реагировать на лечение, мишенью которого является DR5. Таким образом, если опухолевые клетки экспрессируют меньшие количества Мус, чем клетки дикого типа, то существует меньшая вероятность того, что терапия, мишенью которой является DR5, будет эффективной, по сравнению с вариантом, когда уровень экспрессии Мус такой же или более высокий, чем в клетках дикого типа. Таким образом, в настоящем изобретении предложены способы определения эффективности терапии, основанной на применении антител-агонистов к DR5, заключающиеся в том, что получают образец опухолевых клеток из организма пациента и определяют уровни экспрессии Мус в этих клетках, при этом более низкий уровень экспрессии Мус по сравнению с диким типом свидетельствует о том, что лечение будет обладать пониженной эффективностью или будут неэффективным в отношении уничтожения опухолевых клеток.
Примеры
Ниже изобретение более подробно проиллюстрировано на примерах, не ограничивающих его объем. Другие варианты изобретения должны быть очевидны обычному специалисту в данной области, и они подпадают под объем приведенной ниже формулы изобретения.
Соотношения элюентов и других растворителей в смесях даны в виде объемных соотношений (об./об.), если не указано иное.
Визуализация ТСХ:
Полученные при ТСХ пятна, соответствующие конечным соединениям или промежуточным продуктам, которые не выявляются с помощью УФ-облучения, визуализируют путем окрашивания раствором перманганата калия с последующим нагреванием пластины.
Состав предназначенного для окрашивания раствора перманганата калия: 2,5 г КМnO4 (перманганат калия) (фирма Fluka, Бухс, Швейцария) в 800 мл Н2О и 200 мл 1н. H2SO4.
Условия аналитической ЖХВР:
Система 1
Линейный градиент 2-100% СН3СН (0,1% ТФК) и Н2О (0,1% ТФК) в течение 10 мин+в течение 2 мин 100% CH3CN (0,1% ТФК); обнаружение при 215 нм, скорость потока 0,7 мл/мин при 25°С. Колонка: Nucleosil 120-3 С18 (125 д. 3,0 мм).
Система 2 Линейный градиент 20-100% CH3CN (0,1% ТФК) и Н2О (0,1% ТФК) в течение 7 мин+в течение 2 мин 100% СН3СК (0,1% ТФК); обнаружение при 215 нм, скорость потока 1 мл/мин при 30°С. Колонка: Nucleosil 100-3 C18HD (125×4 мм).
Система 3
Линейный градиент 20-100% СН3СN (0,1% ТФК) и H2О (0,1% ТФК) в течение 7 мин+в течение 2 мин 100% СН3СN (0,1% ТФК); обнаружение при 215 нм, скорость потока 1 мл/мин при 30°С. Колонка: Nucleosil 100-3 С8 HD (125×4 мм).
Схема 1 синтеза (примеры 1 и 2):
Пример 1: (S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионидамино]-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9.9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Стадия А: 4н. раствор НСl в диоксане (5,7 мл, 22,77 ммоля, 30 экв.) добавляли в атмосфере аргона к охлажденному (0°С) раствору трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты ((А) на схеме 1 синтеза) (0,352 г, 0,759 ммоля) в абс.CH2Cl2 (5,5 мл). Образовавшейся смеси давали нагреться до КТ и перемешивали в течение 10 мин. Добавляли дополнительную порцию 4н. НСl (1,9 мл, 7,59 ммоля, 10 экв.). Реакционную смесь перемешивали в течение 10 мин и концентрировали, получая неочищенный гидрохлорид в виде пены желтого цвета.
Стадия Б: ДИЭА (абс.) (0,72 мл, 4,14 ммоля, 5 экв.) добавляли по каплям (1,9 мл/мин) к охлажденному (0°С) раствору, содержащему неочищенный гидрохлорид (0,331 г, 0,828 ммоля), (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовую кислоту ((Б) на схеме 1 синтеза) (0,518 г, 0,994 ммоля, 1,2 экв.) и ТБТУ (0,292 г, 0,910 ммоля, 1,1 экв.) в абс.ДМФ (3,0 мл), в атмосфере аргона. Реакционной смеси давали нагреться до КТ, перемешивали в течение 40 мин и сливали на охлажденную до 0°С H2O (45 мл). Образовавшийся осадок собирали вакуумной фильтрацией, растворяли в EtOAc и промывали Н2О. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали. После очистки остатка колоночной хроматографией на силикагеле (25 г) (CH2Cl2/MeOH, 90/10) получили указанное в заголовке соединение в виде пены желтого цвета.
Указанное в заголовке соединение: ES-MC: 754,2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,85 мин (система 1); Rf=0,72 (CH2Cl2/MeOH, 90/10).
Исходные продукты получали следующим образом:
(а) (S)-2-(Бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовая кислота (для стадии Б)
Указанное в заголовке соединение получали нагреванием суспензии, содержащей 3-бромбифенил (1,47 мл, 8,54 ммоля, фирма Aldrich, кат.номер 25,538-6), (S)-2-амино-3-(3,4,5-триметоксифенил)пропионовую кислоту (3,4,5-ОСН3-phe-OH) (3,27 г, 12,81 ммоля), К2СО3 (1,18 г, 8,54 ммоля) и CuI (163 мг, 0,854 ммоля) в абс.ДМФ (10,6 мл), в течение 24 ч при 90°С в атмосфере аргона. Образовавшейся смеси давали охладиться до КТ, затем концентрировали в вакууме и очищали с помощью ЖХУД (СН3СN/Н2О/ТФК), получая указанное в заголовке соединение.
Указанное в заголовке соединение: ES-MC: 408,2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=8,86 мин (система 1).
(б) (S)-2-Амино-3-(3,4,5-триметоксифенил)пропионовая кислота (L-3,4,5-триметоксифенилаланин)
Указанное в заголовке соединение получали из поступающих в продажу 3,4,5-триметоксибензальдегида и N-ацетилглицина согласно известному из литературы методу (Е.М. Oltz, R. С.Bruening, M. J. Smith, К. Kustin и К. Nakanishi, J. Am. Chem., 110 (18), 1998, cc.16162-6172). Разделение рацемицеского метилового эфира N-ацетил-3,4,5-триметоксифенилаланина осуществляли путем катализируемого ферментом гидролиза L-эфира с помощью Alcalase® (фирма Novo Nordisk) согласно описанному в литературе методу (J.J.Nestor, Jr., Т.L.Но, R.A.Simpson, В.L.Horner, G.H.Jones, G. I. McRae и В.Н.Vickery, J. Med. Chem. 25 (7), 1982, cc.795-801; или О.D.Tyagi и Р.M.Boll, Indian J. Chem., 1992, cc.851-854).
Указанное в заголовке соединение: [α]D 20=-18,9((с=1,025, Н2О); ES-MC: 256,1 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=2,08 мин (система 2).
(в) Трет-бутиловый эфир {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил] пропил}карбаминовой кислоты
Указанное в заголовке соединение получили согласно методу, описанному для стадии Б примера 1, используя трифторацетат (S)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутиламмония ((В) на схеме 1 синтеза) (метод получения см. у Kettner С.А. и Shenvi А. В., J. Biol. Chem., 259, 1984, cc. 15106-15114 и у Matteson D. S. и Sadhu К. M. J. Am. Chem. Soc., 103, 1981, cc.5241-5242) (2,395 г, 6,32 ммоля), Boc-L-валин (1,373 г, 6,32 ммоля), ТБТУ (2,23 г, 6,95 ммоля, 1,1 экв.), ДИЭА (3,3 мл, 18,95 ммоля, 3,0 экв.) и ДМФ (24 мл).
Указанное в заголовке соединение: ES-MC: 465,1 [М+Н]+; ЖХВР:
индивидуальный пик, t - 9,95 мин (система 1).
Пример 2: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-бутириламино}-3-метилбутилбороновая кислота
i-BuB(OH)2 добавляли к смеси, содержащей (S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-N-[(R)-3-метил-1 -((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид, метанол (4,3 мл), гексан (4,3 мл) и 1н. НСl (1,45 мл). Реакционную смесь перемешивали в течение 2 ч при КТ и затем разбавляли метанолом (8 мл) и гексаном (8 мл). Разделяли два слоя. Метанольный слой промывали дважды гексаном, разбавляли CH2Cl2, промывали Н2О, сушили (Nа2SO4), фильтровали и концентрировали. После растворения остатка в CH2Cl2 и очистки колоночной хроматографией на силикагеле (20 г) (CH2Cl2/MeOH, 80/20) получили указанное в заголовке соединение в виде пены светло-желтого цвета.
Указанное в заголовке соединение: ES-MC: 618,2 [М-Н]-; Rf=0,03 (CH2Cl2/MeOH, 95/5).
Схема 2 синтеза (примеры 3 и 4):

Пример 3: (S)-3-Метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]-2-[(S)-2-[2-(3-феноксифенил)ацетиламино]-3-(2,3,4-триметоксифенил)пропиониламино]бутирамид
Указанное в заголовке соединение получали из трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты ((А) на схеме 2 синтеза) путем повторения двухступенчатой процедуры (удаление защитных групп/сочетание) этерификации, которая описана в примере 1, но с использованием (S)-2-трет-бутоксикарбониламино-3-(2,3,4-триметоксифенил)пропионовой кислоты ((Г) на схеме 2 синтеза) и (3-феноксифенил)уксусной кислоты ((Е) на схеме 2 синтеза) (Trans World Chemicals, Inc.; Роквилл, шт.Мэдисон, США) в качестве партнеров для каждой из реакций сочетания (стадия Б, пример 1) соответственно. Получили указанное в заголовке соединение в виде твердого вещества белого цвета.
Указанное в заголовке соединение: ES-MC: 812,1 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,13 мин (система 1); Rf=0.41 (CH2Cl2/MeOH, 95/5).
Стадия 3.1: (S)-2-Амино-3-(2,3,4-триметоксифенил)пропионовая кислота (L-2,3,4-триметоксифенилаланин)
Указанное в заголовке соединение получили согласно методу, описанному для получения (S)-2-амино-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1).
Указанное в заголовке соединение: ES-MC: 256,1 [М+Н]+; ЖХВР: tуд.=2,54 мин (система 2); [α]D 20=-18,5((с=0,99, Н2O).
Стадия 3.2: (S)-2-трет-бутоксикарбониламино-3-(2,3,4-триметоксифенил)пропионовая кислота
Указанное в заголовке соединение синтезировали, используя в качестве исходного продукта (S)-2-амино-3-(2,3,4-триметоксифенил)пропионовую кислоту, согласно известному в данной области методу (М. Bodanszky в:
Principles ofPeptide Synthesis, изд-во Akad.-Verlag, 1984).
Указанное в заголовке соединение: ES-MC: 356,1 [М+Н]+; ЖХВР: tуд.=5,35 мин. (система 1); [α]D 20=-2.5° (с=0,985, МеОН).
Пример 4: (R)-3-метил-1-{(S)-3-метил-2-[(S)-2-[2-(3-феноксифенил)ацетиламино]-3-(2,3,4-триметоксифенил)пропиониламино1бутириламино}бутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 676.0 [М-Н]+; Rf=0.025 (CH2Cl2/MeOH, 95/5).
Пример 5: (S)-3-Метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]-2-[(S)-2-(3-фенилпропиониламино)-3-(2,3,4-триметоксифенил)пропиониламино]бутирамид Указанное в заголовке соединение получили из трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты путем повторения двухступенчатой процедуры (удаление защитных групп/сочетание) этерификации, которая описана в примере 1, но с использованием (S)-2-(третбутилоксикарбониламино)-3-(2,3,4-триметоксифенил)пропионовой кислоты и 3-фенилпропионовой кислоты (фирма Fluka, Букс, Швейцария) в качестве партнеров для каждой из реакций сочетания (стадия Б, пример 1) соответственно.
Указанное в заголовке соединение: ES-MC: 734.1 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,25 мин (система 1); Rf=0,41 (CH2Cl2/MeOH, 95/5).
Пример 6: (R)-3-Метил-1-{(S)-3-метил-2-[(S)-2-(3-фенилпропиониламино)-3-(2,3,4-триметоксифенил)пропиониламино]бутириламино}бутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 598,2 [М-Н]+; Rf=0,025 (СН2Сl2/МеОН, 95/5).
Пример 7: (S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино]-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 694,4 [М+Н]; ЖХВР: индивидуальный пик, tуд.=12,01 мин (система 1); Rf=0,56 (СН2Сl2/МеОН, 95/5).
Стадия 7.1: (S)-2-(Бифенил-3-иламино)-3-(4-метоксифенил)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя О-метил-L-тирозин (фирма Bachem). После очистки с помощью ЖХУД (СН3СN/Н2О/ТФК) получали указанное в заголовке соединение; ES-MC: 348,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=9,52 мин (система 1).
Пример 8: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино]-3-метилбутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 558,0 [М-Н]+; ЖХВР: tуд.=6,47 мин (система 3); Rf=0,086 (CH2Cl2/MeOH, 95/5).
Пример 9: (S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропиониламино]-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 724.4 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,75 мин (система 1); Rf=0,41 (CH2Cl2/MeOH, 95/5).
Стадия 9.1: (S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя 3-(3,4-диметоксифенил)-L-аланин (фирма Aldrich). После очистки с помощью ЖХУД (СН3СN/Н2О/ТФК) получали указанное в заголовке соединение; ES-MC: 378.2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=9,10 мин (система 1).
Пример 10: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропиониламино]-3-метилбутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 588,2 [M-H]-; Rf=0,090 (СH2Сl2/МеОН, 95/5).
Пример 11: (S)-2-[(S)-2-(3-изопропилфениламино)-3-(3,4.5-триметоксифенил)пропионидамино1-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (S)-2-(3-изопропилфениламино)-3-(3,4,5-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 720,4 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,85 мин (система 1); Rf=0,43 (CH2Cl2/MeOH, 95/5).
Стадия 11.1: (S)-2-(3-Изопропилфениламино)-3-(3,4,5-триметоксифенил)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя 1-бром-3-изопропилбензол (фирма Lancaster). После очистки с помощью ЖХУД (СН3СН/Н2О/ТФК) получали указанное в заголовке соединение; ES-MC: 374,1 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=8,95 мин (система 1).
Пример 12: (R)-1-{(S)-2-[(S)-2-(3-изопропилфениламино)-3-(3,4,5-триметоксифенил)пропиониламино] -3-метилбутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 584,3 [М-Н]-; Rf=0,13 (CH2Cl2/MeOH, 95/5).
Пример 13: (S)-3-Метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-
3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]-2-[(S)-2-(3-пиридин-2-илфениламино)-3-(3,4,5-триметоксифенил)пропиониламино]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (S)-2-(3-пиридин-2-илфениламино)-3-(3,4,5-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 755,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=9,97 мин (система 1); Rf=0,23 (CH2Cl2/MeOH, 95/5).
Стадия 13.1: 2-(3-Бромфенил)пиридин
Указанное в заголовке соединение получали согласно известным из литературы методам: Zhang Biliang, Breslow Ronald «Ester Hydrolysis by a Catalytic Cyclodextrin Dimer Enzyme Mimic with a Metallobipyridyl Linking Group», J. Am. Chem. Soc., 119(7), 1997, cc.1676-1681; M. Van der Sluis, V. Beverwijk, A. Termaten, F. Bickelhaupt, H. Kooijman, A.L. Spek «Synthesis of Novel Phosphaalkene-Based Bidentate Ligands Mes*P:CH(3-R-Ar) (R=Pyridyl, Carbaldimino) and Formation of Three-Membered Palladacycles Mes*(Me)P-CH(3-R-Ar)-PdCl by Carbopalladation of the P:C Double Bond», Organometallics, 18(8), 1999, cc.1402-1407.
Указанное в заголовке соединение: ES-MC: 235.0 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=6,64 мин (система 1); Rf=0,17 (гексан/Еt2О, 80/20).
Стадия 13.2: (S)-2-(3-Пиридин-2-илфениламино)-3-(3,4,5-триметоксифенил)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя 2-(3-бромфенил)пиридин. После очистки с помощью ЖХУД (СН3СN/Н2О/ТФК) получали указанное в заголовке соединение; ES-MC: 409,2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=6,64 мин (система 1).
Пример 14: (R)-3-Метил-1-{(S)-3-метил-2-[(S)-2-(3-пиридин-2-илфениламино)-3-(3,4,5-триметоксифенил)пропиониламино]бутириламино}бутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 619,2 [М-Н]-; Rf=0,044 (СН3Сl2/МеОН, 95/5).
Пример 15: (S)-2-[(S)-2-(бифeнил-3-илaминo)-3-(2,3,4-тpимeтoкcифeнил)пpoпиoнилaминo]-3-мeтил-N-[(R)-3-мeтил-l-((lS,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (S)-2-(бифенил-3-иламино)-3-(2,3,4-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 754,4 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=12,08 мин (система 1); Rf=0,66 (CH2Cl2/MeOH, 95/5).
Стадия 15.1: (S)-2-(Бифенил-3-иламино)-3-(2,3,4-триметоксифенил)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя (S)-2-амино-3-(2,3,4-триметоксифенил)пропионовую кислоту. После очистки с помощью ЖХУД (СН3СN/Н2О/ТФК) получали указанное в заголовке соединение; ES-MC: 408,2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=9,42 мин (система 1).
Пример 16: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(2,3,4-триметоксифенил)пропиониламино]-3-метил-бутириламино)-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 618,3 [М-Н]-; Rf=0,23 (CH2Cl2/MeOH, 95/5).
Пример 17: (S)-2-[(S)-3-(4-бензилоксифенил)-2-(бифенил-3-иламино)пропиониламино]-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (S)-3-(4-бензилоксифенил)-2-(бифенил-3-иламино)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 770.3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=12,45 мин (система 1); Rf=0,74 (СН2Сl2/МеОН, 95/5).
Стадия 17.1: (S)-3-(4-Бензилоксифенил)-2-(бифенил-3-иламино)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя (S)-2-амино-3-(4-бензилоксифенил)пропионовую кислоту (О-бензил-L-тирозин). После очистки с помощью ЖХУД (СН3СN/Н2О/ТФК) получали указанное в заголовке соединение; ES-MC: 424,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=10,40 мин (система 1).
Пример 18: (R)-1-{(S)-2-[(S)-3-(4-бензилоксифенил)-2-(бифенил-3-иламино)пропиониламино]-3-метилбутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 633,9 [М-Н]-; Rf=0,65 (СН2Сl2/МеОН, 90/10).
Пример 19: (R)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(R)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты.
Указанное в заголовке соединение: ES-MC: 754,1 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,73 мин (система 1); Rf=0,52 (CH2Cl2/MeOH, 95/5).
Стадия 19.1: Трет-бутиловый эфир {(R)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты
Указанное в заголовке соединение получали согласно методу, описанному для трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты (пример 1 (в)), но используя Boc-D-валин (фирма Fluka).
Указанное в заголовке соединение: ES-MC: 465,4 [М+Н]+.
Пример 20: (R)-1-{(R)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метилбутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 618,2 [М-Н]-; Rf=0,088 (СН2Сl2/МеОН, 95/5).
Пример 21: (S)-2-[(R)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя (R)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 754,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,71 мин (система 1); Rf=0,67 (СН2Сl2/МеОН, 95/5).
Стадия 21.1: (R)-2-(Бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовая кислота
Указанное в заголовке соединение получали согласно методу, описанному для (S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропионовой кислоты (пример 1), но используя (R)-2-амино-3-(3,4,5-триметоксифенил)пропионовую кислоту (3,4,5-ОСН3-phe-ОН).
Указанное в заголовке соединение: ES-MC: 408,2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=9,10 мин (система 1).
Путь синтеза (R)-2-амино-3-(3,4,5-триметоксифенил)пропионовой кислоты см. в примере 1.
После ферментативного разделения оставшийся метиловый эфир D-аминокислоты гидролизовали и деацетилировали с помощью протоколов, известных в данной области; [α]D 20=+19,7((с=1,04, Н2О); ES-MC: 256,2 [М+Н]+; индивидуальный пик, tуд.=2,11 мин (система 2).
Пример 22: (R)-1-{(S)-2-[(R)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-бутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 618,2 [М-Н]-; Rf=0,20 (CH2Cl2/MeOH, 90/10).
Пример 23: (S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-N-[3-метил-1-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бутил]бутирамид
Указанное в заголовке соединение получали согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-2-метил-1-[3-метил-1-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бутилкарбамоил]пропил}карбаминовой кислоты.
Указанное в заголовке соединение получили в виде неочищенного продукта; ES-MC: 70-2,3 [М+Н]+; ЖХВР: tуд.=10,31 мин (система 1).
Стадия 23.1: Трет-бутиловый эфир {(S)-2-метил-1-[3-метил-1-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бутилкарбамоил]пропил}карбаминовой кислоты
Указанное в заголовке соединение получали аналогично методу синтеза трет-бутилового эфира {(S)-2-метил-1 -[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты (пример 1 (в)). Указанное в заголовке соединение: ES-MC: 413,3 [М+Н]+.
Пример 24: 1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-бутириламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 618,2 [М-Н]-; Rf=0.076 (CH2Cl2/MeOH, 95/5); ЖХВР: два пика, tуд.=6,23 мин и 6,36 мин (соотношение 1:1) (система 3).
Пример 25: (S)-2-{(S)-3-(3,4-диметоксифенил)-2-[2-(3-феноксифенил)ацетиламино]пропиониламино}-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получали из трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты путем повторения двухступенчатой процедуры (удаление защитных групп/сочетание) этерификации, которая описана в примере 1, но с использованием Вос-L-3,4-диметоксифенилаланина (фирма Synthetech) и (3-феноксифенил)уксусной кислоты (Trans World Chemicals, Inc.; Роквилл, шт.Мэдисон, США) в качестве партнеров каждой из реакций сочетания (стадия Б, пример 1) соответственно. Указанное в заголовке соединение получили в виде пены; ES-MC: 782,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,76 мин (система 1); Rf=0,61 (СН2Сl2/МеОН, 90/10).
Пример 26: (R)-1-((S)-2-{(S)-3-(3,4-диметоксифенил)-2-[2-(3-феноксифенил)ацетиламино]пропиониламино}-3-метил-бутириламино)-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 646,2 [М-Н]-; ЖХВР: индивидуальный пик, tуд.=5,90 мин (система 3); Rf=0,12 (CH2Cl2/MeOH, 90/10).
Пример 27: (S)-3-Метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бyтил]-2-[(S)-2-[2-(3-феноксифенил)ацетиламино1-3-(3,4,5-триметоксифенил)пропиониламино]бутирамид
Указанное в заголовке соединение получали из трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты путем повторения двухступенчатой процедуры (удаление защитных групп/сочетание) этерификации, которая описана в примере 1, но с использованием (S)-2-трет-бутоксикарбониламино-3-(3,4,5-триметоксифенил)пропионовой кислоты и (3-феноксифенил)уксусной кислоты (Trans World Chemicals, Inc.; Роквилл, шт.Мэдисон, США) в качестве партнеров каждой из реакций сочетания (стадия Б, пример 1) соответственно. Указанное в заголовке соединение получили в виде пены желтого цвета; ES-MC: 812,4 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,36 мин (система 1); Rf=0,53 (CH2Cl2/MeOH, 95/5).
Стадия 27.1: (S)-2-трет-бутоксикарбониламино-3-(3,4,5-триметоксифенил)пропионовая кислота
Указанное в заголовке соединение синтезировали согласно методу, описанному для получения (S)-2-трет-бутоксикарбониламино-3-(2,3,4-триметоксифенил)пропионовой кислоты (пример 3), но используя в качестве исходного продукта (S)-2-амино-3-(3,4,5-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 356 [М+Н]+; ЖХВР: tуд.=4,83 мин (система 2); tпл=76-80°С; [α]D 20=+13,4((с=1,01, метанол).
Пример 28: (R)-3-Метил-1-{(S)-3-метил-2-[(S)-2-[2-(3-феноксифенил)ацетиламино]-3-(3,4,5-триметоксифенил)-пропиониламино]бутириламино}бутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 676,2 [М-Н]-; Rf=0,14 (CH2Cl2/MeOH, 95/5).
Пример 29: (S)-2-{(S)-3-(4-Бензилоксифенил)-2-[2-(3-бензилоксифенил)ацетиламино]пропиониламино}-3-метил-N-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]бутирамид
Указанное в заголовке соединение получали из трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил] пропил }карбаминовой кислоты путем повторения двухступенчатой процедуры (удаление защитных групп/сочетание) этерификации, которая описана в примере 1, но с использованием (S)-3-(4-бензилоксифенил)-2-трет-бутоксикарбониламинопропионовой кислоты и (3-феноксифенил)уксусной кислоты (Trans World Chemicals, Inc.; Роквилл, шт.Мэдисон, США) в качестве партнеров каждой из реакций сочетания (стадия Б, пример 1) соответственно. Указанное в заголовке соединение получили в виде пены бежевого цвета; ES-MC: 842,0 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=12,19 мин (система 1); Rf=0,37 (CH2Cl2/MeOH, 95/5).
Стадия 29.1: (S)-3-(4-Бензилоксифенил)-2-трет-бутоксикарбониламинопропионовая кислота
Указанное в заголовке соединение синтезировали согласно методу, описанному для (S)-2-трет-бутоксикарбониламино-3-(2,3,4-триметоксифенил)пропионовой кислоты (пример 3), но используя в качестве исходного продукта О-бензил-Д-тирозин (фирма Fluka).
Указанное в заголовке соединение: ES-MC: 370,1 [М-Н]-; ЖХВР: tуд.=9,23 мин (система 1).
Пример 30: (R)-1-((S)-2-{(S)-3-(4-бензилоксифенил)-2-[2-(3-бензилоксифенил)ацетиламино]пропиониламино}-3-метил-бутириламино)-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 705,8 [М-Н]-; Rf=0,12 (CH2Cl2/MeOH, 95/5).
Пример 31: [(R)-3-Метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]амид (S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-4-метилпентановой кислоты
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-3-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]бутил}карбаминовой кислоты.
Указанное в заголовке соединение: ES-MC: 768.2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,79 мин (система 1); Rf=0,72 (CH2Cl2/MeOH, 95/5).
Стадия 31.1: Трет-бутиловый эфир {(S)-3-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил1бутил}карбаминовой кислоты
Указанное в заголовке соединение получали согласно методу, описанному для трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты (пример 1 (в)), но используя Boc-L-лейцин.
Указанное в заголовке соединение: ES-MC: 479,2 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=10,05 мин (система 1).
Пример 32: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-4-метилпентаноиламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 632,2 [М-Н]-; Rf=0,15 (CH2Cl2/MeOH, 95/5).
Пример 33: [(R)-3-Метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]амид (S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропиониламино]-4-метилпентановой кислоты
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-3-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]бутил}карбаминовой кислоты и (S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 738.3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,76 мин (система 1); Rf=0,59 (CH2Cl2/MeOH, 95/5).
Пример 34: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-4-метил-пентаноиламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 602,2 [М-Н]-; Rf=0,14 (CH2Cl2/MeOH, 95/5).
Пример 35: [(R)-3-Метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутил]амид (S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино]-4-метилпентановой кислоты
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-3-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил] бутил }карбаминовой кислоты и (S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 708,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=12,03 мин (система 1); Rf=0,70 (CH2Cl2/MeOH, 95/5).
Пример 36: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино]-4-метилпентаноиламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 572,1 [М-Н]-; Rf=0,25 (CH2Cl2/MeOH, 90/10).
Пример 37: (S)-2-(Бифенил-3-иламино)-N-{(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}-3-(3,4,5-триметоксифенил)пропионамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутловый эфир {(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил} карбаминовой кислоты.
Указанное в заголовке соединение: ES-MC: 726,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,24 мин (система 1); Rf=0,41 (CH2Cl2/MeOH, 95/5).
Стадия 37.1: Трет-бутиловый эфир {(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил} карбаминовой кислоты
Указанное в заголовке соединение получали согласно методу, описанному для трет-бутилового эфира {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил} карбаминовой кислоты (стадия 1.1, пример 1), но используя Boc-L-аланин (фирма Fluka).
Указанное в заголовке соединение: ES-MC: 437.4 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=10,91 мин (система 1).
Пример 38: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]пропиониламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 590,0 [М-Н]-; Rf=0,12 (CH2Cl2/MeOH, 95/5).
Пример 39: (S)-2-(Бифенил-3-иламино)-N-{(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}-3-(2,3,4-триметоксифенил)пропионамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}карбаминовой кислоты и (S)-2-(бифенил-3-иламино)-3-(2,3,4-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 726,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,71 мин (система 1); Rf=0,45 (CH2Cl2/MeOH, 95/5).
Пример 40: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(2,3,4-триметоксифенил)пропиониламино]пропиониламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 590,0 [М-Н]-; Rf=0,033 (CH2Cl2/MeOH, 95/5).
Пример 41: (S)-2-(Бифенил-3-иламино)-3-(4-метоксифенил)-N-{(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил1этил} пропионамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-1-[(R)-3-метил-1-(((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}карбаминовой кислоты и (S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 666,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд.=11,63 мин (система 1); Rf=0,46 (CH2Cl2/MeOH, 95/5).
Пример 42: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино] пропиониламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получали согласно методу, описанному в примере 2; ES-MC: 530,3 [М-Н]-; Rf=0,051 (CH2Cl2/MeOH, 95/5).
Пример 43: (S)-2-(Бифенил-3-иламино)-3-(3,4-диметоксифенил)-N-{(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}пропионамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}карбаминовой кислоты и (S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 696,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд. = 11,39 мин (система 1); Rf = 0,53 (CH2Cl2/MeOH, 95/5).
Пример 44: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4-диметоксифенил)пропиониламино]пропиониламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 560,2 [М-Н]-; Rf = 0,023 (CH2Cl2/MeOH, 95/5).
Пример 45: (S)-2-(3-Изопропилфениламино)-N-{(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}-3-(3,4,5-триметоксифенил)пропионамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}карбаминовой кислоты и (S)-2-(3-изопропилфениламино)-3-(3,4,5-триметоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 692,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд. = 11,49 мин (система 1); Rf = 0,24 (CH2Cl2/МеОН, 95/5).
Пример 46: (R)-1-{(S)-2-[(S)-2-(3-изопропилфениламино)-3-(3,4,5-триметоксифенил)пропиониламино]пропиониламино}-3-метилбутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 560,2 [М-Н]-; Rf = 0,22 (CH2Cl2/МеОН, 95/5).
Пример 47: (S)-N-{(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]этил}-2-(3-фенилпропиониламино)-3-(2,3,4-триметоксифенил)пропионамид
Указанное в заголовке соединение получили из трет-бутилового эфира {(S)-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02.6]дец-4-ил)бутилкарбамоил]этил}карбаминовой кислоты путем повторения двухступенчатой процедуры (удаление защитных групп/сочетание) этерификации, которая описана в примере 1, но с использованием (S)-2-амино-3-(2,3,4-триметоксифенил)пропионовой кислоты и 3-фенилпропионовой кислоты (фирма Fluka) в качестве партнеров для каждой из реакций сочетания (стадия Б, пример 1) соответственно.
Указанное в заголовке соединение: ES-MC: 706,3 [М+Н]+; ЖХВР: индивидуальный пик, tуд. = 10,81 мин (система 1); Rf = 0,32 (CH2Cl2/МеОН, 95/5).
Пример 48: (R)-3-Метил-1-{(S)-2-[(S)-2-(3-фенилпропиониламино)-3-(2,3,4-триметоксифенил)пропиониламино]пропиониламино}бутилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 570,3 [М-Н]-; Rf = 0,22 (CH2Cl2/МеОН, 95/5).
Пример 49: (S)-2-[(S)-2-(Бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-N-[(R)-2-фенил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)-этил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет -бутиловый эфир {(S)-2-метил-1-[(R)-2-фенил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)этилкарбамоил]пропил}карбаминовой кислоты.
Указанное в заголовке соединение: ES-MC: 788,0 [М+Н]+; ЖХВР: индивидуальный пик, tуд. = 11,66 мин (система 1); Rf = 0,79 (CH2Cl2/МеОН, 95/5).
Стадия 49.1: Трет-бутиловый эфир {(S)-2-метил-1-[(R)-2-фенил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)этилкарбамоил]пропил}карбаминовой кислоты
Указанное в заголовке соединение синтезировали аналогично трет-бутиловому эфиру {(S)-2-метил-1-[(R)-3-метил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)бутилкарбамоил]пропил}карбаминовой кислоты (пример 1(в)).
Указанное в заголовке соединение: ES-MC: 499,1 [М+Н]+; ЖХВР: индивидуальный пик, tуд. = 10,78 мин (система 1).
Пример 50: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(3,4,5-триметоксифенил)пропиониламино]-3-метил-бутириламино}-2-фенилэтилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 652,2 [М-Н]-; Rf = 0,22 (CH2Cl2/MeOH, 95/5).
Пример 51: (S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино]-3-метил-N-[(R)-2-фенил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)этил]бутирамид
Указанное в заголовке соединение получили согласно методу, описанному в примере 1, но используя трет-бутиловый эфир {(S)-2-метил-1-[(R)-2-фенил-1-((1S,2S,6R,8S)-2,9,9-триметил-3,5-диокса-4-боратрицикло[6.1.1.02,6]дец-4-ил)этилкарбамоил]пропил}карбаминовой кислоты и (S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропионовую кислоту.
Указанное в заголовке соединение: ES-MC: 727.9 [М+Н]+; ЖХВР: индивидуальный пик, tуд. = 11,87 мин (система 1); Rf = 0,73 (CH2Cl2/MeOH, 95/5).
Пример 52: (R)-1-{(S)-2-[(S)-2-(бифенил-3-иламино)-3-(4-метоксифенил)пропиониламино]-3-метил-бутириламино}-2-фенилэтилбороновая кислота
Указанное в заголовке соединение получили согласно методу, описанному в примере 2; ES-MC: 591,8 [М-Н]-; Rf = 0,13 (CH2Cl2/МеОН, 95/5).
Пример 53: Ингибирование химотрипсинподобной активности протеосомы 20S
Ниже приведены в качестве примера значения IC50 для соединений формулы I (таблица 1), определенные с помощью описанного выше теста.
Пример 54:
В качестве одного из компонентов разработанного при создании изобретения анализа, предназначенного для скрининга антител к DR5, клонировали, экспрессировали и очищали лиганд TRAIL и оценивали на клетках линии Jurkat для решения вопроса, могут ли клетки уничтожаться при использовании этого лиганда. Для осуществления анализа использовали аламаровый синий, представляющий собой окислительно-восстановительный краситель, флуоресценция которого происходит при восстановлении красителя в живых клетках. Когда клетки погибают в результате апоптоза, образовавшееся окружение окисляется, и краситель не восстанавливается и флуоресценция не наблюдается. Как проиллюстрировано на фиг.1, TRAIL индуцирует апоптоз клеток линии Jurkat.
Осуществляли скрининг антител-агонистов. Мышей иммунизировали рецептором DR5 и В-клетки сливали с миеломами. Образовавшиеся гибридомы вносили в 384-луночные планшеты и после выращивания в течение нескольких дней в лунки, содержащие клетки линии Jurkat, добавляли по 20 мкл супернатанта и перекрестно сшивающего антитела. Через 24 ч добавляли краситель аламаровый синий и еще через 24 ч планшет считывали с помощью устройства типа Acquest. Выявляли несколько позитивных лунок, которые содержали дающие позитивную реакцию антитела.
Тестировали специфичность позитивных антител. Три гибридомы, которые давали в этом опыте позитивный сигнал, субклонировали, размножали и очищали. Двадцать один TNF-рецептор клонировали, экспрессировали и очищали. Рецепторами сенсибилизировали лунки и три антитела подвергали анализу методом ELISA. Результаты свидетельствовали о том, что антитела вступали во взаимодействие только с DR5 и, таким образом, обладали очень высокой специфичностью (см. фиг.2).
На фиг.3 представлены результаты анализа зависимости реакции от дозы. Три антитела-агониста обладали различной зависимостью реакции (способности уничтожать клетки линии Jurkat) от дозы. У антитела А обнаружена наиболее высокая эффективность, и поэтому оно было отобрано для дополнительных исследований. Imgenex-257 представляет собой специфическое для DR5 антитело, не обладающее функциональной активностью.
Оценивали активацию каспазы-3. Для решения вопроса о том, может ли антитело вызывать уничтожение клеток в результате апоптоза, а не с помощью какого-либо иного косвенного или неспецифического механизма, осуществляли оценку активности каспазы-3. Антитело или лиганд смешивали с клетками в различных концентрациях и получали клеточные экстракты обработанных клеток. К лизату добавляли флуоресцентный субстрат, который можно использовать для оценки активности каспазы-3, которая представляет собой индикатор апоптоза. Антитело стимулировало апоптоз с помощью механизма, аналогичного механизму действия лиганда. Результаты представлены на фиг.4.
Оценивали воздействие антитела к DR5 на клеточные линии рака ободочной кишки и меланомы. На фиг.5 представлены графики зависимости реакции различных указанных линий опухолевых клеток от дозы. Все линии клеток оказались чувствительными к индуцирующим апоптоз антителам к DR5 за исключением линии клеток НСТ 116 bax/bax-, которая не может подвергаться апоптозу.
На фиг.6 представлены результаты этого же эксперимента, осуществленного на различных клетках рака молочной железы. Линии T47D и ZR-75-1 представляют собой линии, устойчивые к противоопухолевому действию DR5, а линии MCF-7 и MDA-MB-231 оказались чувствительными.
На фиг.7 представлены результаты, свидетельствующие о том, что опухолевые клетки обладали чувствительностью к действию антитела, в то время как здоровые клетки, а именно человеческие легочные фибробласты (HLF) и эндотелиальные клетки пупочной вены человека (HUVEC), оказались устойчивыми, что доказано по отсутствию зависимости реакции от дозы.
Для дополнительной демонстрации того, что здоровые клетки не уничтожались антителом, в человеческих легочных фибробластах, эпителиальных клетках молочной железы человека и в здоровых первичных человеческих гапатоцитах анализировали активность каспазы-3 после обработки антителом к DR5. Ни в одной из линий здоровых клеток не выявлено активности, в то время как в клетках фолликулярной лимфомы линии DOHH2 и в клетках линии Jurkat обнаружена связанная с апоптозом активация каспазы (см. фиг.8).
Кроме того, линия CaOV3, представляющая собой линию клеток рака яичников, уничтожалась антителом, в то время как линии здоровых клеток HLF и НМЕС оказались совершенно не подвержены действию антитела к DR5.
Оценивали эффективность антител in vivo. Десяти мышам в день 0 инъецировали подкожно 5×10 клеток линии Colo 205 (клетки рака ободочной кишки). Обработку антителом к DR5 (400 мкг) начинали в день 11. После двух инъекций с использованием 400 мкг антитела к DR5 у 5 обработанных животных отсутствовали признаки опухоли, а у 5 животных, обработанных ЗФР, выявлены крупные опухоли. Таким образом, антитело, вероятно, обладает активностью in vivo.
Эксперимент продолжали до дня 32. Необработанные мыши имели крупные опухоли или погибли. У обработанных мышей отсутствовали признаки заболевания. Эксперимент завершили в день 50. Все необработанные животные погибли. Ни у одного обработанного животного не выявлено никакого рецидива к дню 50. На фиг.9 графически представлены результаты изучения эффективности в отношении клеток линии Colo 205. Стрелками обозначены дни обработки.
В предыдущем эксперименте для обработки использовали одну дозу. Для определения эффективности антитела осуществляли эксперимент, в котором использовали несколько доз. Размер группы увеличивали до 8 мышей на группу и вводили дозы, составляющие 50, 200 и 400 мкг, осуществляя опыт аналогично описанному выше эксперименту, применяемому для оценки одной дозы. Результаты свидетельствовали о том, что антитело обладало эффективностью при использовании низких доз (например, 50 мкг) (см. фиг.10).
Осуществляли также оценку зависимости реакции от более низких доз на новой модели опухоли, такой как клетки меланомы линии А2058. Эта линия клеток оказалась более устойчивой к антителу в опытах in vitro. Группа состояла из 2 мышей. При обработке группы мышей дозой 400 мкг обнаружена способность антитела уничтожать опухоль in vivo, а у мышей, обработанных 20 мкг или ЗФР, обнаружены крупные опухоли (см. фиг.11).
Поскольку различные линии клеток характеризовались различным уровнем чувствительности к антителу к DR5, при создании изобретения были изучены небольшие молекулы-синергисты, которые повышали чувствительность устойчивых или частично устойчивых линий клеток к действию антитела. При создании изобретения для решения этой проблемы оценивали пути апоптоза, определяя, можно ли потенциально блокировать апоптоз, и какого типа небольшие молекулы-синергисты могут обладать проапоптозным действием в естественных условиях.
На фиг.12 представлены внешний и внутренний пути апоптоза. Имеющим решающее значение фактором является то, что опухолевые клетки осуществляют сверхэкспрессию ингибиторов апоптоза (IAP) и Bcl2, который блокирует высвобождение играющих решающее значение проапоптозных белков (cyto С и SMAC) из митохондрий. Блокаду, создаваемую этими белками, можно преодолевать добавлением SMAC. SMAC ингибирует IAP. Миметик SMAC, обозначенный как LB 672, тестировали в отношении его возможности синергетически влиять на повышение чувствительности (сенсибилизацию) опухолевых клеток к действию агониста DR5.
На фиг.13 представлены данные о воздействии миметика SMAC на клетки меланомы линии А2058. Предварительно при создании изобретения было установлено, что эти клетки обладают частичной чувствительностью к антителу. Из диаграммы видно, что клетки, обработанные SMAC и антителом к DR5, полностью уничтожались, в то время как само соединение 672 фактически не обладало активностью.
На фиг.14 графически представлена зависимость реакции клеток меланомы линии А2058 от дозы при использовании различных концентраций SMAC. И в этом опыте опухолевые клетки являлись частично устойчивыми, но сенсибилизировались при использовании невысоких концентраций SMAC (50-100 нМ). Однако, что является наиболее важным, ни клетки линии НМЕС, ни клетки линии HLF не сенсибилизировались миметиком SMAC, таким как LB672.
На фиг.15 представлены данные о фармакокинетических свойствах SMAC.
Вторую стратегию синергизма использовали для оценки возможности применения ингибиторов протеосом в качестве синергистов DR4/DR5. Как видно из фиг.16, ингибиторы протеосом предупреждают расщепление IκВ протеосомой. Это в свою очередь предупреждает высвобождение NFκB. Известно, что NFκB обладает способностью к транслокации в ядра и инициирует транскрипцию BCL2, IAP и других антиапоптозных факторов.
При создании изобретения прежде всего оценивали, могут ли ингибиторы протеосом повышать чувствительность опухолевых клеток к DR5 при добавлении MG132, который представляет собой поступающий в продажу слабый ингибитор протеосом. На фиг.17 показано, что умеренно высокие концентрации MG 132 повышали чувствительность устойчивых клеток ободочной кишки линии SW 480 к действию антитела.
Было выявлено несколько эффективных ингибиторов протеосом. Обладающие наиболее высокой эффективностью соединения представляли собой боронаты. Максимальные переносимые дозы этих соединений свидетельствуют об их относительной токсичности, и поэтому они характеризуются узким окном между токсичностью и противоопухолевым действием in vivo (см. фиг.18).
Ингибиторы протеосом повышали чувствительность к антителам к DR5 клеток линии A2058-LUC (см. фиг.19). Ингибиторы протеосом повышали также чувствительность к антителам устойчивых клеток гепатомы линии HUH-7 (см. фиг.20). Однако ни одно из изученных соединений не оказывало воздействия на здоровые клетки линии НМЕС. Кроме того, чувствительность этих клеток к антителу не повышалась (см. фиг.21).
Вариабельные области мышиного антитела А к DR5 клонировали и встраивали в экспрессионную систему SP20. Эти векторы кодируют Fc-фрагмент человеческого IgGl. Образовавшаяся человеческая химера на 80% состояла из человеческих и на 20% из мышиных областей. Нуклеотидные последовательности вариабельных областей тяжелой и легкой цепей представлены на фиг.22. Аминокислотная последовательность вариабельной области тяжелой цепи представлена на фиг.24 или фиг.35, а аминокислотная последовательность вариабельной области легкой цепи представлена на фиг.25 или фиг.35. Химеру экспрессировали в клетках линии SP2/0, получая 20 пг/клетку/день. Образовавшееся человеческое химерное антитело перекрестно сшивали с козьим антителом к человеческому Fc и оценивали функциональную активность. Химера обладала функциональной противоопухолевой активностью, эквивалентной активности мышиного антитела (см. фиг 21).
Пример 55:
Библиотекой молекул siPHK трансфектировали клетки, клетки приводили в контакт с TRAIL и подвергали их скринингу по признаку изменения жизнеспособности по сравнению с клетками, не обработанными TRAIL. Клетки с измененной жизнеспособностью затем применяли для идентификации конкретной siPHK, которой трансфектировали клетку, определяя тем самым ген, ингибируемый siPHK (см. фиг.26 и 27).
На фиг.28 проиллюстрированы генные продукты, соответствующие siPHK, которые были отобраны при скрининге. Генные продукты, ингибирование которых с помощью siPHK приводило к низкому соотношению TRAIL (+/-), представляют собой ингибиторы индуцируемого TRAIL апоптоза.
В таблице 2 представлена дополнительная информация, включающая регистрационные номера в Genbank, для генных продуктов, указанных на фиг.28.
Пример 56:
Были идентифицированы siPHK, которые специфически ингибировали экспрессию Gsk3α или Gsk3β, что давало возможность выявлять воздействие любого генного продукта на индуцируемый TRAIL апоптоз. Как проиллюстрировано на фиг.29, ингибирование Gsk3α, но не Gsk3β, снижало каспазную активность в клетках по сравнению с контролем. Таким образом, Gsk3α является активатором индуцируемого TRAIL апоптоза. Аналогичным путем два других генных продукта, а именно SRP72 и FLJ32312, были также выявлены в качестве активаторов апоптоза.
Взаимосвязь различных компонентов, выявленная при создании изобретения, представлена на фиг.30, где проиллюстрирована взаимосвязь и действие (например, активирующее или ингибирующее апоптоз) различных компонентов пути индуцируемого TRAIL апоптоза.
Пример 57:
Библиотекой siPHK, оказывающей воздействие на 510 генов, которую использовали в 384-луночном формате, трансфектировали клетки линии Не1а. Клетки инкубировали в течение 48 ч, позволяя мишени расщепляться, и обрабатывали TRAIL или оставляли без обработки TRAIL. Жизнеспособность оценивали через 20 ч после обработки TRAIL с использованием аламарового синего. Для каждой siPHK определяли соотношение чувствительности (SR) путем сравнения со всеми 60 значениями, полученными с использованием контрольных siPHK. У клеток линии Неlа, обработанных лигандом TRAIL, обнаружено ~ 40% снижение жизнеспособности при оценке МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид)-анализом по сравнению с контрольными лунками. Были выявлены siPHK, которые в значительной степени снижали или повышали уровень клеточной гибели (см. таблицы 3 и 4 соответственно).
У нескольких siPHK, у которых при скрининге выявлена способность повышать уровень клеточной гибели по данным анализов жизнеспособности, оценивали эффективность в отношении усиления активации каспазы с помощью антител-агонистов к DR5. Антитела к DR5 титровали для определения минимального уровня активации каспазы при оценке с помощью флуорогенных пептидов (DEVD-afc). Клетки линии Hela трансфектировали siPHK, действие которых направлено против nsrna, nsurf, PAK1, stk12, Ask1 и JIK, и затем обрабатывали антителами к DR5. Контрольная siPHK (nsrna) оказывала незначительное действие, в то время как выявленные siPHK в значительной степени повышали каспазную активность.
Создавали несколько дополнительных (отличающихся от применяемых при скрининге) siPHK, оказывающих воздействие на PAK1, и тестировали в отношении их влияния на жизнеспособность в присутствии антитела к DR5 или без него. Эти siPHK представляли собой:
siPAK1-0 AGAGCTGCTACAGCATCAA
siPAK1-1 GACAUCCAACAGCCAGAAA
siPAK1-2 GAGAAAGAGCGGCCAGAGA
hPAK1-6 UACCAGCACUAUGAUUGGA
siPAK1-7 UCUGUAUACACACGGUCUG
РАК1-1 и РАК1-2 в значительной степени снижали жизнеспособность (МТТ-анализ) клеток карциномы ободочной кишки линии НСТ116 bax+/- как через 24, так и через 48 ч.
Клетки НСТ116 bax -/- представляют собой линию клеток с делецией обеих копий bax, что делает эти клетки очень устойчивыми к химиотерапевтической обработке, в том числе к обработке с помощью TRAIL1 и антител к DR5. Однако siPHK PAK1 сохраняли эффективность в отношении снижения жизнеспособности и этих клеток. Аналогичные результаты были получены также при использовании клетки карциномы ободочной кишки линии DLD1.
Для выяснения вопроса о том, может ли молчание или ингибирование PAK1 оказаться токсичным для здоровых клеток, осуществляли оценку воздействия siPHK PAK1 на эмбриональные эпителиальные клетки яичников линии IOSE80. Результаты свидетельствовали о том, что siPHK, действие которых направлено против PAK1, не снижали жизнеспособность здоровых клеток. Thus, PAK1 and the other gene products.
Кроме того, оказалось, что siPAKI не могли в значительной степени снижать жизнеспособность эмбриональных («здоровых») эпителиальных клеток линии НМЕС, в то время как значительно повышали индуцируемое DR5 и DR4 снижение жизнеспособности клеток карциномы ободочной кишки линии НСТ15.
Пример 58: Синергетическое действие антагониста UbcH10 и антитела к DR5
В этом примере продемонстрировано синергетическое действие антагониста человеческой убикитин-конъюгазы UbcH10 (UBE2C) и антитела к DR5 в отношении индукции апоптоза опухолевых клеток. UbcH10 играет основную роль в регуляции клеточного цикла. С помощью глобального анализа экспрессии генов и иммуногистохимия при создании настоящего изобретения было установлено, что происходит выраженная сверхэкспрессия UbcH10 при карциномах различных анатомических областей, в частности, молочной железы, желудка /пищевода, колоректальной системы, легкого и яичника. Полученные данные свидетельствовали о том, что UbcH10 играет важную роль в развитии опухолей. После получения этих данных осуществляли оценку терапевтического потенциала ингибирования UbcH10 для лечения различных видов рака.
Снижение клеточного роста с помощью опосредуемого PHKi молчания экспрессии UbcH10
При создании изобретения впервые исследованы результаты молчания генов в опухолевых клетках с повышенными уровнями UbcH10, также впервые сконструированы последовательности трех различных и неперекрывающихся малых интерферирующих РНК (siPHK) (UbcH10-495, UbcH10-378, UbcH10-412). Каждую siPHK сначала тестировали на двух линиях клеток ТЗМ4 (полученной из карциномы поджелудочной железы) и DLD-1 (полученной из колоректальной карциномы). Все три siPHK, действие которых направлено против UbcH10, в отличие от контрольной siPHK, вызывали резкое снижение уровня белка UbcH10, что коррелировало с их способностью подавлять клеточный рост. Эти данные свидетельствовали о специфичности siPHK в отношении UbcH10 и о том, что результаты не являются следствием не связанных с указанной мишенью действий. Поскольку комплекс UbcH10-APC контролирует расщепление циклина В1, при создании изобретения оценивали также последствия молчания UbcH10 по уровням циклина В1 с помощью анализа методом Вестерн-блоттинга. Полученные результаты позволили выявить обратную корреляцию между уровнями белка UbcH10 в клетках, обработанных siUbcH10, и уровнями циклина В1. Кроме того, анализ клеточного цикла после обработки siUbcH10 показал задержку М-фазы (данные не представлены), что согласуется с известными из литературы сведениями. По данным микроскопического анализа понижающая регуляция UbcH10 не индуцировала каких-либо изменений в клеточной морфологии, которые характерны для апоптоза, таких как округление, отсоединение, ядерная конденсация или производство апоптозных телец в клетках. Кроме того, обработка siUbcH10 не приводила к протеолитическому процессингу двух каспаз-«киллеров», каспазы-3 и -7 (14), что подтверждено анализом методом Вестерн-блоттинга и флуоресцентными анализами каспазной активности.
Понижающая регуляция UbcH10 является аддитивной к действию стандартных химиотерапевтических лекарственных средств:
В организме человека для различных форм рака характерен более высокий уровень сверхэкспрессии UbcH10 по сравнению с большинством здоровых тканей. Для определения возможности терапевтического применения агентов, действие которых направлено против UbcH10, при создании изобретения оценивали несколько известных химиотерапевтических агентов и агент с определенной молекулярной мишенью для выявления возможных специфических для опухолей воздействий, являющихся результатом «молчания (выключения)» UbcH10. Для этих исследований применяли стабилизирующий микротрубки агент паклитаксел, ингибитор веретена винбластин, алкилирующий ДНК агент митомицин с и функциональное антитело-агонист, обладающее способностью инициировать опосредуемый DR5/TRAIL апоптоз, которые представляют собой весь спектр агентов с различными механизмами действия. Две линии клеток рака поджелудочной железы Т3М4 и Panc-1 и линию клеток не зависящей от андрогена карциномы предстательной железы CWR-RV1 обрабатывали siUbcH10 в течение 48 ч с последующей инкубацией с винбластином, паклитакселом, митомицином с и антителом к DR5 в течение еще 24 ч. Результаты свидетельствовали о том, что совместная обработка оказывающими действие на митоз токсикантами и повреждающими ДНК лекарственными средствами после «выключения» UbcH10 приводила к аддитивному снижению жизнеспособности клеток различных изученных клеточных линий (фиг.31). Предварительная обработка раковых клеток в течение 48 ч siUbcH10 снижала количество жизнеспособных клеток более чем на 50%, количество жизнеспособных клеток оказалось возможным дополнительно снижать добавлением цитотоксических агентов в течение следующих 24 ч. После стандартизации количества клеток с молчащей UbcH10, концентрации IC90 или IC50 оказались идентичными, что свидетельствовало об аддитивном действии. Все три независимые siPHK, мишенью которых является UbcH10, проявили действие, аналогичное действию TRAIL, при оценке на клетках линий Т3М4 и Рапс-1. Приведенные данные являются средними по трем повторностям, причем одинаковые результаты были получены в четырех независимых экспериментах.
Понижающая регуляция UbcH10 повышает чувствительность клеток к опосредуемому TRAIL/DR5 уничтожению клеток:
Затем были проведены исследования, в которых эмбриональные фибробласты человека (BJ), эпителиальные клетки молочной железы человека (НМЕС) и клетки линии ТЗМ4 обрабатывали siUbcH10 (siUbcH 10-495) в течение 48 ч с последующей обработкой антителами-агонистами к DR5 (500 нг/мл) в течение еще 6 ч. Флуоресцентно (ФИТЦ) меченые контрольные siPHK применяли для гарантии одинаковой эффективности трансфекции всех клеточных линий, включая клетки BJ и НМЕС. Клетки анализировали с помощью микроскопа. Результаты представлены на фиг.31 и 32. Как видно из чертежей, предварительная обработка siUbcH10 клеток линий Т3М4 и Рапс-1 значительно повышала апоптоз, индуцируемый антителами к DR5, по сравнению с обработкой только siPHK или только антителом к DR5, и при этом не оказывала никакого воздействия на клетки линии CWR-RV1, которые не обладают чувствительностью к TRAIL (фиг.31). Эти данные свидетельствовали о том, что инкубация линий раковых клеток, прежде всего Т3М4, с антителом к DR5 после обработки siUbcH10 приводила к очень резкому повышению апоптоза. Это явление не обнаружено при использовании эмбриональных кожных фибробластов человека (BJ) или эпителиальных клеток молочной железы (НМЕС) (фиг.31 и 32). Вероятно, эти данные отражают общее явление, поскольку другие устойчивые к TRAIL линии опухолевых клеток, а также здоровые клетки не становились чувствительными к TRAIL при понижающей регуляции UbcH10.
Пример 59
Синергетическое действие антител-агонистов к DR4 или к DR5 и ингибиторов протеосом в отношении опухолевых клеток с дефектом Вах
Дефекты системы репарации ДНК (репарация ошибочно спаренных оснований (MMR)) приводит к генетической нестабильности, поскольку ошибки репликации не корректируются. Этот тип генетической нестабильности является имеющим решающее значение фактором в злокачественном развитии наследственного неполипозного колоректального рака (ННПКР) и подтипов спорадического рака ободочной кишки, и частота мутаций является особенно высокой на коротких последовательностях-повторах, например, входящих в гены TGFbetaRII и ВАХ. Так, уменьшение уровня Вах в этих опухолях обеспечивает значительное преимущество с точки зрения выживания при естественном или индуцированном химиотерапевтическими агентами апоптозе.
На фиг.34 проиллюстрировано, что снижение уровня Вах обусловливает устойчивость к лиганду TRAIL. Однако ингибирование протеосом восстанавливает чувствительность к TRAIL. Ингибирование протеосом с помощью ингибиторов с пептидильным каркасом МО-132 или MG262 или с помощью природного соединения лактацистина полностью восстанавливало чувствительность к TRAIL в клетках с дефицитом Вах (см. фиг.34).
Ингибиторы протеосом позволяют устранять дефекты в митохондриальном пути апоптоза. В зависимости от типа клеток активная каспаза-8 может непосредственно приводить к активации расположенных относительно ее в прямом направлении эффекторных каспаз типа каспазы-3 (так называемые клетки типа I). В клетках типа II (большинство клеток, включая НСТ116), два прототипических пути, внешний (рецептор некроза) и внутренний (митохондриальный), связаны с опосредуемым каспазой-8 расщеплением bc1-2, представителя проапаптозного семейства Bid, который усиливает высвобождение митохондриями цитохрома с и SMAC. После высвобождения в цитоплазму цитохром с ассоциируется с Apaf-1 и прокаспазой-9, образуя «апоптосому», что приводит к активации прокаспазы-9 и последующей активации эффекторных каспаз, таких как каспаза-3. С другой стороны, цитозольный агент SMAC связывается с представителями семейства белков IAP (ингибиторы апоптоза) и тем самым препятствует ингибированию с помощью IAP каспазы-3 и -9.
Эти явления легко оценивать с помощью анализа методом Вестерн-блоттинга обработанных TRAIL клеток Вах+/- (высвобождение SMAC и цитохрома с не показано) (см. фиг.34). Аналогично этому в клетках Вах -/-, обработанных TRAIL (Т), процессинг каспазы-8 и процессинг Bid происходил так же как в норме, однако процессинг каспазы-9 и полный процессинг каспазы-3 не происходил (дорожки 2, 3 и 4). Это является ожидаемым результатом, поскольку низкие уровни Вах препятствуют прохождению событий в прямом направлении после расщепления Bid, так как образующийся проапоптозный фрагмент Bid нуждается в присутствии Вах для этих явлений. Обработка TRAIL (Т)+MG-262 (М) полностью восстанавливала митохондриальный путь, приводящий к процессингу каспазы-9 и каспазы-3 и активации, что вызывало гибель клеток. Сам ингибитор MG-262 (М) не оказывал воздействия на этот протеолитический каскад. Эти и другие данные свидетельствовали о том, что ингибирование протеосом является важным для восстановления чувствительности к апоптозу, индуцируемому агонистами рецепторого лиганда TRAIL, опухолевых клеток, которые имеют дефекты в митохондриальном пути апоптоза.
Хотя изобретение описано выше с некоторыми деталями, приведенными с целью его иллюстрации, и примерами, приведенными с целью облегчения понимания, обычному специалисту в данной области в свете изложенного должно быть очевидно, что в настоящее изобретение могут быть внесены изменения и модификации без отклонения от сущности и объема прилагаемой формулы изобретения.
Все публикации, базы данных, последовательности из Genbank, патенты и заявки на патент, процитированные в настоящем описании, включены в него в качестве ссылок в той степени, как если бы каждая из них, указанная конкретно и индивидуально, была включена в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БОРОНОВОЙ КИСЛОТЫ | 2018 |
|
RU2793315C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗЫ | 2015 |
|
RU2686740C2 |
| АНАЛИЗЫ И СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ БИОМАРКЕРЫ | 2005 |
|
RU2410438C2 |
| АНАЛИЗЫ И СПОСОБЫ С ПРИМЕНЕНИЕМ БИОМАРКЕРОВ | 2005 |
|
RU2431676C2 |
| СПОСОБЫ И МАТЕРИАЛЫ ДЛЯ ОБНАРУЖЕНИЯ АПОПТОЗА | 2007 |
|
RU2450273C2 |
| АПОПТОТИЧЕСКАЯ ЧУВСТВИТЕЛЬНОСТЬ К Apo2L/TRAIL ПУТЕМ ТЕСТИРОВАНИЯ ЭКСПРЕССИИ GalNac-T14 В КЛЕТКАХ/ТКАНЯХ | 2006 |
|
RU2416097C2 |
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ АГОНИСТОВ АРО-2L-РЕЦЕПТОРОВ И АКТИВАТОРОВ NK-КЛЕТОК | 2005 |
|
RU2395294C2 |
| АНТИТЕЛО, СЕЛЕКТИВНОЕ В ОТНОШЕНИИ РЕЦЕПТОРА ЛИГАНДА, ИНДУЦИРУЮЩЕГО АПОПТОЗ И СВЯЗАННОГО С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2313537C2 |
| ПРОИЗВОДНЫЕ БОРОНОВОЙ КИСЛОТЫ | 2015 |
|
RU2717558C2 |
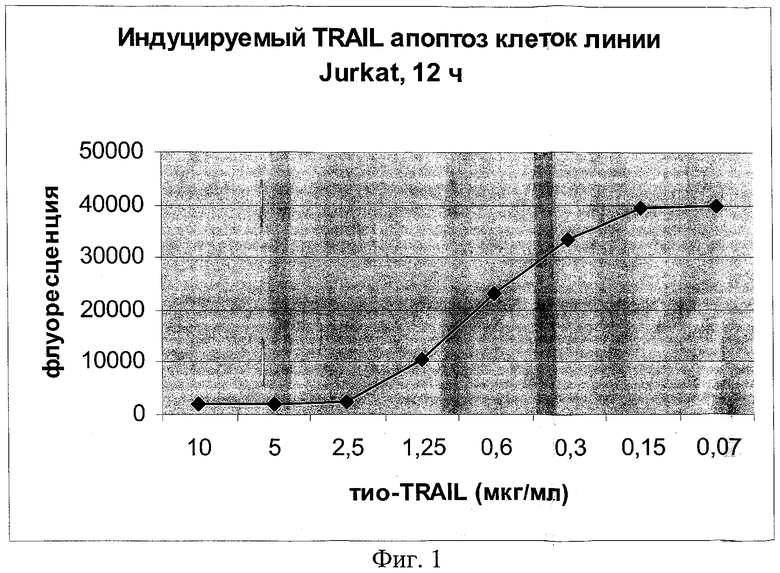
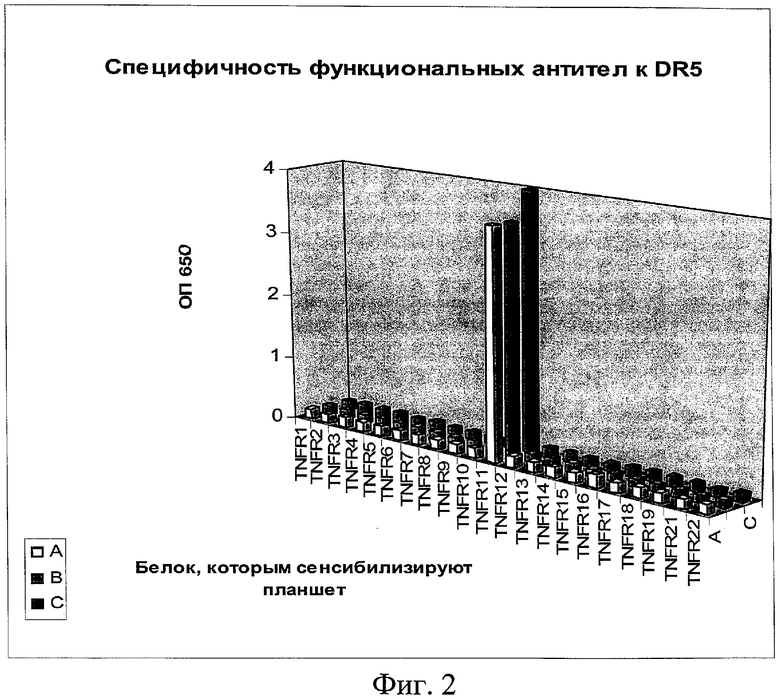
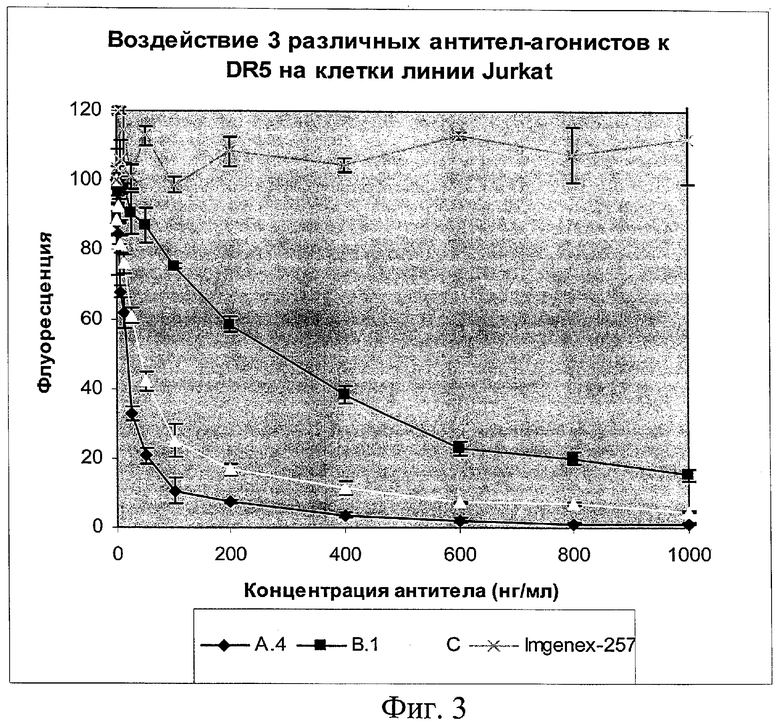
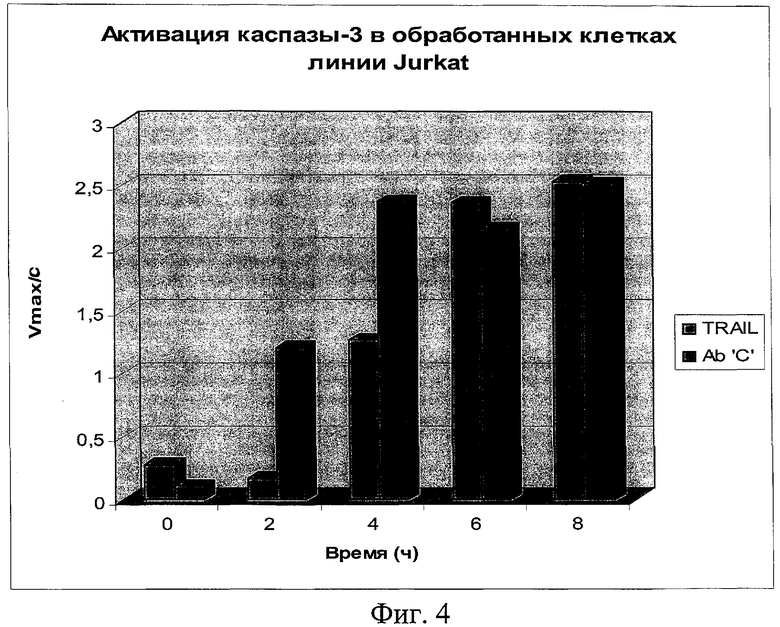
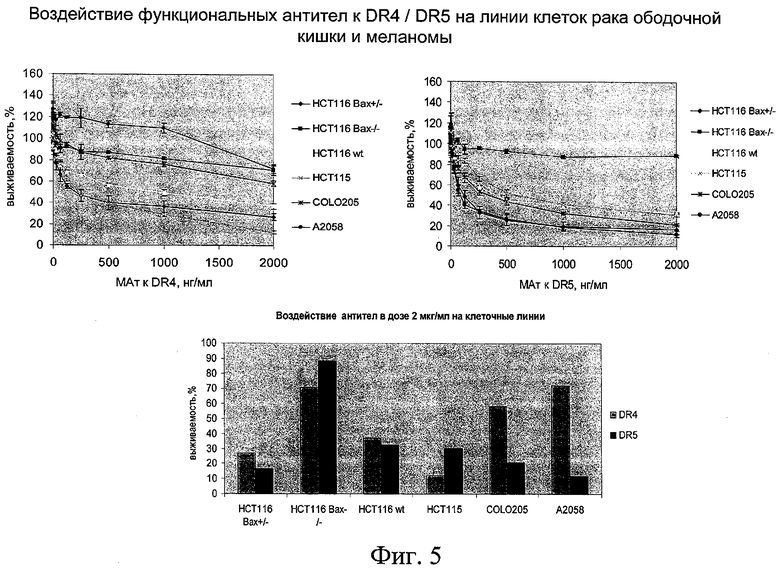
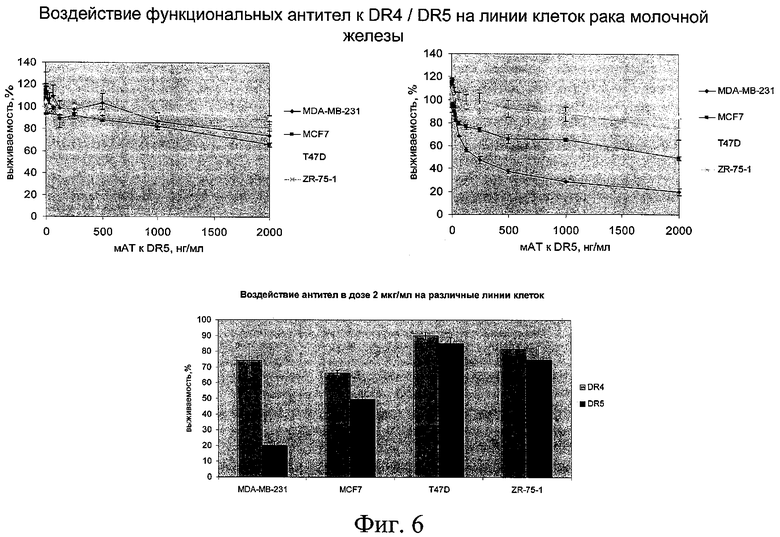
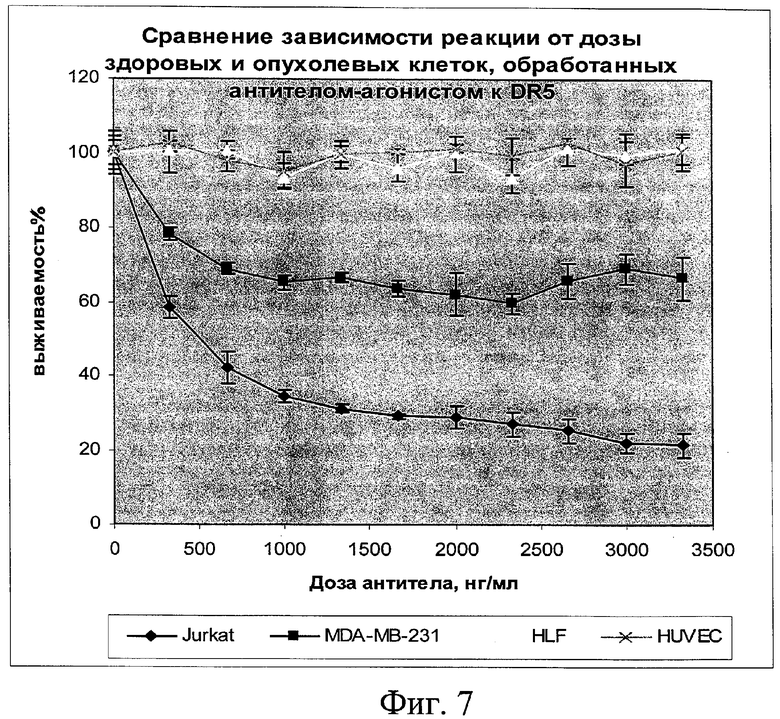
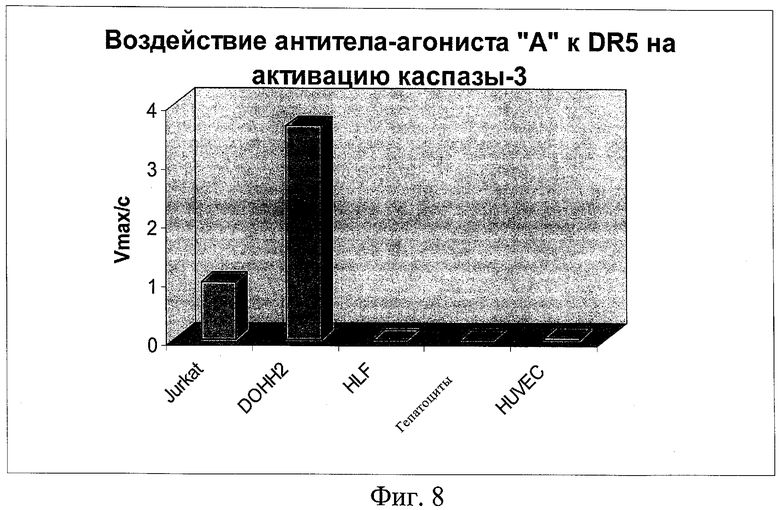
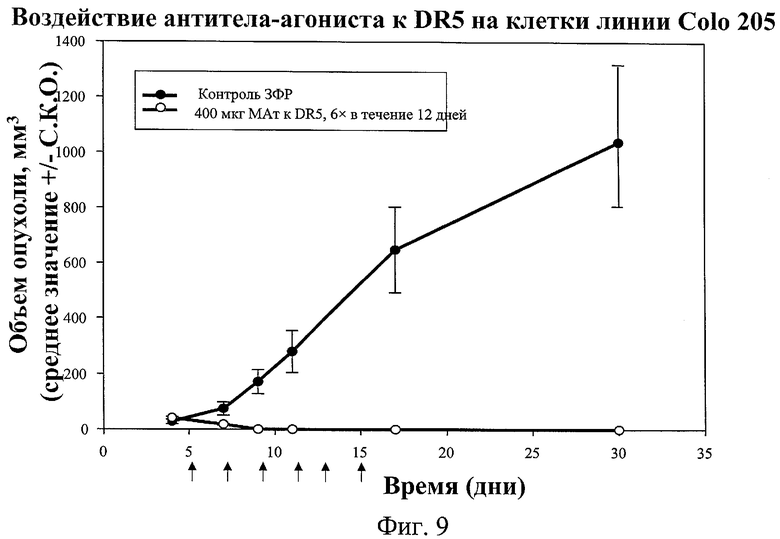
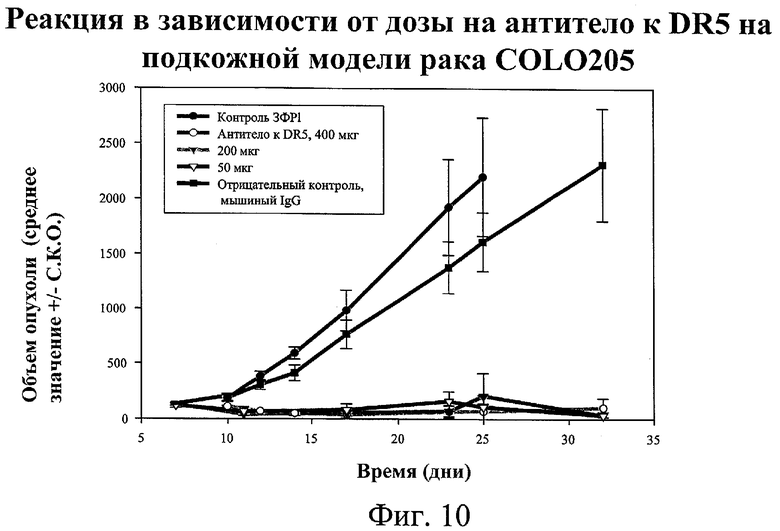
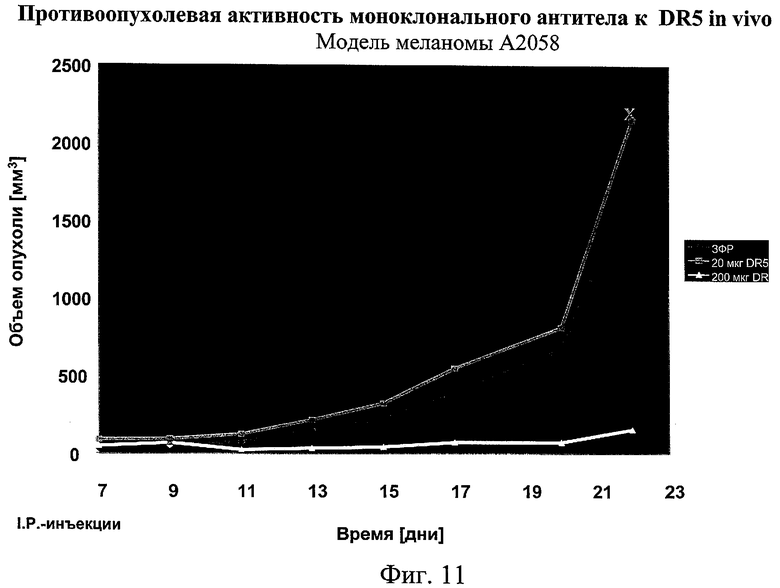
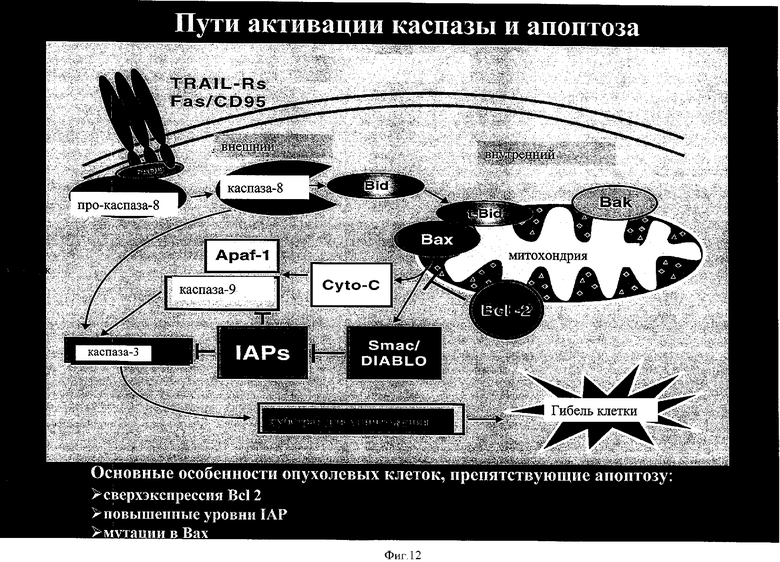
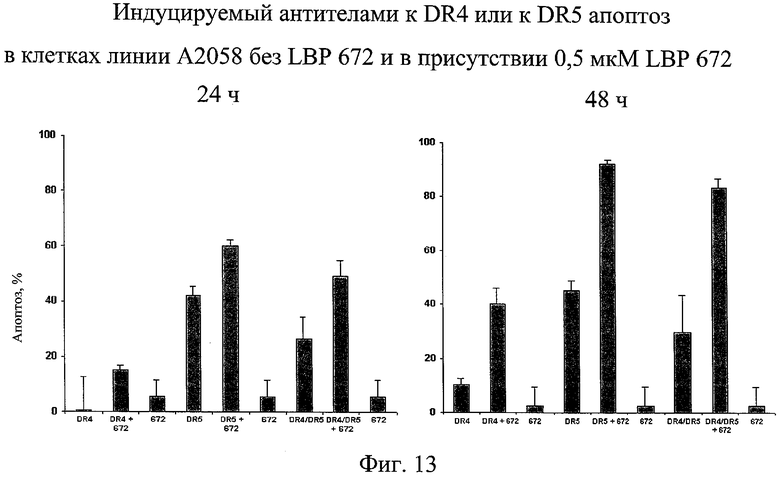
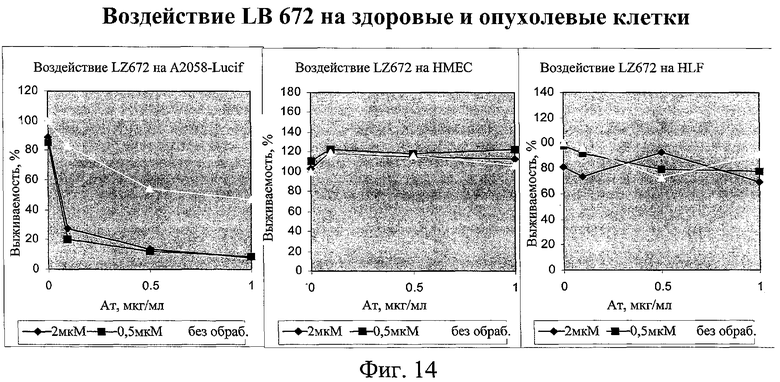
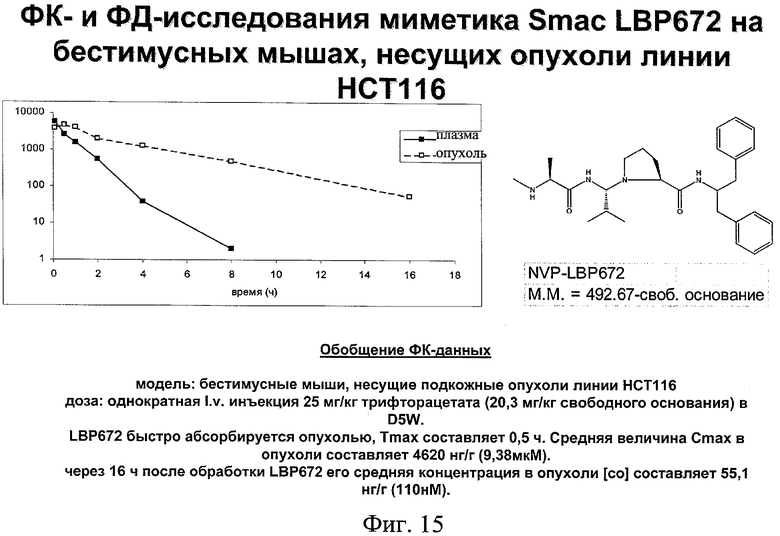
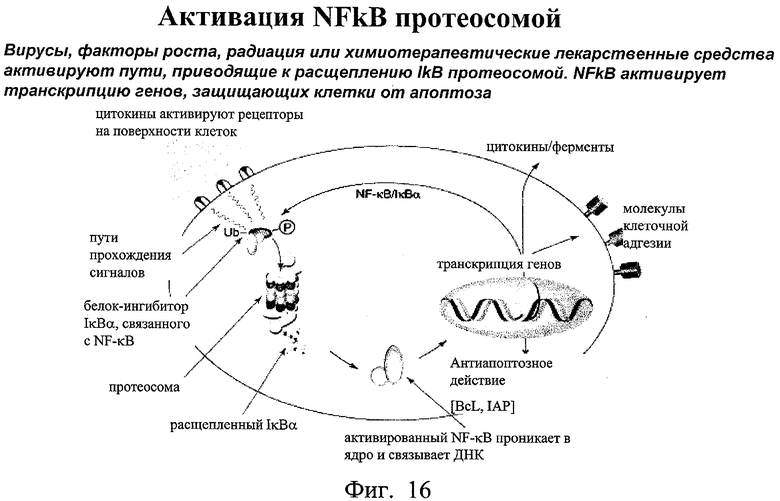
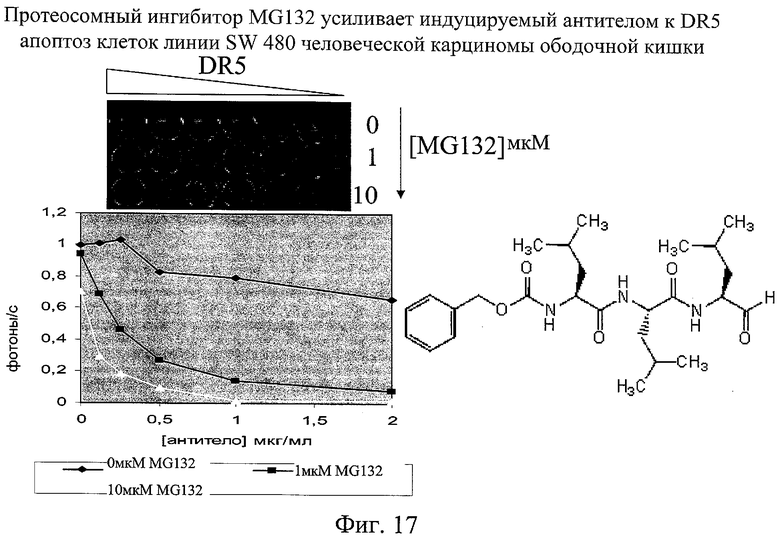
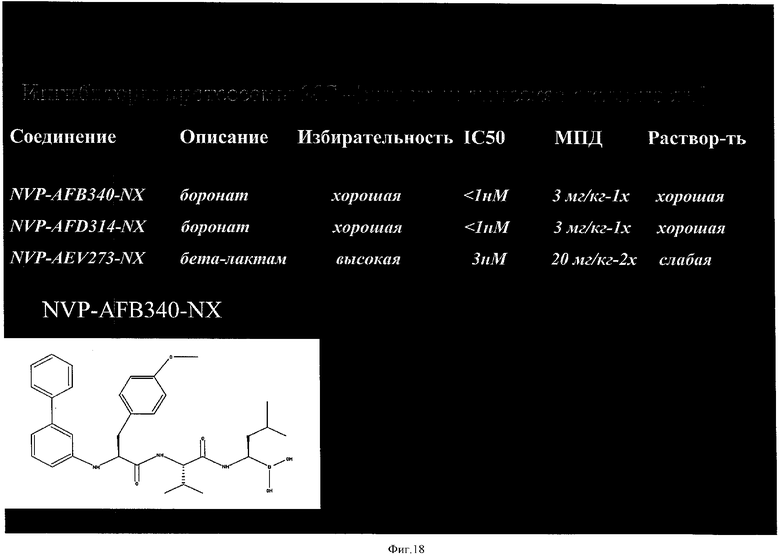
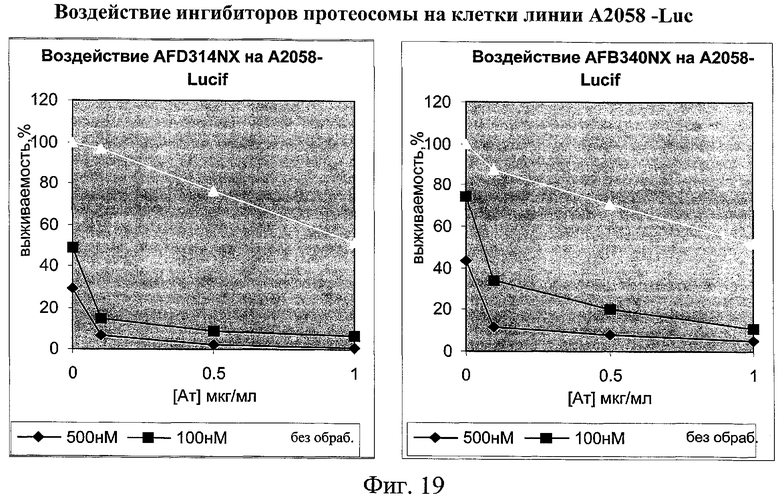
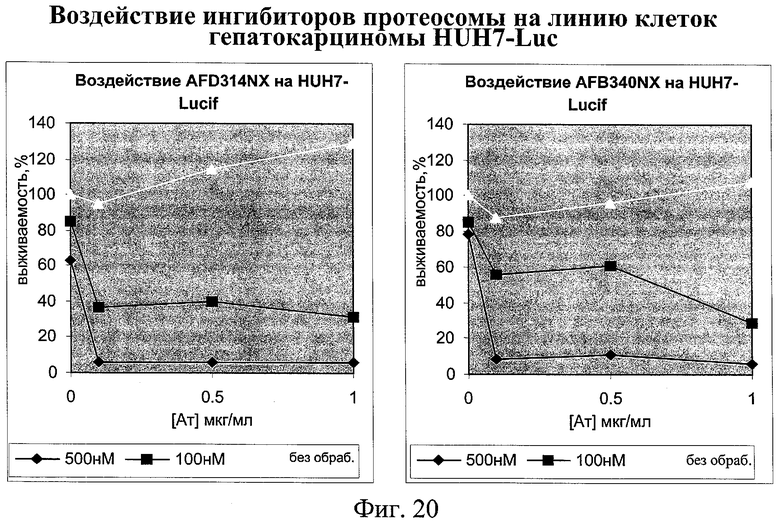
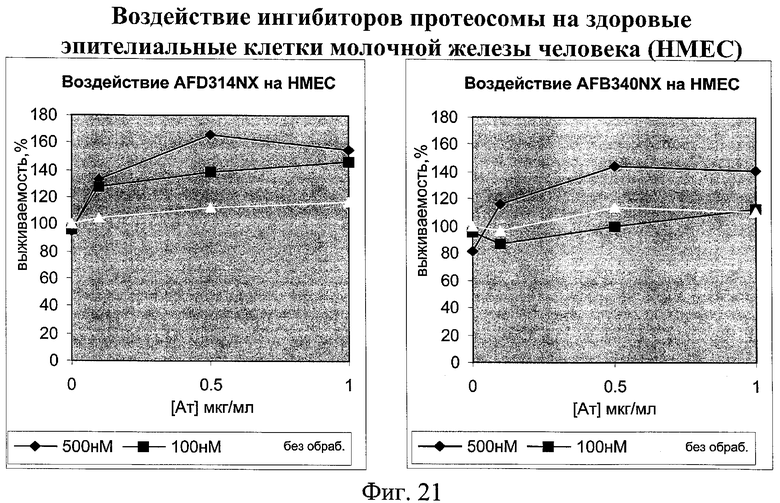
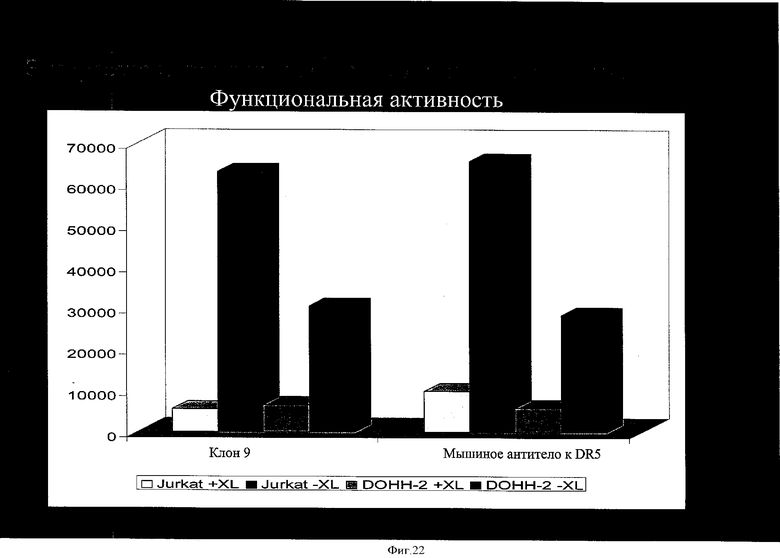




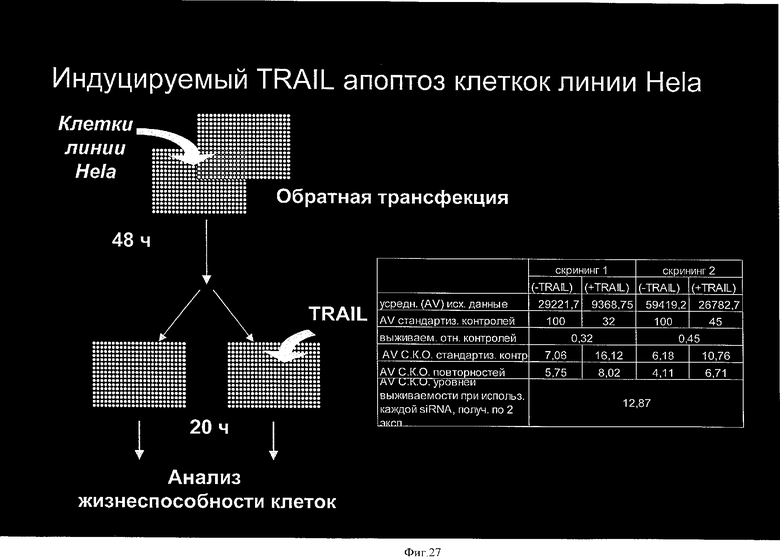

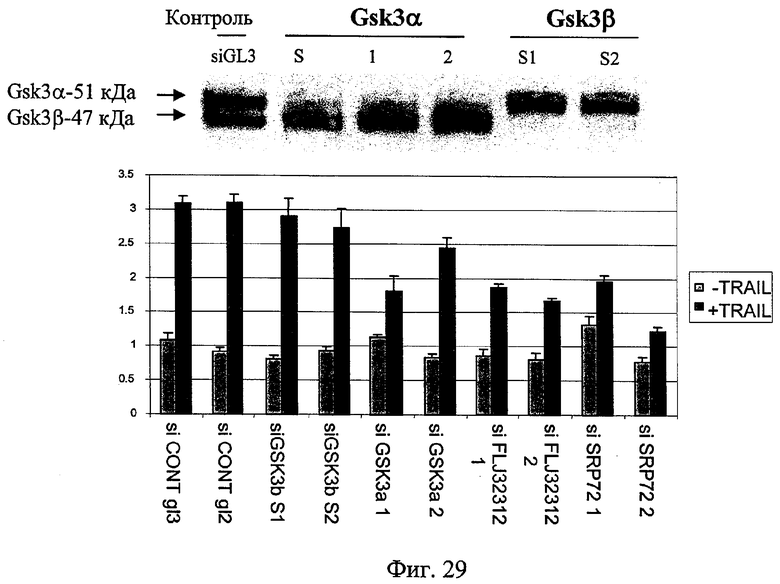
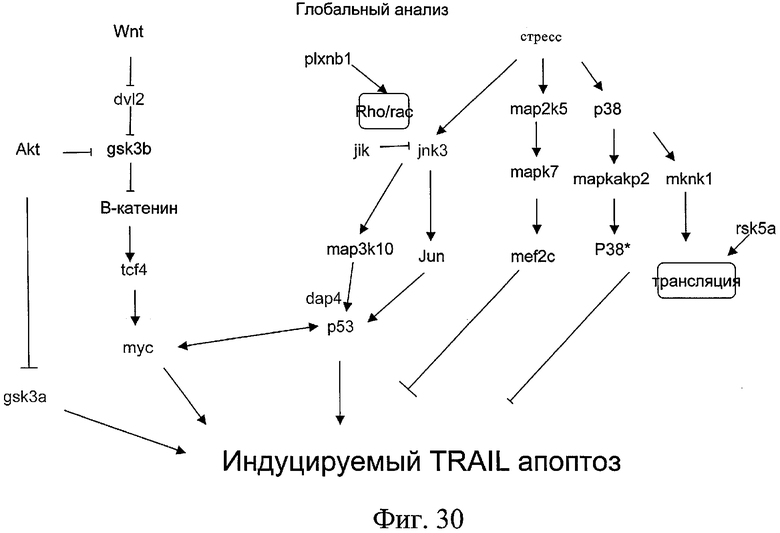
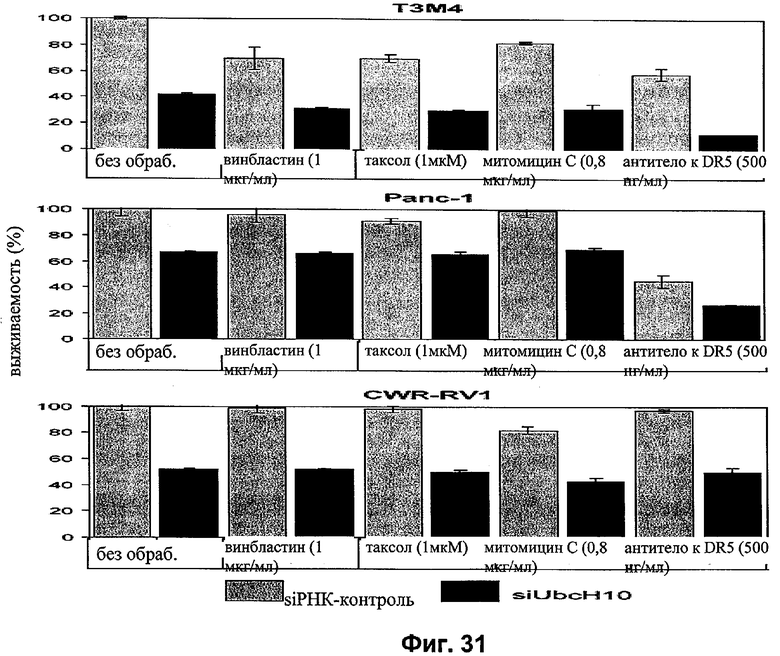
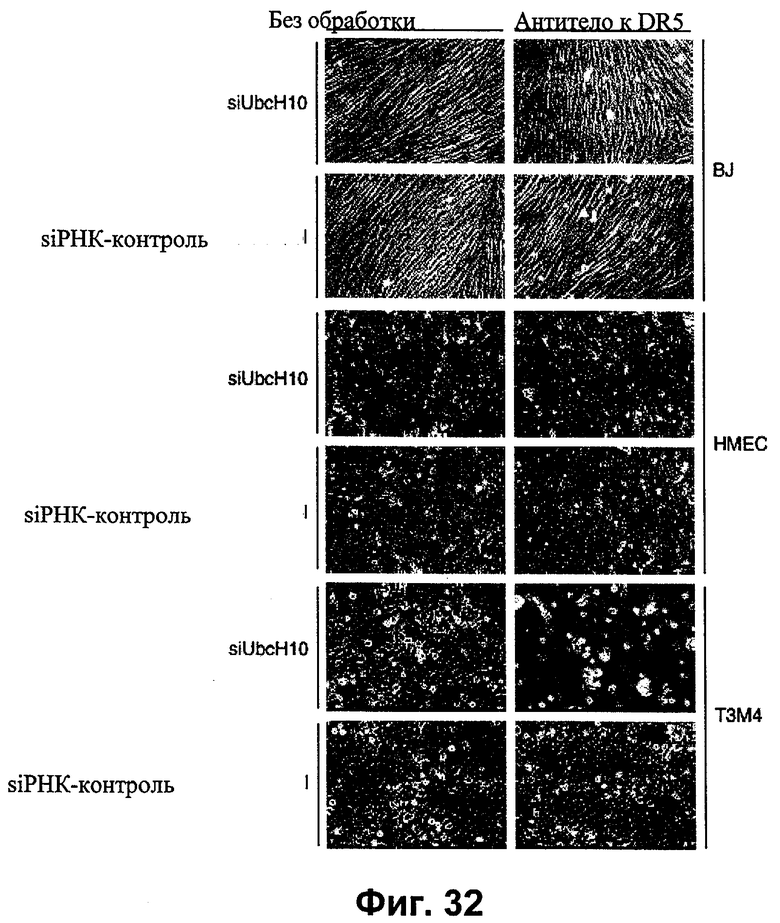
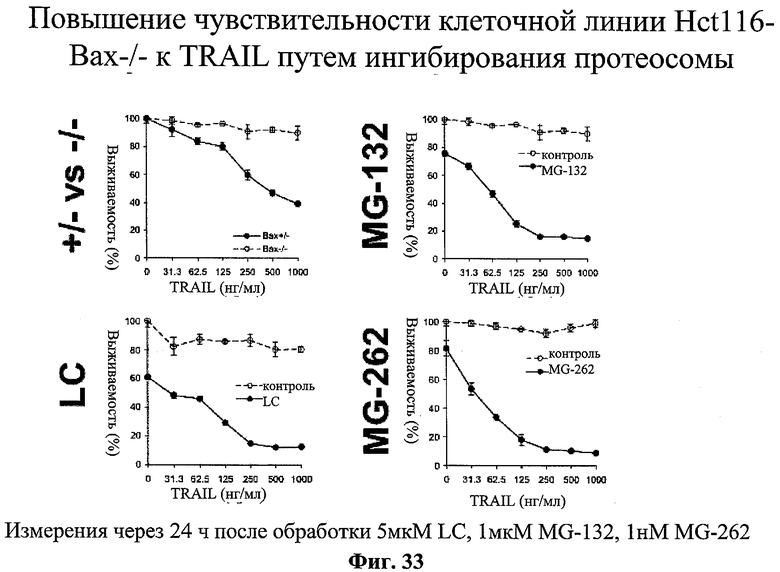
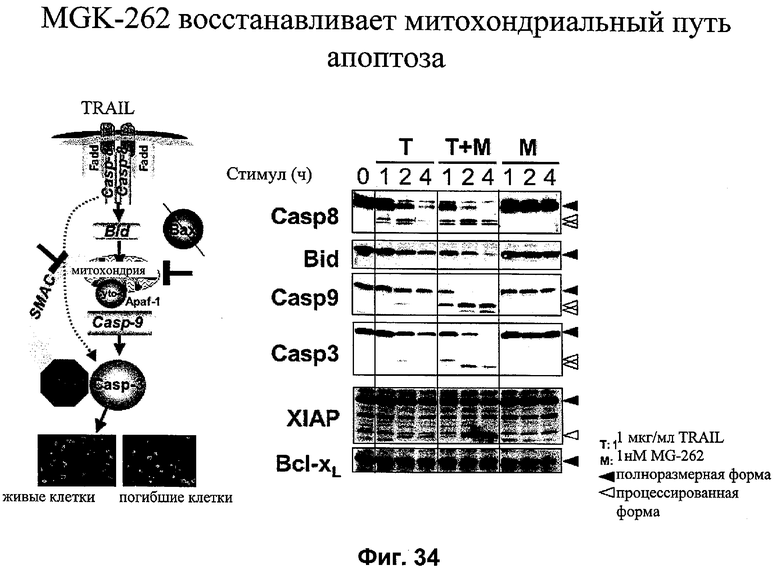

Изобретение относится к области медицины и касается способов и композиций для индукции апоптоза раковых клеток. Сущность изобретения включает модифицированные антитела-агонисты к DR-5, которые в сочетании с апоптоз-индуцирующими агентами синергетически индуцируют апоптоз раковых клеток. Преимущество изобретения заключается в усилении противоопухолевой активности. 7 н. и 12 з.п ф-лы, 4 табл., 35 ил.
1. Выделенная клетка, экспрессирующая антитело, которое содержит гипервариабельный участок вариабельной области тяжелой цепи, представленный на фиг. 24, и вариабельной области легкой цепи, представленный на фиг. 25, и где антитело обладает связывающей специфичностью антитела, включающего вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг. 24, и вариабельную область легкой цепи, содержащую последовательность, которая представлена на фиг. 25.
2. Антитело, которое содержит гипервариабельный участок вариабельной области тяжелой цепи и вариабельной области легкой цепи, представленные на фиг. 35, и где антитело обладает связывающей специфичностью антитела, включающего вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.35, и вариабельную область легкой цепи, содержащую последовательность, которая представлена на фиг. 35.
3. Антитело, которое содержит гипервариабельный участок вариабельной области тяжелой цепи, представленный на фиг. 24, и вариабельной области легкой цепи, представленный на фиг. 25, и где антитело обладает связывающей специфичностью антитела, включающего вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг. 24, и вариабельную область легкой цепи, содержащую последовательность, которая представлена на фиг. 25.
4. Клетка по п.1, где антитело, экспрессируемое клеткой, содержит вариабельную область тяжелой цепи, представленную на фиг. 24, и вариабельную область легкой цепи, представленную на фиг. 25.
5. Клетка по п.1, антитело является гуманизированным антителом.
6. Антитело по п.2, где антитело включает вариабельную область тяжелой цепи и вариабельную область легкой цепи, представленные на фиг. 35.
7. Антитело по п.3, где антитело содержит вариабельную область тяжелой цепи, представленную на фиг. 24, и вариабельную область легкой цепи, представленную на фиг. 25.
8. Антитело по п.2, где антитело является тетрамерным антителом.
9. Антитело по п.2, где антитело является гуманизированным антителом.
10. Антитело по п.3, где антитело является тетрамерным антителом.
11. Антитело по п.3, где антитело является гуманизированным антителом.
12. Выделенная клетка, экспрессирующее антитело, где антитело содержит гипервариабельный участок вариабельной области тяжелой цепи и вариабельной области легкой цепи, представленные на фиг. 35, и где антитело обладает связывающей специфичностью антитела, включающего вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг. 35, и вариабельную область легкой цепи, содержащую последовательность, которая представлена на фиг. 35.
13. Клетка по п.12, где антитело является гуманизированным антителом.
14. Клетка по п.12, где антитело, экспрессируемое клеткой, включает вариабельную область тяжелой цепи и вариабельную область легкой цепи, представленные на фиг. 35.
15. Антитело по п.2, где антитело представляет собой одноцепочечное антитело.
16. Антитело по п.3, где антитело представляет собой одноцепочечное антитело.
17. Способ индукции апоптоза у раковых клеток, заключающийся в контактировании in vitro клеток с антителом по п.2 или 3.
18. Фармацевтическая композиция для индукции апоптоза у раковых клеток, включающая терапевтически эффективное количество антитела по п.2 или п.3.
19. Лекарственное средство для индукции апоптоза у раковых клеток, включающее фармацевтическую композицию по п.18.
| ODOUX С et al., TRAIL, FasL and blocking anti-DR5 antibody augment paclitaxel-induced apoptosis in human non-small-cell lung cancer | |||
| Int | |||
| J | |||
| Cancer, 2002, v.97, pp | |||
| Приспособление для отопления печей нефтью | 1922 |
|
SU458A1 |
| BEAUPARLANT P., SHORE G.C., Theurapeutic activation of caspases in cancer: a question of selectivity, Curr | |||
| Opin | |||
| Drug | |||
| Discov | |||
| Devel, 2003 Mar, v.6, (2), pp.179-187 | |||
| GIULIANO | |||
Авторы
Даты
2010-01-20—Публикация
2003-11-25—Подача