Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к пероральным композициям для введения фармакологических действующих веществ, способам повышения биологической доступности вводимых перорально фармакологических действующих веществ и к способам лечения и/или предупреждения болезни у млекопитающих, включая человека, путем перорального введения фармакологического действующего вещества по изобретению.
Описание известного уровня техники
Пероральный путь введения фармакологических действующих веществ представляет собой наиболее часто применяемый путь введения вследствие его удобства, относительной простоты и полной безболезненности, что облегчает соблюдение больным режима и схем лечения по сравнению с другими путями введения. Однако биологические, химические и физические барьеры, такие как различные значения рН в желудочно-кишечном тракте, действие пищеварительных ферментов и плохое проникновение действующего вещества через мембраны желудочно-кишечного тракта, делает проблематичным использование для млекопитающих перорального пути введения некоторых фармакологических действующих веществ, например, доказано, что пероральное введение кальцитонинов, которые представляют собой полипептидные гормоны с длинной цепью, секретируемые парафолликулярными клетками щитовидной железы млекопитающих и ультимобронхиальной железой птиц и рыб, затруднено, по меньшей мере частично, из-за недостаточной стабильности кальцитонина в желудочно-кишечном тракте, а также из-за отсутствия у кальцитонина способности легко транспортироваться через стенки кишечника в кровоток.
В патентах США №5773647 и 5866536 описаны композиции для перорального введения действующих веществ, таких как гепарин и кальцитонин, с помощью модифицированных аминокислот, таких как N(5-хлорсалицилоил)-8-аминокаприловая кислота (5-CNAC), N-(10-[2-гидроксибензоил]аминодекановая кислота (SNAD) и N-(8-[2-гидроксибензоил]амино)каприловая кислота (SNAC). Кроме того, в WO 00/059863 описаны двунатриевые соли формулы I
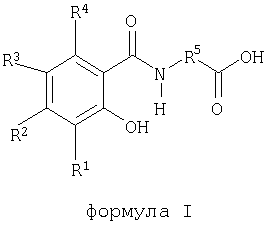
где R1, R2, R3 и R4 независимо друг от друга обозначают водород, -ОН, -NR6R7, галоген, С1-С4алкил или С1-С4алкокси;
R5 обозначает замещенный или незамещенный С2-С16алкилен, замещенный или незамещенный С1-С16алкенилен, замещенный или незамещенный C1-С12алкил(арилен) или замещенный или незамещенный арил(С1-С12алкилен);
R6 и R7 независимо друг от друга обозначают водород, кислород или С1-С4алкил;
и их гидраты и сольваты, в качестве соединений, которые обеспечивают эффективное пероральное введение действующих веществ, таких как кальцитонин, циклоспорин и гепарин.
В настоящем изобретении описаны фармацевтические композиции, которые обеспечивают еще более высокую биологическую доступность вводимых пероральным путем фармакологических действующих веществ, например пептидов, таких как кальцитонин.
Краткое изложение сущности изобретения
Таким образом, настоящее изобретение относится к фармацевтическим композициям, которые совершенно неожиданно в значительной степени повышают биологическую доступность вводимых пероральным путем действующих веществ, в частности пептидов. Более конкретно изобретение относится к твердым фармацевтическим композициям, пригодным для перорального введения фармакологических действующих веществ, которые содержат:
1) терапевтически эффективное количество фармакологического действующего вещества,
2) кросповидон или повидон,
3) агент, способствующий введению указанного фармакологического действующего вещества.
Следующим вариантом осуществления настоящего изобретения являются твердые фармацевтические композиции, пригодные для перорального введения кальцитонина, которые содержат:
1) терапевтически эффективное количество кальцитонина,
2) кросповидон или повидон.
Следующим вариантом осуществления изобретения является способ повышения биологической доступности при пероральном введении фармакологического действующего вещества, заключающийся в введении пациенту, который нуждается в введении указанного фармакологического действующего вещества, эффективного количества фармацевтической композиции по изобретению.
И еще одним вариантом осуществления изобретения является способ лечения костных заболеваний и связанных с кальцием нарушений, заключающийся в введении пациенту, который нуждается в таком лечении, терапевтически эффективного количества композиции по изобретению, где фармакологическое действующее вещество представляет собой кальцитонин.
Другие особенности и преимущества изобретения должны стать очевидными из приведенного ниже подробного описания изобретения.
Подробное описание изобретения
Фармакологические действующие вещества, которые можно применять согласно изобретению, включают как терапевтические, так и профилактические агенты, и прежде всего агенты, которые сами по себе не проникают или проникают лишь в незначительном количестве от вводимой дозы через слизистую оболочку желудочно-кишечного тракта и/или которые чувствительны к расщеплению кислотами и ферментами желудочно-кишечного тракта. Фармакологические действующие вещества включают (но не ограничиваются ими) протеины; полипептиды; гормоны; полисахариды, включая смеси мукополисахаридов; углеводы; липиды и их комбинации.
Конкретные примеры фармакологических действующих веществ включают (но не ограничиваются ими) следующие субстанции, в том числе полученные синтетическим путем, из природных или рекомбинантных источников: гормон роста, включая человеческие гормоны роста (человеческий соматотропный гормон, СТГ), рекомбинантные человеческие гормоны роста (рСТГ), бычьи гормоны роста и свиные гормоны роста; рилизинг-факторы ростовых гормонов; интерфероны, включая α-, β- и γ-интерферон; интерлейкин-1; интерлейкин-2; инсулин, включая свиной, бычий, человеческий и человеческий рекомбинантный инсулин, необязательно имеющий противоионы, такие как натрий, цинк, кальций и аммоний; инсулинподобный фактор роста, включая IGF-1; гепарин, включая нефракционированный гепарин, гепариноиды, дерматаны, хондроитины, гепарины с низкой, очень низкой и ультранизкой молекулярной массой; кальцитонин, включая кальцитонин лосося, свиньи, угря, цыпленка и человека; эритропоэтин; предсердный натриуретический фактор; антигены; моноклональные антитела; соматостатин; ингибиторы протеаз; адренокортикотропин, гонадотропин-рилизинг-гормон; окситоцин; лютеинизирующего гормона рилизинг-фактор; фолликулостимулирующий гормон; глюкоцереброзидазу; тромбопоэтин; филграстим; простагландины; циклоспорин; вазопрессин; натрийкромолин (натриевая или двунатриевая соль хромогликата); ванкомицин; десферриоксамин (ДФО); гормон околощитовидных желез (РТН), включая его фрагменты; антимикробные агенты, включая фунгициды; витамины; аналоги, фрагменты, миметики или модифицированные полиэтиленгликолем (ПЭГ) производные этих соединений, или любые их комбинации.
Предпочтительным фармакологическим действующим веществом является фармакологически активный пептид, в частности кальцитонин. Кальцитонины, представляющие собой известный класс фармакологических действующих веществ, находят различное применение в фармацевтике и обычно их применяют для лечения, например, болезни Педжета, гиперкальциемии и постменопаузального остеопороза. Различные кальцитонины, включая кальцитонин, полученный из лосося, свиньи и угря, поступают в продажу и их, как правило, применяют, например, для лечения болезни Педжета, злокачественной гиперкальциемии и остеопороза. Кальцитонин может представлять собой любой кальцитонин, в том числе природный, синтетический или полученный из рекомбинантных источников, а также производные кальцитонина, такие как 1,7-Asu-кальцитонин угря. Композиции могут содержать один вид кальцитонина или любое сочетание двух или нескольких кальцитонинов. Предпочтительным кальцитонином является синтетический кальцитонин лосося.
Кальцитонины имеются в продаже или их можно синтезировать известными методами.
Количество фармакологического действующего вещества, как правило, представляет собой количество, эффективное для решения поставленной задачи, например терапевтически эффективное количество. Однако это количество может быть меньше указанного количества, когда вводят несколько композиций, т.е. общее эффективное количество можно вводить в виде суммарных доз. Количество действующего вещества можно также превышать эффективное количество, когда композиция обеспечивает непрерывное высвобождение фармакологического действующего вещества. Общее количество действующего вещества, подлежащее введению, можно определять с помощью методов, известных специалистам в данной области. Однако в связи с тем, что с помощью композиций можно вводить действующее вещество более эффективно, чем при использовании известных из прототипов композиций, пациенту можно вводить меньшие количества действующего вещества, чем применяемые в известных из прототипов дозируемых формах или системах введения, достигая при этом аналогичных уровней в крови и/или терапевтических действий.
Когда фармакологическое действующее вещество представляет собой кальцитонин лосося, то соответствующая доза, естественно, должна зависеть, например, от хозяина и природы и серьезности состояния, подлежащего лечению. Однако, как правило, удовлетворительные результаты можно получать систематически при использовании суточных доз от примерно 0,5 до примерно 10 мкг/кг веса тела животного, предпочтительно от 1 до примерно 6 мкг/кг веса тела.
На долю фармакологического действующего вещества, как правило, приходится от 0,05 до 70 мас.% в пересчете на общую массу всей фармацевтической композиции, предпочтительно от 0,01 до 50 мас.%, более предпочтительно от 0,3 до 30 мас.% в пересчете на общую массу всей фармацевтической композиции.
Кросповидон может представлять собой любой кросповидон. Кросповидон представляет собой синтетический сшитый гомополимер N-винил-2-пирролидона, также называемый 1-этенил-2-пирролидиноном, с молекулярной массой 1000000 или более. Имеющиеся в продаже кросповидоны включают Polyplasdone XL, Polyplasdone XL-10, Polyplasdone INF-10 фирмы ISP, Kollidon CL фирмы BASF Corporation. Предпочтительным кросповидоном является Polyplasdone XL.
Повидон представляет собой синтетический полимер, состоящий из линейных групп 1-винил-2-пирролидинона с молекулярной массой от 2500 до 3000000. Поступающие в продажу повидоны включают Kollidon K-30, Kollidon K-90F фирмы BASF Corporation и Plasdone K-30 и Plasdone K-29/32 фирмы ISP.
Как указано выше, кросповидоны и повидоны имеются в продаже. В другом варианте их можно получать синтетическим путем с помощью известных процессов.
Кросповидон, повидон или их комбинация, как правило, присутствуют в композициях в количестве от 0,5 до 50 мас.% в пересчете на общую массу всей фармацевтической композиции, предпочтительно в количестве от 2 до 25%, более предпочтительно от 5 до 20 мас.% в пересчете на общую массу всей фармацевтической композиции.
Способствующие введению агенты по настоящему изобретению представляют собой любые агенты, которые способствуют введению конкретного фармакологического действующего вещества. Пригодные способствующие введению агенты представляют собой любые из 123 модифицированных аминокислот, описанных в вышеуказанном патенте US №5866536, или любые из 193 модифицированных аминокислот, описанных в вышеуказанном патенте US №5773647, или их комбинацию. Содержание вышеуказанных патентов US №№5773647 и 5866536 полностью включено в настоящее описание в качестве ссылки. Кроме того, способствующий введению агент может представлять собой двунатриевую соль любых перечисленных выше модифицированных аминокислот, а также их этанольные сольваты и гидраты. Пригодные соединения включают приведенные ниже соединения формулы I

где R1, R2, R3 и R4 независимо друг от друга обозначают водород, -ОН, NR6R7, галоген, С1-С4алкил или С1-С4алкокси;
R5 обозначает замещенный или незамещенный С1-С16алкилен, замещенный или незамещенный С2-С16алкенилен, замещенный или незамещенный C1-С12алкил(арилен) или замещенный или незамещенный арил(С1-С12алкилен);
R6 и R7 независимо друг от друга обозначают водород, кислород или С1-С4алкил;
и их гидраты и спиртовые сольваты. Соединения формулы I, а также их двунатриевые соли и спиртовые сольваты и гидраты описаны в WO 00/059863, где приведены также методы их получения.
Двунатриевую соль можно получать из этанольного сольвата путем упаривания или сушки этанольного сольвата в помощью методов, хорошо известных в данной области, с получением безводной двунатриевой соли. Сушку, как правило, осуществляют при температуре от примерно 80 до примерно 120°С, предпочтительно от примерно 85 до примерно 90°С и наиболее предпочтительно примерно при 85°С. Стадию сушки обычно осуществляют при давлении 26'' Hg или выше. Безводная двунатриевая соль, как правило, содержит менее примерно 5 мас.% этанола и предпочтительно менее примерно 2 мас.% этанола в пересчете на 100%-ную общую массу безводной двунатриевой соли.
Двунатриевую соль способствующего введению агента можно также получать путем приготовления суспензии способствующего введению агента в воде и добавления двух молярных эквивалентов водного гидроксида натрия, алкоксида натрия или т.п. Пригодные алкоксиды натрия включают (но не ограничиваются ими) метоксид натрия, этоксид натрия и их комбинации.
Еще один метод получения двунатриевой соли предусматривает взаимодействие способствующего введению агента с одним молярным эквивалентом гидроксида натрия с получением двунатриевой соли.
Двунатриевую соль можно выделять в виде твердого вещества путем концентрирования содержащего двунатриевую соль раствора до густой пасты с помощью вакуумной дистилляции. Эту пасту можно сушить в вакуумной печи с получением двунатриевой соли способствующего введению агента в виде твердого вещества. Твердое вещество можно выделять путем сушки распылением водного раствора двунатриевой соли.
Способствующие введению агенты можно получать с помощью методов, известных в данной области, например, с помощью указанных выше методов, в том числе методов, описанных в патентах US №№5773647 и 5866536.
Этанольные сольваты, описанные в вышеуказанной WO 00/059863, включают (но не ограничиваются ими) молекулярный или ионнный комплекс молекул или ионов растворителя этанола с молекулами или ионами двунатриевой соли способствующего введению агента. Как правило, этанольные сольваты включают примерно одну молекулу или ион этанола на каждую молекулу двунатриевой соли способствующего введению агента.
Этанольный сольват двунатриевой соли способствующего введению агента можно получать путем растворения способствующего введению агента в этаноле. Как правило, каждый грамм способствующего введению агента растворяют в от примерно 1 до примерно 50 мл этанола, обычно от примерно 2 до примерно 10 мл этанола. Затем раствор, содержащий способствующий введению агент/этанол, подвергают взаимодействию с молярным избытком относительно способствующего введению агента содержащей натрий соли, такой как однонатриевая соль, т.е. где на каждый моль способствующего введению агента приходится более одного моля катионов натрия, получая этанольный сольват. Пригодные однонатриевые соли включают (но не ограничиваются ими) гидроксид натрия; алкоксиды натрия, такие как метоксид натрия и этоксид натрия; и их любую комбинацию. Предпочтительно по меньшей мере примерно два молярных эквивалента однонатриевой соли добавляют к раствору этанола, т.е. на каждый моль способствующего введению агента приходится по меньшей мере примерно два моля катионов натрия. Как правило, реакцию осуществляют при температуре дефлегмации смеси или при более низкой температуре, например при температуре окружающей среды. Затем этанольный сольват восстанавливают с помощью методов, хорошо известных в данной области, таких как концентрирование образовавшейся суспензии путем дистилляции при атмосферном давлении, охлаждения концентрированной суспензии и фильтрации твердого вещества. После этого восстановленное твердое вещество подвергают вакуумной сушке, получая этанольный сольват.
Гидраты двунатриевых солей способствующих введению агентов можно получать путем сушки этанольного сольвата с получением безводной двунатриевой соли согласно описанным выше методам и гидратации безводной двунатриевой соли. Предпочтительно получают моногидрат двунатриевой соли. Поскольку безводная двунатриевая соль является очень гигроскопичной, гидраты получают путем выдерживания при атмосферой влажности. Как правило, стадию гидратации осуществляют при температуре от примерно соответствующей температуре окружающей среды до примерно 50°С, предпочтительно от температуры окружающей среды до примерно 30°С, и относительной влажности окружающей среды, составляющей по меньшей мере 50%. В другом варианте безводную двунатриевую соль можно гидратировать водным паром.
Предпочтительными способствующими введению агентами являются N-(5-хлорсалицилоил)-8-аминокаприловая кислота (5-CNAC), N-(10-[2-гидроксибензоил]аминодекановая кислота (SNAD) и N-(8-[2-гидроксибензоил]амино)каприловая кислота (SNAC) и их однонатриевые и двунатриевые соли, этанольные сольваты их натриевых солей и моногидраты их натриевых солей и их любые комбинации. Наиболее предпочтительным способствующим введению агентом является двунатриевая соль 5-CNAC и ее моногидрат.
Фармацевтические композиции по настоящему изобретению, как правило, содержат количество, эффективное для обеспечения введения одного или нескольких способствующих введению агентов, т.е. количество, достаточное для введения действующего вещества с целью достижения требуемого действия. Как правило, способствующий введению агент присутствует в количестве от 2,5 до 99,4 мас.%, более предпочтительно от 25 до 50 мас.%.
Фармацевтические композиции по настоящему изобретению могут представлять собой капсулу, в том числе мягкую желатиновую капсулу, таблетку, каплетку или другое твердое пероральное лекарственное средство, все эти формы получают с помощью хорошо известных в данной области методов.
Композиции могут дополнительно содержать добавки в обычно применяемых количествах, которые включают (но не ограничиваются ими) регулятор рН, консервант, корригент, маскирующий вкус агент, отдушку, увлажнитель, тонизирующее средство, краситель, поверхностно-активное вещество, пластификатор, замасливатель, такой как стеарат магния, способствующий скольжению агент, способствующее прессованию вещество, солюбилизатор, эксципиент, разбавитель, такой как микрокристаллическая целлюлоза, например Avicel PH 102, выпускаемая корпорацией FMC, и любую их комбинацию. Другие добавки могут включать фосфатные буферы, лимонную кислоту, гликоли и другие диспергирующие вещества.
Композиция может также включать один или несколько ингибиторов ферментов, таких как актинонин или эпиактинонин и их производные; апротинин, трасилол и ингибитор Боумана-Бирка (Bowman-Birk).
Кроме того, в композициях по настоящему изобретению могут присутствовать ингибитор транспорта, т.е. ρ-гликопротеин, такой как кетопрофин.
Предпочтительно твердые фармацевтические композиции по настоящему изобретению включают разбавитель, такой как Avicel, и замасливатель, такой как стеарат магния.
Твердые фармацевтические композиции по настоящему изобретению можно получать с помощью общепринятых методов, например путем перемешивания смеси действующего вещества или действующих веществ, способствующего введению агента, кросповидона или повидона и других ингредиентов, пластификации и заполнения капсул или, вместо заполнения капсул, формования и последующего таблетирования или прессования-формования с получением таблеток. Кроме того, твердую дисперсию можно получать известными методами с последующей обработкой с получением таблетки или капсулы.
Предпочтительно ингредиенты в фармацевтических композициях по настоящему изобретение смешивают до гомогенного или однородного состояния с получением твердого лекарственного средства.
Композиции по настоящему изобретению можно применять для введения действующего вещества любому нуждающемуся в этом животному, включая (но не ограничиваются ими) млекопитающих, таких как грызуны, коровы, свиньи, собаки, кошки и приматы, в том числе человек.
Ниже изобретение проиллюстрировано на примерах.
Пример 1
Изготавливают таблетки по настоящему изобретению (пример А), а также таблетки, метод изготовления которых описан в сравнительных примерах Б и В, в которых вместо кросповидона применяли Ac-Di-Sol (Ac-Di-Sol представляет собой сшитую натрийкарбоксиметилцеллюлозу), и в сравнительном примере Г, где описано приготовление совместно лиофилизированной капсулы, все эти формы содержат 5-CNAC и кальцитонин лосося.
В частности, таблетки получают следующим методом.
Пример получения А
0,502 г кальцитонина лосося, предварительно просеянного через сито с размером отверстий 40 меш, 120 г двунатриевой соли 5-CNAC, предварительно просеянной через сито с размером отверстий 35 меш, и 20 г Polyplasdone XL (кросповидон, NF (Национальный фармацевтический формуляр)) объединяют в сосуде объемом 500 мл и перемешивают с помощью смесителя типа Turbula в течение 2 мин при скорости вращения 46 об/мин. Дополнительно в сосуд добавляют еще 125,4 г двунатриевой соли 5-CNAC, предварительно просеянной через сито с размером отверстий 35 меш, и 32,5 г Avicel PH 102 и перемешивают в течение 8 мин при скорости вращения 46 об/мин. В сосуд добавляют еще 32,5 г Avicel и перемешивают в течение 5 мин при скорости вращения 46 об/мин. 4,0 г стеарата магния просеивают в сосуд с помощью сита с размером отверстий 35 меш и перемешивают в течение 1 мин при скорости вращения 46 об/мин. Конечную смесь прессуют с получением таблеток с помощью таблетирующего пресса типа Manesty B3B. Масса таблетки составляет примерно 400 мг.
Сравнительный пример Б
Объединяют 14 г двунатриевой соли 5-CNAC и 0,56 г CabOSil и просеивают через сито с размером отверстий 40 меш. 0,3 г смеси двунатриевая соль 5-CNAC/CabOSil, 0,028 г кальцитонина лосося, предварительно просеянного через сито с размером отверстий 40 меш, и 0,56 г Ac-Di-Sol, предварительно просеянного через сито с размером отверстий 30 меш, объединяют в V-образном смесителе с кожухом. Смесь перемешивают в течение 2 мин. Примерно 14,3 г смеси двунатриевая соль 5-CNAC/Cab-O-Sil добавляют в геометрической прогрессии в V-образный смеситель с кожухом и перемешивают в течение 2 мин после каждого добавления (добавляют последовательно примерно 0,8, 1,7, 3,2 и 8,6 г). 12,43 г Avicel PH 102 и 0,42 г стеарата магния, предварительно просеянного через сито с размером отверстий 45 меш, вносят в V-образный смеситель с кожухом и перемешивают в течение 5 мин. Конечную смесь затем просеивают через сито с размером отверстий 40 меш и прессуют с получением таблеток с помощью таблетирующего пресса, например, типа Manesty F3. Масса таблетки составляет примерно 400 мг.
Сравнительный пример В
0,1224 г кальцитонина лосося, предварительно просеянного через сито с размером отверстий 40 меш, 30 г двунатриевой соли 5-CNAC, предварительно просеянной через сито с размером отверстий 35 меш, и 4 г Ac-Di-Sol помещают в сосуд объемом 500 мл из стекла типа Ругех® и перемешивают с использованием смесителя типа Turbula в течение 2 мин при скорости вращения 46 об/мин. Дополнительно в сосуд добавляют еще 31,35 г двунатриевой соли 5-CNAC, предварительно просеянной через сито с размером отверстий 35 меш, и 15 г Avicel PH 102 и перемешивают в течение 8 мин при скорости вращения 46 об/мин. Объединяют 2 г CabOSil и 16,15 г Avicel и просеивают через сито с размером отверстий 18 меш. В сосуд добавляют смесь CabOSil/Avicel и перемешивают в течение 5 мин при скорости вращения 46 об/мин. 1,5 г стеарата магния просеивают в сосуд через сито с размером отверстий 35 меш и перемешивают в течение 2 мин при скорости вращения 46 об/мин. Конечную смесь прессуют с получением таблеток с помощью таблетирующего пресса типа Manesty B3B. Масса таблетки составляет примерно 400 мг.
Сравнительный пример Г
18 кг воды для инъекций и 0,16 кг гидроксида натрия, NF, вносят в сосуд и перемешивают до растворения. В сосуд добавляют 0,800 кг свободной кислоты 5-CNAC и перемешивают при 400-600 об/мин в течение минимум 10 мин. Значение рН смеси в сосуде доводят примерно до 8,5 с помощью 10н. гидроксида натрия. Содержимое сосуда перемешивают минимум в течение 10 мин после каждого добавления 10н. гидроксида натрия. 10н. раствор гидроксида натрия получают, добавляя 40 г гидроксида натрия, NF, к 100 мл воды для инъекций. Конечную массу многокомпонентного раствора доводят до 20,320 кг, добавляя воду для инъекций (плотность 1,016). Содержимое сосуда перемешивают при 400-600 об/мин в течение минимум 30 мин. Многокомпонентный раствор фильтруют в другой сосуд с помощью перистальтического насоса, силиконовой трубки и мембранного капсульного фильтра DuraPore MPHL с размером пор 0,45 мкм. Приготавливают раствор фосфатного буфера, добавляя 13,8 г моногидрата однонатриевой соли фосфорной кислоты, USP (фармакопея США), к 900 г воды для инъекций и доводя значение рН до 4,0 с помощью 1,0н. раствора фосфорной кислоты. Раствор фосфорной кислоты готовят, добавляя 0,96 г фосфорной кислоты, NF, к 25 мл воды для инъекций. Конечную массу раствора фосфатного буфера доводят до 1007 г (плотность 1,007) с помощью воды для инъекций и перемешивают в течение 5 мин.
Забуференный раствор кальцитонина лосося готовят, добавляя 1,6 г кальцитонина лосося к 660 г раствора фосфатного буфера. Конечную массу раствора доводят до 806,4 г (плотность 1,008) с помощью раствора фосфатного буфера и перемешивают в течение минимум 5 мин при скорости вращения 250 об/мин или менее.
0,800 кг забуференного раствора кальцитонина лосося добавляют по каплям в 20 кг раствора 5-CNAC при постоянном перемешивании при скорости вращения 250 об/мин или менее в течение минимум 5 мин.
Примерно 0,75 л раствора кальцитонин лосося/5-CNAC фильтруют в поддон для лиофилизации из нержавеющей стали (размером 30,5×30,5 см) до получения слоя конечного раствора глубиной 0,8-0,9 см. Для фильтрации 21,75 л раствора кальцитонин лосося/5-CNAC используют примерно 29 поддонов. Поддоны помещают в сублимационную сушилку Эдвардса и лиофилизируют с использованием следующего процесса:
1. После загрузки поддонов и запечатывания сублимационной сушилки полки охлаждают со скоростью 1°С/мин.
2. После достижения температуры на полке -45°С поддерживают температуру на полке на уровне -45°С в течение минимум 120 мин.
3. Охлаждают конденсатор до температуры -50°С или ниже.
4. Откачивают воздух из камеры и затем, поддерживая вакуум на уровне 300 мкм, повышают температуру на полке до -30°С со скоростью 1°С/мин.
5. Поддерживают температуру на полке на уровне -30°С в течение 180 мин.
6. Снижают давление в камере до 200 мкм и затем, поддерживая вакуум на уровне 200 мкм, повышают температуру на полке до -20°С со скоростью 1°С/мин.
7. Поддерживают температуру на полке на уровне -20°С в течение 200 мин.
8. Повышают температуру на полке до -10°С со скоростью 1°С/мин.
9. Поддерживают температуру на полке на уровне -10°С в течение 360 мин.
10. Повышают температуру на полке до 0°С со скоростью 1°С/мин.
11. Поддерживают температуру на полке на уровне 0°С в течение 720 мин.
12. Снижают давление в камере до 100 мкм и затем, поддерживая вакуум на уровне 100 мкм, повышают температуру на полке до +10°С со скоростью 1°С/мин.
13. Поддерживают температуру на полке на уровне +10°С в течение 540 мин.
14. Повышают температуру на полке до +25°С со скоростью 1°С/мин.
15. Поддерживают температуру на полке на уровне +25°С в течение 440 мин.
16. Сбрасывают вакуум и выгружают поддоны.
Подвергнутый совместной лиофилизации раствор кальцитонин лосося/5-CNAC удаляют из поддонов и хранят в холодильнике в полиэтиленовых и закрытых фольгой коробках. Для применения каждую капсулу (размером АА) заполняют примерно 400 мг подвергнутого совместной лиофилизации продукта.
Пример 2
Введение приматам
Таблетки или капсулы, приготовленные согласно примеру 1, вводят макакам резус следующим образом: для каждого варианта обработки используют группу, состоящую из 4-6 обезьян, которым вводят либо по 1 капсуле, либо по 2 таблетки, полученные согласно примеру 1, используя следующий метод:
Макак резус закрепляют на стульях за ночь до обработки, и они находятся полностью в сознании на протяжении всего эксперимента. Капсулы или таблетки вводят через желудочный зонд, после чего водят 10 мл воды.
Образцы крови собирают через 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 5 и 6 ч после обработки. Уровень в плазме кальцитонина лосося оценивают с помощью радиоиммуноанализа. Уровни кальцитонина лосося (лКТ) в плазме приматов, полученные для каждой группы обезьян, усредняют и рассчитывают максимальную среднюю концентрацию кальцитонина в плазме и площадь под кривой (AUC), результаты приведены в таблице 1.
Как видно из таблицы 1, для кальцитонина лосося значения Смак и AUC значительно выше для композиции по настоящему изобретению, которая содержит кросповидон (пример А), чем для композиций из сравнительных примеров без кросповидона, что приводит к существенному повышению биологической доступности композиций по изобретению при пероральном введении.
Пример 3
Ускоренная оценка стабильности
Таблетки, содержащие 0,065, 0,400 и 2,500 мг лКТ получают согласно сравнительному примеру В и примеру А соответственно, при этом содержание лКТ и Avicel регулируют таким образом, чтобы получить требуемые концентрации. Таблетки помещают в сосуд из ПЭВП (полиэтилен высокой плотности) с осушителем, после чего запечатывают и закрывают крышкой. Опыты по ускоренной оценке стабильности осуществляют, помещая образцы, стабильность которых изучают, в камеры с условиями, соответствующими условиям окружающей среды, т.е. 25°С и 60%-ная относительная влажность (ОВ). Образцы вынимают из камер в определенные моменты времени, т.е. через 3, 4 и 6 недель и анализируют содержание лКТ с помощью ЖХВР. Результаты представлены в таблице 2.
Сравнение стабильности композиции, полученной согласно сравнительному примеру В, через 4 недели (снижение концентрации лКТ примерно на 10%) и композиции по настоящему изобретению, полученной согласно примеру А, через 6 недель (снижение концентрации лКТ примерно на 5%) при хранении обеих композиций при комнатной температуре свидетельствует о том, что композиция по настоящему изобретению обладает улучшенной стабильностью таблеток, приготовленных согласно способу по изобретению.
Пример 4
Распад таблеток, полученных из твердых композиций, оценивают, изготавливая таблетки согласно методу, описанному в примере 1, которые содержат 60% двунатриевой соли 5-CNAC, 29% Avicel, 1% стеарата магния, но без лКТ. Распад таблеток оценивают согласно тесту USP Disintegration Test <701>, а твердость таблеток определяют с помощью калиброванного прибора для определения твердости таблеток типа Vector/Schleuniger 6D. Результаты представлены в таблице 3.
Результаты, представленные в таблице 3, свидетельствуют о том, что применение Polyplasdone XL (кросповидон) в сочетании с 5-CNAC приводит к более быстрому распаду таблеток по сравнению с таблетками, полученными с использованием 5-CNAC в сочетании с другими эксципиентами, что демонстрирует улучшенный профиль высвобождения фармакологического действующего вещества из твердых композиций по настоящему изобретению.
Пример 5
Химическая стабильность
Образцы для опытов по оценке стабильности в условиях экстремального стресса подготавливают, помещая таблетки (полученные аналогично примеру 1, выше, используя соотношение ингредиентов, указанное в таблице 4) в закрытый сосуд янтарного цвета. Опыты по ускоренной оценке стабильности осуществляют, помещая образцы в калиброванную печь с температурой 60°С. Содержание лКТ в образцах оценивают с помощью ЖХВР в начальный момент времени и через 3 или 4 дня. Результаты представлены в таблице 4.
Как видно из таблицы 4, химическая стабильность лКТ при выдерживании в условиях экстремального стресса была более высокой при использовании композиции по настоящему изобретению (пример Е), содержащей кросповидон (Polyplasdone XL-10), по сравнению с несодержащими кросповидон композициями, полученными согласно сравнительным примерам.
Из приведенного выше описания очевидно, что композиции по настоящему изобретению обладают в значительной степени улучшенной биологической доступностью при пероральном введении действующего вещества, в частности кальцитонина, по сравнению с другими композициями для перорального введения, более высокой скоростью распада и очень хорошей стабильностью.
Приведенные выше варианты осуществления изобретения даны только с целью иллюстрации изобретения и не направлены на ограничение его объема. Специалистам в данной области должны быть очевидны многочисленные другие варианты осуществления и вариации, которые подпадают под объем изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2006 |
|
RU2469709C2 |
| ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ КАЛЬЦИТОНИНА | 2003 |
|
RU2355417C2 |
| ПРИМЕНЕНИЕ КАЛЬЦИТОНИНА ДЛЯ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА | 2006 |
|
RU2453330C2 |
| ПРИМЕНЕНИЕ КАЛЬЦИТОНИНА ПРИ ОСТЕОАРТРИТЕ | 2004 |
|
RU2368390C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ чГР, ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2007 |
|
RU2493868C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ДИНАТРИЕВОЙ СОЛИ N-(5-ХЛОРСАЛИЦИЛОИЛ)-8-АМИНОКАПРИЛОВОЙ КИСЛОТЫ | 2006 |
|
RU2507196C2 |
| ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ ПАРАТИРЕОИДНОГО ГОРМОНА И КАЛЬЦИТОНИНА | 2002 |
|
RU2300392C2 |
| 5-CNAC В КАЧЕСТВЕ АГЕНТА ДЛЯ ПЕРОРАЛЬНОЙ ДОСТАВКИ ФРАГМЕНТОВ ПАРАТИРОИДНОГО ГОРМОНА | 2002 |
|
RU2322256C2 |
| ЛЕЧЕНИЕ ДИАБЕТА И МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2010 |
|
RU2537181C2 |
| МИМЕТИК КАЛЬЦИТОНИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ И НАРУШЕНИЙ | 2014 |
|
RU2689551C1 |
Твердая фармацевтическая композиция содержит терапевтически эффективное количество пептида в качестве фармакологического действующего вещества, кросповидон или повидон и агент, способствующий введению пептида. Пептид представляет собой кальцитонин, предпочтительно, кальцитонин лосося. Способствующий введению агент представляет собой 5-CNAC (N-(5-хлорсалицилоил)-8-аминокаприловую кислоту), предпочтительно двунатриевую соль 5-CNAC. Композиции обеспечивают высокую биологическую доступность пептидов, например, таких как кальцитонин. 9 з.п. ф-лы, 4 табл.
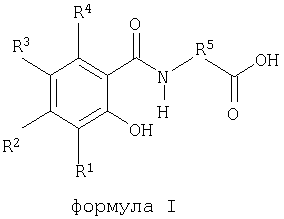
где R1, R2, R3 и R4 независимо друг от друга обозначают водород, -ОН, -NR6R7, галоген, С1-С4алкил или С1-С4алкокси;
R5 обозначает замещенный или незамещенный С2-С16алкилен, замещенный или незамещенный С2-С16алкенилен, замещенный или незамещенный С1-С12алкил(арилен) или замещенный или незамещенный арил(С1-С12алкилен);
R6 и R7 независимо друг от друга обозначают водород, кислород или С1-С4алкил;
их гидраты и спиртовые сольваты и динатриевые соли.
| US 5773647 А, 30.06.1998 | |||
| US 5866536 A, 02.02.1999 | |||
| US 5002771 А, 26.03.1991 | |||
| US 5972381 А, 26.10.1999 | |||
| Способ изготовления зеркальных лимбов, шкал и сеток | 1938 |
|
SU57857A1 |
| ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЭНДОМЕТРИТОВ У КОРОВ | 2005 |
|
RU2295966C1 |
| RU 98118692 А, 20.08.2000. | |||
Авторы
Даты
2006-11-27—Публикация
2001-12-05—Подача