Область изобретения
Настоящее изобретение относится к новым аналогам жирных кислот. Кроме того, данное изобретение относится к применению новых аналогов жирных кислот для лечения и/или предупреждения синдрома X, ожирения, гипертензии, жировой дистрофии печени, диабета, гипергликемии, гиперинсулинемии и стеноза. Изобретение также относится к способам получения новых аналогов жирных кислот.
Предшествующий уровень техники
В европейском патенте ЕР 345.038 описано применение аналогов не подвергающихся β-окислению жирных кислот формулы:
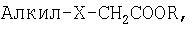
где алкил представляет собой насыщенную или ненасыщенную углеводородную цепь из атомов углерода в количестве от 8 до 22, Х представляет собой О, S, SO или SO2, a R представляет собой водород или C1-C4алкильную группу, для лечения гипергликемических состояний и для снижения концентрации холестерина и триглицеридов в крови млекопитающих.
В PCT/NO95/00195 описаны алкил-S-CH2COOR и алкил-Se-CH2COOR для подавления окислительной модификации ЛПНП (липопротеина низкой плотности). Кроме того, в этой заявке описано применение соединения селена для лечения гиперлипемического состояния и для снижения концентрации холестерина и триглицеридов.
В заявках PCT/NO99/00135, PCT/NO99/00136 и PCT/NO99/00149 описаны аналоги жирных кислот формулы (I)
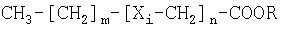
- где n представляет собой целое число от 1 до 12, и
- где m представляет собой целое число от 0 до 23, и
- где i представляет собой нечетное число, которое показывает положение относительно COOR, и
- где Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и CH2, и
- где R представляет собой водород или С1-C4алкил,
- с условием, что по меньшей мере один из Хi не является СН2, или их соли, пролекарства или комплексы.
Эта формула включает в себя одну или несколько Х групп (предпочтительно селен или серу) в положениях 3, 5, 7, 9 и так далее.
Кроме того, в этих заявках РСТ описывают несколько медицинских и пищевых применений.
В PCT/NO99/00135 описано применение аналогов жирных кислот для лечения и/или предупреждения ожирения, гипертензии, жировой дистрофии печени и мультиметаболического синдрома, называемого "метаболическим синдромом" или синдромом X. Кроме того, в этой заявке описан способ лечения или предупреждения состояния ожирения или избыточной массы и способ достижения потери массы или снижения жировой массы у человека или животного, не являющегося человеком. В данной заявке также описаны пищевая композиция, эффективная для снижения или предупреждения увеличения общей массы тела или общей жировой массы тела у человека или животного, не являющегося человеком, а также способ модификации распределения и содержания жира у животных для улучшения качества мяса или таких продуктов, как молоко и яйца.
В PCT/NO99/00136 описано применение аналогов жирных кислот для лечения и/или предупреждения диабета (как типа I, так и II) и способ лечения или предупреждения гипергликемии, гиперинсулинемии и пониженной чувствительности к инсулину. Также описаны пищевая композиция, эффективная для снижения или предупреждения увеличения концентрации глюкозы в крови человека или животного, не являющегося человеком, а также способ снижения концентрации глюкозы в крови человека или животного, не являющегося человеком.
В PCT/NO99/00149 описано применение аналогов жирных кислот для лечения и/или предупреждения первичного и/или вторичного стеноза, и/или заболевания, вызванного процедурной травмой сосудов и/или патологической пролиферацией клеток гладких мышц, и/или повышенного уровня гомоцистеина в плазме.
Благодаря Х-атому (наиболее предпочтительны сера или селен), который замещен в углеродной цепи вышеуказанных аналогов жирных кислот, эти соединения не будут подвергаться β-окислению в митохондриях дальше этого положения. Таким образом, расщепление этих молекул должно начинаться с метилового конца жирной кислоты, а это довольно медленный метаболический процесс. Катаболизм этих аналогов жирных кислот включает ω-окисление и укорачивание цепи дикарбоновой кислоты при помощи пероксисом. Ферменты в эндоплазматическом ретикулуме будут ω-гидроксилировать, а затем окислять гидроксилированную жирную кислоту до дикарбоновой кислоты. У этой кислоты затем может быть укорочена цепь посредством β-окисления в пероксисомах. Изучение на крысах показало, что 50% аналога ТТА (tetradecylthioacetic acid = тетрадецилтиоуксусная кислота) выделялось с мочой в виде коротких сульфоксидикарбоновых кислот в течение 24 часов после введения. В сходных экспериментах было обнаружено, что десатурированный продукт ТТА образуется in vivo. Это обусловлено микросомальным ферментом Δ9-десатуразой, которая вводит двойную связь в положение 9 насыщенных жирных кислот.
Ожидается, что этот десатурированный продукт имеет сходные эффекты и/или опосредует биологические эффекты аналогов насыщенных жирных кислот. Также вероятно, что биологические эффекты аналогов жирных кислот можно усилить посредством замедления их катаболизма. Это можно осуществить посредством введения двойных и/или тройных связей вблизи метилового конца жирных кислот и/или посредством включения алкильных групп или галогенов в эту часть молекулы. Такие молекулы, то есть соединения в соответствии с настоящим изобретением, не будут являться субстратом для подходящих микросомальных ферментов.
ОЖИРЕНИЕ И СВЯЗАННЫЕ С НИМ ЗАБОЛЕВАНИЯ
Ожирение является хроническим заболеванием, которое широко распространено в современном обществе и связано не только с социальным статусом, но также с уменьшением продолжительности жизни и многочисленными медицинскими проблемами, включая неблагоприятное психологическое развитие, заболевания репродуктивных органов, такие как поликистозная болезнь яичников, дерматологические расстройства, такие как инфекции, варикозное расширение вен, акантоз (Acanthosis nigricans) и экзема, непереносимость физических упражнений, сахарный диабет, инсулинорезистентность, гипертензия, гиперхолестеринемия, холелитиаз, остеоартрит, повреждение опорно-двигательного аппарата, тромбоэмболия, рак и коронарная (ишемическая) болезнь сердца.
Поэтому задачей настоящего изобретения является обеспечение режима лечения, который полезен при приведении массы тела лиц, страдающих ожирением, обратно к нормальной, идеальной массе тела.
Другой задачей является обеспечение лечения ожирения, которое приводит к поддержанию пониженной массы тела в течение продолжительного периода времени. Кроме того, задачей является снижение или подавление увеличения массы, как правило, вызываемого богатой жиром пищей.
Еще одной задачей является предупреждение ожирения и, как только лечение начато, задержка развития или предупреждение начала заболеваний, которые являются следствием ожирения или вторичны по отношению к нему, таких как гипертензия и жировая дистрофия печени. Эти и другие задачи будут понятны специалистам в данной области техники.
Ожирение здесь может быть обусловлено любой причиной, либо генетической, либо связанной с внешними условиями. Примеры заболеваний, которые могут приводить к ожирению или быть причиной ожирения, включают в себя переедание и булимию, поликистоз яичников, краниофарингиому, синдром Прадера-Вилли, синдром Фрохлича (Frohlich), диабет II типа, лиц с дефицитом гормона роста, нормальный вариант низкого роста, синдром Тернера и другие патологические состояния, показывающие снижение метаболической активности.
Также задачей настоящего изобретения является обеспечение режима лечения, который полезен при снижении кровяного давления.
Кроме того, задачей настоящего изобретения является обеспечение режима лечения, который полезен при снижении концентрации триацилглицеринов в печени. Ожидается, что такой режим обеспечит сдерживающий эффект на развитие состояния жировой дистрофии печени, а также подойдет в качестве способа лечения уже обнаруженного заболевания.
Соединения по настоящему изобретению активизируют β-окисление, а также снижают концентрацию триглицеридов в печени.
Термин "метаболический синдром" используют для описания мультиметаболического синдрома, который, среди прочего, характеризуется гиперинсулинемией, инсулинорезистентностью, ожирением, непереносимостью глюкозы, сахарным диабетом 2 типа, дислипидемией или гипертензией.
Как указано выше, ожидается, что соединения по настоящему изобретению будут обеспечивать положительный эффект на все состояния, упомянутые выше, то есть посредством регулирования гомеостаза как глюкозы, так и липидов, и, таким образом, ожидается, что соединения по настоящему изобретению будут подходящими агентами для регуляции определенного выше метаболического заболевания (иногда называемого синдромом X).
ДИАБЕТ
Существуют две основные формы сахарного диабета. Одна представляет собой диабет I типа, который также известен как инсулинзависимый сахарный диабет (ИЗСД), а другая представляет собой диабет II типа, который также известен как инсулиннезависимый сахарный диабет (ИНСД). Большинство пациентов с ИЗСД имеют общую патологическую картину; почти полное исчезновение инсулинобразующих бета-клеток поджелудочной железы, которое приводит к гипергликемии.
Накоплены важные доказательства, показывающие, что большая часть ИЗСД является последствием прогрессирующего разрушения бета-клеток в течение бессимптомного периода, часто длящегося многие годы. Период, предшествующий диабету, можно распознать при помощи обнаружения циркулирующих аутоантител к островковым клеткам и аутоантител к инсулину.
Существует необходимость в соединении, которое было бы нетоксичным и не имело бы побочных эффектов, но которое предотвращало бы клинический ИЗСД и ИНСД.
Диабет I типа: тяжелый сахарный диабет, обычно с внезапным началом до достижения зрелости, характеризующийся низкими уровнями инсулина в плазме, полидипсией, полиурией, повышенным аппетитом, потерей массы и эпизодическим кетоацидозом; также называемый ИЗСД.
Диабет II типа: часто мягкая форма сахарного диабета, часто с постепенным началом, обычно у взрослых, характеризующийся абсолютными уровнями инсулина в плазме от нормального до высокого, которые являются сравнительно низкими по отношению к уровням глюкозы в плазме; также называемый ИНСД.
Диабеты I и II типов согласно этиологической классификации считаются "первичными" диабетами соответственно.
Вторичный диабет включает в себя панкреатический, экстрапанкреатический/эндокринный или вызванный лекарствами диабет. Кроме того, некоторые типы диабета классифицируют как исключительные формы. Они включают в себя липоатрофический, миатонический диабет и тип диабета, вызванный нарушением инсулиновых рецепторов.
Принимая во внимание большое распространение диабета в нашем обществе и серьезные последствия, связанные с этим, которые обсуждались выше, любое терапевтическое лекарство, потенциально полезное для лечения и предупреждения этого заболевания, может иметь чрезвычайно полезный эффект на здоровье. В данной области техники существует необходимость в лекарстве, которое будет снижать концентрацию глюкозы в крови у лиц, страдающих диабетом, без значительных вредных побочных эффектов.
Поэтому задачей настоящего изобретения является обеспечение режима лечения, который полезен при снижении уровня глюкозы в крови, и лечение диабетического состояния.
Еще одной задачей изобретения является обеспечение режима лечения, который полезен при снижении концентрации инсулина в крови, и повышение эффекта остающегося инсулина.
СТЕНОЗ
Было обнаружено, что многие патологические состояния связаны с пролиферацией клеток гладких мышц. Такие состояния включают в себя рестеноз, артериосклероз, коронарную (ишемическую) болезнь сердца, тромбоз, инфаркт миокарда, удар, неоплазмы гладких мышц, такие как лейомиома и лейомиосаркома кишечника и матки, и фиброид или фиброма матки.
Каждый год проводят свыше полумиллиона внутрисосудистых оперативных вмешательств. Хотя подобные инвазивные процедуры продолжают совершенствоваться год от года, целых 30-50% процедур, проводимых каждый год, заканчиваются неудачно в результате рестеноза, то есть формирования вторичного стеноза. Уменьшение случаев рестеноза поэтому часто упоминается как наиболее важный фактор при возрастании случаев благоприятного исхода, которые достигаются при лечении сердечно-сосудистого заболевания благодаря применению внутрисосудистых оперативных вмешательств, таких как ангиопластика, атерэктомия, и процедур, в которых используются стенты и лазерная технология.
При баллонной ангиопластике, например чрезкожной внутрипросветной коронарной ангиопластике (ЧВКА), на артерии ноги или руки пациента делают небольшой надрез и в артерию вводят длинную полую трубку, называемую направляющим катетером. Затем в направляющий катетер вставляют толстую направляющую проволоку и ненадутый баллонный катетер и осторожно продвигают по кровеносным сосудам пациента, используя х-лучевую визуализацию. Ненадутый баллон продвигают до тех пор, пока он не достигнет места сужения просвета (сосуда), точки, в которой врач надувает баллон один или более чем один раз до давления приблизительно 4-6 атм в течение приблизительно 60 секунд. При надувании баллон расщепляет и разрушает бляшки и удлиняет мышечное волокно в артериальной стенке сверх его возможности полностью сократиться обратно. Хотя бляшки не удаляются при этой процедуре, разрушение бляшек и удлинение артериальной стенки увеличивает просвет сосуда, таким образом позволяя увеличить кровоток.
Рестеноз, который сопровождает такие процедуры, характеризуется агрегацией и адгезией тромбоцитов, пролиферацией клеток гладких мышц, сужением просвета сосуда, ограниченной вазодилатацией и повышением кровяного давления. Сообщают, что клетки гладких мышц во внутреннем слое артерии начинают цикл развития в пределах приблизительно 2-3 дней после этой процедуры и пролиферируют в течение нескольких дней после этого (внутренняя гиперплазия).
Соединения, которые, как сообщают, подавляют пролиферацию гладких мышц in vitro, могут иметь нежелательные фармакологические побочные эффекты при использовании in vivo. Гепарин представляет собой пример такого соединения, которое, как сообщают, подавляет пролиферацию клеток гладких мышц in vitro, но при использовании in vivo обладает потенциальным вредным побочным эффектом подавления коагуляции.
Как видно из вышеизложенного, много проблем остаются нерешенными при применении ингибиторных лекарств для эффективного лечения мобилизации и пролиферации клеток гладких мышц. Было бы чрезвычайно полезно разработать новые композиции или способы подавления стеноза, рестеноза или связанных с ними расстройств из-за пролиферации и мобилизации клеток гладких мышц сосудов, после, например, травматического повреждения сосудов, нанесенного во время операции на сосудах.
Ожидается, что соединения согласно настоящему изобретению будут эффективны при лечении этих заболеваний.
Детальное описание изобретения
Настоящее изобретение относится к новым аналогам жирных кислот общей формулы (I):
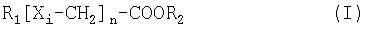
- где R1 представляет собой:
- С6-C24алкен с одной или более чем одной двойной связью, и/или
- С6-C24алкин, и
- где R2 представляет собой водород или С1-C4алкил, и
- где n представляет собой целое число от 1 до 12, и
- где i представляет собой нечетное число и показывает положение относительно COOR2, и
- где X независимо друг от друга выбраны из группы, включающей в себя О, S, Se и СН2, и
- с условием, что по меньшей мере один из Хi не является СН2, и
- с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
- с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или их солям или комплексам.
Другой аспект настоящего изобретения относится к новым аналогам жирных кислот, где R-группировка содержит одну углерод-углеродную тройную связь.
Еще один аспект настоящего изобретения относится к новым аналогам жирных кислот, где R-группировка содержит одну углерод-углеродную двойную связь. Предпочтительно указанная углерод-углеродная двойная связь находится в положении 9 и в цис-конфигурации.
Наиболее предпочтительные воплощения настоящего изобретения относятся к соединениям формулы (I), где сера или селен расположены в положении 3.
Кроме того, изобретение относится к способу получения соединения формулы (I), при котором осуществляют:
- защиту бромалканола путем введения защитной группы для гидроксила;
- введение в полученный защищенный бромалканол ацетиленовой группы с последующим, когда это необходимо, алкилированием и/или восстановлением ацетиленовой группы;
- последовательное или одновременное удаление защитной группы и бромирование;
- взаимодействие полученного соединения с соединением формулы H[Xi-CH2]n-COOR2, где Xi, n и R2 такие, как определено выше, с последующей, когда это необходимо, гидрогенизацией полученного продукта.
Специалисту в данной области техники очевидно, что бромалканол может быть получен путем взаимодействия соответствующего алкандиола с бромистым водородом, при этом предпочтительным является алкандиол с 5-9 атомами углерода. Из уровня техники также известно, что галогенирование (бромирование) алкандиолов осуществляется преимущественно по одной из групп ОН, при этом вторую группу ОН затем защищают, используя хорошо известные защитные группы, такие как 3,4-дигидро-2Н-пиран, триметилсилан, трет-бутилдиметилсилан, бензил или трифенилметил (тритил), предпочтительно 3,4-дигидро-2Н-пиран, в подходящем полярном растворителе, таком как дихлорметан. Методологию защиты см. в Green, Protective Groups in Organic Synthesis, Wiley, 2nd ed., 1991. Введение ацетиленовой группы в полученный защищенный бромалканол осуществляют известными способами, например, с помощью алкилацетиленида, в частности ЕДА-комплекса ацетиленида Li или метилацетиленида Li, в подходящем растворителе, например диметилсульфоксиде или диэтиловом эфире. При необходимости соединение, полученное на этой стадии, может быть подвергнуто алкилированию в присутствии алкилгалогенида, такого как алкилбромид, с последующим восстановлением ацетиленовой группы в присутствии подходящего катализатора, такого как палладиевый катализатор Линдлара. Эта реакция также хорошо известна из уровня техники и используется в тех случаях, когда необходимо остановить восстановление на стадии получения алкена. Защищенный продукт далее подвергают последовательному или одновременному удалению защиты и бромированию. Способы удаления защиты также хорошо известны специалистам в данной области техники (Green, Protective Groups in Organic Synthesis, Wiley, 2nd ed., 1991). Соединение, полученное после удаления защиты и бромирования, подвергают взаимодействию с соединением формулы H[Xi-CH2]n-COOR2, где Xi, n и R2 такие, как определено в настоящем описании выше, с последующей, когда это необходимо, гидрогенизацией полученного продукта. При этом группа R1, которая на этой стадии является полностью насыщенной (алкил), может содержать заместители фторид, хлорид, гидрокси, С1-С4алкокси, С1-C4алкилтио, С2-C5ацилокси или С1-C4алкил, которые могут быть введены в соединение формулы (I) при помощи выбора других субстратов на стадиях, указанных выше. Способы введения Xi также раскрыты в ЕР 345.038 и заявках PCT/NO99/00135, PCT/NO99/00136 и PCT/NO99/00149. При этом специалисту очевидно, что соединения по изобретению, в которых R2 представляет собой С1-C4алкил, могут быть получены способами, хорошо известными специалистам, например, путем этерификации.
Настоящее изобретение также относится к применению соединения формулы (I) в качестве фармацевтического и/или пищевого агента. Ожидается, что настоящие соединения будут проявлять, по существу, такие же биологические активности, как соединения, известные из уровня техники, описанные выше, и настоящее изобретение, таким образом, относится к применению настоящих соединений формулы (I) для использования, которое описано в указанных публикациях.
Таким образом, настоящее изобретение относится к способу лечения и/или предупреждения состояния, выбранного из группы, включающей в себя синдром X, ожирение, гипертензию, жировую дистрофию печени, диабет, гипергликемию, гиперинсулинемию и стеноз, при котором человеку или животному, нуждающемуся в этом, вводят эффективное количество соединения формулы (I)
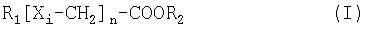
- где R1 представляет собой:
- С6-C24алкен с одной или более чем одной двойной связью, и/или
- С6-C24алкин, и/или
- С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-C4алкилтио, С2-C5ацилокси или С1-C4алкил, и
- где R2 представляет собой водород или С1-C4алкил, и
- где n представляет собой целое число от 1 до 12, и
- где i представляет собой нечетное число и показывает положение относительно COOR2, и
- где X независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
- с условием, что по меньшей мере один из Хi не является СН2, и
- с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
- с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, и
- с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду, за исключением, когда заместитель представляет собой С1-С4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или его соли или комплекса.
Настоящее изобретение также относится к фармацевтической композиции для снижения концентрации холестерина и триглицеридов в крови млекопитающих, подавления окислительной модификации липопротеина низкой плотности, содержащей аналоги жирных кислот общей формулы (I)
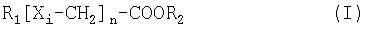
- где R1 представляет собой:
- С6-C24алкен с одной или более чем одной двойной связью, и/или
- С6-C24алкин, и/или
- С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-C4алкилтио, С2-C6ацилокси или С1-C4алкил, и
- где R2 представляет собой водород или С1-C4алкил, и
- где n представляет собой целое число от 1 до 12, и
- где i представляет собой нечетное число и показывает положение относительно COOR2, и
- где Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
- с условием, что по меньшей мере один из Хi не является СН2, и
- с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
- с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом или между (ω-2) углеродом и (ω-3) углеродом, и
- с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду за исключением, когда заместитель представляет собой С1-C4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или их соли или комплексы.
Кроме того, настоящее изобретение относится к пищевой композиции для снижения или предупреждения увеличения общей массы тела или общей жировой массы тела у человека или животного, содержащей аналоги жирных кислот общей формулы (I)
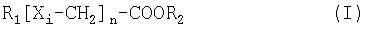
- где R1 представляет собой:
- С6-C24алкен с одной или более чем одной двойной связью, и/или
- С6-C24алкин, и/или
- С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-С4алкилтио, С2-C5ацилокси или С1-C4алкил, и
- где R2 представляет собой водород или С1-C4алкил, и
- где n представляет собой целое число от 1 до 12, и
- где i представляет собой нечетное число и показывает положение относительно COOR2, и
- где Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
- с условием, что по меньшей мере один из Хi не является СН2, и
- с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
- с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом или между (ω-2) углеродом и (ω-3) углеродом, и
- с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду за исключением, когда заместитель представляет собой С1-C4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или их соли или комплексы.
Настоящее изобретение также относится к способу достижения потери массы или снижения жировой массы у человека или животного, нуждающихся в этом, при котором им вводят эффективное количество композиции, содержащей аналоги жирных кислот общей формулы (I)
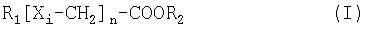
- где Ri представляет собой:
- С6-C24алкен с одной или более чем одной двойной связью, и/или
- С6-C24алкин, и/или
- С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-С4алкокси, С1-C4алкилтио, С2-C5ацилокси или С1-C4алкил, и
- где R2 представляет собой водород или С1-С4алкил, и
- где n представляет собой целое число от 1 до 12, и
- где i представляет собой нечетное число и показывает положение относительно COOR2, и
- где Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
- с условием, что по меньшей мере один из Хi не является CH2, и
- с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
- с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом или между (ω-2) углеродом и (ω-3) углеродом, и
- с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду за исключением, когда заместитель представляет собой С1-С4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или их соли или комплексы.
Описание фигур
Фиг.1 представляет собой схему синтеза соединения (Z) 3-тиа-гептадец-9-еновой кислоты.
Фиг.2 представляет собой схему синтеза 3-тиа-15-гептадецина.
Введение соединений по настоящему изобретению
В качестве фармацевтического препарата соединения по настоящему изобретению можно вводить непосредственно животному при помощи любой подходящей методики, в том числе парентерально, интраназально, перорально или путем всасывания через кожу. Их можно вводить местно или системно. Конкретный путь введения каждого агента будет зависеть, например, от истории болезни животного.
Изобретение будет понято более полно при ссылке на следующие примеры. Они, однако, не ограничивают изобретения.
Экспериментальная часть
Методы
Методы, описанные ниже, использовали в качестве тест-систем для соединений, описанных в предшествующем уровне техники, и таким образом также использовали для проверки биологических эффектов соединений по настоящему изобретению.
Крысы линии Zucker (fa/fa), страдающие ожирением
Крыс линии Zucker (fa/fa), страдающих ожирением, которые были использованы в этом исследовании, выращивали в установке для животных U 465 INSERM от пар, первоначально предоставленных Harriet G. Bird Laboratory (Stow, MA, USA). Если не оговорено иначе, животных содержали при постоянном цикле свет/темнота (свет с 7.00 до 19.00) при 21±1°С и разрешали свободный доступ к пище и воде. Крысы были помещены в клетку по трое. Ежедневно фиксировали прирост массы.
Крысы линии Wistar
Самцов крыс линии Wistar Charles River, весящих 280-358 г, закупали в AnLab Ltd. (Prague, Czech Republic) и помещали в клетки из проволочной сетки при температуре 22±1°С и светорегулируемую комнату (свет с 7.00 до 19.00). Крысам разрешали свободный доступ к пище и воде. Крысы были помещены в клетку по трое. Ежедневно фиксировали прирост массы и прием пищи.
Внутривенные глюкозотолерантные тесты
Самцам крыс линии Zucker (fa/fa) (в возрасте 5 недель) давали наркоз после 5 часов голодания путем внутрибрюшинной инъекции пентобарбитала натрия (50 мг/кг). Крысам вводили глюкозу (0,55 г/кг) в подкожную вену ноги, а образцы крови отбирали из хвостовой вены в пробирки, обработанные гепарином, через 0,5, 10, 15, 20 и 30 минут после введения глюкозы. Образцы помещали на лед, центрифугировали и плазму хранили при -20°С до анализа.
Эугликемический гиперинсулинемический клэмп
Через 21 день соответствующей диеты (смотри выше) крысам давали наркоз путем инъекции гидрохлорида ксилазина (Rometar SPOFA, Prague, Czech Republic; 10 мг/мл) и гидрохлорида кетамина (Narkamon SPOFA, Prague, Czech Republic; 75 мг/мл) и вставляли постоянные канюли в сонную артерию и яремную вену, как описано Koopmans et al. (Koopmans S.J. et al. Biochim Biophys Acta, 1115, 2130-2138, 1992). Крысам, подвергнутым канюлированию, давали возможность восстановиться в течение двух дней после операции перед клэмп-исследованиями, которые проводили согласно Kraegen et al. (Kraegen E.W. et al. Am J Physiol, 248, E353-E362, 1983). Таким образом, на третий день после операции крысам, находящимся в нормальном сознании, делали непрерывное вливание свиного инсулина (Actrapid, Novo Nordisk, Denmark) в виде дозы 6,4 МЕ/кг в минуту для достижения уровня инсулина в плазме в верхнем физиологическом диапазоне. Концентрацию глюкозы в артериальной крови фиксировали (поддерживали) на базальном уровне голодания путем переменного вливания 30%-ного раствора глюкозы (весо-объемный процент) (Leciva, Prague, Czech Republic). Образцы крови для определения концентраций глюкозы и инсулина в плазме отбирали каждые 15 минут после начала вливания глюкозы. Через 90 минут крысам прекращали вливание и немедленно обезглавливали, кровь отбирали для отделения плазмы, прослойки жировой ткани печени и эпидидимиса (придатка яичка) иссекали и взвешивали.
Измерение параметров плазмы
Концентрации глюкозы (GLU, Boehringer Mannheim, Germany), свободных жирных кислот (NEFA, С ACS-ACOD kit; Wako Chemicals, Dalton, USA) и b-гидроксибутирата (310-A kit; Sigma Diagnostics Inc., St. Louis, USA) измеряли, применяя ферментативные методы. Концентрации инсулина определяли при помощи радиоиммуноанализа (CIS bio International, Gif sur Yvette, France), применяя крысиный инсулин в качестве стандарта у крыс линии Zucker. У крыс линии Wistar Charles River концентрации глюкозы в плазме измеряли при помощи анализатора глюкозы Бекмана (Beckman Glucose Analyzer) (Fullerton, CA, USA). Уровени инсулина в плазме измеряли, применяя набор для радиоиммуноанализа от Linco Research Inc. (St. Charles, МО, USA). Фосфолипиды измеряли при помощи ферментативного метода bioMérieux, Marcy-l'Etoile, France, триацилглицерин при помощи Technicon Method no. SA4-0324L90, USA и холестерин при помощи Technicon Method no. SA4-0305L90, USA.
Получение постнуклеарных и митохондриальных фракций и измерение ферментативных активностей
Свежевыделенную печень от отдельных старых крыс линии Zucker гомогенизировали в ледяном сахарозном буфере (0,25 М сахарозы, 10 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты) (рН 7,4) и 2 мМ ЭДТА (этилендиаминтетрауксусной кислоты)). Постнуклеарные и митохондриальные фракции получали, применяя препаративное дифференциальное центрифугирование согласно De Duve et al. (De Duve C. et al. Biochem. J., 60, 604-617, 1955). Модификации, чистота и выход были такими, как описано ранее (Garras A. et al. Biochim. Biophys. Acta, 1255, 154-160, 1995). Кислоторастворимые продукты измеряли в постнуклеарных и митохондриальных обогащенных фракциях, применяя [1-14C]-пальмитоил-CoA и [1-14C]-пальмитоил-L-карнитин (Radiochemical Centre, Amersham, England) в качестве субстратов, как описано ранее (Willumsen N. et al. J. Lipid Res., 34, 13-22, 1993). Активности карнитин-пальмитоилтрансферазы I и II измеряли в постнуклеарных и митохондриальных фракциях, в основном как описано Bremer (Bremer J. Biochim. Biophys. Acta, 665, 628-631, 1981), а 3-гидрокси-3-метилглутарил-CoA-синтазы измеряли согласно Clinkenbeard et al. (Clinkenbeard K.D. et al. J. Biol. Chem., 250, 3108-3116,1975) в митохондриальных фракциях.
Анализ РНК
Выделение РНК (Chomczynski P. et al. Anal. Biochem., 162, 156-159, 1987), нозерн-блоттинг анализ и слот-блоттинг РНК на нейлоновые фильтры и гибридизацию с иммобилизованной РНК осуществляли, как описано ранее (Vaagenes H. et al. Biochem. Pharmacol., 56, 1571-1582, 1998). Следующие фрагменты кДНК использовали в качестве зондов: CPT-I (Esser V. et al. J. Biol. Chem., 268, 5817-5822, 1993), CPT-II (Woeltje K.F. et al. J. Biol. Chem., 265, 10720-10725, 1990), 3-гидрокси-3-метилглутарил-CoA-синтаза (Ayté J. et al. Proc. Natl. Acad. Sci. USA, 87, 3874-3878, 1990) и липаза, чувствительная к гормонам (Holm С. et al. Biochim. Biophys. Acta, 1006, 193-197, 1989). Соответствующие уровни экспрессии РНК оценивали как количества радиоактивных зондов, гибридизовавшихся с соответствующими уровнями 28S рРНК.
Результаты
Пример 1. Синтез новых соединений жирных кислот
А) Аналоги не подвергающихся β-окислению жирных кислот с углерод-углеродной двойной связью.
Синтез соединения в соответствии с настоящим изобретением обычно проводят, согласуясь с синтезом тиа-гептадец-9-еновой кислоты:
(Z)HO(O)C-CH2-S-(CH2)5-CH=CH-C7H15
(Z) означает цис-конфигурацию.
1. Получение 1-бром-5-гидроксипентана
Пентан-1,5-диол, НО-(СН2)5-ОН обрабатывали HBr в бензоле и нагревали с обратным холодильником в течение 24 часов. Смесь продуктов хроматографировали сначала смесью гексан-диэтиловый эфир в соотношении 85:15 для удаления дибромида, а затем смесью в соотношении 70:30. Выход 1-бром-5-гидроксипентана составил 80%.
1H ЯМР: 1,81 (-CH2-CH2OH); 1,44 (-CH2-); 3,35 (-CH2-Br); 3,55 (-CH2-ОН); 3,32 (-ОН); 1,51 (-CH2-CH2Br).
13С ЯМР: 31,43-32,30 (С2, С4); 24,24 (С3); 33,64 (65); 62,11 (C1).
2. Получение 5-(тетрагидропиранилокси)-1-бромпентана
Этому соединению давали провзаимодействовать с 3,4-дигидро-2Н-пираном в CH2Cl2 при 0°С. 2 капли концентрированной HCl использовали в качестве катализатора. После удаления растворителя продукт реакции хроматографировали в системе гексан-диэтиловый эфир в соотношении 95:5. Выход 5-(тетрагидропиранилокси)-1-бромпентана составил 77%.
1H ЯМР: 1,45-1,63 (-CH2-); 1,83 (-CH2-CH2O-); 3,38 (-CH2-Br); 3,27-3,79 (-CH2-O-); 4,52 (-O-CH-О).
13С ЯМР: 24,9-32,92 (C2-C4); 33,61 (C5); 62,26 (C6); 98,83 (C1 в ТНР).
3. Получение 7-(тетрагидропиранилокси)-1-гептина
Продукт стадии 2 обрабатывали EDA-комплексом Li-ацетиленида в сухом диметилсульфоксиде при 0°С в атмосфере аргона. После 4 часов при комнатной температуре реакционную смесь гидролизовали водой и органические продукты экстрагировали диэтиловым эфиром. Остаток после удаления эфира хроматографировали в системе гексан-диэтиловый эфир в соотношении 97:3, получая 7-(тетрагидропиранилокси)-1-гептин с выходом 62%.
1H ЯМР: 1,45-1,66 (-CH2-); 3,45-3,82 (-CH2-O); 2,16 (-CH2-C≡); 1,90 (НС≡С-); 4,53 (-O-CH-О-).
13С ЯМР: 18,27-30,66 (С3-C6); 62,21 (С7); 68,14 (C1); 84,40 (С2).
4. Получение 1-(тетрагидропиранилокси)-тетрадец-6-ина
К 1,6 М раствору BuLi в гексане, растворенному в THF (тетрагидрофуране) при 0°С в атмосфере аргона, и продукту стадии 3 добавляли смесь 1-бромгептана и N,N-диметилпропиленмочевины. После гидролиза, экстракции и хроматографии выделяли 1-(тетрагидропиранилокси)-тетрадец-6-ин с выходом 69%.
1H ЯМР: 0,85 (СН3-); 1,22-1,57 (-CH2-); 2,10 (-CH2-C≡); 3,30-3,84 (-CH2O-);4,55 (-O-CH-O-).
13С ЯМР: 14,02 (C14); 22,60-31,73 (С2-C13); 18,69-18,71 (C5 и C8); 62,23 (C1); 79,91-80,32 (C6 и С7).
5. Получение 1-(тетрагидропиранилокси)-тетрадец-6-ена
Замещенный тетрадец-6-ин стадии 4 восстанавливали водородом в присутствии катализатора Линдлара (Lindlar) в этаноле. Восстановление длилось в течение 4 часов. Полученный 1-(тетрагидропиранилокси)-тетрадец-6-ен был достаточно чистым для стадии 6 без дальнейшей очистки, но мог быть выделен с выходом 89% и после хроматографии.
1H ЯМР: 0,90 (СНз-); 1,27-1,61 (-CH2-); 3,39-3,89 (-CH2-O); 2,04 (-CH2-C=); 4,59 (-O-CH-О-); 5,37 (-НС=СН-).
13С ЯМР: 14,07 (С14); 22,65-31,85 (C2-C13); 62,27 (C1); 27,13, 27,19 (C5 и С8); 129,60-130,04 (С6 и С7).
6. Получение 1-бромтетрадец-б-ена
Продукт стадии 5 бромировали CBr4 при 0°С в дихлорметане в присутствии Ph3Р. Реакционную смесь перемешивали в течение ночи. Выход 1-бромтетрадец-6-ена был количественным.
1H ЯМР: 0,87 (СН3-); 1,27-1,52 (-CH2-); 2,01 (-CH2-C=); 3,39 (-CH2-Br); 1,45 (-CH2-CH2-Br); 1,85 (-CH2-CH2С=); 5,34 (-НС=СН-).
13С ЯМР: 14,00 (C14); 22,60-32,68 (C2-C13); 26,97, 27,24 (C5 и C8); 33,75 (C1); 129,15-130,32 (С6 и С7).
7. Получение (Z) тиа-гептадец-9-еновой кислоты
Бромдецен стадии 6 в метаноле добавляли к 3 эквивалентам КОН и 1,5 эквивалентам HS-CH2-C(O)ОН в метаноле в атмосфере аргона в течение 30 минут. После перемешивания при комнатной температуре в течение 4 часов, кипячения с обратным холодильником в течение еще 12 часов с последующим гидролизом и экстракцией диэтиловым эфиром, а затем подкислением до рН 1-2 выделяли продукт, соединение, приведенное в заголовке, в виде вязкого масла с выходом 60%.
Были проведены следующие анализы: ИК (инфракрасная спектроскопия), 600 МГц 1H и 13С ЯМР (ядерный магнитный резонанс), МС (масс-спектрометрия), ГХ (газовая хроматография), ГХ-МС (масс-спектрометрия - газовая хроматография) метилового эфира. Результаты ЯМР приведены ниже. Все данные приведены в миллионных долях (млн-1). Никаких следов Е-соединений не было обнаружено.
1H ЯМР: 0,86 (СН3-); 1,16-1,60 (-CH2-); 1,99 (-CH2-C=); 2,64 (-CH2-S-); 3,22 (-S-CH2-C(O)OH); 5,33 (НС=СН).
13С ЯМР: 176,63 (C1); 33,34 (С2); 32,69 (C4); 22,63-31,83 (С5-C7, C12-C16); 129,32 и 130,24 (C9, C10); 26,98 и 27,19 (С8, С11); 14,08 (C17).
В) Аналоги не подвергающихся β-окислению жирных кислот, содержащие углерод-углеродную тройную связь.
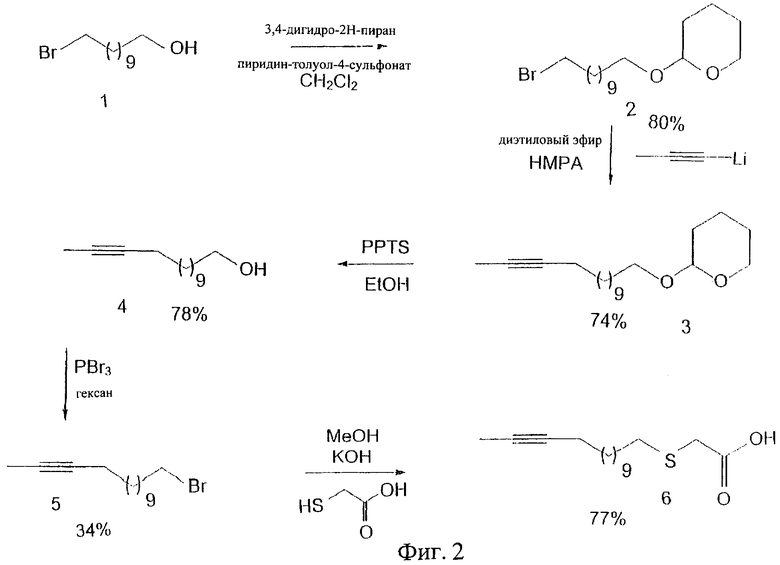
Синтез соединения в соответствии с настоящим изобретением проводят, согласуясь с синтезом 3-тиа-15-гептадецина, как представлено на фигуре 1.
1. Получение 11-бром-1(тетрагидро-2-пиранилокси)ундекана
Пиридин-толуол-4-сульфонат (1,0 г; 4,0 ммоль) и 11-бром-1-ундеканол (10,0 г; 400 ммоль) растворяли в сухом CH2CH2 (200 мл) при температуре окружающей среды и добавляли 3,4-дигидро-2Н-пиран (5,0 г; 60 ммоль). Реакционную смесь перемешивали в течение ночи. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле, который элюировали CH2Cl2. Выход 11-бром-1(тетрагидро-2-пиранилокси)ундекана составил 10,7 г (80%).
2. Получение 14-(тетрагидро-2-пираноил)-2-тетрадецина
Газ пропин пропускали через раствор MeLi в диэтиловом эфире (0,8 М; 60 мл; 51,2 ммоль) со скоростью, подобранной так, чтобы обеспечить дефлегмацию эфира. Когда тепло больше не выделялось, реакцию считали законченной (белая суспензия). 11-бром-1(тетрагидро-2-пиранилокси)ундекан (продукт 2) (13,0 г; 38,8 ммоль) добавляли по капле к этому раствору на протяжении периода 20 минут. Реакционную смесь перемешивали в течение ночи и осторожно по капле добавляли воду (50 мл). Смесь разбавляли диэтиловым эфиром и промывали водой (5х), сушили (MgSO4) и выпаривали растворитель. Неочищенный продукт очищали посредством флэш-хроматографии с CH2Cl2 в качестве элюента. Выход 14-(тетрагидро-2-пираноил)-2-тетрадецина составил 8,5 г (74%).
3. Получение 12-тетрадецин-1-ола
Пиридин-толуол-4-сульфонат (0,3 г; 1,2 ммоль) и алкин (продукт 3) растворяли в этаноле (25 мл) и нагревали до 50°С в течение ночи. Растворитель выпаривали и распределяли между водой и СН2Cl2. Водную фазу промывали водой, сушили (MgSO4) и выпаривали растворитель. Неочищенный продукт очищали посредством флэш-хроматографии с CH2Cl2 в качестве элюента. Выход 12-тетрадецин-1-ола составил 1,5 г (78%).
4. Получение 14-бром-2-тетрадецина
12-тетрадецин-1-ол (5,0 г; 23,8 ммоль) растворяли в гексане (50 мл) и добавляли 10 капель пиридина. Добавляли к этой смеси PBr3. Смесь нагревали до 60°С в течение трех часов, охлаждали и добавляли воду по капле. Смесь промывали водой, сушили (MgSO4) и выпаривали растворитель. Неочищенный продукт очищали посредством флэш-хроматографии с гексаном в качестве элюента до содержания 2,5% EtOAc в гексане. Выход 14-бром-2-тетрадецина составил 2,2 г (34%).
5. Получение 3-тиа-15-гептадецина
КОН (2,76 г; 49,0 ммоль) растворяли в метаноле (30 мл) и добавляли по капле тиогликолевую кислоту (2,04 г; 22,1 ммоль) в метаноле (25 мл). Через 10 минут осторожно по капле добавили 14-бром-2-тетрадецин (5,5 г; 20,1 ммоль) и смесь нагревали до 50°С в течение ночи. Смесь охлаждали до 0°С и добавляли 30 мл HCl (рН 1). Осадок отфильтровывали и промывали водой (2х). Твердое вещество растворяли в хлороформе (100 мл) и промывали водой (1х), сушили (MgSO4) и выпаривали растворитель. Выход соединения 14-бром-2-тетрадецина составил 4,4 г (77%).
1H ЯМР (300 МГц; CDCl3) δ: 1,26 (10Н, острый m); 1,3-1,4 (4Н, m); 1,46 (2Н, квинтет, J=7,0 Гц, ≡CCH2CH2-); 1,60 (2Н, квинтет, J=7,0 Гц, -CH2CH2S-); 1,77 (3Н, t, J=2,6 Гц, СН3С≡); 2,10 (2Н, tq, J=2,6; 7,0 Гц, ≡CCH2-); 2,65 (2Н, t, J=7,3 Гц, -CH2S-); 3,25 (2Н, s, -SCH2COOH); 10,40 (1Н, уширенный s, -COOH).
13С ЯМР (75 МГц; CDCl3) δ: 3,35 (СН3С≡); 18,61 (≡CCH2-); 28,60; 28,78; 28,78; 28,97; 29,04; 29,04; 29,34; 29,38; 29,40; 32,70 (-CH2CH2S-); 33,32 (-SCH2CO); 75,20 (МеС≡С-); 79,31 (МеС≡С-); 176,42 (СО).
С) Аналоги не подвергающихся β-окислению жирных кислот, замещенные в одном или нескольких положениях.
Одна или несколько водородных групп цепи жирной кислоты могут быть замещены одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-С4алкокси, С1-C4алкилтио, С2-C6ацилокси или С1-C4алкил. Заместители можно, например, вводить в соединение формулы (I) при помощи выбора других субстратов на стадиях 1-4, указанных выше.
Наконец, соединения, полученные на вышеуказанной стадии (С), можно превращать в насыщенные соединения обычными реакциями гидрогенизации, таким образом обеспечивая R1 группу, которая полностью насыщена (то есть алкил), но замещена в одном или более чем одном положении.
Пример 2
Исследование токсичности ТТА
Исследования токсичности и тест на мутагенную активность будут проводить, как описано в PCT/N099/00135.
Пример 3
Биологическую активность новых соединений в соответствии с настоящим изобретением будут определять, как описано в вышеуказанной экспериментальной части или как раскрыто в вышеуказанных публикациях.
Пример 4
Новые жирные кислоты с тройными связями на ω-конце (на примере 3-тиа-15-гептадецина) были изучены в экспериментах по кормлению крыс линии Zucker с ожирением. Использовали две различные дозировки жирной кислоты, 50 и 150 мг на кг массы тела в день (мг/кг/день). Исследовали следующие параметры: уровни холестерина в плазме крови, митохондриальное окисление жирных кислот в печени и пероксисомальное окисление жирных кислот в печени.
Новые соединения по настоящему изобретению уменьшали уровень холестерина в плазме крови дозозависимым образом, обеспечивая 40%-ное уменьшение при самом высоком используемом уровне. Это уменьшение более чем в 2 раза превышало величину уменьшения уровня холестерина, полученную при использовании известного аналога насыщенных жирных кислот - ТТА (тетрадецилтиоуксусная кислота) в эквивалентной дозировке (ТТА и тестированное соединение по изобретению отличаются только тем, что соединение по изобретению (3-тиа-15-гептадецин) содержит тройную связь, блокирующую ω-окисление).
Митохондриальное окисление жирных кислот увеличивалось почти в 4 раза в присутствии самой высокой дозы нового содержащего тройную связь соединения. Это увеличение более чем в 6 раз превосходило величину увеличения митохондриального окисления жирных кислот, которую наблюдали в присутствии эквивалентной дозы ТТА.
Активность митохондриального фермента CPT-II, который регулирует скорость митохондриального окисления жирных кислот, увеличивалась на 160% в присутствии нового содержащего тройную связь соединения по сравнению с всего лишь 40%-ным увеличением активности фермента в присутствии ТТА.
Пероксисомальное окисление жирных кислот увеличивалось в 10 раз в присутствии соединения, содержащего тройную связь, по сравнению с удвоением окисления в присутствии ТТА.
Пример 5
Были проведены эксперименты для оценки эффекта перемещения атома Х в разные положения относительно карбоксильного конца аналогов жирных кислот по изобретению. В этих экспериментах измеряли активность (в нмоль/мин/мг/белка) митохондриального β-окисления в печени аналогов жирных кислот по изобретению, содержащих атом серы в 3, 5 и 7 положениях относительно карбоксильного конца. Активности составляли 0,81±0,16 для серы в 3-м положении, 0,61±0,06 для серы в 5-м положении, 0,58±0,09 для серы в 7-м положении. При этом активность для пальмитиновой кислоты, использовавшейся в качестве контроля, не блокирующего β-окисление, составляла 0,47±0,06. Полученные результаты свидетельствуют о том, что β-окисление действительно блокируется аналогами жирных кислот по изобретению и этот эффект уменьшается по мере удаления атома X, замедляющего β-окисление, от карбоксильного конца молекулы.
Пример 6
Мягкая желатиновая капсула
Для изготовления оболочки капсулы используют раствор, содержащий (масс.%):
В качестве наполнителя капсулы используют состав, содержащий:
Мягкие желатиновые капсулы получают капельным способом, хорошо известным из уровня техники.
Пример 7
Корм для лабораторных животных
Состав корма:
Указанную композицию готовят простым смешиванием компонентов в соответствии с традиционными технологиями и фасуют в стандартные упаковки весом по 0,25, 0,5 и 1 кг.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ЖИРНЫХ КИСЛОТ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ И АУТОИММУННЫХ РАССТРОЙСТВ | 2001 |
|
RU2259823C2 |
| АНАЛОГИ ЖИРНЫХ КИСЛОТ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ КОЖНЫХ РАССТРОЙСТВ | 2001 |
|
RU2276602C2 |
| АНАЛОГИ ЖИРНЫХ КИСЛОТ ДЛЯ ЛЕЧЕНИЯ РАКА | 2001 |
|
RU2283105C2 |
| НОВЫЕ АНАЛОГИ ЖИРНЫХ КИСЛОТ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА | 1999 |
|
RU2221558C2 |
| КОМБИНАЦИИ АКТИВАТОРА (АКТИВАТОРОВ) РЕЦЕПТОРА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ (РАПП), И ИНГИБИТОРА (ИНГИБИТОРОВ) ВСАСЫВАНИЯ СТЕРИНА И ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ СОСУДОВ | 2008 |
|
RU2483724C2 |
| СОСТАВ В МЯГКОЙ ЖЕЛАТИНОВОЙ КАПСУЛЕ | 2007 |
|
RU2420291C2 |
| АРИЛЬНЫЕ, ГЕТЕРОАРИЛЬНЫЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕДИЦИНСКИХ НАРУШЕНИЙ | 2018 |
|
RU2801278C2 |
| НОВЫЕ АНАЛОГИ ГЛЮКАГОН-ПОДОБНОГО ПЕПТИДА, КОМПОЗИЦИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2010 |
|
RU2557301C2 |
| АНАЛОГИ БУПРЕНОРФИНА | 2009 |
|
RU2520222C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАЦИИ ЖЕЛТОГО ПЯТНА | 2010 |
|
RU2548762C2 |
Настоящее изобретение относится к новым аналогам жирных кислот общей формулы (I): R2-[X1-CH2]n-COOR2, где R1 представляет собой: С6-C24 алкен с одной или более чем одной двойной связью, и/или С6-C24алкин, и где R2 представляет собой водород или С1-C4алкил, и где n представляет собой целое число от 1 до 12, и где i представляет собой нечетное число и показывает положение относительно COOR2, и где Xi независимо друг от друга выбраны из группы, включающей в себя О, S, Se и СН2, и с условием, что по меньшей мере один из Xi не является СН2, и с условием, что если R1 представляет собой алкин, тогда углерод-углеродная тройная связь располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, их солям или комплексам. Заявленные соединения могут быть использованы для лечения и/или предупреждения синдрома X, ожирения, гипертензии, жировой дистрофии печени, диабета, гипергликемии, гиперинсулинемии и стеноза. Изобретение также относится к способам получения новых аналогов жирных кислот. Кроме того, изобретение относится к пищевой композиции, содержащей указанные аналоги жирных кислот, и способу снижения общей массы или количества жировой ткани у человека или животного. Целью данного изобретения является разработка новых, основанных на аналогах жирных кислот, композиций или способов подавления стеноза, рестеноза или связанных с ними расстройств из-за пролиферации и мобилизации клеток гладких мышц сосудов после, например, травматического повреждения сосудов, нанесенного во время операции на сосудах. 6 н. и 6 з.п. ф-лы, 2 ил.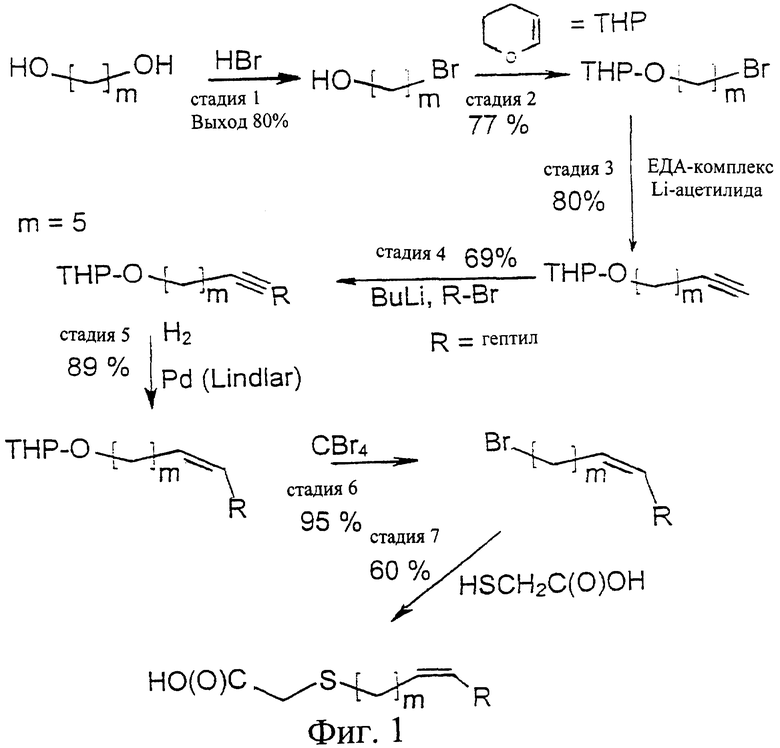
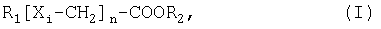
где R1 представляет собой С6-C24алкен с одной или более чем одной двойной связью или
С6-C24алкин,
R2 представляет собой водород или С1-C4алкил, n представляет собой целое число от 1 до 12,
i представляет собой нечетное число и показывает положение относительно COOR2,
Xi независимо друг от друга выбраны из группы, включающей О, S, Se и СН2, и
с условием, что по меньшей мере один из Xi не является СН2, и
с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом,
или их соли или комплексы.
защиту бромалканола путем введения защитной группы для гидроксила;
введение в полученный защищенный бромалканол ацетиленовой группы с последующим, когда это необходимо, алкилированием и/или восстановлением ацетиленовой группы;
последовательное или одновременное удаление защитной группы и бромирование;
взаимодействие полученного соединения с соединением формулы Н[Хi-CH2]n-COOR2, где Хi, n и R2 такие, как определено в п.1, с последующей, когда это необходимо, гидрогенизацией полученного продукта.
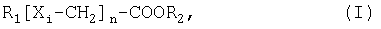
где R1 представляет собой С6-C24алкен с одной или более чем одной двойной связью и/или
С6-C24алкин, и/или
С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-C4алкилтио, С2-C5ацилокси или С1-С4алкил,
R2 представляет собой водород или С1-C4алкил,
n представляет собой целое число от 1 до 12,
i представляет собой нечетное число и показывает положение относительно COOR2,
Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
с условием, что по меньшей мере один из Xi не является СН2, и
с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, и
с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду, за исключением, когда заместитель представляет собой С1-C4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или его соли или комплекса.
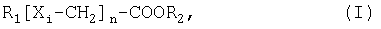
где R1 представляет собой
С6-C24алкен с одной или более чем одной двойной связью, и/или С6-C24алкин, и/или С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-C4алкилтио, С2-C5ацилокси или C1-C4алкил, и
R2 представляет собой водород или С1-C4алкил,
n представляет собой целое число от 1 до 12,
i представляет собой нечетное число и показывает положение относительно COOR2,
Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
с условием, что по меньшей мере один из Xi не является СН2, и
с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, и
с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду, за исключением, когда заместитель представляет собой С1-С4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или его соли или комплекса.
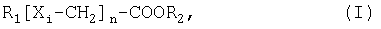
где R1 представляет собой С6-C24алкен с одной или более чем одной двойной связью, и/или С6-C24алкин, и/или С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-C4алкилтио, С2-C5ацилокси или C1-C4алкил, и
R2 представляет собой водород или С1-C4алкил,
n представляет собой целое число от 1 до 12,
i представляет собой нечетное число и показывает положение относительно COOR2,
Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
с условием, что по меньшей мере один из Xi не является СН2, и
с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, и
с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду, за исключением, когда заместитель представляет собой С1-C4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или их соли или комплексы.
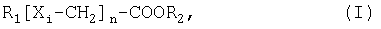
где R1 представляет собой С6-C24алкен с одной или более чем одной двойной связью, и/или С6-C24алкин, и/или С6-C24алкил, замещенный в одном или нескольких положениях одним или более чем одним соединением, выбранным из группы, включающей в себя фторид, хлорид, гидрокси, С1-C4алкокси, С1-C4алкилтио, C2-C5ацилокси или C1-С4алкил, и
R2 представляет собой водород или С1-C4алкил,
n представляет собой целое число от 1 до 12,
i представляет собой нечетное число и показывает положение относительно COOR2,
Xi независимо друг от друга выбраны из группы, включающей в себя О, S, SO, SO2, Se и СН2, и
с условием, что по меньшей мере один из Xi не является СН2, и
с условием, что если R1 представляет собой алкин, тогда одна из углерод-углеродных тройных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, или между (ω-3) углеродом и (ω-4) углеродом, и
с условием, что если R1 представляет собой алкен, тогда одна из углерод-углеродных двойных связей располагается между (ω-1) углеродом и (ω-2) углеродом, или между (ω-2) углеродом и (ω-3) углеродом, и
с условием, что если R1 представляет собой замещенный алкил, тогда замещение располагается по (ω-1) углероду, или (ω-2) углероду, или (ω-3) углероду, за исключением, когда заместитель представляет собой С1-С4алкил, тогда замещение располагается по (ω-2) углероду или (ω-3) углероду,
или их соли или комплексы.
| СВАРНОЙ ТРАК ГУСЕНИЧНОЙ ЦЕПИ | 0 |
|
SU345038A1 |
| RU 2000131222 А, 23.04.1999 | |||
| WO 9958120 A1, 18.11.1999 | |||
| WO 9958123 A2, 18.11.1999 | |||
| WO 9703663 A1, 06.02.1997 | |||
| RU 2063972 C1, 20.07.1996. | |||
Авторы
Даты
2006-11-27—Публикация
2001-03-02—Подача