Изобретение относится к кислотно-аддитивным солям аллиламиновых противогрибковых средств.
Изобретение относится к солям соединения формулы I
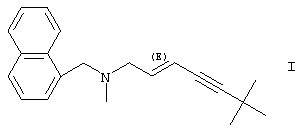
и яблочной кислоты,
т.е. к форме кислотно-аддитивной соли (Е)-N-метил-6,6-диметил-N-(1-нафтилметил)гепт-2-ен-4-инил-1-амина и яблочной кислоты, которые далее сокращенно называются «соединениями по изобретению».
Соединения по изобретению представляют собой новые и обладающие улучшенными фармацевтическими свойствами солями известного соединения формулы I.
Соединение по изобретению находится в рацемической или энантиомерной форме. Соединение находится в форме кислотно-аддитивной соли, представляющей собой малат или бималат, предпочтительно бималат. Фрагмент яблочной кислоты предпочтительно находится в рацемической (DL)-(±)- или L-(-)-энантиомерной, предпочтительно L-(-)-энантиомерной форме. Таким образом, предпочтительными являются (DL)-(±)- и L-(-)-бималаты, прежде всего L-(-)-бималат.
Соединения по изобретению обладают полиморфизмом. Под объем изобретения подпадают соединения по изобретению в любой полиморфной форме, например в форме А или форме Б L-(-)-бималата, которые описаны ниже.
Объектом изобретения является также способ получения соединения по изобретению, который заключается в том, что соединение формулы I в форме свободного основания подвергают взаимодействию с соответствующей формой яблочной кислоты и выделяют образовавшуюся соль из реакционной смеси.
Способ по изобретению можно осуществлять общепринятым образом, например, путем проведения реакции в соответствующем инертном растворителе, таком как изопропанол, этиловый эфир уксусной кислоты, изопропилацетат, циклопентанон, н-бутанол или этилформиат.
Соединение формулы I в форме кислотно-аддитивной соли, а также его эквиваленты, и его применение в качестве противогрибкового средства, например для лечения микоза, вызванного дерматофитной инфекцией, описаны среди прочего в ЕР 24687. Это соединение поступает в продажу под общим названием тербинафин в форме свободного основания или кислотно-аддитивной соли соляной кислоты под товарным знаком Lamisil®. В научной литературе, например в ЕР 515310 А1, описаны также еще две формы соединения в виде соли, а именно лактат и аскорбат, применяемые в фармацевтических композициях, предназначенных для местного нанесения на кожу.
Тербинафин является эффективным противогрибковым агентом при пероральном и местном применении. Он эффективен в отношении широкого спектра грибковых заболеваний, включая грибковую синуситную инфекцию и онихомикоз. Наиболее предпочтительно его применяют для борьбы с дерматофитами, контагиозными грибами, которые поражают омертвевшие ткани кожи или дериваты кожы, такие как роговичный слой, ногти и волосы. Такой грибок ногтей поражает ногтевое ложе, защищенное твердым внешним слоем ногтя. Таким образом, если инфекция проникла под ноготь, то сам ноготь обеспечивает грибок защитным окружением, которое позволяет расти грибку. Воздействие таких грибков может приводить к неприглядному виду ногтей, грибки серьезно осложняют уход за ногами, оказывают отрицательное влияние на общее качество жизни пациента и его самочувствие, снижают работоспособность пациента. При отсутствии лечения грибки могут приводить к деформации ногтей пальцев стопы и вызывать боль при ходьбе. Кроме того, грибки могут вызывать трещины в коже, что является благоприятным для возникновения бактериальных инфекций. В результате таких инфекций у людей, страдающих диабетом, могут наступать серьезные осложнения, такие как синдром диабетических ног, включая первичные связанные с заболеванием осложнения, например гангрену, что в конце концов может представлять опасность для жизни или приводить к необходимости ампутации. Другие подгруппы пациентов с высокой степенью риска включают пациентов, пораженных вирусом иммунодефицита человека (ВИЧ), пациентов, страдающих синдромом приобретенного иммунодефицита (СПИД), и пациентов с другими типами иммунодепрессии (например, реципиентов трансплантатов и пациентов, подвергающихся продолжительному терапевтическому лечению с использованием кортикостероидов). Онихомикоз более часто встречается у людей в пожилом возрасте (к 60 годам встречаемость повышается вплоть до 30%). Наиболее распространенными являются заболевания такими грибками, как Microsporum, Trichophyton, например Trichophyton rubrum или Trichophyton mentagrophytes, и Epidermophyton, например Epidermophyton floccosum. В медицине широко известно, что онихомикоз трудно поддается диагностике и лечению, прежде всего у пациентов в пожилом возрасте.
Тербинафин можно применять также для лечения онихомикоза ногтей пальцев стопы и ногтей пальцев руки (эпидермофитии ногтей), вызванных дерматофитами. В частности, тербинафин разрешен для лечения эпидермофитии ногтей, вызываемой Trichophyton. Например, было установлено, что лечение пальцев стопы использовавшимся ранее стандартным лекарственным средством гризеофульвином, оказалось неэффективным, поскольку для лечения требуется 1-2 года, при этом, как правило, возникают рецидивы и полное излечение является маловероятным.
При пероральном применении с целью лечения онихомикоза гидрохлорид тербинафина, как правило, вводят один раз в день в виде таблетки с быстрым высвобождением, содержащей 250 мг тербинафина. Такая таблетка, поступающая в продажу под товарным знаком Lamisil®, обеспечивает высвобождение 80% тербинафина в течение 30 мин согласно стандартным исследованиям растворимости в условиях in vitro, проводимых, например, с помощью метода с использованием лопастной мешалки при рН 3. Срок лечения тербинафином составляет 12 недель. Его клиническое действие заключается в том, что происходят рост здорового ногтя, вытеснение и замена имеющего неприглядный вид пораженного болезнью ногтя, в котором находятся дебрис и погибшие грибки. Для образования полностью обновленного ногтя требуется приблизительно 10 месяцев.
Хотя, как правило, считается, что тербинафин является таким же безопасным, как и любое разрешенное к применению лекарственное средство, имеются сведения о побочных действиях, связанных с его применением. Выявлено большое количество побочных действий, например головные боли, желудочно-кишечные симптомы (включая диарею, диспепсию, абдоминальную боль, тошноту и метеоризм), аномалии, выявляемые при исследовании печени (например, ферментные аномалии), дерматологические симптомы, такие как чесотка, крапивница и сыпь, и нарушения вкуса, например потеря вкуса. Такие неблагоприятные действия, как правило, являются слабыми и кратковременными. Другие неблагоприятные действия включают симптоматическую идиосинкратическую гепатобилиарную дисфункцию, (например, холестатический гепатит), выраженные кожные реакции, такие как синдром Стивенса-Джонсона, нейтропению и тромбоцитопению. Кроме того, неблагоприятные действия могут приводить к нарушениям зрения, таким как изменения хрусталика и сетчатки глаза, а также к аллергическим реакциям, включая анафилаксию, усталость, рвоту, артралгию, миалгию и потерю волос. Тербинафин является сильным ингибитором CYP2D6 и может приводить к имеющим клиническое значение побочным действиям при совместном введении с лекарственными средствами, представляющими собой субстраты для этой изоформы, такими как нортриптилин, деспрамин, перфеназин, метопролол, энкаинид и пропафенон. Ниже в настоящем описании все такие проявления сокращенно называются побочными действиями.
Фармакокинетические и биофармацевтические свойства гидрохлорида тербинафина являются известными. Известно, что он хорошо абсорбируется. Пиковые концентрации лекарственного средства в плазме (ниже обозначаемые как Сmax), составляющие приблизительно 1,3 мкг/мл (с учетом приблизительно 20%-ной вариации составляют, например, от 0,9 до 1,6 мкг/мл), достигаются в организме человека через 1-2 ч после введения однократной дозы тербинафина 250 мг. Площадь под кривой при измерении зависимости в течение 24 ч (ниже обозначаемая как AUC) составляет приблизительно 4,76 мкг·ч/мл. При введении тербинафина вместе с пищей с высоким содержанием жиров величина AUC увеличивается на 42%. У пациентов с почечной недостаточностью (например, с клиренсом креатинина ≥50 мл/мин) или циррозом печени клиренс тербинафина понижается приблизительно на 50%. В стационарном состоянии, например, когда впадины и пики являются постоянными после приема лекарственного средства в течение нескольких дней, Сmax выше на 25%, а AUC превышает в 2,5 раза соответствующие параметры, достигаемые при введении однократной дозы. Эти данные согласуются с эффективным временем полужизни тербинафина, составляющим приблизительно 36 ч.
Фармакокинетические и абсорбционные свойства описаны, например, у J.Faergemann и др., Acta Derm. Venereol. (Stockh.) 77 (1997), cc.74-76. Однако область абсорбции тербинафина неизвестна и отсутствует доказанная в клинических условиях корреляция вызываемого действия с фармакокинетическим профилем, поэтому не имеется рациональной предпосылки для разработки содержащих тербинафин фармацевтических форм, обладающих улучшенным терапевтическим действием.
Несмотря на очень важную роль тербинафина известные случаи возникновения нежелательных побочных действий являлись препятствием для его более широкого применения или введения пероральным путем. Определенные проблемы, выявленные в случае перорального введения гидрохлорида тербинафина, неизбежно приводили к ограничениям применения терапии с использованием тербинафина для лечения не очень серьезных или неопасных болезненных состояний, например эпидермофитии стоп (Tinea pedis).
При создании изобретения неожиданно было установлено, что соли соединения формулы I и яблочной кислоты обладают особенно благоприятными фармакокинетическими свойствами и, кроме того, было установлено, что они обладают уникальной комбинацией свойств, выгодных с точки зрения приготовления композиции, что делает их особенно предпочтительными для приготовления фармацевтических композиций тербинафина, адаптированных для системного и местного применения.
Так, при системном применении малата соединения формулы I вариабельность фармакокинетических параметров оказывается существенно меньше, чем при применении известных солей или свободного основания указанного соединения, например гидрохлорида.
Это доказано, среди прочего, в фармакологическом исследовании на животных, которое проводили на семи собаках породы Beagle приблизительно 5-летнего возраста, имеющих вес приблизительно 10 кг, которым вводили перорально капсулы, полученные путем смешения действующего вещества, представляющего собой соль тербинафина [гидрохлорид или L-(-)-бималат; эквивалентное 62,5 мг соединения в форме основания на капсулу], с лактозой в массовом соотношении 1:1 и заполнения полученной смесью соответствующих твердых желатиновых капсул (распределение размеров частиц было одинаковым для обеих солей).
Было установлено, что вариабельность концентрации тербинафина в плазме между различными животными (выраженная в виде коэффициента вариации [ниже в настоящем описании обозначенном как CV] площади под кривой [AUC] при введении L-(-)-бималата тербинафина (30%) заметно уменьшается по сравнению с вариабельностью при введении гидрохлорида (39%). Полученные при этом средние значения AUC составляли соответственно 392 и 348 нг·ч/мл, при этом наблюдалось даже небольшое увеличение абсолютной концентрации в плазме при использовании бималата.
Полученные в этом опыте средние значения Сmax составляли 134 и 146 нг/мл соответственно для L-(-)-бималата и гидрохлорида, при этом указанные значения CV составляли соответственно 26 и 47%, что дополнительно свидетельствует о уменьшении вариабельности фармакокинетических параметров при использовании малата.
На основе этих данных можно ожидать, что у человека будет наблюдаться аналогичная уменьшенная вариабельность фармакокинетических параметров, и в результате этого можно достигать более стабильной эффективности при лечении с применением тербинафина в качестве антимикотического средства даже при его использовании в очень высоких дозах, в частности, путем перорального введения, например, при лечении онихомикоза пероральным путем.
Кроме того, соединения по изобретению можно применять также местно, например на ноготь, как это следует из результатов описанного ниже анализа in vitro проникновения/распространения:
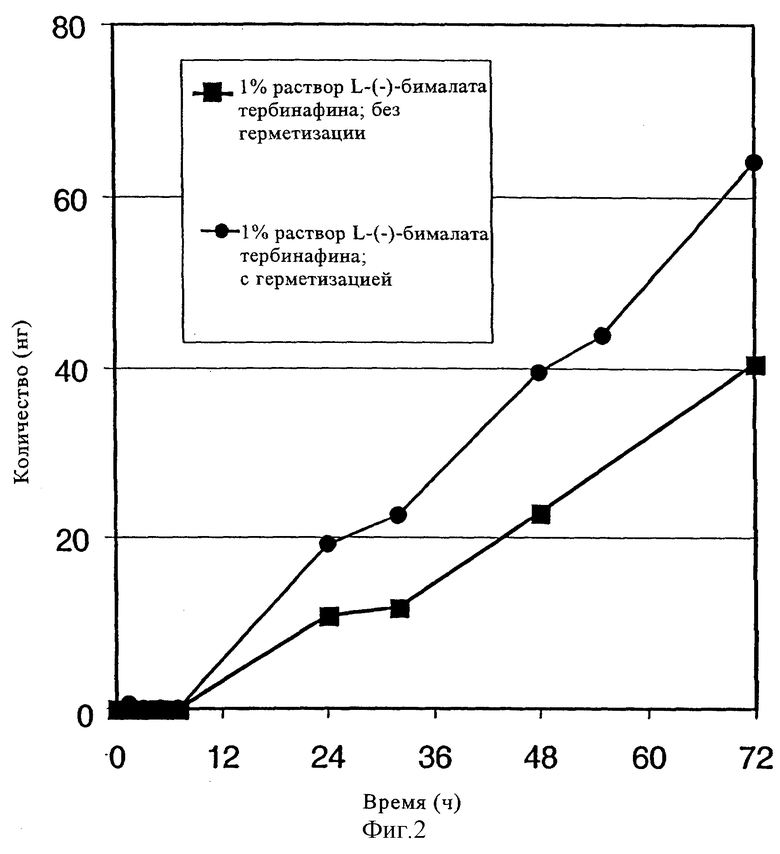
Опыт с использованием ногтей пальцев стопы трупа человека проводили в камере Франца (фиг.1), которую модифицировали для того, чтобы в нее можно было закреплять ногти пальца стопы трупа человека с помощью двух упругих колец, сделанных из силиконового эластомера (полидиметилсилоксана (ПДМС)), который обладает хорошими склеивающими свойствами, для соответствующего закрепления твердых ногтей, при этом для измерения радиоактивности в акцепторной камере использовали жидкостный сцинтилляционный счетчик (ЖСС) (с уровнем чувствительности порядка пикограмма). Каждый опыт проводили в трех повторностях. 90 выбранных случайным образом ногтей выдерживали в течение 72 ч в растворе, содержащем 100 мкл меченного с помощью 14С гидрохлорида тербинафина или L-(-)-бималата (форма А) [раствор 25 мкБк/мл; 1% действующего вещества; 5% 1,2-пропиленгликоля; 2% Cetomacrogol-1000® (полиоксиэтиленгликоль-1000-моноацетата); 25% 94%-ного этанола; 67% дистиллированной воды] (мас.%). Поверхность каждого ногтя, которую подвергали воздействию композиции, имела диаметр 9 мм (приблизительно 64 мм2). Воздействие осуществляли в герметичных (камера, в которую не проникал воздух) и в негерметичных (камера, в которую проникал воздух) условиях.
Несущий радиоактивную метку продукт выявляли в заполненной буфером приемной камере после инкубации в течение приблизительно 8 ч. По данным измерения с помощью ЖСС его концентрация в приемной камере повышается при увеличении времени инкубации и концентрации применяемой композиции. Опыт проводили параллельно в 24 камерах для исследования проникновения. Каждую композицию исследовали в трех повторностях.
Результаты приведены на фиг.2: как в герметичных (черные точки), так и негерметичных (черные квадраты) условиях через 72 ч был выявлен существенный уровень проникновения (соответственно приблизительно 63 и 41 нг).
Кроме того, при создании изобретения неожиданно было установлено, что соединения по изобретению обладают предпочтительными свойствами с точки зрения приготовления композиции. Так, они более легко образуют кристаллы, чем соединения в форме гидрохлорида или свободного основания. Кроме того, кристаллы, например, L-(-)-бималата могут находиться в различных полиморфных формах. Полиморфы обладают различными скоростями растворения, характеристиками размалывания и стабильности, например, в галеновых формах, в которых фармацевтическое действующее вещество находится в твердой форме, таких как таблетки или суспензии, и имеют различную биологическую доступность. Неожиданное наличие полиморфизма дает преимущество с точки зрения процесса обработки, например, в случае полиморфа, обладающего значительной термодинамической устойчивостью в композициях, в которых соединение присутствует в твердой форме, например в таблетках или суспензиях, или полиморфа, характеризующегося особенно высокой скоростью растворения или солюбилизации, в композициях, содержащих растворенное соединение, например в лаках для ногтей. Таким образом, соединения по изобретению являются более пригодными для обработки, например, в случае крупномасштабного производства таблеток; они обладают также предпочтительными свойствами проникновения/распространения и поэтому их легко включать в состав композиций для местного применения, таких как лаки для ногтей. Кроме того, они обладают хорошей растворимостью в воде и во многих органических растворителях, что является предпосылкой для хорошей биологической доступности: так при 25°С L-(-)-бималат имеет растворимость в воде до приблизительно 12-14 мг/мл и >30 мг/мл в этилацетате по сравнению с 6,7 мг/мл в воде и 0,7 мг/мл в этилацетате для гидрохлорида. Кроме того, соединения являются негигроскопичными, что позволяет создавать стабильные композиции при минимальном риске свойственного им химического разложения.
Таким образом, указанные соединения обладают уникальным сочетанием хороших характеристик с точки зрения обработки, хорошей растворимости и отсутствием гигроскопичности, что делает их наиболее пригодными для приготовления фармацевтических композиций, включающих тербинафин.
Кроме того, объектами изобретения являются:
- фармацевтическая композиция, содержащая соединение по изобретению в сочетании по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем,
- фармацевтическая композиция, содержащая соединение формулы I в свободной форме или в форме фармацевтически приемлемой соли, отличной от кислотно-аддитивной соли яблочной кислоты, в случае, когда она получена из соединения по изобретению,
- соединение по изобретению, предназначенное для применения в качестве фармацевтического средства,
- соединение по изобретению, предназначенное для применения при приготовлении лекарственного средства,
- соединение по изобретению в случае, когда оно получено описанным выше способом,
- соединение формулы I в форме свободного основания или соли, отличной от кислотно-аддитивной соли яблочной кислоты, в случае, когда она получена из соединения по изобретению,
- применение соединения по изобретению для приготовления лекарственного средства, предназначенного для лечения, например, путем перорального введения, заболеваний, таких как грибковые заболевания, поддающихся лечению с использованием соединения формулы I в форме свободного основания или в форме соли,
- способ получения фармацевтической композиции, предусматривающий смешение соединения по изобретению по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем, и
- способ профилактики или терапевтического лечения грибковых заболеваний, таких как грибковый синусит или онихомикоз, заключающийся в том, что пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения по изобретению.
Фармацевтические композиции, содержащие соединение по изобретению, предпочтительно включают в состав стандартной дозы лекарственного средства, например, путем заполнения оболочек капсул, например, мягких или твердых желатиновых оболочек капсул, или путем таблетирования, или с использованием какого-либо другого процесса формовки. Таким образом, в изобретении предложены стандартные дозы лекарственного средства, предназначенные для введения один или два раза в день, например, в зависимости от конкретной цели терапии, фазы терапии и т.д., которые содержат соответственно половину или полную суточную дозу. Такие композиции можно вводить два или три раза в неделю. Предпочтительно композиции вводят один раз в день.
Количество соединения по изобретению, естественно, может варьироваться в зависимости, например, от содержания других компонентов, пути введения и требуемого лечения. Однако, как правило, соединение присутствует в количестве от приблизительно 0,1 до приблизительно 35% в пересчете на массу всей композиции. Суммарная суточная доза действующего вещества (в пересчете на количество соединения в форме свободного основания) составляет, например, от приблизительно 50 до приблизительно 500 мг в день, например, 250 мг в день или 400, 600 или 700 мг в день, которую удобно вводить, например, в виде разделенных доз до 4 раз в день. Стандартные дозы лекарственного средства содержат, например, от приблизительно 12,5 до приблизительно 800 мг соединения по изобретению (в пересчете на количество соединения в форме свободного основания) в смеси по меньшей мере с одним твердым или жидким фармацевтически приемлемым носителем или разбавителем.
Соединения по изобретению можно вводить методом, аналогичным методам введения стандартных лекарственных средств, применяемых для таких показаний.
Их можно смешивать с обычными приемлемыми с химиотерапевтической точки зрения носителями или разбавителями и необязательно с другими эксципиентами и вводить, например, перорально, например, в форме таких композиций, как таблетки и капсулы. Предпочтительная композиция в форме таблетки содержит соединение по изобретению, вещество, способствующее прессованию, такое как микрокристаллическая целлюлоза, добавку для обеспечения блеска таблетки, такую как безводный бифосфат кальция, разрыхлитель, такой как гликолят крахмала натрия, и замасливатель, такой как стеарат магния. Предпочтительная композиция в форме капсулы содержит соединение по изобретению, инертный разбавитель и описанные выше безводный разрыхлитель и замасливатель.
В альтернативном варианте соединения можно применять местно, например, в форме композиций, например лосьонов, растворов, мазей или кремов, например, лаков для ногтей, или парентерально или внутривенно. Концентрация действующего вещества, естественно, может варьироваться, например, в зависимости от применяемого соединения по изобретению, требуемого лечения и природы применяемой формы или композиции. В целом удовлетворительные результаты получают, например, при использовании композиций для местного применения, имеющих концентрацию действующего вещества от приблизительно 0,1 до приблизительно 10 мас.%, предпочтительно от приблизительно 0,5 до приблизительно 2 мас.%, наиболее предпочтительно приблизительно 1 мас.%.
Таким образом, в настоящем изобретении предложены новые композиции тербинафина, содержащие соединения по изобретению, которые позволяют устранить или существенно уменьшить встречавшиеся до сих пор проблемы терапии с использованием тербинафина. В частности, они могут содержать тербинафин в достаточно высоких и постоянных концентрациях, что позволяет осуществлять удобное введение пероральным путем один раз в день, при этом одновременно обеспечиваются улучшенная безопасность и переносимость с точки зрения уменьшения побочных действий.
Таким образом, настоящее изобретение позволяет уменьшить количество обработок тербинафином, необходимое для осуществления эффективной терапии, благодаря уменьшению продолжительности обработки тербинафином и улучшения общего профиля безопасности. Кроме того, оно позволяет осуществлять более точную стандартизацию, а также оптимизацию требований к разработке необходимых ежедневных суточных доз для отдельных пациентов, подвергающихся терапевтическому лечению с использованием тербинафина, а также для групп пациентов, подвергающихся такому же терапевтическому лечению. Более точная стандартизация терапевтических режимов, разработанных для конкретных пациентов, позволяет уменьшать величины доз для конкретных групп пациентов, а также снижать требования к режимам, которые необходимо соблюдать, что приводит к существенному снижению стоимости лечения.
Дополнительные фармакокинетические характеристики фармацевтических композиций, содержащих соединения по изобретению, можно определять с помощью стандартных фармакологических опытов (по изучению биологической доступности) на животных и человеке. Например, один из таких стандартных фармакологических опытов можно осуществлять на здоровых некурящих добровольцах, мужчинах или женщинах, в возрасте 18-45 лет, имеющих вес, отличающийся не более чем на 20% от идеального веса тела. Опыт может включать перекрестное введение однократной дозы. Пациенты находятся в домашних условиях в течение 24 ч. Образцы крови отбирают через 1, 2, 4, 8, 16, 32 и 72 ч после введения фармацевтической композиции, содержащей соединение по изобретению, и анализируют на содержание тербинафина. Концентрации тербинафина в крови или плазме можно определять стандартным методом, например, с помощью аналитических методов ЖХВР/УФ или ЖХ-МС. Безопасность оценивают через 1 неделю на основе результатов стандартного опроса, касающегося симптомов побочного действия. Предпочтительно суточная доза соли тербинафина составляет 400, 600 или 700-800 мг в пересчете на количество тербинафина в форме основания. При такой дозе безопасность тербинафина в течение непродолжительного периода лечения является высокой. Пероральные композиции по изобретению предпочтительно обеспечивают величину Сmax, составляющую 100-250%, например 100-150%, по сравнению с таблеткой с быстрым высвобождением, содержащей 250 мг гидрохлорида тербинафина, например, при введении в виде однократной дозы и/или при постоянном лечении, например, при введении один раз в день в течение 7 дней.
Фармакокинетические исследования воздействия концентрации лекарственного средства на кожу и ногти можно осуществлять согласно тем же методам, которые описаны выше для стандартных фармакологических опытов. Например, клинический опыт можно проводить с использованием суточных доз композиций, содержащих соединение по изобретению, при обработке в течение 3-х недель.
Таблетки, содержащие соединения по изобретению, можно применять при тех же показаниях, что и таблетки с быстрым высвобождением на основе гидрохлорида тербинафина. Применимость соединений по изобретению можно оценивать в стандартных клинических опытах или на стандартных моделях с использованием животных. Например, можно оценивать дозы композиций, содержащих соединение по изобретению, которые дают уровни AUC тербинафина в плазме, эквивалентные уровням AUC в плазме, обеспечивающим такое же терапевтическое действие, что и известные пероральные дозируемые формы гидрохлорида тербинафина, например, в виде таблетки. Фармацевтические композиции, содержащие соединение по изобретению, в частности, обладают неожиданно высокой переносимостью с точки зрения указанных выше побочных действий, они вызывают меньшие побочные действия при совместном введении с субстратами CYP2D6, такими как нортриптилин, дезипрамин, перфеназин, метопролол, энкаинид и пропафенон.
На пациентах, страдающих онихомикозом ногтей пальцев ступней, диагноз которого подтвержден с помощью микроскопии и анализов культуры, можно осуществлять рандомизированное двойное, проводимое вслепую исследование с использованием положительного контроля и контроля с использованием плацебо. Обработку проводят в течение 12 недель. Для оценки отсутствия побочных действий клинические испытания следует осуществлять на нескольких сотнях пациентов. Однако терапевтическую эффективность можно оценивать уже на основе результатов испытаний на 25 пациентах возрастом свыше 12 лет. Безопасность оценивают на основе анкеты о побочных действиях, касающихся клинических аспектов и витальных симптомов. Эффективность определяют с помощью микроскопии, процедур культивирования и визуальной оценки признаков и симптомов. Соединения по изобретению эффективны в отношении указанных выше грибов, прежде всего Trichophyton rubrum, Trichophyton mentagrophytes и Epidermophyton floccosum. В группу пациентов входят пациенты, имеющие факторы предрасположенности, такие как нарушение кровообращения, периферическая нейропатия, сахарный диабет, повреждения, обусловленные повторными небольшими травмами, и ограниченные нарушения иммунной системы, а также СПИД. Пациенты имеют (I) дистальный латеральный подногтевой онихомикоз, начинающийся в гипонихии и распространяющийся проксимально в ложе и матриксе ногтя, (II) проксимальный подногтевой онихомикоз, при котором грибок поражает кутикулу и эпонихий, достигая матрикса, после чего он оказывается заключенным в субстанцию пластины ногтя, (III) общий дистрофический онихомикоз и (IV) поверхностный белый онихомикоз. При необходимости концентрации тербинафина в плазме можно определять общепринятым методом или согласно настоящему описанию. Концентрации тербинафина в ногте можно оценивать путем срезания ногтя и последующего его анализа.
Описание чертежей
На чертежах представлены:
фиг.1: схематическое изображение камеры Франца,
фиг.2: результаты анализа проникновения/распространения: количество, обнаруженное в приемной камере (в нг), в зависимости от времени (в ч) в опыте при использовании 1%-ного раствора (L)-(-)-бималата тербинафина:
черные квадраты: в негерметических условиях;
черные точки: в герметических условиях,
фиг.3: картина дифракции рентгеновских лучей на порошке для полиморфной формы А L-(-)-бималата тербинафина (примеры 1 и 3),
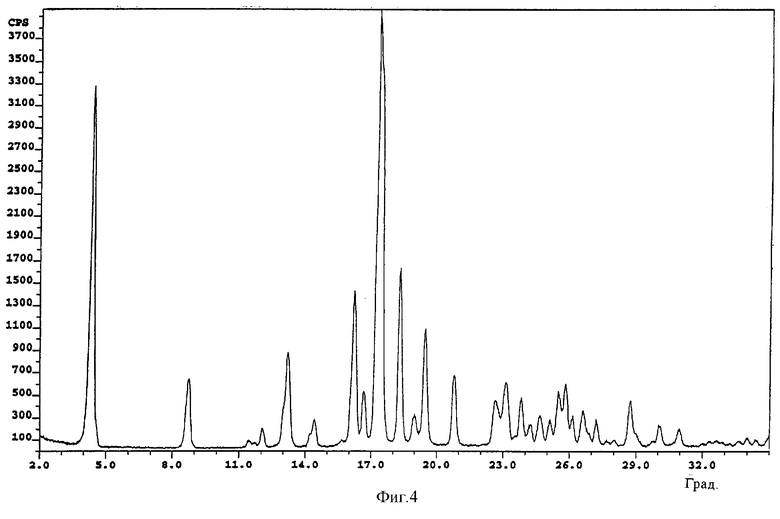
фиг.4: картина дифракции рентгеновских лучей на порошке для полиморфной формы Б L-(-)-бималата тербинафина (пример 2),
фиг.5: картина дифракции рентгеновских лучей на порошке для D-(+)-бималата тербинафина (пример 4),
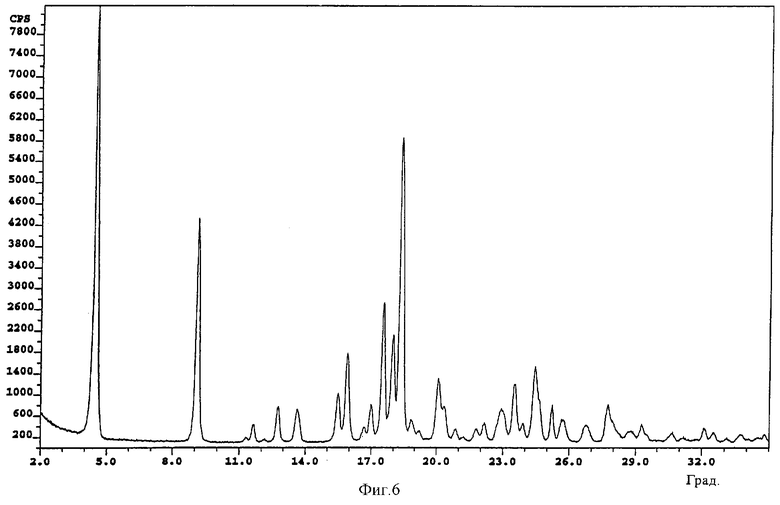
фиг.6: картина дифракции рентгеновских лучей на порошке для DL-(±)-бималата тербинафина (пример 5).
Обозначения на фиг.3-6: cps - интенсивность сигнала (количество импульсов в секунду); Deg - угол дифракции (в градусах).
Изобретение более подробно проиллюстрировано на приведенных ниже примерах. Все температуры даны в градусах Цельсия, tпл обозначает температуру плавления.
Пример 1: L-(-)-бималат тербинафина (полиморфная форма А)
15,54 г (53,32 ммоля) тербинафина в форме основания и 6,79 г (50,65 ммоля) L-(-)-яблочной кислоты растворяют в 125 мл этилацетата при 60°С. Раствор охлаждают до 0°С, при этом происходит медленная кристаллизация. После выстаивания в течение 2 дней при 4° осаждается только небольшое количество кристаллов. После этого смесь перемешивают при 0°С. После перемешивания в течение 8 ч густую суспензию разбавляют 50 мл этилацетата. Смесь фильтруют. Фильтрация происходит медленно. Осадок на фильтре промывают 60 мл этилацетата при 0°С и сушат при 50°С/10 мбар в течение 20 ч. В результате получают указанное в заголовке соединение в форме А (тонкий порошок белого цвета; tпл˜96°С; растворимость при 25°С: в этаноле, смеси этан/вода 2:8 об./об. и в этилацетате >30 мг/мл; в воде ˜12 мг/мл.
Элементарный анализ:
Рассчитано: 70,57% С; 7,34% Н; 3,29% N; 18,80% О
Обнаружено: 70,35% С; 7,39% Н; 3,13% N; 18,94% О
Картина дифракции рентгеновских лучей на порошке приведена на фиг.3.
Пример 2: L-(-)-бималат тербинафина (полиморфная форма Б)
200,0 г (686,2 ммоля) тербинафина в форме основания и 92,02 г L-(-)-яблочной кислоты растворяют в 1500 мл этилацетата при 60°С. Затем прозрачному раствору дают медленно охладиться. При температуре 32°С добавляют 29,2 г затравочных кристаллов формы Б L-(-)-бималата тербинафина (полученных согласно описанному ниже методу) и суспензию перемешивают при комнатной температуре (20-25°С) в течение 20 ч. Затем смесь охлаждают в течение 2 ч до 3°С и перемешивают в течение 4 ч при указанной температуре. Образовавшийся осадок фильтруют. Кристаллы сушат при 50°С и давлении 10 мбар в течение 20 ч. В результате получают указанное в заголовке соединение в форме Б (порошок белого цвета; tпл˜96°С; растворимость при 25°С в воде: 15 мг/мл; [α]20=+7,2°С при 365 нм в метаноле) (для контроля величины положительного вращения 100 мг полученной соли растворяют в 2 мл метиленхлорида, добавляют 3 мл 0,2н. NaOH и измеряют угол вращения для водной фазы, содержащей свободную L-(-)-яблочную кислоту: α20=-0,134°С при 546 нм).
Элементарный анализ:
Рассчитано: 70,57% С; 7,34% Н; 3,29% N; 18,80% О
Обнаружено: 70,54% С; 7,37% Н; 3,26% N; 18,75% О
Картина дифракции рентгеновских лучей на порошке приведена на фиг.4.
Затравочные кристаллы формы Б получают следующим образом:
19,57 г тербинафина в форме основания и 8,55 г L-(-)-яблочной кислоты растворяют в 160 мл этилацетата при 50°C, затем раствор охлаждают в течение 1 ч до 25°C и засевают 5 мг кристаллов L-(-)-бималата тербинафина (форма А), полученными согласно методу, описанному в примере 1; образовавшейся смеси дают выстояться без перемешивания в течение ночи (18 ч), затем медленно перемешивают при комнатной температуре; образовавшуюся желеобразную смесь нагревают до 50°C, после этого полученный прозрачный раствор охлаждают до 25°C и повторно инокулируют 10 мг кристаллов L-(-)-бималата тербинафина (форма А); после чего смеси дают выстояться в течение 3 дней при комнатной температуре без перемешивания. Затем образовавшуюся смесь вновь осторожно перемешивают, после чего происходит медленная кристаллизация. После дополнительного перемешивания в течение 24 ч при комнатной температуре смесь перемешивают в течение 3 ч при 3°C, фильтруют и сушат. В результате получают L-(-)-бималат тербинафина в форме Б.
Пример 3: L-(-)-бималат тербинафина (полиморфная форма А)
400,0 г тербинафина в форме основания (1,3725 моля) и 180,34 г L-(-)-яблочной кислоты (1,3450 моля) растворяют в 3200 мл изопропанола при 35°C. Раствор охлаждают до 25°C в течение 45 мин и засевают 5,72 г L-(-)-бималата тербинафина в форме А (полученного согласно методу, описанному в примере 1). После перемешивания при комнатной температуре в течение 27 ч густую суспензию фильтруют. Фильтрация происходит медленно. Кристаллы промывают 500 мл изопропанола и сушат при 50°C/15 мбар в течение 24 ч. В результате получают указанное в заголовке соединение в форме А (тонкий порошок белого цвета; tпл˜96°C; растворимость при 25°C в этаноле >50 мг/мл, в этилацетате >30 мг/мл, в воде: ˜12 мг/мл).
Элементарный анализ:
Рассчитано: 70,57% С; 7,34% Н; 3,29% N; 18,80% О
Обнаружено: 70,47% С; 7,12% Н; 3,40% N; 18,60% О
Картина дифракции рентгеновских лучей на порошке приведена на фиг.3.
Пример 4: D-(+)-бималат тербинафина
8,70 г (29,8 ммоля) тербинафина в форме основания и 4,00 г (29,8 ммоля) D-(+)-яблочной кислоты растворяют в 100 мл этилацетата при 50°C. Прозрачному раствору дают медленно охладиться и при 25°C добавляют 254 мг затравочных кристаллов D-(+)-бималата тербинафина (полученных согласно описанному ниже методу). Происходит медленная кристаллизация и смесь перемешивают при комнатной температуре (20-25°C) в течение 63 ч. Густую суспензию подвергают фильтрации. Фильтрация происходит очень медленно. Осадок на фильтре промывают 20 мл этилацетата и сушат в течение 20 ч при 50°C/10 мбар. В результате получают указанное в заголовке соединение (tпл˜96°C; растворимость при 25°C в воде: ˜7 мг/мл, перенасыщение, [α]20=-7,0°C при 365 нм в метаноле) (для контроля величины отрицательного вращения 100 мг полученной соли растворяют в 2 мл метиленхлорида, добавляют 3 мл 0,2 н. NaOH и измеряют угол вращения для водной фазы, содержащей свободную D-(+)-яблочную кислоту: α20=+0,137° при 546 нм).
Элементарный анализ:
Рассчитано: 70.57% С; 7,34% Н; 3,29% N; 18,80% О
Обнаружено: 70,42% С; 7,45% Н; 3,20% N; 18,92% О
Картина дифракции рентгеновских лучей на порошке приведена на фиг.5.
Затравочные кристаллы получают следующим образом:
4,35 г тербинафина в форме основания и 2,00 г D-(+)-яблочной кислоты растворяют в 35 мл изопропанола при 80°C. Раствор охлаждают в течение 30 мин до 25°C и вносят 20 мг DL-(±)-малата тербинафина (полученного согласно методу, описанному в примере 3). Затем происходит очень медленная кристаллизация. После перемешивания в течение двух дней при комнатной температуре происходит осаждение лишь небольшого количества кристаллов. Суспензию фильтруют и осадок на фильтре промывают 5 мл изопропанола. Кристаллы сушат при 50°C/10 мбар в течение 20 ч. В результате получают кристаллический D-(+)-бималат тербинафина.
Пример 5: DL-(±)-бималат тербинафина
Суспензию, содержащую 8,70 г тербинафина в форме основания (29,8 ммоля) и 4,00 г DL-яблочной кислоты (29,8 ммоля) в приблизительно 70 мл изопропанола, нагревают до 80°C и получают прозрачный раствор. Раствору дают медленно охладиться. При 25°C добавляют 10 мг L-(-)-бималата тербинафина (полиморфная форма А, полученная согласно методу, описанному в примере 1). Смесь перемешивают в течение 7 ч при комнатной температуре. Образовавшийся осадок фильтруют и осадок на фильтре промывают 30 мл изопропанола. Кристаллы сушат при 50°C/10 мбар в течение 20 ч. В результате получают указанное в заголовке соединение (белый порошок, tпл˜107°C; растворимость при 25°C: в этаноле >50 мг/мл, в этилацетате ˜17 мг/мл, в воде: ˜7 мг/мл).
Элементарный анализ:
Рассчитано: 70,57% С; 7,34% Н; 3,29% N; 18,80% О
Обнаружено: 70,49% С; 7,36 Н; 3,16% N; 18,82% О
Картина дифракции рентгеновских лучей на порошке приведена на фиг.6.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ТЕРБИНАФИНА ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2002 |
|
RU2298402C2 |
| ПРОТИВОГРИБКОВОЕ ПОКРЫТИЕ ДЛЯ НОГТЕЙ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2004 |
|
RU2358718C2 |
| КОМПОЗИЦИЯ ЛАКА ДЛЯ НОГТЕЙ | 2001 |
|
RU2245715C2 |
| СПОСОБ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ДИСФУНКЦИИ, И/ИЛИ НАРУШЕНИЯ СТРУКТУРЫ НОГТЕЙ, ПЛАСТЫРЬ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2310441C9 |
| КОМПОЗИЦИИ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2457830C2 |
| ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 2006 |
|
RU2417073C2 |
| КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ГРИБКОВЫХ ЗАБОЛЕВАНИЙ НОГТЕЙ | 2013 |
|
RU2601896C2 |
| КОМПОЗИЦИИ МЕСТНОГО ПРИМЕНЕНИЯ ДЛЯ НОГТЕЙ | 2006 |
|
RU2408361C2 |
| ПРОТИВОИНФЕКЦИОННЫЕ КОМБИНАЦИИ АКТИВНЫХ ВЕЩЕСТВ И ИХ ПРИМЕНЕНИЕ ДЛЯ МЕСТНОГО ЛЕЧЕНИЯ ГРИБКОВЫХ ЗАБОЛЕВАНИЙ НОГТЕЙ ПАЛЬЦЕВ СТОП И КИСТЕЙ | 2001 |
|
RU2261701C2 |
| НОВАЯ ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 2012 |
|
RU2587064C2 |


Изобретение относится к новой соли тербинафина формулы I

и яблочной кислоты, обладающей антимикотической активностью, способу ее получения и фармацевтической композиции для лечения грибковой инфекции. Наиболее предпочтительна соль в форме L-(-)-бималата. Способ получения соли заключается в том, что соединение формулы I в форме свободного основания подвергают взаимодействию с соответствующей формой яблочной кислоты. Фармацевтическая композиция содержит указанную соль в сочетании по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем. Фармацевтическая композиция может быть приготовлена в форме раствора или в форме лака для ногтей. Предлагаемая соль имеет улучшенные фармакокинетические свойства, что делает ее предпочтительной при изготовлении фармацевтических композиций, адаптированных для системного и местного применения. 3 н. и 5 з.п. ф-лы, 6 ил.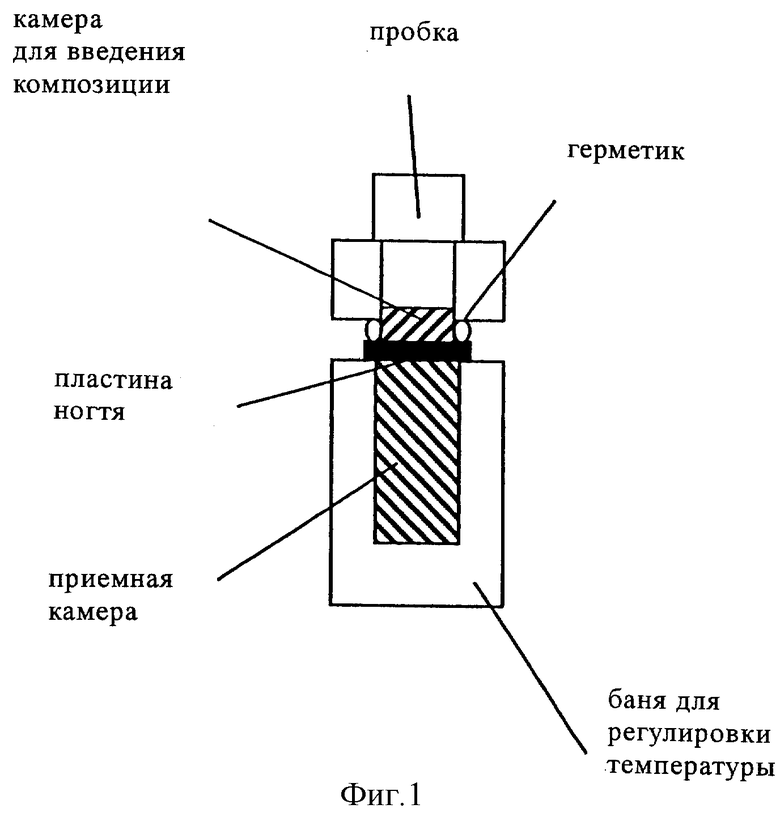
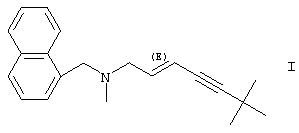
и яблочной кислоты.
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОГРИБКОВЫМ ДЕЙСТВИЕМ | 1992 |
|
RU2110257C1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| 0 |
|
SU318860A1 | |
| Устройство для контроля состояния линии | 1975 |
|
SU515310A1 |
| Контрольная касса | 1930 |
|
SU24587A1 |
Авторы
Даты
2006-12-20—Публикация
2002-02-06—Подача