Изобретение относится к фармацевтическим композициям тербинафина, в частности к твердым лекарственным формам для прерывистого перорального введения, и их применению, в частности, для лечения микозов, прежде всего онихомикоза.
Тербинафин описан, например, в ЕР-А-24587. Он относится к классу аллиламиновых противогрибковых средств. Он поступает в продажу под товарным знаком Lamisil®. Тербинафин обладает эффективностью в отношении широкого спектра микозов как при местном, так и пероральном применении. Тербинафин особенно эффективен в отношении дерматофитов, контагиозных грибов, которые поражают мертвые ткани кожи или ее дериваты, такие как роговичный слой, ногти и волосы.
Тербинафин может находиться в форме свободного основания, например в форме фармацевтически приемлемой соли, например гидрохлорида, лактата, аскорбата или малата, например в форме кислого L(+)-малата.
Предпочтительной кислотно-аддитивной солью является гидрохлорид. Кислотно-аддитивную соль можно получать из свободных оснований общепринятыми методами и наоборот.
Грибки ногтей поражают ногтевое ложе, защищенное твердым внешним ногтем. Таким образом, если инфекция проникла под ноготь, то сам ноготь обеспечивает грибок защитным окружением, которое позволяет расти грибку. Воздействие таких грибков может приводить к неприглядному виду ногтей, грибки серьезно осложняют уход за ногами, оказывают отрицательное влияние на общее качество жизни пациента и его самочувствие и снижают работоспособность пациента. При отсутствии лечения грибки могут приводить к деформации ногтей пальцев стопы и вызывать боль при ходьбе. Кроме того, грибки могут вызывать трещины в коже, что является благоприятным для возникновения бактериальной инфекции. В результате таких инфекций у людей, страдающих диабетом, могут возникать серьезные осложнения, такие как синдром диабетических ног, включая первичные связанные с заболеванием осложнения, например гангрену, что в конце концов может представлять опасность для жизни или приводить к необходимости ампутации. Другие подгруппы пациентов с высокой степенью риска включают пациентов, пораженных вирусом иммунодефицита человека (ВИЧ), пациентов, страдающих синдромом приобретенного иммунодефицита (СПИД), и пациентов с другими типами иммунодепрессии (например, реципиентов трансплантатов и пациентов, подвергающихся продолжительному терапевтическому лечению с использованием кортикостероидов).
Онихомикоз более часто встречается у людей в пожилом возрасте (к 60 годам встречаемость повышается вплоть до 30%). Наиболее распространенными являются заболевания, вызываемые такими грибами, как Microsporum, Trichophyton, например Trichophyton rubrum или Trichophyton mentagrophytes, и Epidermophyton, например Epidermophyton floccosum. Такие инфекции, как правило, рассматривают применительно к пораженным областям тела. Диагноз подтверждают путем выявления патогенного гриба в соскобах в области повреждения либо на основе микроскопического исследования, либо путем выращивания культуры. В медицине широко известно, что онихомикоз трудно поддается диагностике и лечению, прежде всего у пациентов в пожилом возрасте.
Тербинафин можно применять также для лечения онихомикоза ногтей пальцев стопы и ногтей пальцев руки (эпидермофитии ногтей), вызванных дерматофитами. В частности, тербинафин разрешен для лечения эпидермофитии ногтей, вызываемой Trichophyton. Например, в Merck Manual [1987] указано, что лечение пальцев стопы использовавшимся ранее стандартным лекарственным средством гризеофульвином оказалось неэффективным, поскольку для лечения требуется 1-2 года, при этом, как правило, возникают рецидивы и полное излечение является маловероятным.
Для лечения онихомикоза и других заболеваний тербинафин, как правило, вводят один раз в день в виде таблетки с быстрым высвобождением, содержащей 125 или 250 мг тербинафина (в пересчете на свободное основание). Такая таблетка, поступающая в продажу под товарным знаком Lamisil®, обеспечивает высвобождение по меньшей мере 80% тербинафина в течение 30 мин по данным стандартных исследований растворимости в условиях in vitro, проводимых, например, с помощью метода с использованием лопастной мешалки при рН 3. Это касается применения формы с быстрым высвобождением. Срок лечения тербинафином составляет свыше 12 недель (в настоящем описании он обозначен как "период начального лечения". Его клиническое действие проявляется в том, что происходит рост здорового ногтя, вытеснение и замена имеющего неприглядный вид пораженного болезнью ногтя, в котором находятся дебрис и погибшие грибки. Для образования полностью обновленного ногтя пальца стопы требуется приблизительно 10 месяцев.
Хотя в целом считается, что тербинафин является таким же безопасным, как и любое разрешенное к применению лекарственное средство, имеются сведения о побочных действиях, связанных с его применением. Как указано в Physicians' Desk, выявлено большое количество побочных действий, например головные боли, желудочно-кишечные симптомы (включая диарею, диспепсию, абдоминальную боль, тошноту и метеоризм), аномалии, выявляемые при исследовании печени (например, ферментные аномалии, дерматологические симптомы, такие как чесотка, крапивница и сыпь, и нарушения вкуса, например потеря вкуса. Такие побочные действия, как правило, являются слабыми и кратковременными. Другие побочные действия включают симптоматическую идиосинкратическую гепатобилиарную дисфункцию (например, холестатический гепатит), выраженные кожные реакции, такие как синдром Стивенса-Джонсона, нейтропению и тромбоцитопению. Кроме того, побочные действия могут приводить к нарушениям зрения, таким как изменения хрусталика и сетчатки глаза, а также к аллергическим реакциям, включая анафилаксию, усталость, рвоту, артралгию, миалгию и потерю волос. Тербинафин является сильным ингибитором CYP2D6 и может приводить к имеющим клиническое значение побочным действиям при совместном введении с лекарственными средствами, представляющими собой субстраты для этой изоформы, такими как нортриптилин, десипрамин, перфеназин, метопролол, энкаинид и пропафенон. Ниже в настоящем описании все такие проявления сокращенно называются "побочными действиями".
Известны различные фармакокинетические и биофармацевтические свойства тербинафина. Известно, что он хорошо абсорбируется. Пиковые концентрации лекарственного средства в плазме (Сmax), составляющие приблизительно 1 мкг/мл, достигаются в течение 2 ч после введения однократной дозы тербинафина, составляющей 250 мг. Площадь под кривой при измерении зависимости в течение 24 ч (ниже обозначаемая как AUC) составляет приблизительно 4,56 мкг·ч/мл. При введении тербинафина вместе с пищей происходит небольшое увеличение AUC. У пациентов с почечной недостаточностью (например, с клиренсом креатинина ≥ 50 мл/мин) или циррозом печени клиренс тербинафина понижается приблизительно на 50%. В стационарном состоянии, например, когда впадины и пики являются постоянными после приема лекарственного средства в течение нескольких дней, пиковая концентрация тербинафина в крови (Сmax) повышается на 25%, а AUC возрастает в 2,5 раза по сравнению с введением однократной дозы. Эти данные согласуются с эффективным временем полужизни тербинафина, составляющим приблизительно 36 ч.
Фармакокинетические и абсорбционные свойства описаны, например, у J.Faergemann и др., Acta Derm. Venereol. (Stockh.) 77 (1997), сс.74-76 и более ранних публикациях. Однако имеются лишь немногочисленные данные о фармакокинетических характеристиках в периоде стационарного лечения и о фармакокинетических характеристиках после стационарного периода лечения. Хотя была выявлена определенная незначительная абсорбция в нижней области желудочно-кишечного тракта, основная область абсорбции тербинафина точно неизвестна и, как указано выше, нет доказанной в клинических условиях корреляции действия с фармакокинетическим профилем.
Несмотря на очень важную роль тербинафина в противогрибковой терапии, известны случаи возникновения нежелательных побочных действий, которые являлись препятствием для его более широкого применения или введения пероральным путем. Определенные проблемы, выявленные в случае перорального введения тербинафина, неизбежно приводили к ограничениям применения терапии с использованием тербинафина для лечения не очень серьезных или не опасных болезненных состояний, например, эпидермофитии стоп.
Несмотря на то, что были разработаны многочисленные фармацевтические композиции для местного и перорального применения, в настоящее время существует необходимость в создании пригодных для продажи композиций на основе тербинафина, предназначенных для перорального введения, которые являются удобными и приемлемыми для пациентов, прежде всего для детей и пожилых людей. Одной из конкретных проблем при изготовлении пероральной фармацевтической композиции на основе тербинафина является его неприятный, например горький, вкус и/или низкая способность к физической целостности в форме свободного основания. Кроме того, у некоторых пациентов могут возникать нарушение вкуса или потеря вкуса.
При создании изобретения неожиданно было установлено, что тербинафин обладает благоприятным фармакокинетическим профилем даже при использовании высоких доз. Таким образом, его можно применять без нежелательных воздействий, например, на печень, в более высоких суточных дозах, применяемых согласно прерывистой схеме и в течение более короткого периода времени, чем период времени, предназначавшийся ранее для лечения микозов, таких как онихомикоз или грибковый синусит, достигая неожиданного результата, заключающегося в равной или более высокой терапевтической реакции при меньшем воздействии лекарственного средства, что позволяет уменьшать общую дозу лекарственного средства по сравнении с применяемой ранее, например, для непрерывного лечения, приблизительно на 30%. Таким образом, настоящее изобретение позволяет уменьшать продолжительность лечения с помощью тербинафина и общую дозу в течение всего периода лечения, требуемую для осуществления эффективной терапии, уменьшая тем самым время воздействия тербинафина и улучшая общий профиль безопасности.
Кроме того, изобретение позволяет осуществлять более точную стандартизацию, а также оптимизацию требований к применяемым ежедневно дозам для конкретных пациентов, подвергающихся лечению с помощью тербинафина, а также для групп пациентов, подвергающихся такой же терапии. Путем более точной стандартизации режимов терапевтического лечения конкретных пациентов можно уменьшать величины доз для конкретных групп пациентов, а также требования к мониторингу, в результате чего существенно снижается стоимость лечения. Кроме того, поскольку противогрибковая активность тербинафина является не только фунгистатической, но и фунгицидной, его можно применять согласно прерывистой схеме и вводить в течение короткого периода времени, не преследуя лечебных целей, тем самым избегая необходимости профилактического повторного лечения в случае показания, требующего микологического лечения, и достигать при этом повышенной эффективности без соответствующих побочных воздействий.
Благоприятный фармакодинамический профиль тербинафина можно обнаружить, например, в опытах по изучению переносимости при применении высоких доз в течение короткого периода времени. Это установлено, например, в стандартных опытах по исследованию переносимости или фармакокинетических исследованиях, в которых тербинафин в форме с быстрым высвобождением, такой как таблетка, вводили в дозах, превышающих обычные дозы, а именно в опытах, проводимых на собаках породы beagle, по изучению переносимости при пероральном введении (р.о.) лекарственного средства. Измеряли фармакокинетические параметры (токсикокинетические параметры), например tmax, Cmax, Сmax/доза и AUC. Осуществляли также мониторинг содержания следующих веществ: аланинаминотрансферазы, альбумина, щелочной фосфатазы, аспартатаминотрансферазы, кальция, хлорида, общего холестерина, креатинкиназы, креатинина, глюкозы, неорганического фосфора, магния, калия, натрия, общего билирубина, общего протеина, триглицеридов и мочевины, а также гаммаглутамилтрансферазы (ГГТ). Было установлено, что после однократного перорального введения кобелям стандартной таблетки гидрохлорида тербинафина (125 мг в пересчете на основание) в средней дозе 12,0±0,3 мг/кг тербифината (в пересчете на основание) соответствующие величины tmax, Cmax, Сmax/доза составляли соответственно 1 ч; 199±85 нг/мл и 16,6±7,2 (нг/мл)/(мг/кг).
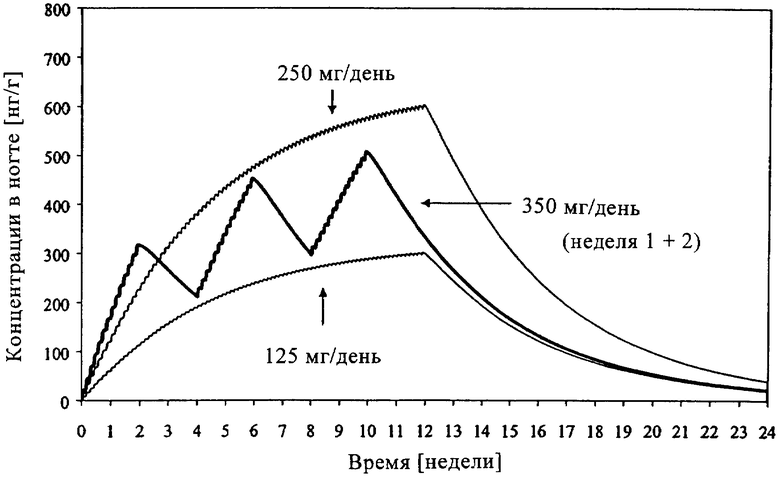
Кроме того, при создании настоящего изобретения в результате широких исследований путем компьютерного моделирования неожиданно было установлено, что, например, при лечении онихомикоза согласно прерывистой схеме с использованием доз, составляющих, например, 350 мг/день, которые вводили в ходе 3 циклов, состоящих из 14 дней введения и 14 дней пропуска, достигали концентраций в ногтях, находящихся в диапазоне концентраций, достигаемых при использовании непрерывного 12-недельного ежедневного лечения, с применением доз, составляющих соответственно от 125 мг/день, которая как известно, является менее эффективной, и до 250 мг/день, которая, как известно, является очень эффективной при лечении онихомикоза, (см. чертеж). Таким образом, можно считать, что периодическая обработка, проводимая согласно указанному выше режиму или его вариантам, является эффективной для пациентов.
Моделирование осуществляли на основе следующих принципов:
а) Концентрации тербинафина в плазме, возникающие при многократном пероральном введении, моделировали на основе известных фармакокинетических параметров при непрерывном введении [J.Nedelman и др. J. Clin. Pharmacol., 36, 1996, cc.452-456; J.Nedelman и др. Biopharm. Drug Dispos. 18, 1997, cc.127-138; и J.Nedelman и др. Eur. J. Drug. Metab., Pharmacocinet., 22, 1997, cc.179-184]. Модель включала центральный, быстро уравновешивающийся (поверхностный) и медленно уравновешивающийся (глубокий) периферический компартменты. Введение лекарственного средства в центральный компартмент представляет собой процесс абсорбции нулевого порядка. Предполагается, что, как обычно, выделение происходило из центрального компартмента.
б) После этого была обнаружена линейная зависимость между концентрацией в ногте [J.Faegergemann и др. Acta Derm. VenereoL, 73, 1993, cc.305-309] и предсказанным на основе модели содержанием лекарственного средства в глубоком периферическом компартменте. Таким образом, количество лекарственного средства в глубоком компартменте может служить пригодным предиктором (предсказателем) концентрации тербинафина в ногте.
Таким образом, в изобретении предлагается новый способ лечения микоза путем введения высоких доз тербунафина в течение короткого промежутка времени, предпочтительно циклически, в результате чего уменьшается общее количество поглощаемого лекарственного средства и, кроме того, оказывается возможным создать соответствующие пероральные галеновы композиции для введения высоких доз лекарственного средства в течение короткого периода времени, которые как правило трудно изготавливать, такие как имеющие соответствующее покрытие и/или системы на основе композиций, состоящих из многих частиц.
Таким образом, одним из объектов изобретения является новая схема введения тербинафина, которая позволяет устранять или существенно уменьшать имеющиеся в данной области проблемы, связанные с применением тербинафина. В частности, она позволяет применять фармацевтические композиции, дающие возможность вводить тербинафин в достаточно высоких концентрациях, что обеспечивает удобное пероральное введение тербинафина один раз в день, сопровождающееся повышенной безопасностью и переносимостью с точки зрения побочных воздействий. Одним из конкретных объектов настоящего изобретения является способ введения тербинафина пациенту, нуждающемуся в лечении тербинафином, предусматривающий прерывистое циклическое введение пациенту тербинафина, где тербинафин вводят в течение более чем одной трети цикла, который ниже в настоящем описании называется "способом, предлагаемым в изобретении").
Например, циклическое введение тербинафина в течение цикла можно осуществлять ежедневно или реже, чем один раз в день, предпочтительно ежедневно, например один раз в день. Предпочтительно тербинафин вводят в течение периода времени, составляющего от более чем одной трети до двух третей, предпочтительно в течение приблизительно половины цикла. Цикл может составлять от приблизительно 10 до приблизительно 50 дней. Предпочтительно цикл составляет 28 дней или календарный месяц. Предпочтительно тербинафин вводят ежедневно последовательно в течение 14 дней 28-дневного или месячного цикла, а именно в течение 14-дневного периода, составляющего приблизительно половину цикла. Предпочтительно используют 3 или 4, прежде всего 3 цикла. Предпочтительно введение осуществляют пероральным путем.
Следует иметь ввиду, что введение тербинафина является эффективным при его введении в течение части, которая превышает треть цикла. Выбор точной продолжительности цикла, в частности 28 дней или календарного месяца, как правило, осуществляют из соображений удобства, принимая во внимание, например, пол пациента.
При необходимости тербинафин можно вводить в каждый второй или третий день. Как правило, общее количество циклов составляет два или больше, предпочтительно 2-5, например 4, прежде всего 3. Предпочтительно вводимую согласно прерывистой схеме дозу тербинафина повышают по сравнению с обычно применяемыми суточными дозами, она составляет от приблизительно 300 до приблизительно 700 мг тербинафина (в пересчете на основание), предпочтительно от приблизительно 300 до приблизительно 450 мг, прежде всего 350 мг/день. Неожиданной является безопасность применения тербинафина в такой дозе согласно способу, предлагаемому в настоящем изобретении. Наиболее предпочтительным является способ введения тербинафина пациенту, нуждающемуся в лечении тербинафином, который основан на использовании трех 28-дневных или месячных циклов, когда в каждом цикле ежедневно однократно вводят пероральным путем 350 мг/день тербинафина (в пересчете на основание) в течение 14 последовательных дней, что приводит к приблизительно 30%-ному уменьшению общего воздействия лекарственного средства (14,7 г) по сравнению с применяемой в настоящее время схемой приема лекарственного средства (12 недель, 250 мг/день, 21 г).
Еще одним объектом настоящего изобретения является применение тербинафина в качестве действующего вещества для приготовления лекарственного средства, предназначенного для применения согласно способу, предлагаемому в настоящем изобретении.
Для удобства такое лекарственное средство, например в форме капсул или хранящееся в бутылках, можно упаковывать в соответствующую коробку, снабженную инструкциями по применению, например для применения согласно указанной выше новой схеме приема лекарственного средства. Например, упаковка может представлять собой коробку, содержащую три или четыре набора, состоящие из 28 капсул, каждая из которых содержит по 175 мг тербинафина (в пересчете на основание), наряду с инструкциями, регламентирующими прием 2 капсул в день в течение 14 последовательных дней в течение первых 2 недель на протяжении трех или четырех последовательных 28-дневных периодов или месяцев.
Еще одним объектом изобретения является упаковка дозируемых форм, содержащая несколько композиций тербинафина, предназначенных для использования согласно способу или применению по изобретению, например прерывистым образом, например тогда, когда удобно, наряду с инструкциями по применению, предпочтительно календарную упаковку, для улучшения удобства необязательно наряду с имеющими такой же вид композициями, представляющими собой плацебо, для применения в оставшейся части цикла, когда тербинафин не вводят.
Предпочтительно период лечения в случае онихомикоза состоит из 3 или 4, прежде всего из 3 циклов. Этот период в настоящее время представляет собой наиболее короткий период лечения рассматриваемого хронического инфекционного заболевания. Неожиданно при создании изобретения было установлено, что применение тербинафина согласно способу, предлагаемому в изобретении, является не менее эффективным, чем применение согласно существующему методу лечения, однако сопровождается меньшими побочными действиями, по сравнению с ожидаемыми.
Указанное выше циклическое лечение удобно применять в сочетании с местной обработкой, например кремом, содержащим тербинафин, например, в концентрации 1 мас.%.
Если в предыдущие годы применяли тербинафин для лечения согласно периодической схеме, то это приводило либо к отрицательным результатам (А.Tosti и др. J. Am. Acad. Dermatol., 34, 1996, cc.595-600), и/или в этих случаях каждый предлагаемый период введения характеризовался меньшей продолжительностью, меньшей начальной дозой и требовалось большее количество повторов (DE 10017996-A1), чем в случае применения согласно настоящему изобретению.
Указанный выше способ, основанный на новой схеме циклического введения тербинафина, можно осуществлять с использованием обычных галеновых форм, например, не имеющих покрытия таблеток с быстрым высвобождением или таблеток с пролонгированным высвобождением (см., например, приведенные ниже примеры А и Б).
Другим вариантом осуществления изобретения являются новые галеновы композиции тербинафина, которые можно вводить преимущественно согласно, например, способу, предлагаемому в настоящем изобретении, и которые позволяют осуществлять наиболее предпочтительное системное введение высоких ежедневных доз лекарственного средства в виде имеющей покрытие и/или состоящей из многих частиц формы, что обеспечивает низкую вариабельность фармакокинетических характеристик и сопровождается незначительными побочными действиями.
Это следует из приведенных ниже данных, полученных при создании изобретения, в опытах на собаках, которые являются неожиданными, свидетельствующие о том, что вариабельность фармакокинетических характеристик при применении стандартной таблетки массой 125 мг с быстрым высвобождением является даже более низкой по сравнению с применением эквивалентной дозы тербинафина в виде состоящей из многих частиц системы (имеющие покрытие минитаблетки из примера 4); было установлено, что вариабельность характеристик при использовании таблетки с быстрым высвобождением, которая уже является низкой, можно дополнительно снижать при использовании системы, состоящей из многих частиц: в то время как при однократном пероральном введении как описано выше кобелям собак породы beagle с помощью стандартной таблетки дозы тербинафина, составляющей 12,0±0,3 мг/кг (в пересчете на основание), средние значения tmax, Сmax, Сmax/доза и AUC составляли соответственно 1 ч; 199±85 нг/мл, 16,6±7,2 (нг/мл)/(мг/кг) и 526±171 нг·ч/мл, для собак, которым вводили имеющие покрытие минитаблетки, содержащие такую же дозу тербинафина, указанные значения составляли соответственно: 0,75 ч; 246±48 нг/мл, 20,5±4,3 (нг/мл)/(мг/кг) и 644±161 нг·ч/мл.
Таким образом, для обеих галеновых форм были выявлены близкие средние значения AUC (644±161 по сравнению с 526±171 нг·ч/мл) и близкие средние значения Сmax; (246±48 по сравнению с 199±85 нг/мл), однако для формы, состоящей из многих частиц, по сравнению со стандартной таблеткой была обнаружена существенно меньшая вариабельность величины Сmax между индивидуумами (стандартное отклонение Сmax составляло ±48 по сравнению с ±85 нг/мл). Кроме того, было установлено, что средние значения tmax для формы, состоящей из многих частиц, и стандартной формы составляли 0,75 и 1 ч соответственно, причем для формы, состоящей из многих частиц, индивидуальные значения варьировались только от 0,5 до 1 ч, тогда как для стандартной формы они варьировались от 0,5 до 2 ч.
Фармакокинетические параметры для обеих композиций получали как для одних и тех же собак, так и с использованием кроссоверной (перекрестной) схемы исследования, таким образом потенциальную вариабельность, связанную с периодом обработки и различиями между животными, можно было исключить. Плазму, содержащую ЭДТК в качестве антикоагулянта, собирали в течение 48 ч после введения дозы и проводили биоанализ с помощью ЖХВР с использованием УФ-обнаружения (измерения проводили при 224 нм) после экстракции образца в системе жидкость-жидкость. Нижний предел обнаружения при использовании указанного биоаналитического метода составлял 1,00 нг/мл плазмы. Перед введением средства собак не кормили. Период вымывания между двумя введениями одной и той же собаке составлял одну неделю. Кормление осуществляли через 6 или более часов после введения дозы.
Таким образом, еще одним объектом настоящего изобретения является новая твердая лекарственная форма тербинафина для перорального введения, которая обеспечивает минимизацию воздействий, связанных, например, с введением высокой дозы, и которая имеет покрытие и/или состоит из многих частиц, например, представляет собой таблетки с покрытием, что обеспечивает меньшее количество случаев возникновения побочных действий/меньшие побочные действия, и/или представляет собой многочисленные легко диспергируемые частицы, что гарантирует воспроизводимое и практически не зависящее от приема пищи прохождение через желудочно-кишечный тракт и обеспечивает большую площадь поверхности, на которой происходит воспроизводимое растворение лекарственного вещества, такие, например, как необязательно имеющие покрытие минитаблетки или пеллеты, заключенные в капсулы, обозначенные ниже в настоящем описании как "композиции, предлагаемые в изобретении".
Прерывистое введение лекарственного средства позволяет вводить не полную дозу, но позволяет вводить высокие суточные дозы: таким образом, повышается возможность возникновения кратковременных побочных действий, а именно
- на системном уровне достигаемые при этом более высокие концентрации в плазме (AUC, Сmax) приводят к повышению риска возникновения побочных действий, связанных с вариабельностью фармакокинетических парамеров, или, например, нарушению вкуса, обусловленному центральной нервной системой; и
- на местном уровне приводят, например, к повышенному риску ощущения горького вкуса тербинафина и/или индуцированных локальных нарушений вкуса.
При создании настоящего изобретения было установлено, что прежде всего предпочтительно использовать системы, состоящие из многих частиц, затем лекарственные средства, снабженные соответствующим покрытием, причем эти две композиции предпочтительно можно объединять друг с другом.
Случаи нарушения вкуса или потери вкуса после введения тербинафина являются относительно редкими и обратимыми. Однако в отдельных случаях побочное действие может продолжаться в течение продолжительного времени, например более 12 недель после прекращения лечения. Вызванные лекарственным средством нарушения вкуса можно разделить на извращение вкуса (дисгевзия) и потерю остроты вкуса (гипогевзия) или полную потерю вкуса (авгезия). Кроме того, может оказаться нарушенным обоняние (гипосмия или аносмия). Такие изменения помимо того, что они являются неприятными, могут влиять на аппетит, приводя к потере веса. Известно, что многие лекарственные средства, том числе противогрибковые агенты гризеофульвин и ампфотерицин В, вызывают нарушения вкуса или потерю вкуса. В этом патогенезе могут участвовать AT1-рецепторы. Тербинафин может приводить также к нарушениям вкуса у небольшого количества пациентов: так, в результате обширного контроля за применением поступающих в продажу лекарственных средств, проведенного в Австрии, Германии, Нидерландах и Великобритании, в ходе которого пациентам ежедневно вводили по 250 мг Lamisil® (тербинафин) в среднем в течение 13,2 недель, при пероральном применении было зарегистрировано 186 случаев нарушения вкуса, что соответствовало общей встречаемости таких нарушений 0,72%, при этом у 0,37% (97 пациентов) была обнаружена первичная дизгевзия (извращение вкуса), а у 0,32% (84 пациента) - авгезия (полная потеря вкуса). После завершения лечения состояние всех пациентов восстановилось.
В ходе 7 других исследований, в которых участвовали 959 пациентов, которых обрабатывали Lamisil® и плацебо, и которые включали 4 исследования с использованием плацебо и 3 исследования при продолжительном применении лекарственного средства, частота нарушений вкуса составляла 3,2% в группе пациентов, которым вводили Lamisil® и плацебо, 1,2% в группе пациентов, которым вводили Lamisil®, при продолжительном применении лекарственного средства и 0,6% в группе пациентов, которых обрабатывали плацебо. У трех пациентов была выявлена авгезия, у других различные формы дисгезии: возникновение соленого вкуса, привкуса металла, невыраженного (пресного) вкуса, горечи. Состояние всех пациентов полностью восстанавливалось, при этом среднее время восстановления составляло 10,2 недели. Хотя они и раздражали пациентов, но ни одно из указанных нарушений вкуса не рассматривалось как опасное для здоровья.
В редких случаях нарушения сохранялись в течение более чем 12 недель. Наибольшая продолжительность нарушения, которая была зарегистрирована, составляла 2,5 года после прекращения приема лекарственного средства.
Таким образом, хотя нарушения вкуса после приема тербинафина являются редкими и не представляют опасности, они могут быть неприятными и вследствие этого до настоящего времени сохраняется потребность в новых средствах, позволяющих лечить микозы, которые не вызывают или вызывают пониженные побочные действия в отношении вкуса. Настоящее изобретение относится также к указанной проблеме и в нем предложен новый подход к ее решению.
Композиции, предлагаемые в настоящем изобретении, приспособлены для высвобождения действующего вещества, представляющего собой тербинафин, в желудке; при этом, например, в 0,04М цитратном буфере с рН 3,0 при 37°С тербинафин высвобождается из композиции и при этом в течение 30 мин растворяется по меньшей мере 50%, например по меньшей мере 70%, предпочтительно по меньшей мере 80%.
Частицы, входящие в систему, состоящую из многих частиц, имеют диаметр от приблизительно 0,5 до приблизительно 4 мм. Они не представляют собой гранулы (обычно размер частиц не превышает приблизительно 0,5 мм) и представляют собой, например, таблетки, пеллеты или минитаблетки. Таблетками, пеллетами или минитаблетками можно заполнять капсулы, например твердые желатиновые капсулы, или саше. Как правило, для одного введения используют несколько пеллетов или минитаблеток для обеспечения требуемой общей суточной дозы тербинафина.
Частицы предпочтительно представляют собой минитаблетки или пеллеты, т.е. они находятся в форме, которая позволяет легко вводить высокую дозу действующего вещества. Понятие "минитаблетки" обозначает небольшие таблетки, общая масса которых без нанесенного покрытия составляет от приблизительно 3 до приблизительно 10 мг, например от приблизительно 4 до приблизительно 7 мг, например приблизительно 6 мг. Минитаблетки могут иметь любую форму, которую специалист считает удобной, например сферическую, например, с диаметром от приблизительно 0,5 до приблизительно 4 мм, например от 1,4 до 4 мм или от 2 до 4 мм; или цилиндрическую, например, выпуклую верхнюю поверхность и выпуклую нижнюю поверхность, и, например, диаметр и высота цилиндра независимо друг от друга могут составлять от приблизительно 0,5 до приблизительно 4 мм, например от 1 до 3 мм; или они могут представлять собой двояковыпуклые круглые минитаблетки, например, у которых высота и диаметр приблизительно одинаковы и составляют от приблизительно 0,5 до приблизительно 4 мм, например от 1,5 до 4 мм, предпочтительно от 1,8 до 2,3 мм,
Минитаблетки могут не иметь покрытия или могут иметь покрытие, состоящее из одного или нескольких слоев.
Согласно одному из вариантов осуществления изобретения минитаблетки не имеют покрытия. В другом варианте осуществления изобретения они имеют покрытие, состоящее только из гидроксипропилметилцеллюлозы (ГПМЦ), например ГПМЦ 603, поставляемой в продажу в виде Pharmacoat® 603 (см., например, ниже Н.Р.Fiedler, в указанном месте, с.1172). Согласно еще одному варианту осуществления изобретения покрытие(я) содержит(ат) вещество, маскирующее вкус, например полиакрилат, предпочтительно Eudragit®, такой как Eudragit®-E, или Eudragit®-RD100 или - RS/RL (см. справочник фармацевтических эксципиентов, ниже в указанном месте, с.362), прежде всего Eudragit®-E. Еще в одном варианте осуществления изобретения на них наносят тройное покрытие, например, из ГПМЦ или полиэтиленгликолей (ПЭГ) для того, чтобы еще более минимизировать любое взаимодействие между минитаблеткой и, например, капсулой. Согласно следующему варианту осуществления изобретения покрытие не содержит пластификатора, такого как дибутилсебацинат, или пластификатора, представляющего собой жирную кислоту, такую как стеариновая кислота, например стеариновая кислота NF (Национальный формуляр. Фармакопея США (USP)). Согласно еще одному варианту осуществления изобретения их не капсулируют. Еще в одном варианте осуществления изобретения желатин, представляющий собой материал, из которого изготавливают капсулу, заменяют на альтернативные материалы для изготовления твердых капсул, например ГПМЦ или крахмал.
Аналогичный подход, описанный выше для минитаблеток, применим с соответствующими изменениями для пеллетов; пеллеты предпочтительно имеют диаметр от приблизительно 0,5 до приблизительно 2 мм.
Композиции, предлагаемые в изобретении, приготавливают таким образом, чтобы они обеспечивали оптимальную доставку лекарственного средства, например они могут не иметь покрытия или предпочтительно иметь соответствующее покрытие. Таким образом, объектом изобретения является также твердая лекарственная форма тербинафина для перорального введения, которая представляет собой, например, имеющие покрытие драже или имеющие покрытие таблетки, пеллеты или минитаблетки. Кроме того, объектом изобретения является твердая лекарственная форма тербинафина для перорального введения, которая состоит из многих частиц, например, необязательно имеющих покрытие минитаблеток или пеллетов, например, заключенных в капсулу. Кроме того, объектом изобретения является новая твердая имеющая покрытие и/или состоящая из многих частиц лекарственная форма тербинафина для перорального введения, которая обладает маскирующими вкус свойствами и/или предупреждает нарушение вкуса или потерю вкуса и связанные с этим побочные действия, такие как уменьшение аппетита и потеря веса.
Пригодные материалы для нанесения покрытия для композиций, предлагаемых в изобретении, включают:
I) фармацевтически приемлемые производные целлюлозы, такие как
этилцеллюлоза (ЭЦ), гидроксипропилцеллюлоза (ГПЦ),
гидроксипропилметилцеллюлоза (ГПМЦ), фталат
гидроксипропилметилцеллюлозы (ФГПМЦ) или фталат ацетата целлюлозы (ФАЦ);
II) полиакрилаты, прежде всего полиметакрилаты, предпочтительно:
а) сополимер, образованный из мономеров, выбранных из метакриловой кислоты, эфиров метакриловой кислоты, акриловой кислоты и эфиров акриловой кислоты;
б) сополимер, образованный из мономеров, выбранных из бутилметакрилата, (2-диметиламиноэтил) метакрилата и метилметакрилата; или
в) сополимер, образованный из мономеров, выбранных из этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата;
например, поступающих в продажу от фирмы Rohm GmbH под товарным знаком Eudragit®-E.
III) фталат поливинилацетата (ФПВА);
IV) поливиниловые спирты;
V) поливинилпирролидоны (ПВП);
VI) сахара, такие как сахароза или глюкоза, или сахароспирты, такие как ксилит или сорбит;
VII) шеллак; и
VIII) смеси указанных соединений.
Предпочтительными производными целлюлозы, указанными в I), являются, например, модифицированные целлюлозы, например
гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза и
гидроксипропилметилцеллюлоза, например гидроксипропилцеллюлоза,
характеризующаяся содержанием гидроксипропила примерно от 5 до 16 мас.% и вязкостью в 2 мас.%-ных водных растворах от приблизительно 2,0 до приблизительно 20 сП (мПа·с), предпочтительно от приблизительно 2,0 до приблизительно 6,0, например 3,0 сП, например
гидроксипропилметилцеллюлоза (ГПМЦ) (например, типа 2910 согласно USP, 3 сП), поступающая в продажу под товарным знаком Pharmacoat® 603.
Особенно предпочтительными полиакриловыми полимерами, указанными в разделе II) являются:
1) сополимеры (1:1), полученные из мономеров, выбранных из метакриловой кислоты и (низш.)алкиловых эфиров метакриловой кислоты, такие как сополимеры (1:1), полученные из метакриловой кислоты и метилакрилата, поступающие в продажу под товарным знаком Eudragit® L, Eudragit® L100 и сополимер (1:1) метакриловой кислоты и этилового эфира акриловой кислоты, поступающий в продажу под товарным знаком Eudragit® L100-55;
2) сополимер (1:2:1), полученный из бутилметакрилата, (2-диметиламиноэтил)метакрилата и метилметакрилата, поступающий в продажу под товарным знаком Eudragit® E; и
3) сополимер (1:2:0,2), полученный из этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата, поступающий в продажу под товарным знаком Eudragit® RL; или соответствующий сополимер (1:2:0,1), поступающий в продажу под товарным знаком Eudragit® RS; или сополимер (1:2:0,2), полученный из этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата, который в сочетании с карбоксиметилцеллюлозой поступает в продажу под товарным знаком Eudragit® RD.
Указанная выше в 3) группа полиакрилатов, как правило, содержит катионные эфирные группы. Примерами таких катионных групп являются диалкиламиноалькильные группы, например диметиламиноалкильные группы. Наиболее предпочтительными катионными группами являются группы четвертичного аммония, предпочтительно три (алкил) аминоалкильная группа. Примерами таких групп являются триметиламиноэтильные эфирные группы. Полиакрилат может содержать определенные карбоксильные группы в свободной форме или в форме анионов солей, например анионов хлорида, для уравновешивания катионных групп. Соотношение катионных групп и нейтральных групп предпочтительно составляет от 1:10 до 1:50, например от 1:10 до 1:30.
Полиакрилаты, входящие в группу, указанную выше в II), имеют среднюю молекулярную массу от приблизительно 50000 до приблизительно 500000, например приблизительно 150000.
Предпочтительно материалы для нанесения покрытия содержат ГПМЦ, различные типы Eudragit или сахар. Было установлено, что полиакрилаты, указанные в II), прежде всего Eudragit® E, наиболее пригодны для нанесения покрытия на твердые лекарственные формы, содержащие тербинафин в форме свободного основания, а также в форме его солей, например гидрохлорида тербинафина, например, вследствие того, что покрытие на основе Eudragit® E не обладает быстрой растворимостью во рту при нейтральном значении рН, а растворяется только при рН ниже 5, что препятствует растворению имеющего горький вкус тербинафина до его попадания в желудок.
Указанные выше материалы для нанесения покрытия можно применять в смеси с другими эксципиентами, которые обычно используют в композициях для нанесения покрытий, например тальком, стеаратом магния или диоксидом кремния, например, синтетической аморфной кремниевой кислотой типа Siloid® (фирма Grace), например Siloid® 244 FP, или коллоидным диоксидом кремния, например Aerosil®, например Aerosil® 200, или смачивающими агентами, например додецилсульфатом натрия или указанными выше полиэтиленгликолями или полисорбатами.
Материалы для нанесения покрытия могут включать дополнительные эксципиенты, например пластификаторы, такие как триэтилцитрат, например Citroflex® (например, от фирмы Morflex); триацетин; различные фталаты, например диэтил- или дибутил фталаты; диэтил- или дибутилсебацинаты; жирные кислоты или их смеси, например лауриловую, миристиновую, пальмитиновую или стеариновую ксилоту; спирты, например лауриловый или стеариловый спирт; смеси моно- или диглицеридов типа Myvacet® (фирма Eastman), например Myvacet® 9-40; указанные выше полиэтиленгликоли, например, имеющие молекулярную массу приблизительно от 6000 до 8000; а также блок-сополимеры этиленоксида/пропиленоксида типа полоксамеров, например типа Pluronic® (фирма BASF) или Synperonic® (фирма ICI), такие как Pluronic® F68 (полоксамер 188), имеющий температуру плавления приблизительно 52°С и молекулярную массу приблизительно от 6800 до 8975, или Synperonic® РЕ L44 (полоксамер 124); порошкообразные антиадгезивы для отделения от форм, например трисиликат магния; крахмал; или синтетическую аморфную кремниевую кислоту типа Syioid®, например Syloid® 244FP.
Согласно одному из вариантов осуществления изобретения на твердые лекарственные формы можно наносить одно или предпочтительно два или более покрытий, которые наносят одно за другим. В одном из вариантов осуществления изобретения на твердые лекарственные формы можно сначала наносить первое (например, защитное) покрытие, которое наносят непосредственно на твердую лекарственную форму и которое содержит, например, ГПМЦ, и затем на первое покрытие наносят второе (например, маскирующее вкус) покрытие, которое содержит, например, Eudragit®, предпочтительно Eudragit® E или Eudragit® RD100 или этилцеллюлозу.
Еще одним объектом изобретения являются твердые лекарственные формы, которые могут иметь дополнительное покрытие, например слой материала, препятствующего прилипанию, который наносят на одно из указанных выше покрытий, например, содержащий продукт на основе коллоидного диоксида кремния, например Aerosil®, который может предотвращать прилипание твердых дозируемых форм друг к другу или к стенкам контейнера, например капсулы.
Как правило, общая масса покрытия, состоящего из материалов для покрытия, указанных в I)-V), составляет от приблизительно 0,5 до приблизительно 10 мг/см2 площади поверхности композиции, не имеющей покрытия, например от приблизительно 1 до приблизительно 4 мг/см2, например, оно составляет приблизительно 1,5 мг/см2. Согласно наиболее предпочтительным вариантам осуществления изобретения для таблетки с покрытием, содержащей 350 мг тербинафина (в пересчете на основание), масса покрытия составляет от приблизительно 3 до приблизительно 14 мг, а для минитаблетки с покрытием, содержащей приблизительно 6,5 мг тербинафина (в пересчете на основание), масса покрытия составляет от приблизительно 0,5 до приблизительно 2 мг.
Как правило, общая масса материалов покрытия, указанных в VI)-VII), составляет от приблизительно 10 до приблизительно 200% в пересчете на массу ядра, предпочтительно от приблизительно 50 до приблизительно 100% в пересчете на массу ядра.
Масса тербинафина в пересчете на основание может составлять от приблизительно 0,1 до приблизительно 95%, например от приблизительно 20 до приблизительно 90%, предпочтительно от приблизительно 30 до приблизительно 80%, наиболее предпочтительно от приблизительно 50 до приблизительно 60% в пересчете на общую массу композиции.
Твердые лекарственные формы, как правило, могут содержать разрыхлители, например такие фармацевтические эксципиенты, которые облегчают дезинтеграцию твердой лекарственной формы при ее помещении в водную окружающую среду, и они могут содержать, например,
(I) встречающиеся в естественных условиях крахмалы, такие как кукурузный крахмал, картофельный крахмал и т.п.; непосредственно сжимаемые крахмалы, например Sta-rx® 1500; модифицированные крахмалы, например карбоксиметильные крахмалы и натрийгликолят крахмала, поступающие в продажу под торговой маркой Primojel®, Explotab®, Explosol®; и такие производные крахмала, как амилоза;
(II) сшитые поливинилпирролидоны, например кросповидоны, например Polyplasdone® XL и Kollidon® CL;
(III) альгиновую кислоту и альгинат натрия;
(IV) соли сополимера метакриловой кислоты/дивинилбензола, например Amberlite® IRP-88; и
(V) сшитую натрийкарбоксиметил целлюлозу, поступающую в продажу, например, под товарными знаками Ac-di-sol®, Primellose®, Pharmacel® XL, Explocel® и Nymcel® ZSX.
Предпочтительными разрыхлителями являются вещества из указанных выше классов (I) и (II), наиболее предпочтительными являются Starx®, Primojel® и Polyplasdone®.
Разрыхлитель может присутствовать в количестве от приблизительно 1 до приблизительно 50%, например от приблизительно 5 до приблизительно 40% в пересчете на общую массу композиции без покрытия.
Еще одним объектом изобретения является композиция, предлагаемая в изобретении, в которой массовое соотношение тербинафина (в пересчете на свободное основание) и разрыхлителя составляет от приблизительно 1:0,01 до приблизительно 1:20, например от приблизительно 1:0,05 до приблизительно 1:5, предпочтительно от приблизительно 1:0,05 до приблизительно 1:1.
Композиции, предлагаемые в изобретении, могут включать также другие компоненты, обычно применяемые при приготовлении лекарственных форм, например твердых лекарственных форм. Эти компоненты включают среди прочего связующие вещества; наполнители и пластификаторы; замасливатели, например стеарат магния; и вещества, способствующие скольжению, например диоксид кремния, например, в частности, продукты на основе коллоидного диоксида кремния, которые поступают в продажу под товарным знаком Aerosil® (см. в указанном месте Н.Р.Fiedler (ниже) с.115; Handbook of Pharmaceutical Excipients в указанном месте (ниже) с.424).
Пригодными связующими веществами являются:
(I) крахмалы, например картофельный крахмал, пшеничный крахмал или кукурузный крахмал;
(II) камеди, такие как трагакантовая камедь, аравийская камедь или желатин;
(III) микрокристаллическая целлюлоза, например продукты, известные под товарными знаками Avicel®, Filtrak®, Heweten® или Pharmacell®;
(IV) модифицированные целлюлозы, например гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилметилцеллюлоза, например гидроксипропилцеллюлоза, имеющая содержание гидроксипропильных звеньев от приблизительно 5 до 16 мас.% и вязкость в 2 мас.%-ных водных растворах от приблизительно 2,0 до приблизительно 20 сП (мПа·с), предпочтительно от приблизительно 2,0 до приблизительно 6,0, например 3,0 сП, например гидроксипропилметилцеллюлоза (ГПМЦ) (например, типа 2910 согласно USP, 3 сП), поступающая в продажу под товарным знаком Pharmacoat® 603; и
(V) поливинилпирролидон, например, поступающий в продажу под товарными знаками Povidone®, Kollidon® или Plasdone®.
Предпочтительным связующим веществом является ГПМЦ (Pharmacoat®). Связующее вещество может присутствовать в количестве от приблизительно 0,5 до приблизительно 50%, например от приблизительно 1 до приблизительно 40%, например от приблизительно 1 до приблизительно 25%, например от приблизительно 1 до приблизительно 15%, предпочтительно от приблизительно 1 до приблизительно 8% в пересчете на массу композиции без покрытия.
Еще одним объектом изобретения является композиция, предлагаемая в изобретении, в которой массовое соотношение тербинафина (в пересчете на основание) и связующего вещества составляет от приблизительно 1:0,01 до приблизительно 1:10, например от приблизительно 1:0,01 до приблизительно 1:1, предпочтительно от приблизительно 1:0,01 до приблизительно 1:0,1, наиболее предпочтительно приблизительно 1:0,04.
В качестве наполнителей и пластификаторов используют эксципиенты, которые обладают предпочтительными свойствами в качестве наполнителей и пластификаторов, и они включают:
(I) практически нерастворимые в воде эксципиенты, такие как микрокристаллическая целлюлоза (которую можно считать также слабым разрыхлителем), например Avicel®, Pharmacel®, Emnocell®, Vivapurl®, предпочтительно Avicel® (фирма FMC Corp.), например, типа Avicel® PH101, 102, 105, RC 581 или RC 591 (см. Fiedler в указанном месте (ниже), с.216);
(II) практически нерастворимые в воде эксципиенты, такие как обладающие способностью к спрессовыванию сахара, например лактоза, сахароза, амилоза, декстроза, маннит и инозит, предпочтительно лактоза; и
(III) дигидрат вторичного кислого ортофосфата кальция, например Emcompress®, или безводный вторичный кислый фосфат кальция, например Fujicalin®.
Масса наполнителя или пластификатора, если они присутствуют, может составлять от приблизительно 0,1 до приблизительно 50%, например от приблизительно 1 до приблизительно 40%, предпочтительно от приблизительно 5 до приблизительно 30% в пересчете на общую массу композиции без покрытия.
Еще одним объектом изобретения является композиция, предлагаемая в изобретении, в которой массовое соотношение тербинафина (в пересчете на основание) и наполнителя или пластификатора составляет от приблизительно 1:0,01 до приблизительно 1:100, например от приблизительно 1:0,01 до приблизительно 1:20, предпочтительно от приблизительно 1:0,1 до приблизительно 1:10, особенно предпочтительно от приблизительно 1:0,1 до приблизительно 1:5, наиболее предпочтительно приблизительно 1:0,2.
Композиции, предлагаемые в изобретении, могут содержать также пригодный забуферивающий компонент, например соль или кислоту, которые частично диссоциируют в водном растворе, и включают такие забуферивающие компоненты, которые после дезинтеграции композиции в водной среде (например, в полости рта) при обработке избытком воды, например, 5-100 мл, способны поддерживать значение рН, при котором тербинафин остается практически нерастворимым, например в диапазоне кислых значений рН, например при рН выше 4, предпочтительно от приблизительно 5 до приблизительно 6. Примерами пригодных буферов являются карбонатные, цитратные, ацетатные, фосфатные, фталатные, тартратные соли катионов щелочных и щелочно-земельных металлов, таких как натрий, калий, магний и кальций. Предпочтительными забуферивающими агентами являются, например, карбонат кальция, тринатрийцитрат и бикарбонат натрия. Для достижения требуемого значения рН забуферивающие агенты можно применять индивидуально или в любой пригодной комбинации, при этом крепость буфера может составлять от приблизительно 0,01 до приблизительно 1 моль/л, предпочтительно от приблизительно 0,01 до приблизительно 0,1 моль/л.
Молярное соотношение тербинафина (в пересчете на основание) и забуферивающего компонента может составлять от приблизительно 1:0,02 до приблизительно 1:10, например от приблизительно 1:0,2 до приблизительно 1:10, предпочтительно от приблизительно 1:0,5 до приблизительно 1:5, более предпочтительно от приблизительно 1:0,5 до приблизительно 1:2.
Следует иметь в виду, что под объем изобретения подпадают:
а) в качестве разрыхлителя любые из компонентов, указанных в I)-V), индивидуально или в сочетании с одним или несколькими другими компонентами, указанными в I)-V);
б) в качестве связующего вещества и наполнителя или пластификатора любые из указанных выше соединений индивидуально или в сочетании; и
в) в качестве забуферивающего компонента любые из указанных выше буферов индивидуально или в сочетании.
Композиции, как правило, могут включать также одну или несколько добавок или ингредиентов в количестве, например, от приблизительно 0,01 до приблизительно 5% в пересчете на общую массу композиции без покрытия, например: подслащивающие вещества, например сорбит, сахарин, аспартам, ацесульфам или сахара, такие как глюкоза, фруктоза или сахароза; корригенты, например, придающие шоколадный, кокосовый, банановый, клубничный или ванильный вкус; и т.д. При необходимости можно применять добавки к сахарному или шеллачному покрытию, обычно используемые в кондитерской промышленности.
Специалист в данной области в целом может определять необходимые пропорции в каждом отдельном случае. Все указанные выше пропорции и диапазоны относительных масс следует рассматривать как рекомендованные в качестве предпочтительных или пригодных для конкретного случая, но не направленных на ограничение объема изобретения в его наиболее широком смысле.
Особенно предпочтительными композициями, предлагаемыми в изобретении, являются имеющие покрытие минитаблетки или пеллеты, где покрытие представляет собой полиакрилатное покрытие (маскирующее вкус), предпочтительно из Eudragit® E или Eudragit® RD100, наиболее предпочтительно из Eudragit® E, где полиакрилатное покрытие и содержащее тербинафин ядро необязательно отделены друг от друга быстро растворяющимся (защитным) покрытием, состоящим предпочтительно из производного целлюлозы, такого как ГПМЦ, и необязательно покрытые еще одним слоем, предотвращающим прилипание минитаблеток или пеллетов друг к другу или к оболочке капсулы, например, включающим коллоидную двуокись кремния, такую как Aerosil® 200; наиболее предпочтительными являются композиции, описанные в примерах 5, 8, 9 и 10, предпочтительно в примерах 5 и 8, прежде всего в примере 8.
Согласно одному из объектов изобретения полиакрилатное (маскирующее вкус) покрытие отделяют от ядра с помощью описанного выше быстро растворяющегося (защитного) покрытия.
Еще одним объектом изобретения является способ получения описанной выше имеющей покрытие композиции, предлагаемой в изобретении, предусматривающий нанесение требуемого покрытия на соответствующую не имеющую покрытия предшествующую форму композиции, предлагаемую в изобретении, согласно общепринятым методам, например, как описано в Remington's Pharmaceutical Sciences, 18-е изд., под ред. Alfonso R.Gennaro, Истон, шт.Пенсильвания, изд-во Mack (1990); и у К.Bauer и др. Uberzogene Arzneiformen, изд-во Wissensch. VG, Штуттгарт, 1988; содержание которых включено в настоящее описание в качестве ссылки. Например, покрытие можно наносить в обычном не имеющем перфорации чане или в перфорированном чане с помощью метода Accela Cota, или метода нанесения покрытия с помощью погруженной лопасти, или метода нанесения покрытия в псевдоожиженном слое.
Получаемые таким образом композиции, предлагаемые в изобретении, имеют приемлемый вкус и являются удобными для приема пациентами и обладают хорошей переносимостью для пациентов благодаря более легкому введению и приему внутрь. Кроме того, композиции, предлагаемые в настоящем изобретении, предпочтительно имеющие покрытие, предотвращают нарушение вкуса или потерю вкуса, что, по-видимому, обусловлено тем, что предотвращается взаимодействие тербинафина с вкусовыми рецепторами, находящимися в полости рта, прежде всего на языке.
Таким образом, композиции, предлагаемые в изобретении, которые, как правило, находятся в твердой форме, например в форме таблетки с покрытием или имеющих покрытие пеллетов или минитаблеток, или драже (т.е. таблеток, имеющих покрытие, содержащее сахар и/или сахароспирты), предпочтительно в форме имеющей покрытие таблетки или имеющих покрытие минитаблеток или пеллетов, можно вводить непосредственно или при необходимости, например в случае имеющих покрытие пеллетов или минитаблеток, в диспергированном, например, в ложке, перед употреблением виде (но предпочтительно в не полностью растворенном виде) в небольшом количестве жидкости или полужидкости, например в воде, молоке, йогурте или соке.
Кроме того, композиции, предлагаемые в изобретении, обладают неожиданно высокой физической и химической стабильностью, например, в течение двух или более лет. Физическую и химическую стабильность можно оценивать общепринятым методом, например, композиции можно тестировать путем измерения времени растворения, дезинтеграции и/или теста на твердость, например, после хранения при комнатной температуре, т.е. при 25°С, и/или после хранения при 40°С. Вкус композиций можно оценивать согласно стандартным клиническим опытам.
Частицы состоящей из многих частиц системы, предлагаемой в изобретении, например минитаблетки или пеллеты, можно упаковывать обычным образом, например, в бутылку или заключать в капсулы, которые необязательно имеют окраску. Такие капсулы могут состоять, например, из двух частей, причем каждая часть может иметь различную окраску.
Композиции, предлагаемые в изобретении, можно использовать в тех случаях, когда показано применение тербинафина, например для следующих состояний: онихомикоз, вызванный дерматофитными грибами, грибковый синусит, дерматомикоз волосистой части головы, микозов кожи, для лечения дерматомикоза гладкой кожи, пахового дерматомикоза, эпидермофитии стоп и инфекции кожи, вызываемые дрожжами рода Candida, например Candida albicans, системного микоза, микоза, вызываемого устойчивыми к азолу штаммами, например, в сочетании с ингибитором 14-α-метилдиметилазы, или инфекций, вызываемых Helicobacter pylori.
Композиции наиболее эффективны для лечения онихомикоза.
Еще одним объектом настоящего изобретения является способ лечения микоза у человека, например онихомикоза, предусматривающий введение фармацевтически эффективного количества композиции, предлагаемой в изобретении, пациенту, нуждающемуся в таком лечении.
Кроме того, в изобретении предлагается способ ингибирования или уменьшения нарушения вкуса или потери вкуса и связанных с этим побочных действий, возникающих после введения тербинафина, предусматривающий введение пациенту, предрасположенному к нарушению вкуса или потере вкуса, композиции, предлагаемой в изобретении.
Кроме того, объектом изобретения является применение композиции, предлагаемой в изобретении, для приготовления лекарственного средства, предназначенного для лечения микозов у человека, в частности онихомикоза.
Кроме того, объектом изобретения является применение композиции, предлагаемой в изобретении, для ингибирования или уменьшения нарушения вкуса или потери вкуса и связанных с этим побочных действий, таких как уменьшение аппетита и потеря веса после введения тербинафина.
Еще одним объектом изобретения является применение композиции, предлагаемой в изобретении, для приготовления лекарственного средства, предназначенного для применения согласно способу, предлагаемому в настоящем изобретении.
Пригодность композиций, предлагаемых в настоящем изобретении, можно продемонстрировать с помощью стандартных тестов по оценке биологической доступности или на стандартных моделях с использованием животных, например, путем оценки доз, которые приводят к уровням тербинафина в крови, которые эквивалентны уровням, вызывающим терапевтическое действие, достигаемым при введении известных пероральных дозируемых форм тербинафина, например таблетки. Как правило, суточные дозы составляют от приблизительно 1 до приблизительно 10 мг/кг, например от приблизительно 1,5 до приблизительно 5 мг/кг, или, например, от приблизительно 3 до приблизительно 4 мг тербинафина (в пересчете на основание)/кг веса тела. Соответствующие дозы должны, конечно, варьироваться в зависимости, например, от хозяина и природы и серьезности подлежащего лечению состояния.
Однако в целом установлено, что удовлетворительные результаты в опытах на животных можно получать при обработке суточными дозами, составляющими от приблизительно 1 до приблизительно 10 мг/кг веса тела животного. Для людей показанная суточная доза составляет от приблизительно 10 до приблизительно 1000 мг/день, причем ее удобно вводить, например, в виде разделенных доз до четырех раз в день или один раз в день. Предпочтительные дозы для детей весом менее 20 кг могут составлять приблизительно 62,5 мг один раз в день, для детей весом от 20 до 40 кг приблизительно 125 мг один раз в день, для детей весом более 40 кг приблизительно 250 мг один раз в день, а для взрослых от приблизительно 250 до 500 мг в день.
Тербинафин можно вводить в форме с быстрым высвобождением, например в виде таблетки или капсулы, например таблетки, содержащей количество действующего вещества, эквивалентное 350 мг основания, или, например, в виде одной или двух капсул, содержащих минитаблетки или пеллеты, включающие в целом количество действующего вещества, эквивалентное 350 мг основания, или в форме с непрерывным высвобождением. Предпочтительными являются формы с быстрым высвобождением.
Пригодные для применения согласно изобретению формы с непрерывным высвобождением описаны в Pharmazeutische Technologie, изд-во Thieme, Штуттгарт/Нью-Йорк, 2-е изд., под ред. Н.Sucker, P.Fuchs, P.Spieser, 1991, например, на cc.370-390. Другие системы описаны, например, в Pharmaceutical Dosage Forms, под ред. Herbert A.Lieberman, Leon Lachman, Joseph В.Schwartz, 2-е изд., т.3, изд-во Marcel Dekker; и в Remington, The Science and Practice of Pharmacy, под ред. Alfonso Gennaro, 19-е изд., 1995. Можно применять широкое разнообразие систем с непрерывным высвобождением.
Особенности эксципиентов, которые можно применять в композициях, предлагаемых в настоящем изобретении, являются известными, например, можно применять поступающие в настоящее время в продажу формы Lamisil® или использовать описанные у Н.Р.Fiedler, "Lexikon der Hilfstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete", изд-во Cantor Verlag Aulendorf, Аулендорф, 4-е пересмотренное и расширенное издание (1996); или в "Handbook of Pharmaceutical Excipients", 2-е изд., под ред. A.Wade P.J. и Weller, объединенная публикация Американской фармацевтической ассоциации (American Pharmaceutical Association), Вашингтон, США и фармацевтического издательства (Pharmaceutical Press), Лондон, Великобритания (1994), или они описаны в соответствующих руководствах производителей, содержание указанных документов включено в настоящее описание в качестве ссылки.
Количество тербинафина в композиции, предлагаемой в изобретении, должно, конечно, варьироваться, например, в зависимости от содержания других компонентов. В целом, однако, тербинафин может присутствовать в количестве от приблизительно 10 до приблизительно 80% в пересчете на общую массу композиции. Композиции предпочтительно приготавливают в виде стандартной дозы, например, путем внесения в оболочки капсул, например в оболочки мягких или твердых желатиновых капсул, или путем таблетирования или иного процесса формования. Так, стандартная доза композиции тербинафина, предназначенная для введения один или два раза в день (например, в зависимости от конкретной цели терапии, фазы терапии и т.д.), должна соответственно содержать половину или всю назначенную суточную дозу. Предпочтительно композиции, предлагаемые в настоящем изобретении, вводят один раз в день.
Как указано выше, предпочтительный способ лечения, предлагаемый в изобретении (ниже обозначенный как способ А), заключается в использовании периодического цикла, в котором тербинафин (в количестве, эквивалентном 350 мг основания) вводят ежедневно в течение приблизительно половины, т.е. двух недель 28-дневного или месячного цикла, после чего следует приблизительно 2 недели, т.е. 14 или 16-17 дней отдыха (без приема лекарства). Затем этот цикл повторяют в общей сложности три или четыре, предпочтительно три, раза.
Фармакокинетические свойства композиций, предлагаемых в изобретении, можно определять с помощью стандартных фармакологических опытов (опытов по изучению биологической доступности) на животных или человеке.
Например, один из таких стандартных фармакологических опытов можно осуществлять на здоровых некурящих добровольцах, мужчинах или женщинах, в возрасте 18-45 лет, имеющих вес, отличающийся не более чем на 20% от идеального. Образцы крови отбирают через 1, 2, 4, 8, 16, 32 и 72 ч после введения согласно способу, предлагаемому в изобретении, и анализируют на содержание тербинафина. Концентрации тербинафина в плазме крови можно определять стандартным методом, например с помощью аналитических методов ЖХВР или ГЖХ. Безопасность оценивают через 1 неделю на основе результатов стандартного опроса, касающегося симптомов побочных действий.
Другой стандартный фармакологический опыт, который проводят с участием 24 здоровых взрослых добровольцев, представляет собой, например, изучение влияния пищи на биологическую доступность в ходе рандомизированного открытого состоящего из трех периодов перекрестного исследования с целью оценки относительной биологической доступности композиции, предлагаемой в изобретении, например капсул, описанных в примере 5 или 8, по сравнению со стандартными таблетками с быстрым высвобождением тербинафина и оценки влияния пищи на фармакокинетические характеристики композиции, предлагаемой в изобретении, после введения однократной дозы. В опыте проводят три перечисленные ниже вида обработки:
- обработка А: однократное введение стандартной таблетки с быстрым высвобождением, содержащей 250 мг действующего вещества, натощак;
- обработка Б: введение капсулы, содержащей 350 мг действующего вещества (2×175 мг), которая описана в примере 5, натощак; и
- обработка В: введение капсулы, содержащей 350 мг действующего вещества (2×175 мг), которая описана в примере 5, во время приема пищи.
Для каждого из трех вариантов обработки проводили оценки безопасности и в определенные моменты времени до 96 ч после введения лекарственного средства отбирали образцы крови для определения среди прочего tmax, Cmax и AUC (площадь под кривой) тербинафина.
Фармакокинетические опыты по оценке концентрации лекарственного средства в коже и ногте можно проводить на основе тех же самых принципов, которые указаны в описанных выше стандартных фармакологических опытах. Например, клинический опыт можно проводить в условиях, описанных для способа А.
Терапевтический клинический опыт можно проводить на основе принципов, указанных выше стандартных фармакологических опытов. Например, с участием пациентов, страдающих онихомикозом ногтей пальцев стопы, диагноз которого подтвержден с помощью микроскопии и анализов культуры, можно осуществлять рандомизированное двойное, проводимое вслепую исследование с использованием положительного контроля и контроля с использованием плацебо. Обработку проводят предпочтительно в течение трех 28-дневных или месячных циклов согласно способу, предлагаемому в изобретении, с использованием капсул, содержащих 175 мг действующего вещества, описанных в примере 5, причем первоначальный период обработки составляет 12 недель. Для оценки отсутствия побочных действий клинические испытания следует осуществлять на нескольких сотнях пациентов. Однако терапевтическую эффективность можно оценивать уже на основе результатов испытаний на 25 пациентах возрастом старше 12 лет. Безопасность оценивают на основе анкеты о побочных действиях, касающихся клинических аспектов и показателей жизненно важных функций. Эффективность определяют с помощью микроскопии, процедур культивирования и визуальной оценки признаков и симптомов. Эффективность соединений по изобретению оценивают на пациентах, зараженных указанными выше грибами, прежде всего Trichophyton rubrum, Trichophyton mentagrophytes и Epidermophyton floccosum. В группу пациентов входят пациенты, имеющие факторы предрасположенности, такие как нарушение кровообращения, периферическая нейропатия, сахарный диабет, повреждения, обусловленные повторными небольшими травмами, и ограниченные нарушения иммунной системы, а также СПИД. Пациенты имеют (I) дистальный латеральный подногтевой онихомикоз, начинающийся в гипонихии и распространяющийся проксимально в ложе и матриксе ногтя, (II) проксимальный подногтевой онихомикоз, при котором грибок поражает кутикулу и эпонихий, достигая матрикса, после чего он оказывается заключенным в субстанцию пластины ногтя, (III) общий дистрофический онихомикоз и (IV) поверхностный белый онихомикоз. При необходимости концентрации тербинафина в сыворотке можно определять общепринятым методом или согласно настоящему описанию. Концентрации тербинафина в ногте можно оценивать как с помощью фото-акустической спектроскопии, так и путем срезания ногтя и последующего анализа, позволяющего определять присутствие тербинафина в ложе ногтя.
Клинические опыты можно проводить, в частности, на подгруппах пациентов, например, таких, которые страдают нарушением функции почек или печени. При использовании способа, предлагаемого в изобретении, изменения стандартных клинических химических параметров, которые измеряют при дисфункции печени, оказались ниже ожидаемых. Было установлено также, что все такие дисфункции являются кратковременными и имеют функциональный характер. Это свидетельствует о хорошей переносимости композиций, предлагаемых в изобретении.
Композиции, предназначенные для применения согласно способу, предлагаемому в изобретении, можно применять для тех же показаний, при которых применяют известные содержащие тербинафин таблетки с быстрым высвобождением, например при грибковом синусите и онихомикозе. Эффективность композиций, предлагаемых в изобретении, можно оценивать с помощью стандартных клинических тестов или на стандартных моделях с использованием животных.
Композиции, применяемые согласно способу, предлагаемому в изобретении, обладают, в частности, неожиданно очень хорошей переносимостью с точки зрения указанных выше побочных действий, вызывая меньшие побочные действия, чем можно было бы ожидать, при первоначальном лечении с использованием стандартной таблетки Lamisil® с быстрым высвобождением, содержащей 250 мг действующего вещества. На основе клинических опытов было установлено, что композиции, предлагаемые в изобретении, эффективны при лечении прежде всего пожилых пациентов, например в возрасте 70 лет и выше, пациентов с нарушенной функцией почек (например, у которых клиренс креатинина ≥ 50 мл/мин) или с циррозом печени, и неожиданно отличаются тем, что вызывают меньшие побочные действия, чем можно ожидать для данной дозы. Кроме того, различие в величине AUC после введения до и после приема пищи оказались меньше, чем можно было ожидать.
Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Все температуры даны в градусах Цельсия.
Использованы следующие сокращения:
ГПМЦ - гидроксипропилметилцеллюлоза
ММ - молекулярная масса
ПЭГ - полиэтиленгликоль
Пример А: Таблетки с быстрым высвобождением, не имеющие покрытия
Таблетки (с быстрым высвобождением), содержащие 350 мг тербинафина в форме гидрохлорида (в пересчете на основание), изготавливали методом, аналогичным тому, которым изготавливают известные таблетки Lamisil® или другие содержащие тербинафин таблетки.
Таблетки имеют состав, указанный ниже в примере 1 под обозначением "Ядро", и они не имеют покрытия.
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, в течение последовательных 14 дней каждого цикла вводят один раз в день по 1 таблетке (350 мг) или по 2 таблетке (700 мг).
Пример Б: Таблетки с непрерывным высвобождением, не имеющие покрытия
Композицию приготавливают с помощью общепринятых методов.
Гидрохлорид тербинафина можно подвергать предварительной грануляции, например, с одной третью гидроксипропилметилцеллюлозы.
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, например, в течение последовательных 14 дней каждого цикла вводят один раз в день по 1 таблетке (350 мг тербинафина в пересчете на основание) или по 2 таблетки (700 мг).
Пример 1: Таблетки с покрытием
Таблетки с покрытием приготавливают обычным методом путем водной грануляции части ингредиентов, смешения с остальными ингредиентами на стадии сухой обработки и нанесения покрытия на образовавшиеся таблетки с помощью водной дисперсии ингредиентов, входящих в состав покрытия. Получаемые таблетки имеют следующий состав:
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, например, в течение последовательных 14 дней каждого цикла вводят один раз в день по 1 таблетке (350 мг тербинафина в пересчете на основание) или по 2 таблетки (700 мг).
Примеры 2-4: Минитаблетки с покрытием
Минитаблетки приготавливают обычным методом путем водной грануляции части ингредиентов, смешения с остальными ингредиентами на стадии сухой обработки и нанесения покрытия на образовавшиеся минитаблетки с помощью водной дисперсии ингредиентов, входящих в состав покрытия. В результате получают двояковыпуклые круглые минитаблетки, имеющие диаметр приблизительно 2,0-2,1 мм:
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, например, в течение последовательных 14 дней каждого цикла, вводят, например, один раз в день по 84 минитаблеток (350 мг тербинафина в пересчете на основание).
Пример 5: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие двуслойное покрытие и слой, препятствующий прилипанию
а) Минитаблетки:
Минитаблетки приготавливают обычным методом путем водной грануляции части ингредиентов, смешения с остальными ингредиентами на стадии сухой обработки, прессования и нанесения покрытия на образовавшиеся минитаблетки с помощью водной дисперсии ингредиентов, входящих в состав покрытия. В результате получают двояковыпуклые круглые минитаблетки, имеющие диаметр приблизительно 2,0-2,1 мм:
** удаляется в процессе производства
б) Капсулы:
Минитаблетки с покрытием, полученные, как описано выше в а), вносят в обычным методом в желатиновые капсулы, необязательно имеющие окраску.
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, например, в течение последовательных 14 дней каждого цикла вводят один раз в день по одной капсуле, содержащей по 84 минитаблеток (1×350 мг) или по две капсулы, содержащие по 42 минитаблетки (2×175 мг) (что в целом эквивалентно 350 мг тербинафина в пересчете на основание).
Пример 6: Твердые желатиновые капсулы, содержащие минитаблетки, не имеющие покрытия
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, однако без нанесения двух покрытий и слоя, препятствующего прилипанию (общая масса: 6,5328 мг/таблетку).
Пример 7: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие однослойное покрытие
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, однако для нанесения покрытия 1 используют 0,02662 мг коллоидного диоксида кремния (Aerosil 200®) вместо 0,07986 мг и не наносят покрытие 2 и слой, препятствующий прилипанию (общая масса: 6,6797 мг/таблетку).
Пример 8: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие уменьшенное защитное покрытие
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, однако для нанесения покрытия 1 используют 0,02662 мг коллоидного диоксида кремния (Aerosil 200®) вместо 0,07986 мг (общая масса: 7,20417 мг/таблетку).
Примеры 9 и 10: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие маскирующее вкус покрытие, но не имеющие защитного покрытия
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, за исключением того, что на полученные минитаблетки не наносят защитное покрытие 1 (общая масса 7,05725 мг/минитаблетку) (пример 9); в одном из вариантов у них отсутствует защитное покрытие 1 и в маскирующем вкус покрытии 2 отсутствует Eudragit Е®, лаурилсульфат натрия и дибутилсебацинат, при этом оно имеет следующий состав:
Пример 11: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие усиленное защитное покрытие
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, но для покрытия 1 (защитное) утраивают количество ГПМЦ и ПЭГ 8000 (0,30078 и 0,06012 мг/минитаблетку соответственно) и используют 6,10020 мг очищенной воды (удаляемой в процессе производства) вместо 2,03340 мг (общая масса 7,49801 мг/минитаблетку).
Примеры 12-14: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие модифицированное покрытие 2
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, но для покрытия 1 (защитное) уменьшают количество коллоидного диоксида кремния (Aerosil 200®) (0,02662 мг/минитаблетку вместо 0,07986 мг/минитаблетку) и для покрытия 2 (маскирующее вкус) применяют следующие ингредиенты:
Примеры 15-16: Твердые желатиновые капсулы, содержащие минитаблетки, имеющие модифицированный слой, препятствующий прилипанию
Минитаблетки приготавливают и вносят в капсулы, которые можно применять для прерывистого циклического введения, описанного в примере 5, но для покрытия 1 (защитное) используют 0,02662 мг коллоидного диоксида кремния (Aerosil 200®) вместо 0,07986 мг и для слоя, препятствующего прилипанию, заменяют большую часть (пример 15) или весь (пример 16) коллоидный диоксид кремния следующими ингредиентами:
Пример 17: Пеллеты, имеющие покрытие
Пеллеты, имеющие покрытие, получают общепринятым методом путем водной грануляции компонентов, входящих в пеллет, экструзии влажного гранулята, сфероидизации, сушки и нанесения покрытия с помощью водной дисперсии входящих в состав покрытия компонентов. Образующиеся пеллеты имеют размер частиц приблизительно 0,8-1,0 мм и следующий состав:
** удаляется в процессе производства
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, в течение последовательных 14 дней каждого цикла вводят, например, один раз в день 924,5 мг пеллетов, имеющих покрытие (что в целом эквивалентно 350 мг тербинафина в пересчете на основание).
Пример 18: Твердые желатиновые капсулы, содержащие пеллеты, имеющие покрытие
Пеллеты, имеющие покрытие, получают, как описано выше в примере 17, и их вносят обычным методом в необязательно окрашенные твердые желатиновые капсулы.
Для применения согласно прерывистому циклу, предлагаемому в настоящем изобретении, например, в течение последовательных 14 дней каждого цикла вводят один раз в день по две капсулы, каждая из которых содержит 462,25 мг пеллетов, имеющих покрытие (2×175 мг тербинафина в пересчете на основание) или по три капсулы, каждая из которых содержит по 308,16 мг пеллетов, имеющих покрытие (3×116,67 мг в пересчете на основание) (что в целом эквивалентно 350 мг тербинафина в пересчете на основание).
Изобретение относится к химико-фармацевтической промышленности и касается твердой лекарственной формы тербинафина (Lamisil®), обладающей высокой эффективностью, содержащей повышенные дозы тербинафина, что позволяет сократить общее количество препарата, вводимого курсом. Лекарственная форма представляет собой таблетки с покрытием или минитаблетки, находящиеся в капсулах или саше. 7 з.п. ф-лы, 8 табл., 1 ил.
| ПРОИЗВОДНЫЕ АМИНОАЛКИЛБЕНЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ С КИСЛОТАМИ | 1990 |
|
RU2033991C1 |
| АНТИМИКОТИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 1992 |
|
RU2093152C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ СРЕДСТВО, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭТО СРЕДСТВО, СПОСОБ ЛЕЧЕНИЯ КОЖНЫХ И СИСТЕМНЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2151589C1 |
| US 5660839 A, 26.08.1997 | |||
| реф | |||
| Goudard M et al | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Pathol Biol (Paris) | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
| Реф | |||
| Petranyi G et al | |||
| "Antifungal activity of the allylamine derivative | |||
Авторы
Даты
2007-05-10—Публикация
2002-07-19—Подача