Перекрестная ссылка на родственные заявки
Данная заявка имеет приоритет предварительных заявок США № 60/345891, поданной 29 октября 2001 г., и № 60/294309, поданной 30 мая 2001 г.
Права государства
Данное изобретение сделано при поддержке правительства США и Национальных институтов здравоохранения на основании грантов 1 R37 CA50286 и 1 R01 CA86312; правительство США имеет определенные права на указанное изобретение.
Область техники
Настоящее изобретение относится к доставке генов и подобных нуклеиновых кислот в сайты-мишени in vivo. В частности, данное изобретение относится к опосредуемой липосомой доставке генов к ангиогенным кровеносным сосудам.
Предпосылки изобретения
Интегрины представляют собой класс клеточных рецепторов, которые, как известно, связывают белки внеклеточного матрикса и таким образом опосредуют межклеточное взаимодействие и взаимодействие клеток с внеклеточным матриксом, определяемое как клеточная адгезия. Хотя в научной литературе описаны многие интегрины и связывающие интегрин лиганды, биологическая функция многих интегринов все еще слабо изучена. Рецепторы интегрина образуют семейство белков с общими структурными признаками комплексов нековалентных гетеродимерных гликопротеинов, образованных α- и β-субъединицами, Cheresh & Mecham. eds., Integrins: Molecular and Biological Responses to the Extracellular Matrix, Academic Press, Inc., San Diego, CA 92101 (1994), Horton, Int. J. Exp. Pathol., 71:741-759 (1990). В настоящее время продолжаются исследования конкретных функций клеточной адгезии, выполняемых указанными интегринами при взаимодействии клеток в тканях.
Взаимодействие эндотелиальных клеток с матриксом играет определенную роль в процессе ангиогенеза, то есть образования новых кровеносных сосудов. Рецептор клеточной адгезии, известный как αvβ3-интегрин, обнаружен на поверхности активированных эндотелиальных клеток, участвующих в ангиогенезе.
Хорошо известно, что ангиогенез необходим для роста злокачественной опухоли и метастазов. При отсутствии ангиогенеза местное развитие опухоли угнетается. Кроме того, известно, что экспрессия специфического маркера ангиогенеза - αvβ3-интегрина соответствует степени развития опухоли.
Установлено, что катионные липосомы, содержащие непептидный антагонист интегрина в качестве вещества направленного действия, могут доставлять такие нуклеиновые кислоты, как гены, к ангиогенным кровеносным сосудам. Правильно выбранные нуклеиновые кислоты могут при желании подавлять или усиливать рост кровеносных сосудов и, таким образом, представляют средство для лечения заболеваний, связанных с ангиогенезом.
Краткое изложение существа изобретения
Настоящее изобретение относится к липосомам направленного действия, которые включают непептидный антагонист рецептора интегрина и нуклеиновую кислоту. Указанные липосомы направленного действия пригодны для избирательной доставки in vivo нуклеиновых кислот, таких как гены, антисмысловые олигонуклеотидные последовательности, ДНК, РНК и тому подобные, к заранее определенному сайту-мишени, например, ангиогенному кровеносному сосуду, при системном или местном введении. Выбранные нуклеиновые кислоты могут быть доставлены к ангиогенным кровеносным сосудам с целью опосредования поглощения таких нуклеиновых кислот эндотелиальными клетками сосудов для экспрессии или доставки антисмысловых последовательностей. При этом может достигаться нарушение роста новых кровеносных сосудов. Кроме того, благодаря соответствующему выбору доставляемой нуклеиновой кислоты можно при желании индуцировать рост новых кровеносных сосудов.
В частности, липосома, направленно воздействующая на рецептор αvβ3-интегрина, представляет наночастицу размером не более примерно 100 нанометров и является однослойным или многослойным пузырьком, содержащим катионное амфифильное вещество, такое как катионный липид, нейтральный липид, липид направленного действия, имеющий домен, направленно воздействующий на αvβ3-интегрин, и гидрофобный домен, а также нуклеиновую кислоту, такую как ген, антисмысловая олигонуклеотидная последовательность, последовательность ДНК, последовательность РНК и тому подобные. Липосома направленного действия может также необязательно включать нейтральный липид. Имеющийся в липиде направленного действия домен направленного действия может быть непосредственно присоединен к гидрофобному домену. Альтернативно домен направленного действия может быть ковалентно связан с гидрофильным связывающим доменом (поверхностный линкер), который в свою очередь ковалентно связан с гидрофобным доменом. Нуклеиновая кислота образует комплекс с катионным амфифильным веществом, присутствующим в липосоме. Домен направленного действия включает непептидный антагонист αvβ3-интегрина.
В липосоме направленного действия катионное амфифильное вещество, такое как катионный липид, присутствует в количестве от около 1 до около 50 молярных процентов, и домен направленного действия составляет в липиде направленного действия от около 1 до около 20 молярных процентов в расчете на общее число молей липида в липосоме. Липиды, образующие липосому направленного действия, могут иметь олигомеризуемые и/или полимеризуемые функциональные группы в соответствующих гидрофобных частях, и по крайней мере часть таких липидов, присутствующих в липосоме, может быть сшита друг с другом при помощи таких групп. Катионный липид может также при желании иметь сшиваемые группы. Альтернативно катионный липид может не иметь сшиваемых групп.
Липосомы направленного действия по настоящему изобретению можно использовать для доставки нуклеиновых кислот с целью лечения рака, воспалительных заболеваний, глазных болезней и тому подобных. Такие липосомы направленного действия можно также использовать для доставки генов с целью идентификации мишеней для лечения в кровеносных сосудах.
Липосомы направленного действия по данному изобретению представляют многофункциональные связывающие наночастицы размером не более около 250 нанометров, предпочтительно от около 40 до около 100 нанометров, которые включают катионный липид или цитофектин, образующие комплекс с нуклеиновой кислотой. Предпочтительный липид направленного действия можно представить как L-X-K, где L означает домен направленного действия, например, антагонист рецептора интегрина, такой как антагонист рецептора αvβ3-интегрина и т.п., Х означает гидрофильный домен, который служит в качестве поверхностного линкера для гидрофобного домена К. Альтернативно липид направленного действия можно представить как L-K, где домен направленного действия L непосредственно связан с гидрофобным доменом К.
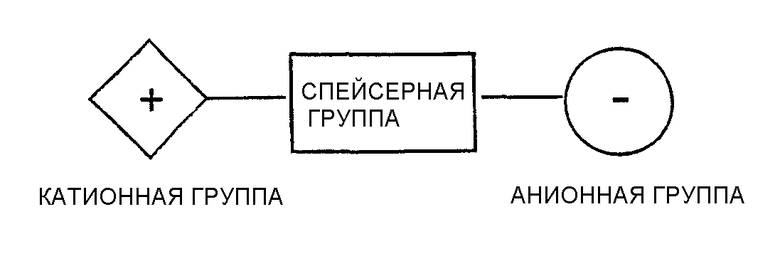
Непептидными антагонистами рецептора интегрина, L, пригодными для достижения целей настоящего изобретения при физиологических значениях рН, являются цвиттерионы, имеющие катионную группу и анионную группу, которые могут взаимодействовать или связываться с рецептором интегрина. Катионная и анионная группы отделены друг от друга спейсерной группой, такой как двухвалентная ароматическая группа. Расстояние между катионной группой и анионной группой в молекуле антагониста рецептора составляет от около 10 до около 100 ангстрем и может быть создано алкоксибензойными кислотами, бициклическими или трициклическими соединениями, спироциклическими соединениями и тому подобными при наличии отделенных друг от друга катионной и анионной групп, предназначенных для взаимодействия с рецептором интегрина при физиологических значения рН. Приемлемые антагонисты рецептора интегрина можно схематически представить следующим образом:
Типичный непептидный антагонист рецептора αvβ3-интегрина имеет формулу
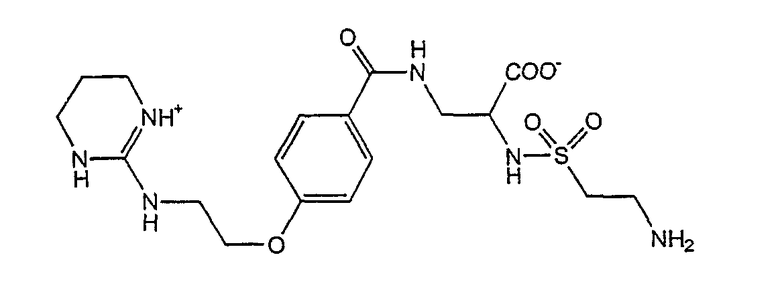
где имеется свободная аминогруппа (NH2), предназначенная для ковалентного связывания антагониста с гидрофобным доменом липосомы при помощи прямой связи или поверхностной линкерной группы.
Другие приемлемые непептидные антагонисты рецептора αvβ3-интегрина, пригодные для достижения целей по настоящему изобретению при связывании с гидрофильным доменом липида направленного действия, описаны в патентах США №№ 5561148, 5776973 и 6204280 и в патентных публикациях WO 00/63178, WO 01/10841, WO 01/14337, WO 01/14338, WO 97/45137, WO 98/35949 и WO 00/26212.
Комбинация непептидного антагониста рецептора интегрина L и необязательного поверхностного линкера Х образует молекулу, направленно воздействующую на рецептор αvβ3-интегрина, или группу, пригодную для конъюгирования с носителем нуклеиновой кислоты, таким как катионная липосома и тому подобные. Полученную липосому направленного действия затем связывают с заранее определенной нуклеиновой кислотой, например, геном, с образованием комплекса.
Краткое описание чертежей
На фиг.1 схематически показана липосома направленного действия по настоящему изобретению.
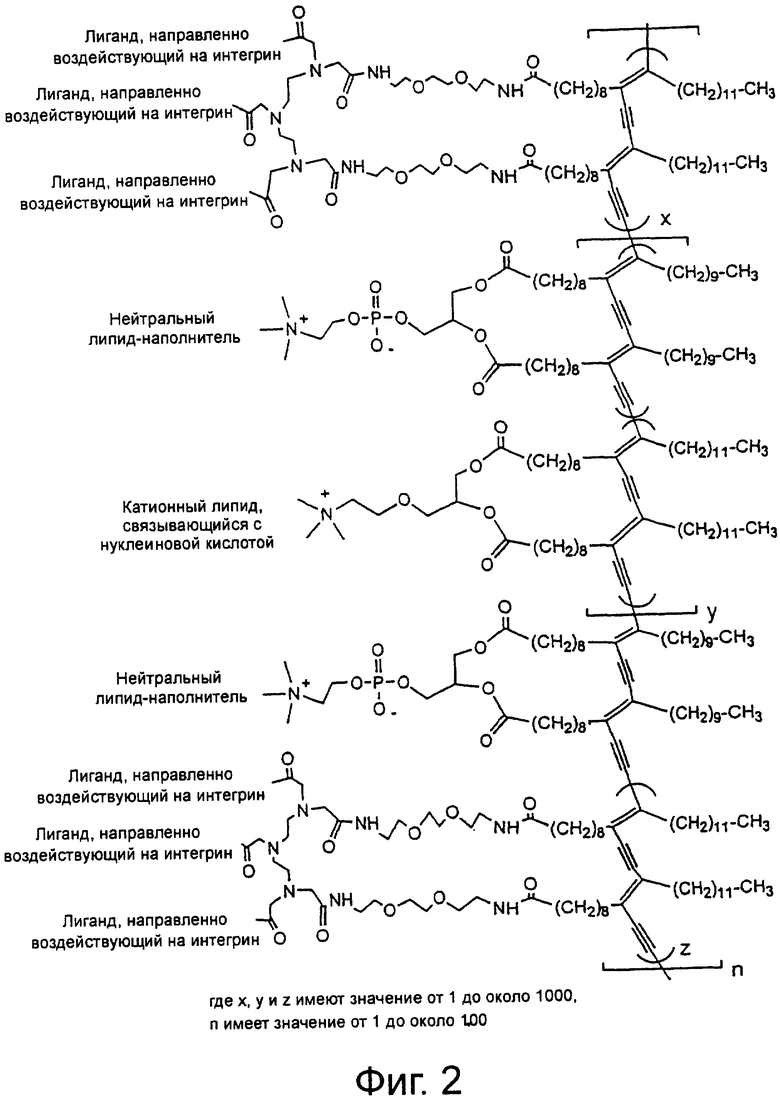
На фиг.2 показана сшитая липосома направленного действия по настоящему изобретению.
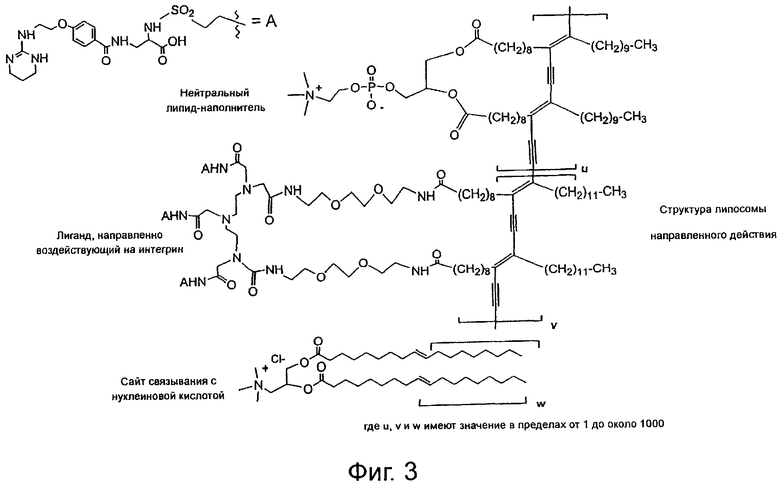
На фиг.3 показана другая сшитая липосома направленного действия по настоящему изобретению.
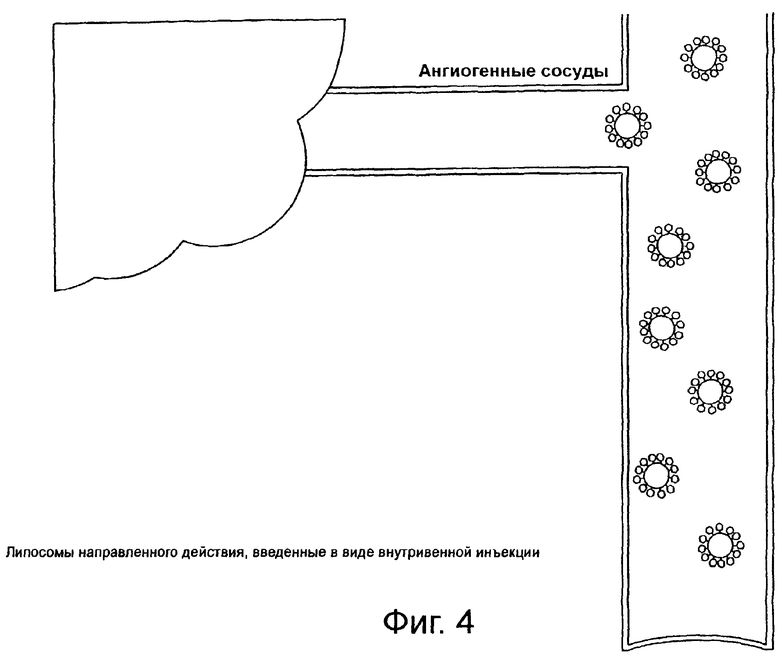
На фиг.4 схематически показаны липосомы направленного действия, циркулирующие системно.
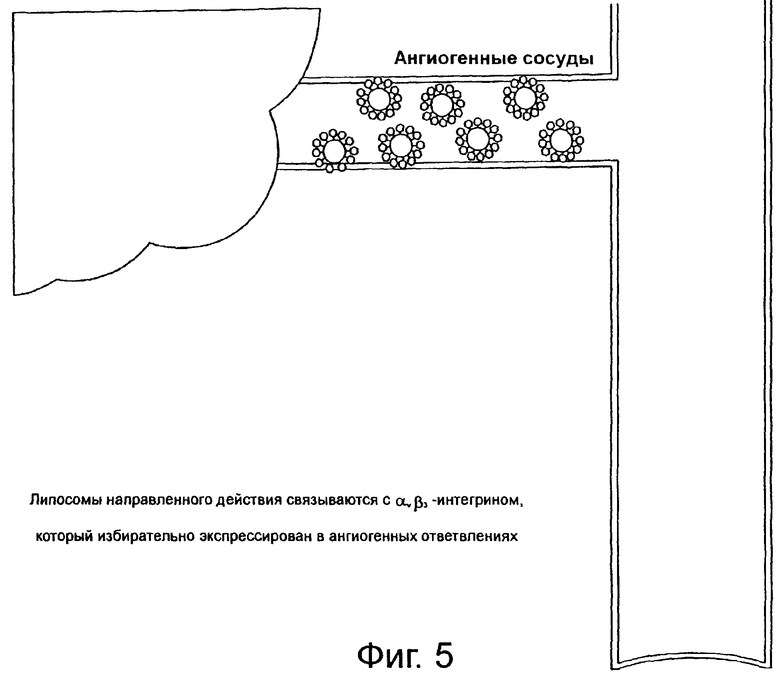
На фиг.5 схематически показаны липосомы направленного действия, скапливающиеся в местах развития кровеносных сосудов.
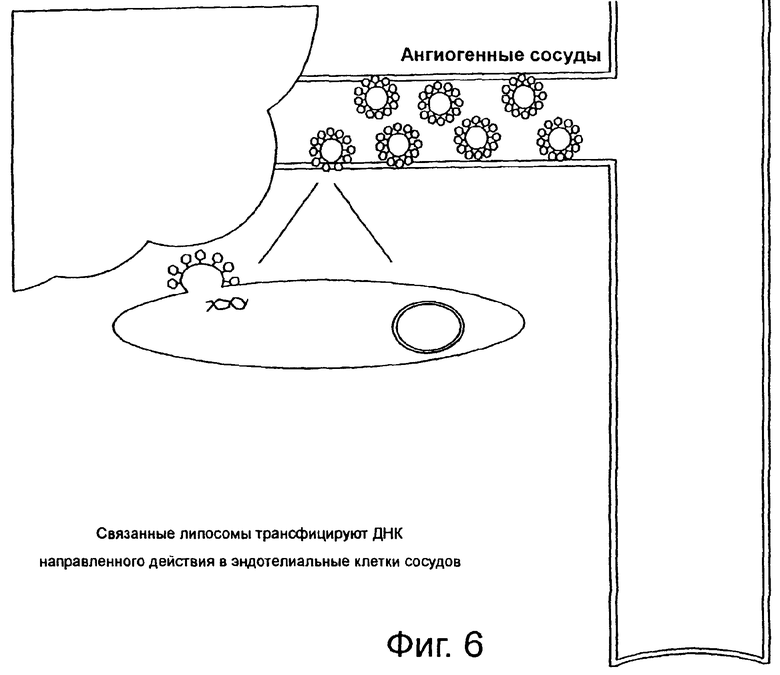
На фиг.6 и 7 схематически показана доставка ДНК, такой как ген, к клеткам-мишеням.
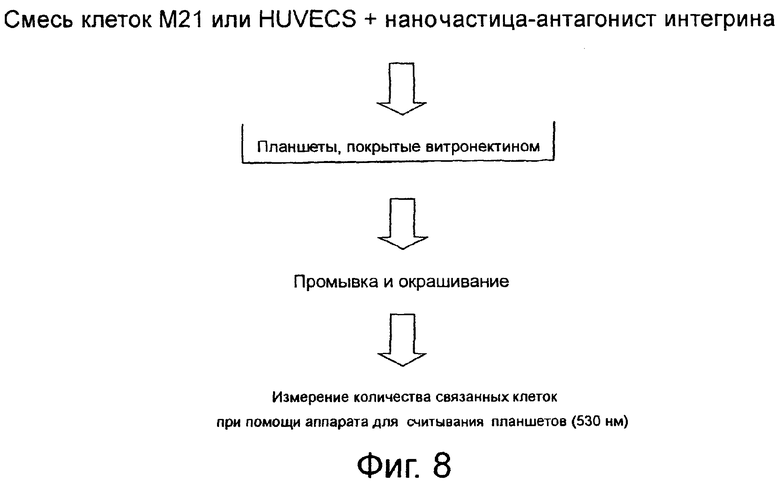
На фиг.8 схематически показан адгезионный анализ, пригодный для испытания αvβ3-антагонистов.
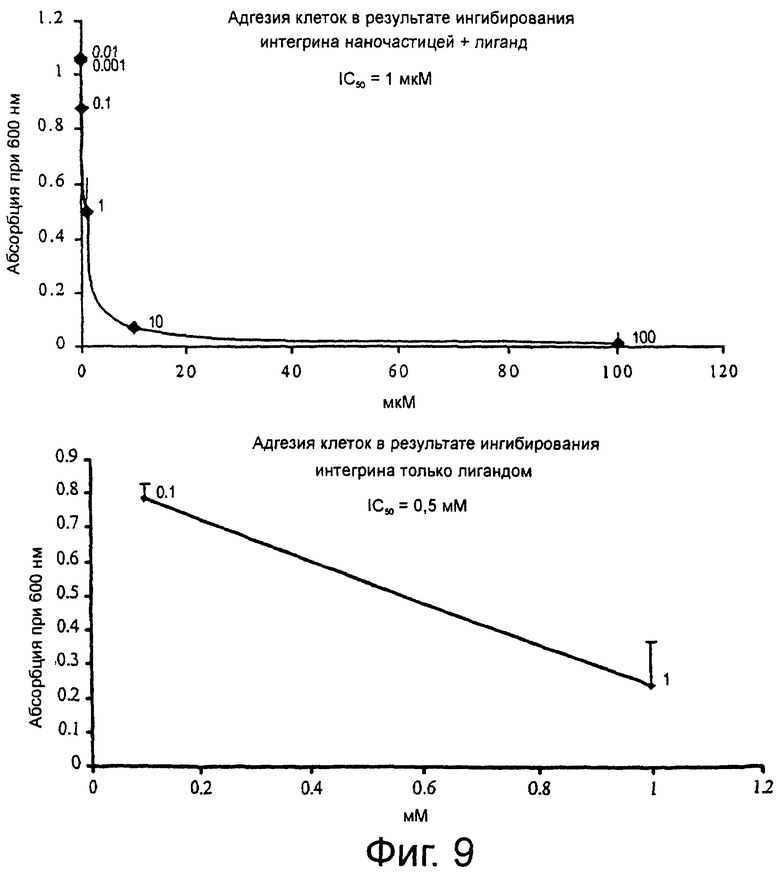
На фиг.9 графически представлены данные, полученные при выполнении адгезионного анализа, показанного на фиг.8, которые свидетельствуют о том, что липосома направленного действия по настоящему изобретению связывается с рецептором αvβ3-интегрина.
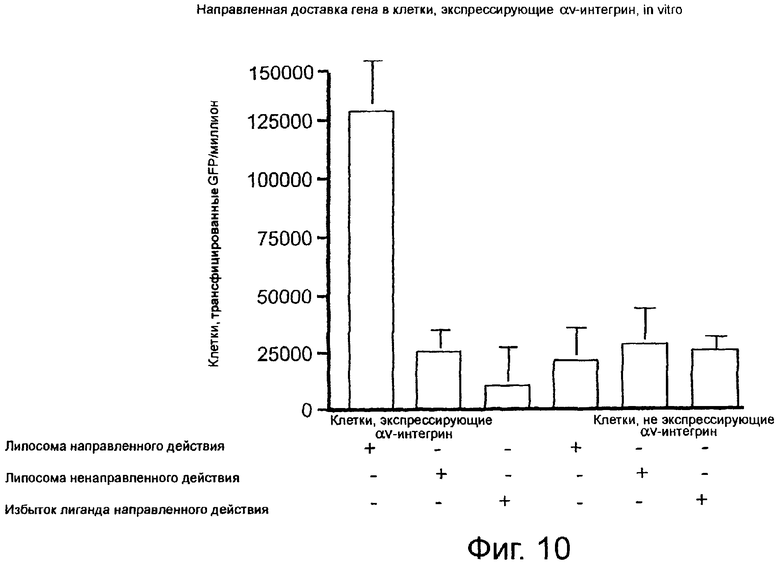
На фиг.10 графически представлены данные, свидетельствующие об эффективной направленной доставке in vivo гена зеленого флуоресцирующего белка (GFP)к клеткам, экспрессирующим αvβ3-интегрин, при использовании липосомы направленного действия по данному изобретению; приведенные данные показывают, что переносящие ген липосомы направленного действия трансфицируют клетки в зависимости от наличия в них αvβ3-интегрина; были использованы клетки меланомы человека М21 и М21L; клетки М21 экспрессируют αvβ3-интегрин, в то время как клетки М21L не экспрессируют αvβ3-интегрин (отсутствие αv-интегрина).
На фиг.11 графически представлены данные, демонстрирующие избирательное направленное воздействие in vivo гена люциферазы светляков на клетки сосудистой сети опухоли, экспрессирующей αvβ3-интегрин, при использовании липосомы направленного действия по данному изобретению; приведенные данные показывают, что носители гена направленного действия трансфицируют клетки опухоли в зависимости от наличия в них αvβ3-интегрина; были использованы клетки меланомы человека М21 и М21L, имплантированные мышам; клетки М21 экспрессируют αvβ3-интегрин, в то время как клетки М21L не экспрессируют αvβ3-интегрин.
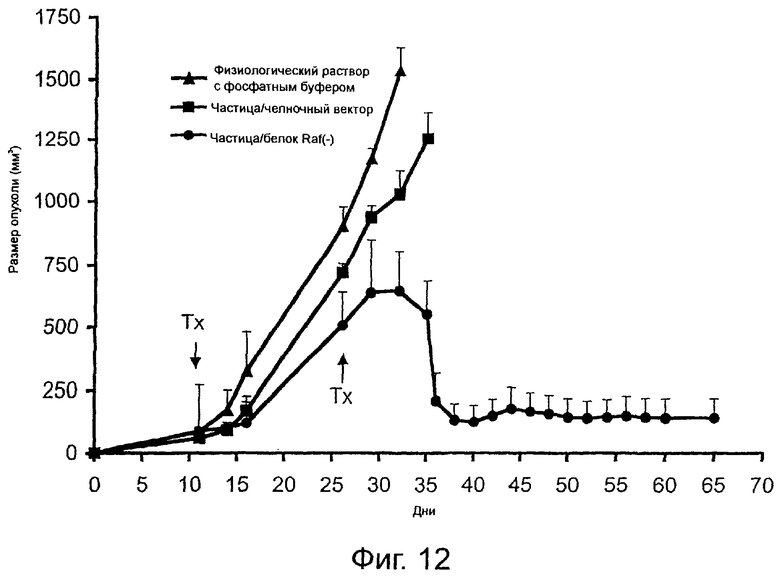
На фиг.12 графически представлены данные, свидетельствующие о подавлении и регрессе роста опухоли in vivo в результате введения липосомы направленного действия, связанной с геном, экспрессирующим мутантный белок Raf, подавляющий ангиогенез.
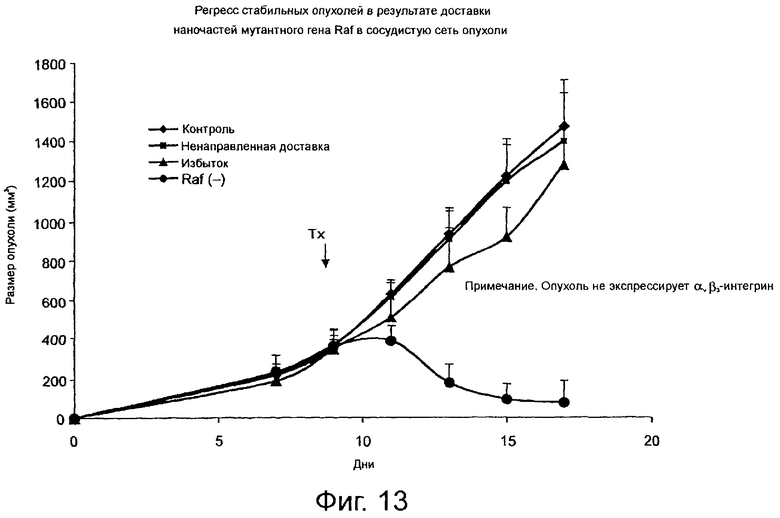
На фиг.13 графически представлены данные, свидетельствующие о подавлении и регрессе роста опухоли in vivo в результате введения липосомы направленного действия, связанной с геном, экспрессирующим мутантный белок Raf, подавляющий ангиогенез.
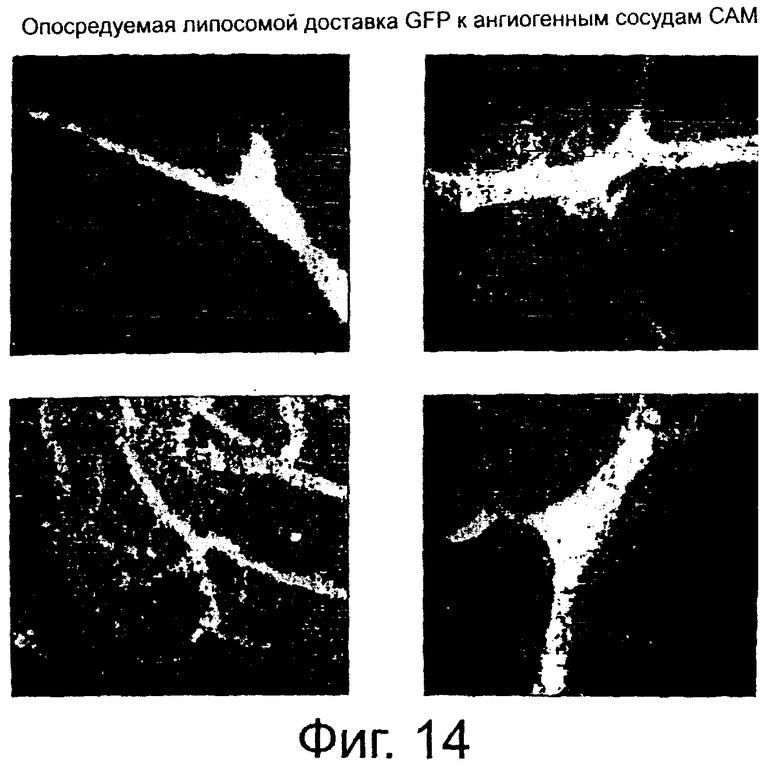
На фиг.14 показаны микрофотографии, свидетельствующие о доставке in vivo гена, кодирующего GFP, к ангиогенным сосудам хорионаллантоисной мембраны (САМ) цыпленка при использовании липосомы направленного действия по данному изобретению.
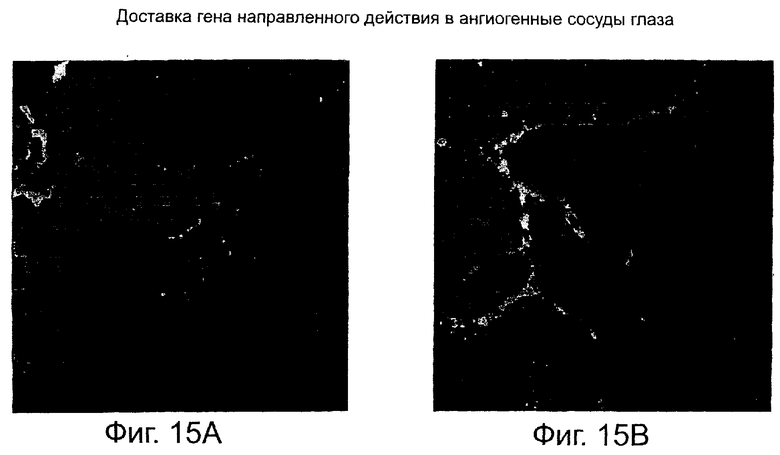
На фиг.15 показаны микрофотографии, свидетельствующие о доставке in vivo к кровеносным сосудам в глазу мыши гена, кодирующего GFP, путем инъекции в стекловидное тело глаза липосомы направленного действия по данному изобретению, связанной с геном.
На фиг.16 показаны микрофотографии, свидетельствующие об апоптозе новых сосудов in vivo благодаря опосредуемой липосомой направленного действия доставке гена, кодирующего мутантный белок Raf, к ангиогенным сосудам в сетчатке мыши.
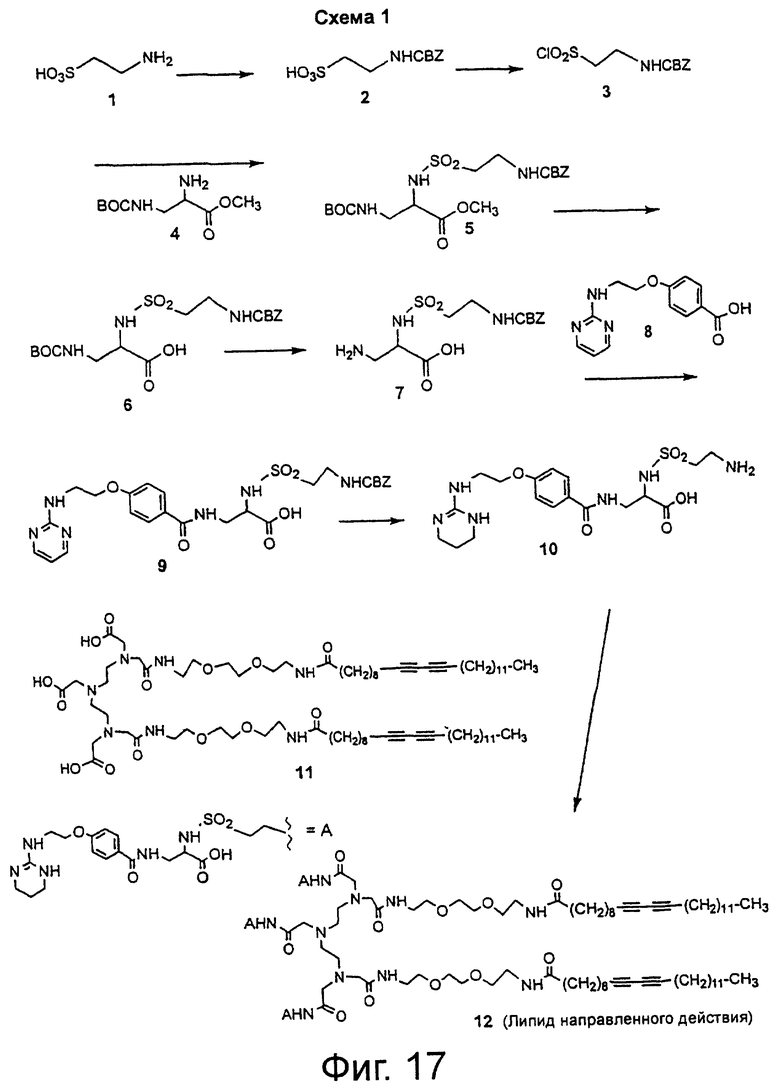
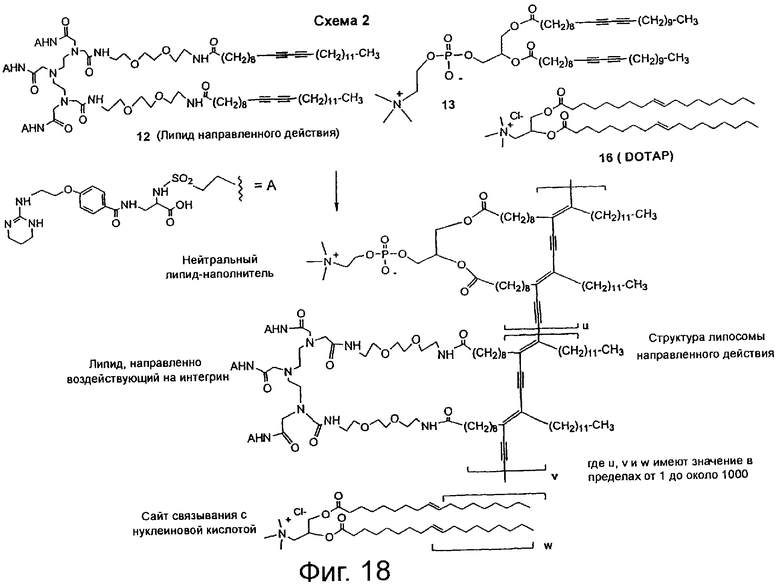
На фиг.17 показана схема синтеза 1 липосомы направленного действия, на которой подробно рассмотрен синтез главного промежуточного конъюгата трехвалентного липида и антагониста интегрина 12.
На фиг.18 показана схема синтеза 2 липосомы направленного действия, на которой рассмотрено образование наночастиц липосом направленного действия (NP)в результате самоассоциации и полимеризации соответствующих липидов из конъюгата трехвалентного липида и антагониста интегрина 12.
Описание предпочтительных вариантов осуществления изобретения
Липосомы направленного действия по настоящему изобретению, показанные на фиг.1-3 и 18, содержат антагонист рецептора интегрина, например антагонист рецептора αvβ3-интегрина, связанный с липидом, и носитель нуклеиновой кислоты, например катионное амфифильное вещество, такое как катионный липид. Указанная липосома может также содержать нейтральный или цвиттерионный липид-наполнитель.
Липид направленного действия имеет домен направленного действия, который включает антагонист рецептора αvβ3-интегрина, ковалентно связанный с гидрофобным доменом. Домен направленного действия может быть непосредственно связан с гидрофобным доменом либо домен направленного действия может быть связан с гидрофильным доменом, таким как линкерная группа (поверхностный линкер), который в свою очередь связан с гидрофобным доменом.
Антагонисты рецептора интегрина, пригодные для достижения целей по настоящему изобретению, представляют цвиттерионы при физиологических значениях рН и имеют катионную и анионную группы, которые могут взаимодействовать или связываться с рецептором интегрина. Катионная и анионная группы отделены друг от друга спейсерной группой, такой как двухвалентная ароматическая группа. Расстояние между катионной группой и анионной группой в молекуле антагониста рецептора находится в пределах от около 10 до около 100 ангстрем и может быть создано п-алкоксибензойными кислотами, бициклическими или трициклическими соединениями, спироциклическими соединениями и подобными соединениями при наличии отделенных друг от друга катионной и анионной групп, предназначенных для взаимодействия с рецептором интегрина при физиологических значениях рН.
Термин "арил" в значении, используемом в описании изобретения и прилагаемой формуле изобретения, означает углеводородный радикал, содержащий по крайней мере одно ароматическое кольцо с 6 атомами углерода, который дополнительно может включать углеводородные заместители с линейной или разветвленной цепью или циклические углеводородные заместители. Термин "гетероарил" означает радикал, содержащий по крайней мере одно ароматическое углеродное кольцо с гетероатомом, который дополнительно может включать углеводородные заместители с линейной или разветвленной цепью или циклические углеводородные заместители, при этом гетероатом может быть любым элементом, выбираемым из групп, определяемых по номенклатуре IUPAC как группа 15 (азотная группа) и группа 16 (кислородная группа) в периодической таблице, включая ароматические гетероциклические радикалы таких соединений, описанные в издании L.A. Paquette, Principles of Modern Heterocyclic Chemistry, Benjamin/Cummings Publishing Company, Inc. (1968), которое включено в данное описание изобретения в качестве ссылки. Указанные арильные и гетероарильные группы могут быть не замещены или замещены.
Термин "гетероциклический" в значении, используемом в описании изобретения и прилагаемой формуле изобретения, означает радикал, содержащий по крайней мере одно углеродное неароматическое кольцо с гетероатомом, который дополнительно может включать углеводородные заместители с линейной или разветвленной цепью или циклические углеводородные заместители, при этом гетероатом может быть любым элементом, выбираемым из групп, определяемых по номенклатуре IUPAC как группа 15 (азотная группа) и группа 16 (кислородная группа) в периодической таблице, включая неароматические гетероциклические радикалы таких соединений, описанные в приведенном выше издании L.A. Paquette, которое включено в данное описание изобретения в качестве ссылки. Гетероциклические группы могут быть не замещены или замещены алкильными группами или реакционноспособными функциональными группами, такими как галогены, аминогруппы, гидроксильные группы, группы карбоновых кислот, группы сульфоновых кислот и тому подобные.
Термин "алкил" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает углеводородную часть, которая может включать линейную или разветвленную цепь или может иметь карбоциклическую кольцевую структуру.
Термин "алкенил" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает алкильную группу, имеющую по крайней мере одну углерод-углеродную двойную связь.
Термин "алкинил" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает алкильную группу, имеющую по крайней мере одну углерод-углеродную тройную связь.
Термин "замещенный" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает замену одного или более атомов водорода в одном из вышеуказанных радикалов алкильной группой, фенильной группой или функциональной группой, такой как гидроксильная, алкоксильная, амино, нитрозо, нитро, азо, азидо, амидо, карбоксильная, оксо, тиоловая, сульфоксильная, сульфонильная, фосфинильная, фосфонильная, фтор-, хлор-, бром-, иодсодержащая и подобные группы, которые описаны в издании R. Panico et al., A Guide To IUPAC Nomenclature of Organic Compounds, Blackwell Science Ltd. (1993), которое включено в данное описание изобретения в качестве ссылки.
Термин "липосома" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает шарик, стенки которого образованы липидными молекулами, которые могут быть сополимеризованы или не сополимеризованы друг с другом.
Термин "липид" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает любое число групп масел, жиров, жироподобных веществ, которые обычно растворяются в относительно неполярных растворителях, но плохо растворяются в водных растворителях. Липиды образуют один из четырех основных классов соединений, присутствующих в тканях живых организмов, и включают жирные кислоты, нейтральные жиры, такие триацилглицерины, сложные эфиры жирных кислот и мыла, длинноцепочечные (жирные) спирты и воски, сфингоиды и другие длинноцепочечные основания, гликолипиды, фосфолипиды, сфинголипиды, каротины, полипренолы, стеролы и тому подобные, а также терпены и подобные изопреноиды.
Термин "цитофектин" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает катионный липид, пригодный для доставки и экспрессии гена, который состоит из катионной головной группы, присоединенной линкером к гидрофобному домену или части.
Термин "нейтральный" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения для обозначения липидов, означает незаряженные липиды, например, холестерин и тому подобные, а также цвиттерионные липиды, например, диолеоилфосфатидилэтаноламин, диолеоилфосфатидилхолин и тому подобные.
Термин "холестерил" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает стероидные углеводородные части, выделенные из холестерина или имеющие подобную структуру.
Термин "антагонист рецептора интегрина" в значении, используемом в данном описании изобретения и прилагаемой формуле изобретения, означает непептидное соединение, которое избирательно связывается с рецептором интегрина, например, с αvβ3-рецептором, αvβ5-рецептором, αvβ6-рецептором и тому подобными, и оказывает антагонистическое действие.
Типичное соединение такого αvβ3-антагониста выражено формулой

где имеющаяся свободная аминогруппа (NH2) ковалентно связывает антагонист с гидрофобным доменом липосомы при помощи поверхностной линкерной группы, такой как карбоксильная и/или другая приемлемая активная группа.
Другие типичные непептидные антагонисты αvβ3-рецепторов, которые пригодны для достижения целей по настоящему изобретению, будучи связанными прямо или косвенно с гидрофобным доменом липида направленного действия, описаны в патентах США №№ 5561148, 5776973 и 6204280 и в патентных публикациях WO 00/63178, WO 01/10841, WO 01/14337, WO 01/14338, WO 97/45137, WO 98/35949 и WO 00/26212, которые включены в данное описание изобретения в качестве ссылки. Такие антагонисты αvβ3-рецепторов показаны ниже

и подобные антагонисты, описанные в патентной заявке WO 01/14338;
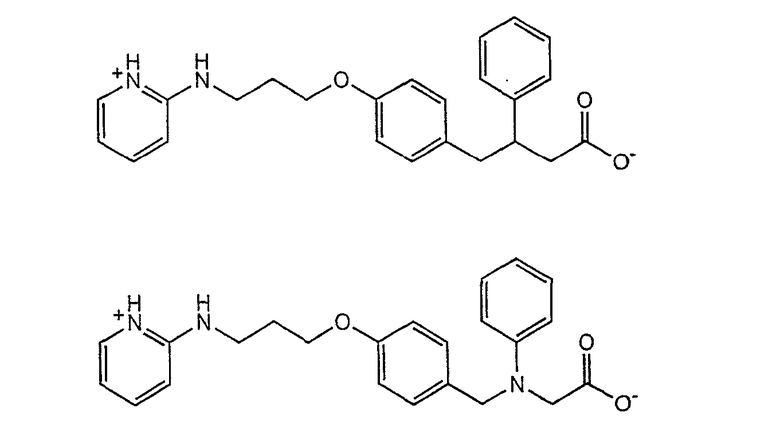
и подобные антагонисты, описанные в патентной заявке WO 01/14337;
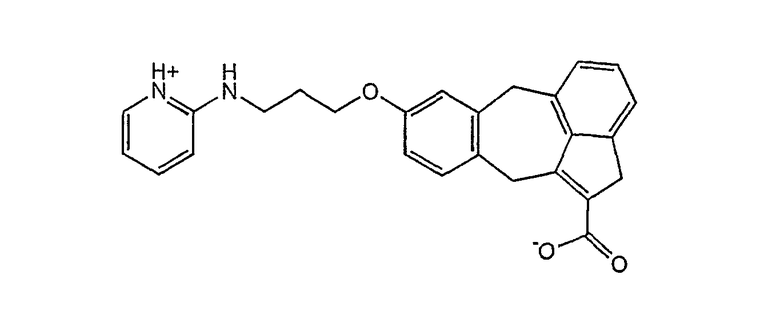
и подобные антагонисты, описанные в патентной заявке WO 00/63178;
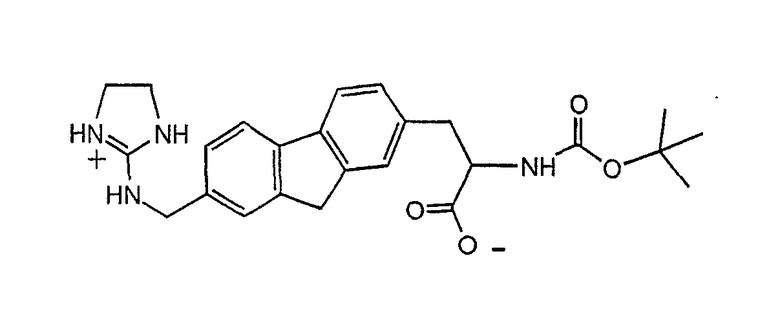
и подобные антагонисты, описанные в патентной заявке WO 01/10841; при условии, что такие соединения включают или модифицированы с возможностью включения функциональной группы или мостиковой группы, которая может взаимодействовать с поверхностным линкером или гидрофобным доменом с образованием липида направленного действия. Такие модификации хорошо известны в области химии. Например, одна из ароматических частей вышеуказанных соединений может быть химически замещена амино, гидроксильной или тиоловой группой, обеспечивая возможность присоединения к поверхностному линкеру. Альтернативно ароматические группы могут быть замещены карбоновой кислотой и поверхностный линкер может представлять, например, замещающую аминогруппу.
Непептидный антагонист рецептора интегрина ковалентно присоединен к гидрофильному поверхностному линкеру или непосредственно к гидрофобному домену при помощи обычных химических методов, обеспечивающих ковалентную связь антагониста с поверхностным линкером или гидрофобным доменом. Химические методы осуществления реакций, позволяющих получить такие связи, хорошо известны в данной области и включают использование комплементарных функциональных групп в поверхностном линкере или гидрофобном домене и лиганде антагониста интегрина. Комплементарные функциональные группы в поверхностном линкере или гидрофобном домене предпочтительно выбирают в зависимости от функциональных групп, которые имеются в лиганде для образования связи или которые можно ввести в данный лиганд для образования связи. Такие дополнительные функциональные группы также хорошо известны в данной области. Например, осуществление взаимодействия между карбоновой кислотой и первичным или вторичным амином в присутствии приемлемых хорошо известных активирующих агентов приводит к образованию амидной связи, которая может ковалентно связывать лиганд с поверхностным линкером или гидрофобным доменом, осуществление взаимодействия между аминогруппой и группой сульфонилгалогенида приводит к образованию сульфонамидной связи, которая может ковалентно связывать лиганд с поверхностным линкером или гидрофобным доменом; и осуществление взаимодействия между спиртом или фенольной группой и алкил- или арилгалогенидом приводит к образованию простой эфирной связи, которая может ковалентно связывать лиганд антагониста интегрина с поверхностным линкером или гидрофобным доменом.
Альтернативно антагонист рецептора интегрина может включать гидрофобный домен, такой как С18-С30 алкильная группа, С18-С30 алкенильная группа, С18-С30 алкинильная группа, холестерильная группа и тому подобные. Гидрофобный домен, имеющий или не имеющий промежуточный поверхностный линкер, присоединен к антагонисту рецептора интегрина в положении, которое сохраняет возможность взаимодействия с сайтом связывания рецептора, и, в частности, в положении, которое позволяет антагонисту ориентироваться для связывания с сайтом связывания рецептора интегрина. Такие положения и способы синтеза для образования связи хорошо известны в данной области.
Предпочтительные антагонисты рецептора αvβ3-интегрина, которые имеют гидрофобный домен или могут быть ковалентно присоединены к гидрофобному домену, выражены формулами (I) и (II)

где в формуле (I) R1 и R2 представляют собой водород или вместе образуют мостиковую 1,2-фениленовую (С6Н4) группу или мостиковую этиленовую группу (-СН=СН-); Х означает -С(O)- или ковалентную связь; n равно 1, 2 или 3; Z1 означает -С(O)-R3; -C(O)OR3 или SO2R3; и R3 означает фенил, замещенный фенил, пиридил, бензил, замещенный бензил, С1-С4 галогеналкил, С2-С30 алкил, С2-С30 алкенил, С2-С30 алкинил или холестерил; и где в формуле (II) R4 и R5 представляют собой водород или вместе образуют ковалентную связь; Y означает -С(О)- или -СН2-; Z2 означает -С(О)-R6, -C(O)OR6 или SO2R6; R6 означает фенил, замещенный фенил, пиридил, бензил, замещенный бензил, С1-С4 галогеналкил, С2-С30 алкил, С2-С30 алкенил, С2-С30 алкинил или холестерил; и Het означает 2-пиридил или 2-имидазолил.
Неограничивающие примеры антагонистов рецептора интегрина формулы (I) включают приведенные ниже соединения Ia, Ib, Ic, Id, Ie и If. Получение указанных соединений описано в публикации РСТ WO 98/35949.
Неограничивающие примеры антагонистов рецептора интегрина формулы (II) включают приведенные ниже соединения IIa, IIb, IIc, IId, IIe и IIf. Получение указанных соединений описано в публикации РСТ WO 00/26212.
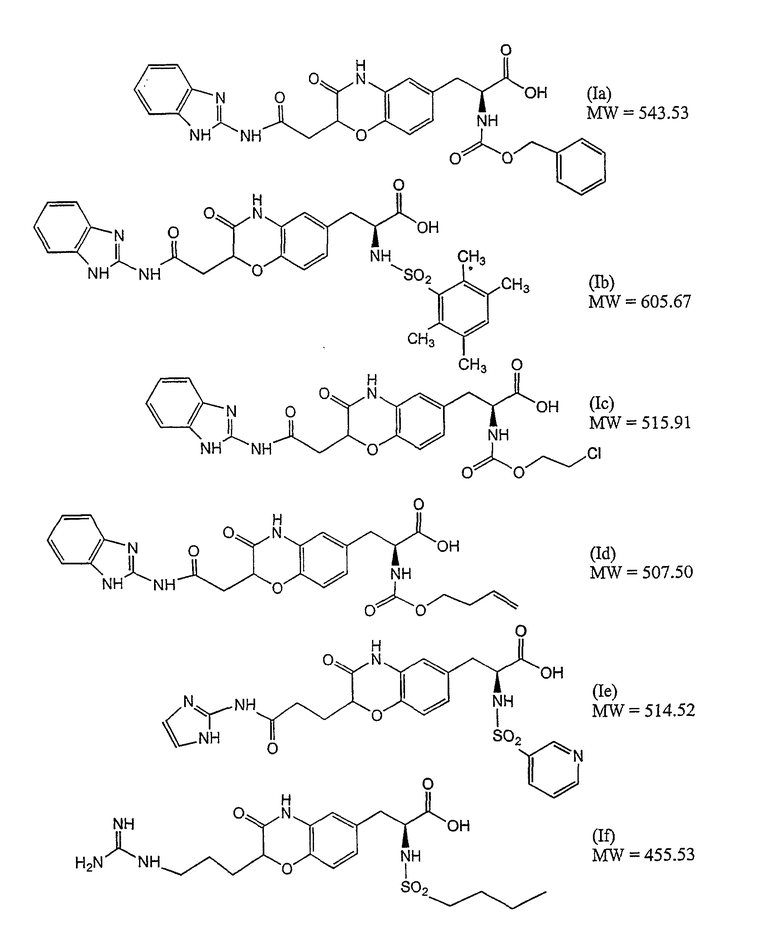
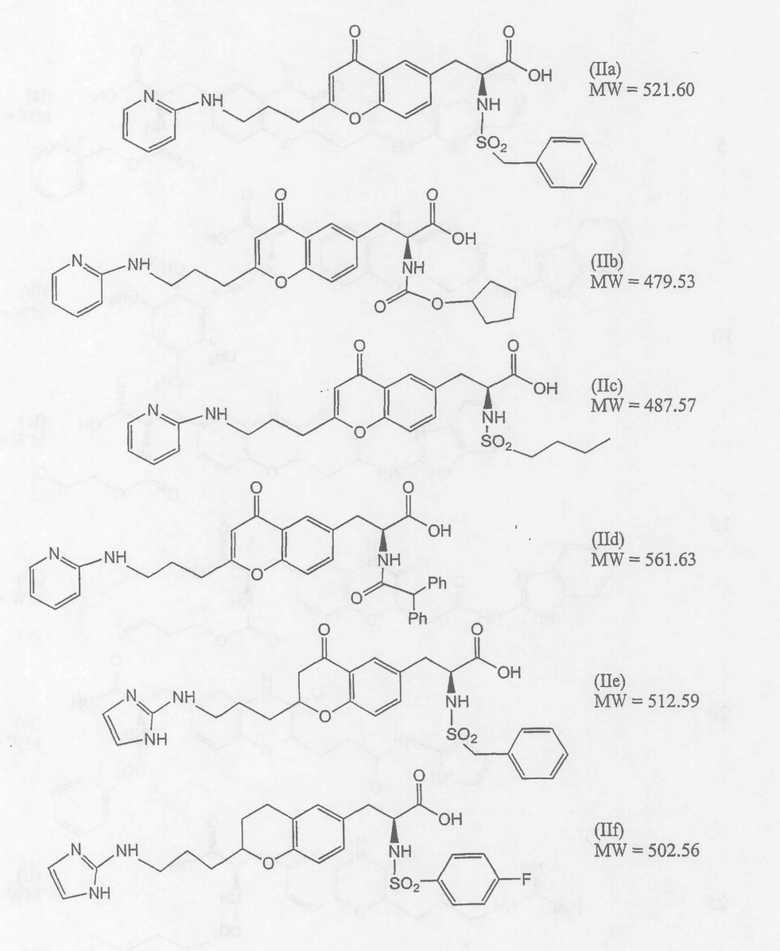
Предпочтительные антагонисты рецептора αvβ3-интегрина имеют молекулярную массу (MW) от около 200 до около 800 дальтон, более предпочтительно от 450 до около 610 дальтон, если указанные соединения не присоединены ковалентно к гидрофобному домену липида направленного действия.
Антагонист рецептора αvβ3-интегрина, ковалентно присоединенный к гидрофобному домену или включающий гидрофобный домен, в сочетании с катионным липидом позволяет получить катионную липосому, которая биологически совместима и по существу неиммуногенна. Биологическая активность липосомы направленного действия может зависеть от валентности, геометрии, состава, размера, гибкости или жесткости и т.д. гидрофильного поверхностного линкера при его наличии и в свою очередь от общей конфигурации липосомы направленного действия, а также от относительной гидрофильности поверхности линкера и подобных факторов. Таким образом, при наличии гидрофильного поверхностного линкера его предпочтительно выбирают с возможностью достижения максимальной биологической активности липосомы направленного действия. Поверхностный линкер можно выбрать с учетом увеличения биологической активности молекулы направленного действия. Поверхностный линкер обычно выбирают из органических молекул с любой структурой, которая ориентирует антагонист в направлении сайта связывания. В этом отношении поверхностный линкер можно рассматривать как "каркас", на котором расположен один или более антагонистов интегрина с достижением требуемой ориентации. Ориентация может представлять, например, расположение антагониста на приемлемом расстоянии от поверхности липосомы для обеспечения эффективного взаимодействия антагониста с активным сайтом рецептора интегрина.
Например, разную ориентацию можно создать, включая в каркасные группы, содержащие моно- и полициклические группы, в том числе арильные и/или гетероарильные группы, или структуры, имеющие одну или более углерод-углеродных множественных связей (алкенильные, алкениленовые, алкинильные или алкиниленовые группы). Другие группы могут также включать олигомеры и полимеры с разветвленными или прямыми цепями. В предпочтительных вариантах осуществления изобретения жесткость достигается благодаря наличию циклических групп (например, арильной, гетероарильной, циклоалкильной, гетероциклической и т.д.). В другом предпочтительном варианте осуществления изобретения кольцо является шести- или десятичленным кольцом. В других предпочтительных вариантах осуществления изобретения кольцо представляет ароматическое кольцо, такое как, например, фенил или нафтил.
Кристаллическая структура внеклеточной части αvβ3-интегрина, связанного с антагонистом интегрина, описана в статье Xiong et al., Science 296: 151-155 (2002). Антагонисты рецептора αvβ3-интегрина, используемые при осуществлении настоящего изобретения, имеют структуру, которая взаимодействует с рецептором αvβ3-интегрина аналогично взаимодействию, описанному в статье Xiong et al.
Специалист в данной области может легко определить разные гидрофильные свойства поверхностного линкера, а также наличие или отсутствие заряженных частей в липосоме. Например, гидрофобный характер поверхностного линкера, полученного из гексаметилендиамина (Н2N(CH2)6NH2) или родственных полиаминов, можно сделать более гидрофильным, заменяя алкиленовую группу поли(оксиалкиленовой) группой, такой как поли(этиленгликоль), поли(пропиленгликоль) и тому подобные.
Свойства поверхностного линкера можно модифицировать, добавляя или вставляя вспомогательные группы в/на поверхностный линкер, например, для изменения растворимости липосом (в воде, жирах, липидах, биологических жидкостях и т.д.), гидрофобности, гидрофильности, гибкости поверхностного линкера, антигенности, устойчивости и т.д. Например, введение одной или более поли(этиленгликолевых) (PEG) групп в/на поверхностный линкер усиливает гидрофильность или водорастворимость наночастиц липосомы, увеличивает молекулярную массу и размер молекулы и в зависимости от характера поверхностно линкера может также увеличить время удерживания in vivo. Кроме того, PEG может уменьшать антигенность и потенциально увеличивать общую жесткость поверхностного линкера.
Вспомогательные группы, которые могут повысить водорастворимость/гидрофильность липосомы, являются полезными при осуществлении данного изобретения. Таким образом, в объем настоящего изобретения входит применение вспомогательных групп, таких как, например, мелкие структурные единицы этиленгликолей, пропиленгликолей, спиртов, полиолов (например, глицерин, пропоксилат глицерина, сахариды, включая моно-, олигосахариды и т.д.), карбоксилатов (например, мелкие структурные единицы глутаминовой кислоты, акриловой кислоты и т.д.), аминов (например, тетраэтиленпентамин) и тому подобные, для увеличения водорастворимости и/или гидрофильности липосомы по данному изобретению. В предпочтительных вариантах осуществления изобретения вспомогательной группой, используемой для улучшения водорастворимости/гидрофильности, является простой полиэфир. Вспомогательная группа может быть присоединена к поверхностному линкеру у липида направленного действия или может быть присоединена к другим липидам в липосоме, таким как, например, катионный липид или нейтральный липид-наполнитель.
В объем данного изобретения входит также введение липофильных вспомогательных групп в структуру поверхностного линкера для увеличения липофильности и/или гидрофобности описанных липосом. Липофильные группы, которые можно использовать с поверхностными линкерами по данному изобретению, включают приводимые только в качестве примеров незамещенные или замещенные арильные и гетероарильные группы, и могут быть замещены по крайней мере одной группой, делающей возможным ковалентное присоединение указанных групп к поверхностному линкеру. Другие липофильные группы, пригодные для использования с поверхностными линкерами по данному изобретению, включают производные жирных кислот, не образующие двойные слои в водной среде до достижения относительно более высоких концентраций.
Гибкость поверхностного линкера можно изменять путем введения объемных и/или жестких вспомогательных групп. Наличие объемных или жестких групп может препятствовать свободному вращению вокруг связей в поверхностном линкере, связей между поверхностным линкером и вспомогательной(ыми) группой(ами) или связей между поверхностным линкером и функциональными группами. Жесткие группы могут включать, например, группы, конформационная неустойчивость которых ограничена присутствием колец и/или множества связей в группе, в частности арильные, гетероарильные, циклоалкильные, циклоалкенильные и гетероциклические группы. Другие группы, способные придавать жесткость, включают полипептидные группы, такие как олиго- или полипролиновые цепи.
Жесткость можно также придать электростатически. Так, если вспомогательные группы положительно или отрицательно заряжены, аналогично заряженные вспомогательные группы будут стремиться к созданию структуры поверхностного линкера, обеспечивающей максимальное расстояние между всеми одинаковыми зарядами. Энергетические затраты, необходимые для сближения одинаково заряженных групп, будут сохранять конфигурацию поверхностного линкера, в которой одинаково заряженные вспомогательные группы отделены друг от друга. Кроме того, вспомогательные группы, имеющие противоположные заряды, будут притягиваться к противоположно заряженным группам и потенциально могут образовывать межмолекулярные и внутримолекулярные ионные связи. Такой нековалентный механизм будет сохранять конфигурацию поверхностного линкера, способствующую образованию связей между противоположно заряженными группами. В объем настоящего изобретения входит введение дополнительных вспомогательных групп, которые заряжены или альтернативно имеют скрытый заряд при снятии защиты после присоединения к поверхностному линкеру, включая удаление защитных групп в карбоксильной, гидроксильной, тиоловой или аминогруппе путем изменения показателя рН, окисления, восстановления или при помощи других механизмов, известных специалистам в данной области.
Жесткость можно также придать путем внутреннего связывания водорода или гидрофобного разрушения.
Объемные группы могут включать, например, большие атомы, ионы (например, иод, серу, ионы металлов и т.д.) или группы, содержащие большие атомы, полициклические группы, в том числе ароматические группы, неароматические группы и структуры, имеющие одну или более углерод-углеродных множественных связей (т.е. алкены и алкины). Объемные группы могут также включать олигомеры и полимеры с разветвленной или прямой цепью. Предполагается, что разветвленные полимеры придают структуре большую жесткость, чем линейные полимеры с аналогичной молекулярной массой.
В некоторых вариантах осуществления изобретения жесткость придается за счет присутствия циклических групп (таких как арильные, гетероарильные, циклоалкильные, гетероциклические и т.д.). В других вариантах осуществления изобретения поверхностный линкер включает одно или более шестичленных колец. В некоторых других вариантах осуществления изобретения кольцо представляет арильную группу, такую как, например, фенил или нафтил.
Соответствующий выбор группы поверхностного линкера, обеспечивающей подходящую ориентацию, ограниченное/неограниченное вращение, требуемую степень гидрофобности/гидрофильности и т.д., должен быть сделан специалистом в данной области. Способы устранения или уменьшения антигенности описанных наночастиц также известны в данной области. В некоторых случаях антигенность наночастицы можно устранить или уменьшить, используя такие группы, как, например, поли(этиленгликолевые) группы.
Носитель нуклеиновой кислоты является катионным амфифильным веществом, таким как катионный липид, катионная липосома или мицелла, имеющая катионные группы, которое может связываться с нуклеиновой кислотой обычно в результате взаимодействия с отрицательно заряженными последовательностями нуклеиновых кислот с образованием комплексов, способных проникать в клетку. Липосомы направленного действия показаны на фиг.1, 2, 3, 17 и 18.
Катионные липиды, пригодные для достижения целей по настоящему изобретению (цитофектины), можно проиллюстрировать такими соединениями, как 1,2-диолеоилокси-3-(N,N,N-триметил-аммоний)пропанхлорид (DOTAP), бромид диметилдиоктадециламмония (DDAB), хлорид диолеоилдиметиламмония, диолеоил-L-α-фосфатидилэтаноламин (DOPE), N-холестерилоксикарбарил-3,7,12-триазапентадекан-1,15-диамин (СТАР) и т.п. Предпочтительным катионным липидом является DOTAP. Другие приемлемые катионные липиды описаны в статьях Miller, Angew. Chem. Int. Ed. 37:1768-1785 (1998) (далее именуемая "статья Миллера") и Cooper et al., Chem. Eur. J. 4(1): 137-151 (1998), которые включены в данное описание изобретения в качестве ссылки.
Липосома направленного действия по настоящему изобретению может быть сшита, частично сшита или не сшита. Сшитые липосомы могут иметь сшитые и несшитые компоненты.
Типичная несшитая липосома направленного действия по настоящему изобретению представляет смесь липидов, включающую DOTAP (катионный липид), холестерин (нейтральный липид), полиэтиленгликоль (гидрофильный вспомогательный компонент), такой как PEG-350 (полиоксиэтилен, имеющий 350 оксиэтиленовых структурных единиц) и непептидный антагонист рецептора интегрина, ковалентно связанный с липидом или включающий липид. Соотношение между DOTAP, холестерином и полиэтиленгликолем предпочтительно составляет примерно 1:1:0,12, при этом липид, содержащий непептидный антагонист рецептора интегрина (липид, направленно воздействующий на интегрин), используют в количестве, достаточном для обеспечения относительно высокой авидности к αvβ3-интегрину. Липосома направленного действия предпочтительно включает липид, направленно воздействующий на интегрин, в количестве от около 1 до около 20 мол.% в расчете на общее число молей липидных компонентов в липосоме, более предпочтительно от около 8 до около 12 мол.%.
Предпочтительная сшитая липосома направленного действия по настоящему изобретению включает полимеризуемый цвиттерионный или нейтральный липид, полимеризуемый липид, направленно воздействующий на интегрин, и полимеризуемый катионный липид, пригодный для связывания нуклеиновой кислоты.
В другом предпочтительном варианте осуществления изобретения сшитая липосома направленного действия включает полимеризуемый цвиттерионный или нейтральный липид, полимеризуемый липид, направленно воздействующий на интегрин, и неполимеризуемый катионный липид.
Липосома, содержащая полимеризуемые липиды, может быть сшита, например, путем добавления приемлемого инициатора радикальной полимеризации, облучения ультрафиолетовым светом с приемлемой длиной волны или другими методами, известными в области полимеризации.
Приемлемые катионные липосомы или цитофектины можно приобрести коммерческим путем и можно получить способами, описанными в статье Sipkins et al., Nature Medicine, 1998, 4(5): (1998), 623-626 или в приведенной выше статье Миллера.
Катионные липосомы можно получить из одного катионного амфифильного вещества или из комбинации катионного амфифильного вещества и нейтрального липида, например, из 3,3-[N-(N',N'-диметиламиноэтан)карбамоил]холестерина и диолеил-L-α-фосфатидилэтаноламина.
Гидрофильные свойства получают благодаря наличию фосфатных, фосфонатных, карбоксилатных, сульфатных, сульфонатных, сульфгидрильных, амино, нитро, гидроксильных и других подобных групп, хорошо известных в данной области. Гидрофобность можно придать введением групп, которые включают, не ограничиваясь ими, насыщенные и ненасыщенные алифатические углеводородные группы с цепями длиной до 20 атомов углерода, и группы, замещенные одной или более арильными, гетероарильными, циклоалкильными и/или гетероциклическими группами. Предпочтительными липидами являются фосфоглицериды и сфинголипиды. Типичные примеры фосфоглицеридов включают фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидную кислоту, пальмитоилолеоилфосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, дистеароилфосфатидилхолин и дилинолеоилфосфатидилхолин. Соединения, не имеющие фосфорсодержащих групп, такие как семейства сфинголипидов и гликосфинголипидов, также входят в группу, определяемую как липид. Кроме того, вышеописанные амфипатические липиды можно смешивать с другими липидами, включая триглицериды и стеролы, такие как холестерин, модифицированные холестерины и т.п.
Антагонисты рецептора интегрины могут иметь гидрофобный домен или могут быть присоединены к поверхностному линкеру или непосредственно к гидрофобному домену в любом приемлемом положении, например, в конце линейной цепи или в любом промежуточном положении, если такое присоединение не мешает связыванию антагониста с рецептором интегрина. Антагонисты рецептора интегрина могут также при желании включать необязательную двухвалентную мостиковую группу, облегчающую присоединение к поверхностному линкеру.
На фиг.1 схематически показана липосома направленного действия в виде частицы сферической формы, на поверхности которой имеются сайты связывания с нуклеиновой кислотой и сайты, направленно воздействующие на интегрин.
На фиг.2 показана сшитая липосома направленного действия по настоящему изобретению.
На фиг.3 показана другая сшитая липосома направленного действия, которая содержит несшитый катионный липид. Получение такой липосомы направленного действия подробно описано в нижеследующем разделе "Вещества и способы". Такая сшитая липосома имеет на внешней поверхности катионные группы, полученные из холина, которые способны связываться с нуклеиновыми кислотами, и сайты связывания с рецептором интегрина, полученные из групп антагониста интегрина, связанных с гидрофильным поверхностным линкером.
Нуклеиновые кислоты могут быть связаны с наночастицей сшитой липосомы в результате контактирования отрицательно заряженной нуклеиновой кислоты с катионной группой, имеющейся в липосоме, например, при смешивании нуклеиновой кислоты и липосомы направленного действия в фармацевтически приемлемой водной среде при физиологическом показателе рН. Липосомы, образующие комплекс с нуклеиновой кислотой, легко поглощаются интегрин-представляющими клетками, которые соприкасаются с липосомами направленного действия in vitro и in vivo.
Соотношение положительных зарядов липосомы направленного действия и отрицательных зарядов нуклеиновой кислоты предпочтительно превышает 1, более предпочтительно равно, по крайней мере, примерно 1,2.
Для избирательного направленного воздействия или антагонистического воздействия на интегрины, в частности αvβ3-интегрины, соединения и композиции по настоящему изобретению можно вводить в терапевтически эффективном количестве парентерально, перорально, путем ингаляции или местно в виде дозированной лекарственной формы, содержащей фармацевтически приемлемые носители, наполнители и адъюванты. Термин "парентеральный" в используемом здесь значении означает внутривенное, подкожное, внутримышечное, внутригрудинное, внутриглазное (например, в стекловидное тело) и внутрибрюшинное введение, а также введения методами вливания.
Можно использовать любой приемлемый способ введения. Фармацевтическую композицию, содержащую связанную с наночастицами нуклеиновую кислоту по настоящему изобретению вводят в дозе, эффективной для намеченного лечения. Терапевтически эффективные количества, необходимые для лечения конкретного заболевания или подавления его развития, могут легко определить специалисты в данной области, выполняя преклинические и клинические исследования, известные в области медицины.
Термин "терапевтически эффективное количество" в используемом здесь значении означает такое количество активного ингредиента, которое вызывает биологическую или медицинскую реакцию ткани, системы, животного или человека, ожидаемую лечащим врачом или исследователем.
Термин "подавление" в используемом здесь значении означает замедление, прерывание или прекращение развития заболевания, но необязательно указывает на полное излечивание болезни. Продолжительная выживаемость субъекта сама по себе свидетельствует о благоприятном лечении заболевания.
Схемы введения нуклеиновых кислот, связанных с липосомой направленного действия по настоящему изобретению или содержащих их композиций, определяют с учетом нескольких факторов, таких как возраст, масса тела, пол и тип заболевания нуждающегося субъекта, тяжесть заболевания, способ введения и антагонистическая активность используемой молекулы направленного действия или лиганда. Схема введения может изменяться в зависимости от вышеуказанных факторов. При лечении рассмотренных выше заболеваний можно использовать дозы в пределах от около 0,01 до около 1000 мг на кг массы тела. Предпочтительны дозы от около 0,01 до около 100 мг на кг массы тела.
Композицию по настоящему изобретению, содержащую липосомы направленного действия и предназначенную для введения в виде инъекций, получают с использованием фармацевтически приемлемого носителя, такого как вода, физиологический раствор или водный раствор декстрозы. Типичная суточная доза для инъекций составляет от около 0,01 до около 100 мг на кг массы тела, при ежедневном введении в виде однократной дозы или нескольких разделенных доз в зависимости от вышеуказанных факторов.
Для подавления ангиогенеза субъекту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество липосом направленного действия по настоящему изобретению, содержащих нуклеиновую кислоту, такую как рибонуклеиновая кислота (РНК) или дезоксирибонуклеиновая кислота (ДНК), способную экспрессировать белок или пептид, подавляющий ангиогенез. Введенная нуклеиновая кислота проникает в ядро клетки и экспрессирует белок направленного действия в эндотелиальных клетках сосудов.
Ниже приведены неограничивающие примеры, более подробно иллюстрирующие разные аспекты данного изобретения. Специалисту в данной области должно быть понятно, что в приведенные примеры и варианты осуществления изобретения могут быть внесены изменения, входящие в объем данного изобретения.
Вещества и способы
Получение наночастиц
Создание мультивалентных липосом направленного действия, связывающихся с интегринами, начинается с определения структуры и синтеза молекулы 12 полимеризуемого липида, направленно воздействующей на интегрины (фиг.17, схема 1). Аминогруппа таурина 1 защищена в виде его бензилоксикарбонильного (CBZ) производного с образованием соединения 2, после чего получают сульфонилхлорид 3, который подвергают реакции сочетания с метиловым эфиром трет-бутоксикарбонилдиаминопропионовой кислоты 4, получая при этом соединение 5. Соединение 5 омыляют с образованием соединения 6, удаляют трет-бутоксикарбонильную (ВОС) группу и получают главное промежуточное соединение 7. Соединение 7 подвергают реакции сочетания с производным бензойной кислоты 8, получая при этом соединение 9, которое гидрируют для снятия защиты с амина и одновременно восстанавливают пиримидиновое кольцо, получая конъюгат антагониста рецептора интегрина и линкера 10. Синтез соединения 8 ранее был описан в статье Duggan et al., J. Med. Chem., 2000, 43, 3736-3745, которая включена в данное описание изобретения в качестве ссылки. Три эквивалента конъюгата 10 подвергают реакции сочетания с хелатообразующим липидом трикарбоновой кислоты 11, используя гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония (ВОР), и получают главное комплексное соединение антагониста интегрина и трехвалентного липида 12. Получение соединения 11 ранее было описано в статье Storrs et al., J. Magn. Reson. Imaging, 1995, 5, 719-724, которая включена в данное описание изобретения в качестве ссылки. Соединение 11 обрабатывают метоксидом натрия в метаноле, получая при этом соединение 15 (т.е. тринатриевую соль соединения 11). Комплекс европия и хелатообразующего липида 14 синтезируют, нагревая соединение 15 с раствором трихлорида европия, как описано в приведенной выше статье Storrs et al.
На схеме 2, показанной на фиг.18, рассмотрено получение сшитых липосом направленного действия (наночастиц) в результате самоассоциации и полимеризации соответствующих липидов, ранее описанное в приведенной выше статье Storrs et al. Типичные сшитые липосомы направленного действия синтезируют, объединяя комплексное соединение антагониста интегрина и трехвалентного липида 12 с цвиттерионным фосфолипидом диацетилена 13 и комплекстом европия и хелатообразующего липида 14 в растворе хлороформа. Соединение 14 добавляют в количестве 1 мас.% ко всем композициям для визуализации частиц при помощи флуоресцентной спектроскопии. К раствору липидов в хлороформе добавляют анионный хелатообразующий липид 15 или катионный липид 16 (DOTAP), чтобы изменить поверхностный заряд. Поверхностную плотность антагониста интегрина на наночастицах регулируют, изменяя количество соединения 12 в липосоме.
Для получения пузырьков растворы объединенных липидов упаривают досуха и сушат в высоком вакууме для удаления остаточного растворителя с образованием липидной пленки. Высушенную липидную пленку гидрируют до известной плотности липида (30 мМ) с использованием деионизированной воды. Полученную суспензию обрабатывают ультразвуком при температуре выше перехода кристаллической фазы гель - жидкость (Тm = 64°С), после чего выполняют способ, описанный в статье Leaver et al., Biochim. Biophys. Acta, 1983, 732, 210-218, используя устройство для обработки ультразвуком с концом в виде зонда, при сохранении показателя рН в пределах от 7,0 до 7,5. После обработки ультразвуком в течение примерно одного часа раствор становится прозрачным. Затем пузырьки полимеризуют, охлаждая раствор до 0°С на слое из мокрого льда, и облучают раствор при длине волны около 254 нм ручной ультрафиолетовой лампой в течение 2 часов. Полученные липосомы (NP1 - NP6) имеют желто-оранжевую окраску и две видимые полосы поглощения, соответствующие длинам волн 490 нм и 535 нм и образуемые конъюгированным полидиацетиленом енового синтеза. Средний диаметр наночастиц, определяемый методом динамического рассеяния света (DLS), находится в пределах от 40 до 50 нм. Дзета-потенциал составляет соответственно от -42 до -53 мВ для наночастиц NP1-NP4 (т.е. наночастицы NP1-NP4 заряжены отрицательно) и от +35 до +43 мВ для наночастиц NP5 и NP6 (т.е. наночастицы NP5 и NP6 заряжены положительно) (Brookhaven Instruments, Holtsville, NY). Липосомы остаются устойчивыми в течение нескольких месяцев без каких-либо существенных изменений физических и биологических свойств в составе препаратов для введения in vivo с использованием 150 мМ хлорида натрия, 50 мМ гистидина и 5% растворов декстрозы.
Составы липосом NP1 - NP6 приведены в нижеследующей таблице 1, в которой компоненты 12 (липид направленного действия), 13 (цвиттерионный липид), 15 (анионный хелатообразующий липид) и 16 (катионный липид; DOTAP) выражены в мол.%.
Составы липосом NP1 - NP6
мол.%
Липосомы получают полимеризацией пузырьков с использованием 0,1, 1 и 10 мол.% комплексного соединения антагониста интегрина и липида 12 и соединения 13, как показано на фиг.18, и дополнительных веществ 14, 15 и 16, которые вводят в липосомы до полимеризации для изменения поверхностной плотности заряда и флуоресцентной визуализации липосом. Для простоты восприятия на фиг.18 не показано соединение 13, которое является необязательным и составляет только 1 мол.% липосомы. Вещества, содержащие 10 мол.% соединения 12 (NP1 и NP5), обладают наибольшим сродством к сайту связывания αvβ3-интегрина. При выполнении анализа конкурентного связывания интегрина при помощи флуоресцентной спектроскопии с разрешением по времени понадобилось 100-кратное количество свободного лиганда 10 (65 мкМ) для уменьшения связывания наночастиц NP1 и αvβ3-интегрина на 50% несмотря на то, что количество антагониста интегрина 10 на поверхности наночастицы NP1 эквивалентно только 0,5 мкМ. При выполнении анализа ингибирования клеточной адгезии in vitro с использованием клеток меланомы М21, содержащих αvβ3-интегрин, на планшетах, покрытых витронектином, IC50 для свободного лиганда 10 составила 64 мкМ. В отличие от этого IC50 для анионной частицы NP1 равна 0,27 мкМ эквиваленту соединения 10 на поверхности. Полученный результат свидетельствует о 200-кратной авидности к поверхности клетки при использовании на наночастицах соединения 10 по сравнению со свободным лигандом. Для катионной частицы NP5 IC50 равна 0,35 мкМ эквиваленту соединения 10, что примерно в 180 раз превышает авидность, присущую свободному лиганду, как показано в нижеследующей таблице 2. Таким образом, независимо от поверхностного заряда наночастицы обладают авидностью к интегринам, которая примерно в 180-200 раз больше аналогичного показателя для мономерного лиганда. Полученный результат показывает, что между поверхностью наночастиц и поверхностью клетки происходит сильное взаимодействие. Указанное взаимодействие не зависит от заряда на поверхности наночастиц и непосредственно связано с взаимодействием со специфическим лигандом рецептора. При мультивалентном представлении антагониста интегрина на поверхности наночастиц достигается примерно двукратное увеличение авидности по сравнению с использованием свободного лиганда. При уменьшении количества соединения 12 в препаратах, содержащих вышеуказанных наночастицы (NP), в 10 и 100 раз соответственно до 1 мол.% и 0,1 мол.%, как это имеет место в NP2 и NP3, способность блокировать клеточную адгезию снижается примерно на один и два порядка величины, как показано в нижеследующей таблице 2.
Физические и биологические свойства липосом NP1-NP6
Липосома NP5 представляет типичную сшитую липосому направленного действия по настоящему изобретению.
Общие способы синтеза
Все используемые растворители и реагенты имеют степень чистоты, установленную для реагентов. Растворители выпаривают при пониженном давлении, создаваемом бытовым вакуумным прибором или вакуумным насосом с прямым приводом Welch при температуре ≤40°С. Спектры 1Н и 13С-ЯМР получены в устройстве JEOL FX90Q при 90 МГц для протонных спектров и примерно при 23 МГц для углеродных спектров в CDCl3, CD3OD, D2O и их смесях, как указано для каждого случая. (Примечание: несмотря на растворимость в CDCl3 добавление к липидам OD3OD препятствует образованию инвертированных мицелл и таким образом способствует получению более резких спектров). Спектры 1Н-ЯМР соотнесены с остаточным CHCl3 (7,25 м.д.), и спектры 13С-ЯМР соотнесены со средней линией CDCl3 (77,00 м.д.). Масс-спектрометрия MALDI-TOF выполнена в приборе PerSeptive DE (масс-спектрометрия, The Scripps Research Institute, La Jolla, CA). ТСХ выполнена на стеклянных пластинках с подложкой Merck 60 F254 (0,2 мм; EM Separation, Wakefield, RI), и проявленные пластинки обычно опрыскивают сульфатом церия (1%) и молибдатом аммония (2,5%) в 10% водном растворе серной кислоты и нагревают до около 150°С. Другие проявители включают иод (обычное применение), 0,5% нингидрин в ацетоне (для аминов) и ультрафиолетовый свет (для уф-хромофоров).
Натриевая соль N-бензилоксикарбонилтаурина (2). Таурин 1 (около 40 г, 320 ммоль) растворяют в 4 н. растворе гидроксида натрия (80 мл) и воде (около 200 мл). К полученному раствору по каплям добавляют бензилоксикарбонилхлорид (около 48 мл, 330 ммоль) при интенсивном перемешивании в течение примерно 4 часов. Показатель рН раствора сохраняют щелочным, добавляя 10% раствор бикарбоната натрия (около 300 мл) и 4 н. раствор гидроксида натрия (около 45 мл). Полученную реакционную смесь промывают диэтиловым эфиром (около 1000 мл), водный слой досуха упаривают в роторном испарителе и дополнительно сушат в высоком вакууме над пентоксидом фосфора в течение ночи, получая при этом около 12,7 г (14%) соединения 2.
1Н-ЯМР (D2O): δ 7,50 (5Н, с, Ar-H), 5,21 (2H, с, Ar-CH2), 3,62 (2H, т, СН2), 3,14 (2Н, т, СН2).
2-Бензилоксикарбониламидоэтансульфонилхлорид (3). Натриевую соль N-CBZ-таурина 2 (около 12,7 г, 32 ммоль) суспендируют в сухом диэтиловом эфире (около 30 мл) в атмосфере аргона при положительном давлении и обрабатывают 5 порциями пентахлорида фосфора (около 7 г, 33,6 ммоль) в течение примерно 15 минут. Реакционную смесь перемешивают в течение примерно 4 часов при комнатной температуре. Растворитель удаляют в роторном испарителе. Добавляют смесь воды со льдом (около 10 мл), колбу и ее содержимое охлаждают на бане со льдом и полученный остаток растирают. Добавляют дополнительное количество смеси воды со льдом (около 50 мл), в результате чего продукт отверждается. Твердые вещества собирают фильтрованием, промывают смесью воды со льдом (около 20 мл) и сушат над пентоксидом фосфора в течение ночи, получая при этом около 6,95 г (78%) соединения 3.
1Н-ЯМР (CDCl3): δ 7,35 (5Н, с, Ar-H), 5,12 (2H, с, Ar-CH2), 3,89 (2H, т, СН2), наложение 3,85 (2Н, т, СН2).
Метил-3-бутилоксикарбониламидо-2-(S)-бензилоксикарбонил-амидоэтилсульфонамидопропионат (5). Смесь сульфонилхлорида 3 (около 21,6 г, 78 ммоль) и метил-3-N-бутоксикарбониламидо-2-аминопропионата (4, около 9,96 г, 39,2 ммоль) в безводном тетрагидрофуране (ТГФ, 150 мл) охлаждают на бане со льдом в атмосфере аргона при положительном давлении. К полученному раствору при помощи капельной воронки по каплям добавляют N-метилморфолин (около 16 мл, 145 ммоль) в безводном ТГФ (около 275 мл) в атмосфере аргона при положительном давлении в течение примерно 30 минут. Реакционную месь перемешивают на бане со льдом в течение примерно 1 часа и по результатам ТСХ определяют по существу полное расходование сульфонилхлорида (Rf=0,65)(элюент: этилацетат/гексан, 1:1). Однако в реакционной смеси все еще остается непрореагировавшая диаминопропионовая кислота (Rf=0,1, распыление нингидрина). К смеси добавляют дополнительное количество сульфонилхлорида (около 5,0 г, 18 ммоль) в течение примерно 3 часов. Полученный продукт реакции фильтруют и упаривают в роторном испарителе для удаления растворителя, растворяют в этилацетате (около 100 мл), промывают холодной разбавленной хлористоводородной кислотой (около 20 мл), насыщенным раствором бикарбоната натрия (около 20 мл) и насыщенным раствором хлорида натрия (около 20 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют в роторном испарителе и образовавшийся остаток сушат в вакууме в течение ночи. Высушенный остаток перекристаллизовывают, растворяя в этилацетате и добавляя такой же объем гексана, и получают сложный метиловый эфир 5 в виде бесцветного твердого вещества с выходом около 13,4 г (примерно 74%).
1Н-ЯМР (CDCl3): δ 7,36 (5Н, с, Ar-H), 5,83 (1H, д, NH), 5,55 (1H, т, NH), 5,12 (2Н, с, Ar-СН2), 5,06 (1Н, т, NH), 4,26 (2H, м, CH), 3,79 (3H, с, СН3), 3,70 (2Н, дд, СН2), 3,26 (2H, дд, СН2), 1,43 (9Н, с, (СН3)3).
3-Бутилоксикарбониламидо-2-(S)-бензилоксикарбониламидо-этилсульфонамидопропионовая кислота (6). Раствор сложного метилового эфира 5 (около 13,3 г, 28,9 ммоль) в тетрагидрофуране (около 160 мл) охлаждают на бане со льдом. К полученному раствору добавляют раствор гидроксида лития (около 5,42 г, 128 ммоль) в смеси воды со льдом (160 мл). Полученную реакционную смесь медленно нагревают до комнатной температуры, убрав баню со льдом, и перемешивают при комнатной температуре в течение примерно 1 часа. Органический растворитель удаляют в роторном испарителе. Остаточную водную часть промывают диэтиловым эфиром (около 20 мл) и подкисляют до около рН 4, используя разбавленную хлористоводородную кислоту. Полученный раствор охлаждают на бане со льдом, затем смешивают с этилацетатом (около 100 мл), подкисляют до около рН 1, используя охлаждаемую льдом разбавленную хлористоводородную кислоту, и сразу же экстрагируют этилацетатом (около 2х200 мл). Этилацетатный слой промывают насыщенным раствором соли (около 50 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют в роторном испарителе и образовавшийся остаток сушат в высоком вакууме в течение ночи, получая при этом около 13,3 г пенистого твердого вещества, которое перекристаллизовывают из гексана/этилацетата (1:1) и получают около 11,6 г (89,7%) соединения 6.
1Н-ЯМР (CDCl3): δ 7,33 (5Н, с, Ar-H), 6,12 (1H, д, NH), 5,68 (1H, т, NH), 5,26 (1Н, т, NH), 5,1 (2Н, c, Ar-CH2), 4,24 (2H, м, CH2), 3,67 (2H, т, СН2), 3,27 (2Н, т, СН2), 1,45 (9Н, с, (СН3)3.
3-Амино-2-(S)-бензилоксикарбониламидоэтилсульфонамидопропионовая кислота (7). N-ВОС-β-аминокислоту 6 (около 11,5 г, 25,8 ммоль) обрабатывают трифторуксусной кислотой (около 68 мл) в метиленхлориде (около 350 мл) в течение примерно 1,5 часов и упаривают досуха в роторном испарителе. Образовавшийся остаток растворяют в воде (около 200 мл) и лиофилизуют, получая при этом около 10,9 г (98,8%) соединения 7 в виде твердого вещества.
1Н-ЯМР (CDCl3): δ 7,30 (5Н, с, Ar-H), 6,07 (1H, д, NH), 5,61 (1H, т, NH), 5,20 (1Н, т, NH), 5,17 (2Н, c, Ar-CH2), 4,11 (2H, м, CH2), 3,53 (2H, т, СН2), 3,32 (2Н, т, СН2). DCI-MS для С13Н19N3O6S: m/z (ион); 346 (M+H) (вычислено для С13Н19N3O6S + H, m/z 346).
4-[2-(Пиримидин-2-иламино)этилокси]бензоил-2-(S)-бензил-оксикарбониламидоэтилсульфонамидо-β-аланин (9). Производное бензойной кислоты 8 (около 6,4 г, 24,7 ммоль) и N-гидроксисукцинимид (около 3,6 г, 31 ммоль) растворяют в безводном диметилсульфоксиде (около 110 мл) в атмосфере аргона при положительном давлении и охлаждают на бане со льдом. К полученному раствору добавляют гидрохлорид 1-(3-(диметиламино)пропил)-3-этилкарбодиимида (около 4,9 г, 25,6 ммоль). Раствор перемешивают при температуре охлаждения льдом в течение 1 часа и оставляют нагреваться до комнатной температуры. Реакционную смесь продолжают перемешивать при комнатной температуре примерно еще 24 часа. К полученной смеси добавляют раствор β-аминокислоты 7 (около 12,2 г, 25,8 ммоль) и N-метилморфолин. Полученную реакционную смесь перемешивают в атмосфере аргона в течение примерно 3 дней. Затем смесь выливают в воду (около 1 л), подкисляют разбавленной хлористоводородной кислотой примерно до рН 1,5 и экстрагируют этилацетатом (около 5х500 мл). Объединенную органическую фазу промывают насыщенным раствором хлорида натрия (около 50 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют в роторном испарителе. Образовавшийся остаток растирают в этилацетате, фильтруют и сушат в высоком вакууме, получая при этом около 10,5 г (72,5%) соединения 9.
1Н-ЯМР (ДМСО-d6): δ 8,30 (2Н, д, Ar-H), 7,99 (2H, д, Ar-H), 7,34 (5H, c, Ar-Н), 7,00 (2Н, д, Ar-Н), 6,60 (1Н, дд, Ar-H), 5,01 (2H, c, CH2), 4,15 (1H, т, СН), 3,67 (2Н, т, СН2), 3,56 (2H, т, СН2), 3,17 (2Н, т, СН2).
4-[2-(3,4,5,6-Тетрагидропиримидин-2-иламино)этилокси]-бензоил-2-(S)-аминоэтилсульфонамидо-β-аланин (10). Раствор производного пиримидина 9 (около 3,7 г, 6,4 ммоль) растворяют в уксусной кислоте (около 190 мл) и концентрированной хлористоводородной кислоте (около 17 мл). Полученный раствор смешивают с 10% палладием на угле (около 1,62 г) и гидрируют в атмосфере газообразного водорода под давлением 3,15 атм (45 фунтов/кв.дюйм) в течение примерно 5 часов. Полученную смесь фильтруют через целит и промывают водой. Растворитель удаляют в роторном испарителе и образовавшийся остаток сушат в высоком вакууме. Высушенный остаток растворяют в воде (около 100 мл), показатель рН доводят примерно до 7, добавляя 1 н. раствор гидроксида натрия, и упаривают досуха в роторном испарителе. Образовавшийся остаток растворяют в метаноле (около 20 мл) и фильтруют. Фильтрат упаривают в роторном испарителе, растворяют в воде (около 275 мл) и лиофилизуют. Полученный лиофилизованный продукт перекристаллизовывают из воды, получая при этом около 2,96 г (примерно 78,9%) продукта 10.
1Н-ЯМР (D2O): δ 7,80 (2Н, д, Ar-H), 7,14 (2H, д, Ar-H), 4,49 (1H, c, CHaHb), 4,28 (2Н, т, CH2), 3,94 (1Н, дд, CHaHb), 3,61 (6H, м, CH2), 3,32 (4H, т, СН2), 1,90 (2Н, т, СН2). ES-MS для С18Н28N6O6S: m/z (ион); 457 (M+H) (вычислено для С18Н28N6O6S + H, m/z 457).
[(PDA-PEG3)2-DTPA-(CONHPM)3] (12) (PDA-PEG3)2-DTPA-(COOH)3 (около 11,69 мг, 50 мкмоль) растворяют в безводном CH3CN (около 5 мл), безводном СН2Cl2 (около 2 мл) и Et3N (около 1 мл) в трехгорлой колбе с круглым основанием, которую предварительно сушат в пламени и заполняют аргоном. К полученному раствору добавляют реагент ВОР (около 134 мг, 150 мкмоль), образовавшуюся смесь тщательно перемешивают в течение 5 минут и получают липидный раствор. Раствор соединения 10 (около 69 мг, 150 мкмоль) получают в сухой пробирке, заполненной аргоном, в смеси безводного CH3CN (около 5 мл) и безводного диметилформамида (ДМФ) (около 2 мл). Раствор соединения 10 добавляют к липидному раствору с помощью сухого шприца при непрерывном перемешивании. Полученную реакционную смесь перемешивают в течение 10 часов в темноте. Результаты ТСХ (растворитель: CHCl3, CH3OH, H2O и СН3СООН) свидетельствуют о полном исчезновении исходного вещества (Rf = 0,53). Образуется один главный продукт (Rf = 0,2) и 5 второстепенных продуктов (Rf < 0,18). Растворитель удаляют в роторном испарителе, образовавшийся остаток сушат в высоком вакууме в течение примерно 24 часов и получают сырой продукт. Сырой продукт очищают ВЭЖХ с нормальной фазой, используя колонку с силикагелем для полупрепаративной хроматографии и скоростью потока около 5 мл/мин (система градиентного элюирования: сначала 100% CHCl3 в течение примерно 5 минут, затем 75% CHCl3/25% CH3OH в течение 10 минут, 50% CHCl3/50% CH3OH в течение 10 минут, 25% CHCl3/75% CH3OH в течение примерно 10 минут и наконец 100% СН3ОН в течение примерно 20 минут). Фракции (время удерживания 35-37 минут), содержащие главный продукт, объединяют и упаривают в роторном испарителе для удаления растворителя, образовавшийся остаток сушат в высоком вакууме в течение примерно 24 часов, получая при этом около 35,5 мг (26,5%) требуемого продукта. MALDI-FTMS с высоким разрешением: m/z 2681,4711 (вычислено для С130Н209N25O29S3 + H, m/z 2681,4882).
ПРИМЕРЫ
Пример 1. Анализ клеточной адгезии
Исследование ингибирования клеточной адгезии выполняют на планшетах, покрытых витронектином, с использованием клеток меланомы человека линии М21. Мультивалентные липосомы NP1-NP6 и мономерный лиганд 10 отдельно инкубируют с клетками М21 и переносят на 48-луночные планшеты, покрытые витронектином. Культуры инкубируют в течение примерно 1 часа, после чего лунки промывают, сросшиеся клетки окрашивают раствором кристаллического фиолетового и измеряют оптическую плотность (OD) при длине волны около 590 нм. Измеренная оптическая плотность пропорциональна числу клеток, связанных с витронектином на планшете; используя полученные данные, строят график зависимости от концентрации компонента 10 на поверхности наночастиц в разных препаратах для вычисления IC50.
На фиг.8 схематически показан анализ клеточной адгезии, при выполнении которого клетки меланомы человека М21, экспрессирующие αvβ3-интегрин, смешивают с липосомами, ковалентно конъюгированными с антагонистом интегрина (лиганд) или только с лигандом. Затем клетки переносят на планшеты, покрытые витронектином, промывают и окрашивают. При помощи аппарата для прочтения планшетов подсчитывают количество связанных клеток.
На фиг.9 графически представлены данные, полученные при выполнении анализа клеточной адгезии, показанного на фиг.8, которые свидетельствуют о том, что липосомы, связанные с антагонистом интегрина, эффективно ингибируют клеточную адгезию (IC50 = 1 мкМ), в то время как только антагонист (лиганд) гораздо менее эффективно ингибирует клеточную адгезию (IC50 = 0,5 мМ).
Пример 2. Анализ трансфекции in vitro
Примерно 30 наномолей катионных липосом NP5 и NP6 с ковалентно конъюгированным лигандом, направленно воздействующим на αvβ3-интегрин, или без него используют для образования комплекса примерно с 2 мкг плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (GFP), в 5% растворе декстрозы и подвергают воздействию клеток меланомы in vitro в течение примерно 1 часа. Эффективность трансфекции определяют, подсчитывая количество флуоресцирующих клеток по сравнению с общим количеством клеток через 24 часа. Использованы клетки меланомы человека М21 и М21L. Клетки М21 экспрессируют αvβ3-интегрин, в то время как клетки М21L не экспрессируют αvβ3-интегрин (отсутствие αv).
Как показано на фиг.10, клетки, экспрессирующие αv-интегрин (М21), которые были обработаны липосомой направленного действия (NP5), образующей комплекс с геном GFP, характеризуются 5-кратной или более высокой степенью трансфекции (>125000 клеток/миллион) по сравнению с клетками, экспрессирующими αv-интегрин, которые были обработаны липомосами ненаправленного действия (NP6)(без антагониста; около 25000 клеток/миллион) или только ДНК (без липосомы; около 12000 клеток/миллион). В отличие от этого в клетках, не экспрессирующих αv-интегрин (М21L), не отмечено преимущественное внедрение гена GFP, что свидетельствуют об относительно низких уровнях трансфекции (25000 клеток/миллион или меньше) независимо от производимой обработки. Таким образом, установлено, что носители гена направленного действия трансфицируют клетки в зависимости от наличия αvβ3-интегрина.
Пример 3. Опосредуемая липосомой направленного действия доставка гена к опухоли in vivo
Примерно 450 наномолей липосом NP5 и NP6 используют для электростатического образования комплекса примерно с 30 мкг плазмидной ДНК, кодирующей люциферазу светляков, примерно в 200 мкл 5% раствора декстрозы, после чего раствор комплекса липосомы и ДНК вводят в виде внутривенной инъекции животным, имеющим подкожную меланому объемом около 150 мм3, не экспрессирующую αvβ3 (М21L). Примерно через 24 часа животных умерщвляют, удаляют указанные органы и опухоли и анализируют активность люциферазы. Активность люциферазы определяют при помощи набора для анализа люциферазы Bright-Glo (Promega Corp., Madison, WI) в соответствии с инструкциями изготовителя за исключением того, что цельные органы измельчают в гомогенизаторе ткани, содержащем реагент для лизиса Bright-Glo в количестве, нормализованном с учетом массы органа.
Как показано на фиг.11, липосома направленного действия (NP5), образующая комплекс с геном люциферазы, характеризуется высокой избирательной экспрессией в ткани опухоли по сравнению с тканями легкого, печени и сердца, при этом уровень экспрессии составляет примерно 4 пикограмма люциферазы/мг ткани по сравнению с уровнями менее пикограмма/мг ткани в других тканях. Липосома ненаправленного действия (NP6), образующая комплекс с люциферазой, неэффективно трансфицируют все ткани. Добавление примерно 20-кратного избытка растворимого лиганда антагониста интегрина эффективно ингибирует трансфекцию клеток лигандом направленного действия.
Пример 4. Регресс стабильных меланом в результате опосредуемой липосомой направленного действия доставки мутантных генов Raf к сосудистой сети опухоли
Меланомы, не экспрессирующие αvβ3-интегрин, (М21L) вводят в виде подкожной инъекции в боковую часть тела животных и оставляют расти до объема около 70 мм3, после чего мышам в виде внутривенной инъекции вводят 200 мкл 5% раствора декстрозы (контрольная группа), липосомы направленного действия NP5, образующей комплекс примерно с 30 мкг плазмидной ДНК, кодирующей мутантную доминантную отрицательную форму киназы Raf (Raf-ATPμ), в 200 мкл 5% раствора декстрозы, или образующей комплекс с челночным вектором, не кодирующим никакую ДНК, в 200 мкл 5% раствора декстрозы. Примерно через пятнадцать дней производят повторную обработку опухолей вышеуказанным способом. Размер опухоли измеряют в интервалы времени, указанные на фиг.12, используя формулу: объем опухоли = (минимальный диаметр)2 · максимальный диаметр/2.
Как показано на фиг.12, обработка мышей, имеющих меланомы с начальным объемом около 70 мм3, липосомами направленного действия NP5, образующими комплекс с мутантной доминантной отрицательной формой киназы Raf (Raf-ATPμ), вызывает первоначальное увеличение объема опухоли примерно до 550 мм3, после чего примерно через 30 дней происходит регресс опухоли с достижением стабильного состояния при объеме опухоли около 200 мм3 на 35-й день (обозначение "частица/Raf(-)" на фиг.12). Стабильный размер опухоли сохраняется в течение последующих 30 дней, по истечении которых выполнение эксперимента прекращают. У мышей, которым вводят только липосому направленного действия NP5 (без гена) (обозначение "частица/челночный вектор") или только мутантный ген Raf (без липосомы), опухоли продолжают расти в течение всех 35 дней без каких-либо признаков обратного развития. Поскольку опухоли не экспрессируют αvβ3-интегрин, а эндотелиальные клетки развивающихся сосудов экспрессируют αvβ3-интегрин, то уменьшение роста опухоли, по-видимому, связано с ингибированием ангиогенеза сосудистой сети опухоли.
Пример 5. Регресс стабильных меланом в результате опосредуемой липосомой направленного действия доставки мутантных генов Raf к сосудистой сети опухоли
Опухоли подвергают такой же обработке, как в примере 4, за исключением того, что опухоли оставляют расти до объема около 300 мм3 до первоначальной обработки, когда животным вводят в виде инъекции (а) примерно 450 наномолей липосомы направленного действия NP5, образующей комплекс в результате электростатического воздействия примерно с 30 мкг плазмидной ДНК, кодирующей Raf-ATPμ, примерно в 200 мкл 5% раствора декстрозы, (b) примерно 450 наномолей липосомы ненаправленного действия NP6, образующей комплекс в результате электростатического воздействия примерно с 30 мкг плазмидной ДНК, кодирующей Raf-ATPμ, в 200 мкл 5% раствора декстрозы,или (с) примерно 450 наномолей липосомы направленного действия, образующей комплекс в результате электростатического воздействия примерно с 30 мкг плазмидной ДНК, кодирующей Raf-ATPμ, в смеси с около 20-молярным избытком конкурирующего лиганда для αvβ3-интегрина примерно в 200 мкл 5% раствора декстрозы. Измерения опухоли производят в интервалы времени, указанные на фиг.13, где эксперимент (а) обозначен как "Raf(-)", (b) обозначен как (ненаправленное действие), (с) обозначен как "избыток". Кроме того, выполнен контрольный эксперимент, в котором опухоль не подвергают никакому воздействию.
Как показано на фиг.13, обработка мышей, имеющих меланомы с начальным объемом опухоли 300 мм3, липосомами направленного действия NP5, образующей комплекс с мутантной доминантной отрицательной формой киназы Raf (Raf-ATPμ), после периода первоначального роста вызывает регресс объема опухоли по сравнению с контрольными группами без обработки.
Пример 6. Избирательность опосредуемой липосомой направленного действия доставки для ангиогенных сосудов
Примерно 300 наномолей NP5 используют для образования комплекса примерно с 20 мкг плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (GFP), примерно в 50 мкл 5% раствора декстрозы и вводят в виде внутривенной инъекции в эмбрионы цыплят, хорионаллантоисные мембраны (САМ) которых предварительно помещают на фильтровальный диск, насыщенный 1 мг/мл bFGF, примерно на 24 часа для стимуляции ангиогенеза. Через один день после инъекции комплекса ткань САМ собирают, промывают PBS, фиксируют в 4% растворе параформальдегида и исследуют на наличие флуоресценции. Результаты представлены на фиг.14.
GFP в большом количестве локализован в сосудистой сети САМ, как видно на микрофотографиях, показанных на фиг.14.
Пример 7. Апоптоз сосудистой сети и последующая гибель клеток в результате опосредуемой липосомой направленного действия доставки мутантных генов Raf к сосудистой сети опухоли
Меланомы, не экспрессирующие αvβ3-интегрин, вводят в виде подкожной инъекции в боковую часть тела мышей. Образовавшиеся опухоли оставляют расти до объема около 200 мм3, после чего мышам в виде внутривенной инъекции вводят около 450 наномолей липосомы NP5, образующей комплекс примерно с 30 мкг плазмидной ДНК, кодирующей Raf-ATPμ или челночный вектор, примерно в 200 мкл 5% раствора декстрозы. Опухоли удаляют примерно через 72 часа, фиксируют в 4% растворе параформальдегида, делают срезы и окрашивают фактором фон Виллебранда (маркер сосудов), после чего исследуют апоптоз клеток методом TUNEL для обнаружения фрагментированной ДНК (Intergen Corp, Purchase, NY).
На микрофотографиях, приведенных на фиг.15, видно, что опухоли, подвергнутые воздействию наночастицы/челночного вектора (контрольный эксперимент), имеют относительно высокую плотность сосудов при апоптозе лишь нескольких клеток. В отличие от этого, большинство сосудов в опухолях подвергнутых воздействию NP5/Raf-ATPμ, подвергают апоптозу и большие области опухоли погибают на определенном расстоянии от апоптозных сосудов, главным образом, вследствие недостаточного кровоснабжения.
Пример 8. Избирательность опосредуемой липосомой направленного действия доставки для ангиогенных сосудов
Боковые ответвления капилляров поверхностного переплетения сосудистой сети сетчатки проникают внутрь сетчатки и образуют глубокую сосудистую сеть между 8-м (Р8) и 10-м (Р10) днями после рождения мыши. В данном исследовании на 10-й день (Р10) после рождения мышам в стекловидное тело вводят в виде инъекции липосому направленного действия NP5, образующую комплекс примерно с 0,15 мкг плазмидной ДНК, кодирующей зеленый флуоресцирующий белок, примерно в 1 мкл 5% раствора декстрозы. Примерно через 24 часа после инъекции NP5, образующей комплекс с геном GFP, мышей умерщвляют, сетчатки окрашивают, используя в качестве иммунной метки связанные с родамином антитела против коллагена IV (маркер сосудов), и исследуют при помощи сканирующей микроскопии с 2-фотонным лазером для определения относительного уровня GFP в кровеносных сосудах сетчатки.
На микрофотографиях, показанных на фиг.16, видно, что GFP в большом количестве локализован в сосудистой сети сетчатки.
В описанные выше варианты осуществления изобретения и примеры могут быть внесены многочисленные изменения и модификации, не выходящие за пределы объема данного изобретения. Представленные варианты осуществления изобретения, а также возможные или предполагаемые варианты не имеют никаких ограничений. Прилагаемая формула изобретения включает все такие модификации, которые входят в объем притязаний.



Настоящее изобретение относится к химико-фармацевтической промышленности и касается липосомы, направленно воздействующей на рецептор αvβ3-интегрина и включающей: катионное амфифильное вещество, включающее 1,2-диол-еоилокси-3-(N,N,N-триметиламмоний)пропанхлорид; нейтральный липид; липид направленного действия, имеющий домен направленного действия и гидрофобный домен, связанный с доменом направленного действия; и нуклеиновую кислоту, образующую комплекс с катионным липидом; при этом катионный липид присутствует в количестве от около 1 до около 50 молярных процентов, и указанный липид направленного действия присутствует в количестве от около 1 до около 20 молярных процентов, причем молярные проценты определяют в расчете на общее число молей липида в липосоме, и домен направленного действия включает непептидный антагонист αvβ3-интегрина, содержащий 4-[2-(3,4,5,6-тетрагидропиримидин-2-иламино)этилокси]-бензоил-2-(S)-аминоэтилсульфонамино-β-аланин (соединение 10), ковалентно связанный с гидрофильным доменом амидной связью. Изобретение также касается способа подавления ангиогенеза, включающего введение субъекту, нуждающемуся в подавлении ангиогенеза, терапевтически эффективного количества липосомы, направленно воздействующей на рецептор αvβ3-интегрина, содержащей нуклеиновую кислоту, которая способна экспрессировать белок или пептид, подавляющий ангиогенез. 4 н. и 23 з.п. ф-лы, 2 табл., 18 ил.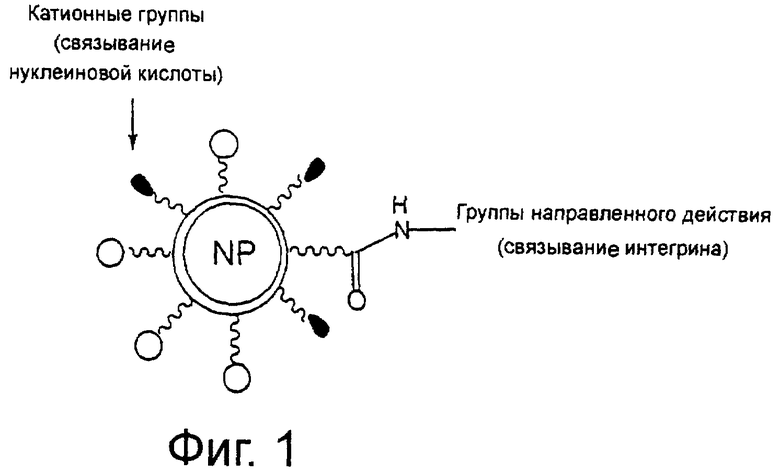
| US 5641662 А, 24.06.1997 | |||
| Сдвигающий регистр | 1973 |
|
SU478363A1 |
| Реф | |||
| Hakomori S., "Tumor-associated carbohydrate antigens defining tumor malignancy: basis for development of anti-cancer vaccines.", Adv Exp Med Biol | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНЫХ ПРЕПАРАТОВ | 1998 |
|
RU2130771C1 |
Авторы
Даты
2007-02-27—Публикация
2002-05-30—Подача