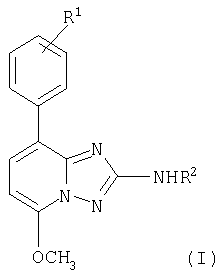
Настоящее изобретение относится к соединениям общей формулы
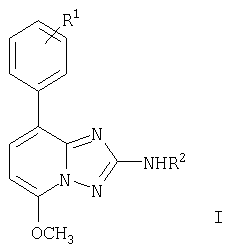
в которой
R1 представляет собой водород, галоген или низший алкокси;
R2 представляет собой водород или -С(O)-низший алкил, или -С(O)-фенил, в котором фенильное кольцо является незамещенным или замещенным одним или двумя заместителями, выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси или трифторметила, или представляет собой -С(O)-фуранил или -С(O)-тиофенил, в которых кольца не замещены или замещены галогеном;
и к их фармацевтически приемлемым солям.
Неожиданно было обнаружено, что соединения общей формулы I являются лигандами рецептора аденозина.
Аденозин является модулятором множества физиологических функций посредством взаимодействия со специфическими рецепторами поверхности клетки. Обзор возможного использования рецепторов аденозина в качестве мишеней для лекарственных средств впервые был сделан в 1982 году. Как по своей структуре, так и по метаболизму, аденозин близок к биологически активным нуклеотидам аденозинтрифосфату (АТФ), аденозиндифосфату (АДФ), аденозинмонофосфату (АМФ) и циклическому аденозинмонофосфату (цАМФ); к биохимическому метилирующему агенту S-аденозил-L-метионину (S-AM); и структурно - к коферментам NAD, FAD и коферменту А; а также к РНК (рибонуклеиновой кислоте). Как аденозин, так и указанные его производные играют важную роль в регулировании многих аспектов метаболизма клеток, а также в модулировании различных видов активности центральной нервной системы.
Рецепторы аденозина классифицируют как А1, А2А, А2В и А3 рецепторы, относящиеся к семейству ассоциированных с G-белком рецепторов. Активация аденозином рецепторов аденозина инициирует механизмы передачи сигнала. Эти механизмы зависят от вида рецептора, ассоциированного с G-белком. Каждый из подтипов рецептора аденозина традиционно характеризуется посредством аденилатциклазной эффекторной системы, в которой цАМФ используется в качестве вторичного мессенджера. А1 и А3 рецепторы, ассоциированные с GS-белками, ингибируют аденилатциклазу, что приводит к снижению содержания цАМФ в клетках, в то время как A2A и А2B рецепторы взаимодействуют с GS-белками и активируют аденилатциклазу, что приводит к повышению содержания цАМФ в клетках. Известно, что система A1 рецептора включает активацию фосфолипазы С и модулирование как калиевых, так кальциевых ионных каналов. Подтип A3, в дополнение к его ассоциации с аденилатциклазой, также стимулирует фосфолипазу С и таким образом активирует кальциевые ионные каналы.
A1 рецептор (326-328 аминокислот) клонируют из различных биологических видов (таких как псовые, человек, крыса, собака, курица, бык, морская свинка) с 90-95% идентичностью последовательности среди видов млекопитающих. A2A рецептор (409-412 аминокислот) клонируют из псовых, крыс, человека, морской свинки и мыши. А2B рецептор (332 аминокислоты) клонируют из человека и мыши с 45%-ной гомологичностью А2B рецептора человека по отношению к A1 и A2A рецепторам человека. A3 рецептор (317-320 аминокислот) клонируют из человека, крысы, собаки, кролика и овцы.
Как полагают, подтипы - A1 и A2A рецепторы - выполняют комплементарную функцию в регулируемой с участием аденозина передаче энергии. Аденозин, который представляет собой продукт метаболизма АТФ, диффундирует из клетки и действует локально, активируя рецепторы аденозина, с понижением при этом потребления кислорода (A1) или повышением подачи кислорода (A2A), и таким образом восстанавливает равновесие между подачей энергии и ее потреблением в тканях. Действие и того, и другого подтипов заключается в повышении количества доступного тканям кислорода и защите клеток от повреждения, вызываемого кратковременным нарушением кислородного баланса. Одной из важных функций эндогенного аденозина является предотвращение повреждений при травмах, таких как гипоксия, ишемия, гипотензия, и состояниях при приступе.
Кроме того, известно, что связывание агониста рецептора аденозина тучными клетками, экспрессирующими аз рецептор крысы, приводит к повышению содержания инозитолтрифосфата и повышению концентрации кальция внутри клетки, что усиливает индуцированную антигеном секрецию противовоспалительных медиаторов. Таким образом, А3 рецептор выполняет роль медиатора при астматических атаках и других аллергических реакциях.
Аденозин также является нейромодулятором, имеющим исключительную важность при модулировании молекулярного механизма, лежащего в основе многих аспектов физиологической функции мозга и осуществляемого при участии аденозина в качестве медиатора ингибирующих эффектов центральной системы. Повышение высвобождения нейротрансмиттеров приводит к травмам, таким как гипоксия, ишемия и приступы. Такие нейротрансмиттеры в основном ответственны за дегенерацию нервной системы и гибель нейронов, которые приводят к повреждению мозга или гибели индивидуума. Агонисты A1 рецептора аденозина, которые имитируют центральные ингибирующие эффекты аденозина, могут, таким образом, быть полезны в качестве нейропротекторных агентов. Предлагалось использовать аденозин в качестве эндогенного противосудорожного агента, ингибирующего высвобождение глутамата из нейронов-возбудителей и ингибирующего запуск нейронов. Агонисты аденозина, таким образом, могут быть использованы в качестве противоэпилептических агентов. Антагонисты аденозина стимулируют активность центральной нервной системы (ЦНС) и, как было показано, эффективны в качестве усилителей познавательной способности. Селективные A2A-антагонисты обладают терапевтическим потенциалом при лечении различным форм деменции, например, в случае болезни Альцгеймера, и могут быть полезны в качестве нейропротекторных агентов. Антагонисты A2 рецептора аденозина ингибируют высвобождение допамина из центральных синаптических терминалов и снижают локомоторную активность, в результате снижается проявление симптомов при болезни Паркинсона. Активность аденозина в отношении центральной нервной системы также связана с молекулярными механизмами, лежащими в основе успокоения, гипноза, шизофрении, беспокойства, боли, дыхания, депрессии и наступления приступов. Следовательно, лекарственные средства, воздействующие на рецепторы аденозина, обладают терапевтическим потенциалом как седативные средства, миорелаксанты, агенты, снимающие или предотвращающие приступы психоза, анксиолитические агенты, анальгетики, стимуляторы дыхания и антидепрессанты.
Аденозин играет важную роль в кардиоваскулярной системе, являясь кардиопротектором. Содержание эндогенного аденозина повышается при реакции на ишемию и гипоксию, что защищает ткани сердца во время и после травмы (стабилизация). Следовательно, агонисты аденозина являются потенциальными кардиопротекторными агентами.
Аденозин является модулятором многих аспектов функционирования почек, включая высвобождение ренина, воздействие на скорость гломерулярной фильтрации и почечный кровоток. Соединения, которые препятствуют вредному воздействию аденозина на почки, являются потенциальными агентами для защиты почек. Кроме того, антагонисты аденозина A3 и/или A2B могут быть полезны для лечения астмы и других аллергических реакций.
Современное состояние исследований в области рецепторов аденозина представлено в большом числе документов, например в следующих публикациях:
Bioorganic & Medicinal Chemistry, 6, (1998), 619-641,
Bioorganic & Medicinal Chemistry, 6, (1998), 707-719,
J. Med. Chem., (1998), 41, 2835-2845,
J. Med. Chem., (1998), 41, 3186-3201,
J. Med. Chem., (1998), 41, 2126-2133,
J. Med. Chem., (1999), 42, 706-721,
J. Med. Chem., (1996), 39, 1164-1171,
Arch. Pharm. Med. Chem., (1999), 332, 39-41.
Целью настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли как сами по себе, так и в качестве фармацевтически активных соединений, их изготовление, лекарственные средства на основе соединений согласно настоящему изобретению и их изготовление, и также применение соединений формулы I для контроля или предотвращения заболеваний, в основе которых лежит модулирование аденозиновой системы, например таких, как болезнь Альцгеймера, болезнь Паркинсона, нейропротекция, шизофрения, беспокойство, боль, недостаточность дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, припадки и приступы. Кроме того, соединения, являющиеся предметом настоящего изобретения, могут быть использованы как седативные агенты, миорелаксанты, агенты, снимающие или предотвращающие приступы психоза, противоэпилептические агенты, противосудорожные агенты и кардиопротекторные агенты. Наиболее предпочтительными направлениями использования в соответствии с настоящим изобретением являются такие, которые базируются на антагонистической активности в отношении A2A рецептора и которые включают нарушения и расстройства центральной нервной системы, например лечение и профилактику некоторых депрессивных состояний, нейропротекторное действие и болезнь Паркинсона.
При использовании в тексте заявки термин "низший алкил" означает алкильную группу с насыщенной линейной или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например, такую как метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и подобные им группы. Предпочтительны низшие алкильные группы с 1-4 атомами углерода.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "низший алкокси" означает группу, в которой алкильный остаток является таким, как определено выше, и которая присоединена через атом кислорода.
Термин "фармацевтически приемлемые соли - продукты присоединения кислоты" означает соли, образованные с неорганическими и органическими кислотами, например с такими, как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и с им подобными кислотами.
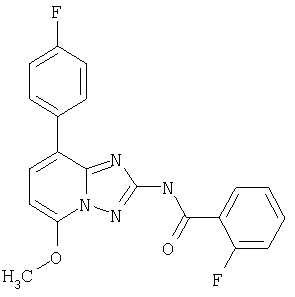
Соединения формулы I согласно настоящему изобретению, в которых R2 представляет собой -С(O)-фенил, замещенный галогеном, являются предпочтительными. Например, это следующие соединения:
4-фтор-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид,
4-бром-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид,
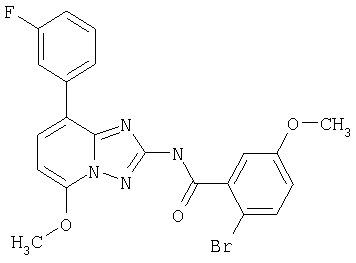
4-бром-N-[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]бензамид,
4-фтор-N-[8-(4-фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-ил]бензамид или
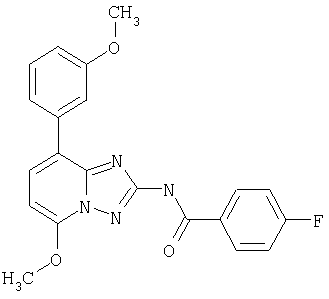
4-фтор-N-[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]бензамид.
Кроме того, предпочтительными являются соединения, в которых R2 представляет собой -С(O)-фуранил, замещенный галогеном. Примерами соединений этой группы служат следующие соединения:
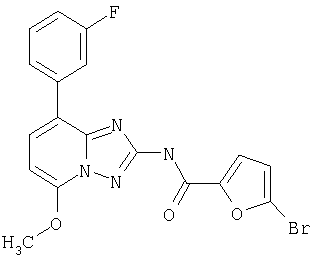
[8-(3-фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-ил]амид 5-бромфуран-2-карбоновой кислоты или
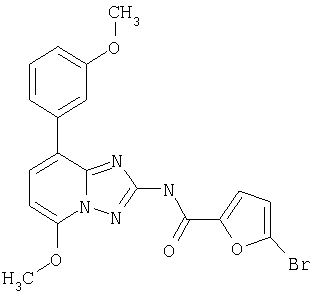
[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]амид 5-бромфуран-2-карбоновой кислоты.
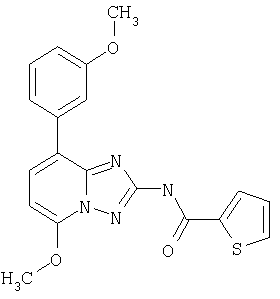
Также предпочтительны соединения формулы I согласно настоящему изобретению, в которых R2 представляет собой -С(O)-тиофенил. Например, следующее соединение:
[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]амид тиофен-2-карбоновой кислоты.
Соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными из уровня техники, например, согласно способу, описанному ниже, этот способ включает
а) взаимодействие соединения формулы
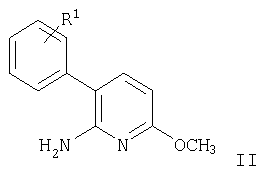
с этоксикарбонилизотиоцианатом с получением при этом соединения формулы
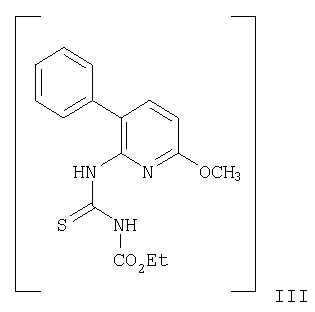
и циклизацию соединения формулы III в присутствии гидроксиламина с получением при этом соединения формулы
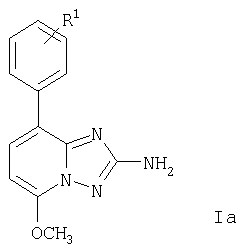
в котором R1 имеет приведенные выше значения, или
б) взаимодействие соединения формулы

с соединением формулы
R2Cl
с получением при этом соединения формулы

в которой R1 и R2 являются такими, как определено выше, и
если необходимо, превращение полученных соединений в фармацевтически приемлемые соли - продукты присоединения кислоты.
В примерах 1-42 и на следующей схеме 1 получение соединений формулы I представлено более подробно.
На схеме 1 ДИПЭА означает N-этилдиизопропиламин.
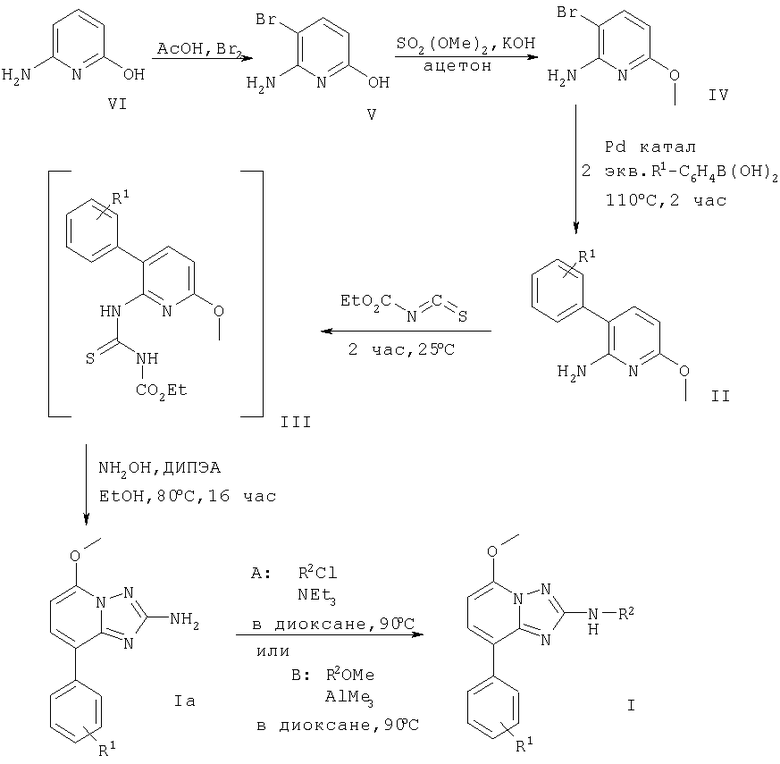
В соответствии со схемой 1 соединение формулы V (6-амино-5-бромпиридин-2-ол) может быть получено, как описано в статье: Kelly, Т.R.; Jagoe, С.Т.; Gu, Z. Tetrahedron Letters, 1991, v.32, р.4263-4266, следующим образом. К раствору 6-аминопиридин-2-ола в уксусной кислоте при комнатной температуре добавляют бром и перемешивают в течение 15 мин. Полученную смесь разбавляют водой и осадок отфильтровывают. Фильтрат экстрагируют, объединенные органические слои высушивают и упаривают досуха. Затем суспензию 6-амино-5-бромо-пиридин-2-ола обрабатывают гранулами КОН и диметилсульфатом. Смесь перемешивают в течение 4 час при комнатной температуре и упаривают досуха. Полученный остаток очищают и получают 3-бромо-6-метокси-пиридин-2-иламин (IV). Затем смесь 3-бром-6-метоксипиридин-2-иламина, фенилбороновой кислоты (в которой фенильное кольцо может быть замещено радикалом R1), Na2СО3 и аддукта - дихлоро[1,1'-бис(дифенилфосфино)ферроцен]палладий II дихлорметана в диоксане нагревают до 110°С в течение 2 час. Смесь концентрируют, добавляют разбавленный водный раствор Na2СО3 и экстрагируют. Объединенные органические фазы высушивают и упаривают. Полученный остаток очищают, получая при этом соответствующее соединение формулы II, например, 6-метокси-3-фенилпиридин-2-иламин. Смесь 6-метокси-3-фенилпиридин-2-иламина (II) и этоксикарбонилизотиоцианата перемешивают при комнатной температуре в течение 2 час, после чего упаривают досуха. Полученное соединение формулы III затем обрабатывают смесью гидроксиламина гидрохлорида и N-этилдиизопропиламина (ДИПЭА). Полученную смесь нагревают до 80°С в течение 16 час, концентрируют досуха, помещают в воду и экстрагируют диэтиловым эфиром. Объединенные органические слои высушивают и упаривают, получая при этом, например, 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламин (Ia). Смесь 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламина и соединение формулы R2Cl, например, хлорангидрид 3-фторфенилкарбоновой кислоты, и NEt3 в диоксане нагревают до 90°С в течение 16 час. Полученную смесь очищают, получая при этом соединение формулы I, например, 3-фторо-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид.
Получение солей осуществляют при комнатной температуре в соответствии с методами, которые по существу известны и хорошо знакомы специалисту в данной области техники. В объем изобретения входят не только соли с неорганическими кислотами, но также и соли, образованные с органическими кислотами. Примерами указанных солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеинаты, сукцинаты, метансульфонаты, n-толуолсульфонаты и подобные им соли.
Соединения формулы I и их фармацевтически приемлемые соли - продукты присоединения кислоты обладают ценными фармакологическими свойствами. А именно, было обнаружено, что соединения, являющиеся предметом настоящего изобретения, являются лигандами рецептора аденозина.
Соединения были исследованы в соответствии с тестами, приведенными ниже.
А2A рецептор аденозина человека
A2A рецептор человека рекомбинантно экспрессируют в овариальных клетках китайского хомяка (СНО-клетках), используя систему экспрессии с вирусом "semliki forest". Клетки собирают, дважды промывают с использованием центрифугирования, гомогенизируют и опять промывают с использованием центрифугирования. Полностью промытые частички мембран суспендируют в трис-буфере (50 мМ), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). Исследование связывания [3H]-SCH-58261 (Dionisotti et al., Br. J. Pharmacol. 1997, v.121, p.353) проводят в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг Ysi-поли-1-лизин-SPA-гранул и 0,1 Ед аденозиндеаминазы в конечном объеме, составляющем 200 мкл буфера А. Неспецифическое связывание определяют, используя ксантинаминный конгенер (ХАС; 2 мкМ). Соединения тестируют при 10 концентрациях, от 10 мкМ до 0,3 нМ. Все исследования осуществляют параллельно в двух сериях, и каждый анализ повторяют по меньшей мере два раза. Перед центрифугированием планшеты, используемые для проведения исследования, инкубируют в течение 1 часа при комнатной температуре, после чего количество связанного лиганда оценивают с использованием сцинтилляционного счетчика "Packard Topcount". Значения IC50 вычисляют, используя программу нелинейной аппроксимации, а величины Ki вычисляют, используя уравнение Ченга-Прусоффа (Cheng-Prussoff).
В соответствии с настоящим изобретением было обнаружено, что соединения формулы I обладают высоким сродством к рецептору А2А.
В приведенной ниже таблице приведены конкретные значения для синтезированных соединений.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарственных средств, например в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например в виде таблеток, таблеток с покрытием, драже, мягких и твердых желатиновых капсул, растворов, эмульсий или суспензий. Однако введение также может быть эффективно осуществлено ректально, например в виде суппозиториев, парентерально, например в виде растворов для инъекций.
Соединения формулы I могут быть использованы вместе с фармацевтически инертными, неорганическими или органическими носителями для изготовления фармацевтических препаратов. Могут быть использованы лактоза, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и подобные им вещества, например, в качестве носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Подходящие носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им вещества. Учитывая природу активного вещества, в случае мягких желатиновых капсул носитель обычно не требуется. Подходящие носители для изготовления растворов и сиропов представляют собой, например, воду, полиолы, глицерин, растительное масло и подобные им вещества. Подходящие носители для суппозиториев представляют собой, например, натуральные или гидрированные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им вещества.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие средства, эмульгаторы, подсластители, подкрашивающие вещества, а также вещества, улучшающие вкус и запах, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Фармацевтические препараты также могут содержать другие терапевтически значимые вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектами настоящего изобретения, как и способ их получения, который включает объединение одного или более соединения формулы I и/или его фармацевтически приемлемой соли - продукта присоединения кислоты и, если необходимо, одного или более другого терапевтически значимого вещества с получением лекарственной формы для введения вместе с одним или более терапевтически инертным агентом.
В соответствии с изобретением соединения формулы I, а также их фармацевтически приемлемые соли пригодны для регулирования протекания или профилактики заболевания, связанного с антагонистической активностью в отношении рецепторов аденозина, например, такого как болезнь Альцгеймера, болезнь Паркинсона, нейропротекторное действие, шизофрения, беспокойство, боль, затрудненность дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, припадки и приступы. Кроме того, соединения, являющиеся предметом настоящего изобретения, могут быть полезны в качестве седативных агентов, миорелаксантов, агентов, снимающих или предотвращающих приступы психоза, противоэлептических агентов, противосудорожных средств и кардиопротекторных агентов, а также для изготовления соответствующих лекарственных средств.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются такие, которые включают нарушения или расстройства центральной нервной системы, например, такие как лечение или профилактика некоторых депрессивных расстройств, купирование или предотвращение приступов психоза и болезнь Паркинсона. Дозировка может варьироваться в широких пределах и, конечно, ее следует регулировать в зависимости от индивидуальных потребностей в каждом конкретном случае. В случае перорального введения дозировка для взрослых может варьироваться от приблизительно 0,01 мг до приблизительно 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Дневная доза может быть введена в виде одной дозы или разделена на несколько доз, и в дополнение, верхний предел может быть превышен в том случае, когда для этого есть показания.
Пример 1
5-Метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламин
а) 6-Амино-5-бромо-пиридин-2-ол
(Литература: Kelly, Т.R.; Jagoe, С.Т.; Gu, Z. Tetrahedron Letters, 1991, v.32, р.4263-4266)
К раствору 11 г (100 ммоль) 6-аминопиридин-2-ола в 220 мл уксусной кислоты при комнатной температуре добавляют 5,12 мл (100 ммоль) брома и перемешивают в течение 15 мин. Смесь разбавляют водой и отфильтровывают осадок. Фильтрат четыре раза экстрагируют, используя 400 мл этилацетата. Объединенные органические слои высушивают над MgSO4 и упаривают досуха, получая при этом 12,2 г (65%) указанного в заголовке соединения в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, ДМСО-d6): δ=10,0 (s, шир, 1Н, ОН), 7,37 (d, J=3 Гц, 1H, H-4), 6,10 (s, шир, 2Н, NH2), 5,58 (d, J=3 Гц, 1H, Н-3).
Масс-спектр: m/e (%): 190 (М+Н+, 100).
б) 3-Бромо-6-метоксипиридин-2-иламин
Суспензию 11,58 г (61 ммоль) 6-амино-5-бромпиридин-2-ола в 200 мл ацетона обрабатывают, используя 10,3 г (184 ммоль) гранул КОН и 10 г (80 ммоль) диметилсульфата. Смесь перемешивают в течение 4 час при комнатной температуре и упаривают досуха. Добавляют 400 мл воды и экстрагируют смесь четыре раза, используя 300 мл этилацетата. Объединенные органические фазы высушивают над MgSO4 и упаривают. Полученный остаток очищают колоночной экспресс-хроматографией на силикагеле, элюируя смесью гексан/этилацетат в соотношении 1:1 и получая при этом 3,455 г (28%) указанного в заголовке соединения в виде оранжевого маслянистого вещества.
1H-ЯМР (400 МГц, ДМСО-d6): δ=7,54 (d, J=2 Гц, 1H, Н-4), 6,10 (s, шир, 2Н, NH2), 5,90 (d, J=2 Гц, 1H, Н-3), 3.75 (s, 3H, ОСН3).
Масс-спектр: m/e (%): 204 (М+Н+ 100).
в) 6-Метокси-3-фенилпиридин-2-иламин
Смесь 330 мг (1,625 ммоль) 3-бромо-6-метоксипиридин-2-иламина, 396 мг (3,25 ммоль) фенилбороновой кислоты, 1 мл 2Н раствора Na2CO3 и 59 мг (0,08 ммоль) аддукта с дихлорметаном
дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (II) в 10 мл диоксана нагревают до 110°С в течение 2 час. Затем смесь концентрируют, добавляют разбавленный водный раствор Na2СО3 и дважды экстрагируют, используя 100 мл диэтилового эфира. Объединенные органические слои высушивают над MgSO4 и выпаривают. Полученный остаток очищают колоночной экспресс-хроматографией на силикагеле, элюируя градиентом гексан/этилацетат и получая при этом 230 мг (71%) указанного в заголовке соединения.
1Н-ЯМР (400 МГц, ДМСО-d6): δ=7,54 (d, J=2 Гц, 1H, Н-4), 7,43 (m, 5H, Ph), 6,12 (s, шир, 2Н, NH2), 5,92 (d, J=2 Гц, 1H, Н-3), 3.73 (s, 3H, ОСН3).
Масс-спектр: m/e (%): 204 (М+Н+ 100).
г) 3-(3-Фторфенил)-6-метоксипиридин-2-иламин
В соответствии со стадией в) указанное в заголовке соединение синтезируют из 3-бромо-6-метоксипиридин-2-иламина и 3-фторфенилбороновой кислоты.
Масс-спектр: m/e (%): 248.7 (M+H+, 100).
д) 3-(4-Фторфенил)-6-метоксипиридин-2-иламин
В соответствии со стадией в) указанное в заголовке соединение синтезируют из 3-бромо-6-метоксипиридин-2-иламина и 4-фторфенилбороновой кислоты.
Масс-спектр: m/e (%): 218,6 (М+Н+, 100).
е) 3-(4-Хлорфенил)-6-метоксипиридин-2-иламин
В соответствии со стадией в) указанное в заголовке соединение синтезируют из 3-бром-6-метоксипиридин-2-иламина и 4-хлорфенилбороновой кислоты.
Масс-спектр: m/e (%): 234.7 (М+Н+, 100).
ж) 6-Метокси-3-(3-метоксифенил)-пиридин-2-иламин
В соответствии со стадией в) указанное в заголовке соединение синтезируют из 3-бром-6-метоксипиридин-2-иламина и 3-метоксифенилбороновой кислоты.
Масс-спектр: m/e (%): 230.7 (М+Н+, 100).
з) 5-Метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламин
Смесь 230 мг (1,15 ммоль) 6-метокси-3-фенилпиридин-2-иламина и 142,8 мкл этоксикарбонилизотиоцианата перемешивают при комнатной температуре в течение 2 час, после чего упаривают досуха. Полученный остаток помещают в 20 мл смеси МеОН/EtOH в соотношении 1:1 и обрабатывают, используя 399 мг (5,74 ммоль) гидрохлорида гидроксиламина и 590 мкл N-этилдиизопропиламина. Смесь нагревают до 80°С в течение 16 час, концентрируют до получения сухого остатка, помещают в 100 мл воды и экстрагируют, используя 3×150 мл диэтилового эфира. Объединенные органические слои высушивают над MgSO4 и выпаривают с получением при этом 379 мг (80%) указанного в заголовке соединения.
1Н-ЯМР (300 МГц, ДМСО-d6): δ=8,05 (d, J=8,49 Гц, 2Н, фенил), 7.73 (d, J=8,31 Гц, 1H, H-7), 7,45 (t, J=7,26 Гц, 2Н, фенил), 7,33 (d, t=7,26 Гц, 1Н, фенил), 6,52 (d, J=8,31 Гц, 1H, Н-6), 6,08 (s, шир, 2Н, NH2), 4,09 (s, 3H, ОСН3).
Масс-спектр: m/e (%): 241,3 (M+H+, 100).
Пример 2
8-(3-Фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин
В соответствии с методикой, приведенной в примере 1з), синтезируют 8-(3-фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин исходя из 3-(3-фторфенил)-6-метокси-пиридин-2-иламина, этоксикарбонилизотиоцианата, с последующей реакцией соответствующего промежуточного соединения с гидрохлоридом гидроксиламина и N-этилдиизопропиламином.
1-Н-ЯМР (300 МГц, AMCO-d6): δ=8,05 (d, J=10.7 Гц, 1H, фенил), 7,92 (d, J=10.7 Гц, 1H, фенил), 6,88 (d, J=8,37 Гц, 1H, 7-Н), 7,49 (m, 1H, фенил), 7,15 (m, 1H, фенил), 6,53 (d, J=8,37 Гц, 1H, 6-Н), 6,14 (s, шир, 2Н, NH2), 4,1 (s, 3H, ОСН3).
Масс-спектр: m/e (%): 259,1 (M+H+, 100).
Пример 3
8-(4-Фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин
В соответствии с методикой, приведенной в примере 1з), синтезируют 8-(4-фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин исходя из 3-(4-фторфенил)-6-метокси-пиридин-2-иламина, этоксикарбонилизотиоцианата, с последующей реакцией соответствующего промежуточного соединения с гидрохлоридом гидроксиламина и N-этилдиизопропиламином.
1H-ЯМР (300 МГц, AMCO-d6): μ=8,16 (t, J=5,67 Гц, 2Н, фенил), 7.79 (d, J=8,22 Гц, 1H, H-7), 7,34 (t, J=5,67 Гц, 2Н, фенил), 6,57 (d, J=8,22 Гц, 1H, Н-6), 6,19 (s, шир, 2Н, NH2), 4.15 (s, 3H, ОСН3).
Масс-спектр: m/e (%): 259,1 (М+Н+ 100).
Пример 4
8-(4-Хлорфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин
В соответствии с методикой, приведенной в примере 1з), синтезируют 8-(4-хлорфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин исходя из 3-(4-хлорфенил)-6-метокси-пиридин-2-иламина, этоксикарбонила изотиоцианата, с последующей реакцией соответствующего промежуточного соединения с гидрохлоридом гидроксиламина и N-этилдиизопропиламином.
1Н-ЯМР (300 МГц, ДМСО-d6): μ=8,13 (d, J=8,67 Гц, 2Н, фенил), 7.79 (d, J=8,37 Гц, 1H, H-7), 7,51 (d, J=8,67 Гц, 2Н, фенил), 6,53 (d, J=8,37 Гц, 1Н, Н-6), 6,11 (s, шир, 2Н, NH2), 4,09 (s, 3H, ОСН3).
Масс-спектр: m/е (%): 275,2 (M+H+, 100).
Пример 5
5-Метокси-8-(3-метоксифенил)-[1.2.41 триазоло[1.5-а]пиридин-2-иламин
В соответствии с методикой, приведенной в примере 1з), синтезируют 8-(3-метоксифенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-иламин, исходя из 3-(3-метоксифенил)-6-метокси-пиридин-2-иламина этоксикарбонилизотиоцианата, с последующей реакцией соответствующего промежуточного соединения с гидрохлоридом гидроксиламина и N-этилдиизопропиламином.
1Н-ЯМР (300 МГц, ДМСО-d6): μ=7.76 (d, J=8,25 Гц, 1H, H-7), 7,68 (s, 1H, фенил), 7,62 (d, J=7,89 Гц, 1H, фенил), 7,36 (t, J=7,89 Гц, 1H, фенил), 6,91 (d, J=7,89 Гц, 1H, фенил), 6,51 (d, J=8,25 Гц, 1H, Н-6), 6,07 (s, шир, 2Н, NH2), 4,09 (s, 3H, ОСН3), 3,87 (s, 3H, ОСН3).
Масс-спектр: m/e (%): 271,2 (М+Н+, 100).
Пример 6
3-Фторо-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид
Смесь 15 мг (0,062 ммоль) 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]-пиридин-2-иламина, 11 мг (0,068 ммоль) хлорангидрида 3-фторфенилкарбоновой кислоты и 31,5 мкл (0,312 ммоль) NEt3 в 1 мл диоксана нагревают до 90°С в течение 16 час. Смесь очищают препаративной ЖХВР (жидкостная хроматография высокого разрешения) с обращенной фазой, элюируя градиентом ацетонитрил/вода. После выпаривания получают указанное в заглавии соединение.
Масс-спектр: m/e (%): 281.7 ((М+СН3CN)+, 100).
Пример 7
3-Бромо-N-(5-метокси-8-фенил-[1-2.4]триазоло[1.5-а]пиридин-2-ил)бензамид
В соответствии с методикой, приведенной в примере 6, указанное в заголовке соединение синтезируют из 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламина и хлорангидрида 3-бромфенилкарбоновой кислоты (Масс-спектр: m/e (%): 423,3 (М+Н+, 100).
Пример 8
4-Фторо-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид
В соответствии с методикой, приведенной в примере 6, указанное в заголовке соединение синтезируют из 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламина и хлорангидрида 4-фторфенилкарбоновой кислоты. (Масс-спектр: m/e (%): 362,4 (М+Н+, 100).
Пример 9
3-Метокси-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид
В соответствии с методикой, приведенной в примере 6, указанное в заголовке соединение синтезируют из 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламина и хлорангидрида 3-метоксифенилкарбоновой кислоты. (Масс-спектр: m/e (%): 374,4 (М+Н+, 100).
Пример 10
4-Бромо-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид
К раствору 24 мг (0,1 ммоль) 5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-иламина в 1 мл диоксана добавляют 0,4 мл (0,4 ммоль) 1 М раствора AlMe3 в толуоле и оставляют смесь при перемешивании на 1 час при комнатной температуре. Добавляют 86 мг (0,4 ммоль) сложного метилового эфира 4-бромфенилкарбоновой кислоты в 1 мл диоксана и перемешивают смесь в течение 48 час при 90°С. Добавляют 0,5 мл 1Н водного раствора HCl и выпаривают смесь досуха. Полученный остаток помещают в 1,5 мл муравьиной кислоты и 0,5 мл метанола, затем подвергают ЖХВР с обращенной фазой, элюируя градиентом вода/ацетонитрил. После выпаривания элюентов получают 6 мг (15%) указанного в заголовке соединения. Масс-спектр: m/e (%): 423,3 (М+Н+, 100).
В соответствии с методикой, приведенной в примере 10, после этого синтезируют производные [1.2.4]триазоло[1.5-а]пиридина. Результаты синтеза представлены в следующей таблице, включающей примеры от 11 до 21.
KI(нМ)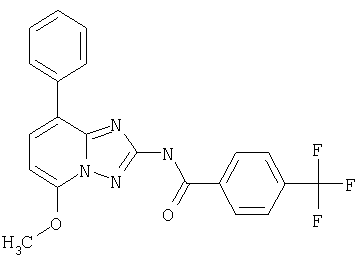
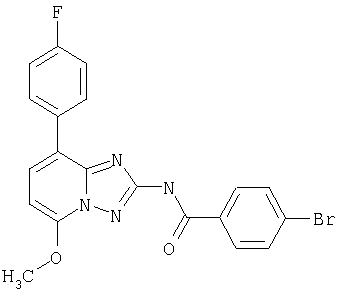
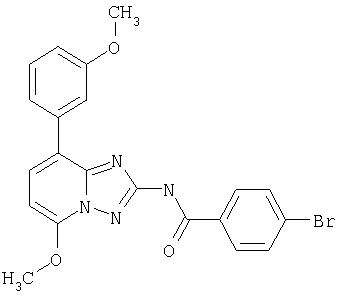
KI(HM)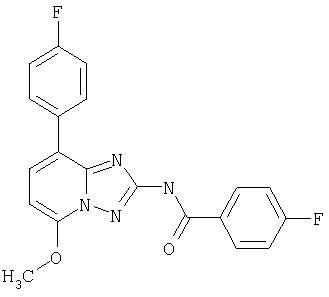
Методика приготовления
1. Смешивают компоненты согласно позициям 1, 2, 3 и 4 и гранулируют, используя очищенную воду.
2. Высушивают гранулы при 50°С.
3. Пропускают гранулы через подходящее оборудование для размалывания.
4. Добавляют компонент согласно позиции 5 и перемешивают в течение трех минут; затем прессуют, используя подходящий пресс.
Методика приготовления
1. Перемешивают в подходящем смесителе компоненты согласно позициям 1, 2 и 3 в течение 30 минут.
2. Добавляют компоненты согласно позициям 4 и 5 и перемешивают в течение 3 минут.
3. Помещают в подходящие капсулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 8-МЕТОКСИ[1,2,4]ТРИАЗОЛО[1,5-a]ПИРИДИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 2002 |
|
RU2297416C2 |
| АМИД 8-АМИНО-[1.2.4]ТРИАЗОЛО-[1.5-А]ПИРИДИН-6-КАРБОНОВОЙ КИСЛОТЫ И СОДЕРЖАЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2002 |
|
RU2296763C2 |
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗИН-4-АМИНА | 2011 |
|
RU2625791C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2534804C1 |
| ПРОИЗВОДНОЕ 1,2,4-ТРИАЗОЛОНА | 2011 |
|
RU2566754C2 |
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗИН-3-АМИНА | 2011 |
|
RU2771819C2 |
| N-(ПИРИД-4-ИЛ)АМИДЫ И N-(ПИРИМИДИН-4-ИЛ)АМИДЫ И ИХ ФАРМАЦЕВТИЧЕСКОЕ И КОСМЕТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2012 |
|
RU2625789C2 |
| БЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ | 2018 |
|
RU2781429C2 |
| ПРОИЗВОДНЫЕ АЗОЛОВ | 2012 |
|
RU2622639C2 |
| ХИНОКСАЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ | 2018 |
|
RU2791168C1 |
Описывается новое производное 5-метокси-8-арил[1,2,4]-триазол[1,5-а]пиридина общей формулы I
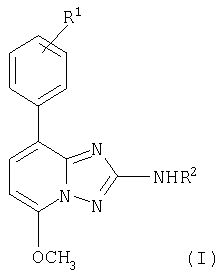
в которой R1 означает водород, галоген или низший алкокси; R2 означает -C(O)-фенил, в котором кольцо может быть незамещенным или замещенным одним или двумя заместителями, выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси или трифторметила, или означает -C(O)-фуранил или -C(O)-тиофенил, в которых кольца не замещены или замещены галогеном; и его фармацевтически приемлемым солям. Технический результат - соединения могут быть использованы при лечении заболеваний, связанных с рецептором аденозина A2. Описывается лекарственное средство для лечения заболеваний, связанных с A2A рецептором аденозина, содержащее соединение формулы (I) и фармацевтически приемлемые наполнители. 2 н. и 6 з.п. ф-лы, 1 табл.
в которой R1 означает водород, галоген или низший алкокси;
R2 означает -C(O)-фенил, в котором кольцо может быть незамещенным или замещенным одним или двумя заместителями, выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси или трифторметила, или означает -C(O)-фуранил или -C(O)-тиофенил, в которых кольца не замещены или замещены галогеном;
и его фармацевтически приемлемые соли.
4-фторо-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид,
4-бромо-N-(5-метокси-8-фенил-[1.2.4]триазоло[1.5-а]пиридин-2-ил)бензамид,
4-бромо-N-[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]бензамид,
4-фторо-N-[8-(4-фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-ил]бензамид или
4-фторо-N-[5-метокси-8-(3-метоксифенил)-[1,2.4]триазоло[1.5-а]пиридин-2-ил]бензамид.
[8-(3-фторфенил)-5-метокси-[1.2.4]триазоло[1.5-а]пиридин-2-ил]амид 5-бромфуран-2-карбоновой кислоты или
[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]амид 5-бромфуран-2-карбоновой кислоты.
[5-метокси-8-(3-метоксифенил)-[1.2.4]триазоло[1.5-а]пиридин-2-ил]амид тиофен-2-карбоновой кислоты.
| Программный регулятор температуры для периодических печей | 1953 |
|
SU117999A1 |
| Машковский Б.Д | |||
| Лекарственные средства, Москва, ООО Новая Волна, с.109-119, 2001, т.1. | |||
Авторы
Даты
2007-04-27—Публикация
2002-09-28—Подача