Изобретение относится к иммунологии, экологии и санитарии. Разработан метод экспресс-диагностики бактериального загрязнения окружающей среды, основанный на иммунохроматографическом (ИХ) определении наличия бактерии Escherichia coli (E.coli) в воде. Сущность изобретения состоит в использовании четырехслойного иммунохроматографического анализа с использованием моноспецифических и моноклональных антител. Моноспецифические антитела (МСАТ) к E.coli, иммобилизованные в тест-зоне ИХ-стрипа на нитроцеллюлозной мембране, реагируют с антигенами (АГ) E.coli в образце воды в процессе тангенциального перемещения материала образца по ИХ-стрипу. Одновременно происходит связывание конъюгата (КГ) МСАТ с пероксидазой хрена (ПХ) с АГ и конъюгата моноклональных антител (MAT) к пероксидазе хрена (ПХ) с коллоидными частицами (КЧ). В результате в тест-зоне иммунохроматографического стрипа образуется комплекс МСАТ-АГ-КГМСАТ ПХ-КГ MAT КЧ. Образовавшийся комплекс позволяет визуализировать наличие АГ E.coli в исследуемой пробе. Обнаружение E.coli таким методом, который относится к твердофазным реакциям типа «четырехслойный сэндвич», позволяет в течение нескольких минут оценить бактериальную загрязненность водоисточника.
УРОВЕНЬ ТЕХНИКИ
Стихийные бедствия и антропогенные катастрофы приводят как к локальным, так и обширным загрязнениям окружающей среды, в частности водоисточников. Для мониторинга состояния водоисточников, особенно питьевых, санитарными службами используется детекция санитарно значимых возбудителей инфекций или микроорганизмов, сопутствующих им. При повреждении под действием землетрясений, наводнений, цунами, а также при террористических актах, антропогенных катастрофах и халатном содержании очистных сооружений их содержимое может попадать в акваторию различных водоисточников, в том числе служащих для забора питьевой воды.
Общепризнанным маркером такого загрязнения водных ресурсов служит микроорганизм Е.coli (представитель нормальной микрофлоры кишечника человека и животных) иногда вызывающий заболевания.
Роль Е.coli в нормальной физиологии человека многообразна: участвует в пищеварении, является продуцентом витаминов группы В, К, Е; выполняет антагонистическую функцию по отношению к патогенным микроорганизмам, выделяют особые вещества - колицины.
Морфологически E.coli грам-палочки, имеют pili common для адгезии и sex для конъюгации. Спор и капсул нет. Факультативные анаэробы, очень биохимически активны, в классической микробиологии дифференцируются с помощью сред, содержащие лактозу. E.coli ферментируют лактозу среди многих enterobacterea, которые ее не ферментируют. Лактозу содержат среды - Эндо, Левена, Плоскирева. Роль E.coli в патологии человека: выделяют следующие патогенные варианты внутри вида:
энтеропатогенные кишечные палочки - вызывают заболевание coli-энтеротиты, чаще всего у новорожденных;
энтеротоксигенные кишечные палочки - вызывают холероподобные заболевания. Выделяют экзотоксин;
энтероинвазивные кишечные палочки - вызывают дизентериеподобные заболевания.
Оценка наличия E.coli на сегодня решается путем анализа в микробиологических лабораториях санэпидстанций (СЭС). Эти исследования занимают от одних до нескольких суток, они требуют специальных лабораторных условий (методические указания МУК 4.2.577-96) и обученного персонала и не могут быть применены в полевых условиях для экстренного мониторинга пострадавших водоисточников.
Также известен способ экспресс определения E.coli с помощью иммунопреципитации (Feldsine et all 1997. Escherichia coli O157:Н7 Visual Immunoprecipitation assay: a comparative validation study. J.AOAC 80:43-48). Недостатком данного метода является длительность постановки (несколько часов) и необходимость наличия лабораторных условий, а также невысокая чувствительность.
Значительно более чувствительным является флуоресцентный анализ (Feng, P.C.S., and P.A.Hartman. 1982. Fluorogenic assays for immediate confirmation of Escherichia coli. Appl. Environ. Microbiol. 43:1320-1329) и его экспресс модификации (Moberg, L.J. et all 1988. Fluorogenic assay for rapid detection of Escherichia coli in chilled and frozen foods: collaborative study. J. Assoc. Off. Anal. Chem. 71:589-602). Их недостатком также является необходимость наличия дорогостоящей лабораторной техники и обученного персонала. Те же недостатки присущи биохимическому (Hartman, P.A. 1989. The MUG (glucuronidase) test for Escherichia coli in food and water, pp.290-308. In: Rapid Methods and Automation in Microbiology and Immunology. A.Balows, R.C.Tilton, and A.Turano (eds). Brixia Academic Press, Brescia, Italy) и наиболее чувствительному ПЦР методу.
Наиболее близким к заявляемому является иммунохроматографический метод определения патогенного штамма E.coli O157:Н7 (Andrew Mackenzie at all. Performance of the ImmunoCard STAT! E.coli O157:H7 Test for Detection of Escherichia coli O157:H7 in Stools Journal of Clinical Microbiology, May 2000, p.1866-1868, Vol.38, №5), принятый в качестве прототипа.
Указанный способ иммунохроматографического определения Escherichia coli в воде состоит в том, что водную среду с обнаруживаемым в ней антигеном Escherichia coli наносят на входной конец тест-полоски, перемещают фронт водной среды за счет капиллярных сил через реакционную зону, обладающую маркерными свойствами и свойствами афинного соответствия с Escherichia coli, далее перемещают фронт водной среды через тест-зону к контрольной зоне с растворением в перемещаемой водной среде реагентов, отвечающих за связывание антигена и за его маркерные свойства, при этом комплекс, состоящий из антигена, афинно соответствующего ему реагента и маркера, иммобилизуют в тест-зоне, а комплекс, содержащий реагент, афинно соответствующий антигену, и маркерный реагент, иммобилизуют в контрольной зоне, а избыток реагентов за контрольной зоной поглощают пористым носителем, причем в качестве маркерного реагента используют конъюгат частиц коллоидного золота с моноклональным антителом, а по окраске тест-зоны либо контрольной зоны принимают решение о наличии Escherichia coli в исследуемой пробе либо, соответственно, о работоспособности тест-полоски, что совпадает с существенными признаками предлагаемого изобретения.
При этом в способе-прототипе для образования маркерного комплекса использовался конъюгат частиц коллоидного золота с моноклональным антителом к обнаруживаемому штамму Escherichia coli.
Таким образом, существо известного способа состоит в том, что искомая бактерия - антиген (АГ) переносится фронтом водной среды вдоль ИХ-полоски. В первой, т.н. реагентной зоне она сцепляется с маркером - частицей коллоидного (КЧ) золота, растворенного в водной среде, продольно перемещающейся вдоль ИХ-полоски за счет капиллярных сил. В следующей, т.н. индикаторной зоне образовавшийся конъюгат АГ-КЧ иммобилизуется за счет связывания с реагентом, афинно соответствующим АГ, окрашивая эту область и таким образом позволяя визуально определить наличие АГ в анализируемой пробе. Одновременно КЧ мигрируют из реагентной зоны в индикаторную, не связываются там и перемещаются далее в контрольную зону, где иммобилизуются, окрашивают контрольную зону, подтверждая работоспособность тест-полоски.
В данном способе-прототипе с помощью трехслойного ИХ анализа в течение 10 минут удавалось выявлять наличие штамма E.coli с высокой чувствительностью и специфичностью. Недостатком данного метода является невозможность выявления других серотипов Е. coli.
Итак, недостаток способа-прототипа [2] состоит в ухудшении следующих характеристик:
- панорамности анализа;
- эффективности анализа;
- надежности оценки эпидемиологической ситуации.
Соответственно, требуемый при реализации устройства технический результат состоит в устранении вышеуказанных недостатков.
Список чертежей
Фиг.1. Принципиальная схема устройства иммунохроматографического стрипа, реализующего предлагаемый способ иммунохроматографического определения Escherichia coli в воде (по п.1 формулы);
Фиг.2. Расположение реагентов и воды (показана заливкой серым цветом) в начале реакции;
Фиг.3. Расположение реагентов и воды (показана заливкой серым цветом) на конечной стадии реакции,
где использованы следующие обозначения составных элементов указанного устройства и обозначены основные этапы его функционирования:
А. ПЭД.
В. Нитроцеллюлозная мембрана.
С. Отсасывающий фильтр.
D. Монтирующая подложка.
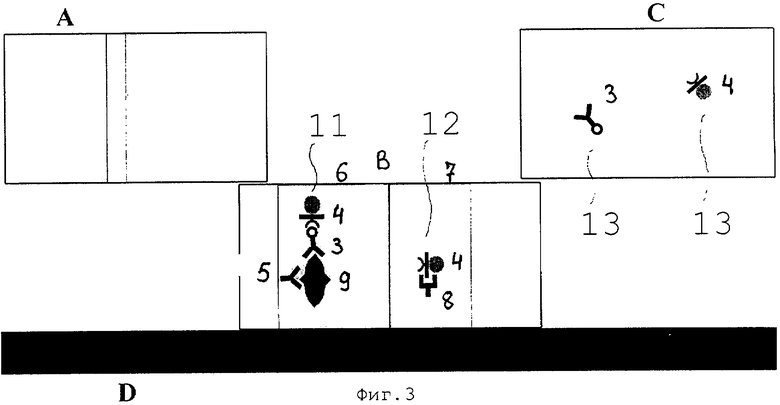
1. Зона нанесения конъюгата (КГ) кроличьих моноспецифических антител против E.coli с пероксидазой хрена (ПХ).
2. Зона нанесения конъюгата мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом.
3. Конъюгат кроличьих моноспецифических антител против E.coli с пероксидазой хрена.
4. Конъюгат мышиных моноклональных антител против пероксидазы хрена, меченный коллоидным золотом.
5. Кроличьи моноспецифические антитела против E.coli.
6. Тест-зона (опытная зона).
7. Контрольная зона.
8. Кроличьи моноспецифические антитела против иммуноглобулинов мыши.
Серым цветом обозначено заполнение участков иммунохроматографического стрипа жидкостью,
9. Антиген E.coli.
10. Образование комплекса: (Е.coli)-конъюгат (кроличьих моноспецифических антител против E.coli с пероксидазой хрена) - (моноклональные антитела против пероксидазы хрена, меченные коллоидным золотом).
11. Образование комплекса: (кроличьи моноспецифические антитела против Е.coli) - (Е.coli)-конъюгат (кроличьих моноспецифических антител против E.coli с пероксидазой хрена) - (моноклональные антитела против пероксидазы хрена, меченные коллоидным золотом).
12 Образование комплекса: конъюгат (мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом) - (кроличьи моноспецифические антитела против иммуноглобулинов мыши).
13. Несвязавшиеся продукты реакции.
На фиг.1 схематично показана последовательность расположения реакционной зоны, состоящей из областей 1 и 2, а также тест-зоны, контрольной зоны и отсасывающего фильтра на поверхности монтирующей подложки D (подразумевается прилегание зон А, В, С, к D). Также показано распределение реагентов 3, 4, 5, 8 в областях 1, 2, 6 и 7. На фиг.2 показано образование комплекса из реагентов 9 и 3: (Е.coli)-конъюгат (кроличьих моноспецифических антител против E.coli с пероксидазой хрена), а также комплекса 10 из реагентов 3, 4, 9.
На фиг.3 показано образование комплекса 11 из реагентов 9, 3, 4 и 5, чем обеспечивается фиксация маркера 4 в тест-зоне. При этом в зоне 7 образуется комплекс 12 из реагентов 4, 8, либо из реагентов 3,4,8 (не показано).
Непрореагировавшие реагенты 13 (3 и 4) поглощаются в зоне С.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для устранения недостатков известного технического решения, в связи с тем, что не существует универсального маркера для всех серотипов E.coli, нами был предложен четырехслойный двухконъюгатный ИХ-анализ для экспресс определения любых микроорганизмов данного вида в воде.
С учетом этого разработан способ иммунохроматографического определения Escherichia coli в воде, состоящий в том, что водную среду с обнаруживаемым в ней антигеном 9 Escherichia coli наносят на входной конец тест-полоски, перемещают фронт водной среды за счет капиллярных сил через реакционную зону, состоящую из областей 1 и 2, обладающую маркерными свойствами (зона 2) и свойствами афинного соответствия с Escherichia coli 9 (зона 1), далее перемещают фронт водной среды через тест-зону 6 к контрольной зоне 7 с растворением в перемещаемой водной среде реагентов, отвечающих за связывание антигена 9 и за его маркерные свойства, при этом комплекс 11, состоящий из антигена 9, афинно соответствующего ему реагента 3 и маркера 4 иммобилизуют в тест-зоне 6, а комплекс 12, содержащий реагент, афинно соответствующий антигену, и маркерный реагент 4, иммобилизуют в контрольной зоне 7, а избыток реагентов за контрольной зоной 7 поглощают отсасывающим фильтром С, причем в качестве маркерного реагента 4 используют конъюгат частиц коллоидного золота с моноклональным антителом, а по окраске тест-зоны 6 либо контрольной зоны 7 принимают решение о наличии Escherichia coli 9 в исследуемой пробе либо, соответственно, о работоспособности тест-полоски, что совпадает с существенными признаками способа-прототипа.
При этом в реакционной зоне (1, 2) выполняют последовательно операцию связывания антигена 9 Escherichia coli с конъюгатом моноспецифического антитела к Escherichia coli с пероксидазой хрена 3 и операцию связывания полученного комплекса с маркерным реагентом 4, содержащим моноклональные антитела к пероксидазе хрена.
Кроме того, в качестве биохимического реагента контрольной зоны 7 используют кроличьи антитела против иммуноглобулинов мыши.
Кроме того, в качестве пористого носителя реагентной зоны используют ПЭД А (инертный пористый носитель из стекловолокна), а в качестве пористого носителя тест-зоны 6 и контрольной зоны 7 используют слой В нитроцелюлозы, нанесенный на лавсановое основание и имеющий капиллярную связь с пористым носителем реагентной зоны (ПЭД). Все элементы А, В, С монтируются на подложке D внахлест, как показано на фиг.1-3.
Работа предлагаемого способа, как и прототипа, основана на связывании конъюгированных и неконъюгированных МСАТ с различными эпитопами комплексного антигена на поверхности E.coli, иммобилизации полученного комплекса в «тест-зоне» на нитроцеллюлозе и визуализации его конъюгатом антител к пероксидазе хрена (ПХ) с коллоидными частицами (КЧ).
В процессе реакции выявления исследуемого антигена водный образец наносят в зону ПЭДа А. Он растворяет конъюгаты и в процессе растворения образуется комплекс АГ-КГ(МСАТПХ)-КГ(МАТКЧ) конъюгатов с присутствующим в образце антигеном 9. Под действием капиллярных сил происходит тангенциальная миграция комплекса в тест-зону 6, где предварительно иммобилизируют МСАТ 5 к антигену 9 Е.coli. В этой зоне (в случае наличия в образце исследуемого антигена) образуется комплекс МСАТ-АГ-КГ(МСАТПХ)-КГ(МАТКЧ). Так как для реакции применяются окрашенные коллоидные частицы 4, этот комплекс визуализируется и дает возможность бесприборного обнаружения исследуемого антигена 9 в исследуемом образце воды. Комплексы, не содержащие АГ 9, но содержащие КЧ 4, мигрируют в контрольную зону 7, окрашивая ее и подтверждая тем самым работоспособность ИХ-полоски. Излишки несвязавшегося конъюгата и антигена мигрируют в отсасывающий фильтр С.
Для определения E.coli 9 оправдано добавление 4 слоя в реакции. Это связано с тем, что для конъюгации с коллоидными частицами 4 используют только моноклональные антитела, так как моноспецифические антитела обладают различными изоэлектрическими точками и поэтому непригодны для получения стабильных конъюгатов с КЧ 4. Получение же моноклональных антител против E.coli 9 невозможно в силу отсутствия видоспецифического антигена, общего для всех серотипов этого микроорганизма. Получение же стабильного конъюгата AT с ПХ 3 не является сложной задачей и широко используется в иммунологии.
ПРИМЕР Получение аффинных моноспецифических антител. Суспензионную культуру E.coli непатогенного штамма трижды отмывали в забуференном физрастворе рН 7,2-7,4 аликвотировали и замораживали при температуре -70°С. Готовили иммуносорбент из BrCN- сефарозы (Pfarmacia) и суспензии E.coli из расчета 20 мг суспензии на 1 мл сефарозы (Pharmacia) по инструкции к сефарозе. Гипериммунную сыворотку получали иммунизируя кроликов АГ E.coli по следующей схеме: 0,5 мг АГ Е.coli в полном адьюванте Фрейнда вводили внутримышечно в 5 точек, а затем дважды с интервалом в 2 недели иммунизацию повторяли из расчета 0,5 мг АГ в неполном адьюванте Фрейнда в четыре точки. Через месяц после третьей иммунизации из кроликов получали сыворотку трижды отбирая кровь из ушной вены с интервалом в три дня между заборами. Сыворотку, предварительно истощенную убитой нагреванием культурой Salmonella sp. из расчета 1 г культуры на 100 мл сыворотки наносили на аффинную колонку с полученным ранее иммуносорбентом из расчета 5 мл сыворотки на 1 мл сорбента, инкубировали в течение ночи и отмывали от несвязавшихся белков избытком фосфатно-солевого буфера рН 7,2-7,4 и снимали аффинные антитела 50 мМ глицин-HCl буфером рН 2,3 под контролем проточного спектрофотометра. Полученные антитела нейтрализовали сухим TRIS до рН 7,2-7,4 и диализовали против 50 мМ фосфатносолевого буфера рН 7,2-7,4. Конъюгацию моноспецифических антител с пероксидазой хрена проводили периодатным методом (Fuchs В.В. et all. Biotechnology and applied biochemistry, 1988, №10, p.273-286). Конъюгацию моноклональных антител к пероксидазе хрена с КЧ в качестве которых использовали коллоидное золото с диаметром частиц 30 нм (BioCell) проводили, как описано в патенте Fuchs et. all (US patent 5968758, Oct.19, 1999). Конъюгаты наносили параллельными полосами в центральной области ПЭДа перпендикулярно току жидкости на расстоянии 2 мм друг от друга и после высушивания монтировали на одной из клеящих зон ИХ-блока CNPF-PD31-L2-P25 (MDI Индия), включающего нитроцеллюлозу с диаметром пор 20 мкм таким образом, чтобы ПЭД на 1-2 мм перекрывал нитроцеллюлозу. На противоположную клеящую зону блока внахлест монтировали фильтровальную бумагу. В 2 мм от середины нитроцеллюлозы параллельно длинной стороне блока наносили полосу МСАТ к E.coli, а на 3 мм ближе к отсасывающему фильтру параллельно ей наносили полосу МСАТ к иммуноглобулинам мыши (контрольная зона) и высушивали. Поверх ПЭДа и отсасывающего фильтра монтировали защитную пленку, разрезали блок на стрипы шириной 5 мм и запаивали в водонепроницаемые пакеты с осушителем. Полученные стрипы использовали для анализа.
Технический результат. С помощью полученных стрипов проводили реакцию определения E.coli в воде. ПЭД погружали на 2 мм в исследуемые образцы. Вода образцов растворяла конъюгаты, высушенные в ПЭД, и образовавшийся комплекс КГ(МАТКЧ)-КГ(МСАТПХ)-АГ E.coli - мигрировал к тест-зоне, где образовывался комплекс КГ(МАТКЧ)-КГ(МСАТПХ)-АГ E.coli-МСАТ, который визуализировал наличие АГ E.coli в растворе. Не связавшийся КГ(МАТКЧ) мигрировал в контрольную зону, где образовывал комплекс КГ(МАТКЧ)-МСАТ против ИГ мыши. Этот комплекс визуализировал пригодность стрипа к работе. Все остальные не связавшиеся компоненты реакции поглощались отсасывающим фильтром. Чувствительность теста составляла 1-10×10-9 г/мл. Собирая образцы с помощью несорбирующих фильтров чувствительность можно повысить на 2-3 порядка.
Итак, существо предлагаемого способа состоит в том, что процесс переноса искомого реагента - АГ делают двухступенчатым, используя начальное объединение АГ с моноспецифическим AT связанного с ПХ, а затем, связывая полученный комплекс с маркерным реагентом, содержащим моноклональные антитела к пероксидазе хрена, чем обеспечивается универсальность реагирования ИХ-полоски на любые типы штаммов АГ E.coli.
Далее покажем, что именно благодаря существенным отличиям предлагаемого способа обеспечивается требуемый технический результат.
То, что в реакционной зоне выполняют последовательно операцию связывания антигена Escherichia coli с конъюгатом моноспецифического антитела к Escherichia coli с пероксидазой хрена, и операцию связывания полученного комплекса с маркерным реагентом, содержащим моноклональные антитела к пероксидазе хрена, обеспечивает универсальность проводимого анализа, повышает надежность оценки эпидемиалогического состояния водной среды.
То, что в качестве биохимического реагента контрольной зоны используют кроличьи антитела против иммуноглобулинов мыши, повышает экономичность способа, стабильность его работы.
То, что в качестве пористого носителя реагентной зоны используют ПЭД (инертный пористый носитель из стекловолокна), а в качестве пористого носителя контрольной зоны используют слой нитроцелюлозы, нанесенный на лавсановое основание и имеющий капиллярную связь с пористым носителем реагентной зоны (ПЭД), также позволяет обеспечить необходимый технический результат.
Достигаемый при этом технический результат также состоит в экономии дорогостоящих реагентов и снижении временных затрат по сравнению с традиционными способами аналогичного назначения, в улучшении его экономических параметров.
Таким образом, показано, что требуемый технический результат, действительно, достигается за счет существенных отличий предлагаемого способа. Проведенные эксперименты показали реализуемость предлагаемого изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОДНОВРЕМЕННОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ ОНКОАНТИГЕНОВ PSA И СЕА | 2008 |
|
RU2422833C2 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВИРУСОВ ГЕПАТИТОВ | 2006 |
|
RU2360253C2 |
| СПОСОБ МНОГОПРОФИЛЬНОГО ИММУНОХИМИЧЕСКОГО ВЫЯВЛЕНИЯ АНТИГЕНОВ В ЖИДКИХ ОБРАЗЦАХ | 2003 |
|
RU2296995C2 |
| Мозаичный рекомбинантный полипептид, содержащий фрагменты белков вируса гепатита Е 1 и 3 генотипов в одной полипептидной цепи, предназначенный для использования в тест-системах, применяемых в серодиагностике гепатита Е | 2020 |
|
RU2754791C1 |
| СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО КОНКУРЕНТНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2022 |
|
RU2789545C1 |
| ТЕСТ-КОМПЛЕКТ ДЛЯ ВЫЯВЛЕНИЯ ХОЛЕРНОГО ТОКСИНА В СРЕДЕ КУЛЬТИВИРОВАНИЯ | 2020 |
|
RU2737776C1 |
| Способ повышения чувствительности иммунохроматографических тест-систем лактатом серебра и гидрохиноном | 2020 |
|
RU2733260C1 |
| МЕТОД ПОЛУЧЕНИЯ МЕЖМОЛЕКУЛЯРНЫХ КОНЪЮГАТОВ ДЛЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЕЛНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2012 |
|
RU2530560C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИММУНОРЕАКТИВНЫХ СОЕДИНЕНИЙ | 2004 |
|
RU2268471C2 |
| СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА С ДВОЙНОЙ КОНКУРЕНЦИЕЙ | 2020 |
|
RU2748901C1 |

Изобретение относится к биотехнологии. Предложен способ иммунохроматографического определения Escherichia coli в воде с использованием тест-полоски. Тест-полоска состоит из частей А, В и С, монтируемых на подложке D таким образом, что часть А на 1-2 мм перекрывает часть В. При этом А представляет собой инертный пористый носитель из стекловолокна (ПЭД) с нанесенной на его поверхность реакционной зоной 1 (с нанесенным конъюгатом кроличьих моноспецифических антител против E.coli с пероксидазой хрена), и реакционной зоной 2 (с нанесенным конъюгатом мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом). Конъюгаты нанесены в реакционной зоне параллельными полосами в центральной области ПЭД перпендикулярно току жидкости на расстоянии 2 мм друг от друга. Часть В тест-полоски представляет собой нитроцеллюлозу, иммобилизованную на лавсановое основание, на поверхность которой нанесена тест-зона 6 и контрольная зона 7. Тест-зона 6 представляет зону с нанесенными полосой параллельно длинной стороне тест-полоски в 2 мм от середины нитроцеллюлозы кроличьими моноспецифическими антителами против E.coli. Контрольная зона 7 представляет зону с нанесенными параллельной полосой на 3 мм от середины ближе с отсасывающему фильтру С кроличьими моноспецифическими антителами против иммуноглобулинов мыши. При этом В имеет капиллярную связь с реакционной зоной носителя А. С-отсасывающий фильтр для поглощения непрореагировавших реагентов. Решение о наличии Escherichia coli принимают по наличию окраски тест-зоны 6. Окраска контрольной зоны свидетельствует о работоспособности тест-полоски. Использование изобретения обеспечивает универсальность определения полоски на любые типы штаммов Escherichia coli с чувствительностью 1-10-8 г/мл. 3 ил.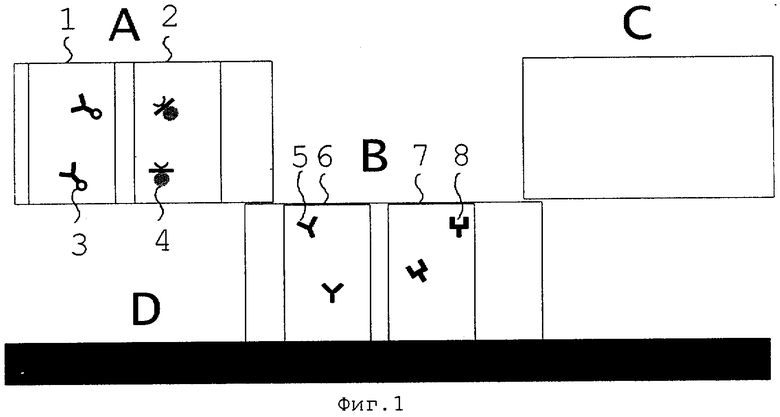
Способ иммунохроматографического определения Escherichia coli, отличающийся тем, что Escherichia coli определяют в воде и при этом используют тест-полоску, которая состоит из частей А, В и С, монтируемых на подложке D так, как приведено на фиг.1, при этом часть А на 1-2 мм перекрывает часть В, где
А - инертный пористый носитель из стекловолокна (ПЭД) с нанесенной на его поверхность реакционной зоной 1 и 2 (см. фиг.1), где реакционная зона 1 представляет зону с нанесенным конъюгатом кроличьих моноспецифических антител против E.coli с пероксидазой хрена, обозначенным 3 на фиг.1, а зона 2 представляет зону с нанесенным конъюгатом мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом, обозначенным 4 на фиг.1, где конъюгаты наносили параллельными полосами в центральной области ПЭД перпендикулярно току жидкости на расстоянии 2 мм друг от друга;
В - нитроцеллюлоза, иммобилизованная на лавсановое основание, с нанесенной на ее поверхность тест-зоной, обозначенной 6 на фиг.1 и контрольной зоной, обозначенной 7 на фиг.1, где тест-зона 6 представляет зону с нанесенными кроличьими моноспецифическими антителами против E.coli, обозначенными 5 на фиг.1, а контрольная зона 7 представляет зону с нанесенными кроличьими моноспецифическими антителами против иммуноглобулинов мыши, обозначенными 8 на фиг.1, где моноспецифические антитела против Е.coli нанесены полосой параллельно длинной стороне тест-полоски в 2 мм от середины нитроцеллюлозы, а моноспецифические антитела против иммуноглобулинов мыши нанесены параллельной полосой на 3 мм от середины ближе к отсасывающему фильтру, причем В имеет капиллярную связь с реакционной зоной носителя А;
С - отсасывающий фильтр для поглощения непрореагировавших реагентов, при этом решение о наличии Escherichia coli принимают по наличию окраски тест-зоны, тогда как окраска контрольной зоны свидетельствует о работоспособности тест-полоски.
| US 5411867, 02.05.1995 | |||
| MACKENZIE et al | |||
| Соломорезка | 1918 |
|
SU157A1 |
| ТЕРТОН М | |||
| и др | |||
| Новые методы иммуноанализа | |||
| - М.: Мир, 1991. | |||
Авторы
Даты
2007-06-10—Публикация
2005-09-19—Подача