Изобретение относится к медицинской микробиологии и может быть использовано в лабораторной диагностике для определения наличия холерного токсина (XT), продуцируемого штаммами Vibrio cholerae и рекомбинантными штаммами бактерий-продуцентов.
Сущность выявления растворимых продуктов жизнедеятельности бактерий, обладающих антигенными свойствами, заключается в образовании комплексов со специфическими антителами, фиксированными на твердом носителе, с последующим обнаружением таких комплексов специфическими антителами, конъюгированными с ферментной, радиоизотопной, люминесцентной или оптической меткой.
Известен способ индикации XT, основанный на методе его нейтрализации специфическими антисыворотками на культуре клеток опухоли надпочечников мыши [1]. Суть метода заключается в том, что супернатант культуральной среды, в которой выращивались V. cholerae, смешанный со специфической сывороткой, добавляется в культуру ткани клеток опухоли надпочечников мыши. Параллельно проводится анализ с не обработанным супернатантом и с холерным токсином, выступающим в роли положительного контроля. Результат оценивается по отсутствию цитопатического эффекта на культуре ткани.
Недостатком такого подхода является:
- необходимость работы с культурой ткани в условиях хорошо оснащенной дорогостоящим оборудованием лаборатории (например, инвертированный микроскоп, CO2-инкубатор и т.д.);
- длительность проведения анализа. Так, только для подготовки монослоя культуры ткани требуется не менее 1 недели, а проведение собственно анализа занимает 3 дня.
Указанные недостатки делают данный подход дорогостоящим и не пригодным для работы в условиях ограниченного времени.
Известен способ иммуноферментного определения продукции XT штаммами V. cholerae, который включает подготовку исследуемого образца, внесение его в лунки планшета, сенсибилизированных GM1 ганглиозидами, инкубацию образца при 37°С в течение 2 часов, отмывку буферным раствором, внесение коньюгата, с последующей инкубацией и учетом результатов по оптической плотности (ОП).
Подготовка образца заключается в индуцировании выхода XT из клеток вибрионов классического и Эль Тор биоваров. Культивирование осуществляют в разных средах, в зависимости от принадлежности V. cholerae к одному из указанных выше биоваров. Холерный вибрион классического биовара культивируют при постоянном помешивании в среде Крейга при температуре 30°С в течение 48 ч, а холерный вибрион биовара Эль Тор культивируют в статичных условиях в среде AKI при температуре 37°С в течение 20 ч или среде Крейга при температуре 30°С в течение 48 ч. [1].
Недостатками описанного подхода для выявления XT являются:
- необходимость предварительного определения принадлежности тестируемого штамма V. cholerae к конкретному биовару и в зависимости от этого применение разных сред и условий для индукции продукции холерного токсина, что сопряжено с длительностью и трудоемкостью процесса индукции, высоким риском биологической опасности из-за больших объемов культуральной среды;
- необходимость сенсибилизации лунок иммунологического планшета GM1 ганглиозидами непосредственно перед началом анализа, что существенно увеличивает трудозатраты на его проведение;
- при данном способе выявления XT используются дорогостоящие реагенты (GM1 ганглиозиды, поликлональная сыворотка против XT) и увеличивается длительность проведения этапа подготовки образца и постановки ИФА;
- антигенное сходство холерного токсина с термолабильным энтеротоксином Escherichia coli не обеспечивает специфичность прикрепления холерного токсина к GM1 ганглиозидам, и, следовательно, не обеспечивает специфичность анализа, направленного на обнаружение холерного токсина.
Известен набор VET-RPLA (Oxoid Limited, Hampshire, England) для реакции латекс-агглютинации, предназначенный для выявления холерного токсина или термолабильного энтеротоксина Escherichia coli. Особенностью этого набора является то, что частицы латекса сенсибилизированы поливалентными иммуноглобулинами, полученными из сыворотки кроликов иммунизированных очищенным холерным токсином [2].
Недостатками данного набора являются:
- отсутствие специфичности, так как частицы латекса агглютинируют как в присутствии холерного токсина, так и при наличии в супернатанте термолабильного энтеротоксина Escherichia coli;
- к общим недостаткам латексных диагностикумов относят то, что партии латекса разнятся по сорбционной активности, что затрудняет стандартизацию диагностикума; гидрофилизированные участки латексного носителя экранируют полимерные цепи иммунореагентов в поверхностном слое латексных частиц, что снижает чувствительность диагностикума; при использовании сорбционных методов нагрузки латексных частиц диагностикум снижает свою чувствительность в 4-8 раз уже в течение месяца; зачастую срок использования латексных диагностикумов сокращается за счет десорбции специфического белка с поверхности полимера из-за конкуренции с балластным белком, содержащимся в диагностикуме [3, 4, 5, 6].
Известна сконструированная на основе поликлональных антител к холерному токсину иммунохроматоргафическая тест-полоса для выявления холерного токсина. Чувствительность иммунохроматографических тест-полосок составляла - 10 нг/мл. [7].
Недостатками данной тест-полосы являются:
- высокая вероятность получения ложноположительных результатов из-за использования поликлональных антител, которые являются причиной выявления термолабильного энтеротоксина Escherichia coli, на что указывают сами авторы;
- производство иммунохроматографических полосок является экономически затратным и их себестоимость в итоге получается достаточно высокой.
Описана тест-система на основе специфичных к холерному токсину моноклональных антител в формате гидрогелевых биочипов, изготовленные по технологии полимеризационной иммобилизации. Предел обнаружения токсина составил 0,44 нг/мл. Представленная тест-система апробирована на пробах, содержащих коммерческий препарат холерного токсина (Sigma, США). Применение современной технологии биомикрочипов дает точные результаты в сжатые сроки [8].
Недостатками данной тест-системы являются:
- сложная технология изготовления биомикрочипов: требуется проверка качества биочипов с помощью биочип-анализатора со специальным программным обеспечением (TestChip и QualityControl);
- для учета результатов требуется дополнительное оборудование -флуоресцентный анализатор.
Известна «Тест-система иммуноферментная для определения продукции холерного токсина штаммами Vibrio cholerae (ИФАХолХТ-М)». Тест-система представляет собой: полистироловый планшет однократного применения для иммуноферментного анализа 12 стрипов по 8 лунок, сенсибилизированнный моноклональными иммуноглобулинами к холерному токсину, и набор компонентов для проведения анализа [9, 10].
Основными недостатками данной тест-системы являются:
- сравнительно не экономное расходование дорогостоящих ингредиентов при изготовлении тест-системы и при проведении анализа;
- при учете результатов реакции предусмотрено фотометрическое измерение изменения окраски в лунках, т.е. требуется дополнительное дорогостоящее оборудование;
- необходимость использования стоп-реагента при проведении анализа;
- невозможность проведения внутреннего контроля реакции в каждой лунке планшета.
Проведенный анализ патентной и научно-технической информации показал, что в настоящее время отсутствуют тест-системы, предназначенные для выявления холерного токсина в среде культивирования методом дот-иммуноанализа на дипстиках. Это говорит об актуальности разработки такой тест-системы, технически простой в использовании и удобной для проведения анализа, в том числе, при эпидемических вспышках холеры в условиях ограниченного доступа к дорогостоящему оборудованию.
Задачей изобретения является разработка эффективной тест-системы для выявления холерного токсина в среде культивирования.
Техническим результатом заявляемого изобретения является высокоспецифичное, простое, биологически менее опасное, быстрое и высокоэффективное выявление холерного токсина в среде культивирования. Кроме того, заявляемое изобретение позволяет сократить время анализа по выявлению холерного токсина, что особенно важно в ургентных ситуациях. Экономический эффект использования заявляемого изобретения состоит в снижении стоимости анализа за счет уменьшения трудозатрат и расхода реактивов (ингредиентов).
Указанный технический результат достигается тест-системой, которая представляет собой комплект содержащий дипстики; навеску среды AKI; коньюгат моноклональных антител, специфичных к В-субъединице холерного токсина изотипа G1 с пероксидазой хрена; реагенты для разведения конъюгата (глицерин, лактальбумин, Tween); реагенты для приготовления субстратной смеси (кислота лимонная, натрия цитрат, 2,2'-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid), мочевина пероксид).
Дипстики, входящие в тест-систему, представляют собой полоски пластика или другого материала, устойчивого к водным растворам солей, с фиксированными на них фрагментами мембраны, имеющими участок, сенсибилизированный специфическими к холерному токсину моноклональными антителами и холерным токсином (положительный контроль).
На дипстике дополнительно иммобилизован внутренний положительный контроль реакции, представленный холерным токсином.
Приготовление дипстика заявляемой тест-системы состоит из нескольких этапов:
1. На полоске пластика (изготовленной, например, из синтетической бумаги «Polylith» марки GH-1 с плотностью 340 г/м2) размером 70×5 мм специальным клеем фиксируется полоска нитроцеллюлозной мембраны с сеткой с размером пор 0,2-0,45 мкм., как показано на фиг. 1.
2. На дипстик (в отдельный квадратик) наносятся связывающие моноклональные антитела к холерному токсину (МКАХТ) 2Е5 (получены в ФКУЗ «РосНИПЧИ «Микроб» Роспотребнадзора. Патент №2583306 опубл. 10.05.2016 г. бюл. №13) в объеме 1-2 мкл. Концентрация МКАХТ составляет 15-25 мкг/мл.
3. В другой отдельный квадратик наносится раствор холерного токсина (получен в ФКУЗ «РосНИПЧИ «Микроб» Роспотребнадзора) в объеме 1-2 мкл. Концентрация холерного токсина составляет 40-80 мкг/мл. Холерный токсин выступает в роли внутреннего контроля тест-системы и положительного контроля.
В качестве отрицательного контроля выступает вся остальная поверхность мембраны, фиксированной на дипстике.
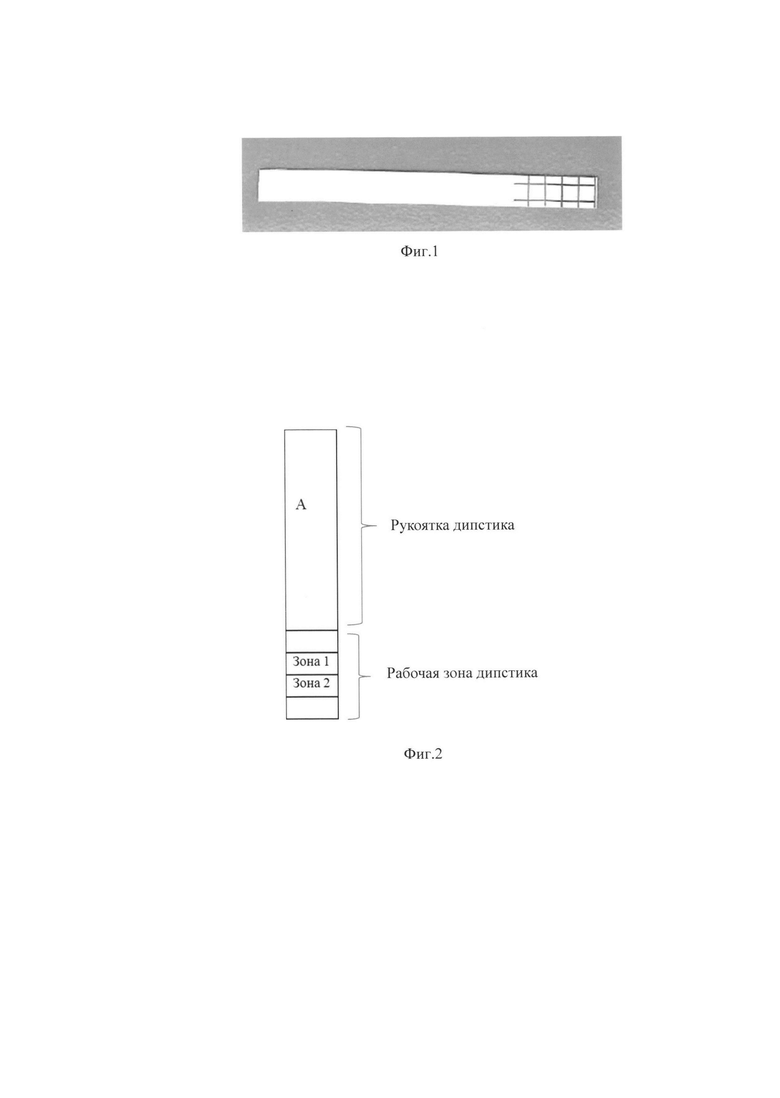
Схема нанесения МКАХТ и холерного токсина представлена на фиг. 2, где
- «А» - рукоятка дипстика;
Рабочая зона дипстика:
- «Зона 1» - зона нанесения холерного токсина (внутренний положительный контроль);
- «Зона 2» - зона нанесения моноклональных антител к холерному токсину.
4. После нанесения МКАХТ и холерного токсина дипстик высушивается в течении 30 минут при температуре 37°С.
5. Свободные участки связывания в рабочей зоне дипстика блокируются путем погружения в раствор для блокировки (1-2% раствор Бычьего сывороточного альбумина (БСА), содержащего 0,05% раствора твина) в течение 1-2 часов при комнатной температуре.
6. Дипстик промывают в фосфатно-солевом буфере с рН-7,2 путем ополаскивания рабочей зоны, высушивают при комнатной температуре и хранят до использования.
Оценка результатов исследования на дипстиках.
Правила учета результатов анализа, с использованием описанных дипстиков, приведены в таблице 1.
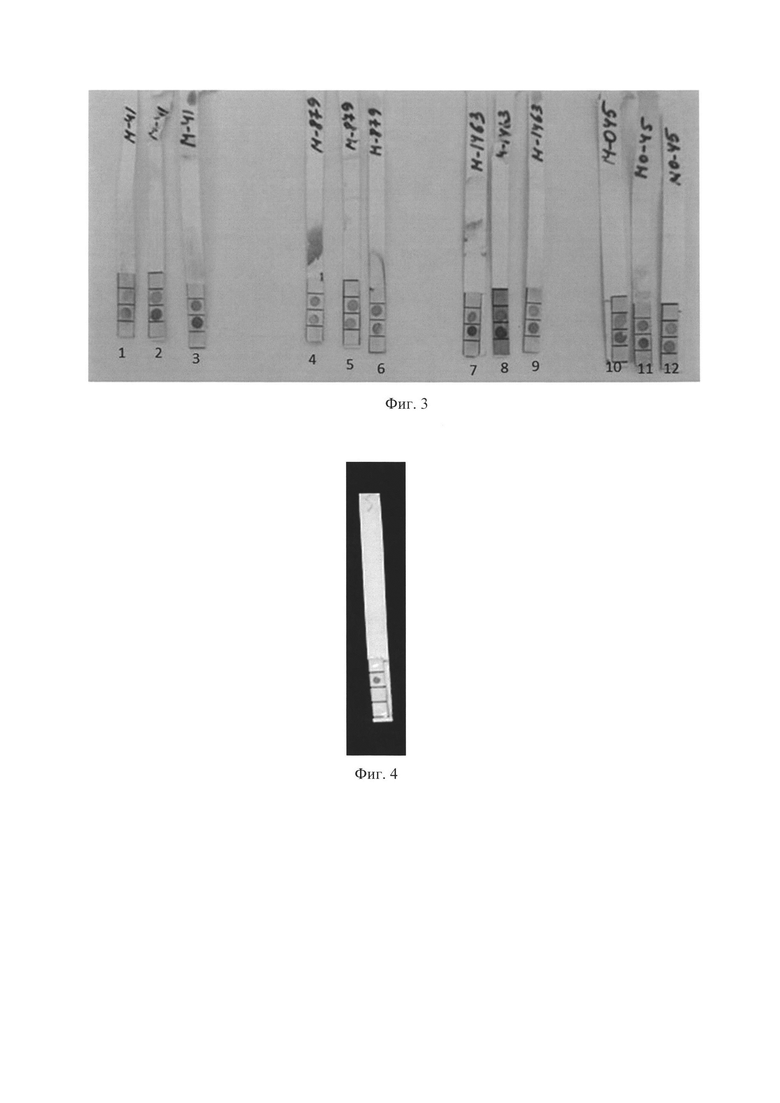
Внешний вид дипстиков после проведения анализа направленного на выявление холерного токсина в среде культивирования представлен на фиг. 3 и фиг. 4.
На фиг. 3 представлены дипстики с положительным результатом анализа на наличие холерного токсина в среде культивирования с использованием разного объема среды AKI по полной и сокращенной схемам. Использованы токсигенные штаммы V.cholerae. Дипстики 1, 4, 10 при проведении анализа по схеме из примера 1; дипстики 2, 5, 7 - из примера 2; дипстики 3, 8, 11 - из примера 3; дипстики 6, 9, 12 - из примера 4.
Верхнее пятно - положительный внутренний контроль, свидетельствующий о правильности работы тест-системы.
Наличие нижнего пятна, свидетельствует о наличии холерного токсина в среде культивирования (в концентрации не менее 2 нг/мл), т.е. о способности исследуемого штамма к продукции холерного токсина (Правила учета результатов приведены в таблице 1).
На фиг. 4. пример дипстика с отрицательным результатом на холерный токсин. Использован нетоксигенный штамм V.cholerae КМ-26. Выражено только верхнее пятно положительного внутреннего контроля (в соответствии с правилами, приведенными в таблице 1).
Применение заявляемой тест-системы осуществляется в соответствии со схемой:
- Этап А) Первичное подращивание агаровой культуры исследуемого штамма в среде AKI, разлитой по 10 мл в стеклянные пробирки, в течение 2,5 часов при температуре 37°С.
- Этап Б) Вторичное подращивание. Осуществляют путем посева 0,2-1 мл исследуемой культуры из среды AKI после первичного подращивания в 1-5 мл среды AKI и инкубация посевов при 37° 16 часов. Варианты выполнения вторичного подращивания указаны в конкретных примерах выполнения анализа.
- Этап В) Собственно выявление холерного токсина,
п. 1. Обработка дипстика в бульонной культуре.
п. 2. Обработка дипстика конъюгатом МКХТ с пероксидазой хрена.
п. 3. Обработка дипстика в субстрате,
п. 4. Учет результатов анализа
Возможно сокращение схемы исследования за счет совмещения этапов «Б» и «В п. 1». Сокращенная схема исследования:
- Этап А.
- Этап Б и этап В, п. 1. При этом сразу после посева в пробирку помещали подготовленный дипстик и инкубацию посевов осуществляли вместе с ним. Это позволяет сократить весь цикл анализа на 45 минут (по сравнению с полной схемой).
- Этап В, пп. 2, 3, 4.
Возможность осуществления заявляемого изобретения поясняется следующими примерами.
Пример 1.
Использование тест-системы для выявления холерного токсина в среде культивирования микроба. Исследование по полной схеме.
Этап А) Первичное подращивание исследуемого штамма осуществляли путем посева агаровой культуры (1/2 бактериологической петли №2) в 10 мл среды AKI с последующей инкубацией при 37°С 2,5 часа.
Этап Б) Вторичное подращивание осуществляли путем пересева 1 мл подращенной культуры в центрифужную пробирку с 5 мл AKI (объем пробирки - 15 мл). Пробирку располагали в термостате наклонном положении (без касания жидкости крышки пробирки). Посев инкубировали при 37°С в течение 16 часов.
Этап В) После вторичного подращивания готовые дипстики (удерживая за рукоятку) погружали в бульонную культуру таким образом, чтобы в кулыуральную среду была погружена только рабочая зона, с дальнейшей инкубацией при комнатной температуре 45 мин. Здесь и далее дипстик удерживается за рукоятку.
Затем дипстик промывали в фосфатно-солевом буфере рН 7,2 путем ополаскивания.
Дипстик помещали в раствор конъюгата МКАХТ с пероксидазой хрена на 45 минут. Дипстик промывали в фосфатно-солевом буфере рН 7,2 путем ополаскивания.
Затем дипстик помещали в раствор субстрата (приготовлен ex tempore) до появления цветных пятен в рабочей зоне, что происходит через 3-5 минут. Дипстик промывается путем ополаскивания и высушивается. Учет результата возможен до высушивания.
При необходимости длительного хранения результата исследования или их денситометрической обработки возможно фотографирование дипстика.
Пример 2.
Использование тест-системы для выявления холерного токсина в среде культивирования микроба с совмещение этапов «Б» и «В п. 1». Исследование по сокращенной схеме.
Этап А) Первичное подращивание осуществляли как в примере 1.
Этав Б и этап В п. 1) Вторичное подращивание осуществляли, как и в примере 1, но сразу после посева в пробирку помещали подготовленный дипстик и инкубацию посевов осуществляли вместе с ним. Это позволяет сократить весь цикл анализа на 45 минут (по сравнению с примером 1).
Этап В, пп. 2-4) После культивирования дипстик промывали в фосфатно-солевом буфере рН 7,2 путем ополаскивания. И все дальнейшие манипуляции проводили как в примере 1.
Пример 3.
Использование тест-системы для выявления холерного токсина в среде культивирования микроба со средним количеством использованной среды AKI (2 мл) для вторичного подращивания, средним количеством посевного материала, взятого после первичного подращивания и с совмещение этапов «Б» и «В п. 1». Исследование по сокращенной схеме.
Этап А) Первичное подращивание осуществляли как в примере 1.
Этап Б и этап В п. 1) Вторичное подращивание осуществляли как в примере 2, но для пересева брали 0,4 мл первично подращенной культуры, которую засевали в центрифужную пробирку с 2 мл AKI (объем пробирки - 5 мл). Так же как и в примере 2, сразу после посева в пробирку помещали подготовленный дипстик и инкубацию посевов осуществляли вместе с ним. Пробирку располагали в термостате наклонном положении (без касания жидкости крышки пробирки). Посев инкубировали при 37°С в течение 16 часов. Весь цикл анализа короче на 45 минут по сравнению с примером 1.
Этап В, пп. 2-4) После культивирования дипстик промывали в фосфатно-солевом буфере рН 7,2 путем ополаскивания. И все дальнейшие манипуляции проводили как в примере 1.
Пример 4.
Использование тест-системы для выявления холерного токсина в среде культивирования микроба с минимальным количеством использованной среды АК1(1 мл) для вторичного подращивания, минимальным количеством посевного материала, взятого после первичного подращивания и с совмещением этапов «Б» и «В п. 1». Исследование по сокращенной схеме.
Этап А) Первичное подращивание осуществляли как в примере 1.
Этап Б и этап В п. 1) Вторичное подращивание осуществляли как в примере 2, но для пересева брали 0,2 мл первично подращенной культуры, которую засевали в центрифужную пробирку с 1 мл AKI (объем пробирки - 2 мл). Так же как и в примере 2, сразу после посева в пробирку помещали подготовленный дипстик и инкубацию посевов осуществляли вместе с ним. Пробирку располагали в термостате в наклонном положении (без касания жидкости крышки пробирки). Посев инкубировали при 37°С в течение 16 часов. Весь цикл анализа короче на 45 минут по сравнению с примером 1.
Этап В, пп. 2-4) После культивирования дипстик промывали в фосфатно-солевом буфере рН 7,2 путем ополаскивания. И все дальнейшие манипуляции проводили как в примере 1.
Пример 5.
Сравнение эффективности анализа с использованием дипстиков и классического ИФА на иммунологических планшетах.
Все этапы исследования проводят, как описано в примерах 1 или 2-4. При этом проведение анализа с объединением этапов Б и В п. 1 (примеры 2-4) не влияет на качество результатов исследования, но влияет на время полного исследования (этапы А-В), которое сокращается на 45 минут.
Результат сравнения классического ИФА и анализа на дипстиках приведен в таблице 2, из которой видно, что заявляемая тест-система по чувствительности и специфичности не уступает методу ИФА, но позволяет сократить время исследования за счет сокращения последнего этапа в 1,8 раза, что достигается путем совмещения вторичного подращивания (этап Б) с обработкой дипстика в бульонной культуре (этап В, п. 1).
Литература.
1. Detection of Cholera Toxin: Laboratory Methods for the Diagnosis of Vibrio cholerae Centers for Disease Control and Prevention Laboratory Methods for the Diagnosis of Vibrio cholerae Centers for Disease Control and Prevention. - Atlanta, JA, 1994. - P. 62-88.
2. Almeida RJ, Hickman-Brenner FW, Sowers EG, Puhr ND, Farmer JJ III, Wachsmuth IK. Comparison of a latex agglutination assay and an enzyme-linked immunosorbent assay for detecting cholera toxin. J Clin Microbiol 1990;28:128-30.
3. Патент РФ 2199750. Способ получения диагностикума суспензионного антигенного на основе фракции 1. / Зайцев А.А. - Опубликовано 27.02.2003.
4. Патент РФ 2298798. Способ контроля биологической пробы в реакции латекс-агглютинации и аналитическая система осуществления./ Зимина Т.М. с соавт. - Опубликовано 10.05.2007.
5. Патент РФ 2231366. Иммунодиагностикум на основе полистирольного латекса./ Леонова В.Б., Розенфельд М.А. - Опубликован 27.06.2004.
6. Вершигора А.Е. Общая иммунология //Киев «Выща школа». - 1990. - 736 с.
7. Eiki Yamasaki, Ryuta Sakamoto, Takashi Matsumoto, Fumiki Morimatsu, Takayuki Kurazono, Toyoko Hiroi, G. Balakrish Nair, and Hisao Kurazono. Development of an Immunochromatographic Test Strip for Detection of Cholera Toxin // BioMed Research International. Volume 2013, Article ID 679038, 7 pages http://dx.doi.Org/10.1155/2013/679038.
8. Петрова, Е.Э. Получение и характеристика моноклональных антител к холерному токсину / Е.Э. Петрова, Р.Л. Комалева, О.Е. Лахтина и др. // Биоорганическая химия. - 2009. - Т. 35, №3. - С. 357-367.
9. Патент RU 2611359. Способ и набор для определения продукции холерного токсина и дифференциации эпидемически значимых штаммов холерных вибрионов классического и эльтор биоваров / Михеева Е.А. с соавт. - Опубликовано - 21.02.2017.
10. Тест-система иммуноферментная для определения продукции холерного токсина штаммами Vibrio cholerae (ИФАХолХТ-М) по ТУ 9388-052-01898109-2015. Регистрационное удостоверение на медицинское изделие от 15 ноября 2016 года №РЗН 2016/5013.

Изобретение относится к области биотехнологии. Предложен тест-комплект для выявления холерного токсина в среде культивирования. Тест-комплект содержит навеску среды AKI, конъюгат моноклональных антител, специфичных к В-субъединице холерного токсина изотипа G1 с пероксидазой хрена, реагенты для разведения конъюгата, реагенты для приготовления субстратной смеси и дипстик. Причем дипстик представляет собой полоску из устойчивого к водным растворам солей материала с фиксированным на нем фрагментом мембраны, сенсибилизированным специфическими к холерному токсину моноклональными антителами, и имеет на поверхности дополнительно иммобилизованный внутренний положительный контроль реакции. Изобретение обеспечивает высокоспецифичное, биологически менее опасное, быстрое и высокоэффективное выявление холерного токсина в среде культивирования при уменьшении трудозатрат и расхода реактивов. 5 пр., 2 табл., 4 ил.
Тест-комплект для выявления холерного токсина в среде культивирования, содержащий навеску среды AKI; конъюгат моноклональных антител, специфичных к В-субъединице холерного токсина изотипа G1 с пероксидазой хрена; реагенты для разведения конъюгата, такие как глицерин, лактальбумин и Tween; реагенты для приготовления субстратной смеси, такие как кислота лимонная, натрия цитрат, 2,2'-азино-бис-(3-этилбензтиозолин-6-сульфокислоты) и мочевина пероксид, отличающийся тем, что содержит по меньшей мере один дипстик, который представляет собой полоску из устойчивого к водным растворам солей материала с фиксированным на нем фрагментом мембраны, сенсибилизированным специфическими к холерному токсину моноклональными антителами, и имеющий на поверхности дополнительно иммобилизованный внутренний положительный контроль реакции, представляющий собой холерный токсин, который обеспечивает контроль реакции при исследовании каждого отдельного штамма микроорганизмов.
| СПОСОБ И НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ ПРОДУКЦИИ ХОЛЕРНОГО ТОКСИНА И ДИФФЕРЕНЦИАЦИИ ЭПИДЕМИЧЕСКИ ЗНАЧИМЫХ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ КЛАССИЧЕСКОГО И ЭЛЬТОР БИОВАРОВ | 2016 |
|
RU2611359C1 |
| Способ получения диагностикума для определения токсина холерного вибриона, выделенного из объектов окружающей среды | 2019 |
|
RU2703282C1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| CN 102375059 B, 14.01.2015 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2020-12-02—Публикация
2020-02-12—Подача