Область изобретения
Настоящее изобретение относится к водорастворимым производным фенилпиридазина, которые демонстрируют отличную активность по ингибированию продуцирования интерлейкина-1β, обладают высокой водорастворимостью и пероральной абсорбируемостью и являются полезными, например, для профилактики и лечения заболеваний иммунной системы, воспалительных заболеваний и ишемических заболеваний, а также к лекарственным средствам, содержащим такие соединения в качестве активного ингредиента.
Предпосылки изобретения
При многих заболеваниях, таких как ревматизм, артрит, остеопороз, воспалительный колит, синдром иммунодефицита, септицемия, гепатит, нефрит, ишемические заболевания, инсулинзависимый сахарный диабет, артериальный склероз, болезнь Паркинсона, болезнь Альцгеймера и лейкоз, наблюдается стимуляция продуцирования интерлейкина-1β, воспалительного цитокина. Такой интерлейкин-1β индуцирует синтез фермента, который, как считается, участвует в воспалении, такого как коллагеназа и PLA2, и при введении путем внутрисуставной инъекции животным вызывает многосуставные повреждения, сильно напоминающие ревматоидный артрит. С другой стороны, в здоровом организме активность интерлейкина-1β контролируется рецептором интерлейкина-1, растворимым рецептором интерлейкина-1 и антагонистом рецептора интерлейкина-1.
В результате исследований, проводимых с использованием рекомбинантных вариантов таких ингибирующих биоактивность веществ, антиинтерлейкин-1β антител и антител против рецептора, направленных против различных моделей заболеваний, а также в результате исследований, проводимых с использованием "knockout" мышей, было обнаружено, что интерлейкин-1β играет важную роль в организме, такие исследования ведут к увеличению потенциала веществ, обладающих активностью ингибирования интерлейкина-1β, в качестве терапевтических средств для лечения таких заболеваний.
Например, были сообщения о том, что иммуносупрессоры и стероиды, используемые для лечения ревматизма, ингибируют продуцирование интерлейкина-1β. Из разрабатываемых в настоящее время соединений, KE298, производное бензоилпропионовой кислоты [The Japanese Society of Inflammation (11th), 1990], например, как сообщалось, демонстрирует ингибиторную активность против продуцирования интерлейкина-1β, хотя оно является иммунорегулятором. Ингибиторная активность против продуцирования интерлейкина-1β также наблюдается у группы соединений, называемых "селективными ингибиторами COX-2", таких как нимесулид, который представляет собой производное феноксисульфонанилида (DE 2333643), T-614, который представляет собой производное феноксибензопирана (US Patent 4954518), и тенидап (производное оксииндола), являющийся двойным ингибитором (COX-1/5-LO).
Однако активность по ингибированию продуцирования интерлейкина-1β не является основным действием какого-либо из указанных соединений, следовательно, ингибиторная активность против продуцирования интерлейкина-1β меньше, чем их основное действие.
Недавно были проведены широкие исследования в области синтеза, в основном направленные на исследование ингибиторной активности против продуцирования интерлейкина-1β. Ингибиторы продуцирования можно классифицировать на (1) группу соединений, которые ингибируют процесс передачи сигнала воспаления ядрам клеток, и (2) другую группу соединений, которые ингибируют фермент ICE, функционирующий в процессинге предшественника интерлейкина-1β. Известные примеры соединений, которые, как полагают, обладают первым действием (1), включают SB203580 [Japanese Language Laid-Open (Kohyo) Publication (PCT) No. HEI 7-503017], FR167653 (Eur. J. Pharm., 327, 169-175, 1997), E-5090 (EP 376288), CGP47969A (Gastroenterology, 109, 812-828, 1995), производные гидроксииндола (Eur. J. Med. Chem.31, 187-198, 1996), и производные триарилпиррола (WO 9705878), тогда как известные примеры соединений, которые, как полагают, обладают вторым действием (2), включают VE-13,045, которое является пептидным соединением (Cytokine, 8 (5), 377-386, 1996).
Однако ни одно из этих соединений не проявляет достаточную ингибиторную активность против продуцирования интерлейкина-1β.
С другой стороны, известно, что производные 5,6-дифенилпиридазина проявляют аналгетическое и противовоспалительное действие (Eur. J. Med. Chem., 14, 53-60, 1979). Кроме того, 6-фенилпиридазиноны, как сообщалось, являются полезными в качестве кардиотонических соединений (US Patent 4404203). Однако не было никаких сообщений относительно ингибиторной активности этих пиридазиновых соединений против продуцирования интерлейкина-1β.
Ранее, в WO 99/44995, авторы настоящего изобретения сообщали, что высокую ингибиторную активность против продуцирования интерлейкина-1β наблюдали у производных фенилпиридазина. Недавно сообщалось о некоторых соединениях фенилпиридазина, обладающих ингибиторной активностью против продуцирования интерлейкина-1β (JP 7-69894 A, WO 98/41511, WO 99/10331, WO 99/10332, WO 99/25697, WO 00/50408). Однако указанные в этих заявках соединения отличаются по своей химической структуре от соединений по настоящему изобретению.
Описание изобретения
Соединения, раскрытые в WO 99/44995, проявляют сильную ингибиторную активность против продуцирования интерлейкина-1β. Однако растворимость в воде таких соединений настолько низкая, что их формулирование в фармацевтические препараты, такие как таблетки, практически невозможно. В ходе дальнейших исследований авторы настоящего изобретения обнаружили, что введение замещенной или незамещенной аминоалкильной группы в положение 4 6-фенилпиридазин-3-она дает соединение, полезное в качестве профилактического или терапевтического средства для лечения заболеваний иммунной системы, воспалительных заболеваний и ишемических заболеваний, например, благодаря его значительно улучшенной водорастворимости, хорошей пероральной абсорбируемости и отличной ингибиторной активности против и продуцирования нтерлейкина-1β, что привело к созданию настоящего изобретения.
Таким образом, в одном своем аспекте настоящее изобретение обеспечивает соединение фенилпиридазина, представленное формулой (1):

где:
R1 представляет собой замещенную или незамещенную алкильную группу или замещенную или незамещенную алкенильную группу;
R2 и R3, каждый независимо, представляет собой атом водорода или алкильную, гидроксиалкильную, дигидроксиалкильную или алкинильную группу, или R2 и R3, соединенные вместе со смежным атомом азота, могут образовывать замещенную или незамещенную азотсодержащую насыщенную гетероциклическую группу;
X, Y и Z, каждый независимо, представляет собой атом водорода или галогена, замещенную или незамещенную алкильную, алкокси, алкилтио, алкилсульфинильную или алкилсульфонильную группу или замещенную или незамещенную арильную группу; и
n имеет значение от 1 до 5;
при условии, что R2 и R3 одновременно не могут представлять атомы водорода или одинаковые C1-C3 алкильные группы, когда R1 представляет собой бензильную группу или C1-C3 алкильную группу; или его соль.
В другом аспекте настоящего изобретения обеспечивается также лекарственное средство, включающее соединение фенилпиридазина (1) или его соль в качестве активного ингредиента.
В следующем аспекте настоящего изобретения обеспечивается также фармацевтическая композиция, включающая соединение фенилпиридазина (1) или его соль и фармакологически приемлемый носитель.
В еще одном аспекте настоящего изобретения обеспечивается также соединение фенилпиридазина (1) или его соль для получения лекарственного средства.
И в еще одном аспекте настоящего изобретения обеспечивается также способ лечения заболевания, вызванного стимуляцией продуцирования интерлейкина-1β, который включает введение соединения фенилпиридазина (1) или его соли.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 графически представлена пероральная абсорбируемость соединения по настоящему изобретению (Пример 83) и сравнительного соединения 3;
На фиг.2 графически представлена пероральная абсорбируемость другого соединения по настоящему изобретению (Пример 23);
На фиг.3 графически представлена пероральная абсорбируемость еще одного соединения по настоящему изобретению (Пример 25);
На фиг.4 графически представлена пероральная абсорбируемость еще одного соединения по настоящему изобретению (Пример 143).
НАИЛУЧШИЕ СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В приведенной выше формуле (1), алкильные фрагменты в алкильной, гидроксиалкильной, дигидроксиалкильной, алкокси, алкилтио, алкилсульфинильной и алкилсульфонильной группах представляют собой фрагменты, содержащие от 1 до 12 атомов углерода, более предпочтительно от 1 до 7 атомов углерода. Такие алкильные фрагменты могут включать линейные, разветвленные и циклические алкильные группы, а также алкильные группы, содержащие циклические структуры, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, циклопропил, циклобутил, циклопентил, циклогексил, циклопропилметил, циклопропилэтил, циклобутилметил, циклопентилметил и циклогексилметил.
В приведенной выше формуле (1), алкильная группа, представленная R1, предпочтительно содержит от 1 до 12 атомов углерода, более предпочтительно, от 1 до 7 атомов углерода, например, от 4 до 7 атомов углерода. Примерами таких алкильных групп являются линейные, разветвленные и циклические алкильные группы, а также алкильные группы, содержащие циклические структуры. Предпочтительные примеры могут включать метил, этил, пропил, изобутил, циклобутил, циклопентил, циклогексил, циклопропилметил, циклопропилэтил, циклобутилметил, циклопентилметил и циклогексилметил, при этом метил, этил, изобутил, циклопропилметил и циклопентилметил являются особенно предпочтительными.
Алкенильная группа, представленная R1, предпочтительно содержит от 2 до 12 атомов углерода, при этом количество атомов углерода от 2 до 7 является особенно предпочтительным. Примерами таких алкенильных групп являются линейные и разветвленные алкенильные группы, в частности винил, пропенил, бутенил и пентенил.
Примерами группы (групп), которые алкильные или алкенильные группы, представленные R1, могут содержать в качестве заместителя (ей), являются замещенные или незамещенные арильные группы и замещенные или незамещенные гетероарильные группы. Примеры арильных групп включают арильные группы, содержащие от 6 до 14 атомов углерода, в частности фенил и нафтил, при этом фенил является особенно предпочтительным. Примеры гетероарильных групп, с другой стороны, включают 5- или 6-членные гетероарильные группы, содержащие от 1 до 3 атомов азота, в частности пирролил, имидазолил, пиразолил, пиридил, пиримидил, пиразинил и пиридазинил, при этом пиридил является особенно предпочтительным.
Такие арильные или гетероарильные группы могут содержать от 1 до 3 заместителей, таких как атом галогена, алкильные группы или алкокси группы. Примеры атома галогена включают фтор, хлор, бром и иод, при этом фтор и хлор являются особенно предпочтительными. Указанные алкильные и алкокси группы предпочтительно содержат от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным.
Алкильные, гидроксиалкильные и дигидроксиалкильные группы, представленные R2 и R3, предпочтительно содержат от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным. Предпочтительно такие группы могут быть линейными или разветвленными. Конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, гидроксиэтил, гидроксипропил, гидроксибутил, дигидроксипропил и дигидроксибутил.
Алкинильные группы, представленные R2 и R3, предпочтительно содержат от 3 до 12 атомов углерода, при этом количество атомов углерода от 3 до 7 является особенно предпочтительным. Примеры представляют собой пропаргил (2-пропинил).
Примерами азотсодержащей насыщенной гетероциклической группы, которая может быть образована в результате соединения R2 и R3 со смежным атомом азота, являются 5-7-членные насыщенные гетероциклические группы, в частности пирролидинил, пиперидино, пиперазинил, гомопиперазинил и морфолино, при этом пиперазинил, пиперидино и морфолино являются особенно предпочтительными.
Примерами группы (групп), которые указанные гетероциклические группы могут содержать в качестве заместителя (ей), являются атом галогена, алкильные группы, алкоксикарбонильные группы и аралкильные группы. Примеры атома галогена включают фтор, хлор, бром и иод. Алкильные группы могут содержать от 1 до 12 атомов углерода, предпочтительно, от 1 до 7 атомов углерода. Примерами алкоксикарбонильных групп являются C1-C12 алкилоксикарбонильные группы, при этом C1-C7 алкилоксикарбонильные группы являются предпочтительными. Примерами аралкильных групп являются группы фенил (C1-C7 алкил), при этом особенно предпочтительным является бензил.
Примерами атомов галогена, представленных X, Y и Z, являются фтор, хлор, бром и иод. Алкильные группы могут содержать от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным. Из таких алкильных групп линейные или разветвленные группы являются особенно предпочтительными. Примерами группы (групп), которые алкильная группа может содержать в качестве заместителя (ей), являются атомы галогенов и алкоксигруппы. Алкокси, алкилтио, алкилсульфинильные и алкилсульфонильные группы могут содержать от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным. Из таких алкокси, алкилтио, алкилсульфинильных и алкилсульфонильных групп линейные или разветвленные группы являются особенно предпочтительными. Конкретные примеры включают метокси, этокси, пропокси, изопропокси, бутокси, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил и бутилсульфонил. Примерами арильной группы являются арильные группы, содержащие от 6 до 14 атомов углерода, в частности фенил и нафтил, при этом фенил является особенно предпочтительным. Примерами группы (групп), которые арильная группа может содержать в качестве заместителя (ей), являются атомы галогенов, алкильные группы и алкоксигруппы.
n представляет собой число от 1 до 5, более предпочтительно от 1 до 3, и наиболее предпочтительно, 1 или 3.
Когда R1 представляет собой бензильную группу или C1-C3 алкильную группу, R2 и R3 одновременно не являются атомами водорода или одинаковыми C1-C3 алкильными группами.
В формуле (1) в качестве R1 особенно предпочтительными являются изобутил, циклопропилметил, циклопентилметил, циннамил, галогенциннамил, бензил, галогенобензил, дигалогенобензил и (галогенофенил)пропил. В качестве R2 и R3 предпочтительными являются водород, C1-7 алкил, C1-7 гидроксиалкил и пропаргил. В качестве гетероциклической группы, образованной R2 и R3, предпочтительными являются пиперазинил, пиперидино, пирролидинил и морфолино, каждый из которых необязательно замещен одной или несколькими C1-7 алкильными или бензильными группами. В качестве X предпочтительными являются метил, метокси, метилтио и галогены. В качестве Y предпочтительными являются водород, метил и галогены. В качестве Z предпочтительным является водород. Предпочтительными значениями n являются 1 и 3.
В качестве соли соединения (1) по настоящему изобретению предпочтительной является кислотно-аддитивная соль. Примеры кислотно-аддитивной соли включают соли неорганических кислот, такие как гидрохлорид, сульфат, нитрат и фосфат, и соли органических кислот, такие как метансульфонат, малеат, фумарат, цитрат и оксалат.
Соединения по настоящему изобретению могут также существовать в форме сольватов или кето-енольных таутомеров. Такие сольваты и таутомеры входят в объем настоящего изобретения. Примерами сольватов являются такие сольваты, которые образуются в результате добавления растворителей, используемых при получении соединений, например воды и спиртов. Нет никаких конкретных ограничений, касающихся растворителей, при условии, что они не оказывают неблагоприятного влияния на ингибиторную или подобную активность соединения по настоящему изобретению против продуцирования интерлейкина-1β. В качестве сольвата предпочтительным является гидрат.
Соединение фенилпиридазина (1) по настоящему изобретению можно получить, например, с использованием указанных ниже способов получения (a) - (d).
Способ получения соединений формулы (1),
в которых n=1
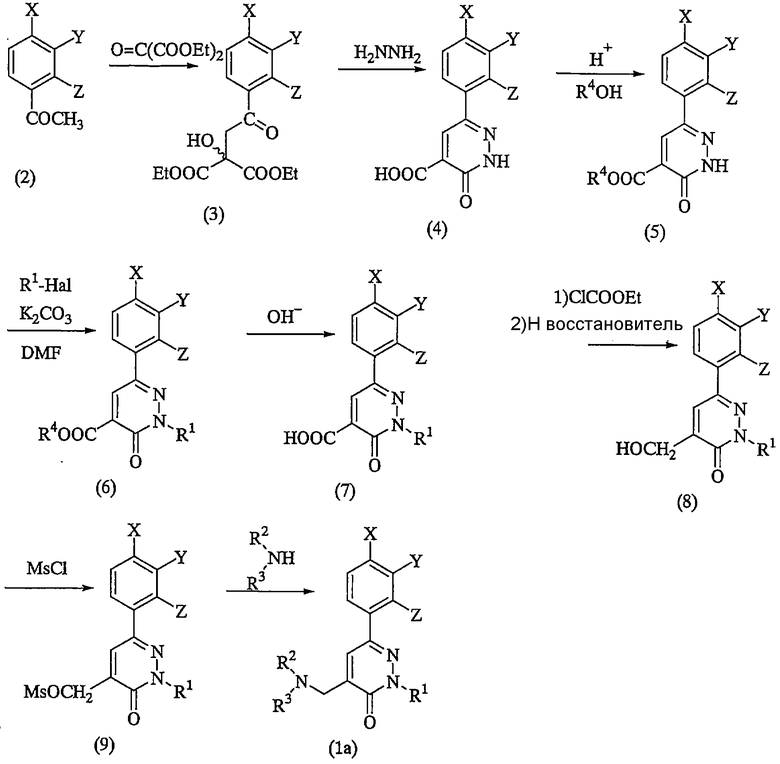
где R4 представляет собой алкильную группу, Hal представляет собой атом галогена, Ms представляет собой метансульфонильную группу и R1, R2, R3, X, Y и Z имеют значения, определенные выше.
Далее будут описаны отдельные стадии реакций.
На стадиях от ацетофенона (2) до соединения (5) ацетофенон (2) и диэтилкетомалонат нагревают при перемешивании с получением соединения (3). Соединение подвергают воздействию гидразина для осуществления реакции циклизации и затем продукт реакции обрабатывают щелочью, например гидроксидом натрия или т.п., с получением соединения (4). Затем соединение (4) подвергают взаимодействию со спиртом, таким как метанол, с получением соединения (5).
R1-Hal подвергают взаимодействию с соединением (5) в присутствии щелочи, такой как карбонат калия, с получением соединения (6). Соединение (6) гидролизуют с получением соединения (7). После воздействия на соединение (7) этилхлоркарбонатом для преобразования его в ангидрид кислоты, ангидрид кислоты восстанавливают при помощи восстановителя, такого как боргидрид натрия, с получением соединения (8). Взаимодействие метансульфонилхлорида с соединением (8) в присутствии основания, такого как триэтиламин, дает соединение (9), являющееся ключевым промежуточным соединением в этой схеме реакций.
Реакция желаемого амина (R2 (R3)NH) с соединением (9) дает целевое соединение (1a). Эту реакцию предпочтительно осуществлять, например, в полярном растворителе, таком как диметилформамид, в присутствии или в отсутствие щелочи, такой как карбонат калия. В случае если в группе R2 или R3 в амине содержится аминогруппа, реакцию можно осуществлять с использованием исходного вещества, защищенного подходящей защитной группой, например алкоксикарбонильной группой, с последующим удалением защитной группы.
Для получения соединения (1a), в котором R2 и R3 являются атомами водорода, фталимид калия подвергают взаимодействию с соединением (9) и затем продукт реакции подвергают взаимодействию с гидразином или т.п.
Соединение (1a), в котором X, Y и/или Z представляет собой метилсульфинильную группу или метилсульфонильную группу, можно получить окислением соответствующего соединения, в котором X, Y и/или Z представляет собой метилтиогруппу, перкислотой, например пербензойной кислотой. Такое метилсульфинирование или метилсульфонирование можно осуществлять на стадии промежуточного соединения (9).
Способ получения соединений формулы (1),
в которых n=3
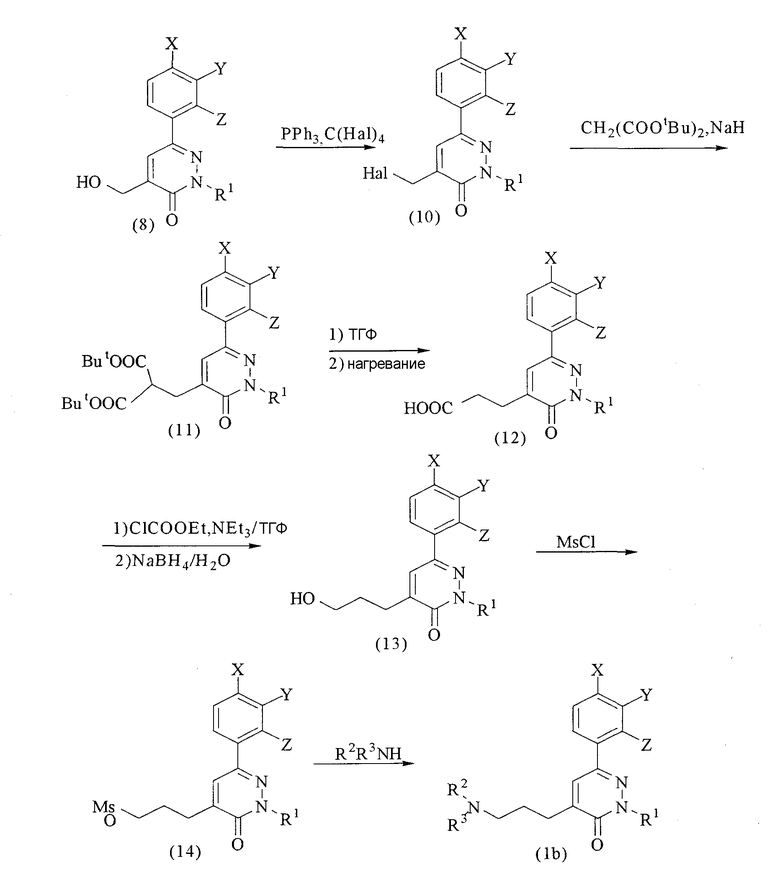
где Hal, Ms, R1, R2, R3, X, Y и Z имеют значения, определенные выше.
В соответствии со способом получения (b) тетрагалогенид углерода, такой как тетрабромид углерода, сначала подвергают взаимодействию с соединением (8), в присутствии трифенилфосфина с получением галогенида (10) с последующим взаимодействием этого соединения с малонатом в присутствии гидрида натрия с получением соединения (11). Соединение (11) подвергают взаимодействию с кислотой, такой как трифторуксусная кислота, для преобразования его в дикарбоновую кислоту с последующим нагреванием с получением соединения (12). Соединение (12) подвергают воздействию этилхлоркарбоната для преобразования в ангидрид кислоты, который затем восстанавливают при помощи восстановителя, такого как боргидрид натрия, с получением соединения (13). Соединение (13) подвергают взаимодействию с метансульфонилхлоридом в присутствии основания, такого как триэтиламин, с получением соединения (14), ключевого промежуточного соединения в способе по настоящему изобретению.
Целевое соединение (1b) можно получить взаимодействием соответствующего амина (R2R3NH) с соединением (14). Эту реакцию можно предпочтительно осуществлять, например, в присутствии или в отсутствие щелочи, такой как карбонат калия, в полярном растворителе, таком как диметилформамид. Когда в группе R2 или R3 амина содержится аминогруппа, реакцию можно осуществлять с использованием исходного вещества, в котором аминогруппа защищена подходящей защитной группой (например, алкоксикарбонильной группой), с последующим удалением защитной группы.
Для получения соединения (1b), в котором R2 и R3 оба представляют собой атомы водорода, это соединение может быть получено взаимодействием фталимида калия с соединением (14) и затем взаимодействием с гидразином или т.п.
(c) Способ получения соединений формулы (1),
в которых n=2

где M представляет атом металла, и Hal, Ms, R1, R2, R3, X, Y и Z имеют значения, определенные выше.
В соответствии со способом получения (c) цианид, такой как цианид натрия, подвергают взаимодействию с галогенидом (10) для преобразования его в нитрильное производное (15), которое затем гидролизуют с получением соединения (16). Из соединения (16) целевое соединение (1c) может быть получено через производное спирта (17) и мезилоксипроизводное (18) с использованием процедуры, аналогичной той, которую используют для получения соединений, каждое из которых содержит три метиленовых группы.
(d) Способ получения соединений формулы (1),
в которых n=4 или 5
Эти соединения можно получить путем объединения способов синтеза (b) и (c).
Соль соединения (1) по настоящему изобретению можно получить действием органической или неорганической кислоты способом, известным из уровня техники.
Соединение (1) по настоящему изобретению можно выделить и очистить, подвергая его очистке, обычно проводимой в химии органического синтеза, например фильтрации, экстракции, промывке, сушке, концентрированию, перекристаллизации, различным хроматографическим методам и/или т.п. Каждый промежуточный продукт можно использовать в последующей реакции без дополнительной очистки. Соединение (1) может быть получено в форме сольвата, в частности в форме гидрата, при использовании растворителя, такого как растворитель, используемый в реакции, или растворитель для перекристаллизации.
Соединение (1) по настоящему изобретению обладает отличной растворимостью в воде, оно также хорошо абсорбируется при пероральном введении и обладает ингибиторной активностью против продуцирования интерлейкина-1β и поэтому является полезным в качестве профилактического или терапевтического средства для лечения заболеваний иммунной системы, воспалительных заболеваний, ишемических заболеваний, остеопороза, ишемии и т.п. Примеры ишемических заболеваний включают ишемические заболевания сердца, ишемическую энцефалопатию, ишемический нефрит и ишемический гепатит.
Фармацевтическая композиция по настоящему изобретению содержит в качестве активного ингредиента соединение (1) или его соль. Активный ингредиент можно использовать отдельно или вместе с фармакологически приемлемым носителем, таким как солюбилизатор, эксципиент, связующее или наполнитель, для получения фармацевтических препаративных форм, таких как таблетки, капсулы, гранулы, порошки, инъекции и суппозитории. Такие фармацевтические препараты можно получать известными методами. Например, препараты для перорального введения можно получать формулированием соответствующих композиций соединения (1) или его соли в сочетании с солюбилизаторами, такими как камедь трагаканта, аравийская камедь, сложные эфиры сахарозы, лецитин, оливковое масло, соевое масло и ПЭГ 400; эксципиентами, такими как крахмал, маннит и лактоза; связующими, такими как натрий карбоксиметилцеллюлоза и гидроксипропилцеллюлоза; разрыхлителями, такими как кристаллическая целлюлоза и кальций карбоксиметилцеллюлоза; смазывающими веществами, такими как тальк и стеарат магния; агентами против прилипания, такими как легкая безводная кремневая кислота. Фармацевтические композиции по настоящему изобретению водят перорально или парентерально.
Вводимая доза фармацевтической композиции по настоящему изобретению варьирует в зависимости от веса тела, возраста, пола, условий и т.п. каждого пациента. Однако, как правило, предпочтительно введение взрослому человеку примерно от 0,01 до 1000 мг, предпочтительно от 0,1 до 100 мг фармацевтической композиции по настоящему изобретению в расчете на соединение (1), в день 1 - 3 порциями.
ПРИМЕРЫ
Далее настоящее изобретение будет описано со ссылкой на примеры. Примеры представлены исключительно в целях иллюстрации, и никоим образом не должны рассматриваться как ограничивающие изобретение.
Пример 1
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
1) Получение4-(1-гидроксиэтил)-2-фтортолуола
К охлажденному льдом раствору 3-фтор-4-метилбензальдегида (50 мг, 0,36 ммоль) в ТГФ (0,5 мл) добавляли по каплям 0,93 M раствор (0,47 мл) метилмагнийбромида (0,44 ммоль) в ТГФ. Смеси снова давали нагреться до комнатной температуры, при которой реакционную смесь перемешивали в течение 1 часа. Затем добавляли 2 моль/л хлористоводородной кислоты и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтого масла (55,8 мг, количественный выход).
1H ЯМР (400 МГц, CDCl3) δ: 1,46 (3Н, д, J=6,4 Гц), 2,26 (3Н, д, J=1,8 Гц), 4,85 (1Н, кв., J=6,4 Гц), 6,99-7,06 (2Н, м), 7,14 (1Н, дд, J=7,8, 7,8 Гц).
2) Получение 3'-фтор-4'-метилацетофенона
К раствору 4-(1-гидроксиэтил)-2-фтортолуола (55,8 мг, 0,36 ммоль) в метиленхлориде (1 мл) добавляли молекулярные сита 4A (56,0 мг) и PCC 94,0 мг (0,43 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали через Celite и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения в виде бледно-желтого масла (47,5 мг, 86,0%).
1H ЯМР (400 МГц, CDCl3) δ: 2,32 (3Н, д, J=1,8 Гц), 2,56 (3Н, с), 7,26 (1Н, дд, J=7,6, 7,6 Гц), 7,56 (1Н, дд, J=1,6, 10,4 Гц), 7,62 (1Н, дд, J=1,6, 7,8 Гц).
3) Получение этил 2-этоксикарбонил-4-(3-фтор-4-метилфенил)-2-гидрокси-4-оксобутаноата
Смесь 3'-фтор-4'-метилацетофенона (4,92 г, 32,3 ммоль) и диэтилкетомалоната (6,19 г, 35,6 ммоль) перемешивали при 120°С в течение 48 час. Температуре реакционной смеси давали понизиться до комнатной и смесь очищали колоночной хроматографией на силикагеле [силикагель 100 г, хлороформ/этилацетат (10/1)] с получением указанного в заголовке соединения в виде желтых кристаллов (8,41 г, 79,3%).
Температура плавления: 68,7-69,0°С
1H ЯМР (400 МГц, CDCl3) δ: 1,30 (6Н, т, J=7,1 Гц), 2,34 (3Н, с), 3,78 (2Н, с), 4,25 (1Н, с), 4,31 (4Н, кв., J=7,1 Гц), 7,29 (1Н, дд, J=7,6 Гц), 7,59 (1Н, д, J=10,2 Гц), 7,65 (1Н, дд, J=1,5, 7,8 Гц).
ИК (KBr) см-1: 3485, 1740, 1684, 1253, 856, 577.
4) Получение 4-карбокси-6-(3-фтор-4-метилфенил)-2H-пиридазин-3-она
К раствору этил 2-этоксикарбонил-4-(3-фтор-4-метилфенил)-2-гидрокси-4-оксобутаноата (8,41 г, 25,8 ммоль) в изопропаноле (100 мл) добавляли гидразинмоногидрат (2,84 г, 56,8 ммоль) и смесь нагревали при перемешивании при 100°С в течение 6 час. Затем добавляли 2 моль/л гидроксида натрия и смесь продолжали перемешивать при той же температуре в течение 4 час. Реакционную смесь охлаждали на льду и добавляли концентрированную хлористоводородную кислоту для подкисления системы. Осадок отфильтровывали, тщательно промывали водой и сушили с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (5,67 г, 87,7%).
Температура плавления: 281,3-282,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,28 (3Н, д, J=1,0 Гц), 7,41 (1Н, дд, J=8,1, 8,1 Гц), 7,67-7,73 (2Н, м), 8,49 (1Н, с), 14,09 (1Н, ушир.).
ИК (KBr) см-1: 1736, 1641, 1441, 1125, 926, 806.
5) Получение 6-(3-фтор-4-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она
К охлажденной льдом суспензии 4-карбокси-6-(3-фтор-4-метилфенил)-2H-пиридазин-3-она (5,50 г, 22,2 ммоль) в метаноле (100 мл) добавляли по каплям тионилхлорид (2,72 г, 24,4 ммоль) и смесь перемешивали при 80°С в течение 8 час. Температуре реакционной смеси давали понизиться до комнатной и растворитель отгоняли при пониженном давлении. К охлажденному на льду остатку добавляли воду. Осадок отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения в виде бледно-желтых тонких игольчатых кристаллов (5,43 г, 92,7%).
Температура плавления: 206,0-207,3°С
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, д, J=1,7 Гц), 4,00 (3Н, с), 7,29 (1Н, дд, J=7,9, 7,9 Гц), 7,46-7,53 (2Н, м), 8,32 (1Н, с), 11,61 (1Н, с).
ИК (KBr) см-1: 1715, 1671, 1266, 1177, 1091, 812.
6) Получение 6-(3-фтор-4-метилфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она
К раствору 6-(3-фтор-4-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она (5,28 г, 20,0 ммоль) в N,N-диметилформамиде (40 мл) добавляли карбонат калия (5,53 г, 40,0 ммоль) и изобутилбромид (3,29 г, 24,0 ммоль) и смесь перемешивали при 80°С в течение 1 часа. Температуре реакционной смеси давали снова понизиться до комнатной. Добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле [силикагель 100 г, хлороформ/метанол (100/1→50/1)) с получением указанного в заголовке соединения в виде оранжевого масла (5,41 г, 84,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,32-2,42 (1Н, м), 2,33 (3Н, с), 3,98 (3H, с), 4,12 (2Н, д, J=7,4 Гц), 7,28 (1Н, дд, J=7,8, 7,8 Гц), 7,46 (1Н, дд, J=1,6, 7,8 Гц), 7,50 (1Н, дд, J=1,6, 10,7 Гц), 8,21 (1Н, с).
7) Получение 4-карбокси-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
К суспензии 6-(3-фтор-4-метилфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она (5,27 г, 16,6 ммоль) в метаноле (50 мл) добавляли 2 моль/л водного раствора гидроксида натрия (50 мл) и смесь перемешивали при 60°С в течение 15 мин. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли воду. После подкисления системы концентрированной хлористоводородной кислотой, смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (4,73 г, 93,8%).
Температура плавления: 159,0-159,5°С
1H ЯМР (400 МГц, CDCl3) δ: 1,02 (6Н, д, J=6,7 Гц), 2,33-2,42 (1Н, м), 2,35 (3Н, д, J=1,6 Гц), 4,21 (2Н, д, J=7,4 Гц), 7,32 (1Н, dd, J=7,8,7,8 Гц), 7,52 (1Н, dd, J=1,8,8,0 Гц), 7,55 (1Н, дд, J=1,8, 10,6 Гц), 8,63 (1Н, с), 14,13 (1Н, с).
ИК (KBr) см-1: 2960, 1742, 1633, 1574, 1425, 1101, 820.
8) Получение 6-(3-фтор-4-метилфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она
К раствору 4-карбокси-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она (4,53 г, 14,9 ммоль) в ТГФ (40 мл) добавляли триэтиламин (1,66 г, 16,4 ммоль). К охлажденной льдом смеси добавляли по каплям раствор этилхлоркарбоната (1,78 г, 16,4 ммоль) в ТГФ (5 мл) и смесь перемешивали в течение 30 мин. Гидрохлорид триэтиламина отфильтровывали. К фильтрату добавляли раствор боргидрида натрия (564 мг, 14,9 ммоль) в воде (1 мл) и смесь перемешивали при комнатной температуре в течение 10 мин. Затем к реакционной смеси добавляли 2 моль/л хлористоводородной кислоты и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле [силикагель 300 г, хлороформ/метанол (100/1>50/1)) с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (1,08 г, 25,0%).
Температура плавления: 147,3-147,5°С
1H ЯМР (400 МГц, CDCl3)δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,39 (1Н, м), 2,32 (3Н, д, J=1,8 Гц), 3,05 (1Н, т, J=6,0 Гц), 4,08 (2Н, д, J=7,4 Гц), 4,71 (2Н, дд, J=1,2, 6,0 Гц), 7,26 (1Н, дд, J=7,8 Гц), 7,46 (1Н, дд, J=7,8, 7,8 Гц), 7,50 (1Н, дд, J=1,8, 10,8 Гц), 7,65 (1Н, с).
ИК (KBr) см-1: 3330, 1644, 1596, 1514, 1226, 1087, 824.
9) Получение 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она
К охлажденному льдом раствору 6-(3-фтор-4-метилфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она (1,08 г, 3,73 ммоль) в метиленхлориде (20 мл) добавляли триэтиламин (491 мг, 4,85 ммоль) и метансульфонилхлорид (513 мг, 4,48 ммоль) и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и затем смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (964 мг, 70,4%).
Температура плавления: 142,7-143,4°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,34 (1Н, м), 2,33 (3Н, д, J=1,8 Гц), 3,17 (3Н, с), 4,08 (2Н, д, J=7,4 Гц), 5,27 (2Н, д, J=1,4 Гц), 7,27 (1Н, дд, J=7,8, 7,8 Гц), 7,45 (1Н, дд, J=1,8, 8,0 Гц), 7,50 (1Н, дд, J=1,8, 10,9 Гц), 7,76 (1Н, т, J=1,4 Гц).
ИК (KBr) см-1: 3435, 2964, 1658, 1610, 1354, 1165, 875.
10) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
К раствору 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она (100 мг, 0,27 ммоль) в ацетонитриле (1 мл) добавляли карбонат калия (56,3 мг, 0,41 ммоль) и трет-бутил 1-пиперазинкарбоксилат (60,7 мг, 0,33 ммоль) и смесь перемешивали при 80°С в течение 2 час. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли воду. Смесь экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле [хлороформ/метанол (40/1)] с получением указанного в заголовке соединения в виде желтого масла (115 мг, 92,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=3,4 Гц), 1,47 (9Н, с), 2,28-2,40 (1Н, м), 2,33 (3Н, с), 2,52 (4Н, т, J=4,7 Гц), 3,51 (4Н, т, J=4,7 Гц), 3,58 (2Н, с), 4,07 (2Н, д, 4,1 Гц), 7,27 (1Н, дд, J=7,6, 7,6 Гц), 7,44-7,52 (2Н, м), 7,77 (1Н, с).
Пример 2
Получение дигидрохлорида 6-(3-фтор-4-метилфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
К раствору 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она (115 мг, 0,25 ммоль) в этилацетате (2 мл) добавляли 4 моль/л раствора (2 мл) хлористоводородной кислоты в этилацетате и смесь перемешивали при 50°С в течение 1 часа. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли диэтиловый эфир. Осадок отделяли с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (81,1 мг, 75,0%).
Температура плавления: 186,2-195,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,22-2,33 (1Н, м), 2,29 (3Н, д, J=2,0 Гц), 3,15 (4Н, ушир.), 3,32 (4Н, т, J=5,2 Гц), 3,93 (2Н, с), 4,02 (2Н, д, J=7,1 Гц), 7,40 (1Н, дд, J=8,1, 8,1 Гц), 7,59-7,66 (2Н, м), 8,21 (1Н, с).
ИК (KBr) см-1: 1656, 1610, 1425, 1306, 956.
Mass m/z: 358 (M+)
Пример 3
Получение 6-(3-фтор-4-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 93,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,28-2,40 (1Н, м), 2,33 (6Н, с), 2,52 (4Н, ушир.), 2,62 (4Н, ушир.), 3,58 (2Н, с), 4,07 (2Н, д, J=7,4 Гц), 7,27 (1Н, дд, J=7,9, 7,9 Гц), 7,46-7,52 (2Н, м), 7,75 (1Н, д, J=1,0 Гц).
Пример 4
Получение дигидрохлорида 6-(3-фтор-4-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
К раствору 6-(3-фтор-4-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она (94,4 мг, 0,25 ммоль) в метаноле (1 мл) добавляли по каплям при комнатной температуре при перемешивании 4 моль/л раствора (0,15 мл) хлористоводородной кислоты в этилацетате. Растворитель отгоняли при пониженном давлении. Остаток перекристаллизовывали из смеси метанол-диэтиловый эфир с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (71,9 мг, 63,7%).
Температура плавления: 248,5-252,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,29 (3Н, д, J=1,8 Гц), 2,22-2,33 (1Н, м), 2,77 (3Н, с), 3,18 (4Н, ушир.), 3,38 (4Н, ушир.), 3,91 (2Н, с), 4,02 (2Н, д, J=7,0 Гц), 7,40 (1Н, дд, J=8,0, 8,0 Гц), 7,59-7,65 (2Н, м), 8,16 (1Н, с).
ИК (KBr) см-1: 1653, 1609, 1451, 1425, 951.
Mass m/z: 372 (M+)
Пример 5
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 84,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,96 (6Н, д, J=6,6 Гц), 2,27 2,38 (1Н, м), 2,30 (3Н, с), 2,70 (4Н, т, J=5,0 Гц), 3,66 (4Н, т, J=5,2 Гц), 3,69 (2Н, с), 4,06 (2Н, д, J=7,2 Гц), 7,23 (1Н, дд, J=7,9,7,9 Гц), 7,46-7,52 (2Н, м), 7,79 (1Н, с).
Пример 6
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 85,9%).
Температура плавления: 159,7-160,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,6 Гц), 2,20-2,34 (1Н, м), 2,30 (3Н, д, J=1,7 Гц), 3,35 (4Н, т, J=5,1 Гц), 3,84 (4Н, т, J=5,1 Гц), 4,05 (2Н, д, J=7,0 Гц), 4,45 (2Н, с), 7,42 (1Н, дд, J=8,2, 8,2 Гц), 7,62-7,68 (2Н, м), 8,47 (1Н, с).
ИК (KBr) см-1: 1663, 1613, 1427, 1087, 1052, 821.
Mass m/z: 359 (M+-H2O)
Пример 7
Получение 4-диметиламинометил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
К 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-ону (100 мг, 0,27 ммоль) добавляли 40% водный раствор диметиламина (1 мл) и смесь перемешивали при 80°С в течение 2 час. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли воду. Смесь экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле [хлороформ/метанол (40/1)] с получением указанного в заголовке соединения в виде желтого масла (69,7 мг, 80,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,23-2,41 (1Н, м), 2,31 (3Н, с), 2,35 (6Н, с), 3,50 (2Н, д, J=1,2 Гц), 4,08 (2Н, д, J=7,4 Гц), 7,26 (1Н, дд, J=7,9,7,9 Гц), 7,47-7,54 (2Н, м), 7,76 (1Н, д, J=1,4 Гц).
Пример 8
Получение гидрохлорида 4-диметиламинометил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 85,4%).
Температура плавления: 246,5-248,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,6 Гц), 2,23-2,34 (1Н, м), 2,30 (3Н, с), 2,81 (6Н, с), 4,05 (2Н, д, J=7,0 Гц), 4,27 (2Н, с), 7,41 (1Н, дд, J=8,0,8,0 Гц), 7,22-7,68 (2Н, м), 8,52 (1Н, с).
ИК (KBr) см-1: 1648, 1607, 1422, 1227, 1110, 1051.
Mass m/z: 317 (M+)
Пример 9
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
1) Получение 4-карбокси-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтых кристаллов (выход: 98,9%).
Температура плавления: 169,1-170,7°С
1H ЯМР (400 МГц, CDCl3) δ: 0,50-0,67 (4Н, m ), 1,40-1,50 (1Н, м), 3,97 (3Н, с), 4,23 (2Н, д, J=7,3 Гц), 7,07 (1Н, дд, J=8,5, 8,5 Гц), 7,57 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,85 (1Н, дд, J=2,2, 12,2 Гц), 8,63 (1Н, с), 14,20 (1Н, с).
ИК (KBr) см-1: 1761, 1629, 1521, 1476, 1461.
Mass m/z: 318 (M+).
2) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых тонких игольчатых кристаллов (выход: 21,3%).
Температура плавления: 119,4-122,6°С
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,60 (4Н, м), 1,36-1,47 (1Н, м), 3,12 (1Н, т, J=6,0 Гц), 3,95 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 4,72 (2Н, дд, J=1,2, 5,9 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,51 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,62 (1Н, дд, J=2,2, 12,4 Гц), 7,65 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 3431, 1652, 1604, 1524.
Mass m/z: 304 (M+).
3) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых тонких игольчатых кристаллов (выход: 80,4%).
Температура плавления: 156,9-158,4°С
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,61 (4Н, м), 1,36-1,46 (1Н, м), 3,18 (3Н, с), 3,95 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 5,28 (2Н, д, J=1,2 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,51 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,62 (1Н, дд, J=2,2, 12,2 Гц), 7,76 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 1656, 1612, 1523, 1358, 1177.
Mass m/z: 382 (M+).
4) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метиламинометил-2H-пиридазин-3-она
Раствор 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она (160 мг, 0,42 ммоль) в 30% метиламин/этаноле (5 мл) перемешивали при 80°С в течение 4 час в герметично закрытой пробирке. Растворитель отгоняли при пониженном давлении и остаток очищали препаративной тонкослойной хроматографией на силикагеле [проявляющий растворитель: хлороформ/метанол (10/1)] с получением указанного в заголовке соединения в виде желтоватого масла (87 мг, 65,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,59 (4Н, м), 1,36-1,47 (1Н, м), 1,85 (1Н, ушир.), 2,52 (3Н, с), 3,80 (2Н, д, J=1,2 Гц), 3,95 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,52 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,62 (1Н, дд, J=2,2, 12,4 Гц), 7,66 (1Н, т, J=1,2 Гц).
Mass m/z: 317 (M+).
Пример 10
Получение гидрохлорида 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метиламинометил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метиламинометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых тонких игольчатых кристаллов (выход: 93,8%).
Температура плавления: 220,8-224,3°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,44-0,54 (4Н, м), 1,29-1,40 (1Н, м), 2,66 (3Н, с), 3,91 (3Н, с), 4,05 (2Н, д, J=7,3 Гц), 4,12 (2Н, с), 7,33 (1Н, дд, J=8,5, 8,5 Гц), 7,70-7,79 (2Н, м), 8,39 (1Н, с).
ИК (KBr) см-1: 1645, 1599, 1521, 1437.
Пример 11
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 73,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,59 (4Н, м), 1,36-1,47 (1Н, м), 2,33 (3Н, с), 2,52 (4Н, ушир.), 2,62 (4Н, ушир.), 3,80 (2Н, д, J=1,2 Гц), 3,58 (2Н, д, J=1,0 Гц), 3,95 (3Н, с), 4,09 (2Н, д, J=7,3 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,53 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,61 (1Н, дд, J=2,2, 12,4 Гц), 7,74 (1Н, т, J=1,2 Гц).
ИК (Чистый) см-1: 1652, 1608, 1520, 1456, 1440.
Mass m/z: 386 (M+).
Пример 12
Получение дигидрохлорида 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 81,0%).
Температура плавления: 237,4-238,4°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,47-0,58 (4Н, м), 1,31-1,41 (1Н, м), 2,33 (3Н, с), 2,52 (4Н, ушир.), 2,62 (4Н, ушир.), 2,90-3,85 (10Н, м), 3,91 (3Н, с), 4,03 (2Н, д, J=7,3 Гц), 7,30 (1Н, дд, J=8,5, 8,5 Гц), 7,70-7,78 (2Н, м), 8,28 (1Н, ушир.с).
ИК (KBr) см-1: 1653, 1608, 1523, 1438.
Пример 13
Получение 2-циклопропилметил-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 88,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,59 (4Н, м), 1,37-1,48 (1Н, м), 2,36 (6Н, с), 3,51 (2Н, с), 3,95 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,53-7,57 (1Н, м), 7,64 (1Н, дд, J=2,2, 12,7 Гц), 7,75 (1Н, с).
ИК (Чистый) см-1: 1652, 1608, 1523, 1456, 1438.
Mass m/z: 331 (M+).
Пример 14
Получение гидрохлорида 2-циклопропилметил-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 89,0%).
Температура плавления: 233,6-235,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,41-0,54 (4Н, м), 1,27-1,37 (1Н, м), 2,83 (6Н, с), 3,92 (3Н, с), 4,06 (2Н, д, J=7,3 Гц), 4,30 (2Н, с), 7,33 (1Н, дд, J=8,8, 8,8 Гц), 7,69-7,77 (2Н, м), 8,51 (1Н, с).
ИК (KBr) см-1: 1648, 1584, 1522, 1439.
Пример 15
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(2-гидроксиэтил)аминометил-2H-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 2-аминоэтанол с получением указанного в заголовке соединения в виде желтого масла (выход: 72,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,59 (4Н, м), 1,36-1,47 (1Н, м), 2,86 (2Н, т, J=5,1 Гц), 3,73 (2Н, т, J=5,1 Гц), 3,84 (2Н, д, J=1,0 Гц), 3,94 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,50-7,54 (1Н, м), 7,62 (1Н, дд, J=2,2, 12,7 Гц), 7,67 (1Н, с).
ИК (Чистый) см-1: 3411, 1651, 1605, 1523, 1439.
Mass m/z: 347 (M+).
Пример 16
Получение гидрохлорида 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(2-гидроксиэтил)аминометил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-N-(2-гидроксиэтил)-аминометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-коричневых игольчатых кристаллов (выход: 79,2%).
Температура плавления: 166,8-169,3°С (разл.)
1H ЯМР (400 МГц, CDCl3) δ: 0,40-0,54 (4Н, м), 1,27-1,37 (1Н, м), 3,13 (2Н, ушир.), 3,28 (2Н, ушир.), 3,74 (3Н, с), 4,05 (2Н, д, J=7,1 Гц), 4,18 (2Н, с), 5,31 (1Н, ушир.), 7,33 (1Н, дд, J=8,8, 8,8 Гц), 7,69-7,79 (2Н, м), 8,40 (1Н, с).
ИК (KBr) см-1: 3334, 1654, 1616, 1604, 1523, 1441.
Пример 17
Получение 4-(4-бензил-1-пиперазинил)метил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-бензилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 97,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,58 (4Н, м), 1,36-1,46 (1Н, м), 2,56 (4Н, ушир.), 2,62 (4Н, ушир.), 3,56 (2Н, с), 3,58 (2Н, д, J=1,0 Гц), 3,95 (3Н, с), 4,09 (2Н, д, J=7,1 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,23-7,36 (5Н, м), 7,50-7,55 (1Н, м), 7,61 (1Н, дд, J=2,2, 12,7 Гц), 7,75 (1Н, с).
ИК (Чистый) см-1: 1652, 1608, 1522, 1438, 1289, 1237.
Mass m/z: 462 (M+).
Пример 18
Получение дигидрохлорида 4-(4-бензил-1-пиперазинил)метил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-(4-бензил-1-пиперазинил)метил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых призматических кристаллов (выход: 85,7%).
Температура плавления: 253,0-257,9°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,41-0,55 (4Н, м), 1,27-1,38 (1Н, м), 3,06-3,49 (10Н, ушир.), 3,56 (2Н, с), 3,91 (3Н, с), 4,02 (2Н, д, J=7,3 Гц), 4,39 (2Н, ушир.с), 7,30 (1Н, дд, J=8,5, 8,5 Гц), 7,44-7,48 (3Н, м), 7,59-7,64 (2Н, м), 7,69-7,77 (2Н, м), 8,30 (1Н, ушир.с).
ИК (KBr) см-1: 1656, 1616, 1523, 1439, 1292, 1271.
Пример 19
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде бледно-коричневого масла (выход: 98,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,59 (4Н, м), 1,47 (9Н, с), 1,38-1,46 (1Н, м), 2,53 (4Н, т, J=4,9 Гц), 3,51 (4Н, т, J=4,9 Гц), 3,58 (2Н, д, J=1,2 Гц), 3,95 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,51 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,61 (1Н, дд, J=2,2, 12,7 Гц), 7,76 (1Н, с).
ИК (Чистый) см-1: 1698, 1653, 1609, 1523, 1438, 1427.
Mass m/z: 472 (M+).
Пример 20
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
4-(4-трет-Бутоксикарбонил-1-пиперазинил)метил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он (220 мг, 0,47 ммоль) растворяли в охлажденной льдом трифторуксусной кислоте (2 мл) и при этой же температуре смесь перемешивали в течение 15 мин. К реакционной смеси добавляли воду (10 мл). Смесь подщелачивали карбонатом калия и дважды экстрагировали хлороформом (20 мл). Экстракты промывали насыщенным солевым раствором (20 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли. Остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (120 мг, 69,2%).
Температура плавления: 111,5-118,0°С
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,59 (4Н, м), 1,36-1,47 (1Н, м), 2,55 (4Н, ушир.), 2,96 (4Н, т, J=4,9 Гц), 3,56 (2Н, д, J=1,5 Гц), 3,95 (3Н, с), 4,09 (2Н, д, J=7,3 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,53 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,62 (1Н, дд, J=2,2, 12,7 Гц), 7,76 (1Н, т, J=1,5 Гц).
ИК (KBr) см-1: 3328, 1648, 1605, 1520, 1437.
Mass m/z: 372 (M+).
Пример 21
Получение дигидрохлорида 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых призматических кристаллов (выход: 94,5%).
Температура плавления: 139,1-142,4°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,42-0,56 (4Н, м), 1,29-1,39 (1Н, м), 3,40 (4Н, ушир.), 3,70 (4Н, ушир.), 3,91 (3Н, с), 4,16 (2Н, д, J=7,3 Гц), 4,16 (2Н, ушир.с), 7,31 (1Н, дд, J=8,5, 8,5 Гц), 7,71-7,73 (2Н, м), 8,41 (1Н, ушир.с).
ИК (KBr) см-1: 3435, 1660, 1610, 1526, 1440, 1291.
Пример 22
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метан-сульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде бледно-коричневого масла (выход: 83,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,43-0,58 (4Н, м), 1,35-1,46 (1Н, м), 2,71 (4Н, т, J=4,9 Гц), 3,67 (4Н, т, J=4,9 Гц), 3,71 (2Н, с), 3,85 (2Н, ушир.), 3,94 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,51-7,56 (1Н, м), 7,61 (1Н, дд, J=2,2, 12,4 Гц), 7,73 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 3616, 3476, 3275, 1648, 1601, 1529.
Mass m/z: 391 (M+).
Пример 23
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (выход: 75,9%).
Температура плавления: 175,2-176,8°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,42-0,55 (4Н, м), 1,28-1,39 (1Н, м), 3,36 (4Н, ушир.), 3,82 (4Н, ушир.), 3,92 (3Н, с), 4,06 (2Н, д, J=7,3 Гц), 4,49 (2Н, ушир.с), 7,33 (1Н, дд, J=8,5, 8,5 Гц), 7,71-7,79 (2Н, м), 8,47 (1Н, ушир.с).
ИК (KBr) см-1: 3162, 1652, 1604, 1531.
Пример 24
Получение 4-аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
1) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-фталимидометил-2H-пиридазин-3-она
К раствору 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она (220 мг, 0,57 ммоль) в N,N-диметилформамиде (5 мл) добавляли фталимид калия (160 мг, 0,87 ммоль) и смесь перемешивали при 80°С в течение 2 час. К реакционной смеси добавляли воду (30 мл). После перемешивания при охлаждении над водой со льдом осажденные кристаллы отфильтровывали, сушили на воздухе и перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (202 мг, 81,0%).
Температура плавления: 241,7-243,6°С
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,59 (4Н, м), 1,37-1,47 (1Н, м), 3,90 (3Н, с), 4,10 (2Н, д, J=7,1 Гц), 4,91 (2Н, д, J=1,2 Гц), 6,95 (1Н, дд, J=8,5, 8,5 Гц), 7,29 (1Н, т, J=1,2 Гц), 7,38 (1Н, ддд, J=1,2, 2,2, 8,5 Гц), 7,48 (1Н, дд, J=2,2, 12,4 Гц), 7,76-7,81 (2Н, м), 7,90-7,95 (2Н, м).
ИК (KBr) см-1: 1712, 1653, 1614, 1524.
Mass m/z: 433 (M+).
2) Получение 4-аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
К раствору 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-фталимидометил-2H-пиридазин-3-она (190 мг, 0,43 ммоль) в метаноле (5 мл) добавляли моногидрат гидразина (110 мг, 2,20 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 2 час. Метанол отгоняли и к остатку добавляли хлороформ (20 мл). Смесь последовательно промывали водой (10 мл) и насыщенным солевым раствором (10 мл) в указанном порядке, и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией на силикагеле [проявляющий растворитель: хлороформ/10% мас./об. раствор метанола в аммиаке (20/1)] с получением указанного в заголовке соединения в виде желтых кристаллов (130 мг, 97,8 %).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,59 (4Н, м), 1,37-1,47 (1Н, м), 1,51 (2Н, ушир.), 3,89 (2Н, д, J=1,2 Гц), 3,95 (3Н, с), 4,11 (2Н, д, J=7,1 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,53 (1Н, ддд, J=1,2, 2,4, 8,5 Гц), 7,63 (1Н, дд, J=2,2, 12,7 Гц), 7,68 (1Н, с).
ИК (KBr) см-1: 3393, 1651, 1606, 1523, 1438, 1293.
Mass m/z: 303 (M+).
Пример 25
Получение гидрохлорида 4-аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (81,0%).
Температура плавления: 188,2-194,2°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,42-0,55 (4Н, м), 1,29-1,39 (1Н, м), 3,92 (3Н, с), 4,01 (2Н, с), 4,06 (2Н, д, J=7,1 Гц), 7,34 (1Н, дд, J=8,5, 8,5 Гц ), 7,71-7,78 (2Н, м), 8,31 (1Н, с).
ИК (KBr)см-1: 3507, 3440, 1644, 1581, 1522, 1438.
Пример 26
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 94,3%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 1,46 (9Н, с), 2,27-2,40 (1Н, м), 2,52 (4Н, т, J=5,2 Гц), 3,50 (4Н, т, J=5,2 Гц), 3,57 (2Н, с), 3,95 (3Н, с), 4,06 (2Н, д, J=7,4 Гц), 7,03 (1Н, дд, J=8,6, 8,6 Гц), 7,51 (1Н, дд, J=1,2, 8,4 Гц), 7,60 (1Н, дд, J=2,2, 12,5 Гц), 7,75 (1Н, с).
Пример 27
Получение дигидрохлорида 6-(3-фтор-4-метоксифенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 58,5%).
Температура плавления: 163,0-177,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,22-2,33 (1Н, м), 3,17 (4Н, ушир.), 3,33 (4Н, т, J=5,3 Гц), 3,92 (3Н, с), 3,96 (2Н, с), 4,01 (2Н, д, J=7,1 Гц), 7,27 (1Н, дд, J=8,9, 8,9 Гц), 7,67-7,72 (2Н, м), 8,22 (1Н, с).
ИК (KBr) см-1: 1656, 1608, 1522, 1440, 1291, 1113.
Mass m/z: 374 (M+)
Пример 28
Получение 6-(3-фтор-4-метоксифенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 80,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,28-2,40 (1Н, м), 2,34 (3Н, с), 2,55 (4Н, ушир.), 2,63 (4Н, ушир.), 3,58 (2Н, д, J=1,4 Гц), 3,95 (3Н, с), 4,06 (2Н, д, J=7,4 Гц), 7,04 (1Н, дд, J=8,6, 8,6 Гц), 7,53 (1Н, дд, J=1,2, 8,6 Гц), 7,61 (1Н, дд, J=2,2, 12,5 Гц), 7,73 (1Н, с).
Пример 29
Получение дигидрохлорида 6-(3-фтор-4-метоксифенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 73,3%).
Температура плавления: 236,9-237,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,21-2,32 (1Н, м), 2,77 (3Н, с), 3,14 (4Н, ушир.), 3,36 (4Н, ушир.), 3,87 (2Н, с), 3,91 (3Н, с), 4,00 (2Н, д, J=7,1 Гц), 7,26 (1Н, дд, J=8,5, 8,5 Гц), 7,66-7,71 (2Н, м), 8,12 (1Н, с).
ИК (KBr) см-1: 1655, 1606, 1524, 1440, 1291, 1113, 1022.
Mass m/z: 388 (M+)
Пример 30
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 87,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,96 (6Н, д, J=6,8 Гц), 2,27-2,39 (1Н, м), 2,71 (4Н, т, J=5,0 Гц), 3,67 (4Н, т, J=5,0 Гц), 3,70 (2Н, с), 3,93 (3Н, с), 4,07 (2Н, д, J=7,4 Гц), 7,01 (1Н, дд, J=8,6, 8,6 Гц), 7,53 (1Н, дд, J=1,4, 8,4 Гц), 7,61 (1Н, дд, J=2,2, 12,5 Гц), 7,72 (1Н, с).
Пример 31
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных хлопьев (выход: 89,0%).
Температура плавления: 129,8-133,1°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,23-2,34 (1Н, м), 3,34 (4Н, т, J=5,1 Гц), 3,83 (4Н, т, J=5,2 Гц), 3,92 (3Н, с), 4,03 (2Н, д, J=7,0 Гц), 4,44 (2Н, с), 7,29 (1Н, дд, J=8,7, 8,7 Гц), 7,69-7,75 (2Н, м), 8,46 (1Н, с).
ИК (KBr) см-1: 1652, 1601, 1525, 1440, 1277.
Mass m/z: 362 (M+-CH2OH)
Пример 32
Получение 4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-3-(фтор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 88,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,30-2,40 (1Н, м), 2,36 (6Н, с), 3,50 (2Н, с), 3,93 (3Н, с), 4,07 (2Н, д, J=7,2 Гц), 7,02 (1Н, дд, J=8,6, 8,6 Гц), 7,55 (1Н, д, J=8,6 Гц), 7,63 (1Н, дд, J=2,1, 12,5 Гц), 7,75 (1Н, с).
Пример 33
Получение гидрохлорида 4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 81,0%).
Температура плавления: 212,4-212,8°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,23-2,33 (1Н, м), 2,81 (6Н, с), 3,92 (3Н, с), 4,04 (2Н, s, J=7,1 Гц), 4,27 (2Н, с), 7,29 (1Н, дд, J=8,1, 8,1 Гц), 7,70-7,75 (2Н, м), 8,51 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1522, 1439, 1292, 1112.
Mass m/z: 333 (M+)
Пример 34
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-фенил-2H-пиридазин-3-она
1) Получение 4-метоксикарбонил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(5), подвергали взаимодействию 4-карбокси-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых кристаллов (выход: 98,9%).
Температура плавления: 202,5-206,2°С
1H ЯМР (400 МГц, CDCl3) δ: 4,01 (3Н, с), 7,45-7,54 (3Н, м), 7,78-7,85 (2Н, м), 8,38 (1Н, с), 11,86 (1Н, ушир.).
ИК (KBr) см-1: 1717, 1670, 1443, 1259.
Mass m/z: 230 (M+).
2) Получение 2-изобутил-4-метоксикарбонил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 4-метоксикарбонил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 94,1%).
1H ЯМР (400 МГц, CDCl3) δ: 1,00 (6Н, д, J=6,6 Гц), 2,33-2,44 (1Н, м), 3,98 (3Н, с), 4,14 (2Н, д, J=7,4 Гц), 7,42-7,51 (3Н, м), 7,79-7,83 (2Н, м), 8,27 (1Н, с).
3) Получение 4-карбокси-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-изобутил-4-метоксикарбонил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 82,5%).
Температура плавления: 120,5-121,0°С
1H ЯМР (400 МГц, CDCl3) δ: 1,03 (6Н, д, J=6,6 Гц), 2,34-2,45 (1Н, м), 4,23 (2Н, д, J=7,4 Гц), 7,49-7,54 (3Н, м), 7,84-7,89 (2Н, м), 8,69 (1Н, с), 14,20 (1Н, с).
ИК (KBr) см-1: 3448, 2956, 1741, 1636, 1418, 1116.
Mass m/z: 272 (M+)
4) Получение 4-гидроксиметил-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-изобутил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 22,3%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 3,67 (1Н, ушир.), 4,08 (2Н, д, J=7,4 Гц), 4,72 (2Н, д, J=3,9 Гц), 7,39-7,49 (3Н, м), 7,76 (1Н, т, J=1,4 Гц), 7,79-7,84 (2Н, м).
5) Получение 2-изобутил-4-метансульфонилоксиметил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 4-гидроксиметил-2-изобутил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 68,4%).
Температура плавления: 129,7°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,30-2,41 (1Н, м), 3,17 (3Н, с), 4,10 (2Н, д, J=7,2 Гц), 5,28 (2Н, д, J=1,2 Гц), 7,43-7,52 (3Н, м), 7,79-7,82 (3Н, м).
ИК (KBr) см-1: 3442, 2963, 1658, 1611, 1355, 1165, 872.
Mass m/z: 336 (M+)
6) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(10), 2-изобутил-4-метансульфонилокси-6-фенил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат подвергали взаимодействию в N,N-диметилформамиде, используемом в качестве растворителя, с получением указанного в заголовке соединения в виде желтого масла (выход: 83,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 1,47 (9Н, с), 2,53 (4Н, т, J=4,9 Гц), 3,50 (4Н, т, J=4,9 Гц), 3,59 (2Н, д, J=1,0 Гц), 4,09 (2Н, д, J=7,2 Гц), 7,40-7,50 (3Н, м), 7,80-7,84 (3Н, м).
Пример 35
Получение дигидрохлорида 2-изобутил-6-фенил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 67,9%).
Температура плавления: 154,3-159,5°С
1H ЯМР (400 МГц, CDCl3) δ: 0,94 (6Н, д, J=6,8 Гц), 2,20-2,32 (1Н, м), 2,86 (4Н, ушир.), 3,21 (4Н, ушир.), 3,71 (2Н, с), 4,01 (2Н, д, J=7,2 Гц), 7,42-7,53 (3Н, м), 7,84-7,89 (2Н, м), 7,96 (1Н, с).
ИК (KBr) см-1: 1656, 1610, 1445, 694.
Mass m/z: 326 (M+)
Пример 36
Получение 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-фенил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 77,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,40 (1Н, м), 2,34 (3Н, с), 2,55 (4Н, ушир.), 2,64 (4Н, ушир.), 3,59 (2Н, д, J=1,4 Гц), 4,08 (2Н, д, J=7,2 Гц), 7,40-7,50 (3Н, м), 7,78-7,84 (3Н, м).
Пример 37
Получение дигидрохлорида 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 66,3%).
Температура плавления: 243,8-244,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,22-2,34 (1Н, м), 2,76 (3Н, с), 3,01 (4Н, ушир.), 3,30 (4Н, ушир.), 3,77 (2Н, с), 4,02 (2Н, д, J=7,2 Гц), 7,43-7,53 (3Н, м), 7,85-7,89 (2Н, м), 8,02 (1Н, с).
ИК (KBr) см-1: 2960, 1653, 1610, 1446.
Mass m/z: 340 (M+)
Пример 38
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-фенил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 38,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 2,79 (4Н, ушир.), 3,70 (4Н, ушир.), 3,80 (2Н, с), 4,09 (2Н, д, J=7,4 Гц), 7,39-7,48 (3Н, м), 7,81-7,87 (3Н, м).
Пример 39
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных хлопьев (выход: 68,4%).
Температура плавления: 131,6-132,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,6 Гц), 2,25-2,35 (1Н, м), 3,35 (4Н, т, J=5,1 Гц), 3,84 (4Н, т, J=5,4 Гц), 4,06 (2Н, д, J=7,1 Гц), 4,47 (2Н, с), 7,45-7,54 (3Н, м), 7,90-7,94 (2Н, м), 8,48 (1Н, с).
ИК (KBr) см-1: 1655, 1610, 1421, 1053.
Mass m/z: 314 (M+-CH2OH)
Пример 40
Получение 4-диметиламинометил-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-фенил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 81,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,32-2,41 (1Н, м), 2,35 (6Н, с), 3,51 (2Н, д, J=1,2 Гц), 4,09 (2Н, д, J=7,2 Гц), 7,38-7,48 (3Н, м), 7,80-7,87 (3Н, м).
Пример 41
Получение гидрохлорида 4-диметиламинометил-2-изобутил-6-фенил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-2-изобутил-6-фенил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых хлопьев (выход: 71,5%).
Температура плавления: 221,7-222,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,8 Гц), 2,24-2,35 (1Н, м), 2,82 (6Н, с), 4,06 (2Н, д, J=7,1 Гц), 4,29 (2Н, с), 7,44-7,54 (3Н, м), 7,90-7,94 (2Н, м), 8,54 (1Н, с).
ИК (KBr) см-1: 1648, 1610, 1460, 1052.
Mass m/z: 285 (M+)
Пример 42
Получение 4-(4-бензил-1-пиперазинил)метил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
1) Получение 2-изобутил-4-метоксикарбонил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 4-метоксикарбонил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 91,6%).
Температура плавления: 67,0-70,1°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,32-2,43 (1Н, м), 2,41 (3Н, с), 3,98 (3Н, с), 4,13 (2Н, д, J=7,3 Гц), 7,28 (2Н, д, J=8,3 Гц), 7,70 (2Н, д, J=8,3 Гц), 8,24 (1Н, с).
ИК (KBr) см-1: 1718, 1663, 1605.
Mass m/z: 300 (M+).
2) Получение 4-карбокси-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-изобутил-4-метоксикарбонил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 86,7%).
Температура плавления: 162,1-165,4°С
1H ЯМР (400 МГц, CDCl3) δ: 1,02 (6Н, д, J=6,8 Гц), 2,34-2,44 (1Н, м), 2,47 (3Н, с), 4,21 (2Н, д, J=7,3 Гц), 7,31 (2Н, д, J=8,3 Гц), 7,75 (2Н, д, J=8,3 Гц), 8,66 (1Н, с), 14,26 (1Н, с).
ИК (KBr) см-1: 1740, 1633, 1571, 1425.
Mass m/z: 286 (M+).
3) Получение 4-гидроксиметил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 46,0%).
Температура плавления: 121,9-123,5°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,40 (1Н, м), 2,40 (3Н, с), 3,22 (1Н, ушир.), 4,08 (2Н, д, J=7,3 Гц), 4,71 (2Н, с), 7,27 (2Н, д, J=8,3 Гц), 7,77 (1Н, с), 7,70 (2Н, д, J=8,3 Гц).
ИК (KBr) см-1: 3334, 1645, 1596, 1522.
Mass m/z: 272 (M+).
4) Получение 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 4-гидроксиметил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 87,4%).
Температура плавления: 132,0-135,5°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,39 (1Н, м), 2,41 (3Н, с), 3,17 (3Н, с), 4,08 (2Н, д, J=7,6 Гц), 5,27 (2Н, т, J=1,5 Гц), 7,27 (2Н, д, J=8,3 Гц), 7,72 (2Н, д, J=8,3 Гц), 7,79 (1Н, т, J=1,5 Гц).
ИК (KBr) см-1: 1656, 1609, 1355, 1166.
Mass m/z: 350 (M+).
5) Получение 4-(4-бензил-1-пиперазинил)метил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и 1-бензилпиперазин с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 97,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,8 Гц), 2,29-2,39 (1Н, м), 2,41 (3Н, с), 2,55 (4Н, ушир.), 2,61 (4Н, ушир.), 3,54 (2Н, с), 3,57 (2Н, д, J=1,5 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,22-7,36 (7Н, м), 7,70 (2Н, д, J=8,3 Гц), 7,77 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1657, 1652, 1518, 1455.
Mass m/z: 430 (M+).
Пример 43
Получение дигидрохлорида 4-(4-бензил-1-пиперазинил)метил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-(4-бензил-1-пиперазинил)метил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 91,8%).
Температура плавления: 253,5-260,1°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,92 (6Н, д, J=6,6 Гц), 2,18-2,28 (1Н, м), 2,34 (3Н, с), 3,43 (10Н, ушир.), 3,99 (2Н, д, J=7,3 Гц), 4,36 (2Н, ушир.с), 7,22 (2Н, д, J=8,1 Гц), 7,43-7,49 (3Н, м), 7,58-7,65 (2Н, м), 7,78 (2Н, д, J=8,1 Гц), 8,30 (1Н, ушир.с).
ИК (KBr) см-1: 1660, 1617, 1452.
Пример 44
Получение 4-диметиламинометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 96,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,38-2,41 (1Н, м), 2,35 (6Н, с), 2,40 (3Н, с), 3,50 (2Н, д, J=1,5 Гц), 4,08 (2Н, д, J=7,3 Гц), 7,26 (2Н, д, J=8,1 Гц), 7,73 (2Н, д, J=8,1 Гц), 7,78 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1652, 1609, 1518, 1455.
Mass m/z: 299 (M+).
Пример 45
Получение гидрохлорида 4-диметиламинометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 91,8%).
Температура плавления: 237,6-239,6°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,19-2,30 (1Н, м), 2,37 (3Н, с), 2,81 (6Н, с), 4,02 (2Н, д, J=7,0 Гц), 4,30 (2Н, с), 7,34 (2Н, д, J=8,1 Гц), 7,81 (2Н, д, J=8,1 Гц), 8,46 (1Н, с).
ИК (KBr) см-1: 1648, 1605, 1460, 1421.
Пример 46
Получение 4-диэтиламинометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и диэтиламин с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 95,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,07 (6Н, т, J=7,1 Гц), 2,30-2,42 (1Н, м), 2,40 (3Н, с), 2,60 (4Н, кв., J=7,1 Гц), 3,60 (2Н, д, J=1,5 Гц), 4,08 (2Н, д, J=7,3 Гц), 7,26 (2Н, д, J=8,1 Гц), 7,73 (2Н, д, J=8,1 Гц), 7,89 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1652, 1609, 1518, 1465, 1455.
Mass m/z: 327 (M+).
Пример 47
Получение гидрохлорида 4-диэтиламинометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диэтиламинометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 93,8%).
Температура плавления: 203,9-207,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 1,27 (6Н, т, J=7,2 Гц), 2,20-2,30 (1Н, м), 2,37 (3Н, с), 3,09-3,24 (4Н, м), 4,03 (2Н, д, J=7,1 Гц), 4,28 (2Н, д, J=5,4 Гц), 7,34 (2Н, д, J=8,1 Гц), 7,82 (2Н, д, J=8,1 Гц), 8,55 (1Н, с).
ИК (KBr) см-1: 1652, 1610, 1523, 1481, 1468.
Пример 48
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 95,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,6 Гц), 2,28-2,41 (1Н, м), 2,40 (3Н, с), 2,71 (4Н, т, J=5,0 Гц), 3,66 (4Н, т, J=5,0 Гц), 3,70 (2Н, с), 3,78 (2Н, ушир.), 4,09 (2Н, д, J=7,6 Гц), 7,26 (2Н, д, J=8,1 Гц), 7,68 (1Н, с), 7,70 (2Н, д, J=8,1 Гц).
ИК (Чистый) см-1: 3392, 1645, 1600, 1520.
Mass m/z: 341 (M+-H2O).
Пример 49
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 86,4%).
Температура плавления: 158,9-161,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,19-2,30 (1Н, м), 2,37 (3Н, с), 3,27-3,46 (4Н, м), 3,77-3,85 (4Н, м), 4,02 (2Н, д, J=7,3 Гц), 4,50 (2Н, ушир.с), 5,35 (2Н, ушир.), 7,34 (2Н, д, J=8,1 Гц), 7,81 (2Н, д, J=8,1 Гц), 8,46 (1Н, с).
ИК (KBr) см-1: 3292, 1664, 1615, 1423.
Пример 50
Получение 4-аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
1) Получение 2-изобутил-6-(4-метилфенил)-4-фталимидометил-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 98,2%).
Температура плавления: 221,6-223,8°С
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,27-2,41 (1Н, м), 2,36 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 4,91 (2Н, д, J=1,5 Гц), 7,20 (2Н, д, J=8,1 Гц), 7,32 (1Н, т, J=1,5 Гц), 7,56 (2Н, д, J=8,1 Гц), 7,75-7,80 (2Н, м), 7,89-7,94 (2Н, м).
ИК (KBr) см-1: 1767, 1721, 1655, 1616.
Mass m/z: 401 (M+).
2) Получение 4-аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 24 (2), подвергали взаимодействию 2-изобутил-6-(4-метилфенил)-4-фталимидометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных призматических кристаллов (выход: 98,1%).
Температура плавления: 74,9-77,9°С
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,9 Гц), 1,68 (2Н, ушир.), 2,28-2,42 (1Н, м), 2,40 (3Н, с), 3,87 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,26 (2Н, д, J=8,0 Гц), 7,69 (1Н, т, J=1,5 Гц), 7,71 (2Н, д, J=8,0 Гц).
ИК (KBr) см-1: 3363, 3289, 1648, 1604, 1519.
Mass m/z: 271 (M+).
Пример 51
Получение гидрохлорида 4-аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (выход: 93,1%).
Температура плавления: 207,4-209,4°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,6 Гц), 2,19-2,30 (1Н, м), 2,37 (3Н, с), 4,01 (2Н, д, J=7,1 Гц), 4,02 (2Н, с), 7,34 (2Н, д, J=8,1 Гц), 7,80 (2Н, д, J=8,1 Гц), 8,26 (1Н, с).
ИК (KBr) см-1: 1655, 1616, 1520, 1467.
Пример 52
Получение 4-(1,3-дигидроксипропан-2-ил)аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и 2-амино-1,3-пропандиол с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 83,7%).
Температура плавления: 134,1-135,2°С
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,6 Гц), 2,29-2,39 (1Н, м), 2,40 (3Н, с), 2,60 (3Н, ушир.), 2,82-2,87 (1Н, м), 3,64 (2Н, дд, J=5,6, 11,2 Гц), 3,80 (2Н, дд, J=4,5, 11,2 Гц), 3,86 (2Н, д, J=1,0 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,26 (2Н, д, J=8,1 Гц), 7,71 (2Н, д, J=8,1 Гц), 7,74 (1Н, с).
ИК (KBr) см-1: 3408, 3293, 1641, 1592, 1520.
Mass m/z: 345 (M+).
Пример 53
Получение гидрохлорида 4-(1,3-дигидроксипропан-2-ил)аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N-(1,3-дигидроксипропан-2-ил)аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 95,7%).
Температура плавления: 191,2-193,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,6 Гц), 2,19-2,30 (1Н, м), 2,37 (3Н, с), 3,29 (1Н, ушир.), 3,60-3,78 (4Н, м), 4,02 (2Н, д, J=7,1 Гц), 4,29 (2Н, с), 5,40 (2Н, ушир.с), 7,34 (2Н, д, J=8,1 Гц), 7,81 (2Н, д, J=8,1 Гц), 8,38 (1Н, с).
ИК (KBr) см-1: 3392, 1652, 1610.
Пример 54
Получение 2-изобутил-4-метиламинометил-6-(4-метилфенил)-2-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и метиламин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 94,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 1,87 (1Н, ушир.), 2,29-2,42 (1Н, м), 2,40 (3Н, с), 2,50 (3Н, с), 3,76 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,26 (2Н, д, J=8,1 Гц), 7,67 (1Н, т, J=1,2 Гц), 7,71 (2Н, д, J=8,1 Гц).
ИК (Чистый) см-1: 3317, 1652, 1607.
Mass m/z: 285 (M+).
Пример 55
Получение гидрохлорида 2-изобутил-4-метиламинометил-6-(4-метилфенил)-2-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-4-метиламинометил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 97,5%).
Температура плавления: 198,3-201,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,20-2,31 (1Н, м), 2,37 (3Н, с), 2,65 (3Н, с), 4,02 (2Н, д, J=7,3 Гц), 4,12 (2Н, с), 7,34 (2Н, д, J=8,1 Гц), 7,80 (2Н, д, J=8,1 Гц), 8,35 (1Н, с).
ИК (KBr) см-1: 3085, 1652, 1612.
Пример 56
Получение 4-(2-гидроксиэтил)аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-метилфенил)-2H-пиридазин-3-он и 2-аминоэтанол с получением указанного в заголовке соединения в виде желтоватого масла (выход: 80,3%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,20-2,38 (3Н, м), 2,39 (3Н, с), 2,84 (2Н, т, J=5,1 Гц), 3,72 (2Н, т, J=5,1 Гц), 3,82 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,26 (2Н, д, J=8,1 Гц), 7,68 (1Н, с), 7,70 (2Н, д, J=8,1 Гц).
ИК (Чистый) см-1: 3429, 1652, 1601, 1519.
Mass m/z: 315 (M+).
Пример 57
Получение гидрохлорида 4-(2-гидроксиэтил)аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N-(2-гидроксиэтил)аминометил-2-изобутил-6-(4-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 93,4%).
Температура плавления: 190,8-191,9°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,20-2,31 (1Н, м), 2,37 (3Н, с), 3,12 (2Н, т, J=5,4 Гц), 3,70-3,76 (2Н, м), 4,02 (2Н, д, J=7,3 Гц), 4,18 (2Н, с), 5,30 (1Н, ушир.), 7,34 (2Н, д, J=8,3 Гц), 7,81 (2Н, д, J=8,3 Гц), 8,36 (1Н, с).
ИК (KBr) см-1: 3491, 1652, 1611.
Пример 58
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
1) Получение этил 2-этоксикарбонил-2-гидрокси-4-(4-трифторметилфенил)-4-оксобутаноата
Следуя методике примера 1(3), подвергали взаимодействию 4'-(трифторметил)ацетофенон с получением указанного в заголовке соединения в виде бледно-желтых кристаллов (выход: 80,8%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30 (6Н, т, J=7,1 Гц), 3,85 (2Н, с), 4,22 (1Н, с), 4,31 (4Н, кв., J=7,1 Гц), 7,76 (2Н, д, J=8,6 Гц), 8,07 (2Н, д, J=8,6 Гц).
ИК (KBr) см-1: 3446, 1750, 1727, 1691.
Mass m/z: 343 (M+-H2O).
2) Получение 4-карбокси-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(4), подвергали взаимодействию этил 2-этоксикарбонил-2-гидрокси-4-(4-трифторметилфенил)-4-оксобутаноат с получением указанного в заголовке соединения в виде бледно-коричневого кристаллического порошка (выход: 91,4%).
3) Получение 4-метоксикарбонил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(5), подвергали взаимодействию 4-карбокси-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 88,5%).
1H ЯМР (400 МГц, CDCl3) δ: 4,02 (3Н, с), 7,75 (2Н, д, J=8,2 Гц), 7,95 (2Н, д, J=8,2 Гц), 8,39 (1Н, с), 11,69 (1Н, ушир.).
ИК (KBr) см-1: 3218, 3140, 3097, 1720, 1678, 1326.
Mass m/z: 298 (M+).
4) Получение 2-изобутил-4-метоксикарбонил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 4-метоксикарбонил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтых кристаллов (выход: 82,2%).
1H ЯМР (400 МГц, CDCl3) δ: 1,00 (6Н, д, J=6,6 Гц), 2,32-2,43 (1Н, м), 3,99 (3Н, с), 4,15 (2Н, д, J=7,2 Гц), 7,74 (2Н, д, J=8,4 Гц), 7,93 (2Н, д, J=8,4 Гц), 8,12 (1Н, с).
ИК (Чистый) см-1: 2961, 1746, 1670, 1327, 1115, 1068.
Mass m/z: 354 (M+).
5) Получение 4-карбокси-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-изобутил-4-метоксикарбонил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 91,6%).
Температура плавления: 184,4-185,0°С
1H ЯМР (400 МГц, CDCl3) δ: 1,03 (6Н, д, J=6,6 Гц), 2,34-2,45 (1Н, м), 4,25 (2Н, д, J=7,2 Гц), 7,78 (2Н, д, J=8,2 Гц), 7,99 (2Н, д, J=8,2 Гц), 8,70 (1Н, с), 14,02 (1Н, с).
ИК (KBr) см-1: 3447, 1739, 1631, 1570, 1330, 1174, 1114, 1070, 847.
Mass m/z: 340 (M+)
6) Получение 4-гидроксиметил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 28,1%).
Температура плавления: 145,8-146,5°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,41 (1Н, м), 2,96 (1Н, т, J=5,9 Гц), 4,11 (2Н, д, J=7,4 Гц), 4,74 (2Н, дд, J=1,4, 5,8 Гц), 7,70-7,74 (3Н, м), 7,94 (2Н, д, J=8,2 Гц).
ИК (KBr) см-1: 3339, 1646, 1596, 1328, 1131, 1070, 848.
7) Получение 2-изобутил-4-метансульфонилоксиметил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 4-гидроксиметил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 89,9%).
Температура плавления: 122,9-123,8°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 3,18 (3Н, с), 4,11 (2Н, д, J=7,2 Гц), 5,29 (2Н, д, J=1,4 Гц), 7,73 (2Н, д, J=8,2 Гц), 7,83 (1Н, т, J=1,4 Гц), 7,93 (2Н, д, J=8,2 Гц).
ИК (KBr) см-1: 3447, 1659, 1613, 1359, 1329, 1169, 1123, 1071, 846.
Mass m/z: 404 (M+)
8) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-трифторметилфенил)-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 83,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 1,47 (9Н, с), 2,29-2,41 (1Н, м), 2,53 (4Н, т, J=4,9 Гц), 3,51 (4Н, т, J=4,8 Гц), 3,60 (2Н, с), 4,10 (2Н, д, J=7,4 Гц), 7,72 (2Н, д, J=8,2 Гц), 7,84 (1Н, с), 7,94 (2Н, д, J=8,2 Гц).
Пример 59
Получение дигидрохлорида 2-изобутил-4-(1-пиперазинил)метил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 95,0%).
Температура плавления: 210,8-212,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,6 Гц), 2,22-2,35 (1Н, м), 3,12 (4Н, ушир.), 3,30 (4Н, т, J=5,2 Гц), 3,92 (2Н, с), 4,05 (2Н, д, J=7,1 Гц), 7,84 (2Н, д, J=8,3 Гц), 8,11 (2Н, д, J=8,1 Гц), 8,25 (1Н, с).
ИК (KBr) см-1: 1656, 1608, 1328, 1125, 1069.
Mass m/z: 394 (M+)
Пример 60
Получение 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-трифторметилфенил)-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 81,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,30-2,41 (1Н, м), 2,33 (3Н, с), 2,53 (4Н, ушир.), 2,63 (4Н, ушир.), 3,60 (2Н, с), 4,10 (2Н, д, J=7,2 Гц), 7,72 (2Н, д, J=8,2 Гц), 7,83 (1Н, с), 7,94 (2Н, д, J=8,2 Гц).
Пример 61
Получение дигидрохлорида 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных хлопьев (выход: 88,6%).
Температура плавления: 249,9-252,8°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,22-2,35 (1Н, м), 2,77 (3Н, с), 3,14 (4Н, ушир.), 3,35 (4Н, ушир.), 3,88 (2Н, с), 4,05 (2Н, д, J=7,2 Гц), 7,84 (2Н, д, J=8,2 Гц), 8,10 (2Н, д, J=8,0 Гц), 8,19 (1Н, с).
ИК (KBr) см-1: 2966, 1653, 1610, 1328, 1125, 1069.
Mass m/z: 408 (M+)
Пример 62
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-трифторметилфенил)-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 79,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 2,72 (4Н, ушир.), 3,67 (4Н, т, J=4,2 Гц), 3,72 (2Н, с), 4,10 (2Н, д, J=7,4 Гц), 7,70 (2Н, д, J=7,6 Гц), 7,82 (1Н, с), 7,94 (2Н, д, J=8,2 Гц).
Пример 63
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 58,2%).
Температура плавления: 134,9-135,4°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,97 (6Н, д, J=6,6 Гц), 2,25-2,36 (1Н, м), 3,34 (4Н, ушир.), 3,83 (4Н, т, J=5,1 Гц), 4,07 (2Н, д, J=7,0 Гц), 4,46 (2Н, с), 7,86 (2Н, д, J=8,2 Гц), 8,13 (2Н, д, J=8,2 Гц), 8,55 (1Н, с).
ИК (KBr) см-1: 1653, 1605, 1319, 1125, 1069.
Mass m/z: 395 (M+-H2O)
Пример 64
Получение 4-диметиламинометил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 80,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,31-2,40 (1Н, м), 2,36 (6Н, с), 3,51 (2Н, д, J=1,2 Гц), 4,10 (2Н, д, J=7,4 Гц), 7,71 (2Н, д, J=8,4 Гц), 7,83 (1Н, т, J=1,4 Гц), 7,97 (2Н, д, J=8,2 Гц).
Пример 65
Получение гидрохлорида 4-диметиламинометил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-2-изобутил-6-(4-трифторметилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых хлопьев (выход: 93,0%).
Температура плавления: 242,2-242,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,97 (6Н, д, J=6,6 Гц), 2,25-2,36 (1Н, м), 2,83 (6Н, с), 4,07 (2Н, д, J=7,3 Гц), 4,30 (2Н, с), 7,86 (2Н, д, J=8,3 Гц), 8,14 (2Н, д, J=8,0 Гц), 8,61 (1Н, с).
ИК (KBr) см-1: 2963, 1646, 1606, 1321, 1115, 1069.
Mass m/z: 353 (M+)
Пример 66
Получение 6-(4-бифенилил)-4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-2H-пиридазин-3-она
1) Получение этил 4-(4-бифенилил)-2-этоксикарбонил-2-гидрокси-4-оксобутаноата
Следуя методике примера 1(3), подвергали взаимодействию 4-ацетилбифенил с получением указанного в заголовке соединения в виде бесцветных хлопьев (выход: 83,3%).
Температура плавления: 88,0-88,3°С
1H ЯМР (400 МГц, CDCl3) δ: 1,31 (6Н, т, J=7,1 Гц), 3,87 (2Н, с), 4,32 (4Н, кв.,7,1 Гц), 7,41 (1Н, тт, J=1,4,7,2 Гц), 7,48 (2Н, дд, J=7,2, 7,2 Гц), 7,63 (2Н, д, J=7,0 Гц), 7,70 (2Н, д, J=8,6 Гц), 8,04 (2Н, д, J=8,6 Гц).
ИК (KBr) см-1: 3449, 1736, 1680, 1604, 1301, 1244, 1204, 763.
2) Получение 6-(4-бифенилил)-4-карбокси-2H-пиридазин-3-она
Следуя методике примера 1(4), подвергали взаимодействию этил 4-(4-бифенилил)-2-этоксикарбонил-2-гидрокси-4-оксобутаноат с получением указанного в заголовке соединения в виде желтого кристаллического порошка (выход: 90,2%).
Температура плавления: 299,7-300,8°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 7,40 (1Н, т, J=7,4 Гц), 7,49 (2Н, дд, J=7,4, 7,4 Гц), 7,74 (2Н, д, J=7,2 Гц), 7,82 (2Н, д, J=8,4 Гц), 8,03 (2Н, д, J=8,4 Гц), 8,54 (1Н, с).
ИК (KBr) см-1: 1753, 1652, 1590, 1446, 1201, 768.
3) Получение 6-(4-бифенилил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(5), подвергали взаимодействию 6-(4-бифенилил)-4-карбокси-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 90,4%).
Температура плавления: 277,0-277,9°С (разл.)
1H ЯМР (400 МГц, CDCl3) δ: 4,01 (3Н, с), 7,39-7,45 (3Н, м), 7,64 (2Н, д, J=7,2 Гц), 7,72 (2Н, д, J=8,2 Гц), 7,89 (2Н, д, J=8,0 Гц), 8,42 (1Н, с), 10,7 (1Н, с).
ИК (KBr) см-1: 2954, 1727, 1671, 1594, 1265, 1098, 768.
4) Получение 6-(4-бифенилил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(4-бифенилил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтых кристаллов (выход: 62,7%).
Температура плавления: 186,2-195,0°С
1H-ЯМР (400 МГц,CDCl3) δ: 1,01 (6Н, д, J=6,8 Гц), 2,34-2,45 (1Н, м), 3,99 (3Н, с), 4,16 (2Н, д, J=7,4 Гц), 7,39 (1Н, тт, J=1,4,7,4 Гц), 7,48 (2Н, дд, J=7,2, 7,2 Гц), 7,64 (2Н, д, J=7,0 Гц), 7,71 (2Н, д, J=8,6 Гц), 7,89 (2Н, д, J=8,6 Гц), 8,31 (1Н, с).
5) Получение 6-(4-бифенилил)-4-карбокси-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 6-(4-бифенилил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 79,2%).
Температура плавления: 156,9-157,6°С
1H ЯМР (400 МГц, CDCl3) δ: 1,04 (6Н, д, J=6,6 Гц), 2,36-2,46 (1Н, м), 4,24 (2Н, д, J=7,4 Гц), 7,41 (1Н, т, J=7,4 Гц), 7,49 (2Н, дд, J=7,4, 7,4 Гц), 7,65 (2Н, д, J=7,0 Гц), 7,74 (2Н, д, J=8,4 Гц), 7,95 (2Н, д, J=8,4 Гц), 8,73 (1Н, с), 14,22 (1Н, с).
ИК (KBr) см-1: 2963, 1749, 1631, 1565, 1470, 735.
6) Получение 6-(4-бифенилил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 6-(4-бифенилил)-4-карбокси-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 15,6%).
Температура плавления: 146,4-147,5°С
1H ЯМР (400 МГц, CDCl3) δ: 1,01 (6Н, д, J=6,8 Гц), 2,32-2,43 (1Н, м), 3,13 (1Н, т, J=6,2 Гц), 4,11 (2Н, д, J=7,4 Гц), 4,74 (2Н, дд, J=1,2, 6,2 Гц), 7,39 (1Н, т, J=7,3 Гц), 7,48 (2Н, дд, J=7,4, 7,4 Гц), 7,64 (2Н, д, J=7,0 Гц), 7,70 (2Н, д, J=8,6 Гц), 7,74 (1Н, т, J=1,2 Гц), 7,90 (2Н, д, J=8,6 Гц).
ИК (KBr) см-1: 3431, 2961, 1647, 1596, 1077, 769.
7) Получение 6-(4-бифенилил)-2-изобутил-4-метан-сульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 6-(4-бифенилил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 79,3%).
Температура плавления: 121,3-122,0°С
1H ЯМР (400 МГц, CDCl3) δ: 1,01 (6Н, д, J=6,8 Гц), 2,33-2,42 (1Н, м), 3,18 (3Н, с), 4,12 (2Н, д, J=7,4 Гц), 5,30 (2Н, д, J=1,2 Гц), 7,39 (1Н, т, J=7,4 Гц), 7,48 (2Н, дд, J=7,6 Гц), 7,64 (2Н, д, J=7,4 Гц), 7,71 (2Н, д, J=8,4 Гц), 7,85-7,91 (3Н, м).
ИК (KBr) см-1: 2964, 1658, 1610, 1354, 1165, 874, 529.
8) Получение 6-(4-бифенилил)-4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-бифенилил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 87,7%).
1H ЯМР (400 МГц, CDCl3) δ: 1,00 (6Н, д, J=6,6 Гц), 1,47 (9Н, с), 2,30-2,43 (1Н, м), 2,54 (4Н, т, J=4,9 Гц), 3,51 (4Н, т, J=4,9 Гц), 3,60 (2Н, д, J=1,4 Гц), 4,10 (2Н, д, J=7,4 Гц), 7,38 (1Н, тт, J=1,4,7,2 Гц), 7,47 (2Н, дд, J=7,4, 7,4 Гц), 7,64 (2Н, д, J=7,0 Гц), 7,70 (2Н, д, J=8,6 Гц), 7,85-7,92 (3Н, м).
Пример 67
Получение дигидрохлорида 6-(4-бифенилил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 6-(4-бифенилил)-4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 51,5%).
Температура плавления: 226,8-228,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,97 (6Н, д, J=6,8 Гц), 2,25-2,36 (1Н, м), 3,19 (4Н, ушир.), 3,34 (4Н, т, J=5,1 Гц), 3,98 (2Н, с), 4,05 (2Н, д, J=7,1 Гц), 7,39 (1Н, т, J=7,3 Гц), 7,49 (2Н, дд, J=7,7, 7,7 Гц), 7,71 (2Н, д, J=7,8 Гц), 7,79 (2Н, д, J=8,3 Гц), 7,99 (2Н, д, J=8,3 Гц), 8,29 (1Н, с).
ИК (KBr) см-1: 1653, 1604, 1446, 771.
Mass m/z: 402 (M+)
Пример 68
Получение 6-(4-бифенилил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-бифенилил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 68,2%).
1H ЯМР (400 МГц, CDCl3) δ: 1,00 (6Н, д, J=6,6 Гц), 2,30-2,43 (1Н, м), 2,34 (3Н, с), 2,55 (4Н, ушир.), 2,65 (4Н, ушир.), 3,61 (2Н, д, J=1,2 Гц), 4,10 (2Н, д, J=7,2 Гц), 7,38 (1Н, т, J=7,3 Гц), 7,47 (2Н, дд, J=7,5, 7,5 Гц), 7,64 (2Н, д, J=7,2 Гц), 7,70 (2Н, д, J=8,4 Гц), 7,84 (1Н, с), 7,90 (2Н, д, J=8,4 Гц).
Пример 69
Получение дигидрохлорида 6-(4-бифенилил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-бифенилил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 69,9%).
Температура плавления: 262,2-263,6°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,97 (6Н, д, J=6,6 Гц), 2,26-2,35 (1Н, м), 2,77 (3Н, с), 3,10 (4Н, ушир.), 3,34 (4Н, ушир.), 3,85 (2Н, с), 4,04 (2Н, д, J=7,1 Гц), 7,39 (1Н, т, J=7,6 Гц), 7,49 (2Н, дд, J=8,0, 8,0 Гц), 7,71 (2Н, д, J=8,0 Гц), 7,78 (2Н, д, J=8,3 Гц), 7,89 (2Н, д, J=8,3 Гц), 8,13 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1465, 1050.
Mass m/z: 416 (M+)
Пример 70
Получение 6-(4-бифенилил)-4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-бифенилил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 62,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,30-2,43 (1Н, м), 2,73 (4Н, т, J=4,8 Гц), 3,67 (4Н, т, J=4,8 Гц), 3,73 (2Н, с), 4,12 (2Н, д, J=7,4 Гц), 7,38 (1Н, т, J=7,2 Гц), 7,47 (2Н, дд, J=7,2, 7,2 Гц), 7,63 (2Н, д, J=7,4 Гц), 7,68 (2Н, д, J=8,2 Гц), 7,79 (1Н, с), 7,89 (2Н, д, J=8,2 Гц).
Пример 71
Получение гидрохлорида 6-(4-бифенилил)-4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-бифенилил)-4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 63,9%).
Температура плавления: 218,3-218,6°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,98 (6Н, д, J=6,8 Гц), 2,26-2,37 (1Н, м), 3,36 (4Н, т, J=5,1 Гц), 3,85 (4Н, т, J=5,1 Гц), 4,08 (2Н, д, J=7,3 Гц), 4,48 (2Н, с), 7,40 (1Н, тт, J=1,2, 7,3 Гц), 7,49 (2Н, дд, J=7,3 Гц), 7,72 (2Н, дд, J=1,2, 7,3 Гц), 7,81 (2Н, д, J=8,3 Гц), 8,01 (2Н, д, J=8,3 Гц), 8,52 (1Н, с).
ИК (KBr) см-1: 1654, 1607, 1053, 847, 769.
m/z (EI): 403 (M+-H2O)
Пример 72
Получение 6-(4-бифенилил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-(4-бифенилил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 87,7%).
1H ЯМР (400 МГц, CDCl3) δ: 1,00 (6Н, д, J=6,6 Гц), 2,36 (6Н, с), 2,29-2,43 (1Н, м), 3,52 (2Н, д, J=1,0 Гц), 4,10 (2Н, д, J=7,2 Гц), 7,37 (1Н, т, J=7,4 Гц), 7,46 (2Н, дд, J=7,4, 7,4 Гц), 7,63 (2Н, д, J=7,2 Гц), 7,68 (2Н, д, J=8,4 Гц), 7,85 (1Н, с), 7,92 (2Н, д, J=8,4 Гц).
Пример 73
Получение гидрохлорида 6-(4-бифенилил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-бифенилил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных хлопьев (выход: 58,2%).
Температура плавления: 243,9-244,1°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,98 (6Н, д, J=6,6 Гц), 2,26-2,37 (1Н, м), 2,83 (6Н, с), 4,03 (2Н, д, J=7,1 Гц), 4,30 (2Н, с), 7,39 (1Н, тт, J=1,2, 7,3 Гц), 7,49 (2Н, дд, J=7,3, 7,3 Гц), 7,72 (2Н, дд, J=1,2, 7,1 Гц), 7,81 (2Н, д, J=8,8 Гц), 8,02 (2Н, д, J=8,6 Гц), 8,57 (1Н, с).
ИК (KBr) см-1: 1647, 1604, 1460, 1409, 1052.
Mass m/z: 361 (M+)
Пример 74
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-хлор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-хлор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 89,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,47 (9Н, с), 2,27-2,40 (1Н, м), 2,52 (4Н, т, J=4,9 Гц), 3,50 (4Н, т, J=5,0 Гц), 3,57 (2Н, д, J=1,4 Гц), 3,96 (3Н, с), 4,07 (2Н, д, J=7,2 Гц), 7,00 (1Н, д, J=8,6 Гц), 7,66 (1Н, дд, J=2,4, 8,6 Гц), 7,74 (1Н, т, J=1,3 Гц), 7,86 (1Н, д, J=2,4 Гц).
Пример 75
Получение дигидрохлорида 6-(3-хлор-4-метоксифенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-хлор-4-меоксифенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 70,2%).
Температура плавления: 203,6-204,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,6 Гц), 2,20-2,34 (1Н, м), 3,14 (4Н, ушир.), 3,31 (4Н, т, J=5,2 Гц), 3,93 (5Н, с), 4,01 (2Н, д, J=7,0 Гц), 7,26 (1Н, д, J=8,8 Гц), 7,84 (1Н, дд, J=2,4, 8,6 Гц), 7,91 (1Н, д, J=2,4 Гц), 8,19 (1Н, с).
ИК (KBr) см-1: 1654, 1608, 1507, 1289, 1065.
Mass m/z: 390 (M+), 392 (M+).
Пример 76
Получение 6-(3-хлор-4-метоксифенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-хлор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 76,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,28-2,40 (1Н, м), 2,33 (3Н, с), 2,53 (4Н, ушир.), 2,63 (4Н, ушир.), 3,58 (2Н, д, J=1,2 Гц), 3,96 (3Н, с), 4,06 (2Н, д, J=7,2 Гц), 7,01 (1Н, д, J=8,6 Гц), 7,67 (1Н, дд, J=2,2, 8,6 Гц), 7,72 (1Н, с), 7,86 (1Н, д, J=2,2 Гц).
Пример 77
Получение дигидрохлорида 6-(3-хлор-4-метоксифенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(3-хлор-4-метоксифенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 67,5%).
Температура плавления: 235,8-236,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,25-2,32 (1Н, м), 2,77 (3Н, с), 3,15 (4Н, ушир.), 3,36 (4Н, ушир.), 3,88 (2Н, с), 3,93 (3Н, с), 4,01 (2Н, д, J=7,0 Гц), 7,26 (1Н, д, J=8,6 Гц), 7,83 (1Н, дд, J=2,2, 8,6 Гц), 7,91 (1Н, д, J=2,2 Гц), 8,12 (1Н, с).
ИК (KBr) см-1: 1653, 1608, 1507, 1289, 1064.
Mass m/z: 404 (M+), 406 (M+).
Пример 78
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-хлор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-хлор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 79,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,96 (6Н, д, J=6,6 Гц), 2,28-2,39 (1Н, м), 2,71 (4Н, т, J=4,9 Гц), 3,66 (4Н, т, J=4,9 Гц), 3,70 (2Н, с), 3,94 (3Н, с), 4,07 (2Н, д, J=7,4 Гц), 6,98 (1Н, д, J=8,8 Гц), 7,68 (1Н, дд, J=1,8, 8,7 Гц), 7,72 (1Н, с), 7,85 (1Н, д, J=2,1 Гц).
Пример 79
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-хлор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-хлор-4-метоксифенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 60,1%).
Температура плавления: 153,0-153,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,6 Гц), 2,23-2,34 (1Н, м), 3,34 (4Н, т, J=5,1 Гц), 3,83 (4Н, т, J=5,1 Гц), 3,94 (3Н, с), 4,04 (2Н, д, J=7,1 Гц), 4,44 (2Н, с), 7,28 (1Н, д, J=8,8 Гц), 7,85 (1Н, дд, J=2,4, 8,6 Гц), 7,94 (1Н, д, J=2,4 Гц), 8,45 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1508, 1421, 1293, 1062.
Mass m/z: 391 (M+-H2O)
Пример 80
Получение 6-(3-хлор-4-метоксифенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-(3-хлор-4-метоксифенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 84,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,31-2,39 (1Н, м), 2,35 (6Н, с), 3,50 (2Н, с), 3,95 (3Н, с), 4,07 (2Н, д, J=7,2 Гц), 6,99 (1Н, д, J=8,6 Гц), 7,70 (1Н, дд, J=1,4, 8,6 Гц), 7,88 (1Н, д, J=1,4 Гц).
Пример 81
Получение гидрохлорида 6-(3-хлор-4-метоксифенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(3-хлор-4-метоксифенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 69,4%).
Температура плавления: 213,6-214,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,22-2,34 (1Н, м), 2,81 (6Н, с), 3,94 (3Н, с), 4,04 (2Н, д, J=7,1 Гц), 4,27 (2Н, с), 7,28 (1Н, д, J=8,8 Гц), 7,87 (1Н, дд, J=2,2, 8,8 Гц), 7,95 (1Н, д, J=2,2 Гц), 8,53 (1Н, с).
ИК (KBr) см-1: 1652, 1608, 1508, 1289, 1064.
Mass m/z: 349 (M+), 351 (M+).
Пример 82
Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение этил 2-этоксикарбонил-4-(4-фтор-3-метилфенил)-2-гидрокси-4-оксобутаноата
Следуя методике примера 1(3), подвергали взаимодействию 5-ацетил-2-фтортолуол с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (выход: 95,9%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30 (6Н, т, J=7,1 Гц), 2,33 (3Н, д, J=1,7 Гц), 3,79 (2Н, с), 4,29 (1Н, с), 4,31 (4Н, кв., J=7,1 Гц), 7,08 (1Н, дд, J=8,8, 8,8 Гц), 7,78-7,85 (2Н, м).
2) Получение 4-карбокси-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(4), подвергали взаимодействию этил 2-этоксикарбонил-4-(4-фтор-3-метилфенил)-2-гидрокси-4-оксобутаноат с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 88,9%).
Температура плавления: 213,6-214,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,51 (3Н, д, J=1,7 Гц), 7,26 (1Н, дд, J=9,1, 9,1 Гц), 7,77-7,81 (1Н, м), 7,89 (1Н, д, J=7,3 Гц), 8,49 (1Н, с), 13,99 (1Н, ушир.).
3) Получение 6-(4-фтор-3-метилфенил)-4-метокси-карбонил-2H-пиридазин-3-она
Следуя методике примера 1(5), подвергали взаимодействию 4-карбокси-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 76,8%).
1H ЯМР (400 МГц, CDCl3) δ: 2,35 (3Н, д, J=2,0 Гц), 3,99 (3Н, с), 7,10 (1Н, дд, J=8,9, 8,9 Гц), 7,58-7,62 (1Н, м), 7,60 (1Н, д, J=7,3 Гц), 8,31 (1Н, с).
4) Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (выход: 86,3%).
Температура плавления: 71,4-73,8°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,31-2,42 (1Н, м), 2,35 (3Н, д, J=2,0 Гц), 3,98 (3Н, с), 4,12 (2Н, д, J=7,3 Гц), 7,10 (1Н, дд, J=8,8, 8,8 Гц), 7,57-7,65 (2Н, м), 8,21 (1Н, с).
5) Получение 4-карбокси-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 90,0%).
Температура плавления: 129,3-132,1°С
1H ЯМР (400 МГц, CDCl3) δ: 1,02 (6Н, д, J=6,8 Гц), 2,33-2,44 (1Н, м), 2,37 (3Н, д, J=2, 0 Гц), 4,21 (2Н, д, J=7,3 Гц), 7,13 (1Н, дд, J=8,8, 8,8 Гц), 7,64-7,71 (2Н, м), 8,63 (1Н, с).
ИК (KBr) см-1: 1742, 1636, 1537, 1422.
Mass m/z: 304 (M+).
6) Получение 6-(4-фтор-3-метилфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 24,7%).
Температура плавления: 107,4-110,4°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 2,35 (3Н, д, J=1,7 Гц), 3,14 (1Н, т, J=5,9 Гц), 4,08 (2Н, д, J=7,6 Гц), 4,71 (2Н, д, J=5,9 Гц), 7,08 (1Н, дд, J=8,8, 8,8 Гц), 7,56-7,65 (3Н, м).
ИК (KBr) см-1: 3401, 1658, 1648, 1618, 1602, 1501.
Mass m/z: 290 (M+).
7) Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 91,4%).
Температура плавления: 114,6-117,1°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,29-2,40 (1Н, м), 2,36 (3Н, с), 3,17 (3Н, с), 4,08 (2Н, д, J=7,6 Гц), 5,27 (2Н, д, J=1,5 Гц), 7,09 (1Н, дд, J=8,9, 8,9 Гц), 7,56-7,69 (2Н, м), 7,75 (1Н, т, J=1,5 Гц).
ИК (KBr) см-1: 1656, 1611, 1505, 1354, 1166.
Mass m/z: 368 (M+).
8) Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 79,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,27-2,40 (1Н, м), 2,32 (3Н, с), 2,36 (3Н, д, J=2,0 Гц), 2,51 (4Н, ушир.), 2,62 (4Н, ушир.), 3,58 (2Н, д, J=1,5 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,09 (1Н, дд, J=8,8, 8,8 Гц), 7,58 (1Н, ддд, J=2,0, 4,9, 8,8 Гц), 7,64 (1Н, дд, J=2,0, 7,3 Гц), 7,73 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1652, 1609, 1503.
Mass m/z: 372 (M+).
Пример 83
Получение дигидрохлорида 6-(4-фтор-3-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных призматических кристаллов (выход: 95,9%).
Температура плавления: 234,8-237,4°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,8 Гц), 2,19-2,30 (1Н, м), 2,32 (3Н, д, J=2,0 Гц), 2,81 (3Н, с), 2,89-3,62 (10Н, ушир.м), 4,00 (2Н, д, J=7,3 Гц), 7,29 (1Н, дд, J=9,0, 9,0 Гц), 7,72-7,78 (1Н, м), 7,83 (1Н, дд, J=2,4, 7,6 Гц), 8,31 (1Н, ушир.с).
ИК (KBr) см-1: 1660, 1609, 1504.
Пример 84
Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-метиламинометил-2H-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 96,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,65 (1Н, ушир.), 2,29-2,42 (1Н, м), 2,34 (3Н, д, J=1,7 Гц), 2,51 (3Н, с), 3,77 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,07 (1Н, дд, J=8,8, 8,8 Гц), 7,54-7,63 (2Н, м), 7,64 (1Н, т, J=1,2 Гц).
ИК (Чистый) см-1: 3306, 1653, 1605, 1507.
Mass m/z: 303 (M+).
Пример 85
Получение гидрохлорида 6-(4-фтор-3-метилфенил)-2-изобутил-4-метиламинометил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метиламинометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных призматических кристаллов (выход: 86,6%).
Температура плавления: 196,8-199,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,8 Гц), 2,19-2,31 (1Н, м), 2,32 (3Н, с), 2,65 (3Н, с), 4,02 (2Н, д, J=7,3 Гц), 4,12 (2Н, с), 7,31 (1Н, дд, J=8,5, 8,5 Гц), 7,72-7,78 (1Н, м), 7,80-7,85 (1Н, м), 8,32 (1Н, с).
ИК (KBr) см-1: 2722, 1652, 1615, 1505.
Пример 86
Получение 4-(4-бензил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-бензилпиперазин с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 98,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,8 Гц), 2,29-2,39 (1Н, м), 2,36 (3Н, д, J=1,7 Гц), 2,55 (4Н, ушир.), 2,61 (4Н, ушир.), 3,55 (2Н, с), 3,57 (2Н, д, J=1,2 Гц), 4,06 (2Н, д, J=7,6 Гц), 7,09 (1Н, дд, J=8,9, 8,9 Гц), 7,23-7,34 (5Н, м), 7,51 (1Н, ддд, J=2,4, 4,8, 8,9 Гц), 7,63 (1Н, дд, J=2,4, 7,2 Гц), 7,72 (1Н, с).
ИК (Чистый) см-1: 1652, 1608, 1505.
Mass m/z: 448 (M+).
Пример 87
Получение дигидрохлорида 4-(4-бензил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-(4-бензил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 95,3%).
Температура плавления: 259,1-263,1°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,6 Гц), 2,17-2,29 (1Н, м), 2,32 (3Н, с), 2,55 (4Н, ушир.), 3,23-3,56 (8Н, brм), 4,00 (2Н, д, J=7,3 Гц), 4,11 (2Н, ушир.с), 4,38 (2Н, ушир.с), 7,29 (1Н, дд, J=9,0, 9,0 Гц), 7,43-7,48 (3Н, м), 7,59-7,65 (2Н, м), 7,72-7,77 (1Н, м), 7,79-7,84 (1Н, м), 8,35 (1Н, ушир.с).
ИК (KBr) см-1: 1660, 1618, 1612, 1453.
Пример 88
Получение 4-диметиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого масла (выход: 96,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,28-2,39 (1Н, м), 2,35 (3Н, д, J=2,2 Гц), 2,56 (6Н, с), 3,50 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,07 (1Н, дд, J=8,9, 8,9 Гц), 7,59-7,67 (2Н, м), 7,74 (1Н, т, J=1,2 Гц).
ИК (Чистый) см-1: 1652, 1608, 1506.
Mass m/z: 317 (M+).
Пример 89
Получение гидрохлорида 4-диметиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 97,2%).
Температура плавления: 208,5-213,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,19-2,30 (1Н, м), 2,32 (3Н, с), 2,81 (6Н, с), 4,03 (2Н, д, J=7,0 Гц), 4,30 (2Н, с), 7,30 (1Н, дд, J=9,0, 9,0 Гц), 7,74-7,80 (1Н, м), 7,85 (1Н, м), 8,51 (1Н, с).
ИК (KBr) см-1: 1648, 1608, 1507.
Пример 90
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 91,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,8 Гц), 2,27-2,40 (1Н, м), 2,34 (3Н, д, J=2,0 Гц), 2,70 (4Н, т, J=5,0 Гц), 3,66 (4Н, д, J=5,0 Гц), 3,69 (2Н, с), 3,91 (2Н, ушир.), 4,07 (2Н, д, J=7,6 Гц), 7,07 (1Н, дд, J=8,9, 8,9 Гц), 7,60 (1Н, ддд, J=2,2, 5,1, 8,9 Гц), 7,64 (1Н, дд, J=2,2, 7,3 Гц), 7,71 (1Н, с).
ИК (Чистый) см-1: 3391, 1654, 1371, 1505.
Mass m/z: 359 (M+-H2O).
Пример 91
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 92,4%).
Температура плавления: 155,1-157,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,20-2,31 (1Н, м), 2,32 (3Н, д, J=1,2 Гц), 3,35 (4Н, ушир., перекрывается с H2O), 3,82 (4Н, ушир.), 4,02 (2Н, д, J=7,3 Гц), 4,50 (2Н, с), 5,37 (2Н, ушир.), 7,30 (1Н, дд, J=9,0, 9,0 Гц), 7,78 (1Н, ддд, J=2,0, 4,9, 9,0 Гц), 7,85 (1Н, дд, J=2,0, 7,3 Гц), 7,71 (1Н, с).
ИК (KBr) см-1: 3281, 1655, 1606.
Пример 92
Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-(пиперидино)метил-2H-пиридазин-3-она
6-(4-Фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он (80 мг, 0,22 ммоль) и пиперидин (55 мг, 0,65 ммоль) растворяли в этаноле (0,5 мл), и смесь нагревали при 80°С в течение 1 часа при перемешивании. Растворитель отгоняли. Остаток очищали препаративной тонкослойной хроматографией на силикагеле [проявляющий растворитель: хлороформ/метанол (10/1)] с получением указанного в заголовке соединения в виде желтоватого масла (73 мг, 94,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,9 Гц), 1,45-1,53 (2Н, м), 1,61- 1,68 (4Н, м), 2,28-2,41 (1Н, м), 2,36 (3Н, д, J=2,0 Гц), 2,47-2,53 (4Н, м), 3,52 (2Н, д, J=1,5 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,08 (1Н, дд, J=8,9, 8,9 Гц), 7,59 (1Н, ддд, J=1,7, 4,9, 8,9 Гц), 7,65 (1Н, дд, J=1,7, 7,3 Гц), 7,76 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1652, 1616, 1506.
Mass m/z: 357 (M+).
Пример 93
Получение гидрохлорида 6-(4-фтор-3-метилфенил)-2-изобутил-4-(пиперидино)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-(пиперидино)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых призматических кристаллов (выход: 90,7%).
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 1,34-1,47 (1Н, м), 1,64-1,73 (1Н, м), 1,74-1,83 (4Н, м), 2,20-2,30 (1Н, м), 2,32 (3Н, с), 2,95-3,02 (2Н, м), 3,36-3,45 (1Н, м), 4,02 (2Н, д, J=7,3 Гц), 4,25 (2Н, д, J=5,1 Гц), 7,30 (1Н, дд, J=9,0, 9,0 Гц), 7,75-7,80 (1Н, м), 7,83-7,87 (1Н, м), 8,59 (1Н, с).
ИК (KBr) см-1: 2532, 1652, 1616, 1505, 1433.
Пример 94
Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-(морфолино)метил-2H-пиридазин-3-она
Следуя методике примера 92, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и морфолин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 97,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,28-2,41 (1Н, м), 2,36 (3Н, д, J=2,0 Гц), 2,58 (4Н, т, J=4,6 Гц), 3,57 (2Н, д, J=1,2 Гц), 3,78 (4Н, т, J=4,6 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,09 (1Н, дд, J=8,8, 8,8 Гц), 7,58 (1Н, ддд, J=2,0, 4,9, 8,8 Гц), 7,64 (1Н, дд, J=2,0, 7,3 Гц), 7,75 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1659, 1606, 1503.
Mass m/z: 359 (M+).
Пример 95
Получение гидрохлорида 6-(4-фтор-3-метилфенил)-2-изобутил-4-(морфолино)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-(морфолино)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных призматических кристаллов (выход: 92,4%).
Температура плавления: 215,4-216,6°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,19-2,30 (1Н, м), 2,32 (3Н, с), 3,21 (2Н, ушир.), 3,79-3,98 (6Н, м), 4,02 (2Н, д, J=7,3 Гц), 4,33 (2Н, ушир.с), 7,30 (1Н, дд, J=9,0, 9,0 Гц), 7,74-7,79 (1Н, м), 7,81-7,86 (1Н, м), 8,56 (1Н, ушир.с).
ИК (KBr) см-1: 2392, 1647, 1607.
Пример 96
Получение 4-аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
1) Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-фталимидометил-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 93,7%).
Температура плавления: 181,2-187,2°С
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 2,30 (3Н, с), 4,07 (2Н, д, J=7,3 Гц), 4,91 (2Н, с), 7,01 (1Н, дд, J=9,0, 9,0 Гц), 7,31 (1Н, с), 7,41-7,46 (1Н, м), 7,50-7,53 (1Н, м), 7,76-7,81 (2Н, м), 7,90-7,95 (2Н, м).
ИК (KBr) см-1: 1720, 1656, 1619, 1611.
Mass m/z: 419 (M+).
2) Получение 4-аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 24 (2), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-фталимидометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого масла (выход: 99,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,64 (2Н, ушир.), 2,30-2,40 (1Н, м), 2,35 (3Н, д, J=2,0 Гц), 3,89 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,07 (1Н, дд, J=8,8, 8,8 Гц), 7,60 (1Н, ддд, J=2,1, 4,9, 8,8 Гц), 7,64 (1Н, дд, J=2,1, 7,4 Гц), 7,67 (1Н, т, J=1,2 Гц).
ИК (Чистый) см-1: 3372, 3301, 1655, 1605, 1504.
Mass m/z: 289 (M+).
Пример 97
Получение гидрохлорида 4-аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 79,8%).
Температура плавления: 217,5-220,5°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,6 Гц), 2,20-2,30 (1Н, м), 2,32 (3Н, д, J=1,7 Гц), 4,01 (2Н, д, J=2,2 Гц), 4,02 (2Н, д, J=7,3 Гц), 7,31 (1Н, дд, J=9,0, 9,0 Гц), 7,75 (1Н, ддд, J=2,1, 4,9, 9,0 Гц), 7,83 (1Н, дд, J=2,1, 7,4 Гц), 8,28 (1Н, с).
ИК (KBr) см-1: 2960, 2927, 2872, 1656, 1614, 1507.
Пример 98
Получение 4-диэтиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтиламин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 94,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,07 (6Н, т, J=7,1 Гц), 2,30-2,41 (1Н, м), 2,35 (3Н, д, J=1,5 Гц), 2,61 (4Н, кв., J=7,1 Гц), 3,60 (2Н, д, J=1,7 Гц), 4,08 (2Н, д, J=7,5 Гц), 7,08 (1Н, дд, J=8,9, 8,9 Гц), 7,60 (1Н, ддд, J=2,2, 4,9, 8,9 Гц), 7,65 (1Н, дд, J=2,2, 7,3 Гц), 7,85 (1Н, т, J=1,5 Гц).
ИК (Чистый) см-1: 1652, 1609, 1506.
Mass m/z: 345 (M+).
Пример 99
Получение гидрохлорида 4-диэтиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диэтиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 70,1%).
Температура плавления: 154,3-157,3°С
1H ЯМР (400 МГц, CDCl3) δ: 0,92 (6Н, д, J=6,8 Гц), 1,29 (6Н, т, J=7,2 Гц), 2,20-2,30 (1Н, м), 2,32 (3Н, д, J=1,2 Гц), 3,09-3,25 (4Н, м), 4,03 (2Н, д, J=7,3 Гц), 4,28 (2Н, д, J=5,6 Гц), 7,30 (1Н, дд, J=9,0, 9,0 Гц), 7,80 (1Н, ддд, J=2,0, 4,9, 9,0 Гц), 7,87 (1Н, дд, J=2,0, 7,3 Гц), 7,85 (1Н, т, J=1,5 Гц).
ИК (KBr) см-1: 2559, 2491, 1652, 1613, 1507.
Пример 100
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтоватого масла (выход: 97,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 1,46 (9Н, с), 2,28-2,40 (1Н, м), 2,36 (3Н, д, J=1,7 Гц), 3,50 (4Н, т, J=4,9 Гц), 3,58 (2Н, д, J=1,0 Гц), 4,08 (2Н, д, J=7,3 Гц), 7,09 (1Н, дд, J=8,9, 8,9 Гц), 7,58 (1Н, ддд, J=2,0, 4,9, 8,9 Гц), 7,63 (1Н, дд, J=2,0, 7,3 Гц), 7,75 (1Н, с).
ИК (Чистый) см-1: 1695, 1652, 1608, 1506.
Пример 101
Получение 6-(4-фтор-3-метилфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: количественный).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,47 (1Н, ушир.), 2,28-2,40 (1Н, м), 2,36 (3Н, д, J=1,7 Гц), 2,56 (4Н, т, J=4,9 Гц), 2,97 (4Н, т, J=4,9 Гц), 3,56 (2Н, д, J=1,4 Гц), 4,07 (2Н, д, J=7,3 Гц), 7,09 (1Н, дд, J=8,8, 8,8 Гц), 7,58 (1Н, ддд, J=2,0, 4,9, 8,8 Гц), 7,64 (1Н, дд, J=2,0, 7,3 Гц), 7,75 (1Н, т, J=1,4 Гц).
Пример 102
Получение дигидрохлорида 6-(4-фтор-3-метилфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(4-фтор-3-метилфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (выход: 87,2%).
Температура плавления: 154,9-158,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,19-2,30 (1Н, м), 2,32 (3Н, д, J=1,7 Гц), 3,04 (4Н, ушир.), 3,71 (4Н, ушир.), 4,01 (2Н, д, J=7,3 Гц), 7,28 (1Н, дд, J=8,8, 8,8 Гц), 7,76 (1Н, ддд, J=2,0, 4,9, 8,8 Гц), 7,83 (1Н, дд, J=2,0, 7,3 Гц), 8,40 (1Н, ушир.с).
ИК (KBr) см-1: 1659, 1610, 1504, 1422.
Пример 103
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
1) Получение этил 4-(3,4-дифторфенил)-2-этоксикарбонил-2-гидрокси-4-оксобутаноата
Следуя методике примера 1(3), подвергали взаимодействию 3',4'-дифторацетофенон с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 81,6%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30 (6Н, т, J=7,1 Гц), 3,78 (2Н, с), 4,22 (1Н, с), 4,31 (4Н, кв., J=7,1 Гц), 7,24-7,30 (1Н, м), 7,73-7,82 (2Н, м).
ИК (Чистый) см-1: 3483, 1740, 1695, 1612.
Mass m/z: 312 (M+-H2O).
2) Получение 4-карбокси-6-(3,4-дифторфенил)-2H-пиридазин-3-она
Следуя методике примера 1(4), подвергали взаимодействию этил 4-(3,4-дифторфенил)-2-этоксикарбонил-2-гидрокси-4-оксобутаноат с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 88,9%).
3) Получение 4-метоксикарбонил-6-(3,4-дифторфенил)-2H-пиридазин-3-она
Следуя методике примера 1(5), подвергали взаимодействию 4-карбокси-6-(3,4-дифторфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 85,8%).
1H ЯМР (400 МГц, CDCl3) δ: 4,01 (3Н, с), 7,25-7,32 (1Н, м), 7,53-7,57 (1Н, м), 7,67-7,73 (1Н, м), 8,31 (1Н, с), 11,70 (1Н, ушир.).
ИК (KBr) см-1: 3223, 3159, 1722, 1676, 1659.
Mass m/z: 266 (M+).
4) Получение 6-(3,4-дифторфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3,4-дифторфенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: количественный).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,41 (1Н, м), 3,98 (3Н, с), 4,13 (2Н, д, J=7,2 Гц), 7,23-7,30 (1Н, м), 7,49-7,55 (1Н, м), 7,68 (1Н, ддд, J=2,2, 7,6, 11,1 Гц), 8,20 (1Н, с).
5) Получение 4-карбокси-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 6-(3,4-дифторфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 91,4%).
Температура плавления: 163,4-163,70°С
1H ЯМР (400 МГц, CDCl3) δ: 1,02 (6Н, д, J=6,6 Гц), 2,33-2,43 (1Н, м), 4,22 (2Н, д, J=7,4 Гц), 7,27-7,35 (1Н, м), 7,56-7,62 (1Н, м), 7,74 (1Н, ддд, J=2,4, 7,6, 11,2 Гц), 8,62 (1Н, с), 14,05 (1Н, с).
ИК (KBr) см-1: 3436, 1737, 1635, 1522, 1434, 1276, 1102, 806.
Mass m/z: 308 (M+)
6) Получение 6-(3,4-дифторфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 25,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,29-2,39 (1Н, м), 2,96 (1Н, т, J=5,9 Гц), 4,08 (2Н, д, J=7,4 Гц), 4,72 (2Н, дд, J=1,2, 5,8 Гц), 7,22-7,28 (1Н, м), 7,51-7,55 (1Н, м), 7,64-7,71 (2Н, м).
7) Получение 6-(3,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 6-(3,4-дифторфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (выход: 81,4%).
Температура плавления: 113,3-113,40°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,27-2,40 (1Н, м), 3,18 (3Н, с), 4,08 (2Н, д, J=7,4 Гц), 5,28 (2Н, д, J=1,6 Гц), 7,23-7,30 (1Н, м), 7,50-7,54 (1Н, м), 7,68 (1Н, ддд, J=2,2, 7,6, 11,1 Гц), 7,75 (1Н, т, J=1,4 Гц).
ИК (KBr) см-1: 3447, 1656, 1613, 1522, 1354, 1167, 1049, 877.
Mass m/z: 372 (M+)
8) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 85,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 1,47 (9Н, с), 2,28-2,38 (1Н, м), 2,52 (4Н, т, J=4,7 Гц), 3,51 (4Н, т, J=4,7 Гц), 3,58 (2Н, с), 4,07 (2Н, д, J=7,2 Гц), 7,21-7,29 (1Н, м), 7,50-7,55 (1Н, м), 7,64-7,71 (1Н, м), 7,76 (1Н, д, J=1,0 Гц).
Пример 104
Получение дигидрохлорида 6-(3,4-дифторфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 72,5%).
Температура плавления: 182,5-186,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,22-2,33 (1Н, м), 3,11 (4Н, ушир.), 3,30 (4Н, т, J=5,1 Гц), 3,90 (2Н, с), 4,02 (2Н, д, J=7,1 Гц), 7,52 (1Н, ддд, J=8,6, 8,6, 10,5 Гц), 7,73-7,78 (1Н, м), 7,90 (1Н, ддд, J=2,2, 8,0, 11,7 Гц), 8,20 (1Н, с).
ИК (KBr) см-1: 1656, 1609, 1522, 1436, 1276, 1112.
Mass m/z: 362 (M+)
Пример 105
Получение 6-(3,4-дифторфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 79,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,28-2,39 (1Н, м), 2,34 (3Н, с), 2,55 (4Н, ушир.), 2,63 (4Н, ушир.), 3,58 (2Н, с), 4,07 (2Н, д, J=7,2 Гц), 7,22-7,29 (1Н, м), 7,50-7,57 (1Н, м), 7,64-7,72 (1Н, м), 7,74 (1Н, с).
Пример 106
Получение дигидрохлорида 6-(3,4-дифторфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(3,4-дифторфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 70,3%).
Температура плавления: 242,5-243,40°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,22-2,33 (1Н, м), 2,77 (3Н, с), 3,11 (4Н, ушир.), 3,34 (4Н, ушир.), 3,84 (2Н, с), 4,02 (2Н, д, J=7,1 Гц), 7,52 (1Н, ддд, J=8,6, 8,6, 10,5 Гц), 7,72-7,77 (1Н, м), 7,89 (1Н, ддд, J=2,2, 7,9, 11,7 Гц), 8,12 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1522, 1435, 1278.
Mass m/z: 376 (M+)
Пример 107
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 75,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,6 Гц), 2,25-2,38 (1Н, м), 2,70 (4Н, ушир.), 3,64-3,70 (6Н, м), 4,06 (2Н, д, J=7,4 Гц), 7,15-7,25 (1Н, м), 7,54-7,58 (1Н, м), 7,67-7,73 (1Н, м), 7,88 (1Н, с).
Пример 108
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 70,3%).
Температура плавления: 127,5-128,30°С
1H ЯМР (400 МГц, DMSO6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,23-2,34 (1Н, м), 3,35 (4Н, т, J=5,1 Гц), 3,84 (4Н, т, J=5,1 Гц), 4,05 (2Н, д, J=7,1 Гц), 4,45 (2Н, с), 7,54 (1Н, ддд, J=8,6, 8,6, 10,5 Гц), 7,76-7,81 (1Н, м), 7,93 (1Н, ддд, J=2,2, 7,8, 12,0 Гц), 8,53 (1Н, с).
ИК (KBr) см-1: 1653, 1604, 1521, 1437, 1275.
Mass m/z: 363 (M+-H2O)
Пример 109
Получение 6-(3,4-дифторфенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-(3,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 85,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,29-2,40 (1Н, м), 2,35 (6Н, с), 3,50 (2Н, с), 4,07 (2Н, д, J=7,4 Гц), 7,20-7,30 (1Н, м), 7,53-7,60 (1Н, м), 7,67-7,73 (1Н, м), 7,74 (1Н, с).
Пример 110
Получение гидрохлорида 6-(3,4-дифторфенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(3,4-дифторфенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения желтоватых хлопьев (выход: 85,9%).
Температура плавления: 226,5-227,70°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,8 Гц), 2,23-2,34 (1Н, м), 2,81 (6Н, с), 4,05 (2Н, д, J=7,1 Гц), 4,28 (2Н, с), 7,54 (ддд, J=8,7, 8,7, 10,5 Гц), 7,76-7,81 (1Н, м), 7,93 (1Н, ддд, J=2,2, 7,9, 12,0 Гц), 8,57 (1Н, с).
ИК (KBr) см-1: 1648, 1607, 1525, 1437, 1288, 1112.
Mass m/z: 321 (M+)
Пример 111
Получение 4-аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
1) Получение этил 4-(2,4-дифторфенил)-2-этоксикарбонил-2-гидрокси-4-оксобутаноата
Следуя методике примера 1(3), подвергали взаимодействию 2',4'-дифторацетофенон с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 76,8%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30 (6Н, т, J=7,1 Гц), 3,81 (2Н, д, J=3,4 Гц), 4,18 (1Н, с), 4,30 (4Н, кв., J=7,1 Гц), 6,90 (1Н, ддд, J=2,4, 8,5, 10,0 Гц), 6,94-7,00 (1Н, м), 7,94 (1Н, ддд, J=6,6, 8,5, 8,5 Гц).
ИК (Чистый) см-1: 3491, 1743, 1692, 1612.
Mass m/z: 312 (M+-H2O)
2) Получение 4-карбокси-6-(2,4-дифторфенил)-2H-пиридазин-3-она
Следуя методике примера 1(4), подвергали взаимодействию этил 4-(2,4-дифторфенил)-2-этоксикарбонил-2-гидрокси-4-оксобутаноат с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 95,2%).
3) Получение 6-(2,4-дифторфенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(5), подвергали взаимодействию 4-карбокси-6-(2,4-дифторфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 81,2%).
1H ЯМР (400 МГц, CDCl3) δ: 3,99 (3Н, с), 6,96 (1Н, ддд, J=2,4, 8,8, 10,1 Гц), 6,99-7,04 (1Н, м), 7,77 (1Н, ддд, J=6,3, 8,8, 8,8 Гц), 8,30 (1Н, д, J=2,0 Гц), 12,05 (1Н, ушир.).
ИК (KBr) см-1: 3217, 3148, 1721, 1673, 1611.
Mass m/z: 266 (M+).
4) Получение 6-(2,4-дифторфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(2,4-дифторфенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 84,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,42 (1Н, м), 3,97 (3Н, с), 4,12 (2Н, д, J=7,3 Гц), 6,94 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,98-7,04 (1Н, м), 7,73 (1Н, ддд, J=6,3, 6,3, 8,8 Гц), 8,18 (1Н, д, J=2,0 Гц).
ИК (Чистый) см-1: 1755, 1748, 1668, 1620, 1506.
Mass m/z: 322 (M+).
5) Получение 4-карбокси-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения желтоватых игольчатых кристаллов (выход: 92,7%).
Температура плавления: 126,5-128,20°С
1H ЯМР (400 МГц, CDCl3) δ: 1,02 (6Н, д, J=6,6 Гц), 2,31-2,43 (1Н, м), 4,22 (2Н, д, J=7,6 Гц), 6,96-7,07 (2Н, м), 7,74 (1Н, ддд, J=6,3, 6,3, 8,8 Гц), 8,61 (1Н, д, J=2,2 Гц), 14,02 (1Н, с).
ИК (KBr) см-1: 1739, 1636, 1618, 1573, 1465.
Mass m/z: 308 (M+).
6) Получение 6-(2,4-дифторфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 45,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,27-2,40 (1Н, м), 3,15 (1Н, т, J=6,1 Гц), 4,08 (2Н, д, J=7,3 Гц), 4,69 (2Н, дд, J=1,2, 6,1 Гц), 6,93 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,96-7,02 (1Н, м), 7,61-7,63 (1Н, м), 7,72 (1Н, ддд, J=6,3, 6,3, 8,8 Гц).
ИК (Чистый) см-1: 3412, 1652, 1620, 1507.
Mass m/z: 294 (M+).
7) Получение 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 6-(2,3-дифторфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 96,3%).
Температура плавления: 86,7-88,6°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,26-2,39 (1Н, м), 3,16 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 5,26 (2Н, д, J=1,2 Гц), 6,94 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,97-7,03 (1Н, м), 7,71 (1Н, ддд, J=6,3, 6,3, 8,8 Гц), 7,73-7,75 (1Н, м).
ИК (KBr) см-1: 1659, 1612, 1508, 1359, 1166.
Mass m/z: 372 (M+).
8) Получение 6-(2,4-дифторфенил)-2-изобутил-4-фталимидометил-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 91,1%).
Температура плавления: 152,3-155,6°С
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,28-2,39 (1Н, м), 4,07 (2Н, д, J=7,3 Гц), 4,89 (2Н, д, J=1,0 Гц), 6,83 (1Н, ддд, J=2,4, 8,8, 11,0 Гц), 6,91-6,97 (1Н, м), 7,27-7,31 (1Н, м), 7,66 (1Н, ддд, J=6,3, 6,3, 8,8 Гц), 7,74-7,80 (2Н, м), 7,86-7,94 (2Н, м).
ИК (KBr) см-1: 1773, 1720, 1650, 1617, 1509, 1418, 1389.
Mass m/z: 423 (M+).
9) Получение 4-аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 24 (2), подвергали взаимодействию 2-изобутил-6-(2,4-дифторфенил)-4-фталимидометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого масла (выход: 98,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,66 (2Н, ушир.), 2,24-2,41 (1Н, м), 3,87 (2Н, с), 4,08 (2Н, д, J=7,3 Гц), 6,92 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,97-7,02 (1Н, м), 7,63 (1Н, т, J=1,1 Гц), 7,71 (1Н, ддд, J=6,3, 6,3, 8,8 Гц).
ИК (Чистый) см-1: 3381, 3307, 1652, 1611, 1508.
Mass m/z: 293 (M+).
Пример 112
Получение гидрохлорида 4-аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 94,9%).
Температура плавления: 161,4-163,9°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,8 Гц), 2,18-2,34 (1Н, м), 4,01 (2Н, с), 4,02 (2Н, д, J=7,3 Гц), 7,24-7,31 (1Н, м), 7,46 (1Н, ддд, J=2,4, 8,8, 11,5 Гц), 7,76 (1Н, ддд, J=6,3, 6,3, 8,8 Гц), 7,95 (1Н, с).
ИК (KBr) см-1: 1652, 1616, 1597, 1509.
Пример 113
Получение 6-(2,4-дифторфенил)-4-диметил-аминометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого масла (выход: 94,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,27-2,38 (1Н, м), 2,34 (6Н, с), 3,49 (2Н, д, J=1,5 Гц), 4,07 (2Н, д, J=7,6 Гц), 6,92 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,95-7,01 (1Н, м), 7,70 (1Н, т, J=1,5 Гц), 7,71 (1Н, ддд, J=6,3, 6,3, 8,8 Гц).
ИК (Чистый) см-1: 1652, 1612, 1508.
Mass m/z: 321 (M+).
Пример 114
Получение гидрохлорида 6-(2,4-дифторфенил)-4-диметил-аминометил-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(2,4-дифторфенил)-4-диметиламинометил-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых призматических кристаллов (выход: 89,8%).
Температура плавления: 170,1-173,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 2,18-2,29 (1Н, м), 2,80 (6Н, с), 4,03 (2Н, д, J=7,3 Гц), 4,30 (2Н, с), 7,25-7,31 (1Н, м), 7,45 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 7,81 (1Н, ддд, J=6,3, 6,3, 8,8 Гц). 8,15 (1Н, д, J=1,7 Гц).
ИК (KBr) см-1: 1648, 1612, 1523, 1510.
Пример 115
Получение 4-диэтиламинометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 9 (4), подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтиламин с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: количественный).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,06 (6Н, т, J=7,1 Гц), 2,27-2,39 (1Н, м), 2,59 (4Н, кв., J=7,1 Гц), 3,59 (2Н, д, J=1,7 Гц), 4,07 (2Н, д, J=7,3 Гц), 6,92 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,95-7,01 (1Н, м), 7,72 (1Н, ддд, J=6,3, 6,3, 8,8 Гц), 7,83 (1Н, тд, J=1,5, 2,9 Гц).
ИК (Чистый) см-1: 1656, 1613, 1508.
Mass m/z: 349 (M+).
Пример 116
Получение гидрохлорида 4-диэтиламинометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диэтиламинометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 80,9%).
Температура плавления: 128,9-131,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,8 Гц), 1,28 (6Н, т, J=7,2 Гц), 2,18-2,29 (1Н, м), 3,10-3,23 (4Н, м), 4,03 (2Н, д, J=7,3 Гц), 4,29 (2Н, д, J=5,4 Гц), 7,28 (1Н, ддд, J=2,2, 8,8, 8,8 Гц), 7,45 (1Н, ддд, J=2,2, 8,8, 8,8 Гц), 7,81 (1Н, ддд, J=6,3, 8,8, 8,8 Гц), 8,24 (1Н, д, J=1,5 Гц).
Пример 117
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтоватого масла (выход: 97,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,6 Гц), 2,26-2,40 (1Н, м), 2,70 (4Н, т, J=5,0 Гц), 3,65 (4Н, т, J=5,0 Гц), 3,70 (2Н, с), 4,09 (2Н, д, J=7,3 Гц), 6,92 (1Н, ддд, J=2,7, 8,8, 11,2 Гц), 6,97-7,03 (1Н, м), 7,63 (1Н, д, J=2,4 Гц), 7,75 (1Н, ддд, J=6,3, 6,3, 8,8 Гц).
ИК (Чистый) см-1: 3401, 1648, 1597, 1508.
Mass m/z: 363 (M+-H2O).
Пример 118
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых призматических кристаллов (выход: 89,0%).
Температура плавления: 161,8-163,9°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,6 Гц), 2,18-2,29 (1Н, м), 3,27-3,40 (4Н, ушир, перекрывается с H2O), 3,76-3,84 (4Н, м), 4,03 (2Н, д, J=7,3 Гц), 4,51 (2Н, ушир.с), 5,34 (2Н, ушир.), 7,24-7,31 (1Н, м), 7,41-7,48 (1Н, м), 7,76-7,84 (1Н, м), 8,15 (1Н, м).
ИК (KBr) см-1: 3233, 3172, 1645, 1613, 1593, 1421.
Пример 119
Получение 6-(2,4-дифторфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде бледно-желтого масла (выход: 94,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,97 (6Н, д, J=6,6 Гц), 2,28-2,38 (1Н, м), 2,31 (3Н, с), 2,50 (4Н, ушир.), 2,61 (4Н, ушир.), 3,57 (2Н, д, J=1,5 Гц), 4,07 (2Н, д, J=7,3 Гц), 6,93 (1Н, ддд, J=2,4, 8,8, 11,2 Гц ), 6,96-7,02 (1Н, м), 7,69-7,75 (2Н, м).
ИК (Чистый) см-1: 1655, 1616, 1596, 1508.
Mass m/z: 376 (M+).
Пример 120
Получение дигидрохлорида 6-(2,4-дифторфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 90,4%).
Температура плавления: 248,1-251,7°С (разл.).
1H ЯМР (400 МГц, ДМСО-d6, 100°С) δ: 0,93 (6Н, д, J=6,8 Гц), 2,20-2,29 (1Н, м), 2,76 (3Н, с), 3,09 (4Н, ушир., перекрывается с H2O), 3,27 (4Н, ушир.), 3,74 (2Н, с), 4,00 (2Н, д, J=7,1 Гц), 7,14-7,29 (2Н, м), 7,71-7,79 (2Н, м).
ИК (KBr) см-1: 1652, 1612, 1514.
Пример 121
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он
Следуя методике примера 1(10), подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтоватого масла (выход: 97,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,47 (9Н, с), 2,28-2,39 (1Н, м), 2,52 (4Н, т, J=4,9 Гц), 3,49 (4Н, т, J=4,9 Гц), 3,57 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 6,93 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,96-7,02 (1Н, м), 7,69-7,75 (2Н, м).
ИК (Чистый) см-1: 1695, 1655, 1613, 1508, 1425.
Mass m/z: 462 (M+).
Пример 122
Получение 6-(2,4-дифторфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 20, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(2,4-дифторфенил)-2-изобутил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: количественный).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 1,81 (1Н, ушир.), 2,27-2,39 (1Н, м), 2,50-2,56 (4Н, ушир.м), 2,94 (4Н, т, J=4,8 Гц), 3,54 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,3 Гц), 6,93 (1Н, ддд, J=2,4, 8,8, 11,2 Гц), 6,94-7,02 (1Н, м), 7,69-7,76 (2Н, м).
ИК (Чистый) см-1: 3314, 1655, 1613, 1508.
Mass m/z: 362 (M+).
Пример 123
Получение дигидрохлорида 6-(2,4-дифторфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 6-(2,4-дифторфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 90,8%).
Температура плавления: 136,3-140,9°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,93 (6Н, д, J=6,6 Гц), 2,20-2,30 (1Н, м), 2,95 (4Н, т, J=5,0 Гц), 3,02 (4Н, т, J=5,0 Гц), 3,76 (2Н, с), 4,00 (2Н, д, J=7,3 Гц), 7,14-7,20 (1Н, м), 7,26 (1Н, ддд, J=2,7, 8,8, 11,2 Гц), 7,86 (1Н, ддд, J=6,6, 6,6, 8,8 Гц), 7,81 (1Н, с).
ИК (KBr) см-1: 1656, 1616, 1597, 1509, 1426.
Пример 124
Получение 2-бензил-4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
1) Получение 2-бензил-6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-он и бензилхлорид с получением указанного в заголовке соединения в виде желтых игольчатых кристаллов (выход: 71,0%).
Температура плавления: 109,0-110,5°С
1H ЯМР (400 МГц, CDCl3) δ: 2,35 (3Н, д, J=1,7 Гц), 3,96 (3Н, с), 5,44 (2Н, с), 7,10 (1Н, дд, J=8,8, 8,8 Гц), 7,28-7,37 (3Н, м), 7,52 (2Н, д, J=6,3 Гц), 7,57-7,64 (2Н, м), 8,21 (1Н, с).
ИК (KBr) см-1: 1750, 1744, 1657, 1278, 1233, 1123,
Mass m/z: 352 (M+).
2) Получение 2-бензил-4-карбокси-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 65,2%).
Температура плавления: 191,2-192,3°С
1H ЯМР (400 МГц, CDCl3) δ: 2,37 (3Н, д, J=2,0 Гц), 5,52 (2Н, с), 7,13 (1Н, дд, J=8,8, 8,8 Гц), 7,33-7,41 (3Н, м), 7,48-7,52 (2Н, м), 7,64-7,70 (2Н, м), 8,62 (1Н, с), 14,01 (1Н, ушир.).
ИК (KBr) см-1: 1739, 1633, 1569, 1457, 1423, 1240.
Mass m/z: 338 (M+).
3) Получение 2-бензил-6-(4-фтор-3-метилфенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 2-бензил-4-карбокси-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 28,4%).
Температура плавления: 119,5-120,6°С
1H ЯМР (400 МГц, CDCl3) δ: 2,34 (3Н, д, J=1,7 Гц), 3,01 (1Н, т, J=5,9 Гц), 4,70 (2Н, дд, J=1,2, 5,9 Гц), 5,41 (2Н, с), 7,08 (1Н, дд, J=8,8, 8,8 Гц), 7,27-7,37 (3Н, м), 7,48 (1Н, д, J=6,6 Гц), 7,57-7,65 (2Н, м), 7,66 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 3330, 1657, 1643, 1611, 1597, 1506, 1239.
Mass m/z: 324 (M+).
4) Получение 2-бензил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 98,9%).
Температура плавления: 147,6-148,3°С
1H ЯМР (400 МГц, CDCl3) δ: 2,35 (3Н, д, J=2,0 Гц), 3,15 (3Н, с), 5,26 (2Н, д, J =1,2 Гц), 5,41 (2Н, с), 7,09 (1Н, дд, J=8,8, 8,8 Гц), 7,27-7,37 (3Н, м), 7,47 (2Н, д, J=6,6 Гц), 7,62 (1Н, д, J=7,3 Гц), 7,57-7,60 (1Н, м), 7,75 (1Н, с).
ИК (KBr) см-1: 1656, 1617, 1507, 1355, 1168, 1033, 879.
Mass m/z: 402 (M+).
5) Получение 2-бензил-4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 91,8%).
1H ЯМР (400 МГц, CDCl3) δ: 1,46 (9Н, с), 2,35 (3Н, д, J=1,8 Гц), 2,50 (4Н, т, J=4,9 Гц), 3,49 (4Н, т, J=4,9 Гц), 3,56 (2Н, д, J=1,4 Гц), 5,40 (2Н, с), 7,26-7,36 (4Н, м), 7,49 (2Н, д, J=6,6 Гц), 7,55-7,60 (1Н, м), 7,63 (1Н, дд, J=1,8, 7,2 Гц), 7,74 (1Н, с).
Пример 125
Получение дигидрохлорида 2-бензил-6-(4-фтор-3-метилфенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 2-бензил-4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 60,9%).
Температура плавления: 162,7-180,7°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, д, J=2,0 Гц), 3,09 (4Н, ушир.), 3,28 (4Н, т, J=5,2 Гц), 3,89 (2Н, с), 5,36 (2Н, с), 7,21-7,40 (6Н, м), 7,70-7,76 (1Н, м), 7,79 (1Н, дд, J=1,7, 7,3 Гц), 8,16 (1Н, с).
ИК (KBr) см-1: 1656, 1607, 1505, 1239, 1126, 700.
Mass m/z: 392 (M+)
Пример 126
Получение 2-бензил-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 81,3%).
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, с), 2,36 (3Н, д, J=1,8 Гц), 2,53 (4Н, ушир.), 2,61 (4Н, ушир.), 3,57 (2Н, д, J=1,4 Гц), 5,40 (2Н, с), 7,08 (1Н, т, J=8,9 Гц), 7,26-7,36 (3Н, м), 7,49 (2Н, д, J=6,8 Гц), 7,56-7,60 (1Н, м), 7,64 (1Н, дд, J=1,8, 7,2 Гц), 7,73 (1Н, с).
Пример 127
Получение дигидрохлорида 2-бензил-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 78,6%).
Температура плавления: 240,0-242,5°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, д, J=1,7 Гц), 2,76 (3Н, с), 3,10 (4Н, ушир.), 3,33 (4Н, ушир.), 3,84 (2Н, с), 5,36 (2Н, с), 7,21-7,39 (6Н, м), 7,69-7,74 (1Н, м), 7,78 (1Н, дд, J=2,1, 7,8 Гц), 8,09 (1Н, с).
ИК (KBr) см-1: 1653, 1607, 1504, 1454, 1240, 1127.
Mass m/z: 406 (M+)
Пример 128
Получение 2-бензил-4-N,N-бис(2-гидроксиэтил)-аминометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 87,6%).
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, с), 2,69 (4Н, т, J=4,9 Гц), 3,64 (4Н, т, J=5,0 Гц), 3,68 (2Н, с), 5,40 (2Н, с), 7,06 (1Н, т, J=8,9 Гц), 7,26-7,38 (3Н, м), 7,45 (2Н, д, J=7,0 Гц), 7,58-7,68 (2Н, м), 7,75 (1Н, с).
Пример 129
Получение гидрохлорида 2-бензил-4-N,N-бис(2-гидроксиэтил)-аминометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-бензил-4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 75,9%).
Температура плавления: 161,7-163,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (2Н, д, J=2,0 Гц), 3,34 (4Н, т, J=5,2 Гц), 3,83 (4Н, т, J=5,4 Гц), 4,47 (2Н, с), 5,39 (2Н, с), 7,23-7,40 (6Н, м), 7,73-7,77 (1Н, м), 7,82 (1Н, дд, J=1,7, 7,3 Гц), 8,47 (1Н, с).
ИК (KBr) см-1: 1602, 1503, 1239, 1088.
Mass m/z: 393 (M+-H2O)
Пример 130
Получение 2-бензил-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-бензил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 92,7%).
1H ЯМР (400 МГц, CDCl3) δ: 2,34 (9Н, с), 3,49 (2Н, с), 5,40 (2Н, с), 7,06 (1Н, т, J=8,9 Гц), 7,25-7,35 (3Н, м), 7,49 (2Н, д, J=7,4 Гц), 7,58-7,67 (2Н, м), 7,75 (1Н, с).
Пример 131
Получение гидрохлорида 2-бензил-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-бензил-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных хлопьев (выход: 72,6%).
Температура плавления: 225,3-226,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3H, д, J=2,0 Гц), 2,81 (6H, с), 4,28 (2H, с), 5,39 (2H, с), 7,21-7,41 (6H, м),
7,73-7, 78 (1H, м), 7,83 (1Н, дд, J=2,2, 7,6 Гц), 8,52 (1H, с).
ИК (KBr) см-1: 1652, 1610, 1506, 1240, 1126, 702.
Mass m/z: 351 (M+)
Пример 132
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
1) Получение 2-циннамил-6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-он и циннамилбромид с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 58,7%).
Температура плавления: 95,9-96,7°С
1H ЯМР (400 МГц, CDC13) δ: 2,35 (3H, д, J=1,7 Гц), 3,99 (3H, с), 5,04 (2H, дд, J=1,2, 6,8 Гц), 6,45 (1Н, дт, J=15,9, 6,8 Гц), 6,75 (1H, д, J=15,9Гц), 7,10 (1H, дд, J=8,9, 8,9 Гц), 7,20-7,33 (3H, м), 7,39 (2H, д, J=7,1 Гц), 7,58-7,66 (2H, м), 8,23 (1H, с).
ИК (KBr) см-1: 1724, 1661, 1603, 1501, 1292, 1234, 1123.
Mass m/z: 378 (M+).
2) Получение 4-карбокси-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 85,1%).
Температура плавления: 142,8-143,6°С
1H ЯМР (400 МГц, CDC13) δ: 2,36 (3H, д, J=2,0 Гц), 5,12 (2H, дд, J=1,2, 6,8 Гц), 6,42 (1Н, дт, J=15,9, 6,8 Гц), 6,80 (1H, д, J=15,9 Гц), 7,13 (1H, дд, J=8,8, 8,8 Гц), 7,22-7,36 (3H, м), 7,40-7,43 (2H, м), 7,65-7,72 (2H, м), 8,64 (1H, с), 14,04 (1H, ушир.).
ИК (KBr) см-1: 3438, 3061, 2688, 1747, 1637, 1567, 1463, 1244.
Mass m/z: 364 (M+).
3) Получение 2-циннамил-6-(4-фтор-3-метилфенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 20,1%).
Температура плавления: 139,9-140,9°С
1H ЯМР (400 МГц, CDC13) δ: 2,34 (3H, д, J=1,5Гц), 3,00 (1H, ушир.), 4,73 (2H, с), 5,01 (2H, д, J=6,6 Гц), 6,44 (1H, дт, J=15,9, 6,6 Гц), 6,72 (2H, д, J=15,9 Гц), 7,08 (1H, дд, J=8,9, 8,9 Гц), 7,24 (1H, т, J=7,3 Гц), 7,30 (2H, дд, J=7,3, 7,3 Гц), 7,39 (2H, д, J=7,3 Гц), 7,58-7,62 (1Н, м), 7,64 (1H, д, J=7,3 Гц), 7,67 (1Н, с).
ИК (KBr) см-1: 3393, 1655, 1648, 1602, 1505, 1451, 1238, 1077.
Mass m/z: 350 (M+).
4) Получение 2-циннамил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 91,9%).
Температура плавления: 78,4-80,5°С
1H ЯМР (400 МГц, CDC13) δ: 2,35 (3H, д, J=2,0 Гц), 3,17 (3H, с), 5,10 (2H, дд, J=1,2, 6,8 Гц), 5,28 (2H, д, J=1,2 Гц), 6,42 (1H, дт, J=15,9, 6,8 Гц), 6,73 (1H, д, J=15,9 Гц), 7,09 (1Н, дд, J=8,9, 8,9 Гц), 7,21-7,33 (3H, м), 7,40 (2H, д, J=8,8 Гц), 7,57-7,62 (1H, м), 7,64 (1H, д, J=8,8 Гц), 7,77 (1H, т, J=1,3 Гц).
ИК (KBr) см-1: 1663, 1612, 1508, 1355, 1241, 1167, 988, 958, 873.
Mass m/z: 428 (M+).
5) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 87,7%).
1H ЯМР (400 МГц, CDC13) δ: 1,47 (9H, с), 2,35 (3H, д, J=1,6 Гц), 2,52 (4H, т, J=5,0 Гц), 3,51 (4H, т, J=4,9 Гц), 3,59 (2H, д, J=1,4 Гц), 5,00 (2H, дд, J=1,0, 6,6 Гц), 6,45 (1H, дт, J=15,8, 6,6 Гц), 6,12 (1Н, д, J=15,8 Гц), 7,08 (1H, дд, J=8,9, 8,9 Гц), 7,22 (1H, т, J=7,2 Гц), 7,29 (2H, дд, J=7,0, 7,0 Гц), 7,38 (2H, д, J=7,7 Гц), 7,56-7,61 (1H, м), 7,65 (1H, дд, J=1,8, 7,2 Гц), 7,77 (1H, с).
Пример 133
Получение дигидрохлорида 2-циннамил-6-(4-фтор-3-метилфенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 96,0%).
Температура плавления: 171,1-187,1°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, д, J=2,0 Гц), 3,21 (4Н, т, J=4,9 Гц), 3,34 (4Н, т, J=5,1 Гц), 3,99 (2Н, с), 4,95 (2Н, дд, J=1,3, 6,4 Гц), 6,45 (1Н, дт, J=16,1, 6,3 Гц), 6,68 (1Н, д, J=16,1 Гц), 7,20-7,26 (2Н, м), 7,29-7,34 (2Н, м), 7,41-7,45 (2Н, м), 7,73-7,79 (1Н, м), 7,83 (1Н, дд, J=1,7, 7,3 Гц), 8,26 (1Н, с).
ИК (KBr) см-1: 1656, 1605, 1505, 1239, 962.
Mass m/z: 418 (M+)
Пример 134
Получение 2-циннамил-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 80,1%).
1H ЯМР (400 МГц, CDCl3) δ: 2,32 (3Н, с), 2,35 (3Н, д, J=1,8 Гц), 2,51 (4Н, ушир.), 2,62 (4Н, ушир.), 3,59 (2Н, д, J=1,4 Гц), 4,99 (2Н, дд, J=1,1, 6,6 Гц), 6,45 (1Н, дт, J=15,8, 6,0 Гц), 6,72 (1Н, д, J=15,8 Гц), 7,08 (1Н, дд, J=8,9, 8,9 Гц), 7,22 (1Н, тт, J=1,6, 7,2 Гц), 7,29 (2Н, дд, J=7,2, 7,2 Гц), 7,39 (2Н, дд, J=1,4, 7,2 Гц), 7,56-7,61 (1Н, м), 7,65 (1Н, дд, J=1,8, 7,2 Гц), 7,75 (1Н, т, J=1,4 Гц).
Пример 135
Получение дигидрохлорида 2-циннамил-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 66,3%).
Температура плавления: 236,1-237,1°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,32 (3Н, д, J=2,2 Гц), 2,76 (3Н, с), 3,08 (4Н, ушир.), 3,32 (4Н, ушир.), 3,83 (2Н, с), 4,94 (2Н, дд, J=1,2, 6,4 Гц), 6,45 (1Н, дт, J=16,1, 6,3 Гц), 6,67 (1Н, д, J=15,8 Гц), 7,19-7,26 (2Н, м), 7,29-7,34 (2Н, м), 7,41-7,44 (2Н, м), 7,71-7,76 (1Н, м), 7,81 (1Н, дд, J=2,2, 7,6 Гц), 8,07 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1505, 1239, 1129.
Mass m/z: 432 (M+)
Пример 136
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 83,7%).
1H ЯМР (400 МГц, CDCl3) δ: 2,32 (3Н, с), 2,69 (4Н, т, J=4,9 Гц), 3,65 (4Н, д, J=4,9 Гц), 3,69 (2Н, с), 4,98 (2Н, д, J=6,6 Гц), 6,41 (1Н, дт, J=15,8, 6,5 Гц), 6,68 (1Н, д, J=15,8 Гц), 7,05 (1Н, дд, J=8,9, 8,9 Гц), 7,21 (1Н, т, J=7,2 Гц), 7,28 (2Н, дд, J=7,2, 7,2 Гц), 7,37 (2Н, д, J=7,6 Гц), 7,58-7,63 (1Н, м), 7,66 (1Н, дд, J=1,8, 7,2 Гц), 7,81 (1Н, с).
Пример 137
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-2-циннамил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 63,2%).
Температура плавления: 112,5-113,2°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,32 (3Н, д, J=1,9 Гц), 3,35 (4Н, т, J=5,1 Гц), 3,84 (4Н, т, J=5,1 Гц), 4,46 (2Н, с), 4,98 (2Н, дд, J=1,5, 6,1 Гц), 6,45 (1Н, дт, J=15,8, 6,1 Гц), 6,69 (1Н, д, J=16,0 Гц), 7,21-7,27 (2Н, м), 7,29-7,34 (2Н, м), 7,41-7,44 (2Н, м), 7,757,80 (1Н, м), 7,85 (1Н, дд, J=2,0, 7,3 Гц), 8,47 (1Н, с).
ИК (KBr) см-1: 1652, 1604, 1505, 1241, 971.
Mass m/z: 419 (M+-H2O)
Пример 138
Получение 2-циннамил-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-циннамил-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 90,9%).
1H ЯМР (400 МГц, CDCl3) δ: 2,34 (3Н, д, J=2,0 Гц), 2,36 (6Н, с),3,51 (2Н, д, J=1,4 Гц), 5,00 (2Н, дд, J=1,3,6,8 Гц), 6,46 (1Н, дт, J=15,8, 6,6 Гц), 6,72 (1Н, д, J=15,8 Гц), 7,07 (1Н, дд, J=8,9,8,9 Гц), 7,22 (1Н, тт, J=1,4, 7,2 Гц), 7,29 (2Н, дд, J=7,2, 7,2 Гц), 7,39 (2Н, дд, J=1,6, 7,0 Гц), 7,60-7,65 (1Н, м), 7,67 (1Н, дд, J=2,2, 7,2 Гц), 7,76 (1Н, с).
Пример 139
Получение гидрохлорида 2-циннамил-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циннамил-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 81,1%).
Температура плавления: 183,6-184,5°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,32 (3Н, д, J=2,0 Гц), 2,83 (6Н, с), 4,29 (2Н, с), 4,98 (2Н, дд, J=1,3, 6,4 Гц), 6,46 (1Н, дт, J=16,1,6,3 Гц), 6,69 (1Н, д, J=16,1 Гц), 7,22-7,27 (2Н, м), 7,297,35 (2Н, м), 7,41-7,44 (2Н, м), 7,76-7,81 (1Н, м), 7,86 (1Н, дд, J=2,2, 7,3 Гц), 8,50 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1505, 1240, 965.
Mass m/z: 377 (M+)
Пример 140
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
1) Получение 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-он и 4-хлорциннамилхлорид с получением указанного в заголовке соединения в виде желтых игольчатых кристаллов (выход: 71,7%).
Температура плавления: 137,8-138,8°С
1H ЯМР (400 МГц, CDCl3) δ: 2,35 (3Н, д, J=1,7 Гц), 3,99 (3Н, с), 5,03 (2Н, д, J=6,6 Гц), 6,43 (1Н, дт, J=15,6, 6,6 Гц), 6,70 (1Н, д, J=15,6 Гц), 7,10 (1Н, д, J=8,8 Гц), 7,27 (2Н, д, J=8,8 Гц), 7,31 (2Н, д, J=8,8 Гц), 7,58-7,63 (1Н, м), 7,64 (1Н, дд, J=2,1, 7,0 Гц), 8,24 (1Н, с).
ИК (KBr) см-1: 1724, 1709, 1667, 1506, 1291, 1236, 1126, 831.
Mass m/z: 412 (M+), 414 (M+).
2) Получение 4-карбокси-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого кристаллического порошка (выход: 86,2%).
Температура плавления: 186,0-186,6°С
1H ЯМР (400 МГц, CDCl3) δ: 2,36 (3Н, д, J=2,0 Гц), 5,11 (2Н, дд, J=1,2, 6,8 Гц), 6,39 (1Н, дт, J=15,9, 6,8 Гц), 6,75 (1Н, д, J=15,6 Гц), 7,13 (1Н, дд, J=8,8, 8,8 Гц), 7,29 (2Н, д, J=8,5 Гц), 7,33 (2Н, д, J=8,5 Гц), 7,65-7,71 (2Н, м), 8,64 (1Н, с), 13,98 (1Н, ушир.).
ИК (KBr) см-1: 3471, 1738, 1631, 1566, 1490, 1467, 1403, 1242, 812, 802.
Mass m/z: 398 (M+), 400 (M+).
3) Получение 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 17,2%).
Температура плавления: 131,8-133,1°С
1H ЯМР (400 МГц, CDCl3) δ: 2,34 (3Н, д, J=2,0 Гц), 4,73 (2Н, д, J=1,2 Гц), 4,99 (2Н, дд, J=1,0, 6,6 Гц), 6,40 (1Н, дт, J=15,9, 6,6 Гц), 6,75 (1Н, д, J=15,9 Гц), 7,08 (1Н, дд, J=8,9, 8,9 Гц), 7,26 (2Н, д, J=8,8 Гц), 7,31 (2Н, д, J=8,8, Гц), 7,57-7,62 (1Н, м), 7,64 (1Н, дд, J=2,2, 7,3 Гц), 7,69 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 3359, 1653, 1598, 1506, 1492, 1240, 1091, 1076.
Mass m/z: 384 (M+), 386 (M+).
4) Получение 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветных игольчатых кристаллов (выход: 94,9%).
Температура плавления: 117,8-119,5°С
1H ЯМР (400 МГц, CDCl3) δ: 2,35 (3Н, д, J=2,0 Гц), 3,17 (3Н, с), 4,99 (2Н, дд, J=1,2, 6,6 Гц), 5,28 (2Н, д, J=1,2 Гц), 6,38 (1Н, дт, J=15,9, 6,6 Гц), 6,75 (1Н, д, J=15,9 Гц), 7,10 (1Н, дд, J=8,8, 8,8 Гц), 7,27 (2Н, д, J=8,5 Гц), 7,32 (2Н, д, J=8,5, Гц), 7,57-7,65 (2Н, м), 7,78 (1Н, т, J=1,3 Гц).
ИК (KBr) см-1: 1663, 1619, 1506, 1492, 1346, 1240, 1172, 960, 830.
Mass m/z: 462 (M+), 464 (M+).
5) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазинона
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 87,9%).
1H ЯМР (400 МГц, CDCl3) δ: 1,47 (9Н, с), 2,35 (3Н, д, J=1,6 Гц), 2,52 (4Н, т, J=4,9 Гц), 3,50 (4Н, т, J=5,0 Гц), 3,59 (2Н, д, J=1,2 Гц), 4,99 (2Н, дд, J=1,0, 6,6 Гц), 6,42 (1Н, дт, J=15,8, 6,6 Гц), 6,67 (1Н, д, J=16,0 Гц), 7,09 (1Н, дд, J=8,9, 8,9 Гц), 7,25 (2Н, д, J=8,8 Гц), 7,31 (2Н, д, J=8,6 Гц), 7,55-7,61 (1Н, м), 7,64 (1Н, дд, J=2,0, 7,2 Гц), 7,77 (1Н, с).
Пример 141
Получение дигидрохлорида 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-коричневого кристаллического порошка (выход: 84,7%).
Температура плавления: 186,7-197,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, д, J=2,0 Гц), 3,15 (4Н, ушир.), 3,31 (4Н, т, J=5,2 Гц), 3,94 (2Н, с), 4,95 (2Н, дд, J=1,3,6,3 Гц), 6,47 (1Н, дт, J=15,9, 6,1 Гц), 6,66 (1Н, д, J=15,9 Гц), 7,22 (1Н, дд, J=9,0, 9,0 Гц), 7,34 (2Н, д, J=8,6 Гц), 7,45 (2Н, д, J=8,6 Гц), 7,73-7,78 (1Н, м), 7,82 (1Н, дд, J=1,9, 7,6 Гц), 8,21 (1Н, с).
ИК (KBr) см-1: 1656, 1606, 1240, 1090, 964.
Mass m/z: 452 (M+), 454 (M+).
Пример 142
Получение 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 71,8%).
1H ЯМР (400 МГц, CDCl3) δ: 2,32 (3Н, с), 2,35 (3Н, с), 2,51 (4Н, ушир.), 2,62 (4Н, ушир.),3,59 (2Н, с), 4,99 (2Н, д, J=6,6 Гц), 6,42 (1Н, дт, J=15,8,6,4 Гц), 6,66 (1Н, д, J=15,9 Гц),7,09 (1Н, дд, J=8,9, 8,9 Гц),7,24 (2Н, д, J=8,6 Гц), 7,30 (2Н, д, J=8,6 Гц), 7,56-7,62 (1Н, м), 7,65 (1Н, дд, J=1,8, 7,2 Гц), 7,76 (1Н, с).
Пример 143
Получение дигидрохлорида 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 80,4%).
Температура плавления: 229,7-243,3°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, д, J=1,8 Гц), 2,76 (3Н, с), 3,09 (4Н, ушир.), 3,33 (4Н, ушир.), 3,83 (2Н, с), 4,94 (2Н, дд, J=1,2, 6,0 Гц), 6,42 (1Н, дт, J=16,0, 6,2 Гц), 6,65 (1Н, д, J=16,0 Гц), 7,22 (1Н, дд, J=9,1, 9,1 Гц), 7,34 (2Н, д, J=8,6 Гц), 7,45 (2Н, д, J=8,6 Гц), 7,71-7,76 (1Н, м), 7,80 (1Н, дд, J=2,2, 7,0 Гц), 8,08 (1Н, с).
ИК (KBr) см-1: 1652, 1608, 1492, 1239, 1130.
Mass m/z: 466 (M+), 468 (M+).
Пример 144
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 76,6%).
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, с), 2,70 (4Н, т, J=4,5 Гц), 3,66 (4Н, т, J=4,9 Гц), 3,70 (2Н, с), 4,98 (2Н, д, J=6,6 Гц), 6,36 (1Н, дт, J=15,8, 6,5 Гц), 6,63 (1Н, д, J=15,8 Гц), 7,06 (1Н, дд, J=8,6, 8,6 Гц), 7,24 (2Н, д, J=8,6 Гц), 7,30 (2Н, д, J=8,2 Гц), 7,58-7,63 (1Н, м), 7,65 (1Н, дд, J=1,8, 7,2 Гц), 7,78 (1Н, с).
Пример 145
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 76,1%).
Температура плавления: 151,9-153,4°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,32 (3Н, д, J=1,7 Гц), 3,35 (4Н, т, J=5,1 Гц), 3,83 (4Н, т, J=5,4 Гц), 4,46 (2Н, с), 4,97 (2Н, дд, J=1,2, 6,1 Гц), 6,48 (1Н, дт, J=15,9, 6,2 Гц), 6,67 (1Н, д, J=15,9 Гц), 7,24 (1Н, дд, J=9,1, 9,1 Гц), 7,35 (2Н, д, J=8,8 Гц), 7,45 (2Н, д, J=8,6 Гц), 7,75-7,80 (1Н, м), 7,85 (1Н, дд, J=1,7,7,9 Гц), 8,48 (1Н, с).
ИК (KBr) см-1: 1652, 1604, 1492, 1240, 1090, 968.
Mass m/z: 440 (M+), 442 (M+).
Пример 146
Получение 2-(4-хлорциннамил)-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 84,6%).
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, д, J=1,6 Гц), 2,36 (6Н, с), 3,52 (2Н, д, J=1,2 Гц), 4,99 (2Н, дд, J=1,0, 6,6 Гц), 6,43 (1Н, дт, J=15,8, 6,6 Гц), 6,66 (1Н, д, J=15,8 Гц), 7,07 (1Н, дд, J=8,9,8,9 Гц), 7,24 (2Н, д, J=8,6 Гц), 7,30 (2Н, д, J=8,6 Гц), 7,60-7,68 (2Н, м), 7,77 (1Н, с).
Пример 147
Получение гидрохлорида 2-(4-хлорциннамил)-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-(4-хлорциннамил)-4-диметиламинометил-6-(4-фтор-3-метилфенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 34,4%).
Температура плавления: 201,3-201,9°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,32 (3Н, д, J=1,7 Гц), 2,83 (6Н, с), 4,28 (2Н, с),4,98 (2Н, дд, J=1,3, 6,1 Гц), 6,48 (1Н, дт, J=16,1, 6,1 Гц), 6,67 (1Н, д, J=16,1 Гц), 7,24 (1Н, дд, J=9,3, 9,3 Гц), 7,35 (2Н, д, J=8,6 Гц), 7,45 (2Н, д, J=8,6 Гц), 7,75-7,80 (1Н, м), 7,85 (1Н, дд, J=2,3, 7,6 Гц), 8,47 (1Н, с).
ИК (KBr) см-1: 1652, 1608, 1491, 1239, 968.
Mass m/z: 411 (M+), 413 (M+).
Пример 148
Получение 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
1) Получение 4-карбокси-2-циклопропилметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-циклопропилметил-4-метоксикарбонил-6-[4-(метилтио)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого кристаллического порошка (выход: 98,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,50-0,66 (4Н, м), 1,40-1,53 (1Н, м), 2,54 (3Н, с), 4,24 (2Н, д, J=7,4 Гц), 7,34 (2Н, д, J=8,6 Гц), 7,78 (2Н, д, J=8,6 Гц), 8,66 (1Н, с), 14,22 (1Н, с).
ИК (KBr) см-1: 3430, 1752, 1631, 1472, 1452, 1403, 1093, 825.
Mass m/z: 316 (M+)
2) Получение 2-циклопропилметил-4-гидроксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-циклопропилметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 22,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,60 (4Н, м), 1,37-1,46 (1Н, м), 2,53 (3Н, с), 3,09 (1Н, т, J=6,1 Гц), 4,11 (2Н, д, J=7,2 Гц), 4,72 (2Н, д, J=6,0 Гц), 7,32 (2Н, д, J=8,6 Гц), 7,67 (1Н, с), 7,74 (2Н, д, J=8,6 Гц).
ИК (KBr) см-1: 3393, 1657, 1602, 1514, 1095, 822.
Mass m/z: 302 (M+).
3) Получение 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-циклопропилметил-4-гидроксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых тонких игольчатых кристаллов (выход: 78,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-1,61 (4Н, м), 1,37-1,47 (1Н, м), 2,53 (3Н, с), 3,17 (3Н, с), 4,11 (2Н, д, J=7,2 Гц), 5,28 (2Н, с), 7,33 (2Н, д, J=8,4 Гц), 7,74 (2Н, д, J=8,4 Гц), 7,79 (1Н, с).
ИК (KBr) см-1: 3446, 1652, 1607, 1359, 1178, 1024, 829.
Mass m/z: 380 (M+).
4) Получение 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 85,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,58 (4Н, м), 1,36-1,48 (1Н, м), 2,33 (3Н, с), 2,53 (3Н, с), 2,47-2,66 (8Н, м), 3,59 (2Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,33 (2Н, д, J=8,3 Гц), 7,75 (2Н, д, J=8,3 Гц), 7,78 (1Н, с).
Пример 149
Получение дигидрохлорида 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-метилтио)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 69,1%).
Температура плавления: 234,6-239,2°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,40-0,45 (2Н, м), 0,50-0,56 (2Н, м), 1,30-1,40 (1Н, м), 2,53 (3Н, с), 2,77 (3Н, с), 2,97 (4Н, ушир.), 3,28 (4Н, ушир.), 3,72 (2Н, с), 4,05 (2Н, д, J=7,1 Гц), 7,39 (2Н, д, J=8,6 Гц), 7,82 (2Н, д, J=8,3 Гц), 7,96 (1Н, с).
ИК (KBr) см-1: 3438, 1651, 1606, 1402, 1095.
Mass m/z: 384 (M+).
Пример 150
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 78,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,59 (4Н, м), 1,36-1,45 (1Н, м), 2,53 (3Н, с), 2,73 (4Н, ушир.), 3,67 (4Н, т, J=4,9 Гц), 3,73 (2Н, с), 4,13 (2Н, д, J=7,3 Гц), 7,32 (2Н, д, J=8,3 Гц), 7,70 (1Н, с), 7,74 (2Н, д, J=8,3 Гц).
Пример 151
Получение гидрохлорида 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-[4-метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого твердого вещества (выход: 75,1%).
Температура плавления: 169,2-171,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,42-0,46 (2Н, м), 0,52-0,57 (2Н, м), 1,30-1,40 (1Н, м), 2,53 (3Н, с), 3,31 (4Н, ушир.), 3,81 (4Н, т, J=5,3 Гц), 4,42 (2Н, с), 7,41 (2Н, д, J=8,8 Гц), 7,85 (2Н, д, J=9,0 Гц), 8,37 (1Н, с).
ИК (KBr) см-1: 3242, 1652, 1604, 1420, 1094, 1059, 823.
Mass m/z: 358 (M+-CH2OH).
Пример 152
Получение 2-циклопропилметил-4-диметиламинометил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 98,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,58 (4Н, м), 1,36-1,48 (1Н, м), 2,35 (6Н, с), 3,51 (2Н, с), 4,51 (2Н, д, J=7,3 Гц), 7,31 (2Н, д, J=8,3 Гц), 7,77 (2Н, д, J=7,8 Гц), 7,78 (1Н, с).
Пример 153
Получение гидрохлорида 2-циклопропилметил-4-диметиламинометил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-4-диметиламинометил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 75,5%).
Температура плавления: 230,2-232,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,42-0,46 (2Н, м), 0,52-0,58 (2Н, м), 1,31-1,40 (1Н, м), 2,53 (3Н, с), 2,82 (6Н, с), 4,09 (2Н, д, J=7,1 Гц), 4,25 (2Н, с), 7,41 (2Н, д, J=8,6 Гц), 7,84 (2Н, д, J=8,5 Гц), 8,34 (1Н, с).
ИК (KBr) см-1: 3435, 1646, 1604, 1402, 1093, 829.
Mass m/z: 329 (M+).
Пример 154
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-[4-(метилтио)-фенил]-2H-пиридазин-3-она
1) Получение 4-карбокси-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
К раствору 4-метоксикарбонил-6-[4-(метилтио)-фенил]-2H-пиридазин-3-она (8,00 г, 29,0 ммоль) в N,N-диметилформамиде (80 мл) добавляли карбонат калия (8,02 g, 58,0 ммоль) и изобутилбромид (4,76 г, 34,8 ммоль) и смесь перемешивали при 80°С в течение 2 час. Температуре реакционной смеси давали снова понизиться до комнатной и добавляли насыщенный водный раствор гидрокарбоната натрия. Затем смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли. Следуя методике примера 1(7), остаток подвергали взаимодействию с получением указанного в заголовке соединения в виде желтого твердого вещества [выход: 65,1% (2 стадии)].
1H ЯМР (400 МГц, CDCl3) δ: 1,01 (6Н, д, J=6,6 Гц), 2,33-2,46 (1Н, м), 2,54 (3Н, с), 4,21 (2Н, д, J=7,4 Гц), 7,34 (2Н, д, J=8,4 Гц), 7,80 (2Н, д, J=8,4 Гц), 8,68 (1Н, с), 12,72 (1Н, с).
Mass m/z: 318 (M+).
2) Получение 4-гидроксиметил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 35,3%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,27-2,39 (1Н, м), 2,53 (3Н, с), 4,08 (2Н, д, J=7,4 Гц), 4,71 (2Н, д, J=5,9 Гц), 7,26 (2Н, д, J=8,4 Гц), 7,66 (1Н, с), 7,73 (2Н, д, J=8,6 Гц).
3) Получение 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 4-гидроксиметил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 73,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,28-2,40 (1Н, м), 2,53 (3Н, с), 3,17 (3Н, с), 4,08 (2Н, д, J=7,4 Гц), 5,27 (2Н, д, J=1,2 Гц), 7,32 (2Н, д, J=8,4 Гц), 7,73 (2Н, д, J=8,4 Гц), 7,75 (1Н, д, J=1,4 Гц).
Mass m/z: 382 (M+).
4) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-6-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 88,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 1,47 (9Н, с), 2,28-2,40 (1Н, м), 2,50-2,55 (4Н, м), 2,53 (3Н, с), 3,50 (4Н, т, J=4,8 Гц), 3,58 (2Н, с), 4,07 (2Н, д, J=7,4 Гц), 7,32 (2Н, д, J=8,4 Гц), 7,73 (2Н, д, J=8,6 Гц), 7,78 (1Н, с).
Пример 155
Получение дигидрохлорида 2-изобутил-6-[4-(метилтио)фенил]-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого кристаллического порошка (выход: 70,5%).
Температура плавления: 248,5-253,7°С (разл.).
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,6 Гц), 2,21-2,33 (1Н, м), 2,52 (3Н, с), 3,10 (4Н, т, J=4,8 Гц), 3,30 (4Н, т, J=5,2 Гц), 3,90 (2Н, с), 4,01 (2Н, д, J=7,3 Гц), 7,39 (2Н, д, J=8,3 Гц), 7,83 (2Н, д, J=8,3 Гц), 8,15 (1Н, с).
ИК (KBr) см-1: 2961, 2442, 1640, 1596, 1511, 1433, 1406, 1089, 912.
Mass m/z: 372 (M+).
Пример 156
Получение 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 68,3%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,29-2,39 (1Н, м), 2,32 (3Н, с), 2,51 (4Н, ушир.), 2,53 (3Н, с), 2,62 (4Н, ушир.), 3,58 (2Н, д, J=1,4 Гц), 4,07 (2Н, д, J=7,4 Гц), 7,33 (2Н, д, J=8,6 Гц), 7,74 (2Н, д, J=6,8 Гц), 7,76 (1Н, с).
Пример 157
Получение дигидрохлорида 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 86,4%).
Температура плавления: 242,6-243,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,21-2,33 (1Н, м), 2,52 (3Н, с), 2,76 (3Н, с), 3,09 (4Н, ушир.), 3,33 (4Н, ушир.), 3,83 (2Н, с), 4,01 (2Н, д, J=7,1 Гц), 7,39 (2Н, д, J=8,6 Гц), 7,82 (2Н, д, J=8,5 Гц), 8,07 (1Н, с).
ИК (KBr) см-1: 3432, 2957, 2437, 1652, 1607, 1090, 953.
Mass m/z: 386 (M+).
Пример 158
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 71,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,96 (6Н, д, J=6,6 Гц), 2,27-2,39 (1Н, м), 2,51 (3Н, с), 2,71 (4Н, т, J=5,1 Гц), 3,66 (4Н, т, J=5,1 Гц), 3,70 (2Н, с), 4,08 (2Н, д, J=7,2 Гц), 7,30 (2Н, д, J=8,6 Гц), 7,71-7,76 (3Н, м).
Пример 159
Получение оксалата 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
К раствору 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она (69,7 мг, 0,18 ммоль) в метаноле (1 мл) добавляли при комнатной температуре дигидрат щавелевой кислоты (22,4 мг, 0,18 ммоль). Растворитель отгоняли. Остаток перекристаллизовывали из смеси хлороформ-диэтиловый эфир с получением указанного в заголовке соединения в виде белого твердого вещества (59,5 мг, 69,4%).
Температура плавления: 116,4-118,1°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,94 (6Н, д, J=6,6 Гц), 2,20-2,33 (1Н, м), 2,52 (3Н, с), 2,91 (4Н, т, J=5,8 Гц), 3,61 (4Н, т, J=5,6 Гц), 3,94 (2Н, с), 4,01 (2Н, д, J=7,3 Гц), 7,39 (2Н, д, J=8,6 Гц), 7,81 (2Н, д, J=8,6 Гц), 8,14 (1Н, с).
ИК (KBr) см-1: 3344, 2927, 1659, 1611, 1402, 1049, 721.
Mass m/z: 360 (M+-CH2OH).
Пример 160
Получение 4-диметиламинометил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 73,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,29-2,41 (1Н, м), 2,36 (6Н, с), 2,52 (3Н, с), 3,52 (2Н, д, J=1,2 Гц), 4,07 (2Н, д, J=7,4 Гц), 7,31 (2Н, д, J=8,6 Гц), 7,77 (2Н, д, J=8,4 Гц), 7,79 (1Н, с).
Пример 161
Получение гидрохлорида 4-диметиламинометил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-2-изобутил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 82,3%).
Температура плавления: 216,8-218,4°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,8 Гц), 2,23-2,36 (1Н, м), 2,53 (3Н, с), 2,82 (6Н, с), 4,05 (2Н, д, J=7,1 Гц), 4,27 (2Н, с), 7,41 (2Н, д, J=8,3 Гц), 7,84 (2Н, д, J=8,3 Гц), 8,42 (1Н, с).
ИК (KBr) см-1: 3485, 1740, 1684, 1253, 856, 577.
Mass m/z: 331 (M+).
Пример 162
Получение 2-изобутил-6-[4-(метилтио)фенил]-4-пропаргиламинометил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-он и пропаргиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 52,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,26 (1Н, т, J=2,3 Гц), 2,29-2,40 (1Н, м), 2,52 (3Н, с), 3,51 (2Н, д, J=2,4 Гц), 3,90 (2Н, с), 4,07 (2Н, д, J=7,4 Гц), 7,31 (2Н, д, J=8,4 Гц), 7,70 (1Н, с), 7,73 (2Н, д, J=8,4 Гц).
Пример 163
Получение гидрохлорида 2-изобутил-6-[4-(метилтио)фенил]-4-пропаргиламинометил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-6-[4-(метилтио)фенил]-4-пропаргиламинометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде белого твердого вещества (выход: 73,6%).
Температура плавления: 197,5-198,4°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,6 Гц), 2,23-2,36 (1Н, м), 2,53 (3Н, с), 3,48 (1Н, т, J=2,4 Гц), 3,95 (2Н, д, J=2,4 Гц), 4,03 (2Н, д, J=7,1 Гц), 4,17 (2Н, с), 7,41 (2Н, д, J=8,3 Гц), 7,82 (2Н, д, J=8,6 Гц), 8,28 (1Н, с).
ИК (KBr) см-1: 3447, 3207, 2958, 2122, 1651, 1607, 1441, 1093.
Mass m/z: 341 (M+).
Пример 164
Получение 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
1) Получение 2-циклопропилметил-4-метансульфонилокси-метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
К раствору 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она (300 мг, 0,79 ммоль) в метиленхлориде (10 мл) добавляли по каплям при -20°С раствор 3-хлорпербензойной кислоты (204 мг, 1,12 ммоль) в метиленхлориде (2 мл) и при той же температуре смесь перемешивали в течение 30 мин. К реакционной смеси добавляли 10% раствор гидросульфита натрия и затем смесь экстрагировали хлороформом. Экстракт последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (139 мг, 44,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,48-0,63 (4Н, м), 1,37-1,46 (1Н, м), 2,77 (3Н, с), 3,18 (3Н, с), 4,14 (2Н, д, J=7,3 Гц), 5,30 (2Н, д, J=1,4 Гц), 7,76 (2Н, д, J=8,6 Гц), 7,84 (1Н, т, J=1,4 Гц), 7,98 (2Н, д, J=8,8 Гц).
Mass m/z: 396 (M+).
2) Получение 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропил-4-метансульфонилоксиметил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 60,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,46-0,60 (4Н, м), 1,37-1,49 (1Н, м), 2,34 (3Н, с), 2,54 (4Н, ушир.), 2,64 (4Н, ушир.), 2,78 (3Н, с), 3,61 (2Н, с), 4,13 (2Н, д, J=7,2 Гц), 7,75 (2Н, д, J=8,2 Гц), 7,84 (1Н, с), 7,99 (2Н, д, J=8,2 Гц).
Пример 165
Получение дигидрохлорида 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 64,3%).
Температура плавления: 80°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,41-0,57 (4Н, м), 1,30-1,41 (1Н, м), 2,76 (3Н, с), 2,77 (3Н, с), 3,01 (4Н, ушир.), 3,31 (4Н, ушир.), 3,77 (2Н, с), 4,08 (2Н, д, J=6,8 Гц), 7,80 (2Н, д, J=8,3 Гц), 8,05-8,09 (3Н, м).
ИК (KBr) см-1: 3430, 3005, 1652, 1607, 1458, 1401, 1010, 838.
Mass m/z: 400 (M+).
Пример 166
Получение 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
1) Получение 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 164 (1), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 54,3%).
1H ЯМР (400 МГц, CDCl3) δ: 1,00 (6Н, д, J=6,8 Гц), 2,29-2,41 (1Н, м), 2,77 (3Н, с), 3,18 (3Н, с), 4,11 (2Н, д, J=7,3 Гц), 5,29 (2Н, д, J=1,5 Гц), 7,76 (2Н, д, J=8,8 Гц), 7,83 (1Н, т, J=1,2 Гц), 7,98 (2Н, д, J=8,6 Гц).
Mass m/z: 398 (M+).
2) Получение 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 61,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,30-2,41 (1Н, м), 2,34 (3Н, с), 2,54 (4Н, ушир.), 2,64 (4Н, ушир.), 2,77 (3Н, с), 3,60 (2Н, с), 4,10 (2Н, д, J=7,4 Гц), 7,75 (2Н, д, J=8,2 Гц), 7,82 (1Н, с), 7,99 (2Н, д, J=8,2 Гц).
Пример 167
Получение дигидрохлорида 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфинил)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 76,1%).
Температура плавления: 224,5-229,1°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,6 Гц), 2,22-2,35 (1Н, м), 2,76 (3Н, с), 2,77 (3Н, с), 3,14 (4Н, ушир.), 3,35 (4Н, ушир.), 3,87 (2Н, с), 4,04 (2Н, д, J=7,1 Гц), 7,80 (2Н, д, J=8,3 Гц), 8,07 (2Н, д, J=8,3 Гц), 8,18 (1Н, с).
ИК (KBr) см-1: 3426, 2960, 1656, 1608, 1459, 1400, 1044, 1011.
Mass m/z: 402 (M+).
Пример 168
Получение 4-диметиламинометил-2-изобутил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 46,2%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,43 (1Н, м), 2,38 (6Н, с), 2,76 (3Н, с), 3,54 (2Н, с), 4,10 (2Н, д, J=7,4 Гц), 7,74 (2Н, д, J=8,2 Гц), 7,87 (1Н, с), 8,02 (2Н, д, J=8,2 Гц).
Пример 169
Получение гидрохлорида 4-диметиламинометил-2-изобутил-6-[4-(метилсульфинил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-2-изобутил-6-[4-(метилсульфинил)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 77,4%).
Температура плавления: 204,2-206,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,97 (6Н, д, J=6,6 Гц), 2,24-2,36 (1Н, м), 2,78 (3Н, с), 2,83 (6Н, с), 4,07 (2Н, д, J=7,1 Гц), 4,28 (2Н, с), 7,82 (2Н, д, J=8,3 Гц), 8,09 (2Н, д, J=8,3 Гц), 8,49 (1Н, с).
ИК (KBr)см-1: 3438, 2961, 1652, 1607, 1467, 1400, 1047.
Mass m/z: 347 (M+).
Пример 170
Получение 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
1) Получение 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
К раствору 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилтио)фенил]-2H-пиридазин-3-она (226 мг, 0,59 ммоль) в метиленхлориде (10 мл) добавляли по каплям при -20°С раствор 3-хлорпербензойной кислоты (410 мг, 2,38 ммоль) в метиленхлориде (2 мл) и при той же температуре смесь перемешивали в течение 30 мин. К реакционной смеси добавляли 10% водный раствор гидросульфита натрия и затем смесь экстрагировали хлороформом. Экстракт последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (209 мг, 85,3%).
1H ЯМР (400 МГц, CDCl3) δ: 0,46-0,63 (4Н, м), 1,37-1,46 (1Н, м), 3,10 (3Н, с), 3,18 (3Н, с), 4,20 (2Н, д, J=7,3 Гц), 5,31 (2Н, д, J=1,2 Гц), 7,86 (1Н, т, J=1,2 Гц), 8,02 (2Н, д, J=8,8 Гц), 8,06 (2Н, д, J=9,0 Гц).
Mass m/z: 412 (M+).
2) Получение 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропил-4-метансульфонилоксиметил-6-[4-метилсульфонил)-фенил]-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 80,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,46-0,61 (4Н, м), 1,38-1,48 (1Н, м), 2,34 (3Н, с), 2,54 (4Н, ушир.), 2,64 (4Н, ушир.), 3,10 (3Н, с), 3,61 (2Н, д, J=1,2 Гц), 4,13 (2Н, д, J=7,1 Гц), 7,85 (1Н, т, J=1,2 Гц), 8,03 (2Н, д, J=9,0 Гц), 8,05 (2Н, д, J=9,0 Гц).
Пример 171
Получение дигидрохлорида 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 76,8%).
Температура плавления: 209,0-211,4°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,41-0,46 (2Н, м), 0,52-0,57 (2Н, м), 1,31-1,41 (1Н, м), 2,77 (3Н, с), 3,04 (4Н, ушир.), 3,21 (3Н, с), 3,31 (4Н, ушир.), 3,80 (2Н, с), 4,09 (2Н, д, J=7,1 Гц), 8,04 (2Н, д, J=8,3 Гц), 8,12 (1Н, с), 8,14 (2Н, д, J=8,3 Гц).
ИК (KBr) см-1: 3434, 3012, 1652, 1596, 1458, 1402, 1302, 1150.
Mass m/z: 416 (M+).
Пример 172
Получение 2-циклопропилметил-4-диметиламинометил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 65,6%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,62 (4Н, м), 1,39-1,49 (1Н, м), 2,38 (6Н, с), 3,09 (3Н, с), 3,55 (2Н, с), 4,14 (2Н, д, J=7,2 Гц), 7,89 (1Н, с), 8,02 (2Н, д, J=8,4 Гц), 8,06 (2Н, д, J=8,6 Гц).
Пример 173
Получение гидрохлорида 2-циклопропилметил-4-диметиламинометил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-4-диметиламинометил-6-[4-(метилсульфонил)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 63,4%).
Температура плавления: 239,5-240,7°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,43-0,59 (4Н, м), 1,33-1,43 (1Н, м), 2,83 (6Н, с), 3,23 (3Н, с), 4,13 (2Н, д, J=7,1 Гц), 4,29 (2Н, с), 8,06 (2Н, д, J=7,8 Гц), 8,17 (2Н, д, J=8,3 Гц), 8,57 (1Н, с).
ИК (KBr) см-1: 3447, 2674, 1646, 1608, 1596, 1306, 1150, 777.
Mass m/z: 361 (M+).
Пример 174
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-[4-(метил-сульфонил)фенил]-2H-пиридазин-3-она
1) Получение 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 170 (1), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилтио)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 97,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,41 (1Н, м), 3,10 (3Н, с), 3,18 (3Н, с), 4,12 (2Н, д, J=7,3 Гц), 5,29 (2Н, д, J=1,2 Гц), 7,85 (1Н, т, J=1,4 Гц), 8,02 (2Н, д, J=8,8 Гц), 8,05 (2Н, д, J=8,8 Гц).
Mass m/z: 414 (M+).
2) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 75,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 1,47 (9Н, с), 2,29-2,41 (1Н, м), 2,54 (4Н, ушир.), 3,09 (3Н, с), 3,51 (4Н, ушир.), 3,60 (2Н, с), 4,11 (2Н, д, J=7,2 Гц), 7,86 (1Н, с), 8,02 (2Н, д, J=8,8 Гц), 8,05 (2Н, д, J=8,8 Гц).
Пример 175
Получение дигидрохлорида 2-изобутил-6-[4-(метилсульфонил)фенил]-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 2, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-изобутил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 88,2%).
Температура плавления: 222,4-224,2°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,96 (6Н, д, J=6,8 Гц), 2,22-2,35 (1Н, м), 3,06 (4Н, ушир.), 3,21 (3Н, с), 3,28 (4Н, т, J=5,2 Гц), 3,87 (2Н, с), 4,05 (2Н, д, J=7,1 Гц), 8,04 (2Н, д, J=8,6 Гц), 8,14 (2Н, д, J=8,3 Гц), 8,22 (1Н, с).
ИК (KBr) см-1: 3421, 2957, 1656, 1611, 1597, 1305, 1149, 961.
Mass m/z: 404 (M+).
Пример 176
Получение 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 88,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,28-2,40 (1Н, м), 2,37 (3Н, с), 2,53 (4Н, ушир.), 2,63 (4Н, ушир.), 3,10 (3Н, с), 3,60 (2Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,84 (1Н, с), 8,02 (2Н, д, J=9,0 Гц), 8,05 (2Н, д, J=8,8 Гц).
Пример 177
Получение дигидрохлорида 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-изобутил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилсульфонил)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 62,0%).
Температура плавления: 224,5-228,0°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,23-2,35 (1Н, м), 2,76 (3Н, с), 3,08 (4Н, ушир.), 3,21 (3Н, с), 3,32 (4Н, ушир.), 3,83 (2Н, с), 4,05 (2Н, д, J=7,1 Гц), 8,04 (2Н, д, J=8,3 Гц), 8,13 (2Н, д, J=8,5 Гц), 8,15 (1Н, с).
ИК (KBr) см-1: 3447, 2958, 1652, 1610, 1596, 1319, 1152, 955.
Mass m/z: 418 (M+).
Пример 178
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-изобутил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 51,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,6 Гц), 2,28-2,40 (1Н, м), 2,73 (4Н, т, J=4,8 Гц), 3,08 (3Н, с), 3,68 (4Н, т, J=4,9 Гц), 3,73 (2Н, с), 4,11 (2Н, д, J=7,4 Гц), 7,93 (1Н, с), 8,00 (2Н, д, J=8,6 Гц), 8,05 (2Н, д, J=8,8 Гц).
Mass m/z: 392 (M+-CH2OH).
Пример 179
Получение 4-диметиламинометил-2-изобутил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-изобутил-4-метансульфонилоксиметил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 82,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,30-2,41 (1Н, м), 2,37 (6Н, с), 3,09 (3Н, с), 3,52 (2Н, с), 4,11 (2Н, д, J=7,2 Гц), 7,86 (1Н, с), 8,02 (2Н, д, J=8,8 Гц), 8,05 (2Н, д, J=8,8 Гц).
Пример 180
Получение гидрохлорида 4-диметиламинометил-2-изобутил-6-[4-(метилсульфонил)фенил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-диметиламинометил-2-изобутил-6-[4-(метилсульфонил)-фенил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 58,6%).
Температура плавления: 221,4-223,3°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,97 (6Н, д, J=6,6 Гц), 2,25-2,36 (1Н, м), 2,82 (6Н, с), 3,22 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 4,28 (2Н, с), 8,06 (2Н, д, J=8,3 Гц), 8,15 (2Н, д, J=8,5 Гц), 8,55 (1Н, с).
ИК (KBr) см-1: 3447, 2963, 1653, 1609, 1597, 1307, 1152, 777.
Mass m/z: 363 (M+).
Пример 181
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-пирролидинометил-2H-пиридазин-3-он
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и пирролидин с получением указанного в заголовке соединения в виде желтого масла (выход: 75,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,61 (4Н, м), 1,42 (1Н, м), 1,85-2,00 (4Н, м), 2,70-3,00 (4Н, м), 3,83 (2Н, ушир.с), 3,94 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,60 (1Н, д, J=8,5 Гц), 7,65 (1Н, дд, J=8,5, 2,0 Гц), 8,00 ( 1Н, ушир.с).
ИК (Чистый) см-1: 1652, 1608, 1523, 1438, 1286, 758.
Mass m/z: 357 (M+).
Пример 182
Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он и циклопентилметилбромид {J. Org. Chem., 36, 3103 (1971)} с получением указанного в заголовке соединения в виде желтых игольчатых кристаллов (выход: 72,0%).
Температура плавления: 56-66°С
1H ЯМР (400 МГц, CDCl3) δ: 1,30-1,45 (2Н, м), 1,53-1,65 (2Н, м), 1,65-1,80 (4Н, м), 2,57 (1Н, м), 3,95 (3Н, с), 3,98 (3Н, с), 4,24 (2Н, д, J=7,8 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,50 (1Н, д, J=8,8 Гц), 7,61 (1Н, д, J=10,2 Гц), 8,19 (1Н, с).
2) Получение 4-карбокси-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 71,1%).
Температура плавления: 159-161°С
1H ЯМР (400 МГц, CDCl3) δ: 1,33-1,45 (2Н, м), 1,58-1,65 (2Н, м), 1,68-1,82 (4Н, м), 2,57 (1Н, м), 3,97 (3Н, с), 4,32 (2Н, д, J=7,6 Гц), 7,06 (1Н, дд, J=8,5, 8,5 Гц), 7,56 (1Н, д, J=8,5 Гц), 7,68 (1Н, дд, J=12,2, 2,0 Гц), 8,61 (1Н, с).
3) Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 47,3%).
Температура плавления: 130-133°С
1H ЯМР (400 МГц, CDCl3) δ: 1,30-1,42 (2Н, м), 1,50-1,62 (2Н, м), 1,62-1,80 (4Н, м), 2,54 (1Н, м), 3,95 (3Н, с), 4,19 (2Н, д, J=7,6 Гц), 4,71 (2Н, с), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,51 (1Н, д, J=8,5 Гц), 7,62 (1Н, дд, J=12,8, 1,5 Гц), 7,63 (1Н, с).
4) Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 75,3%).
Температура плавления: 108-116°С
1H ЯМР (400 МГц, CDCl3) δ: 1,25-1,32 (2Н, м), 1,32-1,45 (2Н, м), 1,65-1,77 (4Н, м), 2,54 (1Н, м), 3,17 (3Н, с), 3,95 (3Н, с), 4,19 (2Н, д, J=7,6 Гц), 5,27 (2Н, с), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,50 (1Н, д, J=8,5 Гц), 7,62 (1Н, дд, J=12,2, 2,2 Гц), 7,74 (1Н, с).
5) Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 61,4%).
1H ЯМР (400 МГц, CDCl3) δ: 1,32-1,42 (2Н, м), 1,50-1,60 (2Н, м), 1,65-1,80 (4Н, м), 2,38, 2,40 (каждый с, всего 3H), 2,54 (1Н, м), 2,60-2,75 (8Н, м), 3,59 (2Н, с), 3,95 (3Н, с), 4,18 (2Н, д, J=7,6 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,54 (1Н, д, J=8,5 Гц), 7,61 (1Н, дд, J=8,5, 2,2 Гц), 7,72 (1Н, с).
ИК (Чистый) см-1: 1652, 1608, 1523, 1439, 1286, 760.
Mass m/z: 414 (M+).
Пример 183
Получение дигидрохлорида 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-коричневого кристаллического порошка (выход: 59,6%).
Температура плавления: 234-236°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 1,28-1,40 (2Н, м), 1,48-1,56 (2Н, м), 1,60-1,73 (4Н, м), 2,46 (1Н, м), 2,82 (3Н, с), 3,50-3,75 (10Н, м), 3,91 (3Н, с), 4,10 (2Н, д, J=7,6 Гц), 7,31 (1Н, дд, J=8,8, 8,8 Гц), 7,68-7,76 (2Н, м), 8,25 (1Н, с).
ИК (KBr) см-1: 1652, 1606, 1523, 1439, 1292, 764.
Пример 184
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 54,9%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30-1,45 (2Н, м), 1,50-1,62 (2Н, м), 1,62-1,80 (4Н, м), 2,53 (1Н, м), 2,75-2,90 (4Н, м), 3,70-3,75 (4Н, м), 3,80-3,85 (2Н, м), 3,94 (3Н, с), 4,20 (2Н, д, J=7,6 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,56 (1Н, д, J=8,5 Гц), 7,63 (1Н, дд, J=8,5, 2,0 Гц), 7,65 (1Н, м).
ИК (Чистый) см-1: 1648, 1598, 1523, 1439, 1267, 728.
Mass m/z: 383 (M+-2H2O).
Пример 185
Получение 2-циклопентилметил-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого масла (выход: 63,7%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30-1,45 (2Н, м), 1,50-1,63 (2Н, м), 1,63-1,80 (4Н, м), 2,43 (6Н, с), 2,55 (1Н, м), 3,61 (2Н, с), 3,94 (3Н, с), 4,19 (2Н, д, J=7,6 Гц), 7,20 (1Н, д, J=8,5, 8,5 Гц), 7,58 (1Н, д, J=8,5 Гц), 7,65 (1Н, дд, J=8,5, 2,2 Гц), 7,91 (1Н, ушир.с).
ИК (Чистый) см-1: 1652, 1608, 1523, 1438, 1288, 762.
Mass m/z: 359 (M+).
Пример 186
Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 78,8%).
1H ЯМР (400 МГц,CDCl3) δ: 1,35-1,43 (2Н, м), 1,47 (9Н, с), 1,55-1,60 (2Н, м), 1,65-1,75 (4Н, м), 2,45-2,60 (5Н, м), 3,45-3,55 (4Н, м), 3,95 (3Н, с), 4,18 (2Н, д, J=7,6 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,52 (1Н, м), 7,62 (1Н, д, J=12,4 Гц), 7,74 (1Н, м).
2) Получение 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 20, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 88,0%).
1H ЯМР (400 МГц, CDCl3) δ: 1,33-1,43 (2Н, м), 1,50-1,62 (2Н, м), 1,62-1,80 (4Н, м), 2,55 (1Н, м), 2,57-2,63 (4Н, м), 3,00-3,02 (4Н, м), 3,56 (2Н, ушир.с), 3,95 (3Н, с), 4,18 (2Н, д, J=7,6 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,52 (1Н, д, J=8,5 Гц), 7,62 (1Н, дд, J=8,5, 2,2 Гц), 7,73 (1Н, с).
ИК (Чистый) см-1: 1652, 1608, 1523, 1439, 1287, 761.
Mass m/z: 400 (M+).
Пример 187
Получение 4-аминометил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением неочищенного продукта. Неочищенный продукт подвергали дальнейшему взаимодействию без очистки в соответствии с процедурой примера 24 (2) с получением указанного в заголовке соединения в виде желтого масла (выход: 53,7%).
1H ЯМР (400 МГц, CDCl3) δ: 1,30-1,45 (2Н, м), 1,50-1,63 (2Н, м), 1,63-1,80 (4Н, м), 2,54 (1Н, м), 3,91 (2Н, с), 3,93 (3Н, с), 4,17 (2Н, д, J=7,6 Гц), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,52 (1Н, д, J=8,5 Гц), 7,62 (1Н, дд, J=8,5, 2,2 Гц), 7,71 (1Н, ушир.с).
ИК (Чистый) см-1: 3376, 1649, 1606, 1523, 1439, 1285, 761.
Mass m/z: 331 (M+).
Пример 188
Получение гидрохлорида 4-аминометил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 59,0%).
Температура плавления: 193-196°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 1,29-1,40 (2Н, м), 1,45-1,57 (2Н, м), 1,60-1,70 (4Н, м), 2,45 (1Н, м), 3,91 (3Н, с), 4,00 (2Н, с), 4,12 (2Н, д, J=7,6 Гц), 7,34 (1Н, дд, J=8,5, 8,5 Гц), 7,69-7,72 (2Н, м), 8,47 (1Н, ушир.с).
ИК (KBr) см-1: 3436, 1656, 1617, 1521, 1438, 1295, 763.
Пример 189
Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он и 4-фторбензилхлорид с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 86,6%).
1H ЯМР (400 МГц, CDCl3) δ: 3,95 (3Н, с), 3,97 (3Н, с), 5,39 (2Н, с), 7,00-7,06 (3Н, м), 7,48-7,63 (4Н, м), 8,19 (1Н, с).
2) Получение 4-карбокси-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 97,7%).
Температура плавления: 222-224°С
1H ЯМР (400 МГц, CDCl3) δ: 3,97 (3Н, с), 5,47 (2Н, с), 7,03-7,10 (3Н, м), 7,49-7,56 (3Н, м), 7,67 (1Н, дд, J=12,1, 2,2 Гц), 8,60 (1Н, с).
3) Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 27,0%).
Температура плавления: 127-130°С
1H ЯМР (400 МГц, CDCl3) δ: 3,95 (3Н, с), 4,79 (2Н, д, J=1,5 Гц), 5,36 (2Н, с), 6,98-7,05 (3Н, м), 7,46-7,52 (3Н, м), 7,61 (1Н, дд, J=12,2, 2,2 Гц), 7,65 (1Н, с).
4) Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого порошка (выход: 49,4%).
Температура плавления: 125-133°С
1H ЯМР (400 МГц, CDCl3) δ: 3,15 (3Н, с), 3,95 (3Н, с), 5,25 (2Н, д, J=1,2 Гц), 5,35 (2Н, с), 7,00-7,06 (3Н, м), 7,45-7,55 (3Н, м), 7,61 (1Н, дд, J=12,4, 2,2 Гц), 7,74 (1Н, с).
5) Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде коричневатого кристаллического порошка (выход: 45,8%).
Температура плавления: 112-113°С
1H ЯМР (400 МГц, CDCl3) δ: 2,39 (3Н, с), 2,60-2,90 (8Н, м), 3,60 (2Н, с), 3,95 (3Н, с), 5,34 (2Н, с), 6,99-7,06 (3Н, м), 7,47-7,51 (3Н, м), 7,59 (1Н, дд, J=12,4, 2,0 Гц), 7,71 (1Н, с).
ИК (KBr) см-1: 1651, 1608, 1518, 1439, 1289, 764.
Mass m/z: 440 (M+).
Пример 190
Получение 4-диметиламинометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 60,8%).
Температура плавления: 127-129°С
1H ЯМР (400 МГц, CDCl3) δ: 2,41 (6Н, с), 3,58 (2Н, с), 3,94 (3Н, с), 5,35 (2Н, с), 6,98-7,05 (3Н, м), 7,46-7,52 (2Н, м), 7,56 (1Н, д, J=8,8 Гц), 7,64 (1Н, дд, J=12,4, 2,2 Гц), 7,90 (1Н, ушир.с).
ИК (KBr) см-1: 1652, 1612, 1519, 1439, 1291, 763.
Mass m/z: 385 (M+).
Пример 191
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 66,1%).
1H ЯМР (400 МГц, CDCl3) δ: 2,70-2,92 (4Н, м), 3,70-3,85 (6Н, м), 3,93 (3Н, с), 5,35 (2Н, с), 6,99-7,04 (3Н, м), 7,45-7,50 (2Н, м), 7,55 (1Н, д, J=8,3 Гц), 7,63 (1Н, дд, J=12,4, 2,0 Гц), 7,90 (1Н, м).
ИК (Чистый) см-1: 1652, 1606, 1520, 1435, 1281, 762.
Mass m/z: 385 (M+-CH2OH).
Пример 192
Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 78,8%).
1H ЯМР (400 МГц, CDCl3) δ: 1,46 (9Н, с), 1,55-1,65 (4Н, м), 3,40-3,60 (4Н, м), 3,95 (3Н, с), 5,34 (2Н, с), 6,96-7,05 (3Н, м), 7,47-7,50 (3Н, м), 7,41 (1Н, д, J=12,4 Гц), 7,74 (1Н, ушир.с).
2) Получение 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 20, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 63,4%).
Температура плавления: 142-143°С
1H ЯМР (400 МГц, CDCl3) δ: 2,50-2,60 (4Н, м), 2,96-3,02 (4Н, м), 3,54 (2Н, д, J=1,2 Гц), 3,95 (3Н, с), 5,34 (2Н, с), 6,98-7,06 (3Н, м), 7,46-7,53 (3Н, м), 7,61 (1Н, дд, J=12,5, 2,2 Гц), 7,74 (1Н, ушир.с).
ИК (KBr) см-1: 1652, 1609, 1523, 1437, 1290, 762.
Mass m/z: 426 (M+).
Пример 193
Получение дигидрохлорида 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 76,9%).
Температура плавления: 153-156°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 3,30-3,75 (10Н, м), 3,90 (3Н, с), 5,33 (2Н, с), 7,15-7,21 (2Н, м), 7,30 (1Н, м), 7,43-7,49 (2Н, м), 7,69-7,78 (3Н, м).
ИК (KBr) см-1: 1660, 1609, 1524, 1439, 1292, 766.
Пример 194
Получение 4-аминометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением неочищенного продукта. Неочищенный продукт подвергали дальнейшему взаимодействию без очистки в соответствии с процедурой примера 24 (2) с получением указанного в заголовке соединения в виде бледно-коричневого кристаллического порошка (выход: 50,4%).
Температура плавления: 145-149°С
1H ЯМР (400 МГц, CDCl3) δ: 3,92 (3Н, с), 3,94 (2Н, с), 5,31 (2Н, с), 6,95-7,03 (3Н, м), 7,40-7,52 (3Н, м), 7,60 (1Н, дд, J=12,5, 2,2 Гц), 7,75 (1Н, ушир.с).
ИК (KBr) см-1: 3391, 1648, 1606, 1519, 1437, 1292, 761.
Mass m/z: 357 (M+).
Пример 195
Получение гидрохлорида 4-аминометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 72,5%).
Температура плавления: 210-214°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 3,91 (3Н, с), 4,01 (2Н, с), 5,35 (2Н, с), 7,16-7,21 (2Н, м), 7,34 (1Н, дд, J=8,8, 8,8 Гц), 7,45-7,49 (2Н, м), 7,68-7,78 (2Н, м), 8,29 (1Н, с).
ИК (KBr) см-1: 3429, 1653, 1612, 1522, 1439, 1292, 764.
Пример 196
Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он и мезилатное производное 3-(4-фторфенил)-1-пропанола {J. Med. Chem., 19, 461 (1976)} с получением указанного в заголовке соединения в виде желтого масла (выход: 90,1%). Мезилатное производное получали в соответствии с процедурой примера 1(9).
1H ЯМР (400 МГц, CDCl3) δ: 2,16-2,26 (2Н, м), 2,71 (2Н, т, J=7,3 Гц), 3,95 (3Н, с), 3,98 (3Н, с), 4,32 (2Н, т, J=7,3 Гц), 6,93-7,06 (3Н, м), 7,14-7,18 (2Н, м), 7,49 (1Н, м), 7,60 (1Н, дд, J=13,2, 2,2 Гц), 8,17 (1Н, с).
2) Получение 4-карбокси-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 89,2%).
Температура плавления: 185-187°С
1H ЯМР (400 МГц,CDCl3) δ: 2,20-2,30 (2Н, м), 2,74 (2Н, т, J=7,3 Гц), 3,97 (3Н, с), 4,40 (2Н, т, J=7,3 Гц), 6,94-7,17 (5Н, м), 7,55 (1Н, д, J=8,5 Гц), 7,66 (1Н, дд, J=12,2, 2,2 Гц), 8,58 (1Н, с).
3) Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 37,0%).
Температура плавления: 130-133°С
1H ЯМР (400 МГц, CDCl3) δ: 2,15-2,22 (2Н, м), 2,71 (2Н, т, J=7,3 Гц), 3,95 (3Н, с), 4,27 (2Н, т, J=7,3 Гц), 4,70 (2Н, д, J=1,2 Гц), 6,93-7,06 (3Н, м), 7,14-7,18 (2Н, м), 7,50 (1Н, д, J=8,8 Гц), 7,61 (1Н, дд, J=12,7, 2,2 Гц), 7,63 (1Н, с).
4) Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого порошка (выход: 92,3%).
Температура плавления: 112-116°С
1H ЯМР (400 МГц, CDCl3) δ: 2,15-2,25 (2Н, м), 2,71 (2Н, т, J=7,3 Гц), 3,17 (3Н, с), 3,95 (3Н, с), 4,27 (2Н, т, J=7,3 Гц), 5,25 (2Н, д, J=1,2 Гц), 6,93-7,05 (3Н, м), 7,14-7,18 (2Н, м), 7,49 (1Н, д, J=8,5 Гц), 7,61 (1Н, дд, J=13,4, 2,0 Гц), 7,72 (1Н, с).
5) Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 79,3%).
1H ЯМР (400 МГц, CDCl3) δ: 2,15-2,25 (2Н, м), 2,41 (3Н, с), 2,60-2,75 (10Н, м), 3,58 (2Н, с), 3,75 (3Н, с), 4,27 (2Н, т, J=7,3 Гц), 6,92-7,06 (3Н, м), 7,14-7,18 (2Н, м), 7,51 (1Н, д, J=8,5 Гц), 7,60 (1Н, дд, J=12,4, 2,0 Гц), 7,69 (1Н, с).
ИК (Чистый) см-1: 1652, 1608, 1511, 1439, 1284, 758.
Mass m/z: 468 (M+).
Пример 197
Получение 4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 61,8%).
Температура плавления: 97-100°С
1H ЯМР (400 МГц, CDCl3) δ: 2,15-2,25 (2Н, м), 2,43 (6Н, с), 2,71 (2Н, т, J=7,3 Гц), 3,60 (2Н, с), 3,94 (3Н, с), 4,27 (2Н, т, J=7,3 Гц), 6,93-7,05 (3Н, м), 7,15-7,18 (2Н, м), 7,57 (1Н, д, J=8,5 Гц), 7,64 (1Н, дд, J=12,6, 2,2 Гц), 7,90 (1Н, ушир.с).
ИК (KBr) см-1: 1653, 1611, 1510, 1436, 1296, 763.
Mass m/z: 413 (M+).
Пример 198
Получение 4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метансульфонилоксиметил-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 67,3%).
1H ЯМР (400 МГц, CDCl3) δ: 2,14-2,22 (2Н, м), 2,70 (2Н, т, J=7,6 Гц), 2,75-2,95 (4Н, м), 3,70-3,80 (6Н, м), 3,94 (3Н, с), 4,28 (2Н, т, J=7,6 Гц), 6,93-7,05 (3Н, м), 7,15-7,18 (2Н, м), 7,56 (1Н, м), 7,63 (1Н, м), 7,85 (1Н, м).
ИК (Чистый) см-1: 1645, 1601, 1510, 1439, 1277, 763.
Mass m/z: 473 (M+).
Пример 199
Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-(1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метансульфонилоксиметил-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 72,6%).
1H ЯМР (400 МГц, CDCl3) δ: 1,40 (9Н, с), 2,07-2,16 (2Н, м), 2,40-2,50 (4Н, м), 2,63 (2Н, т, J=7,6 Гц), 3,36-3,46 (4Н, m) 3,48 (2Н, ушир.с), 3,88 (3Н, с), 4,20 (2Н, т, J=7,6 Гц), 6,84-6,98 (3Н, м), 7,07-7,11 (2Н, м), 7,43 (1Н, д, J=8,1 Гц), 7,53 (1Н, д, J=12,4 Гц), 7,65 (1Н, ушир.с).
2) Получение 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-(1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 20, подвергали взаимодействию 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 97,2%).
1H ЯМР (400 МГц, CDCl3) δ: 2,12-2,22 (2Н, м), 2,50-2,60 (4Н, м), 2,71 (2Н, т, J=7,3 Гц), 2,92-3,02 (4Н, м), 3,53 (2Н, с), 3,95 (3Н, с), 4,27 (2Н, т, J=7,3 Гц), 6,91-7,06 (3Н, м), 7,15-7,18 (2Н, м), 7,51 (1Н, д, J=8,8 Гц), 7,61 (1Н, дд, J=12,5, 2,2 Гц), 7,73 (1Н, с).
ИК (Чистый) см-1: 1650, 1607, 1510, 1439, 1275, 758.
Mass m/z: 454 (M+).
Пример 200
Получение 4-аминометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением неочищенного продукта. Неочищенный продукт подвергали взаимодействию без очистки в соответствии с процедурой примера 24 (2) с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 41,7%).
Температура плавления: 82-84°С
1H ЯМР (400 МГц, CDCl3) δ: 2,12-2,22 (2Н, м), 2,70 (2Н, т, J=7,6 Гц), 3,89 (2Н, с), 3,94 (3Н, с), 4,27 (2Н, т, J=7,6 Гц), 6,93-7,04 (3Н, м), 7,15-7,18 (2Н, м), 7,51 (1Н, д, J=7,3 Гц), 7,61 (1Н, дд, J=12,4, 2,0 Гц), 7,67 (1Н, с).
ИК (KBr) см-1: 3366, 1651, 1605, 1509, 1436, 1273, 764.
Mass m/z: 385 (M+).
Пример 201
Получение гидрохлорида 4-аминометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 73,1%).
Температура плавления: 160-165°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,05-2,15 (2Н, м), 2,66 (2Н, т, J=7,3 Гц), 3,92 (3Н, с), 3,99 (2Н, с), 4,19 (2Н, т, J=7,3 Гц), 7,05-7,12 (2Н, м), 7,23-7,30 (2Н, м), 7,34 (1Н, дд, J=8,8, 8,8 Гц), 7,66-7,76 (2Н, м), 8,25 (1Н, с).
ИК (KBr) см-1: 3430, 1652, 1515, 1436, 1269, 763.
Пример 202
Получение 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он и 4-хлорбензилхлорид с получением указанного в заголовке соединения в виде желтых игольчатых кристаллов (выход: 97,6%).
Температура плавления: 170,5-171,1°С
1H ЯМР (400 МГц, CDCl3) δ: 3,95 (3Н, с), 3,99 (3Н, с), 5,38 (2Н, с), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,31 (2Н, д, J=8,5 Гц), 7,47 (2Н, д, J=8,5 Гц), 7,49 (1Н, м), 7,60 (1Н, дд, J=12,2, 2,2 Гц), 8,20 (1Н, s)
ИК (KBr) см-1: 1723, 1670, 1526, 1271, 1128.
Mass m/z: 402 (M+), 404 ( (M+).
2) Получение 4-карбокси-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 96,0%).
Температура плавления: 228,3-229,1°С
1H ЯМР (400 МГц, CDCl3) δ: 3,97 (3Н, с), 5,46 (2Н, с), 7,07 (1Н, дд, J=8,5, 8,5 Гц), 7,35 (2Н, д, J=8,3 Гц), 7,46 (2Н, д, J=8,3 Гц), 7,55 (1Н, д, J=8,4 Гц), 7,67 (1Н, дд, J=12,2, 2,2 Гц), 8,61 (1Н, с).
ИК (KBr) см-1: 1745, 1635, 1456, 1447, 1431, 1298, 1273.
Mass m/z: 388 (M+), 390 (M+).
3) Получение 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 20,4%).
Температура плавления: 164,6-165,3°С
1H ЯМР (400 МГц, CDCl3) δ: 3,94 (3Н, с), 4,69 (2Н, с), 5,34 (2Н, с), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,30 (2Н, д, J=8,5 Гц), 7,42 (2Н, д, J=8,5 Гц), 7,50 (1Н, м), 7,63 (1Н, дд, J=12,4, 2,2 Гц), 7,67 (1Н, с).
ИК (KBr) см-1: 3373, 1653, 1610, 1527, 1291, 1135,
Mass m/z: 374 (M+), 376 (M+).
4) Получение 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 81,6%).
Температура плавления: 156,5-157,4°С
1H ЯМР (400 МГц, CDCl3) δ: 3,15 (3Н, с), 3,95 (3Н, с), 5,22 (2Н, д, J=1,5 Гц), 5,35 (2Н, с), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,31 (2Н, д, J=8,5 Гц), 7,42 (2Н, д, J=8,5 Гц), 7,49 (1Н, м), 7,61 (1Н, дд, J=12,2, 2,2 Гц), 7,75 (1Н, с).
ИК (KBr) см-1: 1658, 1616, 1358, 1183, 1017,
5) Получение 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде бледно-коричневых призматических кристаллов (выход: 39,5%).
Температура плавления: 128,7-130,2°С
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, с), 2,52 (4Н, ушир.с), 2,60 (4Н, ушир.с), 3,55 (2Н, с), 3,95 (3Н, с), 5,34 (2Н, с), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,30 (2Н, д, J=8,5 Гц), 7,43 (2Н, д, J=8,5 Гц), 7,51 (1Н, м), 7,60 (1Н, дд, J=12,4, 2,0 Гц), 7,73 (1Н, с).
ИК (KBr) см-1: 1652, 1607, 1524, 1516, 1438, 1288, 1135,
Пример 203
Получение 2-(4-хлорбензил)-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 74,7%).
Температура плавления: 95,3-96,7°С
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (6Н, с), 3,47 (2Н, д, J=1,2 Гц), 3,94 (3Н, с), 5,34 (2Н, с), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,30 (2Н, д, J=8,5 Гц), 7,44 (2Н, д, J=8,5 Гц), 7,53 (1Н, ддд, J=8,5, 2,0, 1,2 Гц), 7,62 (1Н, дд, J=12,4, 2,2 Гц), 7,74 (1Н, с).
ИК (KBr) см-1: 1652, 1609, 1524, 1515, 1436, 1289, 1264, 1017,
Mass m/z: 401 (M+), 403 (M+).
Пример 204
Получение гидрохлорида 2-(4-хлорбензил)-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-(4-хлорбензил)-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 59,7%).
Температура плавления: 193,4-194,7°С
1H ЯМР (400 МГц, CD3OD) δ: 2,96 (6Н, с), 3,94 (3Н, с), 4,33 (2Н, с), 5,43 (2Н, с), 7,22 (1Н, дд, J=8,5, 8,5 Гц), 7,36 (2Н, д, J=8,5 Гц), 7,46 (2Н, д, J=8,5 Гц), 7,67-7,72 (2Н, м), 8,20 (1Н, с).
ИК (KBr) см-1: 1655, 1616, 1529, 1327, 1279.
Пример 205
Получение 4-аминометил-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
1) Получение 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-фталимидометил-2H-пиридазин-3-она
Следуя методике примера 24 (1), подвергали взаимодействию 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 75,4%).
Температура плавления: 212,5-213,9°С
1H ЯМР (400 МГц, CDCl3) δ: 3,90 (3Н, с), 4,88 (2Н, д, J=0,73 Гц), 5,35 (2Н, с), 6,95 (1Н, дд, J=8,5, 8,5 Гц), 7,29 (1Н, с), 7,31 (2Н, д, J=8,5 Гц), 7,36 (1Н, м), 7,44 (2Н, д, J=8,5 Гц), 7,47 (1Н, дд, J=12,2, 2,0 Гц), 7,76-7,81 (2Н, м), 7,89-7,94 (2Н, м).
ИК (KBr) см-1: 1773, 1713, 1651, 1610, 1522, 1439, 1419, 1393, 1300.
Mass m/z: 503 (M+), 505 (M+).
2) Получение 4-аминометил-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 24 (2), подвергали взаимодействию 2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-4-фталимидометил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 48,8%).
Температура плавления: 128,5-131,4°С
1H ЯМР (400 МГц, CDCl3) δ: 3,88 (2Н, с), 3,94 (3Н, с), 5,34 (2Н, с), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,30 (2Н, д, J=8,5 Гц), 7,43 (2Н, д, J=8,5 Гц), 7,51 (1Н, ддд, J=8,5, 2,2, 1,2 Гц), 7,61 (1Н, дд, J=12,4, 2,2 Гц), 7,69 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 3392, 1615, 1604, 1520, 1434, 1292, 1133, 1018.
Mass m/z: 373 (M+), 375 ( (M+).
Пример 206
Получение гидрохлорида 4-аминометил-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-аминометил-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 66,0%).
Температура плавления: 202,0-205,5°С
1H ЯМР (400 МГц, CD3OD) δ: 3,94 (3Н, с), 4,13 (2Н, с), 5,41 (2Н, с), 7,21 (1Н, дд, J=8,8, 8,8 Гц), 7,35 (2Н, д, J=8,5 Гц), 7,46 (2Н, д, J=8,5 Гц), 7,65-7,71 (2Н, м), 8,08 (1H. с).
ИК (KBr) см-1: 2940, 1655, 1616, 1526, 1439, 1292.
Пример 207
Получение 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он и 3,4-дифторбензилбромид с получением указанного в заголовке соединения в виде желтого кристаллического порошка (выход: 92,1%).
Температура плавления: 144-148°С
1H ЯМР (400 МГц, CDC13) δ: 3,96 (3H, с), 3,97 (3H, с), 5,35 (2H, с), 7,04 (1H, дд, J=8,5, 8,5Гц), 7,12 (1Н, м), 7,28 (1H, м), 7,36 (1H, м), 7,50 (1H, м), 7,60 (1H, дд, J=12,2, 1,5 Гц), 8,21 (1H, с).
ИК (KBr) см-1: 1756, 1656, 1609, 1518, 1439, 1239, 1293, 1278, 1204.
Mass m/z: 404 (M+).
2) Получение 4-карбокси-2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого кристаллического порошка (выход: 97,6%).
Температура плавления: 194,4-197,0°С
1H ЯМР (400 МГц, CDC13) δ: 3,97 (3H, с), 5,44 (2H, с), 7,07 (1H, дд, J=8,5, 8,5 Гц), 7,17 (1H, м), 7,27 (1H, м), 7,36 (1H, ддд, J=8,1, 8,1, 2,2 Гц), 7,56 (1H, м), 1,66 (1Н, дд, J=12,2, 2,2 Гц), 8,61 (1H, с), 13,83 (1H, с).
ИК (KBr) см-1: 1757, 1636, 1567, 1518, 1463, 1440, 1284.
Mass m/z: 390 (M+).
3) Получение 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 7,7%).
Температура плавления: 154,1-155,5°С
1H ЯМР (400 МГц, CDC13) δ: 2,85 (1H, т, J=5,6Гц), 3,95 (3H, с), 4,71 (2H, д, J=5,6 Гц), 5,33 (2H, с), 7,03 (1H, дд, J=8,5, 8,5 Гц), 7,12 (1H, м), 7,23 (1H, м), 7,31 (1H, ддд, J=11,0, 7,6, 2,2 Гц), 7,51 (1H, ддд, J=8,5, 2,2, 1,2 Гц), 7,61 (1H, дд, J=12,4, 2,2 Гц), 7,68 (1H, т, J=1,2 Гц).
ИК (KBr) см-1: 3390, 1648, 1602, 1518, 1440, 1285, 1141.
Mass m/z: 376 (M+).
4) Получение 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 91,5%).
Температура плавления: 145,6-146,6°С
1H ЯМР (400 МГц, CDC13) δ: 3,16 (3Н, с), 3,96 (3H, с), 5,26 (2H, д, J=1,2 Гц), 5,32 (2H, с), 7,04 (1H, дд, J=8,5 8,5 Гц), 7,13 (1H, м), 7,23 (1H, м), 7,32 (1H, м), 7,50 (1H, м), 7,61 (1H, дд, J=12,4, 2,2 Гц), 7,76 (1H, т, J=1,2 Гц).
ИК (KBr) см-1: 1656, 1612, 1522, 1440, 1352, 1277, 1163.
Mass m/z: 454 (M+).
5) Получение 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 55,0%).
Температура плавления: 135,4-136,0°С
1H ЯМР (400 МГц, CDC13) δ: 2,33 (3H, с), 2,51 (4H, ушир.с), 2,62 (4H, ушир.с), 3,56 (2H, д, J=1,5 Гц), 3,95 (3H, с), 5,31 (2H, с), 7,04 (1H, дд, J=8,5, 8,5 Гц), 7,11 (1H, м), 7,23 (1H, м), 7,32 (1H, ддд, J=11,0, 7,6, 2,0 Гц), 7,52 (1H, ддд, J=8,5, 2,2, 1,2 Гц), 7,59 (1H, дд, J=12,2, 2,2 Гц), 7,74 (1H, т, J=1,2 Гц).
ИК (KBr) см-1: 1652, 1608, 1522, 1437, 1291, 1273, 1139.
Mass m/z: 458 (M+).
Пример 208
Получение 2-(3,4-дифторбензил)-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 77,1%).
Температура плавления: 129,9-130,4°С
1H ЯМР (400 МГц, CDCl3) δ: 2,35 (6Н, с), 3,49 (2Н, с), 3,95 (3Н, с), 5,32 (2Н, с), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,11 (1Н, м), 7,24 (1Н, м), 7,32 (1Н, ддд, J=11,0, 7,6, 2,2 Гц), 7,54 (1Н, ддд, J=8,5, 2,2, 1,2 Гц), 7,62 (1Н, дд, J=12,4, 2,2 Гц), 7,77 (1Н, с).
ИК (KBr) см-1: 1653, 1610, 1519, 1437, 1291, 1283, 1267, 1138, 1114.
Mass m/z: 403 (M+).
Пример 209
Получение 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
1) Получение 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-она
Следуя методике примера 1(6), подвергали взаимодействию 6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он и 4-хлорциннамилхлорид с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 51,1%).
Температура плавления: 117-119°С
1H ЯМР (400 МГц, CDCl3) δ: 3,95 (3Н, с), 3,98 (3Н, с), 5,02 (2Н, дд, J=6,8, 1,2 Гц), 6,43 (1Н, дт, J=15,9, 6,8 Гц), 6,70 (1Н, д, J=15,9 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,25 (2Н, д, J=8,8 Гц), 7,31 (2Н, д, J=8,8 Гц), 7,50 (1Н, дт, J=8,5, 2,2 Гц), 7,62 (1Н, дд, J=12,2, 2,2 Гц), 8,22 (1Н, с).
ИК (KBr) см-1: 1724, 1709, 1667, 1506, 1291, 1236, 1126, 831,
Mass m/z: 412 (M+), 414 (M+).
2) Получение 4-карбокси-2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(7), подвергали взаимодействию 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-метоксикарбонил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтого кристаллического порошка (выход: 98,2%).
Температура плавления: 217,2-218,5°С
1H ЯМР (400 МГц, CDCl3) δ: 3,97 (3Н, с), 5,10 (2Н, д, J=6,8 Гц), 6,39 (1Н, дт, J=15,9, 6,8 Гц), 6,75 (1Н, д, J=15,9 Гц), 7,06 (1Н, дд, J=8,5, 8,5 Гц), 7,30 (2Н, д, J=8,5 Гц), 7,34 (2Н, д, J=8,5 Гц), 7,57 (1Н, м), 7,69 (1Н, дд, J=12,2, 2,2 Гц), 8,63 (1Н, с), 13,99 (1Н, с).
ИК (KBr) см-1: 3059, 1744, 1629, 1523, 1480, 1438, 1426, 1296, 1272.
Mass m/z: 414 (M+), 416 (M+).
3) Получение 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-карбокси-2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых кристаллов (выход: 17,0%).
Температура плавления: 158,2-160,5°С
1H ЯМР (400 МГц, CDCl3) δ: 2,95 (1Н, т, J=5,9 Гц), 3,94 (3Н, с), 4,73 (2Н, дд, J=5,9, 1,2 Гц), 4,98 (2Н, дд, J=6,6, 1,2 Гц), 6,40 (1Н, дт, J=15,9, 6,6 Гц), 6,67 (1Н, д, J=15,9 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,27 (2Н, д, J=8,5 Гц), 7,32 (2Н, д, J=8,5 Гц), 7,51 (1Н, ддд, J=8,8, 2,2, 1,2 Гц), 7,63 (1Н, дд, J=12,4, 2,2 Гц), 7,67 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 3392, 1648, 1603, 1523, 1440, 1284, 1273, 1140.
Mass m/z: 400 (M+), 402 (M+).
4) Получение 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-желтых игольчатых кристаллов (выход: 90,7%).
Температура плавления: 135,8-136,4°С
1H ЯМР (400 МГц, CDCl3) δ: 3,17 (3Н, с), 3,95 (3Н, с), 4,98 (2Н, дд, J=6,6, 0,98 Гц), 5,28 (2Н, д, J=1,5 Гц), 6,39 (1Н, дт, J=15,9, 6,6 Гц), 6,67 (1Н, д, J=15,9 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,27 (2Н, д, J=8,5 Гц), 7,32 (2Н, д, J=8,5 Гц), 7,50 (1Н, м), 7,62 (1Н, дд, J=12,2, 2,2 Гц), 7,77 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 1660, 1615, 1523, 1436, 1360, 1335, 1287, 1273, 1179.
Mass m/z: 478 (M+), 480 (M+).
5) Получение 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде бледно-коричневых игольчатых кристаллов (выход: 66,3%).
Температура плавления: 123,9-125,5°С
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, с), 2,52 (4Н, ушир.с), 2,62 (4Н, ушир.с), 3,58 (2Н, д, J=1,2 Гц), 3,95 (3Н, с), 4,98 (2Н, дд, J=6,8, 1,2 Гц), 6,41 (1Н, дт, J=15,9, 6,8 Гц), 6,66 (1Н, д, J=15,9 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,26 (2Н, д, J=8,5 Гц), 7,32 (2Н, д, J=8,5 Гц), 7,53 (1Н, ддд, J=8,5, 2,0, 1,2 Гц), 7,62 (1Н, дд, J=12,4, 2,2 Гц), 7,75 (1Н, т, J=1,2 Гц).
ИК (KBr) см-1: 1647, 1606, 1522, 1439, 1282, 1270.
Mass m/z: 482 (M+), 484 (M+).
Пример 210
Получение 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-[4-(2-гидроксиэтил)-1-пиперазинил]метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-пиперазинэтанол с получением указанного в заголовке соединения в виде желтоватых игольчатых кристаллов (выход: 65,1%).
Температура плавления: 133,1-134,9°С
1H ЯМР (400 МГц, CDCl3) δ: 2,57-2,62 (11Н, м), 3,58 (2Н, д, J=1,2 Гц), 3,63 (2Н, т, J=5,4 Гц), 3,94 (3Н, с), 4,97 (2Н, д, J=6,6 Гц), 6,41 (1Н, дт, J=15,9, 6,6 Гц), 6,67 (1Н, д, J=15,9 Гц), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,26 (2Н, д, J=8,5 Гц), 7,32 (2Н, д, J=8,5 Гц), 7,53 (1Н, м), 7,61 (1Н, дд, J=12,4, 2,2 Гц), 7,75 (1Н, с).
ИК (KBr) см-1: 3451, 1647, 1605, 1523, 1438, 1285, 1274, 1137.
Mass m/z: 478 (M+), 480 (M+).
Пример 211
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(4-метил-1-пиперазинил)пропил]-2H-пиридазин-3-она
1) Получение 4-бромметил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
2-Циклопропилметил-6-(3-фтор-4-метоксифенил)-4-гидроксиметил-2H-пиридазин-3-он (185 мг, 0,61 ммоль), тетрабромид углерода (404 мг, 1,2 ммоль) и пиридин (48 мг, 0,61 ммоль) растворяли в тетрагидрофуране (3 мл) и при перемешивании при охлаждении льдом добавляли раствор трифенилфосфина (319 мг, 1,2 ммоль) в тетрагидрофуране (3 мл). Смесь перемешивали при охлаждении льдом в течение 1 часа и затем перемешивали в течение ночи при комнатной температуре. Нерастворившиеся вещества отфильтровывали, растворитель отгоняли при пониженном давлении и остаток выделяли и очищали колоночной хроматографией на силикагеле (гексан/этилацетат=2/1) с получением указанного в заголовке соединения в виде желтого порошка (выход: 155 мг, 69,5%).
1H ЯМР (400 МГц, CDCl3) δ: 0,45-0,60 (4Н, м), 1,58 (1Н, м), 3,95 (3Н, с), 4,12 (2Н, д, J=7,3 Гц), 4,49 (2Н, с), 7,03 (1Н, дд, J=8,5, 8,5 Гц), 7,50 (1Н, м), 7,60 (1Н, дд, J=13,4, 2,2 Гц), 7,77 (1Н, с).
2) Получение 2-циклопропилметил-4-[2,2-ди(трет-бутоксикарбонил)этил]-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
После добавления 55% гидрида натрия (322 мг, 7,38 ммоль) к раствору ди-трет-бутилмалоната (970 мг, 4,48 ммоль) в N,N-диметилформамиде (10 мл) при охлаждении льдом добавляли 4-бромметил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он (1,8 г, 4,90 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, выливали в воду и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток выделяли и очищали хроматографией на силикагеле (гексан/этилацетат=3/1) с получением указанного в заголовке соединения в виде желтого порошка (выход: 1,39 мг, 61,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,50 (2Н, м), 0,50-0,58 (2Н, м), 1,41 (18Н, с), 1,56 (1Н, м), 3,12 (2Н, д, J=7,8 Гц), 3,87 (1Н, т, J=7,8 Гц), 3,94 (3Н, с), 4,09 (2Н, д, J=7,8 Гц), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,43 (1Н, д, J=8,5 Гц), 7,50 (1Н, с), 7,57 (1Н, дд, J=12,4, 2,2 Гц).
3) Получение 4-(2-карбоксиэтил)-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
К 2-циклопропилметил-4-[2,2-ди(трет-бутоксикарбонил)этил]-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-ону (1,39 г, 2,77 ммоль) добавляли трифторуксусную кислоту (21 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель отгоняли при пониженном давлении и затем добавляли толуол с последующим азеотропным кипячением. Остаток нагревали при 190- 200°С в течение 30 мин в атмосфере азота с получением указанного в заголовке соединения в виде бледно-коричневого порошка (выход: 907 мг, 94,7%).
1H ЯМР (400 МГц, CDCl3)δ: 0,45-0,50 (2Н, м), 0,50-0,60 (2Н, м), 1,41 (1Н, м), 2,80 (2Н, т, J=7,1 Гц), 2,97 (2Н, т, J=7,1 Гц), 3,94 (3Н, с), 4,10 (2Н, д, J=7,3 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,47 (1Н, д, J=8,5 Гц), 7,55 (1Н, с), 7,59 (1Н, дд, J=12,4, 2,2 Гц).
4) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-гидроксипропил)-2H-пиридазин-3-она
Следуя методике примера 1(8), подвергали взаимодействию 4-(2-карбоксиэтил)-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде коричневого масла (выход: 82,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,52 (2Н, м), 0,52-0,60 (2Н, м), 1,42 (1Н, м), 1,88-1,94 (2Н, м), 2,81 (2Н, т, J=6,1 Гц), 3,63 (2Н, т, J=5,9 Гц), 3,95 (3Н, с), 4,12 (2Н, д, J=7,3 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,50 (1Н, м), 7,52 (1Н, с), 7,60 (1Н, дд, J=12,4, 2,2 Гц).
5) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-метансульфонилоксипропил)-2H-пиридазин-3-она
Следуя методике примера 1(9), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-гидроксипропил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде бледно-коричневого порошка (выход: 82,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,51 (2Н, м), 0,51-0,60 (2Н, м), 1,41 (1Н, м), 2,13-2,21 (2Н, м), 2,80 (2Н, т, J=7,1 Гц), 3,04 (3Н, с), 3,94 (3Н, с), 4,09 (2Н, д, J=7,3 Гц), 4,31 (2Н, т, J=6,1 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,49 (1Н, д, J=8,5 Гц), 7,53 (1Н, с), 7,61 (1Н, дд, J=12,4, 2,2 Гц).
6) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(4-метил-1-пиперазинил)пропил]-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-метансульфонилоксипропил)-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 62,0%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,50 (2Н, м), 0,50-0,60 (2Н, м), 1,41 (1Н, м), 1,90-2,00 (2Н, м), 2,45 (3Н, с), 2,50-3,00 (12Н, м), 3,94 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,48 (1Н, с), 7,50 (1Н, д, J=8,5 Гц), 7,70 (1Н, дд, J=12,3, 2,0 Гц).
ИК (Чистый) см-1: 1648, 1607, 1524, 1286, 1122, 1022, 755.
Mass m/z: 414 (M+).
Пример 212
Получение 2-циклопропилметил-4-(3-диметиламинопропил)-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 7, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-метансульфонилоксипропил)-2H-пиридазин-3-он и диметиламин с получением указанного в заголовке соединения в виде желтого порошка (выход: 64,7%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,50 (2Н, м), 0,53-0,60 (2Н, м), 1,40 (1Н, м), 2,24-2,35 (2Н, м), 2,75-2,80 (2Н, м), 2,79 (6Н, с), 3,03 (2Н, т, J=7,3 Гц), 3,94 (3Н, с), 4,08 (2Н, д, J=7,1 Гц), 7,04 (1Н, дд, J=8,5, 8,5 Гц), 7,57 (1Н, д, J=8,5 Гц), 7,65 (1Н, дд, J=12,4, 2,2 Гц), 7,72 (1Н, с).
ИК (Чистый) см-1: 1649, 1608, 1524, 1288, 1122, 1022, 761.
Mass m/z: 359 (M+).
Пример 213
Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(1-пиперазинил)пропил]-2H-пиридазин-3-она
1) Получение 2-циклопропилметил-4-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пропил]-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-метансульфонилоксипропил)-2H-пиридазин-3-он и трет-бутил 1-пиперазинкарбоксилат с получением указанного в заголовке соединения в виде желтого масла (выход: 76,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,50 (2Н, м), 0,52-0,60 (2Н, м), 1,44 (1Н, м), 1,46 (9Н, с), 2,00-2,40 (2Н, м), 2,50-2,80 (6Н, м), 3,50-3,75 (6Н, м), 3,94 (3Н, с), 4,08 (2Н, д, J=7,1 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,47-7,65 (3Н, м).
2) Получение 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(1-пиперазинил)пропил]-2H-пиридазин-3-она
Следуя методике примера 20, подвергали взаимодействию 2-циклопропилметил-4-[3-(4-трет-бутоксикарбонил-1-пиперазинил)пропил]-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтого масла (выход: 78,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,43-0,50 (2Н, м), 0,50-0,59 (2Н, м), 1,42 (1Н, м), 1,82-1,92 (2Н, м), 2,40-2,50 (6Н, м), 2,68 (2Н, т, J=7,6 Гц), 2,93-2,95 (4Н, м), 3,94 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,45 (1Н, с), 7,48 (1Н, д, J=8,5 Гц), 7,59 (1Н, дд, J=11,4, 2,0 Гц).
ИК (Чистый) см-1: 1648, 1607, 1523, 1288, 1122, 1023, 760.
Mass m/z: 400 (M+).
Пример 214
Получение дигидрохлорида 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(1-пиперазинил)пропил]-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(1-пиперазинил)пропил]-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 83,1%).
Температура плавления: 174-178°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,39-0,45 (2Н, м), 0,45-0,55 (2Н, м), 1,32 (1Н, м), 2,00-2,25 (2Н, м), 2,62-2,66 (2Н, м), 3,20-3,85 (10Н, м), 3,90 (3Н, с), 4,01 (2Н, д, J=7,1 Гц), 7,28 (1Н, дд, J=8,8, 8,8 Гц), 7,72-7,80 (2Н, м), 7,96 (1Н, с).
ИК (KBr) см-1: 1647, 1604, 1523, 1297, 1123, 1020, 762.
Пример 215
Получение 4-[3-[N,N-бис(2-гидроксиэтил)амино]пропил]-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-метансульфонилоксипропил)-2H-пиридазин-3-он и диэтаноламин с получением указанного в заголовке соединения в виде желтого масла (выход: 13,1%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,50 (2Н, м), 0,50-0,60 (2Н, м), 1,41 (1Н, м), 2,10-2,20 (2Н, м), 2,76 (2Н, т, J=7,3 Гц), 3,00-3,15 (6Н, м), 3,87-3,92 (4Н, м), 3,94 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 7,02 (1Н, дд, J=8,5, 8,5 Гц), 7,53 (1Н, д, J=8,5 Гц), 7,60 (1Н, с), 7,62 (1Н, дд, J=12,4, 2,2 Гц).
ИК (Чистый) см-1: 1645, 1602, 1524, 1288, 1123, 1024, 756.
Mass m/z: 400 (M+-CH2OH).
Пример 216
Получение 4-(3-аминопропил)-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 24 (1), 2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(3-метансульфонилоксипропил)-2H-пиридазин-3-он подвергали взаимодействию с получением неочищенного продукта. Неочищенный продукт подвергали дальнейшему взаимодействию без очистки в соответствии с процедурой примера 24 (2) с получением указанного в заголовке соединения в виде желтого масла (выход: 67,8%).
1H ЯМР (400 МГц, CDCl3) δ: 0,44-0,50 (2Н, м), 0,50-0,60 (2Н, м), 1,41 (1Н, м), 1,84-1,96 (2Н, м), 2,67-2,80 (4Н, м), 2,87 (2Н, т, J=6,1 Гц), 3,94 (3Н, с), 4,08 (2Н, д, J=7,3 Гц), 7,01 (1Н, дд, J=8,5, 8,5 Гц), 7,49 (1Н, д, J=8,5 Гц), 7,50 (1Н, с), 7,59 (1Н, дд, J=12,4, 2,2 Гц).
ИК (Чистый) см-1: 3370, 1648, 1606, 1523, 1289, 1122, 1023, 760.
Mass m/z: 331 (M+).
Пример 217
Получение гидрохлорида 4-(3-аминопропил)-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-она
Следуя методике примера 4, подвергали взаимодействию 4-(3-аминопропил)-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2H-пиридазин-3-он с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (выход: 70,6%).
Температура плавления: 183-185°С
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,40-0,45 (2Н, м), 0,45-0,55 (2Н, м), 1,32 (1Н, м), 1,88-1,93 (2Н, м), 2,64 (2Н, т, J=7,3 Гц), 2,78-2,88 (2Н, м), 3,90 (3Н, с), 4,00 (2Н, д, J=7,3 Гц), 7,28 (1Н, дд, J=8,5, 8,5 Гц), 7,70-7,78 (2Н, м), 7,96 (1Н, с).
ИК (KBr) см-1: 3437, 1648, 1608, 1526, 1273, 1122, 1021, 762.
Ссылочный Пример
Получение 3-(2,6-дихлорфенил)-1-пропанолметансульфоната
1) Получение этил 2,6-дихлорциннамата
К раствору 2,6-дихлорбензальдегида (350 мг, 2,0 ммоль) и триэтилфосфоноацетата (448 мг, 2,6 ммоль) в ТГФ (5 мл) при охлаждении льдом добавляли трет-бутоксид калия (291 мг, 2,6 ммоль) и при той же температуре смесь перемешивали в течение 2 час. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующим экстрагированием этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Далее остаток очищали хроматографией на колонке с силикагелем (гексан/этилацетат=50/1) с получением указанного в заголовке соединения в виде бесцветного сиропа (выход: 65,1%).
1H ЯМР (400 МГц, CDCl3) δ: 1,35 (3Н, т, J=7,2 Гц), 4,30 (2Н, кв., J=7,2 Гц), 6,59 (1Н, д, J=16,4 Гц), 7,19 (1Н, т, J=8,0 Гц), 7,36 (2Н, т, J=8,0 Гц), 7,79 (1Н, д, J=16,4 Гц).
2) Получение 3-(2,6-дихлорфенил)-1-пропанола
Литийалюминийгидрид (98,8 мг, 2,60 ммоль) добавляли в ТГФ (5 мл) и при перемешивании при охлаждении льдом добавляли по каплям раствор этил 2,6-дихлорциннамата (319 мг, 1,30 ммоль) в ТГФ (5 мл). Смесь затем перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси добавляли небольшое количество насыщенного водного раствора хлорида аммония, а затем сушили над безводным сульфатом магния. После фильтрации через целит смесь концентрировали при пониженном давлении и затем очищали хроматографией на колонке с силикагелем (гексан/этилацетат=10/1) с получением указанного в заголовке соединения в виде бледно-желтого сиропа (выход: 46,9%).
1H ЯМР (400 МГц, CDCl3) δ: 1,83-1,93 (2Н, м), 3,02 (2Н, т, J=7,8 Гц), 3,73 (2Н, т, J=6,3 Гц), 7,09 (1Н, т, J=8,3 Гц), 7,27 (2Н, д, J=8,3 Гц).
3) Получение 3-(2,6-дихлорфенил)-1-пропанолметансульфоната
К раствору 3-(2,6-дихлорфенил)-1-пропанола (125 мг, 0,61 ммоль) и триэтиламина (123 мг, 1,22 ммоль) в метиленхлориде (3 мл) добавляли при охлаждении льдом метансульфонилхлорид (105 мг, 0,915 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 час. К реакционной смеси добавляли насыщенный солевой раствор. Органический слой отделяли, собирали и сушили над безводным сульфатом натрия. После концентрирования при пониженном давлении остаток очищали хроматографией на колонке с силикагелем (гексан/этилацетат=10/1) с получением указанного в заголовке соединения в виде бледно-желтого сиропа (выход: количественный).
1H ЯМР (400 МГц, CDCl3) δ: 2,02-2,12 (2Н, м), 3,00-3,10 (5Н, м), 4,32 (2Н, т, J=6,3 Гц), 7,10 (1Н, т, J=8,3 Гц), 7,28 (2Н, д, J=8,3 Гц).
Эксперимент 1
Ингибиторная активность против продуцирования интерлейкина-1β
Клетки HL-60 культивировали в течение 4 дней до конфлюенции на среде RPMI 1640, к которой была добавлена 10% фетальная бычья сыворотка (FBC). Среду центрифугировали. Надосадочную жидкость сливали, затем клетки суспендировали при концентрации 1 x 106 клеток/мл в среде RPMI 1640, содержащей 3% FBS и добавляли липополисахарид с получением конечной концентрации 10 мкг/мл. Культуру инокулировали в 24-луночный планшет при 1 мл/лунку. Испытываемое соединение добавляли в количестве 1 мкл/лунку с последующим культивированием в течение 3 дней. Через три дня методом ELISA определяли количество интерлейкина-1β в каждой культуре. Определяли каждое значение ИК50 путем сравнения выходов с контрольным образцом, к которому не добавляли испытываемое соединение. Результаты для некоторых репрезентативных соединений показаны в Таблице 1.
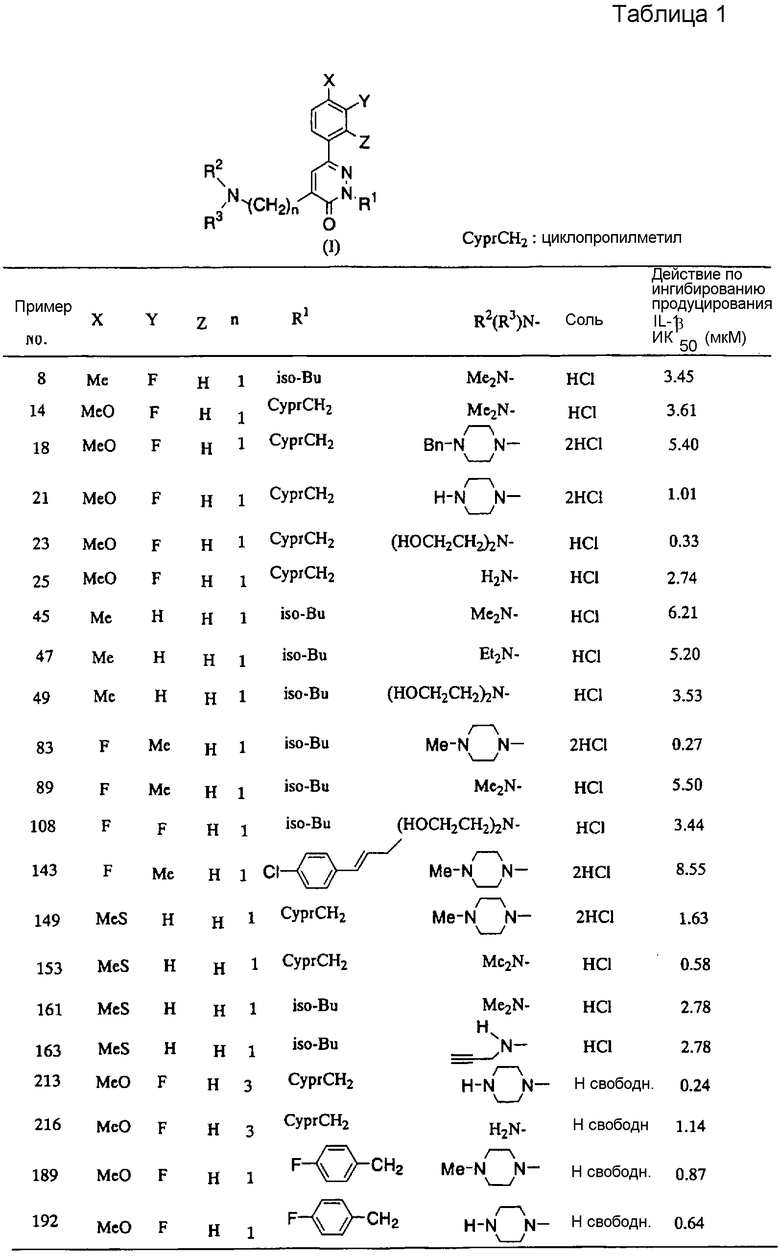
Эксперимент 2 (Испытание растворимости в воде)
Метод испытания
Каждое испытываемое соединение отвешивали в количестве, указанном в Таблице 3, добавляли дистиллированную воду в аликвотах 0,05 мл. Растворимость (%) соединения определяли на основании количества воды, необходимого для его растворения.
Результаты
Как показано в Таблице 2, соединения по настоящему изобретению показали гораздо лучшую растворимость в воде, чем у сравнительных соединений.
(нерастворимый)
(нерастворимый)
(нерастворимый)
(нерастворимый)

Эксперимент 3 (Испытание абсорбируемости при пероральном введении крысам)
Соединение Примера 83 и сравнительное соединение 3 суспендировали соответственно при 2 мг/мл с 0,5% раствором МС в ступках и перорально вводили самцам крыс SD при дозе 10 мг/5 мл/кг. По истечении времени 0,25, 0,5, 1, 2, 4, 6 и 8 часов после введения брали образцы крови и центрифугировали для получения образцов плазмы. Уровни содержания в плазме соответствующих соединений определяли методом ВЭЖХ. Как показано на Фиг. 1, для сравнительного соединения 3 не наблюдали никакой существенной абсорбции, но хорошую абсорбцию наблюдали для соединения Примера 83, обладающего повышенной водорастворимостью. Соединение Примера 83 поэтому является полезным в качестве перорально вводимого лекарственного средства.
Эксперимент 4 (Испытание абсорбируемости при пероральном введении крысам и/или мышам)
Таким же способом, как описано в Эксперименте 3, испытываемые соединения Примеров 23, 25 и 143 вводили перорально мышам и/или крысам для испытания абсорбируемости этих веществ при пероральном введении. Как показано на Фиг.2-4, хорошую абсорбируемость наблюдали для всех испытываемых соединений, таким образом, они являются полезными в качестве перорально вводимых лекарственных средств.
Ознакомившись с описанием настоящего изобретения, специалист должен понимать, что возможны многие изменения и модификации описанных выше вариантов воплощения изобретения без отступления от его сути и объема.
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВИРУЮЩИЙ АГЕНТ ДЛЯ РЕЦЕПТОРА, АКТИВИРУЕМОГО СТИМУЛИРУЮЩИМИ РОСТ ПЕРОКСИСОМ АГЕНТАМИ | 2009 |
|
RU2501794C2 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИН-3-ОНА И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2000 |
|
RU2232755C2 |
| СОЕДИНЕНИЯ ФЕНИЛПИРИДАЗИНА И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2001 |
|
RU2269519C2 |
| ГЕРБИЦИДЫ ДЛЯ СОРНЯКОВ, УСТОЙЧИВЫХ К ГЕРБИЦИДУ НА ОСНОВЕ СУЛЬФОНИЛМОЧЕВИНЫ, СПОСОБ БОРЬБЫ С СОРНЯКАМИ, УСТОЙЧИВЫМИ К ГЕРБИЦИДУ НА ОСНОВЕ СУЛЬФОНИЛМОЧЕВИНЫ, СОЕДИНЕНИЯ | 2003 |
|
RU2292139C2 |
| ПИПЕРИДИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НАТРИЕВЫХ КАНАЛОВ И КАЛИЕВЫХ КАНАЛОВ | 2001 |
|
RU2259365C2 |
| АНТАГОНИСТ NPY Y5 | 2000 |
|
RU2264810C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-АКРИЛОИЛПИПЕРАЗИНА | 1990 |
|
RU2024513C1 |
| ГЛЮКОПИРАНОЗИЛОКСИПИРАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ ПРОИЗВОДНЫЕ, И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2232767C2 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| ХИНОЛИНОВЫЕ И ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2000 |
|
RU2256654C2 |

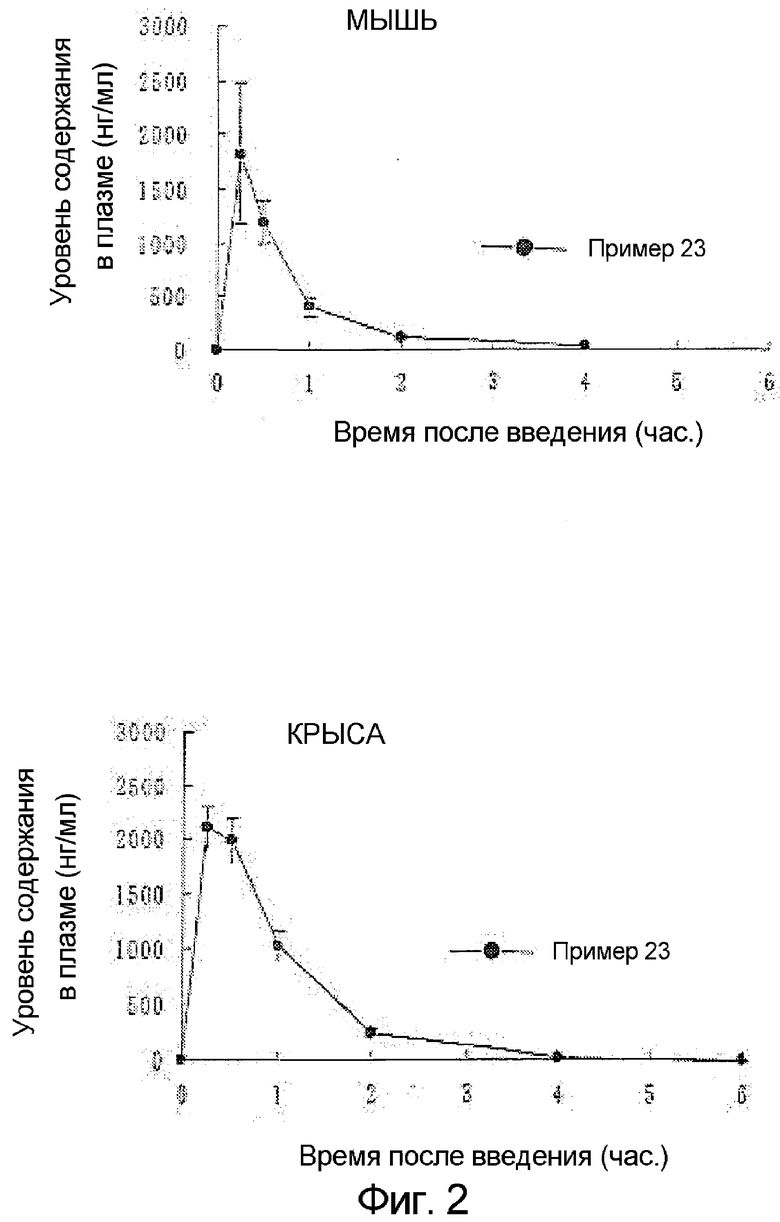
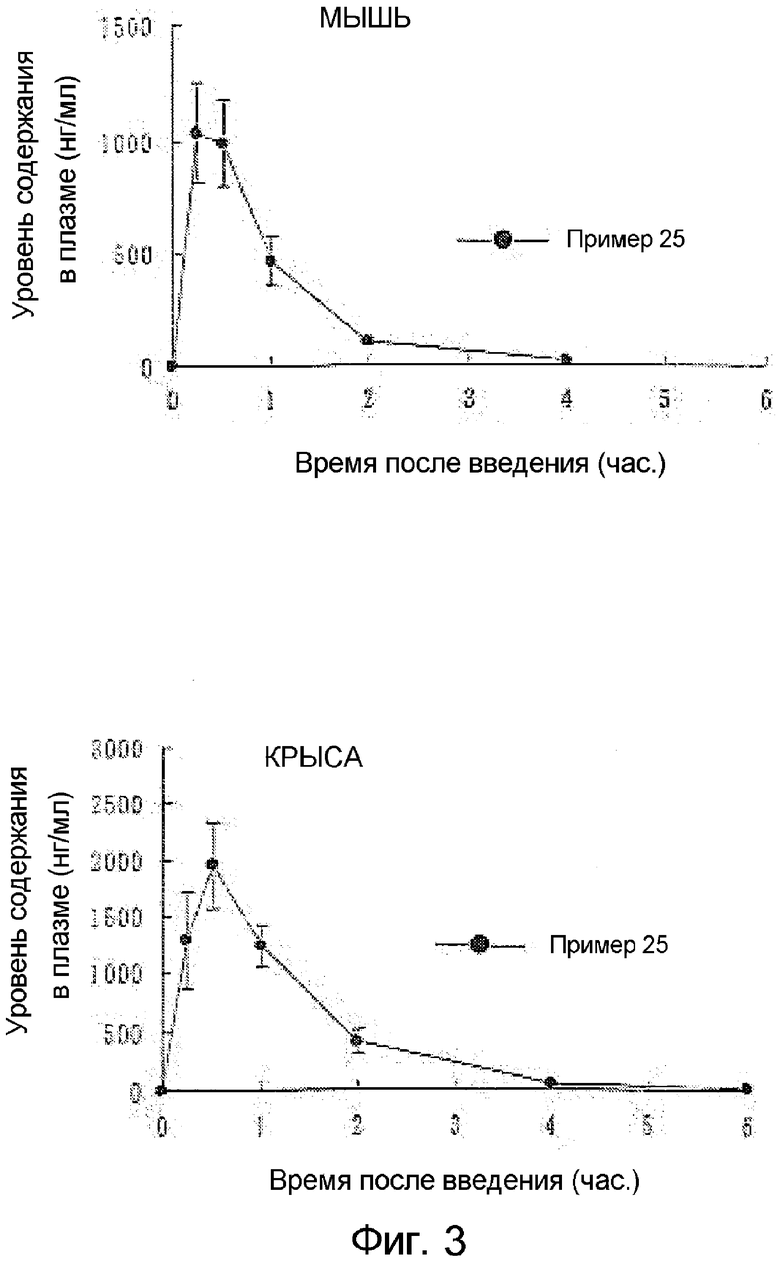

Изобретение относится к производному фенилпиридазина формулы (I), где: R1 представляет собой С1-С12алкил, необязательно содержащий С3-С6 циклические алкильные структуры или необязательно замещенный фенилом, который может быть замещен 1-2 атомами галогена или С1-С12алкенил, замещенный фенилом, который может быть замещен атомом галогена; R2 и R3, каждый независимо, представляет водород или С1-С12алкил, C1-С12гидроксиалкил, С1-С12дигидроксиалкил или С3-С12алкинил, или R2 и R3, соединенные вместе со смежным атомом азота, образуют 5-6-членную насыщенную гетероциклическую группу, содержащую 1-2 атома азота и необязательно содержащую атом кислорода, при этом указанная гетероциклическая группа необязательно замещена С1-С12алкильной, C1-С12алкоксикарбонильной или фенилС1-С7алкильной группой; X, Y и Z, каждый независимо, представляет водород или галоген, С1-С12алкил, который может быть замещен атомом(ами) галогена, С1-С12алкокси, С1-С12алкилтио, С1-С12алкилсульфинил или С1-С12алкилсульфонил, или фенил; и n означает число от 1 до 5; при условии, что R2 и R3 одновременно не являются водородом или одинаковыми C1-С3алкильными группами, когда R1 представляет собой бензильную группу или C1-С3 алкильную группу; или его соли. Эти соединения обладают ингибиторной активностью против продуцирования интерлейкина IL-1β, высокой растворимостью в воде и хорошей пероральной абсорбируемостью. Изобретение также относится к лекарственному средству, ингибитору продуцирования интерлейкина-1β фармацевтической композиции, применению вышеописанных соединений, способу лечения заболевания, вызванного стимуляцией продуцирования интерлейкина-1β и способу лечения заболеваний иммунной системы, воспалительных заболеваний, ишемических заболеваний, остеопороза или септицемии с помощью вышеописанных соединений. 7 н. и 15 з.п. ф-лы, 4 ил., 2 табл.


где
R1 представляет собой С1-С12алкил, необязательно содержащий С3-С6циклические алкильные структуры или необязательно замещенный фенилом, который может быть замещен 1-2 атомами галогена, или С1-С12алкенил, замещенный фенилом, который может быть замещен атомом галогена;
R2 и R3 каждый независимо представляет водород или С1-С12алкил, С1-С12гидроксиалкил, С1-С12дигидроксиалкил или С3-С12алкинил, или R2 и R3, соединенные вместе со смежным атомом азота, образуют 5-6-членную насыщенную гетероциклическую группу, содержащую 1-2 атома азота и необязательно содержащую атом кислорода, при этом указанная гетероциклическая группа необязательно замещена С1-С12алкильной, С1-С12алкоксикарбонильной или фенилС1-С7алкильной группой;
X, Y и Z каждый независимо представляет водород или галоген, С1-С12алкил, который может быть замещен атомом(ами) галогена, С1-С12алкокси, С1-С12алкилтио, С1-С12алкилсульфинил или С1-С12алкилсульфонил, или фенил; и
n означает число от 1 до 5;
при условии, что R2 и R3 одновременно не являются водородом или одинаковыми C1-С3алкильными группами, когда R1 представляет собой бензильную группу или C1-С3алкильную группу; или его соль.
4-диметиламинометил-6-(3-фтор-4-метилфенил)-2-изобутил-2Н-пиридазин-3-он,
2-циклопропилметил-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(4-бензил-1-пиперазинил)метил-2Н-пиридазин-3-он,
2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2Н-пиридазин-3-он,
4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
4-аминометил-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
4-диметиламинометил-2-изобутил-6-(4-метилфенил)-2Н-пиридазин-3-он,
4-диэтиламинометил-2-изобутил-6-(4-метилфенил)-2Н-пиридазин-3-он,
4-N,N-бис(2-гидроксиэтил)аминометил-6-(4-метилфенил)-2-изобутил-2Н-пиридазин-3-он,
6-(4-фтор-3-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
4-диметиламинометил-6-(4-фтор-3-метилфенил)-2-изобутил-2Н-пиридазин-3-он,
4-N,N-бис(2-гидроксиэтил)аминометил-6-(3,4-дифторфенил)-2-изобутил-2Н-пиридазин-3-он,
2-(4-хлорциннамил)-6-(4-фтор-3-метилфенил)-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
2-циклопропилметил-4-(4-метил-1-пиперазинил)метил-6-[4-(метилтио)фенил]-2Н-пиридазин-3-он,
4-N,N-бис(2-гидроксиэтил)аминометил-2-циклопропил-метил-6-[4-(метилтио)фенил]-2Н-пиридазин-3-он,
2-циклопропилметил-4-диметиламинометил-6-[4-(метилтио)-фенил]-2Н-пиридазин-3-он,
2-изобутил-6-[4-(метилтио)-фенил]-4-пропаргиламинометил-2Н-пиридазин-3-он,
4-диметиламинометил-2-изобутил-6-[4-(метилтио)фенил]-2Н-пиридазин-3-он,
2-(4-хлорбензил)-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
2-циклопентилметил-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-циклопентилметил-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2Н-пиридазин-3-он,
4-аминометил-2-циклопентилметил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
4-диметиламинометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-4-(1-пиперазинил)метил-2Н-пиридазин-3-он,
4-аминометил-2-(4-фторбензил)-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
4-аминометил-2-(4-хлорбензил)-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-(3,4-дифторбензил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
2-(3,4-дифторбензил)-4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
4-диметиламинометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2Н-пиридазин-3-он,
4-N,N-бис(2-гидроксиэтил)аминометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2Н-пиридазин-3-он,
6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-4-(1-пиперазинил)метил-2Н-пиридазин-3-он,
4-аминометил-6-(3-фтор-4-метоксифенил)-2-[3-(4-фторфенил)пропил]-2Н-пиридазин-3-он,
2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-[4-(2-гидроксиэтил)-1-пиперазинил]метил-2Н-пиридазин-3-он,
2-(4-хлорциннамил)-6-(3-фтор-4-метоксифенил)-4-(4-метил-1-пиперазинил)метил-2Н-пиридазин-3-он,
2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(4-метил-1-пиперазинил)пропил]-2Н-пиридазин-3-он,
2-циклопропилметил-4-(3-диметиламинопропил)-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он,
2-циклопропилметил-6-(3-фтор-4-метоксифенил)-4-[3-(1-пиперазинил)пропил]-2Н-пиридазин-3-он или
4-(3-аминопропил)-2-циклопропилметил-6-(3-фтор-4-метоксифенил)-2Н-пиридазин-3-он.
| Способ определения среднего заряда и времени накопления ионов в электронно-ионных сгустках | 1982 |
|
SU1061077A1 |
| WO 00/50408 A1, 31.08.2000 | |||
| RU 94019981 A1, 07.06.1994 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2007-07-10—Публикация
2002-09-25—Подача