Настоящее изобретение относится к новому пиперидиновому соединению, его соли или гидрату; к способу его получения; к фармацевтической композиции, содержащей указанные соединения и т.п., и к ее изготовлению. Фибрилляция предсердий, которая является одним из видов аритмии, представляет собой состояние, при котором в предсердии не осуществляется регулярное возбуждение и сокращение в соответствии со стимуляцией, исходящей из синусно-предсердного узла, а это возбуждение часто произвольно повторяется и классифицируется на пароксизмальную предсердную фибрилляцию и хроническую предсердную фибрилляцию. Сообщалось также, что во многих случаях, кризис наступает в результате осложнения органических заболеваний сердца, таких как поражение митрального клапана, ишемическая болезнь сердца, артериальная гипертензия, тиреотоксикоз (представляющие собой четыре главных заболевания) и дискретная фибрилляция предсердий, вызывающая мерцательную аритмию. Кроме того, состояние сердечной недостаточности часто проявляется в виде серцебиения и дискомфорта в области грудной клетки, при этом тромб, образующийся в левом предсердии, часто провоцирует эмболизацию тромбов в различных органах системы организма. Хотя методы лечения (прекращение приступов, предупреждение рецидивов и т.п.) фибрилляции предсердий в случаях пароксизмальной аритмии и хронической фибрилляции предсердий отличаются, однако эффективность лекарственной терапии является недостаточной в обоих случаях, и введение антиаритмических средств является в настоящее время выбором лекарственных средств 1 класса. Известные антиаритмические средства подразделяются на группы, такие как группа I по классификации Вона Вильямса (Vaughan Williams) (класс I: лекарственное средство, подавляющее проводимость мышцы предсердия путем селективного блокирования Na+-канала и ингибирования циркуляции возбуждения), лекарственные средства класса II по данной классификации (класс II: блокада β-адренергических рецепторов) и лекарственные средства класса III по данной классификации (класс III: лекарственное средство, селективно блокирующее К+-канал и удлиняющее продолжительность потенциала действия), лекарственные средства класса IV по данной классификации (класс IV: блокатор Са+-канала) и т.п. Однако лекарственное средство, ингибирующее циркуляцию (круговую волну) возбуждения потенциала мышцы предсердия, является эффективным для прекращения фибрилляции предсердий, и предполагается, что антиаритмическое лекарственное средство класса I и антиаритмическое лекарственное средство класса III являются эффективными. Что касается антиаритмических средств этого класса, то их описание встречается во многих работах; так, например, изобретения, относящиеся к пиперидиновым соединениям, используемым в качестве антиаритмических лекарственных средств, описаны в заявке на патент Японии №62-281858, JP-A 6-501242, JP-A 6-502273, JP-A 6-511014 и т.п., и, кроме того, изобретения, относящиеся к пиперидиновым соединениям, используемым в качестве антиаритмических лекарственных средств, описаны в JP-А 9-505597, JP-A 8-511014, WO 96/13479 и т.п.
Однако поскольку антиаритмическое средство класса I обладает негативным инотропным действием (снижающим насосную функцию сердца), основанным на ингибировании Na+-каналов, то его использование связано с проблемами, заключающимися в том, что оно вызывает обострение или прогрессирование сердечной недостаточности. В противоположность этому, антиаритмическое средство класса III не обладает таким действием и дает превосходный эффект только в отношении увеличения рефрактерного периода, однако при этом стандартное антиаритмическое средство класса III не всегда эффективно в отношении контроля частоты фибрилляции предсердий, оно также удлиняет рефрактерный период мышцы предсердий и часто гораздо больше удлиняет рефрактерный период мышцы предсердий в нормальном состоянии, а не при тахикардии (обратная зависимость от частоты), а поэтому при введении дозы, обеспечивающий терапевтический эффект, возникают проблемы, связанные с индуцированном желудочковой экстрасистолии.
С другой стороны, известно также, что соединение, обладающее действием, направленным на ингибирование Na+-каналов, оказывает благоприятное воздействие на различные невралгии (например, постгерпетическую невралгию, диабетическую невралгию, ВИЧ-ассоциированную невралгию и т.п.). Так, например, для лечения различных невралгий используются лидодерм, применяемый при постгерпетической невралгии, карбамазепин, применяемый при невралгии тройничного нерва, ингибитор Na+-каналов, применяемый в качестве антиаритмического средства (например, мексилетин), ингибиторы Na+-каналов, применяемые в качестве антидепрессанта и противосудорожного средства (например, амитриптилин, карбамазепин) и т.п. Помимо этого, имеется несколько работ (Pain. 83 (1999) 389-400: European Journal of Pain 2 (1998) 3-14; Pain. 73 (1997) 123-139), в которых указывается на тот факт, что антиаритмическое лекарственное средство (мексилетин, лидокаин) является эффективным анальгетиком.
Однако поскольку стандартные ингибиторы Na+-каналов оказывают аналогичное действие как на сердце, так и на нервную систему, то, при лечении обычной невралгии, доза соединения, ингибирующего Na+-каналы, не может быть увеличена, и его анальгезирующее действие явно не проявляется.
Пока еще не существует лекарственного средства, которое обладало бы превосходным действием, направленным на ингибирование Na+-каналов, и удовлетворяло бы требованиям, предъявляемым к его фармакологической активности, дозе, надежности и т.п., как к фармацевтическому средству, и которое, кроме того, было бы эффективным при клиническом применении. А поэтому целью настоящего изобретения является исследование и получение соединения, которое обладало бы превосходным действием, направленным на ингибирование Na+-каналов и которое позволяло бы решить все вышеупомянутые проблемы.
Описание изобретения
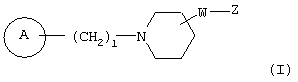
Авторами настоящего изобретения были проведены интенсивные исследования, в результате которых им удалось синтезировать соединение, представляющее собой совершенно новое пиперидиновое соединение формулы (I)
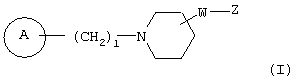
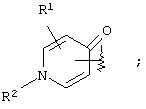
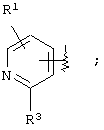
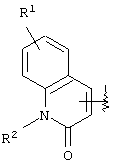
(где кольцо А означает кольцо, представленное формулами
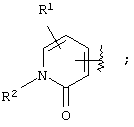
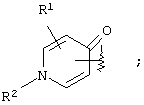
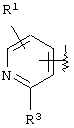
или
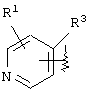
(где R1 означает (1) атом водорода, (2) атом галогена, (3) цианогруппу, (4) необязательно замещенную C1-6алкильную группу, (5) необязательно замещенную С2-6алкенильную группу, (6) необязательно замещенную С2-6алкинильную группу, (7) необязательно замещенную С3-8циклоалкильную группу, (8) необязательно замещенную С3-8циклоалкенильную группу, (9) необязательно замещенную C1-6алкоксигруппу, (10) необязательно замещенную C1-6алкилтиогруппу, (11) необязательно замещенную C1-6алкилсульфинильную группу, (12) необязательно замещенную C1-6алкилсульфонильную группу, (13) необязательно замещенную С6-14ароматическую углеводородную циклическую группу или (14) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу;
R2 представляет (1) атом водорода, (2) необязательно замещенную C1-6алкильную группу, (3) необязательно замещенную С2-6алкенильную группу, (4) необязательно замещенную С2-6алкинильную группу, (5) необязательно замещенную С3-8циклоалкильную группу, (6) необязательно замещенную С3-8циклоалкенильную группу, (7) необязательно замещенную аминогруппу, (8) необязательно замещенную С6-14ароматическую углеводородную циклическую группу или (9) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу;
R3 представляет (1) необязательно замещенную C1-6алкоксигруппу, (2) необязательно замещенную С2-6алкенилоксигруппу, (3) необязательно замещенную С3-7циклоалкилоксигруппу или (4) необязательно замещенную С3-7циклоалкенилоксигруппу;
W представляет (1) простую связь, (2) необязательно замещенную C1-6алкиленовую группу, (3) необязательно замещенную С2-6алкениленовую группу, (4) необязательно замещенную С2-6алкиниленовую группу или (5) группу, представленную формулой -U-V- (где U означает (i) простую связь, (ii) атом кислорода, (iii) атом серы, (iv) группу, представленную формулой -NH-, (v) необязательно замещенную C1-6алкиленовую группу, (vi) необязательно замещенную С2-6алкениленовую группу или (vii) необязательно замещенную С2-6алкиниленовую группу; V означает (i) простую связь, (ii) необязательно замещенную C1-6алкиленовую группу, (iii) необязательно замещенную С2-6алкениленовую группу, (iv) необязательно замещенную С2-6алкиниленовую группу, (v) атом кислорода, (vi) атом серы или (vii) группу, представленную формулой -СО-, (viii) -SO- или (ix) -SO2-, при условии, что исключается случай, где U и V представляют одну и ту же группу в вышеуказанном определении и один из U и V представляет простую связь, необязательно замещенную C1-6алкиленовую группу, необязательно замещенную С2-6алкениленовую группу или необязательно замещенную С2-6алкиниленовую группу) ;
Z представляет (1) необязательно замещенную С2-14ароматическую углеводородную циклическую группу, (2) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу или (3) группу, представленную формулой -N(R4)R5 (где R4 и R5 могут быть одинаковыми или различными и каждый из них представляет (i) атом водорода, (ii) необязательно замещенную C1-6алкильную группу, (iii) необязательно замещенную С2-6алкенильную группу, (iv) необязательно замещенную С2-6алкинильную группу, (v) необязательно замещенную С3-8циклоалкильную группу, (vi) необязательно замещенную С3-8циклоалкенильную группу, (vii) необязательно замещенную С6-14ароматическую углеводородную циклическую группу, (viii) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу или (ix) C1-6алифатическую ацильную группу, либо (х) R4 и R5 могут быть связаны вместе с образованием 3-8-членной азотсодержащей циклической группы);
l означает целое число от 0 до 6,
и, кроме того, авторами было обнаружено, что эти соединения и т.п. обладают превосходным действием, направленным на ингибирование Na+-каналов, а поэтому они могут быть использованы против заболеваний, для лечения или предупреждения которых может оказаться эффективным ингибирование Na+-каналов, например против аритмии (кроме того, снятия у пациента стресса, вызываемого фибрилляцией предсердий, например, сердцебиением, дискомфортом в области грудной клетки, сердечной недостаточностью, тромбами в левом предсердии, тромбоэмболией тромба, приступами), невралгии различных типов (например, диабетической невралгии, ВИЧ-невралгии, постгерпетической невралгии и т.п.) и т.п.). Таким образом, все указанные соединения входят в объем настоящего изобретения.
Таким образом, настоящее изобретение включает 1) соединение, представленное вышеупомянутой формулой (I), его соль или гидрат;
2) в вышеупомянутом соединении 1) W может обозначать группу, представленную формулами -СН2-, -CH2-CH2-, -(СН2)3-, -(CH2)4-, -(CH2)5-, -СН=СН-, -С≡С-, -СО-, -O-, -O-CH2-, -CH2-O-, -CH2-CO-, -(CH2)2-CO-, -CH2-CH(CN)-, -СН2-СН(ОН)-, -SO2-, -CH2-SO2, -NH-CO-, -CH2-NH-CO-, -NH-SO2- или -CH2-NH-SO2-;
3) в вышеупомянутом соединении 1) W может означать группу, представленную формулами -СН2-СН2-, -СН=СН-, -СН≡СН- или СН2-O-,
4) в вышеупомянутом пункте 1) Z может представлять необязательно замещенную С6-14ароматическую углеводородную циклическую группу или необязательно замещенную 5-14-членную ароматическую гетероциклическую группу, 5) в вышеупомянутом пункте 1) Z может представлять необязательно замещенную фенильную группу, пиридильную группу или тиенильную группу, 6) в вышеупомянутом пункте 1) Z может представлять С6-14ароматическую углеводородную циклическую группу или 5-14-членную ароматическую гетероциклическую группу, а указанное кольцо может быть, соответственно, замещено одной или несколькими группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) цианогруппы, (4) необязательно замещенной C1-6алкильной группы, (5) необязательно замещенной С3-8циклоалкильной группы, (6) необязательно замещенной C1-6алкоксигруппы, (7) необязательно замещенной С3-8циклоалкилоксигруппы, (8) необязательно замещенной C1-6алкилтиогруппы, (9) необязательно замещенной С6-14арилоксигруппы, (10) необязательно замещенной 5-14-членной гетероарилоксигруппы, (11) необязательно замещенной аминогруппы, (12) необязательно замещенной 5-14-членной ароматической гетероциклической группы, (13) необязательно замещенной 5-14-членной неароматической гетероциклической группы, (14) C1-6алкилсульфонильной группы и (15) С1-4алкилендиоксигруппы, 7) в вышеупомянутом пункте 1) Z может означать группу, представленную формулой -N(R4)R5 (где R4 и R5 имеют значения, определенные выше, соответственно), 8) в вышеуказанном пункте 7) R4 и R5 могут быть одинаковыми или различными и каждый из них представляет атом водорода, необязательно замещенную C1-6алкильную группу, необязательно замещенную С2-6алкинильную группу, необязательно замещенную С6-14арилС1-6алкильную группу или необязательно замещенную гетероарилС1-6алкильную группу, 9) в вышеупомянутом пункте 7) R4 и R5 могут быть связаны вместе с образованием необязательно замещенной 3-8-членной азотсодержащей циклической группы, 10) в вышеупомянутом пункте 9) Z может представлять пиперидильную группу, которая может быть необязательно замещенной пиперидильной группой, необязательно замещенной пиперазильной группой или необязательно замещенной морфолинильной группой, 11) в вышеупомянутом пункте 1) l может представлять целое число 1, 12) в вышеупомянутом пункте 1) кольцо А может быть представлено формулой
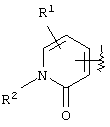
(где R1 и R2 имеют значения, определенные выше, соответственно), 13) в вышеупомянутом пункте 12) R1 может представлять атом водорода, атом галогена или C1-6алкильную группу, 14) в вышеупомянутом пункте 12) R1 может представлять атом водорода, 15) в вышеупомянутом пункте 12) R2 может представлять атом водорода или необязательно замещенную C1-6алкильную группу, 16) в вышеупомянутом пункте 1) кольцо А может быть представлено формулой
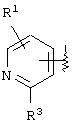
где R1 и R3 имеет значения, определенные выше, соответственно, 17) в вышеупомянутом пункте 16) R3 может представлять гидроксильную группу или C1-6алкоксигруппу, 18) в вышеупомянутом пункте 1) положением присоединения группы -W-Z может быть 2- или 4-положение пиперидинового кольца. Кроме того, настоящее изобретение включает 19) соединение, представленное формулой
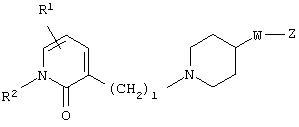
(где R1, R2, W, Z и l имеют те же значения, которые были определены в вышеуказанном пункте 1), его соль или гидрат, 20) соединение, представленное формулой
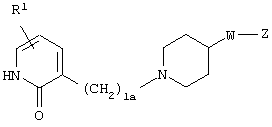
(где R1, W и Z имеют значения, определенные в вышеуказанном пункте 1, соответственно, а la означает целое число 1 или 2), его соль или гидрат, 21) 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(циклогексилметокси)фенил]этил]пиперидин, 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин, 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(фторфенил]этил]пиперидин, 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(изобутилокси)фенил]этил]пиперидин, 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин, 1-[(5-фтор-2-оксо-1,2-дигидро-3-пиридинил) метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин, 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(бензилокси)фенил]-1-этенил]пиперидин, 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин, 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Z)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин, 1-[(5-фтор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин, 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-циклолгексилметилокси)фенил]-1-этинил]пиперидин, 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2,4-(дифторфенокси)метил]пиперидин или 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2,5-(дифторфенокси)метил]пиперидин, их соль или гидрат, 22) способ получения соединения, описанного в вышеуказанном пункте 1), его соли или гидрата, включающий стадию взаимодействия соединения, представленного формулой
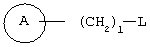
(где кольцо А и l имеют значения, определенные выше в п.1, соответственно; a L представляет уходящую группу), его соли или реакционноспособного производного с соединением, представленным формулой
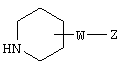
(где W и Z имеют значения, определенные выше в п.1, соответственно), 23) фармацевтическую композицию, содержащую соединение, представленное формулой
(в этой формуле соответствующие символы имеют значения, определенные выше в п.1)), ее соль или гидрат, 24) композицию в вышеуказанном пункте 23), которая может быть ингибитором натриевых каналов или ингибитором калиевых каналов, 25) композицию в вышеуказанном пункте 23), которая может быть средством для предупреждения или лечения аритмии, 26) композицию в вышеуказанном пункте 23), которая может быть лекарственным средством против аритмии класса III по классификации Вона Вильямса, 27) композицию в вышеуказанном пункте 23), которая может быть анальгетиком, 28) композицию в вышеуказанном пункте 23), которая может быть средством для лечения или предупреждения невралгии, и где 29) невралгией в вышеуказанном пункте 28) может быть диабетическая невралгия, ВИЧ-ассоциированная невралгия, посттерапевтическая невралгия, невралгия тройничного нерва, боли в области ампутированной конечности, боли в результате повреждения спинного мозга, таламические боли или послешоковые боли.
Настоящее изобретение относится к использованию соединения, представленного вышеуказанной формулой (I), его соли или гидрата для получения ингибитора натриевых каналов или ингибитора калиевых каналов, средства для лечения или предупреждения аритмии, лекарственного средства против аритмии класса III по классификации Вона Вильямса, анальгетика и средства для лечения или предупреждения невралгии.
Кроме того, настоящее изобретение относится к способу предупреждения или лечения заболевания, эффективным средством против которого является ингибирование натриевых каналов или ингибирование калиевых каналов, где указанный способ предусматривает введение пациенту фармакологически эффективного количества соединения, представленного вышеуказанной формулой (I), или его соли или гидрата.
Кроме того, настоящее изобретение относится к способу предупреждения или лечения аритмии, к лекарственному средству против аритмии класса III по классификации Вона Вильямса, а также к способу лечения или предупреждения боли и невралгии, предусматривающему введение пациенту фармакологически эффективного количества соединения, представленного вышеуказанной формулой (I), его соли или гидрата.
Значения символов, терминов и т.п., описанные в настоящей заявке, приводятся ниже и более подробно иллюстрируют настоящее изобретение.
Кроме того, в описании настоящей заявки структурную формулу соединения представляют как определенный изомер, таким образом, настоящее изобретение включает все геометрические изомеры, которые имеют структуру данного соединения, оптические изомеры на основе асимметрического атома углерода, стереоизомеры, изомеры таутомеров и т.п., и смеси указанных изомеров. Настоящее изобретение не ограничивается описанием указанных формул, приведенных для удобства описания, и может включать один из указанных изомеров и их смеси. В соответствии с этим в соединениях настоящего изобретения может присутствовать оптический активатор и рацемическая структура-основа, которая имеет в данной молекуле асимметрический атом углерода, однако они не ограничивают объема настоящего изобретения и оба они входят в объем изобретения. Изобретение также включает полиморфные формы соединения I, но, аналогично вышеуказанному, изобретение не имеет ограничений, и любая из кристаллических форм может присутствовать отдельно или в виде смеси кристаллических форм и помимо ангидрида может представлять собой гидрат. Так называемый метаболит, который образуется при разложении соединений настоящего изобретения in vivo, также входит в объем, заявленный в настоящей патентной заявке.
Термин "аритмия" в описании настоящего изобретения представляет собой общее название состояний, при которых нарушена регуляция функции сердечных сокращений (нарушение генеза стимулятора и нарушение стимулирующей проводимости), и включает, например, синусовую аритмию, раннюю экстрасистолу, грубую предсердную фибрилляцию, пароксизмальную суправентрикулярнуго тахикардию, синоатриальную блокаду, включает, например, синусовую аритмию, раннюю экстрасистолу, предсердную фибрилляцию, пароксизмальную суправентрикулярную тахикардию, синоатриальную блокаду, атриовентрикулярную блокаду и т.п. Из всех указанный аритмий соединения настоящего изобретения особенно эффективны для лечения фибрилляции предсердий.
Термин "невралгия" в описании настоящего изобретения представляет собой долорифический симптом (истинный или вторичный), возникающий в нервной системе, и означает боль, которая возникает по ходу нерва или в области его локализации. Так, например, этот термин включает такие нарушения, как диабетическая невралгия, ВИЧ-ассоциированная невралгия, боль в области ампутированной конечности, боль после повреждения спинного мозга, таламическая боль, послешоковая боль и т.п. Термин "анальгетик" означает лекарственное средство, которое ослабляет или снимает боль путем изменения восприятия стимулов, не вызывая при этом анастезирующего или бессознательного состояния.
Термин "атом галогена", используемый в описании настоящей заявки, означает атомы, такие как атом фтора, атом хлора, атом брома и атом иода.
Термин "C1-6алкильная группа", используемый в описании настоящей заявки, означает алькильную группу, имеющую от 1 до 6 атомов углерода, и примерами такой группы являются линейные или разветвленные алкильные группы, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, 1,1-диметилпропильная группа, 1,2-диметилпропильная группа, 2,2-диметилпропильная группа, 1-этилпропильная группа, 2-этилпропильная группа, н-гексильная группа, 1-метил-2-этилпропильная группа, 1-этил-2-этилпропильная группа, 1,1,2-триметилпропильная группа, 1-пропилпропильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 1,1-диметилбутильная группа, 1,2-диметилбутильная группа, 2,2-диметилбутильная группа, 1,3-диметилбутильная группа, 2,3-диметилбутильная группа, 2-этилбутильная группа, 2-метилпентильная группа и 3-метилпентильная группа.
Термин "C2-6алкенильная группа", используемый в описании настоящей заявки, означает алкенильную группу, имеющую от 2 до 6 атомов углерода, и примерами такой группы являются линейные или разветвленные алкенильные группы, такие как винильная группа, аллильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 2-метил-1-пропенильная группа, 3-метил-1-пропенильная группа, 2-метил-2-пропенильная группа, 3-метил-2-пропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-пентенильная группа, 1-гексенильная группа, 1,3-гександиенильная группа и 1,6-гександиенильная группа.
Термин "С2-6алкинильная группа", используемый в описании настоящей заявки, означает алкинильную группу, имеющую от 2 до 6 атомов углерода, и примерами такой группы являются линейные или разветвленные алкинильные группы, такие как этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 3-метил-1-пропинильная группа, 1-этинил-2-пропинильная группа, 2-метил-3-пропинильная группа, 1-пентинильная группа, 1-гексинильная группа, 1,3-гександиинильная группа и 1,6-гександиинильная группа.
Термин "С1-6алкоксигруппа", используемый в описании настоящей заявки, означает "C1-6алкилоксигруппу", в которой атом кислорода связан с группой, имеющей те же значения, которые были определены выше для C1-6алкильной группы, и примерами таких групп являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, н-пентилоксигруппа, изопентилоксигруппа, втор-пентилоксигруппа, н-гексоксигруппа, изогексоксигруппа, 1,1-диметилпропилоксигруппа, 1,2-диметилпропоксигруппа, 2,2-диметилпропилоксигруппа, 2-этилпропоксигруппа, 1-метил-2-этилпропоксигруппа, 1-этил-2-метилпропоксигруппа, 1,1,2-триметилпропоксигруппа, 1,1,2-триметилпропоксигруппа, 1,1-диметилбутоксигруппа, 1,2-диметилбутилоксигруппа, 2,2-диметилбутоксигруппа, 2,3-диметилбутилоксигруппа, 1,3-диметилбутилоксигруппа, 2-этилбутоксигруппа, 1,3-диметилбутоксигруппа, 2-метилпентоксигруппа, 3-метилпентоксигруппа и т.п.
Термин "C1-6алкенилоксигруппа"', используемый в описании настоящей заявки, означает группу, в которой атом кислорода связан с группой, имеющей те же значения, которые были определены выше для C1-6алкенильной группы, и предпочтительными примерами таких групп являются винилоксигруппа, аллилоксигруппа, 1-пропенилоксигруппа, 2-пропенилоксигруппа, изопропенилоксигруппа, 2-метил-1-пропенилоксигруппа, 3-метил-1-пропенилоксигруппа, 2-метил-2-пропенилоксигруппа, 3-метил-2-пропенилоксигруппа, 1-бутенилоксигруппа, 2-бутенилоксигруппа, 3-бутенилоксигруппа, 1-пентенилоксигруппа, 1-гексенилоксигруппа, 1,3-гександиенилоксигруппа, 1,6-гександиенилоксигруппа и т.п.
Примерами "С1-6алкилтиогруппы"', используемой в описании настоящей заявки, являются, например, метилтиогруппа, этилтиогруппа, н-пропилтиогруппа, изопропилтиогруппа, н-бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, н-пентилтиогруппа, 1,1-диметилпропилтиогруппа, 1,2-диметилпропилтиогруппа, 2,2-диметилпропилтиогруппа, 1-этилпропилтиогруппа, 2-этилпропилтиогруппа, н-гексилтиогруппа, 1-метил-2-этилпропилтиогруппа, 1-этил-2-этилпропилтиогруппа, 1,1,2-триметилпропилтиогруппа, 1-пропилпропилтиогруппа, 1-метилбутилтиогруппа, 2-метилбутилтиогруппа, 1,1-диметилбутилтиогруппа, 1,2-диметилбутилтиогруппа, 2,2-диметилбутилтиогруппа, 1,3-диметилбутилтиогруппа, 2,3-диметилбутилтиогруппа, 2-этилбутилтиогруппа, 2-метилпентилтиогруппа, 3-метилпентилтиогруппа.
Термин "С3-8циклоалкильная группа", используемый в описании настоящей заявки, означает циклоалкильную группу, в которой кольцо образовано 3-8 атомами углерода, и примерами таких групп являются циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа и т.п. Кроме того, "С3-8циклоалкановая группа", используемая в описании настоящей заявки, означает кольцо, соответствующее вышеупомянутой С3-8циклоалкильной группе.
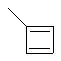
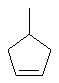
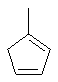
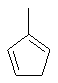
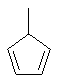
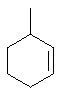
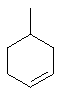
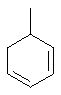
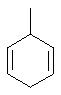
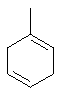
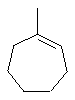
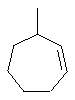
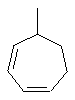
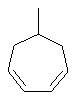
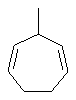
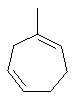
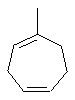
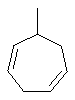
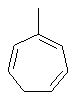
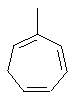
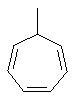
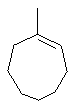
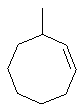
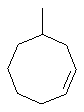
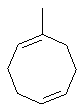
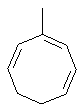
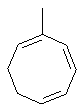
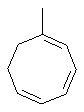
Термин "С3-8циклоалкенильная группа", используемый в описании настоящей заявки, означает циклоалкенильную группу, в которой кольцо образовано 3-8 атомами углерода, и примерами таких групп являются группы, представленные формулами
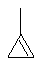
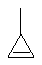
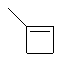
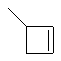




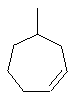
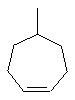
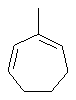
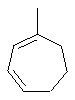

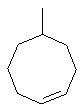

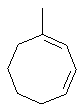
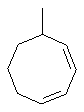


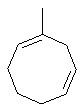
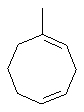
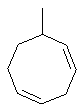
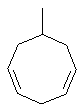
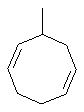
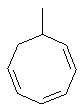
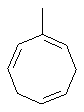

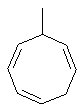 или
или 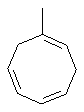
Примерами "С6-14ароматических углеводородных циклических групп", используемых в описании настоящего изобретения, являются моноциклические, бициклические или трициклические С6-14ароматические углеводородные циклические группы, такие как фенильная группа, инденильная группа, 1-нафтильная группа, 2-нафтильная группа, азуленильная группа, гепталенильная группа, бифенильная группа, индатенильная группа, аценафтильная группа, флуоренильная группа, феналенильная группа, фенантренильная группа, антраценильная группа, циклопентациклооктенильная группа и бензоциклооктенильная группа.
Термин "5-14-членная ароматическая гетероциклическая группа", используемый в описании настоящей заявки, означает моноциклическую, бициклическую или трициклическую 5-14-членную ароматическую гетероциклическую группу, содержащую один или несколько гетероатомов, выбранных из атома азота, атома серы и атома кислорода, и примерами таких групп являются: (i) азотсодержащие ароматические гетероциклические группы, такие как пирролильная группа, пиридильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, триазолильная группа, тетразолильная группа, бензотриазолильная группа, пиразолильная группа, имидазолильная группа, бензимидазолильная группа, индолильная группа, изоиндолильная группа, индолизинильная группа, пуринильная группа, индазолильная группа, хинолильная группа, изохинолильная группа, хинолизинильная группа, фталазильная группа, нафтилидинильная группа, хиноксалильная группа, хиназолинильная группа, циннолинильная группа, птеридинильная группа, имидазотриазинильная группа, пиразинопиридазинильная группа, акридинильная группа, фенантридинильная группа, карбазолильная группа, карбазолинильная группа, перимидинильная группа, фенантролинильная группа, фенацинильная группа, имидазопиридинильная группа, имидазопиримидинильная группа, пиразолпиридинильная группа; (ii) серосодержащие ароматические гетероциклические группы, такие как тиенильная группа и бензотиенильная группа; (iii) кислородсодержащие ароматические гетероциклические группы, такие как фурильная группа, пиранильная группа, циклопентапиранильная группа, бензофуранильная группа и изобензофуранильная группа; (iv) ароматические гетероциклические группы, содержащие 2 или более различных гетероатомов, выбранных из атома азота, атома серы и атома кислорода, такие как тиазолильная группа, изотиазолильная группа, бензотиазолильная группа, фенотиазинильная группа, изоксазолильная группа, фуразанильная группа, феноксазинильная группа, оксазолильная группа, бензоксазолильная группа, оксадиазолильная группа, пиразолоксазолильная группа, имидазотиазолильная группа, тиенофуранильная группа, фуропирролильная группа и пиридоксазинильная группа.
Термин "5-14-членное неароматическое гетероциклическое кольцо", используемый в описании настоящей заявки, означает моноциклическое, бициклическое или трициклическое 5-14-членное неароматическое гетероциклическое кольцо, содержащее любой один или несколько гетероатомов, выбранных из атома азота, атома серы и атома кислорода, и примерами таких колец являются пирролидиновое, пирролиновое, пиперидиновое, пиперазиновое, имидазолиновое, пиразолидиновое, имидазолидиновое, морфолиновое, тетрагидрофурановое, тетрагидропирановое, азиридиновое, оксирановое, оксатиорановое и пиридоновое кольцо, и конденсированные кольца, такие как фталимидное кольцо и сукцинимидное кольцо.
Термин "углеводородная группа", используемый в описании настоящей заявки, в частности, означает C1-6алкильную группу, С2-6алкенильную группу, С2-6алкинильную группу, С3-8циклоалкильную или С3-8циклоалкенильную группу, и соответствующие значения этих групп являются такими, как они были определены выше.
В соединении настоящего изобретения, представленном вышеуказанной формулой (I), особенно предпочтительный аспект для каждой группы описан ниже.
В группе, представленной формулами

 или
или 
(где R1, R2 и R3 являются такими, как они были определены выше в пункте 1), и показанной А в вышеуказанной формуле (I), предпочтительным "атомом галогена", обозначенным R1, является атом фтора, атом хлора и атом брома, а более предпочтительными являются атомы фтора и хлора.
"C1-6алкильной группой" в "C1-6алкильной группе, которая может быть замещенной", представленной вышеупомянутыми R1 и R2, предпочтительно является метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа и т.п. Кроме того, "С2-6алкенильной группой" в "С2-6алкенильной группе, которая может быть замещенной", представленной R1 или R2, предпочтительно является винильная группа, аллильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-пентенильная группа, 1-гексенильная группа и т.п. Кроме того, "C2-6алкинильной группой" в "С2-6алкинильной группе, которая может быть замещенной", представленной вышеупомянутыми R1 или R2, предпочтительно является этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-пентинильная группа, 1-гексинильная группа и т.п.
"С3-8циклоалкильной группой" в "С3-8циклоалкильной группе, которая может быть замещенной", представленной вышеупомянутыми R1 или R2, предпочтительно является циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и т.п. Кроме того, "С3-8циклоалкенильной группой" в "С3-8циклоалкенильной группе, которая может быть замещенной", представленной R1 или R2, предпочтительно является циклобутенильная группа, циклопентенильная группа, циклогексенильная группа и т.п.
"C1-6алкоксигруппой" в "C1-6алкоксигруппе, которая может быть замещенной", представленной вышеупомянутыми R1 или R3, предпочтительно является метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, н-пентилоксигруппа, изопентилоксигруппа, втор-пентилоксигруппа, н-гексоксигруппа, изогексоксигруппа и т.п. Кроме того, "C1-6алкенилоксигруппой" в "С2-6алкенилоксигруппе, которая может быть замещенной", представленной вышеупомянутым R3, предпочтительно является винилоксигруппа, аллилоксигруппа, 1-пропенилоксигруппа, 2-пропенилоксигруппа, изопропенилоксигруппа, 2-метил-1-пропенилоксигруппа, 3-метил-1-пропенилоксигруппа, 2-метил-2-пропенилоксигруппа, 3-метил-2-пропенилоксигруппа, 1-бутенилоксигруппа, 2-бутенилоксигруппа, 3-бутенилоксигруппа, 1-пентенилоксигруппа, 1-гексенилоксигруппа, 1,3-гександиенилоксигруппа, 1,6-гександиенилоксигруппа и т.п.
"C1-6алкилтиогруппой" в "C1-6алкилтиогруппе, которая может быть замещенной", представленной вышеупомянутым R1, предпочтительно является метилтиогруппа, этилтиогруппа, н-пропилтиогруппа, изопропилтиогруппа, н-бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, н-пентилтиогруппа, н-гексилтиогруппа и т.п.
"C1-6алкилсульфинильной группой" в "C1-6алкилсульфинильной группе, которая может быть замещенной", представленной вышеупомянутым R1, предпочтительно является метилметилсульфинильная группа, этилсульфинильная группа, н-пропилсульфинильная группа, изопропилсульфинильная группа, н-бутилсульфинильная группа, изобутилсульфинильная группа, втор-бутилсульфинильная группа, трет-бутилсульфинильная группа, н-пентилсульфинильная группа, н-гексилсульфинильная группа и т.п.
"C1-6алкилсульфонильной группой" в "C1-6алкилсульфонильной группе, которая может быть замещенной", представленной вышеупомянутым R1, предпочтительно является метилметилсульфонильная группа, этилсульфонильная группа, н-пропилсульфонильная группа, изопропилсульфонильная группа, н-бутилсульфонильная группа, изобутилсульфонильная группа, втор-бутилсульфонильная группа, трет-бутилсульфонильная группа, н-пентилсульфонильная группа, н-гексилсульфонильная группа и т.п.
"С6-14ароматической углеводородной циклической группой" в "С6-14ароматической углеводородной циклической группе, которая может быть замещенной", представленной вышеупомянутыми R1 или R2, предпочтительно является фенильная группа, нафтильная группа и т.п. Кроме того, "5-14-членной ароматической гетероциклической группой" в "5-14-членной ароматической гетероциклической группе, которая может быть замещенной", представленной вышеупомянутыми R1 или R2, предпочтительно является пиридильная группа, пиразильная группа, пиридинильная группа, пиридазинильная группа, тиенильная группа, тиазолильная группа, имидазолильная группа, фурильная группа и т.п.
В качестве предпочтительного заместителя аминогруппы в "аминогруппе, которая может быть замещенной", представленной вышеупомянутым R2, могут быть упомянуты, например, (1) C1-6алкильная группа, которая может быть замещенной (например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа, которые могут быть, соответственно, замещенными),
(2) C2-6алкенильная группа, которая может быть замещенной (например, винильная группа, аллильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-пентенильная группа, 1-гексенильная группа и т.п., которые могут быть соответственно замещенными),
(3) С2-6алкинильная группа, которая может быть замещенной (например, этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-пентинильная группа, 1-гексинильная группа и т.п., которые могут быть соответственно замещенными),
(4) С3-8циклоалкильная группа, которая может быть замещенной (например, циклопропенильная группа, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и т.п., которые могут быть соответственно замещенными),
(5) С3-8циклоалкенильная группа, которая может быть замещенной (например, циклобутенильная группа, циклопентенильная группа, циклогексенильная группа и т.п., которые могут быть соответственно замещенными), (6) ацильная группа, (7) карбамоильная группа, которая может быть замещенной, и т.п. Соответствующая аминогруппа может иметь в качестве заместителей одну или две группы, выбранные из указанных групп, а более предпочтительными примерами такой аминогруппы является незамещенная аминогруппа, метиламиногруппа, диметиламиногруппа, этиламиногруппа, диэтиламиногруппа, н-пропиламиногруппа, ди(н-пропил)аминогруппа, изопропиламиногруппа, ди(изопропил)аминогруппа и т.п.
"С3-7циклоалкилоксигруппой" в "С3-7циклоалкилоксигруппе, которая может быть замещенной", представленной вышеупомянутым R3, предпочтительно является циклопропилоксигруппа, циклобутилоксигруппа, циклопентилоксигруппа, циклогексилоксигруппа и т.п. Кроме того, "С3-7циклоалкенилоксигруппой" в "С3-7циклоалкенилоксигруппе, которая может быть замещенной", представленной вышеупомянутым R3, предпочтительно является циклобутенилоксигруппа, циклопентенилоксигруппа, циклогексенилоксигруппа и т.п.
Предпочтительными примерами "заместителя" C1-6алкильной группы, С2-6алкенильной группы, С2-6алкинильной группы, С3-8циклоалкильной группы, С3-8циклоалкенильной группы, C1-6алкоксигруппы, C1-6алкилтиогруппы, C1-6алкилсульфинильной группы, C1-6алкилсульфонильной группы, С6-14ароматической углеводородной циклической группы, 5-14-членной ароматической гетероциклической группы, С2-6алкенилоксигруппы, С3-7циклоалкилоксигруппы, С3-7циклоалкенилоксигруппы, представленными вышеупомянутыми R1, R2 или R3 и необязательно замещенными, соответственно, являются (1) гидроксильная группа, (2) атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), (3) цианогруппа, (4) нитрогруппа, (5) C1-6алкильная группа (например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа и т.п.), (6) С2-6алкенильная группа (например, винильная группа, аллильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-пентенильная группа, 1-гексенильная группа и т.п.),
(7) С2-6алкинильная группа (например, этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-пентинильная группа, 1-гексинильная группа и т.п.),
(8) С3-8циклоалкильная группа (например, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и т.п.),
(9) C1-6алкоксигруппа (например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа и т.п.),
(10) C1-6алкилтиогруппа (например, метилтиогруппа, этилтиогруппа и т.п., (11) 5-14-членная неароматическая гетероциклическая группа (например, пиперидильная группа, пиперазильная группа, морфолинильная группа и т.п.), (12) С6-14ароматическая гетероциклическая группа (например, фенильная группа, нафтильная группа и т.п.), (13) 5-14-членная ароматическая углеводородная группа (например, пиридильная группа, тиенильная группа, фурильная группа, тиазолильная группа и т.п.), (14) аминогруппа, которая может быть замещенной (например, аминогруппа, которая может быть замещена одной или двумя группами, выбранными из C1-6алкильной группы, C1-6алкенильной группы, C1-6алкинильной группы, С3-8циклоалкильной группы, С3-8циклоалкенильной группы, ацильной группы, карбамильной группы, которые могут быть замещенными, С1-6алкилсульфонильной группы и т.п. (например, незамещенная аминогруппа, метиламиногруппа, диметиламиногруппа, этиламиногруппа, диэтиламиногруппа, н-пропиламиногруппа, ди(н-пропил)аминогруппа, изопропиламиногруппа, ди(изопропил)аминогруппа и т.п.), либо указанные заместители, взятые вместе, образуют азотсодержащую циклическую группу, которая содержит атомы азота, с которыми они связаны). В качестве заместителя они могут иметь одну или несколько групп, выбранных из вышеуказанных групп.
Примерами более предпочтительной группы из вышеупомянутого R1 являются атом водорода или атом галогена (например, атом фтора, атом хлора, атом брома и т.п.). Кроме того, примерами более предпочтительной группы, представленной R2, являются атом водорода, C1-6алкильная группа, галогенированная C1-6алкильная группа, С1-6алкоксиС1-6алкильная группа, С3-8циклоалкилС1-6алкильная группа, аралкильная группа (например, бензильная группа, фенетильная группа и т.п.), моно(C1-6алкил)аминоС1-6алкильная группа и ди(C1-6алкил)аминоалкильная группа, а наиболее предпочтительным является атом водорода. Кроме того, примерами более предпочтительной группы, представленной R3, является C1-6алкоксигруппа, которая может быть необязательно замещенной, а наиболее предпочтительной является метоксигруппа.
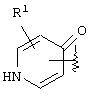
В предпочтительном аспекте настоящего изобретения в соединении, представленном вышеуказанной формулой (I), кольцо А представлено формулами

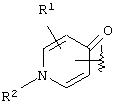 или
или 
где R1, R2 и R3 имеют те же самые значения, которые были определены в вышеупомянутом пункте 1. В частности, предпочтительным является кольцо, представленное формулами
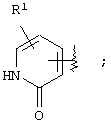
 или
или 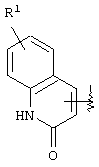
Примерами "C1-6алкиленовой группы, которая может быть замещенной", "C1-6алкениленовой группы, которая может быть замещенной" или "С2-6алкиниленовой группы, которая может быть замещенной", представленными W в вышеуказанной формуле (I), является группа, которая может быть необязательно замещенной и которая представлена формулами -СН2-, -СН2-СН2-, -(СН2)3-, -(СН2)4-, -(СН2)5-, -(СН2)6-, -СН=СН-, -СН=СН-СН2-, -СН2-СН=СН-, -СН2-СН2-СН=СН, -СН2-СН=СН-СН2-, 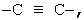
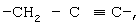
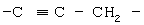 или
или 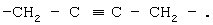 Кроме того, примерами "заместителя" C1-6алкиленовой группы, С2-6алкениленовой группы и С2-6алкиниленовой группы являются гидроксильная группа, атом галогена, цианогруппа, С6-14ароматическая углеводородная циклическая группа (например, фенильная группа и т.п.), 5-14-членная ароматическая гетероциклическая группа (например, пиридильная, тиенильная, фурильная группа и т.п.) и т.п., причем предпочтительными являются гидроксильная группа и цианогруппа.
Кроме того, примерами "заместителя" C1-6алкиленовой группы, С2-6алкениленовой группы и С2-6алкиниленовой группы являются гидроксильная группа, атом галогена, цианогруппа, С6-14ароматическая углеводородная циклическая группа (например, фенильная группа и т.п.), 5-14-членная ароматическая гетероциклическая группа (например, пиридильная, тиенильная, фурильная группа и т.п.) и т.п., причем предпочтительными являются гидроксильная группа и цианогруппа.
Примерами предпочтительной группы, представленной W в вышеуказанной формуле (I), является группа, которая может необязательно замещенной и которая представлена формулами: -СН2-, -СН2-СН2-, -(СН2)3-, -(СН2)4-, -(СН2)5-, -(СН2)6-, -СН=СН-, -СН=СН-СН2-, -СН2-СН=СН-, -СН2-СН2-СН=СН-, -СН2-СН=СН-СН2, 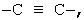
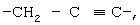
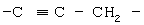 или
или 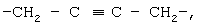 либо группа, представленная формулами -CH2-CO-, -CH2-CH2-CO, (СН2)3-СО-, -СН=СН-СО-, -СН=СН-СН2-СО-,
либо группа, представленная формулами -CH2-CO-, -CH2-CH2-CO, (СН2)3-СО-, -СН=СН-СО-, -СН=СН-СН2-СО-, 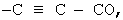 -СН2-О-, -О-СН2-, -СН2-СН2-О-, (СН2)3-О-, -СН-СН-О-, -СН=СН-СН2-О-,
-СН2-О-, -О-СН2-, -СН2-СН2-О-, (СН2)3-О-, -СН-СН-О-, -СН=СН-СН2-О-, 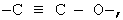 -CH2-SO2-, -CH2-CH2-SO2-, -(СН2)3-SO2-, -CH=CH-SO2-, -CH=CH-CH2-SO2-,
-CH2-SO2-, -CH2-CH2-SO2-, -(СН2)3-SO2-, -CH=CH-SO2-, -CH=CH-CH2-SO2-, 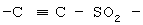 , -CH2-NH-CO-, -CH2-CH2-NH-CO-, (СН2)3-NH-CO-, -CH=CH-NH-CO-, -CH=CH-CH2-NH-CO-,
, -CH2-NH-CO-, -CH2-CH2-NH-CO-, (СН2)3-NH-CO-, -CH=CH-NH-CO-, -CH=CH-CH2-NH-CO-, 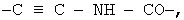 -CH2-NH-SO2-, -CH2-CH2-NH-SO2-, -(CH2)3-NH-SO2-, -CH=CH-NH-SO2-, -CH=CH-CH2-NH-SO2- или
-CH2-NH-SO2-, -CH2-CH2-NH-SO2-, -(CH2)3-NH-SO2-, -CH=CH-NH-SO2-, -CH=CH-CH2-NH-SO2- или  а более предпочтительной является группа, представленная формулами -СН2-СН2-, -СН=СН-, -С≡С-, -СН2-O и тому подобное.
а более предпочтительной является группа, представленная формулами -СН2-СН2-, -СН=СН-, -С≡С-, -СН2-O и тому подобное.
Предпочтительными примерами "С6-14ароматической углеводородной циклической группы" в "С6-14ароматической углеводородной циклической группе, которая может быть замещенной", представленной Z в вышеуказанной формуле (I), является фенильная группа, нафтильная группа (например, 1-нафтильная группа, 2-нафтильная группа и т.п.), азуленильная группа, гепталенильная группа и т.п.
Примерами предпочтительной группы, называемой "5-14-членной ароматической гетероциклической группой, которая может быть замещенной", представленной Z в вышеуказанной формуле (I), является пирролильная, пиридильная группа, тиенильная группа, пиридазильная группа, пиримидильная группа, пиразильная группа, имидазолильная группа, пиразолильная группа, индолильная группа, хинолильная группа, хиназолильная группа, тиазолильная группа, бензотиенильная группа и т.п.
Если Z в вышеуказанной формуле (I) представляет "С6-14ароматическую углеводородную циклическую группу, которая может быть замещенной", или "5-14-членную ароматическую гетероциклическую группу, которая может быть замещенной", то "заместителем" является одна или несколько групп, выбранных из (1) гидроксильной группы, (2) атома галогена (например, атома фтора, атома хлора и атома брома), (3) нитрильной группы, (4) углеводородной группы, которая может замещена одной или несколькими группами, выбранными из (i) атома галогена, (ii) С6-14ароматической углеводородной циклической группы (фенильной группы, нафтильной группы), которая может быть замещена атомом галогена (например, атомом фтора и атомом хлора), (iii) 5-14-членной ароматической гетероциклической группы (например, пиридильной группы, тиенильной группы, фурильной группы, тиазольной группы и т.п.), которая может быть замещена атомом галогена (например, атомом фтора и атомом хлора), (iv) C1-6алкилсульфонильной группы и т.п., такой как C1-6алкильная группа, С2-6алкенильная группа, С2-6алкинильная группа, С3-8циклоалкильная группа или С3-8циклоалкенильная группа, (5) C1-6алкоксигруппы (метоксигруппы, этоксигруппы, н-пропоксигруппы, изопропоксигруппы), которая может быть замещена одной или несколькими группами, выбранными из (i) гидроксильной группы, (ii) атома галогена (например, атома фтора, атома хлора и т.п.), (iii) C1-6алкоксигруппы, (iv) сульфонильной группы, замещенной углеводородной группой (C1-6алкильной группой, C2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), (5) аминогруппы, замещенной углеводородной группой (C1-6алкильной группой, С1-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), (6) С3-7циклоалкилоксигруппы, которая может быть замещена (i) гидроксильной группой, (ii) атомом галогена (например, атомом фтора, атомом хлора и т.п.), (iii) C1-6алкоксигруппой, (iv) сульфонильной группой, замещенной углеводородной группой (C1-6алкильной группой, C2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), (v) аминогруппой, замещенной углеводородной группой (C1-6алкильной группой, С2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), (7) С6-14арилоксигруппы (например, феноксигруппы), которая может быть замещена атомом галогена (например, атомом фтора, атомом хлора и т.п.), (8) гетероарилоксигруппы (например, пиридилоксигруппы, тиенилоксигруппы, фурилоксигруппы и т.п.), которая может быть замещена атомом галогена (например,, атомом фтора, атомом хлора и т.п.), (9) углеводородтиогруппы (например, метилтиогруппы, этилтиогруппы, н-пропилтиогруппы, изопропилтиогруппы и т.п.), которая может быть замещена группой, выбранной из (i) гидроксильной группы, (ii) атома галогена (например, атома фтора, атома хлора и т.п.), (iii) C1-6алкоксигруппы, (iv) сульфонильной группы, замещенной углеводородной группой (C1-6алкильной группой, С2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой) и (v) аминогруппы, которая может быть замещена углеводородной группой (C1-6алкильной группой, С2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), (10) ацильной группы, представленной формулой -CO-N(R6)R7 (где R6 и R7 являются одинаковыми или различными и каждый из них представляет (i) атом водорода или (ii) углеводородную группу (C1-6алкильную группу, С2-6алкенильную группу, С2-6алкинильную группу, С3-8циклоалкильную группу или С3-8циклоалкенильную группу), которая может быть замещена атомом галогена (например, атомом фтора, атомом хлора и т.п.), либо R6 и R7, взятые вместе, могут образовывать 3-7-членное азотсодержащее неароматическое гетероциклическое кольцо (например, пиперидиновое, пиперазиновое, морфолиновое кольцо и т.п.), которое содержит один или два атома, выбранных из атома азота, атома серы и атома кислорода), (11) 5-14-членной ароматической гетероциклической группы (например, фенильной группы, нафтильной группы, пиридильной группы, тиенильной группы, фурильной группы, тиазольной группы и т.п.), которая может быть замещена группой, выбранной из (i) гидроксильной группы, (ii) атома галогена (например, атома фтора, атома хлора и т.п.), (iii) углеводородной группы (C1-6алкильной группы, С2-6алкенильной группы, С2-6алкинильной группы, С3-8циклоалкильной группы или С3-8циклоалкенильной группы), которая может быть замещена атомом галогена (например, атомом фтора, атомом хлора и т.п.), (iv) C1-6алкоксигруппы (метоксигруппы, этоксигруппы, н-пропоксигруппы, изопропоксигруппы и т.п.) и (v) C1-6алкоксигруппы (метоксигруппы, этоксигруппы, н-пропоксигруппы, изопропоксигруппы и т.п.), замещенной углеводородной группой (C1-6алкильной группой, С1-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), которая может быть замещена атомом галогена (например, атомом фтора, атомом хлора и т.п.), (12) 3-8-членной неароматической гетероциклической группы (пиперидильной группы, пиперазильной группы, морфолинильной группы и т.п.), которая содержит один или два атома, выбранных из атома азота, атома серы и атома кислорода), (13) сульфонильной группы, замещенной углеводородной группой (C1-6алкильной группой, С2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой), (14) сульфонамидной группы, которая может быть замещена углеводородной группой (С1-6алкильной группой, С2-6алкенильной группой, С2-6алкинильной группой, С3-8циклоалкильной группой или С3-8циклоалкенильной группой) и (15) С1-4алкилендиоксигруппы (например, метилендиоксигруппы, этилендиоксигруппы и пропилендиоксигруппы). В качестве примера могут служить гидроксильная группа, нитрильная группа, атом галогена (атом фтора, атом хлора, атом брома), метильная группа, этильная группа, н-бутильная группа, трифторметильная группа, метоксигруппа, этоксигруппа, циклопропилметоксигруппа, 2,2,2-трифторэтоксигруппа, 2-метоксиэтоксигруппа, 2-гидроксиэтоксигруппа, 2-(N,N-диметиламино)этоксигруппа, феноксигруппа, фенильная группа, имидазолильная группа, пиразолильная группа, тиазолильная группа, метоксифенильная группа, пиперидильная группа, пиперазильная группа, морфолинильная группа, N-ацетилпиперазильная группа, метилсульфонильная группа, аминогруппа, трифторацетиламиногруппа, метилсульфонильная группа, этилсульфонильная группа, алкилендиоксигруппа и т.п. В настоящем описании "C1-6алкильная группа", "С2-6алкенильная группа", "С2-6алкинильная группа", "С3-8циклоалкильная группа" и "С3-8циклоалкенильная группа", представленные в качестве "углеводородной группы" имеют значения, определенные выше, соответственно.
В группе, представленной формулой -N(R4)R5 (где R4 и R5 имеют значения, определенные выше), обозначенной Z в вышеуказанной формуле (I), "C1-6алкильной группой" в "C1-6алкильной группе, которая может быть замещенной", представленной R4 или R5, предпочтительно является метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа и т.п., "С2-6алкенильной группой" в "С2-6алкенильной группе, которая может быть замещенной", предпочтительно является винильная группа, аллильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-пентенильная группа, 1-гексенильная группа и т.п. и "С2-6алкинильной группой" в "С2-6-алкинильной группе, которая может быть замещенной", предпочтительно является этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-пентинильная группа, 1-гексинильная группа и т.п. Кроме того, "С3-8циклоалкильной группой" в "С3-8-циклоалкильной группе, которая может быть замещенной", представленной R4 или R5, предпочтительно является циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и т.п. и "С3-8циклоалкенильной группой" в "С3-8-циклолкенильной группе, которая может быть замещенной", предпочтительно является циклобутенильная группа, циклопентенильная группа, циклогексенильная группа и т.п. Кроме того, "С6-14ароматической углеводородной циклической группой" в "С6-14ароматической углеводородной циклической группе, которая может быть замещенной", представленной R4 или R5, предпочтительно является фенильная группа, нафтильная группа и т.п. "5-14-членной ароматической гетероциклической группой" в "5-14-членной ароматической гетероциклической группе, которая может быть замещенной", предпочтительно является пиридильная группа, пиразильная группа, пиримидильная группа, пиридазинильная группа, тиенильная группа, тиазолильная группа, имидазолильная группа, фурильная группа и т.п.
Если вышеупомянутые R4 или R5 являются одинаковыми или различными, и каждый из них представляет C1-6алкильную группу, которая может быть замещенной, С2-6алкенильную группу, которая может быть замещенной, С2-6алкинильную группу, которая может быть замещенной, С3-8циклоалкильную группу, которая может быть замещенной или С3-8циклоалкенильную группу, которая может быть замещенной, то предпочтительными примерами указанного "заместителя" являются (1) гидроксильная группа, (2) атом галогена (например, атом фтора, атом хлора, атом брома, атом иода), (3) C1-6алкоксигруппа, которая может быть замещенной (например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, трет-бутоксигруппа и т.п., которые могут быть замещены атомами галогена, соответственно), (4) С6-14ароматическая углеводородная циклическая группа, которая может быть замещенной (например, 5-14-членная ароматическая группа, которая может быть замещена одной или несколькими группами, выбранными из гидроксильной группы, атома галогена, углеводородной группы, которая может быть замещена атомом галогена, C1-6алкоксигруппы, которая может быть замещена атомом галогена, и 5-14-членной ароматической группы), (5) 5-14-членная ароматическая гетероциклическая группа, которая может быть замещенной (например, 5-14-членная ароматическая группа, которая может быть замещена любой одной или несколькими группами, выбранными из гидроксильной группы, атома галогена, углеводородной группы, которая может быть замещена атомом галогена, C1-6алкоксигруппы, которая может быть замещена атомом галогена, и 5-14-членной ароматической группы и т.п.) и т.п. Конкретными примерами таких групп являются одна или две группы, выбранные из этильной группы, 2-метилпропильной группы, изопропильной группы, н-пентильной группы, н-октильной группы, трет-бутильной группы, гидрокси-трет-бутильной группы, циклогексильной группы, циклопропилметильной группы, 1-циклопропилэтильной группы, 2-циклопропилэтильной группы, 2,2,2-трифторэтильной группы, морфолилэтильной группы, гидроксиэтильной группы, гидроксипропильной группы, 5-фенилпентильной группы, 2-пропин-1-ильной группы, 1,2-диметилпропильной группы, 2-этил-н-бутильной группы, бензильной группы, фенэтильной группы, галогенированной бензильной группы, гидроксибензильной группы, о-фенилбензильной группы, метилсульфонилбензильной группы, метилсульфониламинобензильной группы, пиридилметильной группы, фурилметильной группы, N-метилпирролилэтильной группы, дифенилметильной группы, метилендиоксифенилметильной группы, метоксипиридилметильной группы и диметиламинометильной группы.
Если вышеупомянутые R4 и R5 являются одинаковыми или различными, и каждый из них необязательно замещен С6-14ароматической углеводородной циклической группой, 5-14-членной ароматической гетероциклической группой, то предпочтительными примерами указанного "заместителя" являются (1) гидроксигруппа, (2) атом галогена, (3) нитрильная группа, (4) углеводородная группа, которая может быть замещена заместителем, таким как атом галогена, 5-14-членная ароматическая группа, которая может быть замещена атомом галогена и C1-6алкилсульфонильной группой, (5) C1-6алкоксигруппа, которая может быть замещена заместителем, таким как гидроксильная группа, атом галогена, C1-6алкоксигруппа, сульфонильная группа, замещенная, углеводородной группой, и аминогруппа, которая может быть замещена углеводородной группой, (6) С3-7циклоалкилоксигруппа, которая может быть замещена заместителем, таким как гидроксильная группа, атом галогена, C1-6алкоксигруппа, сульфонильная группа, замещенная углеводородной группой, и аминогруппа, которая может быть замещена углеводородной группой, (7) (С6-10арил)оксигруппа, которая может быть замещена атомом галогена и т.п., (8) (5-14-членный гетероарил)оксигруппа, которая может быть замещена атомом галогена и т.п., (9) углеводородтиогруппа, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6алкоксигруппы, сульфонильной группы, замещенной углеводородной группой, и аминогруппы, которая может быть замещена углеводородной группой, (10) ацильная группа, представленная формулой -CO-N(R12)R13 (где R12 и R13 являются одинаковыми или различными, и каждый из них представляет атом водорода или углеводородную группу, которая может быть замещена атомом галогена, и, кроме того, в формуле -CO-N(R12)R13, R12 и R13, взятые вместе, могут образовывать 3-7-членное азотсодержащее неароматическое гетероциклическое кольцо, содержащее один или два атома, выбранных из атома азота, атома кислорода и атома серы), (11) 5-14-членная ароматическая группа, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, углеводородной группы, которая может быть замещена атомом галогена, и углеводородной C1-6алкоксигруппы, которая может быть замещена атомом галогена, (12) 3-7-членная неароматическая гетероциклическая группа, которая содержит один или два атома, выбранных из атома азота, атома кислорода и атома серы), (13) сульфонильная группа, замещенная углеводородной группой, (14) сульфонамидная группа, которая может быть замещена углеводородной группой, (15) C1-2алкилендиоксигруппа и т.п.
"C1-6алифатическая ацильная группа", представленная вышеупомянутыми R4 или R5, означает карбонильную группу, которая была замещена группами, такими как C1-6алкильная группа, С2-6алкенильная группа, С2-6алкинильная группа, С1-6алкоксиС1-6алкильная группа, C1-6алкоксигруппа, С6-14арильная группа, 5-14-членная ароматическая гетероциклическая группа и т.п., а предпочтительными примерами являются ацетильная группа, этилкарбонильная группа и т.п.
В вышеуказанной формуле (I) Z может означать 3-8-членную азотсодержащую циклическую группу, образуемую R4 и R5 в формуле -N(R4)R5, связанными вместе, а предпочтительными примерами указанной группы являются пиперидильная группа, пиперазильная группа, морфолинильная группа и т.п.
В вышеуказанной формуле (I) символ l указывает на целое число 0, 1, 2, 3, 4, 5 или 6, при этом предпочтительным является целое число от 1 до 3, более предпочтительным является целое число 1 или 2, а еще более предпочтительным является целое число 1.
Предпочтительным соединением формулы (I) настоящего изобретения является соединение, представленное формулой

(где R1, R2, W, Z и l имеют значения, определенные выше, соответственно), его соль или гидрат, а в качестве особенно предпочтительного аспекта предложено соединение, представленное формулой
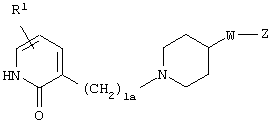
(где R1, W и Z имеют значения, определенные выше, соответственно), его соль или гидрат.
Термин "соль" в описании настоящего изобретения не имеет конкретных ограничений, если только она может быть образована соединением настоящего изобретения и является фармакологически приемлемой. Предпочтительной солью является соль галогеноводородной кислоты (например, гидрофторид, гидрохлорид, гидробромид, гидроиодид и т.п.), соль неорганической кислоты (например, сульфат, нитрат, перхлорат, фосфат, карбонат, бикарбонат и т.п.), соль органической кислоты (например, ацетат, трифторацетат, оксалат, малеат, тартрат, фумарат, цитрат и т.п.), соль сульфонорганической кислоты (например, метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, камфорсульфонат и т.п.), соль аминокислоты (например, аспартат, глутамат и т.п.), соль четвертичного аммония, соль щелочного металла (например, натриевая соль, калиевая соль и т.п.), соль щелочноземельного металла (например, магниевая соль, кальциевая соль и т.п.). Более предпочтительными являются гидрохлорид, оксалат, трифторацетат и т.п.
Типичный способ продуцирования соединения, представленного вышеуказанной формулой (I) настоящего изобретения, описан ниже.
Способ получения 1
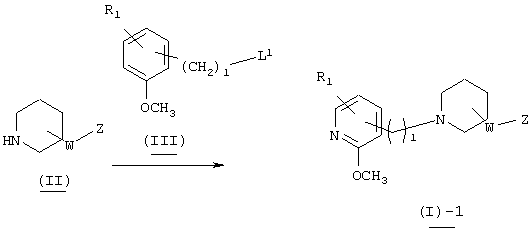
В вышеуказанной формуле R1, W, Z и l имеют значения, определенные выше, a L1 означает уходящую группу (например, атом галогена, тозилат и т.п.) или альдегидную группу. Соединение (I)-1 настоящего изобретения может быть получено посредством конденсации пиперидинового производного (II) с пиридиновым производным (III) в растворителе методом восстановительного аминирования или посредством их конденсации в присутствии основания. При применении метода восстановительного аминирования используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, этилацетат, диметилформамид (ДМФ), диметилсульфоксид (ДМСО), 1-метилпирролидон, ацетонитрил и т.п. В качестве восстановителя могут быть использованы гидриды металлов, такие как борогидрид натрия, триацетоксиборогидрид натрия и т.п. Кроме того, может быть осуществлен метод каталитического восстановления, который обычно используется в этих случаях. Количество используемого восстановителя составляет 1-5 эквивалентов по отношению к исходному материалу. Температура реакции обычно составляет от -50°С до температуры кипения растворителя, а предпочтительно примерно от 0°С до 25°С. В случае конденсации в присутствии основания могут быть использованы все органические растворители, которые являются инертными по отношению к данной реакции, и такими растворителями могут быть, например, бензол, дихлорметан, ацетонитрил, ТГФ, диоксан, диметилформамид, диметилсульфоксид, 1-метилпирролидон и т.п. Основания не имеют конкретных ограничений, но предпочтительными являются гидрид натрия, трет-бутоксид калия, диизопропиламид лития, карбонат калия, гидроксид натрия и т.п. Количество используемого основания составляет 1-10 эквивалентов по отношению к исходному материалу. Температура реакции обычно составляет от -50°С до температуры кипения растворителя, а предпочтительно от 20°С до 80°С.
Ниже описан способ получения в случае, когда в вышеуказанной формуле (I) W представляет "углеводородную цепь, которая может быть замещенной"
Способ получения 2
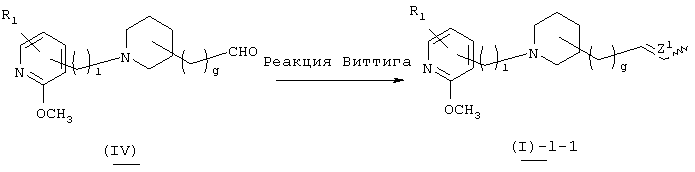
В вышеуказанной формуле R1 и l имеют значения, определенные выше, a Z1 означает 5-14-членную ароматическую группу, которая может быть замещенной, а g означает 0, 1 и 2. Пиридилпиперидиновое производное (I)-1-1 настоящего изобретения может быть получено путем осуществления реакции Виттига или аналогичной реакции, которой подвергают пиперидинальдегидное производное (IV) в органическом растворителе. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, этилацетат, диметилформамид, диметилсульфоксид, толуол, бензол и т.п. Реактив Виттига, который является коммерчески доступным закупают, а реактив, который не является коммерчески доступным, может быть легко получен стандартным методом. Количество используемого реактива Виттига составляет 1-2 эквивалента по отношению к исходному материалу. Примерами используемого основания предпочтительно являются гидрид натрия, трет-бутоксид калия, метоксид калия, этоксид натрия, диизопропиламид лития, диазабициклоундецен, н-бутиллитий, гидроксид натрия и т.п. Количество используемого основания составляет 1-2 эквивалента по отношению к исходному материалу. Температура реакции обычно составляет от -70°С до температуры кипения растворителя, а предпочтительно примерно от -40°С до 60°С.
Способ получения 3
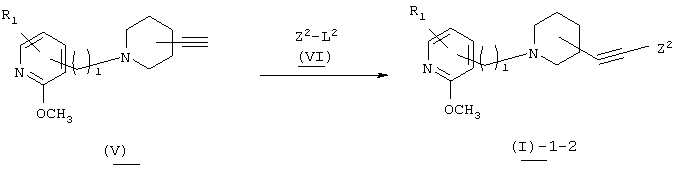
В вышеуказанной формуле R1 и l имеют значения, определенные выше; Z2 означает 5-14-членную ароматическую группу, которая может быть замещенной, a L2 означает уходящую группу (например, атом галогена, трифлат и т.п.). Соединение (I)-1-1 настоящего изобретения может быть получено посредством взаимодействия соединения (VI) (например, арилгалогенида, арилтрифлата и т.п.) с алкинилпиперидиновым производным (V) в растворителе в присутствии катализатора. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, этилацетат, диметилформамид, диметилсульфоксид, толуол, бензол, 1-метилпирролидон и т.п. Настоящая реакция может быть осуществлена в присутствии любого реагента, выбранного из тетракис(трифенилфосфин)палладия или дихлорбис(трифенилфосфин) палладия (II), взятого в каталитическом количестве, иодида меди и третичного амина. В качестве третичного амина предпочтительно использовать, например, триэтиламин, диизопропилэтиламин, диметиланилин, диазабициклоундецен и т.п. Количество используемого катализатора составляет примерно 0,001-0,1 мол.% по отношению к исходному материалу. Реакцию осуществляют в потоке азота, а температура реакции обычно составляет от -20°С до температуры кипения растворителя, а предпочтительно примерно от 80°С до 140°С.
Способ получения 4
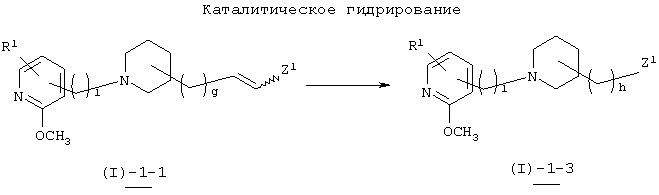
В вышеуказанной формуле R1, l, g и Z1 имеют значения, определенные выше, a h означает любое целое число от 1 до 3. Соединение (I)-1-3 настоящего изобретения может быть получено путем осуществления каталитического гидрирования пиридилпиперидинового производного (I)-1-1, полученного "в реакции 2". Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, этилацетат, диметилформамид, диметилсульфоксид, этанол, метанол и т.п. В данной реакции хороший результат может быть достигнут путем добавления к реакционному раствору соответствующего количества кислоты. В качестве катализатора предпочтительно использовать палладий на угле (Pd-C), никелевый катализатор Ренея, окись платины (PtO2) и т.п. Температура реакции обычно составляет от 0°С до 120°С, а предпочтительно примерно 25°С. Давление водорода во время гидрирования составляет 1-140 кг/см2, а предпочтительно 1-3 кг/см2.
Способ получения 5
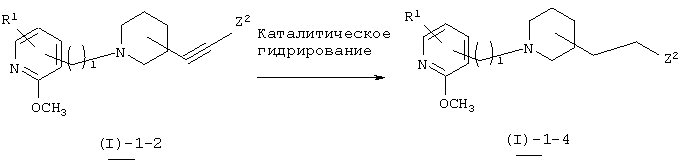
В вышеуказанной формуле R1, l и Z2 имеют значения, определенные выше. Соединение (I)-1-4 настоящего изобретения может быть получено путем осуществления каталитического гидрирования соединения (I)-1-2, полученного в "реакции 3". Данная реакция может быть проведена в условиях, описанных в "реакции 4".
Способ получения 6
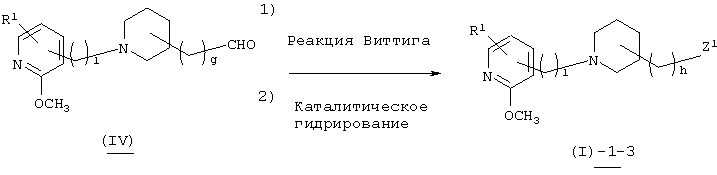
В вышеуказанной формуле R1, l, g, h и Z1 имеют значения, определенные выше. Соединение (I)-1-3 настоящего изобретения может быть получено путем проведения реакции реактива Виттига с пиперидинальдегидным производным (IV) в присутствии основания и осуществления каталитического восстановления полученного пиридилпиперидинового производного (I)-1-1 без выделения. Реакция Виттига может быть осуществлена методом, описанным в "реакции 2", а каталитическое восстановление может быть осуществлено методом, описанным в "реакции 4".
Способ получения 7
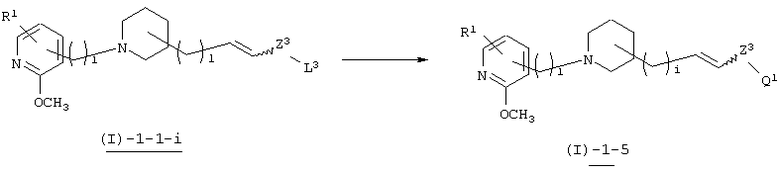
В вышеуказанной формуле R1, l, i и Z1 имеют значения, определенные выше; L3 означает уходящую группу (например, атом галогена, трифлат и т.п.), a Q1 и Z3 означают 5-14-членную ароматическую группу, которая может быть замещенной. Соединение (I)-1-5 настоящего изобретения может быть получено в присутствии палладиевого катализатора из соединения (I)-1-1-i, где Z1 представлен Z3-L3 в соединении (I)-1-1, полученном в "реакции 2". В качестве соединения арилметалла, используемого для данной реакции, служат, например, арилтрибутилолово, арилборная кислота и другие обычно используемые соединения, такие как арилалкоксиборан, арилалкилборан и т.п. Количество используемого катализатора составляет примерно 1-5 эквивалентов, а предпочтительно примерно 2 эквивалента по отношению к исходному материалу. В качестве катализатора используются, например, тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий (II) и т.п. Количество используемого катализатора составляет примерно 0,05 мол.% по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Например, предпочтительными являются тетрагидрофуран (ТГФ), диоксан, диметиловый эфир диэтиленгликоля, толуол, бензол и т.п. Если в качестве соединения арилметалла используется арилборная кислота, то предпочтительными растворителями являются водный карбонат натрия, метанол и смесь органических растворителей. Температура реакции обычно составляет в пределах от комнатной температуры до 150°С, а предпочтительно от 80°С до 130°С. Соединение (I)-1-5, полученное в данном способе, может быть использовано в качестве исходного соединения "в реакции 4".
Способ получения 8
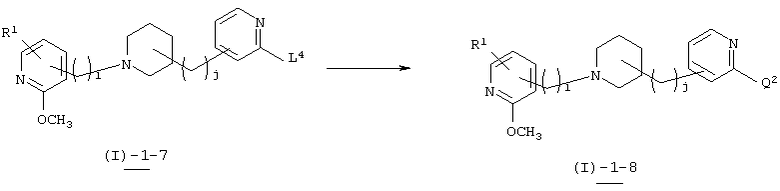
В вышеуказанной формуле R1 и l имеют значения, определенные выше; j означает любое целое целое число от 1 до 3; L4 означает уходящую группу (например, атом галогена, тозилат, трифлат и т.п.), a Q2 означает заместитель (например, C1-6алкоксигруппу, алкиламиногруппу и т.п.). Соединение (I)-1-8 настоящего изобретения может быть также получено посредством последующего взаимодействия пиридинового производного (I)-1-7, которое имеет отщепляющуюся группу L4 в 2-положении ароматических групп, представленных Z и Z1 в соединении, полученном в вышеупомянутых реакциях 1 или 4, с нуклеофилом. В качестве используемого нуклеофила, предпочтительными являются алкоксиды, полученные посредством взаимодействия оснований, таких как гидрид натрия, трет-бутоксид калия, металлический натрий, металлический литий и диизопропиламид натрия, со спиртами, такими как метанол, этанол и диметиламиноэтанол, и, кроме того, первичные и вторичные амины, такие как пиперидин и морфолин. Если в качестве нуклеофила используется амин, то хороший результат может быть достигнут даже если присутствует основание, обладающее слабыми нуклеофильными свойствами, такое как карбонат калия, диизопропилэтиламин и триэтиламин. Количество используемого нуклеофила составляет в пределах от 1 эквивалента до значительного избытка по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, диметилформамид, диметилсульфоксид, 1-метилпирролидон и т.п. Если в качестве нуклеофила используется алкоксид, то в качестве растворителя может быть использован спирт. Температура реакции обычно составляет от 0°С до 200°С, а предпочтительно от 100°С до 170°С.
Способ получения 9
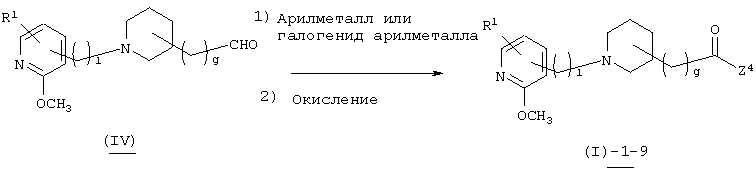
В вышеуказанной формуле R1, l и g имеют значения, определенные выше, а Z4 означает 5-14-членную ароматическую группу, которая может быть замещенной. Соединение (I)-1-9 настоящего изобретения может быть также получено посредством взаимодействия арилметалла или галогенида арилметалла с альдегидным производным (IV) путем 1,2-присоединения с образованием промежуточного соединения и его окисления. Используемый арилметалл или галогенид арилметалла в реакции 1,2-присоединения может быть закуплен, если он является коммерчески доступным, или он может быть получен стандартным методом, если он не является коммерчески доступным. Количество используемого арилметалла или галогенида арилметалла составляет 1-5 эквивалентов по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, толуол, бензол и т.п. Температура реакции обычно составляет от -78°С до 0°С. В качестве окислителя, используемого для реакции окисления, предпочтительными являются, например, окислитель Сверна, который корректируется комплексом "триоксид серы-пиридин", (хлорхромовая кислота)пиридиний, диоксид марганца, ди(хромовая кислота)пиридиний, оксалилхлорид-диметилсульфоксид. Используемый в реакции окисления растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, ацетонитрил, этилацетат, диметилформамид, диметилсульфоксид, 1-метилпирролидон и т.п. Температура реакции обычно составляет от 0°С до температуры кипения растворителя.
Способ получения 10

В вышеуказанной формуле R1, l и Z4 имеют значения, определенные выше, a k означает любое целое число от 0 до 2. Соединение (I)-1-9 настоящего изобретения может быть также получено посредством взаимодействия арилметалла или галогенида арилметалла с амидным производным (VII). Используемый арилметалл или галогенид арилметалла может быть закуплен, если он является коммерчески доступным, или он может быть получен стандартным методом, если он не является коммерчески доступным. Количество используемого арилметалла или галогенида арилметалла составляет примерно от 1 до 2 эквивалентов по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, толуол, бензол и т.п. Температура реакции обычно составляет от -78°С до 0°С.
Способ получения 11
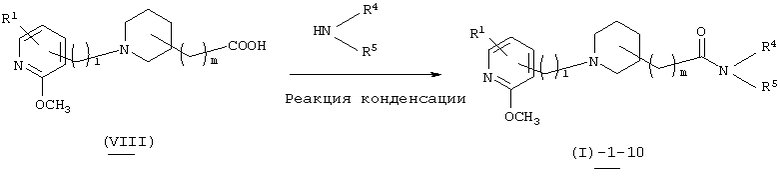
В вышеуказанной формуле R1, R4, R5 и l имеют значения, определенные выше, a m означает любое целое целое число 0, 1 и 2. Соединение (I)-1-10 настоящего изобретения может быть также получено посредством реакции конденсации производного карбоновой кислоты (VIII) и амина, представленного формулой NH(R4)R5 в органическом растворителе. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, диметилформамид, диметилсульфоксид, этанол, метанол и т.п. В качестве реакции конденсации могут быть использованы стандартные реакции. Так, например, может быть использован DCC-метод, DCC-HOBt-метод, DCC-HOSu-метод и усовершенствованный метод, основанный на указанных методах (например, WSC-HOBt-метод) и т.п. Количество используемого конденсирующего агента составляет 1-5 эквивалентов по отношению к исходному материалу (VIII). Кроме того, после получения карбоновокислотного производного пиперидина в качестве обычно используемого реакционноспособного производного эта реакция может быть осуществлена посредством взаимодействия этого производного с амином. В качестве реакционноспособного производного используются, например, хлорангидрид, полученный путем обработки тионилхлоридом и т.п., ангидрид кислоты, введенный посредством взаимодействия изобутилоксикарбонилхлорида (IBCF), 1-этоксикарбонил-2-этокси-1,2-дигидрохинолина (EEDQ), этилхлоркарбоната и т.п. с производным карбоновой кислоты (VIII), при этом предпочтительным является реакционноспособное производное, полученное превращением карбоновой кислоты (VIII) в азид кислоты с использованием дифенилфосфорилазида (DPPA), и т.п. Кроме того, они могут быть введены в активные сложные эфиры, такие как п-нитрофениловый эфир (ONp) и N-гидроксисукцинимид (ONSu). Соединение (I)-1-10 настоящего изобретения может быть получено посредством взаимодействия реакционноспособного производного с амином NH(R4)R5 в органическом растворителе.
Способ получения 12
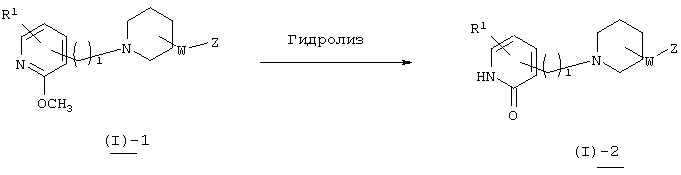
В вышеуказанной формуле R1, W, Z и l имеют значения, определенные выше. Пиридонпиперидиновое производное (I)-2, являющееся соединением настоящего изобретения, может быть получено путем гидролиза пиридилпиперидинового производного (I)-1. Данная реакция может быть осуществлена посредством взаимодействия 2 эквивалентов или значительного избытка соответствующей кислоты в воде или в смешанном растворителе, воды и органических растворителей, таких как метанол, этанол, диоксан и тетрагидрофуран. В качестве кислоты предпочтительно использовать, например, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, трифторуксусную кислоту и т.п., и эта кислота может быть получена в реакционной системе при добавлении тионилхлорида в спиртовом растворителе. Температура реакции обычно составляет в пределах от комнатной температуры до температуры кипения растворителя. Кроме того, данная реакция может быть осуществлена посредством взаимодействия 2 эквивалентов или значительного избытка иодида триметилсилана или смеси хлорид триметилсилила - иодид натрия в органическом растворителе, таком как дихлорметан, хлороформ, дихлорэтан и ацетонитрил. Температура реакции обычно составляет от -78°С до температуры кипения растворителя, а предпочтительно от -20°С до комнатной температуры.
Способ получения 13

В вышеуказанной формуле R1, W, Z и l имеют значения, определенные выше, a L5 означает уходящую группу (например, атом галогена и т.п.). Пиридонпиперидиновое производное (I)-2, являющееся соединением настоящего изобретения, может быть получено путем гидролиза производного 2-замещенного пиридинового производного (X). Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются трет-бутанол и т.п. Основание, используемое для реакции гидролиза, не имеет конкретных ограничений, но предпочтительным является трет-бутоксид калия. Температура реакции обычно составляет в пределах от комнатной температуры до температуры кипения растворителя, а предпочтительно от 100°С до 140°С.
Способ получения 14
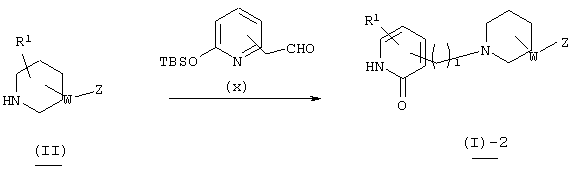
В вышеуказанной формуле R1, W, Z и l имеют значения, определенные выше. Кроме того, в данной формуле TBSO означает трет-бутилдиметилсилиловый эфир. Соединение (I)-2 настоящего изобретения может быть получено посредством конденсации пиперидинового производного (II) и пиридинового производного (X) в растворителе методом восстановительного аминирования. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, диметилформамид, диметилсульфоксид и т.п. В качестве восстановителя предпочтительно использовать, например, гидриды металлов, такие как борогидрид натрия и триацетоксиборогидрид натрия. Кроме того, может быть осуществлен метод каталитического восстановления, который обычно используется в этих случаях. Количество используемого галогенида металла составляет 1-5 эквивалентов по отношению к исходному материалу. В данной реакции трет-бутилдиметилсилильную группу обычно удаляют посредством подкисления силикагеля, используемого в стадии очистки продукта. Температура реакции обычно составляет от -50°С до температуры кипения растворителя, а предпочтительно примерно от 0°С до 25°С.
Способ получения 15
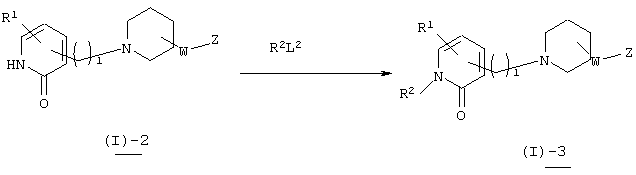
В вышеуказанной формуле R1, W, Z и l имеют значения, определенные выше, a L2 означает уходящую группу (например, атом галогена, тозилат, мезилат и т.п.). N-Замещенное пиридонпиперидиновое производное (I)-3, являющееся соединением настоящего изобретения, может быть получено посредством взаимодействия соединения R2L2 с пиридонпиперидиновым производным (I)-3 вместе с соответствующим основанием в органическом растворителе. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются диметилформамид, диметилсульфоксид, 1-метилпирролидон, простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, этанол, метанол и т.п. В качестве основания предпочтительно использовать, например, гидрид натрия, трет-бутоксид калия, метоксид калия, диизопропиламид лития, карбонат калия, гидроксид натрия и т.п. Количество используемого основания составляет 1-10 эквивалентов по отношению к исходному материалу. Количество используемого соединения R2L2 составляет от 1 эквивалента до значительно избытка по отношению к исходному материалу. Температура реакции обычно составляет в пределах от комнатной температуры до температуры кипения растворителя.
Способ получения 16
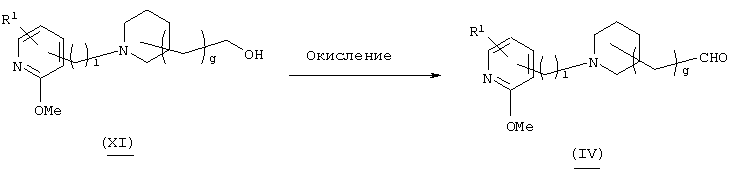
В вышеуказанной формуле R1, l и g имеют значения, определенные выше. Пиперидинальдегидное производное (IV), которое является исходым материалом в вышеупомянутых "реакциях 2, 4 и 1" (I)-1-9 может быть получено посредством окисления спиртового соединения (XI). Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются диметилформамид, диметилсульфоксид, 1-метилпирролидон, простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, ацетонитрил, толуол и т.п. Предпочтительными методами окисления, используемыми для реакции окисления, являются, например, метод с использованием (хлорхромовая кислота)пиридиния, диоксид марганца и ди(хлорхромовая кислота)пиридиния в качестве окислителя, такие методы окисления, как окисление Сверна, окисление Джонса, окисления Кори-Кима (Corey-Khim) и т.п. Температура реакции обычно составляет от -50°С до температуры кипения растворителя.
Способ получения 17
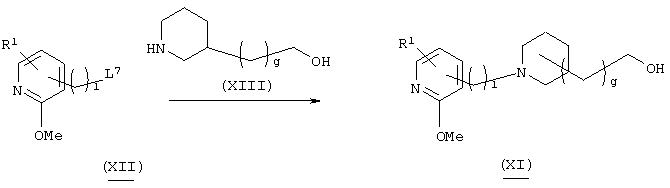
В вышеуказанной формуле R1, l и g имеют значения, определенные выше, a L7 означает уходящую группу (например, атом галогена, тозилат и т.п.) или альдегидную группу. Пиридилпиперидиновое производное (XI), которое является исходным материалом для вышеупомянутой "реакции 17", может быть получено посредством конденсации пиперидинового производного (XIII) и пиридинового производного (XII) либо посредством восстановительного аминирования или посредством их конденсации в присутствии основания. Данная реакция может быть осуществлена в условиях, описанных в вышеупомянутой "реакции 1". Коммерчески доступный продукт пиридинового производного (XII) может быть закуплен, а продукт который не является коммерчески доступным, может быть легко получен стандартным методом.
Способ получения 18
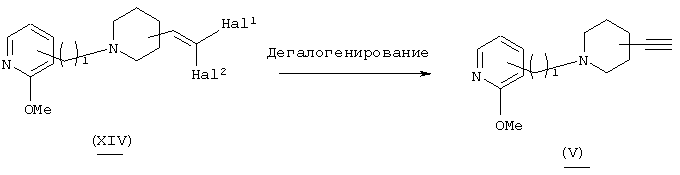
В вышеуказанной формуле R1 и l имеют значения, определенные выше, а каждый из Hal1 и Hal2, которые могут быть одинаковыми или различными, означают атом галогена. Алкинилпиперидиновое производное (V), которое является исходным материалом для вышеупомянутой "реакции 3", может быть получено путем осуществления реакции дегалогенирования олефинового производного (XIV). Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, толуол и т.п. В качестве основания предпочтительно использовать, например, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и т.п. Количество используемого основания составляет 1-10 эквивалентов по отношению к исходному материалу. Температура реакции обычно составляет от -100°С до -50°С.
Способ получения 19
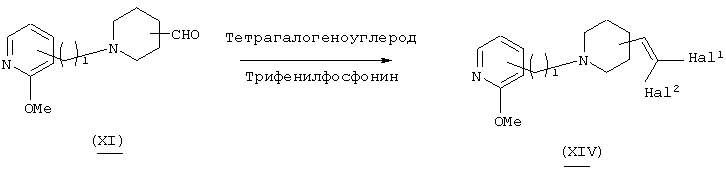
В вышеуказанной формуле R1, l, Hal1 и Hal2 имеют значения, определенные выше. Олефиновое производное (XVI), которое является исходным материалом для вышеупомянутой "реакции 19", может быть получено посредством взаимодействия пиперидинальдегидного производного (IV)-1 и тетрагалогеноуглерода в присутствии трифенилфосфина. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются 1-метилпирролидон, простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, ацетонитрил, толуол, и т.п. В качестве основания предпочтительно использовать, например, третичные амины, такие как триэтиламин и диизопропилэтиламин. Количество используемого основания составляет от 2 эквивалентов до значительного избытка по отношению к исходному материалу. Температура реакции обычно составляет от -50°С до 80°С, а предпочтительно примерно 0°С.
Способ получения 20
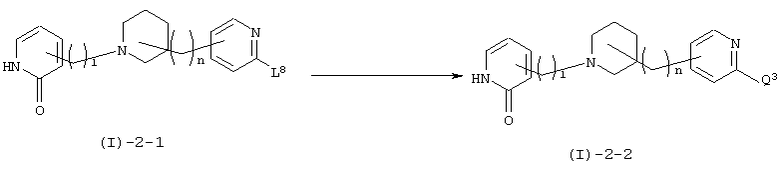
В вышеуказанной формуле R1 и l имеют значения, определенные выше; L8 означает уходящую группу (например, атом галогена, тозилат, трифлат и т.п.); Q3 означает заместитель (например, C1-6алкоксигруппу, алкиламиногруппу и т.п.), а n означает целое число от 1 до 3. В пиридонпиперидиновом производном (I)-2, полученном в каждой из вышеупомянутых "реакций 13, 14 и 15", соединение (I)-2-1, в котором Z представляет пиридильную группу, имеющую уходящую группу во 2-положении, может быть превращено в соединение (I)-2-2 настоящего изобретения посредством осуществления реакции взаимодействия с соответствующим с нуклеофилом. Данная реакция может быть осуществлена в условиях, аналогичных вышеупомянутым условиям "реакции 9".
Способ получения 21
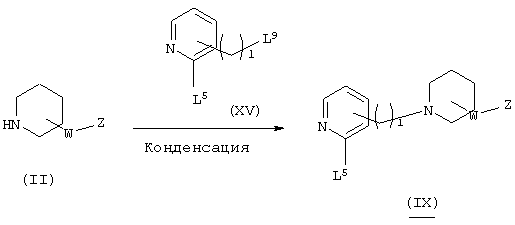
В вышеуказанной формуле R1, l, W и L5 имеют значения, определенные выше, а L7 означает уходящую группу (например, атом галогена, тозилат и т.п.) или альдегидную группу. Пиридилпиперидиновое производное (XI), которое является исходным материалом для вышеупомянутой "реакции 13", может быть получено посредством конденсации пиперидинового производного (II) и пиридинового производного (XV) в растворителе, проводимой путем восстановительного аминирования, либо посредством их конденсации в присутствии основания. Данная реакция может быть осуществлена в условиях, аналогичных условиям в вышеупомянутой "реакции 1". Коммерчески доступное пиридиновое производное (XV) может быть закуплено, а производные, которые не являются коммерчески доступными, могут быть легко получены из известного исходного материала стандартным методом.
Способ получения 22
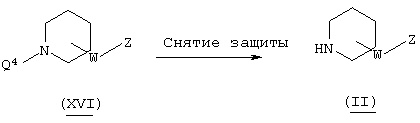
В вышеуказанной формуле W и Z имеют значения, определенные выше, a Q4 означает группу, обычно используемую для защиты аминогруппы. Пиперидиновое производное (II) может быть получено посредством снятия защиты у пиперидинового производного (XVI), которое имеет защитную группу. Снятие защиты может быть проведено в условиях, которые обычно используют для снятия защиты. Так, например, если Q4 представляет бензилоксикарбонильную группу, то оно может быть осуществлено методом каталитического восстановления с использованием палладия-на-угле в качестве катализатора в органическом растворителе, а если Q4 представляет трет-бутилоксикарбонильную группу, то оно может быть осуществлено посредством взаимодействия соответствующей кислоты, такой как соляная кислота, серная кислота и трифторуксусная кислота, в органическом растворителе или смеси воды и органического растворителя. Кроме того, если Q4 представляет бензильную группу, то снятие защиты может быть осуществлено посредством последовательного взаимодействия 1-хлорэтилхлорформиата и метанола в соответствующем органическом растворителе (например, в галогенированных растворителях, таких как дихлорметан).
Способ получения 23
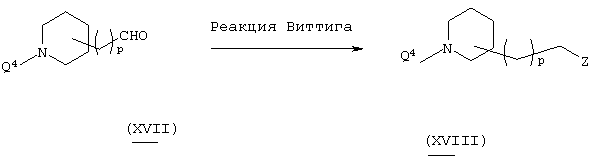
В вышеуказанной формуле Z и Q4 имеют значения, определенные выше, а р означает либо 0, либо 1. Пиперидинальдегидное производное (XVIII), которое является исходным соединением в вышеупомянутой "реакции 22", может быть получено посредством каталитического восстановления олефинового производного, полученного посредством реакции реактива Виттига с пиперидинальдегидным производным (XVII) в присутствии основания. Указанная реакция Виттига может быть осуществлена в условиях, описанных в вышеупомянутой "реакции 2". Коммерчески доступный реактив Виттига может быть закуплен, а реактив, который не является коммерчески доступным, может быть легко получен стандартным методом. Каталитическое гидрирование в данной реакции может быть осуществлено в условиях, описанных в вышеупомянутой "реакции 4".
Способ получения 24
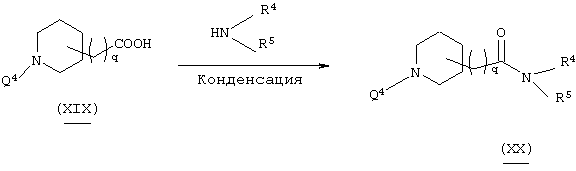
В вышеуказанной формуле R4, R5 и Q4 имеют значения, определенные выше, a q означает любое целое целое число 1 или 2. Амидное производное (XX), которое является исходным соединением для получения соединения настоящего изобретения, может быть получено путем осуществления стандартной реакции конденсации производного карбоновой кислоты (XXI) и амина, представленного формулой NH(R4)R5, в органическом растворителе. Данная реакция может быть осуществлена в условиях, описанных в вышеупомянутой "реакции 11".
Способ получения 25
В вышеуказанной формуле Q4 и q имеют значения, определенные выше. Производное карбоновой кислоты (XIX), используемое в качестве исходного соединения в вышеупомянутой "реакции 24", может быть получено посредством защиты группы атома азота пиперидинового производного (XXI) соответствующей группой. Данная реакция может быть осуществлена в соответствующих условиях, обычно используемых для защиты аминогруппы. Так, например, если Q4 представляет трет-бутоксикарбонильную группу (Boc), то предпочтительным реагентом для присоединения Boc является ди-трет-бутилдикарбонат. Количество используемого реагента составляет 1-5 эквивалентов по отношению к исходному соединению. Реакция присоединения Вое может быть осуществлена в смешанном растворителе, состоящем из воды и органических растворителей, таких как трет-бутанол, в присутствии основания, а температура реакции обычно составляет от 0°С до 80°С, а предпочтительно от 0°С до 25°С.
Способ получения 26
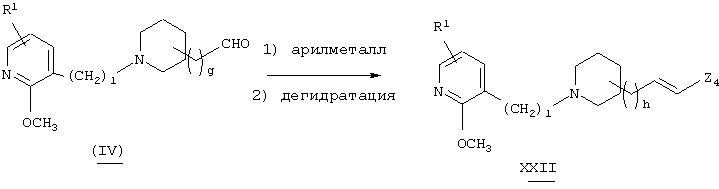
В вышеуказанной формуле R1, l, g, h и Z4 имеют значения, определенные выше, и Z4 означает 5-14-членную ароматическую группу, которая может быть замещенной. Соединение (XXII) настоящего изобретения может быть получено посредством 1,2-присоединения арилметалла к альдегидному производному (IV) с образованием спиртового промежуточного соединения и его дегидратации. Коммерчески доступный арилметалл, используемый для 1,2-присоединения, может быть закуплен, а арилметаллы, которые не являются коммерчески доступными, могут быть получены стандартным методом. Количество используемого арилметалла составляет 1-5 эквивалентов по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан, эфир и диметиловый эфир диэтиленгликоля, и, кроме того, толуол, бензол и т.п. Температура реакции обычно составляет от -78°С до 0°С. В качестве дегидратирующего агента, используемого для реакции дегидратации, предпочтительными являются кислоты, такие как п-толуолсульфоновая кислота, камфорсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота, фосфорная кислота, полифосфорная кислота, соляная кислота, бромистоводородная кислота, азотная кислота и серная кислота, и хлорангидриды, такие как оксихлорид фосфора и тионилхлорид. Если в качестве дегидратирующего агента используется хлорангидрид, то хороший результат может быть также достигнут, если в реакционной системе присутствуют основания, такие как пиридин, триэтиламин и диизопропилэтиламин. Данная реакция может быть осуществлена в соответствующем растворителе или без растворителя. Используемый в реакции окисления растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, толуол, бензол и т.п. Температура реакции обычно составляет от -20°С до температуры кипения растворителя, а предпочтительно от 0°С до 120°С.
Способ получения 27
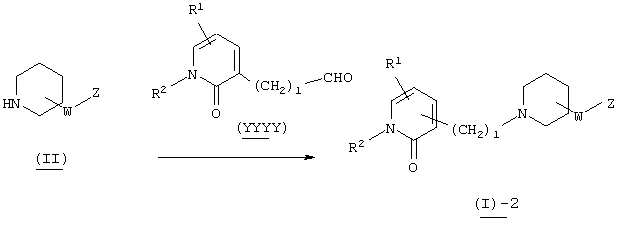
В вышеуказанной формуле R1, R2, W, Z и l имеют значения, определенные выше. Соединение (1)-2 настоящего изобретения может быть получено посредством конденсации пиперидинового производного (II) и пиридинового производного (YYYY) в растворителе путем восстановительного аминирования. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан, и, кроме того, этилацетат, диметилформамид (ДМФ), диметилсульфоксид (ДМСО), 1-метилпирролидон, ацетонитрил и т.п. В качестве восстановителя могут быть использованы, например, гидриды металлов, такие как борогидрид натрия и триацетоксиборогидрид натрия. Кроме того, может быть осуществлен метод каталитического восстановления, который обычно используется в этих случаях. Количество используемого восстановителя составляет 1-5 эквивалентов по отношению к исходному материалу. Температура реакции обычно составляет от -50°С до температуры кипения растворителя, а предпочтительно примерно от 0°С до 25°С.
Способ получения 28
В вышеуказанной формуле R1 и l имеют значения, определенные выше; Х означает уходящую группу (например, атом галогена, трифлат и т.п.), а R1 и L означают соединение арилметалла или соединение алкилметалла. Примерами соединений арилметалла или соединений алкилметалла, используемых в данной реакции, являются, например, обычно используемые арилборная кислота, арилтрибутилолово, алкилборная кислота, алкилтрибутилолово, производные алкоксиборана, производные алкилборана и т.п. Количество используемого соединения арилметалла или соединения алкилметалла обычно составляет 1-5 эквивалентов, а предпочтительно примерно 2 эквивалента по отношению к исходному материалу. В качестве катализатора используются, например, тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий (II) и т.п. Количество используемого катализатора составляет примерно 0,05 мол.% в расчете на исходный материал. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Например, предпочтительными являются тетрагидрофуран (ТГФ), диоксан, диметиловый эфир диэтиленгликоля, толуол, бензол, диметилформамид (ДМФ), 1-метилпирролидон и т.п. Если в качестве соединения арилметалла или алкилметалла используется арилборная кислота или алкилборная кислота, то предпочтительно, чтобы присутствовали основания, такие как карбонат калия, карбонат цезия и карбонат натрия или их водные растворы. Температура реакции обычно составляет в пределах от комнатной температуры до температуры кипения растворителя, а предпочтительно от 80°С до 130°С.
Способ получения 29

В вышеуказанной формуле R1 и l имеют значения, определенные выше, а Х означает уходящую группу (например, атом галогена, трифлат и т.п.). Соединение (XXVI) может быть получено из альдегидного производного (XXV) в условиях, обычно используемых для ацетализации. Так, например, оно может быть получено посредством взаимодействия триметилортоформиата, диметоксипропана и т.п. в органическом растворителе в присутствии катализатора (например, п-толуолсульфоновой кислоты) или монтморрилонита К-10.
Способ получения 30
В вышеуказанной формуле R1 и l имеют значения, определенные выше, а Х означает уходящую группу (например, атом галогена, трифлат и т.п.). Соединение (XXVII) может быть получено посредством взаимодействия цианового соединения с ацетальным производным (XXVI) в присутствии иодида меди и катализатора с последующим гидролизом указанного ацеталя. Используемым цианидным соединением является, например, цианид натрия, цианид калия, цианид цинка и т.п. Количество используемого цианидного соединения обычно составляет 1-5 эквивалентов, а предпочтительно примерно 2 эквивалента по отношению к исходному материалу. В качестве катализатора используются, например, тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий (II) и т.п. Количество используемого катализатора составляет примерно 0,001-0,1 мол.% по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Например, предпочтительными являются тетрагидрофуран (ТГФ), диоксан, диметиловый эфир диэтиленгликоля, толуол, бензол, диметилформамид (ДМФ), 1-метилпирролидон, ацетонитрил, пропионитрил и т.п. Температура реакции обычно составляет в пределах от комнатной температуры до температуры кипения растворителя, а предпочтительно от 80°С до 140°С.
Реакция гидролиза может быть осуществлена в условиях, обычно используемых для гидролиза. Так, например, она может быть осуществлена посредством взаимодействия соответствующей кислоты, такой как соляная кислота, серная кислота, уксусная кислота и трифторуксусная кислота, в органическом растворителе или в смешанном растворителе, состоящем из воды и органического растворителя.
Способ получения 31
В вышеуказанной формуле l имеет значения, определенные выше. Соединение (XXIX) настоящего изобретения может быть получено посредством взаимодействия ацетального производного (XXVIII) с металлоорганическим реагентом для металлирования этого производного и его взаимодействия с фторирующим агентом с последующим гидролизом указанного ацеталя. Реакция металлирования может быть осуществлена в условиях, обычно используемых для металлирования. В качестве металлоорганического реагента для металлирования используются, например, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, фениллитий и т.п. В качестве фторирующего агента используются, например, N-фторимиды, такие как N-фторбензолсульфонимид или N-фторпиридиниевые производные, такие как N-фтор-4-метилпиридиний-2-сульфонат. Количество используемого фторирующего агента обычно составляет 1-2 эквивалента по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан, эфир и диметиловый эфир диэтиленгликоля. Температура реакции обычно составляет от -78°С до 0°С, а предпочтительно от -78°С до -40°С.
Реакция гидролиза может быть осуществлена в условиях, обычно используемых для гидролиза. Так, например, она может быть осуществлена посредством взаимодействия с соответствующей кислотой, такой как соляная кислота, серная кислота, уксусная кислота и трифторуксусная кислота, в органическом растворителе или в смешанном растворителе, состоящем из воды и органического растворителя.
Способ получения 32
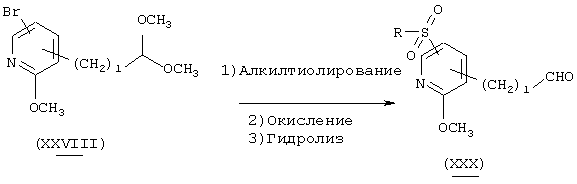
В вышеуказанной формуле l имеет значения, определенные выше, a R означает аралкильную группу. Соединение (XXX) настоящего изобретения может быть получено посредством взаимодействия ацетального производного (XXVIII) с металлоорганическим реагентом для металлирования, взаимодействия полученного соединения с сероорганическим соединением, окисления аралкилтиогруппы с последующим гидролизом ацеталя. Реакция металлирования может быть осуществлена в условиях, которые обычно используются для металлирования. В качестве металлоорганического реагента, используемого для металлирования, могут быть предложены, например, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, фениллитий и т.п. В качестве сероорганического реагента, используемого для алкилтиолирования, могут быть предложены, например, дисульфиды, такие как диметилдисульфид и дифенилдисульфид, сульфенилхлориды, такие как фенилсульфенилхлорид и т.п. Количество используемого сероорганического соединения обычно составляет 1-2 эквивалента по отношению к исходному материалу. Используемый растворитель не имеет конкретных ограничений при условии, если он не ингибирует данную реакцию и растворяет исходное вещество до определенной степени. Так, например, предпочтительными являются простые эфиры, такие как тетрагидрофуран (ТГФ), диоксан, эфир и диметиловый эфир диэтиленгликоля и т.п. Температура реакции обычно составляет от -78°С до 0°С, а предпочтительно от -78°С до -40°С.
Реакция окисления аралкилтиогруппы в аралкилсульфонильную группу может быть осуществлена в обычно используемых условиях окисления. Так, например, она может быть осуществлена посредством взаимодействия неорганического пероксида, такого как пероксид водорода, или органического пероксида, такого как м-хлорпербензойная кислота в галогенированном углеводородном растворителе, таком как дихлорметан. Предпочтительно, чтобы в данной реакции присутствовали основания, такие как бикарбонат натрия, карбонат натрия и карбонат калия.
Последующая реакция гидролиза может быть осуществлена в условиях, обычно используемых для гидролиза. Так, например, она может быть осуществлена посредством взаимодействия соответствующей кислоты, такой как соляная кислота, серная кислота, уксусная кислота и трифторуксусная кислота, в органическом растворителе или в смешанном растворителе, состоящем из воды и органического растворителя.
Способ получения соединения (I) настоящего изобретения был описан выше, однако исходное соединение, используемое для получения соединения настоящего изобретения, может образовывать соль и гидрат, которые не имеют конкретных ограничений, за исключением тех случаев, когда они ингибирует реакцию. Кроме того, если соединение (I) настоящего изобретения получают в виде свободной формы, то вышеупомянутое соединение (I) может быть превращено в форму соли. Кроме того, различные виды изомеров, которые может иметь соединение (I) настоящего изобретения (например, геометрический изомер, оптический изомер на основе асимметрического атома углерода, стереоизомер, таутомер и т.п.) могут быть очищены и выделены стандартными методами разделения (например, перекристаллизацией, методом получения диастереомерной соли, методом ферментативного фракционирования, различными видами хроматографии).
Соединение, представленное вышеуказанной формулой (I), его соль или гидрат могут быть использованы для изготовления препаратов стандартным методом, и предпочтительными примерами таких препаратов являются таблетки, порошки, мелкозернистые гранулы, урапные гранулы, таблетки с покрытием, капсулы, сиропы, пастилки, аэрозоли, суппозитории, инъекции, мази, глазные мази, глазные капли, капли в нос, ушные капли, припарки, лосьоны и т.п. Для получения препаратов обычно используют наполнители, связующие, дезинтеграторы, замасливатели, красители и ароматизаторы, а если это необходимо, то могут быть использованы стабилизаторы, эмульгаторы, ускорители абсорбции, поверхностно-активные вещества, регуляторы рН, антисептики, антиоксиданты и т.п. Ингредиенты, которые обычно используются в качестве сырья для фармацевтических препаратов, могут быть приготовлены стандартным методом. В качестве таких ингредиентов могут служить, например, масла животного и растительного происхождения, такие как соевое масло, глицерид животного жира и синтетический глицерид; углеводороды, такие как жидкое вазелиновое масло, сквален и твердый парафин; эфирные масла, такие как октилдодецилмиристат и изопропилмиристат; высшие спирты, такие как цетостеариловый спирт и бегеновый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как сложный эфир полиоксиэтилена и жирных кислот, сложный эфир сорбитана и жирных кислот, сложный эфир глицерина и жирных кислот, сложный эфир полиоксиэтиленсорбитана и жирных кислот, отвержденное полиоксиэтиленом касторовое масло и блок-сополимер полиоксиэтилена-полиоксипропилена; водорастворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловая кислота, карбоксивиниловый полимер, полиэтиленгликоль, поливинилпирролидон и метилцеллюлоза; низший спирт, такой как этанол и изопропанол; многовалентные спирты, такие как глицерин, пропиленгликоль, дипропиленгликоль и сорбит; сахара, такие как глюкоза и декстроза; неорганические порошки, такие как ангидрид кремниевой кислоты, силикат алюминия-магния и силикат алюминия; очищенная вода и т.п. В частности, в качестве наполнителей используются, например, лактоза, кукурузный крахмал, белый сахар, глюкоза, маннит, сорбит, кристаллическая целлюлоза, двуокись кремния и т.п.; в качестве связующих веществ используются, например, поливиниловый спирт, поливиниловый эфир, метилцеллюлоза, этилцеллюлоза, аравийская камедь, трагакантовая камедь, желатин, шеллак, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, блок-сополимер полипропиленгликоля-полиоксиэтилена, меглумин, цитрат кальция, декстрин, пектин и т.п.; в качестве дезинтеграторов используются, например, крахмал, агар, желатиновый порошок, кристаллическая целлюлоза, карбонат кальция, бикарбонат натрия, цитрат кальция, декстрин, пектин, кальцийсодержащая карбоксиметилцеллюлоза и т.п.; в качестве замасливателей используются, например, стеарат магния, тальк, полиэтиленгликоль, двуокись кремния, отвержденное растительное масло и т.п.; в качестве красителей используются любые красители, которые разрешены для добавления в фармацевтические препараты; в качестве отдушек используются какао-порошок, ментол, порошок-ароматизатор, масло перечной мяты, борнеол, порошкообразная корица и т.п., а в качестве оксидантов, которые разрешены для добавления в фармацевтические препараты, используются, например, аскорбиновая кислота и α-токоферол, соответственно.
Так, например, (1) пероральные препараты изготавливают в виде порошков, мелкозернистых гранул, крупных гранул, таблеток, таблеток с покрытиями, капсул и т.п. в соответствии со стандартным методом после добавления наполнителей и, кроме того, если это необходимо, связующих, дезинтегрантов, замасливателей, красителей, отдушек и т.п. к соединению настоящего изобретения, его соли или гидрату. (2) В случае изготовления таблеток и гранул на них может быть нанесено сахарное покрытие и желатиновое покрытие, если это необходимо, другое соответствующее покрытие. (3) В случае изготовления сиропов, препаратов для инъекций, глазных капель и т.п. добавляют регуляторы рН; добавки, улучшающие выделение; агенты, придающие изотоничность, и т.п. и, если необходимо, солюбилизатор, стабилизаторы, буферы, суспендирующие агенты, антиоксиданты и т.п. и изготавливают композиции в соответствии со стандартным методом. При изготовлении указанных препаратов может быть также получен лиофилизованный продукт, и препараты для инъекции могут быть введены внутривенно, подкожно или внутримышечно. Предпочтительными примерами суспендирующего агента являются метилцеллюлоза, полисорбат 80, гидроксиэтилцеллюлоза, аравийская камедь, порошок трагакантовой камеди, натрийсодержащая карбоксиметилцеллюлоза, полиоксиэтиленсорбитанмонолаурат и т.п.; предпочтительными примерами солюбилизаторов являются отвержденное полиоксиэтиленом касторовое масло, полисорбат 80, никотинамид, полиоксиэтиленсорбитанмонолаурат и т.п.; предпочтительными примерами стабилизатора являются сульфид натрия, метасульфит натрия, эфир и т.п.; предпочтительными примерами консервантов являются метил-п-гидроксибензоат, этил-п-гидроксибензоат, сорбиновая кислота, фенол, крезол, хлоркрезол и т.п. (4) Кроме того, в случае изготовления препаратов для наружного применения способ их получения не имеет конкретных ограничений, и такой препарат может быть получен стандартным методом. В качестве исходного материала для основы данного препарата могут быть использованы различные исходные материалы, которые обычно применяются для фармацевтических препаратов, квазилекарственных средств, косметических средств и т.п. Так, например, могут быть использованы такие исходные материалы, как масла животного и растительного происхождения, минеральное масло, эфирное масло, воски, высшие спирты, жирные кислоты, силиконовое масло, поверхностно-активное вещество, фосфатиды, спирты, многовалентные спирты, водорастворимые полимеры, глинистые минералы, очищенная вода и т.п. Если необходимо, то могут быть добавлены регулятор рН, антиоксидант, хелатообразующий агент, антисептик и фунгицид, краситель, отдушки и т.п. Кроме того, если это необходимо, то в композицию могут быть введены ингредиенты, обладающие дифференциальным модифицирующим действием, ускоритель кровотока, антибактериальные агенты, противовоспалительное средство, клеточный активатор, витамины, аминокислоты, увлажнитель, лекарственное средство против кератолиза и т.п. Доза фармацевтического средства настоящего изобретения до некоторой степени варьируется в зависимости от симптома, возраста, пола, массы тела, формы введения, типа полученной соли, восприимчивости к лекарственному препарату, конкретного эффекта лекарственного средства, однако, взрослому индивидууму, в основном, вводят дозу, составляющую приблизительно 30 мкг - 1000 мг в день для перорального введения, предпочтительно 100 мкг - 500 мг, а более предпочтительно 100 мкг - 100 мг, от одного до нескольких раз в день. Для введения в форме инъекции эта доза составляет приблизительно 3000 мкг/кг, а предпочтительно 3-1000 мкг/кг, один или несколько раз в день.
Соединение, представленное вышеуказанной формулой (I), или его соль, или гидрат обладает действием, направленным на ингибирование Na+-каналов, и может быть использовано как ингибитор Na+-каналов. В соответствии с этим соединение, представленное вышеуказанной формулой (I), или его соль, или гидрат и фармацевтическая композиция, содержащая это соединение, могут оказывать превосходное терапевтическое или профилактическое действие на заболевание, лечение и предупреждение которого направлено на ингибирование Na+-каналов, и являются эффективными в качестве средств для лечения или предупреждения, например, аритмии (и, кроме того, для снятия стресса у пациента, вызываемого таким заболеванием, как предсердная фибрилляция, например сердцебиение, дискомфорт в области грудной клетки, сердечная недостаточность, тромбы в левом предсердии, тромбоэмболия, приступы), невралгии различных типов (например, диабетической невралгии, ВИЧ-ассоциированной невралгии, постгерпетической невралгии, невралгии тройничного нерва, боли в области ампутированных конечностей, боли, связанной с повреждением костного мозга, таламической боли, послешоковой боли и т.п.) и в качестве анальгетиков.
Примеры
Ниже приводятся примеры наилучших вариантов соединения настоящего изобретения (кроме того, его фармакологически приемлемой соли или гидрата и содержащих их фармацевтических препаратов), однако, в любом случае, приведенные ниже сравнительные примеры, примеры и примеры испытаний имеют иллюстративный характер, и соединения настоящего изобретения не ограничиваются указанными примерами. Каждым специалистом могут быть внесены различные модификации не только в нижеприведенные примеры, но также и в объем формулы изобретения настоящей заявки с максимальным ограничением. Кроме того, такие варианты входят в объем формулы изобретения, представленной в настоящей заявке.
Сравнительный пример 1
1-[(2-Метокси-3-пиридил)метил]-4-пиперидинметанол
10 г 4-пиперидинметанола, 13 г 3-(хлорметил)-2-метоксипиридина и 24 г карбоната калия суспендируют в 80 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем этот слой сушат над безводным сульфатом магния. Растворитель выпаривают, в результате чего получают 16,1 г указанного в заголовке соединения в виде светло-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,38 (2Н, м), 1,52 (1Н, м), 1,68-1,76 (2Н, м), 2,01-2,09 (2Н, м), 2,90-2,96 (2Н, м), 3,49 (2Н, с), 3,50 (2Н, д, J=7,5 Гц), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,65 (1Н, дд, J=7,2, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Сравнительный пример 2
1-[(2-Метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегид
16,1 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинметанола и 38 мл триэтиламина суспендируют в 60 мл диметилсульфоксида, затем по каплям добавляют смешанный раствор 21,7 г комплекса триоксид серы - пиридин и 100 мл диметилсульфоксида и полученную смесь перемешивают при комнатной температуре в течение одного часа. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат) с получением 10,9 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,66-1,76 (2H, м), 1,87-1,94 (2Н, м), 2,15-2,30 (3Н, м), 2,82-2,88 (2H, м), 3,50 (2H, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,63 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=5,0, 2,0 Гц), 9,66 (1Н, д, J=1,1 Гц).
Сравнительный пример 3
1-Бензил-4-(2,3-метилендиоксифенэтил)пиперидин
20,3 г 4-(1-бензил)пиперидинкарбоксальдегида и 48,0 г бромида (2,3-метилендиоксибензил)трифенилфосфония и 12,0 г трет-бутоксида калия суспендируют в 200 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:4). Полученный продукт и 2,03 г 10% порошкообразного палладия на угле (продукта, содержащего воду) суспендируют в 200 мл этанола. После замены атмосферы в сосуде на водород смесь перемешивают при комнатной температуре в обычной атмосфере в течение двух часов. Реакционный раствор фильтруют и фильтрат выпаривают с получением 20,3 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,36 (3Н, м), 1,52-1,59 (2H, м), 1,68-1,75 (2H, м), 1,88-1,96 (2H, м), 2,84-2,91 (2H, м), 3,48 (2H, с), 5,91 (2H, с), 6,63-6,69 (2H, м), 6,74 (1Н, дд, J=7,8, 7,8 Гц), 7,24 (1Н, м), 7,29-7,33 (4Н, м).
Сравнительный пример 4
4-(2,3-Метилендиоксифенэтил)пиперидин
20,3 г 1-бензил-4-(2,3-метилендиоксифенэтил)пиперидина растворяют в 100 мл 1,2-дихлорэтана, затем при охлаждении льдом добавляют 7 мл 1-хлорэтилхлорформиата и смесь кипятят с обратным холодильником в течение 30 минут. Растворитель выпаривают, полученный остаток растворяют в 100 мл метанола и смесь кипятят с обратным холодильником в течение одного часа. Растворитель удаляют и полученный остаток подщелачивают добавлением 5 н. водного раствора гидроксида натрия, а затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на NH-форме силикагеля (этилацетат), в результате чего получают 13,1 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,08-1,20 (2Н, м), 1,39 (1Н, м), 1,52-1,59 (2Н, м), 1,70-1,78 (2Н, м), 2,53-2,62 (4Н, м), 3,03-3,10 (2Н, м), 5,93 (2Н, с), 6,64-6,70 (2Н, м), 6,76 (1Н, дд, J=7,8, 7,8 Гц).
Сравнительный пример 5
3-Метилтио-2-тиофенкарбоксальдегид
4,44 г 3-бром-2-тиофенкарбоксальдегида и 1,63 г тиометоксида натрия растворяют в 20 мл N,N-диметилформамида и смесь перемешивают при охлаждении льдом в течение 3 часов. К реакционному раствору добавляют этилацетат. Смесь промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:9), в результате чего получают 3,36 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 2,59 (3Н, с), 7,10 (1Н, д, J=5,1 Гц), 7,73 (1Н, дд, J=5,1, 0,9 Гц), 10,0 (1Н, д, J=0,9 Гц).
Сравнительный пример 6
3-Метилтио-2-тиофенметанол
3,36 г 3-метилтио-2-тиофенкарбоксальдегида и 802 мг борогидрида натрия суспендируют в 20 мл метанола и смесь перемешивают при комнатной температуре в течение одного часа. Растворитель выпаривают, к остатку добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем слой сушат над безводным сульфатом магния. Растворитель выпаривают и полученный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:5) с получением 3,16 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР(400 МГц, CDCl3) δ 2,05 (1H, т, J=4,8 Гц), 2, 42 (3Н, с), 4,87 (1Н, д, J=4,8 Гц), 7,03 (1Н, д, J=5,3 Гц), 7, 27 (1Н, д, J=5, 3 Гц).
Сравнительный пример 7
Хлорид [(3-метилтио-2-тиенил)метил]трифенилфосфония
6,26 г 3-метилтио-2-тиофенметанола растворяют в 40 мл дихлорметана, по каплям добавляют 2,85 мл тионилхлорида при охлаждении льдом и смесь перемешивают в течение 30 минут при охлаждении льдом. Реакционный раствор промывают водным насыщенным раствором NaHCO3, а затем сушат над безводным сульфатом магния.
Растворитель выпаривают и полученный неочищенный продукт и 15,4 г трифенилфосфина растворяют в 120 мл толуола, а затем смесь кипятят с обратным холодильником в течение 20 часов. Полученные кристаллы собирают фильтрацией, промывают этилацетатом и сушат на воздухе с получением 14,3 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 2,07 (3Н, с), 5,85 (2Н, д, J=13,2 Гц), 6,92 (1Н, д, J=5,3 Гц), 7,24 (1Н, дд, J=5,3, 2,4 Гц), 7,63-7,70 (6Н, м), 7,72-7,83 (9Н, м).
Сравнительный пример 8
1-трет-Бутоксикарбонил-4-[2-(3-метилсульфонил-2-тиенил)этил]пиперидин
14,4 г хлорида [(3-метилтио-2-тиенил)метил]трифенилфосфония и 3,67 г трет-бутоксида калия растворяют в 120 мл N,N-диметилформамида. При охлаждении льдом добавляют смешанный раствор 6,97 г 1-трет-бутоксикарбонил-4-пиперидинкарбоксальдегида и 30 мл N,N-диметилформамида и полученную смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:10). Полученный продукт растворяют в 40 мл хлороформа, затем при охлаждении льдом добавляют 3,59 г 3-хлорпербензойной кислоты и смесь перемешивают при комнатной температуре в течение одного часа. К реакционной смеси добавляют водный насыщенный раствор тиосульфата натрия для отделения органического слоя. Органический слой промывают 1 н. водным раствором гидроксида натрия и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:3). Полученный продукт и 3,0 г 10% порошкообразного палладия на угле (продукта, содержащего воду) суспендируют в 150 мл этанола. После замены атмосферы контейнера водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 4 часов. Реакционный раствор фильтруют, а затем растворитель фильтрата выпаривают с получением 11,1 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,10-1,22 (2Н, м), 1,46 (9Н, с), 1,58-1,64 (2Н, м), 1,66-1,77 (3Н, м), 2,63-2,75 (2Н, м), 3,06 (3Н, с), 3,18-3,24 (2Н, м), 4,10 (2Н, шир.с), 7,19 (1Н, дд, J=5,5, 0,4 Гц), 7,31 (1Н, д, J=5,5 Гц).
Сравнительный пример 9
Гидрохлорид 4-[2-(3-метилсульфонил-2-тиенил)этил]пиперидина
11,1 г 1-трет-бутоксикарбонил-4-[2-(3-метилсульфонил-2-тиенил)этил]пиперидина растворяют в 100 мл этилацетата, добавляют 100 мл этилацетатного раствора 4 н. соляной кислоты и смесь перемешивают при комнатной температуре в течение 2 часов. Полученные кристаллы собирают фильтрацией, промывают этилацетатом, сушат на воздухе и получают 7,92 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,42 (2Н, м), 1,48-1,65 (3Н, м), 1,82-1,88 (2Н, м), 2,76-2,88 (2Н, м), 3,12-3,18 (2Н, м), 3,20 (3Н, с), 3,20-3,28 (2Н, м), 7,31 (1Н, д, J=5,5 Гц), 7,57 (1Н, д, J=5,5 Гц).
Сравнительный пример 10
1-[(2-Метокси-3-пиридил)метил]-4-(2,2-дибромвинил)пиперидин
3,0 г ацетальдегида 1-[(2-метокси-3-пиридил)метил]-4-пиперидина, 5,4 мл триэтиламина, 20,1 г трифенилфосфина и 12,9 г тетрабромметана растворяют в 77 мл дихлорэтана при 0°С и смесь перемешивают в течение одного часа. К реакционному раствору добавляют дихлорметан и смесь промывают насыщенным водным раствором бикарбоната натрия, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на NH-форме силикагеля (гексан:этилацетат=20:1), в результате чего получают 2,9 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,44-1,60 (2Н, м), 1,67-1,78 (2Н, м), 2,07-2,20 (2Н, м), 2,31 (1Н, м), 2,84-2,94 (2Н, м), 3,52 (2Н, с), 3,95 (3Н, с), 6,27 (1Н, д, J=9,1 Гц), 6,88 (1Н, дд, J=7,0, 5,0 Гц), 7,65 (1Н, дд, J=7,0, 1,5 Гц), 8,07 (1Н, дд, J=5,0, 1,5 Гц).
Сравнительный пример 11
1-[(2-Метокси-3-пиридил)метил]-4-(1-этинил)пиперидин
2,9 г 1-[(2-метокси-З-пиридил)метил]-4-(2,2-дибромвинил)пиперидина растворяют в 25 мл тетрагидрофурана и по каплям добавляют 12,3 мл 1,50 М раствора н-бутиллития в гексане при -78°С. После завершения добавления по каплям смесь перемешивают при -78°С в течение одного часа. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и получают указанное в заголовке соединение в виде желтого масла (количественный выход).
1H-ЯМР (400 МГц, CDCl3) δ 1,66-1,77 (2Н, м), 1,83-1,92 (2Н, м), 2,07 (1Н, д, J=4,0 Гц), 2,17-2,29 (2Н, м), 2,41 (1Н, м), 2,71-2,80 (2Н, м), 3,48 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,4, 5,0 Гц), 7,64 (1Н, дд, J=7,4, 1,8 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Сравнительный пример 12
1-[(Этоксиметокси)метил]-3,4-метилендиоксибензол
4,56 г пиперонилового спирта и 1,20 г 60% гидрида натрия суспендируют в 30 мл N,N-диметилформамида. После перемешивания в течение 30 минут при охлаждении льдом добавляют 2,28 мл хлорметилэтилового эфира и смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют этилацетат. Смесь промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:20), в результате чего получают 4,98 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,24 (3Н, т, J=7,1 Гц), 3,64 (2Н, кв, J=7,1 Гц), 4,50 (2Н, с), 4,73 (2Н, с), 5,95 (2Н, с), 6,78 (1Н, д, J=7,9 Гц), 6,81 (1Н, дд, J=7,9, 1,6 Гц), 6,86 (1Н, дд, J=1,6 Гц).
Сравнительный пример 13
1-[(Этоксиметокси)метил]-2-(метилтио)-3,4-метилендиоксибензол
1,05 г 1-[(этоксиметокси)метил]-3,4-метилендиоксибензола растворяют в 10 мл диэтилового эфира, добавляют 2 мл 2,52 М раствора н-бутиллития в гексане при 0°С и смесь перемешивают 2 часа, а затем по каплям добавляют 471 мг метилдисульфида при -70°С. После завершения добавления по каплям смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют 1 н. водный раствор гидроксида натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:20) с получением 561 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,25 (3Н, т, J=7,1 Гц), 2,44 (3Н, с), 3,66 (2Н, кв, J=7,1 Гц), 4,68 (2Н, с), 4,76 (2Н, с), 6,03 (2Н, с), 6,73 (1Н, д, J=7,9 Гц), 6,92 (1Н, д, J=7,9 Гц).
Сравнительный пример 14
1-[(Этоксиметокси)метил]-2-(метилсульфонил)-3,4-метилендиоксибензол
1,73 г 1-[(этоксиметокси)метил]-2-(метилтио)-3,4-метилендиоксибензола растворяют в 70 мл хлороформа. Затем при охлаждении льдом добавляют 3,33 г 3-хлорпербензойной кислоты и смесь перемешивают при комнатной температуре в течение 12 часов. Растворитель выпаривают и остаток очищают колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:3), в результате чего получают 1,87 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,25 (3Н, т, J=7,1 Гц), 3,24 (3Н, с), 3,64 (2Н, кв, J=7,1 Гц), 4,77 (2Н, с), 4,94 (2Н, с), 6,15 (2Н, с), 6,97 (1Н, д, J=8,1 Гц), 7,05 (1Н, д, J=8,1 Гц).
Сравнительный пример 15
[2-(Метилсульфонил)-3,4-метилендиоксифенил]метанол
571 мг 1-[(этоксиметокси)метил]-2-(метилсульфонил)-3,4-метилендиоксибензола растворяют в 2 мл дихлорметана, добавляют 2 мл трифторуксусной кислоты и смесь перемешивают при комнатной температуре в течение 30 минут. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:2), в результате чего получают 308 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 3,28 (3Н, с), 4,82 (2Н, с), 6,18 (2Н, с), 6,94 (1Н, д, J=7,9 Гц), 6,98 (1Н, д, J=7,9 Гц).
Сравнительный пример 16
[1-(Бромметил)-2-(метилсульфонил)]-3,4-метилендиоксибензол
907 мг [2-(метилсульфонил)-3,4-метилендиоксифенил]метанола, 1,31 г тетрабромметана и 1,03 г трифенилфосфина растворяют в 5 мл дихлорметана и полученную смесь перемешивают при комнатной температуре в течение 30 минут. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:3), в результате чего получают 1,10 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 3,31 (3Н, с), 5,04 (2Н, с), 6,19 (2Н, с), 6,96 (1Н, д, J=8,1 Гц), 6,99 (1Н, д, J=8,1 Гц).
Сравнительный пример 17
Бромид [2-(метилсульфонил)-3,4-метилендиоксибензил]трифосфония
1,10 г 1-(бромметил)-2-(метилсульфонил)-3,4-метилендиоксибензола и 1,48 г трифенилфосфина растворяют в 20 мл толуола и смесь кипятят с обратным холодильником в течение 12 часов. Полученные кристаллы собирают фильтрацией, промывают эфиром и сушат на воздухе, в результате чего получают 1,90 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 3,02 (3Н, с), 5,90 (2Н, д, J=14,5 Гц), 6,15 (2Н, с), 6,96 (1Н, дд, J=8,1, 0,9 Гц), 7,30 (1Н, дд, J=8,1, 3,3 Гц), 7,62-7,70 (12Н, м), 7,75-7,83 (3Н, м).
Сравнительный пример 18
1-[(2-Метокси-3-пиридил)метил]-4-[2-[[[(трифторметил)сульфонил]окси]-3-пиридил]этил]пиперидин
110 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-оксо-1,2-дигидро-3-пиридинил)этил]пиперидина, 382 мг N-фенил(трифторметан)сульфонимида, 311 мг триэтиламина и 13 мг диметиламинопиридина растворяют в 5 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение 20 часов. Растворитель выпаривают и остаток очищают колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:9), в результате чего получают 151 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,40 (3Н, м), 1,50-1,62 (2Н, м), 1,67-1,76 (2Н, м), 1,98-2,08 (2Н, м), 2,65-2,72 (2Н, м), 2,87-2,94 (2Н, м), 3,48 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,6, 5,2 Гц), 7,29 (1Н, дд, J=7,6, 4,8 Гц), 7,64 (1Н, дд, J=7,6, 2,0 Гц), 7,70 (1Н, дд, J=7,6, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц), 8,21 (1Н, дд, J=4,8, 2,0 Гц).
Сравнительный пример 19
1-[(6-Бром-2-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидин
636 мг указанного в заголовке соединения в виде светло-желтого масла получают из 457 мг 4-(2,3-метилендиоксифенетил)пиперидина, полученного, как описано в сравнительном примере 4, и 409 мг 6-бром-2-пиридинкарбоксальдегида способом, описанным ниже в примере 29.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,38 (3Н, м), 1,52-1,62 (2Н, м), 1,70-1,78 (2Н, м), 2,02-2,10 (2Н, м), 2,56-2,62 (2Н, м), 2,83-2,90 (2Н, м), 3,62 (2Н, с), 5,92 (2Н, с), 6,65 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, дд, J=7,6, 7,6 Гц), 7,34 (1Н, д, J=7,6 Гц), 7,44 (1Н, д, J=7,6 Гц), 7,51 (1Н, дд, J=7,6, 7,6 Гц).
Сравнительный пример 20
1-[(2-Хлор-3-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидин
673 мг указанного в заголовке соединения в виде бесцветного масла получают из 505 мг 4-(2,3-метилендиоксифенэтил)пиперидина, полученного, как описано в сравнительном примере 4, и 464 мг 2-хлор-3-пиридинкарбоксальдегида способом, описанным ниже в примере 29.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,38 (3Н, м), 1,55-1,62 (2Н, м), 1,70-1,80 (2Н, м), 2,06-2,16 (2Н, м), 2,56-2,62 (2Н, м), 2,84-2,91 (2Н, м), 3,59 (2Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=7,8, 1,0 Гц), 6,68 (1Н, дд, J=7,8, 1,0 Гц), 6,76 (1Н, дд, J=7,8, 7,8 Гц), 7,23 (1Н, дд, J=7,2, 5,0 Гц), 7,87 (1Н, дд, J=7,2, 2,0 Гц), 8,27 (1Н, дд, J=5,0, 2,0 Гц).
Сравнительный пример 21
1-[(2-Метокси-З-пиридил)метил]-4-пиперидинэтанол
8,2 г 4-пиперидинэтанола, 10,0 г 3-(хлорметил)-2-метоксипиридина и 17,5 г карбоната калия суспендируют в 65 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и получают указанное в заголовке соединение в виде желтого масла (количественный выход).
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,72 (7Н, м), 2,00-2,10 (2Н, м), 2,86-2,94 (2Н, м), 3,49 (2Н, с), 3,70 (2Н, т, J=6,7 Гц), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,0, 5,0 Гц), 7,65 (1Н, дд, J=7,0, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Сравнительный пример 22
1-[(2-Метокси-З-пиридил)метил]-4-пиперидинацетальдегид
12,0 г указанного в заголовке соединения в виде желтого масла получают из 17,4 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинэтанола способом, описанным в сравнительном примере 30.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,43 (2Н, м), 1,65-1,76 (2Н, м), 1,91 (1Н, с), 2,02-2,17 (2Н, м), 2,83-2,94 (2Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 7,63 (1Н, дд, J=7,1, 1,9 Гц), 8,05 (1Н, дд, J=4,9, 1,9 Гц), 9,78 (1Н, т, J=2,0 Гц).
Сравнительный пример 23
1-[(2-Метокси-3-пиридил)метил]-4-пиперидон
4,0 г гидрохлорида 4-пиперидона, 4,1 г 3-(хлорметил)-2-метоксипиридина и 12,6 г карбоната калия суспендируют в 26 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 15 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат), в результате чего получают 5,5 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 2,45-2,52 (4Н, м), 2,77-2,85 (4Н, м), 3,64 (2Н, с), 3,96 (3Н, с), 6,90 (1Н, дд, J=7,1, 4,9 Гц), 7,70 (1Н, дд, J=7,1, 2,0 Гц), 8,09 (1Н, дд, J=4,9, 2,0 Гц).
Сравнительный пример 24
Этил-2-[1-[(2-метокси-3-пиридил)метил]гексагидро-4-пиридинилиден]ацетат
При охлаждении льдом к суспензии 0,40 г 60% гидрида натрия (масляной суспензии) и 18 мл тетрагидрофурана по каплям добавляют смешанный раствор 2,2 мл триэтилфосфонацетата и 18 мл тетрагидрофурана. После перемешивания в течение 5 минут по каплям добавляют смешанный раствор 2,0 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидона и 9 мл тетрагидрофурана. После завершения добавления по каплям смесь перемешивают при охлаждении льдом в течение 30 минут. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:1), в результате чего получают 2,6 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28 (3Н, т, J=6,9 Гц), 2,32-2,38 (2Н, м), 2,54-2,62 (4Н, м), 2,97-3,05 (2Н, м), 3,53 (2Н, с), 3,95 (3Н, с), 4,14 (2Н, кв, J=6, 9 Гц), 5,64 (1Н, с), 6,88 (1Н, дд, J=7,2, 4,9 Гц), 7,67 (1Н, дд, J=7,2, 2,1 Гц), 8,07 (1Н, дд, J=4,9, 2,1 Гц).
Сравнительный пример 25
Этил-2-[1-[(2-метокси-3-пиридил)метил]-4-пиперидил]ацетат
2,6 г этил-2-[1-[(2-метокси-3-пиридил)метил]гексагидро-4-пиридинилиден]ацетата и 380 мг 10% порошкообразного палладия на угле (продукта, содержащего воду) суспендируют в 20 мл этилацетата. После замены атмосферы контейнера водородом смесь перемешивают при комнатной температуре при нормальном давлении в течение одного часа. Реакционный раствор фильтруют, а затем растворитель фильтрата выпаривают с получением указанного в заголовке соединения в виде желтого масла (с количественным выходом).
1H-ЯМР (400 МГц, CDCl3) δ 1,25 (3Н, т, J=7,1 Гц), 1,28-1,41 (2Н, м), 1,65-1,86 (3Н, м), 2,02-2,12 (2Н, м), 2,23 (2Н, д, J=7,0 Гц), 2,84-2,92 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 4,12 (2Н, кв, J=7,1 Гц), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,65 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=5,0, 2,0 Гц).
Сравнительный пример 26
N-(трет-Бутоксикарбонил)-4-[2-[2-(метилсульфонил)фенил]-2-оксоэтил]пиперидин
2,0 г N-(трет-бутоксикарбонил)-4-[2-гидрокси-2-[2-(метилтио)фенил]этилэтил]пиперидина получают из 2,2 г 2-бромтиоанизола, 6,9 мл 1,53 М раствора н-бутиллития в гексане и 2,0 г N-(трет-бутоксикарбонил)-4-пиперидинацетальдегида способом, описанным ниже в примере 71. Затем получают 2,0 г N-(трет-бутоксикарбонил)-4-[2-[2-(метилтио)фенил]этил-2-оксоэтил]пиперидина в виде светло-желтого масла способом, описанным в сравнительном примере 30. Полученный продукт и 2,7 г 3-хлорпербензойной кислоты растворяют в 15 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют водный раствор тиосульфата натрия и водный раствор гидроксида натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (этилацетат:гексан=1:1), в результате чего получают 1,8 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,14-1,29 (2Н, м), 1,46 (9Н, с), 1,78-1,88 (2Н, м), 2,22 (1Н, м), 2,73-2,86 (2Н, м), 2,87 (2Н, д, J=6,6 Гц), 3,25 (3Н, с), 3,96-4,24 (2Н, с), 7,40 (1Н, д, J=7,5 Гц), 7,62 (1Н, дд, J=7,8, 7,5 Гц), 7,70 (1Н, дд, J=7,5, 7,5 Гц), 8,07 (1Н, д, J=7,8 Гц).
Сравнительный пример 27
Метил-3-[1-[(2-метокси-3-пиридил)метил]-4-пиперидин]пропаноат
2,0 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного как описано в сравнительном примере 2, 1,6 мл триметилфосфонацетата и 60% гидрида натрия суспендируют в 30 мл тетрагидрофурана, и смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют этилацетат и смесь промывают 1 н. водным гидроксидом натрия и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и полученный неочищенный продукт и 400 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 100 мл этанола. После замены атмосферы контейнера водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 20 часов. Реакционный раствор фильтруют и фильтрат выпаривают с получением 2,20 г указанного в заголовке соединения в виде светло-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,35 (3Н, м), 1,55-1,70 (4Н, м), 1,96-2,06 (2Н, м), 2,33 (2Н, т, J=7,8 Гц), 2,84-2,93 (2Н, м), 3,48 (2Н, с), 3,67 (3Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,2, 4,8 Гц), 7,63 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Сравнительный пример 28
3-[1-[(2-Метокси-3-пиридил)метил]-4-пиперидил]пропаналь
2,20 г 3-[1-[(2-метокси-3-пиридил)метил]-4-пиперидин]пропаноата подвергают стандартному восстановлению с использованием алюмогидрида лития. Полученный продукт обрабатывают способом, описанным в сравнительном примере 30, в результате чего получают 1,29 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,34 (3Н, м), 1,56-1,70 (4Н, м), 1,97-2,06 (2Н, м), 2,45 (2Н, тд, J=7,6, 7,6, 1,8 Гц), 2,85-2,93 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,0, 5,0 Гц), 7,63 (1Н, дд, J=7,0, 2,0 Гц), 8,05 (1Н, дд, J=5,0, 2,0 Гц), 9,77 (1Н, т, J=1,8 Гц).
Сравнительный пример 29
2-[1-[(2-Метокси-3-пиридил)метил]-2-пиперидил]-1-этанол
15,6 г 2-метоксиникотинового альдегида, 14 г 2-пиперидинэтанола, 30 г триацетоксиборогидрида натрия, 6,6 мл уксусной кислоты и 200 мл тетрагидрофурана перемешивают при комнатной температуре в течение одного часа. Затем добавляют разбавленный раствор гидроксида натрия, смесь экстрагируют этилацетатом и сушат над безводным сульфатом магния. Затем осушитель отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат, а затем этилацетат:метанол=2:1).
1H-ЯМР (400 МГц, CDCl3) δ 1,35-1,84 (8Н, м), 1,93-2,04 (1Н, м), 2,05-2,34 (1Н, м), 2,76-2,85 (1Н, м), 2,95-3,02 (1Н, м), 3,59 (1Н, д, J=16,0 Гц), 3,65-3,73 (1Н, м), 3,84-3,92 (1Н, м), 3,97 (3Н, с), 4,02 (1Н, д, J=16,0 Гц), 6,85 (1Н, дд, J=6,8 Гц, 6,8 Гц), 7,58 (1Н, д, J=6,8 Гц), 8,06 (1Н, д, J=6,8 Гц).
Сравнительный пример 30
2-[1-[(2-Метокси-3-пиридил)метил]-2-пиперидил]ацетальдегид
Раствор 4,2 г комплекса "пиридин-триоксид серы", растворенного в диметилсульфоксиде (ДМСО), по каплям добавляют к раствору 3 г 2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]-1-этанола и 7,3 мл триэтиламина, растворенного в 15 мл ДМСО, поддерживая при среднемассовой температуре 20°С или менее. После завершения добавления по каплям смесь перемешивают при комнатной температуре в течение одного часа. Затем добавляют водный раствор бикарбоната натрия и смесь экстрагируют этилацетатом. После сушки сульфатом натрия растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (метанол) и получают 2,5 г красно-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,83 (6Н, м), 2,18-2,26 (1Н, м), 2,59-2,69 (2Н, м), 2,70-2,79 (1Н, м), 2,98-3,05 (1Н, м), 3,37 (1Н, д, J=16,0 Гц), 3,76 (1Н, д, J=16,0 Гц), 3,95 (3Н, с), 6,86 (1Н, дд, J=6,8 6,8 Гц), 7,63 (1Н, д, J=6,8 Гц), 8,05 (1Н, д, J=6,8 Гц), 9,83 (1Н, с).
Сравнительный пример 31
1-[(2-Метокси-3-пиридил)метил]-2-пиперидинкарбоксальдегид
1-[(2-Метокси-3-пиридил)метил]-2-пиперидинкарбоксальдегид получают способом, описанным в сравнительном примере 30, с использованием 2-пиперидинметанола вместо 2-пиперидинэтанола.
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,38 (1Н, м), 1,46-1,80 (5Н, м), 2,05-2,14 (1Н, м), 2,86-2,97 (2Н, м), 3,50 (1Н, д, J=16,0 Гц), 3,62 (1Н, д, J=16,0 Гц), 3,94 (3Н, с), 6,88 (1Н, дд, J=6,8, 6,8 Гц), 7,64 (1Н, дд, J=6,8, 2,0 Гц), 8,08 (1Н, дд, J=6,8, 2,0 Гц), 9,60 (1Н, с).
Сравнительный пример 32
Этил-2-(2-пиперидил)ацетат
50 мл этил-2-(2-пиридил)ацетата, 18,7 мл уксусной кислоты, 5 г Pd-C (содержащего воду продукта) и 200 мл этанола загружают в автоклав и смесь перемешивают при 70°С в течение 9 часов под давлением водорода 56 кг/см2. Pd-C отфильтровывают и этанол выпаривают с получением 72,3 г белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,12 (3Н, т, J=7,2 Гц), 1,40-1,86 (6Н, м), 1,96 (3Н, с), 2,54 (1Н, дд, J=16,4 7,2 Гц), 2,70-2,89 (2Н, м), 3,10-3,20 (1Н, м), 3,12-3,30 (1Н, м), 4,13 (2Н, кв, J=7,2 Гц), 8,39 (2Н, с).
Сравнительный пример 33
Этил-2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетат
25 г этил-2-(2-пиперидил)ацетата, 15,6 г альдегида 2-метоксиникотиновой кислоты, 30 г триацетоксиборогидрида натрия, 6,6 мл уксусной кислоты и 200 мл ТГФ перемешивают при комнатной температуре в течение ночи. Затем добавляют гидроксид натрия и смесь экстрагируют этилацетатом. После сушки над безводным сульфатом магния растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=2:1), в результате чего получают 2,8 г бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,12 (3Н, т, J=7,2 Гц), 1,40-1,80 (6Н, м), 2,22-2,32 (1Н, м), 2,42 (1Н, дд, J=16,4, 7,2 Гц), 2,62-2,73 (2Н, м), 2,98-3,05 (1Н, м), 3,41 (1Н, дд, J=15,6 Гц), 3,70 (1Н, д, J=15,6 Гц), 2,95 (3Н, с), 4,12 (2Н, кв, J=7,2 Гц), 6,86 (1Н, дд, J=7,6 4,8 Гц), 7,69 (1Н, дд, J=7,6 2,0 Гц), 8,02 (1Н, дд, J=4,8 2,0 Гц).
J=7,6, 2,0 Гц), 8,02 (1Н, дд, J=4,8, 2,0 Гц).
Сравнительный пример 34
2-[1-[(2-Метокси-3-пиридил)метил]-2-пиперидил]уксусная кислота
2,8 г этил-2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетата, 20 мл 2 н. водного гидроксида натрия и 20 мл метанола перемешивают при 70°С в течение 1,5 часов. Затем добавляют 8 мл 5 н. водной соляной кислоты и растворитель выпаривают. К остатку добавляют этанол и хлорид натрия отфильтровывают. Этанол выпаривают и получают 2,9 г бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,35-1,80 (6Н, м), 2,25-2,40 (2Н, м), 2,60-2,70 (2Н, м), 2,92-3,00 (1Н, м), 3,49 (1Н, д, J=15,6 Гц), 3,77 (1Н, д, J=15,6 Гц), 3,90 (3Н, с), 7,00 (1Н, дд, J=7,6 4,8 Гц), 7,70 (1Н, дд, J=7,6 2,0 Гц), 8,08 (1Н, д, J=4,8 2,0 Гц).
Сравнительный пример 35
2-[(2R)-1-(трет-Бутоксикарбонил)гексагидро-2-пиридинил]уксусная кислота
29,3 г 2-[(2R)-гексагидро-2-пиридинил]уксусной кислоты, 8 г гидроксида натрия, 44,7 г ди-трет-бутилбикарбоната, 240 мл воды и 180 мл трет-бутанола перемешивают при комнатной температуре в течение ночи. Реакционный раствор промывают этилацетатом. Водный слой доводят до рН 1,5 добавлением водного бисульфата калия, а затем экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, а затем этилацетат выпаривают с получением 18,6 г целевого соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,35-1,75 (15Н, м), 2,52-2,66 (2Н, м), 2,73-2,84 (1Н, м), 3,97-4,06 (1Н, м), 4,67-4,75 (1Н, м).
Сравнительный пример 36
трет-Бутил-(2R)-2-[2-(ди(2-пропиниламино)-2-оксоэтил]гексагидро-1-пиридинкарбоксилат
7,4 г 2-[(2R)-1-(трет-бутоксикарбонил)гексагидро-2-пиридинил]уксусной кислоты, 2,7 г дипропаргиламина, 1,2 г WSC (гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида), 2,0 г HOBt (1-гидрокси-1Н-бензотриазола) и 50 мл ДМФ перемешивают при комнатной температуре в течение 2 часов. Затем добавляют насыщенный раствор соли. Смесь экстрагируют этилацетатом и сушат над безводным сульфатом магния. Безводный сульфат натрия отфильтровывают и растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=4:1, а затем 2:1), в результате чего получают 7,7 г целевого продукта в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,75 (15Н, м), 2,22 (1Н, с), 2,30 (1Н, с), 2,50-2,60 (1Н, м), 2,73-2,85 (2Н, м), 3,93-4,05 (1Н, м), 4,18-4,30 (2Н, м), 4,30-4,45 (2Н, м), 4,58-4,65 (1Н, м).
Сравнительный пример 37
N1,N1-Ди(2-пропинил)-2-[(2R)-гексагидро-2-пиридинил]ацетамид
7,7 г трет-бутил-(2R)-2-[2-(ди(2-пропиниламино)-2-оксоэтил]гексагидро-1-пиридинкарбоксилата, 100 мл 5 н. водной соляной кислоты и 50 мл метилового спирта перемешивают при комнатной температуре в течение одного часа. Затем добавляют 110 мл 5 н. водного гидроксида натрия. Затем смесь экстрагируют этилацетатом и сушат над безводным сульфатом натрия. После удаления безводного сульфатат натрия и выпаривания органического растворителя получают 4,4 г целевого продукта в виде масла.
[α]D=-23,4° (С=0,74, МеОН, 28°С).
1H-ЯМР (400 МГц, CDCl3) δ 1,15-1,50 (3Н, м), 1,56-1,63 (2Н, м), 1,72-1,80 (1Н, м), 2,21 (1Н, с), 2,28 (1Н, с), 2,40-2,48 (2Н, м), 2,63-2,72 (1Н, м), 2,93-3,03 (2Н, м), 4,10-4,39 (4Н, м).
Сравнительный пример 38
1-[(2-Метокси-3-пиридил)метил]-2-пиперидинкарбоксальдегид
17 г триацетоксиборогидрида натрия добавляют к реакционному раствору 8,7 г 2-метоксиникотинового альдегида, 5,8 г 2-пиперидинметанола, 3 мл уксусной кислоты и 100 мл тетрагидрофурана (ТГФ) при комнатной температуре и смесь перемешивают в течение ночи. Затем добавляют разбавленный гидроксид натрия и смесь экстрагируют этилацетатом. Растворитель выпаривают и остаток очищают хроматографией на силикагеле (гексан:этилацетат=1:1, затем этилацетат, а затем этилацетат:метанол=4:1) с получением 5,4 г масла. Раствор 8,0 г комплекса пиридин - триоксид серы, растворенного в ДМСО, поддерживая при среднемассовой температуре 20°С или менее, по каплям, перемешивая, добавляют в раствор 5,4 г полученного масла, 14 мл триэтиламина и 20 мл ДМСО. После перемешивания при комнатной температуре в течение 3 часов добавляют охлажденный бикарбонат натрия и смесь экстрагируют этилацетатом. Растворитель выпаривают и остаток очищают хроматографией на силикагеле (гексан:этилацетат=4:1, затем 3:2, а затем 2:1), в результате чего получают 2,7 г желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,80 (6H, м), 2,05-2,14 (1Н, м), 2,85-2,96 (2Н, м), 3,50 (1Н, д, J=14,8 Гц), 3,62 (1Н, д, J=14,8 Гц), 3,94 (3Н, с), 6,85 (1Н, дд, J=6,8, 6,8 Гц), 7,65 (1Н, д, J=6,8 Гц), 8,07 (1Н, д, J=6,8 Гц), 9,60 (1Н, с).
Сравнительный пример 39
Этил-(Е)-3-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]-2-пропеноат
2,4 г трет-бутоксида калия, перемешивая, добавляют при комнатной температуре к раствору 4,2 мл триэтилфосфонацетата, растворенного в 40 мл ТГФ. Через 10 минут, перемешивая при комнатной температуре, добавляют раствор 5 г 1-[(2-метокси-3-пиридил)метил]-2-пиперидинкарбоксальдегида, растворенного в ТГФ. После перемешивания в течение одного часа добавляют воду и смесь экстрагируют этилацетатом. После сушки над безводным сульфатом натрия растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=4:1, а затем 2:1) с получением 3,4 г масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,27 (3Н, т, J=7,2 Гц), 1,28-1,80 (6Н, м), 1,94-2,02 (1Н, м), 2,82-2,97 (2Н, м), 3,19 (1Н, д, J=14,8 Гц), 3,70 (1Н, д, J=14,8 Гц), 3,94 (3Н, с), 4,19 (2Н, кв, J=7,2 Гц), 5,98 (1Н, д, J=16,0 Гц), 6,85 (1Н, дд, J=6,8, 6,8 Гц), 6,96 (1Н, дд, J=16,0, 7,0 Гц), 7,67 (1Н, д, J=6,8 Гц), 8,02 (1Н, д, J=6,8 Гц).
Сравнительный пример 40
Этил-3-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]-2-пропаноат
3,4 г этил-(Е)-3-[1-(2-метокси-3-пиридил)метил]-2-пиперидил]-2-пропеноата растворяют в этаноле, добавляют 1 г Pd-C (продукт, содержащий воду) и смесь каталитически гидрируют в течение ночи при нормальном давлении. Катализатор отфильтровывают и растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=3:1) с получением 1,58 г бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,03 (3Н, т, J=7,2 Гц), 1,30-1,73 (6Н, м), 1,88-1,95 (2Н, м), 2,09-2,17 (1Н, м), 2,23-2,45 (3Н, м), 2,75-2,80 (1Н, м), 3,26 (1Н, д, J=14,8 Гц), 3,83 (1Н, д, J=14,8 Гц), 3,95 (3Н, с), 4,10 (2Н, кв, J=7,2 Гц), 6,84 (1Н, дд, J=6,8, 6,8 Гц), 7,67 (1Н, д, J=6,8 Гц), 8,02 (1Н, д, J=6,8 Гц).
Сравнительный пример 41
(2-Метокси-3-пиридил)метилцианид
4 г (2-метокси-3-пиридил)метилхлорида, 2,5 г цианида натрия и 10 мл ДМФ перемешивают при нагревании в течение 10 минут. Затем добавляют воду и смесь экстрагируют этилацетатом и сушат над безводным сульфатом натрия. Осушитель удаляют и растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=3:1) с получением 2,5 г бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 3,65 (2Н, с), 3,99 (3Н, с), 6,93 (1Н, дд, J=6,8 Гц), 7,66 (1Н, д, J=6,8 Гц), 8,15 (1Н, д, J=6,8 Гц).
Сравнительный пример 42
2-(2-Метокси-3-пирицил)уксусная кислота
2,2 г (2-метокси-3-пиридил)метилцианида, 35 мл 5 н. водного гидроксида натрия и 35 мл метанола перемешивают при нагревании при 100°C в течение 1,5 часов. Смесь охлаждают до комнатной температуры, а затем к ней добавляют 35 мл 5 н. водной соляной кислоты и растворитель выпаривают. К остатку добавляют этанол и твердое вещество отфильтровывают. Этанол выпаривают и к остатку снова добавляют этанол, после чего твердое вещество отфильтровывают. Этанол выпаривают и получают 2,4 г белых кристаллов.
1H-ЯМР (400 МГц, ДМСО-d6) δ 3,53 (2Н, с), 3,86 (3Н, с), 6,95 (1Н, дд, J=6,8 6,8 Гц), 7,60 (1Н, д, J=6,8 Гц), 8,07 (1Н, д, J=6,8 Гц).
Сравнительный пример 43
2-(2-Метокси-3-пиридил)этанол
2,4 г (2-метокси-3-пиридил)уксусной кислоты, 550 мг алюмогидрида лития и 20 мл ТГФ перемешивают при комнатной температуре в течение 0,5 часа. Затем последовательно добавляют 0,27 мл воды, 3,9 мл 3,8 н. водного гидроксида натрия и 0,78 мл воды, после чего полученное твердое вещество отфильтровывают. Фильтрат выпаривают и остаток очищают хроматографией на силикагеле (гексан:этилацетат=2:1, а затем 1:1) с получением 1,2 г желтого масла.
1H-ЯМР (400 МГц, ДМСО-d6) δ 2,83 (3Н, т, J=7,2 Гц), 3,84 (2Н, кв, J=7,2 Гц), 3,97 (3Н, с), 6,83 (1Н, дд, J=6,8 6,8 Гц), 7,42 (1Н, д, J=6,8 Гц), 8,03 (1Н, д, J=6,8 Гц).
Сравнительный пример 44
2-(2-Метокси-3-пиридил)ацетальдегид
Раствор 2,7 г комплекса пиридин-триоксид серы, растворенного в ДМСО, по каплям, при 20°С или менее добавляют к раствору 1,2 г 2-(2-метокси-3-пиридил)этанола и 4,8 мл триэтиламина, растворенного в ДМСО. После перемешивания в течение 0,5 часа добавляют охлажденный бикарбонат натрия и смесь экстрагируют этилацетатом. После сушки над сульфатом натрия, растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=4:1) с получением 200 мг желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 3,60 (2Н, с), 3,95 (3Н, с), 6,85 (1Н, д, J=6,8 6,8 Гц), 7,40 (1Н, д, J=6,8 Гц), 8,10 (1Н, д, J=6,8 Гц).
Сравнительный пример 45
Хлорид [[(2-(циклогексилметилокси)фенил)метил] трифенилфосфония
3,06 г 2-(циклогексилметилокси)бензилового спирта растворяют в 30 мл толуола, к раствору добавляют 1,52 мл тионилхлорида и 5 капель N,N-диметилформамида и смесь перемешивают в течение 70 минут при охлаждении льдом. К реакционному раствору добавляют водный карбонат натрия, и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Раствор фильтруют через окись алюминия и растворитель выпаривают, в результате чего получают светло-желтое масло. Полученное масло растворяют в 3 мл ацетонитрила, добавляют 3,65 г трифенилфосфина и смесь перемешивают при 110°С в течение 1 часа и 45 минут. К реакционному раствору добавляют этилацетат и продукт собирают фильтрацией, в результате чего получают 6,51 г указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 0,75-0,89 (2H, м), 1,06-1,38 (4Н, м), 1,51-1,58 (2H, м), 1,64-1,84 (3Н, м), 3,21 (2H, д, J=6,4 Гц), 5,34 (2H, д, J=14,0 Гц), 6,59 (1Н, д, J=8,0 Гц), 6,80 (1Н, дт, J=8,0, 0,8 Гц), 7,22 (1Н, м), 7,32 (1Н, м), 7,58-7,68 (12Н, м), 7,73-7,81 (3Н, м).
Сравнительный пример 46
Метил-5-метил-2-метокси-3-пиридинкарбоксилат
1,2 г метил-5-бром-2-метокси-3-пиридинкарбоксилата растворяют в 20 мл N,N-диметилформамида, добавляют 440 мг метилборной кислоты, 4,79 г безводного карбоната цезия и 564 мг тетракис(трифенилфосфин)палладия и смесь перемешивают при 120°С в течение 2 часов в атмосфере азота. К реакционному раствору добавляют воду со льдом и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (гексан:этилацетат=20:1), в результате чего получают 461 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 2,29 (3Н, с), 3,90 (3Н, с), 4,02 (3Н, с), 7,99 (1Н, д, J=2,4 Гц), 8,12 (1Н, д, J=2,4 Гц).
Сравнительный пример 47
Метил-5-фенил-2-метокси-3-пиридинкарбоксилат
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 46.
1H-ЯМР (400 МГц, CDCl3) δ 3,94 (3Н, с), 4,10 (3Н, с), 7,38 (1Н, м), 7,44-7,50 (2Н, м), 7,54-7,58 (2Н, м), 8,39 (1Н, д, J=2,8 Гц), 8,54 (1Н, д, J=2,8 Гц).
Сравнительный пример 48
Метил-5-(3-пиридинил)-2-метокси-3-пиридинкарбоксилат
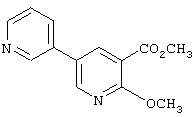
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 46.
1H-ЯМР (400 МГц, CDCl3) δ 3,95 (3Н, с), 4,11 (3Н, с), 7,41 (1Н, дд, J=8,0, 4,8, 1,2 Гц), 7,86 (1Н, ддд, J=8,0, 2,4, 1,6 Гц), 8,39 (1Н, д, J=2,8 Гц), 8,55 (1Н, д, J=2,8 Гц), 8,64 (1Н, дд, J=4,8, 1,6 Гц), 8,83 (1Н, дд, J=2,4, 1,2 Гц).
Сравнительный пример 49
Метил-5-(4-пиридинил)-2-метокси-3-пиридинкарбоксилат
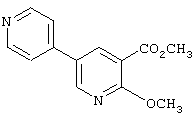
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 46.
1H-ЯМР (400 МГц, CDCl3) δ 3,95 (3Н, с), 4,12 (3Н, с), 7,47-7,53 (2Н, м), 8,44 (1Н, д, J=2,8 Гц), 8,61 (1Н, д, J=2,8 Гц), 8,67-8,73 (2Н, м).
Сравнительный пример 50
6-Метил-2-метокси-3-пиридинметанол
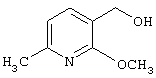
0,9 г алюмогидрида лития суспендируют в 60 мл тетрагидрофурана и к этой суспензии по каплям при охлаждении льдом и при перемешивании добавляют раствор 4,41 г 6-метил-2-метокси-3-пиридинкарбоксилата, растворенного в 20 мл тетрагидрофурана. После перемешивания в течение 30 минут к раствору последовательно добавляют 0,9 мл воды, 0,9 мл 15% водного гидроксида натрия и 2,7 мл воды. Затем добавляют целит и безводный сульфат магния и смесь перемешивают при комнатной температуре. После фильтрации реакционного раствора растворитель выпаривают и получают 3,78 г указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 2,26 (1Н, м), 2,44 (3Н, с), 3,98 (3Н, с), 4,60 (2Н, д, J=5,2 Гц), 6,71 (1Н, д, J=7,2 Гц), 7,42 (1Н, д, J=7,2 Гц).
Сравнительный пример 51
5-Хлор-2-метокси-3-пиридинметанол
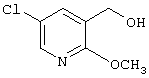
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 50.
1Н-ЯМР (400 МГц, CDCl3) δ 3,97 (3Н, с), 4,63 (2Н, с), 7,59-7,65 (1Н, м), 8,03 (1Н, д, J=2,4 Гц).
Сравнительный пример 52
5-Бром-2-метокси-3-пиридинметанол

Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 50.
1H-ЯМР (400 МГц, CDCl3) δ 3,96 (3Н, с), 4,63 (2Н, с), 7,73 (1Н, д, J=2,4 Гц), 8,13 (1Н, д, J=2,4 Гц).
Сравнительный пример 53
5-Метил-2-метокси-3-пиридинметанол

Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 50.
1H-ЯМР (400 МГц, CDCl3) δ 2,25 (3Н, с), 3,97 (3Н, с), 4,26 (2Н, с), 7,50 (1Н, д, J=2,4 Гц), 7,89 (1Н, д, J=2,4 Гц).
Сравнительный пример 54
5-Фенил-2-метокси-3-пиридинметанол
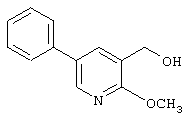
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 50.
1H-ЯМР (400 МГц, CDCl3) δ 4,04 (1Н, с), 4,72 (2Н, с), 7,36 (1Н, м), 7,42-7,48 (2Н, м), 7,52-7,56 (2Н, м), 7,82 (1Н, д, J=2,4 Гц), 8,32 (1Н, д, J=2,4 Гц).
Сравнительный пример 55
5-(3-Пиридинил)-2-метокси-3-пиридинметанол
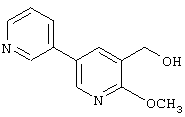
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 50.
1H-ЯМР (400 МГц, CDCl3) δ 4,05 (3Н, с), 4,74 (2Н, с), 7,39 (1Н, ддд, J=8,0, 4,8, 0,4 Гц), 7,85-7,88 (2Н, м), 8,32 (1Н, д, J=2,4 Гц), 8,61 (1Н, дд, J=4,8, 1,6 Гц), 8,11 (1Н, дд, J=2,4, 0,4 Гц).
Сравнительный пример 56
5-(4-Пиридинил)-2-метокси-3-пиридинметанол
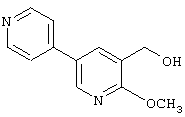
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 50.
1H-ЯМР (400 МГц, CDCl3) δ 2,38 (1Н, с), 4,06 (3Н, с), 4,75 (2Н, с), 7,47-7,50 (2Н, м), 7,91 (1Н, м), 8,40 (1Н, д, J=2,4 Гц), 8,64-8,68 (2Н, м).
Сравнительный пример 57
6-Метил-2-метокси-3-(хлорметил)пиридин
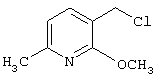
3,78 г 6-метил-2-метокси-3-пиридинметанола растворяют в 60 мл тетрахлорметана, к раствору добавляют 6,48 г трифенилфосфина и смесь кипятят с обратным холодильником в течение 6 часов 30 минут. Растворитель выпаривают, к остатку добавляют н-гексан и нерастворившиеся вещества отфильтровывают. Растворитель выпаривают и неочищенный продукт очищают хроматографией на силикагеле (н-гексан:этилацетат=100:1) с получением 2,29 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 2,45 (3Н, с), 3,98 (3Н, с), 4,58 (2Н, с), 6,72 (1Н, д, J=7,2 Гц), 7,50 (1Н, д, J=7,2 Гц).
Сравнительный пример 58
5-Хлор-2-метокси-3-(хлорметил)пиридин
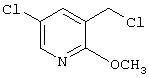
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 57.
1H-ЯМР (400 МГц, CDCl3) δ 3,98 (3Н, с), 4,55 (2Н, с), 7,63-7,68 (1Н, м), 8,07 (1Н, д, J=2,4 Гц).
Сравнительный пример 59
5-Бром-2-метокси-3-(хлорметил)пиридин
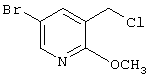
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 57.
1H-ЯМР (400 МГц, CDCl3) δ 3,98 (3Н, с), 4,54 (2Н, с), 7,78 (1Н, д, J=2,4 Гц), 8,12 (1Н, д, J=2,4 Гц).
Сравнительный пример 60
5-Метил-2-метокси-3-(хлорметил)пиридин
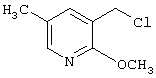
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 57.
1H-ЯМР (400 МГц, CDCl3) δ 2,26 (3Н, с), 3,97 (3Н, с), 4,58 (2Н, с), 7,48 (1Н, д, J=2,0 Гц), 7,93 (1Н, д, J=2,0 Гц).
Сравнительный пример 61
5-Фенил-2-метокси-3-(хлорметил)пиридин
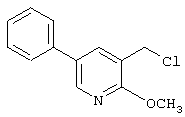
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 57.
1H-ЯМР (400 МГц, CDCl3) δ 4,05 (3Н, с), 4,66 (2Н, с), 7,37 (1Н, м), 7,43-7,48 (2Н, м), 7,52-7,56 (2Н, м), 7,88 (1Н, д, J=2,4 Гц), 8,36 (1Н, д, J=2,4 Гц).
Сравнительный пример 62
5-(4-Пиридинил)-2-метокси-3-пиридинкарбоксальдегид
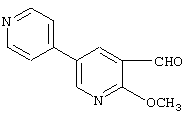
321 мг 5-(4-пиридинил)-2-метокси-3-пиридинметанола растворяют в 10 мл хлороформа, добавляют 1,6 г диоксида марганца и смесь перемешивают при комнатной температуре в течение 14 часов. После фильтрации через целит растворитель выпаривают. Неочищенный продукт очищают хроматографией на силикагеле (толуол:этилацетат=3:1) с получением 329 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 4,17 (3Н, с), 7,48-7,56 (2Н, м), 8,40 (1Н, д, J=2,8 Гц), 8,66-8,76 (3Н, м), 10,45 (1Н, с).
Сравнительный пример 63
5-(3-Пиридинил)-2-метокси-3-пиридинкарбоксальдегид
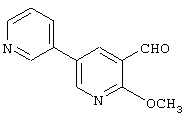
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 62.
1H-ЯМР (400 МГц, CDCl3) δ 4,15 (3Н, с), 7,41 (1Н, ддд, J=0,8, 4,8, 8,0 Гц), 7,87 (1Н, ддд, J=8,0, 2,4, 1,6 Гц), 8,33 (1Н, д, J=2,4 Гц), 8,63 (1Н, д, J=2,4 Гц), 8,65 (1Н, дд, J=4,8, 1,6 Гц), 8,84 (1Н, дд, J=2,4, 0,8 Гц), 10,44 (1Н, с).
Сравнительный пример 64
Диметилацеталь 5-бром-2-метокси-3-пиридинкарбоксальдегида
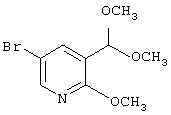
2,58 г 5-бром-2-метокси-3-пиридинкарбоксальдегида растворяют в 30 мл дихлорметана, добавляют смесь 9 мл триметилортоформиата и монтморрилонит К-10 (3 г) и смесь перемешивают при комнатной температуре в течение 2 часов.
После фильтрации реакционного раствора фильтрат выпаривают. К остатку добавляют этилацетат, а затем фильтруют через окись алюминия. Фильтрат выпаривают и получают 3,09 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 3,36 (6Н, с), 3,96 (3Н, с), 5,51 (1Н, с), 7,90 (1Н, дд, J=2,4, 0,4 Гц), 8,18 (1Н, д, J=2,4 Гц).
Сравнительный пример 65
Диметилацеталь 5-(метилсульфонил)-2-метокси-3-пиридинкарбоксальдегида

20 мл тетрагидрофурана охлаждают до -78°С, добавляют 4,17 мл н-бутиллития (1,6 М раствора в гексане) и смесь перемешивают. Затем по каплям добавляют раствор 1,59 г диметилацеталя 5-бром-2-метокси-3-пиридинкарбоксальдегида, растворенного в 5 мл тетрагидрофурана. Через 30 минут по каплям добавляют 0,66 мл диметилдисульфида и смесь перемешивают еще в течение 1,5 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и получают бледно-желтое масло. Полученное масло растворяют в 30 мл дихлорметана, добавляют 5,12 г бикарбоната натрия и 2,32 г м-хлорпербензойной кислоты и смесь перемешивают в течение 30 минут при охлаждении льдом. К реакционному раствору добавляют водный тиосульфат натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой, 1 н. водным гидроксидом натрия и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=2:1) с получением 0,81 г указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 3,08 (3Н, с), 3,38 (6Н, с), 4,08 (3Н, с), 5,51 (1Н, с), 8,29 (1Н, дд, J=2,8, 0,8 Гц), 8,71 (1Н, д, J=2,8 Гц).
Сравнительный пример 66
5-(Метилсульфонил)-2-метокси-3-пиридинкарбоксальдегид

0,81 г диметилацеталя 5-(метилсульфонил)-2-метокси-3-пиридинкарбоксальдегида растворяют в 8 мл ацетона, добавляют 2 мл 5 н. соляной кислоты и смесь перемешивают при комнатной температуре в течение 30 минут. К реакционному раствору добавляют водный карбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают, к остатку добавляют н-гексан и полученный продукт собирают фильтрацией с получением 0,62 г указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 3,11 (3Н, с), 4,12 (3Н, с), 8,58 (1Н, д, J=2,8 Гц), 8,93 (1Н, д, J=2,8 Гц), 10,38 (1Н, с).
Сравнительный пример 67
5-Фтор-2-метокси-3-пиридинкарбоксальдегид
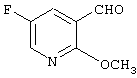
20 мл тетрагидрофурана охлаждают до -78°С, добавляют 2,41 мл н-бутиллития (2,6 М раствора в гексане) и смесь перемешивают. Затем по каплям добавляют раствор 1,50 г диметилацеталя 5-бром-2-метокси-3-пиридинкарбоксальдегида, растворенного в 5 мл тетрагидрофурана. Через 25 минут по каплям в течение 20 минут добавляют раствор 2,16 г N-фторбензолсульфонимида, растворенного в 20 мл тетрагидрофурана, и смесь перемешивают еще в течение 55 минут. К реакционной смеси добавляют насыщенный раствор соли и 20 мл 2 н. соляной кислоты, а затем перемешивают при комнатной температуре. Через 40 минут к реакционному раствору добавляют разбавленный аммиак и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и получают желтое масло. Полученное масло растворяют в 16 мл ацетона, добавляют 4 мл 5 н. соляной кислоты и смесь оставляют на 30 минут при комнатной температуре. К реакционному раствору добавляют водный карбонат калия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=15:1) с получением 234 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 4,07 (3Н, с), 7,84 (1Н, д, J=3,2, 7,6 Гц), 8,24 (1Н, д, J=3,2 Гц), 10,33 (1Н, д, J=2,8 Гц).
Сравнительный пример 68
5-Циано-2-метокси-3-пиридинкарбоксальдегид
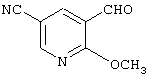
2,00 г диметилацеталя 5-бром-2-метокси-3-пиридинкарбоксальдегида растворяют в 25 мл пропионитрила. К смеси добавляют 449 мг цианида натрия, 152 мг иодида меди и 462 мг тетракис(трифенилфосфин)палладия, а затем перемешивают при 100°С в течение 45 минут в атмосфере азота. К реакционному раствору добавляют разбавленный аммиак и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают с получением масла. Полученное масло растворяют в 16 мл ацетона, добавляют 4 мл 5 н. соляной кислоты и смесь оставляют на 30 минут при комнатной температуре. К реакционному раствору добавляют водный раствор карбоната натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (толуол:этилацетат=1:1) с получением 843 мг указанного в заголовке соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 4,17 (3Н, с), 8,34 (1Н, д, J=2,4 Гц), 8,67 (1Н, д, J=2,4 Гц), 10,33 (1Н, с).
Сравнительный пример 69
1-(Бензилоксикарбонил)-4-[(Е)-2-[2-(циклогексилметилокси)фенил]-1-этенил]пиперидин
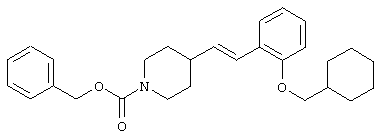
1,75 г хлорида [[2-(циклогексилметилокси)фенил]метил] трифенилфосфония растворяют в 10 мл диметилсульфоксида, добавляют 144 мг 60% гидрида натрия и смесь перемешивают при 70°С. После охлаждения до комнатной температуры по каплям добавляют раствор 800 мг 1-(бензилоксикарбонил)-4-пиперидинкарбоксальдегида, растворенного в 3 мл тетрагидрофурана, и смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают 1 н. соляной кислотой, водным насыщенным бикарбонатом натрия и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=10:1), в результате чего получают 554 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,98-1,50 (7Н, м), 1,63-1,92 (8Н, м), 2,34 (3/4Н, м), 2,66 (1/4Н, м), 2,73-2,97 (2Н, м), 3,66 (1/2Н, д, J=6,0 Гц), 3,68 (3/2Н, д, J=6,0 Гц), 4,20 (2Н, м), 5,13 (1/2Н, с), 5,14 (3/2Н, с), 5,46 (1/4Н, дд, J=11,6, 10,0 Гц), 6,15 (3/4Н, дд, J=16,0, 6,4 Гц), 6,50 (1/4Н, д, J=11,6 Гц), 6,72 (3/4Н, д, J=16,0 Гц), 6,81-6,94 (2Н, м), 7,14-7,41 (7Н, м).
Сравнительный пример 70
(2-Циклогексилметилокси)бромбензол
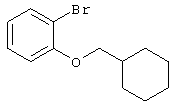
5,00 мл 2-бромфенола растворяют в 90 мл N,N-диметилформамида, добавляют 7,21 мл (бромметил)циклогексана и 7,15 г карбоната калия и смесь перемешивают при 100°С в течение 5 часов. К реакционному раствору добавляют воду и смесь экстрагируют н-гексаном. Органический слой промывают водой, 5 н. гидроксидом натрия и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Смесь фильтруют через окись алюминия и растворитель выпаривают с получением 10,47 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,04-1,38 (5Н, м), 1,67-1,95 (6Н, м), 3,81 (2Н, д, J=6,0 Гц), 6,80 (1Н, дт, J=7,6, 1,2 Гц), 6,87 (1Н, дд, J=8,0, 1,2 Гц), 7,23 (1Н, ддд, J=8,0, 7,6, 2,0 Гц), 7,52 (1Н, д, J=7,6, 2,0 Гц).
Сравнительный пример 71
1-Бензил-4-[2-гидрокси-2-[(2-(циклогексилметилокси)фенил]этил]пиперидин
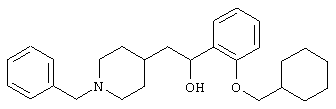
10 мл тетрагидрофурана охлаждают до -78°С, добавляют 5,11 мл н-бутиллития (1,6 М раствора в гексане) и смесь перемешивают. Затем по каплям добавляют раствор 2000 г (2-циклогексилметилокси)бромбензола, растворенного в 5 мл тетрагидрофурана. Через один час по каплям добавляют раствор 1,93 г 1-бензил-4-пиперидинацетальдегида, растворенного в 5 мл тетрагидрофурана и смесь перемешивают еще 1 час. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на NH-форме силикагеля (н-гексан:этилацетат=4:1) с получением 2,986 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,03-1,44 (7Н, м), 1,47-1,90 (11Н, м), 1,92-2,02 (2Н, м), 2,83-2,92 (2Н, м), 3,50 (2Н, с), 3,76 (1Н, дд, J=8,8, 6,0 Гц), 3,82 (1Н, дд, J=8,8, 5,6 Гц), 4,99 (1Н, дд, J=9,2, 7,6 Гц), 6,84 (1Н, дд, J=8,0, 0,8 Гц), 6,93 (1Н, дт, J=7,6, 1,2 Гц), 7,18-7,34 (7Н, м).
Сравнительный пример 72
1-Бензил-4-[(Е)-2-[(2-(циклогексилметилокси)фенил]-1-этенил]пиперидин
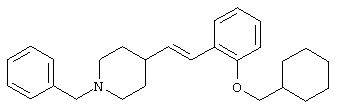
2,986 г 1-бензил-4-[2-гидрокси-2-[(2-(циклогексилметилокси) фенил]этил]пиперидина растворяют в 70 мл толуола. К смеси добавляют 1,38 г п-толуолсульфоновой кислоты, а затем кипятят с обратным холодильником в течение одного часа. К реакционному раствору добавляют водный насыщенный бикарбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и получают 2,848 г указанного в заголовке соединения в виде светло-желтого масла.
1Н-ЯМР (400 МГц, CDCl3) δ 1,02-1,42 (5Н, м), 1,48-1,92 (10Н, м), 2,01-2,10 (2Н, м), 2,16 (1Н, м), 2,89-2,96 (2Н, м), 3,53 (2Н, с), 3,76 (2Н, д, J=6,4 Гц), 6,19 (1Н, дд, J=16,0, 7,2 Гц), 6,70 (1Н, д, J=16,0 Гц), 6,82 (1Н, дд, J=8,8, 0,8 Гц), 6,87 (1Н, дт, J=8,8, 0,8 Гц), 7,14 (1Н, дт, J=8,8, 0,8 Гц), 7,22-7,36 (5Н, м), 7,40 (1Н, дд, J=8,8, 0,8 Гц).
Сравнительный пример 73
1-Бензил-4-[2-[(2-(циклогексилметилокси)фенил]-1-этинил]пиперидин
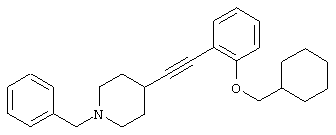
1,19 г 1-бензил-4-этинилпиперидина растворяют в 20 мл N,N-диметилформамида, добавляют 1,774 г (2-циклогексилметилокси)бромбензола, 114 мг иодида меди, 0,92 мл триэтиламина и 347 мг тетракис(трифенилфосфин)палладия и смесь перемешивают при 100°С в течение 3,5 часов в атмосфере азота. К реакционному раствору добавляют воду со льдом и разбавленный аммиак и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. После фильтрации через окись алюминия и силикагель растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=10:1) с получением 316 мг указанного в заголовке соединения в виде светло-желтого масла.
1Н-ЯМР (400 МГц, CDCl3) δ 1,05-1,36 (5Н, м), 1,64-1,98 (10Н, м), 2,22-2,34 (2Н, м), 2,64-2,81 (3Н, м), 3,52 (2Н, с), 3,80 (2Н, д, J=6,0 Гц), 6,82 (1Н, д, J=8,4, 1,2 Гц), 6,84 (1Н, дт, J=8,4, 1,2 Гц), 7,18-7,36 (7Н, м).
Сравнительный пример 74
1-(Винилоксикарбонил)-4-[(Е)-2-[(2-(циклогексилметилокси)фенил]-1-этенил]пиперидин
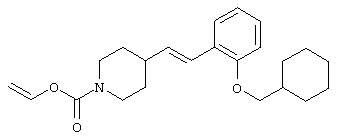
2,848 г 1-бензил-4-[(Е)-2-[(2-(циклогексилметилокси)фенил]-1-этенил]пиперидина растворяют в 15 мл 1,2-дихлорэтана, добавляют 0,93 мл винилхлорформиата и смесь перемешивают при комнатной температуре в течение 50 минут и кипятят с обратным холодильником в течение одного часа. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=50:1) с получением 2,026 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,03-1,52 (7Н, м), 1,67-1,92 (8Н, м), 2,37 (1Н, м), 2,84-3,03 (2Н, м), 3,78 (2Н, д, J=6,4 Гц), 4,16-4,27 (2Н, м), 4,45 (1Н, дд, J=6,4, 1,6 Гц), 4,78 (1Н, дд, J=13,2, 1,6 Гц), 6,15 (1Н, дд, J=16,0, 6,8 Гц), 6,73 (1Н, д, J=16,0 Гц), 6,84 (1Н, дд, J=8,4, 1,2 Гц), 6,88 (1Н, дт, J=8,4, 1,2 Гц), 7,17 (1Н, дт, J=8,4, 1,2 Гц), 7,24 (1Н, дд, J=13,2, 6,4 Гц), 7,39 (1Н, дд, J=8,4, 1,2 Гц).
Сравнительный пример 75
1-(Винилоксикарбонил)-4-[(Е)-2-[(2-(фторфенил)-1-этенил]пиперидин
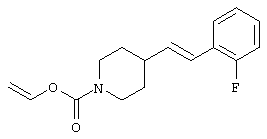
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 74.
1H-ЯМР (400 МГц, CDCl3) δ 1,39-1,52 (2Н, м), 1,83 (2Н, шир.д, J=15,6 Гц), 2,37 (1Н, м), 2,83-3,01 (2Н, м), 4,09-4,29 (2Н, м), 4,46 (1Н, дд, J=6,4, 1,6 Гц), 4,78 (1Н, дд, J=10,4, 1,6 Гц), 6,21 (1Н, дд, J=16,0, 6,8 Гц), 6,56 (1Н, д, J=16,0 Гц), 7,02 (1Н, ддд, J=10,8, 8,4, 1,2 Гц), 7,08 (1Н, дт, J=8,0, 1,2 Гц), 7,15-7,26 (2Н, м), 7,42 (1Н, дт, J=8,0, 1,2 Гц).
Сравнительный пример 76
1-(Винилоксикарбонил)-4-[2-[(2-циклогексилметилокси)фенил]-1-этинил]пиперидин
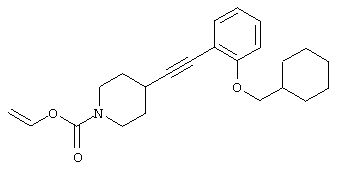
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 74.
1H-ЯМР (400 МГц, CDCl3) δ 1,03-1,35 (5Н, м), 1,65-1,93 (10Н, м), 2,98 (1Н, м), 3,56-3,64 (2Н, м), 3,67-3,79 (2Н, м), 3,79 (2Н, д, J=6,4 Гц), 4,45 (1Н, д, J=6,4, 1,6 Гц), 4,78 (1Н, дд, J=11,6, 1,6 Гц), 6,83 (1Н, дд, J=8,0, 1,2 Гц), 6,86 (1Н, дт, J=8,0, 1,2 Гц), 7,21-7,27 (2Н, м), 7,34 (1Н, дд, J=11,6, 1,6 Гц).
Сравнительный пример 77
1-(Винилоксикарбонил)-4-[(Е)-2-(2-(хлорфенил)-1-этенил]пиперидин
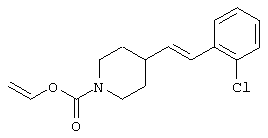
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 74.
1H-ЯМР (400 МГц, CDCl3) δ 1,40-1,54 (2Н, м), 1,85 (2Н, шир.д, J=13,2 Гц), 2,41 (1Н, м), 2,83-3,02 (2Н, м), 4,19-4,29 (2Н, м), 4,46 (1Н, дд, J=6,0, 1,6 Гц), 4,79 (1Н, дд, J=14,4, 1,6 Гц), 6,12 (1Н, дд, J=16,0, 7,2 Гц), 6,56 (1Н, дд, J=16,0, 0,8 Гц), 7,13-7,28 (3Н, м), 7,34 (1Н, дд, J=7,6, 1,2 Гц), 7,50 (1Н, дд, J=7,6, 2,0 Гц).
Сравнительный пример 78
1-(Винилоксикарбонил)-4-[(Е)-2-(2-метилфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 74.
1H-ЯМР (400 МГц, CDCl3) δ 1,39-1,53 (2H, м), 1,84 (2Н, шир.д, J=12,8 Гц), 2,33 (3Н, с), 2,36 (1Н, м), 2,83-3,02 (2H, м), 4,19-4,29 (2H, м), 4,45 (1Н, дд, J=6,4, 1,6 Гц), 4,78 (1Н, дд, J=14,0, 1,6 Гц), 6,01 (1Н, дд, J=16,0, 7,2 Гц), 6,60 (1Н, дд, J=16,0, 0,8 Гц), 7,10-7,19 (3Н, м), 7,34 (1Н, дд, J=14,0, 6,4 Гц), 7,40 (1Н, д, J=8,0 Гц).
Сравнительный пример 79
4-[2-[(Циклогексилметилокси)фенил]пиперидин
398 мг 1-бензил-4-[2-(2-циклогексилметилокси)фенил]-3,4-дегидропиперидина растворяют в 10 мл этанола, добавляют 150 мг порошкообразного 20% гидроксида палладия на угле (продукта, содержащего воду) и смесь перемешивают при комнатной температуре в течение ночи при нормальном давлении в атмосфере водорода. К реакционному раствору добавляют этилацетат и смесь фильтруют. Фильтрат выпаривают и получают 315 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,38 (5Н, м), 1,54-1,92 (10Н, м), 2,74-2,82 (2H, м), 3,10 (1Н, тт, J=12,0, 3,2 Гц), 3,16-3,23 (2H, м), 3,76 (2H, д, J=6,0 Гц), 6,83 (1Н, дд, J=8,0, 1,2 Гц), 6,91 (1Н, дт, J=8,0, 1,2 Гц), 7,15 (1Н, дт, J=8,0, 1,2 Гц), 7,19 (1Н, дд, J=8,0, 1,2 Гц).
Сравнительный пример 80
4-[2-[2-(Циклогексилметилокси)фенил]этил]пиперидин
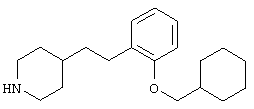
554 мг 1-(бензилоксикарбонил)-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидина растворяют в 10 мл этанола, добавляют 250 мг порошкообразного 10% гидроксида палладия на угле (продукта, содержащего воду) и смесь перемешивают при комнатной температуре в течение ночи при нормальном давлении в атмосфере водорода. Реакционный раствор фильтруют и фильтрат выпаривают с получением 379 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,76 (8Н, м), 1,67-1,96 (10Н, м), 2,56-2,67 (4Н, м), 3,06-3,13 (2Н, м), 3,75 (2Н, д, J=5,6 Гц), 6,81 (1Н, д, J=8,0 Гц), 6,85 (1Н, дт, J=8,0, 1,2 Гц), 7,09-7,16 (2Н, м).
Сравнительный пример 81
4-[2-[2-Изобутилокси)фенил]этил]пиперидин
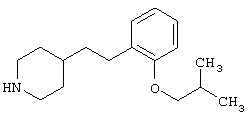
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 80.
1H-ЯМР (400 МГц, CDCl3) δ 1,05 (6Н, д, J=6,8 Гц), 1,12-1,24 (2Н, м), 1,42 (1Н, м), 1,48-1,56 (2Н, м), 1,73-1,81 (2Н, м), 2,10 (1Н, м), 2,56-2,67 (4Н, м), 3,06-3,14 (2Н, м), 3,72 (2Н, д, J=6,4 Гц), 6,80 (1Н, д, J=8,0 Гц), 6,86 (1Н, дт, J=1,2, 7,6 Гц), 7,09-7,17 (2Н, м).
Сравнительный пример 82
4-[[2-(2-Фенилэтил)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 80.
1H-ЯМР (400 МГц, CDCl3) δ 1,13-1,26 (2Н, м), 1,39-1,55 (3Н, м), 1,72-1,79 (2Н, м), 2,56-2,66 (4Н, м), 2,84-2,94 (4Н, м), 3,06-3,14 (2Н, м), 7,12-7,33 (9Н, м).
Сравнительный пример 83
[2-[2-[(Циклогексилметил)амино]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 80.
1H-ЯМР (400 МГц, CDCl3) δ 0,95-1,08 (2Н, м), 1,12-1,34 (5Н, м), 1,40-1,86 (7Н, м), 1,87-2,04 (4Н, м), 2,43-2,50 (2Н, м), 2,62 (2Н, дт, J=12,0, 2,4 Гц), 2,98 (2Н, д, J=6,8 Гц), 3,08-3,14 (2Н, м), 3,61 (1Н, м), 4,22 (2Н, м), 6,61 (1Н, дд, J=1,2, 7,6 Гц), 6,65 (1Н, дт, J=7,6, 1,2 Гц), 7,02 (1Н, дд, J=7,6, 1,2 Гц), 7,11 (1Н, дт, J=7,6, 1,2 Гц).
Сравнительный пример 84
[2-[2-[N-(Циклогексилметил)-N-метиламино]фенил]этил]пиперидин
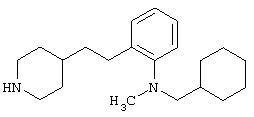
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 80.
1H-ЯМР (400 МГц, CDCl3) δ 0,95-1,08 (2Н, м), 1,12-1,34 (5Н, м), 1,40-1,86 (8Н, м), 1,87-2,04 (4Н, м), 2,43-2,50 (2Н, м), 2,62 (2Н, дт, J=12,0, 2,4 Гц), 2,98 (2Н, д, J=6,8 Гц), 3,08-3,14 (2Н, м), 3,61 (1Н, м), 6,61 (1Н, дд, J=1,2, 7,6 Гц), 6,65 (1Н, дт, J=7,6, 1,2 Гц), 7,02 (1Н, дд, J=7,6, 1,2 Гц), 7,11 (1Н, дт, J=7,6, 1,2 Гц).
Сравнительный пример 85
4-[[2-(Циклогексилэтил)фенокси]метил]пиперидин

1,138 г 1-(трет-бутоксикарбонил)-4-[[2-циклогексилэтил)фенокси]метил]пиперидина растворяют в 3 мл дихлорметана, добавляют 3 мл трифторуксусной кислоты и смесь оставляют на 1 час 30 минут при комнатной температуре. К реакционному раствору добавляют водный карбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и к остатку добавляют н-гексан, в результате чего получают 899 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 0,86-0,97 (2Н, м), 1,09-1,22 (4Н, м), 1,40-1,48 (2Н, м), 1,61-1,80 (7Н, м), 2,05-2,20 (3Н, м), 2,56-2,63 (2Н, м), 2,96 (2Н, дт, J=12,8, 2,4 Гц), 3,50 (2Н, шир.д, J=11,6 Гц), 3,84 (2Н, д, J=6,4 Гц), 6,78 (1Н, д, J=8,0 Гц), 6,89 (1Н, дт, J=7,6, 0,8 Гц), 7,16 (1Н, д, J=7,6 Гц), 7,15 (1Н, дд, J=7,6, 0,8 Гц).
Сравнительный пример 86
4-[(Е)-2-[2-(Циклогексилметилокси)фенил]-1-этенил]пиперидин
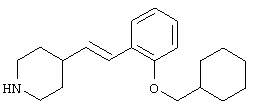
2,026 г 1-(винилоксикарбонил)-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидина суспендируют в 20 мл 10% раствора хлористого водорода в метаноле и смесь перемешивают в течение 20 минут при охлаждении льдом. После перемешивания в течение 15 минут при комнатной температуре смесь кипятят с обратным холодильником в течение одного часа 10 минут. Растворитель выпаривают и к остатку добавляют водный насыщенный бикарбонат натрия. Смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и к остатку добавляют н-гептан. Нерастворившиеся вещества отфильтровывают и фильтрат выпаривают с получением 1,556 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,03-1,46 (6Н, м), 1,66-1,93 (9Н, м), 2,28 (1Н, м), 2,68 (2Н, дт, J=2,4, 12,0 Гц), 3,12 (2Н, дт, J=12,0, 3,2 Гц), 3,77 (2Н, д, J=6,0 Гц), 6,18 (1Н, дд, J=16,0 Гц), 6,70 (1Н, д, J=16,0 Гц), 6,82 (1Н, дд, J=7,6, 0,8 Гц), 6,88 (1Н, дт, J=7,6, 0,8 Гц), 7,15 (1Н, дт, J=7,6, 0,8 Гц), 7,41 (1Н, дд, J=7,6, 0,8 Гц).
Сравнительный пример 87
4-[(Е)-2-(2-Фторфенил)-1-этенил]пиперидин
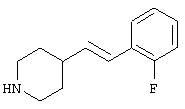
904 мг 1-(винилоксикарбонил)-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидина суспендируют в 5 мл 10% раствора хлористого водорода в метаноле. После перемешивания в течение 15 минут при комнатной температуре смесь нагревают при 70°С в течение одного часа. Растворитель выпаривают и к остатку добавляют воду и этилацетат для отделения водного слоя. Водный слой подщелачивают разбавленным аммиаком и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают с получением 660 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,47 (2Н, м), 1,75-1,84 (2Н, м), 2,29 (1Н, м), 2,64-2,73 (2Н, м), 3,13 (2Н, шир.д, J=12,4 Гц), 6,24 (1Н, дд, J=16,0, 6,4 Гц), 6,54 (1Н, д, J=16,0 Гц), 6,97-7,11 (2Н, м), 7,16 (1Н, м), 7,44 (1Н, м).
Сравнительный пример 88
4-[(Е)-2-(2-Хлорфенил)-1-этенил]пиперидин
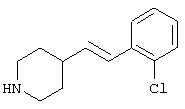
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,46 (2Н, м), 1,75-1,86 (2Н, м), 2,31 (1Н, м), 2,68 (2Н, дт, J=8,4, 2,8 Гц), 3,12 (2Н, дт, J=11,6, 3,2 Гц), 6,15 (1Н, дд, J=16,0, 6,8 Гц), 6,75 (1Н, дд, J=16,0, 0,8 Гц), 7,13 (1Н, дт, J=8,0, 2,0 Гц), 7,20 (1Н, дд, J=8,0, 1,6 Гц), 7,33 (1Н, дд, J=8,0, 1,6 Гц), 7,51 (1Н, дд, J=8,0, 2,0 Гц).
Сравнительный пример 89
4-[(Е)-2-(2-Метилфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,47 (2Н, м), 1,75-1,84 (4Н, м), 2,29 (1Н, м), 2,64-2,73 (2Н, м), 3,13 (2Н, шир.д, J=12,4 Гц), 6,24 (1Н, дд, J=16,0, 6,4 Гц), 6,54 (1Н, д, J=16,0 Гц), 6,97-7,11 (2Н, м), 7,16 (1Н, м), 7,41-7,48 (2Н, м).
Сравнительный пример 90
4-[2-[(2-Циклогексилметилокси)фенил]-1-этинил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в сравнительном примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,03-1,42 (5Н, м), 1,64-1,96 (10Н, м), 2,74 (2Н, ддд, J=3,2, 8,4, 12,0 Гц), 2,81 (1Н, м), 3,10-3,17 (2Н, м), 3,80 (2Н, д, J=6,4 Гц), 6,82 (1Н, дд, J=8,4, 2,0 Гц), 6,85 (1Н, дт, J=8,4, 1,2 Гц), 7,21 (1Н, ддд, J=8,4, 7,6, 2,0 Гц), 7,35 (1Н, дт, J=7,6, 1,2 Гц).
Пример 1
1-[(2-Метокси-3-пиридил)метил]-4-[2-(метилсульфонил)фенэтил]пиперидин
3,90 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, 8,92 г хлорида (2-метилсульфонилбензил)трифенилфосфония и 1,96 г трет-бутоксида калия суспендируют в 80 мл N,N-диметилформамида и смесь перемешивают 3 часа при комнатной температуре. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией с NH-формой силикагеля (этилацетат:гексан=1:4). Полученный продукт и 440 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 80 мл этанола. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре при нормальном давлении в течение 30 минут. Реакционный раствор фильтруют и фильтрат выпаривают с получением 4,05 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (3Н, м), 1,61-1,68 (2Н, м), 1,74-1,81 (2Н, м), 2,02-2,10 (2Н, м), 2,88-2,96 (2Н, м), 3,00-3,08 (2Н, м), 3,08 (3Н, с), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,1, 5,0 Гц), 7,33-7,42 (2Н, м), 7,55 (1Н, ддд, J=7,7, 7,7, 1,3 Гц), 7,65 (1Н, дд, J=7,1, 1,8 Гц), 8,00-8,08 (2Н, м).
Пример 2
1-[(2-Метокси-3-пиридил)метил]-4-(3,4-метилендиоксифенэтил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,37 (3Н, м), 1,47-1,58 (2Н, м), 1,64-1,77 (2Н, м), 1,96-2,07 (2Н, м), 2,50-2,59 (2Н, м), 2,84-2,94 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 5,91 (2Н, с), 6,61 (1Н, дд, J=7,8, 1,6 Гц), 6,67 (1Н, д, J=1,6 Гц), 6,72 (1Н, д, J=7,8 Гц), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 7,64 (1Н, дд, J=7,2, 1,8 Гц), 8,05 (1Н, дд, J=5,2, 1,8 Гц).
Пример 3
1-[(2-Метокси-3-пиридил)метил]-4-фенэтилпиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,39 (3Н, м), 1,52-1,61 (2Н, м), 1,68-1,77 (2Н, м), 1,96-2,07 (2Н, м), 2,58-2,66 (2Н, м), 2,85-2,93 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 7,14-7,21 (3Н, м), 7,23-7,31 (2Н, м), 7,65 (1Н, дд, J=7,1, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 4
1-[(2-Метокси-3-пиридил)метил]-4-(2-гидроксифенэтил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,42 (3Н, м), 1,46-1,54 (2Н, м), 1,69-1,77 (2Н, м), 2,00-2,10 (2Н, м), 2,57-2,63 (2Н, м), 2,73-3,00 (2Н, м), 3,55 (2Н, с), 3,90 (3Н, с), 6,58 (1Н, дд, J=7,5, 1,1 Гц), 6,79 (1Н, ддд, J=7,5, 7,5, 1,1 Гц), 6,86 (1Н, дд, J=7,2, 5,1 Гц), 7,00 (1Н, ддд, J=7,5, 7,5, 1,6 Гц), 7,07 (1Н, дд, J=7,5, 1,6 Гц), 7,62 (1Н, дд, J=7,2, 1,9 Гц), 8,07 (1Н, дд, J=5,1, 1,9 Гц).
Пример 5
1-[(2-Метокси-3-пиридил)метил]-4-(3-фторфенэтил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,21-1,40 (3Н, м), 1,51-1,61 (2Н, м), 1,65-1,77 (2Н, м), 1,95-2,08 (2Н, м), 2,57-2,66 (2Н, м), 2,85-2,94 (2Н, м), 3,48 (2Н, с), 3,95 (3Н, с), 6,83-6,91 (2Н, м), 6,87 (1Н, дд, J=7,1, 4,9 Гц), 6,94 (1Н, м), 7,18-7,26 (1Н, м), 7,64 (1Н, дд, J=7,1, 2,0 Гц), 8,05 (1Н, дд, J=4,9, 2,0 Гц).
Пример 6
1-[(2-Метокси-3-пиридил)метил]-4-(2-трифторметилфенэтил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,42 (3Н, м), 1,51-1,61 (2Н, м), 1,69-1,80 (2Н, м), 1,99-2,11 (2Н, м), 2,73-2,82 (2Н, м), 2,87-2,95 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,1, 4,9 Гц), 7,26 (1Н, дд, J=7,7, 7,6 Гц), 7,31 (1Н, д, J=7,5 Гц), 7,45 (1Н, дд, J=7,6, 7,5 Гц), 7,60 (1Н, д, J=7,7 Гц), 7,65 (1Н, дд, J=7,1, 1,9 Гц), 8,05 (1Н, дд, J=4,9, 1,9 Гц).
Пример 7
1-[(2-Метокси-3-пиридил)метил]-4-[2-(1-пиразоло)фенэтил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,10-1,23 (3Н, м), 1,32-1,39 (2Н, м), 1,49-1,57 (2Н, м), 1,90-1,99 (2Н, м), 2,52-2,59 (2Н, м), 2,78-2,85 (2Н, м), 3,44 (2Н, с), 3,93 (3Н, с), 6,42 (1Н, дд, J=2,0, 2,0 Гц), 6,85 (1Н, дд, J=7,2, 4,8 Гц), 7,24-7,38 (4Н, м), 7,56 (1Н, д, J=2,0 Гц), 7,61 (1Н, дд, J=7,2, 2,0 Гц), 7,70 (1Н, д, J=2,0 Гц), 8,04 (1Н, дд, J=4,8, 2,0 Гц).
Пример 8
1-[(2-Метокси-3-пиридил)метил]-4-[2-(4-ацетилпиперазино)фенэтил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,39 (3Н, м), 1,52-1,61 (2Н, м), 1,71-1,79 (2Н, м), 1,97-2,07 (2Н, м), 2,14 (3Н, с), 2,65-2,72 (2Н, м), 2,81-2,94 (6Н, м), 3,48 (2Н, с), 3,55-3,61 (2Н, м), 3,70-3,78 (2Н, м), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 4,8 Гц), 7,04 (1Н, д, J=7,6 Гц), 7,07 (1Н, дд, J=7,6, 7,2 Гц), 7,17 (1Н, дд, J=7,6, 7,2 Гц), 7,21 (1Н, д, J=7,6 Гц), 7,64 (1Н, дд, J=7,2, 1,6 Гц), 8,05 (1Н, дд, J=4,8, 1,6 Гц).
Пример 9
1-[(2-Метокси-3-пиридил)метил]-4-[6-(метилсульфонил)-2,3-метилендиоксифенэтил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,56-1,66 (2Н, м), 1,73-1,81 (2Н, м), 2,02-2,10 (2Н, м), 2,88-2,99 (4Н, м), 3,04 (3Н, с), 3,49 (2Н, с), 3,95 (3Н, с), 6,08 (2Н, с), 6,78 (1Н, д, J=8,3 Гц), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,62 (1Н, д, J=8,3 Гц), 7,66 (1Н, дд, J=7,2, 1,8 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Пример 10
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-тиенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,59-1,75 (4Н, м), 1,95-2,06 (2Н, м), 2,80-2,93 (4Н, м), 3,47 (2Н, с), 3,94 (3Н, с), 6,77 (1Н, д, J=3,5 Гц), 6,85 (1Н, дд, J=7,1, 4,9 Гц), 6,90 (1Н, дд, J=5,1, 3,5 Гц), 7,09 (1Н, д, J=5,1 Гц), 7,64 (1Н, дд, J=7,1, 1,8 Гц), 8,04 (1Н, дд, J=4,9, 1,8 Гц).
Пример 11
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-метокси-2-тиенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,37 (3Н, м), 1,52-1,59 (2Н, м), 1,67-1,77 (2Н, м), 1,96-2,07 (2Н, м), 2,67-2,74 (2Н, м), 2,85-2,92 (2Н, м), 3,47 (2Н, с), 3,80 (3Н, с), 3,94 (3Н, с), 6,80 (1Н, д, J=5,5 Гц), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 6,98 (1Н, д, J=5,5 Гц), 7,64 (1Н, дд, J=7,1, 1,8 Гц), 8,04 (1Н, дд, J=4,9, 1,8 Гц).
Пример 12
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-циано-2-тиенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,40 (3Н, м), 1,62-1,77 (4Н, м), 1,98-2,09 (2Н, м), 2,87-2,95 (2Н, м), 2,99-3,06 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,1, 4,9 Гц), 7,11 (1Н, д, J=5,3 Гц), 7,17 (1Н, д, J=5,3 Гц), 7,64 (1Н, дд, J=7,1, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 13
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-фенил-2-тиенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,21-1,31 (3Н, м), 1,55-1,69 (4Н, м), 1,91-2,01 (2Н, м), 2,80-2,92 (4Н, м), 3,46 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 7,00 (1Н, д, J=5,2 Гц), 7,15 (1Н, д, J=5,2 Гц), 7,27-7,43 (5Н, м), 7,62 (1Н, дд, J=7,1, 2,0 Гц), 8,04 (1Н, дд, J=4,9, 2,0 Гц).
Пример 14
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-тиенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,38 (3Н, м), 1,54-1,64 (2Н, м), 1,66-1,76 (2Н, м), 1,96-2,07 (2Н, м), 2,62-2,68 (2Н, м), 2,85-2,94 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 6,90-6,95 (2Н, м), 7,24 (1Н, дд, J=5,2, 3,0 Гц), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 15
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-метансульфонил-3-тиенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,41 (3Н, м), 1,56-1,66 (2Н, м), 1,68-1,80 (2Н, м), 1,97-2,10 (2Н, м), 2,85-2,99 (4Н, м), 3,14 (3Н, с), 3,48 (2Н, с), 3,95 (3Н, с), (3Н, с), 6,86 (1Н, ддд, J=7,1, 4,9 Гц), 7,01 (1Н, д, J=5,0 Гц), 7,56 (1Н, д, J=5,0 Гц), 7,64 (1Н, дд, J=7,1, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 16
1-[(2-Метокси-3-пиридил)метил]-4-[2-(бензо[b]тиофен-2-ил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,41 (3Н, м), 1,65-1,78 (4Н, м), 1,96-2,07 (2Н, м), 2,85-2,97 (4Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,1 Гц), 6,99 (1Н, с), 7,24 (1Н, дд, J=7,5, 7,1 Гц), 7,30 (1Н, дд, J=7,9, 7,1 Гц), 7,64 (1Н, дд, J=7,3, 2,0 Гц), 7,66 (1Н, д, J=7,5 Гц), 7,75 (1Н, д, J=7,9 Гц), 8,05 (1Н, дд, J=5,1, 2,0 Гц).
Пример 17
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-метилсульфонил-3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,40 (3Н, м), 1,60-1,68 (2Н, м), 2,02-2,10 (2Н, м), 2,88-2,95 (2Н, м), 3,08-3,14 (2Н, м), 3,37 (3Н, м), 3,50 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 4,8 Гц), 7,43 (1Н, дд, J=7,8, 4,8 Гц), 7,66 (1Н, дд, J=7,2, 1,8 Гц), 7,71 (1Н, дд, J=7,8, 1,8 Гц), 8,05 (1Н, дд, J=4,8, 1,8 Гц), 8,41 (1Н, дд, J=4,8, 1,8 Гц).
Пример 18
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-н-бутил-3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 0,96 (3Н, т, J=7,3 Гц), 1,30-1,48 (5Н, м), 1,48-1,56 (2Н, м), 1,63-1,80 (4Н, м), 2,00-2,11 (2Н, м), 2,57-2,66 (2Н, м), 2,77 (2Н, т, J=8,1 Гц), 2,88-2,97 (2Н, м), 3,50 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,03 (1Н, дд, J=7,6, 4,8 Гц), 7,39 (1Н, дд, J=7,2, 1,8 Гц), 7,65 (1Н, дд, J=7,6, 1,8 Гц), 8,06 (1Н, дд, J=5,0, 1,8 Гц).
Пример 19
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,40 (3Н, м), 1,54-1,62 (2Н, м), 1,67-1,76 (2Н, м), 1,98-2,08 (2Н, м), 2,60-2,66 (2Н, м), 2,87-2,96 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=8,0, 5,0 Гц), 7,20 (1Н, дд, J=8,0, 5,0 Гц), 7,49 (1Н, ддд, J=8,0, 2,0, 2,0 Гц), 7,65 (1Н, д, J=8,0 Гц), 8,06 (1Н, дд, J=5,0, 2,0 Гц), 8,42-8,46 (2Н, м).
Пример 20
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-фенокси-3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,40 (3Н, м), 1,55-1,68 (2Н, м), 1,70-1,80 (2Н, м), 1,98-2,08 (2Н, м), 2,90-2,77 (2Н, м), 1,98-2,08 (2Н, м), 2,70-2,77 (2Н, м), 2,86-2,94 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 5,0 Гц), 6,93 (1Н, дд, J=7,1, 5,0 Гц), 7,07-7,11 (2Н, м), 7,17 (1Н, м), 7,36-7,42 (2Н, м), 7,52 (1Н, дд, J=7,1, 2,0 Гц), 7,64 (1Н, дд, J=7,1, 2,0 Гц), 8,00 (1Н, дд, J=5,0, 2,0 Гц), 8,05 (1Н, дд, J=5,0, 2,0 Гц).
Пример 21
1-[(2-Метокси-3-пиридил)метил]-4-[2-(5-метокси-2-пиридил)этил]пиперидин
310 мг указанного в заголовке соединения в виде бесцветного масла получают из 300 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и 592 мг хлорида [(5-метокси-2-пиридил)метил]трифенилфосфония методом, описанным в примере 1.
1Н-ЯМР (400 МГц, CDCl3) δ 1,24-1,41 (3Н, м), 1,59-1,68 (2Н, м), 1,71-1,83 (2Н, м), 1,97-2,08 (2Н, м), 2,79-2,94 (4Н, м), 3,49 (2Н, с), 3,82 (3Н, м), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,1, 4,9 Гц), 7,09 (1Н, д, J=2,9 Гц), 7,09 (1Н, д, J=2,9 Гц), 7,65 (1Н, дд, J=7,1, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц), 8,11 (1Н, дд, J=2,9, 2,9 Гц).
Пример 22
1-[(2-Метокси-3-пиридил)метил]-4-[2-(4-метоксифенил-3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,11-1,23 (3Н, м), 1,41-1,49 (2Н, м), 1,51-1,59 (2Н, м), 1,90-1,99 (2Н, м), 2,62-2,69 (2Н, м), 2,78-2,88 (2Н, м), 2,44 (2Н, с), 3,85 (3Н, с), 6,85 (1Н, дд, J=7,2, 4,8 Гц), 6,96 (2Н, д, J=8,4 Гц), 7,17 (1Н, дд, J=8,0, 4,8 Гц), 7,49 (2Н, д, J=8,4 Гц), 7,57 (1Н, дд, J=8,0, 1,6 Гц), 7,61 (1Н, дд, J=7,2, 2,0 Гц), 8,04 (1Н, дд, J=4,8, 2,0 Гц), 8,49 (1Н, дд, J=4,8, 1,6 Гц).
Пример 23
1-[(2-Метокси-3-пиридил)метил]-4-[2-(1,3-тиазол-2-илэтил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,40 (3Н, м), 1,69-1,81 (4Н, м), 1,97-2,07 (2Н, м), 2,85-2,93 (2Н, м), 3,01-3,08 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,1 Гц), 7,18 (1Н, д, J=3,5 Гц), 7,64 (1Н, дд, J=7,3, 2,0 Гц), 7,66 (1Н, д, J=3,5 Гц), 8,05 (1Н, дд, J=5,1, 2,0 Гц).
Пример 24
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-(1-морфолино)-3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,39 (3Н, м), 1,56-1,64 (2Н, м), 1,70-1,78 (2Н, м), 1,99-2,07 (2Н, м), 2,60-2,66 (2Н, м), 2,86-2,94 (2Н, м), 3,10 (4Н, т, J=4,7 Гц), 3,49 (2Н, с), 3,85 (4Н, J=4,7 Гц), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,4, 4,8 Гц), 6,93 (1Н, дд, J=7,4, 4,8 Гц), 7,46 (1Н, дд, J=7,4, 1,9 Гц), 7,64 (1Н, дд, J=7,4, 1,9 Гц), 8,06 (1Н, дд, J=4,8, 1,9 Гц), 8,18 (1Н, дд, J=4,8, 1,9 Гц).
Пример 25
1-[(2-Метокси-3-пиридил)метил]-4-(2-аминонофенэтил)пиперидин
255 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 310 мг 1-[ (2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и из 767 мг бромида (2-нитробензил)трифенилфосфония методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,40 (3Н, м), 1,52-1,66 (2Н, м), 1,72-1,82 (2Н, м), 2,00-2,10 (2Н, м), 2,46-2,54 (2Н, м), 2,87-2,96 (2Н, м), 3,49 (2Н, с), 3,59 (2Н, шир.с), 3,95 (3Н, с), 6,68 (1Н, дд, J=8,3, 1,1 Гц), 6,73 (1Н, дд, J=7,4, 1,1 Гц), 6,87 (1Н, дд, J=7,1, 4,9 Гц), 7,01-7,06 (2Н, м), 7,65 (1Н, дд, J=7,1, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 26
1-[(2-Метокси-3-пиридил)метил]-4-[(2-метилсульфониламино)фенэтил]пиперидин
255 мг 1-[(2-метокси-3-пиридил)метил]-4-(2-аминофенэтил)пиперидина, 110 мг метилсульфонилхлорида и 0,13 мл пиридина растворяют в 5 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь подщелачивают добавлением 1 н. водного раствора гидроксида натрия, а затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют хроматографией на NH-форме силикагеля (этилацетат:гексан=1:1), в результате чего получают 286 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,41 (3Н, м), 1,50-1,60 (2Н, м), 1,68-1,78 (2Н, м), 2,00-2,09 (2Н, м), 2,61-2,68 (2Н, м), 2,88-2,95 (2Н, м), 3,03 (3Н, с), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,3, 5,0 Гц), 7,15-7,26 (3Н, м), 7,45 (1Н, м), 7,65 (1Н, дд, J=7,3, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 27
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-хлор-6-метил-3-пиридил)этил]пиперидин
445 мг указанного в заголовке соединения в виде бесцветного масла получают из 500 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и из 1,01 г хлорида [(2-хлор-6-метил-3-пиридил)метил]трифенилфосфония методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,39 (3Н, м), 1,50-1,59 (2Н, м), 1,70-1,78 (2Н, м), 1,98-2,07 (2Н, м), 2,49 (3Н, с), 2,63-2,71 (2Н, м), 2,86-2,95 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,1, 4,9 Гц), 7,01 (1Н, д, J=7,9 Гц), 7,41 (1Н, д, J=7,9 Гц), 7,65 (1Н, дд, J=7,1, 2,0 Гц), 8,05 (1Н, дд, J=4,9, 2,0 Гц).
Пример 28
1-[(2-Метокси-3-пиридил)метил]-4-[2-(6-хлор-3-пиридил)этил]пиперидин
600 мг указанного в заголовке соединения в виде бесцветного масла получают из 504 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и из 1,01 г хлорида [(6-хлор-3-пиридил)метил]трифенилфосфония методом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,38 (3Н, м), 1,50-1,59 (2Н, м), 1,66-1,74 (2Н, м), 1,96-2,06 (2Н, м), 2,57-2,65 (2Н, м), 2,85-2,94 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, д, J=7,1, 5,0 Гц), 7,24 (1Н, д, J=8,3 Гц), 7,46 (1Н, д, J=8,3, 2,4 Гц), 7,63 (1Н, дд, J=7,1, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц), 8,20 (1Н, д, J=2,4 Гц).
Пример 29
1-[(2-Метокси-3-пиридил)метил]-4-[(Е)-2-(2-пиридил)-1-этенил]пиперидин
488 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, 1,07 г хлорида (2-пиридилметил)трифенилфосфония и 561 мг трет-бутоксида калия суспендируют в 10 мл N,N-диметилформамида и смесь перемешивают в течение 1 часа при комнатной температуре. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:9), в результате чего получают 453 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,55-1,70 (3Н, м), 1,75-1,85 (2Н, м), 2,08-2,20 (2Н, м), 2,91-3,00 (2Н, м), 3,53 (2Н, с), 3,96 (3Н, с), 6,48 (1Н, дд, J=15,8, 1,3 Гц), 6,71 (1Н, дд, J=15,8, 6,9 Гц), 6,88 (1Н, дд, J=7,2, 5,0 Гц), 7,10 (1Н, ддд, J=7,6, 4,8, 1,1 Гц), 7,25 (1Н, м), 7,60 (1Н, ддд, J=7,6, 7,6, 1,8 Гц), 7,67 (1Н, дд, J=7,2, 1,9 Гц), 8,06 (1Н, дд, J=5,0, 1,9 Гц), 8,53 (1Н, м).
Пример 30
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-пиридил)этил]пиперидин
332 мг 1-[(2-метокси-3-пиридил)метил]-4-[(Е)-2-(2-пиридил)-1-этенил]пиперидина, полученного в примере 29, и 79 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 5 мл этанола. После замены атмосферы сосуда водородом смесь перемешивают при нормальной температуре и при нормальном давлении в течение 30 минут. Реакционный раствор фильтруют и фильтрат выпаривают с получением 234 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,41 (3Н, м), 1,62-1,78 (4Н, м), 1,98-2,09 (2Н, м), 2,76-2,84 (2Н, м), 2,86-2,95 (2Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,87 (1Н, дд, J=7,5, 5,0 Гц), 7,10 (1Н, ддд, J=7,5, 5,0, 1,2 Гц), 7,14 (1Н, д, J=7,5 Гц), 7,58 (1Н, ддд, J=7,5, 7,5, 2,0Гц), 7,65 (1Н, дд, J=7,5, 2,0 Гц), 8,05 (1Н, дд, J=5,0, 2,0 Гц), 8,52 (1Н, м).
Пример 31
1-[(2-Метокси-3-пиридил)метил]-4-[(Е)-(2,3-(метилендиоксифенил)-1-этенил]пиперидин
324 мг указанного в заголовке соединения в виде бесцветного масла получают из 784 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и 1,76 г хлорида (3,4-метилендиоксибензил)трифенилфосфония методом, описанным в примере 29.
1H-ЯМР (400 МГц, CDCl3) δ 1,48-1,62 (3Н, м), 1,70-1,79 (2Н, м), 2,06-2,18 (2Н, м), 2,90-2,99 (2Н, м), 3,52 (2Н, с), 3,96 (3Н, с), 5,94 (2Н, с), 6,00 (1Н, дд, J=15,8, 7,2 Гц), 6,29 (1Н, д, J=15,8 Гц), 6,70-6,79 (2Н, м), 6,83-6,92 (2Н, м), 7,67 (1Н, дд, J=7,0, 1,8 Гц), 8,06 (1Н, дд, J=5,2, 1,8 Гц).
Пример 32
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидин
2,35 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, 4,68 г хлорида [(2-хлор-3-пиридил)метил]трифенилфосфония и 1,24 г трет-бутоксида калия суспендируют в 50 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:19). Полученный продукт и 330 мг окиси платины суспендируют в смешанном растворителе, состоящем из 20 мл этанола и 40 мл тетрагидрофурана. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 20 часов. Реакционный раствор фильтруют и фильтрат выпаривают. Затем неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:19), в результате чего получают 1,89 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,44 (3Н, м), 1,54-1,62 (2Н, м), 1,70-1,81 (2Н, м), 2,00-2,12 (2Н, м), 2,70-2,77 (2Н, м), 2,88-2,98 (2Н, м), 3,51 (2Н, с), 3,95 (ЗН, с), 6,88 (1Н, дд, J=7,4, 5,2 Гц), 7,17 (1Н, дд, J=7,4, 5,0 Гц), 7,53 (1Н, дд, J=7,4, 2,0 Гц), 7,66 (1Н, дд, J=5,2, 2,0 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц), 8,24 (1Н, дд, J=5,0, 2,0 Гц).
Пример 33
1-[(2-Метокси-3-пиридил)метил]-4-[2-[4-(метилсульфонил)-3-(1,3-тиазол-2-ил)-2-тиенил]этил]пиперидин
250 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, 680 мг бромида [[4-(метилсульфонил)-3-бром-2-тиенил)]метил]трифенилфосфония и 258 мг трет-бутоксида калия суспендируют в 5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:4). Полученный продукт, 408 мг 2-(трибутилстаннил)тиазола и 39 мг тетракис(трифенилфосфин)палладия суспендируют в 5 мл толуола и смесь кипятят с обратным холодильником в течение 8 часов в потоке азота. Растворитель выпаривают, а затем остаток очищают и выделяют колоночной хроматографией на силикагеле (этилацетат). Полученный продукт и 300 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 10 мл этанола. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 3 часов. Реакционный раствор фильтруют и фильтрат выпаривают с получением 230 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,32 (3Н, м), 1,54-1,65 (4Н, м), 1,92-2,02 (2Н, м), 2,76-2,90 (4Н, м), 3,24 (3Н, с), 3,44 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,4, 5,0 Гц), 7,55 (1Н, д, J=3,4 Гц), 7,65 (1Н, дд, J=7,4, 2,0 Гц), 7,94 (1Н, д, J=3,4 Гц), 8,05 (1Н, дд, J=5,0, 2,0 Гц), 8,10 (1Н, с).
Пример 34
1-[(2-Метокси-3-пиридил)метил]-4-[2-[3-(1,3-тиазол-2-ил)-2-тиенил]этил]пиперидин
230 мг указанного в заголовке соединения в виде бесцветного масла получают из 400 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и из 974 мг бромида [(З-бром-2-тиенил)метил]трифенилфосфония методом, описанным в примере 33.
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,43 (3Н, м), 1,65-1,78 (4Н, м), 1,98-2,09 (2Н, м), 2,87-2,95 (2Н, м), 3,21-3,27 (2Н, м), 3,50 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, д, J=7,5, 4,9 Гц), 7,13 (1Н, д, J=5,2 Гц), 7,29 (1Н, д, J=3,4 Гц), 7,40 (1Н, д, J=5,2 Гц), 7,66 (1Н, дд, J=7,5, 2,0 Гц), 7,83 (1Н, д, J=3,4 Гц), 8,05 (1Н, дд, J=4,9, 2,0 Гц).
Пример 35
1-[(2-Метокси-3-пиридил)метил]-4-[2-(1,3-тиазол-2-ил)фенэтил]пиперидин
233 мг указанного в заголовке соединения в виде бесцветного масла получают из 293 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, и из бромида (2-бромбензил)трифенилфосфония методом, описанным в примере 33.
1H-ЯМР (400 МГц, CDCl3) δ 1,15-1,28 (3Н, м), 1,42-1,50 (2Н, м), 1,56-1,66 (2Н, м), 1,93-2,02 (2Н, м), 2,80-2,89 (2Н, м), 2,91-2,98 (2Н, м), 3,45 (2Н, с), 3,94 (3Н, с), 6,85 (1Н, дд, J=6,8, 4,8 Гц), 7,26 (1Н, дд, J=7,6, 7,6 Гц), 7,30 (1Н, д, J=7,6 Гц), 7,35 (1Н, дд, J=7,6, 7,6 Гц), 7,39 (1Н, д, J=3,2 Гц), 7,57 (1Н, д, J=7,6 Гц), 7,62 (1Н, дд, J=6,8, 2,0 Гц), 7,88 (1Н, д, J=3,2 Гц), 8,04 (1Н, дд, J=4,8, 2,0 Гц).
Пример 36
1-[(2-Метокси-3-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидин
591 мг 4-(2,3-метилендиоксифенэтил)пиперидина, 404 мг 3-(хлорметил)-2-метоксипиридина и 415 мг карбоната калия суспендируют в 5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:9) с получением 809 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,53-1,61 (2Н, м), 1,68-1,78 (2Н, м), 1,97-2,06 (2Н, м), 2,56-2,62 (2Н, м), 2,85-2,92 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 5,92 (2Н, с), 6,63-6,70 (2Н, м), 6,75 (1Н, дд, J=7,7, 7,7 Гц), 6,86 (1Н, дд, J=7,1, 5,0 Гц), 7,64 (1Н, дд, J=7,1, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 37
1-[(2-Метокси-3-пиридил)метил]-4-(2-цианофенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,57-1,65 (2Н, м), 1,72-1,80 (2Н, м), 1,98-2,09 (2Н, м), 2,81-2,95 (4Н, м), 3,48 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,3, 5,1 Гц), 7,27 (1Н, ддд, J=7,7, 7,7, 0,9 Гц), 7,31 (1Н, дд, J=7,7, 1,5 Гц), 7,50 (1Н, ддд, J=7,7, 7,7, 1,5 Гц), 7,60 (1Н, дд, J=7,7, 0,9 Гц), 7,65 (1Н, дд, J=7,3, 2,0 Гц), 8,05 (1Н, дд, J=5,1, 2,0 Гц).
Пример 38
1-[(2-Метокси-3-пиридил)метил]-4-(3-цианофенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,39 (3Н, м), 1,52-1,61 (2Н, м), 1,66-1,78 (2Н, м), 1,97-2,07 (2Н, м), 2,61-2,70 (2Н, м), 2,86-2,94 (2Н, м), 3,48 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,3, 5,1 Гц), 7,33-7,50 (4Н, м), 7,64 (1Н, дд, J=7,3, 1,8 Гц), 8,05 (1Н, дд, J=5,1, 1,8 Гц).
Пример 39
1-[(2-Метокси-3-пиридил)метил]-4-(4-фенилфенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,40 (3Н, м), 1,57-1,64 (2Н, м), 1,70-1,80 (2Н, м), 2,00-2,08 (2Н, м), 2,64-2,70 (2Н, м), 2,86-2,94 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,22-7,27 (2Н, м), 7,32 (1Н, м), 7,40-7,45 (2Н, м), 7,49-7,53 (2Н, м), 7,56-7,60 (2Н, м), 7,65 (1Н, дд, J=7,2, 1,8 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Пример 40
1-[(2-Метокси-3-пиридил)метил]-4-(2-фенилфенэтил)пиперидин
181 мг 4-(2-фенилфенэтил)пиперидина, синтезированного из соответствующего исходного материала описанным выше способом, 150 мг 2-метокси-З-пиридинкарбоксальдегида и 226 мг триацетоксиборогидрида натрия суспендируют в 5 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь подщелачивают добавлением 1 н. водного гидроксида натрия, а затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:19) с получением 213 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,07-1,20 (3Н, м), 1,37-1,45 (2Н, м), 1,45-1,53 (2Н, м), 1,87-1,97 (2Н, м), 2,55-2,62 (2Н, м), 2,75-2,83 (2Н, м), 3,43 (2Н, с), 3,93 (3Н, с), 6,85 (1Н, дд, J=7,6, 5,0 Гц), 7,18-7,42 (9Н, м), 7,60 (1Н, дд, J=7,6, 2,0 Гц), 8,04 (1Н, дд, J=5,0, 2,0 Гц).
Пример 41
1-[(2-Метокси-3-пиридил)метил]-4-(2-метилтиофенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,52-1,62 (2Н, м), 1,71-1,82 (2Н, м), 2,02-2,13 (2Н, м), 2,46 (3Н, с), 2,68-2,74 (2Н, м), 2,87-2,97 (2Н, м), 3,51 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 7,04-7,14 (2Н, м), 7,16-7,21 (2Н, м), 7,66 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 42
1-[(2-Метокси-3-пиридил)метил]-4-(2-метоксифенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,38 (3Н, м), 1,48-1,57 (2Н, м), 1,70-1,79 (2Н, м), 1,97-2,07 (2Н, м), 2,57-2,65 (2Н, м), 2,85-2,93 (2Н, м), 3,48 (2Н, с), 3,81 (3Н, с), 3,94 (3Н, с), 6,84 (1Н, дд, J=8,0, 1,2 Гц), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 6,88 (1Н, ддд, J=7,6, 7,6, 1,2 Гц), 7,12 (1Н, дд, J=7,6, 1,6 Гц), 7,17 (1Н, ддд, J=8,0, 7,6, 1,6 Гц), 7,65 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=5,0, 2,0 Гц).
Пример 43
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-метилсульфонил-2-тиенил)этил]пиперидин
4,41 г гидрохлорида 4-[2-(3-метилсульфонил-3-тиенил)этил]пиперидина, 2,36 г 3-(хлорметил)-2-метоксипиридина и 5,90 г карбоната калия суспендируют в 30 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат:гексан=1:3) с получением 809 мг указанного в заголовке соединения в виде бесцветного масла (количественный выход).
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,42 (3Н, м), 1,66-1,78 (4Н, м), 2,00-2,09 (2Н, м), 2,88-2,94 (2Н, м), 3,06 (3Н, с), 3,17-3,23 (2Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,18 (1Н, д, J=5,4 Гц), 7,30 (1Н, д, J=5,4 Гц), 7,64 (1Н, дд, J=7,2, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 44
1-[(2-Метокси-3-пиридил)метил]-4-[2-[3-(метилсульфонил)-2-тиенил]-1-этенил]пиперидин
500 мг 1-[(2-метокси-3-пиридил)метил]-4-(1-этенил)пиперидина, 530 мг 2-бром-3-(метилсульфонил)тиофена, 21 мг безводного иодида меди и 127 мг тетракис(трифенилфосфин)палладия суспендируют в смешанном растворителе, состоящем из 2,2 мл триэтиламина и 2,2 мл N,N-диметилформамида, и смесь перемешивают при 100°С в течение 2 часов в потоке азота. К реакционному раствору добавляют этилацетат и полученные осадки отфильтровывают. К фильтрату добавляют воду и смесь экстрагируют этилацетатом. Растворитель выпаривают, а затем неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат), в результате чего получают 450 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,77-1,89 (2Н, т), 1,93-2,03 (2Н, м), 2,25-2,37 (2Н, м), 2,70-2,84 (3Н, м), 3,19 (3Н, м), 3,51 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, д, J=7,2, 5,0 Гц), 7,21 (1Н, д, J=7,1 Гц), 7,38 (1Н, д, J=7,1 Гц), 7,65 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=5,0, 2,0 Гц).
Пример 45
1-[(2-Метокси-3-пиридил)метил]-4-[2-[3-(метилсульфонил)-2-тиенил]этил]пиперидин
450 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[3-(метилсульфонил)-2-тиенил]-1-этинил]пиперидина и 250 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 10 мл этанола. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 8 часов. Реакционный раствор фильтруют и фильтрат выпаривают с получением указанного в заголовке соединения в виде желтого масла (с количественным выходом).
Данные спектра ЯМР указанного в заголовке соединения совпадают с данными ЯМР соединения примера 42.
Пример 46
1-[(2-Метокси-3-пиридил)метил]-4-[2-(метилсульфонил)-3,4-метилендиоксифенэтил]пиперидин
800 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, 1,90 г бромида [2-(метилсульфонил)-3,4-метилендиоксибензил]трифенилфосфония и 384 мг трет-бутоксида калия суспендируют в 10 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:4). Полученный продукт и 400 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 40 мл этанола. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 30 минут. Реакционный раствор фильтруют и фильтрат выпаривают с получением указанного в заголовке соединения в виде бесцветного масла (с количественным выходом).
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,40 (3Н, м), 1,52-1,60 (2Н, м), 1,68-1,78 (2Н, м), 2,00-2,09 (2Н, м), 2,86-2,93 (2Н, м), 2,96-3,02 (2Н, м), 3,21 (3Н, с), 3,49 (2Н, с), 3,95 (3Н, с), 6,12 (2Н, с), 6,75 (1Н, д, J=8,1 Гц), 6,86 (1Н, д, J=7,1, 5,0 Гц), 6,93 (1Н, д, J=8,1 Гц), 7,64 (1Н, дд, J=7,1, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 47
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-оксо-1,2-дигидро-3-пиридинил)этил]пиперидин
500 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, 905 мг хлорида [ (2-хлор-3-пиридил)метил]трифенилфосфония и 340 мг трет-бутоксида калия суспендируют в 15 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:19). Полученный продукт добавляют к раствору, в котором 116 мг бензилового спирта и 35 мг 60% гидрида натрия, суспендированного в масле, растворяют в 5 мл N,N-диметилформамида и перемешивают при комнатной температуре в течение 1 часа, после чего смесь перемешивают при 120°С в течение 2 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:19). Полученный продукт и 50 мг порошкообразного 5% палладия на угле (продукта, содержащего воду) суспендируют в 20 мл метанола. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 3 часов. Реакционный раствор фильтруют и после выпаривания фильтрата его промывают этилацетатом, в результате чего получают 130 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,39 (3Н, м), 1,49-1,59 (2Н, м), 1,70-1,80 (2Н, м), 1,97-2,09 (2Н, м), 2,50-2,58 (2Н, м), 2,84-2,93 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,20 (1Н, дд, J=6,8, 6,8 Гц), 6,86 (1Н, дд, J=7,2, 4,8 Гц), 7,20 (1Н, дд, J=6,8, 2,0 Гц), 7,26 (1Н, дд, J=6,8, 2,0 Гц), 7,64 (1Н, дд, J=4,8, 2,0 Гц), 8,04 (1Н, дд, J=4,8, 2,0 Гц).
Пример 48
1-[(2-Метокси-3-пиридил)метил]-4-[2-[2-(1,3-тиазол-2-ил)-3-пиридил]этил]пиперидин
150 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[2-[[(трифторметил)сульфонил]окси]-3-пиридил]этил]пиперидина, 180 мг 2-(трибутилстаннил)тиазола и 20 мг тетракис(трифенилфосфин)палладия суспендируют в 4 мл толуола и смесь кипятят с обратным холодильником в течение 2 часов в потоке азота. Растворитель выпаривают, а затем остаток очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:4) с получением 39 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,41 (3Н, м), 1,52-1,62 (2Н, м), 1,72-1,78 (2Н, м), 1,99-2,09 (2Н, м), 2,86-2,94 (2Н, м), 3,27-3,34 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,23 (1Н, дд, J=8,0, 4,8 Гц), 7,40 (1Н, д, J=3,4 Гц), 7,61 (1Н, дд, J=8,0, 1,6 Гц), 7,65 (1Н, дд, J=7,2, 2,0 Гц), 7,91 (1Н, д, J=3,4 Гц), 8,05 (1Н, дд, J=5,0, 2,0 Гц), 8,47 (1Н, дд, J=4,8, 1,6 Гц).
Пример 49
1-[(2-Метокси-3-пиридил)метил]-4-[2-[2-(4-гидрокси)пиперидино]-3-пиридил)этил]пиперидин
269 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[2-[(трифторметил)сульфонил]окси]-3-пиридил]этил]пиперидина, полученного, как описано в сравнительном примере 18, 178 мг 4-гидроксипиперидина и 243 мг карбоната калия суспендируют в 5 мл N,N-диметилформамида и смесь перемешивают при 130°С в течение 3 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:1) с получением 70 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,40 (3Н, м), 1,54-1,80 (6Н, м), 1,98-2,08 (4Н, м), 2,58-2,64 (2Н, м), 2,84-2,95 (4Н, м), 3,25-3,33 (2Н, м), 3,49 (2Н, с), 3,84 (1Н, м), 3,95 (3Н, с), 6,85-6,92 (2Н, м), 7,44 (1Н, д, J=7,2, 1,9 Гц), 7,64 (1Н, д, J=7,2 Гц), 8,06 (1Н, дд, J=4,9, 1,9 Гц), 8,15 (1Н, дд, J=4,9, 1,9 Гц).
Пример 50
1-[(2-Метокси-3-пиридил)метил]-4-[2-[2-(3-цианопропокси)-3-пиридил]этил]пиперидин
200 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-оксо-1,2-дигидро-3-пиридинил)этил]пиперидина, полученного, как описано в сравнительном примере 47, 95 мг γ-бромбутиронитрила и 169 мг карбоната калия суспендируют в 5 мл N,N-диметилформамида и смесь перемешивают при 60°С в течение 4 часов. К смеси добавляют этилацетат, полученную соль отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:4) с получением 77 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,39 (3Н, м), 1,47-1,56 (2Н, м), 1,68-1,77 (2Н, м), 1,97-2,07 (2Н, м), 2,11-2,21 (2Н, м), 2,51-2,61 (4Н, м), 2,86-2,93 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 4,40-4,45 (2Н, м), 6,82 (1Н, дд, J=7,2, 5,0 Гц), 6,87 (1Н, дд, J=7,2, 4,8 Гц), 7,38 (1Н, дд, J=7,2, 2,0 Гц), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 7,97 (1Н, дд, J=5,0, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 51
1-[(2-Метокси-3-пиридил)метил]-4-[2-[1-(2-фторбензил)-2-оксо-1,2-дигидро-3-пиридинил]этил]пиперидин
87 мг указанного в заголовке соединения получают в виде бесцветного масла из 100 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-оксо-1,2-дигидро-3-пиридинил)этил]пиперидина, полученного в примере 47, и из 61 мг 2-фторбензилбромида способом, описанным в примере 49.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,36 (3Н, м), 1,47-1,56 (2Н, м), 1,68-1,78 (2Н, м), 1,97-2,06 (2Н, м), 2,51-2,58 (2Н, м), 2,84-2,92 (2Н, м), 3,47 (2Н, с), 3,94 (3Н, с), 5,17 (2Н, с), 6,08-6,13 (1Н, м), 6,86 (1Н, дд, J=7,2, 5,2 Гц), 7,03-7,16 (3Н, м), 7,24-7,31 (2Н, м), 7,40-7,46 (1Н, м), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 8,04 (1Н, дд, J=5,2, 2,0 Гц).
Пример 52
1-[(2-Бензилокси-3-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидин
369 мг указанного в заголовке соединения в виде бесцветного масла получают из 478 мг 1-[(2-хлор-3-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидина способом, описанным ниже в примере 120.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,36 (3Н, м), 1,54-1,62 (2Н, м), 1,69-1,77 (2Н, м), 1,98-2,07 (2Н, м), 2,56-2,63 (2Н, м), 2,86-2,92 (2Н, м), 3,53 (2Н, с), 5,41 (2Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=7,8, 1,0 Гц), 6,68 (1Н, дд, J=7,8, 1,0 Гц), 6,75 (1Н, дд, J=7,8, 7,8 Гц), 6,89 (1Н, дд, J=7,2, 5,0 Гц), 7,32 (1Н, м), 7,35-7,41 (2Н, м), 7,45-7,50 (2Н, м), 7,68 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=5,0, 2,0 Гц).
Пример 53
1-[(2-Метокси-3-пиридил)метил]-4-[2-гидрокси-2-(2-тиенил)этил]пиперидин
48,4 мл 1,0 М (2-тиенил)лития в тетрагидрофуране растворяют в 40 мл тетрагидрофурана при -78°С и к этому раствору по каплям добавляют смешанный раствор, состоящий из 10,0 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в примере 24, и 40 мл тетрагидрофурана. После завершения добавления по каплям смесь перемешивают еще 20 минут при -78°С. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:3) с получением 12,1 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,55 (3Н, м), 1,65-2,08 (6Н, м), 2,83-2,90 (2Н, м), 3,47 (2Н, с), 3,94 (3Н, с), 5,03 (1Н, д, J=8,3, 5,6), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 6,94-6,99 (2Н, м), 7,25 (1Н, м), 7,63 (1Н, дд, J=7,1, 2,0 Гц), 8,04 (1Н, дд, J=4,9, 2,0 Гц).
Пример 54
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-(2-тиенил)этил]пиперидин
12,0 г 1-[(2-метокси-3-пиридил)метил]-4-[2-гидрокси-2-(2-тиенил)этил]пиперидина и 30,2 мл триэтиламина растворяют в 72 мл диметилсульфоксида и к этому раствору при охлаждении льдом по каплям добавляют смешанный раствор, состоящий из 17,2 г комплекса "триоксид серы - пиридин" и 90 мл диметилсульфоксида. После завершения добавления по каплям смесь перемешивают еще 30 минут при комнатной температуре. К реакционному раствору добавляют водный бикарбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат:гексан=1:1) с получением 9,6 г указанного в заголовке соединения в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,48 (2Н, м), 1,69-1,80 (2Н, м), 1,94-2,15 (3Н, м), 2,82 (2Н, д, J=7,0 Гц), 2,84-2,93 (2Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,0 Гц), 7,13 (1Н, дд, J=4,9, 3,9 Гц), 7,63 (1Н, дд, J=4,9, 1,3 Гц), 7,64 (1Н, дд, J=7,3, 1,9 Гц), 7,70 (1Н, дд, J=3,9, 1,3 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 55
N1-Метокси, N1-метил-2-[1-[(2-метокси-3-пиридил)метил]-4-пиперидил]ацетамид
2,6 г этил-2-[1-[(2-метокси-3-пиридил)метил]-4-(пиперидил)ацетата и 1,3 г гидрохлорида N,O-диметилгидроксиламина суспендируют в 18 мл тетрагидрофурана и к этой суспензии по каплям добавляют 13,2 мл 2 М раствора хлоризопропилмагния в диэтиловом эфире при -23°С. После завершения добавления по каплям смесь перемешивают еще 30 минут при комнатной температуре. К реакционному раствору добавляют водный насыщенный хлорид аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:2) с получением 2,3 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,42 (2Н, м), 1,69-1,78 (2Н, м), 1,88 (1Н, м), 2,05-2,15 (2Н, м), 2,32-2,40 (2Н, м), 2,85-2,94 (2Н, м), 3,18 (3Н, с), 3,49 (2Н, с), 3,67 (3Н, с), 3,95 (3Н, с), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,64 (1Н, дд, J=7,2, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 56
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-(2-тиенил)этил]пиперидин
0,50 г N1-метокси, N1-этил-2-[1-[(2-метокси-3-пиридил)метил]-4-пиперидил]ацетамида, полученного в примере 55, растворяют в 3 мл тетрагидрофурана и к раствору по каплям добавляют 1,8 мл 1,0 М раствора (2-тиенил)лития в тетрагидрофуране при -78°С. После завершения добавления по каплям смесь перемешивают еще 1 час при -78°С. К реакционному раствору добавляют водный насыщенный хлорид аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 0,22 г указанного в заголовке соединения в виде светло-желтого масла. Данные спектра ЯМР указанного в заголовке соединения совпадают с данными ЯМР соединения примера 54.
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,48 (2Н, м), 1,69-1,80 (2Н, м), 1,94-2,15 (3Н, м), 2,82 (2Н, д, J=7,0 Гц), 2,84-2,93 (2Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,0 Гц), 7,13 (1Н, дд, J=4,9, 3,9 Гц), 7,63 (1Н, дд, J=4,9, 1,3 Гц), 7,64 (1Н, дд, J=7,3, 1,9 Гц), 7,70 (1Н, дд, J=3,9, 1,3 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 57
1-[(2-Метокси-3-пиридил)метил]-4-(2-гидрокси-2-фенилэтил)пиперидин
2,2 г указанного в заголовке соединения в виде желтого масла получают из 2,0 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в сравнительном примере, и из 10,0 мл циклогексанового/диэтилэфирного раствора 0,97 М фениллития способом, описанным в примере 53.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,60 (4Н, м), 1,64-1,82 (3Н, м), 1,96-2,07 (2Н, м), 2,82-2,91 (2Н, м), 3,46 (2Н, с), 3,92 (3Н, с), 4,71-4,78 (1Н, м), 6,84 (1Н, дд, J=7,1, 4,9 Гц), 7,23-7,37 (5Н, м), 7,62 (1Н, дд, J=7,1, 2,0 Гц), 8,03 (1Н, дд, J=4,9, 2,0 Гц).
Пример 58
1-[(2-Метокси-3-пиридил)метил]-4-(2-оксо-2-фенилэтил)пиперидин
2,2 г 1-[(2-метокси-3-пиридил)метил]-4-(2-гидрокси-2-фенилэтил)пиперидина и 8,6 г диоксида марганца суспендируют в 35 мл толуола и смесь кипятят с обратным холодильником в течение 2 часов. Реакционный раствор фильтруют и фильтрат выпаривают. Затем остаток очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 1,54 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,47 (2Н, м), 1,70-1,80 (2Н, м), 1,92-2,17 (3Н, м), 2,83-2,94 (4Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,1 Гц), 7,42-7,49 (3Н, м), 7,52-7,59 (1Н, м), 7,64 (1Н, дд, J=7,3, 2,0 Гц), 7,92-7,98 (2Н, м), 8,05 (1Н, дд, J=5,1, 2,0 Гц).
Пример 59
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-хлорфенил)-2-гидроксиэтил]пиперидин
1,0 г 2-бромхлорбензола растворяют в 11 мл тетрагидрофурана и к раствору по каплям при -78°С добавляют 10,0 мл 1,54 М раствора н-бутиллития в гексане. После перемешивания в течение 20 минут к смеси по каплям добавляют смешанный раствор, состоящий из 1,0 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в сравнительном примере 22, и 4 мл тетрагидрофурана. После завершения добавления по каплям смесь перемешивают еще 10 минут при -78°С. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:3) с получением 0,90 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,45 (2Н, м), 1,52-1,95 (5Н, м), 2,83-2,97 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 5,19-5,27 (1Н, м), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,19 (1Н, ддд, J=7,6, 7,6, 1,6 Гц), 7,28 (1Н, дд, J=7,6, 1,6 Гц), 7,31 (1Н, ддд, J=7,6, 7,6, 1,6 Гц), 7,57 (1Н, дд, J=7,6, 1,6 Гц), 7,65 (1Н, дд, J=7,2, 2,0 Гц), 8,04 (1Н, дд, J=5,0, 2,0 Гц).
Пример 60
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-хлорфенил)-2-оксоэтил]пиперидин
720 мг указанного в заголовке соединения в виде светло-желтого масла получают из 900 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-хлорфенил)-2-гидроксиэтил]пиперидина способом, описанным в примере 54.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,46 (2H, м), 1,71-1,80 (2Н, м), 1,93-2,16 (3Н, м), 2,84-2,93 (4Н, м), 3,50 (2H, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,26-7,44 (4Н, м), 7,64 (1Н, д, J=7,2, 1,8 Гц), 8,05 (1Н, д, J=5,0, 1,8 Гц).
Пример 61
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)-2-гидроксиэтил]пиперидин
0,26 мл 2-хлорпиридина, 2,9 мл циклогексанового/диэтилэфирного раствора 0,97 М фениллития и 0,039 мл диизопропиламина растворяют в 9 мл тетрагидрофурана и смесь перемешивают в течение 1 часа при -45°С. К этой смеси по каплям добавляют смешанный раствор, состоящий из 500 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в сравнительном примере 22, и 2 мл тетрагидрофурана, и смесь перемешивают еще 20 минут при -45°С. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:2) с получением 420 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,47 (2H, м), 1,55-1,95 (5Н, м), 2,01-2,14 (2H, м), 2,83-2,97 (2H, м), 3,49 (2H, с), 3,94 (3Н, с), 5,12-5,20 (1Н, м), 6,86 (1Н, дд, J=7,3, 5,0 Гц), 7,28 (1Н, дд, J=7,7, 5,0 Гц), 7,65 (1Н, дд, J=7,3, 2,0 Гц), 7,94 (1Н, дд, J=7,7, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц), 8,29 (1Н, дд, J=5,0, 2,0 Гц).
Пример 62
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)-2-оксоэтил]пиперидин
463 мг указанного в заголовке соединения в виде светло-желтого масла получают из 610 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)-2-гидроксиэтил]пиперидина способом, описанным в примере 54.
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,47 (2Н, м), 1,70-1,79 (2Н, м), 1,93-2,17 (3Н, м), 2,84-2,97 (4Н, м), 3,50 (2Н, с), 3,95 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 7,33 (1Н, дд, J=7,7, 4,9 Гц), 7,63 (1Н, дд, J=7,1, 1,8 Гц), 7,77 (1Н, дд, J=7,7, 1,9 Гц), 8,05 (1Н, дд, J=4,9, 1,9 Гц), 8,48 (1Н, дд, J=4,9, 1,8 Гц).
Пример 63
1-[(2-Метокси-З-пиридил)метил]-4-[2-оксо-2-(2-трифторацетиламинофенил)этил]пиперидин
482 мг 2-бром-N-(трифторацетил)анилина растворяют в смешанном растворителе, состоящем из 1,8 мл тетрагидрофурана и 1,8 мл диэтилового эфира, и к этому раствору по каплям при 0°С добавляют 1,14 М раствор метиллития в диэтиловом эфире. После перемешивания в течение 10 минут смесь медленно загружают через канюлю в раствор, состоящий из 2,4 мл 1,51 М трет-бутиллития и 4 мл диэтилового эфира, и охлажденный до -78°С. Смесь перемешивают в течение 1 часа. Затем к смеси по каплям добавляют смешанный раствор, состоящий из 500 мг N1-метокси,N1-этил-2-[1-[(2-метокси-3-пиридил)метил]-4-пиперидил]ацетамида, полученного в примере 54, и 2 мл тетрагидрофурана, и смесь перемешивают еще 20 минут. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт выделяют путем очистки колоночной хроматографией на силикагеле (этилацетат) с получением 150 мг вышеуказанного соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,35-1,48 (2Н, м), 1,70-1,80 (2Н, м), 1,94-2,18 (3Н, м), 2,87-2,95 (2Н, м), 2,98 (2Н, д, J=6,4 Гц), 3,51 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 4,9 Гц), 7,29 (1Н, дд, J=8,6, 7,7 Гц), 7,62 (1Н, дд, J=7,2, 1,9 Гц), 7,64 (1Н, дд, J=8,1, 7,7 Гц), 8,00 (1Н, д, J=8,1 Гц), 8,06 (1Н, дд, J=4,9, 1,9 Гц), 8,70 (1Н, д, J=8,6 Гц).
Пример 64
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-аминофенил)-2-оксоэтил]пиперидин
150 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-оксо-2-(2-трифторацетиламинофенил)этил]пиперидина, полученного, как описано в сравнительном примере 63, и 141 мг карбоната калия суспендируют в смешанном растворителе, состоящем из 3 мл метанола и 3 мл воды, и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор экстрагируют этилацетатом и органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают с получением указанного в заголовке соединения в виде желтого масла (количественный выход).
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,47 (2Н, м), 1,70-1,79 (2Н, м), 1,90-2,03 (1Н, м), 2,06-2,17 (2Н, м), 2,82-2,94 (4Н, м), 3,50 (2Н, с), 3,94 (3Н, с), 6,64 (1Н, дд, J=8,0, 7,0 Гц), 6,65 (1Н, д, J=7,2 Гц), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,26 (1Н, ддд, J=8,0, 7,2, 1,5 Гц), 7,64 (1Н, дд, J=7,2, 1,8 Гц), 7,73 (1Н, дд, J=7,0, 1,5 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Пример 65
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-метилсульфониламинофенил)-2-оксоэтил]пиперидин
120 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-аминофенил)-2-оксоэтил]пиперидина, полученного, как описано в сравнительном примере 64, 0,1 мл триэтиламина и 0,041 мл метансульфонилхлорида растворяют в 2 мл дихлорметана и смесь перемешивают в течение 2 часов при охлаждении льдом. К реакционному раствору добавляют водный бикарбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 90 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,47 (2Н, м), 1,76-1,85 (2Н, м), 1,99-2,22 (3Н, м), 2,83-2,96 (4Н, м), 3,50 (3Н, с), 3,52 (2Н, с), 3,95 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,0 Гц), 7,40 (1Н, дд, J=5,9, 3,4 Гц), 7,54 (1Н, д, J=3,4 Гц), 7,56 (1Н, д, J=3,4 Гц), 7,65 (1Н, дд, J=7,3, 1,9 Гц), 7,67 (1Н, дд, J=5,9, 3,4 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 66
1-[(2-Метокси-3-пиридил)метил]-4-[2-[(2-метилсульфонил)фенил]-2-оксоэтил]пиперидин
953 мг N-(трет-бутоксикарбонил)-4-[2-[2-(метилсульфонилфенил)]-2-оксоэтил]пиперидина и 19,2 мл 4 М раствора хлористого водорода в этилацетате растворяют в 15 мл этилацетата и смесь перемешивают при комнатной температуре в течение 4 часов. Растворитель выпаривают и остаток перекристаллизовывают из этилацетата с получением 800 мг гидрохлорида 4-[2-(2-метилсульфонилфенил)-2-оксоэтил]пиперидина. Затем полученный продукт суспендируют в 400 мг 3-(хлорметил)-2-метоксипиридина, 1,0 г карбоната калия и 15 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 1,07 г указанного в заголовке соединения в виде сетло-желтого масла (количественный выход).
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,47 (2Н, м), 1,80-1,89 (2Н, м), 2,02-2,20 (3Н, м), 2,85-2,95 (4Н, м), 3,25 (3Н, с), 3,50 (2Н, с), 3,95 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 7,41 (1Н, д, J=7,5 Гц), 7,61 (1Н, дд, J=7,9, 7,5 Гц), 7,64 (1Н, д, 3=1,1, 1,8 Гц), 7,69 (1Н, дд, J=7,5, 7,5 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц), 8,07 (1Н, д, J=7,9 Гц).
Пример 67
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-метоксифенил)-2-оксоэтил]пиперидин
2,4 г 1-[(2-метокси-3-пиридил)метил]-4-[2-(гидрокси-2-метоксифенил)этил]пиперидина получают способом, описанным в примере 59, из 2,1 г 2-броманизола, 7,4 мл 1,54 М раствора н-бутиллития в гексане и 2,0 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в сравнительном примере 22. Затем продукт обрабатывают, как описано в примере 54, и получают 0,93 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,43 (2Н, м), 1,65-1,77 (2Н, м), 1,89-2,15 (3Н, м), 2,81-2,95 (4Н, м), 3,48 (2Н, с), 3,89 (3Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 6,95 (1Н, д, J=8,4 Гц), 6,99 (1Н, дд, J=7,5, 7,5 Гц), 7,44 (1Н, ддд, J=8,4, 7,5, 1,5 Гц), 7,61 (1Н, дд, J=7,5, 1,5 Гц), 7,63 (1Н, дд, J=7,1, 1,8 Гц), 8,04 (1Н, дд, J=4,9, 1,8 Гц).
Пример 68
1-[(2-Метокси-3-пиридил)метил]-4-[2-(2-циклопропилметоксифенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 0,32-0,39 (2Н, м), 0,62-0,70 (2Н, м), 1,22-1,47 (3Н, м), 1,69-1,80 (2Н, м), 1,92-2,19 (3Н, м), 2,70-2,96 (2Н, м), 3,01 (2Н, д, J=6,9 Гц), 3,50 (2Н, с), 3,88 (2Н, д, J=6,5 Гц), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 6,88 (1Н, д, J=8,4 Гц), 6,97 (1Н, дд, J=7,5, 7,4 Гц), 7,40 (1Н, ддд, J=8,4, 7,4, 1,8 Гц), 7,64 (1Н, дд, J=7,5, 1,8 Гц), 7,65 (1Н, дд, J=7,1, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 69
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-(2-трифторметилфенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,43 (2Н, м), 1,73-1,83 (2Н, м), 1,96-2,18 (3Н, м), 2,79 (2Н, д, J=6,6 Гц), 2,85-2,94 (2Н, м), 3,50 (2Н, с), 3,95 (3Н, с), 6,86 (1Н, дд, J=7,2, 4,9 Гц), 7,39 (1Н, д, J=7,5 Гц), 7,54 (1Н, дд, J=7,5, 7,5 Гц), 7,60 (1Н, дд, J=7,5, 7,5 Гц), 7,63 (1Н, дд, J=7,2, 1,8 Гц), 7,71 (1Н, д, J=7,5 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 70
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-(3-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,46 (2Н, м), 1,68-1,80 (2Н, м), 1,92-2,15 (3Н, м), 2,78-2,94 (4Н, м), 3,49 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 4,9 Гц), 7,31 (1Н, дд, J=5,1, 2,9 Гц), 7,54 (1Н, дд, J=5,1, 1,3 Гц), 7,63 (1Н, дд, J=7,1, 1,8 Гц), 8,03 (1Н, дд, J=2,9, 1,3 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 71
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-(1,3-тиазол-2-ил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,37-1,51 (2Н, м), 1,71-1,80 (2Н, м), 1,97-2,16 (3Н, м), 2,85-2,93 (2Н, м), 3,10 (2Н, д, J=6,8 Гц), 3,49 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,1, 5,0 Гц), 7,64 (1Н, дд, J=7,1, 1,8 Гц), 7,67 (1Н, д, J=3,0 Гц), 8,00 (1Н, дд, J=3,0 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Пример 72
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3,4-метилендиоксифенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,38-1,43 (2H, м), 1,68-1,76 (2H, м), 2,09 (1Н, м) 2,80 (2H, д, J=6,8 Гц), 2,84-2,92 (2H, м), 3,48 (2H, с), 3,94 (3Н, с), 6,04 (2H, с), 6,85 (1Н, д, J=8,2 Гц), 6,86 (1Н, дд, J=7,2, 4,9 Гц), 7,43 (1Н, д, J=1,8 Гц), 7,55 (1Н, д, J=8,2, 1,8 Гц), 7,63 (1Н, д, J=7,2, 1,8 Гц), 8,05 (1Н, дд, J=4,9, 1,8 Гц).
Пример 73
1-[(2-Метокси-3-пиридил)метил]-4-[2-(3-бром-2-тиенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,48 (2H, м), 1,72-1,82 (2H, м), 1,95-2,17 (3Н, м), 2,84-2,99 (4Н, м), 3,49 (2H, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,3, 5,1 Гц), 7,11 (1Н, д, J=5,1 Гц), 7,50 (1Н, д, J=5,1 Гц), 7,64 (1Н, дд, J=7,3, 2,0 Гц), 8,05 (1Н, дд, J=5,1, 2,0 Гц).
Пример 74
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-[3-(1,3-тиазол-2-ил)-3-тиенил]этил]пиперидин
300 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(3-бром-2-тиенил)-2-оксоэтил]пиперидина, полученного в примере 73, 438 мг 2-(трибутилстаннил)тиазола и 42 мг тетракис(трифенилфосфин)палладия суспендируют в 4 мл толуола и смесь кипятят с обратным холодильником в течение 2 часов в потоке азота. Растворитель выпаривают, а затем остаток очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 300 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,43 (2Н, м), 1,66-1,96 (2Н, м), 1,94-2,14 (3Н, м), 2,76-2,91 (4Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,85 (1Н, дд, J=7,3, 5,1 Гц), 7,46 (1Н, д, J=3,3 Гц), 7,53 (1Н, д, J=5,2 Гц), 7,62 (1Н, дд, J=7,3, 2,0 Гц), 7,82 (1Н, д, J=5,2 Гц), 7,93 (1Н, д, J=3,3 Гц), 8,05 (1Н, дд, J=5,1, 2,0 Гц).
Пример 75
1-[(2-Метокси-3-пиридил)метил]-4-[2-оксо-2-(3-фенил-2-тиенил)этил]пиперидин
290 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(3-бром-2-тиенил)-2-оксоэтил]пиперидина, полученного в примере 73, 173 мг фенилборной кислоты и 42 мг тетракис(трифенилфосфин)палладия суспендируют в 5,6 мл толуола, 1,4 мл метанола и 2,8 мл 2 М карбоната натрия и смесь кипятят с обратным холодильником в течение 3 часов в потоке азота. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 290 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,09-1,24 (2Н, м), 1,48-1,59 (2Н, м), 1,83 (1Н, м), 1,98-2,11 (2Н, м), 2,42 (2Н, д, J=6,8 Гц), 2,75-2,87 (2Н, м), 3,42 (2Н, с), 6,30 (1Н, дд, J=7,5, 6,0 Гц), 7,06 (1Н, д, J=4,9 Гц), 7,33 (1Н, д, J=6,0 Гц), 7,34-7,46 (5Н, м), 7,48 (1Н, д, J=7,5 Гц), 7,54 (1Н, д, J=4,9 Гц).
Пример 76
1-[(2-Метокси-3-пиридил)метил]-4-(3-фенилпропил)пиперидин
214 мг указанного в заголовке соединения в виде бесцветного масла получают из 332 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в сравнительном примере 22, и из 491 мг хлорида бензилтрифенилфосфония способом, описанным в примере 46.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (5Н, м), 1,57-1,70 (4Н, м), 1,76-2,06 (2Н, м), 2,59 (2Н, т, J=7,7 Гц), 2,84-2,91 (2Н, м), 3,47 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,14-7,20 (3Н, м), 7,24-7,30 (2Н, м), 7,64 (1Н, дд, J=7,2, 1,9 Гц), 8,04 (1Н, дд, J=5,0, 1,9 Гц).
Пример 77
1-[(2-Метокси-3-пиридил)метил]-4-(3-(2-тиенил)пропил)пиперидин
206 мг указанного в заголовке соединения в виде светло-коричневого масла получают из 261 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинацетальдегида, полученного в сравнительном примере 22, и из 499 мг хлорида (2-тиенилметил)трифенилфосфония.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,35 (5Н, м), 1,62-1,74 (4Н, м), 1,76-2,06 (2Н, м), 2,81 (2Н, т, J=7,6 Гц), 2,84-2,92 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,77 (1Н, дд, J=3,4, 1,1 Гц), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 6,91 (1Н, дд, J=5,1, 3,4 Гц), 7,10 (1Н, дд, J=5,1, 1,1 Гц), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 8,04 (1Н, дд, J=5,0, 2,0 Гц).
Пример 78
1-[(2-Метокси-3-пиридил)метил]-4-бензилпиперидин
472 мг указанного в заголовке соединения в виде светло-желтого масла получают из 292 мг 4-бензилпиперидина способом, описанным в примере 43.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,40 (2Н, м), 1,53 (1Н, м), 1,58-1,68 (2Н, м), 1,95-2,04 (2Н, м), 2,54 (2Н, д, J=7,0 Гц), 2,84-2,91 (2Н, м), 3,47 (2Н, с), 3,93 (3Н, с), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,12-7,21 (3Н, м), 7,24-7,30 (2Н, м), 7,63 (1Н, дд, J=7,2, 2,0 Гц), 8,04 (1Н, дд, J=5,0, 2,0 Гц).
Пример 79
1-[(2-Метокси-3-пиридил)метил]-4-(4-фенилбутил)пиперидин
150 мл указанного в заголовке соединения в виде бесцветного масла получают из 220 мг 3-[1-[(2-метокси-3-пиридил)метил]-4-пиперидил]пропаналя, полученного в сравнительном примере 30, и 407 мг хлорида бензилтрифенилфосфония способом, описанным в примере 46.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,38 (7Н, м), 1,55-1,70 (4Н, м), 1,96-2,06 (2Н, м), 2,60 (2Н, т, J=7,7 Гц), 2,84-2,93 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,86 (1Н, дд, J=7,2, 5,0 Гц), 7,14-7,20 (3Н, м), 7,24-7,30 (2Н, м), 7,64 (1Н, дд, J=7,2, 1,8 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Пример 80
1-[(2-Метокси-3-пиридил)метил]-4-[оксо(2-тиенил)метил)пиперидин
101 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 210 мг 4-[оксо(2-тиенил)метил]пиперидина способом, описанным в примере 43.
1H-ЯМР (400 МГц, CDCl3) δ 1,82-1,98 (4Н, м), 2,14-2,23 (2Н, м), 2,94-3,03 (2Н, м), 3,09 (1Н, м), 3,52 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,12 (1Н, дд, J=5,0, 3,8 Гц), 7,62 (1Н, дд, J=5,0, 1,0 Гц), 7,67 (1Н, дд, J=7,2, 1,8 Гц), 7,72 (1Н, дд, J=3,8, 1,0 Гц), 8,05 (1Н, дд, J=5,0, 1,8 Гц).
Пример 81
1-[(2-Метокси-3-пиридил)метил]-4-пиперидинкарбоксамид
832 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 496 мг изонипекотамида способом, описанным в примере 43.
1H-ЯМР (400 МГц, CDCl3) δ 1,73-1,91 (4Н, м), 2,04-2,22 (3Н, м), 2,90-2,98 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 5,35 (1Н, шир.с), 5,47 (1Н, шир.с), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,65 (1Н, дд, J=7,2, 1,9 Гц), 8,06 (1Н, дд, J=5,0, 1,9 Гц).
Пример 82
N4-[(2-Фенил)бензил-1-[(2-метокси-3-пиридил)метил]]-4-пиперидинкарбоксамид
212 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксамида, 0,16 мл 2-(бромметил)бифенила и 46 мг 60% гидрида натрия суспендируют в 5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат:гексан=1:3) с получением 92 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,60-1,78 (4Н, м), 1,96-2,08 (3Н, м), 2,86-2,94 (2Н, м), 3,47 (2Н, с), 3,94 (3Н, с), 4,43 (2Н, д, J=5,5 Гц), 5,48 (1Н, т, J=5,5 Гц), 6,87 (1Н, дд, J=7,2, 5,0 Гц), 7,24-7,45 (9Н, м), 7,63 (1Н, дд, J=7,2, 1,9 Гц), 8,05 (1Н, дд, J=5,0, 1,9 Гц).
Пример 83
1-[(2-Метокси-3-пиридил)метил]-4-[[(2-бром-3-пиридил)окси]метил]пиперидин
1,18 г 1-[(2-метокси-3-пиридил)метил]-4-пиперидинметанола, полученного в сравнительном примере 1, и 0,87 г 2-бром-3-гидроксипиридина растворяют в 50 мл тетрагидрофурана. При охлаждении при 10°С добавляют 1,12 г диизопропилазодикарбоксилата и 1,44 г трифенилфосфина и смесь перемешивают при комнатной температуре в течение 20 часов. Растворитель выпаривают и остаток очищают и выделяют колоночной хроматографией на силикагеле (дихлорметан-метанол) с получением 550 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,40-1,52 (2H, м), 1,84-1,98 (3Н, м), 2,08-2,17 (2H, м), 2,92-3,01 (2H, м), 3,53 (2H, с), 3,87 (2H, д, J=6,4 Гц), 3,96 (3Н, с), 6,88 (1Н, дд, J=6,8, 4,8 Гц), 7,11 (1Н, дд, J=8,0, 1,6 Гц), 7,19 (1Н, дд, J=8,0, 4,8 Гц), 7,65 (1Н, дд, J=6,8, 2,0 Гц), 7,97 (1Н, дд, J=4,8, 1,6 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 84
1-[(2-Метокси-3-пиридил)метил]-4-[[[2-(1,3-тиазол-2-ил)-3-пиридил]окси]метил]пиперидин
238 мг указанного в заголовке соединения в виде бесцветного масла получают из 250 мг 1-[(2-метокси-3-пиридил)метил]-4-[[(2-бром-3-пиридил)окси]метил]пиперидина способом, описанным в примере 33.
1H-ЯМР (400 МГц, CDCl3) δ 1,44-1,59 (2H, м), 1,92-2,20 (5Н, м), 2,93-3,02 (2H, м), 3,54 (2H, с), 3,96 (3Н, с), 4,04 (2H, д, J=6,4 Гц), 6,88 (1Н, дд, J=7,2, 4,8 Гц), 7,31 (1Н, дд, J=8,4, 4,4 Гц), 7,37 (1Н, дд, J=8,4, 1,2 Гц), 7,48 (1Н, д, J=3,2 Гц), 7,66 (1Н, дд, J=7,2, 1,6 Гц), 8,04 (1Н, д, J=3,2 Гц), 8,06 (1Н, дд, J=4,8, 1,6 Гц), 8,39 (1Н, дд, J=4,4, 1,2 Гц).
Пример 85
1-[(2-Метокси-3-пиридил)метил]-4-[2-циано-2-(3,4-метилендиоксифенил)этил]пиперидин
227 мг указанного в заголовке соединения в виде бесцветного масла получают из 200 мг 4-[2-циано-2-(3,4-метилендиоксифенил)этил]пиперидина способом, описанным в примере 33.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,40 (2H, м), 1,43-1,56 (1Н, м), 1,63-1,80 (3Н, м), 1,86-1,96 (1Н, м), 2,00-2,10 (2H, м), 2,84-2,93 (2H, м), 3,48 (2H, с), 3,71-3,77 (1Н, м), 3,94 (3Н, с), 5,98 (2H, с), 6,73-6,80 (3Н, м), 6,86 (1Н, дд, J=7,2, 4,8 Гц), 7,62 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 86
1-[(2-Метокси-3-пиридил)метил]-4-[2-циано-2-(2-метоксифенил)этил]пиперидин
191 мг указанного в заголовке соединения в виде бесцветного масла получают из 242 мг 4-[2-циано-2-(2-метоксифенил)этил]пиперидина способом, описанным в примере 80.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,40 (2H, м), 1,52-1,74 (3Н, м), 1,80-1,91 (2H, м), 2,01-2,12 (2H, м), 2,83-2,95 (2H, м), 3,48 (2H, с), 3,84 (3Н, с), 3,95 (3Н, с), 4,22-4,28 (1Н, м), 6,86 (1Н, дд, J=7,2, 5,2 Гц), 6,88 (1Н, д, J=8,0 Гц), 6,98 (1Н, дд, J=8,0, 7,6 Гц), 7,29 (1Н, дд, J=8,0, 7,6 Гц), 7,40 (1Н, д, J=8,0 Гц), 7,62 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 87
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(метилсульфонил)фенэтил]пиперидин
479 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(метилсульфонил)фенэтил]пиперидина, полученного в сравнительном примере 1, и 2 мл тионилхлорида растворяют в 50 мл этанола и смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь подщелачивают добавлением 1 н. водного гидроксида натрия и смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (этилацетат) с получением 368 мг указанного в заголовке соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,48 (3Н, м), 1,62-1,68 (2Н, т), 1,75-1,82 (2Н, т), 2,06-2,16 (2Н, т), 2,91-2,99 (2Н, т), 3,02-3,07 (2Н, т), 3,08 (3Н, с), 3,48 (2Н, с), 6,33 (1Н, дд, J=6,5, 6,5 Гц), 7,35-7,40 (3Н, т), 7,53-7,58 (2Н, т), 8,03 (1Н, дд, J=8,3, 1,4 Гц).
Пример 88
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(3,4-метилендиоксифенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,38 (3Н, м), 1,49-1,57 (2Н, м), 1,68-1,77 (2Н, м), 2,02-2,12 (2Н, м), 2,52-2,58 (2Н, м), 2,88-2,96 (2Н, м), 3,47 (2Н, с), 5,92 (2Н, с), 6,34 (1Н, дд, J=6,6, 6,6 Гц), 6,61 (1Н, дд, J=7,9, 1,7 Гц), 6,67 (1Н, д, J=1,7 Гц), 6,72 (1Н, д, J=7,9 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,53 (1Н, д, J=6,6 Гц).
Пример 89
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-фенэтилпиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,40 (3Н, м), 1,53-1,62 (2Н, м), 1,69-1,79 (2Н, м), 2,01-2,13 (2Н, м), 2,58-2,67 (2Н, м), 2,88-2,97 (2Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,14-7,21 (3Н, с), 7,24-7,31 (2Н, с), 7,36 (1Н, д, J=6,6 Гц), 7,54 (1Н, д, J=6,6 Гц).
Пример 90
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-гидроксифенэтил)пиперидин
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,12-1,24 (3Н, м), 1,40-1,48 (2Н, м), 1,64-1,71 (2Н, м), 1,87-1,96 (2Н, м), 2,48-2,55 (2Н, м), 2,75-2,82 (2Н, м), 3,22 (2Н, с), 6,16 (1Н, дд, J=6,6, 6,6 Гц), 6,69 (1Н, ддд, J=7,5, 7,5, 1,2 Гц), 6,75 (1Н, дд, J=7,5, 1,2 Гц), 6,96 (1Н, ддд, J=7,5, 7,5, 1,7 Гц), 7,02 (1Н, дд, J=7,5, 1,7 Гц), 7,24 (1Н, дд, J=6,6, 2,2 Гц), 7,37 (1Н, дд, J=6,6, 2,2 Гц).
Пример 91
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(3-фторфенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,40 (3Н, м), 1,52-1,61 (2Н, м), 1,68-1,77 (2Н, м), 2,02-2,12 (2Н, м), 2,58-2,66 (2Н, м), 2,88-2,97 (2Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,8, 6,8 Гц), 6,83-6,91 (2Н, м), 6,94 (1Н, м), 7,19-7,26 (1Н, м), 7,36 (1Н, д, J=6,8 Гц), 7,54 (1Н, д, J=6,8 Гц).
Пример 92
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-трифторметилфенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,45 (3Н, м), 1,51-1,61 (2Н, м), 1,70-1,81 (2Н, м), 2,04-2,16 (2Н, м), 2,73-2,82 (2Н, м), 2,89-2,99 (2Н, м), 3,49 (2Н, с), 6,34 (1Н, дд, J=6,8, 6,8 Гц), 7,26 (1Н, дд, J=7,7, 7,6 Гц), 7,31 (1Н, д, J=7,5 Гц), 7,36 (1Н, д, J=6,8 Гц), 7,45 (1Н, дд, J=7,6, 7,5 Гц), 7,54 (1Н, д, J=6,8 Гц), 7,60 (1Н, д, J=7,7 Гц).
Пример 93
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(1-пиразоло)фенэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,12-1,24 (3Н, м), 1,31-1,40 (2Н, м), 1,50-1,59 (2Н, м), 1,94-2,04 (2Н, м), 2,51-2,59 (2Н, м), 2,81-2,89 (2Н, м), 3,42 (2Н, с), 6,30 (1Н, дд, J=6,4, 6,4 Гц), 6,42 (1Н, дд, J=2,4, 2,0 Гц), 7,23-7,38 (5Н, м), 7,52 (1Н, д, J=6,4 Гц), 7,56 (1Н, д, J=2,4 Гц), 7,70 (1Н, д, J=2,0 Гц).
Пример 94
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(4-ацетилпиперидино)фенэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,40 (3Н, м), 1,53-1,61 (2Н, м), 1,73-1,81 (2Н, м), 2,03-2,12 (2Н, м), 2,13 (3Н, с), 2,65-2,72 (2Н, м), 2,81-2,97 (6Н, м), 3,46 (2Н, с), 3,55-3,61 (2Н, м), 3,68-3,77 (2Н, м), 6,34 (1Н, дд, J=6,4, 6,4 Гц), 7,04 (1Н, д, J=7,6 Гц), 7,07 (1Н, дд, J=7,6, 7,6 Гц), 7,17 (1Н, дд, J=7,6, 7,6 Гц), 7,21 (1Н, д, J=7,6 Гц), 7,36 (1Н, д, J=6,4 Гц), 7,51 (1Н, д, J=6,4 Гц).
Пример 95
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[6-(метилсульфонил)-2,3-метилендиоксифенэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,44 (3Н, м), 1,58-1,67 (2Н, м), 1,74-1,84 (2Н, м), 2,06-2,15 (2Н, м), 2,90-2,98 (4Н, м), 3,05 (3Н, с), 3,49 (2Н, с), 6,09 (2Н, с), 6,34 (1Н, дд, J=6,5, 6,5 Гц), 6,78 (1Н, д, J=8,4 Гц), 7,37 (1Н, д, J=6,5 Гц), 7,54 (1Н, д, J=6,5 Гц), 7,62 (1Н, д, J=8,4 Гц).
Пример 96
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,40 (3Н, м), 1,60-1,77 (4Н, м), 2,02-2,12 (2Н, м), 2,81-2,97 (4Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,9, 6,9 Гц), 6,78 (1Н, д, J=3,5 Гц), 6,91 (1Н, дд, J=5,1, 3,5 Гц), 7,11 (1Н, д, J=5,1 Гц), 7,36 (1Н, д, J=6,9 Гц), 7,52 (1Н, д, J=6,9 Гц).
Пример 97
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3-метокси-2-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,38 (3Н, м), 1,52-1,61 (2Н, м), 1,70-1,79 (2Н, м), 2,01-2,12 (2Н, м), 2,67-2,75 (2Н, м), 2,87-2,96 (2Н, м), 3,46 (2Н, с), 3,81 (3Н, с), 6,33 (1Н, дд, J=6,4, 6,4 Гц), 6,81 (1Н, д, J=5,2 Гц), 6,99 (1Н, д, J=5,2 Гц), 7,36 (1Н, д, J=6,4 Гц), 7,54 (1Н, д, J=6,4 Гц).
Пример 98
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3-циано-2-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,31-1,42 (3Н, м), 1,63-1,81 (4Н, м), 2,03-2,15 (2Н, м), 2,90-2,99 (2Н, м), 3,00-3,07 (2Н, м), 3,48 (2Н, с), 6,33 (1Н, дд, J=6,5, 6,5 Гц), 7,11 (1Н, д, J=5,3 Гц), 7,17 (1Н, д, J=5,3 Гц), 7,35 (1Н, д, J=6,5 Гц), 7,53 (1Н, д, J=6,5 Гц).
Пример 99
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3-фенил-2-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,33 (3Н, м), 1,56-1,66 (4Н, м), 1,96-2,07 (2Н, м), 2,83-2,92 (4Н, м), 3,44 (2Н, с), 6,32 (1Н, дд, J=6,4, 6,4 Гц), 7,00 (1Н, д, J=5,2 Гц), 7,15 (1Н, д, J=5,2 Гц), 7,27-7,43 (6Н, м), 7,52 (1Н, д, J=6,4 Гц).
Пример 100
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,38 (3Н, м), 1,55-1,62 (2Н, м), 1,66-1,78 (2Н, м), 2,01-2,12 (2Н, м), 2,62-2,68 (2Н, м), 2,88-2,96 (2Н, м), 3,47 (2Н, с), 6,34 (1Н, дд, J=6,4 Гц), 6,91-6,95 (2Н, м), 7,24 (2Н, дд, J=4,8, 2,8 Гц), 7,34 (1Н, д, J=6,4 Гц), 7,52 (1Н, д, J=6,4 Гц),
Пример 101
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(метилсульфонил)-3-тиенил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,46 (3Н, м), 1,57-1,66 (2Н, м), 1,73-1,82 (2Н, м), 2,10-2,22 (2Н, м), 2,92-3,03 (4Н, м), 3,14 (3Н, с), 3,54 (2Н, с), 6,34 (1Н, дд, J=6,6, 6,6 Гц), 7,01 (1Н, д, J=5,0 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,54 (1Н, д, J=6,6 Гц), 7,57 (1Н, д, J=5,0 Гц).
Пример 102
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(бензо[b]тиофен-2-ил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,43 (3Н, м), 1,66-1,80 (4Н, м), 2,02-2,13 (2Н, м), 2,89-2,97 (4Н, м), 3,47 (2Н, с), (4Н, м), 2,02-2,13 (2Н, м), 2,89-2,97 (4Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,4, 6,4 Гц), 7,00 (1Н, с), 7,24 (1Н, дд, J=7,2, 7,1 Гц), 7,30 (1Н, дд, J=7,6, 7,1 Гц), 7,36 (1Н, д, J=6,4 Гц), 7,53 (1Н, д, J=6,4 Гц), 7,66 (1Н, д, J=7,2 Гц), 7,76 (1Н, д, J=7,6 Гц).
Пример 103
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(метилсульфонил)-3-пиридил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,46 (3Н, м), 1,62-1,70 (2Н, м), 1,74-1,83 (2Н, м), 2,06-2,17 (2Н, м), 2,91-2,99 (2Н, м), 3,07-3,15 (2Н, м), 3,37 (3Н, с), 3,49 (2Н, с), 6,34 (1Н, дд, J=6,6, 6,6 Гц), 7,37 (1Н, д, J=6,6 Гц), 7,43 (1Н, дд, J=7,8, 4,6 Гц), 7,56 (1Н, д, J=6,6 Гц), 7,72 (1Н, дд, J=7,8, 1,6), 8,42 (1Н, дд, J=4,8, 1,6 Гц).
Пример 104
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-н-бутил-3-пиридил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 0,96 (3Н, т, J=7,3 Гц), 1,34-1,49 (5Н, м), 1,49-1,60 (2Н, м), 1,63-1,80 (4Н, м), 2,06-2,17 (2Н, м), 2,59-2,66 (2Н, м), 2,77 (2Н, т, J=8,1 Гц), 2,92-3,00 (2Н, м), 3,50 (2Н, с), 6,34 (1Н, дд, J=6,4, 6,4 Гц), 7,04 (1Н, дд, J=7,6, 4,8 Гц), 7,33-7,42 (2Н, м), 7,53 (1Н, д, J=6,4 Гц), 8,37 (1Н, дд, J=4,8, 1,8 Гц).
Пример 105
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3-пиридил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,40 (3Н, м), 1,56-1,62 (2Н, м), 1,70-1,78 (2Н, м), 2,04-2,12 (2Н, м), 2,60-2,66 (2Н, м), 2,90-2,97 (2Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,21 (1Н, дд, J=7,8, 4,8 Гц), 7,36 (1Н, д, J=6, 6 Гц), 7,49 (1Н, ддд, J=7,8, 2,0, 2,0 Гц), 7,54 (1Н, д, J=6,6 Гц), 8,42-8,46 (2Н, м).
Пример 106
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-фенокси-3-пиридил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,40 (3Н, м), 1,60-1,68 (2Н, м), 1,72-1,82 (2Н, м), 2,04-2,12 (2Н, м), 2,70-2,77 (2Н, м), 2,90-2,97 (2Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,4, 6,4 Гц), 6,94 (1Н, дд, J=7,2, 5,0 Гц), 7,07-7,12 (2Н, м), 7,17 (1Н, м), 7,33-7,42 (3Н, м), 7,50-7,55 (2Н, м), 8,00 (1Н, дд, J=5,0, 1,8 Гц).
Пример 107
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(5-метокси-2-пиридил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (3Н, м), 1,61-1,70 (2Н, м), 1,74-1,84 (2Н, м), 2,05-2,16 (2Н, м), 2,80-2,87 (2Н, м), 2,91-2,99 (2Н, м), 3,49 (2Н, с), 3,83 (3Н, м), 6,34 (1Н, дд, J=6,4, 6,4 Гц), 7,09 (1Н, д, J=2,8 Гц), 7,09 (1Н, д, J=2,8 Гц), 7,37 (1Н, д, J=6,4 Гц), 7,57 (1Н, д, J=6,4 Гц), 8,11 (1Н, дд, J=2,8, 2,8 Гц).
Пример 108
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(4-метоксифенил-3-пиридил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,13-1,29 (3Н, м), 1,41-1,50 (2Н, м), 1,52-1,62 (2Н, м), 1,96-2,09 (2Н, м), 2,62-2,70 (2Н, дд, J=6,4, 6,4 Гц), 6,96 (2Н, д, J=8,8 Гц), 7,18 (1Н, дд, J=7,8, 4,8 Гц), 7,33 (1Н, д, J=6,4 Гц), 7,40 (2Н, д, J=8,8 Гц), 7,55 (1Н, д, J=6,4 Гц), 7,57 (1Н, дд, J=7,8, 1,6 Гц), 8,50 (1Н, дд, J=4,8, 1,6 Гц).
Пример 109
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(1,3-тиазол-2-ил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,29-1,42 (3Н, м), 1,69-1,83 (4Н, м), 2,03-2,13 (2Н, м), 2,89-2,97 (2Н, м), 3,02-3,10 (2Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,19 (1Н, д, J=3,3 Гц), 7,35 (1Н, д, J=6,6 Гц), 7,53 (1Н, д, J=6, 6 Гц), 7,67 (1Н, д, J=3,3 Гц).
Пример 110
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(1-морфолино)-3-пиридил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,56-1,64 (2Н, м), 1,72-1,80 (2Н, м), 2,04-2,12 (2Н, м), 2,60-2,66 (2Н, м), 2,72-2,78 (2Н, м), 3,10 (4Н, т, J=4,7 Гц), 3,48 (2Н, с), 3,85 (4Н, т, J=4,7 Гц), 6,34 (1Н, дд, J=6,6, 6,6 Гц), 6,93 (1Н, дд, J=7,4, 4,8 Гц), 7,36 (1Н, д, J=6, 6 Гц), 7,47 (1Н, дд, J=7,4, 1,9 Гц), 7,54 (1Н, м), 8,19 (1Н, дд, J=4,8, 1,9 Гц).
Пример 111
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[(метилсульфонил)амино]фенэтил]пиперидин
155 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 286 мг 1-[(2-метокси-3-пиридил)метил]-4-[(2-метилсульфонил)амино]фенэтил]пиперидина, полученного в примере 26, тем же самом способом, что и в примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,31-1,40 (3Н, м), 1,52-1,60 (2Н, м), 1,72-1,80 (2Н, м), 2,04-2,13 (2Н, м), 2,64-2,71 (2Н, м), 2,90-2,97 (2Н, м), 3,03 (3Н, с), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,15-7,28 (3Н, м), 7,34 (1Н, д, J=6,6 Гц), 7,45 (1Н, м), 7,54 (1Н, м).
Пример 112
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метокси-6-метил-3-пиридил)этил]пиперидин
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-6-метил-3-пиридил)этил]пиперидин получают способом, описанным в примере 87, из 275 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-хлор-6-метил-3-пиридил)этил]пиперидина, полученного в примере 27. Затем продукт растворяют в 5 мл 28% водного метоксида натрия и смесь кипятят с обратным холодильником в течение 3 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и получают 80 мг указанного в заголовке соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,21-1,39 (3Н, м), 1,45-1,55 (2Н, м), 1,68-1,78 (2Н, м), 1,97-2,08 (2Н, м), 2,41 (3Н, с), 2,48-2,56 (2Н, м), 2,85-2,95 (2Н, м), 3,49 (2Н, с), 3,92 (3Н, с), 3,95 (3Н, с), 6,35 (1Н, дд, J=6,6, 6,6 Гц), 6,63 (1Н, д, J=7,3 Гц), 7,23 (1Н, д, J=7,3 Гц), 7,37 (1Н, д, J=6,6 Гц), 7,53 (1Н, д, J=6,6 Гц).
Пример 113
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(6-метокси-3-пиридил)этил]пиперидин
86 мг указанного в заголовке соединения в виде белых кристаллов получают из 300 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(6-хлор-3-пиридил)этил]пиперидина, полученного в примере 28, способом, описанным в примере 112.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,44 (3Н, м), 1,47-1,59 (2Н, м), 1,67-1,78 (2Н, м), 2,04-2,17 (2Н, м), 2,51-2,58 (2Н, м), 2,90-3,01 (2Н, м), 3,51 (2Н, с), 3,92 (3Н, м), 6,35 (1Н, дд, J=6,6, 6,6 Гц), 6,68 (1Н, д, J=8,3 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,39 (1Н, д, J=8,3, 2,4 Гц), 7,55 (1Н, д, J=6, 6 Гц), 7,95 (1Н, д, J=2,4 Гц).
Пример 114
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-пиридил)-1-этенил]пиперидин
110 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 121 мг 1-[(2-метокси-3-пиридил)метил]-4-[(Е)-2-(2-пиридил)-1-этенил]пиперидина, полученного в примере 29, способом, описанным в примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,57-1,72 (3Н, м), 1,77-1,88 (2Н, м), 2,15-2,28 (2Н, м), 2,95-3,05 (2Н, м), 3,52 (2Н, с), 6,35 (1Н, дд, J=6,6, 6,6 Гц), 6,49 (1Н, д, J=15,9 Гц), 6,73 (1Н, дд, J=15,9, 7,0 Гц), 7,11 (1Н, дд, J=7,5, 5,0 Гц), 7,25 (1Н, д, J=7,5 Гц), 7,37 (1Н, д, J=6,6 Гц), 7,56-7,65 (2Н, м), 8,54 (1Н, м).
Пример 115
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-пиридил)этил]пиперидин
128 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 150 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-пиридил)этил]пиперидина, полученного в примере 30, способом, описанным в примере 114.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,42 (3Н, м), 1,64-1,82 (4Н, м), 2,03-2,15 (2Н, м), 2,77-2,85 (2Н, м), 2,90-2,99 (2Н, м), 3,48 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,10 (1Н, ддд, J=7,8, 4,4, 1,2 Гц), 7,14 (1Н, д, J=7,8 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,53-7,62 (2Н, м), 7,52 (1Н, дд, J=4,4, 1,2 Гц).
Пример 116
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(E)-2-(2,3-метилендиоксифенил)-1-этенил]пиперидин
64 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 99 мг 1-[(2-метокси-3-пиридил)метил]-4-[(E)-(2,3-метилендиоксифенил)-1-этенил]пиперидина, полученного в примере 31, способом, описанным в примере 114.
1H-ЯМР (400 МГц, CDCl3) δ 1,50-1,64 (3Н, м), 1,70-1,83 (2Н, м), 2,12-2,24 (2Н, м), 2,94-3,02 (2Н, м), 3,51 (2Н, с), 5,94 (2Н, с), 6,01 (1Н, дд, J=15,8, 7,0 Гц), 6,29 (1Н, д, J=15,8 Гц), 6,34 (1Н, дд, J=6,8, 6,8 Гц), 6,74 (1Н, д, J=8,1 Гц), 6,77 (1Н, дд, J=8,1, 1,4 Гц), 6,90 (1Н, д, J=1,4 Гц), 7,35 (1Н, д, J=6,8 Гц), 7,56 (1Н, д, J=6,8 Гц).
Пример 117
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидин
1,15 г указанного в заголовке соединения в виде бесцветных кристаллов получают из 1,37 г 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 32, способом, описанным в примере 1.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,44 (3Н, м), 1,54-1,64 (2Н, м), 1,72-1,84 (2Н, м), 2,07-2,18 (2Н, м), 2,69-2,78 (2Н, м), 2,92-3,01 (2Н, м), 3,51 (2Н, с), 6,34 (1Н, дд, J=6, 6, 6,6 Гц), 7,18 (1Н, дд, J=7,2, 4,8 Гц), 7,37 (1Н, д, J=6,4 Гц), 7,54 (1Н, дд, J=7,2, 1,8 Гц), 7,57 (1Н, д, J=6, 4 Гц), 8,25 (1Н, дд, J=4,8, 1,8 Гц).
Пример 118
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метокси-3-пиридил)этил]пиперидин
192 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 220 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, способом, описанным в примере 112.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,40 (3Н, м), 1,49-1,57 (2Н, м), 1,72-1,80 (2Н, м), 2,03-2,13 (2Н, м), 2,54-2,60 (2Н, м), 2,89-2,98 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,33 (1Н, дд, J=6,6 Гц), 6,80 (1Н, дд, J=7,2, 5,0 Гц), 7,34-7,39 (2Н, м), 7,57 (1Н, д, J=6,6 Гц), 8,01 (1Н, дд, J=5,2, 1,8 Гц).
Пример 119
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метилтио-3-пиридил)этил]пиперидин
168 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, и 354 мг тиометоксида натрия суспендируют в 5 мл 1-метил-2-пирролидинона и смесь перемешивают при 150°С в течение 2 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (метанол:этилацетат=1:19), в результате чего получают 20 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1Н-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (3Н, м), 1,54-1,64 (2Н, м), 1,72-1,83 (2Н, м), 2,05-2,16 (2Н, м), 2,57 (3Н, с), 2,57-2,66 (2Н, м), 2,90-3,00 (2Н, м), 3,49 (2Н, с), 6,34 (1Н, дд, J=6,6 Гц), 6,94 (1Н, дд, J=7,4, 4,8 Гц), 7,31 (1Н, дд, J=7,4, 1,9 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,56 (1Н, д, J=6,6 Гц), 8,32 (1Н, дд, J=4,8, 1,9 Гц).
Пример 120
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-2-[(2-метоксиэтокси-3-пиридил)этил]пиперидин
183 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, и 226 мг диспергированного в масле 60% гидрида натрия суспендируют в 3 мл 2-метоксиэтанола и смесь перемешивают при 150°С в течение 2 часов. К реакционному раствору добавляют воду и смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (метанол:этилацетат=1:19), в результате чего получают 135 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,42 (3Н, м), 1,50-1,60 (2Н, м), 1,72-1,82 (2Н, м), 2,03-2,15 (2Н, м), 2,56-2,65 (2Н, м), 2,89-3,00 (2Н, м), 3,43 (3Н, с), 3,48 (2Н, с), 3,76 (2Н, т, J=4,8 Гц), 4,48 (2Н, т, J=4,8 Гц), 6,34 (1Н, дд, J=6,6 Гц), 6,80 (1Н, дд, J=7,2, 4,8 Гц), 7,34-7,41 (2Н, м), 7,56 (1Н, д, J=6,6 Гц), 7,97 (1Н, дд, J=4,8, 1,8 Гц).
Пример 121
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-циклопропилметокси-3-пиридил)этил]пиперидин
179 мг 1-[(2-оксо-1,2-дигидро-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, и 0,44 мл циклопропанолметанола и 246 мг диспергированного в масле 60% гидрида натрия суспендируют в 5 мл 1-метилпирролидона и смесь перемешивают при 150°С в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (метанол:этилацетат=1:19), в результате чего получают 147 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 0,31-0,70 (2Н, м), 0,54-0,60 (2Н, м), 1,22-1,42 (4Н, м), 1,52-1,60 (2Н, м), 1,74-1,82 (2Н, м), 2,05-2,14 (2Н, м), 2,56-2,64 (2Н, м), 2,90-2,99 (2Н, м), 3,48 (2Н, с), 4,14 (2Н, д, J=7,0 Гц), 6,34 (1Н, дд, J=6,6, 6,6 Гц), 6,78 (1Н, дд, J=7,2, 5,0 Гц), 7,32-7,42 (2Н, м), 7,55 (1Н, д, J=6,6 Гц), 7,96 (1Н, дд, J=5,0, 1,9 Гц).
Пример 122
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-трифторэтокси-3-пиридил)этил]пиперидин
373 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 404 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, и 0,88 мл трифторэтанола способом, описанным в примере 120.
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,40 (3Н, м), 1,50-1,58 (2Н, м), 1,70-1,80 (2Н, м), 2,02-2,14 (2Н, м), 2,56-2,64 (2Н, м), 2,89-2,98 (2Н, м), 3,48 (2Н, с), 4,76 (2Н, кв, J=8,4 Гц), 6,34 (1Н, дд, J=6,6, 6,6 Гц), 6,90 (1Н, дд, J=7,2, 5,0 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,44 (1Н, дд, J=7,2, 2,0 Гц), 7,55 (1Н, д, J=6,6 Гц), 7,98 (1Н, дд, J=5,0, 2,0 Гц).
Пример 123
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-гидроксиэтокси)-3-пиридил)этил]пиперидин
72 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 213 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, и из 395 мг этиленгликоля способом, описанным в примере 121.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,41 (3Н, м), 1,50-1,59 (2Н, м), 1,70-1,79 (2Н, м), 2,03-2,13 (2Н, м), 2,56-2,63 (2Н, м), 2,90-2,97 (2Н, м), 3,47 (2Н, с), 3,92-3,97 (2Н, м), 4,47-4,52 (2Н, м), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 6,85 (1Н, дд, J=7,2, 5,0 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,42 (1Н, дд, J=7,2, 1,8 Гц), 7,55 (1Н, м), 7,95 (1Н, дд, J=5,0, 1,8 Гц).
Пример 124
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(N,N-диметиламино)этокси-3-пиридил]этил]пиперидин
220 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 254 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридил)этил]пиперидина, полученного в примере 117, и из 0,77 мл N,N-диметиламиноэтанола способом, описанным в примере 121.
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,40 (3Н, м), 1,50-1,58 (2Н, м), 1,72-1,80 (2Н, м), 2,04-2,13 (2Н, м), 2,36 (6Н, с), 2,53-2,61 (2Н, м), 2,76 (2Н, т, J=5,8 Гц), 2,90-2,98 (2Н, м), 3,48 (2Н, с), 4,44 (2Н, т, J=5,8 Гц), 6,35 (1Н, дд, J=6,4, 6,4 Гц), 6,80 (1Н, дд, J=7,2, 5,2 Гц), 7,34-7,40 (2Н, м), 7,54 (1Н, д, J=6,4 Гц), 7,99 (1Н, дд, J=5,0, 2,0 Гц).
Пример 125
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[4-(метилсульфонил)-3-(1,3-тиазол-2-ил)-2-тиенил]этил]пиперидин
90 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 230 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[4-(метилсульфонил)-3-(1,3-тиазол-2-ил)-2-тиенил]этил]пиперидина, полученного в примере 33, способом, описанным в примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,33 (3Н, м), 1,54-1,65 (4Н, м), 1,97-2,09 (2Н, м), 2,76-2,94 (4Н, м), 3,24 (3Н, с), 3,44 (2Н, с), 6,31 (1Н, дд, J=6,7, 6,7 Гц), 7,34 (1Н, д, J=6,7 Гц), 7,52 (1Н, д, J=6,7 Гц), 7,55 (1Н, д, J=3,4 Гц), 7,94 (1Н, д, J=3,4 Гц), 8,10 (1Н, с).
Пример 126
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[3-(1,3-тиазол-2-ил)-2-тиенил]этил]пиперидин
156 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 230 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[3-(1,3-тиазол-2-ил)-2-тиенил]этил] пиперидина, полученного в примере 34, способом, описанным в примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,45 (3Н, м), 1,65-1,81 (4Н, м), 2,05-2,16 (2Н, м), 2,90-2,99 (2Н, м), 3,21-3,29 (2Н, м), 3,49 (2Н, с), 6,34 (1Н, дд, J=6,8, 6,8 Гц), 7,13 (1Н, д, J=5,2 Гц), 7,29 (1Н, д, J=3,4 Гц), 7,36 (1Н, д, J=6, 8 Гц), 7,40 (1Н, д, J=5,2 Гц), 7,54 (1Н, д, J=6,8 Гц), 7,83 (1Н, д, J=3,4 Гц).
Пример 127
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(1,3-тиазол-2-ил)фенэтил]пиперидин
171 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 233 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(1,3-тиазол-2-ил)фенэтил]пиперидина, полученного в примере 35, способом, описанным в примере 87.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,33 (3Н, м), 1,43-1,52 (2Н, м), 1,58-1,69 (2Н, м), 1,98-2,09 (2Н, м), 2,82-2,98 (4Н, м), 3,45 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,26 (1Н, дд, J=7,6, 7,6 Гц), 7,30 (1Н, д, J=7,6 Гц), 7,36 (1Н, дд, J=7,6, 7,6 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,39 (1Н, д, J=3,2 Гц), 7,51 (1Н, д, J=6,6 Гц), 7,57 (1Н, д, J=7,6 Гц), 7,89 (1Н, д, J=3,2 Гц).
Пример 128
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2,3-метилендиоксифенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,40 (3Н, м), 1,54-1,62 (2Н, м), 1,70-1,80 (2Н, т), 2,02-2,12 (2Н, т), 2,56-2,63 (2Н, т), 2,88-2,96 (2Н, т), 3,46 (2Н, с), 5,92 (2Н, с), 6,33 (1Н, дд, J=6,5 Гц), 6,64-6,70 (2Н, м), 6,75 (1Н, дд, J=7,8, 7,8 Гц), 7,36 (1Н, д, J=6,5 Гц), 7,54 (1Н, д, J=6,5 Гц).
Пример 129
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-цианофенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,31-1,45 (3Н, м), 1,57-1,67 (2Н, м), 1,72-1,82 (2Н, м), 2,03-2,15 (2Н, м), 2,81-2,99 (4Н, м), 3,47 (2Н, с), 6,32 (1Н, дд, J=6,9, 6,3 Гц), 7,27 (1Н, дд, J=7,6, 7,6 Гц), 7,32 (1Н, д, J=7,6 Гц), 7,36 (1Н, д, J=6, 3 Гц), 7,50 (1Н, дд, J=7,6, 7,6 Гц), 7,58 (1Н, д, J=6, 9 Гц), 7,60 (1Н, д, J=7,6 Гц).
Пример 130
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(3-цианофенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,41 (3Н, м), 1,52-1,62 (2Н, м), 1,68-1,77 (2Н, м), 2,01-2,13 (2Н, м), 2,62-2,71 (2Н, м), 2,89-2,99 (2Н, м), 3,47 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,36-7,50 (4Н, м), 7,36 (1Н, д, J=6,6 Гц), 7,57 (1Н, д, J=6,6 Гц).
Пример 131
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(4-фенилфенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,42 (3Н, м), 1,58-1,65 (2Н, м), 1,73-1,81 (2Н, м), 2,05-2,14 (2Н, м), 2,64-2,70 (2Н, м), 2,91-2,98 (2Н, м), 3,48 (2Н, с), 6,34 (1Н, дд, J=6,4, 6,4 Гц), 7,23-7,28 (2Н, м), 7,32 (1Н, м), 7,37 (1Н, д, J=6,4 Гц), 7,40-7,45 (2Н, м), 7,49-7,60 (5Н, м).
Пример 132
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-фенилфенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,10-1,20 (3Н, м), 1,37-1,45 (2Н, м), 1,46-1,54 (2Н, м), 1,94-2,03 (2Н, м), 2,56-2,62 (2Н, м), 2,79-2,86 (2Н, м), 3,43 (2Н, с), 6,32 (1Н, дд, J=6,4, 6,4 Гц), 7,18-7,42 (10Н, м), 7,48 (1Н, д, J=6,4 Гц).
Пример 133
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-метилфенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,43 (3Н, м), 1,53-1,62 (2Н, м), 1,73-1,84 (2Н, м), 2,06-2,17 (2Н, м), 2,46 (3Н, с), 2,67-2,75 (2Н, м), 2,90-3,00 (2Н, м), 3,49 (2Н, с), 6,34 (1Н, дд, J=6,6 Гц), 7,06-7,16 (2Н, м), 7,18-7,21 (2Н, м), 7,37 (1Н, д, J=6,6 Гц), 7,57 (1Н, д, J=6,6 Гц).
Пример 134
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-метоксифенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,40 (3Н, м), 1,48-1,57 (2Н, м), 1,72-1,82 (2Н, м), 2,02-2,14 (2Н, м), 2,58-2,66 (2Н, м), 2,88-2,97 (2Н, м), 3,48 (2Н, с), 3,81 (3Н, с), 6,35 (1Н, дд, J=6,6, 6,6 Гц), 6,84 (1Н, д, J=8,2 Гц), 6,88 (1Н, дд, J=7,6, 7,6 Гц), 7,12 (1Н, дд, J=7,6, 2,0 Гц), 7,17 (1Н, ддд, J=8,2, 7,6, 2,0Гц), 7,38 (1Н, д, J=6,6 Гц), 7,53 (1Н, д, J=6,6 Гц).
Пример 135
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3-метилсульфонил-2-тиенил)этил]пиперидин
6,09 г 1-[(2-метокси-3-пиридил)метил]-4-[2-[3-(метилсульфонил)-2-тиенил]этил]пиперидина, полученного в примере 43, и 2 мл тионилхлорида растворяют в 50 мл этанола, и смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь подщелачивают добавлением 1 н. водного гидроксида натрия, а затем экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и полученный неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат) с получением 4,89 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (3Н, м), 1,67-1,80 (4Н, м), 2,04-2,13 (2Н, м), 2,90-2,97 (2Н, т), 3,06 (3Н, с), 3,18-3,24 (2Н, т), 3,46 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,18 (1Н, д, J=5,5 Гц), 7,31 (1Н, д, J=5,5 Гц), 7,36 (1Н, дд, J=6,6, 2,0 Гц), 7,56 (1Н, дд, J=6,6, 2,0 Гц).
Пример 136
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(метилсульфонил)-3,4-метилендиоксифенэтил]пиперидин
875 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 1,45 г 1-[(2-метокси-3-пиридил)метил]-4-[2-(метилсульфонил)-3,4-метилендиоксифенэтил] пиперидина, полученного в сравнительном примере 1, способом, описанным в примере 135.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,52-1,60 (2Н, м), 1,72-1,80 (2Н, м), 2,07-2,16 (2Н, м), 2,90-2,96 (2Н, м), 2,96-3,02 (2Н, м), 3,21 (3Н, с), 3,48 (2Н, с), 6,12 (2Н, с), 6,34 (1Н, дд, J=6,5, 6,5 Гц), 6,75 (1Н, д, J=8,1 Гц), 6,93 (1Н, д, J=8,1 Гц), 7,37 (1Н, д, J=6,5 Гц), 7,53 (1Н, д, J=6,5 Гц).
Пример 137
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(1,3-тиазол-2-ил)-3-пиридил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,46 (3Н, м), 1,54-1,63 (2Н, м), 1,73-1,82 (2Н, м), 2,06-2,16 (2Н, м), 2,90-2,98 (2Н, м), 3,27-3,34 (2Н, м), 3,49 (2Н, с), 6,34 (1Н, дд, J=6,4, 6,4 Гц), 7,23 (1Н, дд, J=7,6, 4,4 Гц), 7,37 (1Н, д, J=6,4 Гц), 7,40 (1Н, д, J=3,6 Гц), 7,56 (1Н, д, J=6,4 Гц), 7,61 (1Н, дд, J=7,6, 1,6 Гц), 7,91 (1Н, д, J=3,6 Гц), 8,47 (1Н, дд, J=4,4, 1,6 Гц).
Пример 138
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[1-(4-гидрокси)пиперидино]-3-пиридил]этил]пиперидин
49 мг указанного в заголовке соединения в виде бесцветного масла получают из 70 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[1-(4-гидрокси)пиперидино]-3-пиридил)этил]пиперидина, полученного в примере 49, способом, описанным в примере 135.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,42 (3Н, м), 1,54-1,62 (2Н, м), 1,64-1,82 (4Н, м), 1,96-2,14 (4Н, м), 2,58-2,65 (2Н, м), 2,84-2,99 (4Н, м), 3,25-3,34 (2Н, м), 3,48 (2Н, с), 3,84 (1Н, м), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 6,90 (1Н, дд, J=7,4, 4,9 Гц), 7,37 (1Н, д, J=6,6 Гц), 7,44 (1Н, дд, J=7,4, 1,9 Гц), 7,55 (1Н, д, J=6,6 Гц), 8,15 (1Н, дд, J=4,9, 1,9 Гц).
Пример 139
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(3-цианопропокси)-3-пиридил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,40 (3Н, м), 1,48-1,57 (2Н, м), 1,70-1,81 (2Н, м), 2,03-2,20 (4Н, м), 2,51-2,61 (4Н, м), 2,89-2,97 (2Н, м), 3,47 (2Н, с), 4,40-4,47 (2Н, м), 6,33 (1Н, дд, J=6,4, 6,4 Гц), 6,82 (1Н, дд, J=7,2, 5,2 Гц), 7,35 (1Н, д, J=6,4 Гц), 7,38 (1Н, дд, J=7,2, 2,0 Гц), 7,55 (1Н, д, J=6,4 Гц), 7,97 (1Н, дд, J=5,2, 2,0 Гц).
Пример 140
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[1-(2-фторбензил)-2-оксо-1,2-дигидро-3-пиридинил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,41 (3Н, м), 1,48-1,57 (2Н, м), 1,71-1,82 (2Н, м), 2,01-2,15 (2Н, м), 2,52-2,58 (2Н, м), 2,88-2,98 (2Н, м), 3,49 (2Н, с), 5,17 (2Н, с), 6,08-6,13 (1Н, м), 6,34 (1Н, дд, J=6,4, 6,4 Гц), 7,03-7,17 (3Н, м), 7,24-7,31 (2Н, м), 7,36 (1Н, д, J=6,4 Гц), 7,40-7,46 (1Н, м), 7,55 (1Н, д, J=6,4 Гц).
Пример 141
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-(2-тиенил)этил]пиперидин
9,6 г 1-[(2-метокси-3-пиридил)метил]-4-[2-оксо-2-(2-тиенил)этил]пиперидина, полученного в примере 54, и 8,5 мл тионилхлорида растворяют в 60 мл этанола и смесь кипятят с обратным холодильником в течение 3 часов. Растворитель выпаривают, а затем остаток растворяют в хлороформе и 1 н. водном гидроксиде натрия. Органический слой отделяют, промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт перекристаллизовывают из этанола с получением 9,0 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,49 (2Н, м), 1,72-1,81 (2Н, м), 2,03 (1Н, м), 2,09-2,20 (2Н, м), 2,82 (2Н, д, J=7,0 Гц), 2,87-2,96 (2Н, м), 3,47 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,13 (1Н, дд, J=4,9, 3,9 Гц), 7,35 (1Н, д, J=6,6 Гц), 7,54 (1Н, д, J=6,6 Гц), 7,63 (1Н, дд, J=4,9, 1,1 Гц), 7,70 (1Н, дд, J=3,9, 1,1 Гц).
Пример 142
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-фенилэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,35-1,49 (2Н, м), 1,72-1,82 (2Н, м), 1,97-2,22 (3Н, м), 2,87-2,97 (3Н, м), 3,48 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,46 (1Н, дд, J=8,0, 8,0 Гц), 7,55 (1Н, д, J=6,6 Гц), 7,56 (1Н, дд, J=8,0, 8,0 Гц), 7,95 (1Н, д, J=8,0 Гц).
Пример 143
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлорфенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,47 (2Н, м), 1,72-1,82 (2Н, м), 2,01 (1Н, м), 2,09-2,21 (2Н, м), 2,85-2,96 (4Н, м), 3,47 (2Н, с), 6,32 (1Н, дд, J=6,8, 6,8 Гц), 7,29-7,34 (1Н, м), 7,35 (1Н, д, J=6,8 Гц), 7,35-7,44 (3Н, м), 7,54 (1Н, д, J=6,8 Гц).
Пример 144
1-[(2-Оксо-1,2-дигидро-З-пиридинил)метил]-4-[2-(2-метоксифенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,46 (2Н, м), 1,69-1,79 (2Н, м), 1,99 (1Н, м), 2,09-2,20 (2Н, м), 2,86-2,96 (3Н, м), 3,48 (2Н, с), 3,89 (3Н, с), 6,33 (1Н, дд, J=7,0, 5,8 Гц), 6,99 (1Н, дд, J=7,5, 7,2 Гц), 6,95 (1Н, д, J=8,4 Гц), 7,37 (1Н, д, J=5,8 Гц), 7,44 (1Н, ддд, J=8,4, 7,2, 1,8 Гц), 7,53 (1Н, д, J=7,0 Гц), 7,62 (1Н, дд, J=7,5, 1,8 Гц).
Пример 145
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метилсульфонилфенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,35-1,49 (2Н, м), 1,81-1,91 (2Н, м), 2,05-2,25 (3Н, м), 2,85-2,99 (4Н, м), 3,25 (3Н, с), 3,49 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,2 Гц), 7,36 (1Н, д, J=6,2 Гц), 7,41 (1Н, д, J=7,5 Гц), 7,55 (1Н, д, J=6,6 Гц), 7,61 (1Н, дд, J=7,7, 7,5 Гц), 7,69 (1Н, дд, J=7,5, 7,5 Гц), 8,07 (1Н, д, J=7,7 Гц).
Пример 146
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-циклопропилметоксифенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 0,32-0,38 (2Н, м), 0,63-0,70 (2Н, м), 1,24-1,46 (3Н, м), 1,70-1,80 (2Н, м), 2,02 (1Н, м), 2,08-2,19 (2Н, м), 2,86-2,94 (2Н, м), 3,02 (2Н, д, J=6,8 Гц), 3,47 (2Н, с), 3,89 (2Н, д, J=7,2 Гц), 6,32 (1Н, дд, J=6,9, 5,9 Гц), 6,88 (1Н, д, J=8,2 Гц), 6,97 (1Н, дд, J=7,7, 7,4 Гц), 7,36 (1Н, д, J=5,9 Гц), 7,41 (1Н, дд, J=8,2, 7,4 Гц), 7,53 (1Н, д, J=6,9 Гц), 7,65 (1Н, д, J=7,7 Гц).
Пример 147
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-(2-трифторметилфенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,31-1,45 (2Н, м), 1,75-1,85 (2Н, м), 1,95-2,24 (3Н, м), 2,80 (2Н, д, J=6,6 Гц), 2,88-2,98 (2Н, м), 3,48 (2Н, с), 6,32 (1Н, дд, J=7,1, 6,2 Гц), 7,36 (1Н, д, J=6,2 Гц), 7,40 (1Н, д, J=7,3 Гц), 7,54 (1Н, д, J=7,1 Гц), 7,55 (1Н, дд, J=7,8, 7,1 Гц), 7,60 (1Н, дд, J=7,8, 7,3 Гц), 7,71 (1Н, д, J=7,1 Гц).
Пример 148
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-(3-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,48 (2Н, м), 1,71-1,81 (2Н, м), 2,02 (1Н, м), 2,09-2,21 (2Н, м), 2,80 (2Н, д, J=6,8 Гц), 2,88-2,97 (2Н, м), 3,47 (2Н, с), 6,32 (1Н, дд, J=6,8, 6,8 Гц), 7,31 (1Н, дд, J=5,1, 2,9 Гц), 7,36 (1Н, д, J=6,8 Гц), 7,54 (1Н, д, J=6,8 Гц), 7,545 (1Н, д, J=5,1 Гц), 8,04 (1Н, д, J=2,9 Гц).
Пример 149
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-(1,3-тиазол-2-ил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,39-1,52 (2Н, м), 1,73-1,82 (2Н, м), 2,01-2,21 (3Н, м), 2,87-2,96 (2Н, м), 3,11 (2Н, д, J=6,8 Гц), 3,47 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,34 (1Н, д, J=6,6 Гц), 7,54 (1Н, д, J=6,6 Гц), 7,67 (1Н, д, J=3,1 Гц), 8,00 (1Н, дд, J=3,1 Гц).
Пример 150
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3,4-метилендиоксифенил)-2-оксоэтил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,45 (2H, м), 1,71-1,80 (2Н, м), 2,01 (1Н, м), 2,10-2,20 (2H, м), 2,81 (2H, д, J=6,8 Гц), 2,88-2,96 (2H, м), 3,47 (2H, с), 6,04 (2H, с), 6,33 (1Н, дд, J=6,5, 6,5 Гц), 6,85 (1Н, д, J=8,2 Гц), 7,36 (1Н, д, J=6,5 Гц), 7,43 (1Н, д, J=1,7 Гц), 7,52 (1Н, д, J=6,5 Гц), 7,55 (1Н, дд, J=8,2, 1,7 Гц).
Пример 151
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-[3-(1,3-тиазол-2-ил)-2-тиенил]этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,31-1,45 (2H, м), 1,69-1,78 (2H, м), 1,96-2,19 (3Н, м), 2,80 (2H, д, J=6,8 Гц), 2,85-2,94 (2H, м), 3,46 (2H, с), 6,31 (1Н, дд, J=6,9, 5,9 Гц), 7,35 (1Н, д, J=5,9 Гц), 7,47 (1Н, д, J=3,3 Гц), 7,52 (1Н, д, J=6,9 Гц), 7,54 (1Н, д, J=5,2 Гц), 7,82 (1Н, д, J=5,2 Гц), 7,93 (1Н, д, J=3,3 Гц).
Пример 152
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-оксо-2-(3-фенил-2-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,09-1,24 (2H, м), 1,48-1,59 (2H, м), 1,83 (1Н, м), 1,98-2,11 (2H, м), 2,42 (2H, д, J=6,8 Гц), 2,75-2,87 (2H, м), 3,42 (2H, с), 6,30 (1Н, дд, J=7,5, 6,0 Гц), 7,06 (1Н, д, J=4,9 Гц), 7,33 (1Н, д, J=6,0 Гц), 7,34-7,46 (5Н, м), 7,48 (1Н, д, J=7,5 Гц), 7,54 (1Н, д, J=4,9 Гц).
Пример 153
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-хлор-3-пиридинил)-2-оксоэтил]пиперидин
В ацетонитриле (4 мл) растворяют 100 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-хлор-3-пиридил)-2-оксоэтил]пиперидина, полученного в примере 62, и 0,35 мл 4 М раствора хлористого водорода в этилацетате, а затем кипятят с обратным холодильником в течение 1 часа. Растворитель выпаривают, а затем остаток растворяют в этилацетате и в 1 н. водном растворе гидроксида натрия. Органический слой отделяют, промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт перекристаллизовывают из этанола с получением 46 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,34-1,48 (2Н, м), 1,71-1,81 (2Н, м), 2,02 (1Н, м), 2,09-2,21 (2Н, м), 2,87-2,98 (4Н, м), 3,47 (2Н, с), 6,31 (1Н, дд, J=6,6, 6,6 Гц), 7,33 (1Н, дд, J=7,5, 4,8 Гц), 7,35 (1Н, д, J=6,6 Гц), 7,54 (1Н, д, J=6,6 Гц), 7,77 (1Н, дд, J=7,5, 1,9 Гц), 8,48 (1Н, дд, J=4,8, 1,9 Гц).
Пример 154
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метилсульфониламинофенил)-2-оксоэтил]пиперидин
В ацетонитриле (4 мл) растворяют 90 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-метилсульфониламинофенил)-2-оксоэтил]пиперидина, полученного в примере 65, и 0,30 мл концентрированной соляной кислоты, а затем кипятят с обратным холодильником в течение 5 часов. Растворитель выпаривают, после чего остаток растворяют в этилацетате и в 1 н. водном растворе гидроксида натрия. Органический слой отделяют, промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт перекристаллизовывают из этанола с получением 45 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,47 (2Н, м), 1,75-1,89 (2Н, м), 2,01-2,25 (3Н, м), 2,83-2,98 (4Н, м), 3,50 (5Н, м), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,40 (1Н, дд, J=5,6, 3,2 Гц), 7,52 (1Н, д, J=6,6 Гц), 7,55 (1Н, д, J=3,2 Гц), 7,57 (1Н, дд, J=3,4 Гц), 7,67 (1Н, дд, J=5,6, 3,4 Гц).
Пример 155
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(3-фенилпропил)пиперидин
161 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 214 мг 1-[(2-метокси-3-пиридил)метил]-4-(3-фенилпропил)пиперидина, полученного в примере 76, способом, описанным в примере 141.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,34 (5Н, м), 1,58-1,72 (4Н, м), 2,00-2,10 (2Н, м), 2,59 (2Н, т, J=7,8 Гц), 2,86-2,94 (2Н, м), 3,45 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,14-7,20 (3Н, м), 7,24-7,30 (2Н, м), 7,36 (1Н, д, J=6,6 Гц), 7,53 (1Н, м).
Пример 156
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-бензилпиперидин
365 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 472 мг 1-[(2-метокси-3-пиридил)метил]-4-бензилпиперидина, полученного в примере 78, способом, описанным в примере 141.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (2Н, м), 1,56 (1Н, м), 1,60-1,68 (2Н, м), 2,02-2,10 (2Н, м), 2,55 (2Н, д, J=7,0 Гц), 2,89-2,96 (2Н, м), 3,46 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,12-7,21 (3Н, м), 7,24-7,30 (2Н, м), 7,35 (1Н, д, J=6,6 Гц), 7,54 (1Н, д, J=6,6 Гц).
Пример 157
1-[(2-Оксо-1,2-дигидро-З-пиридинил)метил]-4-(4-фенилбутил)пиперидин
105 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 150 мг 1-[(2-метокси-3-пиридил)метил]-4-(4-фенилбутил)пиперидина, полученного в примере 79, способом, описанным в примере 141.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,40 (7Н, м), 1,56-1,70 (4Н, м), 2,02-2,12 (2Н, м), 2,60 (2Н, т, J=7,7 Гц), 2,88-2,96 (2Н, м), 3,47 (2Н, с), 6,33 (1Н, дд, J=6,5, 6,5 Гц), 7,14-7,20 (3Н, м), 7,24-7,30 (2Н, м), 7,37 (1Н, д, J=6, 5 Гц), 7,54 (1Н, д, J=6,5 Гц).
Пример 158
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[оксо-(2-тиенил)метил]пиперидин
101 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 273 мг 1-[(2-метокси-3-пиридил)метил]-4-[оксо(2-тиенил)метил]пиперидина, полученного в примере 80, способом, описанным в примере 172.
1H-ЯМР (400 МГц, CDCl3) δ 1,86-2,02 (4Н, м), 2,20-2,30 (2Н, м), 3,00-3,07 (2Н, м), 3,13 (1Н, м), 3,52 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 7,14 (1Н, дд, J=5,0, 4,0 Гц), 7,33 (1Н, дд, J=6,6, 2,0 Гц), 7,61 (1Н, м), 7,64 (1Н, дд, J=5,0, 1,0 Гц), 7,74 (1Н, дд, J=4,0, 1,0 Гц).
Пример 159
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(3-оксо-3-фенилпропил)]пиперидин
414 мг 1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксальдегида, полученного, как описано в сравнительном примере 2, 0,46 мл диэтил(2-оксо-2-фенилэтил)фосфоната и 78 мг суспендированного в масле 60% гидрида натрия суспендируют в 8 мл тетрагидрофурана, а затем перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют этилацетат, смесь промывают 1 н. водным раствором гидроксида натрия и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и полученный и 160 мг порошкообразного 10% палладия на угле (продукта, содержащего воду) суспендируют в 10 мл этанола. После замены атмосферы сосуда водородом смесь перемешивают при комнатной температуре и при нормальном давлении в течение 4 часов. Реакционный раствор фильтруют и фильтрат выпаривают. Полученный неочищенный продукт очищают и выделяют колоночной хроматографией на силикагеле (метанол:этилацетат=1:9). Полученный продукт и 0,15 мл тионилхлорида растворяют в этаноле (2 мл), а затем кипятят с обратным холодильником в течение 2 часов. Смесь подщелачивают добавлением 1 н. водного раствора гидроксида натрия, а затем экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и полученный неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат), в результате чего получают 104 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,67-1,78 (4Н, м), 2,04-2,14 (2Н, м), 2,90-2,97 (2Н, м), 3,00 (2Н, т, J=7,5 Гц), 3,46 (2Н, с), 6,32 (1Н, дд, J=6,6, 6,6 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,44-7,49 (2Н, м), 7,53-7,59 (2Н, м), 7,96-7,99 (2Н, м).
Пример 160
N4-(2-Фенил)бензил-1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-пиперидинкарбоксамид
47 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 92 мг N4-[(2-фенил)бензил-1-[(2-метокси-3-пиридил)метил]-4-пиперидинкарбоксамида, полученного в сравнительном примере 82, способом, описанным в примере 141.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,52-1,68 (4Н, м), 1,90-1,98 (2Н, м), 2,14 (1Н, м), 2,78-2,85 (2Н, м), 3,23 (2Н, с), 4,17 (2Н, д, J=5,8 Гц), 6,17 (1Н, дд, J=6,7, 6,7 Гц), 7,19-7,27 (2Н, м), 7,29-7,40 (7Н, м), 7,41-7,47 (2Н, м), 8,18 (1Н, т, J=5,8 Гц).
Пример 161
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[[[2-(1,3-тиазол-2-ил)-3-пиридил]окси]метил]пиперидин
200 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 238 мг 1-[(2-метокси-3-пиридил)метил]-4-[[[2-(1,3-тиазол-2-ил)-3-пиридил]окси]метил] пиперидина, полученного в примере 84, способом, описанным в примере 141.
1H-ЯМР (400 МГц, CDCl3) δ 1,47-1,61 (2Н, м), 1,93-2,26 (5Н, м), 2,97-3,06 (2Н, м), 3,52 (2Н, с), 4,04 (2Н, д, J=6,4 Гц), 6,32 (1Н, дд, J=6,4, 6,4 Гц), 7,30 (1Н, дд, J=8,4, 4,4 Гц), 7,35 (1Н, д, J=6,4 Гц), 7,36 (1Н, дд, J=8,4, 1,2 Гц), 7,48 (1Н, д, J=3,0 Гц), 7,57 (1Н, д, J=6,4 Гц), 8,03 (1Н, д, J=3,0 Гц), 8,40 (1Н, дд, J=4,4, 1,2 Гц).
Пример 162
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-циано-2-(3,4-метилендиоксифенил)этил]пиперидин
183 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 227 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-циано-2-(3,4-метилендиоксифенил)этил] пиперидина, полученного в примере 85, способом, описанным в примере 141.
1H-ЯМР (400 МГц, CDCl3) δ 1,27-1,42 (2H, м), 1,45-1,58 (1Н, м), 1,63-1,79 (3Н, м), 1,85-1,95 (1Н, м), 2,04-2,15 (2H, м), 2,88-2,97 (2H, м), 3,47 (2H, с), 3,70-3,77 (1Н, м), 5,97 (2H, с), 6,30 (1Н, дд, J=6,4, 6,4 Гц), 6,72-6,81 (3Н, м), 7,34 (1Н, д, J=6,4 Гц), 7,54 (1Н, д, J=6,4 Гц).
Пример 163
Дигидрохлорид 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-циано-2-(2-метоксифенил)этил]пиперидина
191 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-циано-2-(2-метоксифенил)этил]пиперидина, полученного в примере 86, растворяют в этаноле (2 мл). К смеси добавляют 0,3 мл 4 н. раствора соляной кислоты в этилацетате, а затем кипятят с обратным холодильником в течение 2 часов. Растворитель выпаривают с получением 199 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,43-1,67 (4Н, м), 1,80-1,96 (3Н, м), 2,87-2,99 (2H, м), 3,28-3,37 (2H, м), 3,81 (3Н, с), 4,00 (2H, с), 4,27-4,33 (1Н, м), 6,27 (1Н, дд, J=6,4, 6,4 Гц), 6,98 (1Н, дд, J=7,6, 7,6 Гц), 7,06 (1Н, д, J=8,0 Гц), 7,32 (1Н, д, J=6,4 Гц), 7,35 (1Н, дд, J=8,0, 7,6 Гц), 7,51 (1Н, д, J=6,4 Гц), 7,77 (1Н, д, J=7,6 Гц).
Пример 164
1-[(6-Метокси-2-пиридил)метил]-4-(3,4-метилендиоксифенэтил)пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,47-1,56 (2H, м), 1,66-1,74 (2H, м), 2,01-2,10 (2H, м), 2,50-2,57 (2H, м), 2,90-2,98 (2H, м), 3,56 (2H, с), 3,91 (3Н, с), 5,91 (2H, с), 6,58 (1Н, д, J=8,2 Гц), 6,61 (1Н, дд, J=7,9, 1,6 Гц), 6,66 (1Н, д, J=1,6 Гц), 6,72 (1Н, д, J=7,9 Гц), 6,98 (1Н, д, J=7,2 Гц), 7,52 (1Н, дд, J=8,2, 7,2 Гц).
Пример 165
1-[(6-Метокси-2-пиридил)метил]-4-[2-(3-тиенил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,39 (3Н, м), 1,54-1,63 (2Н, м), 1,68-1,77 (2Н, м), 2,01-2,11 (2Н, м), 2,61-2,69 (2Н, м), 2,71-2,79 (2Н, м), 3,57 (2Н, с), 3,92 (3Н, с), 6,59 (1Н, д, J=8,2 Гц), 6,92 (1Н, д, J=2,9 Гц), 6,93 (1Н, д, J=7,7 Гц), 6,98 (1Н, д, J=7,3 Гц), 7,24 (1Н, дд, J=7,7, 2,9 Гц), 7,52 (1Н, дд, J=8,2, 7,3 Гц).
Пример 166
1-[(6-Метокси-2-пиридил)метил]-4-[2-(2-метокси-3-пиридил)этил]пиперидин
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,40 (3Н, м), 1,48-1,56 (2Н, м), 1,70-1,78 (2Н, м), 2,02-2,12 (2Н, м), 2,53-2,60 (2Н, м), 2,92-2,99 (2Н, м), 3,57 (2Н, с), 3,92 (3Н, с), 3,94 (3Н, с), 6,59 (1Н, д, J=8,2 Гц), 6,80 (1Н, дд, J=7,1, 5,1 Гц), 6,99 (1Н, д, J=7,1 Гц), 7,36 (1Н, дд, J=7,1, 1,8 Гц), 7,52 (1Н, дд, J=8,2, 7,1 Гц), 8,00 (1Н, дд, J=5,1, 1,8 Гц).
Пример 167
1-[(6-Метокси-2-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидин
В 28% растворе метоксида натрия в метаноле (2 мл) растворяют 218 мг 1-[(6-бром-2-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидина, полученного в сравнительном примере 19, а затем кипятят с обратным холодильником в течение 1 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель выпаривают, в результате чего получают 144 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,54-1,60 (2Н, м), 1,70-1,77 (2Н, м), 2,02-2,10 (2Н, м), 2,56-2,62 (2Н, м), 2,92-2,98 (2Н, м), 3,56 (2Н, с), 3,91 (3Н, с), 5,92 (2Н, с), 6,58 (1Н, д, J=8,2 Гц), 6,66 (1Н, дд, J=7,8, 1,2 Гц), 6,68 (1Н, дд, J=7,8, 1,2 Гц), 6,75 (1Н, дд, J=7,8, 7,8 Гц), 6,98 (1Н, д, J=7,4 Гц), 7,52 (1Н, дд, J=8,2, 7,4 Гц).
Пример 168
1-[[6-(2-Гидроксиэтокси)-2-пиридил]метил]-4-(2,3-метилендиоксифенэтил)пиперидин
226 мг указанного в заголовке соединения в виде бесцветных кристаллов получают из 320 мг 1-[(3-бром-2-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидина, полученного в сравнительном примере 19, способом, описанным в примере 123.
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,38 (3Н, м), 1,54-1,61 (2Н, м), 1,62-1,75 (2Н, м), 1,98-2,06 (2Н, м), 2,55-2,62 (2Н, м), 2,85-2,92 (2Н, м), 3,52 (2Н, с), 3,90-3,94 (2Н, м), 4,45-4,50 (2Н, м), 5,92 (2Н, с), 6,64-6,69 (3Н, м), 6,75 (1Н, дд, J=7,8, 7,8 Гц), 6,97 (1Н, д, J=7,2 Гц), 7,56 (1Н, дд, J=7,8, 7,2 Гц).
Пример 169
1-[(6-Оксо-1,6-дигидро-2-пиридинил)метил]-4-(3,4-метилендиоксифенэтил)пиперидин
186 мг 4-(3,4-метилендиоксифенэтил)пиперидина, полученного в сравнительном примере 4, 228 мг 6-трет-бутилдиметилсилилокси-2-пиридинкарбоксальдегида и 203 мг триацетоксиборогидрида натрия суспендируют в 2 мл тетрагидрофурана, а затем перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору добавляют водный насыщенный бикарбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель выпаривают. Неочищенный продукт очищают и выделяют колоночной хроматографией на NH-форме силикагеля (этилацетат), в результате чего получают 160 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,36 (3Н, м), 1,48-1,61 (2Н, м), 1,66-1,75 (2Н, м), 2,03-2,13 (2Н, м), 2,51-2,58 (2Н, м), 2,73-2,81 (2Н, м), 3,34 (2Н, с), 5,92 (2Н, с), 5,99 (1Н, д, J=6,8 Гц), 6,43 (1Н, д, J=9,3 Гц), 6,62 (1Н, дд, J=7,9, 1,6 Гц), 6,67 (1Н, д, J=1,6 Гц), 6,73 (1Н, д, J=7,9 Гц), 7,31 (1Н, дд, J=9,3, 6,8 Гц).
Пример 170
1-[(6-Оксо-1,6-дигидро-2-пиридинил)метил]-4-[2-(3-тиенил)этил]пиперидин
Указанное в заголовке соединение получают способом, описанным в примере 169.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,37 (3Н, м), 1,53-1,63 (2Н, м), 1,67-1,76 (2Н, м), 2,03-2,13 (2Н, м), 2,61-2,69 (2Н, м), 2,74-2,82 (2Н, м), 3,35 (2Н, с), 5,95 (1Н, д, J=6,8 Гц), 6,43 (1Н, д, J=9,2 Гц), 6,92 (1Н, д, J=2,9 Гц), 6,94 (1Н, д, J=4,8 Гц), 7,25 (1Н, дд, J=4,8, 2,9 Гц), 7,31 (1Н, дд, J=9,2, 6,8 Гц).
Пример 171
1-[(6-Оксо-1,6-дигидро-2-пиридинил)метил]-4-[2-(2-метокси-3-пиридил)этил]пиперидин
Указанное в заголовке соединение получают способом, описанным в примере 169.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,38 (3Н, м), 1,49-1,58 (2Н, м), 1,71-1,79 (2Н, м), 2,04-2,14 (2Н, м), 2,53-2,61 (2Н, м), 2,75-2,83 (2Н, м), 3,36 (2Н, с), 3,95 (2Н, с), 5,95 (1Н, д, J=6,8 Гц), 6,43 (1Н, д, J=9,3 Гц), 6,81 (1Н, дд, J=7,1, 5,1 Гц), 7,32 (1Н, дд, J=9,3, 6,8 Гц), 7,36 (1Н, дд, J=7,1, 1,8 Гц), 8,01 (1Н, дд, J=5,1, 1,8 Гц).
Пример 172
1-[(6-Оксо-1,6-дигидро-2-пиридинил)метил]-4-[2,3-метилендиоксифенэтил]пиперидин
В трет-бутаноле (5 мл) суспендируют 316 мг 1-[(6-бром-2-пиридил)метил]-4-(2,3-метилендиоксифенэтил)пиперидина, полученного в сравнительном примере 19, и 880 мг трет-бутоксида калия, а затем кипятят с обратным холодильником в течение 8 часов. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт выделяют и очищают колоночной хроматографией на NH-форме силикагеля (этилацетат) с получением 96 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,36 (3Н, м), 1,54-1,64 (2Н, м), 1,71-1,78 (2Н, м), 2,04-2,12 (2Н, м), 2,56-2,62 (2Н, м), 2,75-2,82 (2Н, м), 3,35 (2Н, с), 5,93 (2Н, с), 5,99 (1Н, д, J=6,8 Гц), 6,43 (1Н, д, J=7,2 Гц), 6,66 (1Н, дд, J=7,6, 1,2 Гц), 6,69 (1Н, дд, J=7,6, 1,2 Гц), 6,76 (1Н, дд, J=7,6, 7,6 Гц), 7,31 (1Н, дд, J=7,2, 6,8 Гц).
Пример 173
N1-Бензил-2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидинил]ацетамид
1,0 г 2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]уксусной кислоты, 0,41 мл бензиламина, 950 мг WSC и 260 мг HOBt суспендируют в ДМФ, а затем перемешивают в течение 2 часов при комнатной температуре. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. Осушитель отфильтровывают, растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат:метанол=10:1, а затем 5:1) с получением 500 мг указанного в заголовке соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (2Н, м), 1,52-1,85 (4Н, м), 2,03-2,10 (1Н, м), 2,47 (1Н, дд, J=16,4, 4,8 Гц), 2,66-2,73 (1Н, м), 2,76-2,85 (2Н, м), 3,33 (1Н, д, J=13,6 Гц), 3,86 (3Н, с), 3,94 (1Н, д, J=13,6 Гц), 4,30 (1Н, дд, J=14,8, 5,2 Гц), 4,54 (1Н, дд, J=14,8, 6,4 Гц), 6,67 (1Н, дд, J=7,2, 4,8 Гц), 7,17 (1Н, дд, J=7,2, 2 Гц), 7,24-7,34 (5Н, м), 8,02 (1Н, дд, J=4,8, 2 Гц), 8,70 (1Н, шир.с).
Пример 174
N1-(3-Фторбензил)-2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 173.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,45 (2Н, м), 1,52-1,65 (2Н, м), 1,67-1,84 (2Н, м), 2,08-2,17 (1Н, м), 2,51 (1Н, дд, J=16,8, 5,2Гц), 2,69-2,90 (3Н, м), 3,35 (1Н, д, J=13,6 Гц), 3,85 (3Н, с), 3,97 (1Н, д, J=13,6 Гц), 4,28 (1Н, дд, J=14,8, 5,2 Гц), 4,52 (1Н, дд, J=14,8, 6,4 Гц), 6,72 (1Н, дд, J=7,2, 4,8 Гц), 6,90-7,08 (3Н, м), 7,22-7,32 (2Н, м), 8,04 (1Н, дд, J=4,8, 2,0 Гц), 8,03 (1Н, шир.с).
Пример 175
N1,N1-Ди(2-пропинил)-2-[(R)-1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетамид
4,4 г N1,N1-ди(2-пропинил)-2-[(2R)-гексагидро-2-пиридинил]ацетамида, 3,8 г 3-(хлорметил)-2-метоксипиридина, 16,6 г карбоната калия и 50 мл ДМФ перемешивают при комнатной температуре в течение ночи. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия. После отфильтровывания безводного сульфата натрия органический растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1-1:1, затем этилацетат, а затем этилацетат:метанол=9:1), в результате чего получают 640 мг масла.
[α]D=+31,8° (С=0,99, МеОН, 28°С).
1H-ЯМР (400 МГц, CDCl3) δ 1,40-1,70 (5Н, м), 1,75-1,85 (1Н, м), 2,23 (1Н, м), 2,26 (1Н, м), 2,47-2,84 (1Н, м), 2,51 (1Н, дд, J=15,6, 8,4 Гц), 2,69-2,75 (1Н, м), 2,83 (1Н, дд, J=15,6 4,0 Гц), 3,11-3,18 (1Н, м), 3,42 (1Н, д, J=16,0 Гц), 3,68 (1Н, д, J=16,0 Гц), 3,94 (3Н, с), 4,21 (2Н, с), 4,33 (2Н, с), 6,86 (1Н, дд, J=6,8 6,8 Гц), 7,70 (1Н, дд, J=6,8 2,0 Гц), 8,04 (1Н, дд, J=6,8 2,0 Гц).
Пример 176
N1,N1-Ди(2-пропинил)-3-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]пропанамид
500 мг этил-3-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]пропаноата, 2 мл 2 н. водного гидроксида натрия и 2 мл метанола перемешивают при 60°С в течение 2 часов. После охлаждения до комнатной температуры добавляют 4 мл 1 н. водной соляной кислоты и растворитель выпаривают. К остатку добавляют этанол, нерастворившиеся вещества отфильтровывают и растворитель выпаривают. Полученное масло (500 мг), 170 мг дипропаргиламина, 450 мг WSC и 240 мг HOBt растворяют в ДМФ, а затем перемешивают при комнатной температуре в течение 3 часов. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1-1:1, а затем этилацетат), в результате чего получают 300 мг масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,52 (4H, м), 1,60-1,75 (2Н, м), 1,91-2,02 (2Н, м), 2,10-2,25 (3Н, м), 2,44-2,53 (3Н, м), 2,76-2,83 (1Н, м), 3,29 (1Н, д, J=14,8 Гц), 3,83 (1Н, д, J=14,8 Гц), 3,94 (3Н, с), 4,99 (2Н, с), 4,30 (2Н, с), 6,83 (1Н, дд, J=6,8 Гц, 6,8 Гц), 7,69 (1Н, д, J=6,8 Гц), 8,02 (1Н, д, J=6,8 Гц).
Пример 177
N1-(3-Фторбензил)-2-[1-[2-(2-метокси-3-пиридил)этил]-2-пиперидил]ацетамид
200 мг 2-(2-метокси-3-пиридил)ацетальдегида, 400 мг N1-(3-фторбензил)-2-(2-пиперидил)ацетамида, 440 мг триацетоксиборогидрида натрия и 0,12 мл уксусной кислоты суспендируют в ТГФ, а затем перемешивают при комнатной температуре в течение 1 часа. Затем добавляют водный бикарбонат натрия и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. После отфильтровывания осушителя растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат:метанол=8:1, а затем 4:1), в результате чего получают 370 мг желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,75 (6Н, м), 2,26-2,34 (1Н, м), 2,37 (1Н, дд, J=16,8, 4,4 Гц), 2,57-2,80 (5Н, м), 2,93-3,00 (1Н, м), 3,06-3,13 (1Н, м), 3,91 (3Н, с), 4,20 (1Н, дд, J=15,2 5,2 Гц), 4,46 (1Н, дд, J=15,2 6,4 Гц), 6,77 (1Н, дд, J=7,2 5,2 Гц), 6,88-6,98 (2Н, м), 7,01 (1Н, дд, J=7,6 1,0 Гц), 7,22-7,30 (2Н, м), 8,01 (1Н, дд, J=5,2 2,0 Гц), 8,81 (1Н, шир.с).
Пример 178
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-2-[3-(2-пиридил)пропил]пиперидин
В ДМФ растворяют 2,1 г дигидрохлорида трифенил(2-пиридилметил)фосфония, а затем добавляют, размешивая при комнатной температуре, 1,4 г трет-бутоксида калия. Через 15 минут в вышеупомянутый раствор при комнатной температуре и при перемешивании по каплям добавляют раствор 1,25 г 2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетальдегида, растворенного в ДМФ, и смесь оставляют на ночь. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1, затем этилацетат, а затем этилацетат:метанол=4:1). 760 мг полученного коричневого масла, 0,56 мл тионилхлорида и 10 мл этанола перемешивают при кипячении с обратным холодильником в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры, добавляют 2 н. водный гидроксид натрия и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1, затем этилацетат, а затем этилацетат:метанол=4:1). Полученное желтое масло (350 мг) растворяют в 10 мл этанола, добавляют 100 мг 10% палладия на угле (продукта, содержащего воду) и смесь каталитически восстанавливают при нормальном давлении и при перемешивании в течение 1,5 часов. Катализатор отфильтровывают и растворитель выпаривают. Остаток очищают хроматографией на NH-силикагеле (этилацетат, а затем этилацетат:метанол=4:1) и получают 310 мг масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,86 (10Н, м), 2,16-2,24 (1Н, м), 2,40-2,48 (1Н, м), 2,73-2,82 (3Н, м), 3,30 (1Н, д, J=16,0 Гц), 3,77 (1Н, д, J=16,0 Гц), 6,33 (1Н, дд, J=6,8, 6,8 Гц), 7,05-7,13 (2Н, м), 7,35 (1Н, д, J=6,8 Гц), 7,55 (1Н, ддд, J=7,0, 7,0, 2,0 Гц), 7,63 (1Н, д, J=6,8 Гц), 8,50 (1Н, д, J=5 Гц).
Пример 179
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-2-(2-фенилэтил)пиперидин
Указанное в заголовке соединение получают с использованием соединения, полученного в сравнительном примере 31, способом, описанным в примере 163.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,46 (1Н, м), 1,48-1,64 (3Н, м), 1,66-1,98 (4Н, м), 2,20-2,28 (1Н, м), 2,48-2,77 (3Н, м), 2,78-2,86 (1Н, м), 3,34 (1Н, д, J=16 Гц), 3,85 (1Н, д, J=16,0 Гц), 6,32 (1Н, дд, J=6,8, 6,8 Гц), 7,13-7,34 (6Н, м), 7,63 (1Н, д, J=6,8 Гц).
Пример 180
1-[(2-Оксо-1-циклопропилметил-1,2-дигидро-3-пиридинил)метил]-2-[(3-пиридил)пропил]пиперидин
300 мг 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-[3-(2-пиридил)пропил]пиперидина, полученного в примере 178, 0,2 мл (бромметил)циклопропана и 610 мг карбоната калия суспендируют в 5 мл N,N-диметилформамида (ДМФ) и смесь перемешивают при 80°С в течение 4 часов. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. Осушитель отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (гексан:этилацетат=2:1, затем 1:1, а затем этилацетат) с получением 150 мг целевого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,36-0,42 (2Н, м), 0,57-0,64 (2Н, м), 1,20-1,90 (11Н, м), 2,15-2,23 (1Н, м), 2,39-2,47 (1Н, м), 2,72-2,82 (3Н, м), 3,29 (1Н, д, J=16,4 Гц), 3,75 (1Н, д, J=16,4 Гц), 3,81 (2Н, д, J=7,2 Гц), 6,19 (1Н, дд, J=6,8, 6,8 Гц), 7,05-7,14 (2Н, м), 7,27 (1Н, дд, J=6,8, 2 Гц), 7,50-7,58 (2Н, м), 8,48-8,52 (1Н, м).
Пример 181
N1-Бензил-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
К этанолу (5 мл) добавляют 250 мг N1-бензил-2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидинил]ацетамида, полученного в примере 173, и 0,11 мл тионилхлорида, а затем перемешивают при 100°С в течение 1,5 часа. Растворитель выпаривают, к остатку добавляют разбавленный водный гидроксид натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, а затем выпаривают с получением 180 мг целевого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,43 (2Н, м), 1,50-1,82 (4Н, м), 2,07-2,16 (1Н, м), 2,50-2,60 (1Н, м), 2,67-2,80 (2Н, м), 2,83-2,90 (1Н, м), 3,30 (1Н, д, J=14,4 Гц), 3,89 (1Н, д, J=14,4 Гц), 4,33 (1Н, дд, J=14,8 2,8 Гц), 4,51 (1Н, дд, J=14,8 2,0 Гц), 6,05 (1Н, дд, J=6,8 6,8 Гц), 7,06 (1Н, дд, J=6,8 2,0 Гц), 7,11 (1Н, дд, J=6,8 2,0 Гц), 7,18-7,32 (5Н, м), 8,67-8,74 (1Н, м).
Пример 182
N1-(2-Циклопропилэтил)-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиридинил]ацетамид
500 мг N1-(3-фторбензил)-2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетамида, полученного в примере 174, и 2 н. водной соляной кислоты перемешивают при 90°С в течение 3,5 часов. После охлаждения до комнатной темпераутры смесь подщелачивают добавлением 2 н. водного гидроксида натрия и экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. Осушитель отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-форме силикагеля (гексан:этилацетат=1:1, затем этилацетат, а затем этилацетат:метанол=4:1) с получением 270 мг бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,32-1,88 (6Н, м), 2,10-2,21 (1Н, м), 2,52-2,63 (1Н, м), 2,69-2,80 (2Н, м), 2,87-2,95 (1Н, м), 3,29 (1Н, д, J=13,6 Гц), 3,94 (1Н, д, J=13,6 Гц), 4,30 (1Н, дд, J=15,2, 5,2 Гц), 4,51 (1Н, дд, J=15,2, 6,4 Гц) 6,11 (1Н, дд, J=6,8, 6,8 Гц), 6,85-7,10 (4Н, м), 7,17-7,26 (2Н, м), 8,86-8,94 (1Н, м).
Пример 183
N1-(2-Циклопропилэтил)-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
400 мг 2-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил)уксусной кислоты, полученной в примере 34, 200 мг 2-циклопропилэтиламина, 370 мг WSC, 100 мг HOBt, 0,42 мл триэтиламина и 10 мл ДМФ перемешивают при комнатной температуре в течение ночи. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия и растворитель выпаривают. 310 мг полученного масла добавляют к 0,23 мл тионилхлорида и 5 мл этанола и смесь перемешивают при кипячении с обратным холодильником при комнатной температуре в течение 1 часа. Затем добавляют водный разбавленный гидроксид натрия и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия, а затем растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-форме силикагеля (гексан:этилацетат=2:1, затем этилацетат, а затем этилацетат:метанол=10:1, затем 4:1) с получением 290 мг желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ -0,08-0,08 (2Н, м), 0,35-0,40 (2Н, м), 0,58-0,68 (1Н, м), 1,30-1,80 (8Н, м), 2,10-2,20 (1Н, м), 2,45-2,53 (1Н, с), 2,65-2,74 (2Н, м), 2,88-2,95 (1Н, м), 3,13-3,22 (1Н, м), 3,33 (1Н, д, J=14,4 Гц), 3,35-3,45 (1Н, м), 3,91 (1Н, д, J=14,4 Гц), 6,30 (1Н, дд, J=6,8, 6,8 Гц), 7,33 (1Н, дд, J=6,8, 2,0 Гц), 7,44 (1Н, дд, J=6,8, 2,0 Гц).
Пример 184
N1-Циклопропилметил-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 183.
1H-ЯМР (400 МГц, CDCl3) δ 0,25-0,30 (2Н, м), 0,40-0,47 (2Н, м), 0,88-1,00 (1Н, м), 1,30-1,80 (6Н, м), 2,10-2,20 (1Н, м), 2,42-2,50 (1Н, м), 2,67-2,78 (2Н, м), 2,90-3,02 (2Н, м), 3,19-3,27 (1Н, м), 3,34 (1Н, д, J=14,4 Гц), 3,94 (1Н, д, J=14,4 Гц), 6,30 (1Н, дд, J=6,8, 6,8 Гц), 7,35 (1Н, дд, J=6,8, 2 Гц), 7,49 (1Н, дд, J=6,8, 2,0 Гц), 8,20 (1Н, м).
Пример 185
N1-(4-Фторфенил)-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 183.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,84 (6Н, м), 2,49 (1Н, дд, J=16,4, 4,4 Гц), 2,57-2,65 (1Н, м), 2,97-3,06 (2Н, м), 3,11 (1Н, дд, J=16,4, 4 Гц), 4,22 (1Н, д, J=12,8 Гц), 6,09 (1Н, дд, J=6,8, 6,8 Гц), 6,64 (1Н, дд, 6,8, 2,0 Гц), 6,81-6,89 (2Н, м), 7,35 (1Н, дд, J=6,8, 2,0 Гц), 7,50-7,58 (2Н, м), 10,68 (1Н, с).
Пример 186
N1-(2-Пиридилметил)-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 183.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,80 (6Н, м), 2,13-2,22 (1Н, м), 2,05-2,63 (1Н, м), 2,70-2,82 (2Н, м), 2,88-2,95 (1Н, м), 3,35 (1Н, д, J=14,8, 2,0 Гц), 3,92 (1Н, д, J=14,8, 2,0 Гц), 4,49 (1Н, дд, J=16,0, 5,2 Гц), 4,64 (1Н, дд, 16,0, 2,0 Гц), 6,16 (1Н, дд, J=6,8, 6,8 Гц), 7,12-7,17 (1Н, м), 7,22 (1Н, дд, 6,8, 2,0 Гц), 7,25-7,32 (1Н, м), 7,45 (1Н, дд, J=6,8, 2,0 Гц), 7,58-7,64 (1Н, м), 8,47-8,52 (1Н, м), 8,86-8,93 (1Н, м).
Пример 187
N1-(2-Циклопропилэтил)-2-[1-[[1-(циклопропилметил)-2-оксо-1,2-дигидро-3-пиридинил]метил]-2-пиперидил]ацетамид
300 мг N1-(2-циклопропилэтил)-2-[1-(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиридинил]ацетамида, полученного в примере 183, 0,2 мл (бромметил)циклопропана и 470 мг раствора карбоната калия суспендируют в 5 мл N,N-диметилформамида (ДМФ) и смесь перемешивают при 80°С в течение 4 часов. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. Осушитель отфильтровывают и растворитель выпаривают. Остаток очищают хроматографией на NH-силикагеле (гексан:этилацетат=2:1, затем 1:1, а затем этилацетат) с получением 150 мг целевого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,02-0,08 (2Н, м), 0,37-0,45 (4Н, м), 58-0,74 (3Н, м), 1,20-1,84 (9Н, м), 2,02-2,21 (1Н, м), 2,49-2,73 (3Н, м), 2,87-2,96 (1Н, м), 3,17-3,27 (1Н, м), 3,33 (1Н, д, J=14,4 Гц), 3,32-3,43 (1Н, м), 3,81 (1Н, д, J=6,8 Гц), 3,90 (1Н, д, J=14,4 Гц), 6,19 (1Н, дд, J=6,8, 6,8 Гц), 7,31 (1Н, дд, J=6,8, 2 Гц), 7,36 (1Н, дд, J=6,8, 2 Гц), 8,14-8,20 (1Н, м).
Пример 188
N1-(3-Фторбензил)-2-[1-[[1-(циклопропилметил)-2-оксо-1,2-дигидро-3-пиридинил]метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 187.
1H-ЯМР (400 МГц, CDCl3) δ (1Н, м), 1,30-1,85 (6Н, м), 2,09-2,18 (1Н, м), 2,55-2,78 (3Н, м), 2,87-2,96 (1Н, м), 3,27 (1Н, д, J=14,6 Гц), 3,56-3,70 (2Н, м), 3,98 (1Н, д, J=14,6 Гц), 4,38 (1Н, дд, J=15,2, 5,2 Гц), 4,57 (1Н, дд, J=15,2, 6,4 Гц), 6,09 (1Н, дд, J=6,8, 6,8 Гц), 7,00-7,26 (5Н, м), 7,29 (1Н, дд, J=6,8, 2,0 Гц), 8,98-9,06 (1Н, м).
Пример 189
N1-(4-Фторфенил)-2-[1-[[1-(циклопропилметил)-2-оксо-1,2-дигидро-3-пиридинил]метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 187.
1H-ЯМР (400 МГц, CDCl3) δ 0,30-0,40 (2Н, м), 0,56-0,63 (2Н, м), 1,15-1,25 (1Н, м), 1,30-1,87 (6Н, м), 2,16-2,24 (1Н, м), 2,60-2,73 (2Н, м), 2,89 (1Н, дд, J=15,2, 4,0 Гц), 2,99-3,06 (1Н, м), 3,35 (1Н, д, J=13,6 Гц), 3,76 (2Н, дд, J=7,2, 1,6 Гц), 3,99 (1Н, д, J=13,6 Гц), 6,17 (1Н, дд, J=6,8, 6,8 Гц), 6,93-7,00 (2Н, м), 7,31 (1Н, дд, J=6,8, 2,0 Гц), 7,36 (1Н, дд, J=6,8, 2,0 Гц), 7,55-7,63 (2Н, м), 10,49 (1Н, с).
Пример 190
N1-(2-Пиридилметил)-2-[1-[(1-бензил-2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 187.
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,80 (6Н, м), 2,17-2,24 (1Н, м), 2,60-2,75 (2Н, м), 2,76 (1Н, м), 2,40 (1Н, м), 3,39 (1Н, д, J=6,8 Гц), 3,92 (1Н, д, J=6,8 Гц), 4,50 (1Н, дд, J=16,0, 5,2 Гц), 4,64 (1Н, дд, J=16,0, 6,0 Гц), 5,00 (1Н, д, J=14,4 Гц), 5,07 (1Н, д, J=14,4 Гц), 6,06 (1Н, дд, J=6,8, 6,8 Гц), 7,10-7,35 (9Н, м), 7,55 (1Н, ддд, J=7,6, 7,6, 1,6 Гц), 8,48-8,52 (1Н, м), 8,87-8,93 (1Н, м).
Пример 191
N1,N1-Ди(2-пропинил)-2-[(2R)-1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
600 мг N1,N1-ди(2-пропинил)-2-[(R)-1-[(2-метокси-3-пиридил)метил]-2-пиперидил]ацетамида, полученного в примере 175, и 0,45 мл тионилхлорида растворяют в 20 мл этанола и смесь кипятят с обратным холодильником в течение 1,5 часа. После охлаждения до комнатной температуры добавляют 2 н. водный гидроксид натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Безводный сульфат натрия отфильтровывают и этилацетат выпаривают. Остаток очищают хроматографией на силикагеле (этилацетат:метанол=9:1) с получением 530 мг целевого масла.
[α]D=+37,9° (C=0,23, MeOH, 26°C).
1H-ЯМР (400 МГц, CDCl3) δ 1,40-1,70 (5Н, м), 1,81 (1Н, м), 2,22 (1Н, с), 2,28 (1Н, с), 2,37 (1Н, м), 2,53 (1Н, дд, J=15,6, 8,4 Гц), 2,75 (1Н, м), 2,88 (1Н, дд, J=15,6, 4,0 Гц), 3,19 (1Н, м), 3,40 (1Н, д, J=16,0 Гц), 3,68 (1Н, д, J=16,0 Гц), 4,16-4,40 (4Н, м), 6,32 (1Н, т, J=6,8 Гц), 7,34 (1Н, д, J=6,8 Гц), 7,60 (1Н, д, J=6,8 Гц).
Пример 192
N1,N1-Ди(2-пропинил)-2-[(2R)-1-[(1-циклопропилметил)-2-оксо-1,2-дигидро-3-пиридинил)метил]гексагидро-2-пиридинил]ацетамид
200 мг N1,N1-ди(2-пропинил)-2-[(2R)-1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамида, полученного в примере 95, 0,09 мл (бромметил)циклопропана и 510 мг карбоната калия суспендируют в 10 мл ДМФ и смесь перемешивают при 80°С в течение 1,5 часов. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия. Безводный сульфат натрия отфильтровывают и этилацет выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (гексан:этилацетат=2:1, затем 1:1) с получением 100 мг целевого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,35-0,42 (2Н, м), 0,57-0,64 (2Н, м), 1,19-1,30 (1Н, м), 1,40-1,85 (6Н, м), 2,21 (1Н, с), 2,28 (1Н, с), 2,34-2,43 (1Н, м), 2,50-2,60 (1Н, м), 2,69-2,76 (1Н, м), 2,85-2,93 (1Н, м), 3,19 (1Н, шир.с), 3,40 (1Н, д, J=14,8 Гц), 3,68 (1Н, д, J=14,8 Гц), 3,75-3,86 (2Н, м), 4,18-4,40 (4Н, м), 6,20 (1Н, т, J=6,8 Гц), 7,29 (1Н, д, J=6,8 Гц), 7,50 (1Н, д, J=6,8 Гц).
Пример 193
N1,N1-Ди(2-пропинил)-2-[(2R)-1-[[1-(2-метоксиэтил)-2-оксо-1,2-дигидро-3-пиридинил]метил]гексагидро-2-пиперидинил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 192.
1H-ЯМР (400 МГц, CDCl3) δ 1,40-1,83 (6Н, м), 2,21 (1Н, с), 2,28 (1Н, с), 2,33-2,42 (1Н, м), 2,49-2,58 (1Н, м), 2,69-2,76 (1Н, м), 2,83-2,90 (1Н, м), 3,17 (1Н, шир.с), 3,32 (3Н, с), 3,39 (1Н, д, J=15,5 Гц), 3,64-3,71 (3Н, м), 4,06-4,17 (2Н, м), 4,20-4,35 (4Н, м), 6,16 (1Н, дд, J=6,8, 6,8 Гц), 7,23 (1Н, дд, J=6,8, 2 Гц), 7,49 (1Н, дд, J=6,8, 2 Гц).
Пример 194
N1,N1-Ди(2-пропинил)-2-[(2R)-1-[[2-оксо-1-(2,2,2-трифторэтил)-1,2-дигидро-3-пиридинил]метил]гексагидро-2-пиридинил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 192.
1H-ЯМР (400 МГц, CDCl3) δ 1,40-1,70 (5Н, м), 1,75-1,85 (1Н, м), 2,21 (1Н, с), 2,28 (1Н, с), 2,32-2,42 (1Н, м), 2,52 (1Н, дд, J=15,2, 8,4 Гц), 2,68-2,76 (1Н, м), 2,83 (1Н, дд, J=15,2, 4,0 Гц), 3,20 (1Н, шир.с), 3,38 (1Н, д, J=16,4 Гц), 3,66 (1Н, д, J=16,4 Гц), 4,17-4,40 (4Н, м), 4,62 (2Н, кв, J=8,8 Гц) 6,25 (1Н, дд, J=6,6, 6,8 Гц), 7,17 (1Н, д, J=6,8 Гц), 7,53 (1Н, д, J=6,8 Гц).
Пример 195
N1,N1-Ди(2-пропинил)-2-[(2R)-1-[1-[2-(диизопропиламино)этил]-2-оксо-1,2-дигидро-3-пиридинил)метил]гексагидро-2-пиридинил]ацетамид
Указанное в заголовке соединение получают с использованием соответствующего соединения способом, описанным в примере 192.
1H-ЯМР (400 МГц, CDCl3) δ 0,93 (6Н, д, J=6,8 Гц), 1,40-1,65 (5Н, м), 1,74-1,83 (1Н, м) 2,20 (1Н, с), 2,27 (1Н, с), 2,30-2,38 (1Н, м), 2,53 (1Н, дд, J=15,2, 9,2 Гц), 2,65-2,76 (3Н, м), 2,83-2,90 (1Н, м), 2,92-3,02 (2Н, м), 3,13-3,20 (1Н, м), 3,38 (1Н, д, J=15,6 Гц), 3,67 (1Н, д, J=15,6 Гц), 3,80-3,92 (2Н, м), 4,17-4,39 (4Н, м), 6,13 (1Н, дд, J=6,8, 6,8 Гц), 7,16 (1Н, дд, J=6,8, 2,0 Гц), 7,46 (1Н, дд, J=6,8, 2,0 Гц).
Пример 196
N1,N1-Ди(2-пропинил)-3-[1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]ацетамид
300 мг N1,N1-ди(2-пропинил)-3-[1-[(2-метокси-3-пиридил)метил]-2-пиперидил]пропанамида, полученного в примере 176, 0,4 мл тионилхлорида и 5 мл этанола перемешивают при кипячении с обратным холодильником в течение 1 часа, а затем смесь оставляют на ночь. После этого добавляют водный разбавленный гидроксид натрия и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. Сульфат натрия удаляют и растворитель выпаривают. Остаток очищают хроматографией на силикагеле (гексан:этилацетат=3:1, а затем этилацетат:метанол=9:1) с получением 300 мг желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,33-1,57 (4Н, м), 1,62-1,75 (2Н, м), 1,87-2,00 (2Н, м), 2,17-2,27 (2Н, м), 2,30-2,59 (4Н, м), 2,80-2,88 (1Н, м), 3,31 (1Н, д, J=16,0 Гц), 3,82 (1Н, д, J=16,0 Гц), 4,20 (2Н, с), 4,31 (2Н, с), 6,31 (1Н, дд, J=6,8 Гц), 7,33 (1Н, д, J=6,8 Гц), 7,59 (1Н, д, J=6,8 Гц).
Пример 197
N1,N1-Ди(2-пропинил)-3-[1-[(1-циклопропилметил)-2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]пропанамид
300 мг N1,N1-ди(2-пропинил)-3-[1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-2-пиперидил]пропанамида, 0,1 мл циклопропилметилбромида, 620 мг карбоната калия и 5 мл ДМФ нагревают, перемешивая, при 60°С в течение 1 часа и при 80°С в течение 1 часа. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом магния. Осушитель отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на МН-силикагеле (гексан:этилацетат=4:1, затем 2:1, а затем этилацетат) с получением 150 мг масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,35-0,75 (2Н, м), 0,57-0,71 (2Н, м), 1,20-1,30 (1Н, м), 1,30-1,55 (4Н, м), 1,61-1,75 (2Н, м), 1,90-1,97 (2Н, м), 2,15-2,28 (3Н, м), 2,43-2,58 (3Н, м), 2,80-2,87 (1Н, м), 3,29 (1Н, д, J=16,0 Гц), 3,79 (1Н, д, J=16,0 Гц), 3,80 (2Н, д, J=7,2 Гц), 4,22 (2Н, с), 4,30 (2Н, с), 6,17 (1Н, дд, J=6,8, 6,8 Гц), 7,28 (1Н, дд, J=6,8, 2,0 Гц), 7,48 (1Н, дд, J=6, 8, 2,0 Гц).
Пример 198
N1-(3-Фторбензил)-2-[1-[2-(2-оксо-1,2-дигидро-3-пиридинил)этил]-2-пиперидил]ацетамид
370 мг N1-(3-фторбензил)-2-[1-[2-(2-метокси-3-пиридил)этил]-2-пиперидил]ацетамида, полученного в примере 177, 0,44 мл тионилхлорида и 5 мл этанола перемешивают 2 часа при 100°С. Растворитель выпаривают и к остатку добавляют водный бикарбонат натрия. Смесь экстрагируют этилацетатом и сушат над сульфатом натрия. Затем осушитель отфильтровывают и растворитель выпаривают, в результате чего получают 330 мг белых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,77 (6Н, м), 2,30-2,58 (3Н, м), 2,69-2,80 (4Н, м), 2,88-2,97 (1Н, м), 3,00-3,06 (1Н, м), 4,32 (1Н, дд, J=15,2, 5,6 Гц), 4,48 (1Н, дд, J=15,2, 6,0 Гц), 6,16 (1Н, дд, J=6,8, 6,8 Гц), 6,86-6,93 (1Н, м), 6,97-7,03 (1Н, м), 7,04 (1Н, д, J=7,6 Гц), 7,16-7,26 (3Н, м), 8,80-8,86 (1Н, м).
Пример 199
N1-(3-Фторбензил)-2-[1-[2-(1-циклопропилметил)-2-оксо-1,2-дигидро-3-пиридинил)этил]-2-пиперидил]ацетамид
230 мг N1-(3-фторбензил)-2-[1-[2-(2-оксо-1,2-дигидро-3-пиридинил)этил]-2-пиперидил]ацетамида, полученного в примере 102, 0,08 мл циклопропилметилхлорида, 450 мг карбоната калия и 5 мл ДМФ перемешивают при 60°С в течение 1 часа. Затем добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия. Затем осушитель отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (гексан:этилацетат=1:1, а затем этилацетат) в результате чего получают 180 мг бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,30-0,35 (2Н, м), 0,54-0,60 (2Н, м), 1,12-1,22 (1Н, м), 1,28-1,48 (6Н, м), 2,32-2,40 (1Н, м), 2,45-2,63 (3Н, м), 2,67-2,91 (4Н, м), 2,95-3,02 (1Н, м), 3,65-3,77 (2Н, м), 4,29 (1Н, дд, J=15,2, 5,2 Гц), 4,49 (1Н, дд, J=15,2, 5,6 Гц), 6,08 (1Н, дд, J=6,8, 6,8 Гц), 6,87-7,11 (4Н, м), 7,20-7,27 (1Н, м), 8,86 (1Н, шир.с).
Пример 200
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[3-(2-тиенил)пропил]пиперидин
159 мг указанного в заголовке соединения получают в виде бесцветных кристаллов из 206 мг 1-[(2-метокси-3-пиридил)метил]-4-(3-(2-тиенил)пропил)пиперидина, который был получен в примере 77.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,36 (5Н, м), 1,62-1,76 (4Н, м), 2,02-2,10 (2Н, м), 2,81 (2Н, т, J=7,6 Гц), 2,87-2,94 (2Н, м), 3,46 (2Н, с), 6,33 (1Н, дд, J=6,6, 6,6 Гц), 6,77 (1Н, дд, J=3,3, 1,1 Гц), 6,91 (1Н, дд, J=5,1, 3,3 Гц), 7,10 (1Н, дд, J=5,1, 1,1 Гц), 7,36 (1Н, д, J=6,6 Гц), 7,52 (1Н, м).
Пример 201
1-[(2-Метокси-3-пиридинил)метил]-4-[(2-метоксифенокси)метил]пиперидин
200 мг 2-метокси-3-(хлорметил)пиридина, 380 мг 4-[(2-метоксифенокси)метил]пиперидина и 235 мг карбоната калия добавляют к 10 мл ацетонитрила и смесь перемешивают при комнатной температуре в течение 3 часов 15 минут. После фильтрации реакционного раствора растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (гексан:этилацетат=3:2) с получением 359 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,48 (2Н, м), 1,84-1,97 (3Н, м), 2,05-2,14 (2Н, м), 2,94 (2Н, шир.д, J=11,6 Гц), 3,51 (2Н с), 3,86 (3Н, с), 3,87 (2Н, с), 3,95 (ЗН, с), 6,85-6,94 (5Н, м), 7,66 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 202
1-[(2-Метокси-3-пиридинил)метил]-4-[(2-фторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,52 (2Н, м), 1,86 (3Н, шир.д, J=8,8 Гц), 2,10 (2Н, шир.т, J=12,0 Гц), 2,94 (2Н, шир.д, J=8,4 Гц), 3,51 (2Н, с), 3,87 (2Н, д, J=6,0 Гц), 3,95 (3Н, с), 6,84-6,93 (2Н, м), 6,90-7,00 (1Н, м), 7,04 (1Н, т, J=7,6 Гц), 7,00-7,14 (1Н, м), 7,66 (1Н, дд, J=7,6, 2,0 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 203
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[(2-фторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,36-1,52 (2Н, м), 1,87 (3Н, шир.д, J=8,8 Гц), 2,12 (2Н, шир.т, J=10,8 Гц), 2,92 (2Н, шир.д, J=11,6 Гц), 3,46 (2Н, с), 3,88 (2Н, д, J=6,0 Гц), 3,93 (3Н, с), 6,84-6,93 (1Н, м), 6,95 (1Н, т, J=8,0 Гц), 7,00-7,14 (2Н, м), 7,64-7,70 (1Н, м), 7,98 (1Н, д, J=2,0 Гц).
Пример 204
1-[(2-Метокси-3-пиридинил)метил]-4-[(2-циклогексилметилокси)феноксиметил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,01-1,12 (2Н, м), 1,13-1,36 (3Н, м), 1,38-1,50 (2Н, м), 1,64-1,94 (9Н, м), 2,06-2,15 (2Н, м), 2,94 (2Н, шир.д, J=11,6 Гц), 3,51 (2Н, с), 3,78 (2Н, д, J=6,0 Гц), 3,84 (2Н, д, J=6,0 Гц), 3,95 (3Н, с), 6,84-6,92 (5Н, м), 7,67 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 205
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[[2-(2-циклогексилэтил)фенокси]метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 0,87-0,99 (2Н, м), 1,009-1,34 (4Н, м), 1,42-1,54 (4Н, м), 1,60-1,90 (8Н, м), 2,08-2,16 (2Н, м), 2,58-2,64 (2Н, м), 2,96 (2Н, шир.д, J=11,2 Гц), 3,52 (2Н, с), 3,80 (2Н, д, J=5,6 Гц), 3,96 (3Н, с), 6,80 (1Н, д, J=7,6 Гц), 6,83-6,90 (2Н, м), 7,10-7,16 (2Н, м), 7,68 (1Н, дд, J=4,8, 2,0 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 206
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[2-(циклогексилметилокси)феноксиметил]пиперидин
150 мг 5-хлор-2-метокси-3-пиридинкарбоксальдегида и 291 мг 4-[2-(циклогексилметилокси)феноксиметил]пиперидина растворяют в 5 мл 1,2-дихлорэтана. К смеси добавляют 0,06 мл уксусной кислоты и 214 мг триацетоксиборогидрида натрия, а затем смесь перемешивают в течение ночи при комнатной температуре. К реакционному раствору добавляют водный насыщенный бикарбонат натрия, а затем смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=10:1) с получением 285 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,01-1,36 (5Н, м), 1,39-1,52 (2Н, м), 1,65-1,94 (9Н, м), 2,08-2,16 (2Н, м), 2,92 (2Н, шир.д, J=11,6 Гц), 3,46 (2Н, с), 3,78 (2Н, д, J=6,4 Гц), 3,85 (2Н, д, J=6,4 Гц), 3,93 (3Н, с), 6,86-6,92 (4Н, м), 7,67 (1Н, д, J=2,4 Гц), 7,98 (1Н, д, J=2,4 Гц).
Пример 207
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[(2-(циклогексилметилокси)фенил]-1-этенил]пиперидин
К ацетонитрилу (10 мл) добавляют 500 мг 2-метокси-3-(хлорметил)пиридина, 1,04 г 4-[(Е)-2-[(2-(циклогексилметилокси)фенил]-1-этенил]пиперидина и 531 мг карбоната калия, а затем перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют этилацетат и смесь фильтруют через смесь окиси алюминия-силикагеля. Затем растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (гексан:этилацетат=8:1) с получением 961 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,02-1,38 (5Н, м), 1,52-1,92 (10Н, м), 2,10-2,23 (3Н, м), 2,92-2,98 (2Н, м), 3,53 (2Н, с), 3,77 (2Н, д, J=6,0 Гц), 3,96 (3Н, с), 6,19 (1Н, дд, J=16,0, 7,2 Гц), 6,71 (1Н, д, J=16,0 Гц), 6,80-6,92 (3Н, м), 7,15 (1Н, дт, J=7,2, 1,2 Гц), 7,41 (1Н, дд, J=7,2, 1,6 Гц), 7,67 (1Н, дд, J=7,6, 2,0 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 208
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[(Е)-2-[(2-(2-фторфенил)-1-этенил]пиперидин
200 мг 5-хлор-2-метокси-3-пиридинкарбоксальдегида и 263 мг 4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидина растворяют в 5 мл 1,2-дихлорэтана. К смеси добавляют 0,09 мл уксусной кислоты и 339 мг триацетоксиборогидрида натрия, а затем смесь перемешивают при комнатной температуре в течение 2,5 часов. Реакционный раствор фильтруют через NH-форму силикагеля и фильтрат выпаривают. К остатку добавляют этилацетат, смесь фильтруют через окись алюминия и фильтрат выпаривают. Неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=10:1) с получением 245 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,53-1,69 (2Н, м), 1,75-1,83 (2Н, м), 2,10-2,24 (3Н, м), 2,85-2,96 (2Н, м), 3,47 (2Н, с), 3,93 (3Н, с), 6,25 (1Н, дд, J=16,0, 6,8 Гц), 6,55 (1Н, д, J=16,0 Гц), 7,01 (1Н, ддд, J=10,8, 8,0, 1,2 Гц), 7,07 (1Н, дт, J=8,0, 1,2 Гц), 7,16 (1Н, м), 7,44 (1Н, дт, J=8,0, 1,2 Гц), 7,68 (1Н, д, J=2,4 Гц), 7,99 (1Н, д, J=2,4 Гц).
Пример 209
1-[(5-Циано-2-метокси-3-пиридинил)метил]-4-[(Е)-(2-фторфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,53-1,66 (2Н, м), 1,76-1,84 (2Н, м), 2,12-2,26 (3Н, м), 2,85-2,92 (2Н, м), 3,48 (2Н, с), 4,01 (3Н, с), 6,26 (1Н, дд, J=16,0, 6,8 Гц), 6,56 (1Н, д, J=16,0 Гц), 7,01 (1Н, ддд, J=11,2, 8,4, 1,2 Гц), 7,08 (1Н, дт, J=8,4, 1,2 Гц), 7,17 (1Н, м), 7,45 (1Н, дт, J=8,4, 1,2 Гц), 7,95 (1Н, д, J=2,4 Гц), 8,37 (1Н, д, J=2,4 Гц).
Пример 210
1-[(5-Фтор-2-метокси-3-пиридил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин
117 мг 5-фтор-2-метокси-3-пиридинкарбоксальдегида и 291 мг 4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидина растворяют в 3 мл 1,2-дихлорэтана, добавляют 0,06 мл уксусной кислоты и 238 мг триацетоксиборогидрида натрия и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют водный насыщенный карбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=8:1) с получением 221 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,53-1,69 (2Н, м), 1,75-1,83 (2Н, м), 2,11-2,25 (3Н, м), 2,89-2,96 (2Н, м), 3,48 (2Н, с), 3,93 (3Н, с), 6,26 (1Н, дд, J=16,0, 6,8 Гц), 6,55 (1Н, д, J=16,0 Гц), 7,01 (1Н, ддд, J=10,4, 8,0, 1,2 Гц), 7,07 (1Н, дт, J=8,0, 1,2 Гц), 7,16 (1Н, м), 7,44 (1Н, дт, J=8,0, 1,2 Гц), 7,53 (1Н, дд, J=8,4, 3,2 Гц), 7,87 (1Н, д, J=3,2 Гц).
Пример 211
1-[(5-Фтор-2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-циклогексилметилокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,03-1,38 (5Н, м), 1,52-1,93 (10Н, м), 2,12-2,24 (3Н, м), 2,89-2,96 (2Н, м), 3,48 (2Н, с), 3,78 (2Н, д, J=6,0 Гц), 3,93 (3Н, с), 6,20 (1Н, дд, J=16,0, 7,2 Гц), 6,72 (1Н, д, J=16,0 Гц), 6,83 (1Н, д, J=8,0 Гц), 6,88 (1Н, дт, J=7,6, 1,6 Гц), 7,15 (1Н, дт, J=7,6, 2,0 Гц), 7,41 (1Н, дд, J=7,6, 1,6 Гц), 7,53 (1Н, дд, J=8,4, 2,8 Гц), 7,87 (1Н, д, J=2,8 Гц).
Пример 212
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-хлорфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,54-1,66 (2Н, м), 1,76-1,84 (2Н, м), 2,15 (2Н, дт, J=2,4, 12,0 Гц), 2,21 (1Н, м), 2,89-2,96 (2Н, м), 3,47 (2Н, с), 3,93 (3Н, с), 6,17 (1Н, дд, J=16,0, 7,2 Гц), 6,77 (1Н, д, J=16,0 Гц), 7,14 (1Н, дт, J=8,0, 2,0 Гц), 7,20 (1Н, дт, J=8,0, 2,0 Гц), 7,33 (1Н, дд, J=8,0, 2,0 Гц), 7,51 (1Н, дт, J=8,0, 2,0 Гц), 7,68 (1Н, д, J=2,8 Гц).
Пример 213
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-метилфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,53-1,67 (2Н, м), 1,75-1,83 (2Н, м), 2,10-2,24 (3Н, м), 2,33 (3Н, с), 2,89-2,96 (2Н, м), 3,47 (2Н, с), 3,93 (3Н, с), 6,06 (1Н, дд, J=16,0, 7,2 Гц), 6,48 (1Н, дд, J=16,0, 0,8 Гц), 7,08-7,18 (3Н, м), 7,41 (1Н, д, J=6,8 Гц), 7,68 (1Н, д, J=2,8 Гц), 7,98 (1Н, д, J=2,8 Гц).
Пример 214
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-(2-метилфенил)-1-этенил]пиперидин
В N,N-диметилформамиде (10 мл) суспендируют 1,15 г бромида [(2-метилфенил)метил]трифенилфосфония. К суспензии добавляют 288 мг трет-бутоксида калия, а затем перемешивают 15 минут при охлаждении льдом. Затем по каплям добавляют раствор 500 мг 1-[(2-метокси-3-пиридинил)метил]-4-пиперидинкарбоксальдегида, растворенного в 3 мл N,N-диметилформамида, после чего перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют воду со льдом и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=1:1) с получением 473 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,48-1,68 (2Н, м), 1,74-1,83 (2Н, м), 1,96-2,22 (3Н, м), 2,19 (3/4Н с), 2,32 (9/4Н, с), 2,86 (1/2Н, шир.д, J=7,6 Гц), 2,99 (3/2Н, шир.д, J=12 Гц), 3,47 (1/2Н с), 3,52 (3/2Н, с), 3,93 (3/4Н с), 3,96 (9/4Н, с), 5,55 (1/4Н, дд, J=11,6, 10,0 Гц), 6,05 (3/4Н, дд, J=15,6, 7,6 Гц), 6,37 (1/4Н, д, J=11,6 Гц), 6,57 (3/4Н, д, J=15,6 Гц), 6,84-6,92 (1Н, м), 7,00-7,20 (3Н, м), 7,41 (1Н, д, J=6,4 Гц), 7,63 (1/4Н, дд, J=7,2, 2,0 Гц), 7,67 (3/4Н, дд, J=6,8, 2,0 Гц), 8,03-8,09 (1Н, м).
Пример 215
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[3-(бензилокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,50-1,80 (4Н, м), 2,02-2,20 (11/5Н, м), 2,56 (4/5Н, м), 2,85-2,98 (2Н, м), 3,49 (2/5Н, с), 3,52 (8/5Н, с), 3,94 (3/5Н, с), 3,96 (12/5Н, с), 5,07 (2Н, с), 5,50 (1/5Н, дд, J=11,2, 6,0 Гц), 6,17 (4/5Н, дд, J=16,0, 6,8 Гц), 6,34 (1/5Н, д, J=11,2 Гц), 6,35 (4/5Н, д, J=16,0 Гц), 6,80-6,90 (3Н, м), 6,93-7,00 (2Н, м), 7,18-7,25 (1Н, м), 7,20-7,46 (4Н, м), 7,65 (1/5Н, шир.д, J=6,4 Гц), 7,67 (4/5Н, шир.д, J=6,4 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 216
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-фенилметил)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,52-1,66 (2Н, м), 1,74-1,83 (11/6Н, м), 2,01 (1/6Н, м), 2,10-2,24 (17/6Н, м), 2,36 (1/6Н, м), 2,78-3,00 (6Н, м), 3,47 (1/3Н, с), 3,53 (5/3Н, с), 3,53 (1/2Н, с), 3,96 (5/2Н, с), 5,91 (1/6Н, дд, J=11,2, 10,0 Гц), 6,07 (5/6Н, дд, J=15,6, 6,8 Гц), 6,46 (1/6Н, д, J=11,2 Гц), 6,64 (5/6Н, д, J=15,6 Гц), 6,84-6,92 (1Н, м), 7,09-7,24 (6Н, м), 7,25-7,33 (2Н, м), 7,43 (1Н, дд, J=6,8, 2,0 Гц), 7,63 (1/5Н, шир.д, J=6,8 Гц), 7,68 (5/6Н, шир.д, J=6,8 Гц), 8,05 (1/5Н, дд, J=5,2, 2,0 Гц), 8,06 (5/6Н, дд, J=5,2, 2,0 Гц).
Пример 217
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(изобутилокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,02 (6/5Н, д, J=6,8 Гц), 1,05 (24/5Н, д, J=6,8 Гц), 1,48-1,64 (2Н, м), 1,74-1,83 (2Н, м), 2,00-2,22 (19/5Н, м), 2,51 (1/5Н, м), 2,84-2,98 (2Н, м), 3,48 (2/5Н, с), 3,52 (8/5Н, м), 3,72 (2/5Н, д, J=6,4 Гц), 3,74 (8/5Н, д, J=6,4 Гц), 3,94 (3/5Н, с), 3,96 (12/5Н, с), 5,12 (1/5Н, дд, J=11,6, 10,0 Гц), 6,21 (4/5Н, дд, J=16,0, 7,2 Гц), 6,50 (1/5Н, д, J=11,6 Гц), 6,73 (4/5Н, д, J=16,0 Гц), 6,80-6,93 (3Н, м), 7,12-7,24 (1Н, м), 7,41 (1Н, дд, J=7,6, 1,6 Гц), 7,65 (1/5Н, дд, J=6,8, 2,0 Гц), 7,67 (4/5Н, дд, J=6,8, 2,0 Гц), 8,05 (1/5Н, дд, J=5,2, 2,0 Гц), 8,06 (4/5Н, дд, J=5,2, 2,0 Гц).
Пример 218
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[3-(циклогексилметилокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 0,98-1,38 (5Н, м), 1,49-1,92 (10Н, м), 2,03-2,20 (11/4Н, м), 2,60 (1/4Н, м), 2,86-2,98 (2Н, м), 3,49 (1/2Н, с), 3,51 (3/2Н, м), 3,74 (1/2Н, д, J=6,4 Гц), 3,75 (3/2Н, д, J=6,4 Гц), 3,94 (3/4Н, с), 3,96 (9/4Н, с), 5,49 (1/4Н, дд, J=11,6, 10,0 Гц), 6,17 (4/5Н, дд, J=16,0, 6,8 Гц), 6,32 (1/4Н, д, J=11,6 Гц), 6,33 (3/4Н, д, J=16,0 Гц), 6,72-6,93 (4Н, м), 7,16-7,28 (1Н, м), 7,55 (1/4Н, дд, J=7,2, 2,0 Гц), 7,57 (3/4Н, дд, J=7,2, 2,0 Гц), 8,07 (1Н, дд, J=5,6, 2,0 Гц).
Пример 219
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(2-фенилэтокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,48-1,81 (4Н, м), 2,00-2,20 (17/6Н, м), 2,48 (1/6Н, м), 2,85-3,00 (2Н, м), 3,09 (1/3Н, т, J=6,8 Гц), 3,13 (5/3Н, т, J=6,8 Гц), 3,48 (1/3Н, с), 3,53 (5/3Н, с), 3,94 (1/2Н, с), 3,96 (5/2Н, с), 4,179 (1/3Н, т, J=6,8 Гц), 4,19 (5/3Н, т, J=6,8 Гц), 5,52 (1/6Н, дд, J=11,6, 10,0 Гц), 6,15 (5/6Н, дд, J=16,0, 7,2 Гц), 6,44 (1/6Н, д, J=11,6 Гц), 6,67 (5/6Н, д, J=16,0 Гц), 6,80-6,94 (3Н, м), 7,11-7,37 (6Н, м), 7,40 (1Н, дд, J=8,0, 1,6 Гц), 7,65 (1/6Н, шир.д, J=6,8 Гц), 7,69 (5/6Н, шир.д, J=6,8 Гц), 8,05 (1/6Н, дд, J=4,8, 2,0 Гц), 8,06 (5/6Н, дд, J=4,8, 2,0 Гц).
Пример 220
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(феноксиметил)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,46-1,78 (4H, м), 1,95-2,20 (17/6Н, м), 2,31 (1/6Н, м), 2,82-2,96 (2Н, м), 3,43 (1/3Н, с), 3,50 (5/3Н, с), 3,93 (1/2Н, с), 3,95 (5/2Н, с), 5,00 (1/3Н, с), 5,07 (5/3Н, с), 5,61 (1/6Н, дд, J=11,6, 10,0 Гц), 6,11 (5/6Н, дд, J=16,0, 6,8 Гц), 6,48 (1/6Н, дд, J=11,6 Гц), 6,62 (5/6Н, дд, J=16,0 Гц), 6,85-6,90 (1Н, м), 6,92-7,02 (2Н, м), 7,17-7,36 (5Н, м), 7,41 (1Н, дд, J=6,0, 2,0 Гц), 7,50 (1Н, дд, J=7,6, 1,2 Гц), 7,63 (1/6Н, шир.д, J=7,2 Гц), 7,65 (5/6Н, шир.д, J=7,2 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 221
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(циклопентилметилокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1Н-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (2Н, м), 1,50-1,73 (8Н, м), 1,74-1,91 (11/4Н, м), 2,00-2,22 (9/4Н, м), 2,39 (3/4Н, м), 2,51 (1/4Н, м), 2,98 (1/2Н, шир.д, J=11,6 Гц), 2,95 (3/2Н, шир.д, J=11,6 Гц), 3,48 (1/2Н, с), 3,52 (3/2Н, с), 3,84 (1/2Н, д, J=6,8 Гц), 3,85 (3/2Н, д, J=6,8 Гц), 3,94 (3/4Н, д, J=6,8 Гц), 3,96 (9/4Н, с), 5,51 (1/4Н, дд, J=12,0, 10,0 Гц), 6,21 (3/4Н, дд, J=15,6, 7,2 Гц), 6,48 (1/4Н, д, J=12,0 Гц), 6,70 (4/5Н, д, J=15,6 Гц), 6,80-6,94 (3Н, м), 7,12-7,23 (1Н, м), 7,40 (1Н, дд, J=7,6, 1,2 Гц), 7,65 (1/4Н, дд, J=7,2, 2,0 Гц), 7,67 (3/4Н, дд, J=7,2, 2,0 Гц), 8,06 (1/4Н, дд, J=5,2, 2,0 Гц), 8,07 (3/4Н, дд, J=5,2, 2,0 Гц).
Пример 222
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-[2-(2-циклогексилэтил)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 0,85-1,00 (2Н, м), 1,10-1,83 (15Н, м), 1,65-2,04 (3/4Н, м), 2,10-2,23 (2Н, м), 2,32 (1/4Н, м), 2,53-2,59 (1/2Н, м), 2,60-2,67 (3/2Н, м), 2,82-2,88 (1/2Н, м), 2,91-2,99 (3/2Н, м), 3,46 (1/2Н, с), 3,53 (3/2Н, с), 3,93 (3/4Н, с), 3,96 (9/4Н, с), 5,54 (1/4Н, дд, J=11,2, 10,0 Гц), 6,04 (3/4Н, д, J=16,0, 6,8 Гц), 6,44 (1/4Н, д, J=11,2 Гц), 6,60 (3/4Н, д, J=16,0 Гц), 6,84-6,92 (1Н, м), 7,06-7,22 (3Н, м), 7,38-7,44 (1Н, м), 7,63 (1/4Н, дд, J=7,2, 2,0 Гц), 7,67 (1/4Н, дд, J=7,2, 2,0 Гц), 8,05 (1/4Н, дд, J=4,8, 2,0 Гц), 8,06 (3/4Н, дд, J=4,8, 2,0 Гц).
Пример 223
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(циклогексилметилокси)-5-фторфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 0,97-1,38 (5Н, м), 1,48-1,92 (10Н, м), 2,01-2,23 (8/3Н, м), 2,48 (1/3Н, м), 2,85-2,98 (2Н, м), 3,48 (2/3Н, с), 3,52 (4/3Н, с), 3,71 (2/3Н, д, J=6,4 Гц), 3,72 (4/3Н, д, J=6,4 Гц), 3,94 (1Н, с), 3,96 (2Н, с), 5,55 (1/3Н, т, J=11,6 Гц), 6,20 (2/3Н, дд, J=16,0, 6,8 Гц), 6,43 (1/3Н, д, J=11,6 Гц), 6,67 (2/3Н, д, J=16,0 Гц), 6,71-6,93 (3Н, м), 7,11 (1Н, дд, J=9,6, 3,2 Гц), 7,62-7,70 (1Н, м), 8,06 (1Н, м).
Пример 224
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(циклогексилметилокси)-4-фторфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 0,97-1,38 (5Н, м), 1,47-1,81 (10Н, м), 1,99-2,21 (8/3Н, м), 2,43 (1/3Н, м), 2,85-2,97 (2Н, м), 3,47 (2/3Н, с), 3,51 (4/3Н, с), 3,72 (2/3Н, д, J=6,8 Гц), 3,73 (4/3Н, д, J=6,0 Гц), 3,94 (1Н, с), 3,96 (2Н, с), 5,50 (1/3Н, дд, J=11,6, 10,0 Гц), 6,12 (2/3Н, дд, J=16,0, 7,2 Гц), 6,38 (1/3Н, д, J=11,6 Гц), 6,52-6,66 (8/3Н, м), 6,84-6,93 (1Н, м), 7,11 (1/3Н, т, J=7,6 Гц), 7,33 (2/3Н, дд, J=8,4, 6,8 Гц), 7,62-7,70 (1Н, м), 78,03-8,11 (1Н, м).
Пример 225
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(циклогексилметилокси)-6-фторфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,04-1,38 (6Н, м), 1,44 (1Н, м), 1,52-1,65 (2Н, м), 1,68-1,91 (6Н, м), 2,10-2,22 (3Н, м), 2,90-2,98 (2Н, м), 3,52 (2Н, с), 3,78 (2Н, д, J=6,0 Гц), 3,96 (3Н, с), 6,48-6,68 (4Н, м), 6,88 (1Н, дд, J=7,6, 5,2 Гц),7,05 (1Н, дт, J=8,0, 6,4 Гц), 7,67 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 226
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-метокси-5-метилфенил)-1-этенил]пиперидина
Соединение в свободной форме получают из соответствующего исходного материала способом, описанным в примере 214, и это соединение стандартным способом превращают в оксалат с получением указанного в заголовке соединения.
1Н-ЯМР (400 МГц, CDCl3) δ 1,54-1,72 (2Н, м), 1,89 (2Н, шир.д, J=11,6 Гц), 2,23 (3Н, с), 2,30-2,54 (1Н, м), 2,90-3,06 (2Н, м), 3,35 (2Н, шир.д, J=10,8 Гц), 3,75 (3Н, с), 3,94 (3Н, с), 4,20 (2Н, с), 6,10-6,26 (1Н, м), 6,62 (1Н, д, J=16,4 Гц), 6,86 (1Н, д, J=8,4 Гц), 7,02 (1Н, дд, J=8,4, 1,6 Гц), 7,10 (1Н, дд, J=7,2, 4,8 Гц), 7,27 (1Н, с), 7,88 (1Н, д, J=6,4 Гц), 7,27 (1Н, д, J=4,4 Гц).
Пример 227
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[(Е)-2-(3-бромфенил)-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 226.
1H-ЯМР (400 МГц, CDCl3) δ 1,56-1,74 (2Н, м), 1,91 (2Н, шир.д, J=12,8 Гц), 2,36-2,50 (1Н, м), 2,90-3,06 (2Н, м), 3,35 (2Н, шир.д, J=11,2 Гц), 3,94 (3Н, с) 4,19 (2Н, с), 6,30-6,48 (2Н, м), 7,06-7,14 (1Н, м), 7,24-7,38 (1Н, м), 7,38-7,50 (2Н, м), 7,65 (1Н, с), 7,88 (1Н, д, J=7,6 Гц), 8,27 (1Н, д, J=4,4 Гц).
Пример 228
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(циклопентилокси)фенил]-1-этенил]пиперидин
786 мг диэтил-2-(циклопентилокси)бензилфосфоновой кислоты растворяют в 10 мл тетрагидрофурана. К полученной смеси добавляют 281 мг трет-бутоксида калия, а затем перемешивают при охлаждении льдом в течение 15 минут. После этого по каплям добавляют раствор 500 мг 1-[(2-метокси-3-пиридинил)метил]-4-пиперидинкарбоксальдегида, растворенного в 3 мл тетрагидрофурана, с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционному раствору добавляют ледяную воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=1:1), в результате чего получают 473 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,48-1,94 (12Н, м), 2,00-2,22 (11/4Н, м), 2,50 (1/4Н, м), 2,85-3,00 (2Н, м), 3,48 (1/2Н с), 3,52 (3/2Н, с), 3,94 (3/4Н с), 3,96 (9/4Н, с), 4,78 (1Н, м), 5,48 (1/4Н, дд, J=12,0, 10,0 Гц), 6,18 (3/4Н, дд, J=15,6, 7,2 Гц), 6,44 (1/4Н, д, J=12,0 Гц), 6,66 (3/4Н, д, J=15,6 Гц), 6,82-6,92 (11/4Н, м), 7,10-7,22 (5/4Н, м), 7,40 (1Н, дд, J=7,2, 1,6 Гц), 7,63-7,52 (1Н, м), 8,03-8,09 (1Н, м).
Пример 229
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-(2-феноксифенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 228.
1H-ЯМР (400 МГц, CDCl3) δ 1,44-1,74 (4Н, м), 1,98-2,16 (2Н, м), 2,40-2,55 (1Н, м), 2,84-2,94 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 6,20 (1Н, дд, J=16, 7,2 Гц), 6,63 (1Н, д, J=16 Гц), 6,84-7,40 (10Н, м), 7,60-7,66 (1Н, м), 8,02-8,06 (1Н, м).
Пример 230
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[3-(циклопентилокси)фенилфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 228.
1H-ЯМР (400 МГц, CDCl3) δ 1,48-1,96 (12Н, м), 2,04-2,18 (14/5Н, м), 2,61 (1/5Н, м), 2,86-2,99 (2Н, м), 3,50 (2/5Н с), 3,52 (8/5Н, с), 3,94 (3/5Н с), 3,96 (12/5Н, с), 4,72-4,80 (1Н, м), 5,49 (1/5Н, дд, J=11,6, 10,0 Гц), 6,16 (4/5Н, дд, J=15,6, 6,8 Гц), 6,33 (4/5Н, д, J=15,6 Гц), 6,34 (1/5Н, д, J=11,6 Гц), 6,70-6,94 (4Н, м), 7,15-7,25 (1Н, м), 7,63-7,70 (1Н, м), 8,04-8,08 (1Н, м).
Пример 231
1-[(2-Метокси-3-пиридинил)метил]-4-[(Е)-2-[2-(бензилокси)фенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 228.
1H-ЯМР (400 МГц, CDCl3) δ 1,48-1,82 (4Н, м), 2,00-2,23 (14/5Н, м), 2,50 (1/5Н,м), 2,85-2,98 (2Н, м), 3,48 (2/5Н с), 3,51 (8/5Н, с), 3,94 (3/5Н, с), 3,95 (12/5Н, с), 5,10 (2Н, с), 5,55 (1/5Н, дд, J=11,6, 10,0 Гц), 6,18 (4/5Н, дд, J=16,0, 7,2 Гц), 6,54 (1/5Н, д, J=11,6 Гц), 6,78 (4/5Н, д, J=16,0 Гц), 6,84-6,97 (3Н, м), 7,12-7,24 (2Н, м), 7,28-7,48 (5Н, м), 7,64 (1/5Н, шир.д, J=6,8 Гц), 7,66 (4/5Н, шир.д, J=6,8 Гц), 8,05 (1/5Н, дд, J=4,8, 2,4 Гц), 8,06 (4/5Н, дд, J=4,8, 2,4 Гц).
Пример 232
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2,5-диметилфенил)-1-этенил]пиперидина
Методом, описанным в примере 228, получают соединение в свободной форме из соответствующего исходного материала и это соединение стандартным способом превращают в оксалат с получением указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 1,54-1,74 (2Н, м), 1,88 (2Н, шир.д, J=13,2 Гц), 2,22 (3Н, с), 2,25 (3Н, с), 2,30-2,50 (1Н, м), 2,64-2,90 (2Н, м), 3,26 (2Н, шир.д, J=10,8 Гц), 3,92 (3Н, с), 4,06 (2Н, с), 6,09 (1Н, дд, J=16,0, 6,8 Гц), 6,57 (1Н, д, J=16,0 Гц), 6,94 (1Н, д, J=7,6 Гц), 7,03 (1Н, д, J=7,6 Гц), 7,08 (1Н, дд, J=7,6, 5,2 Гц), 7,26 (1Н, с), 7,85 (1Н, дд, J=7,6, 1,2 Гц), 8,23 (1Н, дд, J=5,2, 1,2 Гц).
Пример 233
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[(Е)-2-(3,5-диметилфенил)-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 232.
1H-ЯМР (400 МГц, CDCl3) δ 1,56-1,74 (2Н, м), 1,90 (2Н, шир.д, J=12,0 Гц), 2,24 (6Н, с), 2,30-2,50 (1Н, м), 2,90-3,08 (2Н, м), 3,35 (2Н, шир.д, J=11,2 Гц), 3,93 (3Н, с), 4,20 (2Н, с), 6,10-6,26 (1Н, м), 6,30-6,40 (1Н, м), 6,86 (1Н, с), 7,01 (2Н, с), 7,06-7,14 (1Н, м), 7,89 (1Н, д, J=7,2 Гц), 8,27 (1Н, д, J=4,8 Гц).
Пример 234
1-[(2-Метокси-3-пиридинил)метил]-4-[(Z)-4-[2,3-(метилендиокси)фенил]-1-бутинил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,46 (4Н, м), 1,98-2,08 (2Н, м), 2,19 (1Н м), 2,26-2,42 (2Н, м), 2,63 (2Н, т, J=8,0 Гц), 2,84 (2Н, шир.д, J=11,6 Гц), 3,47(2Н с), 3,95 (3Н, с), 5,24 (1Н, дд, J=10,4, 9,6 Гц), 5,34 (1Н,м), 5,93 (2Н, с), 6,66 (1Н, дд, J=8,0, 2,0 Гц), 6,78 (1Н, дд, J=8,0, 2,0 Гц), 6,74 (1Н, т, J=8,0 Гц), 6,87 (1Н, дд, J=7,2, 4,8 Гц), 7,63 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 235
1-[(2-Метокси-3-пиридинил)метил]-4-[(Z)-4-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин
К дихлорметану (5 мл) добавляют 2,355 г хлорида [[(2-циклогексилметилокси)фенил]метил]трифенилфосфония, 650 мг карбоната калия и 18-краун-6 (11 мг). В полученную смесь, при кипячении с обратным холодильником, в течение 20 минут по каплям добавляют 1,000 г 1-[(2-метокси-3-пиридинил)метил]-4-пиперидинкарбоксальдегида, растворенного в 10 мл дихлорметана. После кипячения с обратным холодильником в течение 6 часов к реакционному раствору добавляют этилацетат и фильтруют через NH-форму силикагеля. Фильтрат выпаривают и полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат=6:1) с получением 1,047 г светло-желтого масла. Полученное масло растворяют в этилацетате, добавляют 944 мг ди-О-бензоил-D-винной кислоты и полученные кристаллы выделяют фильтрацией. К фильтрату добавляют водный насыщенный карбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Раствор фильтруют через окись алюминия и фильтрат выпаривают с получением 374 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,98-1,36 (5Н, м), 1,52-1,92 (10Н, м), 2,00-2,10 (2Н, м), 2,51 (1Н, м), 2,84-2,92 (2Н, м), 3,48 (2Н, с), 3,75 (2Н, д, J=6,4 Гц), 3,94 (3Н, с), 5,52 (1Н, дд, J=11,6, 10,4 Гц), 6,49 (1Н, д, J=11,6 Гц), 6,80-6,94 (3Н, м), 7,15-7,25 (2Н, м), 7,65 (1Н, шир.д, J=7,2 Гц), 8,05 (1H, дд, J=5,2, 2,0 Гц).
Пример 236
1-[(2-Метокси-3-пиридинил)метил]-4-(2,2-дифенил)-1-этенил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 214.
1H-ЯМР (400 МГц, CDCl3) δ 1,52-1,68 (4Н, м), 1,90-2,02 (2Н, м), 2,14 (1H, м), 2,86 (2Н, шир.д, J=10,8 Гц), 3,46 (2Н с), 3,93 (3Н с), 5,92 (1H, д, J=10,0 Гц), 6,87 (1H, дд, J=7,2, 4,8 Гц), 7,14-7,40 (10Н, м), 7,64 (1H, шир.д, J=6,8 Гц), 8,05 (1H, дд, J=5,2, 2,0 Гц).
Пример 237
1-[(2-Метокси-3-пиридинил)метил]-4-[3-[2,3-(метилендиокси)фенил]пропил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,34 (4Н, м), 1,58-1,62 (5Н, м), 2,01 (2Н, шир.т, J=10,8 Гц), 2,55 (2Н, т, J=7,6 Гц), 2,89 (2Н, шир.д, J=11,2 Гц), 3,48 (2Н с), 3,94 (3Н, с), 5,92 (2Н, с), 6,66 (1H, дд, J=7,6, 2,0 Гц), 6,68 (1H, дд, J=7,6, 2,0 Гц), 6,75 (1H, т, J=7,6 Гц), 6,86 (1H, дд, J=7,2, 4,8 Гц), 7,64 (1H, дд, J=7,2, 2,0 Гц), 8,05 (1H, дд, J=4,8, 2,0 Гц).
Пример 238
1-[(2-Метокси-3-пиридинил)метил]-4-[5-[2,3-(метилендиокси)фенил]пентил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,16-1,38 (8Н, м), 1,55-1,70 (5Н, м), 2,01 (2Н, шир.т, J=11,6 Гц), 2,56 (2Н, т, J=8,0 Гц), 2,89 (2Н, шир.д, J=11,6 Гц), 3,48 (2Н с), 3,93 (3Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=8,0, 1,2 Гц), 6,68 (1Н, дд, J=8,0, 1,2 Гц), 6,75 (1Н, т, J=8,0 Гц), 6,86 (1Н, дд, J=7,2, 4,8 Гц), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 239
1-[(6-Метил-2-метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,52-1,59 (2Н, м), 1,67-1,76 (2Н, м), 1,99 (2Н, м), 2,42 (3Н, с), 2,55-2,62 (2Н, м), 2,88 (2Н, шир.д, J=11,6 Гц), 3,45 (2Н с), 3,92 (3Н, с), 5,92 (2Н, с), 6,07 (1Н, шир.д, J=6,8 Гц), 6,65 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, т, J=7,6 Гц), 7,49 (1Н, д, J=7,2 Гц).
Пример 240
1-[(2-Метокси-3-пиридинил)метил]-4-(2,2-дифенилэтил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,17 (1Н, м), 1,24-1,40 (2Н, м), 1,67-1,75 (2Н, м), 1,87-2,02 (4Н, м), 2,84 (2Н, шир.д, J=11,6 Гц), 3,44 (2Н, с), 3,92 (3Н, с), 4,04 (1Н, т, J=7,6 Гц), 6,85 (1Н, дд, J=6,8, 4,8 Гц), 7,14-7,30 (10Н, м), 7,62 (1Н, шир.д, J=6,8 Гц), 8,04 (1Н, дд, J=5,2, 2,0 Гц).
Пример 241
1-[(5-Бром-2-метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,40 (3Н, м), 1,54-1,65 (2Н, м), 1,68-1,79 (2Н, м), 1,98-2,09 (2Н, м), 2,56-2,64 (2Н, м), 2,86 (2Н, шир.д, J=11,6 Гц), 3,43 (2Н, с), 3,91 (3Н, с), 5,93 (2Н, с), 6,66 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,76 (1Н, т, J=7,6 Гц), 7,78 (1Н, шир.д, J=1,2 Гц), 8,07 (1Н, д, J=2,8 Гц).
Пример 242
1-[(5-Метил-2-метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,40 (3Н, м), 1,54-1,62 (2Н, м), 1,68-1,79 (2Н, м), 2,01 (2Н, шир.т, J=11,2 Гц), 2,24 (3Н, с), 2,59 (2Н, шир.т, J=8,0 Гц), 2,89 (2Н, шир.д, J=11,6 Гц), 3,45 (2Н с), 3,91 (3Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, т, J=7,6 Гц), 7,47 (1Н, шир.с), 7,84 (1Н, шир.с).
Пример 243
1-[(2-Метокси-3-пиридинил)метил]-4-[2-(2-бензилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,39 (3Н, м), 1,52-1,60 (2Н, м), 1,66-1,77 (2Н, м), 1,96-2,08 (2Н, м), 2,65-2,72 (2Н, м), 2,87 (2Н, шир.д, J=10,8 Гц), 3,48 (2Н, с), 3,95 (3Н, с), 5,08 (2Н, с), 6,85-6,93 (3Н, м), 7,12-7,18 (2Н, м), 7,28-7,46 (5Н, м), 7,66 (1Н, шир.д, J=6,8 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 244
1-[(5-Фенил-2-метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,40 (3Н, м), 1,52-1,78 (4Н, м), 2,00-2,10 (2Н, м), 2,55-2,62 (2Н, м), 2,90-2,96 (2Н, м), 3,54 (2Н, с), 3,99 (3Н, с), 5,92 (2Н, с), 6,65 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, т, J=7,6 Гц), 7,35 (1Н, м), 7,42-7,48 (2Н, м), 7,53-7,58 (2Н, м), 7,89 (1Н, д, J=2,4 Гц), 8,28 (1Н, д, J=2,4 Гц).
Пример 245
1-[(2-Метокси-3-пиридинил)метил]-4-[[2-(2-пиперидино-2-оксоэтокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,38 (2Н, м), 1,51-1,78 (11Н, м), 1,98-2,08 (2Н, м), 2,62-2,68 (2Н, м), 2,90 (2Н, шир.д, J=10,8 Гц), 3,45-3,60 (6Н, м), 3,95 (3Н, с), 4,67 (2Н, с), 6,84-6,95 (3Н, м), 7,12-7,18 (2Н, м), 7,66 (1Н, шир.д, J=6,8 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 246
1-[(2-Метокси-3-пиридинил)метил]-4-[[2-(4-пиперидинилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,15-1,32 (3Н, м), 1,45-1,54 (2Н, м), 1,57-1,68 (2Н, м), 1,99 (2Н, шир.д, J=10,4 Гц), 2,48-2,55 (2Н, м), 2,87 (2Н, шир.д, J=10,4 Гц), 3,48 (2Н, с), 3,94 (3Н, с), 6,74-6,79 (2Н, м), 6,86 (1Н, дд, J=7,2, 5,2 Гц), 7,00 (1Н, дд, J=7,6, 1,6 Гц), 7,17-7,34 (3Н, м), 7,64 (1Н, шир.д, J=6,8 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц), 8,41-8,46 (2Н, м).
Пример 247
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(1-(диметилкарбамоил)циклопентилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,41 (3Н, м), 1,47-1,58 (2Н, м), 1,68-1,82 (6Н, м), 1,98-2,10 (2Н, м), 2,11-2,20 (2Н, м), 2,38-2,40 (2Н, м), 2,56-2,64 (2Н, м), 2,91 (2Н, м), 2,92 (3Н, с), 3,09 (3Н, с), 3,51 (2Н, с), 3,95 (3Н, с), 6,67 (1Н, дд, J=7,6, 1,2 Гц), 6,82-6,91 (2Н, м), 7,04 (1Н, дд, J=7,6, 1,6 Гц), 7,11 (1Н, дд, J=7,6, 1,6 Гц), 7,66 (1Н, шир.д, J=6,0 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 248
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(бензилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,39 (3Н, м), 1,52-1,60 (2Н, м), 1,66-1,77 (2Н, м), 1,96-2,08 (2Н, м), 2,65-2,72 (2Н, м), 2,87 (2Н, шир.д, J=10,8 Гц), 3,48 (2Н, с), 3,95 (3Н, с), 5,08 (2Н, с), 6,87-6,94 (2Н, м), 7,13-7,20 (2Н, м), 7,29-7,46 (5Н, м), 7,66 (1Н, шир.с), 7,98 (1Н, д, J=2,0 Гц).
Пример 249
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[2-[2-(2-метоксиэтокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,40 (3Н, м), 1,50-1,60 (2Н, м), 1,70-1,80 (2Н, м), 2,00-2,10 (2Н, м), 2,65 (2Н, т, J=8,0 Гц), 2,87 (2Н, шир.д, J=10,8 Гц), 3,44 (2Н, с), 3,46 (3Н, с), 3,76 (2Н, т, J=4,8 Гц), 3,92 (3Н, с), 4,12 (2Н, т, J=4,8 Гц), 6,84 (1Н, д, J=8,0 Гц), 6,89 (1Н, т, J=7,6 Гц), 7,10-7,18 (2Н, м), 7,66 (1Н, д, J=2,8 Гц), 7,97 (1Н, д, J=2,4 Гц).
Пример 250
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(бензиламино)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,39 (3Н, м), 1,55-1,80 (4Н, м), 1,98-2,08 (2Н, м), 2,46-2,54 (2Н, м), 2,89 (2Н, шир.д, J=11,2 Гц), 3,49 (2Н, с), 3,94 (3Н, с), 4,37 (2Н, с), 6,62 (1Н, д, J=9,6 Гц), 6,70 (1Н, дт, J=8,0, 1,2 Гц), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 7,05-7,14 (2Н, м), 7,24-7,42 (5Н, м), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 251
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(N-бензил-N-метиламино)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,40 (3Н, м), 1,47-1,65 (2Н, м), 1,71-1,78 (2Н, м), 1,98-2,08 (2Н, м), 2,56 (3Н, с), 2,75-2,81 (2Н, м), 2,89 (2Н, шир.д, J=11,2 Гц), 3,49 (2Н, с), 3,95 (3Н, с), 4,00 (2Н, с), 6,87 (1Н, дд, J=8,8, 5,2 Гц), 7,02-7,07 (1Н, м), 7,13-7,40 (8Н, м), 7,66 (1Н, дд, J=7,2, 1,6 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 252
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-[(циклогексилметил)амино]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 0,95-1,08 (2Н, м), 1,12-1,42 (5Н, м), 1,52-1,86 (11Н, м), 2,00-2,12 (2Н, м), 2,43-2,49 (2Н, м), 2,92 (2Н, шир.д, J=7,2 Гц), 2,98 (2Н, д, J=6,4 Гц), 3,50 (2Н, с), 3,95 (3Н, с), 6,60 (1Н, дд, J=1,2, 7,6 Гц), 6,65 (1Н, дт, J=7,6, 1,2 Гц), 6,87 (1Н, дд, J=7,2, 4,8 Гц), 7,02 (1Н, дд, J=7,6, 1,2 Гц), 7,11 (1Н, дт, J=7,6, 1,2 Гц), 7,65 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 253
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-[N-(циклогексилметил)-N-метиламино]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 0,81-0,93 (2Н, м), 1,08-1,40 (6Н, м), 1,44-1,60 (3Н, м), 1,61-1,78 (6Н, м), 1,79-1,87 (2Н, м), 1,99-2,08 (2Н, м), 2,56 (3Н, с), 2,65 (2Н, д, J=7,2 Гц), 2,68-2,74 (2Н, м), 2,90 (2Н, шир.д, J=11,2 Гц), 3,49 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 4,8 Гц), 7,01 (1Н, дт, J=7,6, 2,0 Гц), 7,08-7,20 (3Н, м), 7,66 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 254
1-[(2-Метокси-3-пиридинил)метил]-4-[2-(циклогексилметилокси)фенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,38 (5Н, м), 1,60-1,90 (10Н, м), 2,18-2,26 (2Н, м), 2,97 (1Н, м), 3,01-3,07 (2Н, м), 3,56 (2Н, с), 3,76 (2Н, д, J=6,0 Гц), 3,97 (3Н, с), 6,83 (1Н, дд, J=8,0, 1,2 Гц), 6,86-6,94 (2Н, м), 7,15 (1Н, дт, J=8,0, 1,2 Гц), 7,21 (1Н, дт, J=8,0, 1,2 Гц), 7,71 (1Н, дд, J=7,2, 2,0 Гц), 8,07 (1Н, дд, J=7,2, 2,0 Гц).
Пример 255
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[2-(2-феноксифенил)этил]пиперидина
Свободное соединение получают из соответствующего исходного материала способом, описанным в примере 201, и превращают его в оксалат стандартным методом.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,20-1,50 (3Н, м), 1,40-1,55 (2Н, м), 1,75 (2Н, шир.д, J=12,8 Гц), 2,56 (2Н, т, J=8,0 Гц), 2,60-2,80 (2Н, м), 3,18 (2Н, шир.д, J=11,2 Гц), 3,90 (3Н, с), 4,04 (2Н, с), 6,89 (3Н, д, J=8,4 Гц), 7,04-7,18 (3Н, м), 7,23 (1Н, дт, J=1,4, 7,6 Гц), 7,35 (3Н, д, J=8,0 Гц), 7,81 (1Н, дд, J=7,6, 1,6 Гц), 8,22 (1Н, дд, J=5,2, 1,6 Гц).
Пример 256
1-[(2-Метокси-3-пиридинил)метил]-4-[2-(2-метилфенил)этил]пиперидин
В этаноле (10 мл) растворяют 473 мг 1-[(2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-метилфенил)-1-этенил]пиперидина. К смеси добавляют 100 мг порошкообразного 10% палладия на угле (продукт, содержащий воду), затем перемешивают при комнатной температуре и при нормальном давлении в течение ночи, а затем в атмосфере водорода в течение 1,5 часов. Реакционный раствор фильтруют, после чего фильтрат выпаривают с получением 465 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,42 (2Н, м), 1,47-1,55 (2Н, м), 1,66-1,84 (3Н, м), 2,06 (2Н, м), 2,29 (3Н, с), 2,56-2,64 (2Н, м), 2,92 (2Н, шир.д, J=11,2 Гц), 3,50 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=8,8, 4,2 Гц), 7,06-7,16 (4Н, м), 7,66 (1Н, дд, J=8,8, 2,0 Гц), 8,06 (1Н, дд, J=4,2, 2,0 Гц).
Пример 257
1-[(2-Метокси-3-пиридинил)метил]-4-[4-[2,3-(метилендиокси)фенил]бутил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,16-1,39 (6Н, м), 1,55-1,68 (4Н, м), 1,72 (1Н, м), 2,00 (2Н, т, J=11,2 Гц), 2,57 (2Н, т, J=8,0 Гц), 2,88 (2Н, шир.д, J=11,2 Гц), 3,48 (2Н, с), 3,94 (3Н, с), 5,92 (2Н, с), 6,65 (1Н, дд, J=8,0, 2,0 Гц), 6,68 (1Н, дд, J=8,0, 2,0 Гц), 6,75 (1Н, д, J=8,0 Гц), 6,86 (1Н, дд, J=7,2, 4,8 Гц), 7,64 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 258
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(трифторметокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,45 (3Н, м), 1,48-1,60 (2Н, м), 1,73 (2Н, шир.д, J=9,6 Гц), 2,04 (2Н, шир.д, J=10,8 Гц), 2,66 (2Н, т, J=8,4 Гц), 2,91 (2Н, шир.д, J=11,2 Гц), 3,50 (2Н, с), 3,94 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 7,14-7,32 (3Н, м), 7,66 (1Н, дд, J=7,2, 1,2 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 259
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(циклопентилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,38 (3Н, м), 1,46-1,54 (2Н, м), 1,55-1,94 (10Н, м), 1,98-2,10 (2Н, м), 2,54-2,62 (2Н, м), 2,90 (2Н, шир.д, J=11,2 Гц), 3,50 (2Н, с), 3,95 (3Н, с), 4,77 (1Н, м), 6,78-6,90 (3Н, м), 7,08-7,16 (2Н, м), 7,66 (1Н, шир.д, J=6,8 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 260
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[3-(циклопентилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,52-1,95 (12Н, м), 1,96-2,08 (2Н, м), 2,54-2,62 (2Н, м), 2,90 (2Н, шир.д, J=11,2 Гц), 3,49 (2Н, с), 3,94 (3Н, с), 4,75 (1Н, м), 6,66-6,76 (3Н, м), 6,84 (1Н, дд, J=7,2, 4,8 Гц), 7,16 (1Н, м), 7,66 (1Н, шир.д, J=6,8 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 261
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(3-пиридинил)фенил]этил]пиперидин
В метаноле (50 мл) растворяют 0,3 г 1-[(2-метокси-3-пиридинил)метил]-4-[(Е)-2-(3-бромфенил)-1-этенил]пиперидина и 0,3 г 3-пиридинборной кислоты. К смеси добавляют 0,3 мл водного карбоната натрия и 0,1 г тетракис(трифенилфосфин)палладия, а затем кипятят с обратным холодильником в течение 3 часов в потоке газообразного азота. Реакционный раствор охлаждают до комнатной температуры и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле с получением 0,3 г желтого масла. Полученное масло обрабатывают способом, описанным в примере 256, и получают 0,3 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,44 (3Н, м), 1,44-1,80 (2Н, м), 1,60-1,84 (2Н, м), 1,96-2,10 (2Н, м), 2,64-2,74 (2Н, м), 2,86-2,96 (2Н, м), 3,49 (2Н, с) 3,94 (3Н, с), 6,84-6,90 (1Н, м), 7,18-7,30 (1Н, м), 7,32-7,44 (4Н, м), 7,65 (1Н, д, J=6,8 Гц), 7,87 (1Н, д, J=7,6 Гц), 8,05 (1Н, д, J=5,2 Гц), 8,58 (1Н, д, J=4,4 Гц), 8,84 (1Н, д, J=2,0 Гц).
Пример 262
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[3-[(тетрагидропиран-2-ил)метилокси]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,10-2,00 (15Н, м), 2,20-2,40 (2Н, м), 2,55-2,63 (2Н, м), 3,00-3,20 (2Н, м), 3,40-4,10 (5Н, м), 3,96 (3Н, с), 6,70-6,80 (2Н, м), 6,86-6,98 (1Н, м), 7,14-7,22 (1Н, м), 7,42-7,52 (1Н, м), 7,62-7,72 (1Н, м), 8,06-8,16 (1Н, м).
Пример 263
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-[(тетрагидропиран-2-ил)метилокси]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,40 (3Н, м), 1,40-2,00 (10Н, м), 1,97-2,10 (2Н, м), 2,57-2,68 (2Н, м), 2,90 (2Н, шир.д, J=11,2 Гц), 3,49 (2Н, с) 3,45-3,55 (1Н, м), 3,65-3,75 (1Н, м), 3,80-3,90 (1Н, м), 3,95 (3Н, с), 3,93-4,10 (2Н, м), 6,78-6,92 (3Н, м, 7,08-7,18 (2Н, м), 7,66 (1Н, дд, J=7,6, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 264
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[3-[(бензилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,38 (3Н, м), 1,52-1,76 (4Н, м), 1,96-2,08 (2Н, м), 2,56-2,64 (2Н, м), 2,85-2,94 (2Н, м), 3,49 (2Н, с), 3,95 (3Н, с), 5,05 (2Н, с), 6,76-6,83 (3Н, м), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 7,19 (1Н, т, J=8,4 Гц), 7,28-7,46 (5Н, м), 7,66 (1Н, шир.д, J=6,8 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 265
1-[(2-Метокси-3-пиридинил)метил]-4-[[2-(2-фенилэтил)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,40 (3Н, м), 1,48-1,56 (2Н, м), 1,70-1,78 (2Н, м), 2,00-2,10 (2Н, м), 2,58-2,64 (2Н, м), 2,84-2,94 (6Н, м), 3,50 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=7,2, 5,2 Гц), 7,11-7,33 (9Н, м), 7,66 (1Н, шир.д, J=7,2 Гц), 8,05 (1Н, дд, J=4, 8, 1,6 Гц).
Пример 266
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,40 (8Н, м), 1,49-1,58 (2Н, м), 1,65-1,90 (8Н, м), 1,99-2,10 (2Н, м), 2,58-2,66 (2Н, м), 2,86-2,95 (2Н, м), 3,50 (2Н, с), 3,74 (2Н, д, J=6,0 Гц), 3,95 (3Н, с), 6,78-6,90 (3Н, м), 7,08-7,16 (2Н, м), 7,66 (1Н, шир.д, J=7,6 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 267
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(изобутилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,04 (6Н, д, J=6,8 Гц), 1,26-1,38 (3Н, м), 1,50-1,58 (2Н, м), 1,70-1,78 (2Н, м), 1,99-2,15 (3Н, м), 2,60-2,67 (2Н, м), 2,86-2,94 (2Н, м), 3,49 (2Н, с), 3,72 (2Н, д, J=6,4 Гц), 3,95 (3Н, с), 6,80 (1Н, д, J=8,0 Гц), 6,82-6,90 (2Н, м), 7,08-7,16 (2Н, м), 7,66 (1Н, шир.дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 268
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[3-(циклогексилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 0,98-1,11 (2Н, м), 1,14-1,38 (6Н, м), 1,52-1,60 (2Н, м), 1,62-1,91 (8Н, м), 1,97-2,08 (2Н, м), 2,54-2,62 (2Н, м), 2,85-2,93 (2Н, м), 3,48 (2Н, с), 3,73 (2Н, д, J=6,4 Гц), 3,94 (3Н, с), 6,68-6,76 (3Н, м), 6,87 (1Н, дд, J=5,2, 7,6 Гц), 7,17 (1Н, м), 7,65 (1Н, шир.дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц) (2Н, м), 2,64 (2Н, т, J=8,0 Гц), 2,90 (2Н, шир.д, J=10,4 Гц), 3,45 (3Н, т), 3,48 (2Н, с), 3,64-3,80 (2Н, м), 3,95 (3Н, с), 4,11 (2Н, т, J=4,8 Гц), 6,80-6,92 (2Н, м), 7,10-7,18 (1Н, м), 7,42-7,74 (3Н, м), 8,02-8,08 (1Н, м).
Пример 269
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(2-метоксиэтокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,36 (3Н, м), 1,43-1,51 (2Н, м), 1,62-1,75 (2Н, м), 1,99-2,08 (2Н, м), 2,54-2,26 (2Н, м), 2,86-2,94 (2Н, м), 3,10 (2Н, т, J=6,8 Гц), 3,50 (2Н, с), 3,95 (3Н, с), 4,17 (2Н, т, J=6,8 Гц), 6,78-6,90 (3Н, м), 7,07-7,16 (2Н, м), 7,19-7,36 (5Н, м), 7,67 (1Н, шир.д, J=7,2 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 270
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(2-фенилэтокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,36 (3Н, м), 1,43-1,51 (2Н, м), 1,62-1,75 (2Н, м), 1,99-2,08 (2Н, м), 2,54-2,26 (2Н, м), 2,86-2,94 (2Н, м), 3,10 (2Н, т, J=6,8 Гц), 3,50 (2Н, с), 3,95 (3Н, с), 4,17 (2Н, т, J=6,8 Гц), 6,78-6,90 (3Н, м), 7,07-7,16 (2Н, м), 7,19-7,36 (5Н, м), 7,67 (1Н, шир.д, J=7,2 Гц), 8,06 (1Н, дд, J=5,2, 2,0 Гц).
Пример 271
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(феноксиметил)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,39 (3Н, м), 1,54-1,78 (4Н, м), 1,96-2,08 (2Н, м), 2,65-2,73 (2Н, м), 2,84-2,93 (2Н, м), 3,48 (2Н, с), 3,94 (3Н, с), 5,04 (2Н, с), 6,87 (1Н, дд, J=7,6, 5,2 Гц), 6,95-7,01 (2Н, м), 7,18-7,34 (6Н, м), 7,42 (1Н, д, J=7,6 Гц), 7,64 (1Н, шир.д, J=6,4 Гц), 8,05 (1Н, дд, J=4,8, 2,0 Гц).
Пример 272
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[2-(циклопентилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,45 (5Н, м), 1,49-1,88 (10Н, м), 1,98-2,10 (2Н, м), 2,37 (1Н, септ, J=7,4 Гц), 2,58-2,66 (2Н, м), 2,86-2,96 (2Н, м), 3,50 (2Н, с), 3,82 (2Н, д, J=6,8 Гц), 3,95 (3Н, с), 6,78-6,90 (3Н, м), 7,09-7,17 (2Н, м), 7,66 (1Н, дд, J=7,2, 2,0 Гц), 8,05 (1Н, дд, J=5,2, 2,0 Гц).
Пример 273
1-[(2-Метокси-3-пиридинил)метил]-4-[2-[(2-циклогексилэтил)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, CDCl3) δ 0,89-1,01 (2Н, м), 1,10-1,56 (10Н, м), 1,62-1,83 (8Н, м), 2,02-2,11 (2Н, м), 2,56-2,63 (4Н, м), 2,89-2,96 (2Н, м), 3,51 (2Н, с), 3,95 (3Н, с), 6,87 (1Н, дд, J=6,8, 4,8 Гц), 7,08-7,16 (4Н, м), 7,66 (1Н, дд, J=7,2, 2,0 Гц), 8,06 (1Н, дд, J=4,8, 2,0 Гц).
Пример 274
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[2-(2,5-диметилфенил)этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 256.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,55 (5Н, м), 1,80-1,90 (2Н, м), 2,19 (3Н, с), 2,22 (3Н, с), 2,45-2,55 (2Н, м), 2,65-2,85 (2Н, м), 3,15-3,25 (2Н, м), 3,91 (3Н, с), 4,04 (2Н, с), 6,87 (1Н, д, J=9,2 Гц), 6,93 (1Н, с), 6,99 (1Н, д, J=8,0 Гц), 7,07 (1Н, дд, J=7,2, 4,8 Гц), 7,80-7,85 (1Н, м), 8,20-8,25 (1Н, м).
Пример 275
Оксалат 1-[(2-метокси-3-пиридинил)метил]-4-[2-(3,5-диметилфенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 274.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,55 (5Н, м), 1,84 (2Н, шир.д, J=12,8 Гц), 2,22 (3Н, с), 2,50 (3Н, с), 2,45-2,55 (2Н, м), 2,75-2,90 (2Н, м), 3,26 (2Н, шир.д, J=10,8 Гц), 3,92 (3Н, с), 4,12 (2Н, с), 6,79 (3Н, с), 7,08 (1Н, дд, J=7,6, 5,2 Гц), 7,82-7,86 (1Н, м), 8,25 (1Н, дд, J=5,2, 2,0 Гц).
Пример 276
Соль щавелевой кислоты и 1-[(2-метокси-3-пиридинил)метил]-4-[2-(2-метокси-5-метилфенил)этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 274.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,55 (5Н, м), 1,87 (2Н, шир.д, J=11,2 Гц), 2,20 (3Н, с), 2,40-2,60 (2Н, м), 2,80-3,00 (2Н, м), 3,25-3,35 (2Н, м), 3,72 (3Н, с), 3,93 (3Н, с), 4,10-4,20 (2Н, м), 6,81 (1Н, д, J=8,4 Гц), 6,90-7,00 (2Н, м), 7,10 (1Н, дд, J=7,6, 5,6 Гц), 7,85 (1Н, д, J=7,6 Гц), 8,24-8,30 (1Н, м).
Пример 277
1-[[5-(3-Пиридинил)-2-метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,41 (3Н, м), 1,54-1,62 (2Н, м), 1,70-1,80 (2Н, м), 2,07 (2Н, шир.т, J=10,4 Гц), 2,56-2,64 (2Н, м), 2,93 (2Н, шир.д, J=11,2 Гц), 3,15 (2Н, с), 4,00 (3Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=7,6, 1,6 Гц), 6,68 (1Н, дд, J=7,6, 1,6 Гц), 6,75 (1Н, т, J=7,6 Гц), 7,38 (1Н, ддд, J=8,0, 4,8, 1,2 Гц), 7,85 (1Н, ддд, J=8,0, 2,4, 1,6 Гц), 7,92 (1Н, шир.с), 8,27 (1Н, д, J=2,4 Гц), 8,59 (1Н, дд, J=4,8, 1,6 Гц), 8,82 (1Н, дд, J=2,4, 1,2 Гц).
Пример 278
1-[(5-(4-Пиридинил)-2-метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,41 (3Н, м), 1,55-1,63 (2Н, м), 1,68-1,82 (2Н, м), 2,07 (2Н, шир.т, J=11,2 Гц), 2,56-2,64 (2Н, м), 2,92 (2Н, шир.д, J=11,2 Гц), 3,54 (2Н, с), 4,01 (3Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=8,0, 1,2 Гц), 6,68 (1Н, дд, J=8,0, 1,2 Гц), 6,75 (1Н, т, J=8,0 Гц), 7,46-7,52 (2Н, м), 7,97 (1Н, шир.с), 8,35 (1Н, д, J=2,4 Гц), 8,63-8,69 (2Н, м).
Пример 279
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[2-(2-фторфенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,40 (3Н, м), 1,50-1,65 (2Н, м), 1,70-1,80 (2Н, м), 2,04 (2Н, шир.т, J=10,8 Гц), 2,66 (2Н, д, J=7,6 Гц), 2,87 (2Н, шир.д, J=11,6 Гц), 3,43 (2Н, с), 3,92 (3Н, с), 6,96-7,08 (2Н, м), 7,12-7,22 (2Н, м), 7,66 (1Н, д, J=2,8 Гц), 7,97 (1Н, д, J=2,8 Гц).
Пример 280
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[2-[2-циклогексилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,40 (7H, м), 1,49-1,60 (2Н, м), 1,62-1,91 (9Н, м), 1,99-2,11 (2Н, м), 2,58-2,66 (2Н, м), 2,83-2,92 (2Н, м), 3,44 (2Н, с), 3,75 (2Н, д, J=6,0 Гц), 3,92 (3Н, с), 6,80 (1Н, д, J=8,0 Гц), 6,85 (1Н, дт, J=7,2, 1,2 Гц), 7,09-7,20 (2Н, м), 7,67 (1Н, д, J=2,4 Гц), 7,97 (1Н, д, J=2,4 Гц).
Пример 281
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[2-[2-(изобутилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,05 (6Н, д, J=6,8 Гц), 1,24-1,40 (3Н, м), 1,51-1,59 (2Н, м), 1,72-1,80 (2Н, м), 2,00-2,19 (3Н, м), 2,61-2,68 (2Н, м), 2,84-2,92 (2Н, м), 3,44 (2Н, с), 3,72 (2Н, д, J=6,4 Гц), 3,92 (3Н, с), 6,80 (1Н, д, J=8,0 Гц), 6,86 (1Н, дт, J=7,6, 1,2 Гц), 7,10-7,17 (2Н, м), 7,66 (1Н, д, J=2,4 Гц), 7,98 (1Н, д, J=2,4 Гц).
Пример 282
1-[(5-Хлор-2-метокси-3-пиридинил)метил]-4-[[2-(2-фенилэтил)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,26-1,42 (3Н, м), 1,39-1,56 (2Н, м), 1,70-1,80 (2Н, м), 2,02-2,11 (2Н, м), 2,58-2,65 (2Н, м), 2,84-2,95 (6Н, м), 3,44 (2Н, с), 3,92 (3Н, с), 7,12-7,34 (9Н, м), 7,66 (1Н, д, J=2,4 Гц), 7,98 (1Н, д, J=2,4 Гц).
Пример 283
1-[(5-Метилсульфонил)-2-метокси-3-пиридинил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 206.
1H-ЯМР (400 МГц, CDCl3) δ 1,04-1,40 (8Н, м), 1,51-1,58 (2Н, м), 1,64-1,90 (8Н, м), 2,04-2,12 (2Н, м), 2,60-2,68 (2Н, м), 2,82-2,91 (2Н, м), 3,08 (3Н, с), 3,49 (2Н, с), 3,75 (2Н, д, J=6,0 Гц), 4,04 (3Н, с), 6,80 (1Н, д, J=8,0 Гц), 6,85 (1Н, дт, J=8,0, 1,2 Гц), 7,11 (1Н, дд, J=8,0, 1,2 Гц), 7,15 (1Н, дт, J=8,0, 2,0 Гц), 8,18 (1Н, д, J=2,4 Гц), 8,61 (1Н, д, J=2,4 Гц).
Пример 284
1-[(4-Метокси-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 201.
1H-ЯМР (400 МГц, CDCl3) δ 1,20-1,39 (3Н, м), 1,52-1,62 (2Н, м), 1,66-1,76 (2Н, м), 2,00 (2Н, шир.т, J=11,2 Гц), 2,54-2,64 (2Н, м), 2,92 (2Н, шир.д, J=12,0 Гц), 3,53 (2Н, с), 3,86 (3Н, с), 5,92 (2Н, с), 6,65 (1Н, дд, J=7,6, 1,2 Гц), 6,67 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, т, J=7,6 Гц), 6,77 (1Н, д, J=5,6 Гц), 8,40 (1Н, д, J=5,6 Гц), 8,41 (1Н, с).
Пример 285
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метилфенил)этил]пиперидин
В этаноле (10 мл) растворяют 465 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-(2-метилфенил)этенил]пиперидина. К смеси добавляют 1,75 мл раствора 4 н. соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение 3 часов. Растворитель выпаривают, к остатку добавляют водный бикарбонат натрия и смесь экстрагируют хлороформом. Экстракт сушат над безводным сульфатом магния и растворитель выпаривают. Полученное твердое вещество перекристаллизовывают из этилацетата и получают 344 мг указанного в заголовке соединения в виде белых игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,42 (3Н, м), 1,47-1,56 (2Н, м), 1,72-1,83 (2Н, шир. д, J=9,2 Гц), 2,10 (2Н, шир.т, J=10,4 Гц), 2,30 (3Н, с), 2,56-2,64 (2Н, м), 2,95 (2Н, шир.д, J=11,2 Гц), 3,48 (2Н, с), 6,33 (1Н, т, J=6,4 Гц), 7,06-7,18 (4Н, м), 7,37 (1Н, шир.д, J=5,2 Гц), 7,57 (1Н, шир.д, J=6,0 Гц).
Пример 286
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[4-[2,3-(метилендиокси)фенил]бутил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,40 (7Н, м), 1,55-1,70 (4Н, м), 2,06 (2Н, т, J=10,4 Гц), 2,57 (2Н, т, J=7, 6 Гц), 2,92 (2Н, шир.д, J=11,2 Гц), 3,47 (2Н, с), 5,93 (2Н, с), 6,34 (1Н, т, J=6,8 Гц), 6,66 (1Н, дд, J=8,0, 2,0 Гц), 6,80 (1Н, дд, J=8,0, 2,0 Гц), 6,75 (1Н, т, J=8,0 Гц), 7,38 (1Н, м), 7,53 (1Н, шир.д, J=6,8 Гц).
Пример 287
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[3-[2,3-(метилендиокси)фенил]пропил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 28-5.
1H-ЯМР (400 МГц, CDCl3) δ 1,22-1,35 (4Н, м), 1,48-1,53 (5Н, м), 2,08 (2Н, шир.т, J=10,4 Гц), 2,56 (2Н, т, J=8,0 Гц), 2,92 (2Н, шир.д, J=11,2 Гц), 3,48 (2Н, с), 5,92 (2Н, с), 6,34 (1Н, т, J=6,8 Гц), 6,66 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, т, J=7,2 Гц), 7,37 (1Н, м), 7,54 (1Н, шир.д, J=6,4 Гц).
Пример 288
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[5-[2,3-(метилендиокси)фенил]пентил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,16-1,36 (8Н, м), 1,56-1,90 (5Н, м), 2,07 (2Н, шир.т, J=10,0 Гц), 2,57 (2Н, т, J=7,6 Гц), 2,92 (2Н, шир.д, J=10,8 Гц), 3,48 (2Н, с), 3,93 (3Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,75 (1Н, т, J=7,6 Гц), 7,38 (1Н, м), 7,54 (1Н, шир.д, J=6,0 Гц).
Пример 289
1-[(6-Метил-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,38 (3Н, м), 1,53-1,60 (2Н, м), 1,68-1,77 (2Н, м), 2,06 (2Н, м), 2,31 (3Н, с), 2,55-2,62 (2Н, м), 2,93 (2Н, шир.д, J=11,6 Гц), 3,45 (2Н с), 5,92 (2Н, с), 6,07 (1Н, шир.д, J=6,8 Гц), 6,66 (1Н, дд, J=7,6, 1,6 Гц), 6,68 (1Н, дд, J=7,6, 1,6 Гц), 6,75 (1Н, т, J=7,6 Гц), 7,41 (1Н, шир.д, J=6,8 Гц).
Пример 290
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2,2-дифенилэтил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,20 (1Н, м), 1,30-1,42 (2Н, м), 1,69-1,76 (2Н, м), 1,94-2,04 (4Н, м), 2,88 (2Н, шир.д, J=11,6 Гц), 3,43 (2Н, с), 4,04 (1Н, т, J=8,0 Гц), 6,31 (1Н, т, J=6,4 Гц), 7,14-7,19 (2Н, м), 7,21-7,30 (8Н, м), 7,34 (1Н, шир.д, J=5,2 Гц), 7,54 (1Н, шир.д, J=6,4 Гц).
Пример 291
1-[(5-Бром-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (3Н, м), 1,56-1,64 (2Н, м), 1,76-1,86 (2Н, м), 2,09-2,20 (2Н, м), 2,56-2,64 (2Н, м), 2,95 (2Н, шир.д, J=11,6 Гц), 3,57 (2Н, с), 5,93 (2Н, с), 6,65 (1Н, дд, J=7,6, 1,2 Гц), 6,68 (1Н, дд, J=7,6, 1,2 Гц), 6,76 (1Н, т, J=7,6 Гц), 7,48 (1Н, шир.с), 7,94 (1Н, шир.с).
Пример 292
1-[(5-Метил-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,41 (3Н, м), 1,54-1,62 (2Н, м), 1,72-1,80 (2Н, м), 2,08 (2Н, шир.т, J=11,2 Гц), 2,11 (3Н, с), 2,56-2,64 (2Н, м), 2,94 (2Н, шир.д, J=11,2 Гц), 3,46 (2Н, с), 5,92 (2Н, с), 6,66 (1Н, дд, J=8,0, 1,6 Гц), 6,68 (1Н, дд, J=8,0, 1,6 Гц), 6,76 (1Н, т, J=8,0 Гц), 7,17 (1Н, шир.с), 7,39 (1Н, шир.с).
Пример 293
1-[(5-Фенил-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,25-1,44 (3Н, м), 1,54-1,63 (2Н, м), 1,74-1,82 (2Н, м), 2,14 (2Н, шир.т, J=10,8 Гц), 2,56-2,64 (2Н, м), 3,00 (2Н, шир.д, J=11,2 Гц), 3,58 (2Н, с), 5,92 (2Н, с), 6,65 (1Н, дд, J=8,0, 1,2 Гц), 6,68 (1Н, дд, J=8,0, 1,2 Гц), 6,75 (1Н, т, J=8,0 Гц), 7,33 (1Н, м), 7,40-7,50 (5Н, м), 7,70 (1Н, шир.с), 7,87 (1Н, шир.с).
Пример 294
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-пиперидино-2-оксоэтокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,40 (2Н, м), 1,46-1,81 (11Н, м), 2,02-2,14 (2Н, м), 2,62-2,68 (2Н, м), 2,90-2,99 (2Н, м), 3,43-3,60 (6Н, м), 4,68 (2Н, с), 6,35 (1Н, м), 6,83-6,95 (2Н, м), 7,11-7,20 (2Н, м), 7,38 (1Н, м), 7,58 (1Н, м).
Пример 295
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[[2-(4-пиридинилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,18-1,32 (3Н, м), 1,46-1,54 (2Н, м), 1,58-1,68 (2Н, м), 2,02 (2Н, шир.д, J=10,4 Гц), 2,48-2,56 (2Н, м), 2,88 (2Н, шир.д, J=11,2 Гц), 3,44 (2Н, с), 6,32 (1Н, т, J=6,4 Гц), 6,74-6,80 (2Н, м), 7,00 (1Н, дд, J=1,2, 8,0 Гц), 7,18-7,32 (3Н, м), 7,35 (1Н, шир.д, J=6,0 Гц), 7,52 (1Н, шир.д, J=6,0 Гц), 8,42-8,46 (2Н, м).
Пример 296
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-[1-(диметилкарбамоил)циклопентилокси]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,43 (3Н, м), 1,47-1,56 (2Н, м), 1,70-1,82 (6Н, м), 2,06-2,21 (4Н, м), 2,38-2,50 (2Н, м), 2,57-2,64 (2Н, м), 2,93 (3Н, с), 2,96 (2Н, шир.д, J=11,2 Гц), 3,09 (3Н, с), 3,50 (2Н, с), 6,34 (1Н, т, J=6,4 Гц), 6,68 (1Н, дд, J=8,4, 1,2 Гц), 6,86 (1Н, дд, J=7,6, 1,2 Гц), 7,04 (1Н, дд, J=7,6, 2,0 Гц), 7,12 (1Н, дд, J=7,6, 2,0, Гц), 7,37 (1Н, м), 7,56 (1Н, шир.д, J=5,6 Гц).
Пример 297
1-[[5-(3-Пиридинил)-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,28-1,43 (3Н, м), 1,56-1,64 (2Н, м), 1,74-1,83 (2Н, м), 2,14 (2Н, шир.т, J=10,8 Гц), 2,56-2,64 (2Н, м), 2,88 (2Н, шир.д, J=10,8 Гц), 3,58 (2Н, с), 5,93 (2Н, с), 6,66 (1Н, дд, J=7,6, 1,6 Гц), 6,69 (1Н, дд, J=7,6, 1,6 Гц), 6,76 (1Н, т, J=7,6 Гц), 7,37 (1Н, ддд, J=8,0, 5,2, 0,8 Гц), 7,74 (1Н, шир.с), 7,78 (1Н, ддд, J=8,0, 2,4, 1,6 Гц), 8,84 (1Н, шир.с), 8,58 (1Н, дд, J=5,2, 1,6 Гц), 8,76 (1Н, дд, J=2,4, 0,8 Гц).
Пример 298
1-[[5-(4-Пиридинил)-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,30-1,44 (3Н, м), 1,56-1,64 (2Н, м), 1,75-1,84 (2Н, м), 2,15 (2Н, шир.т, J=10,0 Гц), 2,57-2,64 (2Н, м), 2,99 (2Н, шир.д, J=11,2 Гц), 3,58 (2Н, с), 5,93 (2Н, с), 6,66 (1Н, дд, J=7,6, 1,2 Гц), 6,69 (1Н, дд, J=7,6, 1,2 Гц), 6,76 (1Н, т, J=7,6 Гц), 7,38-7,73 (2Н, м), 7,73-7,73 (2Н, м), 8,63-8,68 (2Н, м).
Пример 299
1-[5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(бензилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,23-1,39 (3Н, м), 1,53-1,62 (2Н, м), 1,72-1,80 (2Н, м), 2,09 (2Н, шир.т, J=10,8 Гц), 2,65-2,72 (2Н, м), 2,88 (2Н, шир.д, J=11,6 Гц), 3,51 (2Н, с), 5,08 (2Н, с), 6,88-6,93 (2Н, м), 7,13-7,20 (2Н, м), 7,29-7,46 (6Н, м), 7,77 (1Н, шир.с).
Пример 300
1-[2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[3-(циклогексилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 0,98-1,11 (2Н, м), 1,14-1,42 (6Н, м), 1,53-1,62 (2Н, м), 1,65-1,92 (8Н, м), 2,05-2,16 (2Н, м), 2,55-2,63 (2Н, м), 2,90-2,99 (2Н, м), 3,49 (2Н, с), 3,74 (2Н, д, J=6,4 Гц), 6,36 (1Н, т, J=6,4 Гц), 6,68-6,77 (3Н, м), 7,17 (1Н, дт, J=7,6, 2,0 Гц), 7,36 (1Н, шир.д, J=6,0 Гц), 7,58 (1Н, шир.д, J=6,4 Гц).
Пример 301
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,43 (9Н, м), 1,52-1,60 (2Н, м), 1,66-1,90 (7Н, м), 2,10-2,20 (2Н, м), 2,59-2,66 (2Н, м), 2,94 (2Н, шир.д, J=10,4 Гц), 3,56 (2Н, с), 3,75 (2Н, д, J=5,6 Гц), 6,80 (1Н, д, J=8,0 Гц), 6,85 (1Н, дт, J=8,0, 1,6 Гц), 7,10 (1Н, дд, J=8,0, 1,6 Гц), 7,14 (1Н, дт, J=8,0, 1,6 Гц), 7,35 (1Н, д, J=2,4 Гц), 7,87 (1Н, шир.с).
Пример 302
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидина
В этаноле (4 мл) растворяют 226 мг 1-[(2-метокси-3-пиридил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидина. К смеси добавляют 1 мл раствора 4 н. соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение 1,5 часов. К реакционному раствору добавляют водный бикарбонат натрия и смесь экстрагируют дихлорметаном. Экстрат сушат над безводным сульфатом магния и растворитель выпаривают. Полученное масло растворяют в этаноле, добавляют 49 мг щавелевой кислоты и этилацетат, а затем полученные осадки собирают фильтрацией, в результате чего получают 229 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,05-1,35 (6Н, м), 1,35-1,55 (4Н, м), 1,62-1,90 (8Н, м), 2,56 (2Н, м), 2,88 (2Н, т), 3,23-3,36 (2Н, т), 3,77 (2Н, д, J=5,6 Гц), 4,00 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,83 (1Н, т, J=7,2 Гц), 6,89 (1Н, д, J=8,0 Гц), 7,09-7,17 (2Н, м), 7,52 (1Н, шир.д, J=6,4 Гц), 7,68 (1Н, шир.д, J=6,0 Гц).
Пример 303
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[3-(циклопентилокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,20-1,38 (3Н, м), 1,44-1,80 (10Н, м), 1,82-1,94 (2Н, м), 2,48-2,58 (2Н, м), 3,05 (2Н, м), 3,49 (2Н, шир.с), 3,64 (2Н, шир.с), 4,78 (1Н, шир.т, J=6,0 Гц), 6,23 (1Н, т, J=6,8 Гц), 6,66-6,75 (3Н, м), 7,15 (1Н, т, J=7,6 Гц), 7,39 (1Н, шир.д, J=5,2 Гц), 7,53 (1Н, шир.д, J=5,2 Гц).
Пример 304
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(бензилокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,44 (5Н, м), 1,76-1,86 (2Н, м), 2,60 (2Н, шир.т, J=7,6 Гц), 2,83 (2Н, м), 3,24 (2Н, шир.д, J=8,8 Гц), 3,98 (2Н, с), 5,11 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,87 (1Н, т, J=7,2 Гц), 7,13 (1Н, д, J=8,8 Гц), 7,12-7,18 (2Н, м), 7,29-7,37 (1Н, м), 7,38-7,48 (5Н, м), 7,52 (1Н, дд, J=6,4, 1,2 Гц), 7,67 (1Н, дд, J=6,4, 1,2 Гц).
Пример 305
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[3-(бензилокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,32-1,58 (5Н, м), 1,76-1,88 (2Н, м), 2,55 (2Н, м), 2,84 (1Н, м), 3,28 (2Н, м), 3,56 (2Н, м), 3,98 (2Н, шир.с), 5,08 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,76-6,88 (3Н, м), 7,19 (1Н, т, J=7,6 Гц), 7,24-7,46 (5Н, м), 7,52 (1Н, шир.д, J=6,4 Гц), 7,67 (1Н, шир.д, J=6,4 Гц).
Пример 306
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[[2-(2-фенилэтил)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,34-1,58 (3Н, м), 1,80-1,90 (2Н, м), 2,57 (2Н, шир.т, J=8,0 Гц), 2,74-2,92 (6Н, м), 3,26 (2Н, м), 3,62 (2Н, м), 3,94 (2Н, шир.с), 6,29 (1Н, д, J=6,4 Гц), 7,08-7,33 (9Н, м), 7,50 (1Н, шир.д, J=2,4 Гц), 7,66 (1Н, шир.д, J=6,4 Гц).
Пример 307
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(циклопентилокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,32-1,50 (5Н, м), 1,55-1,76 (6Н, м), 1,78-1,93 (4Н, м), 2,54-2,62 (2Н, м), 2,82 (2Н, шир.с), 3,26 (2Н м), 3,95 (2Н, шир.с), 4,83 (1Н, шир.т, J=5,6 Гц), 6,28 (1Н, т, J=6,8 Гц), 6,81 (1Н, т, J=8,0 Гц), 6,90 (1Н, д, J=8,0 Гц), 7,08-7,16 (2Н, м), 7,50 (1Н, дд, J=6,4, 2,0 Гц), 7,66 (1Н, шир.д, J=6,4 Гц).
Пример 308
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(изобутилокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,01 (6Н, д, J=6, 4 Гц), 1,26-1,40 (3Н, м), 1,42-1,51 (2Н, м), 1,72-1,81 (2Н, м), 2,03 (1Н, м), 2,46 (2Н, м), 2,53-2,60 (2Н, м), 3,06 (2Н, шир.д, J=11,2 Гц), 3,64 (2Н, шир.с), 3,72 (2Н, д, J=6,4 Гц), 6,23 (1Н, т, J=6,8 Гц), 6,83 (1Н, т, J=7,2 Гц), 6,89 (1Н, д, J=8,0 Гц), 7,09-7,16 (2Н, м), 7,40 (1Н, шир.дд, J=6,4, 2,0 Гц), 7,54 (1Н, д, J=5,2 Гц).
Пример 309
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(2-фенилэтокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,28-1,44 (5Н, м), 1,72-1,81 (2Н, м), 2,43-2,50 (2Н, м), 2,86 (2Н, м), 3,03 (2Н, т, J=6,4 Гц), 3,28 (2Н, м), 4,00 (2Н, шир.с), 4,18 (2Н, т, J=5,2 Гц), 6,31 (1Н, т, J=6,8 Гц), 6,83 (1Н, т, J=7,2 Гц), 6,94 (1Н, д, J=7,6 Гц), 7,06-7,16 (2Н, м), 7,18-7,25 (1Н, м), 7,28-7,36 (3Н, м), 7,53 (1Н, дд, J=6,0, 2,0 Гц), 7,68 (1Н, шир.д, J=5,6 Гц).
Пример 310
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(феноксиметил)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,32-1,58 (5Н, м), 1,78-1,86 (2Н, м), 2,62-2,68 (2Н, м), 2,85 (2Н, м), 3,58 (2Н, м), 3,98 (2Н, шир.с), 5,08 (2Н, с), 6,29 (1Н, т, J=6,8 Гц), 6,95 (1Н, т, J=7,2 Гц), 6,99-7,04 (2Н, м), 7,18-7,24 (5Н, м), 7,42 (1Н, дд, J=7,6, 1,2 Гц), 7,52 (1Н, дд, J=6,8, 2,0 Гц), 7,66 (1Н, шир.д, J=6,8 Гц).
Пример 311
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(циклопентилметилокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,28-1,67 (11Н, м), 1,73-1,86 (4Н, м), 2,31 (1Н, септ, J=7,3 Гц), 2,52-2,58 (2Н, м), 2,67 (2Н, м), 3,15-3,24 (2Н, м), 3,83 (2Н, д, J=6,4 Гц), 3,84 (2Н, шир.с), 6,26 (1Н, т, J=6,4 Гц), 6,82 (1Н, дт, J=6,8, 1,2 Гц), 6,90 (1Н, д, J=8,0 Гц), 7,09-7,16 (2Н, м), 7,46 (1Н, дд, J=6,4, 1,2 Гц), 7,61 (1Н, шир.д, J=5,6 Гц).
Пример 312
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[(2-циклогексилэтил)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,87-0,99 (2Н, м), 1,10-1,79 (16Н, м), 1,83-1,92 (2Н, м), 2,51-2,60 (4Н, м), 2,92 (2Н, шир.с), 3,34 (2Н, шир.с), 4,04 (2Н, шир.с), 6,03 (1Н, т, J=6,8 Гц), 7,06-7,16 (4Н, м), 7,54 (1Н, дд, J=6,8, 2,4 Гц), 7,69 (1Н, шир.д, J=10,0 Гц).
Пример 313
Дигидрохлорид 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(бензиламино)фенил]этил]пиперидина
В этаноле (8 мл) растворяют 294 мг 1-[(2-метокси-3-пиридинил)метил]-4-[2-[2-(бензиламино)фенил]этил]пиперидина. К смеси добавляют 3 мл раствора 4 н. соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение 3 часов. После охлаждения, как описано ранее, полученные осадки собирают фильтрацией и перекристаллизовывают из этанола с получением 273 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,42-1,58 (4Н, м), 1,61-1,76 (1Н, м), 1,86-1,96 (2Н, м), 2,51-2,60 (2Н, м), 2,95 (2Н, шир.т, J=11,6 Гц), 3,28 (2Н, шир.д, J=12,4 Гц), 4,06 (2Н, с), 4,36 (2Н, с), 6,31 (1Н, т, J=6,4 Гц), 6,53 (1Н, м), 6,63 (1Н, м), 6,94 (1Н, шир.т, J=7,6 Гц), 7,00 (1Н, шир.д, J=7,2 Гц), 7,18-7,37 (5Н, м), 7,54 (1Н, дд, J=6,4, 2,0 Гц), 7,79 (1Н, дд, J=6,8, 2,0 Гц).
Пример 314
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(N-бензил-N-метиламино)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,36-1,61 (5Н, м), 1,80-1,92 (2Н, м), 2,51 (3Н, с), 2,68-2,76 (2Н, м), 2,87 (2Н, м), 3,28 (2Н, шир.д, J=9,6 Гц), 3,98 (2Н, с), 4,00 (2Н, с), 6,29 (1Н, т, J=6,8 Гц), 7,01 (1Н, дт, J=7,6 Гц), 7,02 (1Н, дт, J=7,2, 1,6 Гц), 7,12-7,28 (4Н, м), 7,30-7,36 (4Н, м), 7,52 (1Н, дд, J=6,4, 2,0 Гц), 7,68 (1Н, дд, J=6,8, 2,0 Гц).
Пример 315
Дигидрохлорид 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-[(циклогексилметил)амино]фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 313.
1H-ЯМР (400 МГц, CDCl3) δ 0,93-1,06 (2Н, м), 1,10-1,26 (3Н, м), 1,46-1,66 (5Н, м), 1,66-1,81 (4Н, м), 1,82-1,96 (4Н, м), 2,67 (2Н, м), 2,90-3,04 (2Н, м), 3,00 (2Н, д, J=6,4 Гц), 3,34-3,42 (2Н, м), 4,06 (2Н, с), 6,31 (1Н, т, J=6, 8 Гц), 7,06-7,42 (4Н, м), 7,54 (1Н, дд, J=6,8, 2,0 Гц), 7,83 (1Н, дд, J=6,8, 2,0 Гц).
Пример 316
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-[N-(циклогексилметил)-N-метиламино]фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,03-1,34 (5Н, м), 1,63-2,00 (10Н, м), 3,04-3,18 (3Н, м), 3,42 (2Н, шир.д, J=12,8 Гц), 3,78 (2Н, д, J=5,6 Гц), 4,08 (2Н, с), 6,30 (1Н, т, J=6,8 Гц), 6,91 (1Н, дт, J=7,6, 1,2 Гц), 6,94 (1Н, дд, J=7,6, 1,2 Гц), 7,13 (1Н, шир.д, J=6,8 Гц), 7,18 (1Н, дт, J=8,0, 1,2 Гц), 7,54 (1Н, дд, J=6,8, 2,0 Гц), 7,73 (1Н, дд, J=6,8, 2,0 Гц).
Пример 317
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(циклогексилметилокси)фенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, CDCl3) δ 0,80-0,92 (2Н, м), 1,08-1,23 (3Н, м), 1,37-1,56 (6Н, м), 1,57-1,70 (3Н, м), 1,72-1,81 (2Н, м), 1,81-1,90 (2Н, м), 2,51 (3Н, с), 2,62 (2Н, д, J=7,2 Гц), 2,62-2,70 (2Н, м), 2,92 (2Н, м), 3,26-3,38 (2Н, м), 4,04 (2Н, с), 6,29 (1Н, т, J=6,8 Гц), 6,97-7,02 (1Н, м), 7,10-7,20 (3Н, м), 7,54 (1Н, дд, J=6,8, 2,0 Гц), 7,70 (1Н, дд, J=6,8, 2,0 Гц).
Пример 318
1-[(5-(Метилсульфонил)-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидин
В этаноле (10 мл) растворяют 138 мг 1-[(5-(метилсульфонил)-2-метокси-3-пиридинил)метил]-4-[2-[2-(циклогексилметилокси)фенил]этил]пиперидина. К смеси добавляют 1 мл тионилхлорида, а затем кипятят с обратным холодильником в течение 2,5 часа. К реакционному раствору добавляют водный раствор карбоната натрия и полученные осадки собирают фильтрацией с получением 127 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 1,05-1,45 (8Н, м), 1,53-1,61 (2Н, м), 1,67-1,90 (8Н, м), 2,15-2,27 (2Н, м), 2,60-2,68 (2Н, м), 2,92 (2Н, шир.д, J=10,8 Гц), 3,08 (3Н, с), 3,60 (2Н, с), 3,76 (2Н, д, J=6,0 Гц), 6,81 (1Н, д, J=8,0 Гц), 6,86 (1Н, дт, J=8,0, 1,2 Гц), 7,11 (1Н, дд, J=8,0, 1,2 Гц), 7,15 (1Н, дт, J=8,0, 2,0 Гц), 7,83 (1Н, шир.д, J=2,4 Гц), 8,35 (1Н, шир.м).
Пример 319
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-[2,3-(метилендиокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,08-1,23 (3Н, м), 1,42-1,50 (2Н, м), 1,60-1,70 (2Н, м), 1,88-2,00 (2Н, м), 2,40-2,60 (2Н, м), 2,73-2,83 (2Н, м), 3,24 (2Н, с), 5,95 (2Н, с), 6,64-6,76 (3Н, м), 7,34 (1Н, с), 7,50 (1Н, с).
Пример 320
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(2-фторфенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,00-1,26 (3Н, м), 1,40-1,54 (2Н, м), 1,67 (2Н, шир.д, J=9,6 Гц), 1,94 (2Н, шир.т, J=10,4 Гц), 2,60 (2Н, д, J=7,6 Гц), 2,77 (2Н, шир.д, J=11,6 Гц), 3,24 (2Н, с), 7,06-7,13 (2Н, м), 7,17-7,24 (1Н, м), 7,27 (1Н, т, J=7,6 Гц), 7,34 (1Н, д, J=2,0 Гц), 7,50 (1Н, д, J=3,2 Гц).
Пример 321
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(2-метоксиэтокси)фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,10-1,25 (3Н, м), 1,40-1,50 (2Н, м), 1,67 (2Н, шир.д, J=8,8 Гц), 1,95 (2Н, шир.т, J=10,8 Гц), 2,54 (2Н, т, J=8,0 Гц), 2,76 (2Н, шир.д, J=11,2 Гц), 3,24 (2Н, с), 3,31 (3Н, с), 3,65 (2Н, т, J=4,4 Гц), 4,05 (2Н, т, J=4,4 Гц), 6,83 (1Н, т, J=7,2 Гц), 6,90 (1Н, д, J=8,0 Гц), 7,10 (1Н, д, J=7,6 Гц), 7,06-7,14 (1Н, м), 7,34 (1Н, д, J=2,8 Гц), 7,50 (1Н, д, J=2,8 Гц).
Пример 322
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2,5-диметилфенил)этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,16-1,36 (3Н, м), 1,32-1,46 (2Н, м), 1,72 (2Н, шир.д, J=10,8 Гц), 2,03 (1Н, шир.с), 2,19 (3Н, с), 2,22 (3Н, с), 2,51 (2Н, т, J=7,6 Гц), 2,85 (2Н, шир.д, J=10,4 Гц), 3,20-3,42 (2Н, м), 6,18 (1Н, т, J=6,4 Гц), 6,87 (1Н, д, J=7,6 Гц), 6,92 (1Н, с), 6,99 (1Н, д, J=7, 6 Гц), 7,28 (1Н, д, J=6,4 Гц), 7,41 (1Н, д, J=6,0 Гц).
Пример 323
Оксалат 1-[(5-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(изобутилокси)]фенил]этил]пиперидина
В этаноле (10 мл) растворяют 443 мг 1-[(5-хлор-2-метокси-3-пиридинил)метил]-4-[2-[2-(изобутилокси)фенил]этил]пиперидина. К смеси добавляют 0,5 мл тионилхлорида, а затем кипятят с обратным холодильником в течение 3 часов. К реакционному раствору добавляют водный карбонат натрия и смесь экстрагируют дихлорметаном. Экстрат сушат над безводным сульфатом магния и растворитель выпаривают. Полученное масло растворяют в этаноле, добавляют 99 мг щавелевой кислоты, а затем полученные осадки собирают фильтрацией, в результате чего получают 382 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,01 (6Н, д, J=6, 8 Гц), 1,24-1,42 (3Н, м), 1,43-1,51 (2Н, м), 1,73-1,82 (2Н, м), 2,03 (1Н, м), 2,45 (2Н, м), 2,54-2,60 (2Н, м), 3,08 (2Н, шир.д, J=11,6 Гц), 3,64 (2Н, шир.с), 3,73 (2Н, д, J=6,4 Гц), 6,83 (1Н, дт, J=7,6, 1,2 Гц), 6,89 (1Н, д, J=7,6 Гц), 7,09-7,16 (2Н, м), 7,58 (1Н, д, J=2,4 Гц), 7,65 (1Н, д, J=2,4 Гц).
Пример 324
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(3,5-диметилфенил)этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,48 (5Н, шир.с), 1,84 (2Н, шир.д, J=9,2 Гц), 2,22 (6Н, с), 2,45-2,55 (2Н, м), 2,85-3,00 (2Н, м), 3,25-3,40 (2Н, м), 4,04 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,79 (3Н, с), 7,53 (1Н, дд, J=6,4, 2,0 Гц), 7,73 (1Н, дд, J=6,8, 2,0 Гц).
Пример 325
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-метокси-5-метилфенил)этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,45 (5Н, шир.с), 1,86 (2Н, шир.д, J=10,4 Гц), 2,20 (3Н, с), 2,44-2,54 (2Н, м), 2,93 (2Н, шир,с), 3,24-3,40 (2Н, м), 3,73 (3Н, с), 4,05 (2Н, с), 6,30 (1Н, т, J=6,4 Гц), 6,82 (1Н, д, J=8,0 Гц), 6,94 (1Н, с), 6,95 (1Н, д, J=8,4 Гц), 7,54 (1Н, дд, J=6,4, 2,0 Гц), 7,72 (1Н, д, J=5,2 Гц).
Пример 326
Оксалат 1-[(2-оксо-1,2-дигидро-3-пириднил)метил]-4-[2-[2-(трифторметокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,34-1,60 (5Н, шир.с), 1,86 (2Н, шир.д, J=11,2 Гц), 2,64 (2Н, т, J=7,6 Гц), 2,94 (2Н, шир.с), 3,24-3,44 (2Н, м) 4,05 (2Н, с), 6,30 (1Н, т, J=6,4 Гц), 7,28-7,40 (3Н, м), 7,38-7,48 (1Н, м), 7,54 (1Н, д, J=6,4 Гц), 7,71 (1Н, д, J=5,6 Гц).
Пример 327
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(3-пиридинил)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,34-1,65 (5Н, м), 1,80-1,94 (2Н, м), 2,66 (2Н, т, J=7,6 Гц), 2,85-3,00 (2Н, м), 3,25-3,40 (2Н, м) 3,95-4,10 (2Н, м), 6,28 (1Н, т, J=6,4 Гц), 7,26 (1Н, д, J=7,2 Гц), 7,40 (1Н, д, J=7,2 Гц), 7,47 (1Н, дд, J=7,2, 4,8 Гц), 7,40-7,60 (3Н, м), 7,69 (1Н, д, J=6,4 Гц), 8,00-8,10 (1Н, м), 8,55 (1Н, дд, J=4,8, 1,6 Гц), 8,87 (1Н, д, J=1,6 Гц).
Пример 328
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[3-[(тетрагидропиран-2-ил)метилокси]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,20-1,60 (9Н, м), 1,62 (1Н, шир.д, J=12,4 Гц), 1,70-1,90 (3Н, м), 2,40-2,60 (2Н, м), 2,80-3,00 (2Н, м) 3,20-3,43 (3Н, м), 3,50-3,63 (1Н, м), 3,75-3,95 (3Н, м), 4,02 (2Н, с), 6,27 (1Н, т, J=6,4 Гц), 6,66-6,80 (3Н, м), 7,14 (1Н, т, J=8,0 Гц), 7,52 (1Н, д, J=6,4 Гц), 7,68 (1Н, д, J=6,0 Гц).
Пример 329
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-[(тетрагидропиран-2-ил)метилокси]фенил]этил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,25-1,55 (9Н, м), 1,64 (1Н, шир.д, J=12,0 Гц), 1,75-1,93 (3Н, м), 2,53 (2Н, т, J=6,4 Гц), 2,80-3,00 (2Н, м), 3,20-3,43 (3Н, м), 3,53-3,63 (1Н, м), 3,83-3,93 (3Н, м), 4,03 (2Н, с), 6,28 (1Н, т, J=6,4 Гц), 6,82 (1Н, т, J=7,2 Гц), 6,89 (1Н, д, J=8,0 Гц), 7,10 (1Н, д, J=7,2 Гц), 7,11 (1Н, т, J=7,2 Гц), 7,52 (1Н, дд, J=6,0, 2,0 Гц), 7,64-7,72 (1Н, м).
Пример 330
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(2-метоксиэтокси)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,34-1,50 (5Н, м), 1,76-1,90 (2Н, м), 2,46-2,56 (2Н, м), 2,80-2,98 (2Н, м), 3,20-3,38 (2Н, м) 3,30 (3Н, с), 3,64 (2Н, т, J=4,0 Гц), 4,02 (2Н, с), 4,06 (2Н, т, J=4,0 Гц), 6,28 (1Н, т, J=6,4 Гц), 6,83 (1Н, т, J=7,2 Гц), 6,91 (1Н, д, J=8,0 Гц), 7,11 (1Н, д, J=7,6 Гц), 7,12 (1Н, т, J=7,6 Гц), 7,52 (1Н, д, J=6,0 Гц), 7,66-7,76 (1Н, м).
Пример 331
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-феноксифенил)этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,25-1,60 (5Н, м), 1,78 (2Н, шир.д, J=12,8 Гц), 2,56 (2Н, т, J=7,6 Гц), 2,66-2,95 (2Н, м), 3,20-3,35 (2Н, м), 4,02 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,84-6,92 (3Н, м), 7,08 (1Н, т, J=7,2 Гц), 7,13 (1Н, т, J=7,2 Гц), 7,23 (1Н, т, J=7,2 Гц), 7,30-7,40 (3Н, м), 7,54 (1Н, д, J=5,2 Гц), 7,68 (1Н, д, J=6,0 Гц).
Пример 332
Оксалат 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[[2-(2-фенилэтил)фенил]этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,25-1,48 (5Н, м), 1,74-1,84 (2Н, м), 2,48 (2Н, м), 2,53-2,61 (2Н, м), 2,76-2,89 (4Н, м), 3,06 (2Н, шир.д, J=10,8 Гц), 3,65 (2Н, шир.с), 6,98-7,32 (9Н, м), 7,58 (1Н, м), 7,65 (1Н, д, J=2,8 Гц).
Пример 333
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2,2-дифенил-1-этенил)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,52-1,76 (4Н, м), 1,98-2,09 (2Н, м), 2,16 (1Н, м), 2,90 (2Н, шир.д, J=10,4 Гц), 3,46 (2Н, с), 5,92 (1Н, д, J=9,6 Гц), 6,33 (1Н, шир.т, J=6,4 Гц), 7,14-7,40 (11Н, м), 7,55 (1Н, м).
Пример 334
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин
В этаноле (8 мл) растворяют 245 мг 1-[(5-хлор-2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидина. К смеси добавляют 7 мл раствора 4 н. соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение 7 часов. К реакционному раствору добавляют водный карбонат натрия и смесь экстрагируют этилацетатом. Экстрат сушат над безводным сульфатом магния, а затем растворитель выпаривают. К полученному маслу добавляют эфир для кристаллизации и получают 116 мг указанного в заголовке соединения в виде светло-желтого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 1,56-1,68 (2Н, м), 1,80-1,89 (2Н, м), 2,18-2,30 (3Н, м), 2,96-3,02 (2Н, м), 3,56 (2Н, с), 6,24 (1Н, дд, J=7,2, 16,0 Гц), 6,56 (1Н, д, J=16,0 Гц), 7,01 (1Н, ддд, J=10,8, 8,4, 1,6 Гц), 7,08 (1Н, дт, J=8,0, 1,2 Гц), 7,17 (1Н, м), 7,40-7,48 (2Н, м), 7,73 (1Н, шир.с).
Пример 335
1-[(5-Фтор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин
В этаноле (12 мл) растворяют 221 мг 1-[(5-хлор-2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидина. К смеси добавляют 12 мл раствора 4 н. соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение 11 часов. К реакционному раствору добавляют водный карбонат натрия и смесь экстрагируют этилацетатом. Экстрат сушат над безводным сульфатом магния, а затем растворитель выпаривают. К полученному маслу добавляют эфир для кристаллизации. Указанное в заголовке соединение (176 мг) получают в виде светло-розового порошка.
1H-ЯМР (400 МГц, CDCl3) δ 1,57-1,69 (2Н, м), 1,81-1,89 (2Н, м), 2,20-2,31 (3Н, м), 2,96-3,04 (2Н, м), 3,60 (2Н, с), 6,23 (1Н, дд, J=16,0, 7,2 Гц), 6,56 (1Н, д, J=16,0 Гц), 7,02 (1Н, ддд, J=10,8, 8,0, 1,2 Гц), 7,08 (1Н, дт, J=8,0, 1,2 Гц), 7,17 (1Н, м), 7,28 (1Н, дд, J=8,0, 2,8 Гц), 7,44 (1Н, дт, J=7,6, 2,0 Гц), 7,72 (1Н, шир.м).
Пример 336
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-хлорфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,46-1,69 (2Н, м), 1,82-1,90 (2Н, м), 2,18-2,34 (3Н, м), 2,95-3,02 (2Н, м), 3,55 (2Н, с), 6,15 (1Н, дд, J=16,0, 6,8 Гц), 6,78 (1Н, д, J=16,0 Гц), 7,15 (1Н, дд, J=8,0, 1,6 Гц), 7,20 (1Н, дт, J=8,0, 1,6 Гц), 7,34 (1Н, дд, J=8,0, 1,6 Гц), 7,45 (1Н, д, J=2,8 Гц), 7,51 (1Н, дд, J=8,0, 1,6 Гц), 7,69 (1Н, шир.с).
Пример 337
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-метилфенил)-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,56-1,68 (2Н, м), 1,81-1,88 (2Н, м), 2,16-2,29 (3Н, м), 2,33 (3Н, с), 2,94-3,02 (2Н, м), 3,54 (2Н, с), 6,04 (1Н, дд, J=16,0, 7,2 Гц), 6,59 (1Н, дд, J=16,0, 0,8 Гц), 7,09-7,19 (3Н, м), 7,41 (1Н, дд, J=7,6, 1,6 Гц), 7,45 (1Н, д, J=2,4 Гц), 7,69 (1Н, шир.с).
Пример 338
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(бензилокси)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,58-1,78 (4Н, м), 1,83-1,94 (2Н, м), 2,40 (7/8Н, м), 2,64 (1/8Н,м), 2,82-3,05 (2Н, м), 3,20-3,42 (2Н, м), 4,01 (2Н, шир.с), 5,12 (1/4Н, с), 5,14 (7/4Н, с), 6,18-6,28 (1Н, м), 6,30 (1Н, т, J=6,4 Гц), 6,50 (1/8Н, д, J=11,6 Гц), 6,72 (7/8Н, д, J=16,0 Гц), 6,89-7,04 (1Н, м), 7,05-7,15 (1Н, м), 7,18-7,55 (8Н, м), 7,66 (1/8Н, шир.д, J=5,2 Гц), 7,69 (7/8Н, шир.д, J=5,2 Гц).
Пример 339
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-фенилэтил)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,60-1,78 (2Н, м), 1,86-1,96 (2Н, м), 2,45 (1Н, м), 2,52-3,04 (6Н, м), 3,21 (2/7Н, шир.д, J=11,2 Гц), 3,34 (12/7Н, шир.д, J=11,2 Гц), 3,92 (2/7Н, шир.с), 4,00 (12/7Н, шир.с), 6,06-6,16 (1Н, м), 6,27 (1/7Н, т, J=6,8 Гц), 6,30 (6/7Н, т, J=6,8 Гц), 6,57 (1/7Н, д, J=11,2 Гц), 6,68 (6/7Н, д, J=16,0 Гц), 7,10-7,32 (9H, м), 7,42-7,47 (1Н, м), 7,49 (1/7Н, дд, J=6,8, 2,0 Гц), 7,52 (6/7Н, дд, J=6,8, 2,0 Гц), 7,62 (1/7Н, шир.д, J=6,8 Гц), 7,68 (6/7Н, дд, J=6,8, 1,6 Гц).
Пример 340
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(изобутилокси)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,97 (3/2Н, д, J=6,8 Гц), 1,01 (9/2Н, д, J=6,8 Гц), 1,58-1,94 (4Н, м), 1,95-2,10 (1Н, м), 2,40 (1/4Н, м), 2,66 (3/4Н, м), 2,94 (2Н, м), 3,20-3,38 (2Н, м), 3,74 (1/2Н, д, J=6,8 Гц), 3,76 (3/2Н, д, J=6,8 Гц), 3,92-4,05 (2Н, м), 6,20-6,33 (2Н, м), 6,48 (1/4Н, д, J=11,6 Гц), 6,64 (3/4Н, д, J=16,0 Гц), 6,86-6,99 (2Н, м), 7,15-7,29 (5/4Н, м), 7,44 (3/4Н, дд, J=8,0, 1,6 Гц), 7,50 (1/4Н, дд, J=6,4, 2,0 Гц), 7,52 (3/4Н, дд, J=6,4, 2,0 Гц), 7,65 (1/4Н, шир.д, J=6,4 Гц), 8,06 (3/4Н, шир.д, J=6,4 Гц).
Пример 341
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(циклопентилметилокси)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,12-1,96 (13Н, м), 2,12-2,54 (1Н, м), 2,64 (1/4Н, м), 2,80-3,02 (7/4Н, м), 3,08-3,39 (2Н, м), 3,82 (1/2Н, д, J=6,8 Гц), 3,83 (3/2Н, д, J=6,8 Гц), 4,00 (2Н, м), 5,45 (1/4Н, дд, J=12,0, 10,0 Гц), 6,20-6,35 (7/4Н, м), 6,45 (1/4Н, д, J=12,0 Гц), 6,62 (3/4Н, д, J=15,6 Гц), 6,85-7,00 (2Н, м), 7,15-7,30 (7/4Н, м), 7,42 (5/4Н, д, J=7,6 Гц), 7,50 (1/4Н, дд, J=7,2, 2,0 Гц), 7,52 (3/4Н, дд, J=7,2, 2,0 Гц), 7,64 (1/4Н, дд, J=5,2, 2,0 Гц), 7,65 (3/4Н, дд, J=5,2, 2,0 Гц).
Пример 342
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(2-циклогексилэтил)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,85-0,98 (2Н, м), 1,07-1,29 (4Н, ш), 1,30-1,40 (2Н, м), 1,57-1,76 (7Н, м), 1,86-1,95 (2Н, м), 2,33 (1/7Н, м), 2,43 (6/7Н, м), 2,51-2,56 (2/7Н, м), 2,58-2,64 (12/7Н, м), 3,19-3,27 (2/7Н, м), 3,27-3,38 (12/7Н, м), 3,92 (2/7Н, с), 4,00 (12/7Н, с), 6,05-6,14 (1Н, м), 6,27 (1/7Н, т, J=6,4 Гц), 6,30 (6/7Н, т, J=6,4 Гц), 6,53 (1/7Н, д, J=11,6 Гц), 6,62 (6/7Н, д, J=15,2 Гц), 7,07-7,22 (3Н, м), 7,40-7,46 (1Н, м), 7,49 (1/7Н, дд, J=6,4, 2,0 Гц), 7,52 (6/7Н, дд, J=6,4, 2,0 Гц), 7,63 (1/7Н, дд, J=5,6, 2,0 Гц), 7,69 (6/7Н, дд, J=5,6, 2,0 Гц).
Пример 343
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидина
В этаноле (16 мл) растворяют 961 мг 1-[(2-метокси-3-пиридил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидина. К смеси добавляют 4 мл 4 н. раствора соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение 3 часов. К реакционному раствору добавляют водный раствор карбоната натрия и смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и растворитель выпаривают. Полученное масло растворяют в этаноле, добавляют 207 мг щавелевой кислоты и этилацетат. Полученные осадки собирают фильтрацией, в результате чего получают 765 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,02-1,34 (5Н, м), 1,57-1,93 (10Н, м), 2,39 (1Н, м), 2,88 (2Н, м), 3,29 (2Н, шир.д, J=9,6 Гц), 3,79 (2Н, д, J=6,0 Гц), 3,94 (2Н, с), 6,19-6,32 (2Н, м), 6,64 (1Н, д, J=16,4 Гц), 6,88 (1Н, т, J=7,2 Гц), 6,95 (1Н, д, J=7,2 Гц), 7,18 (1Н, дт, J=7,2, 1,2 Гц), 7,41 (1Н, дд, J=7,2, 1,2 Гц), 7,50 (1Н, дд, J=7,2, 2,0 Гц), 7,67 (1Н, шир.д, J=5,6 Гц).
Пример 344
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Z)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,97-1,32 (5Н, м), 1,60-1,84 (10Н, м), 2,65 (1Н, м), 2,70-3,00 (2Н, м), 3,26 (2Н, шир.д, J=12,0 Гц), 3,77 (2Н, д, J=7,2 Гц), 3,96 (2Н, с), 5,47 (1Н, м), 6,28 (1Н, т, J=6,8 Гц), 6,47 (1Н, д, J=11,6 Гц), 6,91 (1Н, т, J=7,6 Гц), 6,95 (1Н, д, J=8,0 Гц), 7,18 (1Н, дд, J=7,6, 1,2 Гц), 7,23 (1Н, дт, J=7,6, 1,2 Гц), 7,50 (1Н, дд, J=6,8, 2,0 Гц), 7,66 (1Н, шир.д, J=6,0 Гц).
Пример 345
Оксалат 1-[(5-фтор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,03-1,34 (5Н, м), 1,47-1,88 (10Н, м), 2,28 (1Н, м), 2,42-2,60 (2Н, м), 3,00-3,18 (2Н, м), 3,62-3,74 (2Н, м), 3,79 (2Н, д, J=6,0 Гц), 6,26 (1Н, дд, J=16,0, 6,8 Гц), 6,64 (1Н, д, J=16,0 Гц), 6,88 (1Н, т, J=7,6 Гц), 6,96 (1Н, д, J=7,6 Гц), 7,17 (1Н, дт, J=7,6, 2,0 Гц), 7,42 (1Н, дд, J=7,6, 2,0 Гц), 7,65 (2Н, шир.с).
Пример 346
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(E)-2-[(2-циклогексилметилокси)-5-фторфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,96-1,32 (5Н, м), 1,57-1,92 (10Н, м), 2,41 (7/4Н, м), 2,66 (1/4Н, м), 2,84-3,00 (2Н, м), 3,21-3,36 (2Н, м), 3,75 (1/2Н, д, J=6,4 Гц), 3,77 (3/2Н, д, J=6,4 Гц), 3,94 (1/2Н, м), 3,98 (3/2Н, м), 5,23 (1/4Н, м), 6,25-6,38 (7/4Н, м), 6,42 (1/4Н, д, J=11,6 Гц), 6,62 (3/4Н, д, J=15,6 Гц), 6,93-7,10 (2Н, м), 7,32 (1Н, дд, J=10,0, 2,8 Гц), 7,50 (1/4Н, дд, J=6,4, 2,0Гц), 7,52 (3/4Н, дд, J=6,4, 2,0Гц), 7,65 (1/4Н, дд, J=6,4, 2,0Гц), 7,68 (3/4Н, дд, J=6,4, 2,0 Гц).
Пример 347
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(циклогексилметилокси)-4-фторфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,96-1,34 (5Н, м), 1,57-1,92 (10Н, м), 2,38 (1Н, м), 2,59 (1/5Н, м), 2,78-3,02 (9/5Н, м), 3,20-3,38 (2Н, м), 3,79 (2/5Н, д, J=6,4 Гц), 3,81 (8/5Н, д, J=6,0 Гц), 3,94 (2/5Н, шир.с), 3,99 (8/5Н, шир.с), 5,56 (1/5Н, м), 6,215-6,34 (9/5Н, м), 6,38 (1/5Н, д, J=11,6 Гц), 6,56 (4/5Н, д, J=16,0 Гц), 6,67-6,79 (1Н, м), 6,83-6,92 (1Н, м), 7,20 (1/5Н, т, J=7,2 Гц), 7,26 (1/5Н, д, J=7,2 Гц), 7,42-7,56 (8/5Н, м), 7,63-7,73 (1Н, м).
Пример 348
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(циклогексилметилокси)-6-фторфенил]-1-этенил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,04-1,34 (5Н, м), 1,56-1,92 (10Н, м), 2,39 (1Н, м), 2,83-2,98 (2Н, м), 3,24-3,36 (2Н, м), 3,84 (2Н, д, J=5,6 Гц), 3,97 (2Н, шир.с), 6,29 (1Н, т, J=6,4 Гц), 6,39-6,51 (2Н, м), 7,78 (1Н, дд, J=10,8, 8,4 Гц), 6,84 (1Н, д, J=8,4 Гц), 7,19 (1Н, дд, J=8,4, 6,8 Гц), 7,51 (1Н, дд, J=6,4, 2,0 Гц), 7,68 (1Н, шир.д, J=4,8 Гц).
Пример 349
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[(2-циклогексилметилокси)фенил]-1-этинил]пиперидина
В 1,2-дихлорэтане (3 мл) растворяют 111 мг 4-[2-[2-циклогексилметилокси)фенил]-1-этинил]пиперидина. К смеси добавляют 50 мг 2-оксо-1,2-дигидро-3-пиридинкарбоксальдегида, 0,03 мл уксусной кислоты и 94 мг триацетоксиборогидрида натрия, а затем перемешивают при комнатной температуре в течение 5,5 часов. К полученной смеси добавляют 50 мг 2-оксо-1,2-дигидро-3-пиридинкарбоксальдегида, 0,03 мл уксусной кислоты и 94 мг триацетоксиборогидрида натрия, а затем перемешивают в течение ночи. К реакционному раствору добавляют водный насыщенный бикарбонат натрия и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт очищают колоночной хроматографией на NH-форме силикагеля (этилацетат:метанол=30:1), в результате чего получают 140 мг бесцветного масла. Полученное масло растворяют в этаноле, добавляют 33 мг щавелевой кислоты и этилацетат и полученные осадки собирают фильтрацией, в результате чего получают 120 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,02-1,32 (5Н, м), 1,60-1,87 (8Н, м), 1,99-2,08 (2Н, м), 2,86-3,04 (3Н, м), 3,11-3,22 (2Н, м), 3,82 (2Н, д, J=6,0 Гц), 3,92, (2Н, шир.с), 6,28 (1Н, т, J=6,8 Гц), 6,88 (1Н, дт, J=8,0, 0,8 Гц), 7,00 (1Н, д, J=8,0 Гц), 7,25-7,33 (2Н, м), 7,49 (1Н, дд, J=7,6, 2,0 Гц), 7,66 (1Н, дд, J=7,6, 2,0 Гц).
Пример 350
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-феноксифенил)-1-этенил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,56-1,78 (3Н, м), 1,76-1,88 (1Н, м), 2,10-2,50 (1Н, м), 2,90-3,10 (2Н, м), 3,22-3,40 (2Н, м), 4,05 (2Н, с), 6,29 (1Н, т, J=6, 4 Гц), 6,39 (0,3Н, д, J=11,6 Гц), 6,56 (0,7Н, д, J=16,4 Гц), 6,84-7,40 (8Н, м), 7,54 (1Н, дд, J=6,4, 2,0 Гц), 7,64-7,74 (1Н, м).
Пример 351
1-[(5-Циано-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин
К ацетонитрилу (10 мл) добавляют 214 мг 1-[(5-циано-2-метокси-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидина, 137 мг иодида натрия и 0,1 мл хлортриметилсилана, а затем перемешивают при комнатной температуре. Через 5 часов добавляют 685 мг иодида натрия и 0,5 мл хлортриметилсилана, а затем перемешивают при комнатной температуре в течение 20 минут. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водным карбонатом натрия, водным тиосульфатом натрия и насыщенным раствором соли, а затем сушат над безводным сульфатом магния. Растворитель выпаривают и неочищенный продукт суспендируют в водном карбонате натрия, а затем перемешивают при комнатной температуре. Кристаллы собирают фильтрацией и получают 185 мг указанного в заголовке соединения в виде светло-желтого порошка.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,41-1,54 (2Н, м), 1,68-1,74 (2Н, м), 2,08 (2Н, шир.т, J=10,8 Гц), 2,17 (1Н, м), 2,85 (2Н, шир.д, J=11,6 Гц), 3,29 (2Н, с), 6,38 (1Н, дд, J=16,0, 6,8 Гц), 6,50 (1Н, д, J=16,0 Гц), 7,12-7,21 (2Н, м), 7,25 (1Н, м), 7,53 (1Н, д, J=2,4 Гц), 7,58 (1Н, дт, J=8,4, 1,6 Гц), 8,19 (1Н, д, J=2,4 Гц).
Пример 352
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(циклогексилметилокси)бензилокси]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,00-1,32 (5Н, м), 1,62-2,07 (10Н, м), 3,01 (2Н, м), 3,17 (2Н, м), 3,66 (1Н, м), 3,79 (2Н, д, J=6,4 Гц), 4,00 (2Н, с), 4,49 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,91 (1Н, т, J=7,6 Гц), 6,95 (1Н, д, J=7,6 Гц), 7,24 (1Н, дт, J=7,6, 1,2 Гц), 7,32 (1Н, дд, J=7,6, 1,2 Гц), 7,52 (1Н, дд, J=6,4, 2,0 Гц), 7,68 (1Н, дд, J=6,4, 2,0 Гц).
Пример 353
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(бензилокси)бензилокси]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 349.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,72-1,86 (2Н, м), 1,90-2,02 (2Н, м), 2,85-2,98 (2Н, м), 3,05-3,17 (2Н, м), 3,64 (1Н, м), 3,93 (2Н, с), 4,53 (2Н, с), 5,14 (2Н, с), 6,29 (1Н, т, J=6,8 Гц), 6,95 (1Н, дт, J=7,6, 1,2 Гц), 7,17 (1Н, д, J=7,6 Гц), 7,26-7,42 (5Н, м), 7,43-7,48 (2Н, м), 7,51 (1Н, дд, J=6,8, 2,0 Гц), 7,65 (1Н, дд, J=6,8, 2,0 Гц.
Пример 354
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(хлор-6-фторбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,40-1,55 (2Н, м), 1,78-1,90 (2Н, м), 2,10 (2Н, шир.т, J=9,2 Гц), 2,58-2,70 (2Н, м), 3,22 (2Н, с), 3,33-3,45 (1Н, м), 4,56 (2Н, д, J=2,0 Гц), 6,15 (1Н, т, J=6,4 Гц), 7,18-7,28 (2Н, м), 7,30-7,46 (3Н, м), 11,50 (1Н, с).
Пример 355
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-хлор-6-фторбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,42-1,55 (2Н, м), 1,80-1,90 (2Н, м), 2,14 (2Н, шир.т, J=9,2 Гц), 2,58-2,70 (2Н, м), 3,25 (2Н, с), 3,30-3,50 (1Н, м), 4,56 (2Н, д, J=2,4 Гц), 7,20-7,26 (1Н, м), 7,31-7,37 (2Н, м), 7,37-7,44 (1Н, м), 7,50 (1Н, д, J=2,8 Гц).
Пример 356
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2,6-дифторбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,38-1,52 (2Н, м), 1,78-1,90 (2Н, м), 2,08 (2Н, шир.т, J=9,6 Гц), 2,56-2,70 (2Н, м), 3,21 (2Н, с), 3,30-3,43 (1Н, м), 4,50 (2Н, с), 6,14 (1Н, т, J=6,4 Гц), 7,09 (2Н, т, J=8,0 Гц), 7,23 (1Н, дд, J=6,4, 1,6 Гц), 7,35 (1Н, дд, J=6,4, 1,2 Гц), 7,36-7,48 (1Н, м).
Пример 357
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-(2,6-дифторбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,40-1,53 (2Н, м), 1,78-1,90 (2Н, м), 2,13 (2Н, шир.т, J=9,2 Гц), 2,56-2,70 (2Н, м), 3,24 (2Н, с), 3,30-3,48 (1Н, м), 4,50 (2Н, с), 7,09 (2Н, т, J=8,0 Гц), 7,35 (1Н, д, J=2,0 Гц), 7,38-7,48 (1Н, м), 7,50 (1Н, д, J=2,8 Гц).
Пример 358
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-хлорбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,45-1,60 (2Н, м), 1,82-1,93 (2Н, шир.д, J=10,0 Гц), 2,12 (2Н, шир.т, J=10,0 Гц), 2,60-2,73 (2Н, м), 3,23 (2Н, с), 3,38-3,50 (1Н, м), 4,54 (2Н, с), 6,15 (1Н, т, J=6,4 Гц), 7,24 (1Н, д, J=6,4 Гц), 7,26-7,44 (4Н, м), 7,50 (1Н, д, J=7,6 Гц), 11,50 (1Н, с).
Пример 359
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-хлорбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,47-1,62 (2Н, м), 1,82-1,94 (2Н, м), 2,16 (2Н, шир.т, J=9,6 Гц), 2,60-2,75 (2Н, м), 3,27 (2Н, с), 3,46 (1Н, м), 4,54 (2Н, с), 7,26-7,45 (4Н, м), 7,48-7,56 (2Н, м).
Пример 360
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-фторбензилокси)пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,70-1,90 (2Н, м), 1,90-2,10 (2Н, м), 2,90-3,10 (2Н, м), 3,00-3,20 (2Н, м), 3,60-3,70 (1Н, м), 3,97 (2Н, с), 4,53 (2Н, с), 6,26 (1Н, т, J=6,4 Гц), 7,10-7,22 (2Н, м), 7,30-7,38 (1Н,м), 7,45 (1Н, т, J=6,8 Гц), 7,49 (1Н, д, J=4,8 Гц), 7,67 (1Н, д, J=5,2 Гц).
Пример 361
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-(2-фторбензилокси)пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 323.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,70-1,85 (2Н, м), 1,90-2,05 (2Н, м), 2,77-3,00 (2Н, м), 3,05-3,20 (2Н, м), 3,60-3,70 (1Н, м), 3,92 (2Н, с), 4,54 (2Н, с), 7,14-7,22 (2Н, м), 7,31-7,38 (1Н, м), 7,45 (1Н, дт, J=7,6, 2,0 Гц), 7,73 (1Н, д, J=3,2 Гц), 7,74 (1Н, д, J=2,8 Гц).
Пример 362
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2-метоксифенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,38-1,52 (2Н, м), 1,85-2,00 (3Н, м), 2,15 (2Н, м), 2,98 (2Н, шир.д, J=11,6 Гц), 3,50 (2Н с), 3,86 (3Н, с), 3,88 (2Н, с), 6,33 (1Н, д, J=6,8 Гц), 6,86-6,94 (4Н, м), 7,36 (1Н, шир.дд, J=6,0, 1,2 Гц), 7,57 (1Н, шир.д, J=6,0 Гц).
Пример 363
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(циклогексилметилокси)феноксиметил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 285.
1H-ЯМР (400 МГц, CDCl3) δ 1,00-1,36 (5Н, м), 1,41-1,54 (2Н, м), 1,65-2,00 (7Н, м), 2,16-2,26 (2Н, м), 2,99 (2Н, шир.д, J=11,6 Гц), 3,58 (2Н, с), 3,78 (2Н, д, J=6,0 Гц), 3,85 (2Н, д, J=6,0 Гц), 6,86-6,94 (4Н, м), 7,39 (1Н, д, J=2,4 Гц), 7,80 (1Н, шир.с).
Пример 364
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(циклогексилметилокси)феноксиметил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,98-1,12 (2Н, м), 1,12-1,30 (3Н, м), 1,46-1,84 (8Н, м), 1,88-2,08 (3Н, м), 3,12 (2Н, м), 3,33 (2Н, м), 3,75 (2Н, д, J=6,4 Гц), 3,83 (2Н, м), 3,99 (2Н, м), 6,30 (1Н, т, J=6,8 Гц), 6,82-6,91 (2Н, м), 6,92-7,00 (2Н, м), 7,52 (1Н, шир.д, J=5,2 Гц), 7,68 (1Н, шир.д, J=6,4 Гц).
Пример 365
Оксалат 1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[[2-(циклогексилэтил)фенокси]метил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 302.
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,84-0,96 (2Н, м), 1,06-1,27 (4Н, м), 1,35-1,43 (2Н, м), 1,50-1,77 (7Н, м), 1,86-1,96 (2Н, м), 2,00 (1Н, м), 2,55-2,58 (2Н, м), 2,88 (2Н, м), 3,04 (2Н, м), 3,83 (2Н, м), 3,95 (2Н, с), 6,29 (1Н, т, J=6,8 Гц), 6,84 (1Н, дт, J=7,6, 0,8 Гц), 6,91 (1Н, д, J=7,6 Гц), 7,08-7,16 (2Н, м), 7,50 (1Н, шир.д, J=5,2 Гц), 7,66 (1Н, шир.д, J=4,8 Гц).
Пример 366
Оксалат 1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(бензилокси)феноксиметил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 349.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,40-1,65 (2Н, м), 1,86-1,96 (2Н, м), 2,02 (1Н, м), 2,85-2,96 (2Н, м), 3,26-3,36 (2Н, м), 3,88 (2Н, д, J=6,4 Гц), 3,97 (2Н, с), 5,10 (2Н, с), 6,29 (1Н, т, J=6,4 Гц), 6,84-6,93 (2Н, м), 6,97-7,06 (2Н, м), 7,28-7,47 (5Н, м), 7,51 (1Н, дд, J=6,4, 2,0 Гц), 7,67 (1Н, дд, J=6,8, 2,0 Гц).
Пример 367
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2-фторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,24-1,38 (2Н, м), 1,72 (3Н, шир.д, J=10 Гц), 1,98 (2Н, шир.т, J=10,8 Гц), 2,83 (2Н, шир.д, J=11,2 Гц), 3,25 (2Н, с), 3,88 (2Н, д, J=5,6 Гц), 6,15 (1Н, т, J=6,4 Гц), 6,86-6,94 (1Н, м), 7,04-7,20 (3Н, м), 7,24 (1Н, д, J=6,4 Гц), 7,37 (1Н, д, J=6,8 Гц), 11,50 (1Н, с).
Пример 368
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2-фторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,24-1,40 (2Н, м), 1,74 (3Н, шир.д, J=9,6 Гц), 2,01 (2Н, шир.т, J=10,8 Гц), 2,82 (2Н, шир.д, J=10,8 Гц), 3,27 (2Н, с), 3,86 (2Н, д, J=6,0 Гц), 6,86-6,93 (1Н, м), 7,05-7,20 (3Н, м), 7,36 (1Н, д, J=2,8 Гц), 7,51 (1Н, д, J=3,2 Гц).
Пример 369
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,4-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,22-1,38 (2Н, м), 1,71 (3Н, шир.д, J=10,8 Гц), 1,96 (2Н, шир.т, J=10,8 Гц), 2,82 (2Н, шир.д, J=11,2 Гц), 3,23 (2Н, с), 3,86 (2Н, д, J=5,6 Гц), 6,15 (1Н, т, J=6,4 Гц), 6,93-7,02 (1Н, м), 7,12-7,20 (1Н, м), 7,20-7,28 (1Н, м), 7,36 (1Н, дд, J=6,4, 1,2 Гц), 11,41 (1Н, с).
Пример 370
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,4-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,24-1,38 (2Н, м), 1,72 (3Н, шир.д, J=10,4 Гц), 2,01 (2Н, шир.т, J=10,4 Гц), 2,82 (2Н, шир.д, J=11,6 Гц), 3,27 (2Н, с), 3,87 (2Н, д, J=6,0 Гц), 6,93-7,01 (1Н, м), 7,13-7,21 (1Н, м), 7,21-7,28 (1Н, м), 7,36 (1Н, д, J=2,8 Гц), 7,50 (1Н, д, J=2,8 Гц).
Пример 371
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,5-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,20-1,38 (2Н, м), 1,65-1,83 (1Н, м), 1,71 (2Н, шир.д, J=10,8 Гц), 1,97 (2Н, шир.т, J=11,2 Гц), 2,82 (2Н, шир.д, J=11,2 Гц), 3,24 (2Н, с), 3,90 (2Н, д, J=6,0 Гц), 6,15 (1Н, т, J=6,4 Гц), 6,68-6,76 (1Н, м), 7,06-7,14 (1Н, м), 7,17-7,28 (2Н, м), 7,36 (1Н, дд, J=6,4, 1,2 Гц), 11,51 (1Н, м).
Пример 372
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,5-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,24-1,39 (2Н, м), 1,67-1,80 (1Н, м), 1,73 (2Н, шир.д, J=11,2 Гц), 1,95-2,08 (2Н, м), 2,82 (2Н, шир.д, J=11,2 Гц), 3,27 (2Н, с), 3,91 (2Н, д, J=6,0 Гц), 6,68-6,76 (1Н, м), 7,06-7,13 (1Н, м), 7,18-7,26 (1Н, м), 7,36 (1Н, д, J=2,8 Гц), 7,51 (1Н, д, J=2,8 Гц).
Пример 373
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,6-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,20-1,38 (2Н, м), 1,60-1,80 (1Н, м), 1,72 (2Н, шир.д, J=12,4 Гц), 1,96 (2Н, шир.т, J=11,2 Гц), 2,81 (2Н, шир.д, J=11,2 Гц), 3,23 (2Н, с), 3,93 (2Н, д, J=6,0 Гц), 6,15 (1Н, т, J=6,8 Гц), 7,04-7,18 (3Н, м), 7,23 (1Н, д, J=6,4 Гц) 7,36 (1Н, д, J=6,4 Гц), 11,49 (1Н, с).
Пример 374
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,6-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,22-1,38 (2Н, м), 1,60-1,80 (1Н, м), 1,73 (2Н, шир.д, J=12,8 Гц), 1,95-2,05 (2Н, м), 2,81 (2Н, шир.д, J=11,2 Гц), 3,26 (2Н, с), 3,94 (2Н, д, J=6,0 Гц), 7,04-7,16 (3Н, м), 7,35 (1Н, д, J=2,0 Гц), 7,50 (1Н, д, J=2,8 Гц).
Пример 375
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2-метоксифенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,22-1,36 (2Н, м), 1,66-1,78 (3Н, м), 2,01 (2Н, шир.т, J=10,4 Гц), 2,82 (2Н, шир.д, J=11,6 Гц), 3,27 (2Н, с), 3,72 (3Н, с), 3,78 (2Н, д, J=6,0 Гц), 6,80-6,88 (2Н, м,), 6,88-6,95 (2Н, м), 7,36 (1Н, д, J=2,8 Гц), 7,51 (1Н, д, J=3,2 Гц).
Пример 376
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2-хлорфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,26-1,40 (2Н, м), 1,74 (3Н, шир.д, J=10,8 Гц), 1,98 (2Н, шир.т, J=11,2 Гц), 2,83 (2Н, шир.д, J=11,2 Гц), 3,24 (2Н, с), 3,89 (2Н, д, J=5,6 Гц), 6,16 (1Н, т, J=6,8 Гц), 6,91 (1Н, т, J=7,6 Гц), 7,11 (1Н, д, J=8,0 Гц), 7,20-7,30 (2Н, м), 7,34-7,41 (2Н, м), 11,5 (1Н, шир. с).
Пример 377
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2-хлор-6-фторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,22-1,36 (2Н, м), 1,58-1,73 (1Н, м), 1,74 (2Н, шир.д, J=12 Гц), 1,94-2,04 (2Н, м), 2,80 (2Н, шир.д, J=11,6 Гц), 3,26 (2Н, с), 3,79 (3Н, с), 3,79 (2Н, д, J=6,0 Гц), 6,80 (1Н, т, J=9,6 Гц), 6,85 (1Н, д, J=7,6 Гц), 6,96-7,05 (2Н, м), 7,36 (1Н, д, J=2,0 Гц), 7,50 (1Н, д, J=2,8 Гц).
Пример 378
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(2,3-дифторфенокси)метил]пиперидин
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 318.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,26-1,38 (2Н, м), 1,73 (3Н, шир.д, J=12,8 Гц), 1,96-2,10 (2Н, м), 2,83 (2Н, шир.д, J=11,6 Гц), 3,28 (2Н, с), 3,93 (2Н, д, J=6,4 Гц), 6,90-7,04 (2Н, м), 7,06-7,14 (1Н, м), 7,36 (1Н, д, J=2,8 Гц), 7,51 (1Н, д, J=2,4 Гц).
Пример 379
1-[(4-Оксо-1,4-дигидро-3-пиридинил)метил]-4-[2-[(2,3-(метилендиокси)фенил]метил]пиперидин
259 мг 1-[(4-метокси-3-пиридинил)метил]-4-[2-(2-метилфенил)этил]пиперидина растворяют в 5 мл этанола. К смеси добавляют 1,91 мл 4 н. раствора соляной кислоты в метаноле, а затем кипятят с обратным холодильником в течение ночи. Растворитель выпаривают и к остатку добавляют 2 н. соляную кислоту (15 мл), а затем кипятят с обратным холодильником еще 7 часов. К реакционному раствору добавляют водный раствор карбоната натрия и смесь экстрагируют хлороформом. Экстракт сушат над безводным сульфатом магния и растворитель выпаривают. Неочищенный продукт очищают колоночной хроматографией на NH-силикагеле (н-гексан:этилацетат=2:1) с получением 42 мг указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,44 (3Н, м), 1,56-1,64 (2Н, м), 1,78-1,88 (2Н, м), 2,10-2,20 (2Н, м), 2,56-2,64 (2Н, м), 3,00 (2Н, шир.д, J=11,6 Гц), 3,73 (2Н, с), 5,93 (2Н, с), 6,64 (1Н, дд, J=7,6, 1,6 Гц), 6,69 (1Н, дд, J=7,6, 1,6 Гц), 6,69 (1Н, д, J=5,6 Гц), 6,76 (1Н, т, J=7,6 Гц), 8,10 (1Н, с), 8,25 (1Н, д, J=5,6 Гц).
Пример 380
1-[(2-Оксо-3,4-дигидро-3-хинолинил)метил]-4-[2-[(2,3-(метилендиокси)фенил]этил]пиперидин
В 50 мл тетрагидрофурана растворяют 0,24 г 2-оксо-3,4-дигидро-3-хинолинилкарбоксальдегида и 0,3 г 4-[2-[2,3-(метилендиокси)фенил]этил]пиперидина. К смеси добавляют 0,5 мл уксусной кислоты и 0,42 г триацетоксиборогидрида натрия, а затем перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют насыщенный водный раствор бикарбоната натрия, а затем смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и полученное твердое вещество собирают фильтрацией с получаением 130 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,18-1,28 (3Н, м), 1,68 (2Н, шир.д, J=7,6 Гц), 1,90-2,00 (2Н, м), 2,53 (2Н, шир.т, J=8,0 Гц), 2,84 (2Н, шир.д, J=10,0 Гц), 3,30 (2Н, с), 5,95 (2Н, с), 6,66-6,77 (3Н, м), 7,14 (1Н, т, J=7,6 Гц), 7,27 (1Н, д, J=7,6 Гц), 7,43 (1Н, т, J=7,6 Гц), 7,66 (1Н, д, J=7,6 Гц), 7,80 (1Н, с), 11,74 (1Н, с).
Пример 381
Оксалат 1-[(2-оксо-3,4-дигидро-3-хинолинил)метил]-4-[2-(3-(фенилфенил)этил]пиперидина
Указанное в заголовке соединение получают из соответствующего исходного материала способом, описанным в примере 349.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,70 (5Н, м), 1,86 (2Н, шир.д, J=10,8 Гц), 2,54-2,76 (2Н, м), 2,88 (2Н, шир.с), 3,33 (2Н, шир.д, J=10,8 Гц), 4,07 (2Н, с), 7,14-7,26 (2Н, м), 7,30-7,40 (3Н, м), 7,40-7,50 (4Н, м), 7,55 (1Н, т, J=7,6 Гц), 7,60-7,70 (3Н, м), 8,14 (1Н, с).
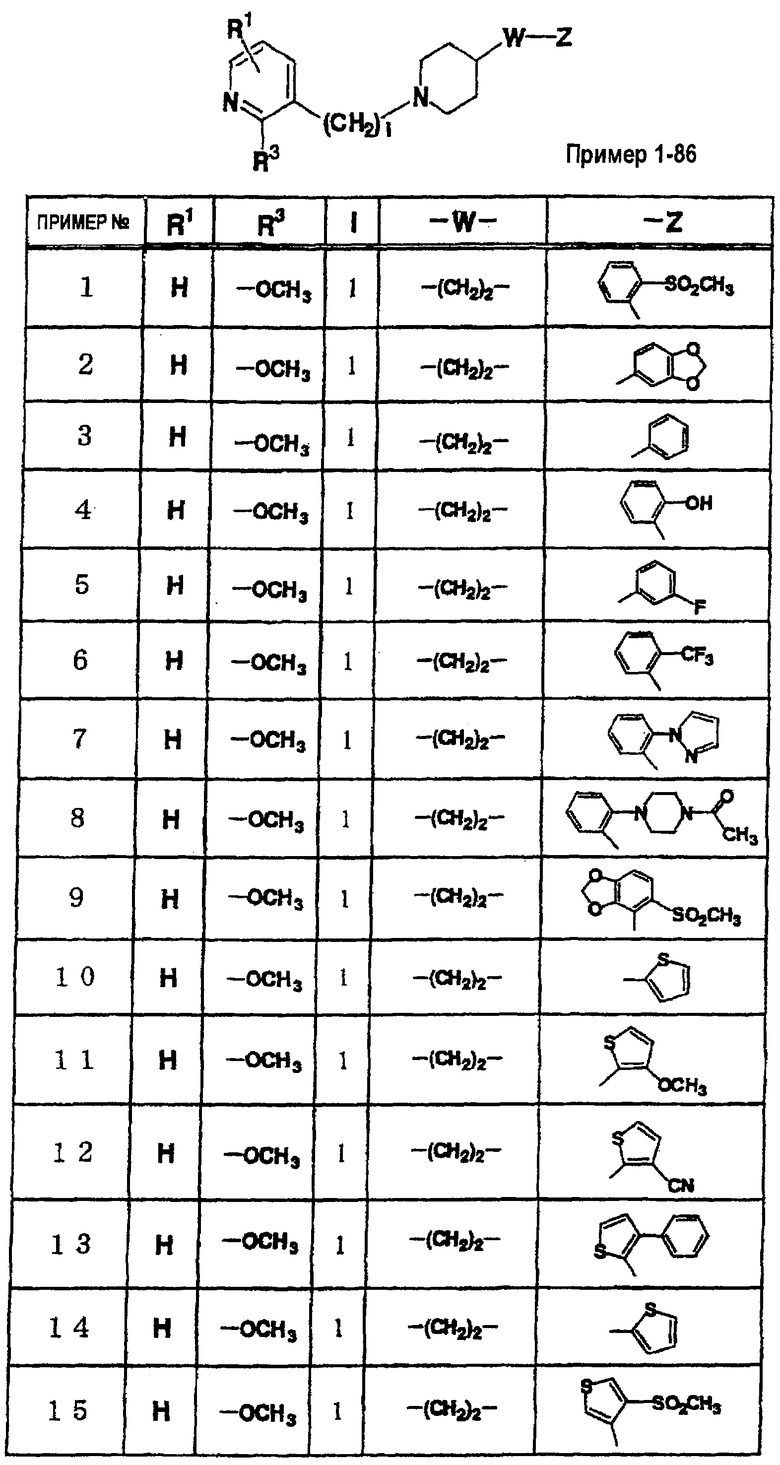
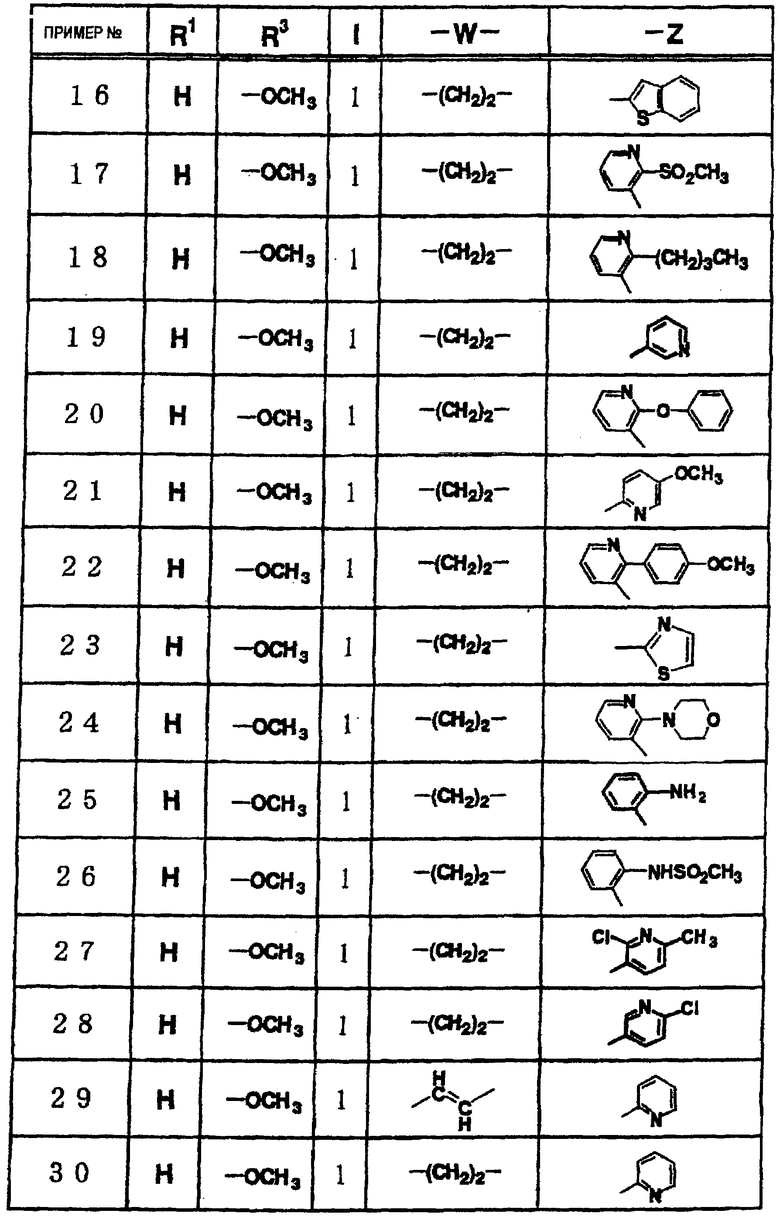
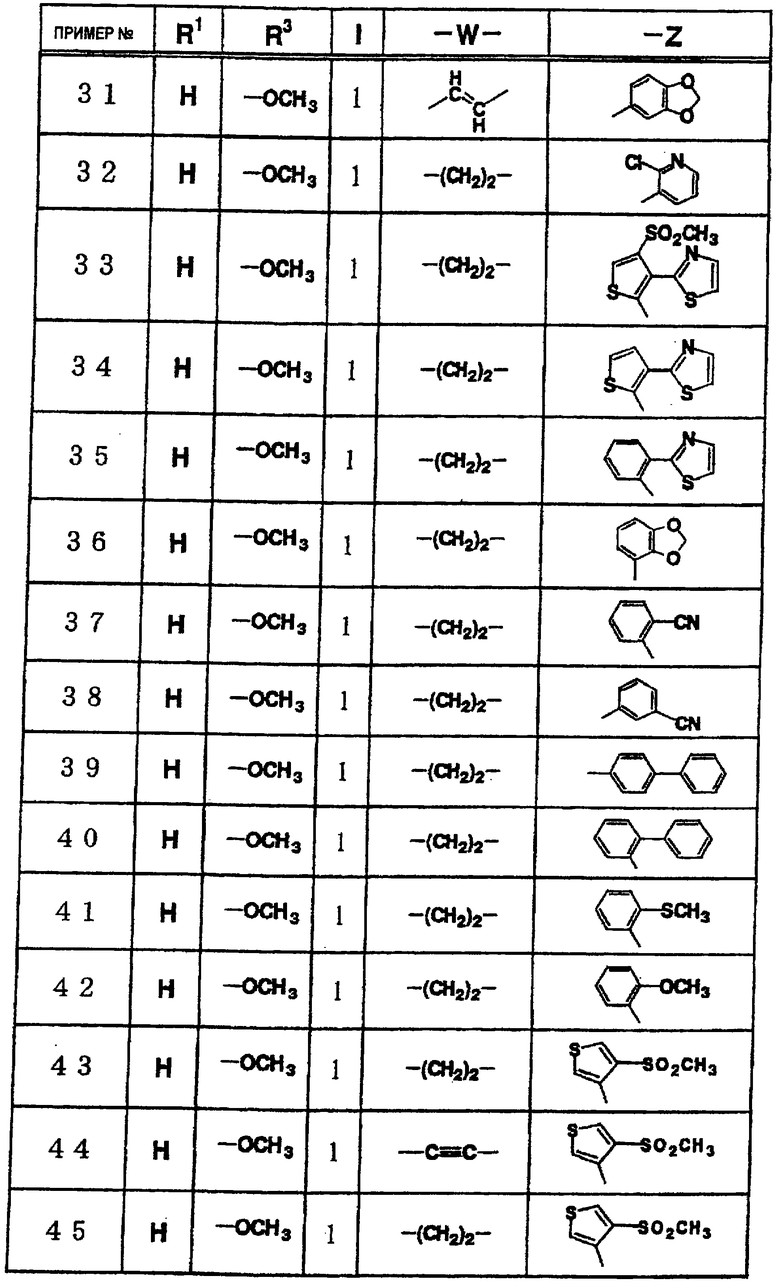
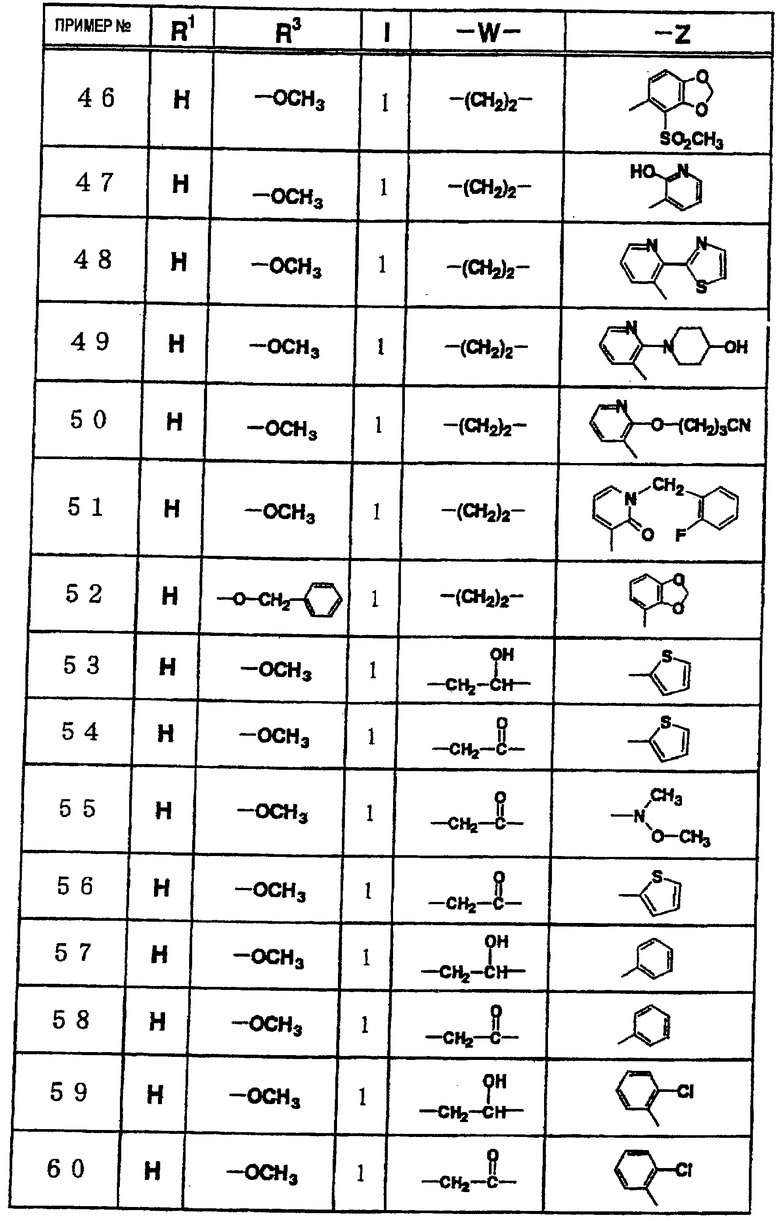

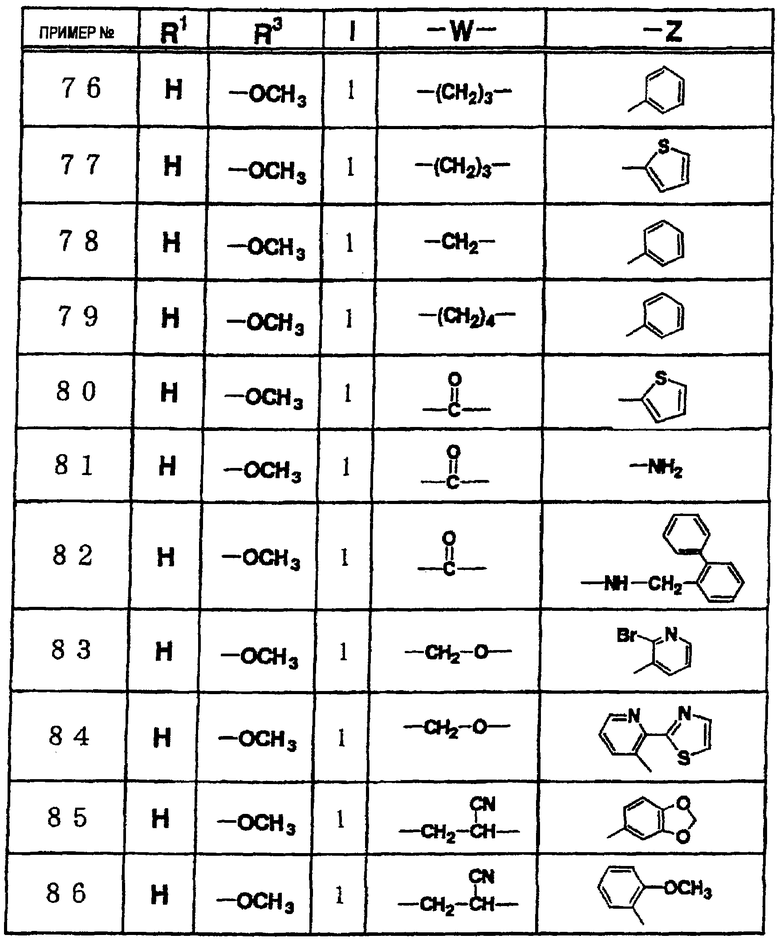
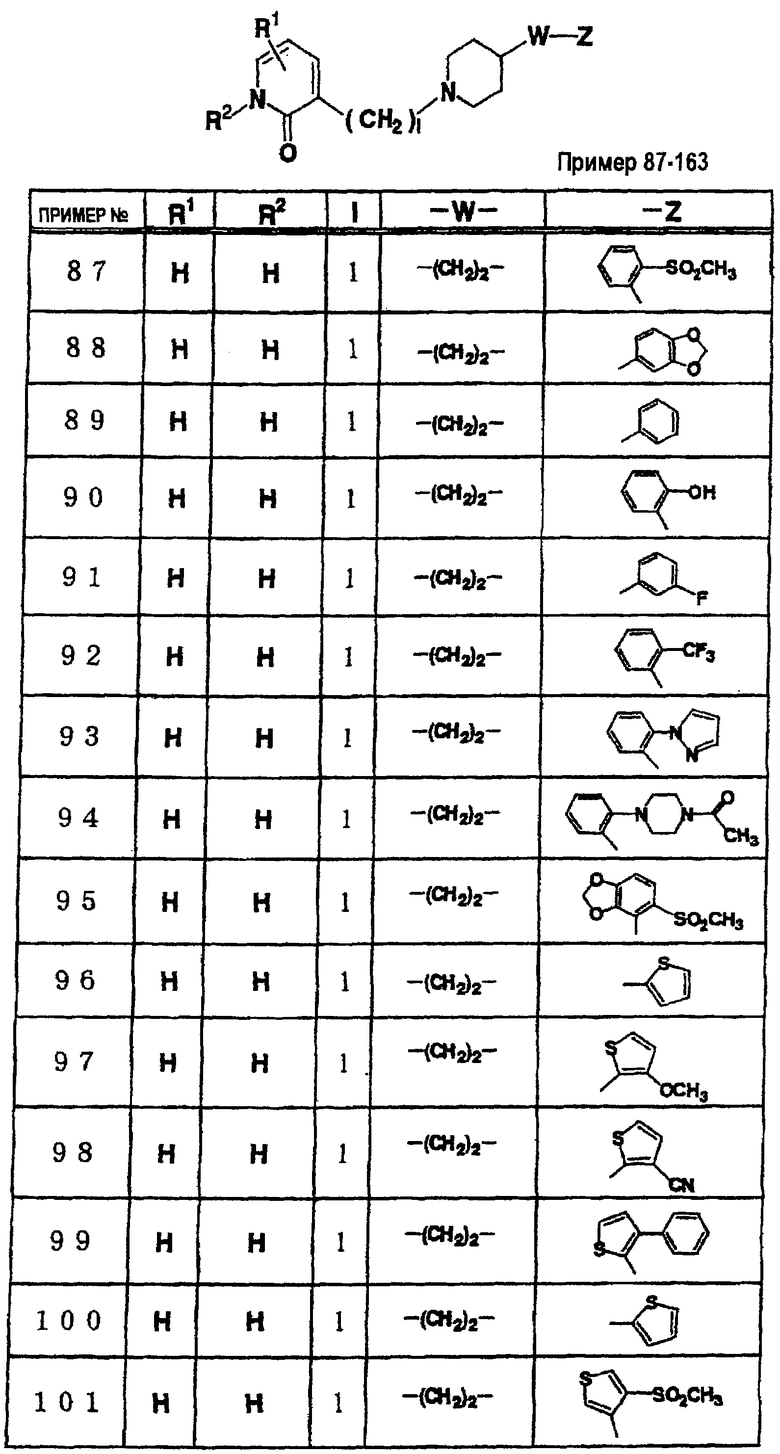


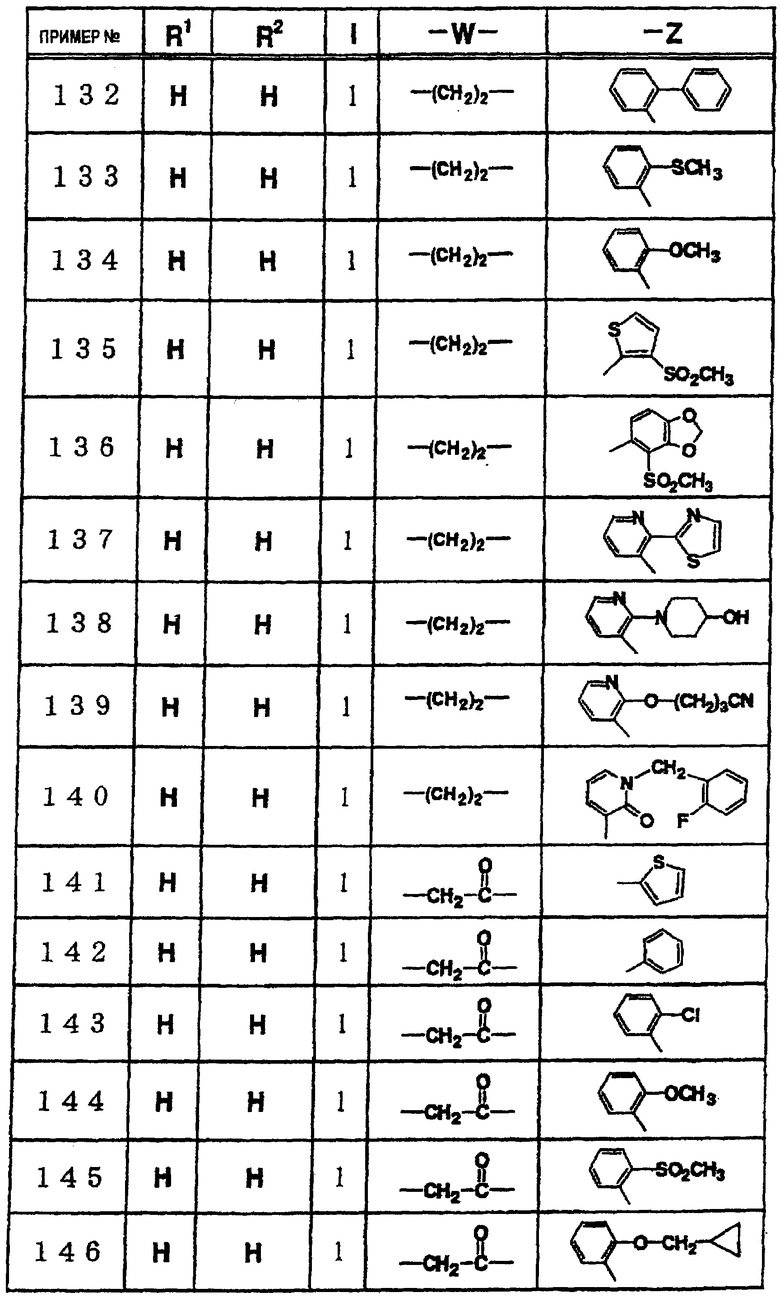
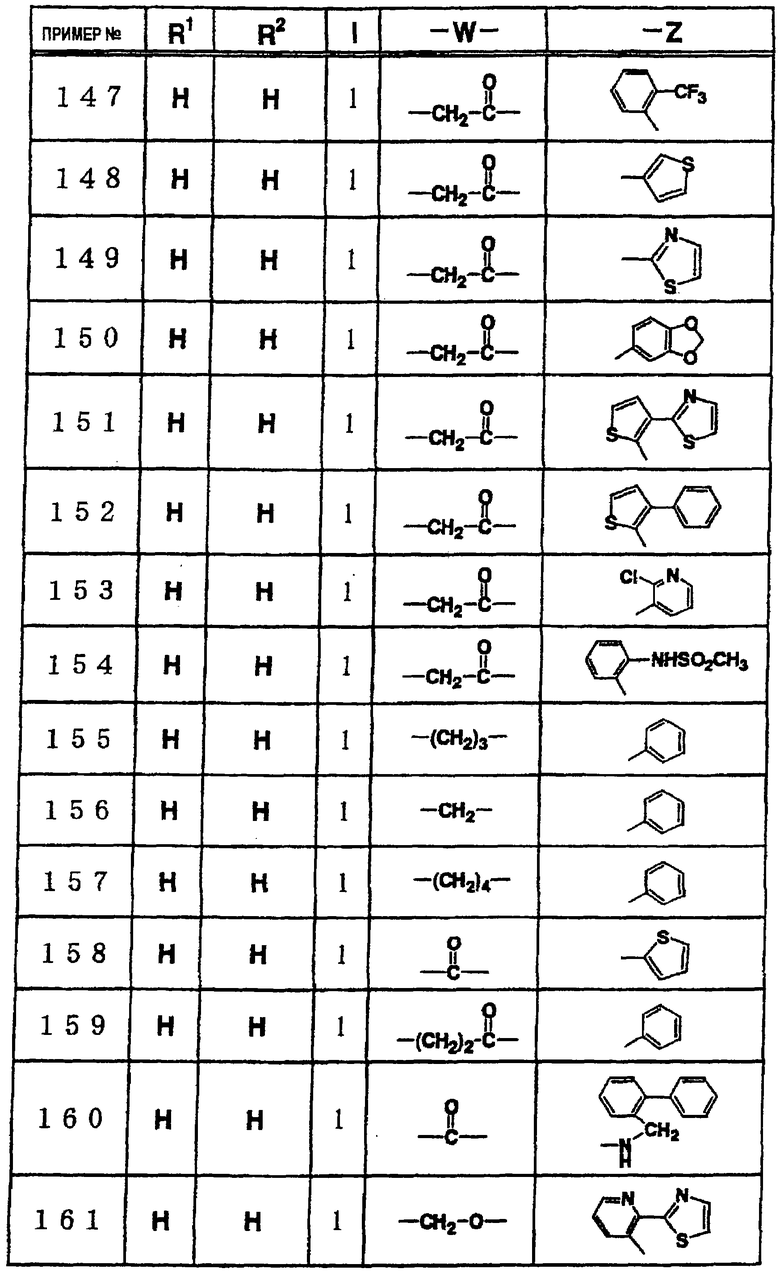
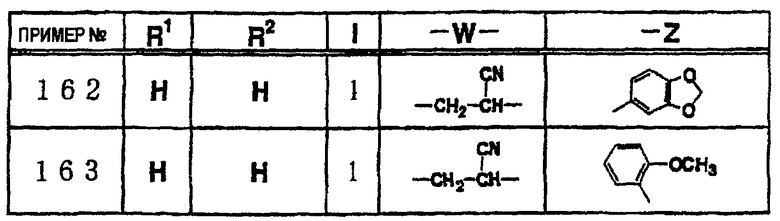
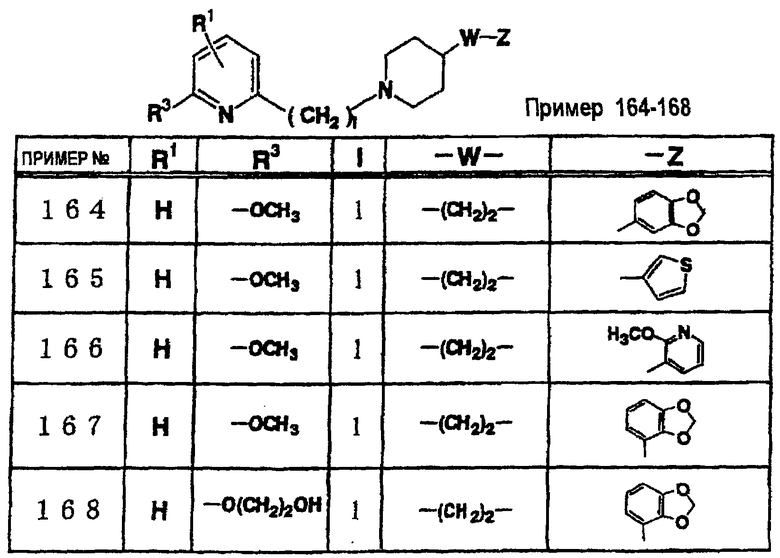
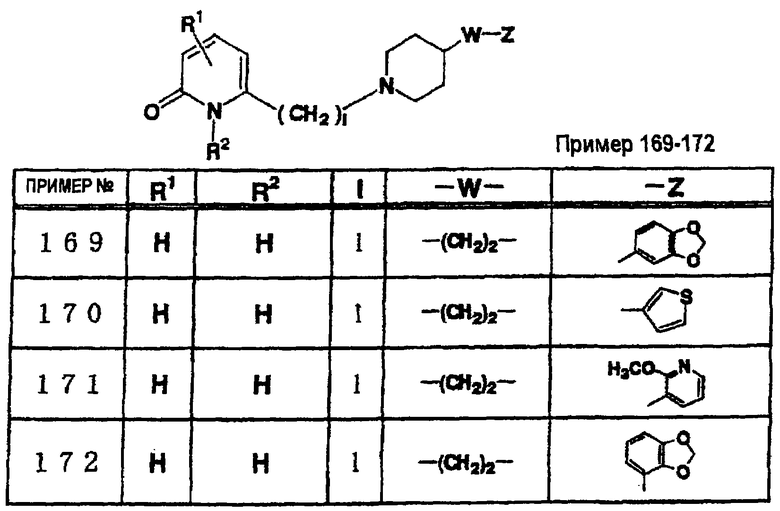
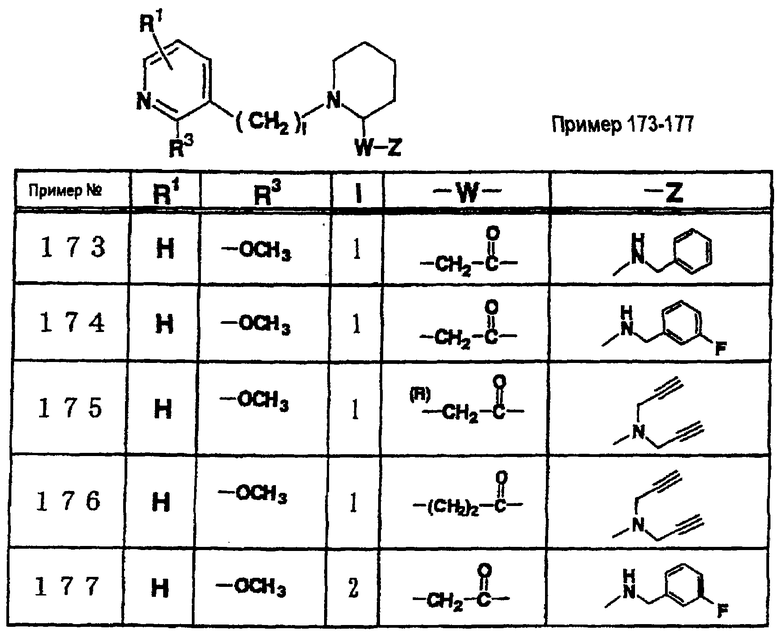
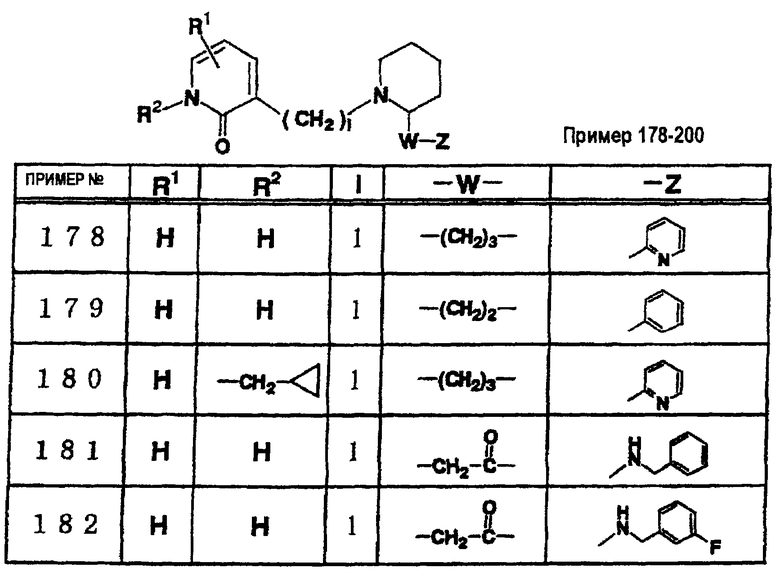
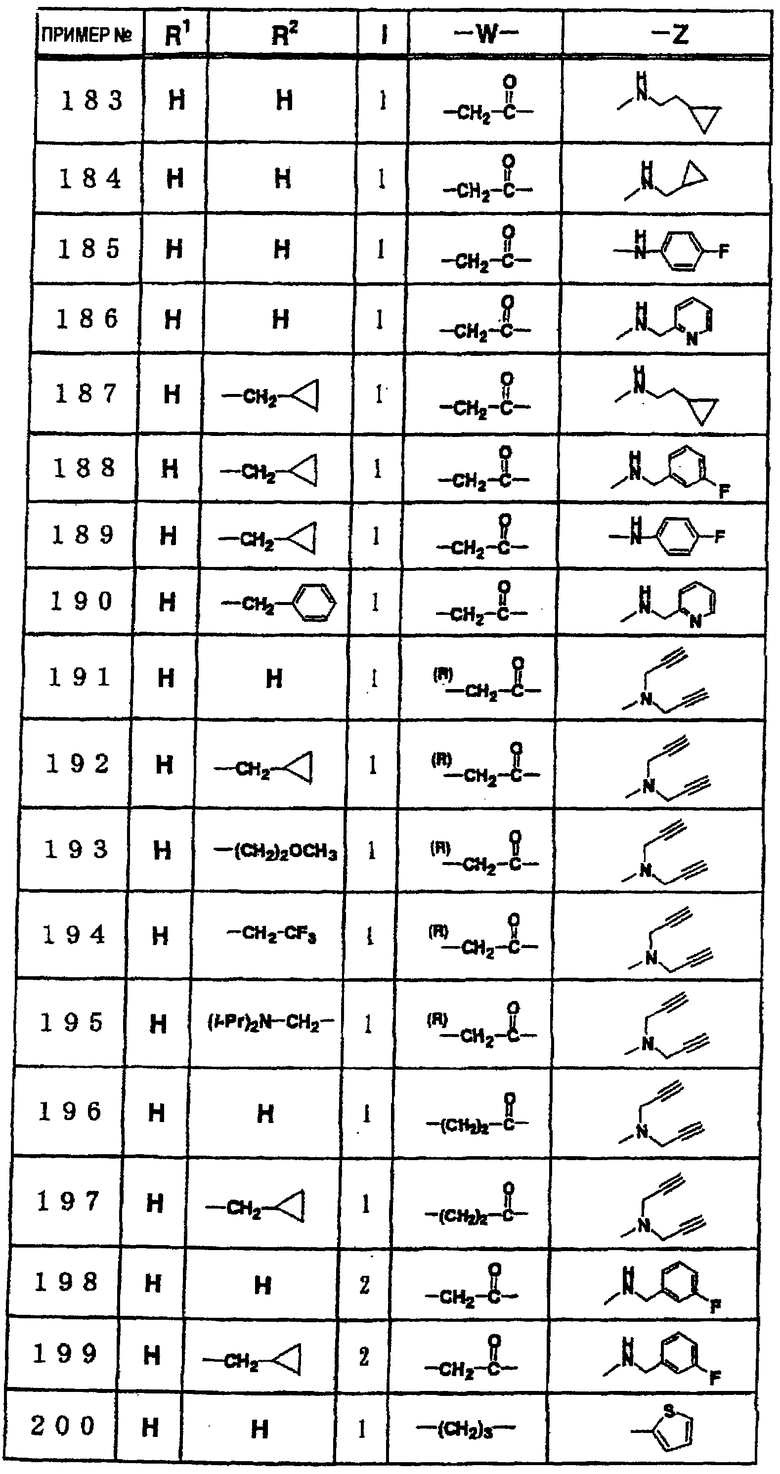
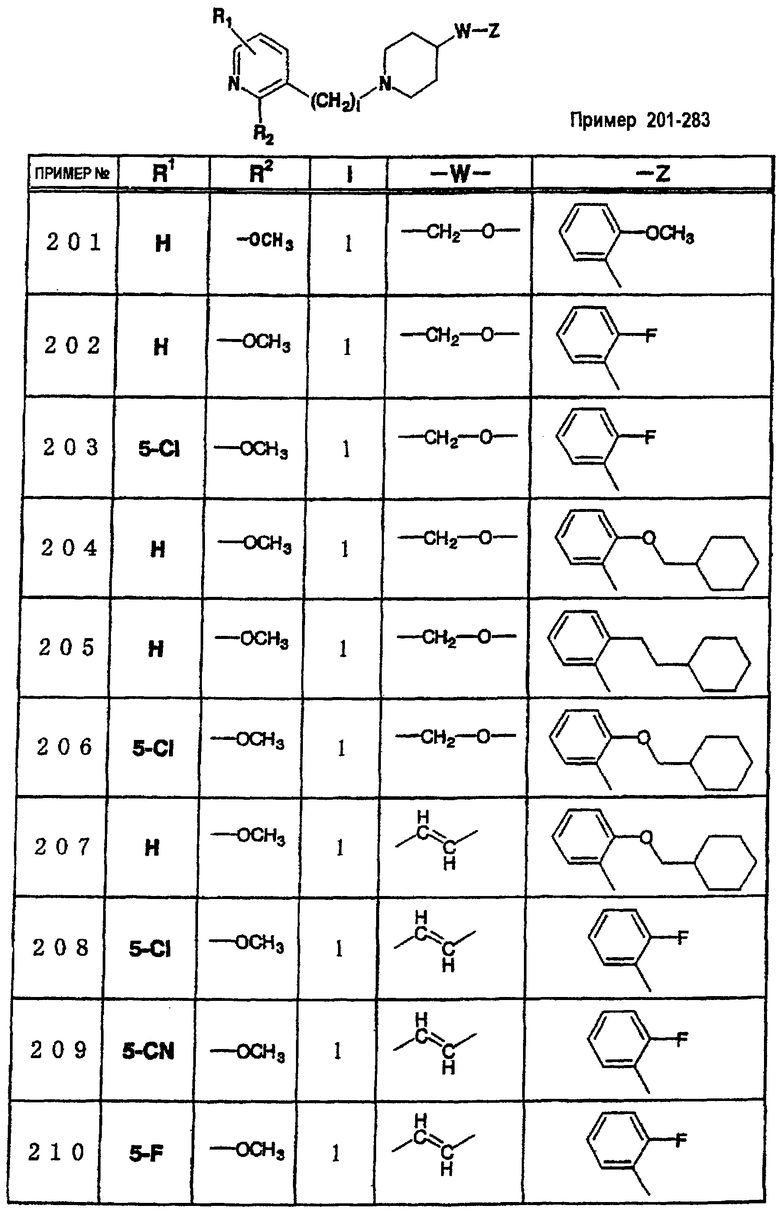
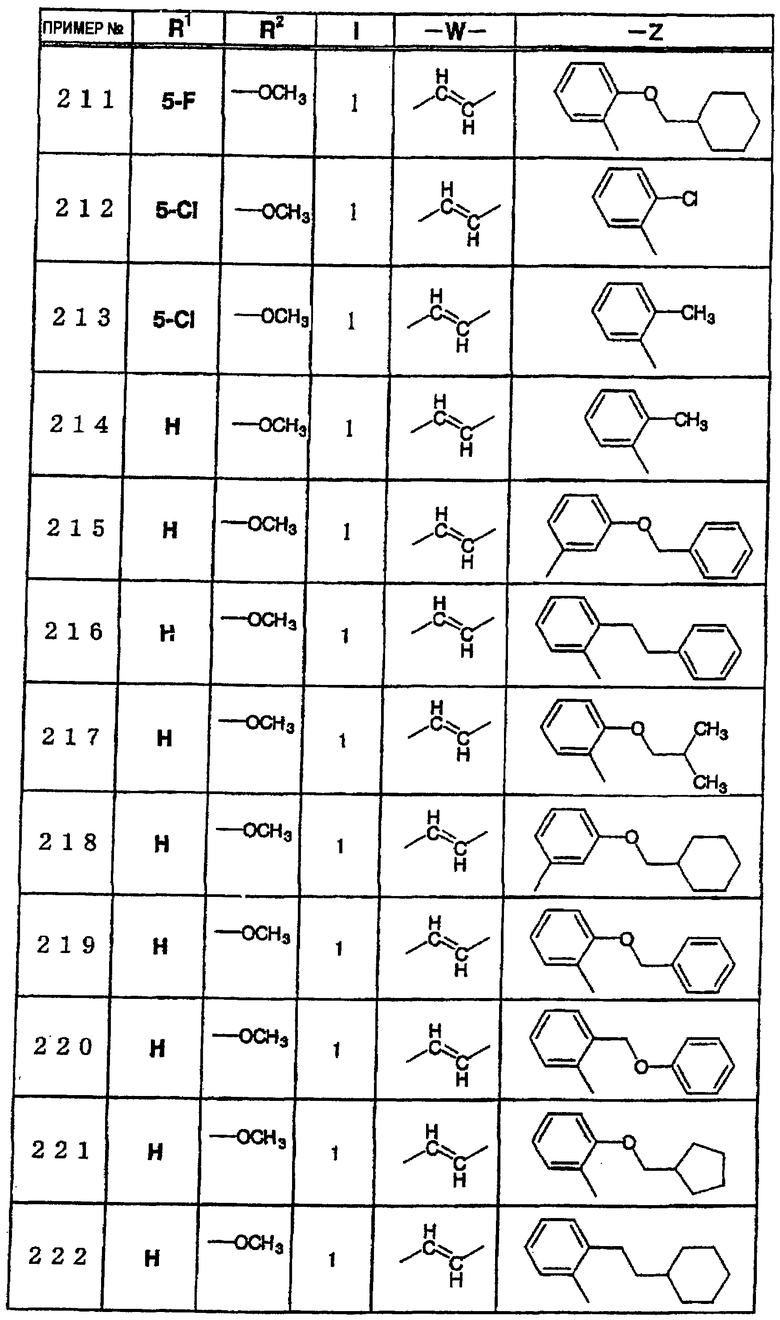
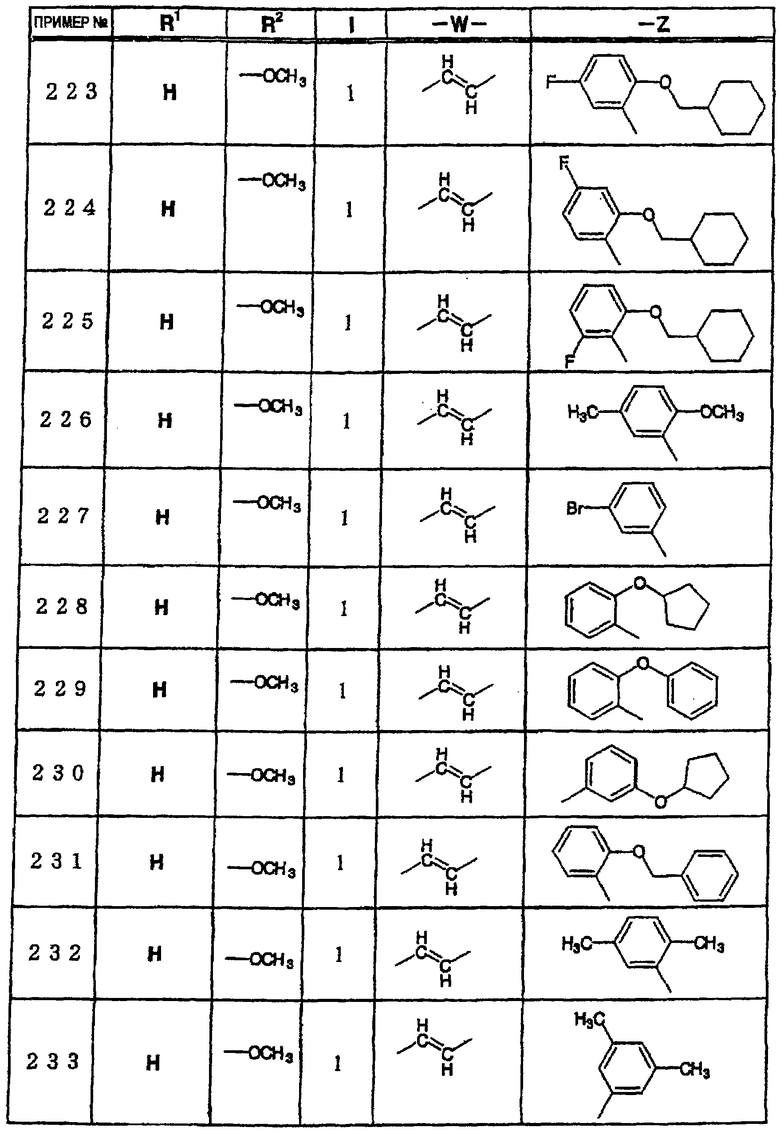

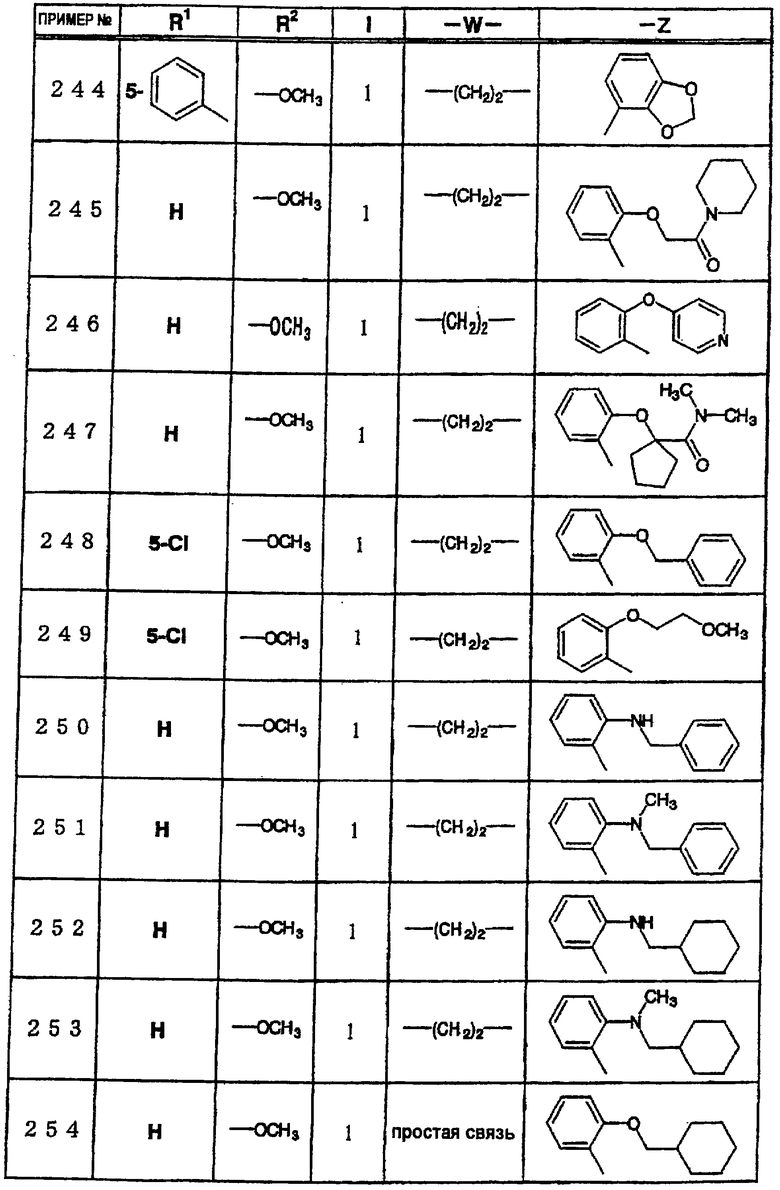
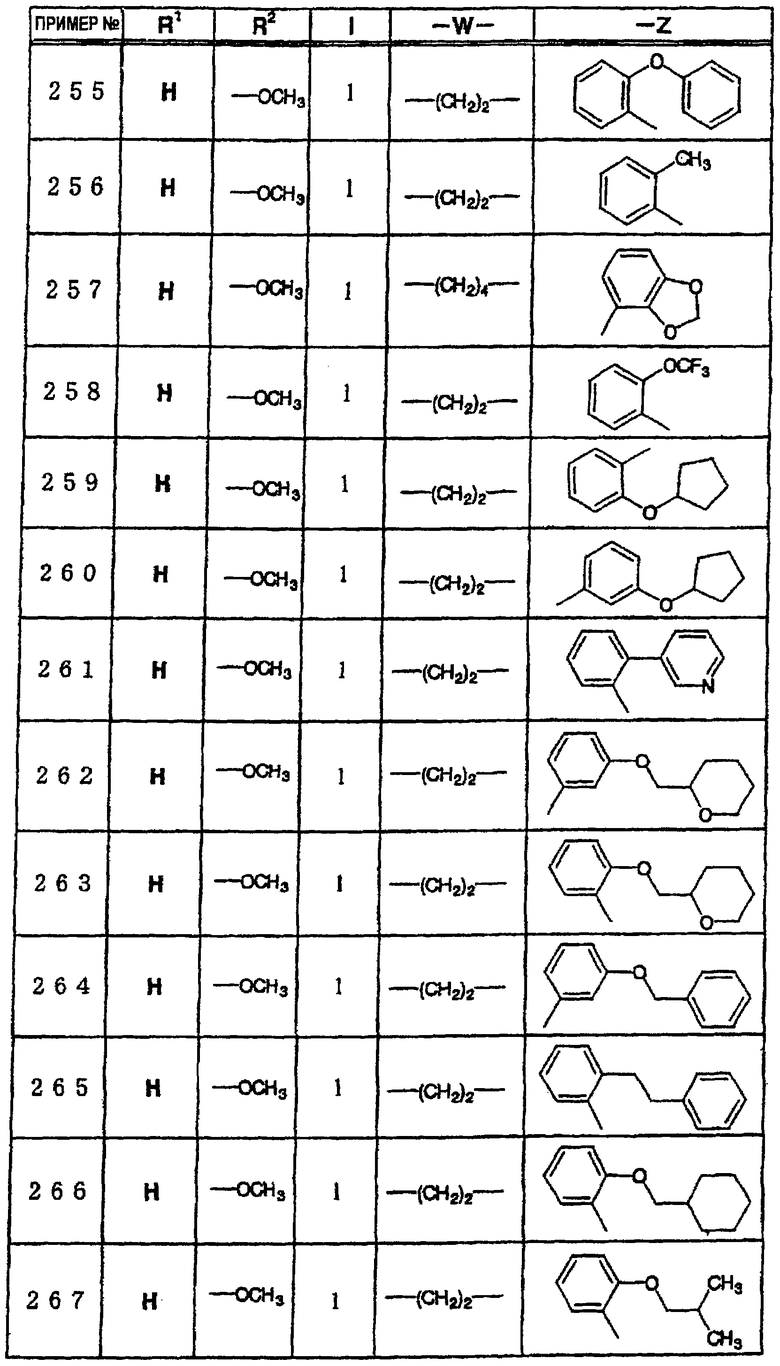
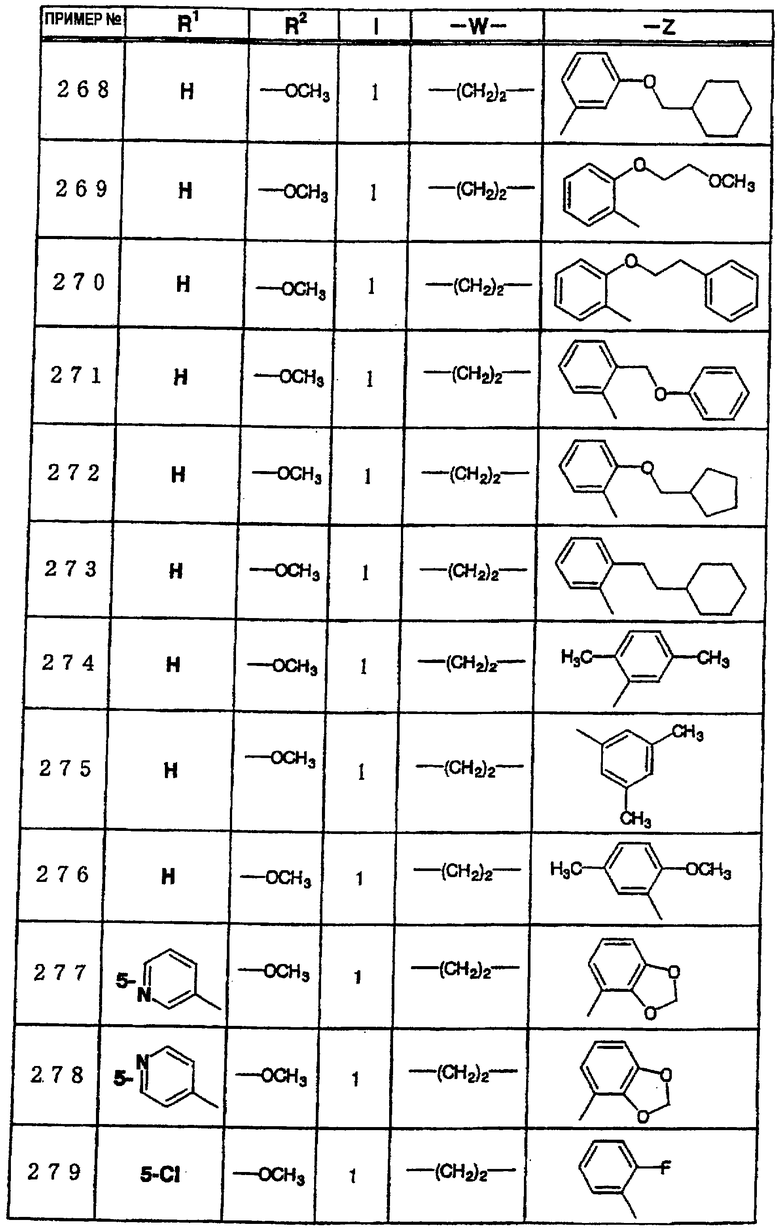
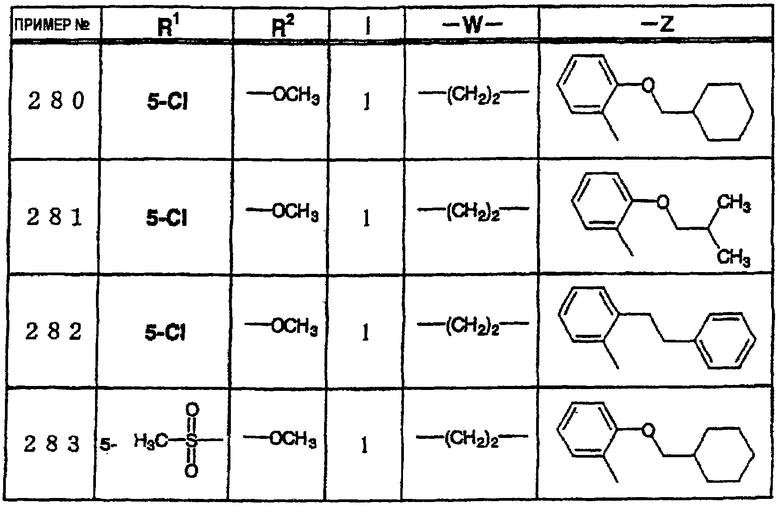
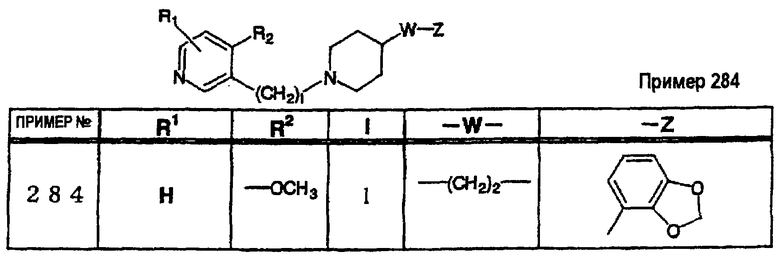
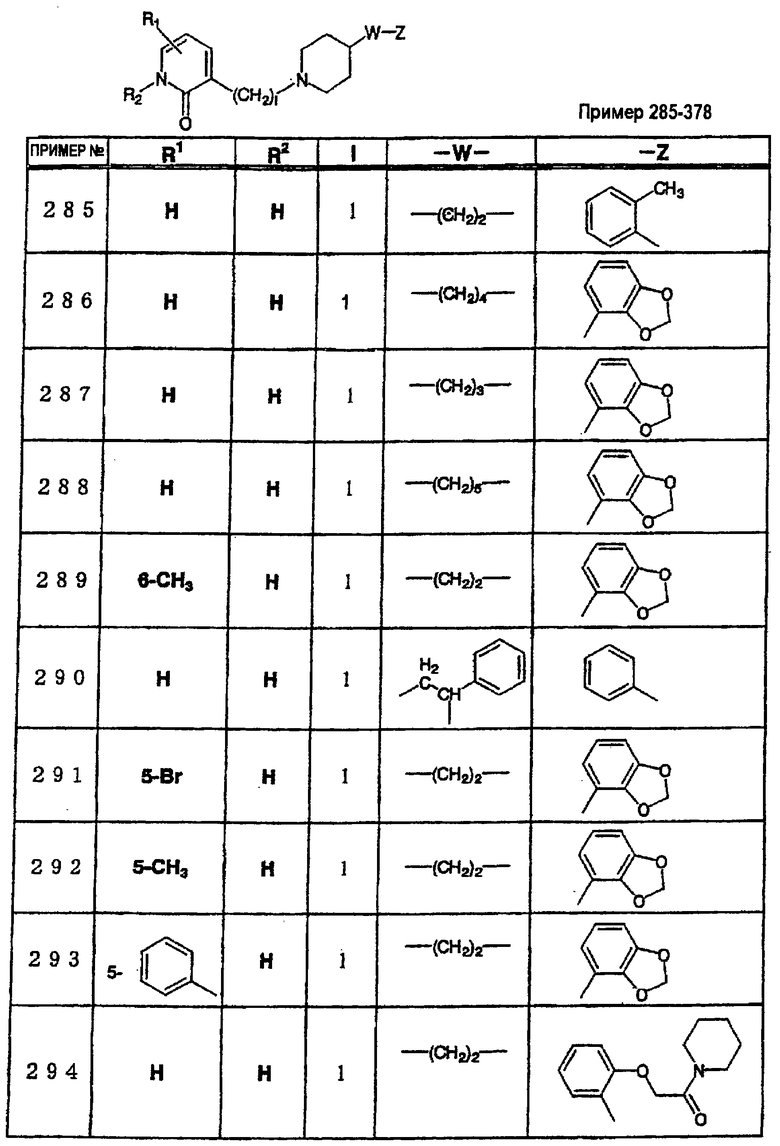

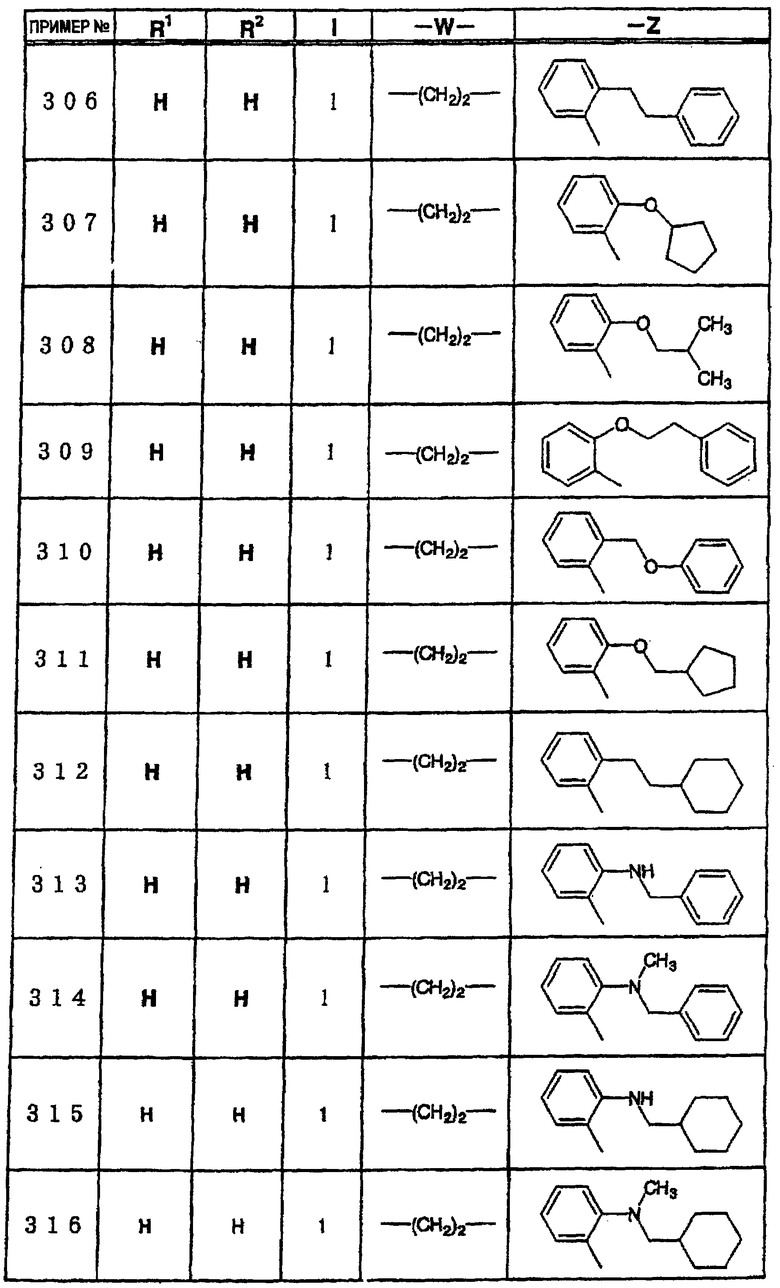
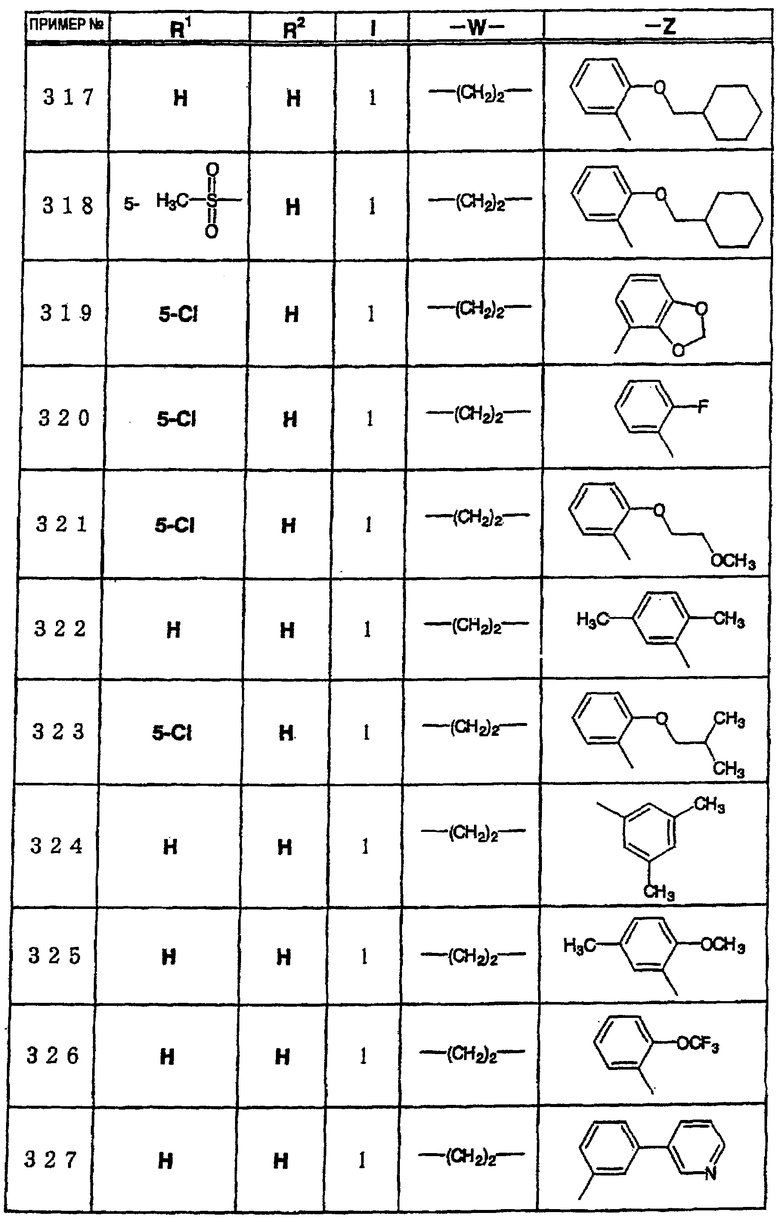
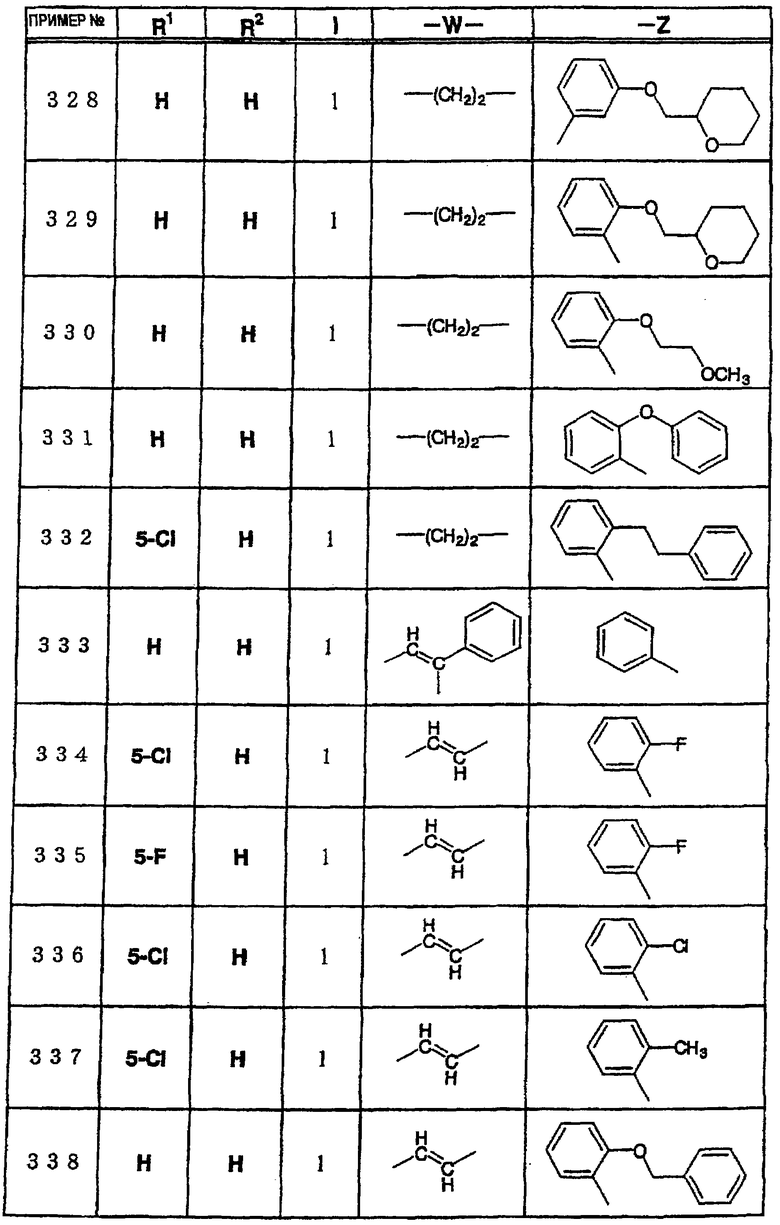
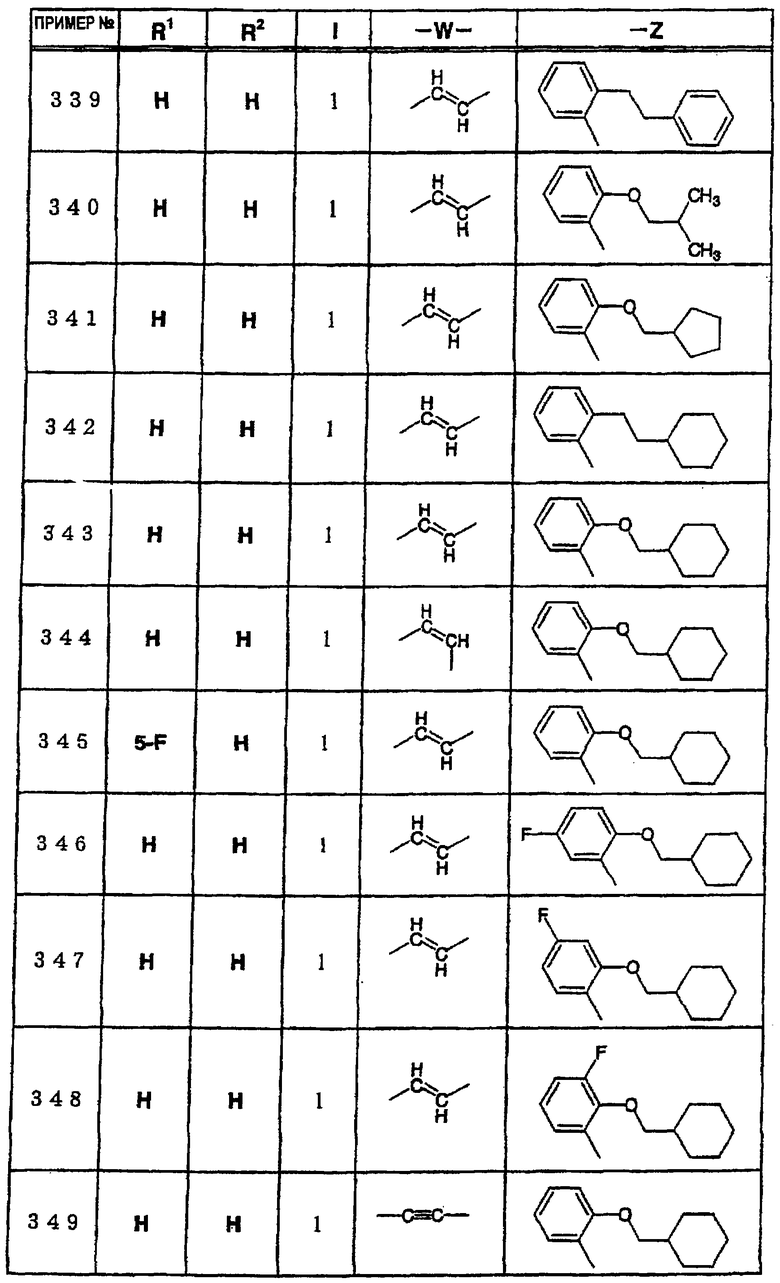
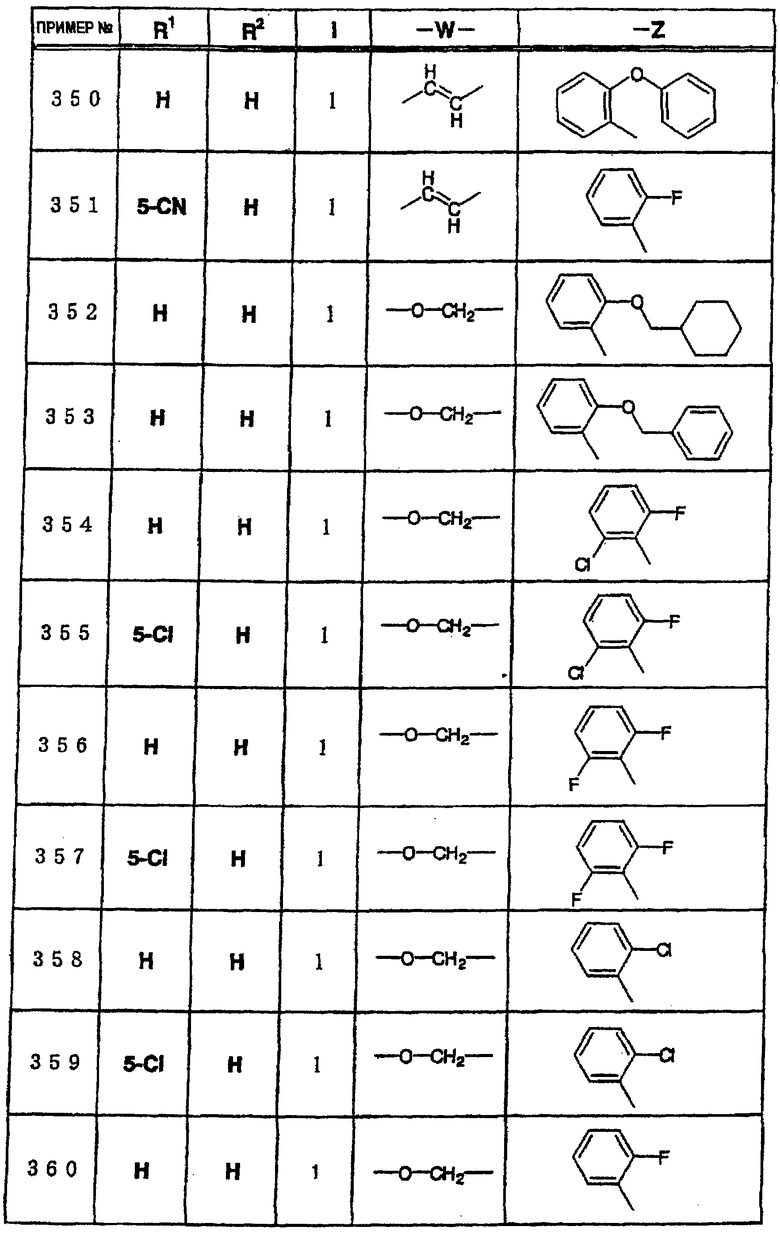

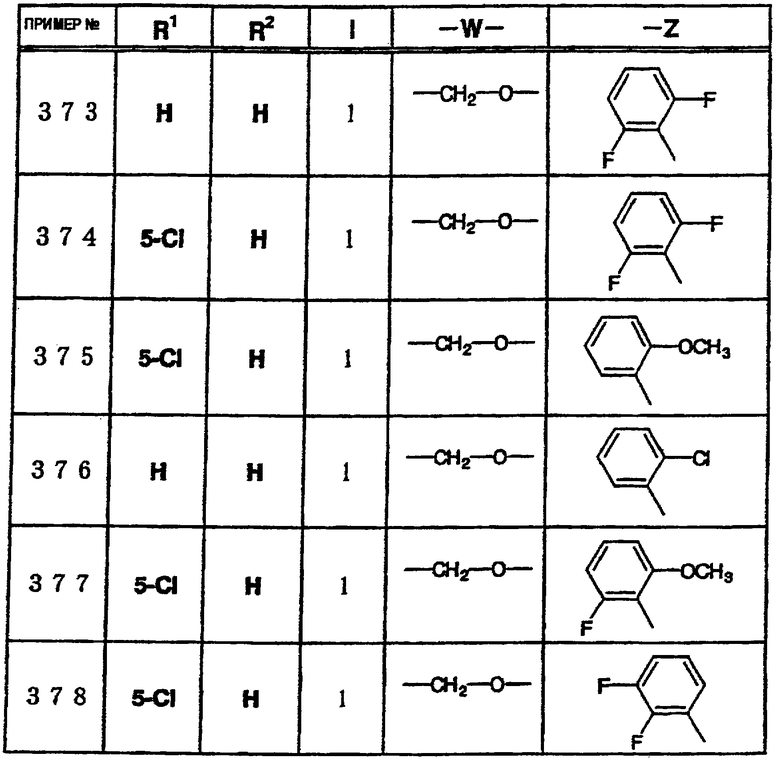
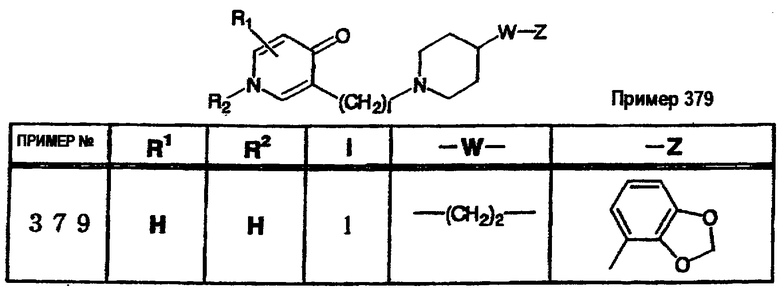
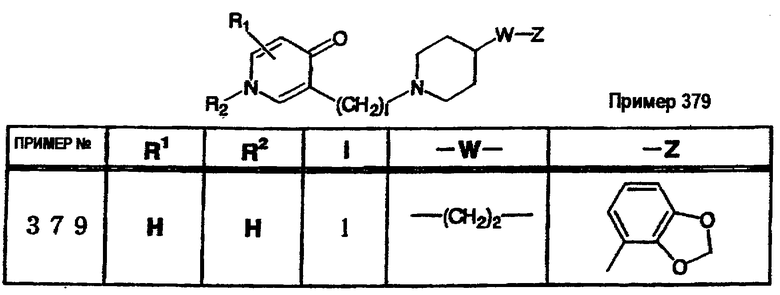
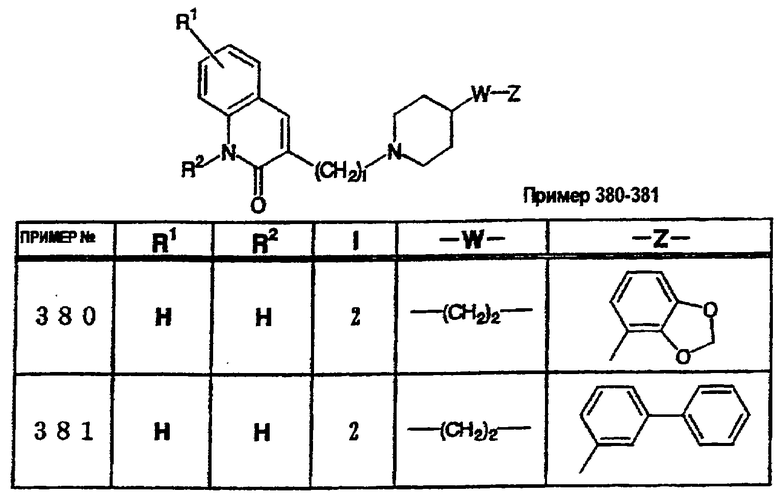
Пример испытаний 1. Эффект прекращения и предупреждения фибрилляции предсердий (ФП) у собак, подвергнутых торакотомии при анестезии.
(1) В настоящем эксперименте использовали собак, подвергнутых торакотомии при анестезии. После вскрытия грудины по линии срединной плоскости и разрезания эпикарда в свободные стенки правого и левого предсердий соответственно вшивали биполярные электроды для определения формы волны потенциала. Кроме того, в свободную стенку правого предсердия вводили проволочный электрод для фиксации и электрической стимуляции. После разрезания шеи по линии срединной плоскости обнажали правый и левый блуждающие нервы. Проволочные электроды для стимуляции блуждающих нервов вставляли вдоль поверхностных слоев с соответствующих обеих сторон для их фиксации и использовали для стимуляции блуждающих нервов.
(2) Электростимуляцию осуществляли при следующих условиях: амплитуда стимуляции составляла 0,1 мс (месс микросекунды); частота стимуляции составляла 20 Гц, а интенсивность стимуляции составляла от 3 до 7 В. Через 5 минут после начала стимуляции правое предсердие подвергали стимуляции с высокой частотой (10 Гц, 1 сек), и были предприняты попытки индуцирования фибрилляции предсердий (далее сокращенно называемой ФП). Интенсивность высокочастотной стимуляции правого предсердия осуществляли, начиная с 1,0 В, а если ФП не индуцировалась, то ее пытались индуцировать посредством увеличения интенсивности стимуляции до 5,0 В. После индуцирования ФП проводили наблюдение в течение 30 минут, которое подтверждало наличие ФП (контрольный эксперимент). Если индуцированная ФП не поддерживалась в течение 30 минут, то эксперимент прекращали.
(3) После подтверждения того, что ФП поддерживается в течение 30 минут или более в контрольном эксперименте, стимуляцию блуждающего нерва прерывали и собаку оставляли на один час для восстановления. После этого снова индуцировали ФП аналогичным образом. Кроме того, стимуляцию блуждающего нерва на этой стадии осуществляли при более высокой интенсивности стимуляции, примерно на 2 В выше, чем в контрольном эксперименте. Через 5 минут после индуцирования ФП вводили тестируемое вещество. Указанное тестируемое вещество вводили в вену в течение 5 минут. После завершения введения проводили наблюдение в течение 5 минут, и если не наблюдалось прекращения ФП, дозу увеличивали и проводили аналогичные наблюдения. Если ФП прекращалась, то сразу после прекращения снова предпринимали попытки индуцировать ФП. На этой стадии, если ФП, которая продолжалась в течение одной минуты или более, индуцировалась снова, то это свидетельствовало о том, что эффект предупреждения отсутствует, и эксперимент проводили аналогичным образом с увеличенной дозой.
(4) Результат (см. таблицу 1): 1/3 образцов продемонстрировали эффект прекращения фибрилляции при дозе 0,3 мг/кг. Для одного образца также подтверждался эффект предупреждения фибрилляции при той же самой дозе. Для двух образцов, для которых эффект прекращения фибрилляции не был подтвержден при дозе 0,3 мг/кг, проводили испытание с увеличенной дозой до 1 мг/кг. В результате эффект прекращения был подтвержден для 2/2 образцов, а также был подтвержден эффект предупреждения.
В данной таблице число в знаменателе означает число образцов, используемых в данном испытании, а число в числителе означает число образцов, в которых данный эффект был подтвержден.
Пример испытаний 2. Эффективный рефрактерный период (ЭРП) у собак, подвергнутых торакотомии при анестезии.
(1) В настоящем эксперименте использовали собак, подвергнутых торакотомии при анестезии. После вскрытия грудины по линии срединной плоскости и разрезания эпикарда в свободные стенки правого и левого предсердий соответственно вшивали биполярные электроды для определения формы волны потенциала. Кроме того, в свободную стенку фиксируемого правого предсердия вводили проволочный электрод для фиксации и электрической стимуляции.
(2) Прибор для программной электрической стимуляции подсоединяли к электроду для электростимуляции в правом предсердии, затем осуществляли периодическую электростимуляцию с продолжительностью 500 мс и измеряли порог электрической стимуляции. Для осуществления стимуляции интенсивность электрической стимуляции для нижеописанных экспериментов устанавливали на величину, которая в 3 раза превышала этот порог. Однако, если указанный порог составлял 0,7 В или менее, то электрическую стимуляцию проводили при 2,0 В. Эффективный рефрактерный период (ЭРП) предусматривал раннюю преждевременную стимуляцию (S2) после основной стимуляции (S1), проводимой 10 раз, и наиболее длинный период сопряжения, при котором потенциал предсердий не генерировался преждевременной стимуляцией, называли ЭРП, при укорочении периода сопряжения (S1-S2) на 5 мс. Аналогичные эксперименты были также проведены и для соответствующей продолжительности основной стимуляции (BCL) 400, 300, 250 и 200 мс (контрольный эксперимент: 1 серия). После осуществления 2 или нескольких контрольных экспериментов и подтверждения того, что ЭРП является стабильным, вводили тестируемое вещество и проводили аналогичные измерения. Затем, после однократного введения в вену тестируемого вещества в течение 5 минут, в вену вводили его поддерживающую дозу. Через 10 минут после начала введения поддерживающей дозы измеряли ЭРП при соответствующей частоте стимуляции. После завершения одной серии измерений концентрацию тестируемого вещества увеличивали и аналогичные эксперименты повторяли. ЭРП и время проводимости в предсердии при соответствующей частоте стимуляции сравнивали с различными показателями, полученными в контрольных условиях. Результаты представлены в виде средних значений.
(3) Результат: соединение настоящего изобретения или его соль или гидрат способно к эффективному прекращению или предупреждению фибрилляции предсердий и дает превосходный эффект удлинения эффективного рефрактерного периода мышцы предсердия (см. таблицы 2 и 3).
(1) Измерение величины ЭРП (мс)
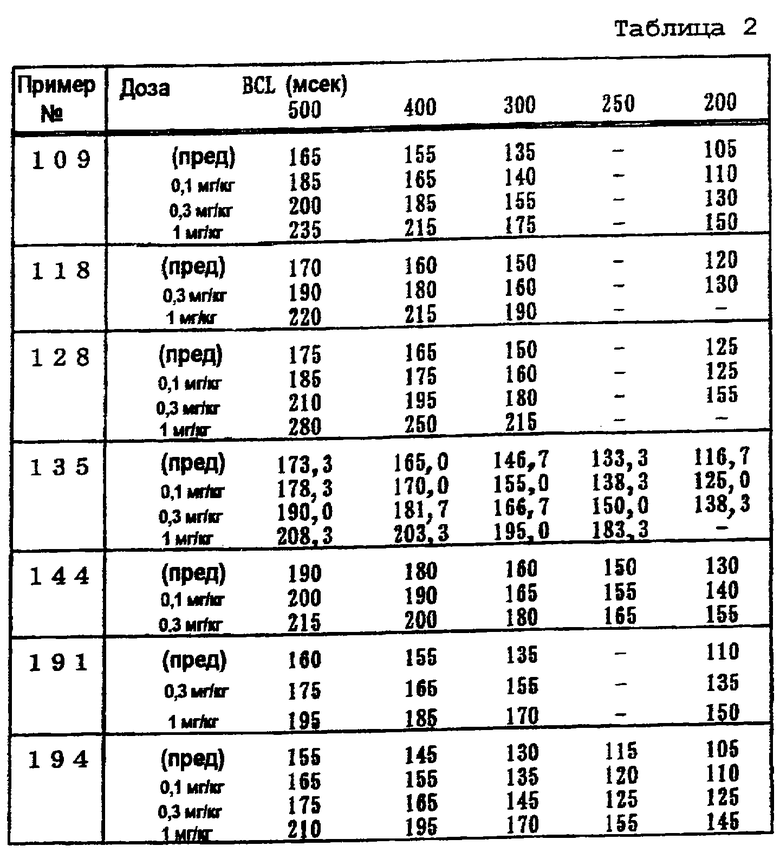
(2) Коэффициент вариации (d%) ЭРП
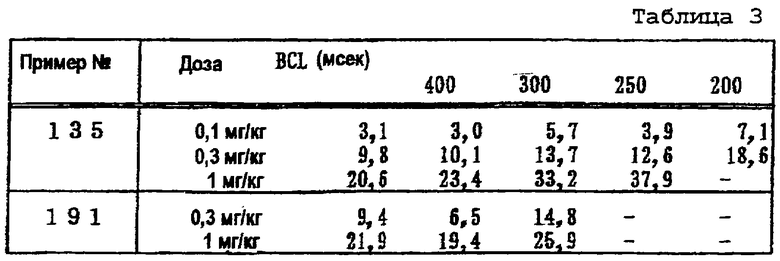
Пример испытаний 3. Анализ на натриевые каналы синаптосомы коры головного мозга крысы.
В настоящем эксперименте использовали синаптосому, которая была извлечена из коры головного мозга крысы. После включения ионочувствительного красителя, SBFI, синаптосому подвергали реакции с соответствующими тестируемыми веществами (3 образца в 6 концентрациях) при комнатной температуре в течение 15 минут в 96-луночном планшете. Активность ингибирования натрия измеряли с использованием приборов FDSS2000 от HAMAMATSU Photonics Co., Ltd. Концентрацию натриевых ионов в синаптосоме измеряли через каждые 5 секунд с использованием интенсивности флуоресценции SBFI в качестве показателя. После 10-кратного измерения контрольной величины добавляли вератридин до конечной концентрации 20 мкМ, после чего проводили измерение 30 раз. Затем вычисляли величину ингибирующей активности тестируемых веществ по отношению к натриевому каналу, где действие лишь одного раствора, не содержащего тестируемого вещества, принимали за 0%, а ингибирующую активность, индуцированную 2 мкМ ТТХ, которую использовали в качестве позитивного контроля, принимали за 100%, и где величину ингибирующей активности, соответствующую этому действию, измеряли с использованием в качестве показателя увеличения интенсивности флуоресценции SBFI по отношению к контрольному значению, которое было получено после добавления вератридина. В результате этого было установлено, что соединение настоящего изобретения обладает превосходным действием, направленным на ингибирование натриевых каналов, как показано в таблице 4 (величина SBFI (IC50 мкМ)).
Пример испытаний 4. Анализ Vmax для мышцы предсердий кролика.
В настоящем эксперименте использовали образец мышцы правого предсердия кролика, которая была подвергнута энуклеации. Электрическую стимуляцию осуществляли для энуклеированной мышцы правого предсердия при следующих условиях: амплитуда стимуляции составляла 1 мс, частота стимуляции составляла 4 Гц, а интенсивность стимуляции была примерно в 1,2 раза выше пороговой. Перед началом эксперимента проводили стимуляцию в течение 30 - 60 минут, и состояние образца было стабилизировано. Потенциал действия регистрировали методом с использованием тонкого стеклянного электрода. Этот стеклянный электрод нагружали 3 М КСl, вводили в образец правого предсердия и регистрировали потенциал действия. Vmax представляет собой параметр, означающий максимальное увеличение скорости регистрируемого потенциала действия, при этом была использована величина, которую автоматически вычисляли с помощью программы для анализа потенциала действия (программы САРА 1.23, разработанный Physiotec.Co., Ltd.). После регистрации потенциала действия в нормальном растворе Тироде, используемом в качестве контроля, регистрировали потенциал действия после непрерывного введения в течение 15 минут тестируемых веществ в соответствующих концентрациях. Влияние тестируемого вещества на Vmax вычисляли как величину IC50. Результат, представленный в таблице 4 (Vmax (IC50 мкМ)), подтвердил, что соединение настоящего изобретения обладает превосходным действием на Vmax.
Пример испытаний 5. Супрессия спонтанного возбуждения нерва.
Для оценки супрессорного действия на спонтанное возбуждение нерва осуществляли эксперимент нижеследующим методом, описанным "Burchiel, K.J., Exp. Nuerol., 102, 249-253 (1988)". А именно, для крыс, у которых наблюдалось спонтанное самовозбуждение, за одну неделю до эксперимента или более вырезали левый подкожный нерв возле синовиального соединения колена и примерно 3 мм этого нерва отрезали так, чтобы этот нерв снова не присоединялся. Левый подкожный нерв обрабатывали при анестезии уретаном (1 г/кг массы тела) и примерно 1 см смежной области из отрезанной части отделяли от периферической ткани. Кроме того, в вену правой части шеи предварительно вставляли катетер для введения соединения. Отделенный нерв подсоединяли к платиновому крючкообразному электроду и на него наносили путем напыления жидкий парафин для предотвращения подсыхания нерва. Этот электрод подсоединяли к усилителю для тонких электродов и величину регистрировали на компьютере через аналого-цифровой (АЦ) преобразователь с осциллоскопа. Зарегистрированное возбуждение нерва анализировали по числу возбуждений за 10 секунд с использованием аналитической программы (AcqKnowledge). Результат, представленный в таблице 4 (эктопическое возбуждение (IC50, мг/кг)), показал, что соединение настоящего изобретения обладает превосходным супрессорным действием на спонтанное возбуждение нерва.
SBFI (IC50, мкМ)
Vmax (IC50, мкМ)
Эктопическое возбуждение (IC50, мк/кг)
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ НЕРВНЫХ КЛЕТОК, СПОСОБ ПРОФИЛАКТИКИ | 2001 |
|
RU2230060C2 |
| ПИРАЗОЛО [1, 5-А] ПИРИДИНЫ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2308457C2 |
| ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ 2Н-ПИРАЗОЛА | 2016 |
|
RU2722363C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПРОТИВООПУХОЛЕВЫХ ЦЕЛЕВЫХ ФЕРМЕНТОВ | 2002 |
|
RU2319482C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА | 2004 |
|
RU2359971C2 |
| ХИНОЛИНОВЫЕ И ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2000 |
|
RU2256654C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МУСКАРИНОВЫЕ АГОНИСТЫ И КОМПОЗИЦИИ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ЛЕЧЕНИЯ | 2002 |
|
RU2292346C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛПИРИМИДИНОНА, СПОСОБ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2263676C2 |
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
| СОЕДИНЕНИЯ 1,2-ДИГИДРОПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2265015C2 |
Изобретение относится к новым пиперидиновым соединениям общей формулы I, где А предпочтительно кольцо формулы
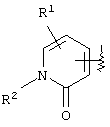
где R1 - Н, галоген, CN, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-C8циклоалкил, С3-С8циклоалкенил, C1-С6алкокси, C1-С6алкилтиогруппа, W - С1-С6алкилен, возможно замещенный, простая связь, Z - необязательно замещенная С6-С14ароматическая углеводородная циклическая группа, l - число от 0 до 6. Соединения обладают превосходной активностью, направленной на ингибирование натриевых каналов и селективное ингибирование калиевых каналов. 4 н. и 22 з.п. ф-лы, 4 табл.
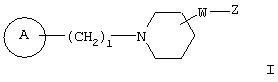
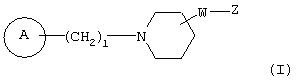
причем в указанной формуле кольцо А означает кольцо, представленное формулами
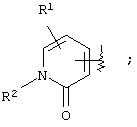
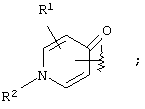
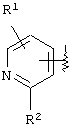
или 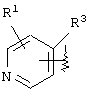
где R1 означает (1) атом водорода, (2) атом галогена, (3) цианогруппу, (4) необязательно замещенную С1-6алкильную группу, (5) необязательно замещенную С2-6алкенильную группу, (6) необязательно замещенную С2-6алкинильную группу, (7) необязательно замещенную С3-8циклоалкильную группу, (8) необязательно замещенную С3-8циклоалкенильную группу, (9) необязательно замещенную C1-6алкоксигруппу, (10) необязательно замещенную С1-6алкилтиогруппу, (11) необязательно замещенную С1-6алкилсульфинильную группу, (12) необязательно замещенную С1-6алкилсульфонильную группу, (13) необязательно замещенную С6-14ароматическую углеводородную циклическую группу или (14) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу;
R2 представляет (1) атом водорода, (2) необязательно замещенную C1-6алкильную группу, (3) необязательно замещенную С2-6алкенильную группу, (4) необязательно замещенную С2-6алкинильную группу, (5) необязательно замещенную С3-8циклоалкильную группу, (6) необязательно замещенную С3-8циклоалкенильную группу, (7) необязательно замещенную аминогруппу, (8) необязательно замещенную С6-14ароматическую углеводородную циклическую группу или (9) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу; и
R3 представляет (1) необязательно замещенную С1-6алкоксигруппу, (2) необязательно замещенную С2-6алкенилоксигруппу, (3) необязательно замещенную С3-7циклоалкилоксигруппу или (4) необязательно замещенную С3-7циклоалкенилоксигруппу;
W представляет (1) простую связь, (2) необязательно замещенную C1-6алкиленовую группу, (3) необязательно замещенную С2-6алкениленовую группу, (4) необязательно замещенную С2-6алкиниленовую группу или (5) группу, представленную формулой -U-V-, где U означает (i) простую связь, (ii) атом кислорода, (iii) атом серы, (iv) группу, представленную формулой -NH-, (v) необязательно замещенную С1-6алкиленовую группу, (vi) необязательно замещенную С2-6алкениленовую группу или (vii) необязательно замещенную С2-6алкиниленовую группу; V означает (i) простую связь, (ii) необязательно замещенную C1-6алкиленовую группу, (iii) необязательно замещенную С2-6алкениленовую группу, (iv) необязательно замещенную С2-6алкиниленовую группу, (v) атом кислорода, (vi) атом серы или (vii) группу, представленную формулой -СО-, (viii) -SO- или (ix) -SO2-, при условии, что исключается случай, где U и V представляют одну и ту же группу в вышеуказанном определении, и один из U и V представляет простую связь, необязательно замещенную С1-6алкиленовую группу, необязательно замещенную С2-6алкениленовую группу или необязательно замещенную С2-6алкиниленовую группу;
Z представляет (1) необязательно замещенную С6-14ароматическую углеводородную циклическую группу, (2) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу или (3) группу, представленную формулой -N(R4)R5 (где R4 и R5 могут быть одинаковыми или различными и каждый из них представляет (i) атом водорода, (ii) необязательно замещенную C1-6алкильную группу, (iii) необязательно замещенную С2-6алкенильную группу, (iv) необязательно замещенную С2-6алкинильную группу, (v) необязательно замещенную С3-8циклоалкильную группу, (vi) необязательно замещенную С3-8циклоалкенильную группу, (vii) необязательно замещенную С6-14ароматическую углеводородную циклическую группу, (viii) необязательно замещенную 5-14-членную ароматическую гетероциклическую группу или (ix) С1-6алифатическую ацильную группу, либо (х) R4 и R5 могут быть связаны вместе с образованием 3-8-членной азотсодержащей циклической группы; и
l означает целое число от 0 до 6.
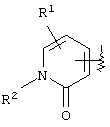
где R1 и R2 имеют значения, определенные выше, соответственно.
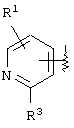
где R1 и R3 имеет значения, определенные выше, соответственно.
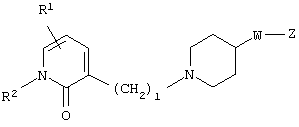
где R1, R2, W, Z и l имеют те же значения, которые были определены в вышеуказанном п.1.
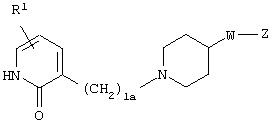
где R1, W и Z имеют те же значения, которые были определены в вышеуказанном п.1, соответственно, a la представляет целое число 1 или 2.
1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(ииклогексилметилокси)фенил]этил]пиперидин,
1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2,3-(метилендиокси)фенил]этил]пиперидин,
1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(фторфенил]этил]пиперидин,
1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-[2-(изобутилокси)фенил]этил]пиперидин,
1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин,
1-[(5-фтор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-(2-фторфенил)-1-этенил]пиперидин,
1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[2-(бензилокси)фенил]-1-этенил]пиперидин,
1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин,
1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Z)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин,
1-[(5-фтор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(Е)-2-[(2-циклогексилметилокси)фенил]-1-этенил]пиперидин,
1-[(2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2-(2-циклогексилметилокси)фенил]-1-этинил]пиперидин,
1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2,4-(дифторфенокси)метил]пиперидин или
1-[(5-хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[2,5-(дифторфенокси)метил]пиперидин, их соль или гидрат.
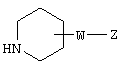
где W и Z имеют значения, определенные выше в п.1, соответственно, с пиридиновым производным, представленным формулой
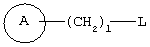
где кольцо А и l имеют такие же значения, которые были определены выше в п.1, соответственно, a L представляет уходящую группу;
его солью или реакционноспособным производным в растворителе методом восстановительного аминирования или посредством их конденсации в присутствии основания.
| РАБОТАЮЩАЯ БЕЗ СМАЗКИ СИСТЕМА УПЛОТНЕНИЯ ШТОКА И СПОСОБ УПЛОТНЕНИЯ ШТОКА С ПОМОЩЬЮ РАБОТАЮЩЕЙ БЕЗ СМАЗКИ СИСТЕМЫ УПЛОТНЕНИЯ ШТОКА | 2005 |
|
RU2361140C2 |
| Ящик | 1947 |
|
SU70939A1 |
| WO 9710238, A1, 20.03.1997 | |||
| WO 9429305, A1, 22.12.1994 | |||
| Электрогидравлический привод с управлением по ускорению | 1975 |
|
SU577325A1 |
| WO 9502405, A1, 26.01.1995 | |||
| WO 9523507, A1, 08.09.1995 | |||
| US 5665719, A, 09.09.1997 | |||
| Почвообрабатывающая фреза для обработки приствольных полос в садах | 1980 |
|
SU934932A1 |
| WO 9843956, A1, 08.10.1998. | |||
Авторы
Даты
2005-08-27—Публикация
2001-01-18—Подача