Настоящее изобретение относится к формуле вакцины, позволяющей провести вакцинацию крупного рогатого скота, в частности, против респираторных патологий. Оно также относится к соответствующей методике вакцинации.
Крупный рогатый скот является носителем потенциально патогенных вирусов и бактерий с разной степенью патогенности.
Вирусы могут размножаться в случае ослабления специфического иммунитета и в случае повреждений дыхательных путей. Далее они выделяются животными и могут заражать других животных.
Среди встречающихся вирусов можно, в частности, назвать вирус парагриппа типа 3 (PI-3), умеренной собственной патогенности, респираторный вирус синцития крупного рогатого скота (RSV) и бычий вирус герпеса (BHV), называемый также вирусом инфекционного ринотрахеита крупного рогатого скота (IBR), высокой собственной патогенности.
Другим вирусом, заслуживающим особого внимания из-за своей роли иммунодепрессанта и неблагоприятного влияния на репродукцию, является вирус заболевания слизистых оболочек, или пестивирус крупного рогатого скота (BVDV).
Эти вирусы проявляются в целом в первичной фазе повышения температуры, гриппозного синдрома и дыхательных нарушений, с нарушениями пищеварения (диареями) в случае BVD. Эта фаза может сопровождаться вторичной фазой с возникновением бронхопневмоний, связанных с бактериальными инфекциями, в частности с такими как Pasteurella, которые могут привести к смерти. Этот феномен особенно усиливается подавлением иммунной системы инфекцией BVD или заражением макрофагов вирусом PI-3. Могут проявиться и другие симптомы, такие как выкидыш плода при BVD и BHV.
Необходимо, следовательно, постараться наладить эффективный способ предупреждения респираторных патологий крупного рогатого скота, вызываемых основными вирусами.
В прошлом уже предлагались сочетания вакцин против некоторых вирусов, вызывающих респираторные патологии крупного рогатого скота.
Такие сочетания, разработанные до настоящего времени, были созданы на основе инактивированных вакцин или живых вакцин, а также на основе смесей таких вакцин. Их создание ставит проблемы совместимости валентности и стабильности. Действительно, необходимо обеспечить одновременно совместимость различных валентностей вакцин как в плане различия используемых антигенов, так и в плане самих таких составов, в частности при сочетании инактивированных вакцин и живых вакцин. Также возникают проблемы сохранения таких комбинированных вакцин и их безвредности, в частности, в присутствии добавок. Такие вакцины в целом достаточно дороги.
В заявках WO-A-9011092, WO-A-9319183, WO-A-9421797 и WO-A-9520660 отражено использование недавно разработанной технологии полинуклеотидных вакцин. Известно, что в этих вакцинах используют плазмиду, способную осуществлять в клетках хозяина экспрессию антигена, встроенного в эту плазмиду. Были предложены все пути введения (внутрибрюшинный, внутривенный, внутримышечный, чрескожный, внутрикожный, через слизистую и т.д.). Также могут быть использованы различные средства вакцинации, такие как ДНК, размещенная на поверхности частиц золота и наносимая таким образом, чтобы она проникала в кожу животного (Tang и др., Nature 356, 152-154, 1992) и жидко-струйные впрыскиватели, позволяющие осуществить трасфекцию одновременно в кожу, мышцы, жировую ткань и в ткани молочных желез (Furth и др., Analytical Biochemistry, 205, 365-368, 1992).
В полинуклеотидных вакцинах могут использоваться как неодетые ДНК, так и ДНК внутри липосом или катионных липидов.
G.J.M.COX уже предлагал полинуклеотидную вакцинацию против бычьего вируса герпеса типа 1 в J. of Virology, том 67, №9, сентябрь 1993, 5664-5667. Авторами были описаны, в частности, плазмиды, несущие гены g1 (gB), gIII (gC) и gIV (gD).
В "Vaccine", том 13, №4, 415-421, 1995, J.E.CROWE представляет общий обзор различных методик вакцинации против респираторного вируса синцития и против вируса парагриппа типа 3. Этот обзор отражает все возможности, предоставляемые современной техникой вакцинации, и в нем уточняется только, что технология полинуклеотидной иммунизации может быть полезна в стратегии иммунизации против RSV и PI-3. Ни плазмидные конструкции, ни результаты вакцинации крупного рогатого скота против этих вирусов в данном документе не описаны.
Задачей изобретения является, таким образом, создание формулы поливалентной вакцины, позволяющей осуществить вакцинацию против некоторого числа патогенных вирусов, вызывающих, в частности, респираторные патологии у крупного рогатого скота, и обеспечить, таким образом, эффективную вакцинацию против этих патологий.
Другой целью изобретения является создание такой формулы вакцины, сочетающей в себе различные валентности при сохранении всех требуемых критериев взаимной совместимости и стабильности валентностей.
Другой целью изобретения является создание такой формулы вакцины, которая позволяет сочетать различные валентности в одном и том же носителе.
Другой целью изобретения является создание такой вакцины, которая была бы проста в применении и являлась бы недорогой.
Еще одной целью изобретения является создание такой формулы вакцины и методики вакцинации крупного рогатого скота, которые позволяют добиться высокоэффективной и долговременной поливалентной защиты, а также безвредности препарата и отсутствия отходов.
Таким образом, объектом настоящего изобретения является формула вакцины, в частности, против респираторных патологий крупного рогатого скота, включающая, по меньшей мере, три валентности полинуклеотидных вакцин, каждая из которых включает плазмиду, содержащую (и обеспечивающую его экспрессию in vivo в клетках хозяина) ген одной валентности респираторного патогена крупного рогатого скота, причем эти валентности выбирают из группы, представленной бычьим вирусом герпеса, респираторным вирусом синцития крупного рогатого скота, вирусом заболевания слизистых оболочек и вирусом парагриппа типа 3, при этом плазмиды включают в себя, для каждой валентности, один или несколько генов, выбранных из группы, представленной gB и gD для бычьего вируса герпеса, F и G для респираторного вируса синцития крупного рогатого скота, Е2, С+Е1+Е2 и Е1+Е2 для вируса заболевания слизистых оболочек, HN и F для вируса парагриппа типа 3. Под валентностью в настоящем изобретении понимают, по меньшей мере, один антиген, обеспечивающий защиту против патогенного вируса, причем валентность может включать в себя в качестве подвалентности один или несколько природных или измененных генов одного или нескольких штаммов данного патогена.
Под геном патогенного агента понимают не только полный ген, но и различные нуклеотидные последовательности, включая фрагменты, которые сохраняют способность индуцировать защитный ответ. Понятие гена распространяется на нуклеотидные последовательности, эквивалентные в точности описанным в примерах, т.е. на различные, но кодирующие один и тот же протеин. Оно также распространяется на нуклеотидные последовательности других штаммов рассматриваемого патогена, обеспечивающие перекрестную защиту или защиту, специфическую для штамма или группы штаммов. Оно также распространяется на нуклеотидные последовательности, измененные в целях облегчения экспрессии in vivo в организме животного-хозяина, но кодирующие тот же протеин.
Предпочтительно формула вакцины по изобретению включает все четыре валентности.
Относительно валентности BHV предпочтительно использовать оба гена, кодирующих gB и gD, в разных плазмидах или в одной плазмиде. Можно также использовать, что является менее предпочтительным, один или другой из этих генов.
Для валентности RSV предпочтительно используют оба гена G и F, встроенные в две разные плазмиды или в одну плазмиду. Можно использовать, что является менее предпочтительным, только ген F.
Для валентности BVD предпочтительно используют плазмиду, включающую ген Е2. Можно использовать, что является менее предпочтительным, плазмиду, кодирующую Е1 и Е2 или С, Е1 и Е2.
Для валентности PI-3 предпочтительно используют оба гена HN и F в двух разных плазмидах или в одной плазмиде. Также можно использовать только ген HN.
Формула вакцины по изобретению в ее предпочтительном варианте обеспечивает экспрессию включенных в нее генов gB и gD (BHV), G и F (RSV), E2 (BVD) и HN и F (PI-3).
Объем дозы формулы вакцины по изобретению может составлять от 0,1 до 10 мл, в частности от 1 до 5 мл.
Доза составляет в целом от 10 нг до 1 мг, предпочтительно от 100 нг до 500 мкг, еще лучше от 1 мкг до 250 мкг на каждый тип плазмиды.
Используют предпочтительно неодетые плазмиды, помещенные в вакцинирующий носитель, такой как физиологический раствор (NaCl 0,9%), ультрачистая вода, буфер ТЕ и т.п. Можно, разумеется, использовать любые формы полинуклеотидных вакцин, описанные в практике прошлого.
Каждая плазмида включает в себя промотор, обеспечивающий экспрессию подчиненного ему гена в клетках-хозяевах. Это может быть сильный эукариотический промотор и, в частности, ранний промотор цитомегаловируса CMV-IE, взятый от человека или от мыши, или, возможно, от других животных, таких как крыса, свинья, морская свинка.
В целом промотор может иметь как вирусное, так и клеточное происхождение. В качестве вирусного промотора, кроме CMV-IE, можно назвать ранний или поздний промотор вируса SV40 или промотор LTR вируса саркомы Рауса. Это может быть также промотор, происходящий от того же вируса, от которого происходит ген, например собственный промотор данного гена.
В качестве клеточного промотора можно назвать промотор гена цитоскелета, например промотор десмина (Bolmont и др., Journal of Submicroscopic Cytology and Patology, 1990, 22, 117-122; и ZHENLIN и др., Gene, 1989, 78, 243-254) или промотор актина.
Если одна плазмида содержит несколько генов, они могут находиться в одной единице транскрипции или в двух разных единицах.
Комбинация различных валентностей вакцины по изобретению может быть получена предпочтительно смешиванием полинуклеотидных плазмид, обеспечивающих экспрессию одного или нескольких антигенов каждой валентности, но можно также осуществить экспрессию антигенов нескольких валентностей с помощью одной и той же плазмиды.
Также объектом изобретения являются формулы одновалентной вакцины, включающие одну или несколько плазмид, кодирующих один или несколько генов одного из вирусов, выбранных из группы, представленной BRSV, BVD и PI-3, при этом гены соответствуют описанным выше. Не считая их одновалентного характера, эти формулы могут обладать вышеизложенными характеристиками в плане выбора генов, их комбинаций, композиции плазмид, объемов доз, доз и т.д.
Формулы одновалентной вакцины могут быть использованы
(I) для получения формулы поливалентной вакцины, как она описана выше,
(II) в индивидуальном порядке против определенной патологии,
(III) в сочетании с вакциной другого типа (цельной живой или инактивированной, рекомбинантной, субъединицей) против другой патологии или
(IV) как вакцины для повторного введения после вакцины, описанной ниже.
Действительно, еще одним объектом изобретения является применение одной или нескольких плазмид по изобретению для получения вакцины, предназначенной для вакцинации крупного рогатого скота, первично вакцинированного первой, обычной вакциной известного типа, выбранной, в частности, из группы, представленной цельной живой вакциной, цельной инактивированной вакциной, субъединичной вакциной, рекомбинантной вакциной, причем эта первая вакцина содержит (или осуществляет их экспрессию) один или несколько антигенов, кодируемых одной или несколькими используемыми плазмидами, или антигенов, обеспечивающих перекрестную защиту.
Заслуживает внимания тот факт, что полинуклеотидная вакцина оказывает сильное действие в качестве второй вакцины, которое проявляется в усилении иммунного ответа и в установлении долговременного иммунитета.
В целом вакцины для первичной вакцинации могут быть выбраны из вакцин, выпускаемых для продажи различными производителями ветеринарных вакцин.
Также объектом изобретения является набор для вакцинации, в который входят вакцина для первичной вакцинации, как она описана выше, и формула вакцины по изобретению для вторичной вакцинации. Оно (изобретение) также относится к формуле вакцины по изобретению с приложенной к ней инструкцией по применению этой формулы при вторичной вакцинации после первичной вакцинации, как она описана выше.
Также объектом изобретения является методика вакцинации крупного рогатого скота против респираторных патологий, включая введение формулы эффективной вакцины, как она описана выше. Эта методика вакцинации включает введение одной или нескольких доз формулы вакцины, причем эти дозы могут быть введены последовательно за короткий промежуток времени и/или последовательно через продолжительные промежутки времени.
Формулы вакцины по изобретению могут быть введены, в рамках данной методики вакцинации, различными путями введения, предусмотренными для полинуклеотидной вакцинации, и с помощью любой известной техники введения.
Также объектом изобретения является методика вакцинации, заключающаяся в том, что проводят первичную вакцинацию, как описано выше, и вторичную вакцинацию формулой вакцины по изобретению.
Согласно предпочтительной форме осуществления способа по изобретению сначала животному вводят эффективную дозу вакцины классического типа, в частности инактивированной, живой, ослабленной или рекомбинантной, или субъединичную вакцину, таким образом, чтобы обеспечить первичную вакцинацию, и предпочтительно через 2-6 недель вводят поливалентную или одновалентную вакцину по изобретению.
Изобретение также относится к методике приготовления формул вакцины, а именно к получению валентностей и их смесей, как следует из данного описания.
Далее следует более детальное описание в способах осуществления изобретения, опирающееся на чертежи.
Список фигур
Фигура 1 Плазмида pVR 1012
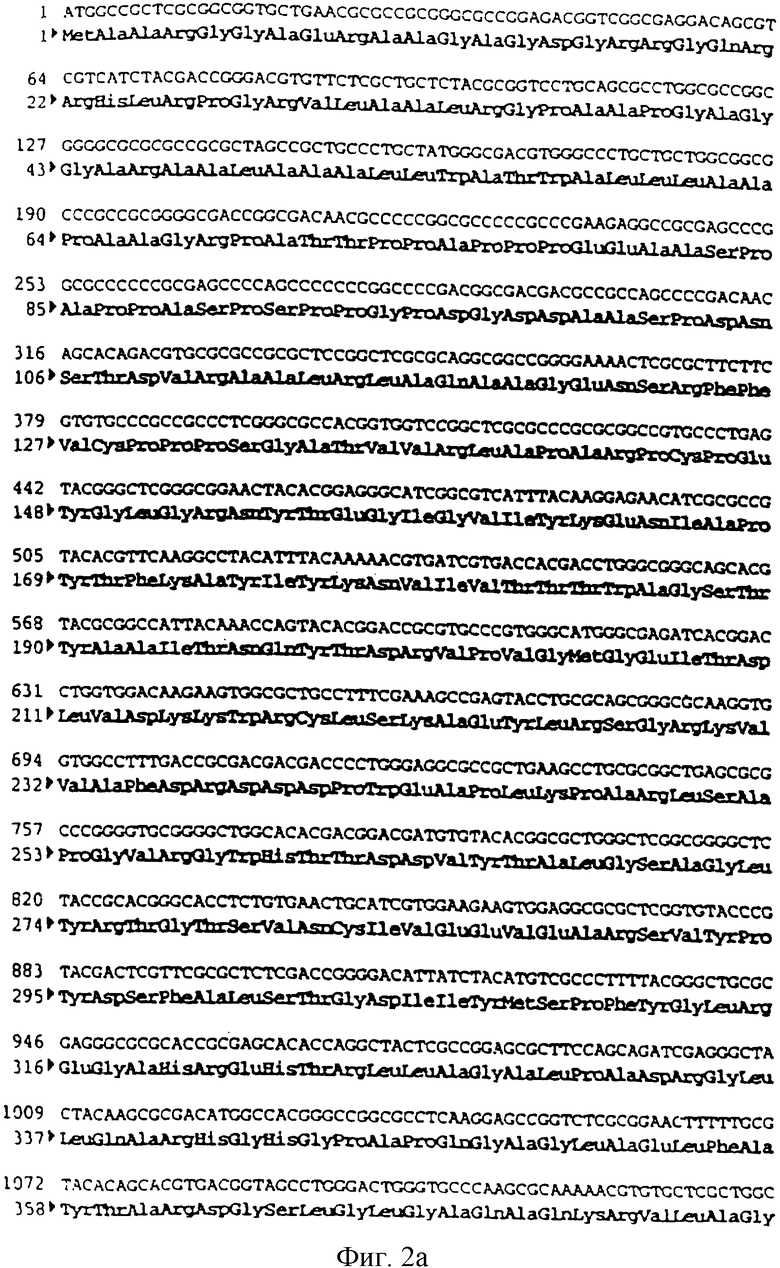
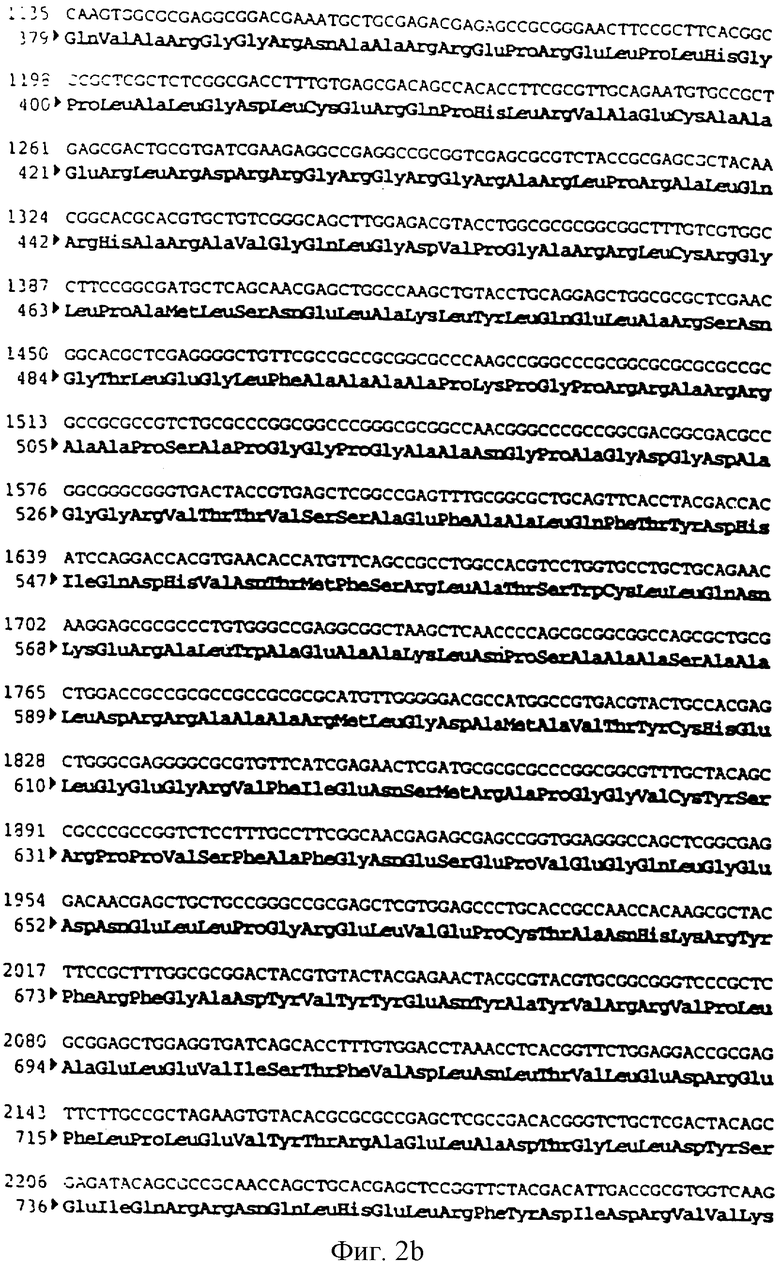
Фигура 2 a,b,c Последовательность гена BHV-1 ST gB
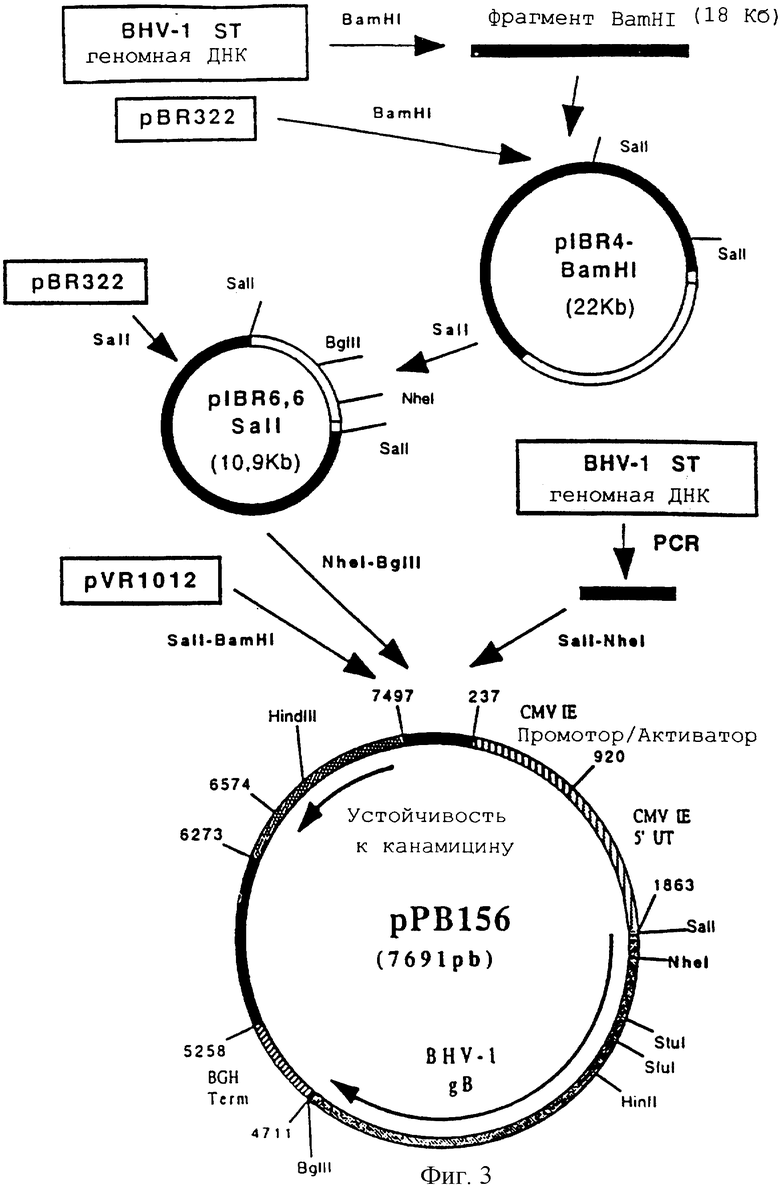
Фигура 3 Конструкция плазмиды р РВ 156
Фигура 4 Плазмида рАВ 087
Фигура 5 Плазмида рАВ 011
Фигура 6 Плазмида рАВ 012
Фигура 7 Плазмида рАВ 058
Фигура 8 Плазмида рАВ 059
Фигура 9 Плазмида рАВ 060
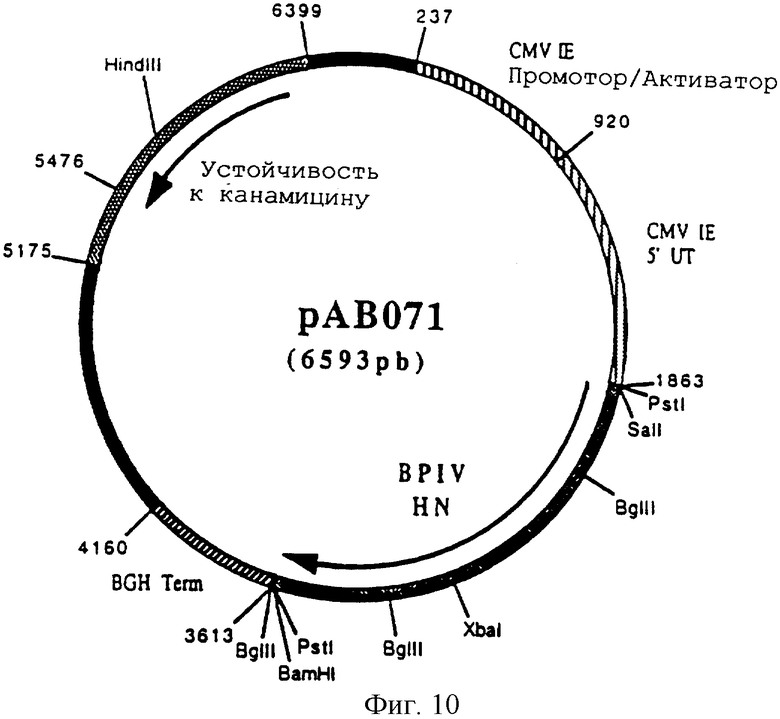
Фигура 10 Плазмида рАВ 071
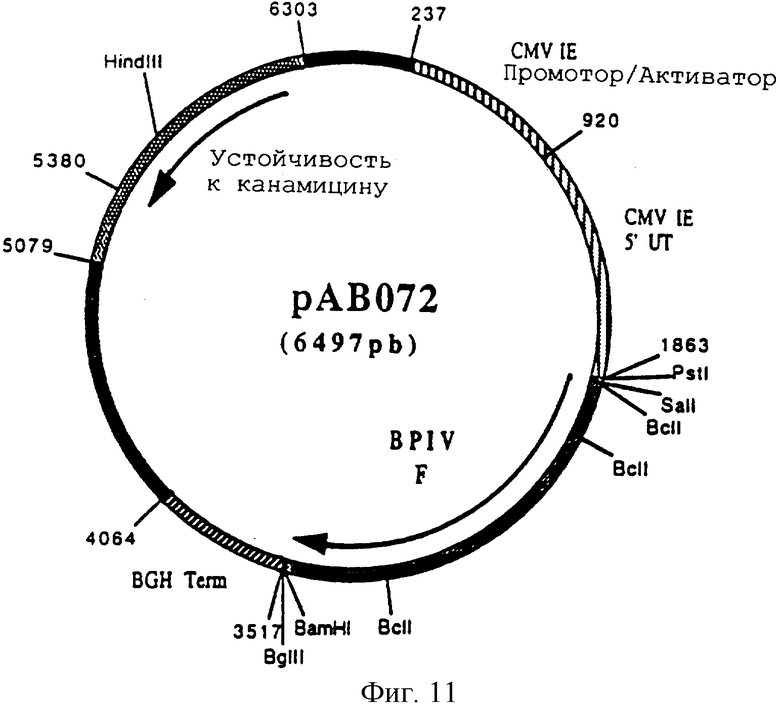
Фигура 11 Плазмида рАВ 072
Список последовательностей SEQ ID №
SEQ ID №1: Последовательность гена BHV-1 gB (штамм ST)
SEQ ID №2: Олигонуклеотид РВ234
SEQ ID №3: Олигонуклеотид РВ235
SEQ ID №4: Олигонуклеотид АВ162
SEQ ID №5: Олигонуклеотид АВ163
SEQ ID №6: Олигонуклеотид АВ026
SEQ ID №7: Олигонуклеотид АВ027
SEQ ID №8: Олигонуклеотид АВ028
SEQ ID №9: Олигонуклеотид АВ029
SEQ ID №10: Олигонуклеотид АВ110
SEQ ID №11: Олигонуклеотид АВ111
SEQ ID №12: Олигонуклеотид АВ114
SEQ ID №13: Олигонуклеотид АВ115
SEQ ID №14: Олигонуклеотид АВ116
SEQ ID №15: Олигонуклеотид АВ117
SEQ ID №16: Олигонуклеотид АВ130
SEQ ID №17: Олигонуклеотид АВ131
SEQ ID №18: Олигонуклеотид АВ132
SEQ ID №19: Олигонуклеотид АВ133
ПРИМЕРЫ
ПРИМЕР 1
Культура вирусов
Вирусы культивируют на соответствующей системе клеток до проявления цитопатического эффекта. Системы клеток, используемые для каждого вируса, хорошо известны специалистам. Коротко говоря, клетки, чувствительные к используемому вирусу, культивируемые в минимальной необходимой среде Игла (среда "MEM") или в другой подходящей среде, заражают исследуемым вирусным штаммом, используя множественность заражения 1. Инфицированные клетки инкубируют при 37°С в течение времени, необходимого для проявления полного цитопатического эффекта (в среднем 36 часов).
ПРИМЕР 2
Экстракция геномных вирусных ДНК
После культивации собирают разрушенные клетки и их плавающие на поверхности обломки и центрифугируют вирусную суспензию при 1.000 g и +4°С в течение 10 минут для удаления обломков клеток. Затем осаждают вирусные частицы с помощью ультрацентрифугирования при 400000 g и +4°С в течение 1 часа. Осадок собирают в минимальном объеме буфера (Tris 10 мМ, EDTA 1 мМ). Эту концентрированную вирусную суспензию обрабатывают протеиназой К (в конечной концентрации 100 мкг/мл) в присутствии додецилсульфата натрия (SDS) (конечн. конц. 0,5%) в течение 2 часов при 37°С. Затем экстрагируют вирусную ДНК с помощью смеси фенол/хлороформ, затем осаждают 2 объемами абсолютного этанола. Оставляют на ночь при -20°С, затем центрифугируют ДНК при 10000 g и +4°С в течение 15 минут. Высушивают осажденную ДНК, затем собирают в минимальном объеме стерильной ультрачистой воды. Теперь она может подвергаться действию ферментов рестрикции.
ПРИМЕР 3
Выделение геномных вирусных РНК
РНК - содержащие вирусы очищают согласно хорошо известным специалистам технологиям. Затем выделяют геномную вирусную РНК каждого вируса, используя технику экстракции "тиоцианат гуанидия/фенолхлороформ", описанную P.Chomczynski и N.Sacchi (Anal. Biochem. 1987, 162, 156-159).
ПРИМЕР 4
Технологии молекулярной биологии
Все плазмидные конструкции были получены при использовании стандартных технологий молекулярной биологии, описанных J.Sambrook и др. (Molecular Cloning: A Laboratory Manual 2-е изд. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Все рестрикционные фрагменты, используемые в настоящем изобретении, были изолированы с помощью набора "Geneclean" (BIO 101 Inc. La Jolla, CA).
ПРИМЕР 5
Технология полимеразной цепной реакции с обратной транскриптазой (RT-PCR)
Специфические олигонуклеотиды (несущие на 5'-концах сайты рестрикции для облегчения клонирования амплифицированных фрагментов) синтезируют таким образом, что они полностью охватывают кодирующие участки генов, которые должны быть амплифицированы (см. специфические примеры). Полимеразную цепную реакцию (ПЦР) с обратной транскриптазой (RT) осуществляют по стандартным технологиям (J.Sambrook и др. Molecular Cloning: A Laboratory Manual. 2-е издание. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Каждую реакцию RT-ПЦР проводят с парой специфических амплимеров, используя в качестве матрицы экстрагированную вирусную геномную РНК. Комплементарную амплифицированную ДНК экстрагировали фенолом/хлороформом/изоамиловым спиртом (25:24:1) перед расщеплением рестрикционными ферментами.
ПРИМЕР 6
Плазмида pVR 1012
Плазмида pVR 1012 (фигура 1) была получена при Vical Inc. San Diego, CA, USA. Ее конструирование было описано в J.Hartikka и др. (Human Gene Therapy. 1996. 7. 1205-1217).
ПРИМЕР 7
Конструирование плазмиды рРВ 156 (ген BHV-1 gB)
ДНК генома бычьего вируса герпеса BHV-1 (Штамм ST) (Leung-Tack P. и др. Virology. 1994. 199. 409-421) была получена по технологии, описанной в примере 2, и расщеплена BamHI. После очистки фрагмент BamHI-BamHI из 18 т.п.н. был клонирован в векторе pBR 322, предварительно расщепленном с помощью BamHI, для получения плазмиды pIBR-4-BamHI (22 т.п.н.).
Затем плазмиду pIBR-4-BamHI расщепили с помощью SalI, чтобы высвободить фрагмент SalI-SalI 6,6 т.п.н., содержащий ген, кодирующий гликопротеин gB вируса BHV-1 (фигура 2 и SEQ ID №1). Этот фрагмент клонировали в векторе pBR 322, предварительно расщепленном с помощью SalI, и получили плазмиду pIBR-6, 6-SalI (10,9 т.п.н.).
Плазмиду pIBR-6, 6-SalI расщепили с помощью NheI и BglII, чтобы высвободить фрагмент NheI-BglII (2676 п.н.), содержащий ген, кодирующий гликопротеин gB бычьего вируса герпеса (BHV-1) (фрагмент А).
Провели реакцию ПЦР с геномной ДНК бычьего вируса герпеса (BHV-1) (Штамм ST) и со следующими олигонуклеотидами:
РВ 234 (30 мер) (SEQ ID №2)
5'ТТГТЦГАЦАТГГЦЦГЦТЦГЦГГЦГГТГЦТГ 3'
РВ 235 (21 мер) (SEQ ID №3)
5'ГЦАГГГЦАГЦГГЦТАГЦГЦГГ 3'
чтобы выделить часть 5'-гена, кодирующего гликопротеин gB (BHV-1).
После очистки продукт ПЦР (153 п.н.) расщепили с помощью SalI и NheI, чтобы изолировать фрагмент SalI-NheI 145 п.н. (фрагмент В).
Фрагменты А и В сшили вместе с вектором pvR 1012 (пример 6), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду ррВ 156 (7691 п.н.) (фигура 3).
ПРИМЕР 8
Конструирование плазмиды рАВ087 (ген BHV-1 gD)
Провели реакцию ПЦР с геномной ДНК бычьего вируса герпеса (BHV-1) (Штамм ST) (P.Leung-Tack и др. Virology. 1994. 199. 409-421), полученной по технологии, описанной в примере 2 и со следующими олигонуклеотидами:
АВ 162 (31 мер) (SEQ ID №4)
5'АААЦТГЦАГАТГЦААГГГЦЦГАЦАТТГГЦЦГ 3'
АВ 163 (27 мер) (SEQ ID №5)
5'АТЦТТГТАЦЦАТАТГАЦЦГГГГЦГТТГ 3'
чтобы амплифицировать часть 5'-гена, кодирующего гликопротеин gD бычьего вируса герпеса (BHV-1) (№ доступа последовательности в Gen Bank'e = L 26360) в виде фрагмента ПЦР 338 п.н. После очистки этот фрагмент расщепили с помощью PstI и NdeI, чтобы изолировать фрагмент PstI-NdeI 317 п.н. (фрагмент А).
Плазмиду pBHV 001 (P.Leung-Tack и др. Virology. 1994. 199. 409-421) расщепили с помощью NdeI и StyI, чтобы высвободить фрагмент 942 п.н., содержащий часть 3'-гена, кодирующего гликопротеин gD вируса BHV-1 (фрагмент В).
Фрагменты А и В сшили вместе с вектором pvR 1012 (пример 6), предварительно расщепленным PstI и XbaI, и получили плазмиду рАВ 087 (6134 п.н.) (фигура 4).
ПРИМЕР 9
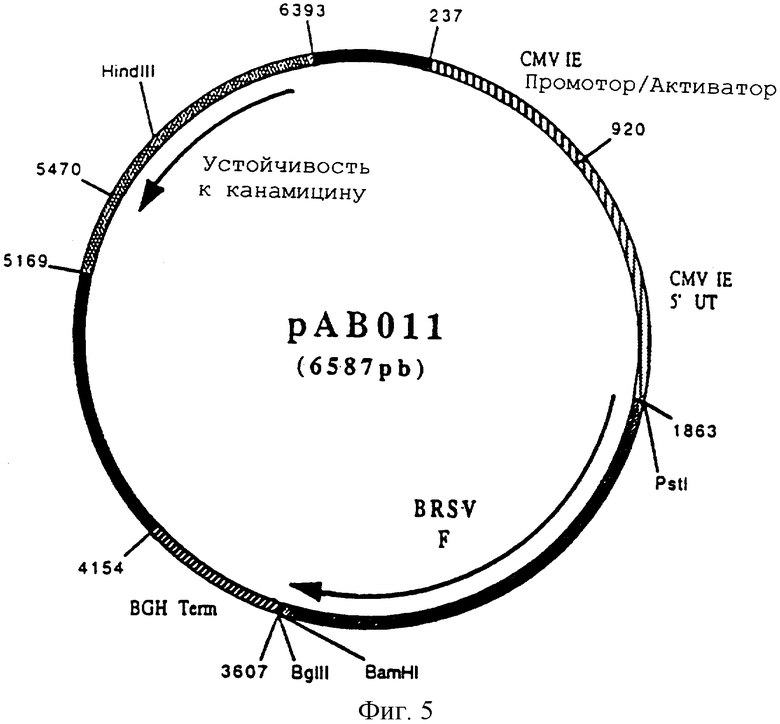
Конструирование плазмиды рАВ 011 (ген BRSV F)
По технологии, описанной в примере 5, провели реакцию RT-ПЦР с геномной РНК респираторного вируса синцития крупного рогатого скота (BRSV) (Штамм 391-2) (R.Lerch и др. Virology. 1991. 181. 118-131), полученной, как указано в примере 3, и со следующими олигонуклеотидами:
АВ 026 (33 мер) (SEQ ID №6)
5'ААААЦТГЦАГГГАТГГЦГГЦААЦАГЦЦАТГАГГ 3'
АВ 027 (31 мер) (SEQ ID №7)
5'ЦГЦГГАТЦЦТЦАТТТАЦТАААГГАААГАТТГ 3'
чтобы выделить ген, кодирующий гликопротеин слияния F (BRSV F) в форме фрагмента ПЦР 1734 п.н. После очистки этот фрагмент расщепили PstI и BamHI, чтобы изолировать фрагмент PstI-BamHI 1717 п.н. Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным PstI и BamHI, и получили плазмиду рАВ 011 (6587 п.н.) (фигура 5).
ПРИМЕР 10
Конструирование плазмиды рАВ 012 (ген BRSV G)
По технологии, описанной в примере 5, провели реакцию RT-ПЦР с геномной РНК респираторного вируса синцития крупного рогатого скота (BRSV) (Штамм 391-2) (R.Lerch и др. J. Virology. 1990. 64. 5559-5569) и со следующими олигонуклеотидами:
АВ 028 (32 мер) (SEQ ID №8)
5'ААААЦТГЦАГАТГТЦЦААЦЦАТАЦЦЦАТЦАТЦ 3'
АВ 029 (35 мер) (SEQ ID №9)
5'ЦГЦГГАТЦЦЦТАГАТЦТГТГТАГТТГАТТГАТТТГ 3'
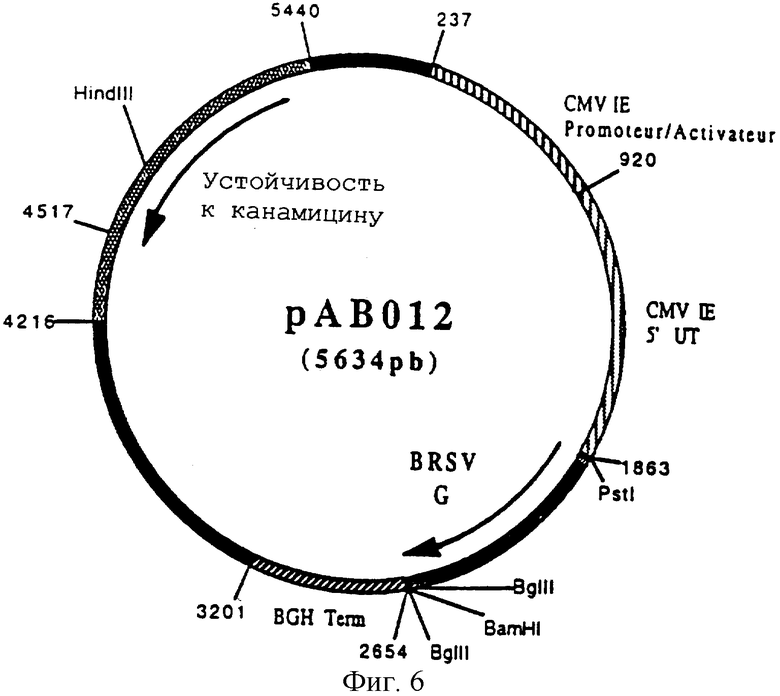
чтобы выделить ген, кодирующий протеин G (BRSV G) в форме фрагмента ПЦР 780 п.н. После очистки этот фрагмент расщепили с помощью PstI и BamHI, чтобы изолировать фрагмент PstI-BamHI 763 п.н. Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным PstI и BamHI, и получили плазмиду рАВ012 (5634 п.н.) (фигура 6).
ПРИМЕР 11
Конструирование плазмиды рАВ058 (ген BVDV С)
По технологии, описанной в примере 5, провели реакцию RT-ПЦР с геномной РНК вируса вирусной диареи крупного рогатого скота (BVDV) (Штамм Osloss) (L.De Moerlooze и др. J. Gen. Virol. 1993. 74. 1433-1438), полученной по технологии, описанной в примере 3, и со следующими олигонуклеотидами:
АВ 110 (35 мер) (SEQ ID №10)
5'ААААЦТГЦАГАТГТЦЦГАЦАЦААААГЦАГААГГГГ 3'
АВ 111 (47 мер) (SEQ ID №11)
5'ЦГЦГГАТЦЦТЦААТАААААТЦАТТЦЦЦАЦТГЦГАЦТТГАААЦААААЦ 3'
чтобы амплифицировать фрагмент в 342 п.н., содержащий ген, кодирующий протеин капсида С вируса BVDV. После очистки продукт реакции RT-ПЦР расщепили с помощью PstI и BamHI и получили фрагмент PstI-BamHI 324 п.н.
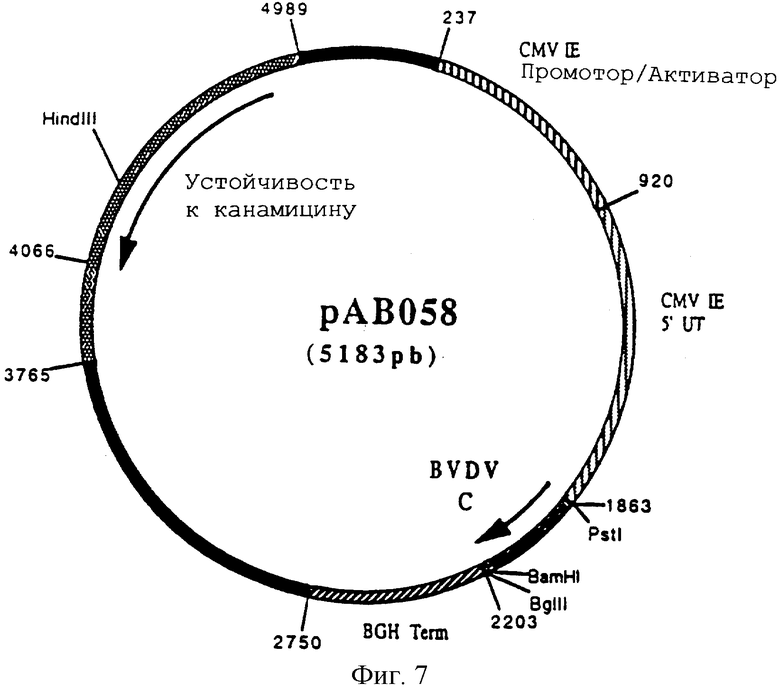
Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ 058 (5183 п.н.) (фигура 7).
ПРИМЕР 12
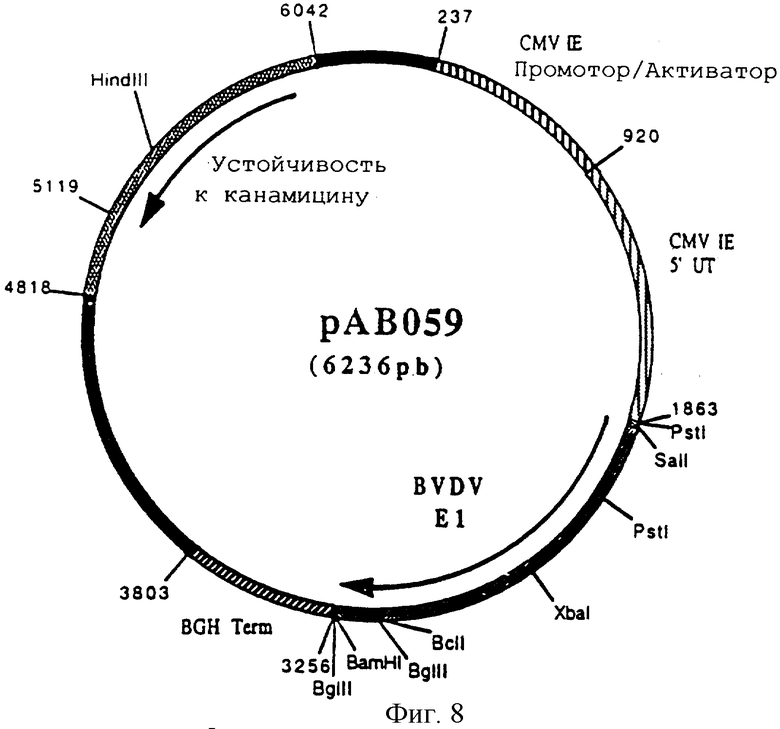
Конструирование плазмиды рАВ 059 (ген BVDV E1)
По технологии, описанной в примере 5, провели реакцию RT-ПЦР с РНК генома вируса вирусной диареи крупного рогатого скота (BVDV) (Штамм Osloss) (L.De Moerlooze и др. J. Gen. Virol. 1993. 74. 1433-1438) и со следующими олигонуклеотидами:
АВ 114 (32 мер) (SEQ ID №12)
5' АЦГЦГТЦГАЦАТГААГАААЦТАГАГАААГЦЦЦ 3'
АВ 115 (33 мер) (SEQ ID №13)
5' ЦГЦГГАТЦЦТЦАГЦЦГГГТТТГЦАААЦТГГГАГ 3'
чтобы выделить последовательность, кодирующую протеин Е1 вируса BVDV, в форме фрагмента ПЦР 1381 п.н. После очистки этот фрагмент расщепили с помощью SalI и BamHI и получили фрагмент SalI-BamHI 1367 п.н.
Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ 059 (6236 п.н.) (фигура 8).
ПРИМЕР 13
Конструирование плазмиды рАВ 060 (ген BVDV E2)
По технологии, описанной в примере 5, провели реакцию RT-ПЦР с геномной РНК вируса вирусной диареи крупного рогатого скота (BVDV) (Штамм Osloss) (L.De Moerlooze и др. J. Gen. Virol. 1993. 74. 1433-1438) и со следующими олигонуклеотидами:
АВ 116 (36 мер) (SEQ ID №14)
5'АЦГЦГТЦГАЦАТГАЦГАЦТАЦТГЦАТТЦЦТГГТАТГ 3'
АВ 117 (33 мер) (SEQ ID №15)
5'ЦГЦГГАТЦЦТЦАТТГАЦГТЦЦЦГАГГТЦАТТТГ 3'
чтобы изолировать последовательность, кодирующую протеин E2 вируса BVDV, в форме фрагмента ПЦР 1252 п.н. После очистки этот фрагмент расщепили SalI и BamHI и получили фрагмент SalI-BamHI 1238 п.н.
Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ (6107 п.н.) (фигура 9).
ПРИМЕР 14
Конструирование плазмиды рАВ 071 (ген BPIV HN)
По технологии, описанной в примере 5, проводят реакцию RT-ПЦР с геномной РНК вируса парагриппа крупного рогатого скота типа 3 (PI3=BPIV) и со следующими олигонуклеотидами:
АВ 130 (33 мер) (SEQ ID №16)
5'ТТТГТЦГАЦАТГГААТАТТГГАААЦАЦАЦАААЦ 3'
АВ 131 (33 мер) (SEQ ID №17)
5'ТТТГГАТЦЦТТАГЦТГЦАГТТТТТЦГГААЦТТЦ 3'
чтобы выделить ген, кодирующий гликопротеин HN BPIV (последовательность гена HN, заявленная H.Shibuta в 1987 № доступа последовательности в Gen Bank'e = Y00115) в форме фрагмента ПЦР 1737 п.н. После очистки этот фрагмент расщепили с помощью SalI и BamHI, чтобы изолировать фрагмент SalI и BamHI 1725 п.н. Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ 071 (6593 п.н.) (фигура 10).
ПРИМЕР 15
Конструирование плазмиды рАВ072 (ген BPIV F)
По технологии, описанной в примере 5, провели реакцию RT-ПЦР с геномной РНК вируса парагриппа крупного рогатого скота типа 3 (PI3=BPIV) и со следующими олигонуклеотидами:
АВ 132 (30 мер) (SEQ ID №18)
5'ТТТГТЦГАЦАТГАТЦАТЦАЦАААЦАЦААТЦ 3'
АВ 133 (30 мер) (SEQ ID №19)
5'ТТТГГАТЦЦТЦАТТГТЦТАЦТТГТТАГТАЦ 3'
чтобы выделить ген, кодирующий протеин F вируса BPIV (последовательность гена F, заявленная H.Shibuta в 1987. №. доступа последовательности в Gen Bank'e=Y00115) в форме фрагмента ПЦР 1641 п.н. После очистки этот фрагмент расщепили с помощью SalI и BamHI, чтобы изолировать фрагмент SalI-BamHI 1629 п.н. Этот фрагмент сшили с вектором pVR 1012 (пример 6), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ 072 (6497 п.н.) (фигура 11).
ПРИМЕР 16
Получение и очистка плазмид
Для получения плазмид, предназначенных для вакцинации животных, можно использовать любую технологию, которая позволяет получить суспензию очищенных плазмид, большей частью в сверхскрученной форме. Такие технологии хорошо известны специалистам. Можно назвать, в частности, технику щелочного лизиса с последующим двукратным центрифугированием в градиенте хлорида цезия в присутствии бромида этидия, как она описана J.Sambrook и др. (Molecular Cloning: A Laboratory Manual 2-е изд. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Также можно обратиться к материалам заявок РСТ WO 95/21250 и РСТ WO 96/02658, где описаны методики получения.


Изобретение относится к области генной инженерии, вирусологии и ветеринарии. Вакцина крупного рогатого скота содержит плазмиду, включающую ген F, ген G или гены F и G респираторного вируса синцития крупного рогатого скота. Вакцина обеспечивает иммунизацию крупного рогатого скота против респираторного вируса синцития. Изобретение может быть использовано в скотоводстве. 6 з.п. ф-лы, 11 ил.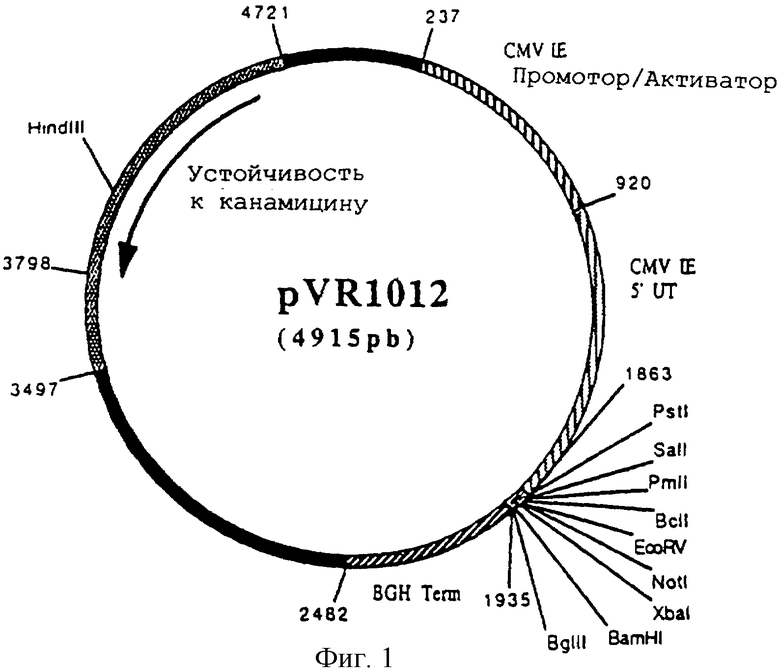
| ZA 9410347, 05.02.1996 | |||
| JP 6022756, 01.02.1994. |
Авторы
Даты
2007-09-10—Публикация
2002-12-05—Подача