Данное изобретение относится к производным индолилалкиламина в качестве лигандов 5-гидрокситриптамина-6, способам их получения, фармацевтическим композициям, содержащим их, и к способам лечения с их применением.
Считают, что различные расстройства нервной системы, такие как тревога, депрессия, двигательные расстройства и т.д., связаны с нарушением нейромедиатора 5-гидрокситриптамина (5-НТ) или серотонина. Серотонин локализуется в центральной и периферической нервной системе, и известно, что он воздействует на многие типы состояний, включая, наряду с другими, психиатрические расстройства, двигательную активность, поведение, связанное с потреблением пищи, половую активность и нейроэндокринную регуляцию. Эффекты серотонина регулируются различными подтипами рецепторов 5-НТ. Известные рецепторы 5-НТ включают семейство 5-НТ1 (например, 5-НТ1А), семейство 5-НТ2 (например, 5-НТ2А), подтипы 5-НТ3, 5-НТ4, 5-НТ5, 5-НТ6 и 5-НТ7.
Был клонирован недавно идентифицированный подтип рецепторов 5-гидрокситриптамина-6 (5-НТ6) человека и сообщалось о широком распределении его мРНК. Самые высокие уровни мРНК рецепторов 5-НТ6 наблюдались в обонятельном бугорке, полосатом теле, околоядерной области, зубчатой доле и областях СА1, СА2 и СА3 гиппокампа. Более низкие уровни мРНК рецепторов 5-НТ6 наблюдаются в зернистом слое мозжечка, нескольких диэнцефальных ядрах, миндалинах и в коре. Норзерн-блоттинги выявили, что мРНК рецепторов 5-НТ6, как оказывается, присутствует исключительно в головном мозге при небольшом количестве данных о ее присутствии в периферических тканях. Высокое сродство ряда антипсихотических средств к рецептору 5-НТ6, в дополнение к локализации его мРНК в полосатом теле, обонятельном бугорке и околоядерной области, свидетельствует о том, что некоторые из клинических действий данных соединений могут быть опосредованы через указанный рецептор. Поэтому считают, что лиганды рецепторов 5-НТ6 потенциально можно применять при лечении определенных расстройств ЦНС, таких как тревога, депрессия, эпилепсия, навязчивое компульсивное расстройство, расстройство с дефицитом внимания, мигрень, для усиления познавательной памяти (например, для лечения болезни Альцгеймера), для лечения расстройств сна, расстройств потребления пищи (например, анорексии или булимии), нейродегенеративных расстройств (например, инсульта или травмы головы), панических атак, синдрома отмены наркотических средств и других веществ после их злоупотребления (например, кокаина, этанола, никотина или бензодиазепинов), шизофрении или им подобных состояний; или при лечении определенных желудочно-кишечных расстройств, таких как синдром раздражимого кишечника.
Поэтому задачей данного изобретения является предоставление соединений, которые можно применять в качестве терапевтических средств при лечении различных расстройств центральной нервной системы, связанных с рецептором 5-НТ6 или его воздействием.
Еще одной задачей данного изобретения является разработка способов лечения и фармацевтических композиций, которые можно применять для лечения расстройств центральной нервной системы, связанных с рецептором 5-НТ6 или его воздействием.
Соединения настоящего изобретения можно также применять для дальнейшего исследования и выяснения роли рецептора 5-НТ6.
Указанные и другие задачи и признаки изобретения станут более очевидны в изложенном здесь ниже подробном описании.
Настоящее изобретение относится к производному индолилалкиламина формулы I

где
Q представляет SO2, CO, CONR9 или CSNR10;
n представляет собой целое число, равное 2 или 3;
каждый R1 и R2 независимо представляет Н, галоген, CN, OCO2R12, CO2R13, CONR14R15, CNR16NR17R18, SOmR19, NR20R21, OR22, COR23 или С1-С6алкильную, С2-С6алкенильную, С2-С6алкинильную, С3-С6циклоалкильную, циклогетероалкильную, арильную или гетероарильную группу, каждую необязательно замещенную;
каждый R3 и R4 независимо представляет Н или необязательно замещенную С1-С6алкильную группу;
каждый R5 и R6 независимо представляет Н или С1-С6алкильную, С2-С6алкенильную, С2-С6алкинильную, С3-С6циклоалкильную, циклогетероалкильную, арильную или гетероарильную группу, каждую необязательно замещенную, или R5 и R6 могут быть взяты вместе с атомом, с которым они соединены, образуя необязательно замещенное 5-7-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O, N или S;
R7 представляет Н, галоген, или С1-С6алкильную, С1-С6алкокси, арильную или гетероарильную группу, каждую необязательно замещенную;
R8 представляет необязательно замещенную 8-13-членную бициклическую или трициклическую кольцевую систему, имеющую атом N в головной части мостиковой связи и, необязательно, содержащую 1, 2 или 3 дополнительных гетероатома, выбранных из N, O или S;
m равно 0 или целому числу, равному 1 или 2;
каждый R9 и R10 независимо представляет Н или С1-С6алкильную, арильную или гетероарильную группу, каждую необязательно замещенную;
каждый R12, R13, R19 и R23 независимо представляет Н или С1-С6алкильную, С2-С6алкенильную, С2-С6алкинильную, С3-С6циклоалкильную, циклогетероалкильную, арильную или гетероарильную группу, каждую необязательно замещенную;
каждый R14, R15 и R22 независимо представляет Н или необязательно замещенную С1-С6алкильную группу; и
каждый R16, R17, R18, R20 и R21 независимо представляет Н или необязательно замещенную С1-С4алкильную группу; или R20 и R21 могут быть взяты вместе с атомом, с которым они соединены, образуя 5-7-членное кольцо, необязательно содержащее другой гетероатом, выбранный из O, N или S; или
его стереоизомерам или его фармацевтически приемлемым солям.
Настоящее изобретение также относится к способам и композициям, которые можно использовать для терапевтического лечения расстройств центральной нервной системы, связанных с рецептором 5-НТ6 или его воздействием.
Рецептор 5-гидрокситриптамина-6 (5-НТ6) является одним из самых важных рецепторов, недавно идентифицированных молекулярным клонированием. Его способность связывать широкий диапазон терапевтических соединений, применяемых в психиатрии, в сочетании с его интригующим распределением в головном мозге, стимулировали значительный интерес к новым соединениям, которые способны взаимодействовать с указанным рецептором или воздействовать на него. Предпринимаются значительные усилия для понимания возможной роли рецептора 5-НТ6 в психиатрии, познавательной дисфункции, двигательной функции и регуляции, памяти, настроении и подобных областях. Для этого проводили методичный поиск соединений, которые демонстрируют сродство связывания к рецептору 5-НТ6 как в качестве вспомогательного средства в изучении рецептора 5-НТ6, так и в качестве потенциальных терапевтических средств при лечении расстройств центральной нервной системы (см., например, С.Reavill and D.C. Rogers, Current Opinion in Investigational Drugs, 2001, 2(1):104-109, Pharma Press Ltd.
В настоящее время обнаружено, что производные индолилалкиламина формулы I демонстрируют сродство к 5-НТ6. Производные указанного амина можно применять в качестве эффективных терапевтических средств для лечения расстройств центральной нервной системы (ЦНС), связанных с рецептором 5-НТ6 или его воздействием. Соответственно, настоящее изобретение относится к производному индолилалкиламина формулы I

где
Q представляет SO2, CO, CONR9 или CSNR10;
n представляет собой целое число, равное 2 или 3;
каждый R1 и R2 независимо представляет Н, галоген, CN, OCO2R12, CO2R13, CONR14R15, CNR16NR17R18, SOmR19, NR20R21, OR22, COR23 или С1-С6алкильную, С2-С6алкенильную, С2-С6алкинильную, С3-С6циклоалкильную, циклогетероалкильную, арильную или гетероарильную группу, каждую необязательно замещенную;
каждый R3 и R4 независимо представляет Н или необязательно замещенную С1-С6алкильную группу;
каждый R5 и R6 независимо представляет Н или С1-С6алкильную, С2-С6алкенильную, С2-С6алкинильную, С3-С6 циклоалкильную, циклогетероалкильную, арильную или гетероарильную группу, каждую необязательно замещенную, или R5 и R6 могут быть взяты вместе с атомом, с которым они соединены, образуя необязательно замещенное 5-7-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O, N или S;
R7 представляет Н, галоген или С1-С6алкильную, С1-С6алкокси, арильную или гетероарильную группу, каждую необязательно замещенную;
R8 представляет необязательно замещенную 8-13-членную бициклическую или трициклическую кольцевую систему, имеющую атом N в головной части мостиковой связи и, необязательно, содержащую 1, 2 или 3 дополнительных гетероатома, выбранных из N, O или S;
m равно 0 или целому числу, равному 1 или 2;
каждый R9 и R10 независимо представляет Н или С1-С6алкильную, арильную или гетероарильную группу, каждую необязательно замещенную;
каждый R12, R13, R19 и R23 независимо представляет Н или С1-С6алкильную, С2-С6алкенильную, С2-С6алкинильную, С3-С6циклоалкильную, циклогетероалкильную, арильную или гетероарильную группу, каждую необязательно замещенную;
каждый R14, R15 и R22 независимо представляет Н или необязательно замещенную С1-С6алкильную группу; и
каждый R16, R17, R18, R20 и R21 независимо представляет Н или необязательно замещенную С1-С4алкильную группу; или R20 и R21 могут быть взяты вместе с атомом, с которым они соединены, образуя 5-7-членное кольцо, необязательно содержащее другой гетероатом, выбранный из O, N или S; или
его стереоизомерам или его фармацевтически приемлемым солям.
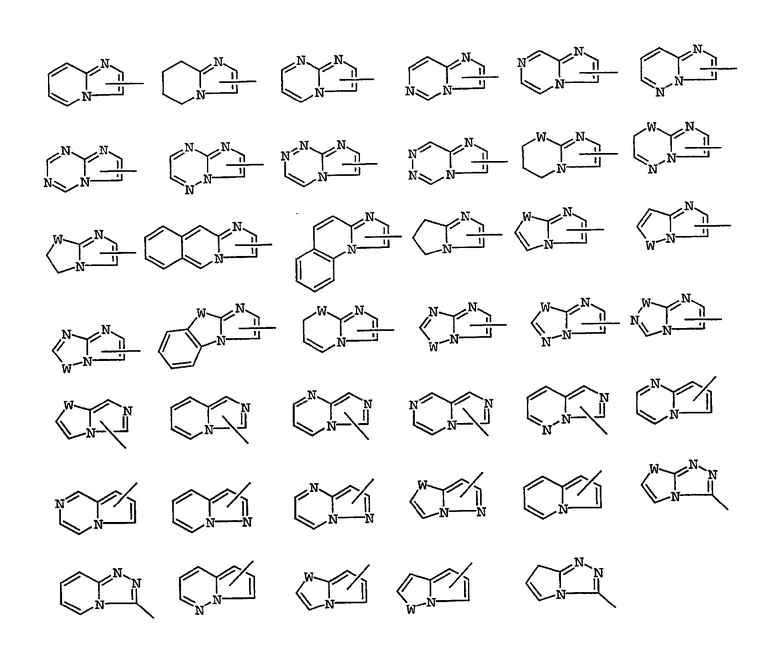
Используемый в описании и формуле изобретения термин «галоген» обозначает Br, Cl, I или F, а термин «циклогетероалкил» обозначает 5-7-членную циклоалкильную кольцевую систему, содержащую 1 или 2 гетероатома, которые могут быть одинаковыми или различными, выбранными из N, O или S, и необязательно содержащими одну двойную связь. Примерами циклогетероалкильных кольцевых систем, включенных в указанный здесь термин, являются следующие кольца, в которых W представляет NR, O или S; и R представляет Н или необязательный заместитель, как описано здесь ниже:

Аналогичным образом, используемый в описании и формуле изобретения термин «гетероарил» обозначает 5-10-членную ароматическую кольцевую систему, содержащую 1, 2 или 3 гетероатома, которые могут быть одинаковыми или различными, выбранными из N, O или S. Такие гетероарильные кольцевые системы включают пирролил, азолил, оксазолил, тиазолил, имидазолил, фурил, тиенил, хинолинил, изохинолинил, индолинил, бензотиенил, бензофуранил, бензизоксазолил или подобные соединения. Термин «арил» обозначает карбоциклическую ароматическую кольцевую систему, например, содержащую 6-10 атомов углерода, такую как фенил, нафтил или подобные соединения. Используемый здесь термин «галогеналкил» обозначает группу CnH2n+1, имеющую от одного до 2n+1 атомов галогена, которые могут быть одинаковыми или различными, и используемый здесь термин «галогеналкокси» обозначает группу OCnH2n+1, имеющую от одного до 2n+1 атомов галогена, которые могут быть одинаковыми или различными.
Примерами 8-13-членных бициклических или трициклических кольцевых систем, имеющих атом N в головной части мостиковой связи и необязательно содержащих 1, 2 или 3 дополнительных гетероатома, выбранных из N, O или S, включенных в обозначенный здесь термин, являются следующие кольцевые системы, где W представляет NR, O или S; а R представляет Н или необязательный заместитель, как описано здесь ниже:
В описании и формуле изобретения, когда такие термины как «С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С7 циклоалкил, циклогетероалкил, арил, гетероарил или 8-13-членная бициклическая или трициклическая кольцевая система, имеющая атом N в головной части мостиковой связи», обозначены как являющиеся необязательно замещенными, замещающие группы, которые могут необязательно присутствовать, могут быть одной или более, например, двумя или тремя, одинаковыми или отличными от групп, обычно используемых в разработке фармацевтических соединений или модификациях таких соединений, воздействуя на их структуру/активность, продолжительность действия, всасывание, устойчивость или другое благоприятное свойство. Конкретные примеры таких заместителей включают атомы галогенов, нитро, циано, тиоцианато, цианато, гидроксильную, алкильную, галоалкильную, алкокси, галоалкокси, амино, алкиламино, диалкиламино, формильную, алкоксикарбонильную, карбоксильную, алканоильную, алкилтио, алкилсульфинильную, алкилсульфонильную, карбамоильную, алкиламидо, фенильную, фенокси, бензильную, бензилокси, гетероарильную, циклогетероарильную или циклоалкильную группы, предпочтительно, атомы галогена или группы низших алкилов. Обычно могут присутствовать 0-3 заместителя. Когда любой из указанных выше заместителей представляет собой или содержит алкильную группу в качестве заместителя, она может быть линейной или разветвленной и может содержать до 12, предпочтительно, до 6, предпочтительнее, до 4 атомов углерода.
Примерами R1 и R2 являются независимо водород, галоген (такой как фтор, хлор, бром), С1-С6алкил (например, метил), гидрокси, С1-С6алкил, замещенный фенилом (например, бензил), и С1-С6алкокси (например, метокси); например, где замещение находится в 5- и/или 6- и/или 7 положении.
Q может представлять, например, SO2.
Примером n является 2.
Примерами R8 являются необязательно замещенные имидазо[1,2-a]пиридиновая, имидазо[2,1-b][1,3]тиазолильная или бензо[d]имидазо[2,1-b][1,3]тиазольная кольцевая система, например, R8 представляет 6-хлоримидазо[2,1-b][1,3]тиазол-5-ил.
Примером R7 является Н.
R3 и R4 могут независимо представлять собой, например, Н или С1-С6алкил, такой как метил. Значение каждого присутствующего R3 и R4 может быть одинаковым или различным, например, один R3 может представлять Н, а другой СН3.
Примерами R5 и R6 являются независимо водород, С1-С6алкил и С1-С6алкил, замещенный фенилом. Примерами R5 и R6, когда они вместе с атомом азота представляют 5- или 6-членное кольцо, являются кольца, такие как пирролидинил, пиперазинил или пиперидинил, каждый необязательно замещенный С1-С6алкилом или СООН.
Фармацевтически приемлемые соли могут представлять собой любую кислотно-аддитивную соль, образованную соединением формулы I и фармацевтически приемлемой кислотой, такой как фосфорная, серная, хлористоводородная, бромистоводородная, лимонная, малеиновая, малоновая, миндальная, янтарная, фумаровая, уксусная, молочная, азотная, сульфоновая, пара-толуолсульфоновая, метансульфоновая кислота или им подобные кислоты.
Соединения настоящего изобретения включают сложные эфиры, карбаматы или другие обычные пролекарственные формы, которые в целом представляют собой функциональные производные соединений настоящего изобретения и которые легко превращаются в активную часть молекулы настоящего изобретения in vivo. Соответственно, способ в соответствии с настоящим изобретением охватывает лечение различных состояний, описанных выше, соединением формулы I или соединением, которое специально не раскрыто, но которое, после введения, превращается в соединение формулы I in vivo. Включены также метаболиты соединений настоящего изобретения, определенные как активные виды, продуцируемые после введения указанных соединений в биологическую систему.
Соединения настоящего изобретения могут существовать в виде одного или более стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Специалисту в данной области будет понятно, что один стереоизомер может быть более активным или может проявлять благоприятные эффекты при обогащении им смеси стереоизомеров относительно другого стереоизомера(ов), или при отделении от другого стереоизомера(ов). Кроме того, специалист в данной области знает, как отделить, обогатить или селективно получить указанные стереоизомеры. Соответственно, настоящее изобретение включает соединения формулы I, их стереоизомеры и их фармацевтически приемлемые соли. Соединения настоящего изобретения могут присутствовать в виде смеси стереоизомеров, отдельных стереоизомеров или в виде оптически активной формы.
Предпочтительными соединениями настоящего изобретения являются соединения формулы I, где Q представляет SO2. Также предпочтительными являются те соединения формулы I, где n равно 2. Другой группой предпочтительных соединений формулы I являются те соединения, где R8 представляет 6-хлоримидазо[2,1-b][1,3]тиазол-5-ил.
Более предпочтительными соединениями настоящего изобретения являются те соединения формулы I, где Q представляет SO2, а R7 представляет Н. Другой группой более предпочтительных соединений являются те соединения формулы I, где Q представляет SO2, n равно 2, а R7 представляет Н. Дальнейшими более предпочтительными соединениями являются соединения формулы I, где Q представляет SO2, n равно 2, R7 представляет Н, а R8 представляет 6-хлоримидазо[2,1-b][1,3]тиазол-5-ил.
Среди предпочтительных соединений изобретения представлены:
2-{1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-индол-3-ил}эиламин;
2-{1-[(имидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-индол-3-ил}эиламин;
{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}мтиламин;
{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}дметиламин;
бензил-{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}аин;
1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-3-(2-пирролидин-1-илэтил)-1Н-индол;
1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-3-[2-(4-метилпиперазин-1-ил)этил]-1Н-индол;
1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-3-(2-пиперидин-1-илэтил)-1Н-индол;
бензил-{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}мтиламин;
{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}фнетиламин;
1-{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1H-индол-3-ил]этил}прролидин-2-карбоновая кислота;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламин;
(R)-2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламин;
(S)-2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламин;
2-[1-(2-хлоримидазо[1,2-a]пиридин-3-сульфонил)-1Н-индол-3-ил]этиламин;
2-[1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламин;
2-[1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этиламин;
{2-[1-(2-хлоримидазо[1,2-а]пиридин-3-сульфонил)-1Н-индол-3-ил]этил}мтиламин;
{2-[1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}мтиламин;
{2-[1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этил}мтиламин;
{2-[1-(2-хлоримидазо[1,2-а]пиридин-3-сульфонил)-1Н-индол-3-ил]этил}дметиламин;
{2-[1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}дметиламин;
{2-[1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этил}дметиламин;
2-[5-хлор-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламин;
2-[5-хлор-1-(2-хлоримидазо[1,2-а]пиридин-3-сульфонил)-1Н-индол-3-ил]этиламин;
2-[5-хлор-1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламин;
2-[5-хлор-1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этиламин;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-5-метокси-1Н-индол-3-ил]этиламин;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-6-метокси-1Н-индол-3-ил]этиламин;
2-[5-бром-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламин;
2-[5-бензилокси-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламин;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-5-метил-1Н-индол-3-ил]этиламин;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-6-метил-1Н-индол-3-ил]этиламин;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-7-метил-1Н-индол-3-ил]этиламин;
3-(2-аминоэтил)-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-5-ол;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-5-фтор-1Н-индол-3-ил]этиламин;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-6-фтор-1Н-индол-3-ил]этиламин;
их стереоизомеры; или их фармацевтически приемлемые соли.
Данное изобретение также относится к способам получения соединений формулы (I), причем способы включают один из следующих:
а) взаимодействие соединения формулы В

где n, R1, R2, R3, R4, R5, R6 и R7 определены выше, с соответствующим сульфонилирующим, ацилирующим, карбамоилирующим или тиокарбамоилирующим агентом, содержащим группу:
R8-Q-
где R8 определен выше, а Q представляет SO2, CO, CONR9 или CSNR10; причем указанные реагирующие соединения при необходимости защищены на реактивных участках и/или на реактивных заместительных группах, и удаление любых защитных групп для получения соответствующего соединения формулы (I);
или
b) удаление защитной группы из соединения формулы I, где R5 замещен защитной группой, с получением соответствующего соединения формулы (I), где NR5R6 представляет собой -NHR6;
или
с) взаимодействие соединения формулы (С):
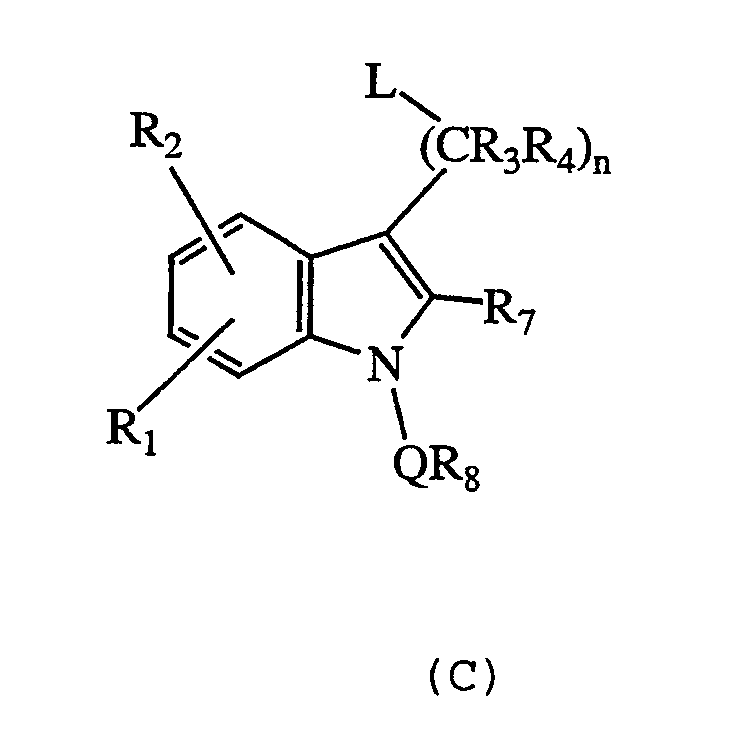
где n, R1, R2, R3, R4, R7, R8 и Q определены выше, а L представляет собой уходящую группу, такую как галоген, например, Br, с амином формулы NHR5R6, с получением соответствующего соединения формулы (I);
d) превращение соединения формулы (I), имеющего реакционно-способную заместительную группу, в другое соединение формулы I;
или
е) превращение основного соединения формулы (I) в кислотно-аддитивную соль или наоборот;
или
f) выделение изомера соединения формулы (I) из смеси изомеров;
или
g) превращение азида формулы (D)
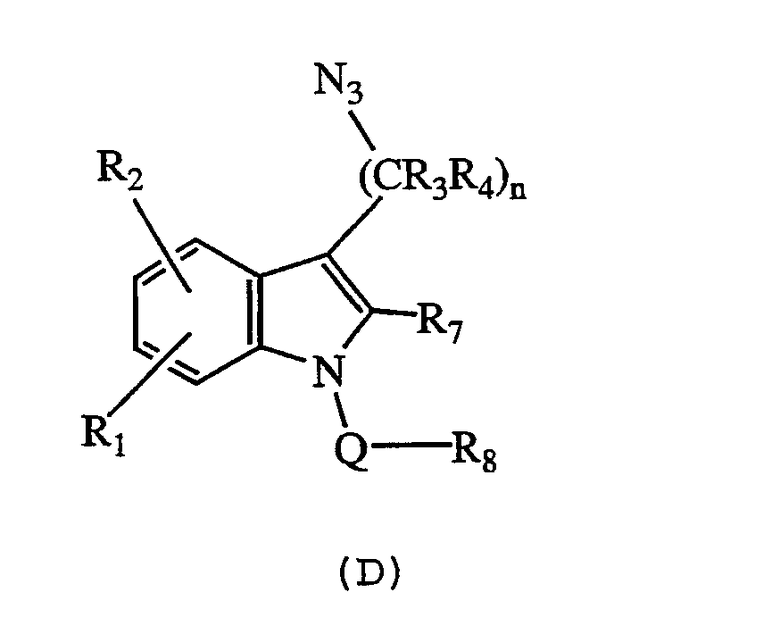
где n, R1, R2, R3, R4, R7, R8 и Q определены выше,
в соответствующее соединение формулы (I), где оба R5 и R6 представляют собой Н.
Способы проведения описанных выше реакций хорошо известны специалистам в данной области и/или проиллюстрированы в настоящем описании. В любых из описанных здесь реакций группы реакционно-способных заместителей или участки в молекуле могут быть защищены перед реакцией использованием соответствующих защитных групп, инертных к условиям реакции, и удалены после реакции.
Соединения изобретения можно подходящим образом получить с использованием обычных синтетических способов и, если требуется, стандартных методик разделения и выделения. Например, соединения формулы I, где Q представляет SO2, n равно 2 и R3 и R4 представляют Н (Ia), можно получить последовательной реакцией индольного производного формулы I с оксалилхлоридом и амином, HNR5R6, получая промежуточное соединение формулы III; восстановлением карбонильных групп формулы III гидридом литийалюминия, получая соответствующее 3-этиламиновое производное соединения формулы IV; и реакцией указанного производного соединения формулы IV с основанием, таким как трет-бутилат калия или гидрид натрия, а затем сульфонилхлоридом, R8SO2Cl, получая желаемый продукт формулы Ia. Последовательность реакции показана на схеме последовательности операций I.
Схема последовательности операций I

Для промежуточных соединений формулы IV, где R5 или R6 представляют Н, амин формулы IV может быть защищен обычным защищающим реагентом, таким как карбонат ди-трет-бутила, перед конечными этапами сульфонилирования. Затем можно снять защиту полученного N-защищенного соединения формулы I в присутствии кислоты.
Альтернативно, соединения формулы Ia можно получить реакцией производного 3-(2-бромэтила) формулы V последовательно с основанием и сульфонилхлоридом, R8SO2Cl, получая промежуточное соединение формулы VI, и реакцией промежуточного соединения формулы VI с амином, HNR5R6, получая желаемый продукт формулы Ia. Этапы реакции показаны на схеме последовательности операций II.
Схема последовательности операций II
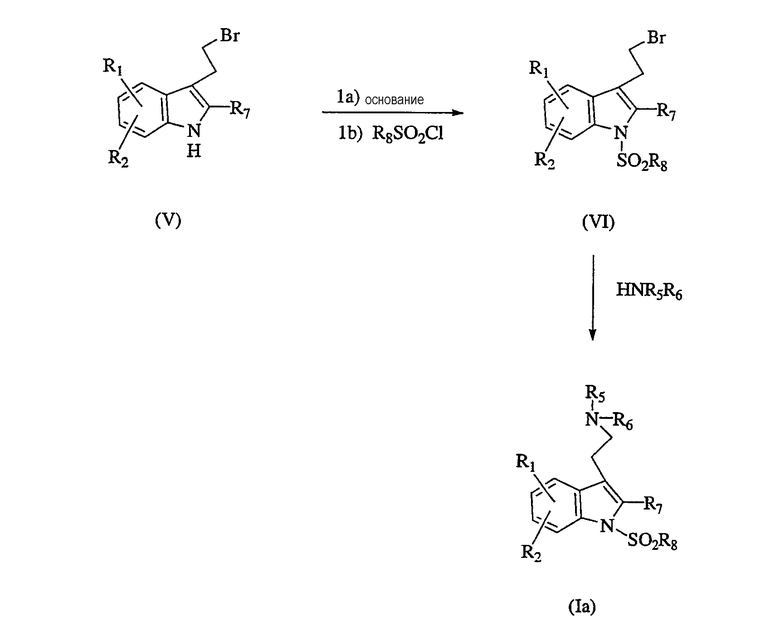
Соединения формулы I, где R3 или R4 представляют собой не Н, а Q представляет SO2 (Ib), можно получить последовательной реакцией промежуточного соединения формулы II с реактивом Гриньяра, таким как этилмагнийбромид, и хлоридом аминокислоты формулы VII, получая 3-ацилированное соединение формулы VIII; восстановлением указанного соединения формулы VIII восстанавливающим агентом, таким как гидрид литийалюминия, получая соответствующее 3-алкиламиносоединение формулы IX, и сульфированием соединения формулы IX, как описано выше в схемах последовательности операций I и II, получая желаемый продукт формулы Ib. Последовательность реакции показана на схеме последовательности операций III.
Схема последовательности операций III

В случае, когда R5 или R6 представляют Н, атом азота хлорида аминокислоты формулы VII защищен, и защиту соответствующего полученного продукта можно снять, используя обычные средства, получая желаемое соединение формулы Ib, где R5 или R6 представляют Н.
Соединения формулы I, где Q представляет SO2; n равно 3; и R3, R4, R5, R6 и R7 представляют Н (Ic), можно получить последовательной реакцией гидрохлорида арилгидразина формулы X с 3,4-дигидро-2Н-пираном, получая индол-3-илпропанол-1-ол формулы XI; заменой гидроксигруппы на бром, получая соответствующее бромсоединение формулы XII; реакцией соединения формулы XII с азидом натрия, получая азид формулы XIII; сульфонилированием азида формулы XIII, получая соединение формулы XIV, и превращением соединения формулы XIV в желаемый амин формулы Ic посредством реакции с трифенилфосфином. Последовательность реакции показана на схеме последовательности операций IV.
Схема последовательности операций IV

Аналогично, соединения формулы I, где Q представляет СО, CONR9 или CSR10, можно получить, используя указанные выше методики, проиллюстрированные в схемах последовательности операций I, II, III и IV, и применяя соответствующим образом замещенный хлорангидрид, изоцианат или изотиоцианат, вместо R8SO2Cl.
Защитные группы, которые можно использовать в описанных выше реакциях, включают карбоксилат трет-бутила, бензил, ацетил, бензилоксикарбонил или любую обычную группу, которая, как известно, защищает основной азот при стандартных методиках синтеза.
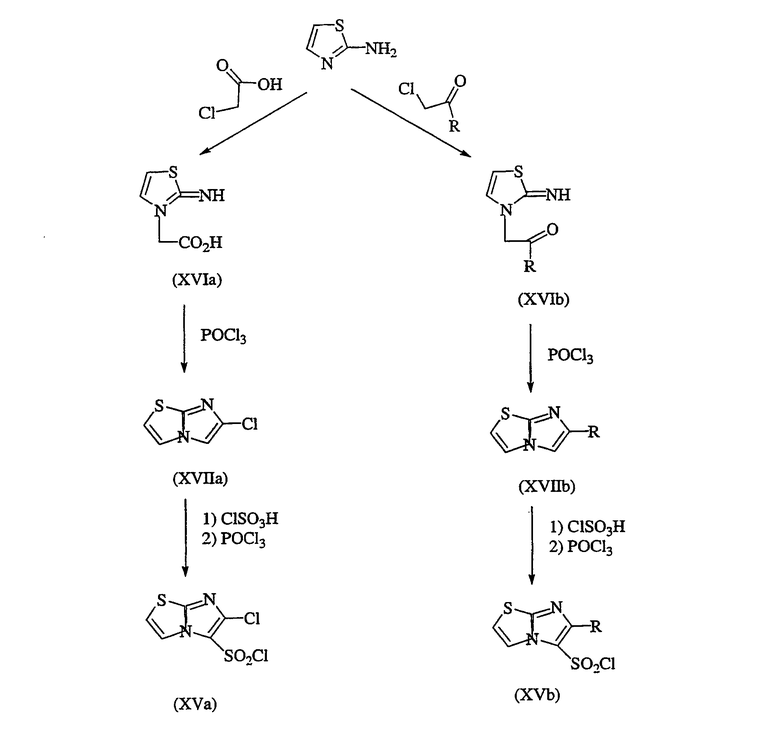
Сульфонилхлориды, R8SO2Cl, можно купить или получить обычными методиками. Например, сульфонилхлориды 6-замещенного-имидазо[2,1-b][1,3]тиазол-5-ила формул XVa и XVb можно получить реакцией 2-аминотиазола с хлоруксусной кислотой или подходящим хлорметилкетоном, получая соответственно 2-имино-4-тиазолин-3-илуксусную кислоту (XVIa) или 2-имино-4-тиазолин-3-илкетон (XVIb); реакцией или XVIa, или XVIb с POCl3, получая, в случае XVIa, 6-хлоримидазо[2,1-b]тиазол (XVIIa), или, в случае XVIb, 6-замещенный-имидазо[2,1-b]тиазол (XVIIb); и последовательной реакцией соответствующих соединений XVIIa и XVIIb с хлорсульфоновой кислотой и POCl3, получая желаемые сульфонилхлориды формул XVa и XVb. Реакции проиллюстрированы в схеме последовательности операций V, где R представляет необязательный заместитель, как описано выше, за исключением галогена.
Схема последовательности операций V
Предпочтительно настоящее изобретение относится к способу получения соединения формулы I, где Q представляет SO2, а R5 и R6 представляют собой не Н (Id), который включает реакцию соединения формулы XVIII с сульфонилхлоридом, R8SO2Cl, в присутствии основания, необязательно, в присутствии растворителя. Процесс показан в схеме последовательности операций VI.
Схема последовательности операций VI

Основания, пригодные для использования в способе изобретения, представляют собой сильные основания, такие как NaH, KOтрет-Bu, или любое обычное основание, способное удалить протон из основного индола или атом азота бензазола.
Преимущественно соединение формулы I изобретения можно успешно использовать при лечении расстройств центральной нервной системы, связанных с рецептором 5-НТ6 или находящихся под его воздействием, таких как расстройства двигательных функций, настроения, психиатрические расстройства, расстройства познавательной функции, нейродегенеративные расстройства или подобные расстройства, например, болезнь Альцгеймера, болезнь Паркинсона, расстройство с дефицитом внимания, тревога, эпилепсия, депрессия, навязчивое компульсивное расстройство, мигрень, расстройства сна, нейродегенеративные расстройства (такие как травма головы или инсульт), расстройства потребления пищи (такие как анорексия или булимия), шизофрения, потеря памяти, расстройства, связанные с наркотической абстиненцией или прекращением злоупотребления никотином или подобные расстройства, или определенные желудочно-кишечные расстройства, такие как синдром раздражимого кишечника. Соответственно, настоящее изобретение относится к способу лечения расстройства центральной нервной системы (ЦНС), связанного с рецептором 5-НТ6, или находящегося под его воздействием, у нуждающегося в нем пациента, который включает введение указанному пациенту терапевтически эффективного количества соединения формулы I, описанного выше. Соединения можно вводить пероральным, или парентеральным путем, или любым обычным путем, который известен как эффективный путь введения терапевтического средства нуждающемуся в нем пациенту.
Терапевтически эффективное количество, предоставляемое при лечении конкретного расстройства ЦНС, может варьировать в соответствии с подвергаемым лечению конкретным состоянием(ями), массой, ростом, возрастом и типом реакции пациента, тяжестью расстройства, оценкой лечащего врача и подобными факторами. В целом, эффективные количества для суточного перорального введения могут составлять приблизительно от 0,01 до 1000 мг/кг, предпочтительно, приблизительно от 0,5 до 500 мг/кг, а эффективные количества для парентерального введения могут составлять приблизительно от 0,1 до 100 мг/кг, предпочтительно, приблизительно от 0,5 до 50 мг/кг.
В реальной практике соединения изобретения предоставляют введением соединения или его предшественника в твердой или жидкой форме, или отдельно, или в комбинации с одним или более обычных фармацевтических носителей или эксципиентов. Соответственно, настоящее изобретение относится к фармацевтической композиции, которая включает фармацевтически приемлемый носитель и эффективное количество соединения формулы I, описанного выше.
Твердые носители, подходящие для использования в композиции изобретения, включают одно или более веществ, которые могут также действовать в качестве ароматизирующих агентов, смазывающих агентов, солюбилизирующих агентов, суспендирующих агентов, наполнителей, глянцевателей, вспомогательных агентов для прессовки, связывающих веществ, агентов, разрыхляющих таблетки, или инкапсулирующих веществ. В порошках носитель может представлять собой тонкоизмельченное твердое вещество, которое представлено в смеси с тонкоизмельченным соединением формулы I. В таблетках соединение формулы I может быть смешано с носителем, имеющим необходимые свойства сжатия в подходящих пропорциях и спрессованным в желаемую форму и размер. Указанные порошки и таблетки могут содержать до 99 мас.% соединения формулы I. Твердые носители, подходящие для использования в композиции изобретения, включают фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, поливинилпирролидон, воски с низкой точкой плавления и ионообменные смолы.
Любой фармацевтически приемлемый жидкий носитель, пригодный для получения растворов, суспензий, эмульсий, сиропов и эликсиров, можно использовать в композиции изобретения. Соединения формулы I можно растворить или суспендировать в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель или фармацевтически приемлемое масло или жир, или в их смеси. Указанная жидкая композиция может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подслащивающие агенты, ароматизирующие агенты, суспендирующие агенты, загустители, красящие агенты, регуляторы вязкости, стабилизаторы, регуляторы осмотического давления или подобные вещества. Примеры жидких носителей, пригодных для перорального и парентерального введения, включают воду (в частности, содержащую указанные выше добавки, например, производные целлюлозы, предпочтительно, раствор натрийкарбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) или их производные, или масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель может также представлять собой маслянистый сложный эфир, такой как олеат или изопропилмиристат.
Композиции настоящего изобретения, которые представляют собой стерильные растворы или суспензии, пригодны для внутримышечной, внутрибрюшинной или подкожной инъекции. Стерильные растворы можно также вводить внутривенно. Композиции изобретения, пригодные для перорального введения, могут быть как в жидкой форме, так и твердой композиции.
Для более ясного понимания и для более ясной иллюстрации изобретения ниже изложены его конкретные примеры. Следующие примеры являются лишь иллюстративными и их никоим образом не следует понимать как ограничивающие диапазон и лежащие в основе принципы изобретения.
При отсутствии других указаний, все части представляют собой части по массе. Термины «ЯМР» и «ВЭЖХ» обозначают соответственно ядерный магнитный резонанс и высокоэффективную жидкостную хроматографию. Термины «ТГФ» и «EtOAc» обозначают соответственно тетрагидрофуран и этилацетат.
ПРИМЕР 1
Получение гидрохлорида 2-{1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-индол-3-ил}эиламина

Раствор триптамина (4,2 г, 26,2 ммоль) в смеси 1:1 ацетона:воды обрабатывают карбонатом ди-трет-бутила (6,5 г, 27,8 ммоль) и К2СО3 (7,5 г, 54,4 ммоль), перемешивают при комнатной температуре в течение 16 ч, концентрируют в вакууме в водную смесь и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Смесь полученного остатка (5,6 г, 21 ммоль) и хлорида 6-хлоримидазо[2,1-b]тиазол-5-сульфонила (5,01 г, 19,5 ммоль) в ТГФ порциями обрабатывают трет-бутилатом калия (4,3 г, 39 ммоль (2 эквивалента)) при комнатной температуре, перемешивают в течение 16 ч, выливают в насыщенный раствор NaHCO3 и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Указанный полученный остаток хроматографируют (силикагель, 10%-60% EtOAc в гексанах в качестве градиентного элюента), получая защищенное 5-сульфонилтриптаминовое промежуточное соединение в виде твердого вещества рыжевато-коричневого цвета, 5,6 г (выход 60%). Раствор указанного промежуточного соединения (6,8 г, 14,2 ммоль) в изопропаноле обрабатывают 4N HCl в диоксане (40 мл, 11 эквивалентов), перемешивают в течение 4 ч и фильтруют. Фильтровальную лепешку промывают простым эфиром и сушат воздухом, получая указанный в заголовке продукт в виде не совсем белого твердого вещества, 3,2 г (выход 55%) с температурой плавления 239-241°С, идентифицируемого ЯМР и масс-спектральным анализами.
ПРИМЕР 2
Получение 3-(2-бромэтил)-1-(6-хлоримидазо[2,1-b]тиазол-5-сульфонил)индола

Смесь 3-(2-бромэтил)индола (1,0 г, 4,46 ммоль) и хлорида 6-хлоримидазо[2,1-b]тиазол-5-сульфонила (0,96 г, 1,1 эквивалента) в ТГФ обрабатывают трет-бутилатом (трет-бутоксидом) калия (0,48 г, 1,1 эквивалента) при комнатной температуре, перемешивают в течение 16 ч, гасят насыщенным NaHCO3 и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме, получая указанный в заголовке продукт в виде коричневого масла, 1,2 г (выход 58%), идентифицируемый ВЭЖХ и масс-спектральным анализами.
ПРИМЕР 3
Получение {2-[1-(6-хлоримидазо[2,1-b]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}мтиламина
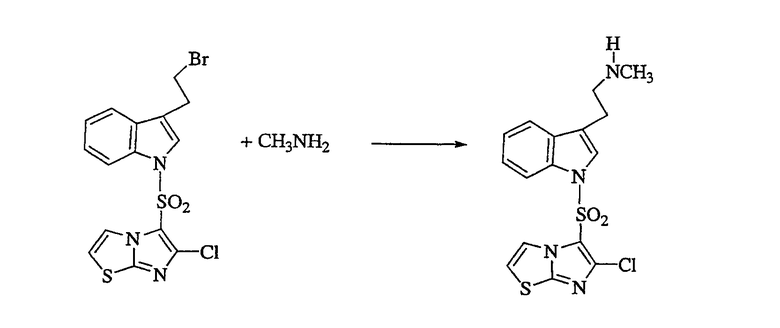
Раствор 3-(2-бромэтил)-1-(6-хлоримидазо[2,1-b]тиазол-5-сульфонил)индола (92 мг, 0,20 ммоль) в ТГФ обрабатывают метиламином (2М в метаноле, 0,4 мл, 2 эквивалента), нагревают при 50°С в течение 24 ч, охлаждают и концентрируют в вакууме. Полученный остаток очищают ВЭЖХ1, получая указанный в заголовке продукт в виде белого твердого вещества, 18,5 мг, идентифицируемого ВЭЖХ2 и масс-спектральным анализами. (1Условия ВЭЖХ (препаративной): Система препаративной ВЭЖХ Джилсона; колонка YMC Pro С18, 20 мм×50 мм внутренний диаметр, 5 мкМ; ввод пробы 2 мл; Растворитель А: 0,02% ТФА/вода; Растворитель В: 0,02% ТФА/ацетонитрил; Градиент: Время 0: 95% А; 2 мин: 95% А; 14 мин: 10% А, 15 мин: 10% А, 16 мин: 95% А; Скорость потока 22,5 мл/мин; Детекция: 254 нм DAD.
2Условия ВЭЖХ (аналитической): Система ВЭЖХ Hewlett Packard 1100; колонка Waters Xterra С18, 2 мм×30 мм внутренний диаметр, 3 мкМ; ввод пробы 5 мкл; Растворитель А: 0,02% ТФА/вода; Растворитель В: 0,02% ТФА/ацетонитрил; Градиент: Время 0: 95% А; 0,2 мин: 95% А; 3 мин: 5% А; Скорость потока 1,2 мл/мин; Детекция: 254 нм DAD.)
ПРИМЕРЫ 4-11
Получение производных N-замещенного-2-{1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-индол-3-ил}эиламина

Используя по существу те же описанные выше методики и применяя соответствующий амин, получают соединения, показанные в таблице I, и идентифицируют ВЭЖХ и масс-спектральным анализами.

ПРИМЕР 12
Получение гидрохлорида 2[1-(6-хлоримидазо[2,1-b]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламина
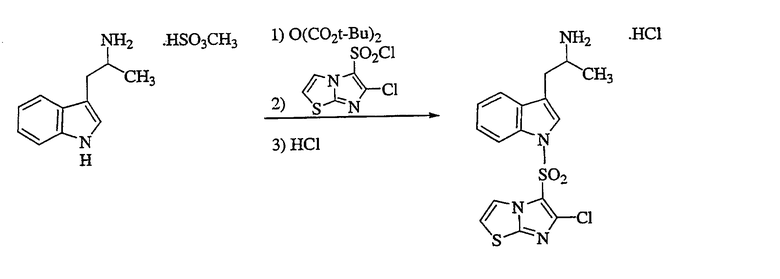
Раствор сульфоната α-метилтриптаминметана (5,0 г, 18,5 ммоль) в смеси 1:1 ацетона:воды обрабатывают дикарбонатом ди-трет-бутила (7,7 г, 55,5 ммоль, 3 эквивалента), перемешивают при комнатной температуре в течение 16 ч, концентрируют в вакууме в водную смесь и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Смесь части полученного остатка (2,0 г, 7,3 ммоль, 1,1 эквивалента) и хлорида 6-хлоримидазо[2,1-b]тиазол-5-сульфонила (1,7 г, 6,6 ммоль, 1,0 эквивалент) в ТГФ порциями обрабатывают трет-бутилатом калия (820 мг, 7,3 ммоль, 1,1 эквивалента) при комнатной температуре, перемешивают в течение 1 ч, загружают в насыщенный раствор NaHCO3 и экстрагируют EtOAc. Экстракты объединяют, сушат над Na2SO4 и концентрируют в вакууме. Указанный полученный остаток хроматографируют (силикагель, 20%-50% EtOAc в гексанах в качестве градиентного элюента), получая свободное основание указанного в заголовке продукта в виде коричневого масла, 1,7 г (выход 50%). Обработка 4N HCl в диоксане и ТГФ с последующей фильтрацией и перекристаллизацией фильтровальной лепешки из этанола дает указанный в заголовке продукт в виде светло-коричневого твердого вещества, 1,0 г (выход 40%), идентифицируемый ЯМР и масс-спектральным анализами.
ПРИМЕР 13
Получение (S)-2-амино-1-(1Н-индол-3-ил)-пропан-1-она

Раствор индола (1,1 г, 9,3 ммоль, 1,0 эквивалент) в метиленхлориде в атмосфере N2 при 0°С обрабатывают по каплям бромидом этилмагния (9 мл, 3,0 М в простом эфире, 27 ммоль, 3 эквивалента), дают согреться до комнатной температуры в течение 1 ч, охлаждают до 0°С, обрабатывают по каплям раствором хлорангидрида Fmoc-L-аланина (14,0 ммоль, 1,5 эквивалента) в метиленхлориде, дают согреться до комнатной температуры в течение 1 ч, загружают на 50 мл водной 1N HCl, охлаждают до 0°С и перемешивают при 0°С в течение 15 мин. Фазы разделяют. Органическую фазу сушат над Na2SO4 и концентрируют в вакууме, получая остаток. Остаток разводят насыщенным NaHCO3 и экстрагируют EtOAc. Экстракты объединяют и концентрируют в вакууме, получая остаток, который растворяют в 10% пиперидине в диметилформамиде и перемешивают в течение 1 ч при комнатной температуре. Полученный раствор разводят насыщенным NaHCO3 и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме, получая указанный в заголовке продукт в виде коричневого масла, 0,8 г (выход 47%), идентифицируемый ВЭЖХ и масс-спектральным анализами.
ПРИМЕР 14
Получение (S)-2-(1Н-индол-3-ил)-1-метилэтиламина

Раствор (S)-2-Амино-1-(1Н-индол-3-ил)-пропан-1-она (0,47 г, 2,5 ммоль, 1,0 эквивалент) в ацетонитриле и изопропаноле обрабатывают порциями NaBH4 (285 мг, 7,49 ммоль, 3,0 эквивалента), нагревают при температуре дефлегмации в течение 24 ч, перемешивают при комнатной температуре в атмосфере N2 в течение 36 ч, гасят метанолом, концентрируют и распределяют между водой и EtOAc. Фазу EtOAc сушат над MgSO4 и концентрируют в вакууме, получая указанный в заголовке продукт в виде коричневого масла, идентифицируемый ВЭЖХ и масс-спектральным анализами.
ПРИМЕР 15
Получение гидрохлорида (S)-2-[1-(6-хлоримидазо[2,1-b]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламина

Смесь (S)-2-(1Н-индол-3-ил)-1-метилэтиламина (0,43 г, 2,5 ммоль) и дикарбоната ди-трет-бутила (0,60 г, 2,75 ммоль) в ацетоне обрабатывают по каплям водным К2СО3 (3,5 г, 25 ммоль) при 0°С, дают согреться до комнатной температуры в течение 16 ч, концентрируют в водный остаток и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме до сухости. Данный остаток хроматографируют (силикагель, 10%-50% EtOAc в гексанах в качестве градиентного элюента), получая защищенный (R)-2-метилтриптамин. Смесь защищенного триптамина (0,17 г, 0,62 ммоль) и хлорида 6-хлоримидазо[2,1-b]тиазол-5-сульфонила (0,16 г, 0,62 ммоль) в ТГФ обрабатывают трет-бутилатом калия (77 мг, 0,68 ммоль) при комнатной температуре, перемешивают в течение 1 ч, загружают в насыщенный NaHCO3 и экстрагируют EtOAc. Экстракты объединяют, сушат над Na2SO4 и концентрируют в вакууме. Полученный остаток диспергируют в ТГФ и 4N HCl в диоксане, перемешивают в течение 16 ч, концентрируют в вакууме и очищают ВЭЖХ1, получая указанный в заголовке продукт в виде бежевого твердого вещества, 0,62 мг (выход 35%), идентифицируемый ЯМР и масс-спектральным анализами.
(1Условия ВЭЖХ: Система ВЭЖХ Hewlett Packard 1100; колонка Waters Xterra С18, 2 мм×30 мм внутренний диаметр, 3 мкМ; ввод пробы 5 мкл; Растворитель А: 0,02% ТФА/вода; Растворитель В: 0,02% ТФА/ацетонитрил; Градиент: Время 0: 95% А; 0,2 мин: 95% А; 3 мин: 5% А; Скорость потока 1,2 мл/мин; Детекция: 254 нм DAD.)
ПРИМЕР 16
Получение гидрохлорида (R)-2-[1-(6-хлоримидазо[2,1-b]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламина

Используя по существу такие же методики, как описано выше, и применяя F-moc-D-аланин в качестве исходного вещества, получают указанный в заголовке продукт и идентифицируют ВЭЖХ и масс-спектральным анализами.
ПРИМЕРЫ 17-40
Получение производных индолилалкиламина
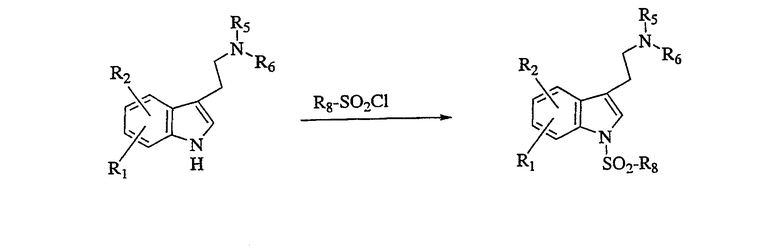
Используя по существу такие же методики, как описано выше, и применяя соответствующий индольный субстрат и галид сульфонила, получают соединения, показанные в таблице II, и идентифицируют ВЭЖХ и масс-спектральным анализами.

ПРИМЕР 41
Получение 3-(фтор-1Н-индол-3-ил)пропан-1-ола

Перемешанную суспензию гидрохлорида 4-фторфенилгидразина (8,13 г, 50 ммоль) в смеси воды и диоксана обрабатывают раствором 3,4-дигидро-2Н-пирана (4,6 мл, 50 ммоль) в течение периода 5 мин, нагревают при 100°С в течение 18 ч, охлаждают, разводят простым эфиром и фильтруют. Фильтрат сушат над Na2SO4 и концентрируют в вакууме. Полученный остаток очищают флэш-хроматографией (силикагель, 1:1 EtOAc/гексан), получая указанный в заголовке продукт в виде масла, 8,31 г (выход 86%), идентифицируемый ЯМР и масс-спектральным анализами.
ПРИМЕР 42
Получение 3-(3-бромпропил)-5-фтор-1Н-индола
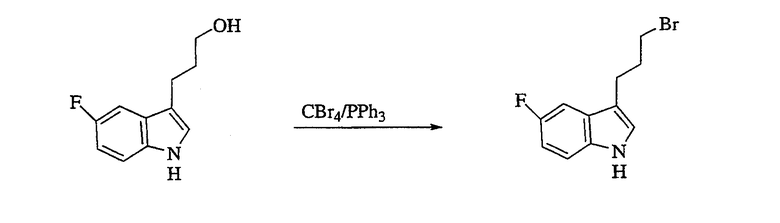
Смесь 3-(5-фтор-1Н-индол-3-ил)-пропан-1-ола (2,15 г, 11,2 ммоль), тетрабромида углерода (4,80 г, 14,5 ммоль) и трифенилфосфина (4,40 г, 16,7 ммоль) в метиленхлориде перемешивают в течение 1 ч и концентрируют в вакууме. Полученный остаток очищают флэш-хроматографией (силикагель, EtOAc/гексан 3/7), получая указанный в заголовке продукт в виде масла, 1,97 г (выход 69%), идентифицируемый ЯМР и масс-спектральным анализами.
ПРИМЕР 43
Получение 3-(3-азидопропил)-5-фтор-1Н-индола

Раствор 3-(3-бромпропил)-5-фтор-1Н-индола (0,95 г, 3 ммоль) и азида натрия (0,59 г, 9 ммоль) в безводном диметилформамиде перемешивают при 60°С в течение 18 ч, выливают в воду и экстрагируют метиленхлоридом. Экстракты объединяют, промывают водой, сушат над Na2SO4 и концентрируют в вакууме. Полученный остаток очищают флэш-хроматографией (силикагель, EtOAc/гексан 3/7), получая указанный в заголовке продукт в виде прозрачного масла, 0,98 г (выход 91%), идентифицируемый ЯМР и масс-спектральным анализами.
ПРИМЕР 44
Получение 3-(3-азидопропил)-1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-5-фтор-1Н-индола

Перемешанный раствор 3-(3-азидопропил)-5-фтор-1Н-индола (150 мг, 0,53 ммоль) в ТГФ обрабатывают KOt-Bu (0,55 мл, 0,55 ммоль, 1М в растворе ТГФ) в атмосфере азота при комнатной температуре, перемешивают в течение 30 мин, обрабатывают 6-хлоримидазо[2,1-b]тиазол-5-сульфонилхлоридом (141 мг, 0,55 ммоль), перемешивают в течение 18 ч при комнатной температуре, гасят 1N HCl и водой и разводят EtOAc. Две фазы разделяют и водную фазу экстрагируют EtOAc. Экстракты объединяют с органической фазой и сушат над MgSO4 и концентрируют в вакууме. Полученный остаток очищают флэш-хроматографией (силикагель, EtOAc/гексан 3/7), получая указанный в заголовке продукт в виде желтого твердого вещества, 203 мг (выход 88%), точка плавления 84-86°С, идентифицируемый ЯМР и масс-спектральным анализами.
ПРИМЕР 45
Получение 3-{1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-5-фтор-1Н-индол-3-ил}попан-1-амина

Смесь 3-(3-азидопропил)-1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-5-фтор-1Н-индола (180 мг, 0,41 ммоль) и трифенилфосфина (161 мг, 0,62 ммоль) в ТГФ и воде перемешивают в атмосфере азота в течение 24 ч при комнатной температуре и концентрируют в вакууме.Полученный остаток очищают флэш-хроматографией (силикагель, EtOAc/2М NH3 в MeOH: 98/2), получая указанный в заголовке продукт в виде не совсем белого твердого вещества, 132 мг (выход 78%), точка плавления 139-141°С, идентифицируемый ЯМР и масс-спектральным анализами.
ПРИМЕР 46
Сравнительная оценка сродства связывания испытуемых соединений с рецептором 5-НТ6
Сродство испытуемых соединений к рецептору 5-НТ6 серотонина оценивают следующим образом. Культивированные клетки HeLa, экспрессирующие человеческие клонированные рецепторы 5-НТ6, собирают и центрифугируют при низкой скорости (1000×g) в течение 10,0 мин для удаления культуральных сред. Собранные клетки суспендируют в половине объема свежего физиологического солевого раствора с фосфатным буфером и повторно центрифугируют при той же скорости. Данную операцию повторяют. Собранные клетки затем гомогенизируют в десяти объемах 50 мМ Tris.HCl (рН 7,4) и 0,5 мМ ЭДТА. Гомогенат центрифугируют при 40000×g в течение 30,0 мин и осадок собирают. Полученный осадок в пробирке после центрифугирования повторно суспендируют в 10 объемах буфера Tris.HCl и повторно центрифугируют при той же скорости. Окончательный осадок в пробирке после центрифугирования суспендируют в небольшом объеме буфера Tris.HCl, и содержание белка в ткани определяют в аликвотных объемах по 10-25 мкл. Альбумин бычьей сыворотки используют в качестве стандарта при определении содержания белка в соответствии с методом, описанным Lowry et al., J. Biol. Chem., 193:265 (1951). Объем суспендированных клеточных мембран доводят, получая концентрацию тканевого белка 1,0 мг/мл суспензии. Полученную суспензию мембран (концентрированную в 10 раз) делят на алкиквотные объемы по 1,0 мл и хранят при -70°С до использования в последующих экспериментах связывания.
Эксперименты связывания проводят в 96-луночных титровочных микропланшетах в общем объеме 200 мкл. В каждую лунку добавляют следующую смесь: 80,0 мкл инкубационного буфера, изготовленного в буфере 50 мМ Tris.HCl (рН 7,4), содержащем 10,0 мМ MgCl2 и 0,5 мМ ЭДТА и 20 мкл [3H]-LSD (S.A., 86,0 Ки/ммоль, продаваемый компанией Amersham Life Science), 3,0 нМ. Константа диссоциации, KD [3H]-LSD на человеческом рецепторе 5-НТ6 серотонина, составляет 2,9 нМ, по данным определения насыщения связывания при возрастающих концентрациях [3H]-LSD. Реакцию запускают окончательным добавлением 100,0 мкл тканевой суспензии. Неспецифическое связывание измеряют в присутствии 10,0 мкМ метиотепина. Испытуемые соединения добавляют в объеме 20,0 мкл.
Реакции проводят в темноте в течение 120 мин при комнатной температуре, и в это время комплекс связанного лиганда-рецептора отфильтровывают на 96-луночном монофильтре сборщиком клеток Packard Filtermate® 196 Harvester. Связанному комплексу, захваченному на диске фильтра, дают высохнуть на воздухе, и радиоактивность измеряют счетчиком Packard TopCount®, оборудованным шестью фотоумножительными детекторами после добавления 40,0 мкл сцинтиллирующего вещества Microscint®-20 в каждую неглубокую лунку. Чашку монофильтра герметизируют термозапайкой и проводят подсчет в Packard TopCount®, при эффективности трития 31,0%.
Специфическое связывание с рецептором 5-НТ6 определяют как общую связанную радиоактивность минус количество, связанное в присутствии 10,0 мкМ немеченого метиотепина. Связывание в присутствии меняющихся концентраций испытуемого соединения выражено в виде процентной доли специфического связывания в отсутствие испытуемого соединения. Результаты наносят на график зависимости логарифма % связывания от логарифма концентрации испытуемого соединения. Нелинейный регрессионный анализ точек данных компьютерной программой Prism® дает значения как IC50, так и КI испытуемых соединений с 95% доверительными пределами. Линию линейной регрессии точек данных наносят на график, по которому определяют величину IC50, а величину KI определяют на основании следующего уравнения:
КI=IC50/(1+L/KD)
где L представляет концентрацию использованного радиоактивного лиганда, а KD представляет константу диссоциации лиганда для рецептора, обе величины, выраженные в нМ.
Используя данный анализ, определяют следующие величины KI и сравнивают с величинами, полученными репрезентативными соединениями, которые, как известно, демонстрируют связывание с рецептором 5-НТ6. Данные показаны ниже в таблице III.
(№ эксперимента)
Как видно из изложенных выше результатов, соединения настоящего изобретения демонстрируют значительное сродство к рецептору 5-НТ6.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1-(АМИНОАЛКИЛ)-3-СУЛЬФОНИЛАЗАИНДОЛЫ В КАЧЕСТВЕ ЛИГАНДОВ 5-ГИДРОКСИТРИПТАМИНА-6 | 2003 |
|
RU2315048C2 |
| ГЕТЕРОЦИКЛИЛ-3-СУЛЬФОНИЛИНДАЗОЛЫ В КАЧЕСТВЕ ЛИГАНДОВ 5-ГИДРОКСИТРИПТАМИНА-6 | 2004 |
|
RU2347780C2 |
| ПРОИЗВОДНЫЕ СУЛЬФОНАМИДА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2002 |
|
RU2293082C2 |
| ИНДОЛЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT | 2007 |
|
RU2449990C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИНДОЛА СО СРОДСТВОМ К РЕЦЕПТОРУ 5-HT | 2002 |
|
RU2294932C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ КОГНИТИВНЫХ РАССТРОЙСТВ | 2005 |
|
RU2420318C2 |
| ФЕНОКСИМЕТИЛЬНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2531274C2 |
| ИМИДАЗОПИРАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗ | 2004 |
|
RU2405784C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617988C2 |
| ЛИГАНДЫ 5-HT РЕЦЕПТОРОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2006 |
|
RU2329044C1 |
Изобретение относится к новым соединениям формулы (I), или его стереоизомерам, или его фармацевтически приемлемым солям:

где: Q означает SO2, п равно 2 или 3;
каждый R1 и R2 независимо означает Н, галоген, OR22 или C1-С6алкил; каждый R3 и R4 означает Н; каждый R5 и R6 независимо означает Н или C1-С6алкил, причем последний может быть замещен фенилом, или R5 и R6, могут вместе с атомом, к которому они присоединены, образовывать необязательно замещенное 5-7-членное кольцо, необязательно содержащее N в качестве второго гетероатома, которое может быть замещено СООН или C1-С6алкилом; R7 означает Н; R8 означает необязательно замещенную 8-13-членную бициклическую или трициклическую кольцевую систему, имеющую атом N в головной части мостиковой связи и, необязательно, содержащую 1, 2 дополнительных гетероатома, выбранных из N, S; где заместитель представляет собой 1 или 2 атома галогена; R22 означает Н или необязательно замещенную фенилом C1-С6алкильную группу. Соединения формулы I проявляют специфическое связывание с рецептором 5-НТ6, что позволяет использовать их в фармацевтических композициях. 4 н. и 6 з.п. ф-лы, 3 табл.
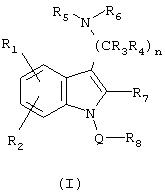
где Q представляет SO2, n представляет собой целое число, равное 2 или 3;
каждый R1 и R2 независимо представляет Н, галоген, OR22 или C1-С6алкил;
каждый R3 и R4 представляет Н;
каждый R5 и R6 независимо представляет Н или C1-С6алкил, причем последний может быть замещен фенилом, или R5 и R6 могут вместе с атомом, к которому они присоединены, образовывать необязательно замещенное 5-7-членное кольцо, необязательно содержащее N в качестве второго гетероатома, которое может быть замещено СООН или C1-С6алкилом;
R7 представляет Н;
R8 представляет необязательно замещенную 8-13-членную бициклическую или трициклическую кольцевую систему, имеющую атом N в головной части мостиковой связи и, необязательно, содержащую 1, 2 дополнительных гетероатома, выбранных из N, S; где заместитель представляет собой 1 или 2 атома галогена;
R22 представляет Н или необязательно замещенную фенилом C1-С6алкильную группу; или
его стереоизомеры или его фармацевтически приемлемые соли.
2-{1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-индол-3-ил}этиламина;
2-{1-[(имидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-индол-3-ил}этиламина;
{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}метиламина;
{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}диметиламина;
бензил-{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}амина;
1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-3-(2-пирролидин-1-ил)этил)-1Н-индола;
1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-3-[2-(4-метилпиперазин-1-ил)этил]-1Н-индола;
1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-3-(2-пиперидин-1-илэтил)-1Н-индола;
бензил-{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}метиламина;
{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил)фенитиламина;
1-{2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил} пирролидин-2-карбоновой кислоты;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламина;
(R)-2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламина;
(S)-2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]-1-метилэтиламина;
2-[1-(2-хлоримидазо[1,2-а]пиридин-3-сульфонил)-1Н-индол-3-ил]этиламина;
2-[1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламина;
2-[1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этиламина;
{2-[1-(2-хлоримидазо[1,2-а]пиридин-3-сульфонил)-1Н-индол-3-ил]этил} метиламина;
{2-[1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}метиламина;
{2-[1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этил}метиламина;
{2-[1-(2-хлоримидазо[1,2-а] пиридин-3-сульфонил)-1Н-индол-3-ил]этил}диметиламина;
{2-[1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этил}диметиламина;
{2-[1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1H-индол-3-ил]этил}диметиламина;
2-[5-хлор-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламина;
2-[5-хлор-1-(2-хлоримидазо[1,2-а]пиридин-3-сульфонил)-1Н-индол-3-ил]этиламина;
2-[5-хлор-1-(2,6-дихлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламина;
2-[5-хлор-1-(2-хлорбензо[d]имидазо[2,1-b][1,3]тиазол-3-сульфонил)-1Н-индол-3-ил]этиламина;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-5-метокси-1Н-индол-3-ил]этиламина;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-6-метокси-1Н-индол-3-ил]этиламина;
2-[5-бром-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламина;
2-[5-бензилокси-1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-3-ил]этиламина;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-5-метил-1Н-индол-3-ил]этиламина;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-6-метил-1Н-индол-3-ил]этиламина;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-7-метил-1Н-индол-3-ил]этиламина;
3-(2-аминоэтил)-1-(6-хлор-имидазо[2,1-b][1,3]тиазол-5-сульфонил)-1Н-индол-5-ола;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-5-фтор-1Н-индол-3-ил]этиламина;
2-[1-(6-хлоримидазо[2,1-b][1,3]тиазол-5-сульфонил)-6-фтор-1Н-индол-3-ил]этиламина;
их стереоизомеров; или их фармацевтически приемлемых солей.

где Q представляет SO2;
n представляет собой целое число, равное 2 или 3;
каждый R1 и R2 независимо представляет Н, галоген, OR22 или C1-С6алкил;
каждый R5 и R6 независимо представляет Н или C1-С6алкил, причем последний может быть замещен фенилом, или R5 и R6 могут вместе с атомом, к которому они присоединены, образовывать необязательно замещенное 5-7-членное кольцо, необязательно содержащее N в качестве второго гетероатома, которое может быть замещено СООН или C1-С6алкилом;
R7 представляет Н; R8 представляет необязательно замещенную 8-13-членную бициклическую или трициклическую кольцевую систему, имеющую атом N в головной части мостиковой связи, и, необязательно, содержащую 1, 2 дополнительных гетероатома, выбранных из N, S; где заместитель представляет собой 1 или 2 атома галогена;
R22 представляет Н или необязательно замещенную фенилом C1-С6алкильную группу, причем способ включает взаимодействие соединения формулы XVIII

где n, R1, R2, R3, R4 R5, R6 и R7 определены выше для формулы Id, с хлоридом сульфонила R8SO2Cl в присутствии основания, необязательно в присутствии растворителя.
| J | |||
| of Medicinal Chemistry | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Ячейка однородной структуры | 1980 |
|
SU941994A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ПРОИЗВОДНЫЕ ИНДОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2101283C1 |
Авторы
Даты
2007-10-27—Публикация
2002-12-17—Подача