Изобретение относится к новым высокопроизводительным технологиям, позволяющим получать высокоэффективные и безопасные препараты природного происхождения на основе натрия дезоксирибонуклеата.
Изобретение может быть использовано в химико-фармацевтической промышленности и биотехнологии, а получаемый лекарственный препарат иммуномодулятор в медицине, ветеринарии, парфюмерии, косметологии, научно-исследовательской практике и т.д.
Производство лекарственных препаратов должно осуществляться в асептических условиях. Препараты на основе натрия дезоксирибонуклеата в водном растворе солей выпускаются в стерильной форме с использованием консерванта.
Международные правила производства фармацевтических препаратов жестко ограничивают содержание балластных и примесных веществ в них.
Известен ряд способов получения лекарственных препаратов на основе натрия дезоксирибонуклеата. Основным недостатком большинства из них является то, что эти способы не учитывают повышенные современные требования, предъявляемые к фармацевтическим производствам и медицинскому оборудованию, а также повышенные требования по эффективности и безопасности лекарственных препаратов.
Известен способ выделения натриевой соли ДНК (Патент RU № 2017496, 61К 35/60, С07Н 21/04, 1990 г.), сущность которого состоит в увеличении выхода целевого продукта. Однако получаемый продукт содержит высокое содержание белка 1,5%, полисахаридов 2%, РНК 2%. Эти примеси вызывают пирогенные реакции, что несовместимо с главным требованием безопасности применения лекарственных средств. Инъекционная форма препарата из выделяемой натриевой соли ДНК производится не может вследствие высокой пирогенности.
Известен способ получения стерильного раствора нативной натриевой соли дезоксирибонуклеиновой кислоты в растворе натрия хлорида (Патент RU № 2055837,С07Н 21/04, 1996 г.). Данный способ осложнен двукратной ультразвуковой обработкой, однако получаемый продукт характеризуется повышенным содержанием примесей. Конечный продукт содержит высокое количество белков (0,09 г/л) и других балластных веществ, что не допускает его использование для производства лекарственных препаратов. Стерильный раствор по данному патенту не может использоваться для внутривенного введения препарата.
Известны способ производства натриевой соли дезоксирибонуклеиновой кислоты из животного сырья и установка для его осуществления (Патент RU № 2005724, C07Р 21/04, 1993 г.). Однако технология производства продукта по патенту не отвечает всем современным требованиям биотехнологического производства, полученный продукт не может использоваться для препаратов внутривенного введения вследствие высокого содержания белка и полисахаридов, что приводит к высоким пирогенным реакциям в организме.
Наиболее близким к предлагаемому изобретению является способ производства иммунотропного стерильного апирогенного толерантного препарата на основе натриевой соли низкомолекулярной нативной дезоксирибонуклеиновой кислоты (Патент RU № 2236853, С07Н 21/04, 2003 г.). Однако получаемый препарат не может использоваться для внутривенного введения вследствие ряда параметров (степень нативности, допустимые примеси, рН и др.).
Задачей настоящего изобретения является разработка промышленного высокопродуктивного способа производства фармацевтического препарата на основе натриевой соли нативной дезоксирибонуклеиновой кислоты, соответствующего современным повышенным требованиям по терапевтической эффективности и безопасности, предъявляемым к фармацевтическим препаратам, на оборудовании, соответствующем современным требованиям фармацевтических производств: минимальными потерями, оптимальным расходом реагентов, позволяющими снизить экологическую нагрузку производства на окружающую среду, с учетом современных требований к организации соответствующих производств, касающихся защиты продукта от микробной контаминации в ходе процесса. И получением продукта с высокой фармацевтической эффективностью и безопасностью использования при введении в организм пациента.
Поставленная задача достигается следующими новыми техническими решениями.
1. Введение 3-4 стадии гомогенизации при повышенной скорости гомогенизатора (12000 об/мин), что вызывает лизис ядерной массы и практически полное выделение рибонуклеиновой кислоты (РНК).
2. Дополнительное введение расчетного количества ДДЦ в процессе 3-4-кратного центрифугирования гомегената при повышенной скорости вращения центрифуги (3500 об/мин) с созданием воздушно-жирового пенообразования, способствующего полному отделению остаточных жировых масс, полисахаридов и РНК.
3. Ведение ультразвуковой обработки реакционной очищенной массы с параметрами: частотой колебаний 21,7-23 кГц, при изгибающем моменте не менее 9 мкм, при мощности генератора 1,5-2 кВт в установленном временном интервале обеспечивает высокий выход ДНК-Na с заданным диапазоном величины молекулярной массы и степенью нативности свыше 2.
4. Проведение сушки субстанции в интервале температур 40-60°С в расчетном ламинарном потоке стерильного воздуха исключает возникновение бактериальных эндотоксинов и повышает категорию чистоты получаемого продукта.
Технический результат изобретения заключается в создании способа промышленного производства лекарственного препарата из природного сырья, соответствующего современным требованиям фармацевтического производства с повышенной эффективностью производства и высоким выходом высокоэффективного, безопасного лекарственного продукта.
Современные требования, предъявляемые к производству фармацевтических субстанций, диктуют более жесткие условия как к осуществлению технологического процесса (использование инертных материалов оборудования, асептические условия производства, минимизация отходов и т.д.), так и к качеству целевого продукта (высокое содержание основного вещества, минимально допустимые примеси) для использования его в фармацевтической промышленности для производства лекарственных препаратов.
Задачей настоящего изобретения является разработка промышленного высокопродуктивного получения фармацевтического препарата на основе натрия дезоксирибонуклеата, соответствующего современным повышенным требованиям по терапевтической эффективности и безопасности, предъявляемым к фармацевтическим препаратам, на оборудовании, соответствующем современным требованиям фармацевтических производств, с минимальными потерями, оптимальными расходами реагентов, позволяющими снизить экологическую нагрузку от данного производства на окружающую среду, с учетом современных требований к организации соответствующих производств, касающихся защиты продукта от микробной контаминации в ходе ведения процесса.
Способ осуществляют следующим образом: животное сырье (молоки осетровых или лососевых рыб) обезжиривают и в измельченном состоянии гомогенизируют в цитратно-солевом растворе, затем гомогенат центрифугируют в отстойной центрифуге, далее надосадочную жидкость с получаемой воздушно-жировой пеной декантируют и удаляют, полученный субстрат многократно гомогенизируют, обрабатывают гомогенат детергентом и концентрированным раствором натрия хлорида при повышенной температуре; затем реакционную смесь охлаждают до 10-15°С, обрабатывают ультразвуком в ваннах с пьезокерамическими излучателями свыше 80 минут с частотой колебаний 21,7-23 кГц и амплитудой колебаний до 12 мкм, "озвученную" массу смешивают с кизельгуром в соотношении соответственно 10:2-30:2 (мас.), жидкую фазу отделяют фильтрованием, фильтрующий осадок дополнительно промывают пермеатом (со стадии концентрирования), суммарный фильтрат концентрируют баромембранной фильтрацией и концентрат фильтруют через стерилизующий фильтр; натрия дезоксирибонуклеат осаждают из концентрата этиловым спиртом и осадок высушивают в асептических условиях при 40-60°С в течение 4 ч при непрерывной подаче в сушильную камеру расчетного количества стерильного воздуха/азота.
Асептические условия - герметичное помещение с контролируемыми параметрами воздуха: кратность воздухообмена не менее 20, температура 21-24°С, запыленность - не более 350000 частиц/м3 (зона С) и не более 3500 ч/м3 (зона А), содержание микробов не более 100 КОЕ/м3 (зона С) и менее 1 КОЕ/м3 (зона А).
Выход стерильной фармацевтической субстанции натрия дезоксирибонуклеата в виде аморфного белого порошка без запаха, хорошо растворимого в воде по предлагаемому изобретению составляет до 7,5% от загруженного сырья и имеет следующие физико-химические характеристики:
- содержание основного вещества не менее 95-105,5%,
- остаточная влажность 5-5,5%;
- содержание балластных веществ:
белок не более 0,1%,
РНК не более 0,2%,
- полисахариды не более 0,1%;
- гипохромный эффект свыше 40%.
Субстанция используется для производства стерильных растворов 1,5% натрия дезоксирибонуклеата в 0,9-0,95% водном растворе натрия хлорида.
Производство натрия дезоксирибонуклеата в промышленных масштабах реализуется посредством предлагаемой установки, показанной на фиг.1.
Ниже изобретение поясняется на конкретных примерах его выполнения.
Пример 1. 1 кг молок лососевых рыб измельчают на мясорубке, гомогенизируют в 2 литрах цитратно-солевого раствора при 12000 об/мин; далее гомогенат центрифугируют в отстойной центрифуге при 3500 об/мин, надосадочную жидкость декантируют и удаляют, осадок гомогенизируют в 2 литрах цитратно-солевого раствора с последующим центрифугированием и декантацией надосадочной жидкости 3 раза, гомогенат помещают в реактор с подогретым цитратно-солевым раствором (7 литров), добавляют 1,9 кг 3% раствора додецилсульфата натрия в 45% этиловом спирте и выдерживают массу при 60°С в течение 1,5 часов с перемешиванием. Затем добавляют 14.1 кг 5М раствора натрия хлорида и продолжают перемешивание при той же температуре 1,5 часа. После этого реакционную массу охлаждают до температуры 10-15°С. Охлажденную массу (26 кг) обрабатывают ультразвуком в течение 85 мин с амплитудой колебаний 9 мкм. Озвученную массу смешивают с кизельгуром в соотношении 10:2 (мас.), далее отделяют жидкую фазу на нутч-фильтре, осадок промывают пермеатом (10 л) и объединяют с фильтратом. После дополнительной микрофильтрации фильтрат концентрируют (баромембранным методом) на мембране с размером пор 0,04 мкм. Получают 5 кг концентрата, содержащего 2,0 мас.% натриевой соли дезоксирибонуклеата. Целевой продукт осаждают из концентрата этиловым спиртом. Полученный осадок отделяют центрифугированием и сушат при 40°С в течение 4 часов.
Получают 70 г натриевой соли дезоксирибонуклеата, имеющей следующие характеристики: мол. масса 480 кД, содержание белка 0,1%, содержание (РНК + полисахариды) 0,2%, влажность 5%, гиперхромный эффект 44%. Расчетное количество порошка отвешивают в асептических условиях при непрерывной подаче стерильного осушенного воздуха в камеру-сушку, растворяют в 0,9% стерильном растворе натрия хлорида и стерильно разливают в терапевтических дозах.
Аналитический паспорт полученного препарата:
подлинность - соответствует;
цветность - бесцветный;
прозрачность - соответствует;
стерильность - стерилен;
токсичность - нетоксичен;
пирогенность - апирогенен;
степень нативности - 2,4;
содержание натрия дезоксирибонуклеата - 0,016 г/мл;
рН - 8;
содержание натрия хлорида 0,9%;
гиперхромный эффект 44%;
содержание РНК 0,2%;
содержание белка 0,1%.
Пример 2. 1 кг молок осетровых рыб измельчают на мясорубке, гомогенизируют в 2 литрах цитратно-солевого раствора при 12000 об/мин, гомогенат центрифугируют в отстойной центрифуге при 3500 об/мин, надосадочную жидкость декантируют и удаляют, осадок гомогенизируют 4 раза в 2 литрах цитратно-солевого раствора с последующим центрифугированием и декантацией надосадочной жидкости; гомогенат помещают в реактор с подогретым цитратно-солевым раствором (7 литров), добавляют 1,9 кг 6% раствора додецилсульфата натрия в 45% этиловом спирте и выдерживают массу при 60°С в течение 1,5 часов при перемешивании. Затем добавляют 14.1 кг 5М раствора натрия хлорида и продолжают перемешивание при той же температуре 1,5 часа; далее реакционную смесь охлаждают до температуры не выше 15°С, далее в течение 90 мин обрабатывают ультразвуком с амплитудой колебаний 11 мкм. Озвученную массу смешивают с кизельгуром в соотношении 30:2 (мас.), и отделяют жидкую фазу на нутч-фильтре. Осадок на фильтре промывают пермеатом (10 кг), промывную жидкость объединяют с фильтратом.
После дополнительной микрофильтрации фильтрат концентрируют (баромембранным методом) на мембране с размером пор 0,04 мкм. Получают 5 кг концентрата, содержащего 1,8 мас.% натриевой соли дезоксирибонуклеата. Натрия дезоксирибонуклеат выделяют осаждением из концентрата этиловым спиртом. Полученный осадок отделяют центрифугированием и сушат при 60°С, в течение 4 часов.
Получают 66 г натриевой соли дезоксирибонуклеата, имеющей следующие характеристики: мол. масса 500 кД, содержание белка 0,1%, содержание (РНК + полисахариды) 0,2%, влажность 5,5%, гиперхромный эффект 46%. Расчетное количество порошка (для приготовления 1,5% раствора) отвешивают в асептических условиях, растворяют в 0,95% стерильном растворе натрия хлорида и стерильно разливают в терапевтических дозах.
Аналитический паспорт полученного препарата:
подлинность - соответствует;
цветность - бесцветный;
прозрачность - соответствует;
стерильность - стерилен;
токсичность - нетоксичен;
пирогенность - апирогенен;
степень нативности - 2,3;
содержание натрия дезоксирибонуклеата 0,015 г/мл;
рН - 7.9;
содержание натрия хлорида 0,95%;
гиперхромный эффект 46%;
содержание РНК 0,2%;
содержание белка 0,1%.
Таким образом, заявленный способ производства стерильной фармацевтической субстанции натрия дезоксирибонуклеата позволяет получать продукт более высокого качества очистки (снижение содержания балластного белка не более 0,1%, РНК + полисахариды до 0,2%, влага до 5,5%) с улучшенными физико-химическими свойствами (степень нативности, пирогенность, подлинность), снизить потребление дорогостоящих и экологически небезопасных реагентов, увеличить технологичность оборудования и облегчить его обслуживание (ванны с пьезокерамическими излучателями не выделяют токсичные примеси, дольше служат и лучше дезинфицируются), получить продукт, соответствующий современным повышенным требованиям к фармацевтическим субстанциям и препаратам (использование стерилизующего оборудования и помещений с асептическими условиями исключает возможность микробной контаминации готового продукта и увеличивает срок хранения субстанции и срок действия препарата). Предлагаемая установка позволяет осуществить заявленный способ производства апирогенного иммунотропного стерильного препарата для внутривенного введения и для безболезненного внутримышечного введения.
В таблице № 1 представлены характеристики прототипа и препарата по предлагаемому изобретению. Из таблицы следует, что качество препарата по предлагаемому изобретению превосходит прототип.
Полученный иммуномодулятор вследствие высокой чистоты и повышенной нативности характеризуется высокой иммунотропностью и восстанавливает иммунный статус на клеточном и гуморальном уровнях, может использоваться для внутривенного введения пациентам. При внутримышечном введении препарат характеризуется безболезненным введением. Кроме высокой терапевтической активности, препарат характеризуется высокой степенью безопасности и может использоваться в качестве профилактического средства для восстановления иммунного статуса человека. Все существующие субстанции натрия дезоксирибонуклеата не могут быть использованы для создания препарата для внутривенного введения.
В таблице № 2 представлен сравнительный терапевтический эффект Реаферона, Интерлейкина-2 и иммуномодулятора по предлагаемому изобретению.
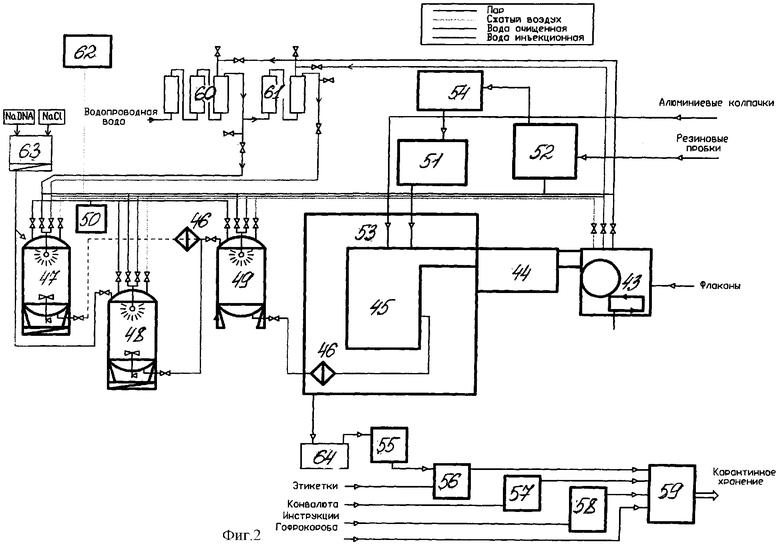
На фиг.1 изображена аппаратурная схема производства субстанции; на фиг.2 - аппаратурная схема производства апирогенного иммуномодулятора.
Установка для производства стерильного апирогенного унифицированного иммуномодулятора - натрия дезоксирибонуклеата из животного сырья включает разделочный стол с весами, мясорубку с электроприводом, микроизмельчитель ткани, отстойную центрифугу, реактор для варки реакционной массы, реактор охлаждения, устройство для ультразвуковой обработки, смеситель для перемешивания реакционной массы с кизельгуром, устройство для отделения жидкой фазы, мембранное устройство для осветляющей микрофильтрации, мембранное устройство для концентрирования жидкой фазы, мембранное устройство для стерилизующей фильтрации, реактор для осаждения целевого продукта этиловым спиртом, оборудование для отделения и высушивания осадка, отстойную центрифугу, воронку Шотта, сушильный шкаф, емкость для 0,9% раствора натрия хлорида, емкости стерильных растворов расчетных концентраций с дозаторами розлива.
Кроме того, установка содержит мерные емкости для отмеривания жидкостей, смесители для приготовления растворов и суспензий при комнатной температуре, реакторы для приготовления растворов и смесей при температуре, отличной от комнатной, и емкости для сбора промежуточных продуктов и отходов производства.
Аппаратурное и технологическое усовершенствование производства натрия дезоксирибонуклеата позволяет повысить объем выпуска технологической линии с проектной мощностью 20 кг/год до 30 кг/год.
Контролируемая молекулярная масса, сохранность вторичной структуры и высокая степень очистки гарантируют высокую биологическую активность, высокую иммунотропность и пролонгированную стабильность лекарственного препарата.
Схема производства иммуномодулятора представлена на фиг.1 и 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОИЗВОДСТВА ИММУНОТРОПНОГО СТЕРИЛЬНОГО АПИРОГЕННОГО ТОЛЕРАНТНОГО ПРЕПАРАТА НА ОСНОВЕ НАТРИЕВОЙ СОЛИ НИЗКОМОЛЕКУЛЯРНОЙ НАТИВНОЙ ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ | 2003 |
|
RU2236853C1 |
| Способ получения лекарственного препарата на основе натрия дезоксирибонуклеата | 2020 |
|
RU2749007C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОВИРУСНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2020 |
|
RU2739186C1 |
| СПОСОБ ПРОИЗВОДСТВА НАТРИЕВОЙ СОЛИ ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ ИЗ ЖИВОТНОГО СЫРЬЯ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1993 |
|
RU2005724C1 |
| ДЕРИНАТ-СУППОЗИТОРИИ ДЛЯ ИСПОЛЬЗОВАНИЯ В МЕДИЦИНСКОЙ ПРАКТИКЕ | 2009 |
|
RU2429854C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОТРОПНОГО ПРОТИВОВИРУСНОГО ПРЕПАРАТА | 2000 |
|
RU2172632C1 |
| СПОСОБ ПРОИЗВОДСТВА СТЕРИЛЬНОЙ ФАРМАЦЕВТИЧЕСКОЙ СУБСТАНЦИИ | 2018 |
|
RU2673802C1 |
| СПОСОБ ВЫДЕЛЕНИЯ НАТРИЕВОЙ СОЛИ ДНК | 1990 |
|
RU2017496C1 |
| ПРОТИВОВИРУСНОЕ ИММУНОТРОПНОЕ СРЕДСТВО | 1999 |
|
RU2158592C1 |
| Натрия дезоксирибонуклеат, таблетки для рассасывания, сублингвальные и способ их получения | 2016 |
|
RU2651043C1 |
Изобретение относится к химико-фармацевтической промышленности и касается способа производства унифицированного апирогенного иммуномодулятора, представляющего собой натриевую соль нативной низкомолекулярной дезоксирибонуклеиновой кислоты, заключающегося в том, что обезжиренные молоки лососевых или осетровых рыб обезжиривают, измельчают и гомогенизируют в цитратно-солевом водном растворе при 12000 об/мин, гомогенат центрифугируют в отстойной центрифуге при 3500 об/мин при охлаждении, надосадочную жидкость удаляют, субстрат повторно 3-4 раза гомогенизируют с добавлением расчетного количества цитратно-солевого раствора с созданием воздушно-жировой пены и декантацией, далее очищенный гомогенат инкубируют в присутствии 3-6% детергента в процессе непрерывного перемешивания при повышенной температуре, в реакционную массу добавляют насыщенный раствор натрия хлорида, реакционную массу охлаждают до температуры ниже комнатной (10°С), обрабатывают ультразвуком в ваннах с пьезокерамическими излучателями с частотой колебаний 21,7-23 кГц и изгибающим моментом не менее 9 мкм при мощности генератора 1,5-2 кВт, далее сорбентом отделяют жидкую фазу, сорбент элюируют пермеатом, элюат, объединенный с жидкой фазой, микрофильтруют, концентрируют, спиртом осаживают осадок натрия дезоксирибонуклеата, центрифугируют, отделяют от жидкой фазы, высушивают при асептических условиях в течение 4-6 часов при температуре 40-60°С, аморфный белый порошок с содержанием основного вещества 95-105,5% с нативностью свыше 2,2 растворяют в 0,9-0,95% водном растворе натрия хлорида в заданных концентрациях и стерильно разливают в терапевтических дозах при рН 8,0 с получением апирогенного иммуномодулятора для внутривенного введения или безболезненного внутримышечного введения. Заявленный способ позволяет получить высокочистый продукт, практически не содержащий посторонних примесей, с высокой степенью нативности и активности. 2 табл., 2 ил.
Способ производства унифицированного апирогенного иммуномодулятора, представляющего собой натриевую соль нативной низкомолекулярной дезоксирибонуклеиновой кислоты, заключающийся в том, что молоки лососевых или осетровых рыб обезжиривают, измельчают и гомогенизируют в цитратно-солевом водном растворе при 12000 об/мин, гомогенат центрифугируют в отстойной центрифуге при 3500 об/мин при охлаждении, надосадочную жидкость удаляют, субстрат повторно 3-4 раза гомогенизируют с добавлением расчетного количества цитратно-солевого раствора созданием воздушно-жировой пены и декантацией, далее очищенный гомогенат инкубируют в присутствии 3-6% детергента в процессе непрерывного перемешивания при повышенной температуре, в реакционную массу добавляют насыщенный раствор натрия хлорида, затем реакционную массу охлаждают до температуры ниже комнатной (10°С), обрабатывают ультразвуком в ваннах с пьезокерамическими излучателями с частотой колебаний 21,7-23 кГц и изгибающим моментом не менее 9 мкм при мощности генератора 1,5-2 кВт, далее сорбентом отделяют жидкую фазу, сорбент элюируют пермеатом, элюат объединенный с жидкой фазой микрофильтруют, концентрируют, спиртом осаждают осадок натрия дезоксирибонуклеата, центрифугируют, отделяют от жидкой фазы, высушивают при асептических условиях в течение 4-6 ч при температуре 40-60°С, аморфный белый порошок с содержанием основного вещества 95-105,5% с нативностью свыше 2,2 растворяют в 0,9-0,95%-ном водном растворе натрия хлорида в заданных концентрациях и стерильно разливают в терапевтических дозах при рН 8,0 с получением апирогенного иммуномодулятора для внутривенного введения или безболезненного внутримышечного введения.
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОТРОПНОГО ПРОТИВОВИРУСНОГО ПРЕПАРАТА | 2000 |
|
RU2172632C1 |
| СПОСОБ ПРОИЗВОДСТВА НАТРИЕВОЙ СОЛИ ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ ИЗ ЖИВОТНОГО СЫРЬЯ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1993 |
|
RU2005724C1 |
| СПОСОБ ПРОИЗВОДСТВА ИММУНОТРОПНОГО СТЕРИЛЬНОГО АПИРОГЕННОГО ТОЛЕРАНТНОГО ПРЕПАРАТА НА ОСНОВЕ НАТРИЕВОЙ СОЛИ НИЗКОМОЛЕКУЛЯРНОЙ НАТИВНОЙ ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ | 2003 |
|
RU2236853C1 |
| СПОСОБ ВЫДЕЛЕНИЯ НАТРИЕВОЙ СОЛИ ДНК | 1990 |
|
RU2017496C1 |
| RU 93018605 A, 27.09.1996. | |||
Авторы
Даты
2007-11-10—Публикация
2006-11-03—Подача