Изобретение относится к медицине, в частности к хирургической гастроэнтерологии, и касается лечения распространенного гнойного перитонита (РГП).
Проблема эффективного лечения распространенного гнойного перитонита (РГП) остается актуальной и в начале XXI века. Только в России ежегодно оперируют более 300000 больных с острыми хирургическими заболеваниями органов брюшной полости. В 15-25% течение ургентных хирургических заболеваний осложняется перитонитом. Развитие теоретической и практической хирургии не привело к радикальному решению проблемы лечения РГП. Летальность при распространенном перитоните, по данным разных авторов, колеблется от 10 до 60%, а при госпитальном перитоните может достигать 90% [4, 7, 9, 15, 21].
Такой широкий диапазон разброса показателей смертности при перитоните можно объяснить, с одной стороны, неодинаковыми методологическими подходами к анализу клинического и секционного материала, с другой - применением различных по эффективности методов лечения перитонита.
Распространенный гнойный перитонит сопровождается выбросом провоспалительных цитокинов, свободных радикалов, снижением эффективности энергопродуцирующих реакций, тяжелыми микроциркуляторными нарушениями. В совокупности эти процессы способствуют формированию синдрома системного воспалительного ответа, который определяет тяжесть экстраабдоминальных осложнений и полиорганной недостаточности [3, 11, 14, 19, 21].
Защитная функция синдрома системной воспалительной реакции трансформируется в патологическую при выбросе в кровоток большого количества провоспалительных медиаторов (интерлейкинов: IL-1, IL-6, IL-8, фактора некроза опухоли (TNF-α) и др.) и острофазовых белков, способных активировать макрофаги, тромбоциты, выброс из эндотелия молекул адгезии и продукцию гормона роста. Развивающаяся острофазовая реакция контролируется эндогенными антагонистами, такими как IL-4, IL-10, IL-13, растворимые рецепторы к TNF и др., получивших название антивоспалительных медиаторов. За счет поддержания баланса между про- и антивоспалительными медиаторами создаются предпосылки для уничтожения патогенных микроорганизмов, поддержания гомеостаза. Однако при выраженном воспалении некоторые цитокины: TNF-α, IL-1, IL-6, IL-10 могут приникать в системную циркуляцию, накапливаться там в количествах, достаточных для реализации повреждающих эффектов. В случае неспособности регулирующих систем к поддержанию гомеостаза деструктивные эффекты цитокинов и других медиаторов начинают доминировать, что приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома диссеминированного внутрисосудистого свертывания, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции [1, 2, 16, 18, 20].
На стадии синдрома ССВР с позиций взаимодействия про- и антивоспалительных медиаторов возможно условное выделение двух периодов. Первый, начальный - период гипервоспаления, характеризующийся выбросом сверхвысоких концентраций провоспалительных цитокинов, окиси азота, что способствует развитию шока и формированию в ранние сроки синдрома полиорганной недостаточности (ПОН). Однако уже в данный момент происходит компенсаторное выделение антивоспалительных цитокинов, скорость их секреции, концентрация в крови и тканях постепенно нарастает с параллельным снижением содержания медиаторов воспаления. Развивается компенса-торный антивоспалительный ответ, сочетающийся снижением функциональной активности иммуннокомпетентных клеток - период «иммунного паралича» [21].
Возникает «порочный круг» - нарастающая эндогенная интоксикация вызывает ряд изменений, ведущих к угнетению иммунной системы, что, в свою очередь, способствует прогрессированию системной воспалительной реакции, нарастанию интоксикации, развитию полиорганной недостаточности. У некоторых больных в силу генетической детерминации или измененной под действием факторов внешней среды реактивности сразу происходит формирование устойчивой антивоспалительной реакции [7, 11, 16, 18].
Ключевым провоспалительным медиатором является фактор некроза опухоли. Важная роль фактора некроза опухоли связана с биологическими эффектами данного медиатора: повышение прокоагулянтных свойств эндотелия, активация адгезии нейтрофилов, индукция других провоспалительных цитокинов, стимуляция катаболизма, лихорадки и синтеза «острофазных» белков. Генерализация повреждающих эффектов опосредована широкой распространенностью рецепторов к TNF и способностью других цитокинов осуществлять его либерацию. С практической точки зрения чрезвычайно важно отметить, что скорость реакций септического каскада при распространенном перитоните резко возрастает в условиях гипоксии из-за экспрессии цитокиновых рецепторов на поверхности клеток [1, 13, 16, 21].
В генезе острой сосудистой недостаточности, лежащей в основе септического шокового синдрома, ведущая роль отводится окиси азота (NO), концентрация которой увеличивается в десятки раз в результате стимуляции макрофагов TNF, IL-1, IFN, а в дальнейшем секреция осуществляется и клетками гладкой мускулатуры сосудов и сами моноциты активируются под действием NO. Кроме того, известно участие нитроксидергической системы в развитии иммунопатологических реакций и синдрома системной воспалительной реакции [6, 8, 10). Поэтому целесообразно исследовать влияния системы оксида азота, цитокинов на апоптоз иммунокомпетентных клеток и разработать методы лечения, позволяющие в известной степени управлять системной воспалительной реакцией, а следовательно, предупреждать развитие полиорганной недостаточности.
При распространенном гнойном перитоните в результате дисфункции печени, почек, кишечника появляются новые факторы повреждающего воздействия. В роли таковых выступают промежуточные и конечные продукты нормального обмена в высоких концентрациях (лактат, мочевина, креатинин, билирубин); накопленные в патологических концентрациях компоненты и эффекторы регуляторных систем (калликреин-кининовой, свертывающей, фибринолитической, перекисного окисления липидов, нейромедиаторов); продукты извращенного обмена (альдегиды, кетоны, высшие спирты), вещества кишечного происхождения типа индола, скатола, путресцина [2, 14, 19].
Традиционно интенсивная терапия гнойного перитонита включает полноценную хирургическую санацию очага инфекции, адекватную антимикробную и дезинтоксикационную терапию. Вместе с тем поддержание жизни больного, предотвращение и устранение органной дисфункции невозможны без проведения целенаправленной иммунокоррекции.
Включение в комплекс интенсивной терапии распространенного гнойного перитонита препаратов, способных регулировать продукцию медиаторов воспаления, позволит управлять системной воспалительной реакцией, а также предупреждать истощение иммунокомпетентных клеток и развитие вторичного иммунодефицита. Учитывая сложность возникающих иммунных нарушений, целесообразным является применять комплексное иммуномодулирующее воздействие, направленное на ослабление иммуносупрессорного влияния группы эндогенных противовоспалительных медиаторов и дозированное увеличение продукции цитокинов с иммуностимулирующей активностью.
Задачей заявленного изобретения является разработка способа иммунокоррекции, способствующего улучшению результатов лечения больных с распространенным гнойным перитонитом путем купирования ССВР и ПОН.
Работа носила клинический характер, была выполнена на кафедре общей хирургии Красноярской государственной медицинской академии, расположенной на базе МУЗ ГКБ №7 г.Красноярска. Всего обследовано 58 больных с различными заболеваниями органов брюшной полости, осложненными распространенным перитонитом. В группу сравнения вошло 28 больных, в исследуемой группе было 30 человек. Группы были сопоставимы по половым, возрастным показателям, тяжести заболевания. Среди обследуемых были лица обоего пола в возрасте от 17 до 68 лет, среди них было 38 мужчин (65,5%) и 20 женщин (34,5%).
Причинами развития перитонита были острый аппендицит, прободная язва желудка и ДПК, острая кишечная непроходимость и деструктивный панкреатит.
Распределение больных в группах по тяжести заболевания отражено в таблице 2.
Все больные были оперированы в течение первых 6 часов с момента поступления в стационар. Объем операции определялся в зависимости от источника перитонита. После устранения источника перитонита оперативным путем всем больным проводили безаппаратную санацию брюшной полости, назоинтестинальную интубацию, дренирование брюшной полости четырьмя и более силиконовыми дренажами.
В группу сравнения вошли больные, получавшие традиционную терапию, как правило, в условиях отделения реанимации. Лечение включало антибиотикотерапию, интенсивную инфузионную терапию, коррекцию гемодинамических, водно-электролитных нарушений, дезинтоксикацию, симптоматическое лечение. В случае необходимости осуществляли инотропную стимуляцию и аппаратную поддержку дыхательной деятельности.
Объем и состав инфузионной терапии зависел от исходного состояния центральной и периферической гемодинамики, степени нарушения водно-электролитного баланса и компенсаторных возможностей миокарда. В среднем при средней степени тяжести объем инфузии составлял 50 мл/кг, при тяжелом состоянии больных достигал 70 мл/кг.
Антибиотикотерапию осуществляли сочетанием цефалоспоринов 3-4 поколений с метронидазолом, фторхинолонов с метронидазолом либо карбапенемами. В общехирургическое отделение больных переводили после стабилизации витальных функций и основных параметров метаболизма.
Для оценки эффективности лечения исследовали изменения показателей иммунного статуса, концентрации цитокинов, уровня оксида азота и активность процессов апоптоза иммунокомпетентных клеток.
У пациентов исследуемой группы в комплекс медикаментозной терапии включали галавит. Препарат вводили внутримышечно. В течение первых суток пребывания больного в стационаре считали целесообразным ежедневное введение препарата по 100 мг. При этом обязательным условием для пациентов являлось введение 200 мг галавита в периоде предоперационной подготовки. Сразу после операции вводили 100 мг препарата. Затем в течение 3-4 суток осуществляли ежедневное введение галавита по 200 мг и далее продолжали по 100 мг в сутки до нормализации температуры тела и числа лейкоцитов периферической крови, после чего продолжали введение препарата по 100 мг один раз в 48 часов в течение двух недель.
Иммуномодулятор «Галавит», выпускаемый ЗАО «ЦСМ «Медикор» (г.Москва), представляет собой 5-амино-1,2,3,4-тетрагидрофталазин-1,4-диона натриевую соль. Галавит регулирует в первую очередь синтез цитокинов макрофагами (ИЛ-1, ФНО и др.) и лимфоцитами (ИЛ-2), а также пролиферативную активность естественных киллеров (NK-клетки) путем обратимого ингибирования синтеза гиперактивированными макрофагами провоспалительных цитокинов на 6-8 часов или стимулирования их при исходной недостаточности. При этом галавит способен восстанавливать угнетенную фагоцитарную функцию макрофагов и нейтрофилов и, следовательно, противоинфекционную защиту. Имеются сообщения также о детоксикационном действии препарата. Галавит стимулирует функциональную активность Т-лимфоцитов, восстанавливает баланс иммунорегуляторных клеток, модулирует иммуноглобулинпродуцирующую способность В-лимфоцитов, стимулирует синтез всеми лейкоцитами интерферонов.
Клинический пример (случай смерти больного с распространенным гнойным перитонитом)
Больной М., 35 лет, поступил в хирургическое отделение городской клинической больницы №7 города Красноярска 15 марта 2004 года. Крепкий мужчина, сотрудник органов внутренних дел. Около 3 дней назад находился в служебной командировке в отдаленном районе Красноярского края. На фоне полного здоровья появились умеренные боли в окружности пупка. Обратиться за медицинской консультацией не было возможности, самостоятельно принимал но-шпу. В течение последующих суток боли усилились, сместились вначале в правую подвздошную область, а затем приняли разлитой характер, поднялась температура до 38°С, появилась тошнота, сухость во рту, слабость. После возвращения в Красноярск сразу обратился в приемный покой дежурной больницы. В приемном покое был осмотрен, установлен диагноз - разлитой перитонит. По экстренным показаниям оперирован. Под комбинированным наркозом выполнен срединный разрез, в брюшной полости до 2 литров гнойного экссудата с неприятным запахом, налеты фибрина на париетальной и висцеральной брюшине, при ревизии обнаружен аппендикс с перфорационным отверстием, из которого в брюшную полость поступал гной. Аппендикс удален. Брюшная полость санирована хлоргексидином до чистых промывных вод, дренирована перчаточными и трубчатыми дренажами через контрапертуры в обеих подвздошных областях и обоих подреберьях. Произведена назоинтенстинальная интубация. Из просвета тонкой кишки удалено до 2 литров застойного содержимого. Брюшная полость ушита через все слои. Принято решение о повторных санациях «по программе». После операции больной находился на лечении в отделении реанимации и интенсивной терапии. Получал инфузионную терапию не менее 2,5-3 литров сутки. Антибиотикотерапию тиенамом в дозировке 2 грамма в сутки, симптоматическое лечение. Через 48 часов после первой операции взят на повторную санационную операцию. На операции хирургом отмечена положительная динамика, брюшная полость санирована, ушита. В течение последующих 5 суток состояние оставалось относительно стабильным. Взята кровь для иммунологического исследования. Анализ иммунограммы показал наличие признаков глубокого иммунодефицита. В анализе крови - высокие концентрации фактора некроза опухоли, интерлейкина 6, снижено содержание интерлейкина 2, существенно повышен уровень оксида азота. На 9 сутки пребывания в стационаре по дренажам из брюшной полости стало поступать отделяемое с неприятным запахом. Взят в операционную, релапаротомия. Обнаружены множественные перфорации терминального отдела подвздошной кишки. Участок кишки с перфорационными отверстиями резецирован, выведена илеостома. В последствии выполнено еще 2 релапаротомии по поводу продолжающегося перитонита, острых перфораций тонкой и толстой кишок. Взят посев крови, диагностирован сепсис. Больной умер на 22 сутки пребывания в стационаре на фоне абдоминального сепсиса и нарастающей полиорганной недостаточности. Посмертный диагноз:
Основной - гангренозный перфоративный аппендицит.
Осложнения - разлитой гнойный перитонит, абдоминальный сепсис, полиорганная недостаточность.
Клинический случай 2 (успешное лечение больного с распространенным гнойным перитонитом)
Больной К., 42 лет, поступил в хирургическое отделение городской клинической больницы №7 города Красноярска 17 июня 2005 года. Крепкий мужчина, без сопутствующих заболеваний, по специальности водитель грузового автомобиля. Около 3 дней назад находился в рейсе. В пути заболел живот в правой подвздошной области, не придал этому особого значения, продолжал поездку. Ночью боли несколько уменьшились. На следующий день боли усилились, приняли разлитой характер, появилось общее недомогание, слабость, поднялась температура тела до 37,5°С. Самостоятельно не смог управлять автомобилем, остаток пути проделал напарник. После возвращения в Красноярск сразу обратился в приемный покой дежурной больницы. В приемном покое был осмотрен, установлен диагноз - разлитой перитонит. Транспортирован в операционную. Во время кратковременной предоперационной подготовки внутримышечно введено 200 мг галавита. Под комбинированным наркозом выполнен срединный разрез, в брюшной полости до 1,5 литров гнойного экссудата с неприятным запахом, налеты фибрина на париетальной и висцеральной брюшине, при ревизии обнаружен аппендикс с перфорационным отверстием. Брюшная полость санирована хлоргексидином до чистых промывных вод, осушена. Аппендикс удален, культя погружена отдельными узловыми швами. Брюшная полость дренирована через контрапертуры в 4 точках. Ушита через все слои. Принято решение о выполнении повторных санаций по программе. После операции введено в мышцу 100 мг галавита. Выведен из операционной в отделение реанимации и интенсивной терапии. Получал инфузионную терапию не менее 2,5-3 литров сутки. Антибиотикотерапию тиенамом в дозировке 2 грамма в сутки, симптоматическое лечение. Ежедневно вводили по 200 мг галавита внутримышечно. Через 48 часов после первой операции взят на повторную санационную операцию. На операции хирургом отмечена положительная динамика - кишечник перистальтировал, уменьшилось количество фибринозных налетов на париетальной и висцеральной брюшине, в брюшной полости незначительное количество светлого экссудата. Брюшная полость санирована, ушита. После повторной операции также находился на лечении в отделении реанимации и интенсивной терапии. На протяжении 4 суток ежедневно вводили в мышцу по 200 мг галавита, затем дозу снизили до 100 мг в сутки, а после нормализации температуры, количества лейкоцитов в периферической крови препарат водили в дозе 100 мг 1 раз в 48 часов на протяжении 2 недель. На 5 сутки наблюдения у больного нормализовалась температура, количество лейкоцитов в периферической крови, показатели иммунограммы, уровень провоспалительных цитокинов и оксида азота. Дополнительных санационных операций не потребовалось. Послеоперационный период протекал гладко. Выведен из отделения реанимации и интенсивной терапии на 7 сутки. Заживление послеоперационных швов первичным натяжением, выписан на 18 сутки с выздоровлением.
Изменения в иммунной системе у больных 1-й группы, получавших традиционную терапию, доказывают неспособность иммунитета противостоять микробной атаке. В условиях напряжения биологических систем адаптации в ответ на воздействие инфекционных агентов синтез цитокинов активируется, что вызывает временное или постоянное нарушение регуляции продукции некоторых цитокинов, в частности IL-2, IL-6 и фактора некроза опухоли (табл.3, 4).
Большинство больных 2-й группы были оперированы в первые 6 часов с момента поступления в стационар. Объем операции определялся в зависимости от источника перитонита.
Длительность проведения иммунной терапии, направленной на коррекцию дефектного звена иммунитета, в каждом конкретном случае определяли индивидуально в зависимости от состояния больных и данных специального иммунологического исследования в динамике. Однако анализ полученных результатов позволил сформулировать общие принципы иммунокоррекции у больных с гнойной инфекцией брюшной полости в предоперационном и в послеоперационном периодах.
Изучение иммунного статуса у пациентов 2-й группы в первые сутки выявило угнетение неспецифического звена иммунитета. Однако уже на 7 сутки наблюдения происходило достоверное повышение содержания фракции CD2+ (66,5±3,2%) по сравнению с исходными показателями. На протяжении всего периода исследования фагоцитарный индекс возрастал, достигая на 14 сутки нормальных значений, тогда как у пациентов 1-й группы в эти сроки показатель оставался пониженным (табл.5).
На 14 сутки лечения у больных 2-й группы восстанавливались значения относительного и абсолютного содержания лимфоцитов крови, фракций CD2+, CD4+ и иммунорегуляторного индекса. Концентрация иммуноглобулинов Ig A, Ig G, Ig M соответствовала норме и достоверно отличалась от первоначальных показателей. Наблюдалось более существенное снижение относительно исходных цифр уровня циркулирующих иммунных комплексов (32,4±3,2 у.е.), в то время как в группе больных, получавших традиционную терапию, происходило достоверное увеличение ЦИК. В пользу эффективности предложенной схемы иммунокорригирующей терапии с применением препарата галавит свидетельствует нормализация уровня АБОК на 14 сутки наблюдения у больных исследуемой группы.
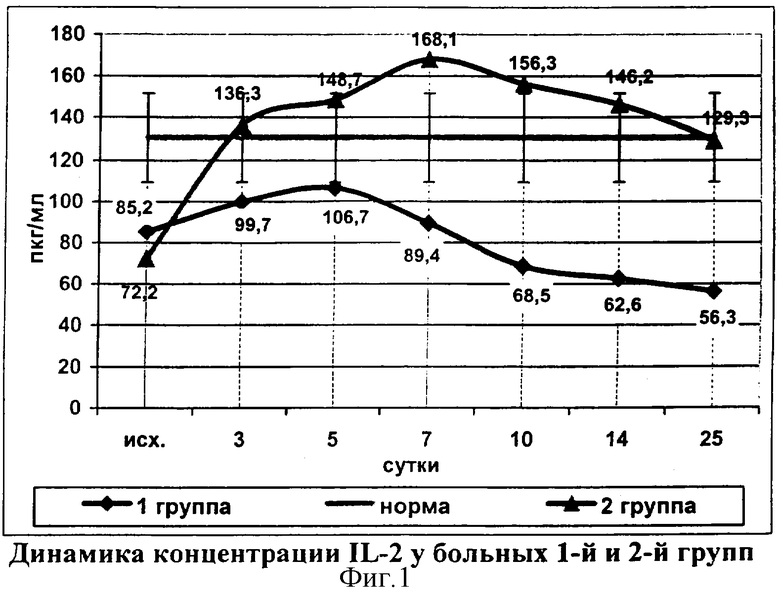
У пациентов 2-й группы на фоне проводимой иммунокорригирующей терапии на 3 сутки наблюдения концентрация IL-2 достигала нормальных цифр (136,3±5,2 пкг/мл). Тенденция к повышению показателя сохранялась на протяжении 7 суток наблюдения, в эти сроки зафиксирована максимальная концентрация IL-2 (168,1±3,1 пкг/мл). Далее происходило умеренное снижение показателя и до конца наблюдения значения указанного цитокина находились в пределах нормы (табл.6).
В группе сравнения нормальные значения уровня IL-2 зафиксированы только на 5 сутки, а к концу наблюдения происходило их снижение до критически низких цифр (фиг.1). Этот факт подтверждает целесообразность раннего применения иммунокорригирующей терапии для лечения больных распространенным гнойным перитонитом.
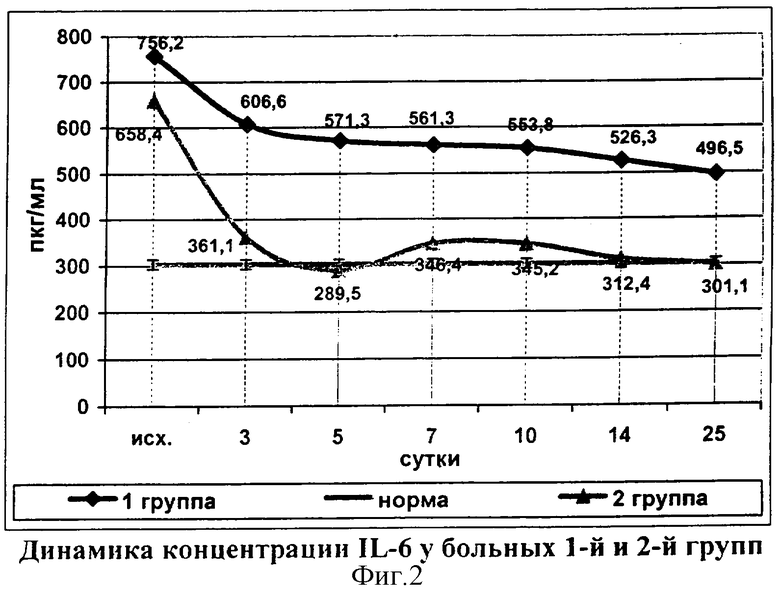
Применения галавита позволило на третьи сутки снизить концентрацию IL-6 в 1,8 раза, а на 5-е сутки данный показатель достигал нормальных значений (289,5±4,2 пкг/мл). Затем, после умеренного увеличения концентрации исследуемого цитокина на 7-е сутки (346,4±6,3 пкг/мл), уровень IL-6 колебался в пределах нормы до конца наблюдения в отличие от 1-й группы, в которой уровень IL-6 был повышенным на протяжении всего периода наблюдения (фиг.2).
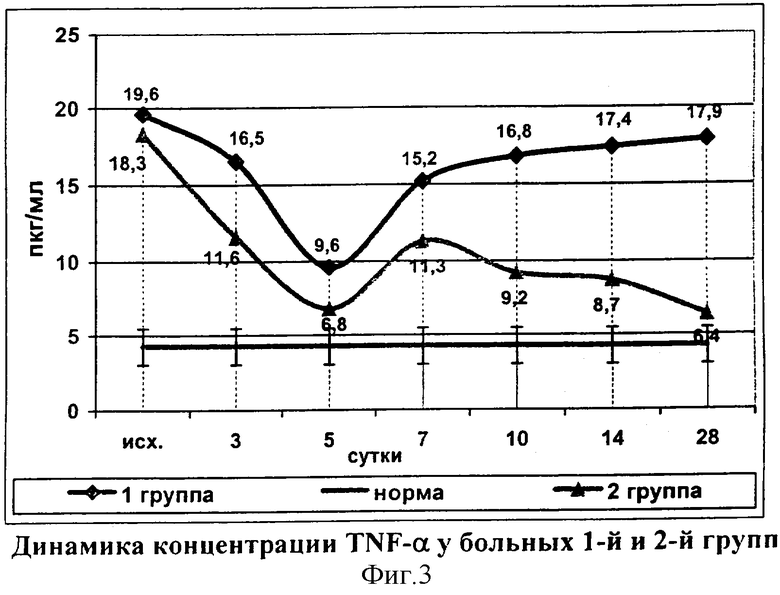
При поступлении концентрация TNF-α у больных 2-й группы, как и в группе сравнения, в несколько раз превышала нормальные значения. Начиная с третьих суток уровень TNF-α у пациентов исследуемой группы был достоверно ниже, чем в группе сравнения, а на 5-е сутки достигал верхней границы нормы (6,8±1,5 пкг/мл). На 7-е сутки концентрация TNF-α вновь возрастала, после чего прослеживалась тенденция к нормализации показателя. В группе сравнения уровень TNF-α в эти сроки возрастал (фиг.3).
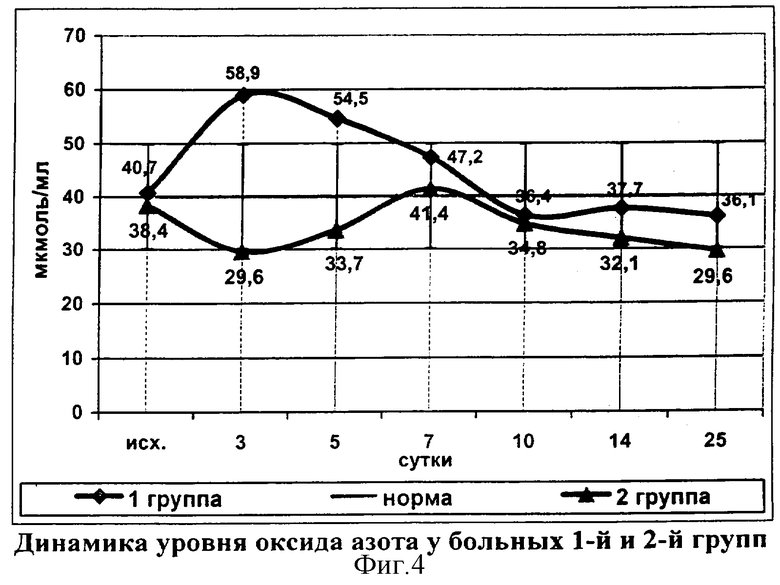
До операции концентрация оксида азота у больных 2-й группы составляла 38,4±1,6 мкмоль/мл и достоверно не отличалась от показателей группы сравнения (фиг.4). На третьи сутки отмечено достоверное снижение показателя до 29,6±1,2 мкмоль/мл в отличие от больных 1-й группы, у которых в этот период наблюдалось значительное увеличение уровня оксида азота. Пик концентрации оксида азота у больных исследуемой группы зафиксирован на 7 сутки (41,4±2,2 мкмоль/мл), после чего было отмечено снижение показателя до нижней нормы.
Обращает внимание существенная разница уровня оксида азота в первые сутки послеоперационного периода между пациентами группы сравнения и исследуемой группы. Установлено, что чрезмерное повышение концентрации оксида азота в первые 2-3 суток заболевания увеличивает риск развития тяжелых системных и местных осложнений.
У больных 2-й группы не происходило критического увеличения концентрации NO на третьи сутки наблюдения. Вероятно, стабилизация концентрации оксида азота на ранней стадии заболевания способствует снижению индукции синтеза провоспалительных цитокинов, предупреждая тем самым, чрезмерный выброс противовоспалительных цитокинов и, следовательно, развитие истощения и декомпенсации иммунной системы организма.
Активация нитроксидергической системы на 7-е сутки является результатом направленного действия провоспалительных цитокинов для обеспечения адекватной антимикробной защиты. Уменьшение же концентрации оксида азота в эти сроки у больных 1-й группы свидетельствует о снижении способности организма противостоять микробной агрессии.
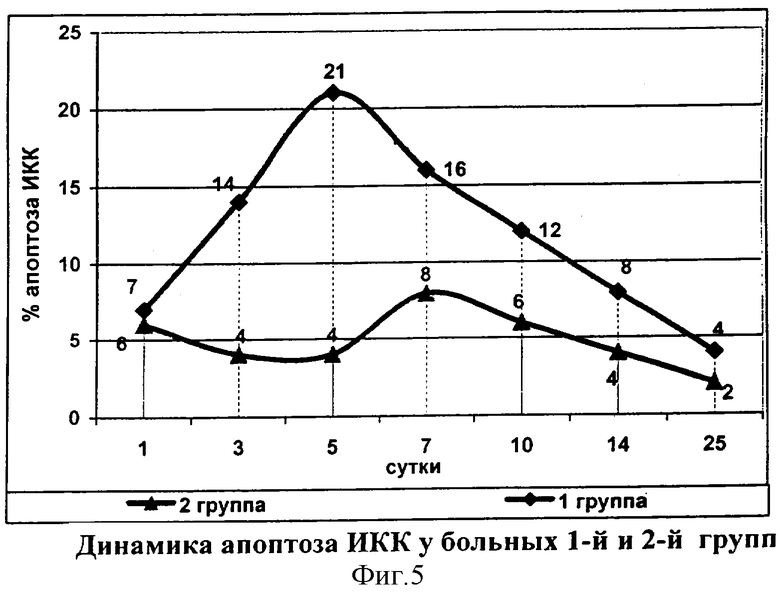
Необходимо отметить, что максимальные значения уровня оксида азота и TNF-α наблюдались в одни и те же сроки, что, вероятно, обусловлено стимулирующим влиянием иммуномоделирующей терапии галавитом на механизмы антимикробной защиты и клеточное звено иммунитета в ответ на микробную атаку. Положительное влияние иммунокорригирующей терапии было зарегистрировано и при исследовании динамики апоптоза иммунокомпетентных клеток периферической крови.
На протяжении первых 5 суток во 2-й группе наблюдался низкий процент апоптоза ИКК, на 7-е сутки происходило его умеренное увеличение (до 8%), после чего показатель достоверно снижался до 5%, в дальнейшем уровень апоптоза ИКК имел тенденцию к снижению, и к концу наблюдения регистрировалась минимальная величина показателя (фиг.5).
Таким образом, результаты применения схемы иммуномодуляции с помощью препарата «Галавит» в комплексном лечении больных с распространенным гнойным перитонитом показали, что препарат обладает направленным иммунорегулирующим воздействием, предотвращает избыточную продукцию медиаторов воспаления в раннем послеоперационном периоде заболевания, способствует устранению цитокинового дисбаланса и предупреждает развитие вторичной иммунной недостаточности.
Сравнительный анализ частоты развития осложнений выявил, что у больных исследуемой группы среднее количество осложнений на пациента составило 0,53, тогда как в группе сравнения данный показатель был равен 1,36. Структура и характер осложнений по группам представлен в таблице 7.
У пациентов 2-й группы потребовалось меньшее количество санаций брюшной полости. В исследуемой группе по одной санации выполнено у 16 больных, дважды она потребовалась в 11 клинических случаях, и двум пациентам выполнено по три санации. В группе сравнения однократное промывание брюшной полости выполнено лишь у одного больного, у 20 и 7 пациентов было выполнено по 2 и 3 санации соответственно. Среднее количество санаций брюшной полости на пациента в 1-й группы составило 2,2, во 2-й группе - 1,46.
Таким образом, в группе больных, получавших иммунокорригирующую терапию с применением галавита, реже развивались системные и местные осложнения, снизилась летальность. Это позволяет сделать вывод о целесообразности включения в комплекс лечебных мероприятий больных распространенным гнойным перитонитом иммунокорригирующей терапии направленного действия. При этом согласно проведенным исследованиям иммунокоррекцию галавитом необходимо начинать с первых суток поступления больного в стационар, причем коррекцию дозировки препарата следует осуществлять основываясь на выявленной динамике уровня провоспалительных цитокинов у этой категории больных.
Таким образом, использование галавита в лечении РГП оказывает стабилизирующее влияние на уровень цитокинов и оксида азота и способствует уменьшению тяжести системной воспалительной реакции в ранние сроки послеоперационного периода больных, оперированных по поводу распространенного гнойного перитонита, способствует предупреждению развития недостаточности как неспецифических, так и специфических механизмов иммунной системы, снижению частоты развития системных и гнойных осложнений перитонита, позволяет уменьшить показатели летальности.
Источники информации
1. Алиев С.А. Некоторые аспекты патогенеза гипоксии и нефармакологические методы ее коррекции при гнойном перитоните / С.А. Алиев, Г.А. Султанов, М.А. Эфендиев // Вестн. интенсивной терапии - 2003. - №2. - с.20-27.
2. Баркаган З.С. Связь эффективности лечения воспалительно-деструктивных заболеваний с деблокадой микроциркуляции в пораженных органах / З.С.Баркаган, Я.Н.Шойхет, М.М.Бобоходжаев // Пробл. гематологии и переливания крови. - 2000, - №2 - с.47-51.
3. Бебуришвили А.Г. Иммунные нарушения и их коррекция при остром панкреатите и гнойном перитоните / А.Г.Бебуришвили, Л.Л.Пугачева, М.П.Козлов // Хирургия. - 1992. - №7-8. - с.114-118.
4. Белокуров Ю.Н. Эндогенная интоксикация при острых хирургических заболеваниях / Ю.Н.Белокуров, В.В.Рыбачков. - Ярославль: ДИА-пресс, 2000. - 284 с.
5. Белушкина Н.Н. Молекулярные основы апоптоза / Н.Н.Белушкина, Х.А Хасан, С.Е.Северин // Вопр. биол. медицины и фармац. химии. - 1998. - №4 - с.15-23.
6. Бондаренко В.М. Антимикробная активность окиси азота и ее роль в инфекционном процессе / В.М.Бондаренко, Н.А Виноградов, В.В.Малеев // Журн. микробиологии. - 1999. - №5 - с.61-67.
7. Васильев И.Т. Механизм развития эндотоксикоза при острых гнойных заболеваниях органов брюшной полости / И.Т.Васильев // Хирургия. - 1995. - №2 - с.54-58.
8. Динамика содержания конечного продукта оксида азота в различных биологических жидкостях при перитоните / П.П.Голиков, Г.В.Пахомова, И.С.Утешев и др. // Вести, интенсивной терапии. - 2000. - №4. - с.31-33.
9. Ерюхин И.А Хирургический сепсис (дискуссионные аспекты проблемы) / И.А.Ерюхин, С.А.Шляпников // Хирургия. - 2000. - №3. - с.44-46.
10. Ивашкин В.Т. Оксид азота в регуляции функциональной активности физиологических систем / В.Т.Ивашкин, О.М.Драпкина // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. - 2000. - №4 - с.16-21.
11. Ю.М.Гаин, С.И.Леонович, Н.В.Завада и др. Иммунный статус при перитоните и пути его патогенетической коррекции. Минск: Юнипресс, 2001. - 255 с.
12. Иммуномодулирующее действие естественного комплекса цитокинов на пролиферацию лимфоцитов и естественных киллеров человека in vitro / К.С.Павлова, А.Л.Шпакова, В.М.Дронова и др. // Иммунология. - 2000. - №2. - с.32-35.
13. К вопросу о взаимодействии иммунной системы и монооксигеназной системы печени / С.В.Сибиряк, И.Л.Красилова, Л.А.Рябчинская и др. // Эксперим. и клинич. фармакология. - 1992. - №4 - с.46-49.
14. Кетлинский С.А. Цитокины мононуклеарных фагоцитов в регуляции реакции воспаления и иммунитета / С.А.Кетлинский, Н.М.Калинина // Иммунология. - 1995. №3, с.30-44.
15. Федоров В.Д., Гостищев В.К., Ермолов АС., Богницкая Т.Н. Современные представления о классификации перитонита и системах оценки тяжести больных // Хирургия. - 2000. - №4 - с.58-62.
16. Bone, R.C. Sepsis, SIRS and CARS / R.C. Bone // Crit. Care Med. - 1996. - V.24. - P.1125-1129.
17. Leithauser, В. Multiple organ failure: hemostasis and mediators in septic patients / B.Leitllauser, F.R.Matthias // Thromb. Haemost. - 1993. - V.69, №6, P.726.
18. Opal, S.M. Anti-inflammatory cytokines / S.M.Opal, V.A DePalo // Chest. - 2000. - V.117, №4 - Р.1162-1172.
19. Pro versus anti inflammatory cytokine pIofile in patients with severe sepsis: a marker for prognosis and future theIapeutic options / C.A Cogos, E.Drosou, H.P.Bassaris, A Skoutelis // J. Infec. Dis. - 2000. - V.181, №1. - P.176-180.
20. Slifka M.K. Clinical implications of dysregulated cytokine production / M.K.Slifka, J.L.Whitton // J. Mol. Med. - 2000. - V.78, №2. - Р.74-80.
21. Van der Poll, T. Bacterial sepsis and septic shock. Cytokines and anticytokines in tile pathogenesis of sepsis / T. van der Poll, S.J.H. van Deventer // Infect. Dis. Clin. N. Am. - 1999. - V.13, №2. - P.413-426.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ДЕСТРУКТИВНОГО ПАНКРЕАТИТА | 2006 |
|
RU2312663C1 |
| СПОСОБ ИММУНОКОРРЕКЦИИ У ДЕТЕЙ С АППЕНДИКУЛЯРНЫМ ПЕРИТОНИТОМ | 2011 |
|
RU2446820C1 |
| СПОСОБ ЛЕЧЕНИЯ ЖЕЛЧНОГО ПЕРИТОНИТА, ОСЛОЖНЕННОГО СИНДРОМОМ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ | 2011 |
|
RU2455034C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННОГО ПЕРИТОНИТА В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2553342C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРИТОНИТА | 2000 |
|
RU2169570C1 |
| СПОСОБ ЛЕЧЕНИЯ АСТЕНИЧЕСКИХ РАССТРОЙСТВ С ИСПОЛЬЗОВАНИЕМ ПРЕПАРАТА "ГАЛАВИТ" | 2005 |
|
RU2319485C2 |
| ЦИТОМЕТРИЧЕСКИЙ СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА РАСПРОСТРАНЕННОГО ГНОЙНОГО ПЕРИТОНИТА | 2018 |
|
RU2691742C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТЬЮ | 2000 |
|
RU2184565C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ АБДОМИНАЛЬНОГО СЕПСИСА У БОЛЬНЫХ С РАСПРОСТРАНЕННЫМ ГНОЙНЫМ ПЕРИТОНИТОМ | 2015 |
|
RU2620560C1 |
| Способ прогнозирования длительности диареи и выбора тактики лечения | 2017 |
|
RU2665945C1 |
Изобретение относится к медицине, в частности к хирургии, и касается лечения распространенного гнойного перитонита. Для этого дополнительно к традиционной интенсивной терапии осуществляют иммунокоррекцию галавитом, вводя его по определенной схеме в пред- и послеоперационный периоды. Способ обеспечивает эффективную иммунокоррекцию путем стабилизации уровня цитокинов и оксида азота, обеспечивая тем самым уменьшение системной воспалительной реакции и предотвращая развитие синдрома полиорганной недостаточности. 7 табл., 5 ил.
Способ лечения распространенного гнойного перитонита, включающий традиционную интенсивную терапию, в том числе хирургическую санацию очага инфекции, отличающийся тем, что терапия дополнительно включает внутримышечное введение галавита, при этом в периоде предоперационной подготовки вводят 200 мг галавита, сразу после операции - 100 мг, затем на протяжении 3-4 суток после операции вводят ежедневно по 200 мг галавита, в последующем продолжают ежедневное введение по 100 мг до нормализации температуры тела и числа лейкоцитов периферической крови, затем галавит вводят по 100 мг один раз в 48 ч на протяжении двух недель.
| Галавит - новое направление в иммунокоррекции | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| СПОСОБ ПОСЛЕОПЕРАЦИОННОЙ ИНТЕНСИВНОЙ ТЕРАПИИ БОЛЬНЫХ С РАСПРОСТРАНЕННЫМ ПЕРИТОНИТОМ | 2003 |
|
RU2228193C1 |
| ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО | 1997 |
|
RU2113222C1 |
| US 2006051744, 09.03.2006, реферат | |||
| Энциклопедия лекарств | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| MATSUKAWA A | |||
| et al | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2007-12-20—Публикация
2006-04-06—Подача