ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым пиридилцианогуанидиновым пролекарствам и их включению в фармацевтические композиции, а также их использованию для производства лекарственных препаратов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Первоначально было открыто, что пиридилцианогуанидины, такие как пинацидил (N-1,2,2-триметилпропил-N'-циано-N''-(4-пиридил)гуанидин), являются веществами, открывающими калиевые каналы, и вследствие этого разрабатывались как антигипертензивные средства. Замена боковой цепи пинацидила более длинными содержащими арил боковыми цепями вызывала потерю антигипертензивного действия, но такие соединения, с другой стороны, как было обнаружено, проявляют противоопухолевое действие при пероральном введении на модели на крысах, имеющих асцитные опухоли Йошида (Yoshida).
Разные группы пиридилцианогуанидинов с антипролиферативной активностью описаны, например, в ЕР 660823, WO 98/54141, WO 98/54143, WO 98/54144, WO 98/54145, WO 00/61559 и WO 00/61561. Взаимосвязь структуры и активности (ВСА, SAR) у таких соединений обсуждается у C. Schou et al., Bioorganic and Medicinal Chemistry Letters 7(24), 1997, p. 3095-3100, которые испытывали антипролиферативное действие ряда пиридилцианогуанидинов in vitro на различных линиях клеток рака легких и молочных желез, а также на нормальных человеческих фибробластах. Соединения испытывали также in vivo на голых мышах, несущих ксенотрансплантаты раковой опухоли легких человека. На основе анализа ВСА было выбрано специфическое соединение (N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидин) по его высокой антипролиферативной активности in vitro и высокой противоопухолевой активности на модели на голых мышах.
P-J. V. Hjarnaa et al., Cancer Res. 59, 1999, pp. 5751-5757, сообщают о результатах дополнительного тестирования соединения N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина в испытаниях in vitro и in vivo. Данное соединение проявляло активность in vitro, которая была сравнима с активностью стандартных цитостатических веществ даунорубицина и паклитаксела, в то же время демонстрируя значительно меньшую антипролиферативную активность на нормальных человеческих эндотелиальных клетках. При испытаниях in vivo с использованием голых мышей, которым подсаживали опухолевые клетки человека, данное соединение проявило существенную противоопухолевую активность также и в отношении опухолевых клеток, которые были устойчивы к общепринятым противораковым лекарственным средствам, таким как паклитаксел.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Хотя, как показано выше, пиридилцианогуанидины являются обещающими противоопухолевыми средствами с чрезвычайно интересными характеристиками активности, они являются высоколипофильными и вследствие этого малорастворимыми соединениями, и как таковых, в основном, возможно только их пероральное введение. Однако многие больные раком находятся в состоянии тяжелого истощения в результате их болезни, дающего увеличение проблем с согласием пациента в отношении перорального приема лекарств.
Поэтому объектом данного изобретения является получение пиридилцианогуанидинов в виде пролекарств с улучшенными характеристиками растворимости, и эти пролекарства могут быть включены в фармацевтические композиции, пригодные для парентерального введения, т.е. жидкие композиции, в которых пролекарство растворено в достаточных количествах, чтобы превращаться в терапевтически эффективные количества активного соединения при введении композиции.
Кроме того, было обнаружено, что пиридилцианогуанидиновые пролекарства проявляют улучшенную всасываемость в желудочно-кишечном тракте при пероральном приеме. Поэтому еще одним объектом данного изобретения является получение пероральных препаратов пиридилцианогуанидинов в качестве пролекарств с улучшенной биодоступностью.
Соответственно, данное изобретение относится к соединению общей формулы I
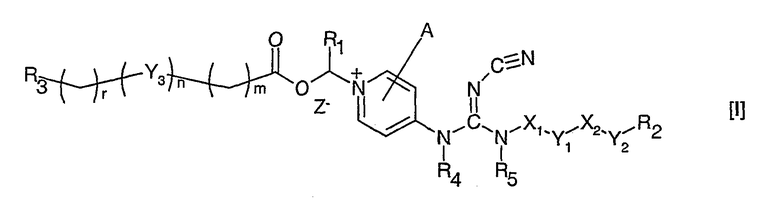
где Х1 и Х2, независимо, представляют связь; линейный, разветвленный и/или циклический углеводородный дирадикал, которые необязательно замещены одним или более гидрокси, галогеном, нитро, амино, циано, аминосульфонилом, алкилсульфониламино, алкилкарбонилом, формилом, аминокарбонилом или алкилкарбониламино; гетероарилен или неароматический гетероциклический углеводородный дирадикал, которые необязательно замещены одним или более линейным, разветвленным или циклическим неароматическим углеводородным радикалом, гидроксилом, галогеном, амино, нитро, циано, аминосульфонилом, алкилсульфониламино, алкилкарбонилом, формилом, аминокарбонилом или алкилкарбониламино;
Y1 и Y2 независимо представляют связь, эфирный дирадикал (R'-О-R''), аминный дирадикал (R'-N-R''), О, S, S(О), S(О)2, С(О), NH-СО, СО-NH, SO2-N(R'), метилен или N(R')-SO2, где R' и R'' независимо представляют углеводородные дирадикалы с прямой или разветвленной цепью, содержащие до 4 атомов углерода;
Y3 представляет О, О-С(О), С(О)-О, N(R8), где R8 является водородом или С1-4алкилом;
R1 представляет водород или линейный, разветвленный и/или циклический алкил, необязательно замещенный фенилом; или ароматический углеводородный радикал;
R2 представляет арил, гетероарил или неароматический гетероциклический углеводородный радикал, которые необязательно замещены; тетрагидропиранилокси, ди-(С1-4-алкокси)фосфиноилокси или С1-4алкоксикарбониламино;
R3 представляет водород; углеводородный радикал с прямой разветвленной или циклической цепью, необязательно замещенный одним или более амино, гидрокси, карбокси, галогеном, нитро, циано, алкокси, аминокарбонилом, С1-4алкоксикарбонилом, С1-4-алкоксикарбониламино, сульфо, гидроксисульфонилокси, дигидроксифосфиноилокси, фосфоно, сульфамино, аминосульфонилом, аминоациламино или диалкоксифосфиноилом; гетероарилом или неароматическим гетероциклическим углеводородным радикалом, которые необязательно замещены одним или более линейным, разветвленным и/или циклическим углеводородным радикалом, амино, гидрокси, карбокси, галогеном, нитро, циано, алкокси, аминокарбонилом, С1-4алкоксикарбонилом, С1-4алкоксикарбониламино, сульфо, гидроксисульфонилокси, дигидроксифосфиноилокси, фосфоно, сульфамино, аминосульфонилом, аминоациламино или диалкоксифосфиноилом;
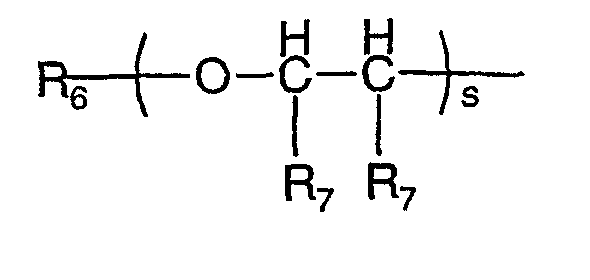
где s является целым числом от 1 до 200; R6 является водородом или необязательно замещенным неароматическим углеводородным радикалом; R7 независимо представляет водород или метил;
R4 и R5, независимо, представляет водород, линейный, разветвленный и/или циклический углеводородный радикал, необязательно замещенный галогеном, гидрокси, амино, нитро или циано.
А представляет водород, необязательно замещеныый линейный, разветвленный и/или циклический углеводородный радикал, гидрокси, галоген, нитро, циано, гетероарил, гетероаралкил или тиол;
m и r независимо являются целыми числами от 0 до 4; и n равно 0 или 1;
Z- является фармацевтически приемлемым анионом, таким как хлорид, бромид, йодид, сульфат, метансульфонат, п-толуол-сульфонат, нитрат или фосфат.
Кроме того, данное изобретение также относится к соединению формулы II, которое является формой свободного основания соединений формулы I, при условии, что R4 является водородом,
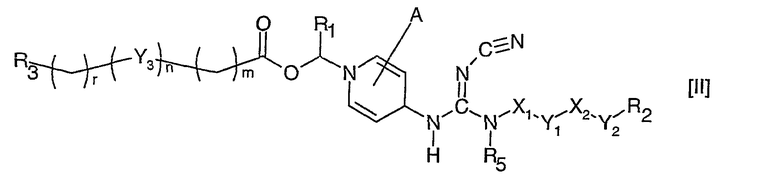
где А, R1, R2, R3, R5, Х1, Х2, Y1, Y2, Y3, m, n и r, имеют значения указанные выше.
Понятно, что соединения данного изобретения включают любые таутомерные формы, оптические изомеры или их диастереомеры. Кроме того, понятно, что данное изобретение включает фармацевтически приемлемые соли соединений формул I и II, включая основные или кислотные группы.
При введении соединения формулы I или формулы II пациенту, группа сложного эфира R3-(СН2)r-(Y3)n-(СН2)m-COOCHR1- ферментативно гидролизуется до свободного активного соединения формулы III
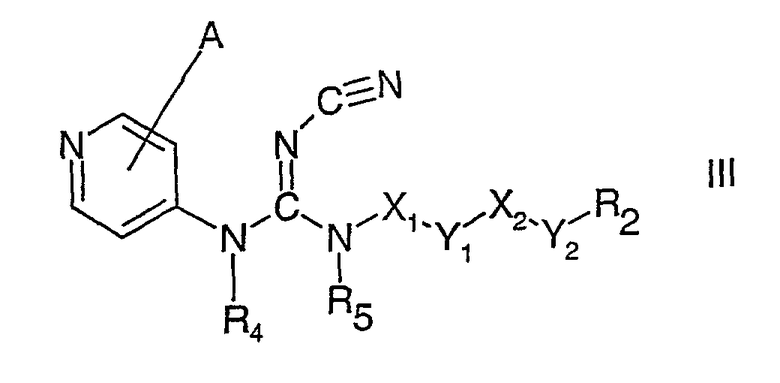
где А, R2, R4, R5, Х1, Х2, Y1 и Y2, как указано выше, вместе с альдегидом R1СНО.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В данном контексте термин «пролекарство» обозначает производное активного соединения, которое как таковое не проявляет физиологической активности активного соединения, но которое может подвергаться ферментативному расщеплению, такому как гидролиз in vivo, таким образом, что освобождается активное соединение при введении пролекарства. В данном конкретном примере пролекарство состоит из активного соединения, которое само по себе является высоко липофильным, снабженного боковой цепью с преимущественно гидрофильными свойствами, что придает свойства улучшенной растворимости пролекарству, делая его тем самым более пригодным для парентерального введения в виде раствора и для перорального введения с получением улучшенной биодоступности. Более конкретно, гидрофильная боковая цепь, выбранная для соединений данного изобретения, состоит из группы сложного эфира R3-(СН2)r-(Y3)n-(СН2)m-COOCHR1- (где R3, R1, Y3, m, n и r, как указано выше).
Термин «алкил» обозначает одновалентный радикал, получаемый от линейного, разветвленного или циклического алкана путем удаления атома водорода у любого атома углерода. Данный термин включает в качестве подгрупп первичный, вторичный и третичный алкил, такой как метил, этил, н-пропил, изопропил, н-бутил, втор.бутил, изобутил, трет.бутил, изопентил, изогексил, циклогексил, циклопентил и циклопропил.
Термин «арил» обозначает радикалы карбоциклических ароматических колец, необязательно, конденсированных би-, три- или тетрациклических колец, где, по меньшей мере, одно кольцо является ароматическим, например, фенильным, нафтильным, инданильным, инденильным, 1,4-дигидронафтильным, флоуренильным или тетралинильным.
Термин «гетероарил» обозначает радикал гетероциклических ароматических колец, в частности, 5- или 6-членных колец с 1-3 гетероатомами, выбранными из О, S и N, или, необязательно, конденсированных бициклических колец, из которых, по меньшей мере, одно является ароматическим, с 1-4 гетероатомами, например, пирролил, фуранил, тиофенил, имидазолил, оксазолил, тиазолил, пиразолил, пиридил, пиримидил, паринил, хинолинил, хроменил или карбазолил.
Термин «аралкил» обозначает ароматическое кольцо с алкильной боковой цепью, например бензил.
Термин «галоген» обозначает фтор, хлор, бром или йод.
Термин «аминосульфонил» обозначает радикал формулы -S(О)2NRа 2, где каждый Rа независимо представляет водород или алкил.
Термин «алкилсульфониламино» обозначает радикал формулы
-NRа 2-S(О)2-Rb, где каждый Rа независимо представляет водород или алкил, Rb представляет алкил.
Термин «алкилкарбонил» обозначает радикал формулы -С(О)Rb, где Rb имеет уже указанное определение.
Термин «амино» обозначает радикал формулы -N(Rа)2, где каждый Rа, независимо, представляет водород или алкил.
Термин «алкилкарбониламино» обозначает радикал формулы
-NRаС(О)Rb, где Rа и Rb как указано выше.
Термин «алкокси» обозначает радикал формулы ORb, где Rb как указано выше.
Термин «алкоксикарбонил» обозначает радикал формулы -С(О)-ORb, где Rb как указано выше.
Термин «аминоациламино» обозначает радикал формулы -NH-С(О)-Rс-NH2, где Rс является дирадикалом, образующийся из любой природной аминокислоты, Н2N-Rс-СООН, или его энантиомеры.
Термин «аминокарбонил» обозначает радикал формулы -С(О)-NRа 2, где Rа, независимо, представляет водород или алкил.
Термин «алкоксикарбониламино» обозначает радикал формулы
-NRа-С(О)-ORb, где Rа и Rb как указано выше.
Термин «углеводород» обозначает соединение, состоящее только из атомов водорода и углерода, он может содержать одну или более двойных или тройных связей углерод-углерод или более, и он может включать циклические группы в сочетании с разветвленными или линейными группами. Термин может быть уточнен как «неароматический гетероциклический», который обозначает насыщенные или частично насыщенные циклические соединения с 1-3 гетероатомами, выбранными из О, S или N, или, необязательно, конденсированные бициклические кольца с 1-4 гетероатомами, такие как пирролидинил, 3-пирролинил, тетрагидрофуранил, тетрагидротиофенил, пиперидинил, пиперазинил.
Термин «фармацевтически приемлемая соль» обозначает соли, полученные реакцией соединения формулы I или II, содержащих основную группу с подходящей неорганической или органической кислотой, например соляной, бромистоводородной, йодистоводородной, серной, азотной, уксусной, фосфорной, молочной, малеиновой, фталевой, лимонной, пропионовой, бензойной, глютаровой, глюконовой, метансульфоновой, салициловой, янтарной, винной, толуолсульфоновой, сульфамовой или фумаровой кислотой. Фармацевтически приемлемые соли соединений формулы II, содержащих кислотную группу, могут быть получены реакцией с подходящим основанием, таким как гидроксид калия, аммония или подобные.
Предпочтительные варианты соединения формулы I или II
В предпочтительном воплощении данного изобретения Х1 и Y1, оба являются связью, тогда как Х2 является линейным, разветвленным или циклическим, насыщенным или ненасыщенным углеводородным дирадикалом с от 4 по 20 атомами углерода; Y2 является О, S, С(О) или метиленом, R2 является необязательно замещенным арилом или гетероарилом, ди-(С1-4-алкокси)фосфиноилокси, С1-4-алкоксикарбониламино или тетрагидропиранилокси; Y3 представляет О или N(R8), где R8 является водородом или С1-4алкилом; R3 является водородом, линейным или разветвленным С1-6алкилом, С3-6-циклоалкилом, С2-6-алкенилом или С2-6алкинилом, которые необязательно замещены амино, карбокси, аминокарбонилом или С1-4-алкоксикарбонилом; необязательно замещенным арилом, аралкилом, гетероарилом или
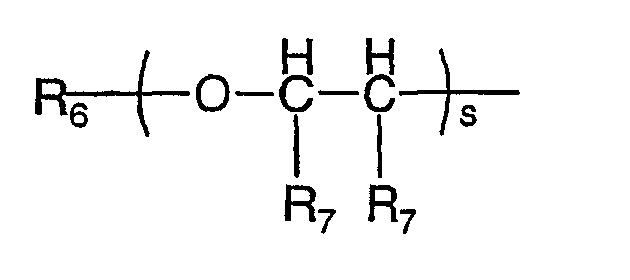
где s является целым числом от 1 до 200;
R6 является водородом или С1-4алкилом;
R7 является водородом или метилом;
R1 является водородом, линейным или разветвленным С1-4-алкилом, аралкилом или арилом;
А, R4 и R5 являются водородом;
m и n, независимо, равны 0 или 1; r равно 0;
и Z- является фармацевтически приемлемым анионом, таким как хлорид, бромид, йодид, сульфат, метансульфонат, п-толуолсульфонат или нитрат.
В другом воплощении соединений формулы I или II, m и n равны 0, и R3 представляет линейный или разветвленный С1-6-алкил, необязательно замещенный амино, гидрокси, карбокси, галогеном, нитро, циано, алкокси, аминокарбонилом, С1-4-алкоксикарбонилом, С1-4-алкоксикарбониламино, сульфо, гидроксисульфонилокси, дигидроксифосфиноилокси, фосфоно, сульфамино, аминосульфонилом, аминоациламином или диалкоксифосфиноилом.
В еще одном воплощении соединения формулы I или II, n равно 1, m равно 0, Y3 представляет NR8, где R8 принимает значения, указанные выше, R3 является водородом; линейный или разветвленный С1-6-алкил, необязательно замещенный амино, гидрокси, карбокси, галогеном, нитро, циано, алкокси, аминокарбонилом, С1-4-алкоксикарбонилом, С1-4алкоксикарбониламино, сульфо, гидроксисульфонилокси, дигидроксифосфиноилокси, фосфоно, сульфамино, аминосульфонилом, аминоациламино или диалкоксифосфиноилом; или R3 и R8 вместе с атомом азота Y3 образуют 5-, 6- или 7-членное кольцо.
В еще одном дополнительном воплощении соединения формулы I или II, n равно 1, m равно 0, Y3 является О, R3 является линейным или разветвленным С1-4алкилом, необязательно замещенным амино, гидрокси, карбокси, галогеном, нитро, циано, алкокси, аминокарбонилом, С1-4алкоксикарбонилом, С1-4алкоксикарбониламино, сульфо, гидроксисульфонилокси, дигидроксифосфиноилокси, фосфоно, сульфамино, аминосульфонилом, аминоациламино или диалкоксифосфиноилом.
В еще одном воплощении соединений формулы I или II, n равно 1, m равно 0 или 1, Y3 является О, R3 представляет R6-(О-СН2-СН2)s, где s является целым числом от 1 до 150, в частности, от 1 до 120, предпочтительно, от 1 до 80, более предпочтительно, от 1 до 50, таким как от 1 до 30, например, от 1 до 20, и R6 является водородом, метилом или этилом. Особенно предпочтительно в данном воплощении является, когда s является целым числом от 2 до 10, таким как 3, 4 или 5, R6 является метилом.
В дополнительном предпочтительном воплощении соединений формулы I или II, n равно 1, m равно 0, Y3 является О, R3 представляет 5-, 6- или 7-членное кольцо неароматический, гетероциклический углеводородный радикал. Особенно предпочтительным в данном воплощении является, когда R3 является пирролидинилом, пиперидилом или гексагидро-1Н-азепинилом.
В предпочтительном воплощении соединений формулы I или II, R2 является необязательно замещенным арилом, в частности фенилом, необязательно замещенным одним заместителем или более, выбранными из группы, состоящей из галогена, трифторметила, гидрокси, С1-4-алкила, С1-4алкокси, С1-4алкоксикарбонила, нитро, циано, амино, аминокарбонила, сульфамоила или С1-4гидроксиалкила. Предпочтительным заместителем является галоген, такой как хлор.
В дополнительном предпочтительном воплощении соединения формулы I или II, Х1 является связью, Х2 является С4-12 углеводородным дирадикалом, или Y1 является связью, Y2 является О.
Примерами конкретных соединений формулы I являются
Общие методы получения
Соединения формулы I могут быть получены реакцией соединения формулы III
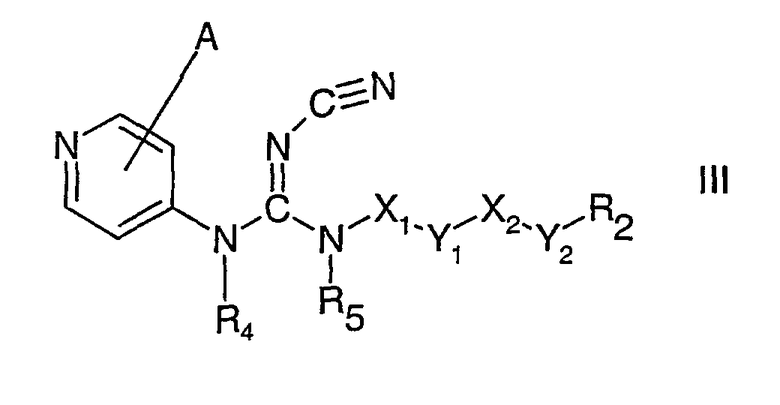
где А, R2, R4, R5, Х1, Х2, Y1 и Y2 принимают значения, указанные выше,
с соединением формулы IV
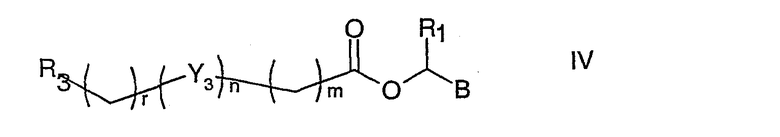
где R1, R3, Y3, m, n и r принимают значения, указанные выше, В является уходящей группой, такой как Cl, Br или I. Кроме того, R3 и Y3 могут, необязательно, содержать защитные группы.
Реакция соединения формулы III с соединением формулы IV может быть проведена в среде без растворителя или в инертном растворителе, таком как ацетонитрил, при температуре от комнатной температуры до 150°С с получением соединения формулы I, необязательно после удаления защитных групп.
Соединения формулы IV известны из литературы или могут быть получены методами, хорошо известными квалифицированным специалистам, например, реакцией галогенангидрида формулы V
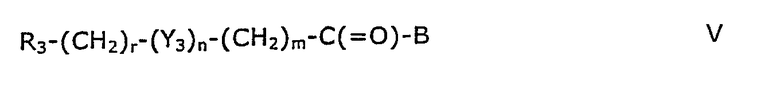
где R3, Y3, В, m, n и r принимают значения, указанные выше для формулы IV, при условии, что m отличен от 0, когда n равно 1, с альдегидом формулы VI
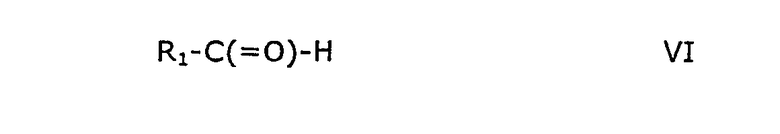
где R1 принимает значения, указанные выше, необязательно в присутствии катализатора, такого как безводный хлорид цинка или безводный хлорид алюминия.
Когда n равен 1, m равен 0, соединения формулы IV могут быть получены реакцией соединения формулы VII

где R3, Y3 и r принимают значения, указанные выше для формулы IV, с соединением формулы VIII
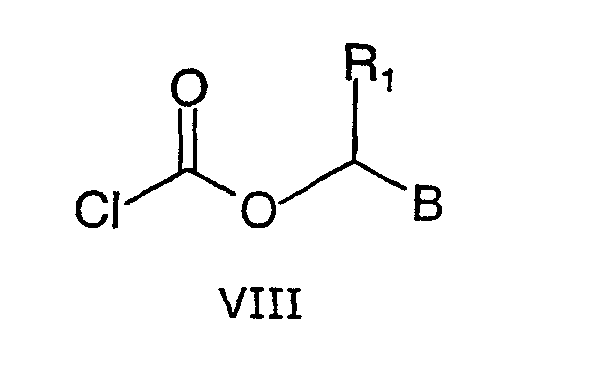
где R1 и В принимают значения, указанные выше.
Реакция соединения формулы VII и соединения формулы VIII может быть приведена при температуре от комнатной температуры до -70°С в инертном органическом растворителе, таком как дихлорметан, в присутствии подходящего основания, такого как пиридин.
В другом методе соединения формулы IV, в которой В является хлором, получают реакцией соединения формулы IX
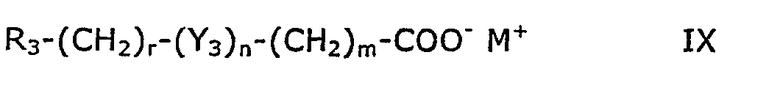
где R3, Y3, m, n и r принимают значения, указанные для формулы V, а М+ является подходящим катионом металла, например катионом щелочного металла, или ионом третичного аммония, с соединением формулы Х
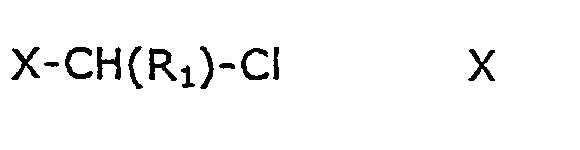
где R1 принимает значения, указанные выше, а Х является йодом, бромом или хлорсульфонилокси.
Реакция между IX и Х может осуществляться в подходящем растворителе, таком как диметилформамид, при подходящей температуре, например при комнатной температуре, когда Х является йодом или бромом. Когда Х представляет собой хлорсульфонилокси, реакция может быть проведена в условиях фазового переноса, как описано в Synthetic Communications 14, 857-864 (1984).
Соединения формулы IV, в которых В является хлором, могут быть превращены в соответствующие соединения, в которых В является йодом, реакцией с йодидом натрия в ацетоне или ацетонитриле.
Соединения формул V, VI, VII, VIII, IX и Х или известны в литературе, или могут быть получены методами, хорошо известными квалифицированным специалистам.
Соединения формулы III известны в литературе и могут быть получены любым из методов, описанных, например, в ЕР 660823, WO 98/54141, WO 98/54143, WO 98/54144, WO 98/54145, WO 00/61559 и WO 00/61561.
Соединение формулы I, при условии, что R4 является водородом, может быть превращено в соответствующее свободное основание формулы II обработкой раствора соединения формулы I в подходящем инертном растворителе, например дихлорметане, подходящим основанием, например водным раствором бикарбоната натрия. Свободное основание формулы II может быть снова превращено в соль формулы I обработкой раствора соединения формулы II в подходящем инертном растворителе, например дихлорметане, соответствующей кислотой формулы ZH, где Z как указано выше.
Фармацевтические композиции
В другом аспекте данное изобретение относится к фармацевтическим композициям соединения формулы I или II, предназначенным для лечения пролиферативных заболеваний. Композиции данного изобретения как для ветеринарии, так и для медицинского применения для людей включают активные ингредиенты в сочетании с фармацевтически приемлемыми носителем(ями) и необязательно другой(ие) терапевтический(ие) ингредиент(ы). Носитель(ли) должны быть «приемлемыми», а именно являться совместимыми с другими ингредиентами композиций и не оказывающими вредного воздействия для принимающего их.
Приемлемо, когда активный ингредиент составляет от 0,1 до 100% по весу от препарата. Удобно, когда дозированная единица композиции содержит количество соединения формулы I или II от 0,07 мг до 1 г.
Термин «дозированная единица» относится к единичной дозе, которая может быть введена пациенту, которую легко обрабатывать и которую легко упаковывать, остающейся в виде физически и химически стабильной дозы, содержащей либо активное вещество как таковое или его смесь с твердыми или жидкими разбавителями или носителями.
Композиции включают, например, те, которые находятся в форме, пригодной для перорального (включая формы с замедленным или отсроченным освобождением), ректального, парентерального (включая подкожный, внутримышечный, внутрисуставной и внутривенный), трансдермального, в глаза, местного, назального и защечного введения.
Композиции могут быть для удобства представлены в виде стандартных лекарственных форм и могут быть получены любым из методов, известных в области фармации, которые, например, описаны в Remington, The Science and Practice of Pharmacy, 20th ed, 2000. Все методы включают стадию приведения активного ингредиента в контакт с носителем, который включает один или более составляющих ингредиентов. В основном, композиции получают однородным и тщательным смешиванием активного ингредиента с жидким носителем или с тонко измельченным твердым носителем или с обоими, и затем, если необходимо, формированием продукта в желаемую препаративную форму.
Композиции данного изобретения, пригодные для перорального введения, могут быть в виде отдельных единиц, таких как капсулы, саше, таблетки или лепешки, каждая из которых содержит предопределенное количество активного ингредиента; в форме порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости, такой как этанол или глицерин; или в виде эмульсии масло-в-воде или эмульсии вода-в-масле. Такие масла могут быть пищевыми маслами, такими как, например, хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические или натуральные смолы, такие как трагакант, альгинат, камедь акации, декстран, натрий-карбоксиметилцеллюлоза, желатин, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбомеры и поливинилпирролидон. Активные ингредиенты могут также вводиться в форме болюса, электуариев или пасты.
Таблетка может быть изготовлена прессованием или формованием активного ингредиента, необязательно с одним или более дополнительным ингредиентом. Прессованные таблетки могут быть получены прессованием в подходящей машине, активного(ых) ингредиента(ов) в свободно текучей форме, такой как порошок или гранулы, необязательно смешанные со связывающим агентом, таким как, например, лактоза, глюкоза, крахмал, желатин, камедь акации, камедь трагаканта, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, воски и подобные; смазывающим агентом, таким как, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия или тому подобное; разрыхляющим веществом, таким как, например, крахмал, метилцеллюлоза, агар, бентонит, натрий-кроскармеллоза, крахмал-гликолят натрия, кросповидон или подобные, или диспергирующим веществом, таким как полисорбат 80. Сплавленные таблетки могут быть изготовлены сплавлением в подходящей машине смеси порошковидного активного ингредиента и подходящего носителя, увлажненных инертным жидким разбавителем.
Композиции для ректального введения могут быть в виде суппозиториев, в которых соединение данного изобретения смешивается с легкоплавкими растворимыми или нерастворимыми в воде твердыми веществами, такими как масло какао, гидрированные растительные масла, полиэтиленгликоли, тогда как эликсиры могут быть изготовлены с использованием миристилпальмитата.
Композиции, пригодные для парентерального введения, обычно включают стерильные масляные или водные составы активных соединений, которые предпочтительно являются изотоничными крови реципиента, например изотонический раствор соли, изотонический раствор глюкозы или буферный раствор. Композиция может быть соответственно стерилизована, например, фильтрованием через задерживающий бактерии фильтр, добавлением к композиции стерилизующего агента, облучением или нагреванием композиции. Липосомные композиции, которые описаны, например, в Encyclopedia of Pharmaceutical Technology, vol.9, 1994, также пригодны для парентерального введения.
Альтернативно, соединение формулы I, могут быть представлены в виде стерильной твердой композиции, например, лиофилизированного порошка, который легко растворяется в стерильном растворителе непосредственно перед использованием.
Трансдермальные композиции могут быть в виде пластыря или накладки.
Композиции, пригодные для введения в глаза могут быть в виде стерильного водного состава активных ингредиентов, которые могут быть в микрокристаллической форме, например в форме водной микрокристаллической суспензии. Липосомные композиции или биоразлагаемые полимерные системы, например те, которые описаны в Encyclopedia of Pharmaceutical Technology, vol.2, 1989, также могут использоваться для формулирования активного ингредиента для введения в глаза.
Композиции, пригодные для местного применения или для введения в глаза, включают жидкие или полужидкие композиции, такие как линименты, лосьоны, гели, примочки, эмульсии масло-в-воде или вода-в-масле, такие как кремы, мази или пасты; или растворы или суспензии, такие как капли.
Композиции, пригодные для назального или защечного введения, включают порошок, композиции с самовыталкиванием или с распылением, такие как аэрозоли или распылители.
В дополнение к вышеназванным ингредиентам, композиции соединения формулы I или II могут включать один или более дополнительных ингредиентов, таких как растворители, буферы, вкусовые и ароматизирующие агенты, красители, поверхностно-активные агенты, загустители, консерванты, например метилгидроксибензоат (включая антиоксиданты), эмульгаторы и подобные.
При системном лечении с использованием суточных доз соединений данного изобретения от 0,01 до 500 мг на килограмм веса тела, предпочтительно, от 0,002 до 100 мг/кг веса тела млекопитающего, например, вводят 0,003-20 мг/кг или 0,003-5 мг/кг соединения формулы I или II, что обычно соответствует суточной дозе для взрослого человека от 0,01 до 37000 мг. Однако данное изобретение также представляет соединения и композиции, предназначенные для введения с более длительными интервалами, например каждую неделю, через каждые три недели или через каждый месяц. При местном лечении дерматологических заболеваний применяются мази, кремы или лосьоны, содержащие от 0,1 до 750 мг/г, предпочтительно от 0,1 до 500 мг/г, например 0,1-200 мг/г соединения формулы I или II. Для местного применения в глазных мазях, каплях или гелях, содержащих от 0,1 до 750 мг/г, предпочтительно от 0,1 до 500 мг/г, например, применяется 0,1-200 мг/г соединения формулы I или II. Пероральные композиции изготавливаются, предпочтительно, в виде таблеток, капсул или капель, содержащих от 0,07 до 1000 мг, предпочтительно от 0,1 до 500 мг, соединения формулы I или II на единичную дозу.
В предпочтительном воплощении данное изобретение представляет фармацевтические композиции, включающие соединение формулы I или II в сочетании с одним или более другими фармакологически активными соединениями, используемыми при лечении пролиферативных заболеваний. Примеры соединений, используемых при лечении пролиферативных заболеваний, которые могут применяться вместе с соединениями данного изобретения, включают S-триазиновые производные, такие как алтретамин; ферменты, такие как аспарагиназа; антибиотические агенты, такие как блеомицин, дактиномицин, даунорубицин, доксорубицин, идарубицин, митомицин, эпирубицин и пликамицин; алкилирующие агенты, такие как бусульфан, карбоплатин, кармустин, хлорамбуцил, цисплатин, циклофосфамид, дакарбазин, ифосфамид, ломустин, мехлоретамин, мелфалан, прокарбазин и тиотепа; антиметаболиты, такие как кладрибин, цитарабин, флоксуридин, флударабин, флуороурацил, гидроксимочевина, меркаптопурин, метотрексат, гемцитабин, пентостатин и тиогуанин; антимитотические средства, такие как этопозид, паклитаксел, тенипозид, винбластин, винорелбин и винкристин; гормональные средства, например ингибиторы ароматазы, такие как аминоглютетимид, кортикостероиды, такие как дексаметазон и преднизон, и релизинг-гормон лютеинизирующего гормона (РГ-ЛГ); антиэстрогены, такие как тамоксифен, форместан и летрозол; антиандрогены, такие как флутамид; модификаторы биологического ответа, например лимфокины, такие как алдеслейкин и другие интерлейкины; интерферон, такой как интерферон-α; факторы роста, такие как эритропоэтин, филграстим и саграмостим; дифференцирующие вещества, такие как производные витамина D и полностью транс- ретиноевая кислота; иммунорегуляторы, такие как левамизол; и моноклональные антитела, фактор некроза опухолей α и ингибиторы ангиогенеза. И наконец, ионизирующая радиация, хотя вероятно не определяемая как вещество, от которой в значительной степени зависит лечение неопластических болезней, может сочетаться с соединениями данного изобретения. Из-за тяжелых побочных эффектов, часто встречающихся у пациентов, получающих антинеопластическую терапию, часто желательно также вводить терапевтические средства, которые сами по себе не являются антинеопластическими, а скорее помогают уменьшить побочные эффекты. Такие соединения включают амифостин, лейковорин и месна.
В частности, антинеопластические соединения, такие как паклитаксел, фторурацил, этопозид, циклофосфамид, цисплатин, карбоплатин, винкристин, гемцитабин, винорелбин, хлорамбуцил, доксорубицин и мелфалан, по-видимому, полезны в комбинированных композициях данного изобретения.
Предполагается, что комбинированная композиция данного изобретения может быть представлена в виде смесей соединений или в виде отдельных соединений, предназначенных для одновременного или последовательного введения. Решение об интервалах между введениями при последовательном режиме введения зависит от опыта квалифицированного специалиста.
В дополнительном аспекте, данное изобретение относится к способу лечения или облегчения пролиферативных заболеваний или патологических состояний, который включает введение пациенту, нуждающемуся в этом, фармацевтической композиции, содержащей соединение формулы I или II, и данное соединение ферментативно гидролизуется после введения с получением соединения формулы III, в количестве, достаточном для осуществления лечения или облегчения указанного пролиферативного заболевания или патологического состояния, необязательно вместе с другим антинеопластическим соединением и/или ионизирующим облучением.
В частности, пролиферативные заболевания или патологические состояния, которые нужно лечить данным способом, включают ряд видов рака и неопластических заболеваний или патологических состояний, включая лейкемию, острую миелоидную лейкемию, хроническую миелоидную лейкемию, хроническую лимфатическую лейкемию, миелодисплазию, множественную миелому, болезнь Ходжкина или лимфому не Ходжкина, мелкоклеточную или немелкоклеточную карциному легких, рак желудка, кишечника или толстого кишечника и прямой кишки, рак простаты, яичников или молочных желез, рак головы, мозга или шеи, рак мочевыводящего тракта, рак почек или мочевого пузыря; злокачественную меланому, рак печени, рак матки или поджелудочной железы.
Данное изобретение относится также к использованию соединений формулы I или II, необязательно вместе с другими антинеопластическими соединениями, как указано выше, для производства лекарственных средств. В частности, указанное лекарственное средство предназначено для использования при лечении пролиферативных заболеваний, например видов рака, которые названы выше.
Как указано выше, предпочтительно вводить соединения данного изобретения парентерально, в такой форме, как жидкость, предпочтительно водная, раствор, предназначенный для внутривенных инъекций или вливаний. Подходящая доза соединения данного изобретения будет зависеть, среди прочего, от возраста и состояния пациента, тяжести заболевания, которое нужно лечить, и других факторов, хорошо известных практикующему врачу. Соединение может вводиться перорально или парентерально в соответствии с разными режимами дозирования, например, с суточными или недельными интервалами. В основном, однократная доза будет находиться в интервале от 0,1 до 400 мг/кг веса тела. Парентерально данное соединение может вводиться в виде болюса (т.е. вся доза вводится сразу) или в виде разделенных доз два или более раз в сутки, или предпочтительно в виде внутривенного вливания.
Данное изобретение описано более детально в следующих примерах, которые никоим образом не предназначены для ограничения объема данного изобретения, который заявлен.
ПРИМЕРЫ
В отношении спектра 1Н ядерного магнитного резонанса (300 МГц) и 13С ЯМР (75,6 МГц) значения химического сдвига приведены по отношению к внутренним тетраметилсилановому (δ=0,00) или хлороформному (δ=7,25) или дейтериохлороформному (δ=76,81 для 13С ЯМР) стандартам. Дано значение мультиплета, любого определенного (синглет (с), дуплет (д), триплет (т), квартет (к)) или нет (широкий (шир)) в примерно среднем положении, если не приведен интервал. Использованные органические растворители были безводными.
Получение 1
Хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат
Хлорметилхлорформиат (2,94 мл) добавляли к ледяному раствору монометилового эфира триэтиленгликоля (4,70 мл) в дихлорметане (30 мл) с последующим добавлением пиридина (2,93 мл) с такой скоростью, что температура поддерживается ниже 10°С. После перемешивания в течение ночи при комнатной температуре реакционную смесь дважды промывали 0,5 М HCl с последующим промыванием водой и водным раствором бикарбоната натрия. Сушка над сульфатом магния, фильтрование, выпаривание в вакууме с последующей дистилляцией в вакууме, Т.кип.: 102-108°С при 0,03 мбар давала соединение, названное в заголовке, в виде бесцветного масла.
1Н ЯМР (CDCl3) δ = 5,73 (с, 2H), 4,37 (м, 2H), 3,75 (м, 2H), 3,70-3,60 (м, 6H), 3,55 (м, 2H), 3,38 (с, 3H)
Получение 2
Хлорметил-2-(2-метоксиэтокси)этилкарбонат
Данное соединение получали по методике, описанной в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля монометиловым эфиром диэтиленгликоля. Бесцветное масло, Т.кип.: 80-82°С при 0,03 мбар.
1Н ЯМР (CDCl3) δ = 5,74 (c, 2H), 4,38 (м, 2H), 3,75 (м, 2H), 3,66 (м, 2H), 3,55 (м, 2H), 3,38 (с, 3H)
Получение 3
Хлорметил-2-метоксиэтилкарбонат
Данное соединение получали, по методике, описанной в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля монометиловым эфиром этиленгликоля. Бесцветное масло, Т.кип.: 36°С при 0,03 мбар.
1Н ЯМР (CDCl3) δ = 5,74 (c, 2H), 4,37 (м, 2Н), 3,64 (м, 2Н), 3,40 (с, 3Н)
Получение 4
1-Хлорэтил-2-(2-метоксиэтокси)этилкарбонат
Данное соединение получали по методике, описанной в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля монометиловым эфиром диэтиленгликоля и хлорметилхлорформиат 1-хлорэтилхлорформиатом. Бесцветное масло, Т.кип.: 82-88°С при 0,03 мбар.
13С ЯМР (CDCl3) δ = 152,9, 84,6, 71,9, 70,6, 68,7, 67,8, 59,1, 25,2
Получение 5
Йодметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат
Хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат (9 г) добавляли к раствору йодида натрия (21,07 г) в ацетоне (45 мл). После перемешивания при 40°С в течение 2,5 часов реакционную смесь охлаждали на льду, фильтровали и выпаривали в вакууме. Остаток собирали в дихлорметан, промывали водным раствором бикарбоната натрия и тиосульфата натрия, сушили над сульфатом магния, фильтровали и выпаривали в вакууме. Очистка на силикагеле с петролейным эфиром/этилацетатом (1:1) в качестве элюента давала соединение, названное в заголовке, в виде светло-желтого масла.
1Н ЯМР (CDCl3) δ = 5,95 (с, 2Н), 4,37 (м, 2Н), 3,74 (м, 2Н), 3,7-3,5 (м, 8Н), 3,38 (с, 3Н)
Получение 6
1-Йодэтил-2-(2-метоксиэтокси)этилкарбонат
Данное соединение получали, как описано в «Получении 5», но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат 1-хлорэтил-2-(2-метоксиэтокси)этилкарбонатом. Полученное масло содержало 35% соединения, названного в заголовке, и 65% исходного материала. Эту смесь использовали на следующей стадии без дополнительной очистки.
Получение 7
Хлорметил-2-(2-(2-метоксиэтокси)этокси)этоксиацетат
Данное соединение получали из 2-(2-(2-метоксиэтокси)этокси)этоксиуксусной кислоты и хлорметилхлорсульфата, как описано в общей методике, представленной в Synthetic Communications 14, 857-864 (1984). Полученное масло очищали дистилляцией под вакуумом, Т.кип.: 130-132°С при 0,06 мбар.
13С ЯМР (CDCl3) δ = 168,8, 72,0, 71,1, 70,7, 70,6, 70,6, 68,6, 68,5, 59,0
Получение 8
Хлорметил-2-(2-(2-(2-метоксиэтокси)этокси)этокси)этилкарбонат
Получали, как описано в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля монометиловым эфиром тетраэтиленгликоля. Желтое масло.
13С ЯМР (CDCl3) δ = 153,4, 72,2, 72,0, 70,7, 70,7, 70,6, 70,5, 68,6, 68,1, 59,0
Получение 9
Йодметил-2-(2-(2-(2-метоксиэтокси)этокси)этокси)этилкарбонат
Получали, как описано в «Получении 5», но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат хлорметил-2-(2-(2-метоксиэтокси)этокси)этокси)этилкарбонатом. Красновато-желтое масло, которое использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (CDCl3) δ = 5,95 (с, 2Н), 4,36 (м, 2Н), 3,74 (м, 2Н), 3,70-3,50 (м, 12Н), 3,38 (с, 3Н)
Получение 10
Хлорметилбензилсукцинат
Получали как описано в «Получении 7», но заменяя 2-(2-(2-метоксиэтокси)этокси)этоксиуксусную кислоту монобензиловым эфиром янтарной кислоты. Полученное масло очищали дистилляцией в вакууме, Т.кип.: 145-151°С при 0,4 мбар.
13С ЯМР (CDCl3) δ = 171,6, 170,4, 135,6, 128,6, 128,4, 128,3, 68,8, 66,7, 29,0, 28,8
Получение 11
Хлорметиловый эфир N-трет-бутоксикарбонил-(L)-валина
Получали, как описано в «Получении 7», но заменяя 2-(2-(2-метоксиэтокси)этокси)этоксиуксусную кислоту N-трет-бутоксикарбонил-(L)-валином. Полученное масло очищали хроматографией на силикагеле.
1Н ЯМР (CDCl3) δ = 5,87 (1H, д), 5,62 (1Н, д), 5,0(1Н, шир.), 4,27 (1Н, м), 2,17 (1Н, м), 1,45(9Н, с), 1,00 (3Н, д), 0,93 (3Н, д)
Получение 12
Хлорметиловый эфир N-трет-бутоксикарбонил-(L)-глицина
Получали, как описано в «Получении 7», но заменяя 2-(2-(2-метоксиэтокси)этокси)этоксиуксусную кислоту N-трет-бутоксикарбонил-(L)-глицином.
1Н ЯМР (CDCl3) δ = 5,75 (2Н, с), 5,05 (1Н, шир.), 3,99 (2Н, д), 1,46 (9Н, с)
Получение 13
Хлорметил-2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этилкарбонат
Получали, как описано в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля монометиловым эфиром пентаэтиленгликоля. Желтое масло.
1Н ЯМР (CDCl3) δ = 5,73 (с, 2Н), 4,37 (м, 2Н), 3,74 (м, 2Н), 3,65 (м, 14Н), 3,55 (м, 2Н), 3,38 (с, 3Н)
Получение 14
Хлорметил-2-(2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этокси)этилкарбонат
Получали, как описано в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля монометиловым эфиром гексаэтиленгликоля. Желтое масло.
1Н ЯМР (CDCl3) δ = 5,74 (с, 2Н), 4,37 (м, 2Н), 3,75(м, 2Н), 3,65 (м, 18Н), 3,53 (м, 2Н), 3,38 (с, 3Н)
Получение 15
Йодметил-2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этилкарбонат
Получали, как описано в «Получении 5», но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат хлорметил-2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этилкарбонатом. Очистка на силикагеле с петролейным эфиром/этилацетатом (1:1) в качестве элюента давала соединение, названное в заголовке в виде светло-желтого масла.
1Н ЯМР (CDCl3) δ = 5,95 (с, 2Н), 4,36 (м, 2Н), 3,74 (м, 2Н), 3,65 (м, 14Н), 3,64 (м, 2Н), 3,38 (с, 3Н)
Получение 16
Йодметил-2-(2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этокси)этилкарбонат
Получали, как описано в «Получении 5», но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат хлорметил-2-(2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этокси)этилкарбонатом. Очистка на силикагеле с петролейным эфиром/этилацетатом (1:1) в качестве элюента давала соединение, названное в заголовке в виде светло-желтого масла.
1Н ЯМР (CDCl3) δ = 5,95 (с, 2Н), 4,36 (м, 2Н), 3,74 (м, 2Н), 3,65 (м, 18Н), 3,55 (м, 2Н), 3,38 (с, 3Н)
Получение 17
Хлорметил-3-(N-трет-бутоксикарбониламино)пропилкарбонат
Получали, как описано в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля 3-(N-трет-бутоксикарбониламино)пропанолом. Бесцветное масло.
1Н ЯМР (CDCl3) δ = 5,73 (с, 2Н), 4,7 (шир., 1Н), 4,29 (т, 2Н), 3,22 (кв, 2Н),1,90 (м, 2Н), 1,44 (с, 9Н)
Получение 18
Йодметил-3-(N-трет-бутоксикарбониламино)пропилкарбонат
Получали, как описано в «Получении 5», но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат 3-(N-трет-бутоксикарбониламино)пропилкарбонатом. Полученное желтое масло очищали хроматографией на силикагеле с петролейным эфиром/этилацетатом (2:1) в качестве элюента. Светло-желтое масло.
1Н ЯМР (CDCl3) δ = 5,95 (с, 2Н), 4,68 (шир., 1Н), 4,29 (т, 2Н), 3,21 (кв, 2Н), 1,89 (м, 2Н), 1,44 (с, 9Н)
Получение 19
Хлорметил-N-(3-(N-трет-бутоксикарбониламино)пропил)карбамат
Раствор хлорметилхлорформиата (2,84 г) в дихлорметане (10 мл) по каплям, при перемешивании добавляли к ледяному раствору 3-(N-трет-бутоксикарбониламино)пропиламина (3,49 г) и диизопропилэтиламина (3,10 г) в дихлорметане (30 мл). После перемешивания в течение еще 3 часов при комнатной температуре смесь экстрагировали ледяной 0,5 М соляной кислотой с последующим экстрагированием водой и водным раствором бикарбоната натрия. Сушка над сульфатом магния и выпаривание в вакууме давали соединение, названное в заголовке в виде бесцветных кристаллов.
1Н ЯМР (CDCl3) δ = 5,75 (с, 2H), 5,74 (шир., 1H), 4,77 (шир., 1H), 3,27 (кв, 2H), 3,19 (кв, 2H), 1,65 (м, 2H), 1,44 (с, 9H)
Получение 20
Йодметил-N-(3-(N-трет-бутоксикарбониламино)пропил)карбамат
Раствор хлорметил-N-(3-трет-бутоксикарбониламино)пропил)карбамата (2 г) и йодида натрия (4,5 г) в ацетонитриле (15 мл) перемешивали в течение 1 часа при комнатной температуре, выпаривали в вакууме, снова растворяли в дихлорметане и фильтровали. Фильтрат выпаривали в вакууме и остаток очищали хроматографией на силикагеле с помощью этилацетата/гексана (1:2) в качестве элюента с получением соединения, названного в заголовке, в виде бесцветных кристаллов.
1Н ЯМР (CDCl3) δ = 5,97 (с,2H), 5,65 (шир., 1H), 4,77 (шир., 1H), 3,26 (кв, 2H), 3,19 (кв, 2H), 1,66 (м, 2H), 1,44 (с, 9H)
Получение 21
Хлорметил-5-(N-трет-бутоксикарбониламино)пентаноат
Данное соединение было получено, как описано в «Получении 7», но заменяя 2-(2-(2-метоксиэтокси)этокси)этоксиуксусную кислоту 5-(N-трет-бутоксикарбониламино)пентановой кислотой. Материал-сырец разделяли между диэтиловым эфиром и водой. Органическую фазу разделяли и сушили над сульфатом магния. Выпаривание в вакууме давало бесцветное масло, которое использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (CDCl3) δ = 5,70 (c, 2H), 4,6 (шир., 1H), 3,13 (кв, 2H), 2,42 (т, 2H), 1,69 (м, 2H), 1,53 (м, 2H), 1,44 (с, 9H)
Получение 22
Йодметил-5-(N-трет-бутоксикарбониламино)пентаноат
Получали, как описано в «Получении 5», но заменяя 2-(2-(2-метоксиэтокси)этокси)этилкарбонат 5-(N-трет-бутоксикарбониламино)пентаноатом. Бесцветное масло, которое кристаллизовалось в морозильнике.
1Н ЯМР (CDCl3) δ = 5,90 (с, 2H), 4,55 (кв, 1H), 3,12 (кв, 2H), 2,36 (т, 2H), 1,66 (м, 2H), 1,52 (м, 2H), 1,44 (с, 9H)
Получение 23
Хлорметил-трет-бутилсукцинат
Получали, как описано в «Получении 7», но заменяя 2-(2-(2-метоксиэтокси)этокси)этоксиуксусную кислоту моно-трет-бутилсукцинатом. Продукт-сырец очищали хроматографией на силикагеле с петролейным эфиром/этилацетатом (9:1) в качестве элюента.
1Н ЯМР (CDCl3) δ = 5,71 (с, 2Н), 2,7-2,5 (м, 4Н), 1,45 (с, 9Н)
Получение 24
Хлорметил-N-(трет-бутоксикарбонилметил)карбамата
Раствор хлорметилхлорформиата (1,69 г) в дихлорметане (5 мл) добавляли по каплям при перемешивании к ледяному раствору трет-бутилглицината гидрохлорида (2,0 г) и диизопропилэтиламина (3,7 г) в дихлорметане (20 мл). После перемешивания в течение еще 2 часов при комнатной температуре смесь экстрагировали ледяным раствором 0,5 М соляной кислоты с последующим экстрагированием водой и водным раствором бикарбоната натрия. Сушка над сульфатом магния и выпаривание в вакууме давали соединение, названное в заголовке в виде бесцветного порошка.
1Н ЯМР (CDCl3) δ = 5,75 (с, 2Н), 5,42 (шир., 1Н), 3,91 (д, 2Н), 1,48 (с, 9Н)
Получение 25
Йодметил-N-(трет-бутоксикарбонилметил)карбамата
Получали, как описано в «Получении 20», но заменяя хлорметил-N-(3-трет-бутоксикарбониламино)пропил)карбамат хлорметил-N-(трет-бутоксикарбонилметил)карбаматом. Светло-желтый порошок.
1Н ЯМР (CDCl3) δ = 5,97 (с, 2Н), 5,34 (шир., 1Н), 3,88 (д,2Н), 1,47 (с,9Н)
Получение 26
Хлорметил-1-(трет-бутоксикарбонил)-4-пиперидилкарбонат
Получали, как описано в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля 1-(трет-бутоксикарбонил)-4-гидроксипиперидином. Светло-красное масло.
1Н ЯМР (CDCl3) δ = 5,73 (с, 2Н), 4,88 (м, 1Н), 3,71 (м, 2Н), 3,26 (м, 2Н), 1,93 (м, 2Н), 1,72 (м, 2Н), 1,46 (с, 9Н)
Получение 27
Йодметил-1-(трет-бутоксикарбонил)-4-пиперидилкарбонат
Получали, как описано в «Получении 5», но заменяя 2-(2-(2-метоксиэтокси)этокси)этилкарбонат 1-(трет-бутоксикарбонил)-4-пиперидилкарбонатом. Полученное масло очищали хроматографией на силикагеле с гексаном/этилацетатом (3:1) в качестве элюента. Желтое масло.
1Н ЯМР (CDCl3) δ = 5,95 (с, 2Н),.4,87 (м, 1Н), 3,71 (м, 2Н), 3,26 (м, 2Н), 1,93 (м, 2Н), 1,71 (м, 2Н), 1,46 (с, 9Н)
Получение 28
Хлорметил-трет-бутоксикарбонилметилкарбонат
Получали, как описано в «Получении 1», но заменяя монометиловый эфир триэтиленгликоля трет-бутилгликолятом. Бесцветное масло.
1Н ЯМР (CDCl3) δ = 5,76 (с, 2Н), 4,58 (с, 2н),1,49 (с, 9Н)
Получение 29
Йодметил-трет-бутоксикарбонилметилкарбонат
Хлорметил-трет-бутоксикарбонилметилкарбонат (6,45 г) добавляли к раствору йодида натрия (16,5 г) в ацетонитриле (65 мл). После перемешивания при 40°С в течение 4 часов реакционную смесь охлаждали на льду, фильтровали и выпаривали в вакууме. Остаток собирали в дихлорметан, промывали водным раствором бикарбоната натрия и тиосульфата натрия, сушили над сульфатом магния, фильтровали и выпаривали в вакууме. Очистка на силикагеле с гексаном/этилацетатом (3:1) в качестве элюента давала соединение, названное в заголовке, в виде бесцветного масла.
1Н ЯМР (CDCl3) δ = 5,98 (с, 2Н), 4,56 (с, 2Н), 1,49 (с, 9Н)
Получение 30
α-Хлорбензил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат
α-Хлорбензилхлорформиат (1 г) добавляли к ледяному раствору монометилового эфира триэтиленгликоля (0,7 мл) в дихлорметане (5 мл) с последующим добавлением пиридина (0,43 мл) с такой скоростью, чтобы температура сохранялась на уровне ниже 10°С. После перемешивания в течение ночи при комнатной температуре реакционную смесь дважды промывали 0,5 М HCl с последующим промыванием водой и водным раствором бикарбоната натрия. Сушка над сульфатом магния, фильтрование, выпаривание в вакууме с последующей хроматографией на силикагеле с гексаном/этилацетатом (1:1) в качестве элюента давали соединение, названное в заголовке, в качестве бесцветного масла.
1Н ЯМР (CDCl3) δ = 7,54 (м, 2Н), 7,41 (м, 3Н), 7,26 (с, 1Н), 4,40 (м, 2Н), 3,76 (м, 2Н), 3,66 (м, 4Н), 3,63 (м, 2Н), 3,53 (м, 2Н), 3,36 (с, 3Н)
Пример 1
1-[2-(2-(2-Метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Смесь N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина (1,13 г) и 2-(2-(2-метоксиэтокси)этокси)этилкарбоната (1,95 г) помещали в предварительно нагретую масляную баню при 100°С. Через 15 минут образовывался прозрачный оранжевый расплав, еще через 45 минут смесь охлаждали до комнатной температуры и добавляли EtOAc (5 мл). Желаемое соединение кристаллизовали и отделяли фильтрованием. Перекристаллизация из изопропанола давала аналитически чистый образец.
13С ЯМР (ДМСО) δ = 157,4, 155,0, 153,0, 144,9, 129,1, 123,9, 116,1, 115,0, 112,8, 80,2, 71,1, 69,6, 69,5, 68,0, 67,7, 67,6, 57,9, 42,2, 28,3, 25,7, 25,0
Пример 2
1-[2-(2-Метоксиэтокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
По методике, описанной в примере 1, но заменяя 2-(2-(2-метоксиэтокси)этокси)этилкарбонат 2-(2-метоксиэтокси)этилкарбонатом, выделяли соединение, названное в заголовке, в виде тонких кристаллов.
13С ЯМР (ДМСО) δ = 157,4, 155,0, 153,0, 144,9, 129,1, 123,9, 116,1, 115,0, 112,7, 80,2, 71,1 69,4, 68,0, 67,7, 67,6, 58,0, 42,2, 28,3, 25,7, 25,0
Пример 3
1-[2-(Метоксиэтокси)карбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
По методике, описанной в примере 1, но заменяя 2-(2-(2-метоксиэтокси)этокси)этилкарбонат 2-метоксиэтоксиэтилкарбонатом, выделяли соединение, названное в заголовке, в виде кристаллического соединения.
13С ЯМР (ДМСО) δ = 157,4, 155,0, 153,0, 144,8, 129,1, 123,9, 116,1, 115,0, 112,8, 80,2, 69,2, 67,8, 67,6, 57,9, 42,1, 28,3, 28,2, 25,7, 25,0
Пример 4
1-[2-(2-(2-Метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат (10 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина (6,4 г) в безводном ацетонитриле (240 мл) с последующим кипячением с обратным холодильником в течение 20 минут. Затем смесь охлаждали до комнатной температуры и растворитель удаляли в вакууме. Кристаллический остаток перемешивали с этилацетатом (100 мл) и выделяли фильтрованием.
13С ЯМР (ДМСО) δ = 10,2 (lH, шир.), 8,9 (lH, шир.), 8,7 (2H,д), 7,5 (2H, шир.), 7,31 (2H, д), 6,94 (2H, д), 6,23 (2H, с), 4,26 (2H, м), 3,96 (2H, т), 3,62 (2H, м), 3,55-3,3 (10H, м), 3,22 (3H, с), 1,71 (2H, м), 1,59 (2H, м), 1,40 (4H, м)
Пример 5
N-[1-(2-(2-(2-Метоксиэтокси)этокси)этоксикарбонилоксиметил]-1,4-дигидропиридин-4-илиден]-N'-циано-N''-(6-(4-хлорфенокси)гексил)гуанидин
Соединение примера 4 растворяли в дихлорметане, промывали избытком водного раствора бикарбоната натрия и тиосульфата натрия, сушили над сульфатом натрия, фильтровали и выпаривали в вакууме с выходом соединения, названного в заголовке, в виде желтого масла.
13С ЯМР (ДМСО) δ = 157,4, 153,3, 129,1, 123,9, 116,1, 79,1, 71,2, 69,6,69,5, 67,8, 67,7, 67,6, 61,6, 57,9, 28,4, 25,9, 25,4, 25,0
Пример 6
1-[2-(2-(2-Метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Продукт примера 5 растворяли в дихлорметане и обрабатывали избытком HCl в эфире. Растворители выпаривали в вакууме и остаток снова растворяли в небольшом объеме дихлорметана. Добавление изопропанола с последующим удалением дихлорметана в вакууме давали кристаллическое соединение, названное в заголовке, идентичное продукту примера 1.
Пример 7
1-[1-(2-(2-Метоксиэтокси)этоксикарбонилокси)этил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Данное соединение получали в соответствии с методиками, описанными в примерах 4, 5 и 6, но заменяя йодметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат смесью 1-йодэтил-2-(2-метоксиэтокси)этилкарбоната и соответствующего хлорэтилового соединения («получение 6»).
13С ЯМР (ДМСО) δ = 11,78 (шир.,1H), 9,03 (шир., lH), 8,88 (д, 2H), 7,66 (шир., 2H), 7,30 (д, 2H), 6,94 (д, 2H), 6,78 (кв, 1H), 4,22 (м, 2H), 3,96 (т, 2H), 3,70-3,40 (м, 8H), 3,22 (с, 3H), 1,83 (д, 3H), 1,71 (м, 2H), 1,59 (м, 2H), 1,50-1,30 (м, 4H)
Пример 8
1-[2-(2-(2-Метоксиэтокси)этокси)этоксиацетоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Данное соединение получали по методике, описанной в примере 1, но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат хлорметил-2-(2-(2-метокси-этокси)этокси)этоксиацетатом. Кристаллическое соединение, названное в заголовке, перекристаллизовывали из изопропанола.
13С ЯМР (ДМСО) δ = 169,5, 157,4, 154,8, 144,9, 129,1, 123,9, 116,1, 115,0, 113,0, 77,6, 71,2, 70,1, 69,6, 69,6, 69,5, 67,6, 67,2, 57,9, 42,2, 28,3, 28,2, 25,7, 25,0
Пример 9
1-[2-(2-(2-(2-Метоксиэтокси)этокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Соединение, названное в заголовке, получали, как описано в примере 4, 5 и 6, но заменяя йодметил-2-(2-(2-метоксиэтокси)-этокси)этилкарбонат в примере 4 йодметил-2-(2-(2-(2-метокси-этокси)этокси)этокси)этилкарбонатом. Кристаллическое соединение (из изопропанола).
13С ЯМР (ДМСО) δ = 157,4, 155,0, 153,0, 144,8, 129,1, 123,9, 116,1, 80,2, 71,2, 69,7, 69,7, 69,6, 69,6, 69,5, 68,1, 67,7, 67,6, 57,9, 28,3, 25,7, 25,0
Пример 10
1-Пивалоилоксиметил-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Смесь N-(6-(4-хлорфенокси)-гексил)-N'-циано-N''-(4-пиридил)гуанидина (0,5 г) и хлорметилпивалата (1 мл) помещали в предварительно нагретую масляную баню при 100°С. Через 10 минут образовывался прозрачный желтый раствор с последующей спонтанной кристаллизацией несколько минут позднее. Еще через 15 минут при 100°С смесь охлаждали до комнатной температуры и обрабатывали EtOAc. Кристаллический продукт выделяли фильтрованием и перекристаллизовывали из изопропанола.
13С ЯМР (ДМСО) δ = 176,5, 157,4, 154,8, 144,5, 129,1, 123,9, 116,1, 115,0, 77,8, 67,6, 38,2, 28,3, 26,3, 25,7, 25,0
Пример 11
1-Ацетоксиметил-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Соединение, названное в заголовке, получали, как описано в примере 10, но заменяя хлорметилпивалат хлорметилацетатом. Продукт-сырец очищали хроматографией на сефадекс LH-20 с дихлорметаном/гексаном/метанолом (75:15:10) в качестве элюента с последующей кристаллизацией из изопропанола.
13С ЯМР (ДМСО) δ = 169,6, 157,4, 154,8, 144,7, 129,1, 123,9, 116,1, 115,1, 112,8, 77,6, 67,6, 42,1, 28,4, 28,2, 25,7, 25,0, 20,3
Пример 12
1-(L)-Валилоксиметил-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид, гидрохлорид
Смесь N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)-N-гуанидина (1,0 г) и хлорметилового эфира N-трет-бутоксикарбонил-(L)-валина (3,4 г) помещали в предварительно нагретую масляную баню при 90°С на 70 минут. После охлаждения до комнатной температуры реакционную смесь растирали с эфиром, чтобы удалить непрореагировавший хлорметиловый эфир. Оставшееся масло собирали в дихлорметан и экстрагировали избытком водного раствора бикарбоната натрия. Органическую фазу сушили и выпаривали в вакууме с получением масла, которое очищали хроматографией на силикагеле. Желаемое промежуточное соединение растворяли в дихлорметане и приводили во взаимодействие с избытком хлористого водорода в эфире при комнатной температуре в течение 75 минут. Кристаллический продукт выделяли фильтрованием, промывали эфиром и сушили в вакууме. Перекристаллизация из метанола/эфира давала аналитически чистое соединение.
1Н ЯМР (D2О) δ = 8,84 (2H, д), 7,7 (2H, шир.), 7,41 (2H, д), 7,05 (2H, д), 6,55 (2H, дд), 4,34 (lH, д), 4,15 (2H, т), 3,62 (2H, т), 2,53 (lH, м), 2,0-1,7 (4H, м), 1,65-1,45 (4H, м), 1,13 (6H, т)
Пример 13
1-Глицилоксиметил-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид, гидрохлорид
Соединение, названное в заголовке, получали, как описано в примере 12, но заменяя хлорметиловый эфир N-трет-бутоксикарбонил-(L)-валина хлорметиловым эфиром N-трет-бутоксикарбонилглицина. Соединение, названное в заголовке, выделяли в виде аморфного порошка.
13С ЯМР (ДМСО) δ = 166,9, 157,4, 145,0, 129,1, 123,9, 116,1, 78,1, 67,6, 28,3, 25,7, 25,0
Пример 14
1-[Монобензилсукцинилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Данное соединение получали, как описано в примере 1, но заменяя хлорметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат хлорметилбензилсукцинатом. Соединение, названное в заголовке, выделяли в виде вещества с тонкими кристаллами.
13С ЯМР (ДМСО) δ = 171,5, 171,3, 157,4, 154,7, 144,7, 135,9, 129,1, 128,3, 127,9, 127,8, 123,9, 116,1, 114,8, 77,6, 67,6, 65,6, 28,3, 28,2, 25,7, 25,0
Пример 15
1-[2-(2-(2-(2-(2-Метоксиэтокси)этокси)этокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Соединение, названное в заголовке, получали, как описано в примере 4, 5 и 6, но заменяя йодметил-2-(2-(2-метоксиэтокси)-этокси)этилкарбонат в примере 4 йодметил-2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этилкарбонатом.
Кристаллическое соединение (из изопропанола).
13С ЯМР (ДМСО) δ = 8,9 (шир., 1H), 8,7 (шир., 2H), 7,5 (шир., 2H), 7,30 (д, 2H), 6,94 (д, 2H), 6,20 (с, 2H), 4,25 (м, 2H), 3,95 (т, 2H), 3,62 (м, 2H), 3,50 (с, 16H), 3,43 (м, 2H), 3,23 (с, 3H), 1,71 (м, 2H), 1,58 (м, 2H), 1,40 (м, 4H)
Пример 16
1-[2-(2-(2-(2-(2-(2-Метоксиэтокси)этокси)этокси)этокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Соединение, названное в заголовке, получали, как описано в примере 4, 5 и 6, но заменяя йодметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат в примере 4 йодметил-2-(2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этокси)этилкарбонатом.
Кристаллическое соединение (из изопропанола).
13С ЯМР (ДМСО) δ = 11,8 (шир., 1H), 9,0 (шир., 1H), 8,7 (шир., 2H), 7,5 (шир., 2H), 7,30 (д, 2H), 6,94 (д, 2H), 6,21 (с, 2H), 4,25 (м, 2H), 3,95 (т, 2H), 3,62 (м, 2H), 3,49 (с, 20H), 3,42 (м, 2H), 3,23 (с, 3H), 1,71 (м, 2H), 1,58 (м, 2H), 1,40 (м, 4H)
Пример 17
1-[2-(2-(2-Метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(9-(диэтоксифосфиноилокси)нонил)-N-гуанидино]пиридиния хлорид
Йодметил-2-(2-(2-метоксиэтокси)этокси)этилкарбонат (3,2 г) добавляли к горячему раствору N-(9-(диэтоксифосфиноилокси)нонил)-N'-циано-N''-(4-пиридил)гуанидина (2,5 г) в безводном ацетонитриле (85 мл) с последующим кипячением с обратным холодильником в течение 20 минут. Смесь затем охлаждали до комнатной температуры и растворитель удаляли в вакууме. Полученное масло собирали в дихлорметан, промывали водным раствором бикарбоната натрия и тиосульфатом натрия, сушили над сульфатом магния, фильтровали и выпаривали в вакууме с получением масла, которое растворяли в этилацетате. Добавляли воду и значение рН снижали до 2 добавлением водного раствора соляной кислоты к перемешиваемой смеси. Водную фазу отделяли и лиофилизировали. После добавления этилацетата выделялось кристаллическое вещество, названное в заголовке.
13С ЯМР (ДМСО) δ = 155,2, 154,8, 153,0, 144,5, 115,3, 112,6, 80,1, 71,2, 69,6, 69,5, 68,0, 67,7, 66,8, 63,0, 57,9, 42,1, 29,6, 28,7, 28,4, 28,3, 26,0, 24,8, 15,9
Пример 18
1-[2-(2-(2-Метоксиэтокси)этокси)этокси)карбонилоксиметил]-4-[N'-циано-N''-(12-(трет-бутилоксикарбониламино)додецил)-N-гуанидино]пиридиния йодид
Соединение, названное в заголовке, получали, как описано в примере 4, но заменяя N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидин N-(12-(трет-бутилоксикарбониламино)додецил)-N'-циано-N''-(4-пиридил)гуанидином.
1С ЯМР (ДМСО) δ = 11,2 (шир., 1H), 8,88 (шир., 1H), 8,71 (д, 2H), 7,48 (шир.,2H), 6,72 (т, 1H), 6,22 (с, 2H), 4,26 (м, 2H), 3,63 (м, 2H), 3,6 - 3,3 (м, 8H), 3,21 (с, 3H), 2,87 (кв, 2H), 1,55 (т, 2H), 1,37 (с, 9H), 1,4-1,15 (м, 20H)
Пример 19
1-[2-(2-(2-Метоксиэтокси)этокси)этокси)карбонил-оксиметил]-4-[N'-циано-N''-(12-(трет-бутилоксикарбониламино)додецил)-N-гуанидино]пиридиния хлорид
Соединение из примера 18 суспендировали в этилацетате и промывали водным раствором бикарбоната натрия и тиосульфата натрия с последующим промыванием водой. Органическую фазу отделяли, добавляли воду и при перемешивании добавляли водный раствор соляной кислоты до рН 2,2. Водную фазу отделяли и лиофилизировали с получением остатка, из которого выделяли кристаллическую форму после добавления этилацетата.
13С ЯМР (ДМСО) δ = 155,6, 155,2, 153,1, 144,9, 115,1, 112,8, 80,3, 77,3, 71,3, 69,7, 69,6, 68,1, 67,8, 58,0, 42,4, 29,5, 29,0, 28,7, 28,6, 28,3, 26,3, 26,1
Пример 20
1-[2-(2-(2-(2-Метоксиэтокси)этокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N''-(12-(трет-бутилоксикарбониламино)додецил)-N-гуанидино]пиридиния хлорид
Получали, как описано в примере 9, но заменяя N-(6-(4-хлорфенокси)-гексил)-N'-циано-N''-(4-пиридил)гуанидин N-(12-(трет-бутилоксикарбониламино)додецил)-N'-циано-N''-(4-пиридил)гуанидином.
Пример 21
1-[3-(N-трет-бутоксикарбониламино)пропилоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-3-(N-трет-бутоксикарбониламино)пропилкарбонат (2,5 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил-N'-циано-N''-(4-пиридил)гуанидина (1,7 г) в безводном ацетонитриле (90 мл) с последующим кипячением с обратным холодильником в течение 20 минут. Соединение, названное в заголовке, кристаллизовалось при охлаждении до комнатной температуры, и его выделяли фильтрованием.
1Н ЯМР (ДМСО) δ = 11,2 (шир., 1H), 8,9 (шир., 1H), 8,72 (д, 2H), 7,5 (шир., 2H), 7,30 (д, 2H), 6,94 (д, 2H), 6,85 (т, 1H), 6,21 (с, 2H), 4,14 (т, 2H), 3,96 (т, 2H), 3,33 (кв, 2H), 2,97 (кв, 2H), 1,75-1,35 (м, 10H), 1,36 (с, 9H)
Пример 22
1-[3-Аминопропилоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид, гидрохлорид
Суспензию 1-[3-(N-трет-бутоксикарбониламино)пропилоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодида (2,2 г) встряхивали с избытком бикарбоната натрия. Органическую фазу сушили над сульфатом магния и фильтровали. Прозрачный фильтрат охлаждали во льду при перемешивании и приводили во взаимодействие с избытком хлористого водорода в эфире. Ледяную баню удаляли и после перемешивания в течение 45 минут растворитель удаляли в вакууме. Добавляли этилацетат и кристаллический материал отделяли фильтрованием. Перекристаллизация из этанола давала аналитически чистое соединение, названное в заголовке.
13С ЯМР (ДМСО) δ = 157,4, 155,0, 152,8, 144,8, 129,1, 123,9, 116,1, 115,1 112,8, 80,2, 67,6, 66,0, 35,6 28,3, 25,9, 25,7, 25,0
Пример 23
1-[3-(N-трет-бутоксикарбониламино)пропилкарбамоилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-N-(3-(N-трет-бутоксикарбониламино)пропил)карбамат (0,5 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил-N'-циано-N''-(4-пиридил)гуанидина (0,35 г) в безводном ацетонитриле (15 мл) с последующим кипячением с обратным холодильником в течение 20 минут. После охлаждения до комнатной температуры и выпаривания в вакууме соединение, названное в заголовке, кристаллизовалось из этилацетата, и его выделяли фильтрованием.
1Н ЯМР (ДМСО) δ = 11,2 (шир., 1H), 8,9 (шир., 1H), 8,68 (д, 2H), 7,73 (т, 1H), 7,5 (шир., 2H), 7,31 (д, 2H), 6,94 (д, 2H), 6,75 (т, 1H), 6,12 (с,2H), 3,95 (т, 2H), 3,30 (кв, 2H), 2,99 (кв, 2H), 2,89 (кв, 2H), 1,73-1,35 (м, 10H), 1,36 (с, 9H)
Пример 24
1-[3-Аминопропилкарбамоилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид, гидрохлорид
Данное соединение получали, как описано в примере 22, но заменяя 1-[3-(N-трет-бутоксикарбониламино)пропилоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид 1-[3-(N-трет-бутоксикарбониламино)пропилкарбамоилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодидом. Выделяли в виде светло-желтого порошка после кристаллизации из изопропанола и перекристаллизации из метанола/эфира.
1Н ЯМР (ДМСО) δ = 11,9 (шир., 1H), 9,1 (шир., 1H), 8,71 (д, 2H), 8,03 (шир., 3H), 7,96 (т, 1H), 7,60 (шир., 2H), 7,30 (д, 2H), 6,95 (д, 2H), 6,13 (с, 2H), 3,95 (т, 2H), 3,36 (кв, 2H), 3,06 (кв, 2H), 2,75 (м, 2H), 1,69 (м, 4H), 1,58 (м, 2H), 1,40 (м, 4H)
Пример 25
1-[5-(N-трет-бутоксикарбониламино)пентаноилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-5-(N-трет-бутоксикарбониламино)пентаноат (1,5 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил-N'-циано-N''-(4-пиридил)гуанидина (1,04 г) в безводном ацетонитриле (45 мл) с последующим кипячением с обратным холодильником в течение 20 минут. После охлаждения до комнатной температуры и выпаривания в вакууме соединение, названное в заголовке, кристаллизовалось из этилацетата, и его выделяли фильтрованием в виде светло-желтого порошка.
1Н ЯМР (ДМСО) δ = 11,2 (шир., 1H), 8,9 (шир., 1H), 8,88 (д, 2H), 7,48 (шир., 2H), 7,30 (д, 2H), 6,95 (д, 2H), 6,76 (т, 1H), 6,18 (с, 2H), 3,95 (т, 2H), 3,30 (кв, 2H), 2,88 (кв, 2H), 2,41 (т, 2H), 1.75-1,35 (м, 12H), 1,36 (с, 9H)
Пример 26
1-[3-Аминопентаноилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид, гидрохлорид
Данное соединение получали, как описано в примере 22, но заменяя 1-[3-(N-трет-бутоксикарбониламино)пропилоксикарбонил-оксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид 1-[5-(N-трет-бутоксикарбониламино)пентаноилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодидом. Выделяли в виде бесцветного порошка из этилацетата.
1Н ЯМР (ДМСО) δ = 12,0 (шир., 1H), 9,2 (шир., 1H), 8,78 (д, 2H), 8,07 (шир., 3H), 7,65 (шир., 2H), 7,30 (д, 2H), 6,95 (д, 2H), 6,22 (с, 2H), 3,96 (т, 2H), 3,41 (м, 2H), 2,74 (м, 2H), 2,44 (м, 2H), 1,71 (м, 2H), 1,58 (м, 6H), 1,40 (м, 4H)
Пример 27
1-[3-(трет-бутоксикарбонил)пропионилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Смесь N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(6-(4-пиридил)-N-гуанидина (2,0 г) и хлорметил-трет-бутилсукцината (3,01 г) помещали в предварительно нагретую масляную баню при 90°С. Через 20 минут образовывался прозрачный расплав, а еще через 20 минут смесь охлаждали до комнатной температуры и добавляли EtOAc (10 мл). Желаемое соединение кристаллизовали и выделяли фильтрованием.
13С ЯМР (ДМСО) δ = 171,4, 170,8, 157,4, 154,7, 144,8, 129,1, 123,9, 116,1, 115,0, 112,7, 80,1, 77,5, 67,6, 42,2, 29,4, 28,4, 28,3, 28,2, 27,6, 25,7, 25,0
Пример 28
1-[3-карбоксипропионилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
5 М Соляную кислоту в диэтиловом эфире (2,6 мл) добавляли при перемешивании к ледяному раствору 1-[3-(трет-бутоксикарбонил)пропионилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорида (0,78 г) в дихлорметане (35 мл). После перемешивания при комнатной температуре в течение 3 часов растворители выпаривали в вакууме; добавляли изопропанол и соединение, названное в заголовке, выделяли фильтрованием и перекристаллизовывали из изопропанола.
13С ЯМР (ДМСО) δ = 173,1, 171,6, 157,4, 154,7, 144,8, 129,1, 123,9, 116,1, 115,0, 112,9, 77,5, 67,6, 42,2, 28,4, 28,4, 28,2, 25,7, 25,4, 25,0
Пример 29
1-[N-(трет-бутоксикарбонилметил)карбамоилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-N-(трет-бутоксикарбонилметил)карбамат (2,84 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина (2,23 г) в безводном ацетонитриле (100 мл) с последующим кипячением с обратным холодильником в течение 20 минут. После охлаждения до комнатной температуры и выпаривания в вакууме соединение, названное в заголовке, кристаллизовали из этилацетата и выделяли фильтрованием в виде светло-желтого порошка.
1Н ЯМР (ДМСО) δ = 11,2 (шир., 1H), 8,9 (шир., 1H), 8,69 (д, 2H), 8,13 (т, 1H), 7,51 (шир., 2H), 7,31 (д, 2H), 6,94 (д, 2H), 6,16 (с, 2H), 3,96 (т, 2H), 3,66 (д, 2H), 3,3 (кв, 2H), 1,71 (м, 2H), 1,58 (м, 2H), 1,48-1,34 (м, 4H), 1,38 (с, 9H)
Пример 30
1-[N-(карбоксиметил)карбамоилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Суспензию 1-[N-(трет-бутоксикарбонилметил)карбамоилокси-метил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодида (2,0 г) в дихлорметане (60 мл) встряхивали с избытком бикарбоната натрия. Органическую фазу сушили над сульфатом магния и фильтровали. Прозрачный фильтрат охлаждали на льду при перемешивании и приводили во взаимодействие с 5 М раствором хлористого водорода в эфире (5,8 мл). Ледяную баню удаляли и после перемешивания в течение 4 часов растворитель удаляли в вакууме. Добавляли изопропанол и бесцветный кристаллический материал отделяли фильтрованием.
13С ЯМР (ДМСО) δ = 170,7, 157,4, 154,7, 144,6, 129,1, 123,9, 116,1, 115,0, 112,8, 78,2, 67,6, 42,0, 28,3, 28,2, 25,7, 25,4, 25,0, 21,4
Пример 31
1-[1-(трет-бутоксикарбонил)-4-пиперидилоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-1-(трет-бутоксикарбонил)-4-пиперидилкарбонат (3,0 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидин (1,93 г) в безводном ацетонитриле (80 мл) с последующим кипячением с обратным холодильником в течение 20 минут. После охлаждения до комнатной температуры и выпаривания в вакууме соединение, названное в заголовке, кристаллизовали из этилацетата и выделяли фильтрованием в виде светло-желтого порошка.
1С ЯМР (ДМСО) δ = 11,3 (шир., 1H), 8,92 (шир., 1H), 8,72 (д, 2H), 7,49 (шир., 2H), 7,30 (д, 2H), 6,95 (д, 2H), 6,22 (с, 2H), 4,80 (м, 1H), 3,96 (т, 2H), 3,52 (м, 2H), 3,35 (м, 2H), 3,19 (м, 2H), 1,83 (м, 2H), 1,71 (м, 2H), 1,63-1,43 (м, 8H), 1,39 (с, 9H)
Пример 32
1-[4-Пиперидилоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид, гидрохлорид
Суспензию 1-[1-(трет-бутоксикарбонил)-4-пиперидилокси-карбонилоксиметилметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодида (1,0 г) в дихлорметане (30 мл) встряхивали с избытком бикарбоната натрия. Органическую фазу сушили над сульфатом магния и фильтровали. Прозрачный фильтрат охлаждали на льду при перемешивании и приводили во взаимодействие с избытком хлористого водорода в эфире. Ледяную баню удаляли и после перемешивания в течение 4 часов растворитель удаляли в вакууме. Остаток кристаллизовали из этанола с получением аналитически чистого соединения, названного в заголовке.
1С ЯМР (ДМСО) δ = 11,9 (шир., 1H), 9,22 (шир., 3H), 8,73 (д, 2H), 7,58 (шир., 2H), 7,30 (д, 2H), 6,95 (д, 2H), 6,22 (с, 2H), 4,88 (м, 1H), 3,96 (т, 2H), 3,44 (шир., 2H), 3,09 (м, 4H), 2,07 (м, 2H), 1,89 (м, 2H), 1,71 (м, 2H), 1,58 (м, 2H), 1,41 (м, 4H)
Пример 33
1-[трет-бутоксикарбонилметоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид
Йодметил-1-трет-бутоксикарбонилметилкарбонат (6,9 г) добавляли к горячему раствору N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина (5,42 г) в безводном ацетонитриле (240 мл) с последующим кипячением с обратным холодильником в течение 20 минут. После охлаждения до комнатной температуры и выпаривания в вакууме соединение, названное в заголовке, кристаллизовали из этилацетата и выделяли фильтрованием в виде светло-желтого порошка.
1С ЯМР (ДМСО) δ = 11,2 (шир.с, 1H), 8,94 (шир.с, 1H), 8,74 (д, 2H), 7,51 (шир.с, 2H), 7,31 (д, 2H), 6,95 (д, 2H), 6,29 (с, 2H), 4,67 (с, 2H), 3,96 (т, 2H), 3,29 (м, 2H), 1,69 (м, 2H), 1,58 (м, 2H), 1,43 (м, 4H), 1,43 (с, 9H)
Пример 34
1-[Карбоксиметоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния хлорид
Получали, как описано в примере 30, но заменяя 1-[N-(трет-бутоксикарбонилметил)карбамоилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодид 1-[N-(трет-бутоксикарбонилметоксикарбонилоксиметил]-4-[N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодидом.
1С ЯМР (ДМСО) δ = 13,2 (шир.с, 1H), 11,9 (шир.с, 1H), 9,56 (шир.с, 1H), 8,72 (д, 2H), 7,70 (шир.с, 2H), 7,30 (д, 2H), 6,94 (д, 2H), 6,27 (с, 2H), 4,68 (с, 2H), 3,96 (т, 2H), 3,38 (шир.м, 2H), 1,69 (шир.м, 2H), 1,59 (м, 2H), 1,41 (шир.м, 4H)
Пример 35
N-[1-(α(2-(2-(2-Метоксиэтокси)этокси)этоксикарбонилокси)бензил)-1,4-дигидропиридин-4-илиден]-N'-циано-N''-(6-(4-хлорфенокси)гексил)-N-гуанидин
Смесь N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина (67 мг) и α-хлорбензил-2-(2-(2-метоксиэтокси)этокси)этилкарбоната (150 мг) помещали в предварительно нагретую масляную баню при 90°С. Через 10 минут образовывался прозрачный желтый расплав, и еще через 20 минут смесь охлаждали до комнатной температуры и добавляли EtOAc (4 мл). Декантация и выпаривание в вакууме давали остаток, который обрабатывали эфиром. После декантации эфира остаток собирали в дихлорметан и промывали избытком бикарбоната натрия. Хроматография на силикагеле с дихлорметаном/метанолом (98:2) в качестве элюента давала соединение, названное в заголовке, в виде бесцветного масла.
1С ЯМР (ДМСО) δ = 7,70 (д, 2H), 7,48 (м, 5H), 7,42 (с, 1H), 7,30 (д, 2H), 6,92 (д, 2H), 6,13 (д, 2H), 4,32 (м, 2H), 3,95 (т, 2H), 3,65 (т, 2H), 3,52 (м, 6H), 3,42 (м, 2H), 3,22 (с, 3H), 3,10 (м, 2H), 1,2-1,8 (м, 8H)
Пример 36
Растворимость в воде соединений формулы I
Растворимость в воде соединений данного изобретения определили путем взбалтывания данных соединений в воде в течение одного часа при комнатной температуре с последующим фильтрованием и определением концентрации соединения в фильтрате с помощью ВЭЖХ. Растворимость соединений, полученных в примерах 8 и 9, сравнивали с растворимостью исходного соединения, N-(6-(4-хлорфенокси)гексил)-N'-циано-N''-(4-пиридил)гуанидина. Результаты представлены в таблице 1, ниже.
Данные в таблице 1 ясно показывают, что путем использования пролекарств данного изобретения достигнуто значительное повышение растворимости. Активное соединение является нерастворимым для всех практических целей, тогда как пролекарство растворимо до уровня более 50 мг/г, что дает возможность изготовления лекарственных средств.
Пример 37:
Фармацевтическая композиция (парентеральный препарат):
125 мг соединения по примеру 9 и 1,5 г лиофилизованной лактозы смешивают с 50 мл изотонического солевого раствора с получением водного препарата, подходящего для внутривенного введения.
Пример 38:
Фармацевтическая композиция для последовательного или одновременного введения:
Контейнер А (парентеральный препарат)
125 мг соединения по примеру 9 и 1,5 г лиофилизованной лактозы смешивают с 50 мл изотонического солевого раствора с получением водного препарата, подходящего для внутривенного введения.
Препарат помещают в 100 мл стеклянные бутылочки (контейнер А).
Контейнер В (парентеральный препарат этопозида)
200 мг этопозида, 20 мг лимонной кислоты, 300 мг бензилового спирта, 800 мг полисорбата и 6,5 мг полиэтиленгликоля 300 растворяют в 10 мл 39,5% (по объему) спирта.
Препарат помещают в 20 мл стеклянные пузырьки (контейнер В).
Пример 39;
Фармацевтическая композиция:
100 мг соединения по примеру 9 могут быть смешаны с 200 мг этопозида, 20 мг лимонной кислоты, 300 мг бензилового спирта, 800 мг полисорбата, 6,5 мг полиэтиленгликоля 300 и 30 мл 39,5% (по объему) спирта с получением жидкого препарата.
Данные по растворимости и биологической активности in vivo соединений по настоящему изобретению приведены в Таблице 2.
Примечания к Таблице 2.
(н.о. =не определялась);
# (мелкоклеточный рак легких) в соответствии с Bioorganic & Medicinal Chemistry Letters 15 (2005) 2491-2494 & Cancer Res. 1999, 59, 5751-5757;
* незначительная токсичность на грызунах и собаках, за исключением возможного желудочно-кишечного раздражения с мукозитом, с диареей и рвотой; отсутствие мутагенных или кластогенных эффектов в соответствии с Cancer Research 59, 5751-5757, 1999;
** предварительные данные в настоящее время дополнительно исследуются.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИАНОГУАНИДИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ЛЕЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2003 |
|
RU2326867C2 |
| ПРОИЗВОДНЫЕ ПИРИДИЛЦИАНОГУАНИДИНОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2292344C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
| ПРОИЗВОДНЫЕ 1, 2-ДИГИДРОЦИКЛОБУТЕНДИОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОРИБОЗИЛТРАНСФЕРАЗЫ НИКОТИНАМИДА | 2009 |
|
RU2529468C2 |
| ИНГИБИТОРЫ CDK | 2011 |
|
RU2621674C2 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА, ИХ ПРИМЕНЕНИЕ В ПРОИЗВОДСТВЕ ИНГИБИРУЮЩЕГО МОНОАМИНООКСИДАЗУ АГЕНТА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ МОНОАМИНООКСИДАЗЫ ТИПА В | 1995 |
|
RU2140414C1 |
| НОВЫЕ 1,2,4-ТРИАЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2293733C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ТЕТРАЗОЛА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ТУБЕРКУЛЕЗА | 2018 |
|
RU2800930C2 |
| НОВОЕ ПРОИЗВОДНОЕ НИКОТИНАМИДА ИЛИ ЕГО СОЛЬ | 2011 |
|
RU2576623C2 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2001 |
|
RU2265011C2 |
Данное изобретение относится к новым производным пиридилцианогуанидина
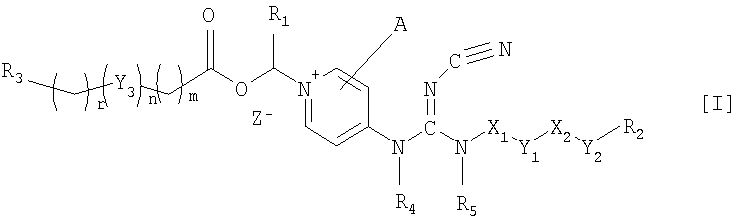
где X1 и Х2 независимо представляют собой связь; прямой или разветвленный углеводородный дирадикал; Y1 и Y2 независимо представляют связь, метилен, или -О-; Y3 представляет собой О, -О-С(О)-, N(R8), где R8 представляет собой водород; R1 представляет собой водород, прямой или разветвленный алкил или фенил; R2 представляет собой арил, гетероарил или неароматический гетероциклический углеводородный радикал, каждый из которых необязательно замещен тетрагидропиранилокси, ди-(С1-4 алкокси)фосфиноилокси и C1-4 алкоксикарбониламино; R3 представляет собой водород, прямой, разветвленный или циклический углеводородный радикал, необязательно замещенный одним или более амино, карбокси, алкокси, С1-4 алкоксикарбонилом, C1-4 алкоксикарбониламином или неароматический азотсодержащий гетероциклический углеводородный радикал, необязательно замещенный С1-4 алкоксикарбонилом; или
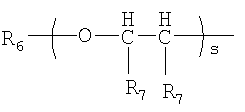
где s представляет собой целое число от 1 до 10; R6 представляет собой водород или необязательно замещенный неароматический углеводородный радикал; R7 независимо представляет собой водород или метил; R4, R5 и А представляют собой водород; Z- представляет собой фармацевтически приемлемый анион, такой как хлорид, бромид, йодид; m и r независимо представляют целое число от 0 до 4; и n равно 0 или 1. Изобретение также относится к соединению формулы 11, к фармацевтической композиции на основе этих соединений для получения лекарственного средства для лечения пролиферативных заболеваний, способам лечения и применению. 6 н. и 31 з.п. ф-лы, 2 табл.
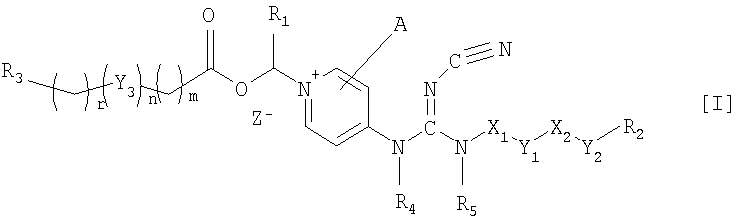
где X1 и X2 независимо представляют собой связь; прямой или разветвленный углеводородный дирадикал;
Y1 и Y2 независимо представляют связь, метилен, или -О-;
Y3 представляет собой О, -О-С(О)-, N(R8), где R8 представляет собой водород;
R1 представляет собой водород, прямой или разветвленный алкил или фенил;
R2 представляет собой арил, гетероарил или неароматический гетероциклический углеводородный радикал, каждый из которых необязательно замещен тетрагидропиранилокси, ди-(С1-4алкокси)фосфиноилокси и С1-4алкоксикарбониламино;
R3 представляет собой водород, прямой, разветвленный или циклический углеводородный радикал, необязательно замещенный одним или более амино, карбокси, алкокси, С1-4алкоксикарбонилом, С1-4алкоксикарбониламином или неароматический азотсодержащий гетероциклический углеводородный радикал, необязательно замещенный С1-4алкоксикарбонилом; или
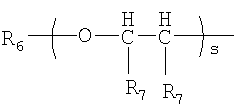
где s представляет собой целое число от 1 до 10; R6 представляет собой водород или необязательно замещенный неароматический углеводородный радикал; R7 независимо представляет собой водород или метил;
R4, R5 и А представляют собой водород;
Z- представляет собой фармацевтически приемлемый анион, такой как хлорид, бромид, йодид;
m и r независимо представляют целое число от 0 до 4; и n равно 0 или 1.
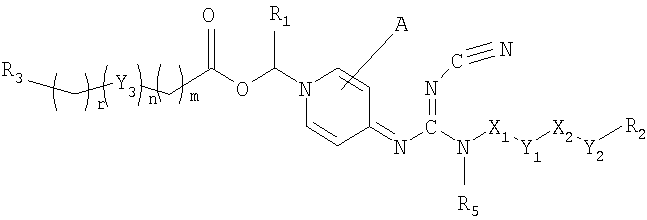
где A, X1, Х2, Y1, Y2, Y3, R1, R2, R3, R5, m, n и r имеют значения, указанные в п.1.
X2 представляет собой прямой или разветвленный, насыщенный или ненасыщенный С4-20 углеводородный дирадикал;
Y2 представляет собой О или метилен;
R1 представляет собой водород, прямой или разветвленный алкил или фенил;
R2 представляет собой необязательно замещенный арил, гетероарил, ди-(С1-4 алкокси)фосфиноилокси, С1-4алкоксикарбониламино;
R3 представляет собой водород, прямой или разветвленный C1-6алкил, C1-6алкенил или С2-6алкинил, каждый из которых необязательно замещен амино, карбокси или С1-4 алкоксикарбонилом;
или неароматический азотсодержащий гетероциклический углеводородный радикал, необязательно замещенный С1-4алкоксикарбонилом; или

где s равно целому числу от 1 до 10;
R6 представляет собой водород или С1-4 алкил;
каждый R7 независимо представляет собой водород или метил;
Y3 представляет собой О или N(R8), где R8 представляет собой водород;
m и n независимо равны 0 или 1; r равно 0;
и Z- представляет собой фармацевтически приемлемый анион, такой как хлорид, бромид, йодид.
R8 имеет значение, указанное в п.1, и R3 представляет собой водород, прямой или разветвленный C1-6алкил, необязательно замещенный амино, карбокси, алкокси, C1-4 алкоксикарбонилом, С1-4алкоксикарбониламином.
1-[2-(2-(2-метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-метоксиэтокси)этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-метоксиэтокси)карбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний йодид;
1-[2-(2-(2-метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[1-(2-(2-метоксиэтокси)этоксикарбонилокси)этил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-Метоксиэтокси)этокси)этоксиацетоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-(2-метоксиэтокси)этокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-пивалоилоксиметил-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-ацетоксиметил-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-(L)-валилоксиметил-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид, гидрохлорид;
1-глицилоксиметил-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид, гидрохлорид;
1-[монобензилсукцинилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)-этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-(2-(2-(2-метоксиэтокси)этокси)этокси)этокси)этокси-этоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-метоксиэтокси)этокси)этоксикарбонилоксиметил]-4-[N'-циано-N"-(9-(диэтоксифосфиноилокси)нонил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-метоксиэтокси)этокси)этокси)карбонилоксиметил]-4-[N'-циано-N"-(12-(трет-бутилоксикарбониламино)додецил)-N-гуанидино]пиридиний йодид;
1-[2-(2-(2-метоксиэтокси)этокси)этокси)карбонилоксиметил]-4-[N'-циано-N"-(12-(трет-бутилоксикарбониламино)додецил)-N-гуанидино]пиридиний хлорид;
1-[2-(2-(2-(2-метоксиэтокси)этокси)этокси)-этоксикарбонилоксиметил]-4-[N'-циано-N"-(12-(трет-бутилоксикарбониламино)додецил)-N-гуанидино]пиридиний хлорид;
1-[3-(N-трет-бутоксикарбониламино)пропилоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний йодид;
1-[3-аминопропилоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид, гидрохлорид;
1-[3-(N-трет-бутоксикарбониламино)пропилкарбамоилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиния йодида;
1-[3-аминопропилкарбамоилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид, гидрохлорид;
1-[5-(N-трет-бутоксикарбониламино)пентаноилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний йодид;
1-[5-аминопентаноилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид, гидрохлорид;
1-[3-(трет-бутоксикарбонил)пропионилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[3-карбоксипропионилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[N-(трет-бутоксикарбонилметил)карбамоилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний йодид;
1-[N-(карбоксиметил)карбамоилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
1-[N-(трет-бутоксикарбонил)-4-пиперидилоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний йодид;
1-[4-пиперидилоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид, гидрохлорид;
1-[трет-бутоксикарбонилметоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний йодид;
1-[карбоксиметоксикарбонилоксиметил]-4-[N'-циано-N"-(6-(4-хлорфенокси)гексил)-N-гуанидино]пиридиний хлорид;
| N-ЦИАНО-N'-ПИРИДИЛГУАНИДИНЫ, ИЛИ ИХ N-ОКСИДЫ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ НЕТОКСИЧНЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 1993 |
|
RU2141951C1 |
| WO 00/61559 А1 19.10.2000 | |||
| WO 00/61561 А1 19.10.2000 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2007-12-20—Публикация
2001-11-14—Подача