Настоящее изобретение относится к применению производных фумаровой кислоты для изготовления лекарственных препаратов для лечения сердечной недостаточности и астмы.
Описание предшествующего уровня техники
Диалкиловые эфиры фумаровой кислоты и моноалкиловые эфиры фумаровой кислоты и их соли длительное время успешно применялись для лечения псориаза. Это применение было описано в ряде патентов, например в DE 2530372, DE 2621214 или EP-B-0312697.
Также было описано применение моно- и диэфиров фумаровой кислоты для лечения аутоиммунных заболеваний, таких как полиартрит или рассеянный склероз (DE 19721099,6 и DE 19853487,6), а также для применения в трансплантационной медицине (DE 19853487,6 и DE 19839566,3). Более того, применение моно- и диэфиров фумаровой кислоты для лечения NFкаппаB опосредованных заболеваний, так же как и лечение митохондриальных заболеваний и/или ингибитор NFкаппаB известны из DE 10101307,8 и DE 10000577,2. Все упомянутые публикации описывают моно- и диэфиры фумаровой кислоты, необязательно в форме некоторых солей.
Применение моно- и диамидов фумаровой кислоты для лечения по указанным показаниям известно также из DE 10133004,9. Эти амиды сформированы с аминокислотами и предпочтительно со специфическими пептидами. Наконец, олигомеры фумаровой кислоты и их применение для лечения указанных заболеваний известны из DE 10217314,1.
Пароксизмальный, выраженный респираторный дистресс понимается как астма (бронхиальная астма), которой страдает приблизительно от 4 до 5% населения индустриальных стран, с возрастающей тенденцией. Этот респираторный дистресс основан на вариабельной и обратимой обструкции респираторного тракта вследствие гиперреактивности бронхиальной системы, которая запускается эндогенными и экзогенными стимулами. Последние включают химические и физические провоцирующие факторы, инфекции, физическое усилие и/или эмоциональные факторы. После продолжительного срока заболевания, как правило, развиваются вторичные заболевания, такие как хронический бронхит, легочная эмфизема, бронхоэктазы, ателектазы или декомпенсированное легочное сердце или респираторная сердечная недостаточность.
В зависимости от причины дифференциация осуществляется между следующими вариантами астмы, а именно астмой, вызванной аллергиями, инфекциями, анальгетиками, условиями труда или физическим усилием, смешанными формами астмы или asthma cardiale (сердечной астмой), вазомоторным ринитом и уремической астмой. В частности, asthma cardiale может привести к респираторному дистрессу, вследствие повышенного застоя в малом круге кровообращения в случае левожелудочковой недостаточности.
В настоящее время в лекарственной терапии и/или для облегчения астмы применяются, например, бета-2 симпатомиметики, кортикостероиды, парасимпатолитики, теофиллины, противовоспалительные агенты и антиаллергические агенты, в дополнение к способам простого избегания триггерных стимулов.
На молекулярном уровне, астма, по-видимому, характеризуется повышенной активностью Th2 лимфоцитов в легких, которая, в свою очередь, приводит к повышенному высвобождению некоторых Th2 цитокинов, которые, в конечном счете, обусловливают известные признаки астмы, такие как переключение изотипа IgE, продукция слизи и рекрутинг и активация эозинофилов. Более того, Th2 цитокины, по-видимому, приводят к дифференциации дальнейших Th2 клеток по пути сигнальной трансдукции, известному как JAK-STAT, результатом которого является круг самоусиления. Также наблюдается увеличенная пролиферация мезенхимальных клеток, в частности гладкомышечных клеток бронхов.
Так называемый путь сигнальной трансдукции JAK-STAT (Киназа Януса Сигнальный Трансдуктор и Активатор пути Транскрипции) это путь для передачи информации, передаваемой с помощью сигнальных пептидов, таких как цитокины, внутрь клетки и/или в ядро. Сигнальная трансдукция происходит с помощью STAT протеинов, которые присутствуют в цитоплазме и изначально инактивированы; у человека известны 7 различных STAT протеинов. В результате присоединения к лиганду рецептора на поверхности клетки эти STAT протеины быстро активируются посредством фосфорилирования, например, посредством киназы Януса. Фосфорилирование приводит к гомо- или гетеродимеризации STAT протеинов, димеры транспортируются в ядро, где они присоединяются к целевому промотеру и резко усиливают скорость транскрипции этого промотера.
Острая или хроническая неспособность сердца нагнетать выброс крови, требуемой для метаболизма, и принимать венозный возврат в условиях стресса (стрессовая недостаточность) или еще в покое (недостаточность покоя), понимаются под сердечной недостаточностью. Недостаточность может встречаться в виде изолированной левожелудочковой или правожелудочковой недостаточности, а может также поражать оба желудочка.
Клиническая картина сердечной недостаточности может быть связана по этиологии с различными причинами, прежде всего с воспалительными и дегенеративными изменениями миокарда и эндокарда, расстройствами коронарного кровообращения, инфарктом миокарда и травмами. Впоследствии сердечная недостаточность приводит к изменениям в периферическом кровообращении, дыхательным расстройствам, в частности сердечной астме, почечной недостаточности и расстройствам электролитного метаболизма и отекам, и сниженной функциональной способности скелетных мышц.
Относительно показаний дифференцирование проводится между острой сердечной недостаточностью, энергетической сердечной недостаточностью, энергетически-динамической сердечной недостаточностью и гиподинамической сердечной недостаточностью, также называемой синдромом ХЕГГЛИНА II, эксцитомоторной сердечной недостаточностью, сердечной недостаточностью в результате сердечной аритмии, гипоксемической, латентной, первичной, компенсированной, относительной или стрессовой недостаточностью и/или левожелудочковой недостаточностью.
В настоящее время субстанции, стимулирующие сокращения, применяются для лекарственной терапии сердечной недостаточности, гликозиды (прежде всего дигоксин и дигитоксин) все еще применяются сегодня для лечения хронических форм. Однако в течение последних нескольких лет приобрели значимость вазодилататоры (нитро-соединения и дигидралазин, альфа-блокаторы, антагонисты кальция и прежде всего ингибиторы АПФ). Ингибиторы АПФ наиболее значимы для длительного лечения. Кроме того, применяются диуретики. Острые формы лечат катехоламинами, по возможности также амриноном.
Объектом изобретения является предоставление нового агента для лечения сердечной недостаточности и астмы. В частности, объектом изобретения является терапевтический агент как для сердечной астмы, так и левожелудочковой недостаточности в области, в которой они перекрывают друг друга. Другим объектом изобретения является терапевтический агент по обоим показаниям индивидуально или в области, в которой они перекрывают друг друга, который вследствие своей хорошей толерантности пригоден для длительной терапии.
Настоящая цель достигается применением производных фумаровой кислоты для изготовления фармацевтических средств или фармацевтических препаратов для лечения астмы и/или сердечной недостаточности, в частности, у человека.
Сущность изобретения
Согласно первому аспекту изобретение имеет отношение к применению производных фумаровой кислоты, выбранных из группы, состоящей из диалкилфумаратов, моноалкилгидрофумаратов (моноалкиловой эфир фумаровой кислоты), солей моноалкиловых эфиров фумаровой кислоты, моноамидов фумаровой кислоты, солей моноамидов фумаровой кислоты, диамидов фумаровой кислоты, моноалкилмоноамидофумаратов, карбоциклических и оксакарбоциклических олигомеров этих соединений и их смесей, для изготовления фармацевтического препарата для лечения или предотвращения сердечной недостаточности, в особенности левожелудочковой недостаточности, инфаркта миокарда и стенокардии.
Согласно второму аспекту изобретение имеет отношение к применению производных фумаровой кислоты, выбранных из группы, состоящей из диалкилфумаратов, моноалкилгидрофумаратов, солей моноалкиловых эфиров фумаровой кислоты, моноамидов фумаровой кислоты, солей моноамидов фумаровой кислоты, диамидов фумаровой кислоты, моноалкилмоноамидофумаратов, карбоциклических и оксакарбоциклических олигомеров этих соединений и их смесей для изготовления фармацевтического препарата для лечения астмы и хронических обструктивных болезней легких, в особенности астмы, вызванной аллергиями, инфекциями, анальгетиками, условиями труда или физическим усилием, смешанных форм астмы или asthma cardiale.
Настоящее изобретение также касается способа ингибирования поглощения 3Н-тимидина гладкомышечными клетками бронхов и способа ингибирования пролиферации этих клеток, как описано ниже и в прилагаемой формуле изобретения.
Наконец, настоящее изобретение касается способа применения вышеупомянутых производных фумаровой кислоты для ингибирования PDGF индуцированной активации STAT1.
Описание чертежей
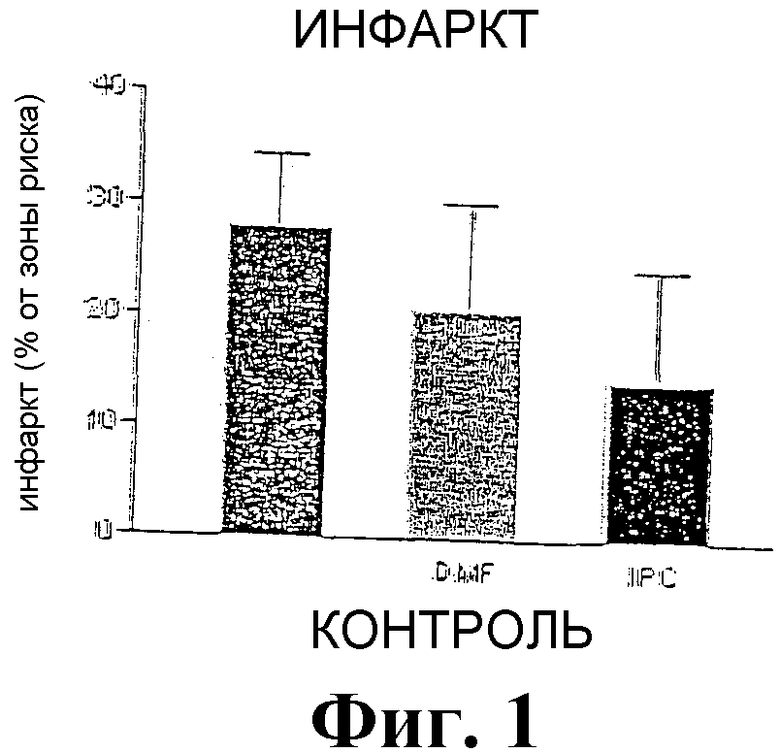
Фиг.1 - это диаграмма, которая показывает размер инфаркта после назначения DMF, ишемии и контроль.
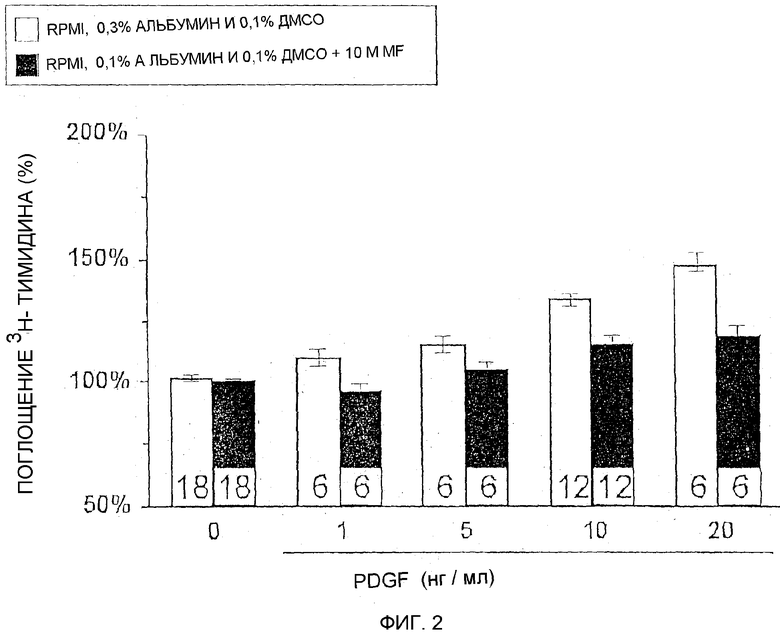
Фиг.2 показывает процент ингибирования PDGF-индуцированного поглощения 3Н-тимидина бронхиальными гладкомышечными клетками при добавлении DMF.
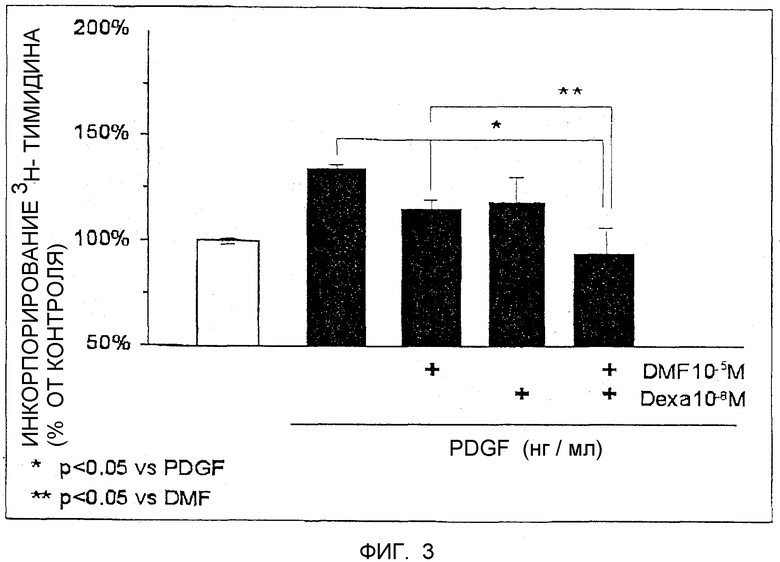
Фиг.3 - это диаграмма, показывающая процент клеточной пролиферации бронхиальных гладкомышечных клеток в ответ на стимуляцию PDGF при отсутствии или в присутствии DMF и/или дексаметазона.
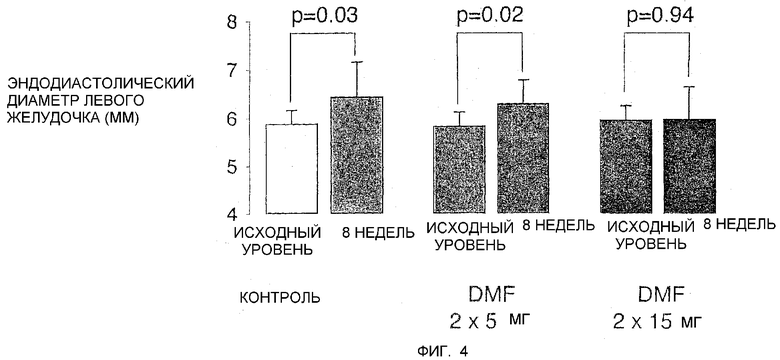
Фиг.4 - это диаграмма, показывающая эндодиастолические диаметры левого желудочка крыс Dahl до и после 8-недельной диеты с большим содержанием соли при отсутствии и в присутствии DMF.
Подробное описание изобретения
Согласно первому аспекту описания настоящее изобретение касается применения производных фумаровой кислоты для изготовления фармацевтического препарата для лечения астмы и хронических обструктивных болезней легких в общем. Предпочтительно это астма, вызванная аллергиями, инфекциями, условиями труда или физическим усилием, особенно предпочтительно asthma cardiale.
Согласно второму аспекту описания изобретение также касается применения производных фумаровой кислоты для изготовления фармацевтического препарата для лечения или предотвращения сердечной недостаточности, инфаркта миокарда и стенокардии. Рассматриваемая сердечная недостаточность может быть любым типом сердечной недостаточности независимо от ее формы и/или этиологии. Примеры сердечной недостаточности, которые лечатся согласно изобретению, это острая сердечная недостаточность, энергетическая сердечная недостаточность, энергетически-динамическая сердечная недостаточность и гиподинамическая сердечная недостаточность, также называемая синдромом HEGGLIN II, эксцитомоторная сердечная недостаточность, сердечная недостаточность в результате сердечных аритмий, гипоксемическая, латентная, первичная, компенсированная, декомпенсированная, относительная или стрессовая недостаточность и/или левожелудочковая недостаточность, более предпочтительно левожелудочковая недостаточность. Композиции также эффективны в предотвращении этих заболеваний и/или инфарктов миокарда, включая первичный, повторный или последующие инфаркты.
Эти применения основаны на обнаружении того, что производные фумаровой кислоты ингибируют PDGF-(тромбоцитарный фактор роста) индуцированную активацию STAT1. Как описано выше, было предположено, что при астме активация STAT приводит к смещению паттерна цитокинов и, в конечном счете, к порочному кругу с повышенной активностью Th2 клеток и последствиям секреции слизи, продукции IgE и рекрутинга эозинофилов (A.B. Pernis, P.B. Rothman, "JAK-STAT signalling in asthma" in: The J. of Clin. Investigation, vol. 10, No. 1, May 2002).
Смещение цитокинового паттерна с Th1 до Th2, которое описано в литературе для производных фумаровой кислоты (см. вышеупомянутые описания изобретений к патентам), предпочтительно обусловливает ожидание интенсификации этого порочного круга. Соответственно, они не будут подходить для лечения астмы. Поразительно, оказалось, что производные фумаровой кислоты могут ингибировать пролиферацию гладкомышечных клеток респираторного тракта. Это, по-видимому, происходит посредством ингибирования PDGF-индуцируемого фактора транскрипции STAT1. Представлялось возможным специфично показать, что производные фумаровой кислоты способны ингибировать PDGF-индуцированную активацию STAT1 и PDGF-стимулированное инкорпорирование тимидина в BSM (бронхиальная гладкая мышца) клетки. В отсутствие необходимости связи, таким образом, этот ингибирующий пролиферацию эффект может быть причинным и для эффективности производных фумаровой кислоты в терапии астмы.
Один или несколько производных фумаровой кислоты, применяемые согласно изобретению, могут быть выбраны из группы, состоящей из диалкилфумаратов (диалкиловые эфиры фумаровой кислоты соответственно), моноалкилгидрофумаратов (моноалкиловые эфиры фумаровой кислоты соответственно), солей моноалкиловых эфиров фумаровой кислоты (соли моноалкиловых эфиров фумаровой кислоты соответственно), физиологически приемлемых катионов, в особенности катионов щелочных или щелочноземельных металлов или катионов переходных металлов, таких как Li+, Na+, K+,NH4 +, Mg2+, Ca2+, Fe2+, Mn2+, и Zn2+, моноамидов фумаровой кислоты и диамидов фумаровой кислоты и их солей, карбоциклических и оксакарбоциклических олигомеров этих соединений и их смесей.
В предпочтительном варианте осуществления производное фумаровой кислоты выбрано из группы, состоящей из произвольно замещенных диалкиловых эфиров фумаровой кислоты и моноалкиловых эфиров фумаровой кислоты в форме свободной кислоты или ее солей и их смесей.
Особенно предпочтительно применение в этом случае диалкиловых эфиров фумаровой кислоты формулы (I)
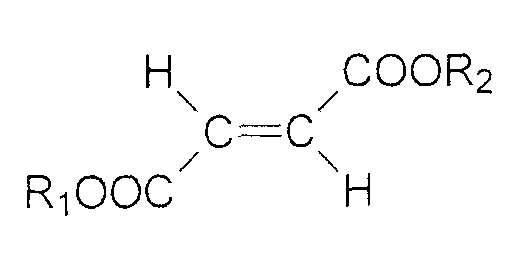
поскольку они описаны в DE 19853487,6, где R1 и R2, которые могут быть одинаковыми или независимо различными, представляют C1-24 алкильный радикал или С5-20 арильный радикал, и эти радикалы необязательно замещены галогеном (F, Cl, Br, I), гидрокси, C1-4 алкокси, нитро или цианогруппой. Предпочтительно, диалкилфумарат представляет собой диметилфумарат, диэтилфумарат и/или метилэтилфумарат.
В общем, под алкильной группой понимается насыщенная или ненасыщенная, прямоцепочечная, разветвленная или циклическая углеводородная группа, имеющая согласно изобретению 1-24 атома углерода, которые могут быть произвольно замещены одним или более заместителями. Предпочтительно алкильная группа - это метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, циклопентил, 2-этилгексил, гексил, циклогексил, гептил, циклогептил, октил, винил, аллил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2,3-дигидроксипропил, 2-метоксиэтил, метоксиметил, 2-метоксипропил, 3-метоксипропил или 2,3-диметоксипропил. Наиболее предпочтительны метил и этил.
Согласно изобретению арильная группа должна пониматься как необязательно замещенный арил, алкилзамещенный арил или аралкил, имеющий 5-20 атомов углерода, предпочтительно арил, алкилзамещенный арил или аралкильная группа, имеющая 6-10 атомов углерода, которыми являются фенил, бензил, фенэтил, метилфенил, этилфенил, пропилфенил и бутилфенил, трет-бутилфенил, фенил и бензил особенно предпочтительны.
Заместители указанных групп предпочтительно выбраны из группы, состоящей из галогена (F, Cl, Br, I), гидрокси, С1-4 алкокси, С1-4 алкил, нитро и циано.
Моноалкиловые эфиры фумаровой кислоты формулы (II)
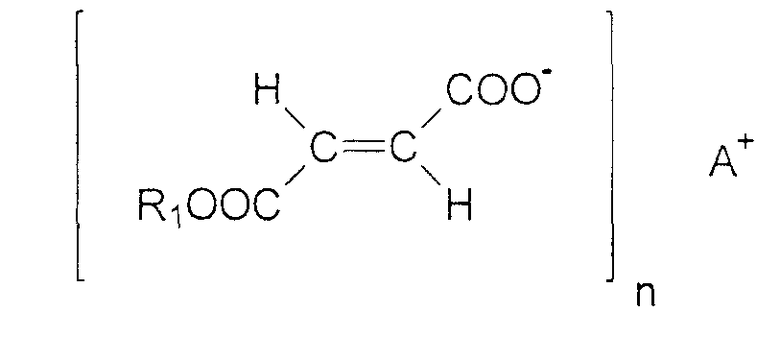
как они описаны в DE 19721099,6, могут быть также успешно применены там, где R1 соответствует вышеприведенному определению, A - это водород, катион щелочного или щелочноземельного металла или физиологически приемлемый катион переходного металла, предпочтительно выбранный из Li+, Na+, K+, Mg2+, Ca2+, Zn2+, Fe2+ и Mn2+, и n равно 1 или 2 и соответствует валентности A.
Примерные соединения формул (I) и (II) - это диметиловый эфир фумаровой кислоты, диэтиловый эфир фумаровой кислоты, метилэтиловый эфир фумаровой кислоты, метилгидрофумарат, этилгидрофумарат, кальция метилфумарат, кальция этилфумарат, магния метилфумарат, магния этилфумарат, цинка метилфумарат, цинка этилфумарат, железа метилфумарат и железа этилфумарат. Они могут применяться по отдельности или в виде смесей.
Предпочтительно амиды фумаровой кислоты, применяемые согласно изобретению, описаны в DE 10133004,9.
Они соответствуют общей формуле (III)
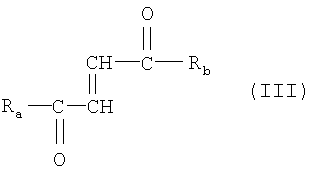
где Ra представляет OR3 или D- или L-аминокислотный радикал -NH-CHR4-COOH, соединенный амидной связью, где R3 - это водород, прямоцепочечный или разветвленный, необязательно замещенный С1-24 алкильный радикал, фенильный радикал или C6-10 арильный или аралкильный радикал и R4 - это боковая цепь природной или синтетической аминокислоты;
Rb представляет D- или L-аминокислотный радикал -NH-CHR5-COOH, соединенный амидной связью, где R5 это боковая цепь природной или синтетической аминокислоты, или пептидный радикал из 2-100 аминокислот, соединенных амидной связью, где каждая аминокислота может быть одинаковой или различной.
Боковая цепь природной или синтетической аминокислоты обычно является боковой цепью, выбранной из группы, состоящей из боковых цепей Ala, Val, Leu, Ile, Trp, Phe, Met, Tyr, Thr, Cys, Asn, Gln, Asp, Glu, Lys, Arg, His, Цитруллина, Hcy, Hse, Hyp, Hyl, Orn, Sar и Me-Gly. Боковые цепи Gly, Ala, Val, Ile, Leu и Me-Gly предпочтительны. ЕслиRa - это L-аминокислотный радикал -NH-CHR4-COOH и Rb - это L-аминокислотный радикал -NH-CHR5-COOH, R4 и R5 могут быть одинаковыми или различными. Более предпочтительно, когда R4 и R5 одинаковы. Наиболее предпочтительно, когдаRa и Rb каждый представлен глицином.
АльтернативноRа может быть радикалом -OR3 и Rb может быть L-аминокислотным радикалом -NH-CHR5-COOH или пептидным радикалом R5, имеющим вышеуказанное значение. В этом случае производное фумаровой кислоты является моноалкилмоноамидофумаратом.
Пептидный радикал соединен амидной связью и имеет от 2 до 100, предпочтительно от 2 до 30, наиболее предпочтительно от 2 до 15 аминокислот, которые могут быть одинаковыми или различными. Пептидный радикал Rb наиболее предпочтительно выбран из группы, состоящей из пептидных гормонов, факторов роста, цитокинов, нейротрансмиттеров, нейропептидов, фрагментов антител, факторов коагуляции и циклоспоринов, и их производных и фрагментов. ПредпочтительноRa - это метокси или этокси иRb - Gly, Ala, Val, Ile, Leu и Me-Gly.
Амиды фумаровой кислоты, как определено выше, могут применяться по отдельности или в смеси или также в смеси с моноалкиловыми или диалкиловыми эфирами фумаровой кислоты, определенными выше.
Наконец, могут быть также применены карбоциклические или оксакарбоциклические олигомеры фумаровой кислоты, как они описаны в DE 10217314,1. Они содержат от 2 до 10, предпочтительно от 2 до 6 и наиболее предпочтительно 2-3 звена, полученных из фумаровой кислоты и/или ее эфиров и/или амидов, согласно вышеприведенному, в виде повторяющихся звеньев.
Эти олигомеры фумаровой кислоты предпочтительно получены посредством (олефиновой) полимеризации двойных связей C-C (для карбоциклических олигомеров) и/или двойных связей C-C и карбонильных атомов кислорода звеньев (для оксакарбоциклических олигомеров). Предпочтительно звенья, полученные из фумаровой кислоты, получены из мономеров, выбранных из группы, состоящей из фумаровой кислоты и диалкилфумаратов, моноалкилгидрофумаратов, моноамидов фумаровой кислоты, диамидов фумаровой кислоты, моноалкилмоноамидофумаратов и их солей и их смесей, которые определены выше. Более предпочтительно олигомер содержит только звенья, полученные из одного или двух мономеров. Наиболее предпочтительно олигомер содержит исключительно идентичные мономерные звенья.
Карбоциклические олигомеры состоят из звеньев, полученных из фумаровой кислоты, таким образом, что звенья соединены 2 и 3 атомами углерода основной цепи фумаровой кислоты посредством ковалентных связей С-С таким образом, что образуется карбоциклический олигомер. Основная цепь олигомера включает четное число атомов углерода и не содержит никаких других мономеров и/или гетероатомов. Эта основная цепь замещена при каждом атоме углерода мономерного звена(ьев) фумаровой кислоты, из которой она построена, одной из карбоновых кислот и/или амидных групп карбоновых кислот.
Оксакарбоциклические олигомеры составлены из мономеров фумаровой кислоты таким образом, что звенья связаны друг с другом в 1 и 3 атомах углерода эфирными мостиками. В то же время этиленовая ненасыщенность атомов C2 и С3 смещена к C1 и C2. Таким образом, согласно изобретению кольцо содержит полиоксипропеновые звенья в случае оксакарбоциклических олигомеров.
Применяемый термин "олигомер" относится к числу, по крайней мере, двух мономерных звеньев фумаровой кислоты. Обычно оксакарбоциклический и/или карбоциклический олигомер фумаровой кислоты содержит от 2 до 10, предпочтительно от 2 до 6 и наиболее предпочтительно 2-3 звена, полученных из фумаровой кислоты. Предпочтительно карбоновая кислота и/или амидные группы карбоновой кислоты, как заместители цикла - все находятся в положении транспозиции друг к другу.
В предпочтительном варианте осуществления карбоциклический олигомер фумаровой кислоты соответствует следующей формуле (IVa)

применяется, где радикалы Rc и Rd одинаковы или различны и выбраны из аминорадикалов (-NR1R2), аминокислотных радикалов -NH-C(COOH)-R5, пептидных радикалов, имеющих от 2 до 100 аминокислот, алкоксирадикалов (-OR1) и гидроксильных радикалов, R1, R2 и R5, как определено выше, и n является целым числом от 2 до 10 включительно, предпочтительно от 2 до 6 включительно.
Предпочтительно радикалы Rc и Rd - это каждый независимо алкоксильный или гидроксильный радикал, в то же время с наибольшим предпочтением Rc и Rd, не означающие гидроксил. Таким образом, мономером(ами) является(ются) предпочтительно один или несколько моноалкилгидрофумарат(ов). В другом варианте осуществления Rc и Rd могут представлять алкоксирадикал -OR1, который более предпочтительно является идентичным. В этом случае мономером(ами) является диалкилфумарат(ы).
Особенно предпочтительно, если r-1, t-2, c-3, t-4-тетракис (метоксикарбонил)циклобутан или r-1, t-2, c-3, t-4, с-5 t-6-гекса(алкоксикарбонил)циклогексан, предпочтительно r-1, t-2, с-3, t-4-тетракис(метоксикарбонил)циклобутан и/или r-1, t-2, с-3, t-4, с-5, t-6-гекса(метоксикарбонил)циклогексан применяются согласно этому варианту осуществления.
Альтернативно применяется оксакарбоциклический олигомер формулы (IVb)
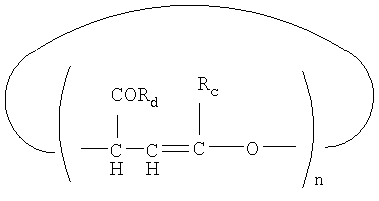
где n=от 2 до 10,
Rс и Rd представлены, как определено выше, и n - целое число от 2 до 10 включительно, более предпочтительно от 2 до 6 включительно.
Производные фумаровой кислоты, применяемые согласно изобретению, могут быть изготовлены согласно известным способам, которые, например, описаны в DE 19721099,6, DE 10133004,9 или DE 10217314,1. Содержание этих публикаций приведено в виде ссылки.
Фармацевтический препарат может быть представлен в форме, подходящей для орального, ректального, трансдермального, дермального, офтальмологического, назального, легочного или перентерального применения. Предпочтительно фармацевтический препарат подходит для перорального приема. Тогда он может быть представлен в форме таблеток, таблеток, покрытых оболочкой, капсул, гранулята, растворов для питья, липосом, наночастиц, нанокапсул, микрокапсул, микротаблеток, пеллетов или порошков и в форме гранулята, упакованного в капсулы или саше, микротаблеток, упакованных в капсулы или саше, пеллетов, упакованных в капсулы или саше, наночастиц, упакованных в капсулы или саше, или порошков, упакованных в капсулы или саше. Предпочтительно лекарственное средство представлено в форме наночастиц, пеллетов или микротаблеток, которые могут быть произвольно упакованы в саше или капсулы.
Предпочтительно все твердые формы дозирования могут быть предоставлены с энтеросомобильным покрытием. Оно, например, может быть нанесено на таблетки, микротаблетки, пеллеты и т.д., а также может быть нанесено на капсулы, которые их содержат.
Оральные фармацевтические формы согласно изобретению могут в основном быть изготовлены согласно классическому способу прессования, а также прямым прессованием, и как твердые дисперсии согласно способу плавления или посредством способа сушки распылением. Если желательно, энтеросомобильное покрытие может быть отлито или распылено по частям на сердцевины таблеток в классическом дражировочном котле или нанесено с помощью аппарата вихревого напыления согласно известным процессам. Позже, после завершения сушки, пленочная оболочка может быть нанесена в том же самом аппарате.
Предпочтительно производные фумаровой кислоты для изготовления фармацевтических препаратов согласно изобретению используются в таком количестве, что этот фармацевтический препарат содержит производное(ные) фумаровой кислоты в количестве одного или более на единицу дозирования, которое соответствует и/или эквивалентно количеству фумаровой кислоты от 1 до 500 мг, предпочтительно от 10 до 300 мг и в основном предпочтительно от 10 до 200 мг.
В случае парентерального введения посредством инъекции (вв, вм, пк, ип) препарат представлен в форме, подходящей для этого. Могут быть применены все общепринятые жидкие носители, подходящие для инъекции.
Согласно предпочтительному варианту осуществления лекарственное средство, произведенное согласно изобретению, может содержать индивидуально или в смеси следующее: от 10 до 500 мг диалкилфумарата, в частности диметилфумарата и/или диэтилфумарата, от 10 до 500 мг кальция алкилфумарата, в частности кальция метилфумарата и/или кальция этилфумарата, от 0 до 250 мг цинка алкилфумарата, в частности, цинка метилфумарата и/или цинка этилфумарата, от 0 до 250 мг алкилгидрофумарата в частности, метилгидрофумарата и/или этилгидрофумарата и от 0 до 250 мг магния алкилфумарата, в частности магния метилфумарата и/или магния этилфумарата, сумма указанных количеств, соответствует эквиваленту от 1 до 500 мг, предпочтительно от 10 до 300 мг и наиболее предпочтительно от 10 до 200 мг фумаровой кислоты.
Согласно изобретению препараты, которые применяются с особым предпочтением, содержат исключительно диметилфумарат в количестве от 10 до 300 мг.
Согласно особенно предпочтительному варианту осуществления фармацевтический препарат представлен в форме микротаблеток или пеллетов. Предпочтительно они имеют размер и/или средний диаметр ≤5000 микрометров, предпочтительно от 300 до 2500 микрометров, в частности от 300 до 1000 микрометров для пеллетов и от 1000 до 2500 микрометров для микротаблеток. Вследствие применения производных фумаровой кислоты в форме микротаблеток, которое предпочтительно согласно изобретению, раздражение желудочно-кишечного тракта и/или побочные эффекты, которые не могут быть исключены при применении таблеток в стандартных однократных дозах, в дальнейшем могут быть уменьшены. По-видимому, это основано на факте, что микротаблетки, предпочтительно микротаблетки с энтеросомобильным покрытием, распределяются уже в желудке и, таким образом, поступают в кишку болюсно, когда активные субстанции высвобождаются в меньших локальных дозах при неизменной общей дозе. Вследствие этого можно избежать локального раздражения эпителиоцитов кишки, из этого следует, что толерантность желудочно-кишечного тракта к микротаблеткам лучше по сравнению с обычными таблетками.
Примеры изготовления
Для объяснения применения согласно изобретению ниже даны различные примеры по изготовлению предпочтительных фармацевтических препаратов. Примеры даны только для наглядности, а не для ограничения изобретения.
Пример 1
Изготовление таблеток с энтеросомобильным покрытием, содержащих 100,0 мг соли монометилфумарата Са, которое соответствует 78 мг фумаровой кислоты
Принимая необходимые меры предосторожности (дыхательная маска, перчатки, защитная одежда, и т.д.), 10 кг соли монометилфумарата Ca измельчены, тщательно смешаны и гомогенизированы посредством сита 800. Затем изготовлена смесь инертного наполнителя следующего состава: 21 кг производных крахмала (STA-RX 1500®), 2 кг микрокристаллической целлюлозы (Avicel PH 101®), 0,6 кг поливинилпирролидона (PVP, Kollidon® 25), 4 кг Primogel®, 0,3 кг коллоидной кремниевой кислоты (Aerosil®).
Активный ингредиент добавлен ко всей порошковой смеси, смешан, гомогенизирован при помощи сита 200 и обычным способом переработан с 2% водным раствором поливинилпирролидона (PVP, Kollidon® 25) в связующие гранулы, и затем смешан с внешней фазой в сухом состоянии. Последняя состоит из 2 кг так называемого комплекса FST, содержащего 80% талька, 10% кремниевой кислоты и 10% магния стеарата.
После этого смесь спрессована обычным способом в выпуклые таблетки с весом 400 мг и диаметром 10,0 мм. Вместо этих классических способов прессования для изготовления таблеток могут также быть применены другие способы, такие как прямое прессование или твердые дисперсии согласно способу плавления и способу вихревого напыления.
Энтеросолюбильное покрытие:
Раствор 2,250 кг гидроксипропилметилцеллюлозы фталата (НРМСР, Pharmacoat HP® 50) растворен в смешанном растворителе, состоящем из 2,50 л из деминерализованной воды, 13 л из ацетона Ph. Helv. VII и 13 л этанола (94% по массе), и затем к раствору добавлено 0,240 кг касторового масла (Ph. Eur. II). Раствор наносится или распыляется частями на сердцевины таблеток в дражировочном котле обычным способом.
После соответствующего высыхания наносится пленочное покрытие. Указанное покрытие состоит из раствора Eudragit® E 12,5%, 4,8 кг талька Ph. Eur. II 0,34 кг, оксида титана (VI) Cronus RN 56® 0,52 кг, цветного лака ZLT-2 синего (Siegle) 0,21 кг, и полиэтиленгликоля 6000 Ph. Helv. VII 0,12 кг в смешанном растворителе из 8,2 кг 2-пропанола Ph. Helv. VII, 0,06 кг глицерина триацетата (Triacetin®) и 0,2 кг деминерализованной воды. Гомогенное распределение в дражировочном котле или псевдоожиженном слое, сопровождается высыханием и полированием обычным способом.
Пример 2
Изготовление капсул с энтеросомобильным покрытием, содержащих 86,5 мг соли моноэтилфумарата Са и 110,0 мг диметилфумарата, которые соответствуют общему количеству фумаровой кислоты 150 мг
Принимая необходимые меры предосторожности (дыхательная маска, перчатки, защитная одежда и т.д.), 8,65 кг соли моноэтилфумарата Са и 11 кг диметилфумарата тщательно смешаны со смесью, состоящей из 15 кг крахмала, 6 кг лактозы Ph. Helv. VII, 2 кг микрокристаллической целлюлозы (Avicel®), 1 кг поливинилпирролидона (Kollidon® 25) и 4 кг Primogel®, и гомогенизированы с помощью сита 800.
Вместе с 2% водным раствором поливинилпирролидона (Kollidon® 25) вся порошковая смесь переработана обычным способом в связующий гранулят и смешана с внешней фазой в высушенном состоянии. Указанная внешняя фаза состоит из 0,35 кг коллоидной кремниевой кислоты (Aerosil®), 0,5 кг стеарата магния и 1,5 кг талька Ph. Helv. VII. Затем гомогенная смесь разлита на части по 500,0 мг в подходящие капсулы, которые затем предоставлены с энтеросомобильным (устойчивым к кислоте желудочного сока) покрытием, состоящим из гидроксипропилэтилцеллюлозы фталата и касторового масла как смягчающего агента обычным образом.
Пример 3
Изготовление энтеральных микротаблеток в капсулах, содержащих 87,0 мг соли моноэтилфумарата Са, 120 мг диметилфумарата, 5,0 мг соли моноэтилфумарата Mg и 3,0 мг соли моноэтилфумарата Zn, которые соответствуют общему количеству фумаровой кислоты 164 мг (таблетки "forte")
Принимая необходимые меры предосторожности (дыхательная маска, перчатки, защитная одежда и т.д.), 8,7 кг соли моноэтилфумарата Са, 12 кг диметилфумарата, 0,5 кг соли моноэтилфумарата Mg и 0,3 кг соли моноэтилфумарата Zn измельчены, тщательно смешаны и гомогенизированы с помощью решета 800. Изготовлена смесь инертного наполнителя следующего состава: 18 кг производных крахмала (STA-RX 1500), 0,3 кг микрокристаллической целлюлозы (Avicel PH 101), 0,75 кг PVP (Kollidon 120), 4 кг Primogel, 0,25 кг коллоидной кремниевой кислоты (Aerosil). Вся порошковая смесь добавлена к смеси активного ингредиента, гомогенизирована с помощью сита 200 и переработана обычным способом 2% водным раствором поливинилпирролидона (Kollidon K25) для получения связующего гранулята и смешанного в сухом состоянии с внешней фазой, которая состоит из 0,5 кг магния стеарата и 1,5 кг талька. Затем порошковая смесь спрессована обычным способом в выпуклые микротаблетки с массой брутто 10,0 мг и диаметром 2,0 мм.
Энтеросомобильное (устойчивое к кислоте желудочного сока) покрытие нанесено в аппарате флюодизированного слоя. Чтобы достичь резистентности к кислоте желудочного сока, части раствора 2,250 кг гидроксипропилметилцеллюлозы фталата (HPMCP, Pharmacoat HP 50) растворены в смеси следующих растворителей: ацетон 13 л, этанол 94 % по массе денатурированный с 2% кетоном 13,5 л и деминерализованная вода 2,5 л. 0,240 кг касторового масла добавлены как смягчающий агент к готовому раствору и нанесены по частям на сердцевины таблеток обычным способом.
Пленочная оболочка: после окончания высыхания, в том же самом аппарате затем нанесена как пленочная оболочка суспензия следующего состава: тальк 0,340 кг, оксид титана (VI) Cronus RN 56 0,4 кг, цветной лак L красный лак 86837 0,324 кг, Eudragit E 12,5% 4,8 кг и полиэтиленгликоль 6000 рН 11 XI 0,12 кг в смеси растворителя следующего состава: 2-пропанол 8,17 кг, деминерализованная вода 0,2 кг и глицерина триацетат (Triacetin) 0,6 кг.
Микротаблетки, устойчивые к кислоте желудочного сока, проанализированы относительно их ингредиентов и затем помещены в твердые желатиновые капсулы в соответствующем весе нетто и запечатаны.
Пример 4
Изготовление энтеральных микротаблеток в капсулах, содержащих 120,0 мг диметилфумарата, который соответствует 96 мг фумаровой кислоты
Принимая необходимые меры предосторожности (дыхательная маска, перчатки, защитная одежда и т.д.), 12 кг диметилфумарата измельчены и гомогенизированы с помощью сита 800. Изготовлена смесь инертного наполнителя следующего состава: 17,5 кг производного крахмала (STA-RX® 1500), 0,30 кг микрокристаллической целлюлозы (Avicel® PH 101), 0,75 кг PVP (Kollidon® 120), 4 кг Primogel®, 0,25 кг коллоидной кремниевой кислоты (Aerosil®). Вся порошковая смесь добавлена к смеси активного ингредиента, смешана, гомогенизирована с помощью сита 200, переработана обычным способом с 2% водным раствором поливинилпирролидона (Kollidon® K25) для получения связующего гранулята и смешана в сухом состоянии с внешней фазой, которая состоит из 0,5 кг Mg стеарата и 1,5 кг талька.
Затем порошковая смесь спрессована обычным способом в выпуклые микротаблетки с массой брутто 10,0 мг и диаметром 2,0 мм.
Для достижения устойчивости к кислоте желудочного сока части раствора 2,25 кг гидроксипропилметилцеллюлозы фталата (HPMCP, Pharmacoat® HP 50), например, растворяются в смеси следующих растворителей: ацетон 13 л, этанол (94% по массе, денатурированный с 2% кетоном) 13,5 л и деминерализованная вода 1,5 л. Касторовое масло (0,24 кг) добавлено как смягчающий агент к готовому раствору и нанесено по частям на сердцевины таблеток обычным способом.
После окончания высыхания в том же самом аппарате затем нанесена как пленочная оболочка суспензия следующего состава: тальк 0,34 кг, оксид титана (VI) Cronus RN 56 0,4 кг, цветной лак L красный лак 86837 0,324 кг, Eudragit E 12,5% 4,8 кг и полиэтиленгликоль 6000 рН 11 XI 0,12 кг в смеси растворителя следующего состава: 2-пропанол 8,17 кг, деминерализованная вода 0,2 кг и глицерина триацетат (Triacetin) 0,6 кг.
Устойчивые к кислоте желудочного сока микротаблетки проанализированы относительно их ингредиентов и затем помещены в твердые желатиновые капсулы в соответствующем весе нетто и запечатаны.
Пример 5
Подготовка микротаблеток с энтеросомобильным покрытием в капсулах, содержащих 120,0 мг диглициндиамида фумаровой кислоты, который соответствует 96 мг фумаровой кислоты
12 кг диглициндиамида фумаровой кислоты измельчены и гомогенизированы, как обозначено выше. Изготовлена смесь инертного наполнителя следующего состава: 23,2 кг микрокристаллической целлюлозы (Avicel® PH 200), 3 кг натрия кроскармелозы (AC-Di-SOL-SD-711), 2,5 кг талька, 0,1 кг ангидрида кремниевой кислоты (Aerosil® 200) и 1 кг Mg стеарата. Вся порошковая смесь добавлена к смеси активного ингредиента и гомогенно смешана. Затем порошковая смесь спрессована прямым прессованием в выпуклые микротаблетки с массой брутто 10,0 мг и диаметром 2,0 мм.
Впоследствии изготовлен раствор 0,94 кг Eudragit® в изопропаноле, который дополнительно содержит 0,07 кг дибутилфталата. Этот раствор распылен на сердцевины таблеток. Затем изготовлена и распылена на сердцевины дисперсия 17,32 кг Eudragit® L D-55 и смеси 2,8 кг микроталька, 2 кг Macrogol 6000 и 0,07 кг Dimeticon в воде.
Впоследствии энтеральные микротаблетки проанализированы относительно их ингредиентов и помещены в твердые желатиновые капсулы в соответствующем весе нетто и запечатаны.
Пример 6
Изготовление микротаблеток с энтеросомобильным покрытием в капсулах, содержащих 60,0 мг r-1, t-2, с-3, t-4-тетракис (метоксикарбонил)циклобутана и 30,0 мг r-1, t-2, c-3, t-4, c-5, t-6-гекса (метоксикарбонил)циклогексана
6,0 кг r-1, t-2, c-3, t-4-тетракис (метоксикарбонил)циклобутана и 3,0 кг r-1, t-2, c-3, t-4, с-5, t-6-гекса (метоксикарбонил)циклогексана измельчены, тщательно смешаны и гомогенизированы с помощью сита 800. Изготовлена смесь инертного наполнителя следующего состава: 18 кг производных крахмала (STA-RX 1500®), 0,30 кг микрокристаллической целлюлозы (Avicel PH 101), 0,75 кг PVP (Kollidon 120), 4,00 кг Primogel, 0,25 кг коллоидной кремниевой кислоты (Аэросил). Активный ингредиент добавлен ко всей порошковой смеси, гомогенизирован с помощью сита 200 и переработан с 2% водным раствором поливинилпирролидона (Kollidon K25) обычным способом в связующие гранулы, и затем смешан с внешней фазой в сухом состоянии. Последняя состоит из 0,50 кг магния стеарата и 1,50 кг талька. После этого порошковая смесь спрессована обычным способом в выпуклые микротаблетки с массой брутто 10,0 мг и диаметром 2,0 мм.
Энтеросомобильное (устойчивое к кислоте желудочного сока) покрытие отливают на сердцевины таблеток в классическом дражировочном котле. Для достижения устойчивости к кислоте желудочного сока части раствора 2,250 кг гидроксипропилметилцеллюлозы фталата (НРМСР, Pharmacoat HP 50) растворены в смеси следующих растворителей: ацетон 13,00 л, этанол 94% по массе денатурированный с 2% кетоном 13,50 л и деминерализованная вода 2,50 л. 0,240 кг касторового масла добавлены как смягчающий агент к готовому раствору и нанесены по частям на сердцевины таблеток обычным способом.
Пленочная оболочка: после окончания высыхания в том же самом приборе как пленочная оболочка нанесена суспензия следующего состава: тальк 0,340 кг, оксид титана (VI) Cronus PvN 56 0,400 кг, цветной лак L красный лак 86837 0,324 кг, Eudragit E 12,5% 4,800 кг и полиэтиленгликоль 6000 рН 11 XI 0,120 кг в смеси растворителя следующего состава: 2-пропанол 8,170 кг, деминерализованная вода 0,200 кг и глицерина триацетат (Triacetin) 0,600 кг.
Впоследствии энтеральные микротаблетки проанализированы относительно их активных ингредиентов и помещены в твердые капсулы желатина в соответствующем весе нетто и запечатаны.
Пример 7
Изготовление суспензии для парентерального применения, содержащей 60,0 мг r-1, t-2, с-3, t-4-тетракис (метоксикарбонил)циклобутана и 30,0 мг r-1, t-2, с-3, t-4, с-5, t-6-гекса (метоксикарбонил)циклогексана.
Вышеупомянутые ингредиенты переработаны в суспензию для парентерального введения, применяя стандартные технологии.
Примеры применения
Пример A
In vivo данные по лечению сердечной недостаточности с DMF, применяя крысиную модель
Эффекты диметилфумарата были исследованы в настоящем эксперименте, применяя модель острой ишемии и реперфузии на крысе. С этой целью здоровые мужские особи крыс были разделены на три группы по 17 животных в каждой. В тестах ишемия вызывалась посредством окклюзии артерии на обнаженном сердце в течение 45 минут, и впоследствии реперфузия осуществлялась в течение 120 минут. В итоге, инфаркт миокарда был вызван посредством реокклюзии, и область риска была определена посредством окрашивания фталоцианиновым синим.
Введение исследуемой субстанции было осуществлено вв в начале первой окклюзии. Контрольная группа получала 0,02% ДМСО (0,5 мл/кг массы тела), группа DMF получала 10 мг диметилфумарата в 0,02% ДМСО (0,5 мл/кг массы тела). Во второй группе животные были предварительно ишемизированы (2 раза по 5 минут каждая ишемия и реперфузия).
Результаты представлены на фиг.1. Очевидно, и диметилфумарат (DMF), и предварительная ишемизация (IPC) ограничивали в наших экспериментах размер зоны инфаркта до статистически значимой степени, область риска была аналогичной во всех 3 группах. Таким образом, данные доказывают, что примененный диметилфумарат может значительно редуцировать размер зоны инфаркта и, таким образом, предотвратить сердечную недостаточность.
Пример B
Ингибирование PDGF-индуцированного поглощения тимидина
Успешное лечение астмы включает три различных пути: (1) редуцированное высвобождение медиаторов воспаления в аллергических реакциях, (2) ингибирование Т-лимфоцитарной инвазии и (3) ингибирование пролиферации мезенхимальных клеток. Доказано, что глюкокортикоиды, которые являются методом выбора при астме, ингибируют пролиферацию мезенхимальных клеток. Этот тест может таким образом быть применен для проверки других возможных активных субстанций для лечения астмы.
BSM (бронхиальная гладкая мышца) клетки культивированы на RPMI, 0,3% альбумине и 0,1% ДМСО при 37°C в присутствии 0, 1, 5, 10 и 20 нг/мл PDGF с 10-5 М диметилфумарата и без него.
После заданного периода времени к питательной среде было добавлено 5μCi 3H-тимидина, и инкубация была продолжена последующие 24 часа. Инкорпорирование было, наконец, остановлено с помощью центрифугирования, удаления супернатанта, промывания и лизиса клеток. Инкорпорирование 3H-тимидина было измерено определением радиоактивности в лизатах в устройстве жидкой сцинтилляции по сравнению с контролем. Результаты показаны на фиг. 2 как процентные значения по сравнению с контролем (100 %). Добавление PDGF очевидно увеличивает инкорпорирование 3H-тимидина и, таким образом, клеточную пролиферацию, тогда как это увеличение значительно редуцировано при добавлении диметилфумарата.
Пример C
Бронхиальные гладкомышечные клетки выращивались в 96-луночных планшетах, пока они не достигли 60-70% конфлюентности. Затем клетки подвергались голоданию 48 часов в бессывороточной RPMI среде, содержащей 0,3% альбумина. За один час до стимуляции клеточной пролиферации с 10 нг/мл PDGF клетки обрабатывались (а) 10-5 М DMF, (b) 10-8 М дексаметазона (dexa), или (с) 10-5 М DMF и 10-8 М dexa. В качестве контроля применялись необработанные клетки (только буферные). Клетки обрабатывались 36 часов, после чего в течение последующих 8 часов было добавлено 5μCi 3H-тимидина. Клетки были лизированы, инкорпорированный в ДНК 3H-тимидин связан с фильтрующими мембранами и инкорпорированный cpm измерен в устройстве жидкой сцинтилляции. Результаты показаны на фиг.3 в процентном содержании от контроля (100%) и сравнены с PDGF индуцированной пролиферацией.
При обработке клеток только dexa (10-8 М), который является терапевтически релевантной дозой, клеточная пролиферация была редуцирована приблизительно до 117±11%. Сопоставимая редукция наблюдалась с 10-5 М DMF (116±4%). Комбинированное применение DMF и dexa в этих концентрациях привело к синергическому уменьшению клеточной пролиферации до почти базового уровня (95±11%). Эти результаты показывают, что DMF может быть полезным в лечении астмы самостоятельно, а также в комбинации обычно с дексаметазоном или глюкокортикоидами.
В особо предпочтительном варианте осуществления для лечения астмы и хронических обструктивных болезней легких подобное лечение представлено, таким образом, в комбинации с глюкокортикоидом. Применение может быть в одном дозирующем устройстве или в отдельных дозирующих устройствах. Применение может также быть параллельным или последовательным. Предпочтительно глюкокортикоид отобран из группы, состоящей из дексаметазона, кортизона, гидрокортизона, преднизолона, преднизона, метилпреднизолона, флуокортолона, триамцинолона, бетаметазона, беклометазона, будесонида, флунизонида, флутиказона и их фармацевтически приемлемых солей и производных. Наиболее предпочтительно глюкокортикоид - это дексаметазон.
Пример D
Dahl-крысы, которые чувствительны к солям, были подвергнуты ежедневному применению варьирующих доз DMF и посажены на высокосолевую диету. После 8 недель лечения были измерены эндодиастолические диаметры левого желудочка у тестовой и контрольной групп эхокардиографическим анализом. Измеренные группы были: контрольная (0 мг DMF; n = 9); группа 1 (2 x 5 мг DMF / кг/d; n = 9) и группа 2 (2 x 15 мг DMF / кг/d; n = 11).
В эхокардиографическом анализе DMF предотвращал дилатацию левого желудочка после 8 недель высокосолевой диеты в дозозависимом характере. Специфично, в DMF группах внутренний диаметр левого желудочка оставался той же самой величины, как в базовой (см. фиг.4). В отличие от этого животные в контрольной группе показали увеличенный левый желудочек, показывая дилатацию левого желудочка. Важно, дилатация левого желудочка обозначает переход от компенсированной гипертрофии к декомпенсированной сердечной недостаточности. Следовательно, DMF задерживает переход к сердечной декомпенсации и, таким образом, предотвращает инфаркты миокарда.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ, ИНФАРКТА МИОКАРДА И СТЕНОКАРДИИ | 2007 |
|
RU2459621C2 |
| ПРОИЗВОДНЫЕ ФУМАРОВОЙ КИСЛОТЫ В КАЧЕСТВЕ ИНГИБИТОРА NF-kappaB | 2002 |
|
RU2282440C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2218918C1 |
| ПРИМЕНЕНИЕ КИСЛЫХ АЛКИЛФУМАРАТОВ ДЛЯ ЛЕЧЕНИЯ ПСОРИАЗА, ПСОРИАТИЧЕСКОГО АРТРИТА, НЕЙРОДЕРМИТА И РЕГИОНАЛЬНОГО ЭНТЕРИТА КРОНА | 1998 |
|
RU2197233C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ В ТРАНСПЛАНТАЦИОННОЙ МЕДИЦИНЕ | 1999 |
|
RU2210364C2 |
| МИКРОТАБЛЕТКИ НА ОСНОВЕ ФУМАРОВОЙ КИСЛОТЫ | 1999 |
|
RU2210366C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ | 1998 |
|
RU2197963C2 |
| Лекарственная форма в виде капсулы, содержащая таблетки с диметилфурмаратом | 2019 |
|
RU2742745C1 |
| АМИДЫ ФУМАРОВОЙ КИСЛОТЫ | 2002 |
|
RU2290946C2 |
| ЭНТЕРОСОЛЮБИЛЬНАЯ ТАБЛЕТКА, СОДЕРЖАЩАЯ ДИМЕТИЛФУМАРАТ | 2020 |
|
RU2786364C1 |
Предложено применение производных фумаровой кислоты, выбранных из группы, состоящей из диалкилфумаратов, моноалкилгидрофумаратов, солей моноалкиловых эфиров фумаровой кислоты, моноамидов фумаровой кислоты, диамидов фумаровой кислоты, моноалкилмоноамидофумаратов, карбоциклических олигомеров этих соединений и их смесей, для изготовления фармацевтического препарата для лечения астмы и хронических обструктивных болезней легких, в особенности астмы, вызванной аллергиями, инфекциями, анальгетиками, условиями труда или физическим усилием, смешанных форм астмы или asthma cardiale. Показано, что диметилфумарат снижал увеличенную пролиферацию клеток гладкой мышцы бронхов. 11 з.п. ф-лы, 4 ил.
a) одного или более диалкиловых эфиров фумаровой кислоты формулы I
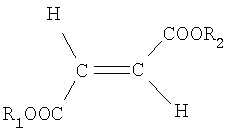
где R1 и R2, которые могут быть одинаковыми или различными, независимо представляют линейный, разветвленный или циклический, насыщенный или ненасыщенный С1-24, алкильный радикал или С5-20 арильный радикал, и где указанные радикалы могут быть произвольно замещены галогеном (F, Cl, Br, I), гидрокси, C1-4 алкокси, С1-4алкил, нитро- или цианогруппой,
b) одного или большего числа моноалкиловых эфиров фумаровой кислоты формулы II
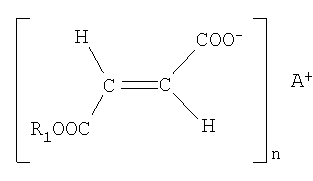
где R1 представляет линейный, разветвленный или циклический, насыщенный или ненасыщенный С1-4 алкильный радикал или С5-20 арильный радикал; А представляет водород, катион щелочного или щелочно-земельного металла или физиологически приемлемый катион переходного металла, предпочтительно выбранный из Li+, Na+, K+, Mg2+, Ca2+, Zn2+, Fe2+, Mn2+, и n равно 1 или 2 и соответствует валентности А,
с) одного или более амидов общей формулы III
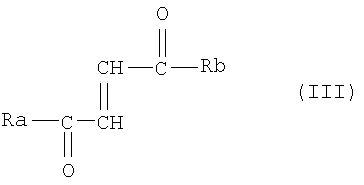
где Ra представляет OR3 или D- или L-аминокислотный радикал -NH-CHR4-СООН, соединенный амидной связью, где R3 - это прямоцепочечный или разветвленный, необязательно замещенный С1-24 алкильный радикал, и R4 - это боковая цепь природной или синтетической аминокислоты; и
Rb представляет D- или L-аминокислотный радикал -NH-CHR5-COOH, соединенный амидной связью, где R5 это боковая цепь природной или синтетической аминокислоты; и/или
d) карбоциклических олигомеров, состоящих из 2 звеньев фумаровой кислоты, в виде повторяющихся звеньев, где звенья фумаровой кислоты получены из мономеров, выбранных из диалкилфумаратов.
| (-)-1-( @ -Амино- @ -цианофенил)-2-изопропиламиноэтанол или его физиологически переносимая кислотно-аддитивная соль, обладающие @ -миметическим и улучшающим функции животных действиями | 1991 |
|
RU2002737C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| DE 10217314 A1, 13.11.2003 | |||
| КАРДИОЛОГИЯ В ТАБЛИЦАХ И СХЕМАХ | |||
| / Под ред | |||
| М.Фрида и С.Грайнс | |||
| - М.: Практика, 1996, с.85-87, 428 | |||
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ В ТРАНСПЛАНТАЦИОННОЙ МЕДИЦИНЕ | 1999 |
|
RU2210364C2 |
| Способ определения теплофизических характеристик плоских образцов материалов и устройство для его осуществления | 1986 |
|
SU1357813A1 |
| DE 19853487 A1, 25.05.2000 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| DE 19839566 A1, 09.03.2000 | |||
| US 6509376 B1, 21.01.2003. | |||
Авторы
Даты
2007-12-27—Публикация
2004-09-03—Подача