Данное изобретение относится к новой стабильной фармацевтической композиции, содержащей фактор VIII.
Фактор VIII является хорошо известным белком плазмы, который является необходимым для процесса свертывания крови и, следовательно, является применимым в лечении гемофилии.
Для лечения гемофилии использовали или предлагали для использования несколько форм фактора VIII в качестве действующих (активных) веществ для лечения гемофилии. Они включают фактор VIII человека (такой как активные ингредиенты Humate® Р, Monoclate® Р, Immunate® или Hemofil® М), рекомбинантный фактор VIII человека (такой как rVIII SQ, который описан в WO 91/09122 (активный ингредиент ReFacto®), или активные ингредиенты Kogenate® или Recombinate®), свиной фактор VIII (который является активным началом продукта Hyate:C®, продаваемым Ipsen, Inc., USA) или рекомбинантный свиной фактор VIII (например, модифицированная не содержащая В-домена форма свиного фактора VIII, подобная описанной в WO 01/68109 и идентифицированной как "POL1212", или белок SEQ ID NO:38 той же самой заявки на патент).
Стабильность готовой формы всегда была проблемой для фармацевтической промышленности, имеющей дело с фармацевтическими композициями фактора VIII.
Для стабилизации этих готовых форм часто использовали альбумин. Однако несмотря на его представляющее интерес стабилизирующее действие альбумин имеет недостаток, заключающийся в том, что он является дорогим, а также представляет опасность, заключающуюся в том, что он может нести инфекционные частицы, такие как прионы. По этим причинам фармацевтическая промышленность в последние годы стремится заменять альбумин другими стабилизирующими агентами в фармацевтических композициях фактора VIII.
Несколько стабильных фармацевтических композиций, не содержащих альбумин, уже известны специалистам с квалификацией в данной области. Например:
- Патент США № 5565427 описывает стабилизированный не содержащий альбумина раствор с активностью фактора VIII:С, содержащий фактор VIII:С, аминокислоту или одну из ее солей или гомологов и детергент (такой как полисорбат 80 или Твин® 80) или органический полимер (такой как полиэтиленгликоль).
- Патент США № 5605884 описывает стабильную композицию фактора VIII, содержащую фактор VIII и среду высокой ионной силы, которая предпочтительно состоит из водного раствора, содержащего смесь хлорида натрия, хлорида кальция и гистидин в качестве буферного иона.
- Патенты США с номерами 5763401 и 5874408, оба, описывают стабильную не содержащую альбумина композицию рекомбинантного фактора VIII, содержащую рекомбинантный фактор VIII, глицин, гистидин, сахарозу, хлорид натрия и хлорид кальция.
- Патент № 5962650 описывает стабильную не содержащую альбумина композицию рекомбинантного фактора VIII, которая состоит из водного раствора с пониженной концентрацией кислорода, содержащего рекомбинантный фактор VIII, соль кальция, такую как хлорид кальция, и предпочтительно антиоксидант, неионогенный сурфактант (поверхностно-активное вещество), хлорид натрия или калия, аминокислоту и моно- или дисахарид.
- Патент США № 5972885 относится к фармацевтической готовой форме для подкожного, внутримышечного или интрадермального введения, которая содержит высококонцентрированный (по меньшей мере 1000 МЕ/мл) рекомбинантный фактор VIII и, предпочтительно, один или несколько компонентов, выбранных из группы, состоящей (в частности) из хлорида натрия или калия, хлорида кальция, неионогенного сурфактанта (например, полоксамера), моно- или дисахарида (предпочтительно сахарозы) и антиоксидантов (например, лимонной кислоты).
- РСТ-заявка на патент WO 89/09784 описывает способ получения термостабильного концентрата фактора VIII, который включает гель-фильтрацию буферного раствора, содержащего указанный фактор VIII и трис(гидроксиметил)метиламин, тринатрийцитрат, хлорид натрия, сахарозу и хлорид натрия, с последующей лиофилизацией полученного концентрата. Приготовленный таким образом фактор VIII способен выдерживать температуры до 80оС в течение до 72 часов.
- WO 94/07510 описывает композицию фактора VIII, которая стабилизирована неионогенным сурфактантом (например, полоксамером, таким как полисорбат 80). Такая композиция может также содержать один или несколько элементов, выбранных из группы, состоящей (в частности) из хлорида натрия или калия, хлорида кальция, аминокислоты, моно- или дисахарида, такого как сахароза.
Неожиданно было обнаружено, что твердая фармацевтическая композиция, получаемая лиофилизацией раствора, не содержащего аминокислот, содержащая следующие компоненты:
(а) фактор VIII;
(b) сурфактант (поверхностно-активное вещество);
(с) хлорид кальция;
(d) сахарозу;
(е) хлорид натрия;
(f) тринатрийцитрат и
(g) буфер, не содержащий аминокислот;
причем указанная фармацевтическая композиция имеет рН 6-8 перед лиофилизацией и после восстановления в воде для инъекции, также обнаруживает стабильность на протяжении времени.
Под фактором VIII в данной заявке имеют в виду фактор VIII человека, рекомбинантный фактор VIII человека, свиной фактор VIII, рекомбинантный свиной фактор VIII или в более общем виде любой другой рекомбинантный фактор VIII, который может быть использован для их замены.
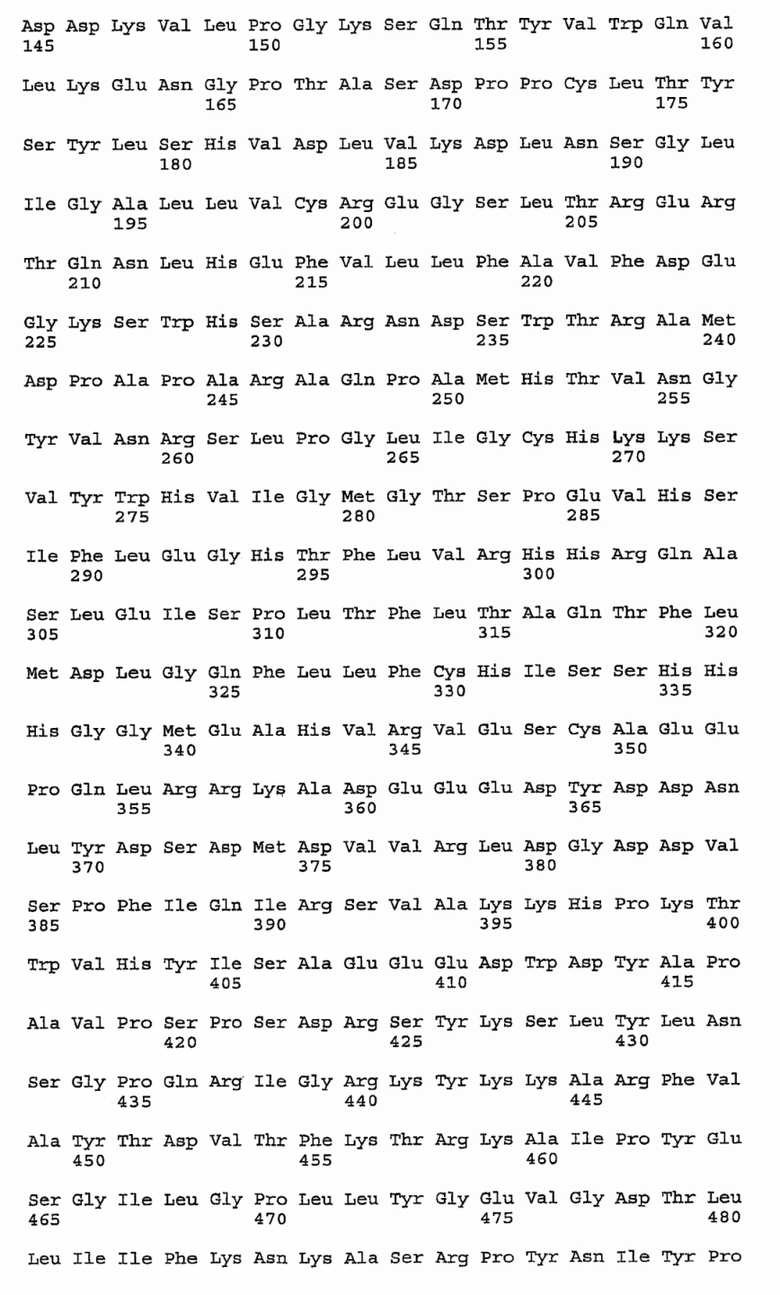
Предпочтительно, фактор VIII, содержащийся в композициях согласно данному изобретению, будет выбран из свиного фактора VIII или рекомбинантного свиного фактора VIII. Еще более предпочтительно, фактор VIII, содержащийся в композициях согласно данному изобретению, будет рекомбинантным свиным фактором VIII, в частности не содержащей В-домена формой свиного фактора VIII, такой как форма, описанная в заявке на патент WO 01/68109, т.е. модифицированным свиным фактором VIII, имеющим аминокислотную последовательность SEQ ID NO:1, приведенную далее:
SEQ ID NO:1:




Предпочтительно, сурфактантом будет неионогенный сурфактант. Неионогенные сурфактанты включают, в частности, полисорбаты и блок-сополимеры, такие как полоксамеры (т.е. сополимеры полиэтилена и пропиленгликоля). Согласно предпочтительному варианту данного изобретения, этот сурфактант будет полисорбатом. Более предпочтительно, полисорбат, включенный в композицию в соответствии с данным изобретением, будет иметь среднюю степень полимеризации 20-100 мономерных элементарных звеньев (предпочтительно приблизительно 80) и может быть, например, полисорбатом 80. Предпочтительно также, этот полисорбат должет быть полученным из растений.
Предпочтительно, буфером, не содержащим аминокислот, будет трис(гидроксиметил)метиламин (далее сокращаемый как "трис").
Предпочтительно также, рН этой фармацевтической композиции перед лиофилизацией и после растворения в воде для инъекции будет равен 6,5-7,5 и более предпочтительно приблизительно 7,0.
Предпочтительно, твердая композиция в соответствии с данным изобретением будет такой, что она может быть получена лиофилизацией раствора, не содержащего аминокислот, который имеет:
(а) концентрацию фактора VIII в диапазоне 50-10000 международных единиц на мл для фактора VIII человека или рекомбинантного фактора VIII человека или 50-10000 свиных единиц на мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) концентрацию сурфактанта (поверхностно-активного вещества) в диапазоне от концентрации выше критической мицеллярной концентрации до 1% (об./об.);
(с) концентрацию хлорида кальция в диапазоне 0,5-10 мМ;
(d) концентрацию сахарозы в диапазоне 5-50 мМ;
(е) концентрацию хлорида натрия в диапазоне 0,15-0,5 М;
(f) концентрацию тринатрийцитрата в диапазоне 1-50 мМ и
(g) концентрацию буфера, не содержащего аминокислот, в диапазоне 1-50 мМ.
Для оценки активности в международных единицах фактора VIII продукт должен быть анализирован в сравнении с концентратом-стандартом, таким как стандарт NIBSC 95/608 Соединенного Королевства (UK) (NIBSC обозначает Национальный Институт Биологических Стандартов и Контроля).
Под свиной единицей фактора VIII имеют в виду национальную стандартную единицу Соединенного Королевства, используемую NIBSC Соединенного Королевства. Для оценки активности в единицах свиного фактора VIII испытуемый продукт анализируют в сравнении с национальным свиным стандартом NIBSC 86/514 UK. Что касается рекомбинантного свиного фактора VIII, должно быть понятно, что 1 единица активности рекомбинантного свиного фактора VIII эквивалентна 1 единице активности свиного фактора VIII.
Более предпочтительно, твердая композиция в соответствии с данным изобретением будет такой, что она может быть получена лиофилизацией раствора, не содержащего аминокислот, который имеет по меньшей мере одну из следующих характеристик:
концентрацию фактора VIII в диапазоне 100-5000 международных единиц на мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 100-5000 свиных единиц на мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
концентрацию сурфактанта (поверхностно-активного вещества) в диапазоне 0,002%-0,04% (об./об.);
концентрацию хлорида кальция в диапазоне 1-5 мМ;
концентрацию сахарозы в диапазоне 5-25 мМ;
концентрацию хлорида натрия в диапазоне 0,2-0,4 М;
концентрацию тринатрийцитрата в диапазоне 1-20 мМ или
концентрацию буфера, не содержащего аминокислот, в диапазоне 1-20 мМ.
Еще более предпочтительно, твердая композиция в соответствии с данным изобретением будет такой, что она может быть получена лиофилизацией раствора, не содержащего аминокислот, который имеет по меньшей мере одну из следующих характеристик:
концентрацию фактора VIII в диапазоне 200-2000 международных единиц на мл (и, в частности, приблизительно 1000 международных единиц/мл) для фактора VIII человека или рекомбинантного фактора VIII человека или 200-2000 свиных единиц на мл (и, в частности, приблизительно 1000 свиных единиц на мл) для свиного фактора VIII или рекомбинантного свиного фактора VIII;
концентрацию сурфактанта (поверхностно-активного вещества) в диапазоне 0,002%-0,02%(об./об.) (и, в частности, приблизительно 0,01% об./об.);
концентрацию хлорида кальция в диапазоне 1-3 мМ (и, в частности, приблизительно 2 мМ);
концентрацию сахарозы в диапазоне 5-15 мМ (и, в частности, приблизительно 11,7 мМ);
концентрацию хлорида натрия в диапазоне 0,25-0,35 М (и, в частности, приблизительно 0,3 М);
концентрацию тринатрийцитрата в диапазоне 1-20 мМ (и, в частности, приблизительно 10 мМ) или
концентрацию буфера, не содержащего аминокислот, в диапазоне 5-15 мМ (и, в частности, приблизительно 10 мМ).
Твердые композиции фактора VIII, согласно данному изобретению, могут быть получены лиофилизацией раствора, содержащего подходящие количества идентифицированных выше компонентов, таких как (а), (b), (c), (d), (e), (f) и (g), в соответствии со стандартными процедурами приготовления (стерильные условия и т.д.).
Стабильность композиции на протяжении определенного периода времени может быть определена, например, способом, описанным здесь в части, озаглавленной "Аналитические способы", или любым другим способом, найденным как подходящий способ, специалистом с квалификацией в данной области.
Композиция данного изобретения считается стабильной в течение определенного периода времени, если 70-130% (и предпочтительно 80-120%) исходной активности фактора VIII, оцениваемой с использованием способа, описанного в части, озаглавленной "Аналитические способы", приведенной ниже, поддерживается на протяжении указанного периода времени.
Предпочтительно, твердые композиции данного изобретения будут стабильными в течение по меньшей мере 6 или 12 месяцев при хранении при температуре 2-8°С. Более предпочтительно, они будут стабильными в течение по меньшей мере 6 или 12 месяцев при хранении при температуре 30-32°С.
Твердые композиции фактора VIII данного изобретения могут быть разведены стерильной водой, необязательно содержащей хлорид натрия, и затем полученная жидкая фармацевтическая композиция может инъецироваться непосредственно пациенту, нуждающемуся в этом. Полученная жидкая фармацевтическая композиция, а также жидкие фармацевтические композиции, получаемые разведением твердых композиций фактора VIII, в соответствии с данным изобретением, стерильной водой, содержащей хлорид натрия, являются также частью этого изобретения.
Способы лечения гемофилии, предусматривающие введение жидкой композиции данного изобретения пациенту, нуждающемуся в этом, находятся также в рамках данного изобретения. Способом введения жидких композиций данного изобретения будет предпочтительно внутривенное введение. Доза композиции данного изобретения, которая должна вводиться, будет определяться лечащим врачом или ветеринаром с учетом тяжести заболевания для каждого пациента.
Термин "приблизительно" относится к интервалу около рассматриваемой величины. В применении к данной патентной заявке, "приблизительно Х" означает интервал от Х минус 10% Х до Х плюс 10% Х, предпочтительно интервал от Х минус 5% Х до Х плюс 5% Х.
Если нет других указаний, все технические и научные термины, используемые здесь, имеют то же самое значение, какое обычно понимается специалистом со средней квалификацией в области, к которой относится данное изобретение. Подобным образом, все публикации, заявки на патенты, все патенты и все другие ссылки, упоминаемые здесь, включены в качестве ссылки.
Следующие примеры представлены для иллюстрации приведенного выше описания и ни в коем случае не должны рассматриваться как ограничение объема данного изобретения.
ПРИМЕРЫ
Пример 1
Готовят раствор в 0,5 мл стерильной воды, содержащий следующие компоненты:
Эту смесь лиофилизируют в стерилизованном флаконе, который затем герметизируют. Полученную твердую композицию испытывали, и было показано, что она является стабильной при температуре 2-8°С в течение по меньшей мере 18 месяцев и при 30-32°С в течение по меньшей мере шести месяцев при испытании по активности фактора VIII. Не было указания на образование высокомолекулярного компонента, как определено распределительно гель-эксклюзионной ВЖХ (SEC HPLC), или фрагментов, как определено электрофорезом в ДСН-ПААГ.
Полученную лиофилизированную смесь обычно восстанавливают в виде раствора с использованием 1,0 мл стерильной воды перед инъекцией в пациента.
Пример 2
Готовят раствор в 1,0 мл стерильной воды, содержащий следующие компоненты:
Эту смесь лиофилизируют в стерилизованном флаконе, который затем герметизируют.
Полученную лиофилизированную смесь обычно растворяют с использованием 2,0 мл стерильной воды перед инъекцией в пациента.
Пример 3
Готовят раствор в 0,5 мл стерильной воды, содержащий следующие компоненты:
Эту смесь лиофилизируют в стерилизованном флаконе, который затем герметизируют.
Полученную лиофилизированную смесь обычно восстанавливают в виде раствора с использованием 1,0 мл стерильной воды перед инъекцией в пациента.
Аналитические способы
Хромогенный анализ
Активность фактора VIII определяют модифицированным хромогенным анализом (Technochrom FVIII:C Reagent Kit, Technoclone). Образование активированного фактора Х фактором IX стимулируют фактором VIII, который действует в этой реакции в качестве кофактора. Высвобождение п-нитроанилина из этого хромогенного субстрата катализируют активированным фактором Х. Количество п-нитроанилина, которое высвобождается, измеряют фотометрически при 405нм, и этот анализ дает линейную корреляцию между количеством п-нитроанилина и содержанием фактора VIII (FVIII).
SEC HPLC
Растворимые высокомолекулярные компоненты и фрагменты определяли гель-фильтрацией, выполняемой на приборе HPLC (ВЖХ) с использованием предварительно упакованной колонки 0,78×30 см TosoHaas TSK G3000 SWXL с детектором флуоресценции (Waters LC Module 1 plus). Длина волны возбуждения 280 нм и длина волны испускания 340 нм. Оценку результатов выполняли интеграцией площадей пиков.
Анализ с использованием электрофореза в ДСН-ПААГ
Электрофорез в ДСН-ПААГ (электрофорез в полиакриламидном геле с использованием системы электрофореза с применением пластинок (Multiphor II LKB) и преформированных 7,5% гелей (EXCELGEL SDS, Pharmacia) использовали для определения любых продуктов распада молекулы FVIII. Белковые полосы визуализировали окрашиванием Кумасси синим.
Анализ стабильности
Стабильность может анализироваться выполнением вышеописанных анализов в различных временных точках на пробе одной и той же композиции, выдерживаемой при выбранных температурах (которые могут быть температурами около +4°С или +31°С). После того как активность фактора VIII падает более чем на 30%, считают, что данная композиция потеряла ее стабильность.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРЕПАРАТ КОАГУЛЯЦИОННОГО ФАКТОРА VIII, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА В КАЧЕСТВЕ СТАБИЛИЗАТОРА | 1993 |
|
RU2136294C1 |
| СУХАЯ КОМПОЗИЦИЯ ТРАНСГЛУТАМИНАЗЫ | 2009 |
|
RU2616847C2 |
| НОВЫЕ НЕ СОДЕРЖАЩИЕ АЛЬБУМИН СОСТАВЫ ФАКТОРА VIII | 2000 |
|
RU2244556C2 |
| НОВЫЕ ЗАЩИТНЫЕ КОМПОЗИЦИИ ДЛЯ РЕКОМБИНАНТНОГО ФАКТОРА VIII | 2009 |
|
RU2510279C2 |
| НОВЫЙ СТАБИЛИЗАТОР ДЛЯ ФАРМАЦЕВТИЧЕСКИХ БЕЛКОВ | 2011 |
|
RU2571496C2 |
| НОВЫЙ СТАБИЛИЗАТОР ДЛЯ ФАРМАЦЕВТИЧЕСКИХ БЕЛКОВ | 2011 |
|
RU2707090C2 |
| КОНЦЕНТРИРОВАННЫЕ БЕЛКОВЫЕ ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2626512C2 |
| СТАБИЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ, КОТОРЫЕ СОДЕРЖАТ ИНТЕРФЕРОНЫ ГАММА И АЛЬФА В СИНЕРГИЧНЫХ СООТНОШЕНИЯХ | 2006 |
|
RU2403057C2 |
| СОСТАВ ДЛЯ СТАБИЛИЗАЦИИ БЕЛКОВ, КОТОРЫЙ НЕ СОДЕРЖИТ ЭКСЦИПИЕНТЫ ИЗ МЛЕКОПИТАЮЩИХ | 2010 |
|
RU2539388C2 |
| СТАБИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ АНТИТЕЛА К PD-1 И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2016 |
|
RU2731418C2 |
Изобретение относится к медицине, точнее к новой стабильной готовой форме фармацевтической композиции, содержащей фактор VIII. Изобретение является применимым в лечении гемофилии. Изобретение относится к твердой фармацевтической композиции, получаемой лиофилизацией раствора, свободного от аминокислот, содержащей: (а) фактор VIII в концентрации от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека, или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII; (b) сурфактант в концентрации от концентрации выше критической мицеллярной концентрации до 1% (об./об.); (с) хлорид кальция; (d) сахарозу; (е) хлорид натрия; (f) тринатрийцитрат и (g) буфер, свободный от аминокислот в концентрации от 1 до 50 мМ, имеющей значение рН от 6 до 8 перед лиофилизацией и после растворения в воде для инъекции. Изобретение относится также к жидкой фармацевтической композиции, получаемой после растворения указанной стабильной твердой фармацевтической композиции стерильной водой, необязательно содержащей хлорид натрия. Изобретение обеспечивает создание стабильной готовой формы фармацевтической композиции фактора VIII, в которой альбумин заменен другими стабилизирующими агентами. 2 н. и 23 з.п. ф-лы, 3 табл.
(a) фактор VIII в концентрации от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) сурфактант в концентрации выше критической мицеллярной концентрации до 1% об./об.;
(c) хлорид кальция в концентрации от 0,5 до 10 мМ;
(d) сахарозу в концентрации от 5 до 50 мМ;
(e) хлорид натрия в концентрации от 0,15 до 0,5 М;
(f) тринатрийцитрат в концентрации от 1 до 50 мМ и
(g) буфер, свободный от аминокислот в концентрации от 1 до 50 мМ;
имеющая значение рН от 6 до 8 перед лиофилизацией и после растворения в воде для инъекции.
(a) концентрацию фактора VIII в диапазоне от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) концентрацию сурфактанта в диапазоне от концентрации выше критической мицеллярной концентрации до 1% об./об.;
(c) концентрацию хлорида кальция в диапазоне от 0,5 до 10 мМ;
(d) концентрацию сахарозы в диапазоне от 5 до 50 мМ;
(e) концентрацию хлорида натрия в диапазоне от 0,15 до 0,5 М;
(f) концентрацию тринатрийцитрата в диапазоне от 1 до 50 мМ и концентрацию буфера в диапазоне от 1 до 50 мМ.
(а) концентрацию фактора VIII в диапазоне от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) концентрацию сурфактанта в диапазоне от концентрации выше критической мицеллярной концентрации до 1% об./об;
(c) концентрацию хлорида кальция в диапазоне от 0,5 до 10 мМ;
(d) концентрацию сахарозы в диапазоне от 5 до 50 мМ;
(e) концентрацию хлорида натрия в диапазоне от 0,15 до 0,5 М;
(f) концентрацию тринатрийцитрата в диапазоне от 1 до 50 мМ и концентрацию буфера в диапазоне от 1 до 50 мМ.
(a) концентрацию фактора VIII в диапазоне от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) концентрацию сурфактанта в диапазоне от концентрации выше критической мицеллярной концентрации до 1% об./об.;
(c) концентрацию хлорида кальция в диапазоне от 0,5 до 10 мМ;
(d) концентрацию сахарозы в диапазоне от 5 до 50 мМ;
(e) концентрацию хлорида натрия в диапазоне от 0,15 до 0,5 М;
(f) концентрацию тринатрийцитрата в диапазоне от 1 до 50 мМ и концентрацию буфера в диапазоне от 1 до 50 мМ.
(a) концентрацию фактора VIII в диапазоне от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) концентрацию сурфактанта в диапазоне от концентрации выше критической мицеллярной концентрации до 1% об./об.;
(c) концентрацию хлорида кальция в диапазоне от 0,5 до 10 мМ;
(d) концентрацию сахарозы в диапазоне от 5 до 50 мМ;
(e) концентрацию хлорида натрия в диапазоне от 0,15 до 0,5 М;
(f) концентрацию тринатрийцитрата в диапазоне от 1 до 50 мМ и концентрацию буфера в диапазоне от 1 до 50 мМ.
(a) концентрацию фактора VIII в диапазоне от 50 до 10000 международных единиц/мл для фактора VIII человека или рекомбинантного фактора VIII человека или от 50 до 10000 единиц/мл для свиного фактора VIII или рекомбинантного свиного фактора VIII;
(b) концентрацию сурфактанта в диапазоне от концентрации выше критической мицеллярной концентрации до 1% об./об.;
(c) концентрацию хлорида кальция в диапазоне от 0,5 до 10 мМ;
(d) концентрацию сахарозы в диапазоне от 5 до 50 мМ;
(e) концентрацию хлорида натрия в диапазоне от 0,15 до 0,5 М;
(f) концентрацию тринатрийцитрата в диапазоне от 1 до 50 мМ и концентрацию буфера в диапазоне от 1 до 50 мМ.
| И ПЮРЕОБРАЗНЫХ ПИЩЕВЫХ ПРОДУКТОВ | 0 |
|
SU168109A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДСТАВЛЯЮЩАЯ МИКРОЭМУЛЬСИЮ С БИОЛОГИЧЕСКИ АКТИВНЫМ МАКРОМОЛЕКУЛЯРНЫМ МАТЕРИАЛОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1989 |
|
RU2122403C1 |
| RU 2002124123 A, 27.03.2004 | |||
| US 5763401, 09.06.1998 | |||
| WO 9407510, 14.04.1994 | |||
| Устройство для быстродействующей телеграфии | 1935 |
|
SU48635A1 |
| WO 9109122, 27.06.1991. | |||
Авторы
Даты
2008-01-20—Публикация
2003-03-26—Подача