Изобретение относится к новым амидным производным антраниловой кислоты, способам их получения, их применению в способе лечения человека или животного, к их применению индивидуально или в сочетании с одним или несколькими другими фармацевтическими действующими веществами, прежде всего для лечения неопластического заболевания, такого как опухолевое заболевание, ретинопатия и связанная с возрастом дегенерация желтого пятна; к способу лечения такого заболевания у животных, прежде всего у человека, и к применению такого соединения, индивидуально или в сочетании с одним или несколькими другими фармацевтическими действующими веществами для приготовления фармацевтической композиции (лекарственного средства), предназначенной для лечения неопластического заболевания, ретинопатии или связанной с возрастом дегенерации желтого пятна.
Известно, что определенные заболевания связаны с нарушением регуляции ангиогенеза, например, болезни, связанные с неоваскуляризацией глаза, такие как ретинопатии (включая диабетическую ретинопатию), связанная с возрастом дегенерация желтого пятна, псориаз, гемангиобластома, гемангиома, артериосклероз, воспалительные заболевания, такие как ревматоидное или ревматическое воспалительные заболевания, прежде всего артрит, например ревматоидный артрит, или другие хронические воспалительные заболевания, такие как хроническая астма, артериальный или пост-транплантационный атеросклероз, эндометриоз, и прежде всего неопластические заболевания, например, так называемые плотные опухоли и опухоли жидких тканей (такие как лейкозы).
Известно, что в основе механизма, регулирующего рост и дифференциацию сосудистой системы и ее компонентов как в процессе эмбрионального развития, так и при нормальном росте, а также при многочисленных патологических аномалиях и заболеваниях, лежит ангиогенный фактор, известный как "сосудистый эндотелиальный фактор роста" ("Vascular Endothelial Growth Factor") (VEGF), димерный связанный дисульфидным мостиком гликопротеин с молекулярной массой 46 кДа, а также его клеточные рецепторы (см. Breier G. и др. Trends in Cell Biology, 6, 1996, cc.454-456).
Рецепторы VEGF представляют собой трансмембранные тирозинкиназные рецепторы. Известны различные типы рецепторов VEGF, например VEGFR-1, VGEFR-2 и VGEFR-3.
Большое количество опухолей человека, в частности глиомы и карциномы, экспрессируют высокие уровни VEGF и его рецепторов. Это привело к гипотезе о том, что VEGF, вырабатываемый клетками опухоли, может паракринным путем стимулировать рост кровеносных капилляров и пролиферацию эндотелия опухоли и, таким образом, вследствие усиленного кровоснабжения может ускорять рост опухоли. Прямое доказательство роли VEGF как фактора ангиогенеза опухоли in vivo было получено на основе исследований, в которых активность VEGF ингибировали антителами.
Считается, что ангиогенез является абсолютно необходимым для опухолей, максимальный диаметр которых превышает приблизительно 1-2 мм; до этого предела обеспечение опухолевых клеток кислородом и другими питательными веществами может осуществляться путем диффузии.
Три основных механизма играют важную роль в противоопухолевой активности ингибиторов ангиогенеза: 1) ингибирование роста сосудов, в частности, капилляров, в аваскулярных опухолях, которые находятся в состоянии покоя, результатом чего является отсутствие роста опухоли благодаря достигнутому балансу между апоптозом и пролиферацией; 2) предотвращение миграции опухолевых клеток благодаря отсутствию кровотока в направлении к опухолям и от них; 3) ингибирование пролиферации эндотелиальных клеток, что устраняет паракринное стимулирующее рост воздействие, оказываемое на окружающую ткань эндотелиальными клетками, которые в норме выстилают сосуды.
В WO 00/27820 описаны соединения, принадлежащие к классу амидов антраниловой кислоты, которые, как установлено, ингибируют активность тирозинкиназного рецептора VEGF, рост опухолей и зависящую от VEGF пролиферацию клеток.
При создании изобретения неожиданно было установлено, что описанные ниже амиды антраниловой кислоты формулы I обладают ценными фармакологическими свойствами и ингибируют, например, активность тирозинкиназных рецепторов VEGF, рост опухолей и зависящую от VEGF пролиферацию клеток.
Амиды антраниловой кислоты формулы I можно применять, например, для лечения болезней, прежде всего болезней, при лечении и предупреждении которых ингибирование ангиогенеза и/или тирозинкиназного рецептора VEGF оказывает благоприятное действие.
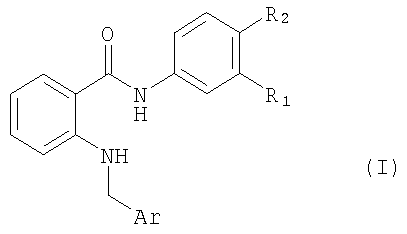
Изобретение относится к амидам антраниловой кислоты формулы I,
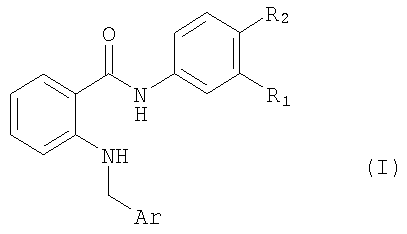
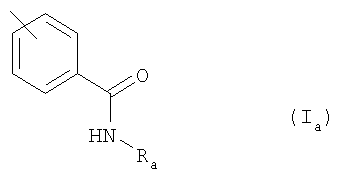
где Ar обозначает подформулу Ia
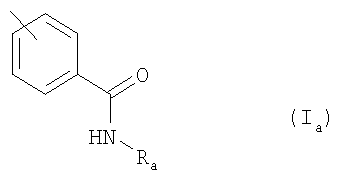
где Ra обозначает Н или (низш.)алкил,
R1 обозначает Н или перфтор(низш.)алкил и
R2 обозначает Н, галоген, С2-С7алкил, С2-С7алкенил или (низш.)алкинил; или
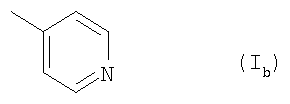
Ar обозначает подформулу 1ь,
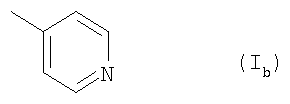
и
R1 обозначает перфтор(низш.)алкил и
R1 обозначает бром, йод, С5-C7алкил, С2-С7алкенил или (низш.)алкинил или
R1 обозначает Н и
R2 обозначает фтор, бром, йод, этил, С5-С7алкил, С2-С7алкенил или (низш.)алкинил,
к их N-оксидам и таутомерам, и к солям указанных амидов антраниловой кислоты, их N-оксидам и таутомерам.
Общие понятия, которые используются выше и ниже в настоящем описании, предпочтительно, если не указано иное, имеют следующие значения.
Приставка "(низш.)" обозначает радикал, имеющий вплоть до 7 атомов углерода, прежде всего вплоть до 4 атомов углерода, причем эти радикалы могут быть либо линейными, либо разветвленными, и могут иметь одно или несколько разветвлений.
Если для соединений, солей и т.п. используется множественная форма, следует понимать, что она обозначает также индивидуальное соединение, соль или т.п.
Любые асимметричные атомы углерода (например, в соединениях формулы I, в которых R9 обозначает (низш.)алкил), могут присутствовать в (R)-, (S)- или в (RS)-конфигурации, предпочтительно в (R)- или (S)-конфигурации. Таким образом, соединения могут находиться в виде смесей изомеров или в виде чистых изомеров, предпочтительно в виде энантиомерно чистых диастереомеров.
Изобретение относится также к возможным таутомерам соединений формулы I.
В предпочтительном варианте осуществления изобретения алкил имеет вплоть до 12 атомов углерода и предпочтительно обозначает (низш.)алкил.
(Низш.)алкил предпочтительно обозначает алкил, имеющий от 1 включительно и до 7 включительно, предпочтительно от 1 включительно и до 4 включительно атомов углерода, и он может быть линейным или разветвленным;
предпочтительно (низш.)алкил обозначает бутил, такой как н-бутил, втор-бутил, изобутил, трет-бутил, пропил, такой как н-пропил или изопропил, этил или предпочтительно метил.
Понятие "перфтор(низш.)алкил" в контексте настоящего описания обозначает (низш.)алкильный радикал, в котором все атомы водорода замещены атомами фтора.
Галоген обозначает прежде всего фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром.
Указанные соли, предпочтительно фармацевтически приемлемые соли, получают, например, в виде кислотно-аддитивных солей, предпочтительно солей соединений формулы I, несущих основный атом азота, с органическими или неорганическими кислотами. Приемлемыми неорганическими кислотами являются, например, галогенводородные кислоты, такие как соляная кислота, серная кислота или фосфорная кислота. Приемлемыми органическими кислотами являются, например, карбоновые, фосфоновые, сульфоновые или сульфаминовые кислоты, например, уксусная кислота, пропионовая кислота, октановая кислота, декановая кислота, додекановая кислота, гликолевая кислота, молочная кислота, фумаровая кислота, янтарная кислота, адипиновая кислота, пимелиновая кислота, субериновая кислота, азелаиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, салициловая кислота, 4-аминосалициловая кислота, фталевая кислота, фенилуксусная кислота, миндальная кислота, коричная кислота, метан- или этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталиндисульфоновая кислота, 2-, 3- или 4-метилбензолсульфоновая кислота, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота или другие органические протонные кислоты, такие как аскорбиновая кислота.
Для целей выделения или очистки можно использовать также неприемлемые с фармацевтической точки зрения соли, например, пикраты или перхлораты. Для терапевтического применения используют только фармацевтически приемлемые соли или свободные соединения (при необходимости в форме фармацевтических композиций), и они являются предпочтительными.
Вследствие близкого сходства между новыми соединениями в свободной форме и в форме их солей, включая те соли, которые можно использовать в качестве промежуточных продуктов, например, при очистке или идентификации новых соединений, следует понимать, что любая ссылка на свободное соединение, приведенная выше или ниже в настоящем описании, относится также к соответствующим солям, когда это является необходимым и целесообразным.
Соединения формулы I и их N-оксиды обладают ценными фармакологическими свойствами, как это указано выше и ниже в настоящем описании.
Эффективность соединений, предлагаемых в изобретении, в качестве ингибиторов активности тирозинкиназного рецептора VEGF можно продемонстрировать следующим образом.
Тест по определению активности в отношении тирозинкиназного рецептора VEGF.
Тест проводят с использованием тирозинкиназного рецептора VEGF (Flt-1). Более конкретно метод состоит в следующем: 30 мкл раствора киназы (10 нг киназного домена Flt-1, Shibuya и др., Oncogen 5, 1990, cc.519-524) в буфере, содержащем 20 мМ Трис•HCl, рН 7,5, 3 мМ дихлорид марганца (MnCl2), 3 мМ хлорид магния (MgCl2), 10 мкМ ванадат натрия, 0,25 мг/мл полиэтиленгликоля (ПЭГ) 20000, 1 мМ дитиотреитол и 30 мкг/мл поли(Glu,Туг), 4:1 (фирма Sigma, Букс, Швейцария), 8 мкМ [33Р]-АТФ (0,2 мкКи), 1% диметилсульфоксида и от 0 до 100 мкМ подлежащего тестированию соединения, инкубируют вместе в течение 10 мин при комнатной температуре. Затем реакцию прекращают, добавляя 10 мкл 0,25 М этилендиаминтетраацетата (ЭДТА), рН 7. С помощью многоканального диспенсера (фирма LAB SYSTEMS, США) вносят аликвоты по 20 мкл на мембрану типа Immobilon P из ПВДФ (поливинилдифторид) (фирма Millipore, США), которая включает микротитрационное фильтрационное устройство типа Millipore, и подвергают вакуумированию. После полного удаления жидкости мембрану последовательно промывают 4 раза в бане, содержащей 0,5%-ную фосфорную кислоту (Н3PO4), и один раз промывают этанолом, инкубируют каждый раз в течение 10 мин при встряхивании, затем помещают в устройство типа Hewlett Packard TopCount Manifold и измеряют радиоактивность после добавления 10 мкл Microscint® (сцинтилляционная жидкость для подсчета β-излучения). Значения IC50 определяют с помощью линейного регрессионного анализа процентов ингибирования при использовании трех концентраций каждого соединения (как правило, 0,01, 0,1 и 1 мкмоль). Значения IC50, которые удалось определить для соединений формулы I, находятся в диапазоне от 0,01 до 1 мкМ, предпочтительно в диапазоне от 0,01 до 0,1 мкМ.
Противоопухолевую активность соединений, предлагаемых в изобретении, можно продемонстрировать в опытах in vivo следующим образом.
Активность in vivo с использованием в качестве модели бестимусных мышей, подвергнутых ксенотрансплантации.
Самок бестимусных мышей линии BALB/c (возрастом 8-12 недель, фирма Novartis Animal Farm, Сисселн, Швейцария) выдерживают в стерильных условиях, давая им воду и корм ad libitum (без ограничения). Опухоли индуцируют у мышей либо путем подкожной инъекции опухолевых клеток (например, линии клеток карциномы предстательной железы Du 145 (регистрационный номер АТСС НТВ 81; см. Cancer Research, 37, 1978, cc.4049-4058)), либо путем имплантации фрагментов опухоли (приблизительно 25 мг) подкожно в левый бок животных с помощью троакар-иглы 13-го размера под анестезией фореном (Forene®, фирма Abbott, Швейцария). Обработку тестируемым соединением начинают тогда, когда средний объем опухоли достигает 100 мм3. Рост опухоли оценивают два-три раза в неделю и через 24 ч после последней обработки, определяя длину в двух перпендикулярных направлениях. Объемы опухоли рассчитывают согласно опубликованным методам (см. Evans и др., Brit. J. Cancer 45, 1982, cc.466-468). Противоопухолевую активность определяют по среднему увеличению объема опухолей у обработанных животных, деленному на среднее увеличение объема опухолей у необработанных животных (контроль), и после умножения на 100 выражают в виде Т/С%. Уменьшение опухолей (данное в %) определяют как отношение наименьшего среднего объема опухоли к среднему объему опухоли в начале обработки. Тестируемое соединение вводят ежедневно с помощью желудочного зонда.
В альтернативном варианте аналогичным образом также могут применяться другие линии клеток, например:
- линия клеток аденокарциномы молочной железы MCF-7 (АТСС №НТВ 22; см. также J. Natl. Cancer Inst. (Bethesda) 51, 1973, cc.1409-1416);
- линия клеток аденокарциномы молочной железы MDA-MB 468 (АТСС №НТВ 132; см. также In Vitro 14, 1978, cc.911-915);
- линия клеток аденокарциномы молочной железы MDA-MB 231 (АТСС №НТВ 26; см. также J. Natl. Cancer Inst. (Bethesda) 53, 1974, cc.661-674);
- линия клеток карциномы ободочной кишки Colo 205 (АТСС №CCL 222; см. также Cancer Res. 38, 1978, cc.1345-1355);
- линия клеток карциномы ободочной кишки НСТ 116 (АТСС №CCL 247; см. также Cancer Res. 41, 1981, cc.1751-1756);
- линия клеток карциномы предстательной железы DU145 (АТСС №НТВ 81; см. также Cancer Res. 37, 1978, cc.4049-4058); и
- линия клеток карциномы предстательной железы РС-3 (АТСС №CRL 1435; см. также Cancer Res. 40, 1980, cc.524-534).
Ингибирование индуцируемого VEGF автофосфорилирования KDR-рецептора можно подтверждать дополнительно в экспериментах in vitro на клетках следующим образом: трансфектированные СНО-клетки, которые непрерывно экспрессируют человеческий рецептор VEGF (KDR), высевают в полную культуральную среду, дополненную 10% ФТС (фетальная телячья сыворотка), в 6-луночные планшеты для культуры клеток и инкубируют при 37°С в атмосфере 5% CO2 до достижения примерно 80%-ной конфлюэнтности. Затем подлежащие тестированию соединения разбавляют культуральной средой (без ФТС, но с добавлением 0,1% бычьего сывороточного альбумина) и добавляют к клеткам. (Контрольные варианты включают среду без тестируемых соединений). После инкубации в течение 2 ч при 37°С добавляют рекомбинантный VEGF; конечная концентрация VEGF составляет 20 нг/мл. После дополнительной пятиминутной инкубации при 37°С клетки дважды промывают охлажденным на льду ЗФР (забуференный фосфатом физиологический раствор) и немедленно лизируют, используя по 100 мкл буфера для лизиса на лунку. Затем лизаты центрифугируют для удаления ядер клеток и концентрации протеина супернатантов определяют с помощью имеющегося в продаже набора для анализа протеинов (фирма BIORAD). Затем лизаты либо сразу же используют для экспериментов, либо при необходимости хранят при -20°С.
Для оценки фосфорилирования рецептора KDR осуществляют твердофазный иммуноферментный анализ (ELISA) с использованием иммуносэндвича следующим образом: моноклональное антитело к KDR (например, МАт 1495.12.14, полученное от Н. Towbin) иммобилизуют на черных планшетах для ELISA (типа OptiPlate™ HTRF-96, фирма Packard). Затем планшеты промывают и оставшиеся свободные протеинсвязывающие сайты насыщают с помощью 1% БСА в ЗФР. Затем в этих планшетах клеточные лизаты (20 мкг протеина на лунку) инкубируют в течение ночи при 4°С с антителом к фосфотирозину, сшитому с щелочной фосфатазой (АФ) (РY20:АФ фирмы Transduction Laboratories). Планшеты вновь промывают и затем выявляют связывание антитела к фосфотирозину с улавливающим фосфорилированным рецептором с использованием люминисцентного субстрата для АФ (типа CDP-Star, готовый к применению, с Emerald II; фирма TROPIX). Люминесценцию оценивают с помощью сцинтилляционного счетчика типа Packard Top Count Microplate Scintillation Counter (фирма Top Count). Разница между сигналом положительного контроля (стимулированного VEGF) и сигналом отрицательного контроля (не стимулированного VEGF) соответствует индуцируемому VEGF фосфорилированию KDR-рецептора (=100%). Активность тестируемых соединений рассчитывают как ингибирование (в %) индуцируемого VEGF фосфорилирования KDR-рецептора, при этом концентрацию вещества, которая индуцирует половину от максимального ингибирования, обозначают как ED50 (доза, вызывающая 50%-ное ингибирование).
Кроме того, соединение формулы I или его N-оксид ингибирует в различной степени другие тирозинкиназы, участвующие в трансдукции сигнала, которые опосредуются трофическими факторами, например, киназу из Src-семейства, предпочтительно c-Src-киназу, Lck и Fyn; а также киназы из EGF-семейства, например, с-еrbВ2-киназу (HER-2), с-еrbВ3-киназу, с-еrbВ4-киназу; киназный рецептор инсулинподобного фактора роста (IGF-1-киназа), прежде всего, представители семейства тирозинкиназных рецепторов PDGF, такие как киназный рецептор PDGF, киназный рецептор CSF-1, киназный рецептор Kit и киназный рецептор VEGF; а также серин/треонинкиназы, все они играют роль в регуляции роста и трансформации в клетках млекопитающих, включая клетки человека.
На основе этих исследований установлено, что соединение формулы I, предлагаемое в изобретении, обладает терапевтической эффективностью, в частности, в отношении заболеваний, зависящих от протеиновой киназы, прежде всего пролиферативных заболеваний.
Возможность применения соединения формулы I для лечения артрита, являющегося примером воспалительного ревматического или ревматоидного заболевания, можно продемонстрировать следующим образом.
Для определения антиартрической активности соединений формулы I или их солей используют хорошо известную модель вызванного адъювантом артрита у крыс (Pearson, Proc. Soc. Exp.BioL, 91,1956, cc.95-101). Вызванный адъювантом артрит можно лечить с помощью двух различных схем применения лекарственного средства: либо (I), начиная с момента иммунизации адъювантом (профилактическая обработка); либо (II), начиная с 15 дня, когда артрическая реакция уже проявляется (терапевтическая обработка). Предпочтительно применяют терапевтическую схему введения лекарственного средства. Для сравнения отдельную группу обрабатывают ингибитором циклооксигеназы-2, таким как 5-бром-2-(4-фторфенил)-3-[4-(метилсульфонил)фенил]тиофен или диклофенак.
Более подробно метод состоит в следующем: самцам крыс линии Wistar (по 5 животных весом примерно по 200 г в группе, поставляемых фирмой Credo, Франция) вводят в.к. (внутрикожно) в основание хвоста 0,1 мл минерального масла, содержащего 0,6 мг лиофилизированных убитых тепловой обработкой бактерий штамма Mycobacterium tuberculosis. Крыс обрабатывают тестируемым соединением (3, 10 или 30 мг/кг перорально, один раз в день) или носителем (водой), осуществляя обработку с 15 по 22 день (терапевтическая схема введения лекарственного средства). В конце эксперимента с помощью микроциркуля оценивают припухлость суставов лап. Ингибирование припухлости лап (в %) рассчитывают путем сравнения с припухлостью лап страдающих артритом обработанных носителем животных (ингибирование 0%) и здоровых обработанных носителем животных (ингибирование 100%).
На основе этих исследований неожиданно было установлено, что соединение формулы I можно применять для лечения воспалительных (предпочтительно ревматических или ревматоидных) заболеваний.
Вследствие их эффективности в качестве ингибиторов активности тирозинкиназного рецептора VEGF соединения формулы I прежде всего ингибируют рост кровеносных сосудов, и поэтому они эффективны, например, в отношении многих заболеваний, связанных с нарушением ангиогенеза, в частности, болезней, связанных с неоваскуляризацией глаза, предпочтительно ретинопатий, таких как диабетическая ретинопатия или связанная с возрастом дегенерация желтого пятна, а также таких заболеваний, как псориаз, гемангиобластома, такая как гемангиома, пролиферативные нарушения мезангиальных клеток, такие как хронические или острые болезни почек, например, диабетическая нефропатия, злокачественный нефросклероз, синдромы тромбозной микроангиопатии или отторжение трансплантата, или, в частности, воспалительное заболевание почек, такое как гломерулонефрит, прежде всего мезангиопролиферативный гломерулонефрит, гемолитико-уремический синдром, диабетическая нефропатия, гипертензивный нефросклероз, атерома, артериальный рестеноз, аутоиммунные болезни, острое воспаление, фиброзные болезни (например, цирроз печени), диабет, эндометриоз, хроническая астма, артериальный атеросклероз или атеросклероз, возникающий после трансплантации, нейродегенеративные болезни и, прежде всего болезни, связанные с неоплазией, типа лейкозов, прежде всего острый лимфобластный лейкоз, острый миелоидный лейкоз и хронический миелоидный лейкоз и другие "опухоли жидких тканей", прежде всего те, которые экспрессируют c-kit, KDR или fit-1, и плотные опухоли, прежде всего, такие как рак молочной железы, рак ободочной кишки, рак легкого (прежде всего мелкоклеточный рак легкого), рак предстательной железы или саркома Капоши. Соединение формулы I (или его N-оксид) ингибирует рост опухоли и, прежде всего его можно применять для предупреждения метастатического распространения опухолей и роста микрометастазов.
Соединение формулы I можно вводить индивидуально или в сочетании с одним или несколькими другими терапевтическими агентами для совместной терапии, причем можно использовать фиксированные комбинации или можно использовать последовательное или не зависящее друг от друга введение соединения, предлагаемого в изобретении, и одного или нескольких других терапевтических агентов, или можно использовать комбинированное введение фиксированных комбинаций и одного или нескольких других терапевтических агентов. Соединение формулы I, в частности, при лечении опухолей, можно применяться помимо химиотерапии, радиотерапии, иммунотерапии, хирургического вмешательства или в дополнение к ним или в сочетании с ними. С точки зрения других режимов лечения продолжительную терапию равным образом можно рассматривать как вспомогательную терапию в сочетании с другими лечебными мероприятиями, как это описано выше. Другие возможные режимы лечения представляют собой терапию, предназначенную для поддержания состояния пациента после уменьшения опухоли, или даже химиопревентивную терапию, например, для пациентов из группы риска.
В качестве терапевтических агентов в сочетании с соединениями, предлагаемыми в изобретении, можно применять одну или несколько антипролиферативных, цитостатических или цитотоксических субстанций, например, химиотерапевтический агент или несколько соединений, выбранных из группы, которая включает (но не ограничена ими) ингибитор биосинтеза полиаминов, ингибитор протеинкиназы, особенно серин/треонин-протеинкиназы, такой как протеинкиназа С, или тирозинпротеинкиназы, такой как тирозинкиназный рецептор эпидермального фактора роста (EGF), например, PKI166, тирозинкиназный рецептор VEGF, например, РТК787, или тирозинкиназный рецептор PDGF, например, STI571, цитокин, понижающий регулятор роста, такой как TGF-β или IFN-β, ингибитор ароматазы, например, летрозол или анастрозол, ингибитор взаимодействия SH2-домена с фосфорилированным протеином, антиэстрогены, ингибиторы топоизомеразы I, такие как иринотекан, ингибиторы топоизомеразы II, активные в отношении микротрубок агенты, например, паклитаксел, дискодермолид или эпотилон, алкилирующие агенты, антинеопластические антиметаболиты, такие как гемцитабин или капецитабин, содержащие платину соединения, такие как карбоплатин или цисплатин, антиангиогенные соединения, агонисты гонадорелина, антиандрогены, бисфосфонаты, например, AREDIA® или ZOMETA®, и трастузумаб. Структуру действующих веществ можно идентифицировать по номеру кода, родовому названию или товарному знаку, которые можно обнаружить в последних изданиях стандартного справочника "The Merck Index" или из базы данных, например международных заявок на патент (Patents International) (например, IMS World Publications). Их имеющее отношение к настоящему изобретению содержание включено в настоящее описание в качестве ссылок.
В группах указанных ниже предпочтительных соединений формулы I и их N-оксидов из общего перечня указанных выше обозначений целесообразно использовать определенные обозначения заместителей, например, для замены более общих обозначений более конкретными обозначениями, или, в частности, обозначениями, которые являются предпочтительными.
Кроме того, изобретение относится к применению соединения формулы I или его N-оксида, или фармацевтически приемлемой соли, в которых радикалы и символы имеют указанное выше значение, для приготовления фармацевтической композиции для лечения ретинопатии или связанной с возрастом дегенерации желтого пятна.
Изобретение также относится к способу лечения неопластического заболевания, которое облегчается при ингибировании активности тирозинкиназного рецептора VEGF, предусматривающему введение соединения формулы I или его N-оксида или фармацевтически приемлемой соли, в которых радикалы и символы имеют указанное выше значение, в количестве, эффективном в отношении указанной болезни, теплокровному животному, которое нуждается в таком лечении.
Кроме того, изобретение относится к способу лечения ретинопатии или связанной с возрастом дегенерации желтого пятна, предусматривающему введение соединения формулы I или его N-оксида или фармацевтически приемлемой соли, в которых радикалы и символы имеют указанное выше значение, в количестве, эффективном в отношении указанной болезни, теплокровному животному, которое нуждается в таком лечении.
Изобретение относится, в частности, к соединению формулы I, в котором Ar обозначает подформулу Ia,
где Ra обозначает Н или (низш.)алкил и
R1 обозначает Н или трифторметил,
R2 обозначает Н, галоген, С2-C7алкил, С2-С7алкенил или (низш.)алкинил; или
Ar обозначает подформулу Iв и
R1 обозначает трифторметил и
R2 обозначает бром, йод, С2-C7алкил, С2-C7алкенил или (низш.)алкинил, или
R1 обозначает Н и
R2 обозначает фтор, бром, йод, этил, С5-С7алкил, С2-С7алкенил или
(низш.)алкинил,
к его N-оксиду или таутомеру или к соли амида антраниловой кислоты, его N-оксида или его таутомера.
Предпочтительными являются соединения формулы I, в которых
Ar обозначает подформулу Ia,
где Ra обозначает Н или (низш.)алкил,
R1 обозначает Н или трифторметил и
R2 обозначает Н, галоген, С2-С7алкил, С2-С7алкенил или (низш.)алкинил.
Также предпочтительными являются соединения формулы I, в которых
Ar обозначает подформулу Ib,
R1 обозначает трифторметил и
R2 обозначает бром, йод, С5-С7алкил, С2-С7алкенил или (низш.)алкинил, или
R1 обозначает Н и
R2 обозначает фтор, бром, йод, этил, С5-С7алкил, С2-С7алкенил или (низш.)алкинил.
Более предпочтительными являются соединения формулы I, в которых
Ar обозначает подформулу Ib,
R1 обозначает трифторметил и
R2 обозначает бром, пропил, пропенил или пропинил, или
R1 обозначает Н
R2 обозначает фтор, бром, пропенил или пропинил.
Одним из вариантов осуществления изобретения является амид атраниловой кислоты формулы I, в котором
Ar обозначает N-оксид подформулы Ib,
R1 обозначает трифторметил,
R2 обозначает бром, пропил, пропенил или пропинил.
В частности предпочтительными являются следующие соединения формулы I:
2-[4-пиридинилметил]амино-N-[4-бром-3-(трифторметил)фенил]бензамид,
2-[4-пиридинилметил]амино-N-(4-бромфенил)бензамид,
2-[[3-[(метиламино)карбонил]фенил]метил]амино-N-[3-(трифторметил)фенил]бензамид,
2-[4-пиридинилметил]амино-N-[4-(1-пропинил)-3-(трифторметил)фенил]бензамид,
2-[4-пиридинилметил]амино-N-[4-(1-пропинил)фенил]бензамид,
гидрохлорид 2-[4-пиридинилметил]амино-N-[4-[(Z)-1-пропенил]-3-(трифторметил)фенил]бензамида,
2-[4-пиридинилметил]амино-N-[4-(1-пропил)-3-(трифторметил)фенил]бензамид,
N-(4-хлор-3-трифторметилфенил)-2-[(1-оксипиридин-4-илметил)амино]бензамид и
N-(4-фтор-3-трифторметилфенил)-2-[(1-оксипиридин-4-илметил)амино]бензамид,
и их таутомеры
или соль указанного соединения или его таутомера.
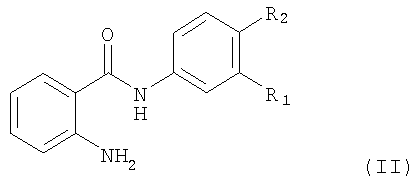
Соединение, предлагаемое в изобретении, можно получать с помощью методов, которые хотя и не применялись для получения новых соединений, предлагаемых в настоящем изобретении, хорошо известны, прежде всего с помощью метода, который отличается тем, что для синтеза соединения формула I, в котором R2 обозначает водород или галоген, а остальные символы R1 и Ar имеют значения, указанные выше для соединения формулы I, соединение формула II
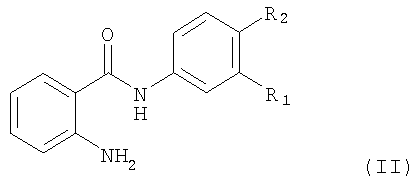
в котором R1 и R2 имеют указанные выше значения, подвергают взаимодействию с карбонильным производным формула III

в котором Ar имеет значения, указанные выше для соединения формулы I, в присутствии восстановителя,
где в применяемых в качестве исходных продуктов соединениях формулы II и III функциональные группы при необходимости могут находиться в защищенной форме и/или в форме солей, при условии, если присутствует солеобразующая группа и возможна реакция с участием соединений в форме соли;
удаляют любые защитные группы в защищенном производном соединения формулы I;
и при необходимости превращают полученное соединение формулы I в другое соединение формулы I или в его N-оксид, превращают свободное соединение формулы I в соль, превращают полученную соль соединения формулы I в свободное соединение или в другую соль, и/или разделяют смесь изомеров соединений формулы I на индивидуальные изомеры.
В альтернативном варианте соединение формулы II можно подвергать взаимодействию с соединением формулы III в присутствии кислоты, например, камфор-10-сульфоновой кислоты, в приемлемом растворителе типа толуола или бензола при температуре дефлегмации в течение промежутка времени примерно от 15 мин до 6 ч с получением бициклического соединения формулы IV,
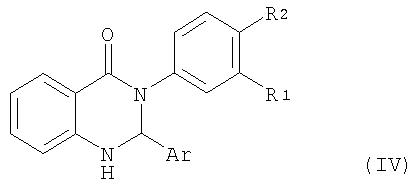
в котором R2 обозначает водород или галоген, а остальные символы R1 и Ar имеют значения, указанные выше для соединения формулы I, далее это бициклическое соединение формулы IV можно подвергать взаимодействию в приемлемом растворителе с триэтилсиланом и трифторуксусной кислотой при температуре от 60 до 90°С в течение 4 - 12 ч с получением соединения формулы I, в котором R2 обозначает водород или галоген, а остальные символы R1 и Ar имеют значения, указанные выше для соединения формулы I.
Подробное описание восстановительного алкилирования.
В приведенном ниже более подробном описании процесса, если не указано иное, R1, R2 и Ar имеют значения, указанные для соединений формулы I.
Карбонильное производное формулы III может присутствовать также в форме реакционноспособного производного; однако предпочтительным является свободные альдегид или кетон.
Реакционноспособные производные соединений формулы III представляют собой, например, соответствующие бисульфитные аддукты или предпочтительно полуацетали, ацетали, полукетали или кетали соединений формулы III со спиртами, например, (низш.)алканолами; или тиоацетали или тиокетали соединений формулы III с меркаптанами, например (низш.)алкансульфидами.
Восстановительное алкилирование предпочтительно осуществляют гидрированием в присутствии катализатора, в частности катализатора из благородного металла, как правило, из платины или предпочтительно палладия, который предпочтительно связывают с носителем, таким как уголь, или в присутствии катализатора из тяжелого металла, как правило, никеля Ренея, при нормальном давлении или при давлении от 0,1 до 10 мегапаскалей (МПа), или восстановление проводят с помощью комплекса гидридов, таких как борогидриды, предпочтительно цианборогидриды щелочного металла, например, цианборогидрида натрия, в присутствии приемлемой кислоты, предпочтительно относительно слабых кислот, таких как (низш.)алканкарбоновые кислоты, предпочтительно уксусная кислота, или сульфоновой кислоты, такой как паратолуолсульфоновая кислота; в общепринятых растворителях, например в спиртах, таких как метанол или этанол, или в простых эфирах, например в циклических эфирах, таких как тетрагидрофуран, в присутствии воды или без воды.
Защитные группы
Если в соединении формул II или III присутствуют одна или несколько других функциональных групп, например, карбокси-, гидрокси-, амино- или меркаптогруппа, или они должны быть защищены, поскольку они не должны принимать участие в реакции, эти группы представляют собой группы, которые обычно используют при синтезе пептидных соединений, цефалоспоринов и пенициллинов, а также производных нуклеиновых кислот и сахаров.
Защитные группы могут уже присутствовать в предшественниках и должны защищать функциональные группы от нежелательных вторичных реакций, таких как ацилирование, образование простых и сложных эфиров, окисление, сольволиз, и других аналогичных реакций. Характерной особенностью защитных групп является то, что они легко поддаются удалению, т.е. поддаются удалению без нежелательных вторичных реакций, как правило, путем сольволиза, восстановления, фотолиза или в результате ферментативной активности, например, в условиях, аналогичных физиологическим условиям, и поэтому они не присутствуют в конечных продуктах. Специалисту должно быть ясно или он легко может установить, какие защитные группы пригодны для указанных выше и ниже реакций.
Защита указанных функциональных групп такими защитными группами, сами защитные группы и реакции их отщепления описаны, например, в обычных справочных руководствах, таких как J.F.W. McOmie, "Protective Groups in Organic Chemistry", изд-во Plenum Press, London и New York 1973, у T.W. Greene, в "Protective Groups in Organic Synthesis", изд-во Wiley, New York 1981, в "The Peptides", том 3 (ред. E.Gross, и J.Meienhofer), изд-во Academic Press, London и New York 1981, в "Methoden der organischen Chemie (Методы органической химии), Houben Weyl, 4-ое изд., том 15/I, изд-во Georg Thieme Verlag, Stuttgart 1974, у H.-D. Jakubke и H. Jescheit в: "Aminosaären, Peptide, Proteine" (Аминокислоты, пептиды, протеины), изд-во Verlag Chemie, Weinheim, Deerfield Beach и Basel 1982, и у Jochen Lehmann в: "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Химия углеводов: моносахариды и их производные), изд-во Georg Thieme Verlag, Stuttgart 1974.
Дополнительные стадии процесса
Соли соединения формулы I, несущего солеобразующую группу, можно получать хорошо известными методами. Например, кислотно-аддитивные соли соединений формулы I можно получать обработкой кислотой или приемлемым анионобменным реагентом. Соль с двумя молекулами кислоты (например, дигалогенид соединения формулы I) также можно превращать в соль с одной молекулой кислоты на соединение (например, в моногалогенид); это можно осуществлять нагреванием до расплавленного состояния или, например, нагреванием соединения в виде твердого вещества в глубоком вакууме при повышенной температуре, например, при температуре от 130 до 170°С, при этом одна молекула кислоты замещается одной молекулой соединения формулы I.
Как правило, соли можно превращать в свободные соединения, например, обработкой приемлемыми щелочными агентами, например карбонатами щелочных металлов, бикарбонатами щелочных металлов или гидроксидами щелочных металлов, как правило, карбонатом калия или гидроксидом натрия.
Амид антраниловой кислоты формулы I, в котором R2 обозначает галоген, предпочтительно бром, можно дополнительно подвергать взаимодействию согласно следующему методу.
Амид антраниловой кислоты формулы I, в котором R2 обозначает галоген, растворяют в приемлемом ароматическом растворителе типа бензола, толуола или ксилола и подвергают взаимодействию со станнаном формулы VII,
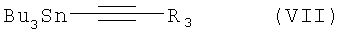
где R3 обозначает Н или (низш.)алкил, в присутствии приемлемого катализатора, предпочтительно тетракис(трифенилфосфин)палладия(0), при температуре от 90 до 150°С, предпочтительно в атмосфере аргона в течение 12-36 ч в приемлемом ароматическом растворителе типа бензола, толуола или ксилола.
Полученное соединение формулы I, в котором R2 обозначает алкинильный радикал -С≡С-R3, можно трансформировать в соответствующие алкенильный или алкильный радикалы с помощью известных в данной области реакций.
Например, соединение формулы I, в котором R2 обозначает алкинильный радикал -С≡С-R3, можно гидрировать в метаноле при атмосферном давлении в присутствии никеля Ренея при температуре от 15 до 30°С с получением соединения формулы I, в котором R2 обозначает С2-C7алкенил. Такое полученное в результате реакции соединение формулы I, в котором R2 обозначает С2-C7алкенил можно дополнительно гидрировать в метаноле при атмосферном давлении в присутствии 5% платины на угле при температуре от 15 до 30°С, получая соединение формулы I, в котором R2 обозначает С2-С7алкил.
Сокращения:
Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Температуры даны в градусах Цельсия (°С). Если не указано иное, то реакции проводят при комнатной температуре.
Примеры
Сравнительный пример 1:2-[[6-метокси-3-пиридинил]метил]амино-N-[4-бром-3-(трифторметил)фенил]бензамид (не подпадает под объем изобретения)
Цианборогидрид натрия (8,80 г 95%-ного продукта, 133 ммоля) добавляют порциями в течение 30 мин при перемешивании к смеси, содержащей уксусную кислоту (3,8 мл), 6-метокси-3-пиридинкарбоксальдегид (фирма Fluka, Букс, Швейцария; 7,80 г, 57 ммолей) и 2-амино-N-(4-бром-3-трифторметилфенил)бензамид (стадия 1.2; 13,65 г, 38 ммолей) в метаноле (380 мл), при 25°С. Смесь перемешивают в течение 16 ч. Растворитель выпаривают при пониженном давлении, получая остаток, который обрабатывают насыщенным водным раствором бикарбоната натрия (500 мл) и экстрагируют дихлорметаном (3×150 мл). Объединенные экстракты сушат (Na2SO4), фильтруют и растворитель выпаривают при пониженном давлении, получая неочищенный продукт, который очищают колончатой хроматографией на силикагеле, элюент 5% EtOAc в дихлорметане, и перекристаллизовывают из диэтилового эфира - гексана, получая указанное в заголовке соединение в виде кристаллического твердого вещества бежевого цвета, tпл 101-103°С.
Стадия 1.1: 2-Нитро-N-(4-бром-3-трифторметилфенил)бензамид
Раствор 3-амино-6-бромбензотрифторида (фирма Fluka, Букс, Швейцария; 24,0 г, 100 ммолей) в EtOAc (240 мл) добавляют при перемешивании к водному раствору гидроксида натрия (110 мл, 1М раствор) при комнатной температуре. К этому раствору затем добавляют при перемешивании по каплям в течение 30 мин раствор 2-нитробензоилхлорида (фирма Fluka, Букс, Швейцария; 14,5 мл, 110 ммолей) в EtOAc (150 мл). Затем образовавшуюся смесь перемешивают в течение 30 мин при температуре окружающей среды. Смесь экстрагируют EtOAc (3×100 мл) и объединенные экстракты последовательно промывают соляной кислотой (2×100 мл 2М раствора), водой (2×100 мл), насыщенным водным раствором бикарбоната натрия (2×100 мл) и насыщенным водным раствором хлорида натрия (1×100 мл), сушат (MgSO4), фильтруют и растворитель выпаривают при пониженном давлении, получая неочищенный продукт, который очищают перекристаллизацией из EtOAc-гексана, получая указанное в заголовке соединение в виде кристаллического твердого вещества бежевого цвета, tпл 157-158°С.
Стадия 1.2: 2-Амино-N-(4-бром-3-трифторметилфенил)бензамид
Раствор 2-нитро-N-(4-бром-3-трифторметилфенил)бензамида (промежуточный продукт 1а; 32 г, 82 ммоля) в метаноле (1000 мл) гидрируют при атмосферном давлении в присутствии никеля Ренея (6 г) при 21°С. Через 7 ч добавляют рассчитанное количество водорода. Смесь фильтруют и растворитель выпаривают при пониженном давлении, получая неочищенный продукт, который очищают перекристаллизацией из диэтилового эфира - гексана, получая указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества, tпл 142-144°C.
Пример 2: 2-[4-Пиридинилметил]амино-N-[4-бром-3-(трифторметил)фенил]бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному в примере 1, используя промежуточный продукт, полученный на стадии 1.2, и 4-пиридинкарбоксальдегид; tпл 123-124°С.
Пример 3: 2-[4-Пиридинилметил]амино-N-(4-бромфенил)бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному в примере 1, используя промежуточный продукт, полученный на стадии, полученный на стадии 3.2, и 4-пиридинкарбоксальдегид; tпл 136-137°С.
Стадия 3.1: 2-Нитро-N-(4-бромфенил)бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному на стадии 1.1, используя 4-броманилин (фирма Fluka, Букс, Швейцария); tпл 202-205°С.
Стадия 3.2: 2-Амино-N-(4-бромфенил)бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному на стадии 1.2., используя 2-нитро-N-(4-бромфенил)бензамид (стадия 3.1); tпл 139-144°С.
Пример 4: 2-[[3-[(Метиламино)карбонил]фенил]метил]амино-N-[3-(трифторметил)фенил]бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному в примере 1, используя промежуточный продукт, полученный на стадии 4.2, и 3-формил-N-метилбензамид (полученный с помощью метода, описанного в WO 98/14449); tпл 166-167°С.
Стадия 4.1: 2-Нитро-N-[3-(трифторметил)фенил]бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному на стадии 1.1, используя 3-(трифторметил)бензоламин (фирма Aldrich, Букс, Швейцария); tпл 134-135°С.
Стадия 4.2: 2-Амино-N-[(3-трифторметил)фенил)бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному на стадии 1.2, используя 2-нитро-N-[(3-трифторметил)фенил)бензамид (стадия 2.1); tпл 132-133°С.
Сравнительный пример 5: 2-[[6-Метокси-3-пиридинил]метил]амино-N-[4-(1-пропинил)-3-(трифторметил)фенил]бензамид (не подпадает под объем изобретения)
Раствор 2-[[6-метокси-3-пиридинил]метил]амино-N-[4-бром-3-(трифторметил)фенил]бензамида (пример 1; 3,98 г, 8,3 ммоля) в безводном толуоле (200 мл) продувают при перемешивании аргоном в течение 20 мин при 25°С. Затем добавляют трибутил-1-пропинилстаннан (4,1 г, 80%, 9,96 ммоля) и тетракис(трифенилфосфин)палладия(0) (260 мг) и образовавшуюся смесь выдерживают при 100°С в течение 17 ч в атмосфере аргона. Затем смесь охлаждают, обрабатывают водным раствором гидроксида натрия (85 мл, 0,1М) продувают воздухом в течение 2 ч. Образовавшуюся смесь экстрагируют EtOAc (3×100 мл). Органическую фазу последовательно промывают водой (2×40 мл) и насыщенным водным раствором хлорида натрия (1×40 мл), сушат (Na2SO4), фильтруют и растворитель выпаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле, элюент 33% EtOAc в гексане и перекристаллизовывают из диэтилового эфира-гексана, получая указанное в заголовке соединение в виде кристаллического твердого вещества; tпл 123-124°С.
Пример 6: 2-[4-Пиридинилметил]амино-N-[4-(1-пропинил)-3-(трифторметил)фенил]бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному в примере 5, используя 2-[4-пиридинилметил]амино-N-[4-бром-3-(трифторметил)фенил]бензамид (Пример 2); tпл 165-166°С.
Пример 7: 2-[4-Пиридинилметил]амино-N-[4-(1-пропинил)фенил]бензамид
Указанное в заголовке соединение получают с помощью метода, аналогичного описанному в примере 5, используя 2-[4-пиридинилметил]амино-N-[4-бромфенил]бензамид (Пример 3); tпл 147-155°С.
Пример 8: Гидрохлорид 2-[4-пиридинилметил]амино-N-[4-[(Z)-1-пропенил]-3-(трифторметил)фенил] бензамида
Раствор 2-[4-пиридинилметил] амино-N-[4-(1-пропинил)-3-(трифторметил)фенил]бензамида (пример 6; 0,13 г, 0,32 ммоля) в метаноле (6 мл) гидрируют при атмосферном давлении в присутствии никеля Ренея (50 мг) при 22°С. Через 7 ч добавляют водород. Затем смесь фильтруют и растворитель выпаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле, элюент 50% EtOAc в дихлорметане, получая продукт в виде масла. Масло растворяют в этаноле, подкисляют раствором хлористого водорода в EtOAc (2М) и разбавляют диэтиловым эфиром. Образовавшийся осадок отфильтровывают, промывают диэтиловым эфиром, сушат и очищают перекристаллизацией из диэтилового эфира - этанола, получая указанное в заголовке соединение в виде твердого вещества бежевого цвета.
Пример 9: 2-[4-Пиридинилметил]амино-N-[4-(1-пропил)-3-(трифторметил)фенил]бензамид
Раствор 2-[4-пиридинилметил]амино-N-[4-[(Z)-1-пропенил]-3-(трифторметил)фенил]бензамида (пример 8; 0,80 г, 1,75 ммоля) в метаноле (25 мл) гидрируют при атмосферном давлении в присутствии 5% платины на угле (0,2 г) при 22°С. Через 12 ч добавляют рассчитанное количество водорода. Затем смесь фильтруют и растворитель выпаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле, элюент 20% дихлорметана в EtOAc и перекристаллизовывают из диэтилового эфира-гексана, получая указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества; tпл 134-135°С.
Пример 10: N-(4-хдор-3-трифторметилфенил)-2-[(1-оксипиридин-4-илметил)амино]бензамид
В атмосфере N2 0,50 г (1,2 ммоля) рацемического 3-(4-хлор-3-трифторметилфенил)-2-(1-оксипиридин-4-ил)-2,3-дигидро-1Н-хиназолин-4-она суспендируют в 8 мл охлажденного на льду 1,2-дихлорэтана. Добавляют 0,47 мл (3,0 ммоля) триэтилсилана, а затем через 5 мин 0,56 мл (7,2 ммоля) трифторуксусной кислоты. Образовавшийся раствор перемешивают в течение 7 ч при 80°С, охлаждают до КТ и разбавляют 100 мл EtOAc. Затем раствор промывают дважды насыщенным раствором NaHCO3 и соляным раствором. Водные слои экстрагируют дважды EtOAc, органические фазы сушат (Na2SO4) и частично концентрируют в вакууме до кристаллизации продукта. После фильтрации и промывки EtOAc получают указанное в заголовке соединение; tпл 213-214°С. Дополнительную порцию продукта можно получать из фильтрата с помощью колончатой хроматографии (SiO2; EtOAc/MeOH, 8:2).
Стадия 10.1: Рацемический 3-(4-хлор-3-трифторметилфенил)-2-(1-оксипиридин-4-ил)-2,3-дигидро-1Н-хиназолин-4-он
Суспензию, содержащую 10,04 г (31,9 ммоля) 2-амино-N-[4-хлор-3-трифторметил)фенил]бензамида (получение см. в WO 00/27820; промежуточный продукт 2f) в 80 мл толуола, готовят в снабженном сепаратором сосуде с водой. Добавляют 3,93 г (31,9 ммоля) 1-оксипиридин-4-карбальдегида и 23 мг камфор-10-сульфоновой кислоты. Смесь нагревают до 120°С в течение 1 ч. После охлаждения до КТ реакционную смесь фильтруют и полученный остаток промывают толуолом и диэтиловым эфиром, получая указанное в заголовке соединение; tпл 261-262°С.
Пример 11: N-(4-Фтор-3-трифторметилфенил)-2-[(1-оксипиридин-4-илметил)амино]бензамид
В атмосфере N2 1,50 г (3,7 ммоля) рацемического 3-(4-фтор-3-трифторметилфенил)-2-(1-оксипиридин-4-ил)-2,3-дигидро-1Н-хиназолин-4-она суспендируют в 25 мл охлажденного на льду дихлорметана. Затем добавляют 0,83 мл (5,2 ммоля) триэтилсилана, а затем 1,79 мл (23 ммоля) трифторуксусной кислоты. Образовавшийся раствор перемешивают в течение 72 ч при КТ, затем добавляют еще 0,42 мл триэтилсилана. После выдерживания в течение всего 138 ч при КТ раствор разбавляют 300 мл EtOAc и 300 мл насыщенного раствора NaHCO3. Водный слой отделяют и экстрагируют дважды EtOAc. Органические фазы промывают насыщенным раствором NaHCO3 и соляным раствором, сушат (Na2SO4) и концентрируют. Остаток растворяют в метаноле, добавляют SiO2 и смесь концентрируют. Образовавшийся порошок вносят в хроматографическую колонку (SiO2). После элюирования ацетоном / EtOH, 3:1 получают указанное в заголовке соединение; tпл 182-184°С.
Стадия 11.1: Рацемический 3-(4-фтор-3-трифторметилфенил)-2-(1-оксипиридин-4-ил)-2,3-дигидро-1Н-хиназолин-4-он
После конденсации 2,42 г (8,1 ммоля) 2-амино-N-[4-фтор-3-трифторметил)фенил]бензамида (получение см. в WO 00/27820; промежуточный продукт 2h) и 980 мг (7,96 ммоля) 1-оксипиридин-4-карбальдегида в 20 мл толуола и 5 мг камфор-10-сульфоновой кислоты аналогично методу, описанному на стадия 10.1, получают указанное в заголовке соединение; tпл 257-258°С.
Пример 12: Мягкие желатиновые капсулы
Партию из 5000 мягких желатиновых капсул, каждая из которых в качестве действующего вещества содержит 0,05 г одного из соединений формулы I, указанных в предыдущих примерах, получают следующим образом.
Состав
Процесс приготовления: Порошкообразное действующее вещество суспендируют в Lauroglykol® (лаурат пропиленгликоля, фирма Gattefossu S.A., Сен-Пре, Франция) и размалывают при увлажнении в мельнице тонкого помола, получая частицы размером приблизительно 1-3 мкм. С помощью машины для заполнения капсул в мягкие желатиновые капсулы вносят порции смеси по 0,419 г каждая.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИДЫ АНТРАНИЛОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ НОВООБРАЗОВАНИЕМ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ОБЛАДАЮЩИЙ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ТИРОЗИНКИНАЗНОГО РЕЦЕПТОРА VEGF | 2002 |
|
RU2318811C2 |
| N-АРИЛАМИДЫ АНТРАНИЛОВОЙ КИСЛОТЫ И ТИОАНТРАНИЛОВОЙ КИСЛОТЫ | 1999 |
|
RU2286338C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОНИКОТИНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ VEGF-РЕЦЕПТОРА ТИРОЗИНКИНАЗЫ | 2001 |
|
RU2296124C2 |
| ИНГИБИТОРЫ ТИРОЗИНКИНАЗ | 2008 |
|
RU2445309C2 |
| НОВЫЕ АНТРАНИЛАМИДОПИРИДИНМОЧЕВИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ РЕЦЕПТОРА VEGF | 2005 |
|
RU2415850C2 |
| НОВЫЕ ПИРИМИДИНАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2378267C2 |
| ФТАЛАЗИНЫ, ОБЛАДАЮЩИЕ АНГИОГЕНЕЗИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 1998 |
|
RU2207132C2 |
| ПРОИЗВОДНЫЕ АМИНОФОСФОНОВЫХ И -ФОСФИНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ НА ИХ ОСНОВЕ | 1997 |
|
RU2181362C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЦЕПТОРОВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ 2 ПОДТИПА (VEGFR-2) И ПРОТЕИНТИРОЗИНКИНАЗЫ | 2009 |
|
RU2522444C2 |
| ПРИМЕНЕНИЕ ПИРИМИДИЛАМИНОБЕНЗАМИДОВ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ЧУВСТВИТЕЛЬНЫХ К МОДУЛЯЦИИ АКТИВНОСТИ КИНАЗЫ Тie-2 | 2006 |
|
RU2404776C2 |
Изобретение относится к амидам антраниловой кислоты формулы I, в котором Ar обозначает подформулу Ia, где Ra обозначает Н или (низш.)алкил и R1 обозначает Н или перфтор(низш.)алкил и R2 обозначает Н; или Ar обозначает подформулу Ib и R1 обозначает перфтор(низш.)алкил и R2 обозначает бром, фтор, хлор, С2-С7алкил, С2-С7алкенил или (низш.)алкинил или R1 обозначает Н и R2 обозначает бром или (низш.)алкинил, или его N-оксид или таутомер, или соль амида антраниловой кислоты, или его таутомера. Изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью тирозинкиназных рецепторов VEGF, содержащей амид антраниловой кислоты формулы I или его N-оксид или его таутомер, либо фармацевтически приемлемую соль такого соединения, и по меньшей мере один фармацевтически приемлемый носитель. Изобретение также относится к способу получения амида антраниловой кислоты формулы I, в котором R2 обозначает водород или галоген, а остальные символы R1 и Ar имеют значения, указанные в п.1, где соединение формула II, в котором R1 и R2 имеют значения, указанные выше для формулы I, подвергают взаимодействию с карбонильным производным формулы (III), в котором Ar имеет значения, указанные выше для соединения формулы I, в присутствии восстановителя, при этом в применяемых в качестве исходных продуктов соединениях формулы II и III функциональные группы при необходимости могут находиться в защищенной форме и/или в форме солей, при условии, если присутствует солеобразующая группа и возможна реакция с участием соединений в форме соли; удаляют любые защитные группы в защищенном производном соединения формулы I; и при необходимости превращают полученное соединение формулы I в другое соединение формулы I или в его N-оксид, превращают свободное соединение формулы I в соль, и превращают полученную соль соединения формулы I в свободное соединение или в другую соль. Технический результат - амид антраниловой кислоты формулы I или его N-оксид или таутомер, либо фармацевтически приемлемая соль такого соединения, предназначенные для лечения заболевания, чувствительного к ингибированию активности тирозинкиназного рецептора VEGF. 5 н. и 11 з.п. ф-лы.
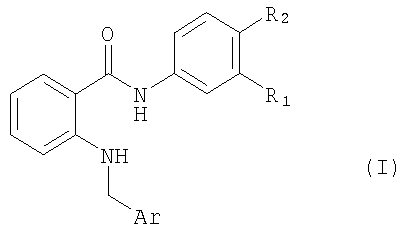

в котором Ar обозначает подформулу Ia
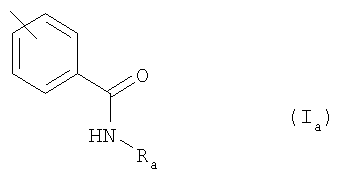
где Ra обозначает Н или (низш.)алкил и
R1 обозначает Н или перфтор(низш.)алкил и
R2 обозначает Н; или
Ar обозначает подформулу Ib и
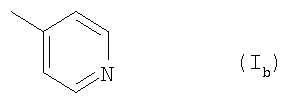
R1 обозначает перфтор(низш.)алкил и
R2 обозначает бром, фтор, хлор, С2-С7алкил, С2-C7алкенил или (низш.)алкинил или
R1 обозначает Н и
R2 обозначает бром или (низш.)алкинил, или его N-оксид или таутомер, или соль амида атраниловой кислоты, или его таутомера.
Ar обозначает подформулу Ia,
где Ra обозначает Н или (низш.)алкил и
R1 обозначает Н или трифторметил и
R2 обозначает Н; или
Ar обозначает подформулу Ib и
R1 обозначает трифторметил и
R2 обозначает бром, С2-С7алкил, С2-С7алкенил или (низш.)алкинил или
R1 обозначает Н и
R2 обозначает бром или (низш.)алкинил, или соль амида антраниловой кислоты или его таутомера.
Ar обозначает подформулу Ia,
где Ra обозначает Н или (низш.)алкил,
R1 обозначает Н или трифторметил и
R2 обозначает Н, или соль амида антраниловой кислоты или его таутомера.
Ar обозначает подформулу Ia,
где Ra обозначает Н или (низш.)алкил,
R1 обозначает Н или трифторметил и
R2 обозначает Н, или соль амида антраниловой кислоты или его таутомера.
R1 обозначает трифторметил и
R2 обозначает фтор, бром, С2-С7алкил, С2-С7алкенил или (низш.)алкинил или
R1 обозначает Н и
R2 обозначает бром или (низш.)алкинил, или его N-оксид или таутомер, или соль амида антраниловой кислоты или его таутомера.
Ar обозначает подформулу Ib,
R1 обозначает трифторметил и
R2 обозначает фтор, бром, С2-С7алкил, С2-С7алкенил или (низш.)алкинил или
R1 обозначает Н и
R2 обозначает бром или (низш.)алкинил, или его N-оксид или таутомер, или соль амида антраниловой кислоты или его таутомера.
Ar обозначает подформулу Ib,
R1 обозначает трифторметил и
R2 обозначает бром, пропил, пропенил или пропинил или
R1 обозначает Н и
R2 обозначает бром или пропинил, или его N-оксид или таутомер, или соль амида антраниловой кислоты, или его таутомера.
Ar обозначает N-оксид подформулы Ib,
R1 обозначает трифторметил и
R2 обозначает бром, пропил, пропенил или пропинил, или его таутомер, или соль амида антраниловой кислоты или его таутомера.
2-[4-пиридинилметил]амино-N-[4-бром-3-(трифторметил)фенил]бензамид,
2-[4-пиридинилметил]амино-N-(4-бромфенил)бензамид,
2-[[3-[(метиламино)карбонил]фенил]метил]амино-N-[3-(трифторметил)фенил]бензамид,
2-[4-пиридинилметил]амино-N-[4-(1-пропинил)-3-(трифторметил)фенил]бензамид,
2-[4-пиридинилметил]амино-N-[4-(1-пропинил)фенил]бензамид,
гидрохлорид 2-[4-пиридинилметил]амино-N-[4-[(Z)-1-пропенил]-3-(трифторметил)фенил]бензамида,
2-[4-пиридинилметил]амино-N-[4-(1-пропил)-3-(трифторметил)фенил] бензамид,
N-(4-хлор-3-трифторметилфенил)-2-[(1-оксипиридин-4-илметил)амино]бензамид и
N-(4-фтор-3-трифторметилфенил)-2-[(1-оксипиридин-4-илметил)амино]бензамид, или его N-оксид или таутомер, или соль амида антраниловой кислоты, или его таутомера.

в котором R2 обозначает водород или галоген, а остальные символы R1 и Ar имеют значения, указанные в п.1, где соединение формула II
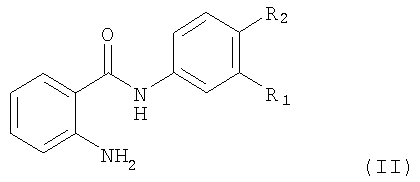
в котором R1 и R2 имеют значения, указанные выше для формулы I, подвергают взаимодействию с карбонильным производным формулы III

в котором Ar имеет значения, указанные выше для соединения формулы I, в присутствии восстановителя, при этом в применяемых в качестве исходных продуктов соединениях формулы II и III функциональные группы при необходимости могут находиться в защищенной форме и/или в форме солей, при условии, если присутствует солеобразующая группа и возможна реакция с участием соединений в форме соли;
удаляют любые защитные группы в защищенном производном соединения формулы I;
и при необходимости превращают полученное соединение формулы I в другое соединение формулы I или в его N-оксид, превращают свободное соединение формулы I в соль, и превращают полученную соль соединения формулы I в свободное соединение или в другую соль.
Приоритет по пунктам:
| WO 00/27820 A1, 18.05.2000 | |||
| US 3226394 A, 28.12.1965 | |||
| ПРОИЗВОДНЫЕ АНТРАНИЛОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1994 |
|
RU2128644C1 |
Авторы
Даты
2008-01-27—Публикация
2002-11-07—Подача