Область изобретения
Изобретение относится к производному антраниловой кислоты, обладающему превосходной активностью в качестве лекарственного средства.
Предпосылки изобретения, предшествующий уровень техники
Стенокардия, которая является одним из ишемических заболеваний сердца, известна как заболевание, которое часто поражает пожилых людей. Хотя нитраты и нитриты, антагонисты кальция, β- блокаторы и т.д. использовались в качестве лекарств для ее лечения, эти средства еще недостаточно эффективны при лечении стенокардии или для предотвращения ее развития в инфаркт миокарда. Кроме того, недавно обнаружено снижение возраста больных, поражаемых стенокардией, и осложнение состояния больных, вызванное изменением стиля жизни и стрессом в результате возрастания сложностей социальной жизни, таким образом разработка нового типа улучшенных лекарственных средств остро необходима. Что касается нитратов и нитритов из числа используемых в настоящее время лекарственных средств, то полагают, что их действие связано с циклическим гуанозинмонофосфатом (далее, сокращенно, цГМФ), который является одним из циклических нуклеотидов, известным как внутриклеточный вторичный медиатор. Хорошо известно, что цГМФ обладает релаксантной активностью на гладкие мышцы сосудов и бронхов. Хотя механизм действия этого средства не всегда ясен, но активность цГМФ, как обычно полагают, должна быть связана с синтезом цГМФ, ускоряемым активированной гуанилатциклазой. Однако эти средства проявляют низкую биодоступность и действуют относительно короткое время, сообщается также о наличии устойчивости к ним, что становится клинической проблемой.
Описание изобретения
Учитывая эти обстоятельства, авторы настоящего изобретения начали разработку нового типа улучшенных лекарственных средств.
А именно, авторы изобретения направили свое внимание на ингибирующую активность против цГМФ-фосфодиэстеразы (далее, сокращенно, цГМФ-ФДЭ) и интенсивно изучали соединения, обладающие такой активностью, в течение ряда лет. В результате исследования обнаружено, что производное антраниловой кислоты, описанное ниже, обладает такой активностью и эффективно для лечения различных ишемических заболеваний сердца. Настоящее изобретение выполнено на основе этой находки.
Настоящее изобретение относится к производному антраниловой кислоты общей формулы (1) или его фармакологически приемлемым солям.
Производные антраниловой кислоты общей формулы 1 или их фармакологически приемлемые соли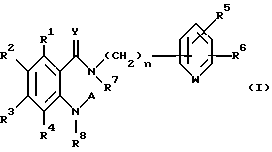
где R1, R2, R3 и R4 - одинаковые или различные и означают атом водорода, атом галогена, необязательно галогенированную низшую алкоксигруппу, нитро-, цианогруппу, пиразолильную группу, группу формулы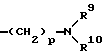
где R9 и R10 являются одинаковыми или различными и означают атом водорода, низшую алкильную группу и p является целым числом от 0 до 6, группу формулы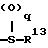
где R13 представляет атом водорода, низшую алкильную группу;
q является целым числом от 0 до 2;
R2 может быть 1,2,4-триазолильной группой;
R5 и R6 являются одинаковыми или различными и представляют атом водорода, атом галогена, цианогруппу, низшую алкоксигруппу, или R5 и R6 вместе с атомами углерода, к которым они присоединены, образуют оксолановое кольцо, 1,3-диоксолановое или 1,4-диоксановое кольцо,
W представляет группу -N= или -CH=,
R7 и R8 - являются одинаковыми или различными и представляют атом водорода, низшую алкильную группу,
или R1 и R7 вместе с атомами углерода и азота соответственно, к которым они присоединены, образуют пиперидиновое или пирролидиновое кольцо, A представляет атом водорода, необязательно галогенированную низшую алкильную группу или группу формулы:
-X-(CH2)m - Z,
где X представляет -CO-, -CH2- или - S(О)2-;
Z представляет водород, галоген, фенильную группу, которая может быть замещена низшим алкилом, низшей алкоксигруппой, карбоксигруппой или низшей алкоксикарбонильной группой, пиридильную группу, группу формулы NR11R12, где R11 и R12, вместе с атомом азота, к которому они присоединены, образуют пиперидиновое или пирролидиновое кольцо, которое может быть замещено низшей алкильной группой, оксигруппой, карбоксигруппой, низшей алкоксикарбонильной группой, циклоалкильную группу, содержащую 3-8 атомов углерода, которая может быть замещена оксигруппой, цианогруппой, низшей алкилкарбонилоксигруппой, карбоксигруппой или низшей алкоксикарбонильной группой, пиперидильной группой, m является целым числом от 0 до 6, Y представляет атом кислорода, и n является целым числом от 0 до 6.
Изобретение относится также к промежуточным продуктам для их получения, а именно к производным антраниловой кислоты общей формулы II или их фармакологически приемлемым солям: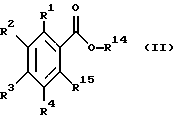
где R1 - R4 одинаковые или различные и означают атом водорода, атом галогена, цианогруппу, низшую алкоксигруппу, пиразолильную группу, R2 может быть 1,2,4-триазолильной группой,
R14 представляет фенилалкил, замещенный низшей алкоксигруппой,
R15 представляет аминогруппу,
к производным антраниловой кислоты общей формулы III или их фармакологически приемлемым солям: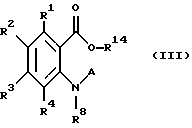
где R1 - R4 имеют значения, указанные выше;
R8 означает атом водорода;
A означает атом водорода, группу формулы
-X-(CH2)m - Z,
где X представляет CO;
Z представляет группу формулы, -NR11R12, в которой R11 и R12 вместе с атомом азота, к которому они присоединены, образуют пиперидиновое или пирролидиновое кольцо, возможно замещенное окси-группой, карбокси-группой или низшей алкоксикарбонильной группой,
m - целое число от 0 до 6,
к производным антраниловой кислоты общей формулы IV или их фармакологически приемлемым солям:
где R1 - R4 представляют атом водорода, атом галогена;
m - от 0 до 6,
Z представляет фенильную группу, замещенную низшей алкоксикарбонильной группой.
Изобретение относится также к лекарственному препарату, проявляющему ингибирующую активность в отношении циклической гуанозинмонофосфат фосфодиэстеразы, который содержит эффективное количество производного антраниловой кислоты или его фармакологически приемлемой соли общей формулы I и фармакологически приемлемый носитель.
Некоторые соединения по настоящему изобретению образуют гидраты и нет необходимости говорить, что эти гидраты попадают в объем настоящего изобретения.
Далее будут описаны основные способы получения соединения по настоящему изобретению.
Способ получения 1.
Соединение, представленное общей формулой I, где Y является атомом кислорода, может быть получено следующим способом: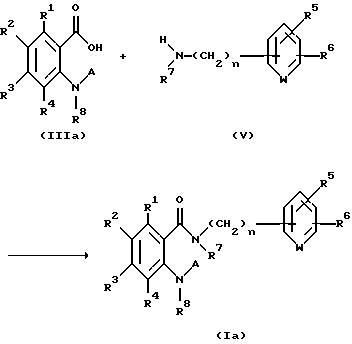
(где R1 - R8, A и n, каждый, определены выше).
Соответственно, этот способ является способом, по которому производное антраниловой кислоты, представленное общей формулой Ia, можно получать конденсацией производного антраниловой кислоты, представленного общей формулой IIIa, с амином, представленным общей формулой V, обычным методом.
Хотя эту конденсацию можно осуществлять обычным методом, использование конденсирующего средства является предпочтительным.
Конденсирующий реагент, который используется в этом способе, может быть любым обычным конденсирующим реагентом, и его примеры включают N,N'-дициклогексилкарбодиимид, N-этил-N'-(3- димeтилaминoпpoпил)кapбoдиимид и 2-этокси-1-этоксикарбонил-1,2- дигидрохинолин.
Конденсация может быть ускорена в присутствии N-гидроксисукцинимида или N-гидроксибензтриазола.
Растворителем для конденсации может быть любой органический растворитель, инертный по отношению к воде и к конденсации. Примеры такого растворителя включают простые эфиры, такие как эфир, тетрагидрофуран и 1,4-диоксан; углеводороды, такие как бензол, толуол и ксилол; дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил, N,N-диметилформамид и пиридин.
Температура реакции может изменяться от около 0oC до температуры кипения растворителя.
Способ получения 2.
Соединение, представленное общей формулой I где A -группа формулы -CO(CH2)m-Z (где Z и m, каждый, определены выше), может быть получено также следующим способом: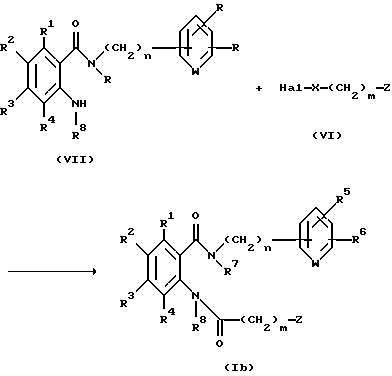
(где R1-R8, m, n и Z, каждый, определены выше).
Соответственно, этот способ является способом, в котором целевое соединение, представленное общей формулой Ib, может быть получено взаимодействием соединения, представленного общей формулой VI, с производным антраниловой кислоты, представленного общей формулой VII.
Растворитель, используемый в этой реакции, может быть любым органическим растворителем, инертным по отношению к взаимодействию, и его примеры включают простые эфиры, такие как эфир, тетрагидрофуран и 1,4-диоксан; углеводороды, такие как бензол, толуол и ксилол; дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил, N,N-диметилформамид и пиридин.
Температура реакции может изменяться от около -20oC до температуры кипения растворителя.
Реакция может быть ускорена добавлением органического основания, такого как триэтиламин, диизопропилэтиламин или лутидин; или неорганического основания, такого как гидрокарбонат натрия, карбонат натрия, карбонат калия или гидроксид натрия.
Способ получения 3.
Соединение, представленное общей формулой I, где Z является карбоксильной группой, может быть получено следующим способом: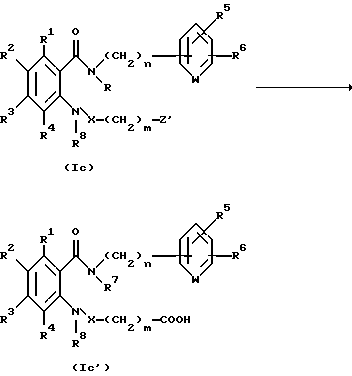
(где R1 - R8, m и n, каждый, определены выше, и Z' представляет защищенную карбоксильную группу).
Соответственно, этот способ является способом, по которому целевое соединение, представленное общей формулой Ic', может быть получено гидролизом соединения, представленного общей формулой Ic.
Растворитель, используемый для гидролиза, может быть любым органическим растворителем, инертным по отношению к гидролизу, и его примеры включают спирты, такие как метанол и этанол; и простые эфиры, такие как тетрагидрофуран и 1,4-диоксан.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Кроме того, присутствие неорганического основания в процессе гидролиза дает желаемый результат, и примеры основания включают гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид бария.
Способ получения 4.
Соединение, представленное общей формулой I, где Z представлено группой NR11R12, может быть получено также следующим способом: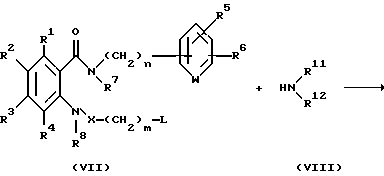
(где R1 - R8, R11, R12, n и m, каждый, определены выше; и L представляет уходящую группу, такую как атом галогена, п-толуолсульфонилоксигруппу или метансульфонилоксигруппу).
Соответственно, этот способ является способом, по которому целевое соединение, представленное формулой Id, может быть получено взаимодействием соединения, представленного общей формулой VII, с амином, представленным общей формулой VIII.
Растворитель, используемый в этой реакции, включает простые эфиры, такие как эфир, тетрагидрофуран и 1,4-диоксан; спирты, такие как метанол и этанол; дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил, N.N-диметилформамид и диметилсульфоксид.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Способ получения 5.
Соединение, представленное обшей формулой I, где R8 обозначает водород и X представлен формулой: -CH2-, может быть получено следующим способом:
(где R1 - R7, m, n и Z, каждый, определены выше).
Соответственно, этот способ является способом, в котором целевое соединение, представленное обшей формулой Ie, может быть получено взаимодействием соединения, представленного общей формулой IV, с соединением, представленным обшей формулы V.
Указанное выше взаимодействие может быть проведено в растворителе, инертном по отношению к взаимодействию, и примеры таких растворителей включают простые эфиры, такие как эфир, тетрагидрофуран и 1,4-диоксан; углеводороды, такие как бензол, толуол и ксилол; ацетонитрил, N,N-димeтилфopмaмид; диметилсульфоксид; дихлорметан; хлороформ и 1,2-дихлорэтан.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Кроме того, использование каталитического количества основания в реакции дает желаемый результат, и примеры основания включают 4-диметиламинопиридин и 4-пирролидинопиридин.
Способ получения 6.
Соединение, представленное общей формулой I, где R8 и A, каждый, обозначают атом водорода, может быть получено также следующим способом: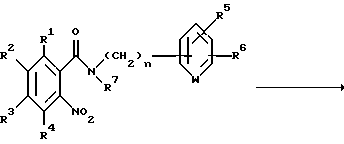

(где R1 - R7 и n, каждый, определены выше).
Соответственно, этот способ является способом, в котором целевое соединение, представленное общей формулой If, может быть получено восстановлением соединения, представленного общей формулой If', обычным способом.
Восстановление может быть проведено любым обычным способом, и примеры включают каталитическое восстановление с использованием палладия на угле или оксида платины, или восстановление с использованием металла (такое как железо, олово или цинк), восстановление с помощью кислоты (такой как соляная или уксусная кислоты) и восстановление с использованием хлорида олова (II).
Растворитель, используемый для вышеуказанного восстановления, может быть растворителем, инертным по отношению к восстановлению, например метанолом или этанолом.
Температура реакции изменяется предпочтительно от около 0oC до температуры кипения растворителя.
Способ получения 7.
Соединение, представленное общей формулой IIIa, являющееся исходным продуктом по Способу получения 1, может быть получено следующим способом:
(где R1 - R4, R8 и A, каждый, определены выше; и R14 представляет группу, выбранную из групп, определенных для R14, за исключением атомов водорода.
Соответственно, соединение, представленное общей формулой IIIa, может быть получено снятием защиты у соединения, представленного общей формулой III.
Когда R14 обозначает алкил, то предпочтительно, чтобы растворитель, инертный по отношению к снятию защиты (такой как метанол, этанол, тетрагидрофуран или 1,4-диоксан), использовался в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия или гидроксид бария, при температуре от около 0oC до температуры кипения растворителя.
Когда R14 является бензилом, то соединение, представленное общей формулой IIIa, может быть получено каталитическим восстановлением с использованием палладия на угле или ему подобных в качестве катализатора.
Кроме того, когда R14 является 4-метоксибензилом, бензгидрилом или тому подобное, то снятие защиты можно проводить, используя трифторуксусную кислоту, в растворителе, таком как дихлорметан, хлороформ или 1,2-дихлорэтан, в присутствие анизола. В этом случае предпочтительно, чтобы температура реакции изменялась от около 0oC до температуры кипения растворителя.
Способ получения 8.
Соединение, представленное общей формулой III, где X представлен формулой: -CO-; m= 0; и R8 является атомом водорода, являющееся исходным продуктом по Способу получения 7, может быть получено следующим способом: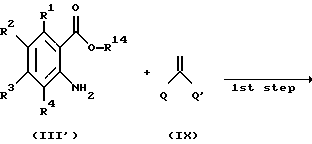
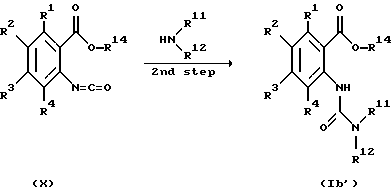
(где Q и Q', каждый представляет атом хлора, трихлорметоксигруппу или имидазолильную группу; и R1 - R4 и R11 - R13, каждый, определены выше), (1-я стадия).
Соответственно, эта стадия является стадией, по которой соединение, представленное общей формулой X, получают взаимодействием соединения, представленного общей формулой III', с соединением, представленным общей формулой IX.
При проведении вышеуказанной реакции можно использовать инертный растворитель, и примеры растворителя включают эфир, тетрагидрофуран, 1,4-диоксан, дихлорметан, хлороформ, 1,2- дихлорэтан, бензол, толуол и ксилол.
Температура реакции изменяется предпочтительно от около 0oC до температуры кипения растворителя.
Если необходимо, для ровного протекания вышеуказанной реакции можно использовать основание, такое как триэтиламин или диизопропилэтиламин.
Соединение X, полученное на этой стадии, может быть использовано без его выделения на следующей 2-й стадии (2-я стадия).
Эта стадия является стадией, в которой соединение, представленное общей формулой I'b, получают взаимодействием соединения X, полученного на вышеуказанной 1-й стадии, с соединением, представленным общей формулой VIII.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Способ получения 9.
Среди производных антраниловой кислоты (III') в качестве исходного продукта по Способу получения 8, может быть получено антраниловое производное по свободной карбоксильной группе (IIa') следующим способом: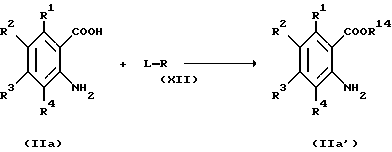
(где R1 - R4 и R14, каждый, определены выше).
Соответственно, этот способ является способом, по которому соединение, представленное общей формулой IIa', может быть получено взаимодействием соединения, представленного общей формулой IIa, с соединением, представленным общей формулой XII.
Реакцию предпочтительно проводят в растворителе, таком как N,N-диметилформамид, ацетонитрил, бензол, толуол, ксилол, дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран или 1,4-диоксан в присутствии основания, такого как гидрокарбонат натрия, карбонат натрия, карбонат калия или карбонат цезия при температуре от около 0oC до температуры кипения растворителя.
Способ получения 10.
Соединение, представленное общей формулой VII, которое является исходным продуктом по Способу получения 4, может быть получено следующим способом: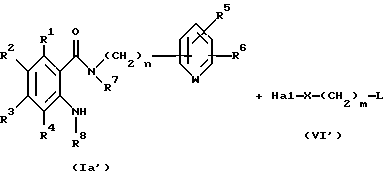
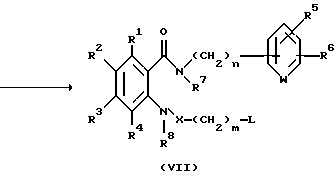
(где Hal представляет атом галогена; L представляет уходящую группу, такую как атом галогена, п-толуолсульфонилоксигруппу или метансульфонилоксигруппу; и R1 - R8, m, n и X, каждый, определены выше).
Соответственно, этот способ является способом, в котором соединение, представленное общей формулой Id', может быть получено взаимодействием соединения, представленного общей формулой Ia', с соединением, представленным общей формулой VI'.
Растворитель, используемый в этой реакции, может быть любым растворителем, инертным по отношению к реакции, и примеры таких растворителей включают эфир, тетрагидрофуран, 1,4-диоксан, бензол, толуол, ксилол, дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил, N,N-диметилформамид и пиридин.
Температура реакции предпочтительно изменяется от -20oC до температуры кипения растворителя.
Кроме того, одновременное присутствие основания в реакции дает желаемые результаты, и примеры основания включают органические основания, такие как триэтиламин, диизопропилэтиламин и лутидин; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия и гидроксид натрия.
Способ получения 11.
Соединение, представленное общей формулой IV, которое является исходным продуктом по Способу получения 5, может быть получено следующим способом: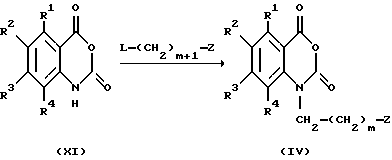
(где R1 - R4, m, X, Hal и Z, каждый, определены выше).
Соответственно, этот способ является способом, по которому целевое соединение, представленное общей формулой IV, может быть получено взаимодействием соединения, представленного общей формулой XI, с гидроксидом натрия, гидридом калия или подобными соединениями, и взаимодействием образующегося продукта с соединением, представленным общей формулой VI'.
При проведении взаимодействия можно использовать растворитель, инертный по отношению к реакции, и примеры растворителя включают N,N-диметилформамид, N,N-диметилацетамид и тетрагидрофуран.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Способ получения 12.
Соединение, представленное общей формулой If', которое является исходным продуктом по Способу получения 6, может быть получено следующим способом:
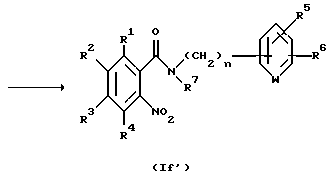
(где R1 - R7 и n, каждый, определены выше).
Соответственно, этот способ является способом, по которому соединение, представленное общей формулой If', может быть получено взаимодействием карбоновой кислоты, представленной общей формулой IIa, или ее реакционноспособным производным, с соединением, представленным общей формулой V, посредством амидирования.
Реакционноспособное производное соединение IIa включает галогенангидриды кислот, такие как ацилхлорид и ацилбромид; азиды кислот; их активные эфиры с N-гидроксибензтриазолом и N-гидроксисукцинимидом; и их смешанные ангидриды кислот с п-толуолсульфокислотой и эфирами фосфорной кислоты.
Когда в качестве соединения IIa используют свободную карбоновую кислоту, то взаимодействие можно проводить в присутствии конденсирующего агента, такого как N, N'-дициклогексилкарбодиимид, N-этил-N'-(3-диметиламинопропил)карбодиимид или 2-этокси-1- этоксикарбонил-1,2-дигидрохинолин.
При проведении реакции можно использовать органический растворитель, инертный по отношению к реакции, и примеры растворителя включают эфир, тетрагидрофуран, 1,4-диоксан, бензол, толуол, ксилол, дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил и N,N-диметилформамид.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Когда используют некоторые реакционноспособные соединения, добавление основания к реакционной системе дает желаемые результаты, и примеры основания включают триэтиламин, диизопропилэтиламин, пиридин, лутидин, гидрокарбонат натрия, карбонат натрия и карбонат калия.
Способ получения 13.
Соединение, представленное формулой IIa, которое является исходным продуктом по Способу получения 12, могут быть получены следующим способом: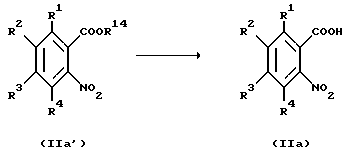
(где R1 - R4 и R14, каждый, определены выше).
Соответственно, соединение, представленное общей формулой IIa, может быть получено снятием защиты у соединения, представленного общей формулой IIa'.
Вышеуказанную реакцию проводят предпочтительно в инертном растворителе (таком как метанол, этанол, тетрагидрофуран или 1,4-диоксан) в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия или гидроксид бария при температуре, изменяющейся от около 0oC до температуры кипения растворителя.
Способ получения 14.
Соединение, представленное общей формулой III', которое является исходным продуктом по Способу получения 8, может быть получено следующим способом: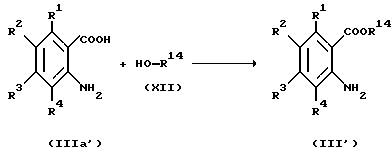
(где R1 - R4 и R14, каждый, определены выше).
Соответственно, соединение, представленное общей формулой III', может быть получено конденсацией соединения, представленного общей формулой IIIa', с соединением, представленным общей формулой XII.
Хотя конденсацию можно проводить обычным способом, использование конденсирующего агента предпочтительно. Примеры конденсирующего агента включают N, N'-дициклoгeкcилкapбoдиимид, N-этил-N'-(3- димeтилaминoпpoпил)кapбoдиимид и 2-этокси-1-этоксикарбонил-1,2- дигидрохинолин, хотя можно использовать любой общеизвестный обычно используемый конденсирующий агент.
Реакцию можно ускорить добавлением 4-диметиламинопиридина или 4- пирролидинопиридина.
Реакцию предпочтительно проводят в инертном по отношению к реакции растворителе, таком как ацетонитрил, дихлорметан, хлороформ или N,N-диметилформамид при температуре, изменяющейся от около 0oC до температуры кипения растворителя.
Способ получения 15.
Соединение, представленное общей формулой III, где X представлен формулой: -CO-; m=0; R2 является цианогруппой; и R8 обозначает атом водорода, которое является исходным продуктом по Способу получения 7, может быть получено следующим способом:
(где R1, R3, R4 и R14 каждый, определены выше; М представляет атом металла; и p является целым числом от 1 до 3).
Соответственно, соединение, представленное общей формулой XIV, может быть получено взаимодействием соединения, представленного общей формулой III'', с цианидом переходного металла, представленного общей формулой XX.
Цианидом переходного металла предпочтительно является цианид меди(I).
Реакцию предпочтительно проводят либо без какого-либо растворителя, либо в присутствии органического растворителя, инертного по отношению к реакции, такого как пиридин, хинолин, N,N-диметилформамид, N-метил-2-пирролидон или гексаметилфосфортриамид (ГМФТА) при температуре от около 0oC до температуры кипения растворителя.
Способ получения 16.
Соединение, представленное общей формулой V, по Способу получения 1, где R7 является атомом водорода, может быть получено следующим способом: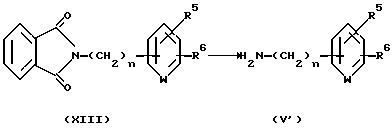
(где R5, R6 и n, каждый, определены выше).
Соответственно, соединение, представленное общей формулой V', может быть получено снятием защиты у соединения, представленного общей формулой XIII. Хотя снятие защиты можно проводить кислотным или щелочным гидролизом, предпочтительно осуществлять снятие защиты с использованием гидразина.
Растворитель, используемый в вышеописанной реакции, может быть любым растворителем, инертным по отношению к реакции, и примеры включают метанол, этанол, тетрагидрофуран и 1,4-диоксан.
Реакцию предпочтительно проводят при температуре от около 0oC до температуры кипения растворителя.
Способ получения 17.
Соединение, представленное общей формулой XIII, которое используется в качестве исходного продукта по Способу получения 16, может быть получено следующим способом: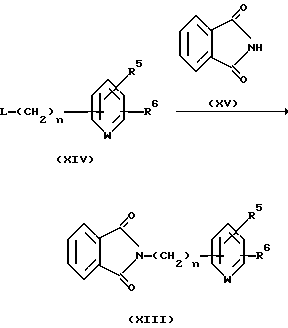
(где R5,R6, n и L, каждый определены выше).
Соответственно, соединение, представленное общей формулой XIII, может быть получено взаимодействием соединения, представленного общей формулой XIV, с фталимидом, представленным общей формулой XV.
Когда L - гидроксигруппа, соединение, представленное общей формулой XIII, можно получать конденсацией соединения, представленного общей формулой XIV, с фталимидом по реакции Мицунобу (Mitsunobu). Хотя эту реакцию можно проводить обычным способом, она может быть проведена с использованием производного фосфина, такого как трифенилфосфин и трибутилфосфин, и диэтилазокарбоксилата или диэфира азокарбоновой кислоты, такого как диэтилазокарбоксилат.
Вышеуказанную реакцию предпочтительно проводят в растворителе, инертном по отношению к реакции, таком как тетрагидрофуран, 1,4-диоксан или ацетонитрил, при температуре от около 0oC до температуры кипения растворителя.
Когда L является уходящей группой, такой как атом галогена, метансульфонилокси или п-толуолсульфонилокси, то соединение, представленное общей формулой XIII, может быть получено взаимодействием соединения формулы XIV с фталимидом или его солью с щелочным металлом. Соль щелочного металла фталимида включает его натриевую и калиевую соль.
Растворитель, используемый в реакции, может быть инертным по отношению к реакции, и примеры такого растворителя включают ацетонитрил, N,N-диметилформамид, метанол, этанол, тетрагидрофуран и 1,4-диоксан.
Когда используют фталимид, то реакцию можно ускорить добавлением неорганического основания, такого как карбонат натрия, гидрокарбонат натрия или карбонат калия, или органического основания, такого как триэтиламин, трибутиламин или диазациклоундецен.
Температура реакции предпочтительно изменяется от около 0oC до температуры кипения растворителя.
Способ получения 18.
Соединение, представленное общей формулой I, где Y является атомом кислорода, и R1 и R7 соединяются вместе с образованием кольца, может быть получено следующим способом:
(где R2 - R6, n и L, каждый, определены выше).
Соответственно, соединение, представленное общей формулой Ig, может быть получено взаимодействием соединения, представленного общей формулой Ig', с соединением, представленным общей формулой XVI.
Предпочтительно, реакцию проводят в присутствии основания, такого как гидрид натрия, гидрид калия или трет-бутоксид калия.
Реакцию предпочтительно проводят в растворителе, инертном по отношению к реакции, таком как тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метил-2-пирролидон, при температуре от около 0oC до температуры кипения растворителя.
Способ получения 19.
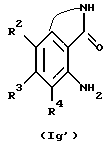
Соединение, представленное общей формулой Ig', которое является исходным продуктом по Способу получения 18, может быть получено следующим способом:

(где R2 - R4, R14 и L, каждый, определены выше; и q представляет целое число от 1 до 6). (1-я стадия)
Соответственно, соединение, представленное общей формулой XVIII, получают взаимодействием соединения, представленного общей формулой XVII, с аммиаком.
При проведении реакции можно использовать растворитель, инертный по отношению к реакции, и примеры растворителя включают метанол, этанол, тетрагидрофуран и 1,4-диоксан.
Температура реакции предпочтительно колеблется от около 0oC до температуры кипения растворителя. (2-я стадия)
Соответственно, соединение, представленное общей формулой Ig', получают восстановлением соединения, представленного общей формулой XVIII, обычным способом.
Восстановление можно осуществлять обычным способом, и примеры способа включают каталитическое восстановление с применением палладия на угле или оксида платины; восстановление металлом, таким как железо, олово или цинк, и кислотой, такой как соляная кислота или уксусная кислота; и восстановление хлоридом олова (II).
Растворитель, используемый при восстановлении, может быть растворителем, инертным по отношению к реакции, например метанол или этанол.
Реакцию проводят при температуре от 0oC до температуры кипения растворителя.
Способ получения 20.
Соединение, представленное общей формулой Ig', которое является исходным продуктом по Способу получения 18, может быть получено также следующим способом: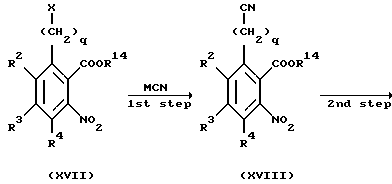
(где R2 - R4, R14, L и q, каждый, определены выше). (1-я стадия)
Соответственно, соединение, представленное общей формулой XVIII, получают взаимодействием соединения, представленного общей формулой XVII, с цианидом металла.
При проведении вышеуказанной реакции можно использовать растворитель, инертный по отношению к реакции, и примеры таких растворителей включают воду, метанол, этанол, тетрагидрофуран, 1,4-диоксан, ацетонитрил, N,N-диметилформамид и диметилсульфоксид.
Температура реакции предпочтительно колеблется от около 0oC до температуры кипения растворителя. (2-я стадия)
Соответственно, соединение, представленное общей формулой Ig', получают восстановлением соединения, представленного общей формулой XVIII, обычным способом.
Это восстановление может быть осуществлено обычным способом, и примеры включают каталитическое восстановление с использованием палладия на угле или оксида платины; восстановление металлом, таким как железо, олово или цинк, и кислотой, такой как соляная кислота или уксусная кислота; и восстановление хлоридом олова(II).
Растворитель, используемый в восстановлении, может быть растворителем, инертным к восстановлению, например метанолом или этанолом.
Температура реакции предпочтительно колеблется от около 0oC до температуры кипения растворителя.
Способ получения 21.
Соединение, представленное общей формулой Ig', где R2 является атомом галогена, которое является исходным продуктом по Способу получения 18, может быть получено следующим способом: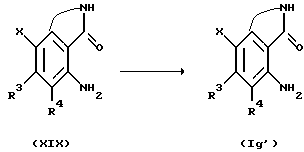
(где R3, R4 и X, каждый, определены выше).
Соответственно, соединение, представленное общей формулой Ig', может быть получено галогенированием соединения, представленного общей формулой XIX, обычным способом.
Это галогенирование можно проводить обычным способом, и примеры способа включают способы с использованием хлора, брома, тетра-н-бутиламмонийтрибромида и бензилтриметиламмонийтрибромида, соответственно.
Растворитель, используемый при галогенировании, может быть растворителем, инертным по отношению к галогенированию, например дихлорметан, хлороформ или уксусная кислота.
Температура реакции предпочтительно колеблется от около 0oC до температуры кипения растворителя.
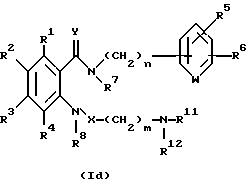
Настоящее изобретение также относится к следующим соединениям: соединения, представленные общей формулой II, и их фармакологически приемлемые соли:
общая формула II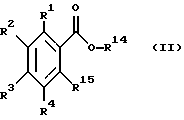
(где R1, R2, R3 и R4, каждый, определены выше; R14 представляет атом водорода, необязательно галогенированную низшую алкильную группу или необязательно замещенную арилалкильнцю группу; и R15 представляет нитрогруппу или аминогруппу).
Соединения, представленные общей формулой III, и их фармакологически приемлемые соли:
общая формула III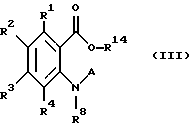
(где R1, R2, R3, R4, R8, R14 и A, каждый, определены выше);
и соединения, представленные общей формулой IV, и их фармакологически приемлемые соли:
общая формула IV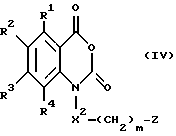
(где R1, R2, R3, R4, m и Z, каждый, определены выше; и X2 представляет группу -CH2-).
Эти соединения II, III и IV используются в качестве промежуточных продуктов для получения соединений I.
Далее описан Фармакологический экспериментальный пример для демонстрации полезности соединений по настоящему изобретению.
Фармакологический экспериментальный пример
Ферментативная ингибирующая активность с использованием cGMP-PDE, полученного из аорты свиньи
1. Методика опыта
Ферментативная активность cGMP-PDE, полученного из аорты свиньи, определяли по методу Томпсона и др. Это определение проводили в присутствии 1 мМ EGTA, используя в качестве субстрата 1 мкМ cGMP. Каждое соединение, согласно настоящему изобретению, растворяли в ДМСО и добавляли к реакционной системе, чтобы определить его ингибирующую активность. Конечную концентрацию ДМСО в реакционной системе устанавливают в 4% и ниже.
cGMP-PDE получали следующим способом:
Аорту свиньи разрезали на мелкие кусочки, добавляли 10-кратный объем буфера A (20 мМ трис/HCl, 2 мМ ацетата магния, 1 мМ дитиотрейтола, 5 мМ EDTA, 1400 TIU/л апротинина, 10 мг/л лейпептина, 1 мМ бензамидина, 0.2 мМ PMSF, pH 7.5). Полученную смесь гомогенизируют и центрифугируют при 100000 оборотов в час. Полученную надосадочную жидкость (супернатант) помещают в колонку DEAE-Toyopearl 650S (продукт фирмы Tosoh, Токио, Япония) с последующим промыванием колонки буфером В (50 мМ Трис/HCl, 0.1 мМ EGTA, 2 мМ ацетата магния, 1 мМ Дитиотрейтола, 0.2 мМ PMSF, pH 7.5). Полученную колонку подвергают градиентному элюированию 0.05-0.4 М хлоридом натрия для получения CaM-независимых фракций cGMP-PDE.
2. Результаты опыта
Ингибирующая активность cGMP-PDE соединений по настоящему изобретению, определенная таким образом, приведена в таблице 1, где более низкое значение IC50 (ИК50) отражает более значительный эффект.
Из результатов Фармакологического экспериментального Примера можно понять, что соединение по настоящему изобретению обладает ингибирующей активностью против PDE, в частности cGMP-PDE. Другими словами, можно понять, что соединение по настоящему изобретению обладает действием по увеличению концентрации in vivo cGMP благодаря ингибирующей активности против cGMP-PDE. Соответственно, производные антраниловой кислоты по настоящему изобретению эффективны при профилактике и лечении заболеваний, для которых эффективно ингибирующее cGMP-PDE действие. Примеры таких заболеваний включают ишемические заболевания сердца, такие как стенокардия, инфаркт миокарда, хроническая и острая сердечная недостаточность; легочная гипертензия, сопровождающаяся или не сопровождающаяся легочное сердце; гипертензия, обусловленная различными причинами; недостаточность периферийного кровообращения; недостаточность мозгового кровообращения; дисфункция мозга; и аллергические заболевания, такие как бронхиальная астма, атонический дерматит и аллергический ринит.
Кроме того, соединения по настоящему изобретению менее токсичны и более безопасны, будучи, таким образом, полезны в этом смысле.
Настоящее изобретение относится к профилактическому и терапевтическому агенту для лечения заболеваний, для которых эффективно ингибирование фосфодиэстеразы, причем средства содержат производные антраниловой кислоты или их фармакологически приемлемые соли, описанные выше, в качестве активных компонентов; и профилактические и терапевтические агенты для лечения заболеваний, для которых эффективно ингибирование циклической GMP, причем агент содержит производное антраниловой кислоты или его фармакологически приемлемую соль, как описано выше, в качестве активного ингредиента.
Соединение по настоящему изобретению особенно эффективно против ишемических заболеваний сердца, стенокардии, гипертензии, легочной гипертензии, сердечной недостаточности и астмы.
Кроме того, настоящее изобретение относится к лекарственному средству, содержащие фармакологически эффективное количество производного антраниловой кислоты или его фармакологически приемлемой соли, описанной выше, и фармакологически приемлемый носитель; и к способу профилактики и лечения заболеваний, который включает введение фармакологически приемлемого количества производного антраниловой кислоты или его фармакологически приемлемой соли, описанной выше, для ингибирования фосфодиэстеразы.
Соединение по настоящему изобретению вводят в качестве лекарственного средства перорально или парентерально. Его доза изменяется в зависимости от степени заболевания; возраста, пола, веса и чувствительности к лекарствам; схемы приема лекарственного средства; выбора времени дозирования; интервала между приемами; вида препарата; лекарства, вводимого одновременно; вида активного компонента и т.д., но не ограничивается только этим.
При пероральном введении дневная доза для взрослого обычно составляет около 0.1-1000 мг, предпочтительно около 5-500 мг, которые могут быть введены от одной до трех порциями в день.
При введении в виде инъекции дневная доза обычно составляет от около 1 мкг/кг до 3000 мкг/кг, предпочтительно около 3-1000 мкг/кг.
Твердый препарат для перорального введения согласно настоящему изобретению получают добавлением наполнителя и, если необходимо, связующего, разрыхлителя, смазки, красителя и/или добавки к активному ингредиенту и формованием полученной смеси в таблетки, покрытые таблетки, гранулы, порошки или капсулы.
Примеры наполнителя включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и диоксид кремния; примеры связующего включают поливиниловый спирт, поливиниловый эфир, этилцеллюлозу, метилцеллюлозу, аравийскую камедь, трагакант, желатин, шеллак, гидроксипропилцеллюлозу, цитрат кальция, декстрин и пектин; примеры смазывающих агентов включают стеарат магния, тальк, полиэтиленгликоль, оксид кремния и затвердевающие растительные масла; примеры красителя включают красители, разрешенные в качестве фармацевтических добавок; и примеры добавок включают порошок какао, ментол, ароматический порошок, ментоловое масло, борнеол и порошок корицы. Конечно, таблетки и гранулы могут быть соответственно покрыты сахаром, желатином или тому подобным, если необходимо.
Когда получают инъекционный препарат, согласно настоящему изобретению можно добавлять к активному ингредиенту pH регулятор, буфер, суспендирующий агент, солюбилизирующий агент, стабилизатор, изотонический агент и/или консервант, при необходимости, и готовят смесь для внутривенного, подкожного или внутримышечного введения обычным способом. Кроме того, инъекционный препарат может быть высушен вымораживанием, если необходимо.
Примеры суспендирующего агента включают метилцеллюлозу, Полисорбат 80, гидроксиэтилцеллюлозу, аравийскую камедь, порошок трагаканта, натрийкарбоксиметилцеллюлозу и полиоксиэтиленсорбитанмонолаурат.
Примеры солюбилизирующего средства включают полиоксиэтилен, затвердевающее касторовое масло, Полисорбат 80, никотинамид, полиоксиэтиленсорбитанмонолаурат, Макрогол (Macrogol) и этиловый эфир жирных кислот касторового масла.
Далее для более ясного понимания настоящего изобретения будут описаны примеры, хотя они предшествуют Препаративным примерам как примерам синтеза, по которым получают исходные соединения, необходимые для получения соединений по настоящему изобретению.
Препаративный пример 1
1-[(2-Карбокси-4-хлорфенил)карбамоил]пиперидин-4-карбоновая кислота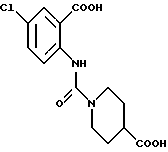
Анизол (4,7 мл) добавляют к 4,09 г этил-1-[[4-хлор-2-[(4- метоксибензилохси)карбонил] фенил] карбамоил]пиперидин-4-карбоксилата, затем по каплям добавляют 6,6 мл трифторуксусной кислоты. Полученную смесь перемешивают при комнатной температуре один час и концентрируют и добавляют эфир. Образующуюся смесь экстрагируют насыщенным водным раствором гидрокарбоната натрия. pH водного раствора устанавливают 2 с помощью концентрированной соляной кислоты для осаждения кристаллов. Кристаллы выделяют фильтрованием и промывают водой с получением 2,09 г указанного в заголовке соединения в виде белого порошка (выход: 69%).
Т.пл. 159-160oC (разл.)
(белые иглы из водного этанола).
ЯМР (400 МГц, δ, CDCl3):
1.27 (т, J-7.1 Гц, 3H), 1.78 (м, 2H), 2.02 (м, 2H), 2.58 (м, 1H), 3.10 (м, 2H), 4.11 (м, 2H), 4.18 (к, J=7.1 Гц, 2H), 7.47 (дд, J=2.7, 9.2 Гц, 1H), 8.01 (д, J=2.7 Гц, 1H), 8.47 (д, J=9.2 Гц, 1H), 10.70 (с, 1H).
Препаративный пример 2
Этил-1-[[4-хлор-2-(4-метохсибензилокси)карбонилфенил] карбамоил] - пиперидин-4-карбоксилат
К 4-метоксибензил-2-амино-5-хлорбензоату (20.74 г), растворенному в 180 мл тетрагидрофурана, добавляют 12.69 г 1,1'-карбонилдиимидазола. Полученную смесь кипятят с обратным холодильником 43 ч и оставляют охлаждаться, затем добавляют 12.06 мл этилизонипекотата. Полученную смесь выдерживают при комнатной температуре один час и концентрируют, добавляют воду и экстрагируют этилацетатом. Органическую фазу промывают 1H соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором обычной соли, последовательно, сушат над безводным сульфатом магния и отгоняют растворитель. Hерастворимое в бензоле вещество отфильтровывают, а фильтрат очищают колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3:1)) и получают 11.07 г указанного в заголовке соединения в виде желтого масла с выходом 33%.
ЯМР (400 МГц, δ, CDCl3):
1.27 (т, J = 7.1 Гц, 3H), 1.76 (м, 2H), 2.01 (м, 2H), 2.54 (м, 1H), 3.07 (м, 2H), 3.83 (с, 3H), 4.12 (м, 2H), 4.32 (к, 7.1 Гц, 2H), 5.28 (с, 2H), 6.91-6.96 (м, 2H), 7.36-7.40 (м, 2H), 7.43 (дд, J - 2.6, 9.2 Гц, 1H), 7.95 (д, J = 2.6 Гц), 8.66 (д, J = 9.2 Гц), 10.68 (с, 1H).
Препаративный пример 3
4-Метоксибензил-2-амино-5-хлорбензоат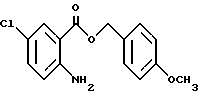
2-Амино-5-хлорбензойную кислоту (15.00 г), метоксибензилхлорид (13.1 мл) и карбонат калия (13.3 г) добавляют к N,N-диметилформамиду (175 мл). Полученную смесь перемешивают при комнатной температуре 43 ч, затем к смеси добавляют ледяную воду. Полученную смесь экстрагируют этилацетатом. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле (растворитель н-гексан/этилацетат (5:1)) и получают 20.97 г указанного в заголовке соединения в виде бледно-желтого масла с выходом 82%.
ЯМР (400 МГц, δ, CDCl3):
3.82 (с, 3H), 5.24 (с, 2H), 5.74 (ш, 2H), 6.59 (д, J = 8.8 Гц, 1H), 6.89-6.94 (м, 2H), 7.18 (дд, J = 2.6, 8.8 Гц, 1H), 7.34-7.39 (м, 2H), 7.82 (д, J = 2.6 Гц, 1H).
Препаративный пример 4
Матил-2-амидо-5-диметиламинометилбензоат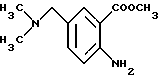
Метил-5-диметиламинометил-2-нитробензоат (12.92 г) и дигидрат хлорида олова(II) (60.39 г) добавляют к 110 мл этанола. Полученную смесь перемешивают при 70oC в течение одного часа, затем добавляют ледяную воду. Полученную смесь подщелачивают карбонатом натрия и экстрагируют этилацетатом. Органическую фазу сушат безводным сульфатом магния и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол (от 30: 1 до 10:1)) и получают 10.93 г указанного в заголовке соединения в виде бледно-желтой жидкости с выходом 97%.
ЯМР (400 МГц, δ, CDCl3):
2.20 (с, 6H), 3.29 (с, 2H), 3.85 (с, 3H), 5.68 (ш, 2H), 6.63 (д, J = 8.4 Гц, 1H), 7.22 (дд, J = 2.2, 8.4 Гц, 1H), 7.74 (д, J = 2.2 Гц, 1H).
Препаративный пример 5
Метил-5-диметиламинометил-2-нитробензоат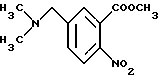
К метил-5-метил-2-нитробензоату (8.06 г), растворенному в 140 мл четыреххлористого углерода, добавляют 7.72 г N-бромсукцинимида и 0.50 г бензоилпероксида. Полученную смесь кипятят с обратным холодильником 5 ч и отфильтровывают нерастворимый материал. Фильтрат концентрируют до получения желтого масла. Это масло растворяют в 80 мл ацетонитрила, добавляют 4.04 г хлоргидрата диметиламина и 6.86 г карбоната калия. Полученную смесь перемешивают при комнатной температуре 5 ч и концентрируют, затем добавляют воду. Полученную смесь экстрагируют этилацетатом. Органическую фазу сушат безводным сульфатом магния и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол (30:1)) и получают 3.17 г целевого соединения в виде желтого масла с выходом 32%.
ЯМР (400 МГц, δ, CDCl3):
2.26 (с, 6H), 3.51 (с, 2H), 3.93 (с, H) 7.59 (дд, J = 1.8, 8.4 Гц, 1H), 7.68 (д, J = 1.8 Гц, 1H), 7.91 (д, J = 8.4 Гц, 1H).
Препаративный пример 6
6-Хлор-1-[4-(этоксикарбонил)бутил] -1,2-дигидро-4H-1,3- бензоксазин-2,4-дион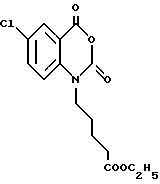
1.11 г 60% гидрида натрия (суспендированного в минеральном масле) суспендируют в 80 мл N, N-диметилацетамида и по частям добавляют 5.00 г 6-хлор-1,2-дигидро-4H-3,1-бензоксазин-2,4-диона. Полученную смесь перемешивают при комнатной температуре в течение одного часа и добавляют 4.81 мл этил-5-бромвалерата. Полученную смесь перемешивают при 50oC 24 ч, выливают в 200 мл смеси 1H соляной кислоты и льда и экстрагируют этилацетатом. Органическую фазу промывают водой и насыщенным водным раствором соли, сушат безводным сульфатом магния и растворитель отгоняют. К полученному твердому остатку либо добавляют эфир. Полученную смесь фильтруют и получают 4.89 г целевого соединения в виде бледно-желтого порошка, выход 60%.
Т.пл. 97-99oC (слабо-желтые иглы из н-гексан/этилацетата).
ЯМР (400 МГц, δ, CDCl3):
1.25 (т, J = 7.1 Гц, 3H), 1.72 - 1.86 (м, 4H), 2.40 (т, J = 7.0 Гц, 2H), 4.07 (т, J = 7.3 Гц, 2H), 4.13 (к, J = 7.1 Гц, 2H), 7.17 (д, J = 9.0 Гц, 1H), 7.71 (дд, J = 2.6, 9.0 Гц, 1H), 8.12 (д, J = 2.6 Гц, 1H)
Препаративный пример 7
6-Хлор-1-[3-(этоксикарбонил)пропил] -1,2-дигидро-4H-1,3- бензоксазин-2,4-дион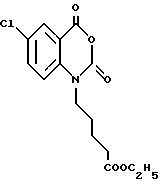
Бледно-желтый порошок получен с выходом 60%.
Т.пл. 78-80oC
(бледно-желтые призмы из н-гексан/этилацетата)
ЯМР (400 МГц, δ CDCl3):
1.30 (т, J = 7.1 Гц, 3H), 1.99 - 2.09 (м, 2H), 2.51 (т, J = 6.2 Гц, 2H), 4.12 (т, J = 8.1 Гц, 2H), 4.19 (к, J = 7.1 Гц, 2H), 7.52 (д, J = 9.0 Гц, 1H), 7.75 (дд, J = 2.4, 9.0 Гц, 1H), 8.12 (д, J = 2.4 Гц, 1H)
Препаративный пример 8
6-Хлор-1-(4-метоксикарбонилбензил)-1,2-дигидро-4H-1,3- бензоксазин-2,4-дион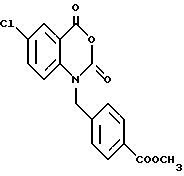
Слабо-желтый порошок получен с выходом 89%
Т.пл. 214-217oC
(белые иглы из EtOAc).
ЯМР (400 МГц, δ, CDCl3):
3.91 (с, 3H), 6.97 (д, J = 9.0 Гц, 1H), 7.33 - 7.38 (м, 2H), 7.57 (дд, J = 2.6, 9.0 Гц, 1H), 8.02 - 8.06 (м, 2H), 8.14 (д, J = 2.6 Гц)
Препаративный пример 9
4-Метоксибензил-2-амино-5-бромбензоат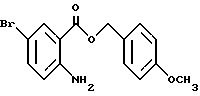
2-Амино-5-бромбензойную кислоту (15.59 г), 4-метоксибензиловый спирт (7.5 мл), 1,3-дициклогексилкарбодиимид (14.89 г) и 4-диметиламинопиридин (8.07 г) добавляют к 200 мл ацетонитрила. Полученную смесь перемешивают при комнатной температуре 18 ч и нерастворимый материал отфильтровывают. Фильтрат концентрируют в вакууме, добавляют воду и образующуюся смесь экстрагируют этилацетатом. Этилацетную фазу последовательно промывают водой, 1H соляной кислотой, водой, 1H гидроксидом натрия, водой и насыщенным водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 8:1 до 5:1)), выход 65%.
1H-ЯМР (400 МГц, CDCl3) δ:
3.82 (3H, с), 5.24 (2H, с), 5.76 (2H, ш с), 6.54 (1H, д, J = 8.8 Гц), 6.92 (2H, м), 7.30 (1H, дд, J = 8.8, 2.6 Гц), 7.37 (2H, м), 7.96 (1H, д, J = 2.6 Гц).
Препаративный пример 10
4-Метоксибензил-2-амино-5-цианобензоат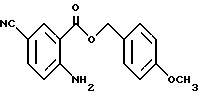
2-Амино-5-цианобензойную кислоту (32.18 г), 4-метоксибензилхлорид (28.34 мл) и безводный карбонат калия (28.89 г) добавляют к 400 мл N,N-димeтилфopмaмидa. Полученную смесь перемешивают при комнатной температуре 15 часов, добавляют ледяную воду и экстрагируют этилацетатом. Этилацетатную фазу промывают последовательно водой, 1H соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 4: 1 до 3:1)). Полученный твердый материал промывают смесью н-гексан/этилацетат и получают 28.92 г указанного в заголовке соединения в виде бледно-желтого порошка, выход 52%.
Т.пл. 120-122oC.
Масс.: 283 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.83 (3H, с), 5.26 (2H, с), 6.30 (2H, ш с), 6.65 (1H, д, J = 8.6 Гц), 6.91 - 6.98 (2H, м), 7.35 - 7.40 (2H, м), 7.43 (1H, дд, J = 8.6, 2.0 Гц), 8.19 (1H, д, J = 2.0 Гц).
Препаративный пример 11
Этил-1-[[4-бром-2-[(4-метоксибензилокси)карбонил] фенил] - карбамоил]пиперидин-4-карбоксилат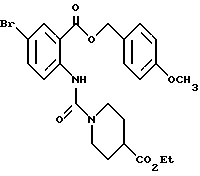
4-Метоксибензил-2-амино-5-бромбензоат (13.13 г) и 1,1'- карбонилдиимидазол (6.97 г) добавляют к 100 мл тетрагидрофурана. Полученную смесь нагревают при кипячении с обратным холодильником 41 ч, оставляют охлаждаться и затем добавляют 6.63 мл этилизонипекотата. Полученную смесь перемешивают при комнатной температуре один час и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3: 1)) и получают 4.40 г указанного в заголовке соединения в виде бледно-желтого твердого вещества, выход 20%.
Т.пл. 98-100oC.
Масс.: 520 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.76 (2H, м), 2.01 (2H, м), 2.55 (1H, м), 3.07 (2H, м), 3.83 (3H, с), 4.12 (2H, м), 4.17 (2H, к, J = 7.1 Гц), 5.28 (2H, с), 6.94 (2H, м), 7.38 (2H, м), 7.56 (1H, дд, J = 9.2, 2.6 Гц), 8.09 (1H, д, J = 2.6 Гц), 8.46 (1H, д, J = 9.2 Гц), 10.69 (1H, с).
Прапаративный пример 12
1-[[4-Хлор-2-[(4-метоксибензилокси)карбонил] фенил]- карбамоил]-4-гидроксипиперидин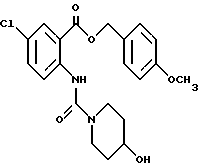
Указанное в заголовке соединение получают как в Препаративном примере 3 в виде белого твердого вещества, выход 4%.
Т.пл. 112-114oC.
Масс.: 419 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.55 - 1.65 (3H, м), 1.98 (2H, м), 3.27 (2H, ддд, J = 13.7, 9.2, 3.3 Гц), 3.83 (3H, с), 3.91 - 4.00 (3H, м), 5.28 (2H, с), 6.91 - 6.96 (2H, м), 7.35 - 7.40 (2H, м), 7.43 (1H, дд, J = 9.2, 2.6 Гц), 7.95 (1H, д, J - 2.6 Гц), 8.52 (1H, д, J = 9.2 Гц), 10.69 (1H, с).
Препаративный пример 13
1-[[4-Циано-2-[(4-метоксибензилокси)карбонил] фенил] карбамоил] - 4-гидроксипиперидин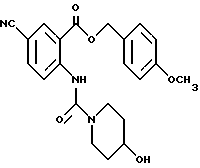
Указанное в заголовке соединение получают, как в Препаративном примере 3, в виде белого твердого вещества, выход 4%.
Т.пл. 167-169oC.
Масс.: 410 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.56 - 1.67 (3H, м), 1.99 (2H, м), 3.33 (2H, ддд, J - 13.7, 9.0, 3.5 Гц), 3.84 (3H, с), 3.91 - 4.03 (3H, м), 5.31 (2H, с), 6.92 - 6.97 (2H, м), 7.35 - 7.40 (2H, м), 7.69 (1H, дд, J = 9.0, 2.2 Гц), 8.30 (1H, д, J = 2.2 Гц), 8.69 (1H, д, J = 9.0 Гц), 11.04 (1H, с).
Препаративный пример 14
Этил-1-[(4-бром-2-карбоксифенил)карбамоил]пиперидин-4-карбо- ксилат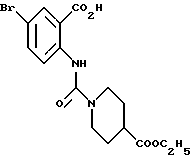
Смесь, содержащую 3.82 г этил-1-[[4-бром-2-[(4- метоксибензилокси)карбонил] фенил]карбамоил]пиперидин-4-карбоксилата, 4.02 мл анизола и 5.7 мл трифторуксусной кислоты, перемешивают при комнатной температуре 2.5 ч и концентрируют в вакууме. К остатку добавляют водный раствор карбоната натрия и эфир для отделения водной фазы. Эфирную фазу экстрагируют водным раствором карбоната натрия. Обе водные фазы объединяют и промывают эфиром. Полученную водную фазу подкисляют концентрированной соляной кислотой, что дает осадок. Осадок отделяют фильтрованием и получают 2.50 г целевого соединения в виде белого порошка, выход 85%.
Т.пл. 153-155oC (разл.).
Масс.: 399 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.28 (3H, т, J = 7.1 Гц), 1.77 (2H, м), 2.02 (2H, м), 2.58 (1H, м), 3.09 (2H, м), 4.11 (2H, м), 4.18 (2H, к, J = 7.1 Гц), 7.61 (1H, дд, J = 9.2, 2.6 Гц), 8.16 (1H, д, J = 2.6 Гц), 8.42 (1H, д, J = 9.2 Гц), 10.67 (1H, с).
Препаративный пример 15
1-[(2-Карбокси-4-хлорфенил)карбамоил]-4-гидроксипиперидин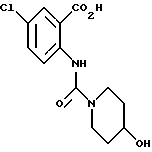
Указанное в заголовке соединение получают, как в Препаративном примере 6, в виде белого твердого вещества, выход 77%.
Т.пл. 168-170oC (разл.).
Масс.: 299 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.36 (2H, м), 1.78 (2H, м), 3.16 (2H, ддд, J = 13.5, 9.5, 3.1 Гц), 3.67 - 3.83 (3H, м), 7.57 (1H, дд, J = 9.2, 2.7 Гц), 7.89 (1H, д, J = 2.7 Гц), 8.43 (1H, д, J = 9.2 Гц), 10.85 (1H, с).
Препаративный пример 16
1-[(2-Карбокси-4-цианофенил)карбамоил]-4-гидроксипиперидин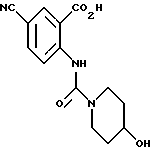
Указанное в заголовке соединение получают, как в Препаративном примере 6, в виде белого твердого вещества, выход 77%.
Т.пл. 175-179oC (разл.).
Масс: 290 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.37 (2H, м), 1.78 (2H, м), 3.19 (2H, ддд, J = 13.2, 9.3, 3.5 Гц), 2.68 - 3.82 (3H, м), 7.93 (1H, дд, J = 9.0, 2.2 Гц), 8.30 (1H, д, J = 2.2 Гц), 8.55 (1H, д, J = 9.0 Гц), 11.23 (1H, с).
Препаративный пример 17
Метил-2-амино-5-бром-4-метоксибензоат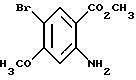
Метил-2-амино-4-метоксибензоат (8.44 г) и карбонат кальция (5.13 г) растворяли в смешанном растворителе, содержащем 250 мл дихлорметана и 100 мл метанола, и порциями добавляют 19.09 г бензилтриметиламмонийтрибромида. Полученную смесь перемешивают при комнатной температуре один час и отфильтровывают нерастворимый материал. Фильтрат концентрируют в вакууме, к остатку добавляют этилацетат и смесь фильтруют через силикагель. Фильтрат концентрируют в вакууме и остаток очищают колоночной хроматографией на силикагеле (растворитель н-гексан/этилацетат (4:1)). Полученный твердый материал промывают н-гексаном и получают 10.37 г указанного в заголовке соединения в виде бледно-желтого твердого вещества, выход 86%.
Т.пл. 104-105oC.
Масс: 260 (MH+).
1Н-ЯМР (400 МГц, CDCl3) δ:
3.84 (3H, с), 3.87 (3H, с), 5.85 (2H, ш, с), 6.12 (1H, с), 8.01 (1H, с).
Препаративный пример 18
7-Hитроизоиндолин-1-он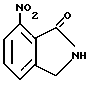
Метил-2-бромметил-5-нитробензоат (6.59 г) суспендировали в 130 мл метанола. Через полученную суспензию пропускали большой избыток аммиака при комнатной температуре. Полученную смесь перемешивали при комнатной температуре 20 ч и концентрировали в вакууме. К остатку добавляли воду, нерастворимый материал отфильтровывали и промывали эфиром. Указанное в заголовке соединение получали в виде слабо-желтого порошка, выход 90%.
Т.пл. 218-221oC.
Масс: 179 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
4.48 (2H, с), 7.80 (1H, дд, J = 7.7, 7.3 Гц), 7.87 (1H, д, J = 7.3 Гц), 7.88 (1H, д, J = 7.7 Гц), 8.98 (1H, ш с).
Препаративный пример 19
7-Аминоизоиндолин-1-он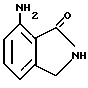
7-Hитроизоиндолинон (6.52 г) суспендировали в 1000 мл тетрагидрофурана, добавляли 1 г 10% палладия на угле (водосодержащий). Полученную смесь подвергали каталитическому восстановлению в условиях комнатной температуры и 1 атм. Через 18 ч катализатор отфильтровывали и фильтрат концентрировали в вакууме. Полученное твердое вещество промывали эфиром и получали 5.13 г целевого соединения в виде слабо-желтого порошка, выход 95%.
Т.пл. 153-155oC.
Масс: 149 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ: 4.36 (2H, с), 5.21 (2H, ш с), 6.57 (1H, д, J = 8.1 Гц), 6.70 (1H, д, J = 7.3 Гц), 6.72 (1H, ш с), 7.27 (1H, дд, J = 8.1, 7.3 Гц).
Препаративный пример 20
Метил-2-цианометил-6-нитробензоат
Метил-2-бромметил-5-нитробензоат (11.64 г) суспендировали в 200 мл метанола и добавляли раствор 2.19 г цианида натрия в 20 мл воды. Полученную смесь перемешивали 3 ч при 50oC и концентрировали в вакууме. К остатку добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 3:1 до 2: 1)). Полученный твердый материал промывали н-гексаном и получали 5.43 г указанного в заголовке соединения в виде белого твердого вещества, выход 58%.
Т.пл. 103-105oC.
Масс: 221 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.91 (2H, с), 3.98 (3H, с), 7.68 (lH, т, J = 8.1 Гц), 7.87 (1H, дд, J = 8.1, 1.1 Гц), 8.11 (1H, дд, J = 8.1, 1.1 Гц).
Препаративный пример 21
8-Амино-1,2,3,4-тетрагидро-1-изохинолинон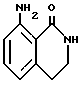
Метил-2-цианометил-5-нитробензоат (54.43 г) суспендируют в 200 мл метанола и добавляют 4.5 мл концентрированной соляной кислоты и 0.18 г оксида платины. Полученную смесь подвергали каталитическому восстановлению при комнатной температуре и давлении 3 кг/см2. Через 7 ч катализатор отфильтровывали и фильтрат концентрировали в вакууме.
Остаток растворяли в 50 мл метанола и добавляли 7.50 г безводного карбоната калия. Полученную смесь кипятили с обратным холодильником 9.5 ч и отфильтровывали нерастворимый осадок. Фильтрат концентрировали в вакууме и добавляли воду. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол (30:1)) и получали 0.75 г указанного в заголовке соединения в виде белого порошка, выход 19%.
Т.пл. 128-130oC.
Масс: 163 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
2.90 (2H, т, J = 6.6 Гц), 3.47 (1H, дт, J = 6.6, 2.9 Гц), 5.98 (1H, ш с), 6.05 (2H, ш с), 6.43 (1H, дд, J = 7.3, 1.1 Гц), 6.52 (IH, дд, J = 8.3, 1.1 Гц), 7.12 (1H, дд, J = 8.1, 7.3 Гц).
Препаративный пример 22
7-Амино-4-бромизоиндолинон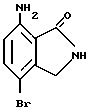
Указанное в заголовке соединение получают, как в Препаративном примере 9, в виде белого порошка, выход 62%.
Т.пл, 253-258oC (разл.).
Масс: 227 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
4.12 (2H, с), 6.20 (2H, ш с), 6.56 (1H, д, J = 8.6 Гц), 7.32 (1H, Д, J = 8.6 Гц), 8.38 (1H, ш с).
Прапаративный пример 23
5-Бром-8-аминоизохинолин-1-он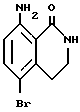
Указанное в заголовке соединение получают, как в Препаративном примере 9, в виде белого порошка, выход 66%.
Т.пл. 158-160oC (разл.).
Масс: 241 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.01 (2H, т, J = 6.6 Гц), 3.48 (2H, дт, J = 6.6, 2.9 Гц), 6.13 (2H, ш с), 6.19 (1H, ш с), 6.45 (1H, д, J = 8.8 Гц), 7.32 (1H, д, J = 8.8 Гц).
Прапаративный пример 24
Метил-2-амино-5-цианобензоат
Метил- 2-амино-5-бромбензоат (5.00 г) растворяли в 10 мл N-метил-2-пирролидона и добавляли 2.14 г цианида меди(I). Полученную смесь перемешивали при 180oC 4 ч и добавляли водный раствор этилендиамина. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 3:1 до 2:1)) Полученный твердый материал промывали н-гексаном и получали 2.84 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 74%.
Т.пл. 127-130oC.
Масс: 177 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 6.30 (2H, ш с), 6.67 (1H, д, J = 8.8 Гц), 7.45 (1H, дд, J = 8.6, 2.0 Гц), 8.20 (1H, д, J = 2.0 Гц).
Препаративный пример 25
2-Амино-5-цианобензойная кислота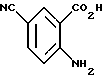
Метил-2-амино-5-цианобензоат (2.84 г) растворяли в 60 мл этанола и добавляли 24 мл 1H гидроксида натрия. Полученную смесь перемешивали при комнатной температуре 6 ч и концентрировали в вакууме. К остатку добавляли воду и эфир и водную фазу отделяли. Эфирную фазу экстрагировали водой. Обе водные фазы объединяли и подкисляли концентрированной соляной кислотой до выпадения осадка. Осадок отделяли фильтрованием и получали указанное в заголовке соединение в виде белого порошка, выход 98%.
Т.пл. 268-272oC.
Масс: 163 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
6.85 (1H, д, J = 8.8 Гц), 7.49 (2H, ш с), 7.55 (1H, дд, J = 8.8, 2.2 Гц), 8.03 (1H, д, J = 2.2 Гц).
Препаративный пример 26
2-Амино-5-(1,2,4-триазол-1-ил)бензойная кислота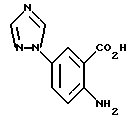
Этил-2-амино-5-(1,2,4-триазол-1-ил)бензоат (2.00 г) суспендировали в 15 мл этанола и добавляли 9.2 мл 1H гидроксида натрия. Полученную смесь перемешивали при 65oC 1 ч и концентрировали в вакууме. К остатку добавляли воду и смесь подкисляли концентрированной соляной кислотой до выпадения осадка. Осадок отделяли фильтрованием и получали 2.55 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 100%.
Т.пл. 229-231oC.
Масс: 235 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) :
8.24 - 8.27 (2H, м), 8.34 (1H, м), 8.36 (1H, с), 9.57 (1H, с).
Препаративный пример 27
2-Амино-5-(1-пиразолил)бензойная кислота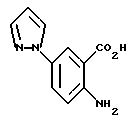
Указанное в заголовке соединение получали, как в Препаративном примере 18, в виде слабо-желтого порошка, выход 100%
Т.пл. 246-248oC.
Масс: 234 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6 δ:
6.67 (1H, дд, J = 2.6, 1.8 Гц), 7.90 (1H, д, J = 1.8 Гц), 8.18 - 8.24 (2H, м), 8.27 (1H, м), 8.79 (1H, д, J = 2.6 Гц).
Препаративный пример 28
2-Амино-5-бром-4-метоксибензойная кислота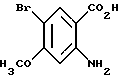
Указанное в заголовке соединение получали, как в Препаративном примере 17, в виде слабо-желтого порошка, выход 97%.
Т.пл. 198oC (разл.).
Масс: 245 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6): δ:
3.80 (3H, с), 6.42 (1H, с), 7.71 (1H, с)
Препаративный пример 29
5-Хлор-2-хлорацетамидо-N-(3-хлор-4- метоксибензил)бензамид
2-Амино-5-хлор-N-(3-хлор-4- метоксибензил)бензамид (1.74 г) растворяли в 18 мл тетрагидрофурана, добавляли 0.82 мл триэтиламина. При охлаждении льдом прибавляли по каплям хлорацетилхлорид (0.47 мл). Полученную смесь перемешивали при комнатной температуре 2 ч и добавляли воду. Выпавший осадок отделяли фильтрованием, промывали водой и эфиром и получали 1.77 г указанного в заголовке соединения в виде слабо-кремового порошка, выход 82%.
Т.пл. 174-176oC.
Масс: 401 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.91 (3H, с), 4.18 (2H, с), 4.54 (2H, д, J = 5.9 Гц), 6.55 (1H, м), 6.92 (1H, д, J = 8.4 Гц), 7.22 (1H, дд, J = 8.4, 2.2 Гц), 7.38 (1H, д, J = 2.2 Гц), 7.41 (IH, дд, J = 8.8, 2.4 Гц), 7.44 (IH, д, J = 2.4 Гц), 8.53 (1H, д, J = 8.8 Гц), 11.71 (1H, ш с).
Препаративный пример 30
2-(4-Бромпропиониламино)-5-хлор-N-(3,4-метилендиоксибензил)- бензамид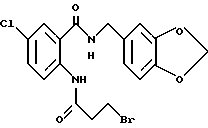
Указанное в заголовке соединение получали, как в Препаративном примере 21, в виде слабо-оранжевого порошка, выход 95%.
Т.пл. 170-171oC.
Масс: 439 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
2.88, 3.00 (всего 2H, т, J = 6.8 Гц), 3.69, 3.87 (всего 2H, т, J = 6.8 Гц), 4.50 (2H, д, J = 5.5 Гц), 5.97 (2H, с), 6.49 (1H, ш м), 6.79 (1H, д, J = 7.9 Гц), 6.81 (1H, д, J = 7.9 Гц), 6.83 (1H, с), 7.41 (1H, д, J = 2.4 Гц), 7.41 (1H, дд, J = 9.5, 2.4 Гц), 8.57 (1H, д, J = 9.5 Гц), 11.12 (1H, ш с).
Препаративный пример 31
2-(4-Бромбутириламино)-5-хлор-N-(3,4-метилендиоксибензил)бензамид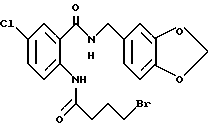
Указанное в заголовке соединение получают, как в Препаративном примере 21, в виде слабо-охристого порошка, выход 90%.
Т.пл. 158-159oC.
Масс: 455 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
2.28 (2H, тт, J = 7.1, 6.4 Гц), 2.61 (2H, т, J = 7.1 Гц), 3.52 (2H, т, J = 6.4 Гц), 4.51 (2H, д, J = 5.5 Гц), 5.98 (2H, с), 6.46 (1H, м), 6.78 - 6.86 (3H, м), 7.40 (1H, д, J = 2.4 Гц), 7.40 (1H, дд, J = 9.5, 2.4 Гц), 8.56 (1H, д, J = 9.5 Гц), 11.02 (1H, ш с).
Препаративный пример 32
Этил-транс-4-(трет-бутоксикарбониламино)циклогексанкарбоксилат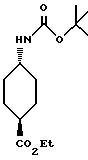
Моноэтиловый эфир транс-1,4-циклогександикарбоновой кислоты (10.00 г) растворяли в 200 мл трет-бутанола, добавляли 7.67 мл триэтиламина и 11.85 мл дифенилфосфорилазида. Полученную смесь кипятили с обратным холодильником 7 ч, концентрировали и добавляли воду. Образующуюся смесь экстрагировали этилацетатом. Органическую фазу промывали 1H соляной кислотой, водой, 1H гидроксидом натрия и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 8:1 до 4: 1)) и получали 5.36 г указанного в заголовке соединения в виде белого твердого вещества, выход 40%.
Т.пл. 89-91oC.
Масс: 270 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ: 1.11 (2H, м), 1.25 (3H, т, J = 7.1 Гц), 1.44 (9H, с), 1.52 (2H, м), 1.96 - 2.15 (4H, м), 2.20 (1H, дт, J = 12.3, 3.5 Гц), 3.41 (1H, ш с), 4.11 (2H, к, J = 7.1 Гц), 4.39 (1H, ш с).
Препаративный пример 33
Этил-транс-4-[К-(5-бромбутил)-N-(трет- бутоксикарбонил)амино] -циклогексанкарбоксилат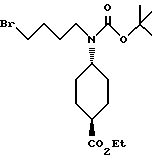
Этил-транс-4-(третбутоксикарбониламино)циклогексанкарбоксилат (5.36 г) и 1,5-дибромбутан (13.5 мл) растворяли в 50 мл N.N-диметилформамида и добавляли 0.87 г 60% гидрида натрия. Полученную смесь перемешивали при 50oC 5 ч и выливали в воду со льдом. Смесь экстрагировали этилацетатом. Органическую фазу промывали 1H соляной кислотой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 10:1 до 5:1)) и получали 4.32 г указанного в заголовке соединения в виде бесцветного масла, выход 52%.
Масс: 420 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.25 (3H, т, J = 7.1 Гц), 1.35 - 1.60 (17H, м), 1.99 - 2.12 (2H, м), 2.19 (1H, м), 3.05 (2H, ш с), 3.41 (2H, т, J - 6.8 Гц), 3.86 (1H, ш с), 4.12 (2H, к, J = 7.1 Гц).
Препаративный пример 34
Этил-транс-4-пиперидиноциклогексанкарбоксилат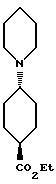
Этил-трант-4-[N-(5-бромбутил)-N-(трет-бутоксикарбонил)- амино] циклогексанкарбоксилат (5.92 г) растворяли в 20 мл хлороформе и добавляли 18 мл 4H соляной кислоты/этилацетата. Полученную смесь перемешивали при комнатной температуре 14 ч и концентрировали. Остаток растворяли в 30 мл этанола и добавляли 5.85 г безводного карбоната калия. Полученную смесь перемешивали при комнатной температуре 3 ч, затем 6 ч при 80oC и добавляли Целит. Hерастворимый материал отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол/концентрированный водный аммиак (1000:100:2)) и получали 1.91 г указанного в заголовке соединения в виде бледно-желтого масла, выход 57%.
Масс: 240 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.25 (3H, т, J = 7.1 Гц), 1.28 (2H, м), 1.38 - 1.51 (4H, м), 1.54 - 1.62 (4H, м), 1.95 (2H, м), 2.04 (2H, м), 2.15 - 2.31 (2H, м), 2.48 - 2.53 (4H, м), 4.11 (2H, к, J = 7.1 Гц).
Прапаративный пример 35
транс-4-Пиперидиноциклогексанкарбоновая кислота
Этил-транс-4-пиперидиноциклогексанкарбоксилат (1.91 г) растворяли в 20 мл этанола. Полученный раствор перемешивали при комнатной температуре 3 дня, устанавливали pH 7 1H соляной кислотой, концентрировали в вакууме и очищали колоночной хроматографией на ODS (растворитель: вода) и добавляли воду. Нерастворимый осадок отфильтровывали, фильтрат концентрировали в вакууме и добавляли метанол. Нерастворимый осадок отфильтровывали и фильтрат концентрировали в вакууме. Полученный твердый материал промывали эфиром и получали 1.54 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 91%.
Масс: 212 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.14 - 1.32 (4H, м), 1.36 (2H, м), 1.41 - 1.49 (4H, м), 1.73 (2H, м), 1.88 (2H, м), 1.96 (1H, м), 2.19 (1H, м), 2.36 - 2.48 (4H, м).
Препаративный пример 36
N-(3,4-Метилендиоксибензил)-2-нитро-5-(1-пиразолил)бензамид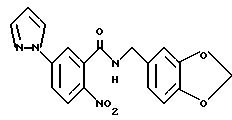
2-Hитро-5-(1-пиразолил)бензойную кислоту (1.40 г), пиперониламин (0.82 мл), хлоргидрат 1-(3-диметиламинопропил)-3-этилкарбодиимида (1.27 г), 1-гидроксибензтриазол (0.89 г) и триэтиламин (0.92 мл) добавляли к 20 мл N, N-диметилформамида. Полученную смесь перемешивали при комнатной температуре 14 ч и добавляли воду. Осадок отделяли фильтрованием и получали 2.19 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 100%.
Т.пл. 179-180oC.
Масс: 367 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.56 (2H, д, J = 5.5 Гц), 5.95 (2H, с), 6.18 (1H, м), 6.56 (1H, дд, J = 2.6, 1.8 Гц), 6.78 (1H, д, J = 7.9 Гц), 6.85 (1H, дд, J = 7.9, 1.6 Гц), 6.91 (1H, д, J = 1.6 Гц), 7.78 (1H, д, J = 1.8 Гц), 7.83 (1H, дд, J = 9.0, 2.4 Гц), 7.86 (1H, д, J = 2.4 Гц), 8.01 (1H, д, J = 2.6 Гц), 8.19 (1H, д, J = 9.0 Гц).
Препаративный пример 37
N-(3,4-Метилендиоксибензил)-2-нитро-5-(1,2,4-триазол-1-ил)- бензамид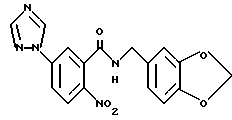
Указанное в заголовке соединение получали, как в Препаративном примере 28, в виде порошка цвета бледной охры, выход 84%.
Т.пл. 187-190oC.
Масс: 368 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.58 (2H, д, J = 5.5 Гц), 5.97 (2H, с), 6.12 (1H, ш), 6.76 (1H, д, J = 7.9 Гц), 6.86 (1H, дд, J = 7.9, 1.7 Гц), 6.91 (1H, д, J = 1.7 Гц), 7.91 (1H, дд, J = 9.5, 2.6 Гц), 7.91 (1H, д, J = 2.6 Гц), 8.16 (1H, с), 8.27 (1H, д, J = 9.5 Гц), 8.69 (1H, с).
Препаративный пример 38
N-(4-Хлор-3-метоксибензил)фталимид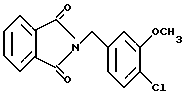
Хлор-5-метиланизол (8.00 г), N-бромсукцинимид (9.55 г) и бензоилпероксид (0.62 г) добавляли к 170 мл четыреххлористого углерода. Полученную смесь кипятили с обратным холодильником 1 ч и оставляли охлаждаться. Нерастворимый материал отделяли фильтрованием и фильтрат концентрировали в вакууме. Остаток растворяли в 100 мл N,N-диметилформамида и добавляли 10.41 г фталимида калия. Полученную смесь перемешивали при 50oC 1 ч и добавляли воду со льдом. Осадок отделяли фильтрованием, промывали водой и эфиром и получали 8.66 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 52%.
Т.пл. 156-159oC.
Масс: 301 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.80 (2H, с), 6.98 (1H, дд, J = 8.1, 1.8 Гц), 7.05 (1H, д, J = 1.8 Гц), 7.29 (1H, д, J = 8.1 Гц), 7.69 - 7.75 (2H, м), 7.82 -7.88 (2H, м).
Препаративный пример 39
N-[(2-Meтoкcи-5-пиpидил)мeтил]фтaлимид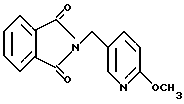
2-Метокси-5-пиридинметанол (2.79 г), фталимид (2.92 г) и трифенилфосфин (5.71 г) добавляли к 35 мл тетрагидрофурана. Полученную смесь охлаждали льдом и по каплям добавляли раствор 3.43 г диэтилазодикарбоксилата в 5 мл тетрагидрофурана. Полученную смесь перемешивали при охлаждении льдом 1 ч, затем 15 ч при комнатной температуре и выливали в воду со льдом. Смесь экстрагировали этилацетатом. Органическую фазу промывали 1H соляной кислотой, водой, насыщенным водным раствором гидрокарбонатом натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме и добавляли бензол. Нерастворимый материал отфильтровывали и фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3: 1)). Полученное твердое вещество промывали н-гексаном и получали 4.07 г указанного в заголовке соединения в виде белого порошка, выход 77%.
Т.пл. 122-124oC.
Масс: 269 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.78 (2H, с), 6.99 (1H, д, J = 8.6 Гц), 7.68 (1H, дд, J = 8.6, 2.6 Гц), 7.68 - 7.74 (2H, м), 7.81 - 7.87 (2H, м), 8.27 (1H, д, J = 2.6 Гц).
Прапаративный пример 40
N-(3-Формил-4-метоксибензил)фталимид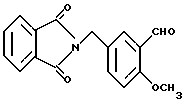
N-(4-Meтoкcибeнзил)фтaлимид (14.00 г) растворяли в 100 мл трифторуксусной кислоты и по частям добавляли 8.09 г гексаметилентетрамина. Образующуюся смесь перемешивали при комнатной температуре 1 ч, кипятили с обратным холодильником 3.5 ч и добавляли воду со льдом. Смесь экстрагировали этилацетатом. Органическую фазу промывали 1H NaOH и нерастворимый материал отфильтровывали. Органическую фазу промывали водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и растворитель отгоняли в вакууме. Полученные твердое вещество и вышеуказанный нерастворимый материал объединяли и промывали этилацетатом и получали 13.13 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 85%.
Т.пл. 177-179oC.
Масс: 296 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.82 (2H, с), 6.95 (1H, д, J = 8.6 Гц), 7.64 (1H, дд, J = 8.6, 2.4 Гц), 7.69 - 7.74 (2H, м), 7.82 - 7.87 (3H, м), 10.41 (IH, с).
Препаративный пример 41
N-(3-Гидроксиимино-4-метоксибензил)фталимид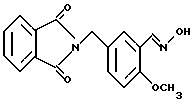
N-(3-Фopмил-4-мeтoкcибeнзил)фтaлимид (12.50 г) суспендировали в 200 мл тетрагидрофурана и добавляли 3.24 г хлоргидрата гидроксиламина, 7.64 г ацетата натрия и 30 мл воды. Смесь перемешивали 30 мин при 60oC и концентрировали в вакууме. Осадок отделяли фильтрованием, промывали эфиром и получали 11.51 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 88%.
Т.пл. 214-217oC.
Масс: 311 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.25 (1H, ш с), 3.82 (3H, с), 4.79 (2H, с), 6.85 (1H, д, J = 8.6 Гц), 7.44 (1H, дд, J = 8.6, 2.4 Гц), 7.66 - 7.72 (2H, м), 7.78 (1H, д, J = 2.4 Гц), 7.80 - 7.86 (2H, м), 8.42 (1H, с).
Препаративный пример 42
N-(3-Циано-4-метоксибензил)фталимид
N-(3-Гидpoкcилиминo-4-мeтoкcибeнзил)фтaлимид (11.00 г) суспендировали в 120 мл ксилола и добавляли 3.68 мл уксусного ангидрида. Смесь кипятили с обратным холодильником 14 ч и оставляли охлаждаться. Образующийся осадок отделяли фильтрованием, промывали ксилолом и получали 9.11 г указанного в заголовке соединения в виде белого порошка, выход 88%.
Т.пл. 205-209oC.
Масс: 293 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.78 (2H, с), 6.92 (1H, м), 7.62 - 7.66 (2H, м), 7.70 - 7.76 (2H, м), 7.83 - 7.88 (2H, м).
Препаративный пример 43
Гидрохлорид 4-хлор-3-метоксибензиламина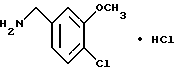
N-(4-Хлор-3-метоксибензил)фталимид (8.40 г) и моногидрат гидразина (1.49 мл) добавляли к 100 мл этанола. Смесь кипятили с обратным холодильником 1.5 ч, нерастворимый материал отделяли фильтрованием, фильтрат концентрировали в вакууме и добавляли 1H соляную кислоту. Нерастворимый материал отделяли фильтрованием. Водную фазу промывали эфиром, подщелачивали концентрированным водным аммиаком и экстрагировали эфиром. Эфирную фазу сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растворяли в этилацетате и добавляли 4H хлорид водорода/этилацетат. Образующийся осадок отделяли фильтрованием, промывали этилацетатом и получали 4.83 г указанного в заголовке соединения в виде белого порошка, выход 83%.
Т.пл. 237-242oC.
Масс: 172 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.88 (3H, с), 4.01 (2H, с), 7.07 (1H, дд, J = 8.0, 1.8 Гц), 7.45 (1H, д, J = 8.0 Гц), 7.46 (1H, д, J = 1.8 Гц), 8.57 (3H, ш с).
Препаративный пример 44
Дигидрохлорид 5-амино-2-метоксипиридина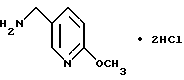
Указанное в заголовке соединение получали, как в Препаративном примере 36, в виде белого порошка, выход 58%.
Т.пл. 165oC (разл.).
Масс: 139 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.87 (3H, с), 3.98 (2H, к, J = 5.9 Гц), 6.89 (1H, д, J = 8.4 Гц), 7.94 (1H, дд, J = 8.4, 2.4 Гц), 8.14 (1H, м), 8.29 (1H, д, J = 2.4 Гц), 8.58 (2H, ш с).
Прапаративный пример 45
3-Циано-4-метоксибензиламин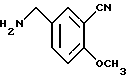
N-(3-Циaнo- 4-мeтoкcибeнзил)фтaлимид (8.60 г) и моногидрат гидразина (1.71 мл) растворяли в смешанном растворителе, содержащем 100 мл этанола и 100 мл 1,4-диоксана. Полученный раствор кипятили с обратным холодильником 2 ч, нерастворимый материал отделяли фильтрованием, концентрировали фильтрат в вакууме и добавляли 1H гидроксида натрия. Образующуюся смесь экстрагировали хлороформом. Органическую фазу сушили над безводным карбонатом калия и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол/концентрированный водный аммиак (100:10:1)) и получали 4.24 г указанного в заголовке соединения в виде слабо-желтого твердого вещества, выход 89%.
Масс: 163 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.40 (2H, с), 3.84 (2H, с), 3.92 (3H, с), 6.94 (1H, д, J = 8.4 Гц), 7.49 - 7.54 (2H, м).
Пример 1
Гидрохлорид 2-амино-5-хлор-N-(3,4-метилендиоксибензил)бензамида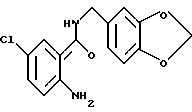
(1) 2-Hитро-5-хлорбензойную кислоту (5.0 г), тионилхлорид (3 мл) и 50 мл бензола кипятили с обратным холодильником 4 ч и смесь концентрировали для получения ацилхлорида. Ацилхлорид добавляло к раствору 3.2 мл пиперониламина и 5 мл триэтиламина в ТГФ для проведения реакции. Реакционную смесь обрабатывали обычным способом, продукт перекристаллизовывали из этилацетата и получали 5.8 г 5-хлор-2-нитро-N-(3,4-метилендиоксибензил)бензамида.
ЯМР (CDCl3) δ:
4.56 (2H, д, J = 5.7 Гц), 5.97 (2H, с + 1H, ш.с), 6.80 (1H, д, J = 7.9 Гц), 6.85 (1H, дд, J = 7.9 Гц, 1.8 Гц), 6.90 (1H, д, J = 1.8 Гц), 7.50 (1H, д, J = 2.2 Гц), 7.54 (1H, дд, J = 8.6 Гц, 2.2 Гц), 8.05 (1H, д, J = 8.6 Гц).
(2) 5-Xлop-2-нитpo-N-(3,4-мeтилeндиoкcибeнзил)бeнзaмид (620 мг), уксусную кислоту (1 мл), воду (1 мл) и этанол (20 мл) кипятили с обратным холодильником и добавляли 1.0 г порошка железа по частям при перемешивании. Смесь кипятили с обратным холодильником 1 ч и фильтровали горячей для отделения коричневого нерастворимого материала. Фильтрат концентрировали и добавляли этанол. Смесь нагревали для растворения. Порциями добавляли концентрированную соляную кислоту, в результате чего коричневый раствор становился желтым и прозрачным. В раствор добавляли затравку кристаллизации. Смесь охлаждали и кристаллы выделяли фильтрованием. Кристаллы промывали этанолом и эфиром, сушили и получали 520 мг указанного в заголовке соединения.
Т.пл. 225-228oC (разл.).
Масс: 305 (M - HCl • H+).
ЯМР (400 МГц, ДМСО-d6) δ:
4.32 (2H, д, J- 5.6 Гц), 5.07 (3H, шс), 5.98 (2H, с), 6.78 (IH, дд, J = 8.0, 1.2 Гц), 6.84 (1H, д, J = 8.0 Гц), 6.85 (1H, д, J = 8.8 Гц), 6.89 (1H, д, J = 1.2 Гц), 7.23 (1H, дд, J = 8.8, 2.4 Гц), 7.65 (1H, д, J = 2.4 Гц), 8.94 (1H, т, J = 5.6 Гц).
Пример 2
2-Аминo-5-xлop-N-(3,4-мeтилeндиoкcибeнзил)бeнзaмид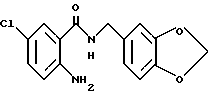
2-Амино-5-хлорбензойную кислоту (10.0 г), 3,4-метилендиоксибензиламин (7.62 мл), 1-(3-диметиламинопропил)-3- этил-карбодиимидхлоргидрат (11.74 г), N-гидроксибензтриазол (8.27 г) и триэтиламин (8.53 мл) добавляли к 200 мл ацетонитрила. Смесь перемешивали при комнатной температуре 20 ч, концентрировали и добавляли воду. Образующуюся смесь экстрагировали этилацетатом. Органическую фазу промывали последовательно 1H соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали. Полученное твердое вещество промывали этанолом и получали 14.13 г указанного в заголовке соединения в виде слабо-оранжевого порошка, выход 80%.
Т.пл. 142-145oC
(белые иглы из этанола).
ЯМР (400 МГц, CDCl3) δ:
4.49 (д, J = 5.7 Гц, 2H), 5.48 - 5.58 (ш, 2H), 5.96 (с, 2H), 6.22 (ш, 1H), 6.63 (д, J = 8.8 Гц, 1H), 6.78 (д, J = 7.9 Гц, 1H), 6.81 (дд, J = 0.5, 7.9 Гц, 1H), 6.84 (д, J = 0.5 Гц, 1Н), 7.15 (дд, J = 2.4, 8.8 Гц, 1H), 7.26 (д, J = 2.4 Гц, 1H).
Пример 3
2-Аминo-5-бpoм-N-(3,4-метилендиоксибензил)бензамид.

Получали бледно-кремовые иглы, выход 92%.
Т.пл. 157-158oC
(бледные оранжево-желтые иглы из этанола).
ЯМР (400 МГц, CDCl3) δ:
4.49 (д, J = 5.7 Гц, 2H), 5.57 (ш, 2H), 5.97 (с, 2H), 6.20 (ш, 1H), 6.58 (д, J = 8.8 Гц, 1H), 6.78 (дд, J = 0.7, 7.9 Гц, 1H), 6.81 (дд, J = 1.3, 7.9 Гц, 1H), 6.84 (дд, J = 0.7, 1.3 Гц, 1H), 7.27 (дд, J = 2.2, 8.8 Гц, 1H), 7.39 (д, J = 2.2 Гц, 1H).
Пример 4
2-Амино-5-хлор-N-метил-N-(3,4-метилендиоксибензил)бензамид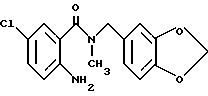
Указанное в заголовке соединение получали в виде бледно-желтого порошка, выход 91%
Т.пл. 122-124oC
(слабо-желтые иглы из водного этанола
ЯМР (400 МГц, CDCl3) δ:
2.9 (с, 3H), 4.34 (с, 2H), 4.55 (ш, 2H), 5.96 (с, 2Н), 6.60 - 6.88 (м, 4Н ), 6.66 (д, J = 8.6 Гц), 6.77 (д, J = 7.7 Гц), 7.06 - 7,13 (м, 2H).
Пример 5
2-Амино-5-диметиламинометил-N-(3,4-метилендиоксибензил)бензамид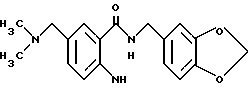
Метил-2-амино-5-диметиламинометил)бензоат (10.93 г) растворяли в 100 мл этанола и добавляли 63.1 мл 1H гидроксида натрия. Смесь перемешивали при комнатной температуре 14 ч, затем 4 ч при 100oC и добавляли 63.1 мл 1H соляной кислоты. Полученную смесь концентрировали для получения бледно-желтого порошка.
Этот порошок растворяли в 270 мл ацетонитрила, содержащего 50% воды, и добавляли 7.19 мл 3,4-метилендиоксибензиламина, 11.93 г 1,3-дициклогексилкарбодиимида и 7.81 г N-гидроксибензтриазола. Смесь перемешивали 14 ч при 70oC и отфильтровывали нерастворимый материал. К фильтрату добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали хлороформом. Органическую фазу сушили над безводным сульфатом магния и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле (растворитель; дихлорметан/метанол/концентрированный водный аммиак 1000:100:3) и получали 15.45 г указанного в заголовке соединения в виде бледно-желтого твердого вещества, выход 90%.
ЯМР (400 МГц, CDCl3) δ: 2.26 (с, 6H), 3.35 (с, 2H), 4.49 (д, J = 5.9 Гц, 2H), 5.58 (ш, 2H), 5.95 (с, 2H), 6.63 (д, J = 8.4 Гц, 1H), 6.70 (ш, 1H), 6.77 (д, J = 7.9 Гц, 1H), 6.82 (дд, J = 1.6, 7,9 Гц, 1H), 6.87 (д, J = 1.6 Гц, 1H), 7.10 (дд, J= 1.6, 8.4 Гц, 1H), 7.39 (д, J = 1.6 Гц, 1H).
Пример 6
Этил-1-[[4-хлор-2-(3,4-метилендиоксибензил)карбамоил] фенил]- карбамоил] пиперидин-4-карбоксилат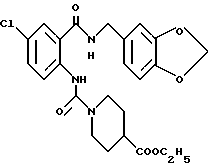
Этил-1-[(2-карбокси-4-хлорфенил)карбамоил] пиперидин-4- карбоксилат (850 мг), 3,4-метилендиоксибензиламин (0.45 мл), 1,3-дициклогексилкарбодиимид (0.54 г), N-гидрохсибензтриазол (0.36 г) и 4-диметиламинопиридин (каталитическое количество) добавляли к 10 мл диметилформамида. Смесь перемешивали при комнатной температуре 16 ч и добавляли воду и этилацетат. Нерастворимый осадок отделяли фильтрованием, отделяли органическую фазу и промывали ее 1H соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором соли, сушили над безводным сульфатом магния и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол (30:1)) и получали 1.10 г указанного в заголовке соединения в виде белого твердого вещества, выход 99%.
Т.пл. 153-155oC
(белые иглы из водного этанола).
ЯМР (400 МГц, CDCl3) δ:
1.27 (т, J = 7.1 Гц, 3H), 1.75 (м, 2H), 1.99 (м, 2H), 2.52 (м, 1H), 3.04 (м, 2H), 4.08 (м, 2H), 4.16 (к, J = 7.1 Гц, 2H), 4.47 (д, J = 5.7 Гц), 5.97 (с, 2H), 6.79 (дд, J = 0.5, 7.9 Гц, 1H), 6.82 (дд, J = 1.5, 7.9 Гц, 1H), 6.86 (дд, J = 0.5, 1.5 Гц, 1H), 7.01 (т, J = 5.7 Гц, 1H), 7.24 (дд, J = 2.6, 9.0 Гц, 1H), 7.32 (д, J = 2.6 Гц, 1H), 8.22 (д, J = 9.0 Гц, 1H), 10.57 (с, 1H).
Пример 7
Этил-1-[[4-хлор-2-(3-хлор-4-метоксибензил)карбамоил] фенил] - карбамоил] пиперидин-4-карбоксилат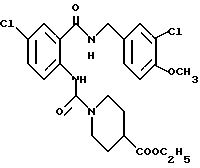
Белый порошок получали с выходом 96%
Т.пл. 131-132oC
(белые иглы из EtOH).
ЯМР (400 МГц, DCl3) δ;
1.27 (т, J = 7.1 Гц, 3H), 1.75 (м, 2H), 1.99 (м, 2H), 2.52 (м, 1H), 3.05 (м, 1H), 3.91 (с, 3H), 4.08 (м, 2H), 4.16 (к, J = 7.1 Гц, 2H), 4.48 (д, J = 5.7 Гц, 2H), 6.93 (д, J = 8.4 Гц, 1H), 7.12 (т, J = 5.7 Гц, 1H), 7.22 (дд, J = 2.4, 9.0 Гц, 1H), 7.22 (дд, J = 2.2, 8.4 Гц, 1H), 7.32 (д, J = 2.4 Гц, 1H), 7.40 (д, J = 2.2 Гц, 1H), 8.19 (д, J = 9.0 Гц, 1H), 10.54 (с, 1H).
Пример 8
Этил-1-[[4-хлор-2-[(2,3-дигидробензофуран-5-ил)метил] карбамоил]- фенил] пиперидин-4-карбоксилат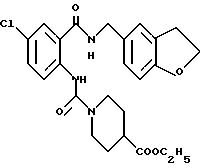
Белый порошок получали с выходом 96%.
Т.пл. 120-122oC
(белые иглы из водного этанола).
ЯМР (400 МГц, CDCl3) δ:
1.27 (т, J = 7.1 Гц, 3H), 1.75 (м, 2H), 2.00 (м, 2H), 2.52 (м, 1H), 3.05 (м, 2H), 3.22 (т, J = 8.8 Гц, 2H), 4.10 (м, 2H), 4.16 (К, J = 7.1 Гц, 2H), 4.49 (д, J = 5.5 Гц, 2H), 4.59 (т, J = 8.8 Гц, 2H), 6.69 (т, J = 5.5 Гц, 1H), 6.77 (д, J = 8.1 Гц, 1H), 7.09 (дд, J = 1.8, 8.1 Гц, 1H), 7.19 (д, J = 1.8 Гц, 1H), 7.28 (дд, J = 2.4, 9.2 Гц, 1H), 7.33 (д, J = 2.4 Гц, 1H), 8.29 (д, J = 9.2 Гц, 1H), 10.68 (с, 1H).
Пример 9
5-Хлор-N-(3,4-метилендиоксибензил)-2-(изоникотиноиламино) бензамид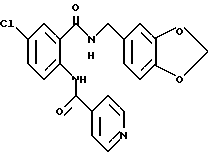
2-Амино-5-хлор-N-(3,4-метилендиоксибензил)бензамид (1.0 г) растворяли в 10 мл пиридина и добавляли 0.64 г хлоргидрата изоникотиноилхлорида. Смесь перемешивали при комнатной температуре 1 ч, добавляли воду со льдом и экстрагировали этилацетатом. Органическую фазу промывали 1н. соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором соли, последовательно, сушили над безводным сульфатом магния и отгоняли растворитель. Остаток очищали колоночной хроматографией на силикагеле (растворитель; дихлорметан/метанол (50:1)), перекристаллизовывали из этилацетата и получали 630 мг указанного в заголовке соединения в виде белых игл, выход 47%.
Т.пл. 204-205oC
(из этилацетата).
Масс: (FAB) 410 (MH+).
Элементный анализ:
рассчитано (%): C 61.55, H 3.94, N 10.25;
найдено (%): C 61.58, H 3.99, N 10.16.
ЯМР (400 МГц, ДМСО-d6) δ:
4.44, (д, J = 5.9 Гц, 2H), 5.99 (с, 2H), 6.85 (дд, J = 1.5, 8.1 Гц, 1H), 6.87 (дд, J = 0.5, 8.1 Гц, 1H), 6.96 (дд, J = 0.5, 1.5 Гц, 1H), 7.66 (дд, J = 2.4, 9.0 Гц, 1H), 7.78 - 7.82 (м, 2H), 7.99 (д, J = 2.4 Гц, 1H), 8.60 (д, J = 9.0 Гц, 1H), 8.82 - 8.87 (м, (2H), 9.49 (т, J = 5.9 Гц, 1H), 12.62 (с, 1H).
Пример 10
5-Хлор-2-(никотиноиламино)-N-(3,4-метилендиоксибензил)бензамид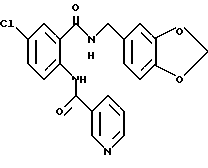
Получали белые иглы, выход 81%.
Т.пл. 152-154oC
(этилацетат).
Масс: (FAB) 410 (MH+).
Элементный анализ:
рассчитано (%).: C 61.55, H 3.94, N 10.25;
найдено (%): C 61.42, H 3.89, N 10.23.
ЯМР (400 МГц, CDCl3) δ:
4.54 (д, J = 5.5 Гц, 2H), 5.96 (с, 2H) 6.79 (дд, J = 0.5, 7.9 Гц, 1H), 6.82 (ш, 1H), 6.82 (дд, J = 1.6, 7.9 Гц), 6.85 (дд, J = 0.5, 1.6 Гц, 1H), 7.43 - 7.48 (м, 2H), 7.50 (д, J = 2.4 Гц, 1H), 8.28 (ддд, J = 1.6, 2.4, 8.1 Гц, 1H), 8.75 (д, J = 8.8 Гц, 1H), 8.78 (дд, J = 1.6, 4.8 Гц, 1H), 9.26 (дд, J = 0.4, 2.4 Гц, 1H), 12.28 (с, 1H).
Пример 11
5-Хлор-2-хлорацетамидо-N-(3,4-метилендиоксибензил)бензамид
2-Амино-5-хлор-N-(3,4- метилендиоксибензил)бензамид (5.00 г) растворяли в 60 мл тетрагидрофурана и добавляли 2.52 мл триэтиламина. Смесь перемешивали при охлаждении льдом. К образующейся смеси по каплям добавляли хлорацетилхлорид (1.44 мл) так, чтобы температура смеси не превышала 10oC. Через 1 ч добавляли к смеси лед и воду и экстрагировали этилацетатом. Органическую фазу промывали соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором соли, последовательно, сушили над безводным сульфатом магния и отгоняли растворитель. Полученное твердое вещество промывали небольшим количеством этилацетата и получали 5.37 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 86%.
Т.пл. 186-187oC
(белые иглы из этанола).
ЯМР (400 МГЦ, CDCl3) δ:
4.18 (с, 2H), 4.52 (д, J = 5.5 Гц, 2H), 5.98 (с, 2H), 6.49 (ш, 1H), 6.79 (дд, J = 0.5, 7.9 Гц, 1H), 6.82 (дд, J = 1.6, 7.9 Гц, 1H), 6.85 (дд, J = 0.5, 1.6 Гц, 1H), 7.42 (дд, J = 2.6, 8.6 Гц, 1H), 7.44 (д, J = 2.6 Гц, 1H), 8.54 (д, J = 8.6 Гц, 1H), 11.75 (ш, 1H).
Пример 12
2-Ацетамидо-5-хлор-N-(3,4-метилендиоксибензил)бензамид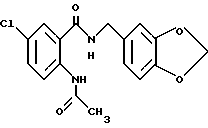
2-Амино-5-хлор-N-(3,4-метилендиоксибензил)бензамидхлоргидрат (100 мг) вводили в реакцию с 40 мкл ацетилхлорида в 5 мл тетрагидрофурана в присутствии 150 мкл диизопропилэтиламина. Реакционную смесь экстрагировали этилацетатом и водой, продукт перекристаллизовывали из смеси этилацетат/гексан и получали 85 мг целевого соединения с выходом 84%.
Т.пл. 187-188oC
(разл.).
Масс: 347 (MH+).
ЯМР (400 МГц, CDCl3) δ:
2.21 (3H, с), 4.51 (2H, д, J = 5.5 Гц), 5.98 (2H, с), 6.41 (1H, широкий с), 6.81 (2H, с), 6.84 (1H, с), 7.38 - 7.42 (2H, м), 8.57 (1H, д, J = 8.8 Гц), 10.91 (1H, широкий с).
Пример 13
5-Хлор-N-(3,4-метилендиоксибензил)-2-феноксикарбониламино- бензамид
Гидрохлорид 2-амино-5-хлор-N-(3,4-метилендиоксибензил)- бензамида (100 мг) вводили в реакцию с 50 мкл фенилхлоркарбоната в 5 мл тетрагидрофурана в присутствии 150 мкл диизопропилэтиламина. Реакционную смесь экстрагировали этилацетатом и водой и подвергали перекристаллизации из смеси этилацетат/гексана и получали 110 мг 5-хлор-N-(3,4-метилендиоксибензил)-2-феноксикарбониламинобензамида, выход 88%.
Т.пл. 149-150oC.
ЯМР (400 МГц, CDCl3) δ:
4.54 (2H, д, J = 5.6 Гц), 5.98 (2H, с), 6.41 (1H, ш с), 6.80 - 6.87 (3H, м), 7.17 - 7.26 (2H, м), 7.37 - 7.46 (5H, м), 8.38 (1H, д, J = 9.2 Гц), 10.82 (1H, с).
Пример 14
5-Хлор-2-[[транс-4-(этоксикарбонил)циклогексанкарбонил] амино]- N-(3,4-метилендиоксибензил)бензамид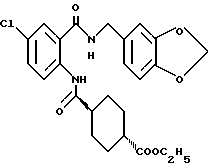
2-Амино-5-хлор-N-(3,4-метилендиоксибензил)бензамид (1.5 г) растворяли в 15 мл пиридина и охлаждали льдом. По каплям добавляли раствор 2.28 г транс-4-этоксикарбонилциклогексан-карбонилхлорида в 5 мл дихлорметана, так чтобы температура реакции не превышала 10oC. Смесь перемешивали 2 ч, добавляли лед с водой и экстрагировали этилацетатом. Органическую фазу промывали 1н. соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором соли, последовательно, сушили над безводным сульфатом магния и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3:1)), кристаллизовали из эфира и получали 1.30 г указанного в заголовке соединения в виде бесцветных призм, выход 55%.
Т.пл. 156-158oC
(белые иглы из водного этанола).
ЯМР (400 МГц, CDCl3) δ:
1.26 (т, J = 7.1 Гц, 3H), 1.43 - 1.62 (м, 4H), 2.06 2.14 (м, 4H), 2.22 - 2.36 (м, 2H), 4.13 (к, J = 7.1 Гц, 2H), 4.50 (д, J = 5.7 Гц, 2H), 5.97 (с, 2H), 6.70 (т, J = 5.7 Гц, 1H), 6.76 - 6.85 (м, 3H), 7.32 (дд, J = 2.4, 9.0 Гц, 1H), 7.41 (д, J = 2.4 Гц, 1H), 8.54 (д, J = 9.0, 1H), 11.02 (с, 1H).
Пример 15
5-Бром-2-[[транс-4-(этоксикарбонил)циклогексанкарбонил] амино]- N-(3,4-метилендиоксибензил)бензамид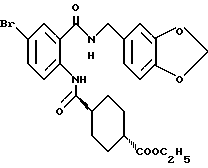
Белый порошок получали с выходом 79%.
Т.пл. 147-149oC
(белые иглы из n-Hex/EtOAc).
ЯМР (400 МГц, CDCl3) δ:
1.26 (т, J = 7.1 Гц, 3H), 1.44 - 1.53 (м, 4H), 2.07 - 2.15 (м, 4H), 2.25 - 2.37 (м, 2H), 4.13 (к, J = 7.1 Гц, 2H), 4.51 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.51 (т подобный, J = 5 Гц, 1H), 6.78 - 6.83 (м, 2H), 6.84 (д, J = 0.9 Гц, 1H), 7.53 (дд, J = 2.4, 8.4 Гц, 1H), 7.55 (д, J = 2.4 Гц, 1H), 8.53 (д, J = 8.4 Гц, 1H), 11.02 (с, 1H).
Пример 16
5-Хлор-2-[[3-(этоксикарбонил)акрилоил] амино] -N-(3,4- метилендиоксибензил)бензамид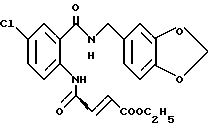
Т.пл. 181-184oC
(из этилацетата).
Масс: (FAB) 431 (MH+).
Элементный анализ:
рассчитано (%): C 58.54, H 4.44, N 6.50;
найдено (%): C 58.44, H 4.41, N 6.49.
ЯМР (400 МГц, CDCl3) δ:
1.35 (т, J = 7.1 Гц, 3H), 4.28 (к, J = 7.1 Гц, 2H), 4.52 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.53 (м, 1H), 6.78 - 6.86 (м, 3H), 6.90 (д, J = 15.4 Гц, 1H), 7.08 (д, J = 15.4 Гц, 1H), 7.42 - 7.48 (м, 2H), 8.69 (д, J = 9.7 Гц, 1H), 11.57 (с, 1H).
Пример 17
5-Хлор-2-[[5-(этоксикарбонил)валерил] амино] - N-(3,4-метилен-диоксибензил)бензамид
Белые иглы получали с выходом 54%.
Т.пл. 154-156oC
(белые иглы из водного EtOH).
ЯМР (400 МГц, CDCl3) δ:
1.25 (т, J = 7.1 Гц, 3H), 1.67 - 1.81 (м, 4H), 2.35 (т, J = 7.3 Гц, 2H), 2.43 (т, J - 7.0 Гц, 2H), 4.13 (к J = 7.1 Гц, 2H), 4.50 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.52 (т, J = 5.7 Гц), 6.75 - 6.87 (м, 3H), 7.37 - 7.42 (м, 2H), 8.57 (д, J = 9.3 Гц, 1H), 10.96 (c, 1H).
Пример 18
5-Хлор-2-[[4-(метоксикарбонил)бензоил] амино] -N- (3,4-метилендиоксибензил)бензамид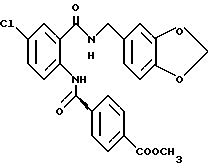
Слабо-желтый порошок получали с выходом 73%.
Т.пл. 208-210oC
(белые иглы из водного этанола).
ЯМР (400 МГц, ДМСО-d6) δ:
3.90 (с, 3H), 4.42 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.83 (дд, J = 1.5, 7.9 Гц, 1H), 6.86 (дд, J = 0.5, 7.9 Гц), 6.95 (д, J = 0.5 Гц, 1H), 7.66 (дд, J = 2.6, 9.0 Гц, 1H), 7.97 (д, J = 2.6 Гц, 1H), 7.99 - 8.05 (м, 2H), 8.11 - 8.16 (м, 2H), 8.61 (д, J = 9.0 Гц, 1H), 9.47 (т, J = 5.7 Гц), 12.50 (с, 1H).
Пример 19
5-Хлор-2-[(циклогексанкарбонил)амино] -N-(3,4- метилендиоксибензил)бензамид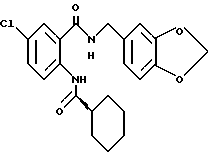
Белые иглы получали с выходом 44%
Т.пл. 141-142oC
(из эфира).
Масс: (FAB) 415 (MH+).
Элементный анализ:
рассчитано (%): C 63.69, H 5.59, N 6.75;
найдено (%): C 63.47, H 5.60, N 6.65.
ЯМР (400 МГц, CDCl3) δ:
1.18 - 1.39 (м, 3H), 1.45 - 1.57 (м, 2H), 1.70 (м, 1H), 1.79 - 1.87 (м, 2H), 1.95 - 2.03 (м, 2H), 2.29 (м, 1H), 4.51 (д, J = 5.5 Гц, 2H), 6.54 (шт, 1H), 6.77 - 6.83 (м, 2H), 6.84 (м, 1H), 7.37 (дд, J = 2.2, 8.8 Гц, 1H), 7.40 (д, J = 2.2 Гц, 1H), 8.58 (д, J = 8.8 Гц, 1H), 10.91 (с, 1H).
Пример 20
5-Хлор-2-[(1-метилпиперидин-4-карбонил)амино] -N-(3,4- метилендиоксибензил)беизамид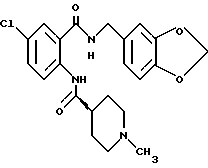
Слабо-желтые иглы получали с выходом 13%.
Т.пл. 177-178oC
(EtOAc).
Масс: (FAB) 43 (MH+).
Элементный анализ:
рассчитано (%): C 61.47, H 5.63, N 9.77;
найдено (%): C 61.11, H 5.62, N 9.70.
ЯМР (400 МГц, CDCl3) δ:
1.80 - 1.92 (м, 2H), 1.94 - 2.06 (м, 4H), 2.70 (м, 1H), 2.29 (с, 3H), 2.88 - 2.98 (м, 2H), 4.51 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.52 (ш, 1H), 6.77 - 6.86 (м, 3H), 7.39 (дд, J = 2.4, 9.7 Гц, 1H), 7.40 (д, J = 2.4 Гц, 1H), 8.60 (д, J = 9.7 Гц, 1H), 11.05 (с, 1H).
Пример 21
5-Диметиламинометил-2-[[4-(метоксикарбонил)бензоил] амино] - N-(3,4-метилендиоксибензил)бензамид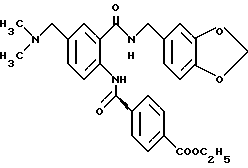
Белый порошок получали с выходом 50%.
Т.пл. 171-174oC
(белые иглы из водного EtOН).
ЯМР (400 МГц, CDCl3) δ:
2.24 (с, 6H), 3.40 (с, 2H), 3.96 (с, 3H), 4.54 (д, J = 5.7 Гц, 2H), 5.96 (с, 2H), 6.79 (д, J = 7.9 Гц, 1H), 6.83 (дд, J = 1.5, 7.9 Гц, 1H), 6.87 (д, J = 1.5 Гц, 1H), 6.88 (ш, 1H), 7.42 (дд, J = 1.8, 8.4 Гц, 1H), 7.56 (д, J = 1.8 Гц, 1H), 8.08 - 8.13 (м, 2H), 8.15 - 8.21 (м, 2H), 8.76 (д, J = 8.4 Гц, 1H), 12.36 (с, 1H).
Пример 22
5-Диметиламинометил-2-[[транс-4-(этоксикарбонил)- циклогексанкарбонил] амино]-N-(3,4-метилендиоксибензил)бензамид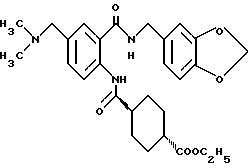
Белый порошок получали с выходом 32%.
Т.пл. 144-145oC.
ЯМР (400 МГц, CDCl3) δ:
1.25 (т, J = 7.1 Гц, 3H), 1.43 - 1.64 (м, 4H), 2.05 - 2.13 (м, 4H), 2.20 (с, 6H), 2.24 - 2.35 (м, 2H), 3.35 (с, 2H), 4.12 (к, J = 7.1 Гц, 2H), 4.50 (д, J = 5.7 Гц, 2H), 5.95 (с, 2H), 6.77 (дд, J = 0.5, 7.9 Гц, 1H), 6.80 (дд, J = 1.1, 7.9 Гц, 1H), 6.84 (дд, J = 0.5, 1.1 Гц), 6.86 (т, J = 5.7 Гц, 1H), 7.32 (дд, J = 1.8, 8.4 Гц, 1H), 7.48 (д, J = 1.8 Гц, 1H), 8.54 (д, J = 8.4 Гц, 1H), 11.18 (с, 1H).
Пример 23
5-Хлор-2-[[транс-4-(этоксикарбонил)циклогексанкарбонил] - амино] -N-метил-N-(3,4-метилендиоксибензил)бензамид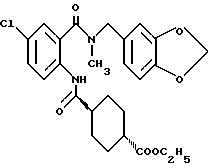
Белый порошок получали с выходом 82%.
Т.пл. 153-155oC
(белые иглы из водного EtOH).
ЯМР (400 МГц, CDCl3) δ:
1.27 (т, J = 7.1 Гц, 3H), 1.41 - 1.62 (м, 4H), 1.96 - 2.35 (м, 6H), 2.88 - 3.08 (ш, 3H), 4.14 (к, J = 7.1 Гц, 2H), 4.45, 4.62 (ш, всего 2H), 5.98 (ш с, 2H), 6.45 - 6.59, 6.71 - 6.93 (ш, всего 3H), 7.24 (ш м, 1H), 7.36 (дд, J = 2.4, 8.8 Гц, 1H), 8.13 (д, J = 8.8 Гц, 1H), 8.80 - 9.01 (ш, 1H).
Пример 24
5-Хлор-2-(4-гидроксипиперидино)ацетамидо-N-(3,4- метилендиоксибензил)бензамид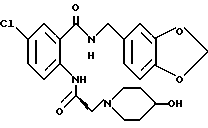
5-Xлop-2-xлopaцeтaмидo-N-(3,4-мeтилeндиoкcибeнзил)бeнзамид (570 мг) растворяли в 5 мл N,N-диметилформамида, добавляли 450 мг 4-гидроксипиперидина, 620 мг карбоната калия и каталитическое количество тетра-(н-бутил)аммонийиодида. Полученную смесь перемешивали при комнатной температуре 1 ч и затем добавляли воду. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным водным раствором соли, сушили над сульфатом магния и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол (30:1)) и перекристаллизовывали из смеси этилацетата/н-гексана и получали белый порошок, выход 84%.
Т.пл. 149-152oC
(этилацетат/н-гексан).
Масс: (FAB) 446 (MH+).
Элементный анализ:
рассчитано (%): C 59.26, H 5.43, N 9.42;
найдено (%): C 59.28, H 5.51, N 9.37.
ЯМР (400 МГц, ДМСО-d6) δ:
1.55 - 1.65 (м, 2H), 1.68 - 1.78 (м, 2H), 2.19 - 2.28 (м, 2H), 2.64 - 2.73 (м, 2H), 3.06 (с, 2H), 3.50 (м, 1H), 4.39 (д, J = 5.9 Гц, 2H), 4.58 (д, J = 3.7 Гц, 1H), 5.99 (с, 2H), 6.83 (дд, J = 1.3, 8.1 Гц, 1H), 6.87 (д, J = 8.1 Гц, 1H), 6.92 (д, J = 1.3 Гц, 1H), 7.54 (дд, J = 2.6, 9.0 Гц, 1H), 7.73 (д, J = 2.6 Гц, 1H), 8.52 (д, J = 9.0 Гц, 1H), 9.23 (т, J = 5.9 Гц, 1H), 11.69 (с, 1H).
Пример 25
5-Хлор-N-(3,4-метилендиоксибензил)-2-(пиперидиноацетамидо)- бензамид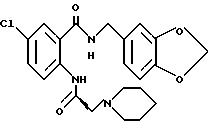
Белый порошок получали с выходом 45%
Т.пл. 155-156oC
(этилацетат/н-гексан).
Масс: (FAB) 430 (MH+).
Элементный анализ (%):
рассчитано: C 61.47, H 5.63, N 9.77;
найдено: C 61.38, H 5.61, N 9.75.
ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.42 (м, 2H), 1.52 - 1.51 (м, 4H), 2.35 - 2.45 (м, 4H), 3.03 (с, 2H), 4.38 (д, J = 5.9 Гц, 2H), 5.98 (с, 3H), 6.81 (дд, J = 1.3, 7.9 Гц, 1H), 6.86 (д, J = 7.9 Гц, 1H), 6.92 (д, J = 1.3 Гц, 1H), 7.54 (дд, J = 2.6, 9.0 Гц, 1H), 7.74 (д, J = 2.6 Гц, 1H), 8.54 (д, J = 9.0 Гц, 1H), 9.25 (т, J = 5.9 Гц, 1H), 11.70 (с, 1H).
Пример 26
5-Хлор-2-[4-(этоксикарбонил)пиперидино] ацетамидо-N-(3,4- метилендиоксибензил)бензамид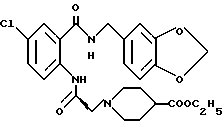
Белое аморфное вещество получали с выходом 99%.
ЯМР (400 МГц, CDCl3) δ:
1.24 (т, J = 7.1 Гц, 3H), 1.90 - 1.98 (м, 2H), 1.98 2.10 (м, 2H), 2.26 - 2.36 (м, 3H), 2.81 - 2.90 (м, 2H), 3.10 (с, 2H), 4.13 (к, J = 7.1 Гц, 2H), 4.50 (д, J = 5.9 Гц, 2H), 5.96 (с, 2H), 6.71 (т, J = 5.9 Гц, 1H), 6.77 (дд, J = 0.4, 7.9 Гц, 1H), 6.81 (дд, J = 1.8, 7.9 Гц, 1H), 6.85 (дд, J = 0.4, 1.8 Гц, 1H), 7.30 (дд, J = 2.4, 9.0 Гц, 1H), 7.40 (д, J = 2.4 Гц, 1H), 8.49 (д, J = 9.0 Гц, 1H), 11.61 (с, 1H).
Пример 27
5-Xлop-N-(3,4-мeтилeндиoкcибeнзил)-2-[(4-мeтилпипepaзинo)- ацетамидо] бензамид
Белый порошок получали с выходом 70%.
Т.пл. 162-164oC
(EtOAc/n-Hex).
Масс: (FAB) 445 (MH+).
Элементный анализ (%):
рассчитано: C 59.39, H 5.66, N 12.59;
найдено: C 58.80, H 5.66, N 12.45.
ЯМР (400 МГц, CDCl3) δ:
2.35 (с, 3H), 2.50 - 2.75 (м, 8H), 3.17 (с, 2H), 4.53 (д, J = 5.7 Гц, 2H), 5.97 (с, 2H), 6.40 (ш, 1H), 6.77 - 6.82 (м, 2H), 6.85 (м, 1H), 7.39 (дд, J = 2.0, 8.8 Гц, 1H), 7.41 (д, J = 2.0 Гц, 1H), 8.57 (д, J = 8.8 Гц, 1H), 11.56 (ш, 1H).
Пример 28
5-Хлор-N-(3,4-метилендиоксибензил)-2-[(3-оксопиперазино)- ацетамидо] бензамид
Белые хлопья получали с выходом 52%
Т.пл. 202-203oC
(из водного этанола).
Масс: (FAB) 445 (MH+).
Элементный анализ (%):
рассчитано: C 56.70, H 4.76, N 12.59;
найдено: C 56.65, H 4.78, N 12.56.
ЯМР (400 МГц, ДМСО-d6) δ:
2.65 (т, J = 5.3 Гц, 2H), 3.10 (с, 2H), 3.21 (с, 2H), 3.23 - 3.30 (м, 2H), 4.36 (д, J = 5.7 Гц, 2H), 5.99 (с, 2H), 6.81 (дд, J = 1.6, 8.0 Гц, 1H), 6.88 (д, J = 8.0 Гц, 1H), 6.90 (д, J = 1.6 Гц, 1H), 7.56 (дд, J = 2.6, 9.0 Гц, 1H), 7.77 (д, J = 2.6 Гц, 1H), 7.83 (ш с, 1H), 8.52 (д, J = 9.0 Гц, 1H), 9.26 (т, J - 5.7 Гц, 1H), 11.72 (с, 1H).
Пример 29
5-Хлор-2-[4-(этоксикарбонил)бутиламино] -N-(3,4- метилендиоксибензил)бензамид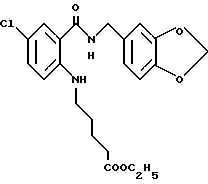
6-Хлор-1-[4-(этоксикарбонил)бутил] -1,2-дигидро-4H-1,3- бензоксазин-2,4-дион (3.50 г) растворяли в 35 мл диметилформамида и добавляли 0.13 г 4-диметиламинопиридина и 1.47 мл 3,4-метилендиоксибензиламина. Смесь перемешивали при комнатной температуре 1 ч и добавляли лед с водой. Образующуюся смесь экстрагировали этилацетатом. Органическую фазу промывали 1н. соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором соли, последовательно, сушили над безводным сульфатом магния и растворитель отгоняли. Полученное твердое вещество промывали этанолом и получали 3.35 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 72%.
Т.пл. 89-91oC
(белые иглы из водного EtOH).
ЯМР (400 МГц, CDCl3) δ:
1.25 (т, J = 7.1 Гц, 3H), 1.65 - 1.80 (м, 4H), 2.35 (т, J = 7.0 Гц, 2H), 3.13 (м, 2H), 4.13 (к, J = 7.1 Гц, 2H), 4.46 (д, J = 5.7 Гц, 2H), 5.96 (с, 2H), 6.26 (ш т, 1H), 6.60 (д, J = 9.0 Гц, 1H), 6.76 - 6.81 (м, 2H), 6.83 (м, 1H), 7.22 (дд, J = 2.4, 9.0 Гц, 1H), 7.26 (д, J = 2.4 Гц, 1H), 7.52 (ш т, 1H).
Пример 30
5-Хлор-2-[3-(этоксикарбонил)пропиламино] -N-(3,4- метилендиоксибензил)бензамид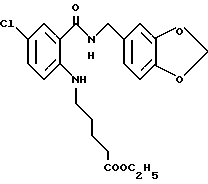
Бледно-желтое твердое вещество получали с выходом 88%.
ЯМР (400 МГц, CDCl3) δ:
1.26 (т, J = 7.1 Гц, 3H), 1.97 (м, 2H), 2.42 (т, J = 7.3 Гц, 2H), 3.19 (м, 2H), 4.14 (к, J = 7.1 Гц, 2H), 4.47 (д, J = 5.5 Гц, 2H), 5.96 (с, 2H), 6.26 (м, 1H), 6.64 (д, J = 8,8 Гц, 1H), 6.76 - 6.82 (м, 2H), 6.83 (м, 1H), 7.22 (дд, J = 2.4, 8.8 Гц, 1H), 7.27 (д, J = 2.4 Гц, 1H), 7.57 (м, 1H).
Пример 31
5-Хлор-2-метиламино-N-(3,4-метилендиоксибензил)бензамид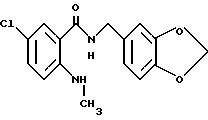
Сероватый порошок получали с выходом 94%.
Т.пл. 152-154oC
(белые иглы из водного EtOH).
ЯМР (400 МГц, ДМСО-d6) δ:
2.76 (д, J = 5.1 Гц, 3H), 4.31 (д, J = 5.9 Гц, 2H), 5.98 (с, 2H), 6.64 (д, J = 9.0 Гц, 1H), 6.73 (дд, J = 1.5, 7.9 Гц, 1H), 6.85 (д, J = 7.9 Гц, 1H), 6.88 (д, J = 1.5 Гц, 1H), 7.31 (дд, J = 2.6, 9.0 Гц, 1H), 7.64 (д, J = 2.6 Гц, 1H), 7.74 (к, J = 5.1 Гц, 1H), 8.93 (т, J = 5.9 Гц, 1H).
Пример 32
5-Хлор-2-(4-метоксикарбонилбензиламино)-N-(3,4- метилендиоксибензил)бензамид
Слабо-желтый порошок получали с выходом 89%.
Т.пл. 156-158oC
(белые иглы из водного EtOH).
ЯМР (400 МГц, CDCl3) δ:
3.91 (с, 3H), 4.46 (д, J = 5.5 Гц, 2H), 4.50 (д, J = 5.5 Гц, 2H), 5.97 (с, 2H), 6.29 (ш т, J = 5 Гц, 1H), 6.46 (д, J = 9.0 Гц, 1H), 6.79 (дд, J = 0.7, 7.9 Гц, 1H), 6.82 (дд, J = 1.5, 7.9 Гц), 6.85 (дд, J = 0.7, 1.5 Гц), 7.14 (дд, J = 2.6, 9.0 Гц), 7.31 (д, J = 2.6 Гц, 1H), 7.38 - 7.43 (м, 2H), 7.97 - 8.02 (м, 2H), 8.16 (ш т, J = 5 Гц, 1H).
Пример 33
5-Хлор-N-(3,4-метилендиоксибензил)-2-(4-пиколил)аминобензамид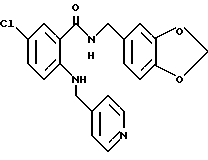
Суспензию 60% гидрида натрия в минеральном масле (1.34 г) суспендировали в 50 мл диметилформамида и добавляли по частям 3.0 г 6-хлор-1,2-дигидро-4H-1,3-бензоксазина. Полученную смесь перемешивали при комнатной температуре 1 ч и добавляли хлоргидрат 4- пиколилхлорида по частям. Через 1.5 ч образующуюся смесь нагревали до 50oC, перемешивали 24 ч и оставляли охлаждаться. К смеси добавляли 3,4-метилендиоксибензиламин (2.1 мл) и 4-диметиламинопиридин (0.19 г). Полученную смесь перемешивали при комнатной температуре 1 ч и добавляли воду со льдом и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (от 1:1 до 1:2)) и перекристаллизовывали из этанола и получали 870 мг указанного в заголовке соединения в виде белых игл, выход 14%.
Т.пл. 163-166oC.
Масс: (FAB) 396 (MH+).
Элементный анализ (%):
рассчитано: C 63.72, H 4.58, N 10.62;
найдено: C 63.79, H 4.57, N 10.62.
ЯМР (400 МГц, CDCl3) δ:
4.43 (д, J = 5.9 Гц, 2H), 4.51 (д, J = 5.7 Гц, 2H), 5.97 (с, 2H), 6.40 (м, 1H), 6.40 (д, J = 9.0 Гц, 1H), 6.79 (дд, J = 0.5, 7.9 Гц, 1H), 6.82 (дд, J = 1.5, 7.9 Гц, 1H), 6.85 (дд, J = 0.5, 1.5 Гц, 1H), 7.15 (дд, J = 2.4, 9.0 Гц, 1H), 7.24 - 7.27 (м, 2H), 7.33 (д, J = 2.4 Гц, 1H), 8.21 (т, J = 5.9 Гц, 1H), 8.52 - 8.55 (м, 2H).
Пример 34
5-Хлор-2-[[транс-4-(этоксикарбонил)циклогексил]метиламино]- N-(3,4- метилендиоксибензил)бензамид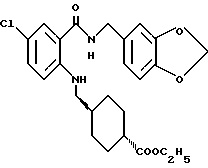
Бледно-желтый порошок получали с выходом 11%
Т.пл. 128-129oC
(бледно-желтые иглы из водного EtOH).
ЯМР (400 МГц, CDCl3) δ:
0.98 - 1.11 (м, 2H), 1.25 (т, J = 7.1 Гц, 3H), 1.38 - 1.51 (м, 2H), 1.63 (м, 1H), 1.90 - 1.99 (м, 2H), 1.99 - 2.06 (м, 2H), 2.25 (м, 1H), 2.95 - 3.02 (м, 2H), 4.12 (к, J = 7.1 Гц, 2H), 4.48 (к, J = 5.7 Гц, 2H), 5.96 (с, 2H), 6.21 (ш т, 1H), 6.60 (д, J = 9.0 Гц, 1H), 6.76 - 6.82 (м, 2H), 6.83 (м, 1H), 7.21 (дд, J = 2.6, 9.0 Гц, 1H), 7.26 (д, J = 2.6 Гц, 1H), 7.65 (ш т, 1H).
Пример 35
2-[(4-Карбоксибутирил)амино]-5-хлор-N-(3,4- метилендиоксибензил)бензамид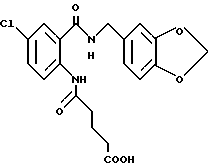
2-Амино-5-хлор-N-(3,4-метилендиоксибензил)бензамид (1.0 г) растворяли в 10 мл пиридина и добавляли 0.41 г глутарового ангидрида. Смесь перемешивали при комнатной температуре 20 ч, концентрировали и добавляли этилацетат. Образующуюся смесь экстрагировали 1н. гидроксида натрия и устанавливали в водной фазе pH 2. Осадок отделяли фильтрованием, перекристаллизовывали из водного этанола и получали 500 мг указанного в заголовке соединения в виде белого порошка, выход 36%.
Т.пл. 154-155oC (водный этанол).
Масс: (FAB) 419 (MH+).
Элементный анализ (%):
рассчитано: C 57.35, H 4.57, N 6.69;
найдено: C 57.17, H 4.56, N 6.64.
ЯМР (400 МГц, ДМСО-d6) δ:
1.80 (дт, J = 7.3, 7.5 Гц, 2H), 2.28 (т, J = 7.3 Гц, 2H), 2.38 (т, 7.5 Гц, 2H), 4.37 (д, J = 5.9 Гц, 2H), 5.99 (с, 2H), 6.82 (дд, J = 1.6, 7.9 Гц, 1H), 6.87 (дд, J = 0.4, 7.9 Гц, 1H), 6.93 (дд, J = 0.4, 1.6 Гц, 1H), 7.55 (дд, J = 2.6, 9.0 Гц, 1H), 7.82 (д, J = 2.6 Гц, 1H), 8.38 (д, J = 9.0 Гц, 1H), 9.30 (т, J = 5.9 Гц, 1H), 11.17 (с, 1H).
Пример 36
2-[(3-Kapбoкcипpoпиoнил)aминo] -5-xлop-N-(3,4- мeтилeндиoкcибензил)бензамид
Белые иглы получали с выходом 38%.
Т.пл. 217-220oC (EtOH).
Масс: (FAB) 405 (MH+).
Элементный анализ (%):
рассчитано: C 56.37, H 4.23, N 6.92;
найдено: C 56.24, H 4.25, N 6.88.
ЯМР (400 МГц, ДМСО-d6) δ:
2.48 - 2.60 (м, 4H), 4.38 (д, J = 5.9 Гц, 2H), 5.99 (c, 2H), 6.82 (ддд, J = 0.4, 1.7, 7.9 Гц, 1H), 6.87 (дд, J = 1.7, 7.9 Гц, 1H), 6.93 (дд, J = 0.4, 1.7 Гц, 1H), 7.55 (дд, J = 2.4, 9.0 Гц, 1H), 7.83 (д, J = 2.4 Гц, 1H), 8.38 (д, J = 9.0 Гц, 1H), 9.31 (т, J = 5.9 Гц, 1H), 11.24 (с, 1H).
Пример 37
2-[N-(4-Карбоксибутирил)-N-метил] амино-5-хлор-N'-(3,4- метилендиоксибензил)бензамид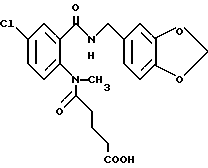
Белое аморфное вещество получали с выходом 39%.
Масс: (FAB) 433 (MH+).
ЯМР (400 МГц, CDCl3) δ:
1.75 - 1.86 (м, 2H), 1.99 - 2.48 (м, 4H), 3.15, 3.22 (с, всего 3H), 4.41 (дд, J = 5.7, 14.5 Гц, 1H), 4.46 (дд, J = 5.7, 14.5 Гц, 1H), 5.94 (с, 2H), 6.69, 7.04 (м, всего 1H), 6.73 - 6.82 (м, 3H), 7.05, 7.12 (д, J = 8.4 Гц, всего 1H), 7.40, 7.44 (дд, J = 2.4, 8.4 Гц, 1H), 7.47, 7.60 (д, J = 2.4 Гц, 1H).
Пример 38
1-[[4-Хлор-2-[(3,4-метилендиоксибензил)карбамоил] фенил] карбамоил]пиперидин-4-карбоновая кислота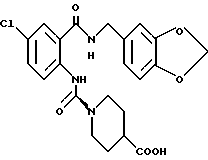
Этанол (100 мл), тетрагидрофуран (100 мл) и 1н. гидроксид натрия (65 мл) добавляли к 10.09 г этил-1-[[4-хлор-2-[(3,4- метилендиоксибензил)карбамоил] фенил] карбамоил]пиперидин-4- карбоксилата. Смесь перемешивали при комнатной температуре 2 ч и добавляли 100 мл воды. Образующуюся смесь концентрировали и добавляли воду и этилацетат. Водную фазу отделяли, а органическую фазу экстрагировали 1н. гидроксида натрия. Обе водные фазы объединяли и устанавливали pH 2 концентрированной соляной кислоты. Осадок отделяли фильтрованием, перекристаллизовывали из водного этанола и получали 6.84 г указанного в заголовке соединения в виде белых игл, выход 72%.
Т.пл. 263-264oC (EtOH).
Масс: (FAB) 460 (MH+).
Элементный анализ (%):
рассчитано: C 57.46, H 4.82, N 9.14;
найдено: C 57.39, H 4.73, N 9.09.
ЯМР (400 МГц, ДМСО-d6) δ:
1.46 (м, 2H), 1.86 (м, 2H), 2.49 (м, 1H), 2.98 (м, 2H), 3.91 (м, 2H), 4.38 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.81 (дд, J = 1.5, 8.1 Гц, 1H), 6.86 (д, J = 8.1 Гц, 1H), 6.91 (д, J = 1.5 Гц, 1H), 7.49 (дд, J = 2.6, 9.0 Гц, 1H), 7.82 (д, J = 2.6 Гц, 1H), 8.31 (д, J = 9.0 Гц, 1H), 9.35 (т, J = 5.7 Гц), 11.06 (с, 1H).
Пример 39
2-(транс-4-Карбоксициклогексанкарбониламино)-5-хлор-N- (3,4-метилендиоксибензил)бензамид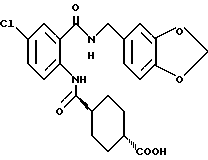
Этанол (100 мл), тетрагидрофуран (100 мл) и 1н. гидроксид натрия (65 мл) добавляли к 10.0 г 5-хлор-2-[транс-4-(этоксикарбонил)- циклогексанкарбонил] амино-N-(3,4-метилендиоксибензил)бензамида. Полученную смесь перемешивали при комнатной температуре 8 ч и концентрировали. Остаток растворяли в воде и подвергали хроматографии с обращенной фазой на силикагеле (растворитель: смесь вода/метанол, содержащая 30% воды). Фракции объединяли и концентрировали для удаления метанола. Образующийся раствор подкисляли 1н. соляной кислоты. Осадок отделяли фильтрованием, перекристаллизовывали из водного этанола и получали 7.10 г указанного в заголовке соединения в виде белых игл, выход 75%.
Т.пл. 228-230oC (из этанола).
Масс: (FAB) 459 (MH+).
Элементный анализ (%):
рассчитано: C 60.20, H 5.05, N 6.10;
найдено: C 59.95, H 5.11, N 6.08.
ЯМР (400 МГц, ДМСО-d6) δ:
1.31 - 1.48 (м, 4H), 1.87 - 2.03 (м, 4H), 2.13 - 2.29 (м, 2H), 4.38 (д, J = 5.7 Гц, 2H), 5.99 (с, 2H), 6.82 (дд, J = 1.6, 7.9 Гц, 1H), 6.87 (д, J = 7.9 Гц, 1H), 6.93 (д, J = 1.6 Гц, 1H), 7.54 (дд, J = 2.6, 9.0 Гц, 1H), 7.83 (д, J = 2.6 Гц, 1H), 8.40 (д, J = 9.0 Гц, 1H), 9.32 (т, J = 5.7 Гц, 1H), 11.19 (с, 1H).
Пример 40
2-(5-Карбоксивалерил)амино-5-хлор-N-(3,4-метилендиоксибензил)- бензамид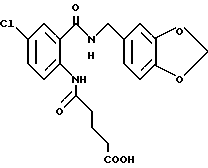
Белые иглы получали с выходом 30%.
Т.пл. 197-199oC (из этанола).
Масс: (FAB) 433 (MH+).
Элементный анализ (%):
рассчитано: C 58.27, H 4.89, N 6.47;
найдено: C 58.03, H 4.96, N 6.38.
ЯМР (400 МГц, ДМСО-d6) δ:
1.49 - 1.63 (м, 4H), 2.23 (т, J = 7.3 Гц, 2H), 2.34 (т, J = 6.8 Гц, 2H), 4.37 (д, J = 5.7 Гц, 2H), 5.99 (с, 2H), 6.82 (дд, J = 1.6, 7.9 Гц, 1H), 6.87 (дд, J = 0.4, 7.9 Гц, 1H), 6.93 (дд, J = 0.4, 1.6 Гц, 1H), 7.55 (дд, J = 2.6, 9.0 Гц, 1H), 7.82 (д, J = 2.6 Гц, 1H), 8.39 (д, J = 9.0 Гц, 1H), 9.30 (т, J = 5.7 Гц, 1H), 11.15 (с, 1H).
Пример 41
2-(4-Карбоксибензоил)амино-5-хлор-N-(3,4- метилендиоксибензил)бензамид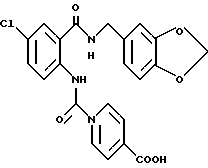
Белые иглы получали с выходом 74%.
Т.пл. 260-262oC (из водного этанола)
Масс: (FAB) 453 (MH+).
Элементный анализ (%):
рассчитано: C 61.00, H 3.78, N 6.19;
найдено: C 60.83, H 3.98, N 6.09.
ЯМР (400 МГц, ДМСО-d6) δ:
4.42 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.83 (дд, J = 1.5, 7.9 Гц, 1H), 6.86 (дд, J = 0.5, 7.9 Гц, 1H), 6.95 (дд, J = 0.5, 1.5 Гц, 1H), 7.66 (дд, J = 2.4, 9.0 Гц, 1H), 7.97 (д, J = 2.4 Гц, 1H), 7.98 8.03 (м, 2H), 8.09 - 8.15 (м, 2H), 8.62 (д, J = 9.0 Гц, 1H), 9.47 (т, J = 5.7 Гц, 1H), 12.50 (с, 1H).
Пример 42
1-[[4-Хлор-2-[[(2,3-дигидробензофуран-5-ил)метил] карбамоил] - фенил] карбамоил]пиперидин-4-карбоновая] кислота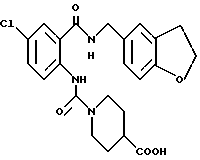
Белые иглы получали с выходом 26%
Т.пл. 288-291oC
(водный EtOH).
Масс: (FAB) 458 (MH+).
Элементный анализ (%):
рассчитано: C 60.33, H 5.28, N 9.18;
найдено: C 60.18, H 5.25, N 9.16.
ЯМР (400 МГц, ДМСО-d6) δ:
1.47 (м, 2H), 1.86 (м, 2H), 2.47 (м, 1H), 2.99 (м, 2H), 3.15 (т, J = 8.8 Гц, 2H), 3.91 (м, 2H), 4.38 (д, J = 5.9 Гц, 2H), 4.50 (т, J = 8.8 Гц, 2H), 6.70 (д, J = 8.2 Гц, 1H), 7.05 (дд, J = 1.8, 8.2 Гц, 1H), 7.20 (д, J = 1.8 Гц, 1H), 7.48 (дд, J = 2.6, 9.2 Гц, 1H), 7.82 (д, J = 2.6 Гц, 1H), 8.32 (д, J = 9.2 Гц, 1H), 9.34 (т, J = 5.9 Гц, 1H), 11.12 (с, 1H).
Пример 43
1-[[4-Хлор-2-(3-хлор-4-метоксибензил)карбамоил] фенил] карбамоил]пиперидин-4-карбоновая кислота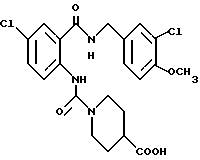
Белые иглы получали с выходом 63%
Т.пл. 288-291oC
(водный EtOH).
Масс: (FAB) 480 (MH+).
Элементный анализ (%):
рассчитано: C 55.01, H 4.83, N 8.75)
найдено: C 54.80, H 4.81, N 8.64.
ЯМР (400 МГц, ДМСО-d6) δ:
1.47 (м, 2H), 1.86 (м, 2H), 2.46 (м, 1H), 2.99 (м, 2H), 3.83 (с, 3H), 3.91 (м, 2H), 4.40 (д, J = 5.7 Гц, 2H), 7.11 (д, J = 9.6 Гц, 1H), 7.28 (дд, J = 2.0, 8.6 Гц, 1H), 7.40 (д, J = 2.0 Гц, 1H), 7.49 (дд, J 2.6, 9.0 Гц, 1H), 7.82 (д, J = 2.6 Гц, 1H), 8.31 (д, J = 9.0 Гц, 1H), 9.37 (т, J = 5.7 Гц), 11.02 (с, 1H).
Пример 44
2-(3-Карбоксиакрилоил)амино-5-хлор-N-(3,4- метилендиоксибензил)бензамид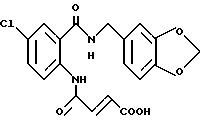
Белые иглы получали с выходом 9%
Т.пл. 256-258oC (разл.)
(этанол).
Масс: (FAB) 403 (MH+).
Элементный анализ (%):
рассчитано: C 56.66, H 3.75, N 6.95;
найдено: C 56.17, H 3.68, N 6.75.
ЯМР (400 МГц, ДМСО-d6) δ:
4.38 (д, J = 5.7 Гц, 2H), 5.98 (с, 2H), 6.64 (д, J = 15.4 Гц, 1H), 6.82 (дд, J = 1.5, 7.9 Гц, 1H), 6.86 (д, J = 7.9 Гц, 1H), 6.93 (д, J = 1.5 Гц, 1H), 7.00 (д, J = 15.4 Гц, 1H), 7.60 (дд, J = 2.4, 8.8 Гц, 1H), 7.83 (д, J = 2.4 Гц, 1H), 8.29 (д, J = 8.8 Гц, 1H), 9.29 (т, J = 5.7 Гц, 1H), 11.49 (с, 1H).
Пример 45
5-Бром-2-(транс-4-карбоксициклогексанкарбонил)амино- N-(3,4-метилендиоксибензил)бензамид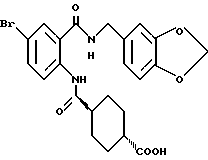
Белые иглы получали с выходом 74%.
Т.пл. 236-238oC
(белые иглы из водного EtOH).
ЯМР (406 МГц, ДМСО-d6) δ:
1.31 - 1.47 (м, 4H), 1.85 - 2.03 (м, 4H), 2.14 - 2.30 (м, 2H), 4.38 (д, J = 5.9 Гц, 2H), 5.99 (с, 2H), 6.81 (дд, J = 1.5, 7.9 Гц, 1H), 6.87 (д, J = 7.9 Гц, 1H), 6.93 (д, J = 1.5 Гц, 1H), 7.67 (дд, J = 2.4, 9.0 Гц, 1H), 7.94 (д, J = 2.4 Гц, 1H), 8.35 (д, J = 9.0 Гц, 1H), 9.33 (т, J = 5.9 Гц, 1H), 11.20 (с, 1H), 12.09 (ш, 1H).
Пример 46
2-(транс-4-Карбоксициклогексанкарбонил)амино-5-хлор-N- метил-N-(3,4-метилендиоксибензил)бензамид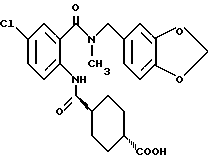
Белые призмы получали с выходом 78%.
Т.пл. 202-204oC
(белые призмы из водного EtOH)
ЯМР (400 МГц, ДМСО-d6) δ:
1.24 - 1.50 (м, 4H), 1.66 - 2.01 (м, 4H), 2.10 - 2.42 (м, 2H), 2.67, 2.83 (с, всего 3H), 4.22, 4.51 (с, всего 2H), 6.00, 6.01 (с, всего 2H), 6.62 - 6.67, 6.80 - 6.89 (м, всего 2H), 6.77, 7.02 (с, всего 1H), 7.35 - 7.57 (м, 3H), 9.57, 9.62 (с, всего 1H), 12.08 (ш, 1H).
Пример 47
транс-4-[4-Хлор-2-(3,4-метилендиоксибензил)карбамоил] фенил] аминометилциклогексанкарбоксилат натрия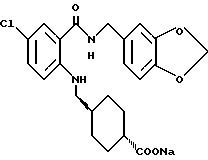
Этанол (7 мл), тетрагидрофуран (7 мл) и 1н. гидроксид натрия (7 мл) добавляли к 800 мг 5-хлор-2-[транс-4-(этоксикарбонил)- циклогексил]метил] амино-N-(3,4-метилендиоксибензил)бензамида и смесь перемешивали при комнатной температуре 17 ч.
Реакционную смесь концентрировали и очищали колоночной хроматографией с обращенной фазой на силикагеле (растворитель: 40% водный метанол). Фракции объединяли и концентрировали досуха. Твердый остаток промывали 2-пропанолом и получали 780 мг указанного в заголовке соединения в виде слабо-желтого порошка, выход 98%.
Т.пл. 266-271oC (разл.).
Масс: (FAB) 489 (M + Na)+, 467 (MH+).
ЯМР (400 МГц, ДМСО-d6) δ:
0.85 - 1.00 (м, 2H), 1.13 - 1.28 (м, 2H), 1.44 (м, 1H), 1.69 - 1.80 (м, 2H), 1.80 - 1.92 (м, 2H), 2.85 2.97 (м, 2H), 4.32 (д, J = 5.5 Гц, 2H), 5.98 (с, 2H), 6.67 (д, J = 9.3 Гц, 1H), 6.78 (дд, J = 1.5, 7.8 Гц, 1H), 6.85 (д, J = 7.8 Гц, 1H), 6.88 (д, J = 1.5 Гц, 1H), 7.26 (дд, J = 2.4, 9.3 Гц, 1H), 7.66 (д, J = 2.4 Гц, 1H), 7.97 (т, J = 5.5 Гц, 1H), 9.03 (т, J = 5.7 Гц, 1H).
Пример 48
4-[[4-Хлор-2-(3,4-метилендиоксибензил)карбамоил] фенил] - аминометилбензоат натрия
Слабо-желтый порошок получали с выходом 88%
Т.пл. > 300oC.
Масс: (FAB) 461 (MH+), 483 ((M + Na)+).
ЯМР (400 МГц, ДМСО-d6) δ:
4.33 (д, J = 5.7 Гц, 2H), 4.36 (д, J = 5.5 Гц, 2H), 5.99 (с, 2H), 6.63 (д, J = 9.0 Гц, 1H), 6.80 (дд, J = 1.5, 7.9 Гц, 1H), 6.88 (д, J = 7.9 Гц, 1H), 6.90 (д, J = 1.5 Гц, 1H), 7.20 (д, J = 8.1 Гц, 2H), 7.23 (дд, J = 2.6, 8.1 Гц, 1H), 7.67 (д, J = 2.6 Гц, 1H), 7.81 (д, J = 8.1 Гц, 2H), 8.29 (т, J = 5.7 Гц, 1H), 9.03 (т, J = 5.5 Гц, 1H).
Пример 49
4-[[4-Хлор-2-(3,4-метилендиоксибензил)карбамоил] фенил] - аминобутират натрия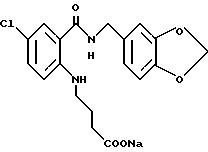
Слабо-желтый порошок получали с выходом 35%.
Масс: (FAB) 435 (MH + Na+).
ЯМР (400 МГц, ДМСО-d6) δ:
1.71 (м, 2H), 1.98 (м, 2H), 3.06 (м, 2H), 4.32 (д, J = 4.4 Гц, 2H), 5.98 (с, 2H), 6.72 (д, J = 9.0 Гц, 1H), 6.79 (дд, J = 1.1, 7.9 Гц, 1H), 6.85 (д, J = 7.9 Гц, 1H), 6.89 (д, J = 1.1 Гц, 1H), 7.25 (дд, J = 2.4, 9.0 Гц, 1H), 7.64 (д, J = 2.4 Гц, 1H), 7.86 (т, J = 4.4 Гц, 1H), 9.00 (д, J = 5.5 Гц).
Пример 50
5-[[4-Хлор-2-(3,4-метилендиоксибензил)карбамоил] фенил] - аминовалерат натрия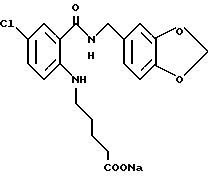
Слабо-желтый порошок получали с выходом 41%.
Масс: (FAB) 449 ((M + Na)+).
ЯМР (400 МГц, ДМСО-d6) δ:
1.48 - 1.60 (м, 4H), 1.88 - 1.98 (м, 2H), 2.99 -3.08 (м, 2H), 4.32 (д, J = 5.3 Гц, 2H), 5.97 (с, 2H), 6.66 (д, J = 9.0 Гц, 1H), 6.79 (дд, J = 1.5, 7.9 Гц, 1H), 6.85 (д, J = 7.9 Гц), 6.89 (д, J = 1.5 Гц, 1H), 7.27 (дд, J = 2.4, 9.0 Гц), 7.67 (д, J = 2.4 Гц, 1H), 7.87 (т, J = 5.3 Гц, 1H), 9.04 (т, J = 5.3 Гц, 1H).
Пример 51
1-[[[4-Хлор-2-(3,4-метилендиоксибензил)карбамоил] фенил]карбамоилметил] пиперидин-4-карбоксилат натрия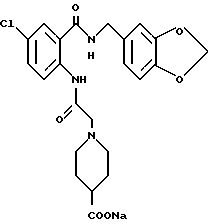
Белый порошок получали с выходом 76%
Т.пл. 244-249oC (разл.).
Масс: (FAB) 518 ((M + Na)+), 496 (MH+).
ЯМР (400 МГц, ДМСО-d6) δ:
1.68 - 1.85 (м, 4H), 2.05 - 2.16 (м, 2H), 2.67 - 2.77 (м, 2H), 3.01 (c, 2H), 3.42 (ш, 1H), 4.38 (ш, с, 2H), 5.98 (с, 2H), 6.85 (дд, J = 1.3, 8.1 Гц, 1H), 6.87 (дд, J = 0.7, 8.1 Гц, 1H), 6.93 (д, J = 0.7 Гц, 1H), 7.52 (дд, J = 2.6, 9.0 Гц, 1H), 7.74 (д, J = 2.6 Гц, 1H), 8.48 (д, J = 9.0 Гц, 1H), 9.38 (ш, 1H), 11.59 (ш, 1H).
Пример 52
4-[[[4-Диметиламинометил-2-(3,4-метилендиоксибензил)карбамоил] фенил] карбамоил]бензоат натрия
Белый порошок получали с выходом 48%.
Т.пл. 280oC (разл.).
ЯМР (400 МГц, ДМСО-d6) δ:
2.16 (с, 6H), 3.38 (с, 2H), 4.33 (д, J = 4.9 Гц, 2H), 5.98 (с, 2H), 6.82 - 6.88 (м, 2H), 6.95 (с, 1H), 7.48 (дд, J = 0.5, 8.4 Гц, 1H), 7.92 (д, J = 0.5 Гц, 1H), 7.82 (д, J = 8.1 Гц, 2H), 7.99 (д, J = 8.1 Гц, 1H), 8.59 (д, J = 8.4 Гц, 1H), 9.45 (ш, 1H), 12.42 (с, 1H).
Пример 53
2-Амино-5-бром-4-метокси-N-(3,4-метилендиоксибензил)бензамид
2-Амино-5-бром-4-метоксибензойную кислоту (1.50 г), пиперониламин (0.84 мл), гидрохлорид 1-(3-диметиламинопропил)-3- этилкарбодиимида (1.29 г), 1-гидроксибензтриазол (0.91 г) и триэтиламин (0.93 мл) добавляли к 20 мл N, N-димeтилфopмaмида. Смесь перемешивали при комнатной температуре 20 ч и добавляли воду. Образовавшийся осадок отделяли фильтрованием и получали 2.19 г целевого соединения в виде слабо-оранжевого порошка, выход 100%.
Т.пл. 143-144.
Масс: 378 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.85 (3H, с), 4.46 (2H, д, J = 5.7 Гц), 5.81 (2H, с), 5.95 (2H, с), 6.15 (1H, с), 6.15 (1H, м), 6.77 (1H, дд, J = 7.9, 0.5 Гц), 6.79 (IH, дд, J = 7.9, 2.2 Гц), 6.83 (1H, дд, J = 2.2, 0.5 Гц), 7.44 (1H, с).
Пример 54
2-Амино-5-бром-М-(3-хлор-4-метоксибензил)-4-метоксибензамид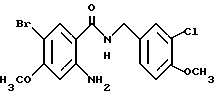
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-оранжевого порошка, выход 100%.
Т.пл. 146-148oC.
Масс: 400 (MH+).
ЯМР (400 МГц, CDCl3) δ:
3.85 (3H, с), 3.89 (3H, с), 4.47 (2H, д, J = 5.7 Гц), 5.81 (2H, с), 6.15 (1H, с), 6.23 (1H, т, J = 5.7 Гц), 6.89 (1H, д, J = 8.4 Гц), 7.19 (1H, дд, J = 8.4, 2.2 Гц), 7.34 (1H, д, J = 2.2 Гц), 7.45 (1H, с).
Пример 55
2-Амино-5-хлор-N-(3-хлор-4-метоксибензил)бензамид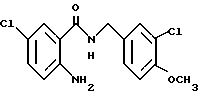
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-охристого порошка, выход 93%.
Т.пл. 176-178oC.
Масс: 324 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.50 (2H, д, J = 5.7 Гц), 5.54 (2H, с), 6.28 (1H, с), 6.63 (1H, д, J = 8.8 Гц), 6.90 (1H, д, J = 8.4 Гц), 7.15 (1H, дд, J = 8.4, 2.4 Гц), 7.21 (1H, дд, J = 8.4, 2.2 Гц), 7.27 (1H, д, J = 2.4 Гц), 7.36 (1H, д, J = 2.2 Гц).
Пример 56
2-Амино-5-хлор-N-[(2-метокси-5-пиридил)метил]бензамид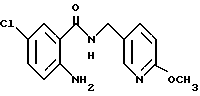
Указанное в заголовке соединение получали, как в Примере 53, в виде белого порошка, выход 73%.
Т.пл. 156-159oC.
Масс: 292 (MH+).
ЯМР (400 МГц, CDCl3) δ:
3.94 (3H, с), 4.52 (2H, д, J = 5.7 Гц), 5.54 (2H, с), 6.22 (1H, с), 6.63 (1H, д, J = 8.8 Гц), 6.75 (1H, д, J = 8.4 Гц), 7.15 (1H, дд, J = 8.8, 2.4 Гц), 7.25 (1H, дд, J = 2.4 Гц), 7.60 (1H, дд, J = 8.4, 2.6 Гц), 8.14 (1H, д, J = 2.6 Гц).
Пример 57
2-Аминo-N-(3,4-мeтилeндиoкcибeнзил)-5-тpифтopмeтoкcибeнзaмид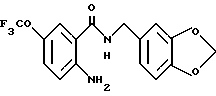
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-желтого порошка, выход 100%.
Т.пл. 150-153oC.
Масс: 354 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.50 (2H, д, J = 5.7 Гц), 5.59 (2H, с), 5.96 (2H, с), 6.19 (1H, с), 6.66 (1H, д, J = 8.8 Гц), 6.78 (1H, дд, J = 7.9, 0.5 Гц), 6.81 (1H, дд, J = 7.9, 1.5 Гц), 6.85 (1H, дд, J = 1.5, 0.5 Гц), 7.09 (1H, м), 7.14 (1H, д, J = 2.6 Гц).
Пример 58
2-Аминo-5-xлop-N-(3-циaнo-4-мeтoкcибeнзил)бeнзaмид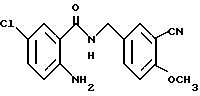
Указанное в заголовке соединение получали, как в Примере 53, в виде белого порошка, выход 100%.
Т.пл. 174-177oC
Масс: 315 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.89 (3H, с), 4.36 (2H, д, J = 5.7 Гц), 6.59 (2H, с), 6.73 (1H, д, J = 8.8 Гц), 7.17 (1H, дд, J = 8.8, 2.6 Гц), 7.22 (1H, д, J = 8.6 Гц), 7.58 -7.66 (3H, м), 8.89 (1H, т, J = 5.7 Гц).
Пример 59
2-Амино-5-бром-N-(3-хлор-4-метоксибензил)бензамид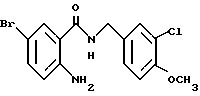
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-оранжевого порошка, выход 98%.
Т.пл. 168-170oC.
Масс: 370 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.49 (2H, д, J = 5.7 Гц), 5.56 (2H, с), 6.30 (1H, с), 6.58 (1H, д, J = 8.8 Гц), 6.90 (1H, д, J = 8.4 Гц), 7.20 (1H, дд, J = 8.4, 2.2 Гц), 7.27 (1H, дд, J = 8.8, 2.2 Гц), 7.35 (1H, д, J = 2.2 Гц), 7.40 (1H, д, J = 2.2 Гц).
Пример 60
2-Аминo-5-xлop-N-(4-xлop-3-мeтoкcибeнзил)бeнзaмид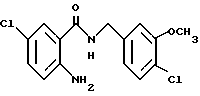
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-охристого порошка, выход 99%.
Т.пл. 162-163oC.
Масс: 324 (M+).
H-ЯМР (400 МГц, CDCl3 δ:
3.91 (3H, с), 4.55 (2H, д, J = 5.7 Гц), 5.54 (2H, с), 6.31 (1H, с), 6.46 (1H, д, J = 8.8 Гц), 6.87 (1H, дд, J = 8.1, 1.8 Гц), 6.92 (1H, д, J = 1.8 Гц), 7.16 (1H, дд, J = 8.8, 2.4 Гц), 7.28 (1H, д, J = 2.4 Гц), 7.34 (1H, д, J = 8.1 Гц).
Пример 61
2-Амино-5-циано-N-(3,4-метилендиоксибензил)бензамид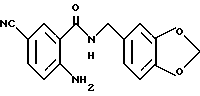
Указанное в заголовке соединение получали, как в примере 1, в виде слабо-желтого порошка, выход 88%.
Т.пл. 163-166oC.
Масс: 295 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.49 (2H, д, J = 5.5 Гц), 5.96 (2H, с), 6.22 (1H, с), 6.40 (1H, м), 6.63 (1H, д, J = 8.6 Гц), 6.79 (1H, д, J = 8.1 Гц), 6.81 (1H, дд, J = 8.1, 1.3 Гц), 6.84 (1H, д, J = 1.3 Гц), 7.40 (1H, дд, J = 8.1, 1.8 Гц), 7.65 (1H, д, J = 1.8 Гц).
Пример 62
2-Амино-N-(3-хлор-4-метоксибензил)-5-цианобензамид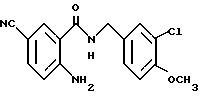
Указанное в заголовке соединение получали, как в Примере 53, в виде бледно-желтого порошка, выход 100%.
Т.пл. 184-186oC.
Масс: 316 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.50 (2H, д, J = 5.7 Гц), 6.23 (2H, с), 6.47 (1H, м), 6.67 (1H, д, J = 8.6 Гц), 6.92 (1H, д, J = 8.4 Гц), 7.22 (1H, дд, J = 8.4, 2.2 Гц), 7.37 (1H, д, J = 2.2 Гц), 7.41 (1H, дд, J = 8.6, 2.0 Гц), 7.67 (1H, д, J = 2.0 Гц).
Пример 63
2-Амино-N-(3-хлор-4-метоксибензил)-5-нитробензамид
Указанное в заголовке соединение получали, как в Примере 53, в виде желтого порошка, выход 79%.
Т.пл. 194-198oC.
Масс: 336 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.90 (3H, с), 4.53 (2H, д, J = 5.7 Гц), 6.50 - 6.64 (3H, м), 6.66 (1H, д, J = 9.2 Гц), 6.91 (1H, д, J = 8.4 Гц), 7.23 (1H, дд, J = 8.4, 2.2 Гц), 7.38 (1H, д, J = 2.6 Гц), 8.08 (1H, дд, J = 9.2, 2.6 Гц), 8.34 (1H, д, J = 2.4 Гц).
Пример 64
2-Амино-5-диметилсульфамоил-N-3-хлор-4-метоксибензил)бензамид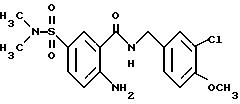
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-желтого порошка, выход 93%.
Т.пл. 195-199oC.
Масс: 398 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
2.66 (6H, с), 3.89 (3H, с), 4.51 (2H, д, J = 5.9 Гц), 6.26 (2H, с), 6.72 (1H, д, J = 8.8 Гц), 6.89 (1H, д, J = 8.4 Гц), 6.89 (1H, т, J = 5.9 Гц), 7.24 (1H, дд, J = 8.4, 2.2 Гц), 7.39 (1H, д, J = 2.2 Гц), 7.54 (1H, дд, J = 8.8, 2.0 Гц), 7.84 (1H, д, J = 2.0 Гц).
Пример 65
2-Амино-5-метилсульфамоил-N-(3-хлор-4-метоксибензил)бензамид
Указанное в заголовке соединение получали, как в Примере 53, в виде слабо-желтого порошка, выход 78%.
Т.пл. 154-155oC.
Масс: 383 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
2.57 (3H, д, J = 5.5 Гц), 3.87 (3H, с), 4.47 (2H, д, J = 5.9 Гц), 4.66 (1H, к, J = 5.5 Гц), 6.26 (2H, с), 6.68 (1H, д, J = 8.6 Гц), 6.86 (1H, д, J = 8.6 Гц), 7.01 (1H, т, J = 5.9 Гц), 7.20 (1H, дд, J = 8.6, 2.2 Гц), 7.36 (1H, д, J = 2.2 Гц), 7.57 (1H, дд, J = 8.6, 2.2 Гц), 7.93 (1H, д, J = 2.2 Гц).
Пример 66
2-Амино-N-(3,4-метилендиоксибензил)-5-(1-пиразолил)бензамид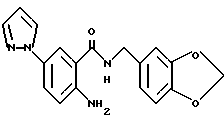
N-(3,4-Метилендиоксибензил)-2-нитро-5-(1-пиразолил)бензамид (1.80 г) растворяли в 120 мл тетрагидрофурана и добавляли 1.8 г 10% палладия на угле (водосодержащего). Смесь подвергали каталитическому восстановлению при комнатной температуре и 1 атм. Через 13 ч катализатор отфильтровывали и реакционную смесь концентрировали в вакууме. Остаток кристаллизовали из эфира. Образующиеся кристаллы отделяли фильтрованием и получали 1.50 г целевого соединения в виде порошка, выход 91%.
Т.пл. 146-147oC.
Масс: 336 (M+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.50 (2H, д, J = 5.7 Гц), 5.65 (2H, с), 5.95 (2H, с), 6.42 (1H, дд, J = 2.4, 1.8 Гц), 6.75 (1H, д, J = 8.8 Гц), 6.77 (1H, д, J = 8.2 Гц), 6.81 (1H, дд, J = 8.2, 1.6 Гц), 6.85 (1H, д, J = 1.6 Гц), 7.41 (1H, дд, J = 8.8, 2.4 Гц), 7.65 (1H, д, J = 1.8 Гц), 7.69 (1H, д, J = 2.4 Гц), 7.76 (1H, д, J = 2.4 Гц).
Пример 67
2-Амино-N-(3,4-метилендиоксибензил)-5-(1,2,4-триазол-1- ил)бензамид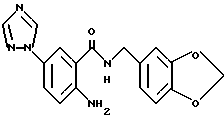
Указанное в заголовке соединение получали, как в Примере 66, в виде белого порошка, выход 94%.
Т.пл. 163-164oC.
Масс: 338 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.51 (2H, д, J = 5.5 Гц), 5.79 (2H, с), 5.96 (2H, с), 6.48 (1H, с), 6.78 (1H, д, J = 8.2 Гц), 6.78 (1H, д, J = 8.9 Гц), 6.81 (1H, дд, J = 8.2, 1.6 Гц), 6.85 (1H, д, J = 1.6 Гц), 7.41 (1H, дд, J = 8.9, 2.4 Гц), 7.62 (1H, д, J = 2.4 Гц), 8.03 (1H, с), 8.37 (1H, с).
Пример 68
2-Амино-4-метокси-N-(3-хлор-4-метоксибензил)-5-цианобензамид
2-Амино-5-бром-4-метокси-N-(3-хлор-4-метоксибензил)бензамид (4.67 г) растворяли в 10 мл N-мeтил-2-пиppoлидoнa и добавляли 1.15 г цианида меди. Смесь перемешивали при 180oC 4 ч и добавляли водный раствор этилендиамина. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3:2)). Полученное твердое вещество промывали эфиром и получали 1.58 г указанного в заголовке соединения в виде слабо-желтого порошка, выход 39%.
Т.пл. 184-185oC.
Масс: 346 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.83 (3H, с), 3.90 (3H, с), 4.48 (2H, д, J = 5.9 Гц), 6.08 (1H, с), 6.32 - 6.42 (3H, м), 6.91 (1H, д, J = 8.4 Гц), 7.21 (1H, дд, J = 8.4, 2.2 Гц), 7.36 (1H, д, J = 2.2 Гц), 7.59 (1H, с).
Пример 69
7-Аминo-4-бpoм-N-(3,4-мeтилeндиoкcибeнзил)изoиндoлин-1-он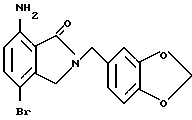
7-Амино-4-бромизоиндолинон (0.35 г) суспендировали в 50 мл диметилформамида и добавляли 0.29 г 60% гидрида натрия. Смесь перемешивали при комнатной температуре 45 мин и добавляли 0.29 г пиперонилхлорида. Полученную смесь перемешивали при комнатной температуре 4 ч и добавляли лед с водой и смесь экстрагировали этилацетатом. Органическую фазу промывали 1н. соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3:1)). Твердый остаток промывали н-гексаном и получали 0.25 г указанного в заголовке соединения в виде бледно-желтого порошка, выход 46%.
Т.пл. 151-153oC.
Масс: 361 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
4.08 (2H, с), 4.63 (2H, с), 5.26 (2H, с), 5.95 (2H, с), 6.50 (1H, д, J = 8.6 Гц), 6.76 - 6.79 (3H, м), 7.28 (1H, д, J = 8.6 Гц).
Пример 70
8-Амино-5-хлор-N-(3,4-метилендиоксибензил)-1,2,3,4- тетрагидроизохинолин-1-он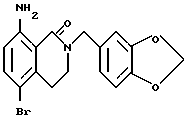
Указанное в заголовке соединение получали, как в Примере 69, в виде слабо-желтого порошка, выход 84%.
1H-ЯМР (400 МГц, CDCl3) δ:
2.94 (2H, т, J = 6.6 Гц), 3.40 (2H, т, J = 6.6 Гц), 4.63 (2H, с), 5.94 (2H, с), 6.18 (2H, с), 6.46 (1H, д, J = 8.8 Гц), 6.75 (1H, дд, J = 7.9, 0.5 Гц), 6.78 (1H, дд, J = 7.9, 1.2 Гц), 6.82 (1H, дд, J = 1.2, 0.7 Гц), 7.30 (1H, д, J = 8.8 Гц).
Пример 71
1-[[4-Хлор-2-[(3,4-метилендиоксибензил)карбамоил] фенил]карбамоил]-4-гидроксипиперидин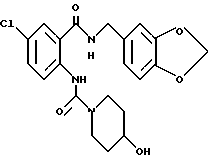
1-(2-Карбокси-4-хлорфенилкарбамоил)-4-гидроксипиперидин (0.5 г), пиперониламин (0.42 мл), 1,3-дициклогексилкарбодиимид (0.38 г), 1-гидроксибензтриазол (0.25 г) и 4-диметиламинопиридин (25 мг) добавляли к 8 мл N.N-диметилформамида. Смесь перемешивали при комнатной температуре 61 ч и добавляли воду и этилацетат. Нерастворимый материал отфильтровывали, органическую фазу отделяли, промывали 1н. соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан/метанол (30:1)). Полученное вещество кристаллизовали из н-гексан/этилацетата, перекристаллизовывали из водного этанола и получали 0.39 г целевого соединения в виде белого порошка, выход 53%.
Т.пл. 151-155oC (разл.).
Масс: 432 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
0.56 (2H, м), 1.74 (1H, м), 1.95 (2H, м), 3.21 (2H, ддд, J = 13.6, 9.3, 3.3 Гц), 3.83 - 3.97 (3H, м), 4.47 (2H, д, J = 5.7 Гц), 5.96 (2H, с), 6.87 (1H, дд, J = 7.9, 0.5 Гц), 6.81 (1H, дд, J = 7.9, 1.6 Гц), 6.85 (1H, дд, J = 1.6, 0.5 Гц), 7.03 (1H, т, J = 5.7 Гц), 7.25 (1H, дд, J = 9.2, 2.4 Гц), 7.33 (1H, д, J = 2.4 Гц), 8.21 (1H, д, J = 9.2 Гц), 10.57 (1H, с).
Пример 72
Этил-1-[[4-бром-2-[(3,4-метилендиоксибензил)карбамоил]фенил]- карбамоил] пиперидин-4-карбоксилат
Этил-1-[(4-бром-2-карбоксифенил)карбамоил] пиперидин-4- карбоксилат (1.2 г), пиперониламин (0.56 мл), 1,3-дициклогексилкарбодиимид (0.68 г), 1-гидроксибензтриазол (0.45 г) и 4-диметиламинопиридин (каталитическое количество) добавляли к 10 мл диметилформамида. Полученную смесь перемешивали при комнатной температуре 20 ч, затем добавляли воду и этилацетат. Нерастворимый материал отфильтровывали, органическую фазу отделяли, промывали 1н. соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (2:1)). Полученное твердое вещество промывали эфиром и получали 1.27 г указанного в заголовке соединения в виде белого порошка, выход 77%.
Т.пл. 156-159oC.
Масс: 532 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.75 (2H, м), 1.99 (2H, м), 2.52 (1H, м), 3.05 (2H, м), 4.09 (2H, м), 4.16 (2H, кв, J = 7.1 Гц), 4.47 (2H, д, J = 5.7 Гц), 5.97 (2H, с), 6.79 (1H, дд, J = 8.1, 0.5 Гц), 6.82 (1H, дд, J = 8.1, 1.5 Гц), 6.85 (1H, дд, J = 1.5, 0.5 Гц), 6.89 (1H, т, J = 5.7 Гц), 7.39 (1H, дд, J = 9.0, 2.4 Гц), 7.46 (1H, д, J = 2.4 Гц), 8.19 (1H, д, J = 9.0 Гц), 10.57 (1H, с).
Пример 73
1-[[4-Хлор-2-[(3-хлор-4-метоксибензил)карбамоил] фенил]карбамоил]- 4-гидроксипиперидин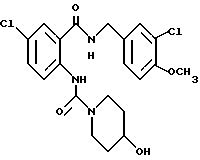
1-[(2-Карбокси-4-хлорфенил)карбамоил] -4-гидроксипиперидин (0.5 г), 3-хлор-4-метоксибензиламинхлоргидрат (0.7 г), 1,3-дициклогексилкарбодиимид (0.38 г), 1-гидроксибензтриазол (0.25 г), 4-диметиламинопиридин (25 мг) и триэтиламин (0.47 мл) добавляли к 8 мл N,N-димeтилфopмaмидa. Полученную смесь перемешивали при комнатной температуре 61 ч и добавляли воду и этилацетат. Нерастворимый материал отфильтровывали, органическую фазу отделяли и промывали 1н. соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и водным насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель дихлорметан/метанол (30: 1)). Полученное вещество кристаллизовали из н-гексана/этилацетата и перекристаллизовывали из водного этанола и получали 0.51 г указанного в заголовке соединения в виде белого порошка, выход 66%.
Т.пл. 173-174oC (разл.).
Масс: 452 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.33 (2H, м), 1.76 (2H, м), 3.11 (2H, ддд, J = 13.0, 9.5, 3.1 Гц), 3.64 - 3.78 (3H, м), 3.84 (3H, с), 4.40 (2H, д, J = 5.7 Гц), 4.46 (1H, д, J = 4.2 Гц), 7.11 (1H, д, J = 8.6 Гц), 7.28 (2H, дд, J = 8.6, 2.2 Гц), 7.41 (1H, д, J = 2.2 Гц), 7.50 (1H, дд, J = 9.2, 2.6 Гц), 7.82 (1H, д, J = 2.6 Гц), 8.32 (1H, д, J = 9.2 Гц), 9.37 (1H, т, J = 5.7 Гц), 11.02 (1H, с).
Пример 74
1-[[2-[(3-Хлор-4-метоксибензил)карбамоил] -4-цианофенил]- карбамоил]-4-гидроксипиперидин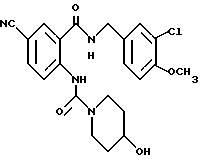
Указанное в заголовке соединение получали, как в Примере 73, в виде белого порошка, выход 13%.
Т.пл. 194-196oC.
Масс: 443 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.35 (2H, м), 1.77 (2H, м), 3.16 (2H, м), 3.64 -3.80 (3H, м), 3.84 (3H, с), 4.42 (2H, д, J = 5.5 Гц), 4.77 (1H, д, J = 4.2 Гц), 7.11 (1H, д, J = 8.4 Гц), 7.29 (1H, дд, J = 8.9, 2.0 Гц), 7.43 (1H, д, J = 2.0 Гц), 7.86 (1H, дд, J = 9.0, 1.6 Гц), 8.24 (1H, д, J = 1.6 Гц), 8.49 (1H, д, J = 9.0 Гц), 9.42 (1H, м), 11.47 (1H, с).
Пример 75
Этил-1-[[4-бром-2-[(3-хлор-4-метоксибензил)карбамоил] фенил]- карбамоил] пиперидин-4-карбоксилат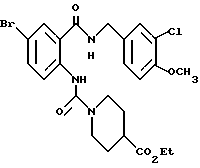
Этил- 1-[(4-бром-2-карбоксифенил)карбамоил]пиперидин-4- карбоксилат (1.0 г), 3-хлор-4-метоксибензиламин (0.78 г), 1,3-дициклогексилкарбодиимид (0.57 г), 1-гидроксибензтриазол (0.37 г), 4-диметиламинопиридин (каталитическое количество) и триэтиламин (0.52 мл) добавляли к 8 мл диметилформамида. Полученную смесь перемешивали при комнатной температуре 66 ч и добавляли воду и этилацетат. Нерастворимый материал отфильтровывали, органическую фазу отделяли и промывали 1н. соляной кислотой, водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (2: 1)). Твердое вещество промывали эфиром и получали 1.00 г указанного в заголовке соединения в виде белого порошка, выход 72%.
Т.пл. 172-174oC.
Масс: 554 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.75 (2H, м), 1.99 (2H, м), 2.52 (1H, м), 3.05 (2H, м), 3.91 (3H, с), 4.08 (2H, м), 4.16 (2H, к, J = 7.1 Гц), 4.47 (2H, д, J = 5.7 Гц), 6.92 (1H, д, J = 8.4 Гц), 7.22 (1H, м), 7.22 (1H, дд, J = 8.4, 2.2 Гц), 7.33 (1H, дд, J = 9.2, 2.4 Гц), 7.41 (1H, д, J = 2.2 Гц), 7.45 (1H, д, J = 2.4 Гц), 8.10 (1H, д, J = 9.2 Гц), 10.53 (1H, с).
Пример 76
5-Хлор-N-(3-хлор-4-метоксибензил)-2-(пиперидиноацетамидо)бензамид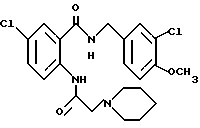
5-Хлор-2-хлорацетамидо-N-(3-хлор-4-метоксибензил)бензамид (0.7 г), пиперидин (0.51 мл), безводный карбонат калия (0.72 г) и тетра-н-бутиламмонийиодид (каталитическое количество) добавляли к 6 мл диметилформамида. Полученную смесь перемешивали при комнатной температуре 1.5 ч, добавляли воду и экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (3:1)), перекристаллизовывали из водного этанола и получали 0.37 г указанного в заголовке соединения в виде белых игл, выход 48%.
Т.пл. 126-129oC.
Масс: 450 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.42 - 1.50 (2H, м), 1.66 - 1.74 (4H, м), 2.46 - 2.56 (4H, м), 3.07 (2H, с), 3.90 (3H, с), 4.53 (2H, д, J = 5.7 Гц), 6.62 (1H, т, J = 5.9 Гц), 6.89 (1H, д, J = 8.4 Гц), 7.20 (1H, дд, J = 8.4, 2.2 Гц), 7.32 (1H, дд, J = 9.0, 2.0 Гц), 7.36 (1H, д, J = 2.2 Гц), 7.40 (1H, д, J = 2.4 Гц), 8.49 (1H, д, J = 9.0 Гц), 11.52 (1H, с).
Пример 77
5-Хлор-N-(3-хлор-4-метоксибензил)-2-(пирролидиноацетамидо)- бензамид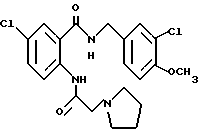
Указанное в заголовке соединение получали, как в Примере 24, в виде слабо-желтых призм, выход 86%.
Т.пл. 98-100oC.
Масс: 436 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.81 - 1.92 (4H, м), 2.61 - 2.72 (4H, м), 3.28 (2H, с), 3.89 (3H, с), 4.49 (2H, д, J = 5.9 Гц), 6.88 (1H, д, J = 8.4 Гц), 6.89 (1H, т, J = 5.9 Гц), 7.19 (1H, дд, J = 8.4, 2.2 Гц), 7.27 (1H, дд, J = 9.0, 2.4 Гц), 7.35 (1H, д, J = 2.2 Гц), 7.41 (1H, д, J = 2.4 Гц), 8.42 (1H, д, J = 9.0 Гц), 11.49 (1H, с).
Пример 78
5-Хлор-N-(3,4-метилендиоксибензил)-2-(пиперидинопропиониламидо)- бензамид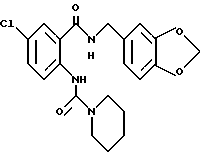
Указанное в заголовке соединение получали, как в Примере 24, в виде бледно-желтых игл, выход 60%.
Т.пл. 136-141oC.
Масс: 444 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.40 - 1.48 (2H, м), 1.56 - 1.64 (4H, м), 2.44 (4H, с), 2.56 (2H, т, J = 7.0 Гц), 2.70 (2H, т, J = 7.0 Гц), 4.48 (2H, д, J = 5.7 Гц), 5.97 (2H, с), 6.26 (1H, м), 6.78 (1H, д, J = 7.8 Гц), 6.80 (1H, д, J = 7.8 Гц), 6.83 (1H, с), 7.35 (1H, дд, J = 9.0, 2.4 Гц), 7.40 (1H, д, J = 2.4 Гц), 8.31 (1H, д, J = 9.0 Гц), 11.03 (1H, с).
Пример 79
5-Хлор-N-(3,4-метилендиоксибензил)-2-(4-пиперидинобутириламино)- бензамид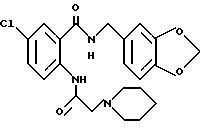
Указанное в заголовке соединение получали, как в Примере 24, в виде бледно-желтых игл, выход 7%.
Т.пл. 121-122oC.
Масс: 458 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.37 - 1.45 (2H, м), 1.51 - 1.59 (4H, м), 1.91 (2H, квинтет, J = 7.5 Гц), 2.31 - 2.46 (8H, м), 4.50 (2H, д, J = 5.7 Гц), 5.98 (2H, с), 6.43 (1H, м), 6.78 - 6.85 (3H, м), 7.39 (1H, д, J = 2.6 Гц), 7.39 (1H, дд, J = 9.7, 2.6 Гц), 8.56 (1H, д, J = 9.7 Гц), 10.96 (1H, с).
Пример 80
5-Циано-2-(изоникотиноиламино)-N-(3-хлор-4-метоксибензил)- бензамид
2-Амино-N-(3-хлор-4-метоксибензил)-5-цианобензамид (0.33 г) растворяли в 5 мл пиридина и охлаждали льдом. К раствору добавляли хлоргидрат изоникотиноилхлорида (0.2 г) и смесь перемешивали при комнатной температуре 4 ч и добавляли воду. Образующийся осадок отделяли фильтрованием, промывали водой и эфиром, перекристаллизовывали из этилацетата и получали бледно-желтые иглы, выход 64%.
Т.пл. 243-245oC (разл.).
Масс: 421 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.83 (2H, с), 4.47 (2H, д, J = 5.7 Гц), 7.32 (1H, дд, J = 8.4, 2.2 Гц), 7.46 (1H, д, J = 2.2 Гц), 7.79 - 7.83 (2H, м), 8.06 (1H, дд, J = 8.8, 1.8 Гц), 8.40 (1H, д, J = 1.8 Гц), 8.77 (1H, д, J = 8,8 Гц), 8,84 - 8.88 (2H, м), 9,56 (1H, т, J = 5,7 Гц), 12,90 (1H, с).
Пример 81
5-Бром-N-(3-хлор-4-метоксибензил)-2-(изоникотиноиламино) бензамид
Указанное в заголовке соединение получали, как в Примере 80, в виде белых игл, выход 75%.
Т.пл. 190-192oC.
Масс: 476 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3,90 (3H, с), 4,57 (2H, д, J = 5,7 Гц), 6,70 (1H, т, J = 5,7 Гц), 6,92 (1H, д, J = 8,4 Гц), 7,23 (1H, дд, J = 8,4, 2,2 Гц), 7,40 (1H, д, J = 2,2 Гц), 7,64 (1H, дд, J = 9,3, 2,2 Гц), 7,65 (1H, д, J = 2,2 Гц), 7,83 - 7,87 (2H, м), 8,72 (1H, д, J = 9,3 Гц), 8,81 - 8,85 (2H, м), 12,33 (1H, с)
Пример 82
5-Бром-2-(изоникотиноиламино)-4-метокси-N-(3-хлор-4-метоксибензил) бензамид
Указанное в заголовке соединение получали, как в Примере 80, в виде белых игл, выход 40%.
Т.пл. 252-253oC (разл.).
Масс: 506 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.83 (3H, с), 3.95 (3H, с), 4.45 (2H, д, J = 5.7 Гц), 7.11 (1H, д, J = 8.6 Гц), 7.30 (1H, дд, J = 8.6, 2.2 Гц), 7.42 (1H, д, J = 2.2 Гц), 7.80 - 7.84 (2H, м), 8.24 (1H, с), 8.55 (1H, с), 8.84 - 8.88 (2H, м), 9.39 (1H, т, J = 5.7 Гц), 13.26 (1H, с).
Пример 83
2-(Изоникотиноиламино)-4-метокси-N-(3-хлор-4- метоксибензил)-5-цианобензамид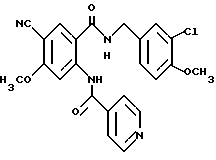
Указанное в заголовке соединение получали, как в Примере 80, в виде белых игл, выход 81%.
Т.пл. 262-267oC (разл.).
Масс: 451 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.83 (3H, с), 4.00 (3H, с), 4.46 (2H, д, J = 5.7 Гц), 7.11 (1H, д, J = 8.6 Гц), 7.31 (1H, дд, J = 8.6, 2.2 Гц), 7.44 (1H, д, J = 2.2 Гц), 7.81 - 7.84 (2H, м), 8.40 (1H, с), 8.60 (1H, с), 8.85 - 8.90 (2H, м), 9.42 (1H, т, J = 5.7 Гц), 13.48 (1H, с).
Пример 84
5-Бром-2-(изоникотиноиламино)-4-метокси-N-(3,4- метилендиоксибензил)бензамид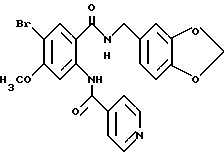
Указанное в заголовке соединение получали, как в Примере 80, в виде бледно-желтых игл, выход 75%.
Т.пл. 249-254oC (разл.).
Масс: 484 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.94 (3H, с), 4.42 (2H, д, J = 5.7 Гц), 5.98 (2H, с), 6.83 (1H, дд, J = 8.0, 1.3 Гц), 6.86 (1H, дд, J = 8.0, 0.4 Гц), 6.94 (1H, дд, J = 1.3, 0.4 Гц), 7.80 - 7.84 (2H, м), 8.24 (1H, с), 8.55 (1H, с), 8.83 - 8.88 (2H, м), 9.36 (1H, т, J = 5.7 Гц), 13.32 (1H, с).
Пример 85
5-Бром-2-(изоникотиноиламино)-N-(3,4-метилендиоксибензил)- бензамид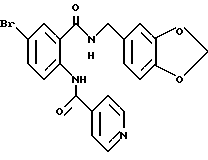
Указанное в заголовке соединение получали, как в Примере 80, в виде бледно-желтых игл, выход 49%.
Т.пл. 207-211oC.
Масс: 454 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
4.42 (2H, д, J = 5.7 Гц), 5.98 (2H, с), 6.83 (1H, дд, J = 7.9, 1.5 Гц), 6.86 (1H, д, J = 7.9 Гц), 6.95 (1H, д, J = 1.5 Гц), 7.75 - 7.83 (3H, м), 8.10 (1H, д, J = 2.2 Гц), 8.53 (1H, д, J = 9.0 Гц), 8.81 - 8.87 (2H, м), 9.48 (1H, т, J = 5.7 Гц), 12.61 (1H, с).
Т.пл. 183-184oC.
Масс: 451 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.54 - 1.75 (4H, м), 2.08 - 2.16 (2H, м), 2.20 - 2.28 (2H, м), 2.39 (1H, м), 2.51 (1H, м), 3.91 (3H, с), 4.53 (2H, д, J = 5.7 Гц), 6.92 (1H, т, J = 5.7 Гц), 6.93 (1H, д, J = 8.4 Гц), 7.22 (1H, дд, J = 8.4, 2.2 Гц), 7.39 (1H, д, J = 2.2 Гц), 7.70 (1H, дд, J = 8.0, 2.0 Гц), 7.86 (1H, д, J = 2.0 Гц), 8.79 (1H, д, J = 8.8 Гц), 11.57 (1H, с).
Пример 87
5-Бром-2-[(транс-4-цианоциклогексанкарбонил)амино] -N-(3,4- метилендиоксибензил)бензамид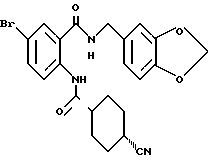
Указанное в заголовке соединение получали, как в Примере 86, в виде белых кристаллических гранул, выход 75%.
Т.пл. 147-149oC.
Масс: 484 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.54 - 1.73 (4H, м), 2.07 - 2.14 (2H, м), 2.19 - 2.27 (2H, м), 2.35 (1H, м), 2.50 (1H, м), 4.51 (2H, д, J = 5.5 Гц), 5.98 (2H, с), 6.47 (1H, м), 6.80 (2H, с), 6.84 (1H, с), 7.55 (1H, дд, J = 9.5, 2.2 Гц), 7.55 (1H, д, J = 2.2 Гц), 8.52 (1H, д, J = 9.5 Гц), 11.13 (1H, с).
Пример 88
2-[(транс-4-(Ацетокси)циклогексанкарбонил)aмино] -N-(3- хлор-4-метоксибензил)-5-цианобензамид
Указанное в заголовке соединение получали, как в Примере 86, в виде белых игл, выход 60%.
Т.пл. 194-196oC.
Масс: 484 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.39 - 1.50 (2H, м), 1.62 - 1.74 (2H, м), 2.05 (3H, с), 2.05 - 2.15 (4H, м), 2.34 (1H, тт, J = 11.7, 3.3 Гц), 3.91 (3H, с), 4.54 (2H, д, J = 5.9 Гц), 4.73 (1H, тт, J = 11.0, 4.0 Гц), 6.82 (1H, т, J = 5.9 Гц), 6.93 (1H, д, J = 8.4 Гц), 7.23 (1H, дд, J = 8.4, 2.2 Гц), 7.40 (1H, д, J = 2.2 Гц), 7.70 (1H, дд, J = 8.8, 2.0 Гц), 7.83 (1H, д, J = 2.0 Гц), 8.81 (1H, д, J = 8.8 Гц), 11.47 (1H, с).
Пример 89
5-Хлор-N-(3,4-метилендиоксибензил)-2-[(транс-4- пиперидиноциклогексанкарбонил)амино]бензамид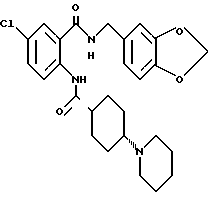
Указанное в заголовке соединение получали, как в Примере 86, в виде бледно-желтых игл, выход 17%.
Т.пл. 162-163oC.
Масс: 498 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.29 - 1.48 (4H, м), 1.50 - 1.63 (6H, м), 2.00 (2H, м), 2.10 (2H, м), 2.22 (1H, м), 2.32 (1H, м), 2.46 - 2.58 (4H, м), 4.51 (2H, д, J = 5.7 Гц), 5.97 (2H, с), 6.51 (1H, т, J = 5.7 Гц), 6.77 - 6.85 (3H, м), 7.38 (1H, дд, J = 8.6, 2.6 Гц), 7.39 (1H, д, J = 2.6 Гц), 8.57 (1H, д, J = 8.6 Гц), 10.94 (1H, с).
Пример 90
N-(3-Xлop-4-мeтoкcибeнзил)-5-циaнo-2-[(тpaнc-4- пипepидинoциклогексанкарбонил)амино]бензамид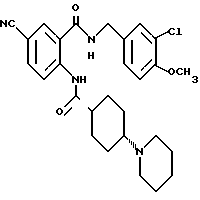
Указанное в заголовке соединение получали, как в Примере 86, в виде белых игл, выход 2%.
Т.пл. 215-218oC (разл.).
Масс: 509 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.31 - 1.48 (4H, м), 1.51 - 1.64 (4H, м), 2.01 (2H, м), 2.11 (2H, м), 2.22 - 2.38 (2H, м), 2.48 - 2.56 (4H, м), 3.91 (3H, с), 4.54 (2H, д, J = 5.7 Гц), 6.71 (1H, т, J = 5.7 Гц), 6.93 (1H, д, J = 8.4 Гц), 7.22 (1H, дд, J = 8.4, 2.2 Гц), 7.40 (1H, д, J = 8.8, 2.0 Гц), 7.79 (1H, д, J = 2.0 Гц), 8.81 (1H, д, J = 8.8 Гц), 11.34 (1H, с).
Пример 91
N-(3-Хлор-4-метоксибензил)-5-циано-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]бензамид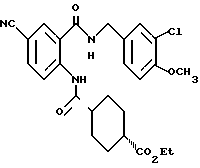
2-Амино-N-(3-хлор-4-метоксибензил)-5-цианобензамид (1.2 г) растворяли в 10 мл пиридина и охлаждали льдом. К раствору прикапывали раствор 1.0 г транс-4-этоксикарбонилциклогексанкарбонилхлорида в 2 мл дихлорметана таким путем, чтобы температура реакционной смеси не превышала 10oC. Полученную смесь перемешивали 4 ч, добавляли лед с водой и экстрагировали этилацетатом. Органическую фазу промывали 1н. соляной кислотой, водой, насыщенным водным раствором гидрохлорида натрия, водой и насыщенным водным раствором соли, сушили над безводным сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: н-гексан/этилацетат (2:1)). Полученное твердое вещество промывали эфиром и получали 0.9 г указанного в заголовке соединения в виде белого порошка, выход 48%.
Т.пл. 153-155oC.
Масс: 498 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.64 (4H, м), 2.05 - 2.19 (4H, м), 2.28 - 2.38 (2H, м), 3.91 (3H, с), 4.14 (2H, к, J = 7.1 Гц), 4.54 (2H, д, J = 5.7 Гц), 6.82 (1H, т, J = 5.7 Гц), 6.93 (1H, д, J = 8.4 Гц), 7.23 (1H, дд, J = 8.4, 2.2 Гц), 7.40 (1H, д, J = 2.2 Гц), 7.69 (1H, дд, J = 9.0, 1.8 Гц), 7.83 (1H, д, J = 1.8 Гц), 8.81 (1H, д, J = 9.0 Гц), 11.45 (1H, с).
Пример 92
5-Hитро-N-(3-хлор-4-метоксибензил-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]бензамид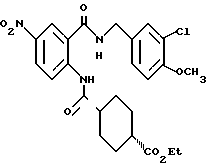
Указанное в заголовке соединение получали, как в Примере 91, в виде бледно-желтого порошка с выходом 61%.
Т.пл. 166-169oC.
Масс: 518 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.47 - 1.66 (4H, м), 2.07 - 2.20 (4H, м), 2.29 - 2.40 (2H, м), 3.91 (3H, с), 4.14 (2H, к, J = 7.1 Гц), 4.57 (2H, д, J = 5.7 Гц), 6.79 (1H, т, J = 5.7 Гц), 6.93 (1H, д, J = 8.4 Гц), 7.24 (1H, дд, J = 8.4, 2.2 Гц), 7.41 (1H, д, J = 2.2 Гц), 8.30 (1H, дд, J = 9.3, 2.6 Гц), 8.39 (1H, д, J = 2.6 Гц), 8.88 (1H, д, J = 9.3 Гц), 11.64 (1H, с).
Пример 93
5-Хлор-N-(3-хлор-4-метоксибензил)-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]бензамид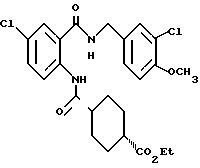
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 83%.
Т.пл. 122-125oC.
Масс: 507 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.43 - 1.63 (4H, м), 2.06 - 2.14 (4H, м), 2.24 - 2.36 (2H, м), 3.91 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.52 (2H, д, J = 5.7 Гц), 6.67 (1H, т, J = 5.7 Гц), 6.92 (1H, д, J = 8.4 Гц), 7.21 (1H, дд, J = 8.4, 2.2 Гц), 7.37 (1H, д, J = 2.2 Гц), 7.38 (1H, дд, J = 9.0, 2.4 Гц), 7.42 (1H, д, J = 2.4 Гц), 8.55 (1H, д, J = 9.0 Гц), 10.99 (1H, с).
Пример 94.
5-Хлор-2-[(транс-4-(этоксикарбонил)циклогексанкарбонил)амино] - N-(2-метокси-5-пиридилметил)бензамид
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 94%.
Т.пл.: 141-144oC.
Масс: 474 (MH+)
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.45 - 1.63 (4H, м), 2.04 - 2.18 (4H, м), 2.24 - 2.36 (2H, м), 3.94 (3H, с), 4.14 (2H, к, J = 7.1 Гц), 4.54 (2H, д, J = 5.7 Гц), 6.55 (1H, т, J = 5.7 Гц), 6.76 (1H, д, J = 8.6 Гц), 7.39 (1H, д, J = 2.4 Гц), 7.40 (1H, дд, J = 9.7, 2.4 Гц), 7.59 (1H, дд, J = 8.6, 2.6 Гц), 8.16 (1H, д, J = 2.6 Гц), 8.58 (1H, д, J = 9.7 Гц), 10.98 (1H, с).
Пример 95
5-Хлор-N-(3-циано-4-метоксибензил)-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]бензамид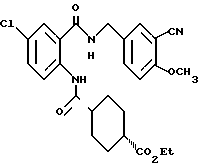
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 87%.
Т.пл. 157-160oC.
Масс: 496 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.44 - 1.62 (4H, м), 2.03 - 2.17 (4H, м), 2.24 - 2.36 (2H, м), 3.94 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.55 (2H, д, J = 5.9 Гц), 6.85 (1H, т, J = 5.9 Гц), 6.98 (1H, м), 7.39 (1H, дд, J = 9.0, 2.4 Гц), 7.44 (1H, д, J = 2.4 Гц), 7.53 - 7.58 (2H, м), 8.56 (1H, д, J = 9.0 Гц), 11.00 (1H, с).
Пример 96
5-Хлор-N-(4-хлор-3-метоксибензил)-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]бензамид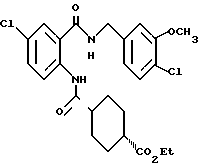
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 83%.
Т.пл. 167-168oC.
Масс: 507 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.44 - 1.64 (4H, м), 2.04 - 2.18 (4H, м), 2.25 - 2.36 (2H, м), 3.92 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.58 (2H, д, J = 5.7 Гц), 6.54 (1H, т, J = 5.7 Гц), 6.88 (1H, дд, J = 8.1, 1.6 Гц), 6.91 (1H, д, J = 1.6 Гц), 7.36 (1H, д, J = 8.1 Гц), 7.42 (1H, д, J = 2.2 Гц), 7.42 (1H, дд, J = 9.5, 2.2 Гц), 8.60 (1H, д, J = 9.5 Гц), 10.99 (1H, с).
Пример 97
5-Бром-N-(3-хлор-4-метоксибензил)-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]-4-метоксибензамид
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 76%.
Т.пл. 160oC (разл.).
Масс: 583 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.65 (4H, м), 2.08 - 2.16 (4H, м), 2.27 - 2.37 (2H, м), 3.91 (3H, с), 3.95 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.51 (2H, д, J = 5.5 Гц), 6.41 (1H, т, J = 5.5 Гц), 6.92 (1H, д, J = 8.4 Гц), 7.21 (1H, дд, J = 8.4, 2.2 Гц), 7.37 (1H, д, J = 2.2 Гц), 7.61 (1H, с), 8.52 (1H, с), 11.62 (1H, с).
Пример 98
5-Бром-4-метокси-N-(3-хлор-4-метоксибензил)-2- [[транс-4-(этоксикарбонил)циклогексанкарбонил]амино]бензамид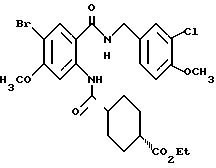
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 71%.
Т.пл. 171-173oC.
Масс: 553 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3ЗH, т, J = 7.1 Гц), 1.43 - 1.62 (4H, м), 2.03 - 2.16 (4H, м), 2.24 - 2.35 (2H, м), 3.90 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.52 (2H, д, J = 5.7 Гц), 6.79 (1H, т, J = 5.7 Гц), 6.91 (1H, д, J = 8.4 Гц), 7.21 (1H, дд, J = 8.4, 2.2 Гц), 7.37 (1H, д, J = 2.2 Гц), 7.50 (1H, дд, J = 9.0, 2.4 Гц), 7.57 (1H, д, J = 2.4 Гц), 8.47 (1H, д, J = 9.0 Гц), 11.01 (1H, с).
Пример 99
N-(3-Хлор-4-метоксибензил)-5-циано-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]-4-метоксибензамид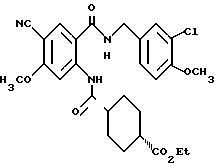
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 72%.
Т.пл. 193-195oC.
Масс: 526 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.65 (4H, м), 2.06 - 2.19 (4H, м), 2.28 - 2.39 (2H, м), 3.91 (3H, с), 3.98 (3H, с), 4.14 (2H, к, J = 7.1 Гц), 4.51 (2H, д, J = 5.7 Гц), 6.66 (1H, т, J = 5.7 Гц), 6.93 (1H, д, J = 8.6 Гц), 7.22 (1H, дд, J = 8.6, 2.2 Гц), 7.39 (1H, д, J = 2.2 Гц), 7.75 (1H, с), 8.58 (1H, с), 11.92 (1H, с).
Пример 100
N-(3-Хлор-4-метоксибензил)-5-диметилсульфамоил-2- [[транс-4-(этоксикарбонил)циклогексанкарбонил]амино]бензамид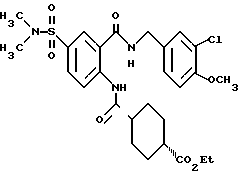
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 89%.
Т.пл. 197-198oC.
Масс: 580 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.47 - 1.65 (4H, м), 2.06 - 2.19 (4H, м), 2.29 - 2.39 (2H, м), 2.67 (6H, с), 3.90 (3H, с), 4.14 (2H, к, J = 7.1 Гц), 4.56 (2H, д, J = 5.9 Гц), 6.90 (1H, к, J = 8.4 Гц), 7.26 (1H, дд, J = 8.4, 2.2 Гц), 7.32 (1H, т, J = 5.9 Гц), 7.42 (1H, д, J = 2.2 Гц), 7.79 (1H, дд, J = 9.0, 2.2 Гц), 7.99 (1H, д, J = 2.2 Гц), 8.88 (1H, д, J = 9.0 Гц), 11.63 (1H, с).
Пример 101
N-(3-Хлор-4-метоксибензил)-2-[[транс-4- (этоксикарбонил)циклогексанкарбонил]амино]-5-метилсульфамоилбензамид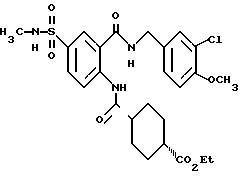
Указанное в заголовке соединение получали, как в Примере 91, в виде белого порошка с выходом 44%.
Т.пл. 190-191oC.
Масс: 566 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.46 - 1.65 (4H, м), 2.06 - 2.18 (4H, м), 2.29 - 2.39 (2H, м), 2.61 (3H, д, J = 5.3 Гц), 3.89 (3H, с), 4.14 (2H, к, J = 7.1 Гц), 4.53 (2H, д, J = 5.9 Гц), 4.65 (1H, к, J = 5.3 Гц), 6.89 (1H, д, J = 8.6 Гц), 7.20 (1H, т, J = 5.9 Гц), 7.23 (1H, дд, J = 8.6, 2.2 Гц), 7.40 (1H, д, J = 2.2 Гц), 7.84 (1H, дд, J = 9.0, 2.2 Гц), 8.03 (1H, д, J = 2.2 Гц), 8.83 (1H, д, J = 9.0 Гц), 11.58 (1H, с).
Пример 102
2-[(транс-4-(Этоксикарбонил)циклогексанкарбонил)амино] -N- (3,4-метилендиоксибензил)-5-(1-пиразолил)бензамид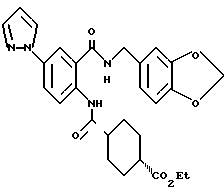
Указанное в заголовке соединение получали, как в Примере 86, в виде белого порошка с выходом 85%.
Т.пл. 197-201oC.
Масс: 519 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.46 - 1.66 (4H, м), 2.08 - 2.18 (4H, м), 2.27 - 2.38 (2H, м), 4.14 (2H, к, J = 7.1 Гц), 4.52 (2H, д, J = 5.7 Гц), 5.96 (2H, с), 6.47 (1H, дд, J = 2.4, 1.6 Гц), 6.78 (1H, д, J = 7.9 Гц), 6.80 (1H, дд, J = 7.9, 1.6 Гц), 6.84 (1H, д, J = 1.6 Гц), 6.85 (1H, м), 7.59 (1H, дд, J = 9.2, 2.6 Гц), 7.68 (1H, д, J = 1.6 Гц), 7.89 (1H, д, J = 2.6 Гц), 7.95 (1H, д, J = 2.4 Гц), 8.73 (1H, д, J = 9.2 Гц), 11.18 (1H, с).
Пример 103
2-[[транс-4-(Этоксикарбонил)циклогексанкарбонил] амино] -N-(3,4- метилендиоксибензил)-5-(1,2,4-триазол-1-ил)бензамид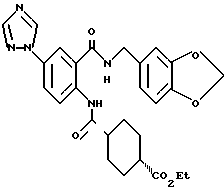
Указанное в заголовке соединение получали, как в Примере 86, в виде белого порошка с выходом 69%.
Т.пл. 204-206oC.
Масс: 520 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.27 (3H, т, J = 7.1 Гц), 1.45 - 1.65 (4H, м), 2.05 - 2.19 (4H, м), 2.28 - 2.38 (2H, м), 4.14 (2H, к, J = 7.1 Гц), 4.55 (2H, д, J = 5.7 Гц), 5.97 (2H, с), 6.79 (1H, д, J = 7.9 Гц), 6.82 (1H, дд, J = 7.9, 1.6 Гц), 6.85 (1H, д, J = 1.6 Гц), 6.91 (1H, т, J = 5.7 Гц), 7.64 (1H, дд, J = 9.2, 2.6 Гц), 7.86 (1H, д, J = 2.6 Гц), 8.05 (1H, с), 8.49 (1H, с), 8.79 (1H, д, J = 9.2 Гц), 11.21 (1H, с).
Пример 104
2-[[транс-4-(Этоксикарбонил)циклогексанкарбонил] амино] -N-(3,4- метилендиоксибензил)-5-трифторметоксибензамид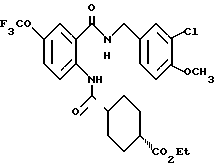
Указанное в заголовке соединение получали, как в Примере 86, в виде белого порошка с выходом 63%.
Т.пл. 179-180oC.
Масс: 537 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.44 - 1.64 (4H, м), 2.05 - 2.17 (4H, м), 2.25 - 2.37 (2H, м), 4.13 (2H, к, J = 7.1 Гц), 4.52 (2H, д, J = 5.7 Гц), 5.97 (2H, с), 6.53 (1H, т, J = 5.7 Гц), 6.79 (1H, д, J = 7.9 Гц), 6.81 (1H, д, J = 7.9 Гц), 6.84 (1H, с), 7.28 (1H, д, J = 2.7 Гц), 7.32 (1H, дд, J = 9.2, 2.6 Гц), 8.66 (1H, д, J = 9.2 Гц), 11.03 (1H, с).
Пример 105
5-Циано-2-[[транс-4-(этоксикарбонил)циклогексанкарбонил] - амино] -N-(3,4-метилендиоксибензил)бензамид
Указанное в заголовке соединение получали, как в Примере 86, в виде белого порошка с выходом 36%.
Т.пл. 150-153oC.
Масс: 478 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.64 (4H, м), 2.05 - 2.18 (4H, м), 2.28 - 2.38 (2H, м), 4.14 (2H, к, J = 7.1 Гц), 4.52 (2H, д, J = 5.7 Гц), 5.98 (2H, с), 6.75 (1H, т, J = 5.7 Гц), 6.80 (1H, дд, J = 7.9, 0.7 Гц), 6.83 (1H, дд, J = 7.9, 1.3 Гц), 6.85 (1H, дд, J = 1.3, 0.7 Гц), 7.69 (1H, дд, J = 9.0, 2.0 Гц), 7.81 (1H, д, J = 2.0 Гц), 8.80 (1H, д, J = 9.0 Гц), 11.46 (1H, с).
Пример 106
5-Бром-2-[[транс-4-(этоксикарбонил)циклогексанкарбонил] амино] - 4-метокси-N-(3,4-метилендиоксибензил)бензамид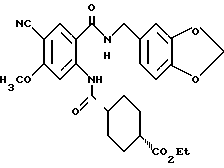
Указанное в заголовке соединение получали, как в Примере 86, в виде белого порошка с выходом 67%.
Т.пл. 194-195oC.
Масс: 561 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.66 (4H, м), 2.08 - 2.16 (4H, м), 2.27 - 2.37 (2H, м), 3.95 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.50 (2H, д, J = 5.5 Гц), 5.97 (2H, с), 6.35 (1H, т, J = 5.5 Гц), 6.80 (2H, с), 6.84 (1H, с), 7.60 (1H, с), 8.52 (1H, с), 11.65 (1H, с).
Пример 107
4-Бром-7-[[транс-4-(этоксикарбонил)циклогексанкарбонил] амино]- N-(3,4-метилендиоксибензил)изоиндолин-1-он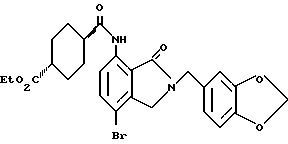
Указанное в заголовке соединение получали, как в Примере 86, в виде белого порошка с выходом 67%.
Т.пл. 135-137oC.
Масс: 543 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.68 (4H, м), 2.10 - 2.20 (4H, м), 2.29 - 2.41 (2H, м), 4.14 (2H, к, J = 7.1 Гц), 4.17 (2H, с), 4.66 (2H, с), 5.96 (2H, с), 6.76 - 6.82 (3H, м), 7.55 (1H, д, J = 8.8 Гц), 8.44 (1H, д, J = 8.8 Гц), 10.42 (1H, с).
Пример 108
5-Бром-8-[[транс-4-(этоксикарбонил)циклогексанкарбонил] - амино] -N-(3,4-метилендиоксибензил)-1,2,3,4-тетрагидроизохинолин- 1-он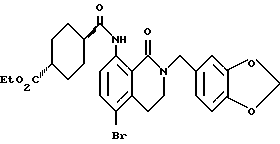
Указанное в заголовке соединение получали, как в Примере 86, в виде бесцветного масла с выходом 86%.
Масс: 557 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.46 - 1.67 (4H, м), 2.06 - 2.17 (4H, м), 2.28 - 2.38 (2H, м), 3.01 (2H, т, J = 6.6 Гц), 3.46 (2H, т, J = 6.6 Гц), 4.13 (2H, к, J = 7.1 Гц), 4.67 (2H, с), 5.96 (2H, с), 6.77 (1H, дд, J = 7.2, 1.3 Гц), 6.79 (1H, д, J = 7.2 Гц), 6.81 (1H, д, J = 1.3 Гц), 7.60 (1H, д, J = 9.0 Гц), 8.57 (1H, д, J = 9.0 Гц), 12.38 (1H, с).
Пример 109
N-(3-Хлор-4-метоксибензил)-5-циано-2-[(транс-4- гидроксициклогексанкарбонил)амино]бензамид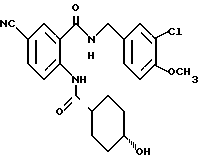
2-(транс-4-Ацетоксициклогексанкарбониламино)-N-(3-хлор-4- метоксибензил)-5-цианобензамид (0.9 г) растворяли в смешанном растворителе, содержащем 10 мл этанола и 10 мл тетрагидрофурана, и добавляли 6 мл 1н. гидроксида натрия. Смесь перемешивали при комнатной температуре 2 ч, добавляли воду и экстрагировали смесью этилацетат/тетрагидрофуран/этанол. Органическую фазу промывали насыщенным водным раствором соли, сушили над безводным сульфатом магния и растворитель отгоняли в вакууме. Твердое вещество промывали эфиром, перекристаллизовывали из водного этанола и получали 0.33 г указанного в заголовке соединения в виде белых игл, выход 39%.
Т.пл. 164-165oC.
Масс: 442 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.14 - 1.26 (2H, м), 1.35 - 1.47 (2H, м), 1.83 - 1.93 (4H, м), 3.35 (1H, м), 3.84 (3H, с), 4.42 (2H, д, J = 5.5 Гц), 4.61 (1H, д, J = 4.4 Гц), 7.12 (1H, д, J = 8.4 Гц), 7.30 (1H, дд, J = 8.4, 2.2 Гц), 7.44 (1H, д, J = 2.2 Гц), 7.94 (1H, дд, J = 8.8, 2.0 Гц), 8.25 (1H, д, J = 2.0 Гц), 8.58 (1H, д, J = 8.8 Гц), 9.24 (1H, т, J = 5.5 Гц), 11.54 (1H, с).
Пример 110
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -N-(3- хлор-4-метоксибензил)-5-цианобензамид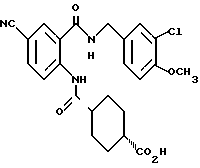
N-(3-Хлор-4-метоксибензил)-5-циано-2-(транс-4- этоксикарбонилциклогексанкарбониламино)бензамид (0.9 г) растворяли в смешанном растворителе, содержащем 10 мл этанола и 10 мл тетрагидрофурана, и добавляли 6 мл 1н. гидроксида натрия. Смесь перемешивали при комнатной температуре 8 ч и добавляли воду и этилацетат. Водную фазу отделяли, а фазу этилацетата экстрагировали водой. Обе водные фазы объединяли и подкисляли 1н. соляной кислотой. Образующийся осадок отделяли фильтрованием, перекристаллизовывали из водного этанола и получали 0.42 г указанного в заголовке соединения в виде белых игл, выход 72%.
Т.пл. 223-227oC.
Масс: 470 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.48 (4H, м), 1.89 - 2.02 (4H, м), 2.18 (1H, м), 2.31 (1H, м), 3.84 (3H, с), 4.43 (2H, д, J = 5.7 Гц), 7.12 (1H, д, J = 8.6 Гц), 7.31 (1H, дд, J = 8.6, 2.2 Гц), 7.44 (1H, д, J = 2.2 Гц), 7.93 (1H, дд, J = 8.8, 2.0 Гц), 8.26 (1H, д, J = 2.0 Гц), 8.60 (1H, д, J = 8.8 Гц), 9.43 (1H, т, J = 5.7 Гц), 11.57 (1H, с), 12.10 (1H, с).
Пример 111
1-[[4-Бром-2-[(3-хлор-4-метоксибензил)карбамоил]фенил] карбамоил]пиперидин-4-карбоновая кислота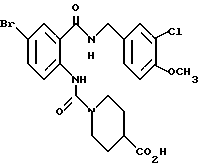
Указанное в заголовке соединение получали, как в Примере 110, в виде белого порошка с выходом 64%.
Т.пл. 259oC (разл.).
Масс: 526 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.48 (2H, м), 1.87 (2H, м), 2.49 (1H, м), 2.98 (1H, м), 3.84 (3H, с), 3.91 (2H, м), 4.40 (2H, д, J = 5.7 Гц), 7.11 (1H, д, J = 8.6 Гц), 7.28 (1H, дд, J = 8.6, 2.0 Гц), 7.61 (1H, д, J = 2.0 Гц), 7.94 (1H, д, J = 2.4 Гц), 8.26 (1H, д, J = 9.2 Гц), 9.38 (1H, т, J = 5.7 Гц), 11.04 (1H, с), 12.30 (1H, с).
Пример 112
2-[(транс-4-Карбоксициклогексанкарбонил)амино] - 5-хлор-N-(3-хлор-4-метоксибензил)бензамид
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 77%.
Т.пл. 233-235oC.
Масс: 478 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.30 - 1.47 (4H, м), 1.85 - 2.02 (4H, м), 2.13 - 2.29 (2H, м), 3.84 (3H, с), 4.40 (2H, д, J = 5.7 Гц), 7.11 (1H, д, J = 8.4 Гц), 7.29 (1H, дд, J = 8.4, 2.2 Гц), 7.41 (1H, д, J = 2.2 Гц), 7.55 (1H, дд, J = 9.0, 2.4 Гц), 7.82 (1H, д, J = 2.4 Гц), 8.39 (1H, д, J = 9.0 Гц), 9.35 (1H, т, J = 5.7 Гц), 11.15 (1H, с), 12.08 (1H, с).
Пример 113
5-Бром-2-[(транс-4-карбоксициклогексанкарбонил)амино] - N-(3-хлор-4-метоксибензил)бензамид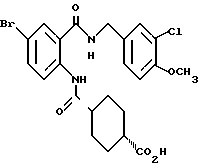
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл, выход 58%.
Т.пл. 247-250oC.
Масс: 523 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.30 - 1.46 (4H, м), 1.88 - 2.02 (4H, м), 2.13 - 2.29 (2H, м), 3.84 (3H, с), 4.40 (2H, д, J = 5.7 Гц), 7.11 (1H, д, J = 8.4 Гц), 7.28 (1H, дд, J = 8.4, 2.2 Гц), 7.41 (1H, д, J = 2.2 Гц), 7.67 (1H, дд, J = 9.0, 2.2 Гц), 7.94 (1H, д, J = 2.2 Гц), 8.33 (1H, д, J = 9.0 Гц), 9.35 (1H, т, J = 5.7 Гц), 11.16 (1H, с), 12.08 (1H, с).
Пример 114
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -N- (3-хлор-4-метоксибензил)-5-нитробензамид
Указанное в заголовке соединение получали, как в Примере 110, в виде бледно-желтых игл с выходом 65%.
Т.пл. 235-244oC (разл.).
Масс: 490 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.50 (4H, м), 1.91 - 2.04 (4H, м), 2.13 (1H, м), 2.34 (1H, м), 3.84 (3H, с), 4.45 (2H, д, J = 5.3 Гц), 7.12 (1H, д, J = 8.4 Гц), 7.31 (1H, дд, J = 8.4, 2.2 Гц), 7.44 (1H, д, J = 2.2 Гц), 8.38 (1H, дд, J = 9.3, 2.7 Гц), 8.68 (1H, д, J = 9.3 Гц), 8.69 (1H, д, J = 2.7 Гц), 9.68 (1H, т, J = 5.3 Гц), 11.76 (1H, с), 12.10 (1H, с).
Пример 115
5-Бром-2-[(транс-4-карбоксициклогексанкарбонил)амино] - N-(3-хлор-4-метоксибензил)-4-метоксибензамид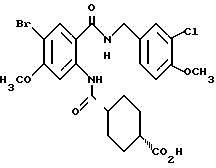
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 67%.
Т.пл. 223-229oC.
Масс: 555 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.50 (4H, м), 1.90 - 2.02 (4H, м), 2.18 (1H, м), 2.26 (1H, м), 3.83 (3H, с), 3.87 (3H, с), 4.39 (2H, д, J = 5.7 Гц), 7.11 (1H, д, J = 8.4 Гц), 7.27 (1H, дд, J = 8.4, 2.2 Гц), 7.39 (1H, д, J = 2.2 Гц), 8.09 (1H, с), 8.42 (1H, с), 9.24 (1H, т, J = 5.7 Гц), 11.92 (1H, с), 12.01 (1H, с).
Пример 116
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -N-(3-хлор-4- метоксибензил)-4-метокси-5-цианобензамид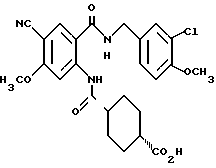
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 51%.
Т.пл. 255-257oC.
Масс: 500 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.33 - 1.51 (4H, м), 1.91 - 2.03 (4H, м), 2.19 (1H, м), 2.31 (1H, м), 3.84 (3H, с), 3.93 (3H, с), 4.41 (2H, д, J = 5.5 Гц), 7.11 (1H, д, J = 8.4 Гц), 7.29 (1H, дд, J = 8.4, 2.2 Гц), 7.41 (1H, д, J = 2.2 Гц), 8.27 (1H, с), 8.47 (1H, с), 9.28 (1H, т, J = 5.7 Гц), 12.01 (1H, с), 12.19 (1H, с).
Пример 117
2-[(транс-4-Карбоксициклогексанкарбонил)амино] - N-(3-хлор-4-метоксибензил)-5-диметилсульфамоилбензамид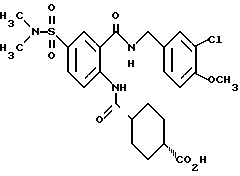
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 68%.
Т.пл. 245-246oC.
Масс: 552 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.46 (4H, м), 1.89 - 2.03 (4H, м), 2.19 (1H, м), 2.31 (1H, м), 2.63 (6H, с), 3.84 (3H, с), 4.45 (2H, д, J = 5.7 Гц), 7.12 (1H, д, J = 8.4 Гц), 7.29 (1H, дд, J = 8.4, 2.0 Гц), 7.42 (1H, д, J = 2.0 Гц), 7.86 (1H, дд, J = 8.8, 2.2 Гц), 8.10 (1H, д, J = 2.2 Гц), 8.64 (1H, д, J = 8.8 Гц), 9.58 (1H, т, J = 5.7 Гц), 11.50 (1H, с), 12.09 (1H, с).
Пример 118
2-[(транс-4-Карбоксициклогексанкарбонил)амино] - N-(3-хлор-4-метоксибензил)-5-метилсульфамоилбензамид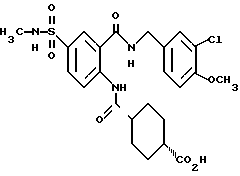
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 38%.
Т.пл. 247-249oC.
Масс: 538 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.31 - 1.48 (4H, м), 1.88 - 2.03 (4H, м), 2.18 (1H, м), 2.30 (1H, м), 2.41 (3H, д, J = 4.9 Гц), 3.84 (3H, с), 4.45 (2H, д, J = 5.9 Гц), 7.12 (1H, д, J = 8.4 Гц), 7.30 (1H, дд, J = 8.4, 2.2 Гц), 7.40 (1H, к, J = 4.9 Гц), 7.42 (1H, д, J = 2.2 Гц), 7.86 (1H, дд, J = 8.8, 2.2 Гц), 8.10 (1H, д, J = 2.2 Гц), 8.55 (1H, д, J = 8.8 Гц), 9.53 (1H, т, J = 5.9 Гц), 11.30 (1H, с), 12.08 (1H, с).
Пример 119
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -5-хлор- N-[(2-метокси-5-пиридил)метил]бензамид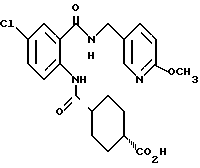
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 78%.
Т.пл. 219-221oC.
Масс: 446 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.30 - 1.46 (4H, м), 1.85 - 2.02 (4H, м), 2.13 - 2.29 (2H, м), 3.83 (3H, с), 4.41 (2H, д, J = 5.7 Гц), 6.80 (1H, д, J = 8.6 Гц), 7.54 (1H, дд, J = 9.0, 2.4 Гц), 7.70 (1H, дд, J = 8.6, 2.4 Гц), 7.81 (1H, д, J = 2.4 Гц), 8.16 (1H, д, J = 2.4 Гц), 8.38 (1H, д, J = 9.0 Гц), 9.33 (1H, т, J = 5.7 Гц), 11.13 (1H, с), 12.08 (1H, с).
Пример 120
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -5- хлор-N-(3-циано-4-метоксибензил)бензамид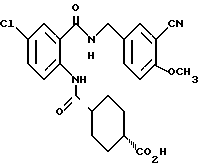
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 77%.
Т.пл. 190-193oC.
Масс: 470 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.30 - 1.46 (4H, м), 1.84 - 2.02 (4H, м), 2.12 - 2.28 (2H, м), 3.90 (3H, с), 4.43 (2H, д, J = 5.7 Гц), 7.23 (1H, д, J = 8.8 Гц), 7.55 (1H, дд, J = 9.0, 2.6 Гц), 7.65 (1H, дд, J = 8.8, 2.4 Гц), 7.70 (1H, д, J = 2.4 Гц), 7.78 (1H, д, J = 2.6 Гц), 8.36 (1H, д, J = 9.0 Гц), 9.34 (1H, т, J = 5.7 Гц), 11.10 (1H, с), 12.08 (1H, с).
Пример 121
2-[(транс-4-Карбоксициклогексанкарбонил)амино] - 5-хлор-N-(4-хлор-3-метоксибензил)бензамид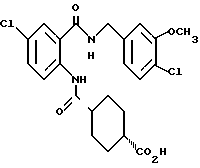
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 38%.
Т.пл. 224-225oC.
Масс: 479 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.29 - 1.46 (4H, м), 1.85 - 2.01 (4H, м), 2.13 - 2.28 (2H, м), 3.86 (3H, с), 4.47 (2H, д, J = 5.9 Гц), 6.93 (1H, дд, J = 8.1, 1.5 Гц), 7.15 (1H, д, J = 1.5 Гц), 7.37 (1H, д, J = 8.1 Гц), 7.56 (1H, дд, J = 9.0, 2.4 Гц), 7.85 (1H, д, J = 2.4 Гц), 8.39 (1H, д, J = 9.0 Гц), 9.39 (1H, т, J = 5.9 Гц), 11.16 (1H, с), 12.08 (1H, с).
Пример 122
1-[[4-Бром-2-[(3,4-метилендиоксибензил)карбамоил] фенил] карбамоил]пиперидин-4-карбоновая кислота
Указанное в заголовке соединение получали, как в Примере 110, в виде белого порошка с выходом 62%.
Т.пл. 276-280oC (разл.).
Масс: 504 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.47 (2H, м), 1.86 (2H, м), 2.49 (1H, м), 2.98 (1H, м), 3.91 (2H, м), 4.37 (2H, д, J = 5.7 Гц), 5.99 (2H, с), 6.81(1H, дд, J = 7.9, 1.6 Гц), 6.87 (1H, д, J = 1.6 Гц), 6.92 (1H, д, J = 7.9 Гц), 7.61 (1H, дд, J = 9.2, 2.4 Гц), 7.94 (1H, д, J = 2.4 Гц), 8.26 (1H, д, J = 9.2 Гц), 9.35 (1H, т, J = 5.7 Гц), 11.07 (1H, с), 12.30 (1H, с).
Пример 123
4-Бром-7-[(транс-4-карбоксициклогексанкарбонил)амино] - N-(3,4-метилендиоксибензил)изоиндолин-1-он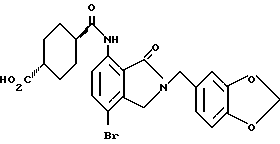
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 48%.
Т.пл. 261-263oC.
Масс: 515 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.34 - 1.54 (4H, м), 1.95 - 2.06 (4H, м), 2.21 (1H, м), 2.37 (1H, м), 4.29 (2H, с), 4.63 (2H, с), 6.00 (2H, с), 6.83 (1H, дд, J = 7.9, 1.6 Гц), 6.89 (1H, д, J = 7.9 Гц), 6.91 (1H, д, J = 1.6 Гц), 7.71 (1H, д, J = 8.8 Гц), 8.28 (1H, д, J = 8.8 Гц), 10.38 (1H, с), 12.01 (1H, с).
Пример 124
5-Бром-8-[(транс-4-карбоксициклогексанкарбонил)амино] - N-(3,4-метилендиоксибензил)-1,2,3,4-тетрагидро-1-изохинолинон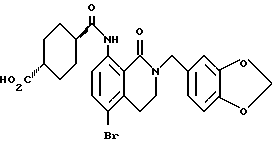
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 45%.
Т.пл. 241-244oC.
Масс: 529 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6 δ:
1.33 - 1.52 (4H, м), 1.92 - 2.04 (4H, м), 2.20 (1H, м), 2.28 (1H, м), 2.97 (2H, т, J = 6.8 Гц), 3.50 (2H, т, J = 6.8 Гц), 4.64 (2H, с), 6.00 (2H, с), 6.83 (1H, дд, J = 8.1, 1.5 Гц), 6.88 (1H, д, J = 8.1 Гц), 6.92 (1H, д, J = 1.5 Гц), 7.73 (1H, д, J = 9.0 Гц), 8.45 (1H, д, J = 9.0 Гц), 12.10 (1H, с), 12.39 (1H, с).
Пример 125
2-[(транс-4-Карбоксициклогексанкарбонил)амино] - N-(3,4-метилендиоксибензил)-5-трифторметоксибензамид
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 72%.
Т.пл. 245-250oC.
Масс: 509 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.31 - 1.48 (4H, м), 1.86 - 2.03 (4H, м), 2.14 - 2.32 (2H, м), 4.39 (2H, д, J = 5.7 Гц), 5.99 (2H, с), 6.82 (1H, дд, J = 8.1, 1.6 Гц), 6.87 (1H, д, J = 8.1 Гц), 6.94 (1H, д, J = 1.6 Гц), 7.52 (1H, дд, J = 9.2, 2.8 Гц), 7.76 (1H, д, J = 2.8 Гц), 8.46 (1H, д, J = 9.2 Гц), 9.33 (1H, т, J = 5.7 Гц), 11.22 (1H, с), 12.09 (1H, с).
Пример 126
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -N- (3,4-метилендиоксибензил)-5-(1-пиразолил)бензамид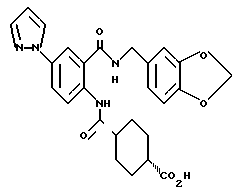
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 65%.
Т.пл. 219-221oC.
Масс: 491 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.49 (4H, м), 1.89 - 2.03 (4H, м), 2.15 -2.31 (2H, м), 4.42 (2H, д, J = 5.9 Гц), 5.99 (2H, с), 6.56 (1H, дд, J = 2.4, 1.8 Гц), 6.84 (1H, дд, J = 7.8, 1.5 Гц), 6.87 (1H, д, J = 7.8 Гц), 6.95 (1H, д, J = 1.5 Гц), 7.76 (1H, д, J = 1.8 Гц), 7.94 (1H, дд, J = 9.0, 2.6 Гц), 8.16 (1H, д, J = 2.6 Гц), 8.48 (1H, д, J = 9.0 Гц), 8.48 (1H, д, J = 2.4 Гц), 9.38 (1H, т, J = 5.9 Гц), 11.18 (1H, с), 12.08 (1H, с).
Пример 127
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -N-(3,4- метилендиоксибензил)-5-(1,2,4-триазол-1-ил)бензамид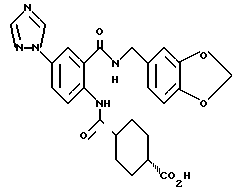
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 73%.
Т.пл. 278-281oC (разл.).
Масс: 492 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.50 (4H, м), 1.90 - 2.03 (4H, м), 2.15 - 2.33 (2H, м), 4.43 (2H, д, J = 5.7 Гц), 5.99 (2H, с), 6.84 (1H, дд, J = 8.1, 1.1 Гц), 6.87 (1H, д, J = 8.1 Гц), 6.95 (1H, д, J = 1.1 Гц), 7.96 (1H, дд, J = 9.0, 2.4 Гц), 8.21 (1H, д, J = 2.4 Гц), 8.25 (1H, с), 8.54 (1H, д, J = 9.0 Гц), 9.24 (1H, с), 9.37 (1H, т, J = 5.7 Гц), 11.23 (1H, с), 12.09 (1H, с).
Пример 128
2-[(транс-4-Карбоксициклогексанкарбонил)амино] -5-циано- N-(3,4-метилендиоксибензил)бензамид
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 72%.
Т.пл. 238-241oC (разл.).
Масс: 450 (MH+).
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.32 - 1.48 (4H, м), 1.89 - 2.03 (4H, м), 2.19 (1H, м), 2.31 (1H, м), 4.40 (2H, д, J = 5.7 Гц), 5.99 (2H, с), 6.83 (1H, дд, J = 7.9, 1.5 Гц), 6.87 (1H, д, J = 7.9 Гц), 6.95 (1H, д, J = 1.5 Гц), 7.93 (1H, дд, J = 8.8, 2.0 Гц), 8.26 (1H, д, J = 2.0 Гц), 8.60 (1H, д, J = 8.8 Гц), 9.40 (1H, т, J = 5.7 Гц), 11.61 (1H, с), 12.09 (1H, с).
Пример 129
5-Бром-2-[(транс-4-карбоксициклогексанкарбонил)амино] -4- метокси-N-(3,4-метилендиоксибензил)бензамид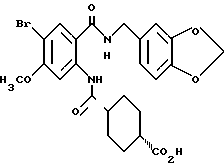
Указанное в заголовке соединение получали, как в Примере 110, в виде белых игл с выходом 26%.
Т.пл. 245-249oC.
Масс: 533 (MH+).
+H-ЯМР (400 МГц, ДMCO-d6) δ:
1.32 - 1.50 (4H, м), 1.90 - 2.18 (1H, м), 2.26 (1H, м), 3.87 (3H, с), 4.37 (2H, д, J = 5.7 Гц), 5.99 (2H, с), 6.80 (1H, дд, J = 7.9, 1.6 Гц), 6.86 (1H, д, J = 7.9 Гц), 6.91 (1H, д, J = 1.6 Гц), 8.10 (1H, с), 8.42 (1H, с), 9.21 (1H, т, J = 5.7 Гц), 11.96 (1H, с), 12.01 (1H, с).
Пример 130
5-Хлор-2-(2,5-диметоксибензамидо)-N-(3,4- метилендиоксибензил)бензамид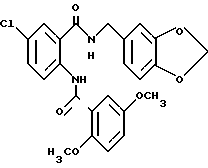
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 56%.
Масс: 469 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ:
3.84 (3H, с), 4.04 (3H, с), 4.52 (2H, д, J = 5.7 Гц), 5.94 (2H, с), 6.34 (1H, т, J = 5.7 Гц), 6.73 - 6.84 (3H, м), 6.95 (1H, д, J = 9.0 Гц), 7.06 (1H, дд, J = 3.1, 9.0 Гц), 7.38 - 7.44 (2H, м), 7.77 (1H, д, J = 3.1 Гц), 11.71 (1H, с).
Пример 131
4-Амино-5-бром-2-[(изоникотиноил)амино] -N-(3,4- метилендиоксибензил)бензамид
Указанное в заголовке соединение получали, как в Примере 34, в виде светло-коричневых кристаллов с выходом 78%.
1H-ЯМР (400, ДМСО-d6) δ:
4.38 (2H, д, J = 5.7 Гц), 5.98 (2H, с), 6.19 (2H, ш с), 6.80 (1H, дд, J = 1.6, 7.9 Гц), 6.86 (1H, д, J = 7.9 Гц), 6.91 (1H, д, J = 1.6 Гц), 7.80 (2H, д, J = 5.9 Гц), 8.05 (1H, с), 8.22 (1H, с), 8.84 (2H, д, J = 5.9 Гц), 9.10 (1H, т, J = 5.7 Гц), 13.35 (1H, с).
Пример 132
4-Амино-5-бром-2-[(4-трет-бутилбензолсульфонил)амино] - N-(3,4-метилендиоксибензил)бензамид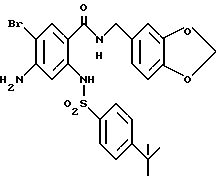
Указанное в заголовке соединение получали, как в Примере 34, в виде белого кристаллического порошка с выходом 79%.
Т.пл. 234-235oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.25 (9H, с), 4.28 (2H, д, J = 5.8 Гц), 6.00 (2H, ш с), 6.78 (1H, дд, J = 1.6, 8.1 Гц), 6.87 (1H, д, J = 1.6 Гц), 6.88 (1H, д, J = 8.1 Гц), 7.00 (1H, с), 7.49 - 7.54 (2H, м), 7.66 - 7.71 (2H, м), 7.86 (1H, с), 8.97 (1H, т, J = 5.8 Гц), 12.68 (1H, с).
Пример 133
4-Аминo-5-бpoм-2-(мeтaнcульфoнил)aминo-N-(3,4- мeтилeндиoкcи бензил)бензамид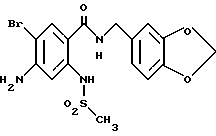
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 41%.
Т.пл. 178-180oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
3.08 (3H, с), 3.83 (3H, с), 4.33 (2H, д, J = 5.7 Гц), 6.17 (2H, ш с), 6.94 (1H, с), 7.11 (1H, д, J = 8.6 Гц), 7.25 (1H, дд, J = 2.0, 8.6 Гц), 7.36 (1H, д, J = 2.0 Гц), 8.00 (1H, с), 9.07 (1H, т, J = 5.7 Гц), 11.80 (1H, с).
Пример 134
5-Бpoм-2-бeнзoлcульфoнилaмидo-N-(3,4-мeтилeндиoкcибeнзил)- бeнзамид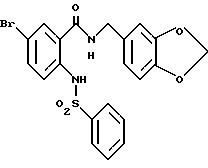
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 69%.
Т.пл. 172-173oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
4.31 (2H, д, J = 5.9 Гц), 6.77 (1H, дд, J = 1.6 Гц, 7.9 Гц), 6.87 (1H, д, J = 1.6 Гц), 6.89 (1H, д, J = 7.9 Гц), 7.45 - 7.55 (3H, м), 7.60 - 7.74 (4H, м), 9.33 (1H, м), 11.56 (1H, с).
Пример 135
N-(3-Хлор-4-метоксибензил)-5-циано-2-[[(S)-5- оксо-2-тетрагидрофуранкарбонил]амино]бензамид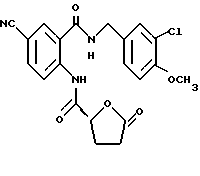
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 24%.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
2.23 - 2.35 (1H, м), 2.52 - 2.63 (3H, м), 3.84 (3H, с), 4.43 (2H, д, J = 5.7 Гц), 5.12 - 5.17 (1H, м), 7.12 (1H, д, J = 8.6 Гц), 7.32 (1H, дд, J = 8.0, 2.4 Гц), 7.43 (1H, д, J = 2.4 Гц), 8.00 (1H, дд, J = 1.6, 8.9 Гц), 8.30 (1H, д, J = 1.6 Гц), 8.60 (1H, д, J = 8.9 Гц), 9.41 (1H, т, J = 5.7 Гц), 12.02 (1H, с).
Пример 136
N-(3-Хлор-4-метоксибензил)-5-циано-2-[((R)-5- оксо-2-тетрагидрофуранкарбонил)амино]бензамид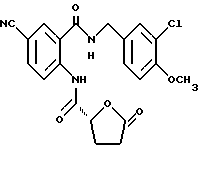
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 42%.
Т.пл. 231-232oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
2.23 - 2.35 (1H, м), 2.52 - 2.63 (3H, м), 3.84 (3H, с), 4.43 (2H, д, J = 5.7 Гц), 5.12 - 5.17 (1H, м), 7.12 (1H, д, J = 8.6 Гц), 7.32 (1H, дд, J = 8.0, 2.4 Гц), 7.43 (1H, д, J = 2.4 Гц), 8.00 (1H, дд, J = 1.6, 8.9 Гц), 8.30 (1H, д, J = 1.6 Гц), 8.60 (1H, д, J = 8.9 Гц), 8.30 (1H, д, J = 1.6 Гц), 8.60 (1H, д, J = 8.9 Гц), 9.41 (1H, т, J = 5.7 Гц), 12.02 (1H, с).
Пример 137
4-Амино-5-бром-2-[[транс-4-(этоксикарбонил)циклогексанкарбонил] aмино]-N-(3,4-метилендиоксибензил)бензамид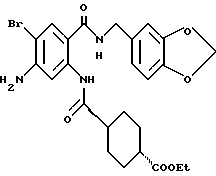
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 59%.
1H-ЯМР (400 МГц, CDCl3) δ:
1.26 (3H, т, J = 7.1 Гц), 1.44 - 1.64 (4H, м), 2.06 - 2.14 (4H, м), 2.25 - 2.36 (2H, м), 4.13 (2H, к, J = 7.1 Гц), 4.42 - 4.49 (4H, м), 5.97 (2H, с), 6.30 (1H, т, J = 5.5 Гц), 5.97 (2H, с), 6.83 (1H, с); 7.49 (1H, с), 8.20 (1H, с), 11.57 (1H, с).
Пример 138
4-Амино-5-бром-N-(3-хлор-4-метоксибензил)-2- [[транс-4-(этоксикарбонил)циклогексанкарбонил]амино]бензамид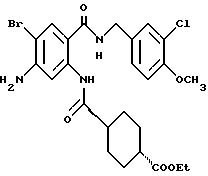
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 67%.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.26 (3H, т, J = 7.1 Гц), 1.42 - 1.64 (4H, м), 2.24 - 2.37 (2H, м), 3.91 (3H, с), 4.13 (2H, к, J = 7.1 Гц), 4.46 (2H, ш с), 4.49 (2H, д, J = 5.6 Гц), 6.30 (1H, т, J = 5.6 Гц), 6.92 (1H, д, J = 8.4 Гц), 7.20 (1H, дд, J = 2.2, 8.4 Гц), 7.37 (1H, д, J = 2.2 Гц), 7.49 (1H, с), 8.21 (1H, с), 11.54 (1H, с).
Пример 139
4-Аминo-5-бpoм-2-[(тpaнc-4-кapбoкcициклoгeкcaнкapбoнил)- aмино] -N-(3,4-метилендиоксибензил]бензамид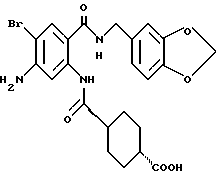
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 75%.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.30 - 1.47 (4H, м), 1.90 - 1.99 (4H, м), 2.13 - 2.24 (2H, м), 4.33 (2H, д, J = 5.6 Гц), 5.98 (2H, с), 6.00 (2H, ш с), 6.77 (1H, дд, J = 1.6, 8.1. Гц), 6.88 (1H, д, J = 1.6 Гц), 7.90 (1H, с), 8.04 (1H, с), 8.95 (1H, т, J - 4.0 Гц), 11.93 (1H, с).
Пример 140
4-Амино-5-бром-2-[(транс-4-карбоксициклогексанкарбонил) амино] -N-(3-хлор-4-метоксибензил)бензамид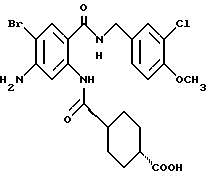
Указанное в заголовке соединение получали, как в Примере 34, в виде белых кристаллов с выходом 64%.
Т.пл. 274-276oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.30 - 1.47 (4H, м), 1.90 - 1.98 (4H, м), 2.12 -2.23 (2H, м), 3.83 (3H, с), 4.35 (2H, д, J = 5.6 Гц), 6.01 (2H, ш с), 7.11 (1H, д, J = 8.6 Гц), 7.25 (1H, дд, J = 8.6, 2.2 Гц), 7.36 (1H, д, J = 2.2 Гц), 7.90 (1H, с), 8.03 (1H, с), 8.98 (1H, т, J = 5.4 Гц), 11.89 (1H, с).
Пример 141
2-[[(R)-4-Карбамоил-2-гидроксибутирил] амино] -N- (3-хлор-4-метоксибензил)-5-цианобензамид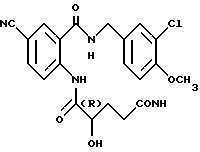
N-(3-Хлор-4-метоксибензил)-5-циано-2-[[(R)-5-оксо-2- тетрагидрофуранкарбонил] амино] бензамид (500 мг) растворяли в 2.5 мл 1,4-диоксана и добавляли 2.5 мл концентрированного водного аммиака. Смесь кипятили с обратным холодильником и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (растворитель: этилацетат) и получали 150 мг указанного в заголовке соединения в виде белых кристаллов, выход 29%.
Т.пл. 168-170oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
1.68 - 1.80 (1H, м), 1.95 - 2.05 (1H, м), 2.12 - 2.30 (2H, м), 3.84 (3H, с), 4.05 - 4.13 (1H, м), 4.40 - 4.47 (2H, м), 6.35 (1H, ш с), 6.79 (1H, ш с), 7.09 - 7.15 (1H, м), 7.29 - 7.42 (2H, м), 7.43 (1H, д, J = 2.0 Гц), 7.96 (1H, дд, J = 2.0, 8.8 Гц), 8.27 (1H, д, J = 2.0 Гц), 8.77 (1H, д, J = 8.8 Гц), 9.40 (1H, т, J = 5.7 Гц), 12.16 (1H, ш с).
Пример 142
2,4-Диамино-N-(3,4-метилендиоксибензил)бензамид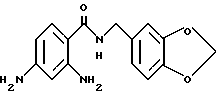
4-Hитроантраниловую кислоту (7.0 г), пиперониламин (6.42 г), N,N'-дициклoгeкcилкapбoдиимид (8.78 г) и 1-гидроксибензтриазол (5.75 г) добавляли в 500 мл ацетонитрила. Смесь нагревали 3 ч при 60oC, охлаждали и отфильтровывали образующиеся кристаллы. Фильтрат концентрировали и экстрагировали этилацетатом. Этилацетат удаляли и получали неочищенные кристаллы. К кристаллам добавляли этанол (50 мл), диметилформамид (50 мл) и оксид платины (50 мг). Полученную смесь подвергали каталитическому гидрированию при повышенном давлении в течение 2 ч при комнатной температуре. Катализатор отделяли фильтрованием и растворитель отгоняли. К остатку добавляли дихлорметан, чтобы провести кристаллизацию. Кристаллы отделяли фильтрованием, сушили и получали 4.63 г указанного в заголовке соединения в виде серых кристаллов, выход 42%.
Т.пл. 180-182oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
4.25 (2H, д, J = 6.0 Гц), 5.28 (2H, с), 5.76 - 5.80 (2H, м), 5.96 (2H, с), 6.39 (2H, с), 6.81 - 6.86 (2H, м), 7.28 (1H, д, J = 9.2 Гц), 8.21 (1H, т, J = 6.0 Гц).
Пример 143
5-Бром-2,4-диамино-N-(3,4-метилендиоксибензил)бензамид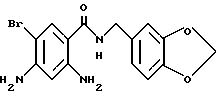
2,4-Диамино-N-(3,4-метилендиоксибензил)бензамид (6.47 г) суспендировали в 50 мл этанола и постепенно добавляли 3 мл 47% водной бромистоводородной кислоты. После завершения осаждения кристаллов растворитель полностью отгоняли в вакууме. К остатку добавляли диметилсульфоксид (30 мл), смесь нагревали при перемешивании и 150oC 1 ч и диметилсульфоксид отгоняли в вакууме. Остаток очищали колоночной хроматографией на силикагеле (растворитель: толуол/этилацетат (1:1)) и получали 1.80 г указанного в заголовке соединения в виде белых кристаллов, выход 22%.
Т.пл. 148-150oC.
1H-ЯМР (400 МГц, ДМСО-d6) δ:
4.25 (2H, д, J = 5.9 Гц), 5.45 (2Н, с), 5.97 (2Н, с), 6.02 (1H, с), 6.49 (2H, с), 6.74 (1H, дд, J = 1.6, 8.1 Гц), 6.82 - 6.86 (2H, м), 7.62 (1H, с), 8.44 (1H, т, J = 5.9 Гц).
Исследование заявленных соединений на острую токсичность
Соединение по примеру 43 вводят крысам в вену. Соединение, полученное по примеру 110 вводят крысам перорально. В случае соединения по примеру 43 не отмечено гибели крыс при введении соединения в дозе около 20 мг/кг или менее. В случае соединения по примеру 110 не отмечено гибели крыс при введении соединения в дозе около 600 мг/кг или менее.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЙ ПИРИДАЗИН ИЛИ ЕГО ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ЦИКЛИЧЕСКОЙ ГМФ- ФОСФОДИЭСТЕРАЗЫ | 1995 |
|
RU2128175C1 |
| ПРОИЗВОДНЫЕ ДИФЕНИЛА, ПРОИЗВОДНОЕ ФЕНИЛПИПЕРАЗИНА И СПОСОБ ЛЕЧЕНИЯ | 1995 |
|
RU2125051C1 |
| ПИРАЗОЛО [1, 5-А] ПИРИДИНЫ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2308457C2 |
| ГЕТЕРОЦИКЛО-ЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АМИНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ХОЛИНЭСТЕРАЗЫ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1992 |
|
RU2119920C1 |
| КОМБИНАЦИОННОЕ ЛЕКАРСТВО | 2003 |
|
RU2328280C2 |
| СОЕДИНЕНИЯ АЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2142947C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЯ | 2002 |
|
RU2358733C2 |
| ЦИКЛОГЕКСАНОВОЕ ПРОИЗВОДНОЕ, СПОСОБ РАССЛАБЛЕНИЯ ГЛАДКОЙ МЫШЦЫ МЛЕКОПИТАЮЩЕГО | 1994 |
|
RU2129113C1 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ АМИНОДИГИДРОТИАЗИНА | 2009 |
|
RU2476431C2 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТЫ | 1994 |
|
RU2127261C1 |

Изобретение относится к новым производным антраниловой кислоты общей формулы (1) или их фармакологически приемлемым солям, где R1, R2, R3 и R4 - одинаковые или различные и означают атом водорода, атом галогена, необязательно галогенированную низшую алкоксигруппу, нитро-, цианогруппу, пиразолильную группу, группу формулы (II), где R9 и R10 являются одинаковыми или различными и означают атом водорода, низшую алкильную группу и р является целым числом от 0 до 6, группу формулы (III), где R13 представляет атом водорода, низшую алкильную группу, q является целым числом от 0 до 2; и R2 может быть 1,2,4-триазолильной группой; R5 и R6 являются одинаковыми или различными и представляют атом водорода, атом галогена, цианогруппу, низшую алкоксигруппу, или R5 и R6 вместе с атомами углерода, к которым они присоединены, образуют оксолановое кольцо, 1,3-диоксолановое или 1,4-диоксановое кольцо; W представляет группу - N = или -СН=; R7 и R8 являются одинаковыми или различными и представляют атом водорода, низшую алкильную группу, или R1 и R7 , вместе с атомами углерода и азота соответственно, к которым они присоединены, образуют пиперидиновое или пирролидиновое кольцо, А представляет атом водорода, необязательно галогенированную низшую алкильную группу или группу формулы -Х-(СН2)m -Z, где Х представляет -СО-, -СН2- или -S(O)2-; Z представляет водород, галоген, фенильную группу, которая может быть замещена низшим алкилом, низшей алкоксигруппой, карбоксигруппой или низшей алкоксикарбонильной группой, пиридильную группу, группу формулы NR11R12, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют пиперидиновое или пирролидиновое кольцо, которое может быть замещено низшей алкильной группой, оксигруппой, карбоксигруппой, низшей алкоксикарбонильной группой, циклоалкильную группу, содержащую 3-8 атомов углерода, которая может быть замещена оксигруппой, цианогруппой, низшей алкилкарбонилоксигруппой, карбоксигруппой или низшей алкоксикарбонильной группой, пиперидильной группой, m является целым числом от 0 до 6, Y - атом кислорода; n - целое число от 0 до 6. Описывается также лекарственный препарат, проявляющий ингибирующую активность в отношении циклической гуанозинмонофосфатфосфодиэстеразы на базе соединения формулы (1). 5 с.п. ф-лы, 1 табл.
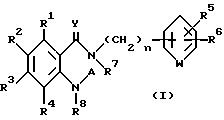
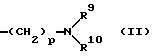
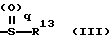
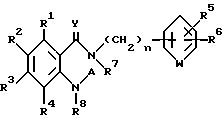
где R1, R2, R3 и R4 - одинаковые или различные и означают атом водорода, атом галогена, необязательно галогенированную низшую алкоксигруппу, нитро-, цианогруппу, пиразолильную группу, группу формулы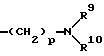
где R9 и R10 являются одинаковыми или различными и означают атом водорода, низшую алкильную группу Р является целым числом от 0 до 6,
группу формулы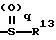
где R13 представляет атом водорода, низшую алкильную группу,
q является целым числом от 0 до 2;
и R2 может быть 1,2,4-триазолильной группой;
R5 и R6 являются одинаковыми или различными и представляют атом водорода, атом галогена, цианогруппу, низшую алкоксигруппу или R5 и R6 вместе с атомами углерода, к которым они присоединены, образуют оксолановое кольцо, 1,3-диоксолановое или 1,4-диоксановое кольцо;
W представляет группу - N = или -CH=;
R7 и R8 является одинаковыми или различными и представляют атом водорода, низшую алкильную группу,
или R1 и R7 вместе с атомами углерода и азота соответственно, к которым они присоединены, образуют пиперидиновое или пирролидиновое кольцо;
А представляет атом водорода, необязательно галогенированную низшую алкильную группу или группу формулы -X- (CH2)m-Z, где Х представляет -СО-, -СН2- или -S(O)2-;
Z представляет водород, галоген, фенильную группу, которая может быть замещена низшим алкилом, низшей алкоксигруппой, карбоксигруппой или низшей алкоксикарбонильной группой, пиридильную группу, группу формулы NR11R12, где R11 и R12, вместе с атомом азота, к которому они присоединены, образуют пиперидиновое или пирролидиновое кольцо, которое может быть замещено низшей алкильной группой, оксигруппой, карбоксигруппой, низшей алкоксикарбонильной группой, циклоалкильную группу, содержащую 3 - 8 атомов углерода, которая может быть замещена оксигруппой, цианогруппой, низшей алкилкарбонилокси группой, карбоксигруппой или низшей алкоксикарбонильной группой, пиперидильной группой;
m является целым числом от 0 до 6;
У представляет атом кислорода;
n является целым числом от 6 до 6.
где R1 - R4 - одинаковые или различные и означают атом водорода, атом галогена, цианогруппу, низшую алкоксигруппу, пиразолильную группу;
R2 может быть 1,2,4-триазолильной группой;
R14 представляет фенилалкил, замещенный низшей алкоксигруппой;
R15 представляет аминогруппу.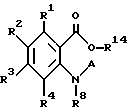
где R1 - R4 имеют значения, указанные в п.2 формулы;
R8 означает атом водорода;
А означает атом водорода, группу формулы -X- (CH2)m-Z, где Х представляет СО;
Z представляет группу формулы -NR11R12, в которой R11 и R12, вместе с атомом азота, к которому они присоединены, образуют пиперидиновое или пирролидиновое кольцо, возможно замещенное оксигруппой, карбоксигруппой или низшей алкоксикарбонильной группой;
m - целое число от 0 до 6.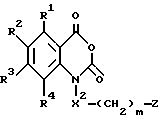
где R1 - R4 представляют атом водорода, атом галогена;
m является целым числом от 0 до 6;
Z представляет фенильную группу, замещенную низшей алкоксикарбонильной группой.
6 Приоритет по признакам:
27.12.93 - R1, R2, R3 или R4 являются одинаковыми или различными и представляют атом водорода, атом галогена, необязательно галогенированную низшую алкоксигруппу, нитрогруппу, цианогруппу, группу формулы -(CH2)p-NR9R10, триазолильную группу, пиразолильную группу, группу формулы -S-(O)q-R13 (где R13 представляет атом водорода или низшую алкильную группу и q является целым числом от 0 до 2);
R7 и R8 является одинаковыми или различными и представляют атом водорода или низшую алкильную группу,
W представляет группу формулы -СН=;
А представляет атом водорода, необязательно галогенированную низшую алкильную группу или группу формулы -X-(CH2)m-Z где Х представляет -СО- или -СН2-;
09.11.94 - R1, R2, R3 или R4 являются одинаковыми или различными и представляют атом водорода, атом галогена, необязательно галогенированную низшую алкоксигруппу, нитрогруппу, цианогруппу, группу формулы -(CH2)p-NR9R10, триазолильную группу, пиразолильную группу, группу формулы -S-(O)q-R13 (где R13 представляет атом водорода или низшую алкильную группу и q является целым числом от 0 до 2);
R7 и R8 является одинаковыми или различными и представляют атом водорода или низшую алкильную группу или R1 и R7 вместе с атомами углерода и азота, к которым они соответственно присоединены, образуют кольцо;
W представляет группу формулы - N = или -СН=;
А представляет атом водорода, необязательно галогенированную низшую алкильную группу или группу формулы -X-(CH2)m-Z, где Х представляет -СО-, -СН2- или -S(O)2-
| Способ крашения тканей | 1922 |
|
SU62A1 |
| УСТРОЙСТВО для МЕХАНИЗИРОВАННОЙ ЗАГРУЗКИ ШНУРОВ С ТАБАЧНЫМИ ЛИСТЬЯМИ В СУШИЛЬНЫЙ САРАЙ | 0 |
|
SU201188A1 |
| Б АВТОМАТИЧЕСКОГО УПРАВЛЕНИЯ ТРУБЧАТЫМ РЕАКТОРОМ СИНТЕЗА АММИАКА | 0 |
|
SU306869A1 |
| US 4029815 A, 18.11.76 | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1988, ч.I, с.439-441. | |||
Авторы
Даты
1999-04-10—Публикация
1994-12-27—Подача