Изобретение относится к новым замещенным пиримидиниламинобензамидам, способам их получения, содержащим их фармацевтическим композициям, применению их необязательно в комбинации с одним или несколькими другими фармацевтически активными соединениями для лечения заболевания, которое связано с ингибированием активности протеинкиназы, особенно опухолевого заболевания, в частности лейкемии, и способу лечения такого заболевания.
Уровень техники
Протеинкиназы (PK) являются ферментами, которые катализируют фосфорилирование специфических остатков серина, треонина или тирозина в клеточных белках. Эти посттрансляционные модификации субстратных белков действуют в качестве молекулярных выключателей, регулирующих клеточную пролиферацию, активацию и/или дифференциацию. Отклоненная от нормы или избыточная активность PK наблюдается для многих заболеваний, включая доброкачественные и злокачественные пролиферативные заболевания. В ряде случаев излечение заболеваний, таких как пролиферативные заболевания, возможно благодаря применению ингибиторов PK in vitro и in vivo.
Ввиду большого количества ингибиторов протеинкиназы и множества пролиферативных и других связанных с PK заболеваний все еще существует необходимость получения новых классов соединений, которые будут полезны в качестве ингибиторов PK и, следовательно, для лечения этих связанных с PTK заболеваний. Это обеспечивается новыми классами фармацевтически полезных ингибирующих PK соединений.
Филадельфийская хромосома является признаком хронической миелогенной лейкемии (CML) и несет гибридный ген, который содержит N-терминальные экзоны bcr гена и главную С-терминальную часть (экзоны 2-11) с-abl гена. Продуктом гена является белок 210 кДа (р210 Bcr-Abl). Abl-часть белка Bcr-Abl содержит abl-тирозинкиназу, которая сильно регулируется с-abl дикого типа, но изначально активируется в слитом белке Bcr-Abl. Эта нерегулируемая тирозинкиназа взаимодействует с многочисленными клеточными сигналами, приводя к трансформации и нарушению регулирования пролиферации клеток (Lugo и др., Science 247, 1079 [1990]).
Общее описание изобретения
Было обнаружено, что различные соединения класса пиримидиниламинобензамидов проявляют ингибирование активности протеинкиназы. Соединения формулы I, описанные далее более подробно, особенно проявляют ингибирование одной или нескольких тирозинкиназ, таких как с-Abl, Bcr-Abl, рецептора тирозинкиназ PDGF-RFlt3, VEGF-R, EGF-R и с-Kit, а также комбинаций двух или нескольких из них; в случае новых пиримидиниламинобензамидов в соответствии с изобретением соединения подходят для ингибирования этих и/или других протеинкиназ, особенно протеинкиназ, упомянутых выше, и/или для ингибирования мутантов этих ферментов, особенно Bcr-Abl, например мутанта Glu255 -> валин. Благодаря этой активности соединения могут использоваться для лечения заболеваний, связанных особенно с отклоненной от нормы или избыточной активностью таких типов киназ, особенно упомянутых выше.
Подробное описание изобретения
Изобретение относится к соединению формулы I
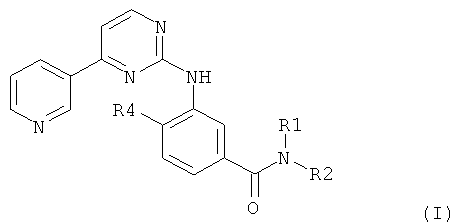
где
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил, ацилокси-низший алкил, карбокси-низший алкил, низший алкоксикарбонил-низший алкил или фенил-низший алкил;
R2 представляет собой водород, низший алкил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами R3, циклоалкил, бензциклоалкил, гетероциклил, арильную группу или моно- или бициклическую гетероарильную группу, включающую ноль, один, два или три кольцевых атома азота и ноль или один атом кислорода и ноль или один атом серы, где группы в каждом случае являются незамещенными или моно- или полизамещенными;
и R3 представляет собой гидрокси, низший алкокси, ацилокси, карбокси, низший алкоксикарбонил, карбамоил, N-моно- или N,N-дизамещенный карбамоил, амино, моно- или дизамещенный амино, циклоалкил, гетероциклил, арильную группу или моно- или бициклическую гетероарильную группу, включающую ноль, один, два или три кольцевых атома азота и ноль или один атом кислорода и ноль или один атом серы, где группы в каждом случае являются незамещенными или моно- или полизамещенными;
или где R1 и R2 вместе представляют собой алкилен с четырьмя, пятью или шестью атомами углерода, необязательно моно- или дизамещенный низшим алкилом, циклоалкилом, гетероциклилом, фенилом, гидрокси, низшим алкокси, амино, моно- или дизамещенным амино, оксо, пиридилом, пиразинилом или пиримидинилом; бензалкилен с четырьмя или пятью атомами углерода; оксаалкилен с одним атомом кислорода и тремя или четырьмя атомами углерода; или азаалкилен с одним атомом азота и тремя или четырьмя атомами углерода, где атом азота является незамещенным или замещен низшим алкилом, фенил-низшим алкилом, низший алкоксикарбонил-низшим алкилом, карбокси-низшим алкилом, карбамоил-низшим алкилом, N-моно- или N,N-дизамещенный карбамоил-низшим алкилом, циклоалкилом, низшим алкоксикарбонилом, карбокси, фенилом, замещенным фенилом, пиридинилом, пиримидинилом или пиразинилом;
R4 представляет собой водород, низший алкил или галоген;
и N-оксид или фармацевтически приемлемая соль такого соединения.
Используемые здесь и далее общие термины в контексте данного описания имеют, предпочтительно, следующие значения, если не указано иное.
Термин "низший" обозначает радикал, имеющий включительно до 7, особенно включительно до 4 атомов углерода, эти радикалы являются линейными или разветвленными с одним или несколькими ветвлениями.
При использовании множественной формы соединения, соли и т.д. она обозначает также форму единственного числа соединение, соль или им подобные.
Любые асимметричные атомы углерода могут присутствовать в (R)-, (S)- или (R,S)-конфигурации, предпочтительно в (R)- или (S)-конфигурации. Соединения могут такими образом присутствовать в виде смеси изомеров или в виде чистых изомеров, предпочтительно в виде энантиомерно чистых диастереомеров.
Изобретение также относится к возможным таутомерам соединений формулы I.
Низший алкил предпочтительно представляет собой алкил с 1-7 включительно, предпочтительно с 1-4 включительно атомами углерода, и является линейным или разветвленным; предпочтительно, низший алкил представляет собой бутил, такой как н-бутил, втор-бутил, изобутил, трет-бутил, пропил, такой как н-пропил или изопропил, этил или метил. Предпочтительно низший алкил представляет собой метил, пропил или трет-бутил.
Низший ацил предпочтительно представляет собой формил или низший алкилкарбонил, в частности ацетил.
Арильная группа представляет собой ароматический радикал, который присоединяется к молекуле через связь с атомом углерода ароматического кольца этого радикала. В предпочтительном варианте осуществления арил представляет собой ароматический радикал, имеющий 6-14 атомов углерода, особенно фенил, нафтил, тетрагидронафтил, флуоренил или фенантренил, и является незамещенным или замещенным одним или несколькими, предпочтительно до трех, особенно одним или двумя заместителями, особенно выбранными из амино, моно- или дизамещенного амино, галогена, низшего алкила, замещенного низшего алкила, низшего алкенила, низшего алкинила, фенила, гидрокси, этерифицированного гидрокси, нитро, циано, карбокси, этерифицированного или эстерифицированного карбокси, алканоила, бензоила, карбамоила, N-моно- или N,N-дизамещенного карбамоила, амидино, гуанидино, уреидо, меркапто, сульфо, низшего алкилтио, фенилтио, фенил-низшего алкилтио, низшего алкилфенилтио, низшего алкилсульфинила, фенилсульфинила, фенил-низшего алкилсульфинила, низшего алкилфенилсульфинила, низшего алкилсульфонила, фенилсульфонила, фенил-низшего алкилсульфонила, низшего алкилфенилсульфонила, галоген-низшего алкилмеркапто, галоген-низшего алкилсульфонила, такого как особенно трифторметансульфонила, дигидроксибора (-В(ОН)2), гетероциклила и низший алкилен-диоксисвязанного на соседних С-атомах кольца, такого как метилендиокси. Арил наиболее предпочтительно представляет собой фенил, нафтил или тетрагидронафтил, которые в каждом случае являются незамещенными или независимо замещены одним или двумя заместителями, выбранными из группы, включающей галоген, особенно фтор, хлор или бром; гидрокси; гидрокси, этерифицированный низшим алкилом, например метилом, галоген-низшим алкилом, например трифторметилом, или фенилом; низший алкилен-диоксисвязанный с двумя соседними С-атомами, например метилендиокси, низший алкил, например метил или пропил; галоген-низший алкил, например трифторметил; гидрокси-низший алкил, например гидроксиметил или 2-гидрокси-2-пропил; низший алкокси-низший алкил; например метоксиметил или 2-метоксиэтил; низший алкоксикарбонил-низший алкил, например метоксикарбонилметил; низший алкинил, такой как 1-пропинил; этерифицированный карбокси, особенно низший алкоксикарбонил, например метоксикарбонил, н-пропоксикарбонил или изопропоксикарбонил; N-моно-замещенный карбамоил, в частности карбамоил, монозамещенный низшим алкилом, например метил, н-пропил или изопропил; амино; низший алкиламино, например метиламино; динизший алкиламино, например диметиламино или диэтиламино; низший алкилен-амино, например пирролидино или пиперидино; низший оксаалкилен-амино, например морфолино, низший азаалкилен-амино, например пиперазино, ациламино, например ацетиламино или бензоиламино; низший алкилсульфонил, например метилсульфонил; сульфамоил; или фенилсульфонил.
Циклоалкильная группа предпочтительно представляет собой циклопропил, циклопентил, циклогексил или циклогептил и может быть незамещенной или замещенной одним или несколькими, особенно одним или двумя заместителями, выбранными из определенной выше группы для заместителей арила, наиболее предпочтительно низшим алкилом, таким как метил, низшим алкокси, таким как метокси или этокси, или гидрокси, а также оксо, или конденсирована с бензольным кольцом, так как в бензциклопентиле или бензциклогексиле.
Замещенный алкил представляет собой алкил, как определено выше, особенно низший алкил, предпочтительно метил; где может присутствовать один или несколько, особенно до трех, заместителей из группы, выбранной из галогена, особенно фтора, амино, N-низшего алкиламино, N,N-динизшего алкиламино, N-низшего алканоиламино, гидрокси, циано, карбокси, низшего алкоксикарбонила и фенил-низшего алкоксикарбонила. Трифторметил является особенно предпочтительным.
Моно- или дизамещенный амино особенно представляет собой амино, замещенный одним или двумя радикалами, независимо выбранными из низшего алкила, такого как метил; гидрокси-низшего алкила, такого как 2-гидроксиэтил; фенил-низшего алкила, такого как бензил или 2-фенилэтил; низшего алканоила, такого как ацетил; бензоила; замещенного бензоила, где фенильный радикал является, в частности, замещенным одним или несколькими, предпочтительно одним или двумя заместителями, выбранными из нитро, амино, галогена, N-низшего алкиламино, N,N-динизшего алкиламино, гидрокси, циано, карбокси, низшего алкоксикарбонила, низшего алканоила и карбамоила; и фенил-низшего алкоксикарбонила, где фенильный радикал является незамещенным или особенно замещен одним или несколькими, предпочтительно одним или двумя заместителями, выбранными из нитро, амино, галогена, N-низшего алкиламино, N,N-динизшего алкиламино, гидрокси, циано, карбокси, низшего алкоксикарбонила, низшего алканоила и карбамоила; и, предпочтительно, представляет собой N-низший алкиламино, такой как N-метиламино, гидрокси-низший алкиламино, такой как 2-гидроксиэтиламино, фенил-низший алкиламино, такой как бензиламино, N,N-динизший алкиламино, N-фенил-низший алкил-N-низший алкиламино, N,N-динизший алкилфениламино, низший алканоиламино, такой как ацетиламино, или заместитель, выбранный из группы, включающей бензоиламино и фенил-низший алкоксикарбониламино, где фенильный радикал в каждом случае является незамещенным или особенно замещенным нитро или амино, или также галогеном, амино, N-низшим алкиламино, N,N-динизшим алкиламино, гидрокси, циано, карбокси, низшим алкоксикарбонилом, низшим алканоилом, карбамоилом или аминокарбониламино. Дизамещенный амино также представляет собой низший алкилен-амино, например пирролидино, 2-оксопирролидино или пиперидино; низший оксаалкиленамино, например морфолино, или низший азаалкиленамино, например пиперазино или N-замещенный пиперазино, такой как N-метилпиперазино или N-метоксикарбонилпиперазино.
Галоген представляет собой особенно фтор, хлор, бром, или йод, особенно фтор, хлор или бром.
Этерифицированный гидрокси представляет собой особенно C8-С20алкилокси, такой как н-децилокси, низший алкокси (предпочтительно), такой как метокси, этокси, изопропилокси или трет-бутилокси, фенил-низший алкокси, такой как бензилокси, фенилокси, или галоген-низший алкокси, такой как трифторметокси, 2,2,2-трифторэтокси или 1,1,2,2-тетрафторэтокси.
Эстерифицированный гидрокси представляет собой особенно низший алканоилокси, бензоилокси, низший алкоксикарбонилокси, такой как трет-бутоксикарбонилокси или фенил-низший алкоксикарбонилокси, такой как бензилоксикарбонилокси.
Эстерифицированный карбокси представляет собой особенно низший алкоксикарбонил, такой как трет-бутоксикарбонил, изопропоксикарбонил, метоксикарбонил или этоксикарбонил, фенил-низший алкоксикарбонил или фенилоксикарбонил.
Алканоил представляет собой прежде всего алкилкарбонил, особенно низший алканоил, например ацетил.
N-Моно- или N,N-дизамещенный карбамоил особенно замещен одним или двумя заместителями, независимо выбранными из низшего алкила, фенил-низшего алкила и гидрокси-низшего алкила, или низшего алкилена, окса-низшего алкилена или аза-низшего алкилена, необязательно замещенного на конечном атоме азота.
Моно- или бициклическая гетероарильная группа, включающая ноль, один, два или три атома азота в кольце и ноль или один атом кислорода и ноль или один атом серы, где группы в каждом случае являются незамещенными или моно- или полизамещенными, обозначает гетероциклическую группу, которая является ненасыщенной в кольце, связывающем гетероарильный радикал с остатком молекулы формулы I, и предпочтительно представляет собой кольцо, в связывающем кольце, но необязательно также в любом нелинейном кольце, по крайней мере один атом углерода замещен гетероатомом, выбранным из группы, состоящей из азота, кислорода и серы; где связывающее кольцо предпочтительно имеет 5-12, наиболее предпочтительно 5 или 6 атомов в кольце; и которое может быть незамещенным или замещенным одним или несколькими, особенно одним или двумя заместителями, выбранными из группы, определенной выше для заместителей арила, наиболее предпочтительно низшим алкилом, таким как метил, низшим алкокси, таким как метокси или этокси, или гидрокси. Предпочтительно моно- или бициклическая гетероарильная группа выбрана из 2Н-пирролила, пирролила, имидазолила, бензимидазолила, пиразолила, индазолила, пуринила, пиридила, пиразинила, пиримидинила, пиридазинила, 4Н-хинолизинила, изохинолила, хинолила, фталазинила, нафтиридинила, хиноксалила, хиназолинила, хиннолинила, птеридинила, индолизинила, 3Н-индолила, индолила, изоиндолила, оксазолила, изоксазолила, тиазолила, изотиазолила, триазолила, тетразолила, фуразанила, бензо[d]пиразолила, тиенила и фуранила. Наиболее предпочтительно моно- или бициклическая гетероарильная группа выбрана из группы, состоящей из пирролила, имидазолила, такого как 1Н-имидазол-1-ил, бензимидазолила, такого как 1-бензимидазолил, индазолила, особенно 5-индазолила, пиридила, особенно 2-, 3- или 4-пиридила, пиримидинила, особенно 2-пиримидинила, пиразинила, изохинолинила, особенно 3-изохинолинила, хинолинила, особенно 4- или 8-хинолинила, индолила, особенно 3-индолила, тиазолила, бензо[d]пиразолила, тиенила и фуранила. В одном предпочтительном варианте осуществления изобретения пиридильный радикал замещен гидрокси в орто-положении к атому азота и, следовательно, существует, по крайней мере частично, в форме соответствующего таутомера, который представляет собой пиридин-(1Н)2-он. В другом предпочтительном варианте осуществления пиримидинильный радикал замещен гидрокси в положениях 2 и 4 и, следовательно, существует в нескольких таутомерных формах, например в виде пиримидин-(1Н,3Н)2,4-диона.
Гетероциклил представляет собой особенно пяти-, шести- или семичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот, кислород и серу, которая может быть ненасыщенной или полностью или частично насыщенной, и является незамещенной или замещенной особенно низшим алкилом, таким как метил, фенил-низшим алкилом, таким как бензил, оксо или гетероарилом, таким как 2-пиперазинил; гетероциклил представляет собой особенно 2- или 3-пирролидинил, 2-оксо-5-пирролидинил, 4-пиперидинил, N-бензил-4-пиперидинил, 2- или 3-морфолинил, 2-оксо-1Н-азепин-3-ил, 2-тетрагидрофуранил или 2-метил-1,3-диоксолан-2-ил.
Соли представляют собой особенно фармацевтически приемлемые соли соединений формулы I.
Такие соли получают, например, в виде кислотных аддитивных солей, предпочтительно с органическими или неорганическими кислотами, из соединений формулы I с основным атомом азота, особенно фармацевтически приемлемых солей. Подходящими неорганическими кислотами являются, например, галогенсодержащие кислоты, такие как соляная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновые, фосфорные, сульфоновые или сульфамовые кислоты, например уксусная кислота, пропановая кислота, октановая кислота, декановая кислота, додекановая кислота, гликолевая кислота, молочная кислота, фумаровая кислота, янтарная кислота, адипиновая кислота, пимелиновая кислота, субериновая кислота, азелаиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, салициловая кислота, 4-аминосалициловая кислота, фталиевая кислота, фенилуксусная кислота, миндальная кислота, коричная кислота, метан- или этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталенсульфоновая кислота, 1,5-нафталендисульфоновая кислота, 2-, 3- или 4-метилбензолсульфоновая кислота, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфамовая кислота, N-метил-, N-этил- или N-пропилсульфамовая кислота или другие органические протонные кислоты, такие как аскорбиновая кислота.
В присутствии отрицательно заряженных радикалов, таких как карбокси или сульфо, соли могут также получаться с основаниями, например соли с металлом или аммонием, такие как соли с щелочным металлом или щелочноземельным металлом, например соли с натрием, калием, магнием или кальцием, или аммониевые соли с аммонием или подходящими органическими аминами, такими как третичные моноамины, например триэтиламин или три(2-гидроксиэтил)амин, или гетероциклическими основаниями, например N-этилпиперидин или N,N'-диметилпиперазин.
Когда в одной молекуле присутствует и основная группа, и кислотная группа, соединение формулы I может также образовывать внутренние соли.
Для выделения или очистки также возможно применение фармацевтически неприемлемых солей, например пикратов или перхлоратов. Для терапевтического применения используются только фармацевтически приемлемые соли или свободные соединения (где приемлемо - в форме фармацевтических составов), и они являются, следовательно, предпочтительными.
Благодаря близости новых соединений в свободной форме и соединений в форме их солей, включая соли, которые могут использоваться в качестве промежуточных соединений, например, при очистке или идентификации новых соединений, любое указание на соединения в свободной форме здесь и далее должно пониматься как указание также соответствующих солей, где это подходит и является целесообразным.
Соединения формулы I и их N-оксиды имеют ценные фармакологические свойства, как описано здесь и далее.
Эффективность соединений по изобретению в качестве ингибиторов активности с-Abl, Bcr-Abl и VEGF-рецепторов тирозинкиназы может быть определена следующим образом.
Тест на активность по отношению к с-Abl протеинтирозинкиназе. Тест проводили как испытание на связывание следующим образом: His-меченый домен киназы с-Abl клонировали и экспрессировали в системе бакуловирус/Sf9, как описано у Bhat и др., J Biol Chem. 272, 16170-5 (1997). Белок 37 кДа (с-Abl киназа) очищали двухстадийным способом на колонке с хелатом кобальта и затем на анионообменной колонке с выходом 1-2 мг/л Sf9 клеток. Чистота с-Abl киназы составляла >90%, что определено SDS-PAGE после подкрашивания кумачовым синим. Испытание содержит: с-Abl киназу (50 нг), 20 мМ Tris-HCl, рН 7,5, 10 мМ MgCl2, 10 мкМ Na3VO4, 1 мМ DTT и 0,06 мк Ci/испытание [γ33 Р]-АТФ (5 мкМ АТФ) с 30 мкг/мл поли-Ala,Glu,Lys,Tyr - 6:2:5:1 (Poly-AEKY, Sigma P1152) в присутствии 1% ДМСО, общий объем 30 мкл. Реакции останавливали добавлением 10 мкл 250 мМ EDTA и 30 мкл реакционной смеси переносили на мембрану Immobilon-PVDF (Millipore, Bedford, MA, USA), предварительно пропитанную в течение 5 мин метанолом, промытую водой, затем пропитанную в течение 5 мин 0,5% H3PO4 и установленную на вакуумном коллекторе с неподсоединенным источником вакуума. После определения всех образцов подсоединяли вакуум и каждую ячейку промывали 200 мкл 0,5% H3PO4. Мембраны удаляли и промывали на мешалке 0,5% H3PO4 (4 раза) и один раз этанолом. Количественное определение мембран проводили после высушивания при температуре окружающей среды, устанавливая в Packard TopCount 96-ячеечную рамку и добавляя 10 мкл/ячейку Microscint TM (Packard).
Тест на активность в отношении Bcr-Abl. Мышечную миелоидную прародительскую клеточную линию 32Dcl3, трансфецированную с вектором экспрессии р210 Bcr-Abl pGDp210Bcr/Abl (32D-bcr/abl), получали от J. Griffin (Dana Faber Cancer Institue, Bosten, MA, USA). Клетки экспрессировали слитой белок Bcr-Abl с изначально активной abl киназой и пролиферировали независимо фактор роста. Клетки расширяли в RPMI 1640 (AMIMED), 10% эмбриональной телячьей сыворотке, 2 мМ глутамина (Gibco) («полная среда») и рабочий запас готовили замораживанием аликвотных количеств 2×106 клеток на сосуд в замораживающейся среде (95% FCS, 5% ДМСО (SIGMA)). После оттаивания клетки использовали в течение максимально 10-12 раз в экспериментах.
Для клеточных испытаний соединения растворяли в ДМСО и разбавляли полной средой до получения исходной концентрации 10 мкМ с последующим получением 3-кратных серийных разбавлений в полной среде. 200'000 32D-Bcr/Abl клетки в 50 мкл полной среды высаживали в ячейки в 96-ячеечные круглодонные подложки для культуры ткани. К клеткам добавляли трижды 50 мкл на ячейку 3-кратных серийных разбавлений тестируемого соединения. Необработанные клетки использовались в качестве контроля. Соединение инкубировали вместе с клетками в течение 90 мин при 37°С, 5% СО2, с последующим центрифугированием подложек культуры ткани при 1300 об/мин (центрифуга Beckmann GPR) и удалением супернатантов тщательным продуванием, чтобы не удалить разрушенные клетки. Остатки клеток подвергали лизису добавлением 150 мкл лизисного буфера (50 мМ Tris/HCl, pH 7,4, 150 мМ хлорида натрия, 5 мМ EDTA, 1 мМ EGTA, 1% NP-40, 2 мМ орто-ванадата натрия, 1 мМ PMSF, 50 мкг/мл апротинина и 80 мкг/мл леупептина) и немедленно использовали для ELISA или хранили замороженными в подложках при -20°С до применения. Черные подложки ELISA (черные подложки Packard HTRF-96) предварительно обрабатывали в течение ночи при 4°С 50 нг/ячейка поликлональным анти-abl-SH3 доменом Ab 06-466 кролика от Upstate в 50 мкл PBS. После промывки 3 раза 200 мкл/ячейка PBS, содержащим 0,05% Tween20 (PBST) и 0,5% TopBlock (Juro), оставшиеся сайты связывания белка блокировали 200 мкл/ячейка PBST, 3% TopBlock в течение 4 ч при комнатной температуре с последующим инкубированием с 50 мкл лизатов необработанных или обработанных соединением клеток (20 мкг общего белка на ячейку) в течение 3-4 ч при 4°С. После 3 промывок добавляли 50 мкл/ячейка анти-фосфотирозина Ab PY20(AP), меченного щелочной фосфатазой (Zymed), разбавленного до 0,2 мкг/мл в блокирующем буфере, и инкубировали в течение ночи (4°С). Для всех стадий инкубирования подложки закрывали крышками (Costar). Наконец, подложки промывали еще три раза промывочным буфером и один раз деионизированной водой перед добавлением 90 мкл/ячейка АР-субстрата CDPStar RTU с Emerald II. Подложки, закрытые Packard TopSeal™ - крышками для подложек, инкубировали в течение 45 мин при комнатной температуре в темноте и определяли количество люминесценции измерением показателей в секунду (CPS) с помощью Packard Top Count Microplate Scintillation Counter (Top Count). Подсчитывали различие между ELISA-считыванием (CPS), полученным для лизата с необработанными 32D-Bcr/Abl клетками, и считыванием для испытания-основы (все компоненты, но без клеточного лизата) и принимали за 100% отражения изначально фосфорилированного белка Bcr-Abl, присутствующего в этих клетках. Активность соединения относительно Bcr-Abl киназы выражали в виде процентного отношения уменьшения фосфорилирования Bcr-Abl. Значения IC50 и IC90 определяли из кривых зависимости от дозы графическим экстраполированием.
Тест на активность в отношении VEGF-рецептора тирозинкиназы. Тест проводили с помощью Flt-1 VEGF-рецептора тирозинкиназы. Подробная методика является следующей: 30 мкл раствора киназы (10 нг домена киназы Flt-1, Shibuya и др., Oncogene 5, 519-24 [1990]) в 20 мМ Tris*HCl pH 7,5, 3 мМ дихлорида марганца (MnCl2), 3 мМ хлорида магния (MgCl2), 10 мкМ ванадата натрия, 0,25 мг/мл полиэтиленгликоля (PEG) 20000, 1 мМ дитиотреитола и 3 мкг/мл поли(Glu,Tyr) 4:1 (Sigma, Buchs, Switzerland), 8 мкМ [33Р]-АТФ (0,2 мкCi), 1% ДМСО и 0-100 мкМ тестируемого соединения инкубировали вместе в течение 10 минут при комнатной температуре. Реакцию затем останавливали добавлением 10 мкл 0,25 М этилендиаминтетраацетата (EDTA) pH 7. С помощью мультиканального распределительного устройства (LAB SYSTEMS, USA) аликвоту 20 мкл подавали на мембрану PVDF (= поливинилдифторид) Immobilon Р (Millipore, Bedford, USA), через микротитровальный складчатый фильтр Gibco-BRL и связанную с вакуумом. После полного разделения жидкости мембрану промывали 4 раза в бане, содержащей 0,5% фосфорную кислоту (H3PO4), и один раз этанолом, инкубировали в течение 10 минут каждый раз при встряхивании, затем устанавливали на Hewlett Packard TopCount Manifold и измеряли радиоактивность после добавления 10 мкл Microscint™ (жидкость для В-стинцилляционного счетчика). Определяли значения IC50 линейным регрессионным анализом процентного отношения для ингибирования каждого соединения по крайней мере в четырех концентрациях (как правило, 0,01, 0,1, 1,0 и 10 мкмоль). Значения IC50, которые могут быть обнаружены для соединений формулы I, находятся в пределах от 1 до 10'000 нМ, предпочтительно в области от 1 до 100 нМ.
Ингибирование вызванного VEGF автофосфорилирования KDR-рецептора может быть также подтверждено экспериментом in vitro на клетках: трансфицированные СНО клетки, которые постоянно экспрессируют рецептор VEGF человека (KDR), высаживали в полной культуральной среде с 10% эмбриональной телячьей сывороткой (FCS) в 6-ячеечные подложки для клеточной культуры и инкубировали при 37°С под 5% СО2 до 80% слияния. Затем тестируемые соединения разбавляли культуральной средой (без FCS, с 0,1% бычьим сывороточным альбумином) и добавляли к клеткам. (Контроли содержали среду без тестируемых соединений.) Через два часа инкубирования при 37°С добавляли рекомбинатный VEGF; конечная концентрация VEGF составляла 20 нг/мл. После следующих пяти минут инкубирования при 37°С клетки промывали два раза ледяным PBS (фосфатно-буферный соляный раствор) и немедленно подвергали лизису в 100 мкл лизисном буфере на ячейку. Лизаты затем центрифугировали для удаления ядер клеток и определяли концентрации белка супернатантов с помощью коммерческого анализа белка (BIORAD). Затем лизаты могут немедленно использоваться или, при необходимости, храниться при -20°С.
Сэндвич ELISA проводили для измерения фосфорилирования рецептора KDR: моноклональное антитело для KDR (например, Mab 1495,12,14) иммобилизировали на черных подложках ELISA (OptiPlate™ HTRF-96 от Packard). Подложки затем промывали и оставшиеся свободные сайты связывания белка насыщали 1% БСА в PBS. Лизаты клеток (20 мкг белка на ячейку) затем инкубировали на этих подложках в течение ночи при 4°С вместе с антифосфотирозиновым антителом, связанным с щелочной фосфатазой (PY20:AP от Transduction Laboratories). Подложки промывали опять и затем определяли связывание антифосфотирозинового антитела с захваченным фосфорилированным рецептором с помощью люминисцентного АР субстрата (CDP-Star, готовый к использованию, с Emerald II; TROPIX). Люминисценцию измеряли с помощью Packard Top Count Microplate Scintillation Counter (Top Count). Различие между сигналом положительного контроля (стимулируемого VEGF) и сигналом отрицательного контроля (не стимулируемого VEGF) соответствует вызванному VEGF фосфорилированию рецептора KDR (=100%). Активность тестируемых веществ рассчитывали как % ингибирования вызванного VEGF фосфорилирования рецептора KDR, где концентрация вещества, которая проявляет половину от максимального ингибирования, определяли как ED50 (эффективная доза для 50% ингибирования). Соединения формулы I предпочтительно проявляют значения ED50 в области от 0,25 нМ до 1000 нМ, предпочтительно от 0,25 до 250 нМ.
Соединение формулы I или его N-оксид ингибирует также в различной степени другие тирозинкиназы, вовлеченные в передачу сигналов, которые медиируются трофными факторами, например Bcr-Abl и Abl киназой, Arg, киназами из семейства Src, особенно c-Src киназой, Lck и Fyn; также киназами семейства EGF, например с-erbB2 киназой (HER-2), с-erbB3 киназой, с-erbB4 киназой; киназой рецептора инсулиноподобного фактора роста (IGF-1 киназа), особенно членами семейства тирозинкиназ PDGF-рецептора, такими как киназа PDGF-рецептора, киназа CSF-1-рецептора, киназа Kit-рецептора и киназа VEGF-рецептора; а также серин/треониновыми киназами, каждая из которых играет роль в регулировании роста и трансформации клеток млекопитающего, включая клетки человека.
Ингибирование с-erbB2 тирозинкиназы (HER-2) может быть измерено, например, аналогично ингибированию EGF-R протеинкиназы, используя известные методики.
На основе этих исследований соединение формулы I в соответствии с изобретением проявляет терапевтическую эффективность особенно против заболеваний, зависимых от протеинкиназы, особенно пролиферативных заболеваний.
На основе их эффективности в качестве ингибиторов активности тирозинкиназы VEGF-рецептора соединения формулы I прежде всего ингибируют рост кровеносных сосудов и, таким образом, например, эффективны против множества заболеваний, связанных с нерегулируемым ангиогенезом, особенно заболеваний, вызванных глазной неоваскуляризацией, особенно ретинопатиями, такими как диабетическая ретинопатия или возрастные пятна, псориаз, гемангиобластома, такая как гаемангиома, пролиферативные заболевания мезангиальных клеток, такие как хронические или острые заболевания почек, например диабетическая нефропатия, злокачественный нефросклероз, синдром тромботической микроангиопатии или отторжение трансплантата, или особенно воспалительное заболевание почек, такое как гломерулонефрит, особенно мезангиопролиферативный гломерулонефрит, гемолитический-уремический синдром, диабетическая нефропатия, гипертензивный нефросклероз, атерома, артериальный рестеноз, аутоиммунные заболевания, диабет, эндометриоз, хроническая астма и особенно опухолевые заболевания (твердые опухоли, а также лейкемии и другие "жидкие опухоли", особенно опухоли, экспрессирующие c-kit, KDR, Flt-1 или Flt-3), такие как особенно рак груди, рак толстой кишки, рак легких (особенно рак маленьких клеток легких), рак простаты или саркома Капоши. Соединение формулы I (или его N-оксид) ингибирует рост опухолей и особенно подходит для предотвращения распространения метастатических опухолей и роста микрометастаз.
Соединение формулы I может вводиться отдельно или в комбинации с одним или несколькими другими терапевтическими агентами, возможная комбинированная терапия имеет форму фиксированных комбинаций или введение соединения по изобретению и одного или нескольких других терапевтических агентов, вводимых или принимаемых независимо друг от друга, или объединенное введение фиксированных комбинаций и одного или нескольких других терапевтических агентов. Соединение формулы I может, кроме того, вводиться особенно для лечения опухоли, такой как при лечении лейкемии, в комбинации с химиотерапией, радиотерапией, иммунотерапией, хирургическим вмешательством или их комбинацией. Одинаково возможна как длительная терапия, так и вспомогательная терапия с другими методами лечения, как описано выше. Другими возможными лечениями является терапия для поддержания состояния пациента после регресса опухоли или даже химиотерапии, например, у пациентов группы риска.
Терапевтическими агентами для возможной комбинации являются особенно один или несколько цитостатических или цитотоксических соединений, например химиотерапевтический агент или агенты, выбранные из группы, включающей индарубицин, цитарубицин, интерферон, гидроксимочевина, бисульфан или ингибитор биосинтеза полиамина, ингибитор протеинкиназы, особенно серин/треониновой протеинкиназы, такой как протеинкиназа С, или тирозиновой протеинкиназы, такой как тирозинкиназы рецептора эпидермального фактора роста, цитокин, отрицательный регулятор роста, такой как TGF-β или IFN-β, ингибитор ароматазы, классический цитостатический агент и ингибитор взаимодействия SH2 домена с фосфорилированным белком.
Соединение в соответствии с изобретением полезно не только для (профилактического и предпочтительно терапевтического) введения людям, но также и для лечения других теплокровных животных, например промышленно полезных животных, например грызунов, таких как мыши, кролики или крысы, или морских свинок. Такое соединение может также использоваться в качестве ссылочного стандарта в описанных выше тестовых системах для сравнения с другими соединениями.
Вообще изобретение также относится к применению соединения формулы I или его N-оксида для ингибирования активности тирозинкиназы, in vitro или in vivo.
В группах упомянутых далее предпочтительных соединений формулы I и их N-оксидов определения заместителей из общих упомянутых ранее определений могут успешно использоваться, например, для замены более общих определений более конкретными определениями или особенно предпочтительными определениями.
В частности, изобретение относится к соединениям формулы I, где
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил, ацилокси-низший алкил, карбокси-низший алкил, низший алкоксикарбонил-низший алкил или фенил-низший алкил;
R2 представляет собой водород, низший алкил, необязательно замещенный одним или двумя одинаковыми или различными радикалами R3, циклоалкил, бензциклоалкил, гетероциклил, арильную группу или моно- или бициклическую гетероарильную группу, включающую один, два или три атома азота или один атом серы, где арильная и гетероарильная группы в каждом случае являются незамещенными или моно- или полизамещенными;
и R3 представляет собой гидрокси, низший алкокси, ацилокси, карбокси, низший алкоксикарбонил, карбамоил, N-моно- или N,N-дизамещенный карбамоил, амино, моно- или дизамещенный амино, циклоалкил, гетероциклил, арильную группу, фураноил, тиеноил или моно- или бициклическую гетероарильную группу, включающую один, два или три атома азота в кольце, ноль или один атом кислорода в кольце и ноль или один атом серы в кольце, где арильная и гетероарильная группы в каждом случае являются незамещенными или моно- или полизамещенными;
или где R1 и R2 вместе представляют собой алкилен с четырьмя или пятью атомами углерода, необязательно моно- или дизамещенный низшим алкилом, циклоалкилом, гетероциклилом, фенилом, гидрокси, низшим алкокси, амино, моно- или дизамещенным амино, пиридилом, пиразинилом или пиримидинилом; бензалкилен с четырьмя или пятью атомами углерода в алкиленовой группе; оксаалкилен с одним отомом кислорода и тремя или четырьмя атомами углерода, или азаалкилен с одним атомом азота и тремя или четырьмя атомами углерода, где азот является незамещенным или замещенным низшим алкилом, фенил-низшим алкилом, низший алкоксикарбонил-низшим алкилом, карбокси-низшим алкилом, карбамоил-низшим алкилом, N-моно- или N,N-дизамещенный карбамоил-низшим алкилом, циклоалкилом, низшим алкоксикарбонилом, фенилом, замещенным фенилом, пиридинилом, пиримидинилом или пиразинилом;
R4 представляет собой водород, низший алкил или галоген;
и N-оксид или фармацевтически приемлемая соль такого соединения.
Более конкретно, изобретение относится к соединениям формулы I, где
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил, низший алкоксикарбонил-низший алкил или фенил-низший алкил;
R2 представляет собой водород, низший алкил, необязательно замещенный одним или двумя одинаковыми или различными радикалами R3, циклопентил, бензциклопентил, циклогексил, пирролидинил, оксазолинил, пиперидинил, N-замещенный пиперидинил, морфолинил, азепинил, оксоазепинил, оксазепинил, фенил, нафталинил, тетрагидронафталинил или моно- или бициклическую гетероарильную группу, включающую один или два атома азота, где фенильная, нафталинильная и гетероарильная группы в каждом случае являются незамещенными или моно- или полизамещенными, тиенил или низший алкоксикарбонил-низший алкилтиенил;
и R3 представляет собой гидрокси, низший алкокси, ацилокси, карбокси, низший алкоксикарбонил, карбамоил, N-моно- или N,N-дизамещенный карбамоил, амино, низший алкиламино, ди-низший алкиламино, фениламино, N-низший алкил-N-фениламино, пирролидино, оксопирролидино, пиперидино, морфолино, имидазолино, оксоимидазолино, циклоалкил, гетероциклил, фурил, фенил, нафталинил, тетрагидронафталинил или моно- или бициклическую гетероарильную группу, включающую один или два атома азота, где фенильная, нафталинильная и гетероарильная группа являются незамещенными или моно- или полизамещенными;
или где R1 и R2 вместе представляют собой алкилен с четырьмя или пятью атомами углерода, необязательно моно- или дизамещенный низшим алкилом, циклоалкилом, гетероциклилом, фенилом, гидрокси, низшим алкокси, амино, моно- или дизамещенным амино, пиридилом, пиразинилом или пиримидинилом; бензалкилен с четырьмя или пятью атомами углерода в алкиленовой группе; оксаалкилен с одним атомом кислорода и четырьмя атомами углерода; или азаалкилен с одним атомом азота и четырьмя атомами углерода, где азот является незамещенным или замещенным низшим алкилом, фенил-низшим алкилом, низший алкоксикарбонил-низшим алкилом, карбокси-низшим алкилом, карбамоил-низшим алкилом, N-моно- или N,N-дизамещенный карбамоил-низшим алкилом, циклоалкилом, низшим алкоксикарбонилом, фенилом, замещенным фенилом, пиридинилом, пиримидинилом или пиразинилом;
R4 представляет собой водород, низший алкил или галоген;
и N-оксид или фармацевтически приемлемая соль такого соединения.
Более конкретно, изобретение относится к соединениям формулы I, где
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил, низший алкоксикарбонил-низший алкил или фенил-низший алкил;
R2 представляет собой водород; низший алкил, необязательно замещенный одним радикалом R3, двумя фенильными группами, двумя низшими алкоксикарбонильными группами, фенилом и низшим алкоксикарбонилом или гидроксифенилом и низшим алкоксикарбонилом; циклопентил; бензциклопентил; циклогексил; пирролидинил; оксазолинил; пиперидинил; N-низший алкилпиперидинил; N-бензилпиперидинил; N-пиримидинилпиперидинил; морфолинил; азепинил; оксоазепинил; оксазепинил; фенил, нафталинил, тетрагидронафталинил или моно- или бициклическую гетероарильную группу, включающую один или два атома азота, где фенильная, нафталинильная и гетероарильная группы в каждом случае являются незамещенными или замещенными одним или двумя заместителями, выбранными из группы, состоящей из низшего алкила, трифтор-низшего алкила, гидрокси-низшего алкила, низший алкокси-низшего алкила, амино-низшего алкила, низший алкиламино-низшего алкила, динизший алкиламино-низшего алкила, N-циклогексил-N-низший алкиламино-низшего алкила, низший алкоксикарбонилпиперидино-низшего алкила, N-низший алкилпиперазино-низшего алкила, низший алкоксикарбонил-низшего алкила, гидрокси, низшего алкокси, трифтор-низшего алкокси, 1H-имидазолил-низшего алкокси, низшего алканоилокси, бензоилокси, карбокси, низшего алкоксикарбонил, карбамоила, низшый алкил-карбамоила, амино, низшего алканоиламино, бензоиламино, амино, моно- или дизамещенного низшим алкилом, гидрокси-низшим алкилом или низший алкокси-низшим алкилом, 1H-имидазолила, низший алкил-1H-имидазолила, пирролидино, пиперидино, пиперазино, N-низшего алкилпиперазино, морфолино, сульфамоила, низшего алкилсульфонила, фенилсульфонила, низшего алкилсульфинила, фенилсульфинила, низшего алкилтио, фенилтио, фенила, пиридила, галогенила или бензоила; тиенила или низший алкоксикарбонил-низшего алкилтиенила;
и R3 представляет собой гидрокси, низший алкокси, ацилокси, карбокси, низший алкоксикарбонил, карбамоил, карбамоил, моно- или дизамещенный низшим алкилом, фенилом или низшим алкиленом, амино, низшим алкиламино, динизшим алкиламино, фениламино, N-низший алкил-N-фениламино, пирролидино, оксопирролидино, пиперидино, морфолино, имидазолино, оксоимидазолино, циклоалкилом, гетероциклилом, фурилом; фенил, нафталинил, тетрагидронафталинил или моно- или бициклическую гетероарильную группу, включающую один или два атома азота, где фенильная, нафталинильная и гетероарильная группа является незамещенной или замещенной одним или двумя заместителями, выбранными из группы, состоящей из низшего алкила, трифтор-низшего алкила, низший алкоксикарбонил-низшего алкила, гидрокси, низшего алкокси, трифтор-низшего алкокси, низшего алканоилокси, бензоилокси, карбокси, низшего алкоксикарбонила, карбамоила, амино, низшего алканоиламино, бензоиламино, амино, моно- или дизамещенного низшим алкилом, гидрокси-низшим алкилом или низший алкокси-низшим алкилом, пирролидино, пиперидино, морфолино, пиперазино, N-низшего алкилпиперазино, N-низшего алкоксикарбонилпиперазино, фенила, пиридила, 1H-имидазолила, низшего алкил-1H-имидазолила, сульфамоила, низшего алкилсульфонила, фенилсульфонила, низшего алкилсульфинила, фенилсульфинила, низшего алкилтио, фенилтио, галогенила или бензоила;
или где R1 и R2 вместе представляют собой алкилен с четырьмя или пятью атомами углерода, необязательно моно- или дизамещенный низшим алкилом, циклоалкилом, фенилом, гидрокси, низшим алкокси, амино, бензоиламино, пиперидино, пиридилом, пиразинилом или пиримидинилом; бензалкилен с четырьмя или пятью атомами углерода в алкиленовой группе; оксаалкилен с одним атомом кислорода и четырьмя атомами углерода; или азаалкилен с одним атомом азота и четырьмя атомами углерода, где азот является незамещенным или замещенным низшим алкилом, фенил-низшим алкилом, низший алкоксикарбонил-низшим алкилом, карбокси-низшим алкилом, карбамоил-низшим алкилом, карбамоил-низшим алкилом, N-моно- или N,N-дизамещенным низшим алкилом, фенилом, низшим алкиленом или окса-низшим алкиленом, циклоалкилом, низшим алкоксикарбонилом, фенилом, метоксифенилом, трифторметилфенилом, трифторметоксифенилом, пиридинилом, пиримидинилом или пиразинилом;
R4 представляет собой водород или низший алкил;
и N-оксид или фармацевтически приемлемая соль такого соединения.
В предпочтительной группе соединений формулы I
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил или бензил;
R2 представляет собой низший алкил, необязательно замещенный одним радикалом R3, двумя фенильными группами, двумя низшими алкоксикарбонильными группами, фенилом и низшим алкоксикарбонилом или гидроксифенилом и низшим алкоксикарбонилом; циклопентил; бензциклопентил; циклогексил; пирролидинил; пиперидинил; N-низший алкилпиперидинил; N-бензилпиперидинил; N-пиримидинилпиперидинил; морфолинил; азепинил; оксоазепинил; фенил; нафталинил; тетрагидронафталинил; пиридил; низший алкил-пиридил; хинолинил; тиенил; низший алкоксикарбонилметилтиенил или фенил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из низшего алкила, трифтор-низшего алкила, гидрокси-низшего алкила, амино-низшего алкила, низший алкиламино-низшего алкила, динизший алкиламино-низшего алкила, N-циклогексил-N-низший алкиламино-низшего алкила, низший алкоксикарбонилпиперидино-низшего алкила, N-низший алкилпиперазино-низшего алкила, низший алкоксикарбонил-низшего алкила, гидрокси, низшего алкокси, трифтор-низшего алкокси, 1Н-имидазолил-низшего алкокси, низшего алканоилокси, бензоилокси, карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила, амино, низшего алканоиламино, бензоиламино, амино, моно- или дизамещенного низшим алкилом, гидрокси-низшим алкилом или низший алкокси-низшим алкилом, 1H-имидазолила, низшего алкил-1H-имидазолила, пирролидино, пиперидино, пиперазино, N-низшего алкилпиперазино, морфолино, сульфамоила, низшего алкилсульфонила, фенила, пиридила, галогенила или бензоила;
и R3 представляет собой гидрокси, низший алкокси, низший алканоилокси, бензоилокси, карбокси, низший алкоксикарбонил, карбамоил, амино, низший алкиламино, динизший алкиламино, фениламино, N-низший алкил-N-фениламино, пирролидино, оксопирролидино, пиперидино, морфолино, имидазолино, оксоимидазолино, циклопропил, циклопентил, циклогексил, тетрагидрофуранил, фенил, нафталинил, тетрагидронафталинил, фурил, моно- или бициклическую гетероарильную группу, включающую один или два атома азота, где гетероарильная группа является незамещенной или моно- или дизамещенной низшим алкилом, гидрокси и низшим алкокси, или фенил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из низшего алкила, трифтор-низшего алкила, низший алкоксикарбонил-низшего алкила, гидрокси, низшего алкокси, трифтор-низшего алкокси, низшего алканоилокси, бензоилокси, карбокси, низшего алкоксикарбонила, карбамоила, амино, низшего алканоиламино, бензоиламино, амино, моно- или дизамещенного низшим алкилом, гидрокси-низшим алкилом или низший алкокси-низшим алкилом, пирролидино, пиперидино, морфолино, пиперазино, N-низшего алкилпиперазино, N-низшего алкоксикарбонилпиперазино, фенила, пиридила, 1H-имидазолила, низший алкил-1Н-имидазолила, сульфамоила, низшего алкилсульфонила, галогенила или бензоила;
или где R1 и R2 вместе представляют собой алкилен с четырьмя или пятью атомами углерода, необязательно моно- или дизамещенный фенилом, гидрокси, амино, бензоиламино или пиперидино; бензалкилен с четырьмя или пятью атомами углерода в алкиленовой группе; оксаалкилен с одним атомом кислорода и четырьмя атомами углерода; или азаалкилен с одним атомом азота и четырьмя атомами углерода, где азот является незамещенным или замещенным низшим алкилом, фенил-низшим алкилом, низший алкоксикарбонил-низшим алкилом, карбамоил-низшим алкилом, пирролидинокарбонил-низшим алкилом, морфолинокарбонил-низшим алкилом, циклопентилом, низшим алкоксикарбонилом, фенилом, метоксифенилом, трифторметилфенилом, пиридинилом, пиримидинилом или пиразинилом;
R4 представляет собой водород или метил;
и N-оксид или фармацевтически приемлемая соль такого соединения.
Особенно предпочтительная группа соединений включает соединения формулы I, где
R1 представляет собой водород и
R2 представляет собой фенил, замещенный трифторметилом, особенно 3-трифторметилфенил, и необязательно также имеющий заместитель, выбранный из группы, состоящей из гидрокси-низшего алкила, например 1-гидрокси-1-метилэтила, низшего алкиламино, например метил- или этиламино, гидрокси-низшего алкиламино, например 2-гидрокси-1-пропиламино или 2-гидрокси-2-пропиламино, динизшего алкиламино, например диэтиламино, 1H-имидазолил, низший алкил-1Н-имидазолила, например 2- или 4-метил-1Н-имидазолил, карбамоила, низшего алкилкарбамоила, например метилкарбамоил, пирролидино, пиперидино, пиперазино, низшего алкилпиперазино, например 4-метилпиперазино, морфолино, низшего алкокси, например метокси, фтор низшего алкокси, например трифторметокси или 2,2,2-трифторэтокси, фенила, пиридила, например 2-, 3- или 4-пиридила и галогенила, например хлора или фтора;
R4 представляет собой метил;
и N-оксид или фармацевтически приемлемая соль такого соединения.
Особенно предпочтительными являются соединения, описанные в примерах.
Другими соединениями, которые являются особенно предпочтительными, являются:
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензанилид,
4-метил-N-(3-пиридинил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
N-(4-хлорфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
2(R)- и 2(S)-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоиламино]пропановая кислота,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(8-хинолинил)бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(3-[трифторметокси]фенил)бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(2-пирролидиноэтил)бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(3-пирролидинофенил)бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(1-[2-пиримидинил]-4-пиперидинил)бензамид,
N-(4-ди-[2-метоксиэтил]амино-3-трифторметилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
N-(4-[1Н-имидазолил]-3-трифторметилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(2-пирролидино-5-трифторметилфенил)бензамид,
N-(3,4-дифторфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(3-трифторметилбензил)бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(3-трифторметилфенил)бензамид,
N-(3-хлор-5-трифторметилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
N-(4-диметиламинобутил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-N-[4-(4-метил-1-пиперазинил)-3-трифторметилфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(2,2,2-трифторэтокси)-3-трифторметилфенил]бензамид,
4-метил-N-[4-(2-метил-1Н-имидазолил)-3-трифторметилфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-N-(4-фенил-3-трифторметилфенил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-N-[4-(4-метил-1Н-имидазолил)-3-трифторметилфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
метил 2(R)- и 2(S)-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоиламино]-3-[4-гидроксифенил]пропаноат,
N-[2-(N-циклогексил-N-метиламинометил)фенил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
N-[3-[2-(1Н-имидазолил)этокси]фенил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-N-[3-морфолино-5-трифторметилфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(4-пирролидино-3-трифторметилфенил)бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(4-пиперидино-3-трифторметилфенил)бензамид,
4-метил-N-[4-морфолино-3-трифторметилфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
N-(4-этиламино-3-трифторметилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(3-трифторметоксифенил)бензамид,
N-[4-(2-гидроксипропиламино)-3-трифторметилфенил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
N-(4-диэтиламино-3-трифторметилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-(3-пиридинил)-5-трифторфенил]бензамид,
N-[3-[3-(1Н-имидазолил)пропокси]фенил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(3-пиридинил)-3-трифторфенил]бензамид,
4-метил-N-[3-(4-метил-1-пиперазинил)-5-трифторфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-N-[3-метилкарбамоил-5-трифторфенил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид,
4-метил-N-[3-метилкарбамоил-5-морфолино]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид.
Следующими соединениями, которые являются особенно предпочтительными, являются:
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[3-(1Н-имидазол-1-ил)пропокси]фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[2-(1H-имидазол-1-ил)этокси]фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(этиламино)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(диэтиламино)-3-(трифторметил)фенил]бензамид,
(±)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-[(2-гидроксипропил)амино]-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-[бис(2-метоксиэтил)амино]-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(4-метил-1-пиперазинил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(1-пиперидинил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(1-пирролидинил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(4-морфолинил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-фенил-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[4-(3-пиридинил)-3-(трифторметил)фенил]метил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(2,4-диметил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(2-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-(4-морфолинил)-5-[(метиламино)карбонил]фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[(метиламино)карбонил]-5-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(3-пиридинил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(4-морфолинил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(2-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(5-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид,
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-(4-метил-1-пиперазинил)-5-(трифторметил)фенил]бензамид и
4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[2-(1-пирролидинил)-5-(трифторметил)фенил]бензамид.
Изобретение также относится к 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоте и к 3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоте; промежуточным соединениям для получения предпочтительных амидов по изобретению.
Особенно изобретение относится к применению соединения формулы I или его N-оксида или возможного таутомера или фармацевтически приемлемой соли такого соединения для получения фармацевтической композиции для лечения заболевания, которое связано с ингибированием активности протеинкиназы, где заболеванием является опухолевое заболевание.
Более конкретно, изобретение относится к применению соединения формулы I или его N-оксида или возможного таутомера или фармацевтически приемлемой соли такого соединения для получения фармацевтической композиции для лечения лейкемии, которая связана с ингибированием активности Abl тирозинкиназы.
Кроме того, изобретение относится к способу лечения заболевания, которое связано с ингибированием активности протеинкиназы, который включает введение соединения формулы I или его N-оксида или фармацевтически приемлемой соли, где радикалы и символы имеют значения, определенные выше, в количестве, эффективном против указанного заболевания, теплокровному животному, нуждающемуся в таком лечении.
Соединение по изобретению может быть получено способами, которые, хотя и не применялись до настоящего времени для получения новых соединений настоящего изобретения, являются известными, особенно способом, характеризующимся тем, что для синтеза соединения формулы I, где символы R1, R2 и R4 являются такими, как определено для соединения формулы I, 4-R4-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойная кислота формулы II
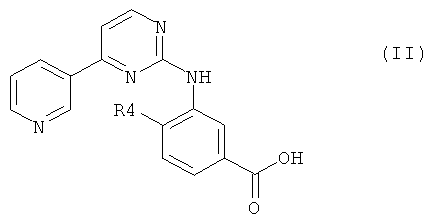
где R4 является таким, как определено для соединения формулы I, или ее производное, где карбоксигруппа -СООН находится в активированной форме, реагирует с амином формулы III

где R1 и R2 являются такими, как определено для соединения формулы I, необязательно в присутствии дегидрирующего агента и инертного основания и/или подходящего катализатора, и необязательно в присутствии инертного растворителя;
где указанные выше исходные соединения II и III могут также присутствовать при необходимости с функциональными группами в защищенной форме и/или в форме солей, при условии, что присутствует образующая соль группа и реакция в форме соли является возможной;
любая защитная группа в защищенном производном соединения формулы I удаляется;
и, при желании, получаемое соединение формулы I превращается в другое соединение формулы I или его N-оксид, свободное соединение формулы I превращается в соль, получаемая соль соединения формулы I превращается в свободное соединение или другую соль, и/или смесь изомерных соединений формулы I разделяется в индивидуальные изомеры.
Подробное описание способа.
Производное соединения формулы II, где карбоксигруппа находится в активированной форме, представляет собой особенно реакционный эфир, реакционный ангидрид или реакционный циклический амид.
Реакционные эфиры кислоты формулы II представляют собой особенно эфиры, ненасыщенные на связанном атоме углерода эфирного радикала, например эфиры винильного типа, такие как просто виниловые эфиры (получаемые, например, трансэтерификацией соответствующего эфира винилацетатом; метод активированного винилового эфира), карбамоилвиниловые эфиры (получаемые, например, обработкой соответствующей кислоты изоксазолиновым реагентом; 1,2-оксазолиновый метод или метод Вудварда), или 1-низшие алкоксивиниловые эфиры (получаемые, например, обработкой соответствующей кислоты низшим алкоксиацетиленом; этоксиацетиленовый метод), или эфиры амидинотипа, такие как N,N'-дизамещенные амидиноэфиры (получаемые, например, обработкой соответствующей кислоты подходящим N,N'-дизамещенным карбодиимидом, например N,N-дициклогексилкарбодиимидом; карбодиимидный метод), или N,N-дизамещенные амидиноэфиры (получаемые, например, обработкой соответствующей кислоты N,N-дизамещенным цианамидом; цианамидный метод), подходящие арильные эфиры, особенно фениловые эфиры, соответственно замещенные электрон-акцепторными заместителями (получаемые, например, обработкой соответствующей кислоты соответствующим замещенным фенолом, например 4-нитрофенолом, 4-метилсульфонилфенолом, 2,4,5-трихлорфенолом, 2,3,4,5,6-пентахлорфенолом или 4-фенилдиазофенолом, в присутствии конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид; метод активированных арильных эфиров), цианометиловые эфиры (получаемые, например, обработкой соответствующей кислоты хлорацетонитрилом в присутствии основания; метод цианометиловых эфиров), тиоэфиры, особенно незамещенные или замещенные, например нитро-замещенные, фенилтиоэфиры (получаемые, например, обработкой соответствующей кислоты незамещенными или замещенными, например нитро-замещенными тиофенолами, inter alia ангидридным или карбодиимидным методом; метод активированных тиоэфиров), амино- или амидоэфиры (получаемые, например, обработкой соответствующей кислоты N-гидроксиамино- или N-гидроксиамидосоединением, например N-гидроксисукцинимидом, N-гидроксипиперидином, N-гидроксифталимидом или 1-гидроксибензотриазолом, например, ангидридным или карбодиимидным методом; метод активированных N-гидроксиэфиров) или силильные эфиры (получаемые, например, обработкой соответствующей кислоты силирующим агентом, например гексаметилдисилазаном, и реакцией с гидроксигруппами, но не с аминогруппами).
Ангидриды кислоты формулы II могут быть симметричными или предпочтительно смешанными ангидридами этой кислоты, например ангидриды с неорганическими кислотами, такие как кислотные галиды, особенно кислотные хлориды (получаемые, например, обработкой соответствующей кислоты тионилхлоридом, пентахлоридом фосфора или оксалилхлоридом; метод кислотных хлоридов), азиды (получаемые, например, из соответствующего эфира кислоты через соответствующий гидразид и обработкой его азотной кислотой; азидный метод), ангидриды с полупроизводными карбоновой кислоты, такие как соответствующие эфиры, например низшие алкиловые полуэфиры карбоновой кислоты (получаемые, например, обработкой соответствующей кислоты низшими алкиловыми эфирами галогенмуравьиной, такой как хлормуравиьной, кислоты или 1-низший алкоксикарбонил-2-низший алкокси-1,2-дигидрохинолином, например 1-низший алкоксикарбонил-2-этокси-1,2-дигидрохинолином; метод смешанных ангидридов O-алкилкарбоновой кислоты), или ангидриды дигалогенированной, особенно дихлорированной фосфорной кислоты (получаемые, например, обработкой соответствующей кислоты оксихлоридом фосфора; метод оксихлорида фосфора), или ангидриды органических кислот, такие как смешанные ангидриды органических карбоновых кислот (получаемые, например, обработкой соответствующей кислоты незамещенным или замещенным галидом низший алкан- или фенилалканкарбоновой кислоты, например хлоридом фенилуксусной кислоты, хлоридом пивалиновой кислоты или хлоридом трифторуксусной кислоты; метод смешанных ангидридов карбоновой кислоты), с органическими сульфоновыми кислотами (получаемыми, например, обработкой соли, такой как соль щелочного металла, соответствующей кислоты, подходящим галидом органической сульфоновой кислоты, таким как хлорид низший алкан- или арил-, например метан- или п-толуолсульфоновой кислоты; метод смешанных ангидридов сульфоновой кислоты), или с органическими фосфоновыми кислотами (получаемые, например, обработкой соответствующей кислоты подходящим органическим фосфоновым ангидридом или фосфоновым цианидом; метод смешанных ангидридов фосфоновой кислоты) и симметричные ангидриды (получаемые, например, конденсацией соответствующей кислоты в присутствии карбодиимида или 1-диэтиламинопропина; метод симметричных ангидридов).
Подходящие циклические амиды представляют собой особенно амиды с пятичленными диазациклами ароматической природы, такие как амиды имидазолов, например имидазола (получаемые, например, обработкой соответствующей кислоты N,N'-карбонилдиимидазолом; имидазолидиновый метод) или пиразолов, например 3,5-диметилпиразол (получаемые, например, из гидразида кислоты обработкой ацетилацетоном; пиразолидиновый метод).
Производные кислоты формулы II, где карбоксигруппа находится в активированной форме, предпочтительно получают in situ. Например, N,N'-дизамещенные амидиноэфиры могут быть получены in situ реакцией смеси кислоты формулы II и амина формулы III в присутствии подходящего N,N-дизамещенного карбодиимида, например N,N'-дициклогексилкарбодиимида. Реакционные смешанные ангидриды кислоты формулы II с органической фосфоновой кислотой могут быть получены in situ реакцией, например, с пропилфосфоновым ангидридом или диэтилцианофосфонатом в присутствии подходящего основания, предпочтительно третичного амина, например триэтиламина или диметиламинопиридина.
Реакция может осуществляться известным способом, причем условия реакции будут зависеть особенно от того, является ли карбоксигруппа карбоновой кислоты формулы II активированной, и если да, то каким образом, обычно в присутствии подходящего растворителя или разбавителя или их смеси и, при необходимости, в присутствии конденсирующего агента, который, например, когда карбоксигруппа присутствует в реакции в форме ангидрида, может также выступать связывающим кислоту агентом, при охлаждении или нагревании, например, в области температур от около -30°С до около +150°С, особенно от около 0°С до +100°С, предпочтительно от комнатной температуры (приблизит. +20°С) до +70°С, в открытом или закрытом реакционном сосуде и/или в атмосфере инертного газа, например азота. Обычными конденсирующими агентами являются, например, карбодиимиды, например N,N'-диэтил-, N,N'-дипропил-, N,N'-дициклогексил- или N-этил-N'-(3-диметиламинопропил)карбодиимид, подходящие карбонильные соединения, например карбонилдиимидазол, или 1,2-оксазолиновые соединения, например 2-этил-5-фенил-1,2-оксазолин 3'-сульфонат и 2-трет-бутил-5-метилизоксазолинперхлорат, или подходящее ациламиносоединение, например 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин. Обычными связывающими кислоту конденсирующими агентами являются, например, карбонаты щелочных металлов или гидрокарбонаты, например карбонат натрия или калия или гидрокарбонат (обычно вместе с сульфатом), или органические основания, такие как, обычно, пиридин или триэтиламин, или стерически затрудненные тринизшие алкиламины, например N,N-диизопропил-N-этиламин.
В предпочтительном варианте осуществления карбоновая кислота формулы II реагирует с амином формулы III в подходящем растворителе, таком как, например, N,N-диметилформамид, в присутствии пропилфосфонового ангидрида или диэтилцианофосфоната и триэтиламина, от 1 до 48 часов между 0°С и около 50°С, предпочтительно при комнатной температуре.
Защитные группы
Если одна или несколько функциональных групп, например карбокси, гидрокси, амино или меркапто, являются защищенными или должны быть защищены в соединении формулы III, поскольку они не принимают участия в реакции, присутствуют такие группы, которые обычно используются в синтезе амидов, в частности пептидных соединений, а также цефалоспоринов и пенициллинов, а также производных нуклеиновых кислот и сахаров.
Защитные группы могут уже присутствовать в предшественнике и защищать функциональные группы от нежелательных побочных реакций, таких как ацилирование, этерификации, эстерификации, окисление, сольволиз и подобных реакций. Характеристикой защитных групп является то, что они легко, т.е. без нежелательных побочных реакций, удаляются, обычно сольволизом, восстановлением, фотолизом или также ферментативной активностью, например, в условиях, аналогичных физиологическим условиям, и что они не присутствуют в конечном продукте. Специалисту известны или он может легко установить, какие защитные группы подходят для реакций, упомянутых здесь и далее.
Защита таких функциональных групп такими защитными группами, сами защитные группы и реакции для их удаления описаны, например, в стандартных источниках пептидного синтеза, указанных ранее, и в специальных источниках по защитным группам, таких как J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London и New York 1973, в "Methoden der organischen Chemie" (Methods of organic chemistry), Houben-Weyl, 4th edition, Volume 15/1, Georg Thieme Verlag, Stuttgart 1974 и в Т.W.Greene, "Protective Groups in Organic Synthesis", Wiley, New York.
Дополнительные стадии процесса
В дополнительных стадиях процесса, проводимых при необходимости, функциональные группы исходных соединений, которые не принимают участие в реакции, могут присутствовать в незащищенной форме или могут быть защищены, например, одной или несколькими защитными группами, упомянутыми выше как "защитные группы". Защитные группы затем полностью или частично удаляются в соответствии с одним из описанных здесь способов.
Соли соединения формулы I с соль-образующей группой могут быть получены известным способом. Кислотные аддитивные соли соединений формулы I могут быть получены обработкой кислотой или подходящим анионообменным реагентом.
Соли могут обычно преобразовываться в свободные соединения, например, обработкой подходящими основными агентами, например карбонатами щелочных металлов, гидрокарбонатами щелочных металлов или гидроксидами щелочных металлов, обычно карбонатом калия или гидроксидом натрия.
Стехиометрические смеси, например смеси диастереомеров, могут быть выделены в их соответствующие изомеры известным способом подходящими способами разделения. Диастереомерные смеси, например, могут быть выделены в их индивидуальные диастереомеры фракционной кристаллизацией, хроматографией, выбором растворителя и подобными процедурами. Это разделение может иметь место или для исходного соединения, или для соединения формулы I непосредственно. Энантиомеры могут быть выделены образованием диастереомерных солей, например образованием соли с энантиомерно-чистой хиральной кислотой, или хроматографией, например ВЭЖХ, используя хроматографические субстраты с хиральными лигандами.
Соединение формулы I, где R1 представляет собой водород, может быть преобразовано в соответствующее соединение, где R1 представляет собой низший алкил, по реакции, например, с диазонизшим алкильным соединением, особенно диазометаном, в инертном растворителе, предпочтительно в присутствии катализатора благородных металлов, особенно в дисперсной форме, например меди, или соли благородного металла, например хлорида меди(I) или сульфата меди(II). Также возможна реакция с низшими алкилгалогенидами или с другими низшими алканами, несущими уходящую группу, например низшими алкильными спиртами, этерифицированными сильной органической сульфоновой кислотой, такими как низшая алкансульфоновая кислота (необязательно замещенная галогеном, таким как фтор), ароматической сульфоновой кислотой, например незамещенной или замещенной бензолсульфоновой кислотой, где заместители предпочтительно выбраны из низшего алкила, такого как метил, галогена, такого как бром и/или нитро, например, этерифицированной метансульфоновой кислотой, или п-толуолсульфоновой кислотой. Алкилирование имеет место при обычных условиях алкилирования амидов, особенно в водном растворе и/или в присутствии полярных растворителей, обычно спиртов, например метанола, этанола, изопропанола или этиленгликоля, или диполярных апротонных растворителей, например тетрагидрофурана, диоксана или диметилформамида, где, возможно, в присутствии кислотного или основного катализатора, обычно при температурах от около 0°С до температуры кипения соответствующей реакционной смеси, предпочтительно между 20°С и температурой кипения растворителя, при необходимости при повышенном давлении, например, в запаянной пробирке, и/или в атмосфере инертного газа, обычно азота или аргона.
Следует подчеркнуть, что для соответствующих промежуточных соединений могут также иметь место реакции, аналогичные превращениям, упомянутым в этом разделе.
Общие условия процесса
Все описанные здесь стадии процесса могут осуществляться в известных реакционных условиях, предпочтительно в конкретно описанных выше условиях, в отсутствие или обычно в присутствии растворителей или разбавителей, предпочтительно таких, которые являются инертными к используемым реагентам и способными растворять их, в отсутствие или присутствии катализаторов, конденсирующих агентов или нейтрализующих агентов, например ионообменников, обычно катионообменников, например, в Н+ форме, в зависимости от типа реакции и/или реагента при пониженной, нормальной или повышенной температуре, например в области от -100°С до около 190°С, предпочтительно от около -80°С до около 150°С, например при от -80 до -60°С, при комнатной температуре, при от -20 до 40°С или при температуре кипения используемого растворителя, под атмосферным давлением или в закрытом сосуде, возможно, под давлением, и/или в инертной атмосфере, например под аргоном или азотом.
Соли могут присутствовать во всех исходных соединениях и промежуточных веществах, если они содержат соль-образующие группы. Соли могут также присутствовать в процессе реакции таких соединений, при условии, что они не разрушаются в процессе реакции.
Во всех реакционных стадиях присутствующие изомерные смеси могут быть разделены на их индивидуальные изомеры, например диастереомеры или энантиомеры, или на любые смеси изомеров, например рацематы или диастереомерные смеси.
Изобретение также относится к тем формам процесса, в которых он начинается из соединения, полученного на любой стадии в виде промежуточного вещества, и выполняет отсутствующие стадии, или прерывает процесс на любой стадии, или образует исходный материал в реакционных условиях, или использует указанный исходный материал в форме реакционного производного или соли, или производит получаемое соединение способом в соответствии с изобретением и обрабатывает упомянутое соединение. В предпочтительном варианте осуществления каждая стадия начинается из тех исходных материалов, которые приводят к соединениям, описанным выше как предпочтительные, особенно как особо предпочтительные, прежде всего предпочтительные и/или предпочтительные из всех вышеупомянутых.
В предпочтительном варианте осуществления соединение формулы I получают способом или аналогично способам и стадиям процесса, указанным в примерах.
Соединения формулы I, включая их соли, также получают в форме гидратов, или их кристаллы могут включать, например, растворитель, используемый для кристаллизации (присутствующий в качестве сольвата).
Фармацевтические составы, способы и применения
Настоящее изобретение, кроме того, относится к способу лечения опухолевого заболевания, которое связано с ингибированием активности протеинкиназы, который включает введение соединения формулы I или его N-оксида или фармацевтически приемлемой соли, где радикалы и символы имеют значения, как указано выше для формулы I, в количестве, эффективном для указанного заболевания, теплокровному животному, нуждающемуся в таком лечении.
В частности, изобретение относится к способу лечения лейкемии, который связан с ингибированием активности Abl тирозинкиназы, который включает введение соединения формулы I или его N-оксида или фармацевтически приемлемой соли, где радикалы и символы имеют значения, как указано выше для формулы I, в количестве, эффективном для указанной лейкемии, теплокровному животному, нуждающемуся в таком лечении.
Настоящее изобретение также относится к фармацевтическим композициям, которые включают соединение формулы I или его N-оксид в качестве активного ингредиента и которые могут использоваться особенно для лечения упомянутых в начале заболеваний. Композиции для энтерального введения, такого как назальное, буккальное, ректальное или, особенно, оральное введение, и для парентерального введения, такого как внутривенное, внутримышечное или подкожное введение, теплокровному животному, особенно человеку, являются особенно предпочтительными. Композиции включают активный ингредиент отдельно или, предпочтительно, вместе с фармацевтически приемлемым носителем. Дозировка активного ингредиента зависит от излечиваемого заболевания и от вида, возраста, веса и индивидуальных условий, индивидуальных фармакокинетических данных и способа введения.
Настоящее изобретение относится особенно к фармацевтическим композициям, которые включают соединение формулы I, его таутомер, N-оксид или фармацевтически приемлемую соль, или гидрат, или сольват, и по крайней мере один фармацевтически приемлемый носитель.
Изобретение также относится к фармацевтическим композициям для применения в способе профилактики или особенно терапевтического лечения человека или животного, к способу их получения (особенно в форме композиций для лечения опухолей) и к способу лечения опухолевых заболеваний, особенно упомянутых выше.
Изобретение также относится к способам к применению соединений формулы I или их N-оксидов для получения фармацевтических составов, которые включают соединения формулы I или их N-оксиды в качестве активного компонента (активный ингредиент).
В предпочтительном варианте осуществления фармацевтический состав подходит для введения теплокровному животному, особенно человеку или промышленно полезным млекопитающим, страдающих заболеванием, связанным с ингибированием Abl тирозинкиназы, например хронической миелогенной лейкемией (CML), и включает эффективное количество соединения формулы I или его N-оксиды для ингибирования слитого белка Bcr-Abl, или его фармацевтически приемлемую соль, если присутствуют соль-образующие группы, вместе с по крайней мере одним фармацевтически приемлемым носителем.
Фармацевтическая композиция для профилактики или особенно терапевтического лечения опухолевого и других пролиферативных заболеваний теплокровного животного, особенно человека или промышленно полезного млекопитающего, нуждающегося в таком лечении, особенно страдающего таким заболеванием, включающая в качестве активного ингредиента в количестве, которое является профилактически или особенно терапевтически активным против указанных заболеваний, новое соединение формулы I или его N-оксиды, является особенно предпочтительной.
Фармацевтические композиции включают от около 1% до около 95% активного ингредиента, формы введения отдельной дозой включают в предпочтительном варианте осуществления от около 20% до около 90% активного ингредиента и формы не отдельных доз включают в предпочтительном варианте осуществления от около 5% до около 20% активного ингредиента. Единичными дозированными формами являются, например, покрытые и непокрытые таблетки, ампулы, пузырьки, свечи или капсулы. Другими дозированными формами являются, например, мази, кремы, пасты, пены, настойки, спреи и т.д. Примерами являются капсулы, содержащие от около 0,05 г до около 1,0 г активного ингредиента.
Фармацевтические композиции настоящего изобретения получают известным способом, например, обычными методами смешения, гранулирования, покрытия, растворения или лиофилизации.
Предпочтение отдано применению растворов активного ингредиента, а также суспензий или дисперсий, особенно изотонических водных растворов, дисперсий или суспензий, которые, например, в случае лиофилизованных композиций, включающих активный ингредиент отдельно или вместе с носителем, могут быть получены перед применением. Фармацевтические композиции могут быть стерильными и/или могут включать эксципиенты, например консерванты, стабилизаторы, увлажняющие агенты и/или эмульсификаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы и получаются известным способом, например, обычными методами растворения и лиофилизации. Указанные растворы или суспензии могут включать повышающие вязкость агенты или солюбилизаторы.
Суспензии в масле включают в качестве масла компонент растительных, синтетических или полусинтетических масел, обычных для инъекционных целей. В этом отношении могут применяться жидкие эфиры жирных кислот, которые содержат в качестве кислотного компонента жирную кислоту с длинной цепью, имеющую от 8 до 22 атомов углерода. Спиртовой компонент этих эфиров жирных кислот имеет максимально 6 атомов углерода и является моновалентным или поливалентным, например моно-, ди- или тривалентным спиртом, особенно гликолем и глицерином.
Фармацевтические композиции для орального введения могут быть получены, например, объединением активного ингредиента с одним или несколькими твердыми носителями, при желании измельчением полученной смеси и обработкой смеси или гранул, если желательно или необходимо, с включением дополнительных эксципиентов, в форму таблетки или ядро таблетки.
Подходящими носителями являются особенно наполнители, такие как сахар, составы целлюлозы и/или фосфаты кальция, а также связующие вещества, такие как крахмал и/или поливинилпирролидон, и/или, если желательно, дезинтеграторы. Дополнительными эксципиентами являются особенно текучие кондиционеры и лубриканты.
Ядра таблетки могут быть составлены с подходящими, необязательно энтеральными покрытиями с помощью применения концентрированных растворов сахаров, которые могут включают гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или раствор покрытия в подходящих органических растворителях или смеси растворителей, или для получения энтеральных покрытий подходят растворы целлюлозных составов.
Фармацевтические композиции для орального введения также включают твердые желатиновые капсулы, а также мягкие закрытые капсулы, состоящие из желатина и пластификатора. Твердые капсулы могут содержать активный ингредиент в форме гранул, например, в смеси с наполнителями, связующими веществами и/или глидантами и необязательно стабилизаторами. В мягких капсулах активный ингредиент является предпочтительно растворенным или суспендированным в подходящих жидких эксципиентах, к которым могут также добавляться стабилизаторы и моющие средства.
Фармацевтическими композициями, подходящими для ректального введения, являются, например, свечи, которые состоят из комбинации активного ингредиента и основы для свечи.
Для парентерального введения водные растворы активного ингредиента в растворимой в воде форме, например растворимой в воде соли, или водные инъекционные суспензии, которые содержат вещества, увеличивающие вязкость, например карбоксиметилцеллюлозу натрия, сорбит и/или декстран, и если желательно стабилизаторы, являются особенно подходящими. Активный ингредиент, необязательно вместе с эксципиентами, может также быть в форме лиофилизата и может быть растворен перед парентеральным введением добавлением подходящих растворителей.
Растворы, которые используются, например, для парентерального введения, могут также использоваться в качестве инфузионных растворов.
Предпочтительными консервантами являются, например, антиоксиданты, такие как аскорбиновая кислота, или микробициды, такие как сорбиновая кислота или бензойная кислота.
Изобретение аналогично относится к процессу или способу лечения одного из упомянутых выше патологических состояний, особенно заболевания, которое связано с ингибированием тирозинкиназы, особенно соответствующего опухолевого заболевания. Соединения формулы I или их N-оксиды могут вводиться также или особенно в форме фармацевтических композиций, профилактически или терапевтически, предпочтительно в количестве, эффективном против упомянутых заболеваний, теплокровному животному, например человеку, нуждающемуся в таком лечении. Когда пациент имеет вес тела приблизительно 70 кг, ежедневная вводимая доза составляет от около 0,05 г до около 5 г, предпочтительно от около 0,25 г до около 1,5 г соединения настоящего изобретения.
Настоящее изобретение особенно относится к также к применению соединения формулы I или его N-оксидов или его фармацевтически приемлемой соли, особенно соединения формулы I, которое считается предпочтительным, или его фармацевтически приемлемой соли, как такового или в форме фармацевтического состава по крайней мере с одним фармацевтически приемлемым носителем для терапевтического, а также профилактического введения для одного или нескольких упомянутых выше заболеваний, предпочтительно заболевания, которое связано с ингибированием протеинкиназы, особенно опухолевого заболевания, более конкретно лейкемии, которое связано с ингибированием Abl тирозинкиназы.
Предпочтительное дозовое количество, композиция и получение фармацевтических составов (лекарственных средств), которые должны использоваться в каждом случае, описаны выше.
Исходные материалы
Новые исходные материалы и/или промежуточные соединения, а также способы для их получения, являются также объектом изобретения. В предпочтительном варианте осуществления используются такие исходные материалы и условия реакции, чтобы получить предпочтительные соединения.
Замещенная аминобензойная кислота формулы II, например, может быть получена реакцией эфира 3-амино-4-R4-бензойной кислоты, например 3-амино-4-метилбензойной кислоты, с цианамидом и конденсацией полученного гуанидина с 3-(диметиламино)-1-(3-пиридинил)-2-пропен-1-оном и, наконец, гидролизом эфирной группы.
Исходные материалы формулы III являются известными, промышленно доступными или могут быть получены аналогично или в соответствии со способами, известными из уровня техники.
Следующие примеры служат для иллюстрации изобретения без ограничения объема изобретения.
Сокращения
Примеры
Пример 1: N-(2-Фуранилметил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид
Раствор, содержащий ~50% пропилфосфонового ангидрида в N,N-диметилформамиде (Fluka, Buchs, Switzerland; 674 мкл, ~1 ммоль), добавляли в течение 20 минут к перемешиваемой смеси 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты (214,4 мг, 0,7 ммоль), фурфуриламина (Aldrich, Buchs, Switzerland; 61,8 мкл, 0,7 ммоль) и триэтиламина (776 мкл, 5,6 ммоль) в 2 мл N,N-диметилформамида. После перемешивания в течение 24 часов при комнатной температуре смесь обрабатывали полунасыщенным водным раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Растворитель упаривали при пониженном давлении и остаток высушивали в вакууме. Сырой продукт перекристаллизовывали из дихлорметана с получением указанного в заголовке соединения в виде кристаллического твердого вещества.
1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3H); 4,43 (d, 2H); 6,23 (m, 1H); 6,33-6,37 (m, 1H); 7,30 (d, 1H); 7,42 (d, 1H); 7,49 (ddd, 1H); 7,53 (m, 1H); 7,59 (dd, 1H); 8,11 (d, 1H); 8,38 (m, 1H); 8,49 (d, 1H); 8,66 (dd, 1H); 8,87 (t, 1H); 9,05 (s, 1H); 9,22 (m, 1H).
Исходный материал получали следующим образом.
Пример 1а: Мононитрат этилового эфира 3-[(аминоиминометил)амино]-4-метилбензойной кислоты
Цианамид (Fluka, Buchs, Switzerland; 77,4 г, 1,842 моль) добавляли к раствору этилового эфира 3-амино-4-метилбензойной кислоты (J. Med. Chem. 16, 118-122, 1973; 150 г, 0,837 моль) в 850 мл этанола. Затем по каплям добавляли соляную кислоту (Fluka, Buchs, Switzerland; 108 мл 12М, 1,27 моль) в течение 15 мин и реакционную смесь затем перемешивали при 90°С (температура бани) в течение 15 часов. Растворитель упаривали при пониженном давлении с получением остатка, который обрабатывали водой (1000 мл), и перемешивали при охлаждении до 5-10°С. По каплям добавляли раствор нитрата аммония (Merck, Darmstadt, Germany; 134,8 г, 1,68 моль) в воде (400 мл) в течение 30 мин, затем ледяную воду (1200 мл). После перемешивания в течение дополнительных 30 мин продукт отфильтровывали, промывали ледяной водой (3×1000 мл) и высушивали на воздухе. Остаток промывали диэтиловым эфиром (2×2000 мл) и высушивали в вакууме при 50° с получением указанного в заголовке соединения в виде кристаллического твердого вещества, tпл 195-197°С.
Пример 1b: Этиловый эфир 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил1амино]бензойной кислоты
Перемешиваемую смесь промежуточного соединения из примера 1а (164 г, 0,577 моль), 3-(диметиламино)-1-(3-пиридинил)-2-пропен-1-она (113,8 г, 0,646 моль) и порошка NaOH (99%; Merck, Darmstadt, Germany; 26,6 г, 0,658 моль) в этаноле (2200 мл) нагревали при кипячении с обратным холодильником в течение 68 ч. Растворитель реакции упаривали при пониженном давлении и остаток разделяли между этилацетатом и водой. Органический слой отделяли и водную фазу экстрагировали дважды этилацетатом. Объединенные органические экстракты промывали водой и соляным раствором, высушивали (Na2SO4) и растворитель упаривали при пониженном давлении с получением остатка, который перекристаллизовывали из диэтилового эфира с получением указанного в заголовке соединения в виде кристаллического твердого вещества, tпл 95-96°C.
Пример 1с: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойная кислота
Водный гидроксид натрия (500 мл 2М) по каплям добавляли к перемешиваемой суспензии промежуточного соединения примера 1b (132,8 г, 0,397 моль) в этаноле (1200 мл) и воды (1200 мл). Реакционную смесь перемешивали при 45°С в течение 2,5 ч и затем по каплям обрабатывали водным HCl (1000 мл 1М) в течение 1,5 часов. После добавления воды (1000 мл) осадок отфильтровывали, промывали водой (4×500 мл) и высушивали при комнатной температуре. Оставшуюся воду, присутствующую в высушенном на воздухе продукте, удаляли азеотропной дистилляцией с толуолом при пониженном давлении. Высушенную толуольную суспензию разбавляли диэтиловым эфиром и отфильтровывали. Оставшееся твердое вещество промывали диэтиловым эфиром и высушивали в вакууме при 80°С с получением указанного в заголовке соединения, tпл 277-278°С.
Пример 2: N-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-[(4-метил-1-пиперазинил)метил]бензоламин
Раствор, содержащий ~50% пропилфосфонового ангидрида в N,N-диметилформамиде (Fluka, Buchs, Switzerland; 875 мкл, ~1,5 ммоль) добавляли в течение 20 минут к перемешиваемой смеси 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты (306 мг, 1,0 ммоль), 4-[(4-метил-1-пиперазинил)метил]бензоламина (Chem. Abstr. Reg. Number: 70261-82-4; 205 мг, 1,0 ммоль) и триэтиламина (830 мкл, 6,0 ммоль) в 8 мл N,N-диметилформамида. После перемешивания в течение 24 часов при комнатной температуре смесь обрабатывали насыщенным водным хлоридом аммония и экстрагировали три раза этилацетатом. Растворитель упаривали при пониженном давлении и остаток высушивали в вакууме. Сырой продукт перекристаллизовывали из смеси этанол-этилацетат с получением указанного в заголовке соединения в виде кристаллического твердого вещества, tпл 153-155°С.
Пример 3: 1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-(2-пиридинил)пиперазин
Раствор, содержащий ~50% пропилфосфонового ангидрида в N,N-диметилформамиде (Fluka, Buchs, Switzerland; 674 мкл, ~1 ммоль), добавляли в течение 20 минут к перемешиваемой смеси 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты (214,4 мг, 0,7 ммоль), 1-(2-пиридил)пиперазина (Aldrich, Buchs, Switzerland; 114,3 мг, 0,7 ммоль) и триэтиламина (776 мкл, 5,6 ммоль) в 2 мл N-диметилформамида. После перемешивания в течение 24 часов при комнатной температуре смесь обрабатывали полунасыщенным водным раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Растворитель упаривали при пониженном давлении и остаток высушивали в вакууме. Сырой продукт очищали колоночной хроматографией на силикагеле, элюент 5-10% метанол в дихлорметане, с получением указанного в заголовке соединения в виде твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,31 (s, 3H); 3,35-3,74 (m, 8H); 6,65 (ddd, 1H); 6,79 (d, 1H); 7,13 (dd, 1H); 7,32 (d, 1H); 7,44 (d, 1H); 7,49-7,56 (m, 2H); 7,69 (m, 1H); 8,11 (m, 1H); 8,40 (m, 1H); 8,52 (d, 1H); 8,66 (dd, 1H); 9,06 (s, 1H); 9,24 (m, 1H).
Следующие соединения получали аналогично, используя соответствующий амин (приведенный в скобках).
Пример 4: 4-Метил-N-[2-(2-пиридинил)этил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-(2-аминоэтил)пиридин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,27 (s, 3Н); 2,97 (t, 2H); 3,58 (m, 2H); 7,18 (ddd, 1H); 7,25 (m, 1H); 7,29 (d, 1H); 7,42 (d, 1H); 7,47-7,56 (m, 2H); 7,65 (m, 1H); 8,06 (d, 1H); 8,39 (m, 1H); 8,44-8,51 (m, 3Н); 8,66 (dd, 1H); 9,04 (s, 1H); 9,22 (m, 1H).
Пример 5: 4-Метил-N-[1-(фенилметил)-4-пиперидинил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 4-амино-1-бензилпиперидин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,47-1,63 (m, 2H); 1,69-1,80 (m, 2H); 1,92-2,05 (m, 2H); 2,27 (s, 3Н); 2,73-2,83 (m, 2H); 3,43 (s, 2H); 3,68-3,83 (m, 1H); 7,18-7,33 (m, 6H); 7,42 (d, 1H); 7,49 (ddd, 1H); 7,55 (dd, 1H); 8,10 (m, 1H); 8,14 (d, 1H); 8,37 (m, 1H); 8,49 (d, 1H); 8,65 (dd, 1H); 9,04 (s, 1H); 9,21 (m, 1H).
Пример 6: 4-Метил-N-(4-пиридинилметил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 4-(аминометил)пиридин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,30 (s, 3Н); 4,46 (d, 2H); 7,26 (m, 2H); 7,33 (d, 1H); 7,43 (d, 1H); 7,47 (ddd, 1H); 7,62 (dd, 1H); 8,16 (d, 1H); 8,38 (m, 1H); 8,45 (m, 2H); 8,50 (d, 1H); 8,66 (dd, 1H); 9,03 (t, 1H); 9,08 (s, 1H); 9,23 (m, 1H).
Пример 7: 4-Метил-N-[2-(1-метил-1Н-пиррол-2-ил)этил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-(2-аминоэтил)-1-метилпиррол [Chem. Abstr. Reg. Number: 83732-75-6]. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 2,75 (t, 2H); 3,42 (m, 2H); 3,51 (s, 3Н); 5,76-5,85 (m, 2H); 6,57 (m, 1H); 7,30 (d, 1H); 7,43 (d, 1H); 7,46-7,58 (m, 2H); 8,10 (br, 1H); 8,40 (m, 1H); 8,48-8,55 (m, 2H); 8,64-8,69 (m, 1H); 9,05 (s, 1H); 9,23 (m, 1H).
Пример 8: N-[(4-Метоксифенил)метил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 4-метоксибензиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 3,69 (s, 3Н); 4,37 (d, 2Н); 6,80-6,87 (m, 2H); 7,17-7,23 (m, 2H); 7,31 (d, 1H); 7,42 (d, 1H); 7,47 (ddd, 1H); 7,59 (dd, 1H); 8,11 (d, 1H); 8,38 (m, 1H); 8,49 (d, 1H); 8,66 (dd, 1H); 8,87 (t, 1H); 9,05 (s, 1H); 9,23 (m, 1H).
Пример 9: 4-Метил-N-(2-метилпропил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя изобутиламин (Fluka, Buchs, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 0,85 (d, 6H); 1,81 (m, 1H); 2,27 (s, 3Н); 3,04 (m, 2H); 7,29 (d, 1H); 7,42 (d, 1H); 7,48 (dd, 1H); 7,55 (dd, 1H); 8,07 (d, 1H); 8,31-8,41 (m, 2H); 8,49 (d, 1H); 8,65 (dd, 1H); 9,05 (s, 1H); 9,22 (m, 1H).
Пример 10: 4-Метил-N-(2-морфолиноэтил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 4-(2-аминоэтил)морфолин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 2,33-2,46 (m, 6H); 3,30-3,40 (m, 2H); 3,53 (m, 4H); 7,30 (d, 1H); 7,42 (d, 1H); 7,46-7,57 (m, 2H); 8,06 (d, 1H); 8,30 (m, 1H); 8,38 (m, 1H); 8,49 (d, 1H); 8,66 (dd, 1H); 9,05 (s, 1H); 9,22 (m, 1H).
Пример 11: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[(тетрагидро-2-фуранил)метил]бензамид, используя тетрагидрофурфуриламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,49-1,63 (m, 1H); 1,70-1,93 (m, 3Н); 2,27 (s, 3Н); 3,27 (m, 2H); 3,58 (m, 1H); 3,72 (m, 1H); 3,94 (m, 1H); 7,29 (d, 1H); 7,42 (d, 1H); 7,49 (ddd, 1H); 7,56 (dd, 1H); 8,08 (d, 1H); 8,35-8,45 (m, 2H); 8,49 (d, 1H); 8,66 (dd, 1H); 9,04 (s, 1H); 9,21 (m, 1H).
Пример 12: N-[2-(2,4-Дигидрокси-5-пиримидинил)этил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 5-(2-аминоэтил)-2,4(1Н,3Н)-пиримидиндион [Chem. Abstr. Reg. Number: 221170-25-8]. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,27 (s, 3Н); 2,40 (t, 2H); 3,34 (m, 2H); 7,15 (m, 1H); 7,29 (d, 1H); 7,42 (d, 1H); 7,47-7,55 (m, 2H); 8,07 (d, 1H); 8,35-8,42 (m, 2H); 8,49 (d, 1H); 8,66 (dd, 1H); 9,04 (s, 1H); 9,22 (m, 1H); 10,59 (s, 1H); 11,01 (s, 1H).
Пример 13: N-Циклогексил-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя циклогексиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,00-1,16 (m, 1H); 1,18-1,36 (m, 4H); 1,52-1,85 (m, 5H); 2,27 (s, 3Н); 3,66-3,82 (m, 1H); 7,28 (d, 1H); 7,41 (d, 1H); 7,48 (m, 1H); 7,55 (dd, 1H); 8,06-8,12 (m, 2H); 8,37 (m, 1H); 8,49 (d, 1H); 8,66 (dd, 1H); 9,04 (s, 1H); 9,21 (m, 1H).
Пример 14: N-[(3S)-Гексагидро-2-оксо-1Н-азепин-3-ил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя L(-)-альфа-амино-эпсилон-капролактам [Chem. Abstr. Reg. Number: 21568-87-6]. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,11-1,31 (m, 1H); 1,37-1,82 (m, 3H); 1,83-1,96 (m, 2H); 2,28 (s, 3H); 3,00-3,13 (m, 1H); 3,15-3,30 (m, 1H); 4,58 (m, 1H); 7,32 (d, 1H); 7,43 (d, 1H); 7,51 (ddd, 1H); 7,55 (dd, 1H); 7,84 (m, 1H); 8,08 (d, 1H); 8,13 (d, 1H); 8,40 (m, 1H); 8,50 (d, 1H); 8,66 (dd, 1H); 9,06 (s, 1H); 9,22 (m, 1H).
Пример 15: N-[2-(3,4-Диметоксифенил)этил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-(3,4-диметоксифенил)этиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,27 (s, 3H); 2,75 (t, 2H); 3,43 (m, 2H); 3,67 (s, 6H); 6,70 (dd, 1H); 6,77-6,83 (m, 2H); 7,30 (d, 1H); 7,42 (d, 1H); 7,46-7,57 (m, 2H); 8,07 (d, 1H); 8,36-8,46 (m, 2H); 8,49 (d, 1H); 8,66 (dd, 1H); 9,05 (s, 1H); 9,22 (m, 1H).
Пример 16: Этиловый эфир 2-[[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]амино]-4-тиазолуксусной кислоты, используя этил 2-амино-4-тиазолацетат (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,16 (t, 3H); 2,32 (s, 3H); 3,70 (s, 2H); 4,06 (q, 2H); 7,01 (s, 1H); 7,36 (d, 1H); 7,42-7,54 (m, 2H); 7,82 (d, 1H); 8,34-8,47 (m, 2H); 8,52 (d, 1H); 8,66 (m, 1H); 9,08 (s, 1H); 9,24 (m, 1H); 12,57 (br., 1H).
Пример 17: N-[3-(1Н-Имидазол-1-ил)пропил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 1-(3-аминопропил)имидазол (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,96 (qui, 2H); 2,30 (s, 3H); 3,24 (m, 2H); 4,01 (t, 2H); 6,91 (s, 1H); 7,22 (m, 1H); 7,34 (d, 1H); 7,45 (d, 1H); 7,51 (ddd, 1H); 7,59 (dd, 1H); 7,70 (s, 1H); 8,14 (d, 1H); 8,42 (m, 1H); 8,47 (t, 1H); 8,52 (d, 1H); 8,68 (dd, 1H); 9,10 (s, 1H); 9,25 (m, 1H).
Пример 18: N-(Циклопропилметил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя циклоргорапеметиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 0,17-0,22 (m, 2H); 0,36-0,42 (m, 2H); 0,96-1,06 (m, 1H); 2,28 (s, 3H); 3,11 (m, 2H); 7,31 (d, 1H); 7,43 (d, 1H); 7,50 (ddd, 1H); 7,58 (dd, 1H); 8,10 (d, 1H); 8,40 (m, 1H); 8,47 (t, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,07 (s, 1H); 9,23 (m, 1H).
Пример 19: N-(2-метоксиэтил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-метоксиэтиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 3,23 (s, 3H); 3,36-3,46 (m, 4H); 7,31 (d.lH); 7,43 (d, 1H); 7,51 (ddd, 1H); 7,57 (dd, 1H); 8,10 (d, 1H); 8,38-8,47 (m, 2H); 8,50 (d, 1H); 8,68 (dd, 1H); 9,07 (s, 1H); 9,23 (m, 1H).
Пример 20: 4-Метил-N-[3-(2-оксо-1-пирролидинил)пропил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 1-(3-аминопропил)-2-пирролидинон (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,67 (m, 2H); 1,89 (m, 2H); 2,18 (t, 2H); 2,28 (s, 3Н); 3,19 (m, 4H); 3,32 (m, 2H); 7,30 (d, 1H); 7,42 (d, 1H); 7,49 (ddd, 1H); 7,54 (dd, 1H); 8,09 (d, 1H); 8,31-8,42 (m, 2H); 8,49 (d, 1H); 8,66 (dd, 1H); 9,04 (s, 1H); 9,22 (m, 1H).
Пример 21: N,4-Диметил-N-(фенилметил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя N-бензилметиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 2,86 (s, 3Н); 4,51-4,68 (m, 2H); 7,08-7,35 (m,7H); 7,43 (d, 1H); 7,48 (m, 1H); 7,71 (s, 1H); 8,35-8,54 (m, 2H); 8,67 (m, 1H); 8,97-9,09 (m, 1H); 9,24 (m, 1H).
Пример 22: N-[4-(Ацетиламино)фенил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 4-аминоацетанилид (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,01 (s, 3Н); 2,32 (s, 3Н); 7,38 (d, 1H); 7,45 (d, 1H); 7,47-7,54 (m, 3Н); 7,63-7,71 (m, 3Н); 8,22 (m, 1H); 8,43 (m, 1H); 8,52 (d, 1H); 8,67 (dd, 1H); 9,13 (s, 1H); 9,25 (m, 1H); 9,90 (s, 1H); 10,11 (s, 1H).
Пример 23: N-(4-Метокси-2-метилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 4-метокси-2-метиланилин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,16 (s, 3Н); 2,32 (s, 3Н); 3,73 (s, 3Н); 6,75 (dd, 1H); 6,82 (m, 1H); 7,16 (d, 1H); 7,37 (d, 1H); 7,45 (d, 1H); 7,49 (ddd, 1H); 7,69 (dd, 1H); 8,25 (d, 1H); 8,41 (m, 1H); 8,52 (d, 1H); 8,67 (dd, 1H); 9,12 (s, 1H); 9,25 (m, 1H); 9,69 (s, 1H).
Пример 24: 4-Метил-N-[4-(метилсульфонил)бензил]-3-[[4-(3-пирилинил)-2-пиримидинил]амино]бензамид, используя гидрохлорид 4-метилсульфонилбензиламина (Acros, Morris Plains, NJ). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,30 (s, 3Н); 3,16 (s, 3Н); 4,54 (d, 2H); 7,34 (d, 1H); 7,44 (d, 1H); 7,49 (ddd, 1H); 7,55 (m, 2H); 7,63 (dd, 1H); 7,86 (m, 2H); 8,16 (d, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,67 (dd, 1H); 9,10 (m, 2H); 9,24 (m, 1H).
Пример 25: N-[[4-(Диметиламино)фенил]метил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя дигидрохлорид 4-(диметиламино)бензиламина (Aldrich, Buchs, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 2,82 (s, 6H); 4,32 (d, 2H); 6,64 (m, 2H); 7,11 (m, 2H); 7,31 (d, 1H); 7,43 (d, 1H); 7,48 (ddd, 1H); 7,59 (dd, 1H); 8,12 (d, 1H); 8,39 (m, 1H); 8,50 (d, 1H); 8,68 (dd, 1H); 8,81 (t, 1H); 9,07 (s, 1H); 9,24 (m, 1H).
Пример 26: N-(2-Амино-2-оксоэтил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя гидрохлорид глицинамида (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3Н); 3,78 (d, 2H); 7,02 (s, 1H); 7,30-7,36 (m, 2H); 7,44 (d, 1H); 7,53 (ddd, 1H); 7,61 (dd, 1H); 8,11 (m, 1H); 8,41 (m, 1H); 8,50 (d, 1H); 8,57 (t, 1H); 8,67 (dd, 1H); 9,08 (s, 1H); 9,24 (m, 1H).
Пример 27: Метиловый эфир N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]глицина, используя гидрохлорид глицинметилового эфира (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3Н); 3,63 (s, 3Н); 3,98 (d, 2H); 7,34 (d, 1H); 7,44 (d, 1H); 7,52 (ddd, 1H); 7,59 (dd, 1H); 8,11 (d, 1H); 8,41 (m, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 8,87 (t, 1H); 9,09 (s, 1H); 9,23 (m, 1H).
Пример 28: Метиловый эфир N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]бета-аланина, используя гидрохлорид метилового эфира бета-аланина (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,27 (s, 3Н); 2,57 (t, 2H); 3,46 (m, 2H); 3,57 (s, 3Н); 7,31 (d, 1H); 7,43 (d, 1H); 7,50-7,55 (m, 2H); 8,07 (d, 1H); 8,40 (m, 1H); 8,47 (t, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,07 (s, 1H); 9,23 (m, 1H).
Пример 29: N-[[4-(Аминосульфонил)фенил]метил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя гидрохлорид п-(аминометил)бензолсульфонамида (Sigma, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3Н); 4,51 (d, 2H); 7,30 (s, 2H); 7,34 (d, 1H); 7,43-7,50 (m, 4H); 7,62 (dd, 1H); 7,75 (m, 2H); 8,16 (d, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,06 (t, 1H); 9,09 (s, 1H); 9,24 (m, 1H).
Пример 30: N-(3-Гидроксипропил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 3-амино-1-пропанол (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,65 (qui, 2H); 2,28 (s, 3H); 3,29 (m, 2H); 3,42 (m, 2H); 4,50 (m, 1H); 7,30 (d, 1H); 7,43 (d, 1H); 7,51 (ddd, 1H); 7,56 (dd, 1H); 8,09 (d, 1H); 8,36-8,43 (m, 2H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,07 (s, 1H); 9,23 (m, 1H).
Пример 31: N,N-Диэтил-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя диэтиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,04 (m, 6Н); 2,28 (s, 3H); 3,31 (m, 4H); 7,02 (dd, 1H); 7,27 (d, 1H); 7,44 (d, 1H); 7,51 (ddd, 1H); 7,61 (m, 1H); 8,39 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,01 (s, 1H); 9,23 (m, 1H).
Пример 32: 1,1-Диметилэтиловый эфир N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-(L)-фенилаланина, используя гидрохлорид трет-бутилового эфира L-фенилаланина (Novabiochem (Juro), Lucerne, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,32 (s, 9H); 2,28 (s, 3H); 3,07 (m, 2H); 4,53 (m, 1H); 7,13-7,29 (m, 5H); 7,32 (d, 1H); 7,44 (d, 1H); 7,50 (ddd, 1H); 7,55 (dd, 1H); 8,05 (m, 1H); 8,39 (m, 1H); 8,49 (d, 1H); 8,63 (d, 1H); 8,67 (dd, 1H); 9,08 (s, 1H); 9,23 (m, 1H).
Пример 33: 1,1-Диметилэтиловый эфир N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-(D)-аланина, используя гидрохлорид трет-бутилового эфира D-аланина (Novabiochem (Juro), Lucerne, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 1,34 (d, 3H); 1,38 (s, 9H); 2,28 (s, 3H); 4,32 (m, 1H); 7,33 (d, 1H); 7,43 (d, 1H); 7,51 (ddd, 1H); 7,61 (dd, 1H); 8,14 (m, 1H); 8,40 (m, 1H); 8,50 (m, 1H); 8,58 (d, 1H); 8,67 (dd, 1H); 9,08 (s, 1H); 9,23 (m, 1H).
Пример 34: N-[1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-пиперидинил]бензамид, используя N-4-пиперидинилбензамид (Maybridge Chemical Co. Ltd). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,49 (m, 2H); 1,68-1,94 (m, 2H); 2,30 (s, 3H); 2,92 (m, 1H); 3,16 (m, 1H); 3,79 (m, 1H); 4,05 (m, 1H); 4,42 (m, 1H); 7,08 (dd, 1H); 7,31 (d, 1H); 7,41-7,54 (m, 5H); 7,63 (m, 1H); 7,79-7,84 (m, 2H); 8,28 (d, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,66 (dd, 1H); 9,06 (s, 1H); 9,24 (m, 1H).
Пример 35: 4-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]морфолин, используя морфолин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3Н); 3,47 (m, 8H); 7,10 (dd, 1H); 7,30 (d, 1H); 7,44 (m, 1H); 7,52 (ddd, 1H); 7,65 (m, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,69 (dd, 1H); 9,05 (s, 1H); 9,23 (m, 1H).
Пример 36: 1-(4-Метоксифенил)-4-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]пиперазин, используя 1-(4-метоксифенил)пиперазин (Emka Chemie, Neufahrn, Germany). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,30 (s, 3Н); 2,87-3,08 (m, 4H); 3,50-3,75 (m, 4H); 3,67 (s, 3Н); 6,78-6,88 (m, 4H); 7,12 (dd, 1H); 7,31 (d, 1H); 7,44 (m, 1H); 7,51 (ddd, 1H); 7,67 (m, 1H); 8,38 (m, 1H); 8,52 (m, 1H); 8,67 (dd, 1H); 9,06 (s, 1H); 9,23 (m, 1H).
Пример 37: 1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-(4-пиридинил)пиперазин, используя 1-(4-пиридил)пиперазин (Emka Chemie, Neufahrn, Germany). Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,31 (s, 3Н); 3,30 (m, 4H); 3,59 (m, 4H); 6,77 (m, 2H); 7,14 (dd, 1H); 7,32 (d, 1H); 7,45 (d, 1H); 7,52 (ddd, 1H); 7,70 (m, 1H); 8,16 (m, 2H); 8,41 (m, 1H); 8,53 (d, 1H); 8,67 (dd, 1H); 9,07 (s, 1H); 9,24 (m, 1H).
Пример 38: 1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-(пиразинил)пиперазин, используя 1-(2-пиразинил)пиперазин (Emka Chemie, Neufahrn, Germany). Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,31 (s, 3Н); 3,57 (m, 8H); 7,14 (dd, 1H); 7,32 (d, 1H); 7,45 (d, 1H); 7,51 (ddd, 1H); 7,72 (m, 1H); 7,85 (d, 1H); 8,08 (d, 1H); 8,29 (d, 1H); 8,40 (m, 1H); 8,53 (d, 1H); 8,65 (dd, 1H); 9,06 (s, 1H); 9,24 (m, 1H).
Пример 39: 1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-(фенилметил)пиперазин, используя 1-бензилпиперазин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,21-2,42 (m, 4H); 2,28 (s, 3Н); 3,34-3,63 (m, 6H); 7,07 (dd, 1H); 7,21-7,34 (m, 6H); 7,43-7,50 (m, 2H); 7,63 (m, 1H); 8,38 (m, 1H); 8,50 (d, 1H); 8,65 (dd, 1H); 9,03 (s, 1H); 9,22 (m, 1H).
Пример 40: 1-Циклопентил-4-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]пиперазин, используя 1-циклопентилпиперазин (Emka Chemie, Neufahrn, Germany). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,20-1,31 (m, 2H); 1,39-1,62 (m, 4H); 1,65-1,75 (m, 2H); 2,18-2,47 (m, 8H); 3,27-3,62 (m, 4H); 7,08 (dd, 1H); 7,29 (d, 1H); 7,44 (d, 1H); 7,51 (ddd, 1H); 7,62 (m, 1H); 8,38 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,04 (s, 1H); 9,22 (m, 1H).
Пример 41: 4-{{4-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-1-пиперазинил}ацетил}морфолин, используя 4-[2-(пиперазин-1-ил)ацетил]морфолин (Emka Chemie, Neufahrn, Germany). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3Н); 2,31-2,49 (m, 4H); 3,16 (s, 2H); 3,37-3,60 (m, 12H); 7,07 (dd, 1H); 7,29 (d,lH); 7,45 (d, 1H); 7,52 (ddd, 1H); 7,65 (m, 1H); 8,39 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,04 (s, 1H); 9,23 (m, 1H).
Пример 42: 1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-[2-оксо-2-(1-пирролидинил)этил]пиперазин, используя 1-[2-(пиперазин-1-ил)-ацетилпирролидин (Emka Chemie, Neufahrn, Germany). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,73 (m, 2H); 1,83 (m, 2H); 2,29 (s, 3Н); 2,43 (m, 4H); 3,09 (s, 2H); 3,25 (m, 2H); 3,34-3,63 (m, 6H); 7,07 (dd, 1H); 7,29 (d, 1H); 7,45 (d, 1H); 7,52 (ddd, 1H); 7,64 (m, 1H); 8,39 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,04 (s, 1H); 9,22 (m, 1H).
Пример 43: Этиловый эфир 4-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-1-пиперазинкарбоновой кислоты, используя этил 1-пиперазинкарбоксилат (Aldrich, Buchs, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 1,16 (t, 3Н); 2,29 (s, 3Н); 3,19-3,63 (m, 8H); 4,02 (q, 2H); 7,10 (dd, 1H); 7,30 (d, 1H); 7,45 (d, 1H); 7,52 (ddd, 1H); 7,66 (m, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,06 (s, 1H); 9,23 (m, 1H).
Пример 44: 2-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-1,2,3,4-тетрагидроизохинолин, используя 1,2,3,4-тетрагидроизохинолин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,31 (s, 3Н); 2,79 (m, 2H); 3,57-3,90 (m, 2H); 4,58-4,79 (m, 2H); 7,08-7,23 (m, 5H); 7,32 (d, 1H); 7,42-7,50 (m, 2H); 7,70 (m, 1H); 8,39 (m, 1H); 8,51 (d, 1H); 8,67 (dd, 1H); 9,05 (s, 1H); 9,24 (m, 1H).
Пример 45: N,N-бис(2-Метоксиэтил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя бис(2-метоксиэтил)амин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,28 (s, 3Н); 3,09 (br.s, 3Н); 3,23 (br.s, 3Н); 3,47 (m, 8H); 7,04 (dd, 1H); 7,27 (d, 1H); 7,44 (d, 1H); 7,51 (ddd, 1H); 7,62 (m, 1H); 8,39 (m, 1H); 8,51 (d, 1H); 8,68 (dd, 1H); 9,01 (s, 1H); 9,23 (m, 1H).
Пример 46: 1'-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-1,4'-биспиперидин, используя 4-пиперидинопиперидин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,21-1,50 (m, 8H); 1,51-1,83 (m, 2H); 2,29 (s, 3Н); 2,39 (m, 4H); 2,68 (m, 1H); 2,95 (m, 1H); 3,71 (m, 1H); 4,42 (m, 1H); 7,07 (dd, 1H); 7,28 (d, 1H); 7,45 (d, 1H); 7,52 (ddd, 1H); 7,63 (m, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,67 (dd, 1H); 9,03 (s, 1H); 9,23 (m, 1H).
Пример 47: Этиловый эфир N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-N-(фенилметил)глицина, используя этиловый эфир N-бензилглицина (Fluka, Buchs, Switzerland). 1Н-ЯМР (300 МГц, ДМСО-d6, δ): 0,97-l,20 (m, 3Н); 2,27 (s, 3Н); 3,90-4,12 (m, 4H); 4,58-4,68 (m, 2H); 7,07 (m, 1H); 7,15-7,34 (m, 6H); 7,38-7,53 (m, 2H); 7,65-7,74 (m, 1H); 8,35-8,51 (m, 2H); 8,66 (dd, 1H); 8,96-9,04 (m, 1H); 9,22 (m, 1H).
Пример 48: N-(3-Хлорфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 3-хлоранилин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,33 (s, 3Н); 7,14 (m, 1H); 7,36 (m, 1H); 7,41 (d, 1H); 7,46 (d, 1H); 7,49 (ddd, 1H); 7,68-7,73 (m, 2H); 7,95 (m, 1H); 8,25 (m, 1H); 8,43 (m, 1H); 8,53 (d, 1H); 8,66 (dd, 1H); 9,15 (s, 1H); 9,26 (m, 1H); 10,33 (s, 1H).
Пример 49: N-(2,2-Дифенилэтил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2,2-дифенилэтиламин (Aldrich, Buchs, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 2,24 (s, 3Н); 3,87 (m, 2H); 4,41 (m, 1H); 7,12-7,17 (m, 2H); 7,23-7,31 (m, 9H); 7,41-7,44 (m, 2H); 7,51 (ddd, 1H); 7,97 (m, 1H); 8,37-8,44 (m, 2H); 8,48 (d, 1H); 8,68 (dd, 1H); 9,05 (s, 1H); 9,23 (m, 1H).
Пример 50: N-(2,3-Дигидро-1Н-инден-1-ил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 1-аминоиндан (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,90-2,01 (m, 1H); 2,29 (s, 3Н); 2,43 (m, 1H); 2,77-2,86 (m, 1H); 2,91-2,98 (m, 1H); 5,56 (m, 1H); 7,08-7,25 (m, 4H); 7,31 (d, 1H); 7,43 (d, 1H); 7,50 (ddd, 1H); 7,64 (dd, 1H); 8,20 (m, 1H); 8,40 (m, 1H); 8,50 (d, 1H); 8,68-8,72 (m, 2H); 9,08 (s, 1H); 9,24 (m, 1H).
Пример 51: N-(Дифенилметил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя альфа-аминодифенилметан (Fluka, Buchs, Switzerland) 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3Н); 6,41 (d, 1H); 7,20-7,36 (m, 11H); 7,43 (d, 1H); 7,46 (ddd, 1H); 7,67 (dd, 1H); 8,18 (m, 1H); 8,38 (m, 1H); 8,50 (d, 1H); 8,68 (dd, 1H); 9,10 (s, 1H); 9,20 (d, 1H); 9,24 (m, 1H).
Пример 52: 4-Метил-N-[2-(1-пиперидинил)этил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 1-(2-аминоэтил)пиперидин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,30-1,38 (m, 2H); 1,41-1,48 (m, 4H); 2,28 (s, 3Н); 2,31-2,41 (m, 6H); 3,33 (m, 2H); 7,31 (d, 1H); 7,44 (d, 1H); 7,51 (ddd, 1H); 7,55 (dd, 1H); 8,08 (m, 1H); 8,28 (t, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,67 (dd, 1H); 9,07 (s, 1H); 9,24 (m, 1H).
Пример 53: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-(5,6,7,8-тетрагидро-1-нафталенил)бензамид, используя 5,6,7,8-тетрагидро-1-нафтиламин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,63-1,71 (m, 4H); 2,32 (s, 3Н); 2,60 (m, 2H); 2,74 (m, 2H); 6,96 dd, 1H); 7,07-7,14 (m, 2H); 7,37 (d, 1H); 7,45 (d, 1H); 7,49 (ddd, 1H); 7,69 (dd, 1H); 8,25 (m, 1H); 8,41 (m, 1H); 8,52 (d, 1H); 8,67 (dd, 1H); 9,12 (s, 1H); 9,25 (m, 1H); 9,65 (br.s).
Пример 54: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[[4-(трифторметил)фенил]метил]бензамид, используя 4-(трифторметил)бензиламин (Aldrich, Buchs, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 2,30 (s, 3H); 4,53 (d, 2H); 7,34 (d, 1H); 7,44 (d, 1H); 7,46-7,53 (m, 3H); 7,62 (dd, 1H); 7,66 (m, 2H); 8,16 (m, 1H); 8,40 (m, 1H); 8,51 (d, 1H); 8,67 (dd, 1H); 9,08 (t, 1H); 9,10 (s, 1H); 9,24 (m, 1H).
Пример 55: 4-Метил-N-[(5-метилпиразинил)метил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-(аминометил)-5-метилпиразин (TCI-JP, Distrib. Zürich, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,29 (s, 3H); 2,45 (s, 3H); 4,54 (d, 2H); 7,33 (d, 1H); 7,44 (d, 1H); 7,49 (ddd, 1H); 7,62 (dd, 1H); 8,14 (m, 1H); 8,40 (m, 1H); 8,45 (m, 2H); 8,50 (d, 1H); 8,66 (dd, 1H); 9,07 (t, 1H); 9,09 (s, 1H); 9,23 (m, 1H).
Пример 56: N-(2-Этоксиэтил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-этоксиэтиламин (TCI-JP, Distrib. Zurich, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,07 (t, 3H); 2,28 (s, 3H); 3,30-3,49 (m, 6H); 7,31 (d, 1H); 7,43 (d, 1H); 7,51 (ddd, 1H); 7,57 (dd, 1H); 8,09 (m, 1H); 8,38-8,45 (m, 2H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,07 (s, 1H); 9,24 (m, 1H).
Пример 57: 4-Метил-N-[2-(2-оксо-l-имидазолидинил)этил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 1-(2-аминоэтил)имидазолидин-2-он [Chem. Abstr. Reg. Number: 6281-42-1]. 1H-ЯМР (400 МГц, ДМСО-d6, δ): 2,27 (s, 3H); 3,13-3,22 (m, 4H); 3,30-3,40 (m. 4H); 6,27 (br.s, 1H); 7,30 (d, 1H); 7,43 (d, 1H); 7,49-7,56 (m, 2H); 8,08 (d, 1H); 8,40 (m, 1H); 8,45 (t, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,06 (s, 1H); 9,23 (m, 1H).
Пример 58: 4-Метил-N-(5-метил-2-пиридинил)-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-амино-5-пиколин (Aldrich, Buchs, Switzerland). 1H-ЯМР (400 МГц, ДМСО-d6, δ): 2,26 (s, 3H); 2,32 (s, 3H); 7,35 (d. 1H); 7,45 (d, 1H); 7,49 (ddd, 1H); 7,64 (dd, 1H); 7,77 (dd, 1H); 8,07 (d, 1H); 8,18 (m, 1H); 8,31 (d, 1H); 8,43 (m, 1H); 8,52 (d, 1H); 8,66 (dd, 1H); 9,08 (s, 1H); 9,25 (m, 1H); 10,58 (s, 1H).
Пример 59: 1-[4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]-4-фенил-4-пиперидинол, используя 4-гидрокси-4-фенилпиперидин (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,45-1,73 (m, 2H); 1,88 (m, 2H); 2,28 (s, 3H); 3,15 (m, 1H); 3,47 (m, 1H); 3,64 (m, 1H); 4,39 (m, 1H); 5,14 (s, 1H); 7,14 (dd, 1H); 7,19 (m, 1H); 7,26-7,31 (m, 3H); 7,43 (d, 1H); 7,45-7,51 (m, 3H); 7,69 (d, 1H); 8,40 (m, 1H); 8,48 (d, 1H); 8,67 (dd, 1H); 9,03 (s, 1H); 9,24 (m, 1H).
Пример 60: N-(3-Бензоилфенил)-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 3-аминобензофенон (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,32 (s, 3H); 7,39 (d, 1H); 7,43-7,58 (m, 6H); 7,67 (m, 1H); 7,70-7,77 (m, 3H); 8,13 (m, 1H); 8,20 (m, 1H); 8,27 (m, 1H); 8,42 (m, 1H); 8,52 (d, 1H); 8,66 (dd, 1H); 9,14 (s, 1H); 9,25 (m, 1H); 10,41 (s, 1H).
Пример 61: 1,1-Диметилэтиловый эфир N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]глицина, используя гидрохлорид трет-бутилового эфира глицина (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,40 (s, 9H); 2,29 (s, 3H); 3,86 (d, 2H); 7,33 (d, 1H); 7,43 (d, 1H); 7,51 (ddd, 1H); 7,58 (dd, 1H); 8,10 (d, 1H); 8,40 (m, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 8,75 (t, 1H); 9,08 (s, 1H); 9,23 (m, 1H).
Пример 62: Этиловый эфир 4-[[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]амино]бензолуксусной кислоты, используя этил 4-аминофенилацетат (Maybridge Chemical Co. Ltd.). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,16 (t, 3H); 2,32 (s, 3H); 3,60 (s, 2H); 4,06 (q, 2H); 7,21 (m, 2H); 7,38 (d, 1H); 7,45 (d, 1H); 7,48 (ddd, 1H); 7,70 (m, 3H); 8,23 (m, 1H); 8,41 (m, 1H); 8,52 (d, 1H); 8,66 (dd, 1H); 9,13 (s, 1H); 9,25 (m, 1H); 10,16 (s, 1H).
Пример 63: 4-Метил-N-[3-(метилфениламино)пропил]-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя N-(3-аминопропил)-N-метиланилин (TCI-JP, Distrib. Zürich, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,73 (qui, 2H); 2,28 (s, 3H); 2,84 (s, 3H); 3,24-3,37 (m, 4H); 6,55 (m, 1H); 6,65 (m, 2H); 7,10 (m, 2H); 7,31 (d, 1H); 7,43 (d, 1H); 7,47 (ddd, 1H); 7,55 (dd, 1H); 8,10 (d, 1H); 8,37-8,44 (m, 2H); 8,50 (d, 1H); 8,65 (dd, 1H); 9,06 (s, 1H); 9,23 (m, 1H).
Пример 64: Этиловый эфир 1-[[3-[[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]амино]фенил]метил]-4-пиперидинкарбоновой кислоты, используя этил 1-(3-аминобензил)пиперидин-4-карбоксилат (Maybridge Chemical Co. Ltd.). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,14 (t, 3H); 1,49-1,61 (m, 2H); 1,72-1,80 (m, 2H); 1,92-2,02 (m, 2H); 2,27 (m, 1H); 2,32 (s, 3H); 2,74 (m, 2H); 3,40 (s, 2H); 4,03 (q, 2H); 6,98 (d, 1H); 7,25 (m, 1H); 7,38 (d, 1H); 7,43-7,51 (m, 2H); 7,66-7,73 (m, 3H); 8,25 (s, 1H); 8,42 (m, 1H); 8,52 (d, 1H); 8,65 (dd, 1H); 9,12 (s, 1H); 9,25 (m, 1H); 10,14 (s, 1H).
Пример 65: Диэтиловый эфир [[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензоил]амино]пропандионовой кислоты, используя гидрохлорид диэтиламиномалоната (Aldrich, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,19 (t, 6H); 2,30 (s, 3H); 4,10-4,22 (m, 4H); 5,27 (d, 1H); 7,35 (d, 1H); 7,44 (d, 1H); 7,51 (ddd, 1H); 7,63 (dd, 1H); 8,15 (m, 1H); 8,40 (m, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,11 (s, 1H); 9,21-9,25 (m, 2H).
Пример 66: N-[2-[бис(1-Метилэтил)амино]этил]-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид, используя 2-диизопропиламиноэтиламин (Fluka, Buchs, Switzerland). 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 0,95 (m, 12H); 2,28 (s, 3H); 2.49 (m, 2H); 2,94 (m, 2H); 3,17 (m, 2H); 7,30 (d, 1H); 7,43 (d, 1H); 7,50 (ddd, 1H); 7,54 (dd, 1H); 8,09 (br.s, 1H); 8,27 (m, 1H); 8,40 (m, 1H); 8,50 (d, 1H); 8,67 (dd, 1H); 9,06 (s, 1H); 9,23 (m, 1H).
Пример 67: N-[3-(Диэтиламино)фенил1-4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензамид
Раствор, содержащий ~50% пропилфосфонового ангидрида в N,N-диметилформамиде (Fluka, Buchs, Switzerland; 674 мкл, ~1,05 ммоль), добавляли в течение 20 минут к перемешиваемой смеси 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты (214,4 мг, 0,7 ммоль), N,N-диэтил-1,3-бензолдиамина (115 мг, 0,7 ммоль) и триэтиламина (776 мкл, 5,6 ммоль) в 2 мл N-диметилформамида. После перемешивания в течение 24 часов при комнатной температуре смесь обрабатывали полунасыщенным водным раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Растворитель упаривали при пониженном давлении и остаток высушивали в вакууме. Сырой продукт очищали хроматографией на силикагеле, элюент 2% метанол в дихлорметане и перекристаллизовывали из ацетона с получением указанного в заголовке соединения в виде кристаллического твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 1,07 (t, 6H); 2,31 (s, 3H); 3,29 (m, 4H); 6,38 (m, 1H); 7,06 (m, 2H); 7,11 (m, 1H); 7,36 (d, 1H); 7,43-7,50 (m, 2H); 7,67 (m, 1H); 8,21 (m, 1H); 8,43 (m, 1H); 8,51 (d, 1H); 8,66 (dd, 1H); 9,12 (s, 1H); 9,24 (m, 1H); 9,90 (s, 1H).
Пример 68: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[[3-[(1-гидрокси-1-метилэтил)1-5-(1,1,1-трифторметил)фенил]метил]бензамид
Диэтилцианофосфонат (Aldrich, Buchs, Switzerland; 0,33 мл, 2,0 ммоль) добавляли к перемешиваемой смеси 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты (306 мг, 1,0 ммоль), 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина (220 мг, 1,0 ммоль) и триэтиламина (560 мкл, 4,0 ммоль) в 5 мл N,N-диметилформамида при 10°С. После перемешивания в течение 3 часов при 60°С смесь обрабатывали насыщенным водным раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Объединенные экстракты высушивали (MgSO4), отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который перекристаллизовывали из этилацетата с получением указанного в заголовке соединения в виде кристаллического твердого вещества, tпл 253-258°С.
Пример 69: 3-[[4-(3-Пиридинил)-2-пиримидинил]амино]-N-[(4-метил-1-пиперазинил)метил]бензамид
Диэтилцианофосфонат (Aldrich, Buchs, Switzerland; 0,50 мл, 3,0 ммоль) добавляли к перемешиваемой смеси 3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты (438 мг, 1,5 ммоль), 4-[(4-метил-1-пиперазинил)метил]бензоламина (308 мг, 1,5 ммоль) и триэтиламина (840 мкл, 3,0 ммоль) в 10 мл N-диметилформамида при 10°С. После перемешивания в течение 12 часов при 60°С смесь обрабатывали водным раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Объединенные экстракты промывали водой и растворитель упаривали при пониженном давлении с получением остатка. Остаток суспендировали в воде и отфильтровывали с получением сырого продукта, который перекристаллизовывали из смеси тетрагидрофуран-этилацетат с получением N-[3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[(4-метил-1-пиперазинил)метил]бензамида в виде кристаллического твердого вещества, tпл 220-224°С.
Пример 69а: Мононитрат метилового эфира 3-[(аминоиминометил)амино]-4-метилбензойной кислоты
Используя процедуру, описанную в примере 1а, но с метиловым эфиром 3-аминобензойной кислоты (Fluka, Buchs, Switzerland) вместо этилового эфира 3-амино-4-метилбензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 170-172°С.
Пример 69b: Метиловый эфир 3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты
Используя процедуру, описанную в примере 1b, но с промежуточным соединением примера 69а вместо мононитрата этилового эфира 4-метил-3-[(аминоиминометил)амино]-4-метилбензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 195-200°С.
Пример 69с: 3-[[4-(3-Пиридинил)-2-пиримидинил]амино]бензойная кислота
Используя процедуру, описанную в примере 1с, но с промежуточным соединением примера 69b вместо этилового эфира 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 285-293°C.
Пример 70: 3-[[4-(3-Пиридинил)-2-пиримидинил]амино]-N-[(3-(1-гидрокси-1-метилэтил)-5-(1,1,1-трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но с 3-(1-гидрокси-1-метилэтил)-5-(1,1,1-трифторметил)бензоламином вместо 4-[(4-метил-1-пиперазинил)метил]бензоламина, получали 3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[(3-(1-гидрокси-1-метилэтил)-5-(1,1,1-трифторметил)фенил]бензамид в виде кристаллического твердого вещества, tпл 213-215°С.
Пример 71: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[3-(1Н-имидазол-1-ил)пропокси]фенил] бензамид
Используя процедуру, описанную в примере 3, но применяя 3-[3-(1Н-имидазол-1-ил)пропокси]бензоламин (Takao Nishi и др., JP 10182459) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,12-2,21 (m, 2H); 2,33 (s, 3H); 3,87 (t, 2H); 4,13 (t, 2H); 6,66 (dd, 1H); 6,87 (s, 1H); 7,15-7,26 (m, 2H); 7,32-7,42 (m, 2H); 7,44-7,52 (m, 3H); 7,61 (s, 1H); 7,70 (d, 1H); 8,24 (s, 1H); 8,43 (d, 1H); 8,53 (d, 1H); 8,67 (d, 1H); 9,13 (s, 1H); 9,26 (br. s, 1H); 10,13 (s, 1H).
Пример 72: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[2-(1Н-имидазол-1-ил)этокси]фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 3-[2-(1Н-имидазол-1-ил)этокси]бензоламин (Rolf Paul и др., Journal of Medicinal Chemistry (1993), 36 (19), 2716-25) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 2,34 (s, 3H); 4,22 (t, 2H); 4,37 (t, 2H); 6,68 (dd, 1H); 6,90 (s, 1H); 7,21-7,27 (m, 2H); 7,36-7,43 (m, 2H); 7,46-7,53 (m, 3H); 7,67-7,74 (m, 2H); 8,25 (br. s, 1H); 8,44 (dt, 1H); 8,54 (d, 1H); 8,68 (dd, 1H); 9,15 (s, 1H); 9,27 (br. d, 1H); 10,15 (s, 1H).
Пример 73: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(этиламино)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя N-этил-2-(трифторметил)-1,4-бензолдиамин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 178-180°С.
Анилин получали следующим образом.
Пример 73а: N-этил-2-(трифторметил)-1,4-бензолдиамин
Смесь 2-бром-5-нитробензотрифторида (Lancaster Synthesis, GmbH; 5,4 г, 20 ммоль) и раствор этиламина в этаноле (50 мл 2М, 100 ммоль) нагревали при 80°С в течение 18 часов в стальном сосуде под давлением. Смесь затем охлаждали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент 20% этилацетат в гексане) с получением N-этил-4-нитро-6-(трифторметил)бензоламина в виде желтого масла. Этот продукт растворяли в этаноле (180 мл) и гидрировали при атмосферном давлении над никелем Ренея (0,5 г) при 45°С. Рассчетное количество водорода подавали в течение 50 часов. Смесь затем отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали хроматографией (силикагель; элюент 50% этилацетат в гексане) и перекристаллизовывали из смеси эфир-гексан с получением указанного в заголовке соединения в виде бежевого кристаллического твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6): 1,11 (t, 3H), 3,05 (m, 2Н), 4,18 (br t, 1H), 4,66 (br.s, 2H), 6,58-6,64 (m, 1H) и 6,68-6,75 (m, 2H).
Пример 74: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(диэтиламино)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя N,N-диэтил-2-(трифторметил)-1,4-бензолдиамин (Toshio Niwa, DE 3524519) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 128-131°С.
Пример 75: (±)-4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-[(2-гидроксипропил)амино]-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя (±)-1-[[4-амино-2-(трифторметил)фенил]амино]-2-пропанол (Tsutomu Mano, EP 299497) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 184-186°С.
Пример 76: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-[бис(2-метоксиэтил)амино]-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя N,N-бис(2-метоксиэтил)-2-(трифторметил)-1,4-бензолдиамин (Toshio Niwa, DE 3524519) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 156-157°С.
Пример 77: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(4-метил-1-пиперазинил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 4-(4-метил-1-пиперазинил)-3-(трифторметил)бензоламин (Anthony David Baxter, WO 0119800) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 214-217°С.
Пример 78: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(1-пиперидинил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 4-(1-пиперидинил)-3-(трифторметил)бензоламин (Leping Li, WO 0151456) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 201-202°С.
Пример 79: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(1-пирролидинил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 4-(1-пирролидинил)-3-(трифторметил)бензоламин (Steven Lee Bender WO 0153274) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 129-130°С.
Пример 80: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(4-морфолинил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 4-(4-морфолинил)-3-(трифторметил)бензоламин (Steven Lee Bender WO 0153274) вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 216-218°С.
Пример 81: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-фенил-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 4-(фенил)-3-(трифторметил)бензоламин вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 172-174°С.
Анилин получали следующим образом.
Пример 81а: 4-(Фенил)-3-(трифторметил)бензоламин
Фенилборную кислоту (Aldrich, Buchs, Switzerland; 2,7 г, 22 ммоль), ацетат палладия II (0,225 г, 1 ммоль), три-о-толилфосфин (0,608 г, 2 ммоль) и водный раствор карбоната калия (50 мл 1 М) добавляли к перемешиваемому раствору 2-бром-5-нитробензотрифторида (Lancaster Synthesis, GmbH; 5,4 г, 20 ммоль) в диметилформамиде (200 мл) и нагревали при 120°С под атмосферой аргона в течение 1 ч. Смесь затем упаривали досуха при пониженном давлении и остаток обрабатывали водой (100 мл) и экстрагировали этилацетатом (3×80 мл). Объединенные экстракты промывали (соляным раствором), высушивали (MgSO4), отфильтровывали и растворитель упаривали при пониженном давлении с получением 4'-нитро-2'-(трифторметил)-[1,11-бифенила]. Бифенил растворяли в этаноле (200 мл) и гидрировали при атмосферном давлении над никелем Ренея (2 г) при 22°С. Рассчетное количество водорода подавали в течение 11 часов. Смесь затем отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали хроматографией (силикагель; элюент этилацетат) с получением указанного в заголовке соединения в виде коричневого масла. 1Н-ЯМР (400 МГц, ДМСО-d6): 5,62 (br.s, 2Н), 6,80 (dd, 1Н), 6,96 (d, 1H), 6,99 (d, 1H), 7,19-7,23 (m, 2H), и 7,29-7,39 (m, 3H).
Пример 82: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[4-(3-пиридинил)-3-(трифторметил)фенил]метил]бензамид
Используя процедуру, описанную в примере 69, но применяя 4-(3-пиридинил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 276-280°С.
Анилин получали следующим образом.
Пример 82а: 4-(3-Пиридинил)-3-(трифторметил)бензоламин
Перемешиваемый раствор 2-бром-5-нитробензотрифторида (Lancaster Synthesis, GmbH; 3,37 г, 12,5 ммоль) и 3-(три-н-бутилстаннил)пиридина (Maybridge Chemical Co. Ltd., England; 5,0 г, 13,5 ммоль) в ксилоле (75 мл) насыщали аргоном в течение 10 минут при 20°С. Затем добавляли тетракис(трифенилфосфин)палладий (0) (1,4 г, 1,25 ммоль) и полученную смесь нагревали при 130°С в течение 24 часов под атмосферой аргона. Смесь затем охлаждали, обрабатывали водным раствором гидроксида натрия (150 мл 0,1 М) и насыщали воздухом в течение 2 часов. Порлученную смесь затем разбавляли этилацетатом (200 мл) и отфильтровывали. Органическую фазу затем последовательно промывали водой (2×80 мл) и насыщенным водным хлоридом натрия (1×80 мл), высушивали (MgSO4), отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент 50% этилацетат в гексане) с получением 3-[(4-нитро-3-(трифторметил)фенил]пиридина. Этот продукт растворяли в этаноле (200 мл) и гидрировали при атмосферном давлении над никелем Ренея (0,23 г) при 22°С. Рассчетное количество водорода подавали в течение 24 часов. Смесь затем отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали хроматографией (силикагель; элюент 50% этилацетат в гексане) и перекристаллизовывали из смеси эфир-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического твердого вещества, tпл 92-93°С.
Пример 83: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 4-(1Н-имидазол-1-ил)-3-(трифторметил)бензоламин (Steven Lee Bender WO 0153274) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 226-229°С.
Пример 84: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(2,4-диметил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 4-(2,4-диметил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде аморфного твердого вещества.
Анилин получали следующим образом.
Пример 84а: 4-(2,4-диметил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин
Смесь 2-бром-5-нитробензотрифторида (Lancaster Synthesis, GmbH; 6,0 г, 22 ммоль) и 2,4-диметилимидазола (10,6 г, 110 ммоль) нагревали при 120°С в течение 36 часов под атмосферой аргона. Смесь затем охлаждали и остаток обрабатывали водой (150 мл) и экстрагировали этилацетатом (3×80 мл). Объединенные экстракты промывали (соляным раствором), высушивали (MgSO4), отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент этилацетат), с получением 1-[4-нитро-2-(трифторметил)фенил]-1Н-имидазола в виде желтого кристаллического твердого вещества. Этот продукт растворяли в этаноле (290 мл) и гидрировали при атмосферном давлении над никелем Ренея (1,15 г) при 25°С. Рассчетное количество водорода подавали в течение 14 часов. Смесь затем отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали перекристаллизацией из смеси эфир-гексан с получением указанного в заголовке соединения в виде кристаллического твердого вещества, tпл 163-164°С.
Пример 85: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 4-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 154-163°С.
Анилин получали следующим образом.
Пример 85а: 4-(4-Метил-1Н-имидазол-1-ил)-3-(трифторметил)-бензоламин
Используя процедуру, описанную в примере 84а, но применяя 4(5)-метил-1Н-имидазол вместо 2,4-диметилимидазола, получали указанное в заголовке соединение в виде бежевого кристаллического твердого вещества, tпл 141-143°С.
Пример 86: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[4-(2-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 4-(2-метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 154-163°С.
Анилин получали следующим образом.
Пример 86а: 4-(2-Метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин
Используя процедуру, описанную в примере 84а, но применяя 2-метил-1Н-имидазол вместо 2,4-диметилимидазола, получали указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества, tпл 117-119°С.
Пример 87: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-(4-морфолинил)-5-[(метиламино)карбонил1фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 3-амино-5-(4-морфолинил)-N-(метил)бензамид вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 153-156°С.
Анилин получали следующим образом.
Пример 87а: 3-Бром-5-нитробензойная кислота, 1,1-диметилэтиловый эфир
Раствор п-бутиллития в гексане (12,8 мл 2,5 М, 32 ммоль) добавляли при перемешивании к трет-бутанолу (46 мл) при 25°С под атмосферой аргона. Через 30 мин смесь по каплям обрабатывали раствором 3-бром-5-нитробензоилхлорида (J. Mindl, Collect. Czech. Chem. Commun. (1973), 38, 3496-505; 32 ммоль) в сухом ТГФ (40 мл) и перемешивали в течение 17 ч. Смесь затем обрабатывали эфиром (250 мл) и промывали соляным раствором. Эфирный раствор высушивали (MgSO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент 20% этилацетат в гексане) и перекристаллизовывали из смеси эфир-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического твердого вещества, tпл 77-78°С.
Пример 87b: 3-(4-Морфолинил)-5-нитробензойная кислота, 1,1-диметилэтиловый эфир
Перемешиваемую смесь 3-бром-5-нитробензойной кислоты, 1,1-диметилэтилового эфира (пример 86а; 3,02 г, 10 ммоль) и морфолина (1,22 мл, 14 ммоль) в толуоле (50 мл) обрабатывали трет-бутилатом натрия (1,34 г, 14 ммоль), три-трет-бутилфосфином (3 мл, 1,5 ммоль) и трис-(дибензилиденацетон)дипалладием[0] (0,45 г, 0,5 ммоль) под атмосферой аргона и затем нагревали при 60°С в течение 18 ч. Смесь разбавляли этилацетатом (150 мл), отфильтровывали, промывали соляным раствором (2×50 мл), высушивали (MgSO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент 15% этилацетат в гексане) и перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического твердого вещества, tпл 116-118°C.
Пример 87с: 3-(4-Морфолинил)-5-нитробензойная кислота, метиловый эфир
Смесь 3-(4-морфолинил)-5-нитробензойной кислоты, 1,1-диметилэтилового эфира (пример 87b; 0,77 г, 2,5 ммоль), 1,8-диазабицикло[5,4,0]ундец-7-ена (0,56 мл, 3,75 мл) и бромида калия (1,09 г, 12,5 ммоль) в метаноле (25 мл) перемешивали при 90°С в течение 250 мин. Затем добавляли охлажденную смесь к соляной кислоте (50 мл 0,1 М) и экстрагировали этилацетатом (3×100 мл). Объединенные экстракты промывали насыщенным водным гидрокарбонатом натрия (2×25 мл), водой (2×25 мл) и соляным раствором (2×50 мл), высушивали (MgSO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали перекристаллизацией из смеси этилацетат-гексан с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества.
Пример 87d: 3-(4-Морфолинил)-5-нитро-N-(метил)бензамид
Перемешиваемый раствор 3-(4-морфолинил)-5-нитробензойной кислоты, метилового эфира (пример 86с; 0,53 г, 2 ммоль) в толуоле (5 мл) под атмосферой аргона обрабатывали смесью гидрохлорида метиламина (0,27 г, 4 ммоль), триметилалюминия (2 мл 2 М раствора в толуоле, 4 ммоль) в толуоле (5 мл) и нагревали при 60°С в течение 18 ч. Охлажденную смесь затем обрабатывали соляной кислотой (10 мл 2 М), перемешивали в течение 5 мин и затем обрабатывали водным гидроксидом натрия (5 мл 4 М). Смесь затем обрабатывали водой (100 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные экстракты промывали соляным раствором (2×50 мл), высушивали (MgSO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали перекристаллизацией из этилацетата с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества, tпл 204-207°С.
Пример 87е: 3-Амино-5-(4-морфолинил)-N-(метил)бензамид
Раствор 3-(4-морфолинил)-5-нитро-N-(метил)бензамида (пример 86d; 300 мг, 1,12 ммоль) в этаноле (20 мл) гидрировали при атмосферном давлении над никелем Ренея (0,2 г) при 25°С. Расчетное количество водорода подавали в течение 19 часов. Смесь затем отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали перекристаллизацией из этилацетата, с получением указанного в заголовке соединения в виде бежевого кристаллического твердого вещества, tпл 201-204°С.
Пример 88: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-[(метиламино)карбонил]-5-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 3-амино-5-(трифторметил)-N-(метил)бензамид вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 245-249°С.
Пример 88а: 3-Амино-5-(трифторметил)-N-(метил)бензамид
Используя процедуру, описанную в примере 86е, но применяя α,α,α,-трифтор-N-метил-5-нитро-м-толуамид (Dean E. Welch, J. Med. Chem. (1969), 12, 299-303) вместо 3-(4-морфолинил)-5-нитро-N-(метил)бензамида, получали указанное в заголовке соединение в виде бежевого кристаллического твердого вещества, tпл 113-115°С.
Пример 89: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(3-пиридинил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 5-(3-пиридинил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 275-279°С.
Анилин получали следующим образом.
Пример 89а: 5-(3-Пиридинил)-3-(трифторметил)бензоламин
Перемешиваемый раствор 3-амино-5-бромбензотрифторида (Apollo, England; 1,12 г, 5 ммоль) и 3-(три-н-бутилстаннил)пиридина (Maybridge Chemical Co. Ltd., England; 2,0 г, 5,4 ммоль) в ксилоле (30 мл) насыщали аргоном в течение 10 минут при 20°С. Затем добавляли тетракис(трифенилфосфин)палладий(0) (1,16 г, 1,0 ммоль) и полученную смесь нагревали при 140°С в течение 36 часов под атмосферой аргона. Смесь затем охлаждали, обрабатывали водным раствором гидроксида натрия (100 мл 0,1 М) и насыщали воздухом в течение 2 часов. Полученную смесь затем разбавляли этилацетатом (200 мл) и отфильтровывали. Органическую фазу затем последовательно промывали водой (2×80 мл) и насыщенным водным хлоридом натрия (1×80 мл), высушивали (MgSO4), отфильтровывали и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент этилацетат) с получением указанного в заголовке соединения в виде коричневого масла. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 5,73 (br s, 2Н), 6,83 (dd, 1H), 6,99 (d, 1H), 7,04 (d, 1H), 7,39 (dd, 1H), 7,64 (d, 1H), 8,42 (m, 1H) и 8,53 (dd, 1H).
Пример 90: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(4-морфолинил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 5-(4-морфолинил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 208-211°С.
Анилин получали следующим образом.
Пример 90а: [3-Бром-5-(трифторметил)фенил]карбоновая кислота, 1,1-диметилэтиловый эфир
Смесь 3-амино-5-бромбензотрифторида (Apollo, England; 12 г, 50 ммоль), ди-трет-бутилдикарбоната (12 г, 55 ммоль) и 4-диметиламинопиридина (0,61 г, 5 ммоль) в ацетонитриле (100 мл) перемешивали при 60°С в течение 8 ч. Растворитель затем упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент 10% этилацетат в гексане) и перекристаллизовывали из гексана с получением указанного в заголовке соединения в виде бесцветного кристаллического твердого вещества, tпл 113-115°С.
Пример 90b: [3-(4-Морфолинил)-5-(трифторметил)фенил]карбоновая кислота, 1,1-диметилэтиловый эфир
Используя процедуру, описанную в примере 86b, но применяя [3-бром-5-(трифторметил)фенил]карбоновую кислоту, 1,1 -диметилэтиловый эфир (Пример 90а) вместо 3-бром-5-нитробензойной кислоты, 1,1-диметилэтилового эфира, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 146-148°С.
Пример 90с: 5-(4-Морфолинил)-3-(трифторметил)бензоламин
[3-(4-Морфолинил)-5-(трифторметил)фенил]карбоновую кислоту, 1,1-диметилэтиловый эфир (Пример 90b; 1,7 г, 5 ммоль) обрабатывали раствором хлорида водорода в изопропаноле (30 мл 4 М) и нагревали при 60°С в течение 5 ч. Растворитель упаривали при пониженном давлении и остаток обрабатывали водным раствором гидрокарбоната натрия (80 мл) и экстрагировали этилацетатом (3×80 мл). Объединенные экстракты промывали соляным раствором (2×50 мл), высушивали (MgSO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали перекристаллизацией из смеси эфир-гексан с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества, tпл 96-97°C.
Пример 91: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(2-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 5-(2-метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 242-247°С.
Анилин получали следующим образом.
Пример 91а: 3-(2-Метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрил
Смесь 3-фтор-5-(трифторметил)бензонитрила (Lancaster Synthesis GmbH; 17 г, 89 ммоль) и 2-метилимидазола (Fluka, Buchs, Switzerland; 22,2 г, 270 ммоль) в N,N-диметилацетамиде (80 мл) перемешивали при 145°С в течение 19 ч. Растворитель упаривали при пониженном давлении и остаток растворяли в этилацетате (200 мл). Раствор промывали соляным раствором (200 мл), высушивали (Na2SO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали перекристаллизацией из смеси эфир-гексан с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества, tпл 132-134°С.
Пример 91b: 3-(2-Метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойная кислота
Раствор 3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрила (пример 91а; 16,7 г, 66 ммоль) в диоксане (300 мл) добавляли к водному раствору гидроксида натрия (275 мл 1 М) и смесь нагревали при 95°С в течение 18 ч. Растворитель упаривали при пониженном давлении и остаток нейтрализовали соляной кислотой (1 М) и экстрагировали бутанолом (2×250 мл). Растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения. 1Н-ЯМР (400 МГц, ДМСО-d6, δ): 7,17 (s, 1H); 8,03 (s, 1H); 8,12 (s, 1H); 8,35 (s, 1H); 8,41 (s, 1H); 8,53 (s, 1H); 13,90 (br., 1H).
Пример 91с: [3-(2-Метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновая кислота, 1,1-диметилэтиловый эфир
Триэтиламин (5,23 мл, 37,5 ммоль) добавляли к перемешиваемой суспензии 3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойной кислоты (пример 91b; 6,8 г, 25 ммоль) в трет-бутаноле (200 мл). К полученному раствору добавляли дифенилфосфорилазид (7,6 г, 27,5 ммоль) и смесь нагревали при 80°С в течение 16 ч. Растворитель упаривали при пониженном давлении и остаток обрабатывали водой (100 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные экстракты промывали соляным раствором (100 мл), высушивали (Na2SO4) и растворитель упаривали при пониженном давлении с получением сырого продукта, который очищали колоночной хроматографией (силикагель, элюент 2% этанола в этилацетате) и перекристаллизовывали из смеси эфир-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического твердого вещества, tпл 203-208°С.
Пример 91d: 5-(2-Метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин
Используя процедуру, описанную в примере 90с, но применяя [3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновую кислоту, 1,1-диметилэтиловый эфир (пример 91с) вместо [3-(4-морфолинил)-5-(трифторметил)фенил]карбоновой кислоты, 1,1-диметилэтилового эфира, получали указанное в заголовке соединение в виде желтого кристаллического твердого вещества, tпл 130-133°С.
Пример 92: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 5-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 235-236°С.
Анилин получали следующим образом.
Пример 92а: 3-(4-Метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрил
Используя процедуру, описанную в примере 91а, но применяя 4-метил-1Н-имидазол вместо 2-метилимидазола, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 127-128°С.
Пример 92b: 3-(4-Метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойная кислота
Используя процедуру, описанную в примере 91b, но применяя 3-(4-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрил (пример 92а) вместо 3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрила, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл>300°С.
Пример 92с: [3-(4-Метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновая кислота, 1,1-диметилэтиловый эфир
Используя процедуру, описанную в пример 91с, но применяя 3-(4-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойную кислоту (пример 92b) вместо 3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 186-188°С.
Пример 92d: 5-(2-Метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин
Используя процедуру, описанную в примере 91d, но применяя [3-(4-метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновую кислоту, 1,1-диметилэтиловый эфир (пример 92с) вместо [3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновой кислоты, 1,1-диметилэтилового эфира, получали указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества, tпл 127-131°С.
Пример 93: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[5-(5-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 5-(5-метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 231-233°С.
Анилин получали следующим образом.
Пример 93а: 3-(5-Метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрил
Используя процедуру, описанную в примере 91а, но применяя 4-метил-1H-имидазол вместо 2-метилимидазола, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 99-101°С.
Пример 93b: 3-(5-Метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойная кислота
Используя процедуру, описанную в примере 91b, но применяя 3-(5-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрил (пример 93а) вместо 3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензонитрила, получали указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества, tпл 243-245°C.
Пример 93с: [3-(5-Метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновая кислота, 1,1-диметилэтиловый эфир
Используя процедуру, описанную в примере 91с, но применяя 3-(5-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойную кислоту (пример 93b) вместо 3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)бензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 169-171°С.
Пример 93d: 5-(5-Метил-1Н-имидазол-1-ил)-3-(трифторметил)-бензоламин
Используя процедуру, описанную в примере 91d, но применяя [3-(5-метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновую кислоту, 1,1-диметилэтиловый эфир (пример 93с) вместо [3-(2-метил-1Н-имидазол-1-ил)-5-(трифторметил)фенил]карбоновой кислоты, 1,1-диметилэтилового эфира, получали указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества, tпл 131-133°С.
Пример 94: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[3-(4-метил-1-пиперазинил)-5-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 69, но применяя 3-(4-метил-1-пиперазинил)-5-(трифторметил)бензоламин вместо 3-[(1-гидрокси-1-метилэтил)]-5-(1,1,1-трифторметил)бензоламина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 192-194°С.
Анилин получали следующим образом.
Пример 94а: [3-(4-Метил-1-пиперазинил)-5-(трифторметил)фенил]карбоновая кислота, 1,1-диметилэтиловый эфир
Используя процедуру, описанную в примере 87b, но применяя 1-метил-1-пиперазин вместо морфолина, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 225°С.
Пример 94b: 3-(4-Метил-1-пиперазинил)-5-(трифторметил)бензоламин
Используя процедуру, описанную в примере 90с, но применяя [3-(4-метил-1-пиперазинил)-5-(трифторметил)фенил]карбоновую кислоту, 1,1-диметилэтиловый эфир (пример 94а) вместо [3-(4-морфолинил)-5-(трифторметил)фенил]карбоновой кислоты, 1,1-диметилэтилового эфира, получали указанное в заголовке соединение в виде масла. 1Н-ЯМР (400 МГц, ДМСО-d6): 2,20 (s, 3H), 2,42 (m, 4Н), 3,07 (m, 4H), 3,32 (br s, 2H), 5,34 (s, 1H) и 6,31 (s, 2H).
Пример 95: 4-Метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]-N-[2-(1-пирролидинил)-5-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 3, но применяя 2-(1-пирролидинил)-5-(трифторметил)бензоламин (Lancaster Synthesis Ltd.; Yasuhiro Ohtake и др. WO 9965874) вместо 1-(2-пиридил)пиперазина, получали указанное в заголовке соединение в виде кристаллического твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6): 1,77-1,82 (m, 4H); 2,34 (s, 3H); 3,31-3,37 (m, 4H); 6,86 (d, 1H); 7,34-7,44 (m, 2H); 7,47 (d, 1H); 7,49-7,53 (m, 1H); 7,73 (dd, 1H); 8,27 (d, 1H); 8,43 (dt, 1H); 8,53 (d, 1H); 8,69 (dd, 1H); 9,13 (s, 1H); 9,27 (d, 1H); 9,96 (s, 1H).
Пример 96: 3-[[4-(3-Пиридинил)-2-пиримидинил]амино]-N-[5-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)фенил]бензамид
Используя процедуру, описанную в примере 1, но применяя 3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойную кислоту вместо 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты и 5-(4-метил-1Н-имидазол-1-ил)-3-(трифторметил)бензоламин вместо фурфуриламина, получали указанное в заголовке соединение в виде светло-желтого кристаллического твердого вещества, tпл 264-266°С.
Пример 96а: Мононитрат этилового эфира 3-[(аминоиминометил)амино]бензойной кислоты
Используя процедуру, описанную в примере 1, но применяя этиловый эфир 3-аминобензойной кислоты (Fluka, Buchs, Switzerland) вместо этилового эфира 3-амино-4-метилбензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 170-172°С.
Пример 96b: Этиловый эфир 3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты
Используя процедуру, описанную в примере 1b, но применяя мононитрат этилового эфира 3-[(аминоиминометил)амино]бензойной кислоты вместо мононитрата этилового эфира 3-[(аминоиминометил)амино]-4-метилбензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 197-199°С.
Пример 96с: 3-[[4-(3-Пиридинил)-2-пиримидинил]амино]бензойная кислота
Используя процедуру, описанную в примере 1с, но применяя этиловый эфир 3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойную кислоту вместо этилового эфира 4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]бензойной кислоты, получали указанное в заголовке соединение в виде кристаллического твердого вещества, tпл 291-295°С.
Пример 97: Мягкие капсулы
5000 мягких желатиновых капсул, каждая из которых включает в качестве активного ингредиента 0,05 г одного из соединений формулы I, упомянутых выше в примерах, получали следующим образом:
250 г измельченного активного ингредиента суспендировали в 2 л Lauroglykol® (пропиленгликольлаурат, Gattefbssé S.A., Saint Priest, France) и помещали во влажный пульверизатор для получения частиц размером около от 1 до 3 мкм. 0,419 г смеси затем помещали в мягкие желатиновые капсулы с помощью наполняющего капсулы устройства.
Пример 98: Фармакокинетические данные
Тестируемое соединение формулы I формулировали для введения самкам OF1 мышей от IFACREDO, France, сначала растворяя в N-метилпирролидоне (NMP) и затем разбавляя PEG300 до конечной концентрации 10% об./об. NMP: 90% об./об. PEG300, получая чистый раствор соединения. Концентрации доводили для введения постоянного объема 10 мл/кг веса тела. Соединение получали непосредственно перед применением. Сформулированное соединение вводили перорально желудочным зондом для обеспечения доз 50 мг/кг. В определенные временные точки мышей (4 в каждое время) анестезировали с помощью 3% изофлурана в медицинском кислороде и образцы крови отбирали сердечной пункцией в гепаринизированные пробирки (приблизительно 30 IU/мл). Животных затем умерщвляли без восстановления после анестезии. Плазму получали из крови центрифугированием (10,000 г, 5 мин) и анализировали немедленно или хранили замороженными при -70°С.
Образцы плазмы (10-250 мкл), например, разрушали с помощью 5 мкл внутреннего стандарта, смешанного с 200 мкл 0,1 М NaOH и 500 мкл хлороформа в пробирке Эппендорфа на 1,5 мл и тщательно встряхивали в течение 10 минут на смесителе Эппендорфа. Затем смесь центрифугировали (3 мин при 10'000×об/мин), органическую фазу переносили во вторую пробирку Эппендорфа и упаривали досуха в а вакуумной центрифуге (Speedvac 5301). Сухой остаток, например, растворяли в 250 мкл 10% об./об. ацетонитрила в воде, содержащего 0,1% муравьиной кислоты. Последующий анализ проводили, например, высокоэффективной жидкостной хроматографией/тандемной масс-спектрометрией (ВЭЖХ/MS-MS) с помощью системы ВЭЖХ Agilent 1100 Series (Agilent, Palo Alto, CA, USA) с вакуумным дегазатором, двойным насосом и термостатическим колоночным отделением, связанным с охлаждающей системой автообразца (HTS PAL, CTC Analytics, Zwingen, Switzerland). Образец (5-15 мкл) наносили, например, на колонку Ultra Phenyl (размер частиц 3 мкм, 50×1 мм; Restek, Bellefonte, USA) с защитной колонкой (4×2 мм) из того же материала (Phenomenex, Torrance, USA). После уравновешивания, например, водой и латентного периода 1 мин образец элюировали, например, линейным градиентом 0-100% ацетонитрила в воде, содержащим 0,2% об./об. муравьиной кислоты, в течение 11 мин при скорости потока 60 мкл/мин. Колонку получали для следующего образца, например, повторным уравновешиванием в течение 3 мин 100% водой до исходных положений. Разделение осуществляли, например, при температуре колонки 40°С. Поток на колонку вводили, например, непосредственно в ионный источник тройной стадии квадропольного масс-спектрометра (Quattro Ultima™, Micromass, Manchester, UK), контролируемого программным обеспечением Masslynx™ 3,5 (Micromass, Manchester, UK), используя в качестве метода ионизации электрораспылительное ионизирующее положительное устройство (ESI+). Соединение определяли с помощью MS/MS с последующей фрагментацией входящий ионов. Ограничение ксантования определяли, например, при 0,002 нмоль/л. Колибровочные кривые строили по известным количествам соединения, включая фиксированное количество внутреннего стандарта в плазме, обработанной, как указано выше. Концентрацию неизвестных образцов рассчитывали из отношения площади под пиком выбранного дочернего иона аналитического образца для продукта его внутреннего стандарта (ось ординат) от номинальной концентрации (ось абсцисс). Регрессионный анализ осуществляли с помощью программного обеспечения Quanlynx™, Masslynx™ 3,5 (Micromass, Manchester, UK).
Пример 99: Данные ингибирования in vitro
Данные ферментативного (с-Abl, KDR, Flt3) ингибирования in vitro выражены как % ингибирования при 10 мкМ. Измерения осуществляли, как указано выше в общем описании.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПИРИМИДИНАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2378267C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ИНГИБИТОРЫ Bcr-Abl/c-Kit/PDGF-R TK, ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2452492C2 |
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗЫ | 2011 |
|
RU2524210C2 |
| СПОСОБ СИНТЕЗА 5-(МЕТИЛ-1Н-ИМИДАЗОЛ-1-ИЛ)-3-(ТРИФТОРМЕТИЛ)БЕНЗАМИДА | 2006 |
|
RU2444520C2 |
| ТИАЗОЛОПИРИМИДИНЫ | 2012 |
|
RU2610840C2 |
| Соединения 1-циано-пирролидинов в качестве ингибиторов USP30 | 2016 |
|
RU2717238C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
| ПРОИЗВОДНЫЕ 2-(ФЕНИЛ ИЛИ ПИРИД-3-ИЛ)АМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2647849C2 |
| НОВЫЕ 4-АМИНО-N-ГИДРОКСИБЕНЗАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ HDAC ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2591190C2 |
| 5-АРОМАТИЧЕСКОЕ АЛКИНИЛЗАМЕЩЕННОЕ БЕНЗАМИДНОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2695371C2 |
Изобретение относится к новым соединениям формулы (I), где для лечения заболевания, которое связано с ингибированием активности протеинкиназы, особенно опухолевого заболевания, в частности лейкемии, способу лечения такого заболевания и способу получения соединений. В формуле (I)
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил; R2 представляет собой низший алкил, замещенный одним или несколькими одинаковыми или различными радикалами R3, циклогексил, циклогептил, бензциклопентил(индан), бензциклогексил, пяти-, шести- или семичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот и кислород, которая может быть ненасыщенной или полностью насыщенной, и является незамещенной или замещенной низшим алкилом, фенил-низшим алкилом или оксо; фенил, который является незамещенным или замещенным одним или двумя заместителями, выбранными из группы, включающей низший алкил, низший алкоксикарбонилпиперидино-низший алкил, N-низший алкилпиперазино-низший алкил, низший алкоксикарбонил-низший алкил, низший алкокси, 1Н-имидазолил-низший алкокси, низший алкоксикарбонил, низший алкилкарбамоил, амино, моно- или дизамещенный низшим алкилом, морфолино, низшим алкилсульфонилом, галогеном и бензоилом; и значение R3 указано в формуле изобретения, или R1 и R2 вместе представляют собой алкилен с четырьмя, пятью или шестью атомами углерода, необязательно моно- или дизамещенный низшим алкилом; шестичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот, которая может быть ненасыщенной или полностью насыщенной, и является незамещенной или замещенной, как указано в формуле изобретения, R4 представляет собой водород или низший алкил. 4 н. и 1 з.п. ф-лы, 99 пр.
1. Соединение формулы

где R1 представляет собой водород, низший алкил, низший алкокси-низший алкил;
R2 представляет собой низший алкил, замещенный одним или несколькими одинаковыми или различными радикалами R3, циклогексил, циклогептил, бензциклопентил(индан), бензциклогексил, пяти-, шести- или семичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот и кислород, которая может быть ненасыщенной или полностью насыщенной и является незамещенной или замещенной низшим алкилом, фенил-низшим алкилом или оксо; фенил, который является незамещенным или замещенным одним или двумя заместителями, выбранными из группы, включающей низший алкил, низший алкоксикарбонилпиперидино-низший алкил, N-низший алкилпиперазино-низший алкил, низший алкоксикарбонил-низший алкил, низший алкокси, 1Н-имидазолил-низший алкокси, низший алкоксикарбонил, низший алкилкарбамоил, амино, моно- или дизамещенный низшим алкилом, морфолино, низшим алкилсульфонилом, галогеном и бензоилом; и
R3 представляет собой гидрокси, низший алкокси, карбокси, низший алкоксикарбонил, N-монофенилкарбамоил, моно- или дизамещенный низшим алкилом или низшим алкокси амино, циклопропил, пяти- или шестичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот и кислород, которая может быть ненасыщенной или полностью или частично насыщенной и является незамещенной или замещенной низшим алкилом, фенил-низшим алкилом или оксо; фенил, который является незамещенным или замещенным одним или двумя заместителями выбранными из группы, включающей низший алкокси, сульфамоил, низший алкилсульфонил; моноциклическую гетероарильную группу, включающую два атома азота в кольце и ноль атомов кислорода, выбранную из имидазолила, пиразинила и фуранила, где они являются незамещенными; или где
R1 и R2 вместе представляют собой алкилен с четырьмя, пятью или шестью атомами углерода, необязательно моно- или дизамещенный низшим алкилом; шестичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот, которая может быть ненасыщенной или полностью насыщенной и является незамещенной или замещенной низшим алкилом, гидрокси, пиридилом, пиразинилом или пиримидинилом; оксаалкилен с одним атомом кислорода и тремя или четырьмя атомами углерода или азаалкилен с одним атомом азота и тремя или четырьмя атомами углерода, где азот является незамещенным или замещенным низшим алкилом, фенил-низшим алкилом, замещенным низшей алкокси фенилом, пиридинилом или пиразинилом;
R4 представляет собой водород или низший алкил;
причем R2 не означает 3-аминопропил, если R1 и R4 представляет собой водород, а префикс "низший" означает радикал, имеющий включительно до 7 атомов углерода,
или фармацевтически приемлемая соль такого соединения.
2. Соединение формулы I по п.1, где
R1 представляет собой водород, низший алкил, низший алкокси-низший алкил;
R2 представляет собой низший алкил, замещенный одним или двумя одинаковыми или различными радикалами R3, бензциклопентил(индан), бензциклогексил, циклогексил, пирролидинил, оксазолинил, пиперидинил, N-замещенный пиперидинил, морфолинил, азепинил, оксоазепинил, оксазепинил, фенил, который является незамещенным или замещенным одним или двумя заместителями, выбранными из группы, включающей низший алкил, низший алкоксикарбонилпиперидино-низший алкил, N-низший алкилпиперазино-низший алкил, 1H-имидазолил-низший алкокси, низший алкоксикарбонил, низший алкилкарбамоил, амино моно- или дизамещенный низшим алкилом, морфолино, галогеном и бензоилом; и
R3 представляет собой гидрокси, низший алкокси, карбокси, низший алкоксикарбонил, карбамоил, N-монофенилкарбамоил, пяти- или шестичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот и кислород, которая может быть ненасыщенной или полностью или частично насыщенной и является незамещенной или замещенной низшим алкилом, фенил-низшим алкилом или оксо, фенил, который является незамещенным или замещенным одним или двумя заместителями, выбранными из группы, включающей низший алкокси, сульфамоил, низший алкилсульфонил; фенилом, пиридилом, галогенилом и бензоилом; моноциклическую гетероарильную группу, включающую один или два атома азота, выбранную из имидазолила, бензимидазолила, пиразинила и фуранила, или где
R1 и R2 вместе представляют собой алкилен с четырьмя или пятью атомами углерода, необязательно моно- или дизамещенный низшим алкилом; шестичленную гетероциклическую систему с одним или двумя гетероатомами, выбранными из группы, включающей азот, которая может быть ненасыщенной или полностью насыщенной и является незамещенной или замещенной низшим алкилом, гидрокси, пиридилом, пиразинилом или пиримидинилом; оксаалкилен с одним атомом кислорода и четырьмя атомами углерода или азаалкилен с одним атомом азота и четырьмя атомами углерода, где азот является незамещенным или замещенным низшим алкилом, фенил-низшим алкилом, пиридинилом или пиразинилом;
R4 представляет собой водород или низший алкил;
причем R2 не означает 3-аминопропил, если R1 и R4 представляют собой водород, а префикс "низший"означает радикал, имеющий включительно до 7 атомов углерода, или фармацевтически приемлемая соль такого соединения.
3. Способ получения соединения формулы I по п.1

или фармацевтически приемлемой соли, где символы R1, R2 и R4 являются такими, как определено в п.1, характеризующийся тем, что соединение формулы II

где R4 является таким, как определено для соединения формулы I, или его производное, где карбоксигруппа -СООН находится в активированной форме, подвергают реакции с амином формулы III

где R1 и R2 являются такими, как определено для соединения формулы I, необязательно в присутствии дегидрирующего агента и инертного основания и необязательно в присутствии инертного растворителя;
где указанные выше исходные соединения II и III могут также присутствовать с защищенными функциональными группами, при необходимости и/или в форме солей при условии наличия сольобразующей группы и возможности реакции в форме соли;
любую защитную группу в защищенном производном соединения формулы I удаляют;
и, при необходимости, свободное соединение формулы I превращают в фармацевтически приемлемую соль, полученную фармацевтически приемлемую соль соединения формулы I превращают в свободное соединение или другую фармацевтически приемлемую соль.
4. Фармацевтическая композиция, ингибирующая активность протеинкиназы, включающая в качестве активного ингредиента соединение формулы I по любому из пп.1 и 2 или фармацевтически приемлемую соль в эффективном количестве вместе с фармацевтически приемлемым носителем.
5. Способ лечения заболевания, которое связано с ингибированием активности протеинкиназы, который включает введение соединения формулы I по любому из пп.1 или 2 или фармацевтически приемлемой соли.
| ZIMMERMANN JURG et al | |||
| Potent and selectiveinhibitors of the ABL-kinase: phenylaminopyrimidine (PAP) derivatives // Bioorganic & Medici-nal Chemistry Letters, 1997, 7(2), 187-92 (примеры 17, 24, таблица 1) | |||
| Способ рафинирования олова от сурьмы и мышьяка | 1976 |
|
SU588762A1 |
| ZIMMERMANN JURG et al | |||
| Phenylaminopyrimidine (PAP) derivatives: new class of potent and highly selective | |||
Авторы
Даты
2012-03-20—Публикация
2008-09-24—Подача