Изобретение относится к химии производных адамантана, а именно к новому способу получения адамантилсодержащих нитрилов общей формулы
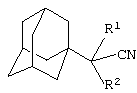
где R1=H: R2=H, СН3, С2H5, (СH3)2СН2, С6Н5, С10Н5, C5H10N, C5H10NCH2, (СН2)3СN; R1=СН3: R2=СН3,
которые представляют собой важные полупродукты в синтезе некоторых биологически активных веществ. Адамантилсодержащие нитрилы путем восстановления могут быть легко превращены в амины. Стоит отметить, что получение данных нитрилов традиционными методами является многостадийным и трудоемким.
Так, в литературе приводятся сведения о способе получения адамантилацетонитрила через тозилат 1-оксиметиладамантана, обработкой которого цианидом калия в диметилформамиде в течение суток при 120°С получается целевой продукт [Freser L.F., Naser M.Z., Archer S. и др. Naphthoquinone antimalarials. XXX. 2-Hydroxy-3-[ω-(l-adamantyl)-alkyl]-l,4’-naphthoquinones//J. Med. Chem., 1967, 10, N4, p. 517-521].
Недостатком данного метода является то, что с его помощью можно получить только одно производное, а именно адамантилацетонитрил, а также большое время реакции.
Известно также, что при нагревании 1,3-бис(карбоксиметил)адамантана в токе газообразного аммиака при 250-450°С в присутствии сложных металлооксидных катализаторов в течение 3-15 часов образуется 1,3-бис(цианометил)адамантан [Способ получения адамантандиацетонитрилов. Имамото Иосиаки, Кадано Такэси. Яп. Пат. №49-46612, опубл. 11.12.74].
Среди недостатков этого метода можно отметить высокую температуру, использование дорогих катализаторов, длительное время реакции, а также то, что в результате получаются динитрилы, структура которых не соответствует структуре заявляемых соединений.
Наиболее близким к предполагаемому изобретению является синтез нитрилов из соответствующей карбоновой кислоты с адамант-1-ильным радикалом, из которой известными методами синтезируют ее хлорангидрид [Sasaki Kadashi, Eguchi Shoji, Tom Takeshi. Synthesis of adamantane derivatives. II. Preparation of some derivatives from adamantylacetic acid// Bull. Soc. Chim. Japan., -1968. 41, №1, p. 238-240], который, в свою очередь, является исходным реагентом для получения соответствующего амида [Климова Н.В., Арендарук А.П., Баранова М.А. и др. Синтез производных 1-аминоадамантана //Ж. Фарм. хим., 1970, 4, №11. С. 14-18].
Для получения адамантилсодержащих нитрилов адамантилкарбоновых кислот из соответствующих амидов в качестве дегидратирующих агентов используют хлорокись фосфора или тионилхлорид в кипящем бензоле или толуоле, в течение 5-8 часов синтезируют адамантилсодержащий нитрил [Хардин А.П., Брель Н.А., Новаков И.А., Радченко С.С., Зоуэр О.А., Озолс А.И., Бирзниекс К.А. Исследование реакции дегидратации амидов адамантанкарбоновых кислот. Тезисы докладов научной конференции по химии органических полимеров, Волгоград, 1981, с.65].
Недостатком этого способа является многостадийность. Помимо этого, данный метод имеет и другой существенный недостаток, серьезно ограничивающий его применение, а именно: для получения нитрила необходима соответствующая исходная карбоновая кислота. Синтез же многих карбоновых кислот, содержащих адамант-1-ильный радикал, сам является трудоемким процессом. В литературе описаны лишь три представителя 1-адамантилалкилкарбоновых кислот: адамантанкарбоновой, адамантилуксусной и н-адамантилпропионовой кислот. Получение других соединений данного класса представляется чрезвычайно трудоемким или невозможным при использовании обычно применяемых методов.
Задачей предлагаемого изобретения является разработка технологичного малостадийного метода синтеза адамантилсодержащих нитрилов практически любого строения, протекающего с высоким выходом по исходному адамантану.
Техническим результатом является повышение выхода и ассортимента заявляемых соединений.
Поставленный технический результат достигается в новом способе получения адамантилсодержащих нитрилов общей формулы
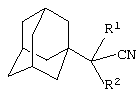
где R1=H: R2=H, СН3, С2H5, (СH3)2СН2, С6Н5, С10Н7, C5H10N, C5H10NCH2, (СН2)3СN; R1=СН3: R2=СН3,
путем взаимодействия 1,3-дегидроадамантана с нитрилами из ряда: ацетонитрил, пропионитрил, н-бутиронитрил, изовалеронитрил, изобутиронитрил, фенилацетонитрил, α-нафтилацетонитрил, адиподинитрил, пиперидиноацетонитрил, 3-пиперидинопропионитрил при мольных соотношениях реагентов, равном 1:3-10, при температуре 60-140°С в течение 4-8 часов.
Присоединение по α-углеродному атому нитрилов напряженных алкенов в литературе ранее не описывалось. Описана реакция взаимодействия адамантилкатиона в сильнокислых средах с рядом алифатических нитрилов с образованием ацетоамида адамантана и его гомологов (реакция Риттера), но данная реакция протекает по группе C=N и никогда не приводит к нитрилам указанной формулы. Присоединение по α-углеродному атому характерно для реакционно способных алкенов в присутствии сильноосновного катализа (натрий, гидрид натрия и т.д.). До настоящего времени взаимодействие дегидроадамантана с нитриламим не было описано. Нитрилы в отличие от других соединений (кетоны, β-дикетоны, нитросоединения) являются слабыми СН-кислотами (рКа=25-26). Нами впервые осуществлено взаимодействие 1,3-дегидроадамантана с нитрилами. Столь значительная разница в выходах ожидаемых нитрилов объясняется, очевидно, лишь различием в температурных условиях проведения реакции, в свою очередь обуславлавливаемых температурами кипения исходных соединений, так как кислотность нитрилов с увеличением длины и разветвленности углеводородной цепи, очевидно, значительно не изменяется. Низкий же выход продукта адамантилирования ацетонитрила по сравнению с присоединением фенилацетонитрила и α-нафтилацетонитрила при практически одинаковых температурных условиях проведения реакции объясняется, очевидно, именно более низкой подвижностью протона в ацетонитриле и стерическим фактором оснафтильного радикала, в значительной степени препятствующим атаке протоном метиленовой группы исходного нитрила молекулы 1,3-ДГА.
Следует отметить, что в случае присоединения фенилацетонитрила и α-нафтилацетонитрила продуктов побочного присоединения 1,3-ДГА по ароматическим группам данных соединений не обнаружено, а реакция прошла за 4 часа.
Присоединение нитрилов другого строения к дегидроадамантану завершалось с высокими (80-92%) выходами за 6-8 часов.
Высокие величины выходов продуктов данной реакции можно объяснить сильным электроноакцепторным влиянием заместителей у α-углеродного атома, которое привело к повышению кислотных свойств исходных нитрилов.
Сущностью метода является реакция получения адамантилнитрилов по реакции присоединения к 1,3-дегидроадамантану нитрилов, представляющих собой слабые СН-кислоты, по их α-углеродному атому
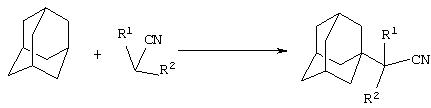
где R1=H: R2=H, СН3, С2H5, (СH3)2СН2, С6Н5, С10Н7, C5H10N, C5H10NCH2, (СН2)3СN; R1=СН3: R2=СН3.
Высокая нуклеофильность 1,3-дегидроадамантана позволяет получать продукты указанной общей формулы с высокими выходами в достаточно мягких условиях.
Способ осуществляется следующим образом.
К 3-10-кратному мольному избытку нитрила приливают раствор 1,3-дегидроадамантана в легкокипящем инертном растворителе, который затем удаляется из реакционной смеси отгонкой. Смесь 1,3-дегидроадамантана и нитрила нагревают в течение 8 часов при температуре 60-140°С (лучше 100-120°С), после чего избыток исходного нитрила отгоняют. Регенерированный нитрил не содержит каких-либо примесей и пригоден для использования в аналогичном синтезе. Таким образом, возможна организация рецикла исходных нитрилов с добавлением рассчитанного количества свежего нитрила. Синтезированные адамантилнитрилы после отгонки исходных нитрилов направляются на стадию дальнейшей очистки. Полученные соединения чистят перекристаллизацией из изопропанола либо вакуумной перегонкой с последующей перекристаллизацией. Выход данных продуктов составляет до 92%.
Как показали проведенные исследования, оптимальным и технологичным условием проведения реакции присоединения нитрилов к 1,3-дегидроадамантану является ее осуществление в среде самих исходных нитрилов при мольном соотношении 1,3-дегидроадамантан:нитрил 1:5-10. Меньший избыток приводил к некоторому снижению выхода целевых продуктов за счет плохой растворимости 1,3-дегидроадамантана в нитрилах, а также за счет его возможной гомополимеризации. Дальнейшее увеличение содержания нитрилов не влияло на выход целевых продуктов и являлось нецелесообразным. Оптимальной температурой реакции является температура кипения самих исходных нитрилов, то есть 60-140°С. Снижение температуры до комнатной приводит к сильному увеличению продолжительности данного взаимодействия, в то время как ее дальнейшее повышение наряду с ускорением реакции приводит к некоторому осмолению реакционной смеси, гомополимеризации 1,3-дегидроадамантана и потерям целевого продукта.
Строение синтезированных соединений подтверждено ИК-, ПМР- и масс-спектроскопией, свойства известных веществ (адамант-1-илацетонитрил) соответствовали литературным данным.
Изобретение иллюстрируется следующими примерами.
Пример 1. Адамант-1-илацетонитрил.
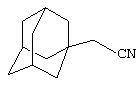
К 6 г (0.14 моль) абсолютного ацетонитрила в атмосфере сухого азота при комнатной температуре прикапывают раствор 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:10) в 20 мл абсолютного диэтилового эфира, после чего растворитель отгоняют, реакционную смесь выдерживают при температуре ее кипения (82-90°С) в течение 8 часов, после чего избыток ацетонитрила удаляют перегонкой, остаток вакуумируют при 100°С (5 мм рт. ст.) для удаления непрореагировавшего 1,3-ДГА, продукт перегоняют с воздушным холодильником и получают 0.8 г (0.0046 моль, 30.6%) адамант-1-илацетонитрила, белое кристаллическое вещество, Тпл.=75-78°C (лит. Тпл.=78°С).
Пример 2. 1-(Адамант-1-ил)пропионитрил.
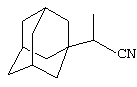
Аналогично, из 6 г (0.14 моль) абсолютного пропионитрила и раствора 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:10) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 8 часов при Ткип пропионитнила (97°С), отгонки исходного нитрила и вакуумной перегонки получают 2.3 г (0.014 моль, 81.6%) 1-(адамант-1-ил)пропионитрила, белое кристаллическое вещество, Ткип.=121°С/ 2 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 1.1 т (3Н, СН3), 1.4-2.3 3с (15 Н, адамант-1-ил), 2.5 c (l H, CHCN).
Найдено, %: С 82.44, Н 9.98, N 7.21. С13Н19N. Вычислено, %: С 82.48, H 10.12, N 7.40.
Пример 3. 1-(Адамант-1-ил)бутиронитрил.
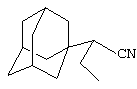
Аналогично, из 30 г (0.15 моль) абсолютного н-бутиронитрила и раствора 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:10) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 8 часов при Ткип. н-бутиронитрила (118°С), отгонки исходного нитрила и вакуумной перегонки получают 2 г (0.0 моль, 88.5%) 1-(адамант-1-ил)пропионитрила, белое кристаллическое вещество, Ткип.=120°С/ 1 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 1.05 т (3Н, СН3),1.46-2.05 3с (15 Н, адамант-1-ил), 2.4 с (1 Н, CHCN).
Найдено, %: С 83.03, Н 10.43, N 6.40. C15H22N. Вычислено, %: С 82.70, Н 10.41, N 6.89.
Пример 4. 1-(Адамант-1-ил)-2-метилбутиронитрил.
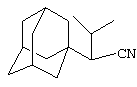
Аналогично, из 5 г (0.06 моль) абсолютного изовалеронитрила и раствора 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:4) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 8 часов при температуре ее кипения (130-140°С), отгонки исходного нитрила и вакуумной перегонки продукта получают 2.27 г (0.014 моль, 92%) ожидаемого нитрила, представляющего собой белое кристаллическое вещество, Тпл.=38-39°С, Ткип.=153°С/5 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 0.8 2т (6Н, СН3), 1.5-2.4 3с (15 Н, адамант-1-ил), 2.3с (1Н, СНСN).
Найдено, %: С 82.83, Н 10.51, N 6.66. С15H23N. Вычислено, %: С 82.89, Н 10.67, N 6.44.
Пример 5. Адамант-1-илдиметилацетонитрил.
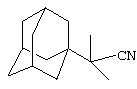
Аналогично, из 10 г (0.145 моль) абсолютного изобутиронитрила и раствора 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:10) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 8 часов при температуре ее кипения (105-110°С), отгонки исходного нитрила и вакуумной перегонки продукта получают 2.55 г (0.013 моль, 85%) адамант-1-илдиметилацетонитрила, представляющего собой белое кристаллическое вещество, Тпл.=84°С, Ткип.=116°С/3 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 1.02 2т (6 Н, СН3), 1.89-2.35 3с (15 Н, адамант-1-ил).
Найдено, %: С 82.65, Н 10.26, N 6.94. C14H21N. Вычислено, %: С 82.70, Н 10.41, N 6.89.
Пример 6. Адамант-1-ил(фенил)ацетонитрил.
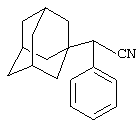
Аналогично, из 10 г (0.085 моль) безводного фенилацетонитрила и раствора 4 г (0.03 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:3) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 4 часов при температуре 70-80°С, отгонки исходного нитрила и вакуумной перегонки продукта получают 6.77 г (0.027 моль, 90.3%) адамант-1-ил(фенил)ацетонитрила, представляющего собой белое кристаллическое вещество, Тпл.=120°С, Ткип.=173°С/3 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 7.20-7.40 м (5 Н, C6H5), 1.64-2.03 3с (15 Н, адамант-1-ил), 3.90 с (1 Н, СН).
Найдено, %: С 85.94, Н 8.35, N 5.61. C18H21N. Вычислено, %: С 86.01, H 8.42, N 5.57.
Пример 7. Адамант-1-ил(α-нафтил)ацетонитрил.
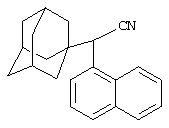
Аналогично, из 10 г (0.06 моль) α-нафтилацетонитрила и раствора 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:4) в 20 мл абсолютного диэтилового эфира, после выдерживания при температуре 60-80°С в течение 4 часов и последующей отгонки избытка исходного нитрила в вакууме, вакуумной перегонкой получают 2.9 г (0.0096 моль, 64.6%) адамант-1-ил(α-нафтил)ацетонитрила. Продукт дополнительно очищают перекристаллизацией из изопропанола; бесцветное кристаллическое вещество, Ткип.=240-242°С/1 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 7.9-8.6 м (8 Н, C10H8), 1.64-2.36 3с (15 Н, адамант-1-ил), 4.15 с (1 Н, CHCN).
Найдено, %: С 85.94, Н 8.35, N 5.61. C18H21N. Вычислено, %: С 87.66, H 7.69, N 4.65.
Пример 8. 1-(Адамант-1-ил)адиподинитрил.
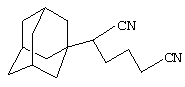
К 8 г (0.05 моль) адиподинитрила прибавляют раствор 2 г (0.015 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:4) в 20 мл абсолютного толуола и кипятят реакционную смесь 6 часов, после чего толуол перегоняют, избыток адиподинитрила отгоняют в вакууме водоструйного насоса, остаток перегоняют в вакууме и получают 2.2 г (0.0078 моль, 61.1%) 1-(адамант-1-ил)адиподинитрила, белое кристаллическое вещество, Тпл.=82-83°С, Ткип.=182°С/1 мм рт. ст.
Спектры ЯМР 1Н, δ, м.д.: 1.40-2.03 5с (15 Н, адамант-1-ил, 4Н, СН2СН2), 2.65 с (2Н, СН3СN), 3.08 с (1 Н, CHCN).
Найдено, %: С 79.81, Н 9.19, N 11.55. C16H22N2. Вычислено, %: С 79.29, H 9.15, N 11.56.
Пример 9. 2-(Адамант-1-ил)-2-(1-пиперидино)ацетонитрил
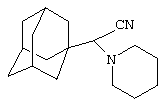
Аналогично, из 10 г (0.08 моль) пиперидиноацетонитрила и раствора 4 г (0.03 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:3) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 6 часов и последующей отгонки избытка исходного нитрила в вакууме, вакуумной перегонкой получают 8.5 г (0.033 моль, 74.6%) 2-(адамант-1-ил)-2-(1-пиперидино)ацетонитрил, белое кристаллическое вещество, Ткип.=165-167°С/1 мм рт. ст.
Масс-спектр, м/е: 258 (М+, 14,5%), 135 (Ad+, 100%), 123 (M+-Ad, 27,7%).
Найдено, %: С 79.14, Н 10.09, N 11.07. C17H26N2. Вычислено, %: С 79.02, Н 10.14, N 10.84.
Пример 10. 2-(Адамант-1-ил)-3-(1-пиперидино)пропионитрил
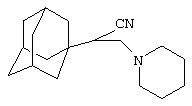
Аналогично, из 10 г (0.072 моль) 3-пиперидинопропионитрила и раствора 4 г (0.03 моль) свежевозогнанного 1,3-ДГА (соотношение 1,3-ДГА:исходный нитрил=1:3) в 20 мл абсолютного диэтилового эфира, после выдерживания реакционной массы в течение 6 часов и последующей отгонки избытка исходного нитрила в вакууме, вакуумной перегонкой получают 5.3 г (0.019 моль, 65.3%) 2-(адамант-1-ил)-3-(1-пиперидино)пропионитрил. Продукт дополнительно очищают перекристаллизацией из изопропанола, белое кристаллическое вещество, Ткип.=142-145°С/1 мм рт. ст.
Масс-спектр, м/е: 272 (М+, 4,5%), 135 (Ad+, 100%), 137 (M+-Ad, 10,7%).
Найдено, %: С 79.24, Н 9.89, N 11.06. C19H28N2. Вычислено, %: С 79.36, Н 10.36, N 10.28.
Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий:
- средство, воплощающее заявленное изобретение при его осуществлении, предназначено для применения в различных отраслях промышленности;
- для заявленного изобретения в том виде, как оно охарактеризовано в независимом пункте нижеизложенной формулы изобретения, подтверждена возможность его осуществления с помощью вышеописанных в заявке или известных до даты приоритета средств и методов;
- средство, воплощающее заявленное изобретение при его осуществлении, способно обеспечить достижение технического результата.
Следовательно, заявленное изобретение соответствует требованию "промышленная применимость".
Выводы
Разработан технологически малостадийный метод синтеза адамантилсодержащих нитрилов, позволяющий получать широкий ряд соединений с высоким выходом. Структура описанных соединений подтверждена ПК-, ПМР-, масс-спектроскопией и элементным анализом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ α-АДАМАНТИЛСОДЕРЖАЩИХ АЛИФАТИЧЕСКИХ И ЖИРНОАРОМАТИЧЕСКИХ КЕТОНОВ | 2000 |
|
RU2186760C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ АЛЬДЕГИДОВ | 2003 |
|
RU2240303C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ФТАЛИМИДОАЛКИЛАДАМАНТАНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2003 |
|
RU2247114C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ β-ДИКЕТОНОВ И КЕТОЭФИРОВ | 2000 |
|
RU2187493C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ СИММЕТРИЧНЫХ 1,4-ДИКЕТОНОВ | 2006 |
|
RU2330013C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ГАЛОГЕН-1-(ЭТОКСИКАРБОНИЛ)АЛКИЛАДАМАНТАНОВ | 2006 |
|
RU2301796C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАЛКИЛАМИДОВ 3-БРОМ-1-АДАМАНТИЛАЛКАНКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2344122C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-БРОМАДАМАНТИЛ-1-АЛКИЛ(АРИЛ)КЕТОНОВ | 2006 |
|
RU2309937C1 |
| СПОСОБ ПОЛУЧЕНИЯ N,N-ДИАЛКИЛЗАМЕЩЕННЫХ АМИДОВ АДАМАНТИЛАЛКИЛКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2348611C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ ТРИМЕТИЛБИЦИКЛО[2.2.1]ГЕПТАН-2-ОНА | 2006 |
|
RU2311401C1 |
Настоящее изобретение относится к способу получения адамантилсодержащих нитрилов общей формулы
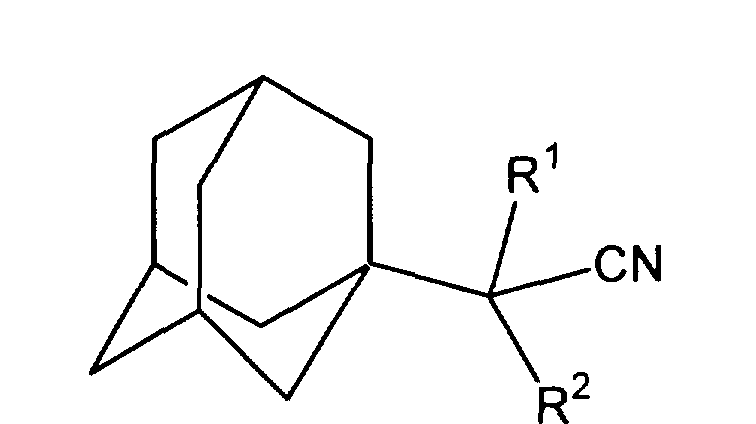
где, если R1=H, то R2=H, СН3, С2H5, (CH3)2СН2, С6Н5, С10Н7, C5H10N, C5H10NCH2, (СН2)3CN; если R1=СН3, то R2=СН3, которые являются полупродуктами для синтеза биологически активных веществ. Способ заключается в присоединении к производному адамантана соответствующего нитрила, причем в качестве производного адамантана используют 1,3-дегидроадамантан, взаимодействующий с нитрилами из ряда: ацетонитрил, пропионитрил, н-бутиронитрил, изовалеронитрил, изобутиронитрил, фенилацетонитрил, α-нафтилацетонитрил, адиподинитрил, пиперидиноацетонитрил, 3-пиперидинопропионитрил при мольном соотношении реагентов, равном 1 : 3-10, при температуре 60-140°С в течение 4-8 часов. Способ позволяет упростить получение адамантилсодержащих нитрилов, а также получать целевые соединения разветвленного строения.
Способ получения адамантилсодержащих нитрилов общей формулы
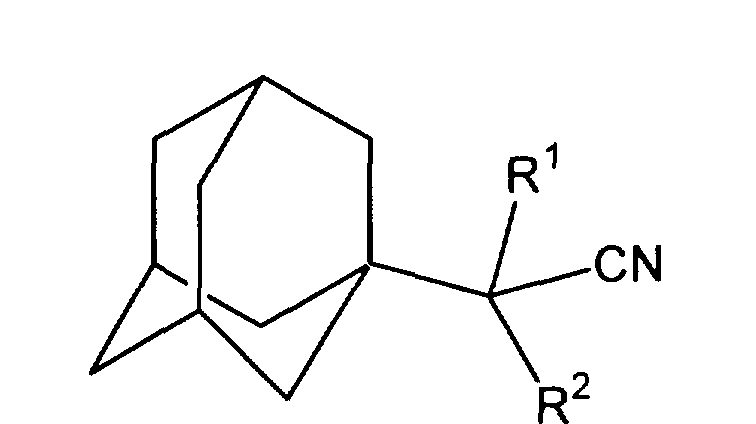
где если R1 - H, то R2 - H, СН3, С2H5, (СH3)2СН2, С6Н5, С10Н7, C5H10N, C5H10NCH2, (СН2)3СN;
если R1 - СН3, то R2 - СН3,
с использованием производного адамантана, отличающийся тем, что способ заключается в присоединении к производному адамантана соответствующего нитрила, причем в качестве производного адамантана используют 1,3-дегидроадамантан, взаимодействующий с нитрилами из ряда ацетонитрил, пропионитрил, н-бутиронитрил, изовалеронитрил, изобутиронитрил, фенилацетонитрил, α-нафтилацетонитрил, адиподинитрил, пиперидиноацетонитрил, 3-пиперидинопропионитрил при мольном соотношении реагентов, равном 1 : 3-10, при температуре 60-140°С в течение 4-8 ч.
| ХАРДИН и др | |||
| Исследование реакции дегидратации амидов адамантанкарбоновых кислот | |||
| Тезисы докладов научной конференции по химии органических полимеров | |||
| - Волгоград, 1981, с.65 | |||
| US 3821275 A, 28.06.1974 | |||
| FRESER L.F | |||
| et al | |||
| Naphthoquinone antimalarials | |||
| XXX | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Chem | |||
| Запальная свеча для двигателей | 1924 |
|
SU1967A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАЛКИЛБЕНЗИЛЦИАНИДА | 1998 |
|
RU2219165C2 |
Авторы
Даты
2004-11-20—Публикация
2003-06-02—Подача