Изобретение относится к области получения гелей, которые применяются в качестве носителей, в частности пептидов и протеинов, и может быть использовано при производстве композиций, содержащих биологически активные вещества.
Технический результат настоящего изобретения заключается в том, что разработан способ получения супрамолекулярного (супрамолекулярный - образованный в результате ассоциации частиц, удерживаемых вместе межмолекулярными взаимодействиями (а не прочными химическими связями)) тиксотропного геля, в котором структурировано от 10 до 103 массовых долей растворителя (на долю растворенных веществ, обладающих биоцидными свойствами).
Технический результат достигается тем, что при температуре от 10 до 40°С смешивают водный раствор цистеина с водным раствором нитрата серебра, так что конечные концентрации (в смеси) составили цистеина от 1·10-3 М до 6·10-2 М и нитрата серебра от 3·10-3 М до 1·10-1 М, и оставляют стоять в защищенном от света месте в течение 15-24 часов.
Исследованием уровня техники установлено, что способов получения супрамолекулярного биоцидного геля на основе цистеина и нитрата серебра не обнаруживается.
Сущность изобретения заключается в следующем.
Тиксотропный биоцидный гель на основе цистеина и нитрата серебра относится к классу сетчатых супрамолекулярных полимеров, имеющих фрактальную структуру (Б.Мандельброт. Фрактальная геометрия природы. М.: Мир, 2002; Е.Федер. Фракталы. М.: Мир, 1991; В.Смирнов. Физика фрактальных кластеров. М.: Наука, 1991).
Цистеин - это серосодержащая аминокислота, которая входит в состав кератина - основного белка ногтей, кожи и волос. Цистеин помогает обезвреживать токсические вещества и защищает организм от действия радиации. Это один из самых мощных антиоксидантов. Цистеин ускоряет выздоровление после операций, ожогов, связывает тяжелые металлы и растворимое железо, играет важную роль в активизации лейкоцитов и лимфоцитов.
В водном растворе цистеин взаимодействует с ионами серебра с образованием меркаптида серебра по SH-группе (тиольной группе). Это подтверждается данными ИК-спектроскопии: в ИК-спектре дегидратированного геля отсутствует полоса поглощения валентных колебаний тиольной группы.
В избытке ионов серебра меркаптид серебра образует ассоциаты с помощью слабых водородных, координационных связей и вандерваальсовских взамодействий. Эти ассоциаты имеют несколько активных точек дальнейшего роста: на Фиг.1 представлен результат ассоциации двух молекул меркаптида серебра и иона серебра с образованием димерной частицы (а), фрактального кластера (б) и слияния кластеров (в).
Зародышевые димерные частицы продолжают свой рост с образованием полимолекулярных ассоциатов со средним размером от нескольких нанометров до десятков и сотен нанометров, в зависимости от концентрации растворенного вещества. Это установлено с помощью метода динамического светорассеяния. Измерение интенсивности динамического светорассеяния осуществляли с помощью спектрометра, включающего AL-Sp 81 гониметр и цифровой фотонный коррелятор-структуатор ALV-5000 с углом рассеяния 90°. В качестве источника света использовали He-Ne лазер (длина волны 632,8 нм) мощностью 36 мВт. Фиг.2 иллюстрирует развитие кластерообразования во времени для раствора цистеина концентрации 1,31·10-3 М и нитрата серебра концентрации 3,73·10-3 М. С течением времени происходит увеличение среднего гидродинамического радиуса частиц (для а - 14 мин он равен 29,8 нм, б - 56 мин - 39,1 нм, в - 124 мин - 51,3 нм). Средний гидродинамический радиус частиц рассчитывается из уравнения Эйнштейна-Стокса на основании графика зависимости распределения коэффициента диффузии W(D) от коэффициента диффузии.
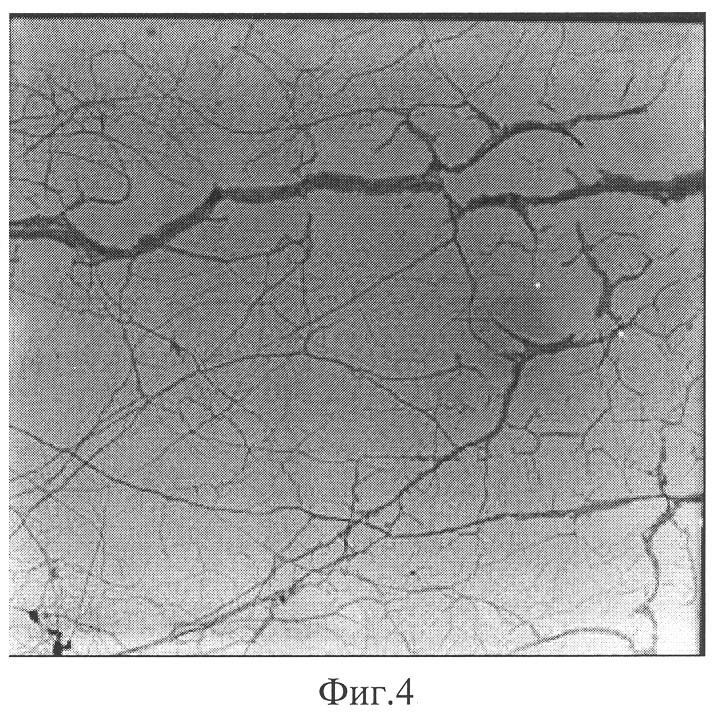
На Фиг.3 представлены данные динамического светорассеяния, которые свидетельствуют о наличии в гелеобразующей системе фрактальных кластеров различных размеров, в частности на графике а - 52,4; 1235 нм (концентрации цистеина 3,12·10-3 М, нитрата серебра 8,85·10-3 М), на графике б - 15,0; 87,5; 454,9; 1731 нм (концентрации цистеина 7,6·10-3 М, нитрата серебра 21,0·10-3 М). С увеличением концентрации компонентов увеличивается средний гидродинамический радиус частиц и число групп кластеров. Растущие фрактальные кластеры взаимодействуют между собой по поверхности раздела с образованием пространственной гель-сетки, что иллюстрируется электронно-микроскопическими снимками, полученными на пропускающем электронном микроскопе «Zeiss ЕМ 10» Фиг.4, концентрации цистеина 1,32·10-3 М, нитрата серебра 3,72·10-3 М, подтверждающие образование сетки фрактальных кластеров при формировании структуры геля.
На Фиг.5 представлены электронно-микроскопические снимки высушенных гелей, полученные на сканирующем электронном микроскопе "DSM 962", Zeiss, концентрации цистеина 1,32·10-3 М, нитрата серебра 3,72·10-3 М, иллюстрирующие самоорганизацию твердой фазы при дегидратации супрамолекулярного геля: образуются характерные дендритные и палочкообразные структуры.
Такого рода гель может служить матрицей, например, для липосом - концентрических сфер из двойных фосфолипидных слоев с включенными в них биологически активными веществами.
Изменение упругих свойств системы с течением времени можно проиллюстрировать с помощью фиг.6, на которой показана способность геля (концентрации цистеина 1,32·10-3 М, нитрата серебра 3,72·10-3 М) к деформации при переворачивании цилиндра с гелем на 180°. Видно что с увеличением времени гелеобразования (а - исходная система, в - через 24 часа, с - через 48 часов) гель теряет способность к текучести.
Основное преимущество полученного геля - способность к гелеобразованию при очень низких концентрациях в водном растворе. Биоцидные свойства геля определяются внедрением в его каркас ионов серебра.
Гель-система на основе цистеина и нитрата серебра построена из физиологически активных компонентов, не токсична, фазовоустойчива и является перспективной матрицей для включения биологически активных веществ.
Гель совместим с другими супрамолекулярными системами: липосомами, мицеллами, и это открывает возможности для конструирования новых биоматериалов.
Получение композиций с гелем нового типа, имеющим принципиально другую структуру по сравнению с полимерными гелями, позволяет резко уменьшить содержание в композиции гелеобразующих веществ.
Развитие ассортимента фармакологических препаратов, предохранение их от разрушения под воздействием специфических ферментов, содержащихся в организме человека, осуществляется по пути иммобилизации биологически активных веществ на каком-либо носителе - матрице.
Самый старый способ иммобилизации - физическая адсорбция. Ее преимущество - простота методики, доступность и дешевизна сорбентов. Недостаток - десорбция, протекающая при изменении таких характеристик физиологических жидкостей, как рН, ионная сила, температура.
Недостатков адсорбции удается избежать при иммобилизации биологически активных веществ в поры геля. В качестве гелей-матриц используют несшитые полимерные гели, образуемые полисахаридами: крахмалом, агар-агаром, альгинатом, каррагинаном - при охлаждении их горячих растворов. В последнее время получили распространение сшитые полимерные гели - поливиниловый спирт и поливинилпирролидон. Способ получения последних заключается в облучении водных растворов полимеров средней молекулярной массы ультрафиолетовым светом, гамма-излучением или потоком электронов. При этом образуются свободные радикалы, частично сшивающие полимерные цепи. Широкое распространение получили полиакриламидные гели, сшивающий агент - метилен-бис-акриламид.
Недостатками композиций на основе полимерных гелей являются гелеобразование при высоких концентрациях полимера и тот факт, что гель является балластным веществом, функции которого исчерпываются свойством быть матрицей. Длительное хранение композиций невозможно без добавления бактерицидных веществ.
Способы получения сшитых полимерных гелей сложны и требуют дорогостоящего оборудования.
Заявляемый способ имеет простое аппаратурное оформление и принципиально отличается от существующих методом подхода к формированию гель-матрицы для биологически активных веществ.
Способ осуществляется следующим образом.
При температуре от 10 до 40°С смешивают водный раствор цистеина с водным раствором нитрата серебра, так что конечные концентрации (в смеси) составили цистеина от 1·10-3 М до 6·10-2 М и нитрата серебра от 3·10-3 М до 1·10-1 М, и оставляют стоять в термостате при температуре от 10 до 40°С в течение 15-24 часов.
Изменяя соотношение компонентов, получают фрактальные кластеры желаемого объема, способные к избирательной иммобилизации биологически активных веществ.
Пример выполнения способа.
При температуре 25°С смешивают водный раствор цистеина с водным раствором нитрата серебра, так что конечные концентрации (в смеси) составили цистеина от 1,31·10-3 М и нитрата серебра от 3,73·10-3 М, и оставляют стоять в термостате при температуре 25°С в течение 24 часов.
Фиг.7 иллюстрирует способность геля к иммобилизации липосом (1 - липосомы в геле, 2 - липосомы в воде): в присутствии геля водная дисперсия липосом стабилизируется. По изменению оптической плотности водной дисперсии липосом в зависимости от времени хранения можно судить о ее устойчивости. В присутствии геля отмечается меньшее изменение оптической плотности со временем по сравнению с нестабилизированным раствором, следовательно, эта система фазоустойчива.
Выбор носителя и метода иммобилизации для каждого конкретного случая в настоящее время носит только эмпирический характер и может контролироваться только экспериментально.
Создав банк данных по структуре и объему фрактальных кластеров для супрамолекулярного геля на основе цистеина и нитрата серебра в зависимости от условий его получения, можно прогнозировать возможность иммобилизации на нем как на матрице того или иного вещества.
Полученный супрамолекулярный гель не подвергается изменениям в течение двух лет при хранении при комнатной температуре.
Разрушителями геля могут быть кислоты - рН меньше 4, щелочи - рН больше 9, ацетонитрил, изопропиловый спирт, соли переходных металлов, взятые в количествах, превышающих содержание нитрата серебра. Однако с учетом того, что в организме человека такие разрушительные факторы практически не имеют места, супрамолекулярный гель на основе цистеина и нитрата серебра можно считать очень устойчивой матрицей для иммобилизации. Одним из основных требований, предъявляемых к иммобилизуемому биологически активному веществу, является его химическая индифферентность по отношению к супрамолекулярном гелю, то есть иммобилизат не должен искажать его химическую структуру.
Заявляемый способ соответствует критерию "Промышленная применимость", так как не требует специального оборудования и может быть внедрен на существующих фармацевтических предприятиях соответствующего профиля, а необходимые препараты выпускаются отечественной промышленностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРИГОТОВЛЕНИЯ КОМПОЗИЦИЙ ЛИПОСОМ С ГЕЛЯМИ, СИНТЕЗИРОВАННЫМИ ИЗ ЦИСТЕИНА И НИТРАТА СЕРЕБРА | 2006 |
|
RU2310663C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНОЙ СИСТЕМЫ РАЗВЕТВЛЕННЫХ ФРАКТАЛЬНЫХ КЛАСТЕРОВ НА ОСНОВЕ L-ЦИСТЕИНА | 2009 |
|
RU2423384C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОКОНЦЕНТРИРОВАННЫХ ГЕЛЕЙ НА ОСНОВЕ N-АЦЕТИЛ-L-ЦИСТЕИНА И НИТРАТА СЕРЕБРА | 2013 |
|
RU2530572C1 |
| СПОСОБ ИЗМЕНЕНИЯ ЭФФЕКТИВНОЙ ВЯЗКОСТИ НИЗКОКОНЦЕНТРИРОВАННЫХ ГЕЛЕЙ НА ОСНОВЕ L-ЦИСТЕИНА И НИТРАТА СЕРЕБРА | 2009 |
|
RU2432937C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУПРАМОЛЕКУЛЯРНОГО ГИДРОГЕЛЯ | 2016 |
|
RU2641111C1 |
| КАТИОННЫЙ АНТИСЕПТИК НА ОСНОВЕ КОМПОЗИЦИЙ L-ЦИСТЕИН-СЕРЕБРЯНОГО РАСТВОРА И ПИЩЕВОГО ХИТОЗАНА | 2014 |
|
RU2562113C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ СЕРЕБРА | 2013 |
|
RU2526390C1 |
| Способ получения тиксотропных супрамолекулярных гидрогелей заданной прочности | 2017 |
|
RU2676473C1 |
| Способ получения гелей для медицинских целей на основе L-цистеина, нитрата серебра и поливинилового спирта | 2019 |
|
RU2709181C1 |
| Способ получения супрамолекулярного геля, содержащего наночастицы серебра | 2021 |
|
RU2761210C1 |





Изобретение относится к области коллоидной химии. Смешивают водный раствор цистеина с водным раствором нитрата серебра, так что конечные концентрации (в смеси) составляют от 1·10-3 М до 6·10-2 М цистеина и от 3·10-3 М до 1·10-1 М нитрата серебра, и оставляют стоять в термостате при температуре 10-40°С в течение 15-24 часов. Данное изобретение позволяет получать гель, используемый в качестве носителя для пептидов и протеинов, который обладает биоцидными свойствами и не изменяется в течение двух лет при хранении при комнатной температуре. 7 ил.
Способ получения супрамолекулярного геля, заключающийся в том, что при температуре от 10 до 40°С смешивают водный раствор цистеина с водным раствором нитрата серебра, так что конечные концентрации (в смеси) составили цистеина от 1·10-3 до 6·10-2 М и нитрата серебра от 3·10-3 до 1·10-1 М, и оставляют стоять в термостате при температуре 10-40°С в течение 15-24 ч.
| JP 7316009 А, 05.12.1995 | |||
| JP 10274631 А, 13.10.1998 | |||
| US 6348212 А, 19.02.2002 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕЛЯ | 1989 |
|
RU2026349C1 |
| ГЕЛЬ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНО-ДИСТРОФИЧЕСКИХ ПОРАЖЕНИЙ СУСТАВНОГО ХРЯЩА И МЕЖПОЗВОНОЧНЫХ ДИСКОВ "СТОПАРТРОЗ" И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2241473C2 |
Авторы
Даты
2008-02-20—Публикация
2006-03-29—Подача