Изобретения относятся к биотехнологии и марикультуре, в частности к способам получения посадочного материала в виде проростков с ризоидами красной водоросли гелидиум, и могут быть использованы для его промышленного культивирования.
Получение проростков как посадочного материала красной водоросли гелидиум, широко используемой для получения агара, очень актуально в связи с ее плантационным культивированием в ряде стран Европы и Америки и отсутствием в мировой практике быстрых и экономичных способов получения проростков, несущих ризоиды, с помощью которых растения прикрепляются к субстрату.
Известно несколько способов получения посадочного материала для плантационного (растение прикрепляется к субстрату) способа культивирования гелидиума. Техника получения проростков с ризоидами из спор зрелых дикорастущих растений один раз в году описана в работе Rojas R.H., Leon N.M., Rojas R.O. Practical and descriptive techniques for Gelidium rex (Gelidiales, Rhodophyta) culture. Hydrobiologia 1996. Vol. 326/327. P. 367-370. Выход спор стимулировался искусственно, споры оседали на мертвые раковины моллюсков и прикреплялись к ним ризоидами. Посадочный материал представлял собой проростки гелидиума, прикрепленные к раковинам. При высадке материала на плантации раковины фиксировались к субстрату.
Однако данный способ не только технически сложен, но и имеет временные ограничения, поскольку водоросли спороносят только один раз в году.
Другим способом получения проростков гелидиума является использование фрагментов длиной 4 см из верхней части слоевища, закрепление их на твердом субстрате, богатом карбонатом магния и кальция, и выращивание на этих фрагментах ризоидов в увлажняющей культуре с распылением среды (Salinas J.M.Spray system for re-attachment of Gelidium sesquipidale (Clem.) Born. et Thuret (Gelidiales, Rhodophyta). Hydrobiologia 221: 107-117, 1991).
Способ не нашел широкого применения в плантационном культивировании гелидиума из-за дороговизны и сложности, поскольку требует не только закрепления фрагментов на твердом субстрате, но и постоянного орошения.
Задача изобретения - разработка способов быстрого и массового получения проростков гелидиума с ризоидами в любое время года за счет проведения процесса выращивания в постоянно перемешиваемой и аэрируемой культуре.
Поставленная задача решается тем, что в известный способ получения посадочного материала красной водоросли гелидуим с ризоидами, включающий отбор верхушечных фрагментов слоевища водоросли и культивирование в питательной среде, согласно изобретению вносят следующие изменения, верхушечные фрагменты помещают в жидкую питательную среду, предварительно затенив их нижнюю часть, а культивирование ведут по меньшей мере в течение 5-ти недель, постоянном перемешивании и аэрировании с еженедельной сменой питательной среды.
Получение проростков гелидиума с ризоидами в жидкой перемешиваемой культуре без прикрепления к субстрату значительно упрощает и ускоряет не только способ культивирования посадочного материала, но и, как следствие, значительно снижает трудоемкость всего цикла плантационного культивирования водоросли. Получение проростков с ризоидами в постоянно перемешиваемой и аэрируемой культуре авторами заявляемого изобретения предложено впервые.
Установлено, что именно затенение нижней части верхушечных фрагментов способствует росту ризоидов у водоросли.
Культивирование в течение не менее 5-ти недель позволяет получить проростки с ризоидами. Проведение процесса менее пяти недель не обеспечивает достижения роста проростков с ризоидами, достаточного для использования их в качестве посадочного материала для дальнейшего использования в плантационной культуре.
Ведение процесса культивирования при постоянном перемешивании и аэрировании способствует нормальному развитию и росту культуры, обеспечивая таким образом получение жизнеспособного готового конечного продукта, а именно проростков гелидиума с ризоидами.
Еженедельная смена питательной среды во время культивирования дает возможность получать бактеориологически относительно чистую культуру, а также поддерживает в жидкой среде оптимальную концентрацию ингредиентов, обеспечивающих оптимальные условия роста проростков с ризоидами.
Для культивирования берут верхушечные фрагменты длиной не более 1 мм.
Использование фрагментов длиной не более 1 мм обеспечивает в нем максимальное содержание количества меристематической ткани, что оказывает влияние на скорость роста проростков на начальной их стадии культивирования и, как следствие, позволяет получить проростки с ризоидами достаточных размеров и хорошего качества за меньшее время культивирования.
Способ осуществляется следующим образом.
Пример 1
Верхние части растений (фиг.1а) очищались от эпифитов жесткой волосяной щеткой и промывались под струей стерилизованной морской воды. Затем от них отрезались верхушки ветвей длиной не более 1 см (в основном от 0,5 до 1 мм) (фиг.1б). Нижняя половина верхушечных фрагментов обворачивалась несколькими слоями черной пластиковой сетки, которая закреплялась на фрагменте силиконовой трубкой (фиг.1в). Фрагменты, завернутые в сетку, помещались в сосуды с жидкой питательной средой, где перемешивались и аэрировались пузырьками воздуха. Питательная среда заменялась на новую еженедельно. Растения выдерживались при температуре 14-15°С, освещенности около 120 мкмоль/м2 × сек, фотопериоде 12:12 (свет: темнота), солености 27.7‰ и pH 8.1. Растения культивировались в течение 5 недель.
Пример 2
Выполняют аналогично Примеру 1, только растения культивируют в течение 6 недель.
Морфофизиологические характеристики проростков, выращенных из верхних ветвей растений в перемешиваемой и аэрируемой культуре, согласно примерам 1 и 2 по сравнению с контролем без затенения представлены в табл.1, а рост и развитие ризоидов наглядно демонстрируется фиг.1, где а) верхушечные части гелидиума; б) фрагменты гелидиума длиной до 1 мм, отрезанные для культивирования; в) затененные сеткой и закрепленные на носителе фрагменты гелидиума; г) образцы гелидуума через 6 недель культивирования, имеющие пролификации в базальной части фрагмента; д) образование ризоидов на базальных пролификациях, е) внешний вид ризоидов.
Как видно из табл.1 и фиг.1, за это время длина растений увеличилась в 2.5 раза, а их вес - в 3 раза. Средняя скорость роста составляла 1.5% в день (табл. 1). В верхней (свободной от сетки) части фрагментов на ветвях второго порядка появились пролификации в виде ветвей третьего порядка. В нижней (закрытой сеткой) части фрагментов пролификации были обнаружены только в области среза (фиг.1е). В верхней половине пролификации в 90% случаев появились ризоиды (фиг.1д, е, табл. 1). Таким образом, за 5-6 недель культивирования верхушечных частей гелидиума в перемешиваемой и культивируемой культуре с затенением базальной части фрагментов были получены проростки, имеющие ризоиды, которые могут быть использованы как посадочный материал для дальнейшего плантационного культивирования.
Заявляемый изобретением технический результат достигается также тем, что в известном способе получения посадочного материала красной водоросли гелидуим с ризоидами, включающем отбор верхушечных фрагментов слоевища водоросли и культивирование в жидкой питательной среде, согласно изобретению перед культивированием в жидкой питательной среде верхушечные фрагменты подвергают глубокой заморозке в течение 10-30 мин, затем оттаивают при комнатной температуре и выдерживают в жидкой питательной среде 1-2 недели с ежедневной ее заменой. Для культивирования отбирают у оттаивших водорослей верхушки ветвей, а культивирование ведут в течение не менее шести недель при постоянном перемешивании и аэрировании с еженедельной сменой питательной среды.
Глубокая заморозка значительно позволяет упростить отбор жизнеспособного материала для дальнейшего получения проростков с ризоидами. Кроме того, в этом жизнеспособном материале - верхушечных микрофрагментах, полученных после размораживания, живыми остаются только клетки меристематической ткани, что существенно повышает впоследствии скорость роста проростков, а мертвая паренхиматозная ткань затеняет часть проростков.
Заморозку ведут в течение 10-30 минут. Ведение заморозки менее 10 минут не обеспечивает глубокого промораживания исходного материала и в результате не позволяет получить качественный исходный материал для культивирования, а это в свою очередь приводит к увеличению длительности процесса получения посадочного материала с ризоидами необходимых размеров. Проведение процесса заморозки более 30 минут нецелесообразно, поскольку это никоим образом не сказывается на качестве получения исходного материала для культивирования.
Выдержка оттаивших водорослей в питательной среде в течение одной-двух недель позволяет не только подрасти оставшейся жизнеспособной меристатической ткани, но и способствует визуальному проявлению четких контуров между живой меристатической тканью и мертвой паренхиматозной тканью слоевищ, которая за это время обесцвечивается. Выдержка менее одной недели не обеспечивает достижение вышеуказанного эффекта и, как следствие, осложняет отделение меристематической ткани и замедляет способ получения жизнеспособного материала, а выдержка более двух недель не оказывает влияния на процесс разделения живой и мертвой ткани. Ежедневная смена питательной среды в процессе оттаивания позволяет получить бактериологически относительно чистую культуру.
Культивирование посадочного материала осуществляют путем выдержки в жидкой питательной среде в течение не менее 6-ти недель при постоянном перемешивании и аэрировании. Именно данное время выдержки позволяет получить проростки с ризоидами достаточных размеров, которые в дальнейшем могут использоваться как посадочный материал.
Проведение культивирования проростков гелидиума и получение на них ризоидов в интенсивно перемешиваемой культуре авторами предложено впервые. Постоянное аэрирование необходимо для поддержания жизнедеятельности и роста проростков.
Еженедельная смена жидкой питательной среды в процессе культивирования дает возможность избежать массового появления бактерий, а также поддерживает в жидкой питательной среде оптимальную концентрацию ингредиентов, обеспечивающих оптимальные условия роста проростков.
Пример 3
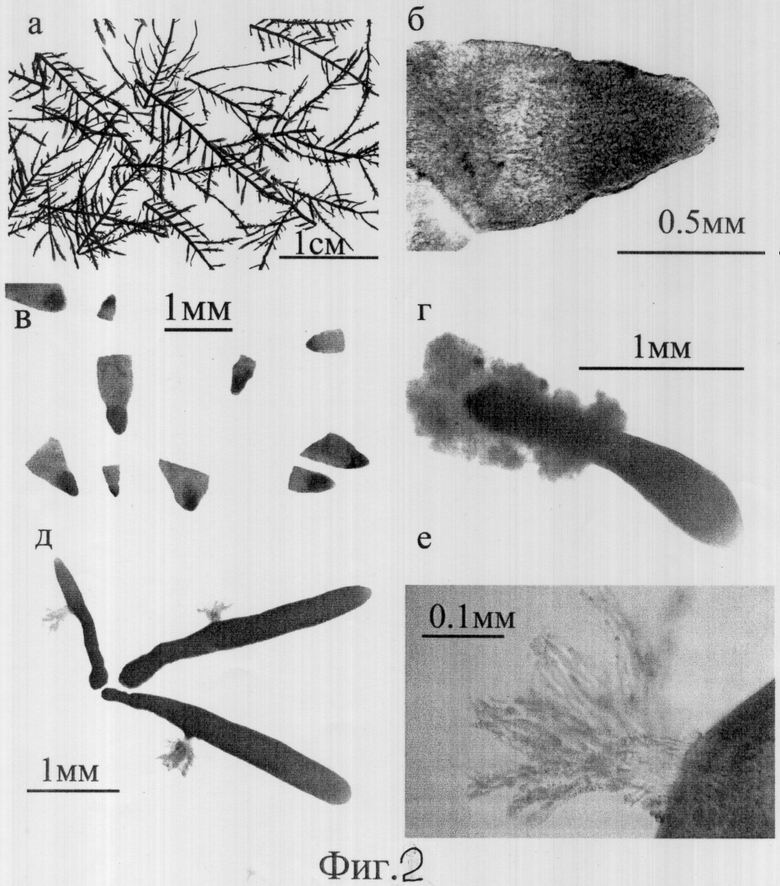
Верхнюю часть талломов гелидиума очищают от эпифитов, как описано в примере 1. Затем от верхних частей растений отрезают фрагменты длиной 2-3 см, имеющие наибольшее количество ветвей второго и третьего порядков (фиг.2а). Фрагменты промокают фильтровальной бумагой и заворачивают в алюминиевую фольгу. Пакет с водорослями помещают в цилиндр, сделанный из папье-маше, цилиндр закрывают с обеих сторон пробками и помещают в шкаф глубокого охлаждения (-80°С) на 10 мин. После глубокого охлаждения водоросли размораживают при комнатной температуре. Водоросли после оттаивания помещают в чашки с жидкой питательной средой на 1 неделю. Питательную среду в чашках меняют ежедневно. Замораживание водорослей приводит к гибели всех клеток слоевища, кроме меристематических. Через две недели выдерживания водорослей в питательной среде погибшие клетки обесцвечиваются, а клетки меристемы продолжают делиться, оставаясь яркоокрашенными, что дает возможность идентифицировать живую ткань в верхушечной части ветвей (фиг.2б). Затем отрезаются верхушки ветвей, содержащие живую и мертвую части (фиг.2в), помещают в сосуды с жидкой питательной средой и культивируют в перемешиваемой и аэрируемой культуре в течение 6 недель, как сказано в примере 1.
Пример 4
Верхнюю часть талломов гелидиума очищают от эпифитов, как описано в примере 1. Затем от верхних частей растений отрезают фрагменты длиной 2-3 см, имеющие наибольшее количество ветвей второго и третьего порядков (фиг.2а). Фрагменты промокают фильтровальной бумагой и заворачивают в алюминиевую фольгу. Пакет с водорослями помещают в цилиндр, сделанный из папье-маше, цилиндр закрывают с обеих сторон пробками и помещают в шкаф глубокого охлаждения (-80°С) на 30 мин. После глубокого охлаждения водоросли размораживают при комнатной температуре. Водоросли после оттаивания помещают в чашки с жидкой питательной средой на 2 недели. Питательную среду в чашках меняют ежедневно. Замораживание водорослей приводит к гибели всех клеток слоевища, кроме меристематических. Через две недели выдерживания водорослей в питательной среде погибшие клетки обесцвечиваются, а клетки меристемы продолжают делиться, оставаясь яркоокрашенными, что дает возможность идентифицировать живую ткань в верхушечной части ветвей (фиг.2б). Затем отрезаются верхушки ветвей, содержащие живую и мертвую части (фиг.2в), помещают в сосуды с жидкой питательной средой и культивируют в перемешиваемой и аэрируемой культуре в течение 8 недель, как сказано в примере 3.
Изменение биомассы и относительная скорость роста двух образцов замороженных-оттаянных верхушечных фрагментов ветвей слоевища гелидиума при культивировании в жидкой питательной среде, при перемешивании и аэрировании согласно примерам 3 и 4 представлены в таблице 2 (где первая цифра соответствует примеру 3, а вторая - примеру 4), а на фото 2 наглядно показано развитие проростков при культивировании, где на фиг.2а показан исходный материал, верхние части; 2б - точка роста слоевища после замораживания-оттаивания с живой меристематической и мертвой паренхиматозной тканями; 2в - верхушки ветвей слоевища гелидиума после зхамораживания-оттаивания и содержания в жидкой питательной среде в течение 2-х недель, являющегося исходным материалом для выращивания проростков с ризоидами; 2г - проросток гелидиума после 4-х недель культивирования, мертвая паренхиматозная ткань затеняет растущий проросток; 2д - проросток гелидиума с ризоидами после 8-ми недель культивирования; 2е - внешний вид ризоидов.
Как видно из представленных результатов, в течение первой недели культивирования рост фрагментов отсутствует. Наибольшая скорость роста фрагментов до 12% в сутки отмечена к четвертой неделе выращивания (табл. 2). В это время одна часть проростка покрыта (затеняется) мертвой тканью, другая находится вне нее (фиг.2г). В течение 8 недель культивирования биомасса образца растущих фрагментов увеличивается в 30-40 раз (табл. 2). В конце эксперимента проростки представляют собой молодые талломы длиной 3-5 мм, имеющие одну точку роста и один пучок ризоидов (фиг.2д, е). Эти молодые талломы могут быть использованы как посадочный материал в плантационной культуре.
Таким образом, заявляемые технические решения решают проблемы массового и быстрого получения проростков из красных водорослей с ризоидами для экстенсивного, плантационного и интенсивного культивирования красных водорослей в любое время года. Авторами впервые предложено получать проростки гелидиума с ризоидами без закрепления их на субстрат в интенсивно перемешиваемой жидкой культуре.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОСАДОЧНОГО МАТЕРИАЛА МОРСКИХ КРАСНЫХ ВОДОРОСЛЕЙ (ВАРИАНТЫ) | 2006 |
|
RU2318375C1 |
| Способ совместного разведения ламинарии и морского ежа | 2021 |
|
RU2764265C1 |
| Способ клонального микроразмножения растений сем. Betulaceae | 2016 |
|
RU2627194C1 |
| Способ аэропонного выращивания каучуконосного растения кок-сагыз Taraxacum kok-saghyz R | 2022 |
|
RU2779988C1 |
| Способ размножения катальпы бигнониевидной (Catalpa bignonioides) | 2024 |
|
RU2834051C1 |
| Способ культивирования красной водоросли грацилярии | 1988 |
|
SU1630675A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЧЕРНОМОРСКОЙ КРАСНОЙ ВОДОРОСЛИ GELIDIUM SPINOSUM (GREV.) BORN. ET THUR (RHODOPHYTA) | 2017 |
|
RU2691579C2 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК РАСТЕНИЙ PANAX GINSENG C.A. MEY - ПРОДУЦЕНТ ГИНЗЕНОЗИДОВ | 1992 |
|
RU2038378C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЛАМИНАРИИ В ОДНОГОДИЧНОМ ЦИКЛЕ В УСЛОВИЯХ ДАЛЬНЕГО ВОСТОКА | 1995 |
|
RU2077840C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ПОЛЕЙ БУРОЙ ВОДОРОСЛИ ЛАМИНАРИИ | 2004 |
|
RU2264082C1 |

Изобретения относятся к биотехнологии и марикультуре, в частности к промышленному культивированию посадочного материала красных водорослей с ризоидами. Способ включает отбор верхушечных фрагментов слоевища водоросли и культивирование их в жидкой питательной среде, предварительно затенив их нижнюю часть. Культивирование ведут в течение не менее 5-ти недель при постоянном перемешивании и аэрировании с еженедельной сменой питательной среды. Для культивирования берут верхушечные фрагменты длиной не более 1 мм. Во втором способе перед культивированием в жидкой питательной среде верхушечные фрагменты подвергают глубокой заморозке в течение 10-30 мин. Затем оттаивают при комнатной температуре и выдерживают в жидкой питательной среде 1-2 недели, после чего отбирают живые верхушки ветвей. Культивирование ведут в течение не менее 6-ти недель при периодическом освещении, постоянном перемешивании и аэрировании с еженедельной сменой питательной среды. Изобретения позволяют быстро получить проростки из красных водорослей с ризоидами без закрепления их на субстрат в интенсивно перемешиваемой жидкой культуре для экстенсивного, плантационного и интенсивного культивирования красных водорослей в любое время года. 2 н. и 1 з.п. ф-лы, 2 ил., 2 табл.
| SALINAS J.M.Spray system for re-attachment of Gelidium sesquipidale (Clem.) Born | |||
| et Thuret (Gelidiales, Rhodophyta), Hydrobiologia 221:107-117, 1991; PETEIRO С., SALINAS J.M., FREIRE O., FUERTES С | |||
| Cultivation of the autoctonous seaweed Laminaria saccharina off the Galician coast (NW Spain): production and features of the sporophytes for an annual |
Авторы
Даты
2008-03-10—Публикация
2006-07-31—Подача