Область техники
Настоящее изобретение относится к производным бензонафтоазулена класса тиофенов, к их фармакологически приемлемым солям и сольватам, к способам и промежуточным продуктам для их получения, а также к их противовоспалительным эффектам, в особенности к ингибированию продуцирования фактора некроза опухоли-α (ФНО-α) и к ингибированию продуцирования интерлейкина-1 (ИЛ-1), а также к их болеутоляющему действию.
Предшествующий уровень
Некоторые производные 1,3-диазадибензоазулена и их соли хорошо известны в качестве нового класса соединений, обладающих противовоспалительным действием (патенты США №№ 3711489, 4198421 и патент Канады № 967573). Из класса 1-тиадибензоазуленов в литературе раскрыты производные, замещенные в положении 2 метилом, метилкетоном, нитрогруппой или карбоксильной группой (Cagniant PG, C.R. Hebd. Sceances Acad. Sci, 1976, 283:683-686) и производные 1-тиадибензоазулена, имеющие алкилоксизаместители в положении 2 (WO 01/878990), которые также обладают сильным противовоспалительным действием.
Хорошо известны также некоторые бензонафтоазулены класса тиофенов, такие как 9,14-дигидро-9,14-диоксо-8-окса-1-тиабензо[е]нафто[3,2-h]азулены, у которых положение 3 замещено цианогруппой, а в положении 2 в качестве заместителя может быть амин, мочевина или ацетамид (Nyiondi-Bonguen E et. al., J. Chem. Soc., Perkin Trans. 1, 1994, 15: 2191-2195). Однако в соответствии с имеющимися у авторов сведениями и доступными литературными данными бензонафтоазулены класса тиофенов согласно настоящему изобретению не известны. Неизвестно также, что такие соединения могли бы обладать противовоспалительным действием в качестве ингибиторов секреции ФНО-α и в качестве ингибиторов секреции ИЛ-1, а также болеутоляющим действием. В 1975г. ФНО-α был определен как сывороточный фактор, индуцированный эндотоксином и вызывающий некроз опухоли in vitro и in vivo (Carswell EA et al., Proc. Natl. Acad. Sci. U.S.A., 1975, 72:3666-3670). Кроме противоопухолевого действия ФНО-α обладает также другими многочисленными биологическими действиями, являющимися важными в гомеостазе организмов и при патофизиологических состояниях. Основные источники ФНО-α представляют собой моноциты-макрофаги, Т-лимфоциты и лаброциты.
Обнаружение того, что антитела анти-ФНО-α (сA2) обладают действием при лечении больных ревматоидным артритом (РА) (Elliott M et al., Lancet, 1994, 344:1105-1110) привело к повышенной заинтересованности в нахождении новых ингибиторов ФНО-α как возможных сильнодействующих лекарственных средств для РА. Ревматоидный артрит является аутоиммунным хроническим воспалительным заболеванием, характеризующимся необратимыми патологическими изменениями в суставах. Кроме использования при РА, антагонисты ФНО-α могут быть использованы также при многочисленных патологических состояниях и заболеваниях, таких как спондилит, остеоартрит, подагра и другие артритные состояния, сепсис, септический шок, токсический шок, атопический дерматит, контактный дерматит, псориаз, гломерулонефрит, красная волчанка, склеродермия, астма, кахексия, хроническое обструктивное заболевание легких, остановка сердца, инсулинорезистентность, фиброз легких, рассеянный склероз, болезнь Крона, язвенный колит, вирусные инфекции и AIDS (СПИД).
Доказательство биологической важности ФНО-α было получено в испытаниях in vivo, осуществляемых на мышах, в которых инактивировали гены мышей, отвечающие за ФНО-α или его рецептор. Такие животные были резистентны к вызванному коллагеном артриту (Mori L et al., J. Immunol., 1996, 157:3178-3182) и к вызванному эндотоксином шоку (Pfeffer K. et al., Cell, 1993, 73:457-467). Когда в испытаниях на животных уровень ФНО-α повышался, проявлялся хронический воспалительный полиартрит (Georgopoulos S et al., J. Inflamm., 1996, 46:86-97; Keffer J. et al., EMBO J., 1991, 10:4025-4031) и его патологическая картина смягчалась ингибиторами продуцирования ФНО-α. Лечение таких воспалительных и патологических состояний обычно включает употребление нестероидных противовоспалительных лекарственных средств, а в более тяжелых случаях вводят соли золота, D-пенициллинамин или метотрексат. Данные лекарственные средства действуют симптоматически, но они не останавливают патологический процесс. Новые подходы в терапии ревматоидного артрита основаны на лекарственных средствах, таких как тенидап, лефлуномид, циклоспорин, FK-506, и на биомолекулах, нейтрализующих действие ФНО-α. В настоящее время имеются коммерчески доступный этанерсепт (Enbrel, Immunex/Wyeth), слитый белок растворимого рецептора ФНО-α, и инфликсимаб (Remicade, Centocor) - химерное моноклональное антитело человека и мыши. Кроме использования в терапии РА, этанерсепт и инфликсимаб зарегистрированы так же, как лекарственные средства для терапии болезни Крона (Exp. Opin. Invest. Drugs, 2000, 9:103).
Кроме ингибирования секреции ФНО-α, в терапии РА очень важно также ингибирование секреции ИЛ-1, поскольку ИЛ-1 является важным цитокином в регуляции и иммунорегуляции клеток, а также в патофизиологических состояниях, таких как воспаление (Dinarello CA et al., Rev. Infect. Disease, 1984, 6:51). Хорошо известные виды биологической активности ИЛ-1 представляют собой активацию Т-лимфоцитов, индуцирование повышенной температуры, стимуляцию секреции простагландина или коллагеназы, хемотаксис нейтрофилов и уменьшение уровня железа в плазме (Dinarello CA, J. Clinical Immunology, 1985, 5:287). Два рецептора, с которыми может быть связан ИЛ-1, хорошо известны ИЛ-1RI и ИЛ-1RII. В то время как ИЛ-1RI передает сигнал внутриклеточно, ИЛ-1RII расположен на поверхности клеток и не передает сигнал внутрь клеток. Так как ИЛ-1RII связывает ИЛ-1, а также ИЛ-1RI, он может действовать как отрицательный регулятор действия ИЛ-1. Кроме указанного механизма регуляции передачи сигнала, в клетках присутствует другой природный антагонист рецептора ИЛ-1 (ИЛ-1ra). Данный белок связывается с ИЛ-1RI, но не передает какой-либо сигнал. Однако его действенность в прекращении передачи сигнала является невысокой и его концентрация для достижения разрыва в передаче сигнала должна быть в 500 раз больше концентрации ИЛ-1. Рекомбинантный человеческий ИЛ-1ra (Amgen) был клинически испытан (Bresnihan B et al., Arthrit. Rheum., 1996, 39:73), и полученные результаты показали улучшение клинической картины у 472 больных РА по сравнению с плацебо. Полученные результаты показывают важность ингибирования действия ИЛ-1 в лечении заболеваний, таких как РА, при которых нарушено продуцирование ИЛ-1. Поскольку существует синергическое действие ФНО-α и ИЛ-1, бензонафтоазулены могут быть использованы при лечении состояний и заболеваний, связанных с повышенной секрецией ФНО-α и ИЛ-1.
Сущность изобретения
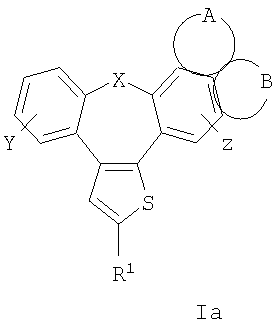
Настоящее изобретение относится к бензонафтоазуленам формулы I
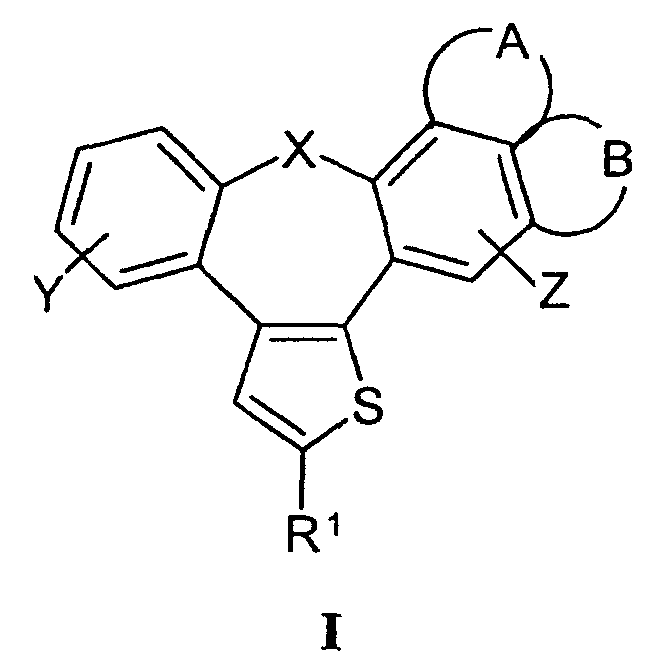
где Х может представлять собой СН2 или гетероатом, такой как О, S, S(=O), S(=O)2 или NRa, где Ra представляет собой водород или защитную группу;
Y и Z независимо друг от друга означают один или несколько идентичных или различных заместителей, связанных с любым доступным атомом углерода, и могут представлять собой водород, галоген, С1-С4-алкил, С2-С4-алкенил, С2-С4-алкинил, трифторметил, галоген-С1-С4-алкил, гидрокси, С1-С4-алкокси, трифторметокси, С1-С4-алканоил, амино, амино-С1-С4-алкил, С1-С4-алкиламино, N-(С1-С4-алкил)амино, N,N-ди(С1-С4-алкил)амино, тиол, С1-С4-алкилтио, сульфонил, С1-С4-алкилсульфонил, сульфинил, С1-С4-алкилсульфинил, карбокси, С1-С4-алкоксикарбонил, нитро;
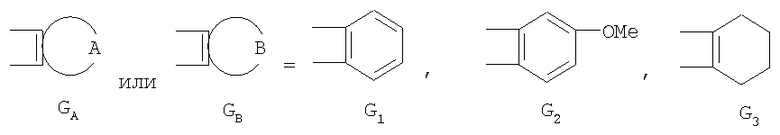
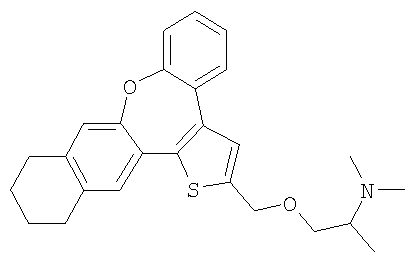
GА или GВ:

независимо друг от друга означают один или несколько идентичных или различных заместителей, связанных с любым доступным атомом углерода, и могут представлять собой галоген, С1-С4-алкил, С2-С4-алкенил, С2-С4-алкинил, трифторметил, галоген-С1-С4-алкил, гидрокси, С1-С4-алкокси, трифторметокси, С1-С4-алканоил, амино, амино-С1-С4-алкил, С1-С4-алкиламино, N-(С1-С4-алкил)амино, N,N-ди(С1-С4-алкил)амино, тиол, С1-С4-алкилтио, сульфонил, С1-С4-алкилсульфонил, сульфинил, С1-С4-алкилсульфинил, карбокси, С1-С4-алкоксикарбонил, нитро;
R1 может представлять собой галоген, необязательно замещенный С1-С7-алкил или С2-С7-алкенил, С2-С7-алкинил, необязательно замещенный арил или гетероарил и гетероцикл, гидрокси, гидрокси-С2-С7-алкенил, гидрокси-С2-С7-алкинил, С1-С7-алкокси, тиол, тио-С2-С7-алкенил, тио-С2-С7-алкинил, С1-С7-алкилтио, амино-С1-С7-алкил, амино-С2-С7-алкенил, амино-С2-С7-алкинил, амино-С1-С7-алкокси, С1-С7-алканоил, ароил, оксо-С1-С7-алкил, С1-С7-алканоилокси, карбокси, необязательно замещенный С1-С7-алкилоксикарбонил или арилоксикарбонил, карбамоил, N-(С1-С7-алкил)карбамоил, N,N-ди(С1-С7-алкил)карбамоил, циано-С1-С7-алкил, сульфонил, С1-С7-алкилсульфонил, сульфинил, С1-С7-алкилсульфинил, нитро или заместитель формулы II
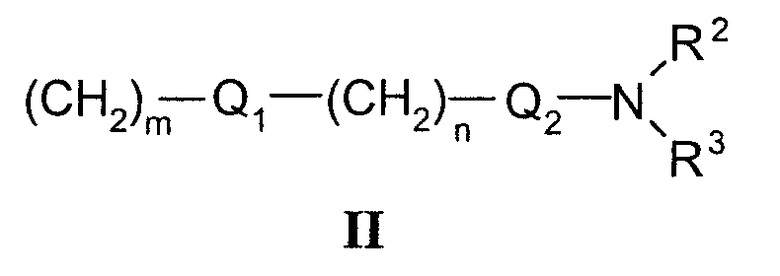
где R2 и R3 одновременно или независимо друг от друга могут представлять собой водород, C1-C4-алкил, арил или вместе с N означают необязательно замещенный гетероцикл или гетероарил;
n представляет собой целое число от 0 до 3;
m представляет собой целое число от 1 до 3;
Q1 и Q2 независимо друг от друга представляют собой кислород, серу или группы:
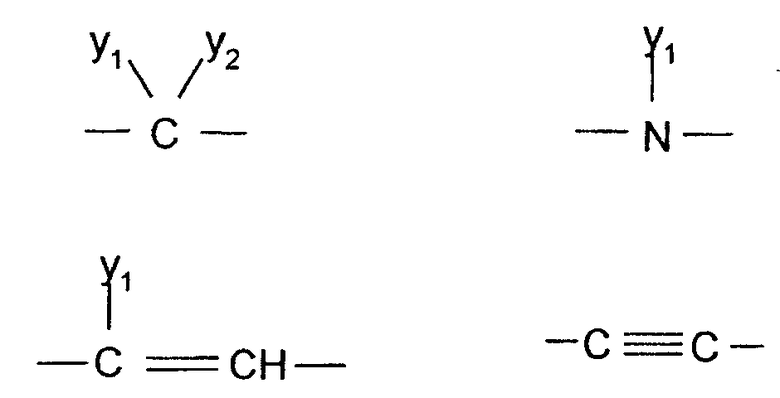
где заместители Y1 и Y2 независимо друг от друга могут представлять собой водород, галоген, необязательно замещенный C1-C4-алкил или арил, гидрокси, C1-C4-алкокси, C1-C4-алканоил, тиол, C1-C4-алкилтио, сульфонил, C1-C4-алкилсульфонил, сульфинил, C1-C4-алкилсульфинил, нитро или образуют вместе карбонильную или иминогруппу;
а также к их фармакологически приемлемым солям и сольватам.
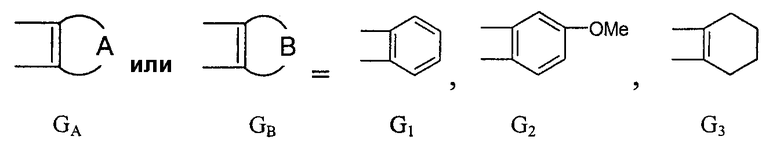
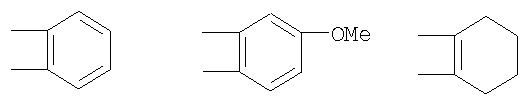
Предпочтительны соединения, где Х означает S или О; Y и Z означают Н; R1 означает CO2Et, СН2ОН; R1 означает формулу II; символ m равен 1, n равно 1 или 2, Q1 означает О и Q2 означает CH2; R2 и/или R3 означают Н, СН3 или вместе с N означают морфолин-4-ил, пиперидин-1-ил или пирролидин-1-ил; GА или GВ означают структуры
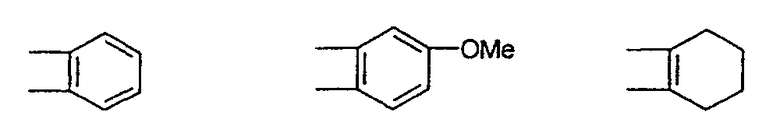
Термин «гало», «гал» или «галоген» относится к атому галогена, который может представлять собой фтор, хлор, бром или иод.
Термин «алкил» относится к алкильным группам со значением алканов, из которых произведены радикалы, которые могут быть прямыми, разветвленными или циклическими или могут представлять собой комбинацию прямого и циклического радикала и разветвленного и циклического радикала. Предпочтительными прямыми или разветвленными алкилами являются, например, метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил. Предпочтительными циклическими алкилами являются, например, циклопентил или циклогексил.
Термин «галогеналкил» относится к алкильным группам, которые должны быть замещены, по меньшей мере, одним атомом галогена. Наиболее часто галогеналкилы представляют собой, например, хлорметил, дихлорметил, трифторметил или 1, 2-дихлорпропил.
Термин «алкенил» относится к алкенильным группам, имеющим значение углеводородных радикалов, которые могут быть прямыми, разветвленными или циклическими или могут представлять собой комбинацию прямого и циклического радикала или разветвленного и циклического радикала, но имеющим при этом, по меньшей мере, одну углерод-углеродную двойную связь. Наиболее часто алкенилы представляют собой этенил, пропенил, бутенил или циклогексенил.
Термин «алкинил» относится к алкинильным группам, имеющим значение углеводородных радикалов, которые являются прямыми или разветвленными и содержат, по меньшей мере, одну и не более чем две углерод-углеродные тройные связи. Наиболее часто алкинилы представляют собой, например, этинил, пропинил или бутинил.
Термин «алкокси» относится к прямым или разветвленным цепям алкоксильной группы. Примерами таких групп являются метокси, пропокси, пропил-2-окси, бутокси, бутил-2-окси или метилпропил-2-окси.
Термин «арил» относится к группам, имеющим значение ароматического кольца, например к фенилу, а также к конденсированным ароматическим кольцам. Арил содержит одно кольцо, по меньшей мере, с 6 атомами углерода или два кольца, содержащих в целом 10 атомов углерода, при этом кольца имеют чередующиеся двойные (резонансные) связи между атомами углерода. Наиболее часто используемые арилы представляют собой, например, фенил или нафтил. Арильные группы могут быть обычно связаны с остальной молекулой любым доступным атомом углерода через простую связь или через С1-С4-алкиленовую группу, такую как метилен или этилен.
Термин «гетероарил» относится к группам, имеющим значение ароматической и частично ароматической группы моноциклического или бициклического кольца с 4-12 атомами, по меньшей мере, один из которых представляет собой гетероатом, такой как O, S или N, и доступный атом азота или атом углерода является местом связывания группы с остальной молекулой или через простую связь или через определенную выше С1-С4-алкиленовую группу. Примерами групп указанного типа являются тиофенил, пирролил, имидазолил, пиридинил, оксазолил, тиазолил, пиразолил, тетразолил, пиримидинил, пиразинил, хинолинил или триазинил.
Термин «гетероцикл» относится к пятичленным или шестичленным полностью насыщенным или частично ненасыщенным гетероциклическим группам, содержащим, по меньшей мере, один гетероатом, такой как O, S или N, и доступный атом азота или атом углерода является местом связывания группы с остальной молекулой или через простую связь или через определенную выше С1-С4-алкиленовую группу. Наиболее часто встречающимися примерами таких групп являются морфолинил, пиперидинил, пиперазинил, пирролидинил, пиразинил или имилазолил.
Термин «алканоильная» группа относится к прямым цепям ацильной группы, такой как формильная, ацетильная или пропаноильная.
Термин «ароильная» группа относится к ароматическим ацильным группам, таким как бензоильная.
Термин «необязательно замещенный алкил» относится к алкильным группам, которые могут быть необязательно дополнительно замещены одним, двумя, тремя или более заместителями. Такие заместители могут представлять собой атом галогена (предпочтительно фтор или хлор), гидрокси, С1-С4-алкокси (предпочтительно метокси или этокси), тиол, С1-С4-алкилтио (предпочтительно метилтио или этилтио), амино, N-(C1-C4)алкиламино (предпочтительно N-метиламино или N-этиламино), N,N-ди(С1-С4-алкил)амино (предпочтительно диметиламино или диэтиламино), сульфонил, С1-С4-алкилсульфонил (предпочтительно метилсульфонил или этилсульфонил), сульфинил, С1-С4-алкилсульфинил (предпочтительно метилсульфинил).
Термин «необязательно замещенный алкенил» относится к алкенильным группам, необязательно дополнительно замещенным одним, двумя или тремя атомами галогена. Такие заместители могут представлять собой, например, 2-хлорэтенил, 1,2-дихлорэтенил или 2-бромпропен-1-ил.
Термин «необязательно замещенный арил, гетероарил или гетероцикл» относится к арильной, гетероарильной или гетероциклической группам, которые могут быть необязательно дополнительно замещены одним или двумя заместителями. Заместители могут представлять собой галоген (предпочтительно хлор или фтор), С1-С4-алкил (предпочтительно метил, этил или изопропил), циано, нитро, гидрокси, С1-С4-алкокси (предпочтительно метокси или этокси), тиол, С1-С4-алкилтио (предпочтительно метилтио или этилтио), амино, N-(C1-C4)алкиламино (предпочтительно N-метиламино или N-этиламино), N,N-ди(С1-С4-алкил)амино (предпочтительно N,N-диметиламино или N,N-диэтиламино), сульфонил, С1-С4-алкилсульфонил (предпочтительно метилсульфонил или этилсульфонил), сульфинил, С1-С4-алкилсульфинил (предпочтительно метилсульфинил).
Когда Х означает NRa и Ra означает защитную группу, тогда Ra относится к таким группам, как алкильная (предпочтительно метильная или этильная), алканоильная (предпочтительно ацетильная), алкоксикарбонильная (предпочтительно метоксикарбонильная или трет-бутоксикарбонильная), арилметоксикарбонильная (предпочтительно бензилоксикарбонильная), ароильная (предпочтительно бензоильная), арилалкильная (предпочтительно бензильная), алкилсилильная (предпочтительно триметилсилильная) или алкилсилилалкоксиалкильная (предпочтительно триметилсилилэтоксиметильная).
Когда R2 и R3 вместе с N означают гетероарил или гетероцикл, это означает, что такие гетероарилы или гетероциклы имеют, по меньшей мере, один атом углерода, замещенный атомом азота через группы, которые связаны с остальной молекулой. Примерами таких групп являются морфолин-4-ил, пиперидин-1-ил, пирролидин-1-ил, имидазол-1-ил или пиперазин-1-ил.
Термин «фармацевтически приемлемые соли» относится к солям соединений формулы I и включает, например, соли с С1-С4-алкилгалогенидами (предпочтительно с метилбромидом, метилхлоридом) (соли четвертичного аммония), с неорганическими кислотами (такими как хлористоводородная, бромистоводородная, фосфорная, метафосфорная, азотная или серная кислота) или с органическими кислотами (такими как винная, уксусная, лимонная, малеиновая, молочная, фумаровая, бензойная, янтарная, метансульфоновая или п-толуолсульфоновая кислота).
Некоторые соединения формулы I могут образовывать соли с органическими или неорганическими кислотами или основаниями и они также включены в настоящее изобретение.
Предметом настоящего изобретения являются также сольваты (наиболее часто гидраты), которые могут образовывать соединения формулы I или их соли.
В зависимости от природы конкретных заместителей соединения формулы I могут иметь геометрические изомеры и один или несколько хиральных центров, так что могут существовать энантиомеры или диастереоизомеры. Настоящее изобретение относится также к таким изомерам и их смесям, включающим рацематы.
Настоящее изобретение относится также ко всем возможным таутомерным формам конкретных соединений формулы I.
Следующая цель настоящего изобретения состоит в получении соединений формулы I в соответствии со способами, включающими
а) для получения соединений формулы I, где R1 представляет собой алкилоксикарбонил,
циклизацию соединения формулы III
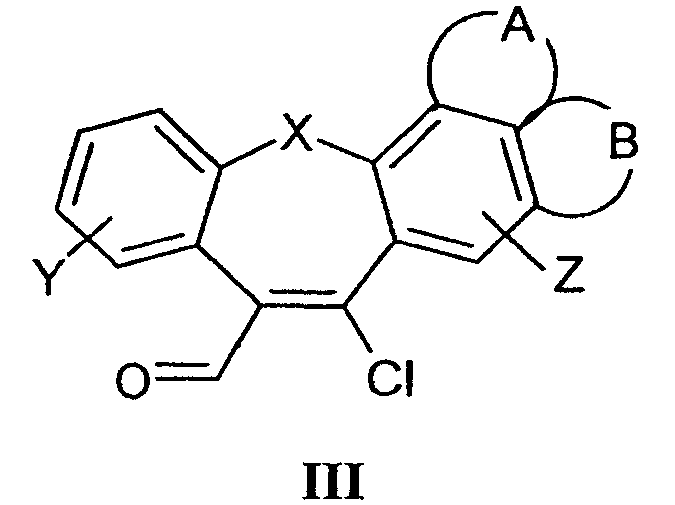
со сложными эфирами меркаптоуксусной кислоты;
b) для получения соединений формулы I, где Q1 означает -О-,
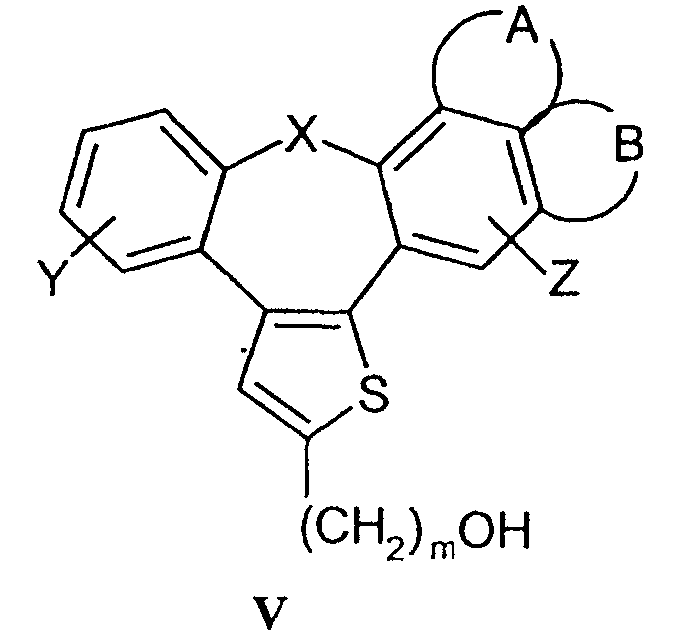
взаимодействие спиртов формулы V
с соединениями формулы IV
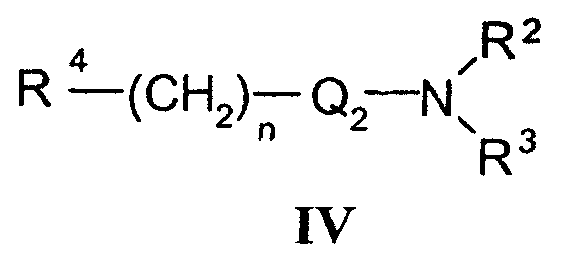
где R4 означает удаляемую группу;
с) для получения соединений формулы I, где Q1 означает -О-, -NH-, -S- или -С С-,
С-,
взаимодействие соединений формулы Va
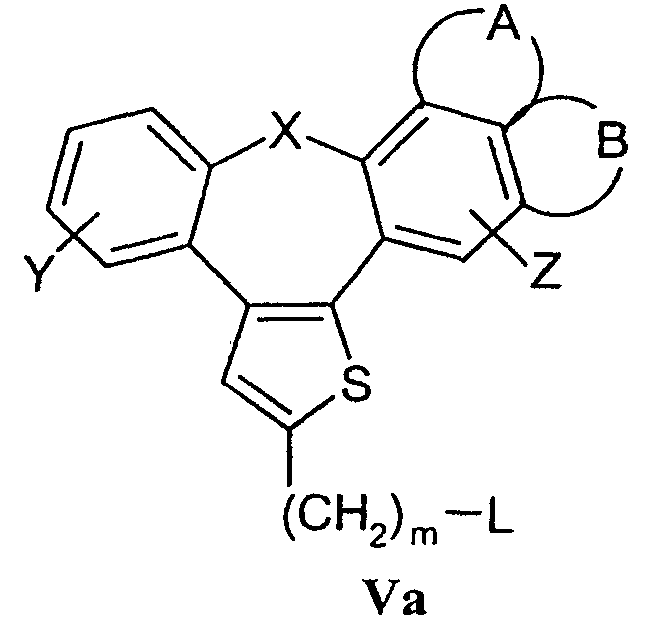
где L означает удаляемую группу с соединениями формулы IVa
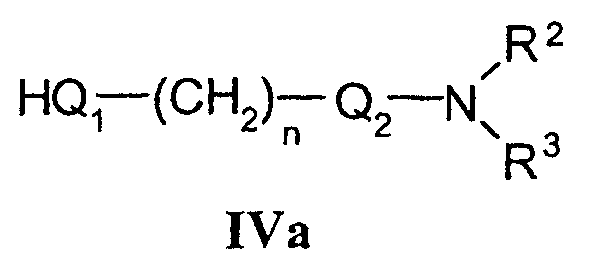
d) для получения соединений формулы I, где Q1 означает гетероатом -О-, -NH- или -S-,
взаимодействие соединений формулы Vb
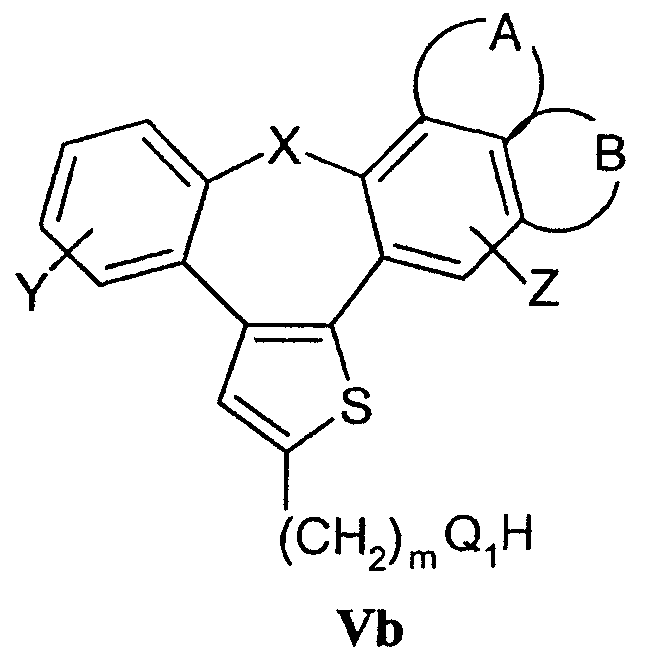
с соединениями формулы IV, где R4 означает удаляемую группу;
е) для получения соединений формулы I, где Q1 означает -С=С-,
взаимодействие соединений формулы Vb, где Q1 означает карбонил, с фосфористыми илидами.
Способы получения
а) Циклизацию соединений формулы III с этилмеркаптоацетатом осуществляют способами, раскрытыми для получения аналогичных соединений. Реакцию проводят в присутствии органических оснований (предпочтительно в присутствии пиридина) при температуре кипения в течение 1-5 часов. Полученные тетрациклические продукты могут быть выделены колоночной хроматографией или перекристаллизацией из подходящего растворителя.
Исходные вещества для получения соединений формулы III, кетонов формулы VI
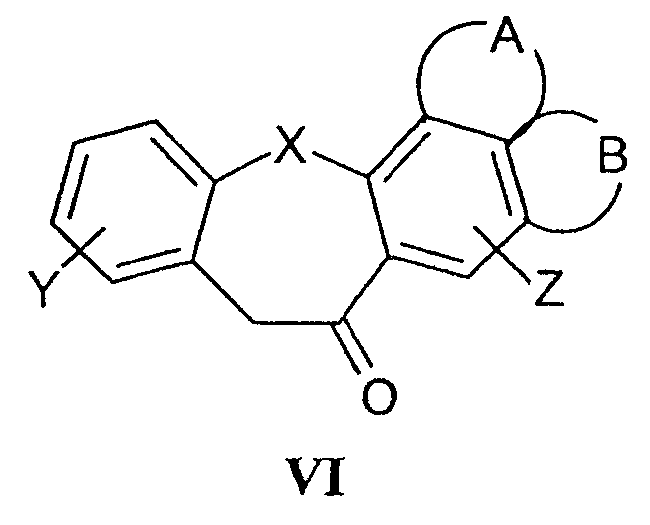
являются уже известными или их получают способами, раскрытыми для получения аналогичных соединений. Так, например, соединения формулы VI могут быть получены исходя из соединений формулы VIII
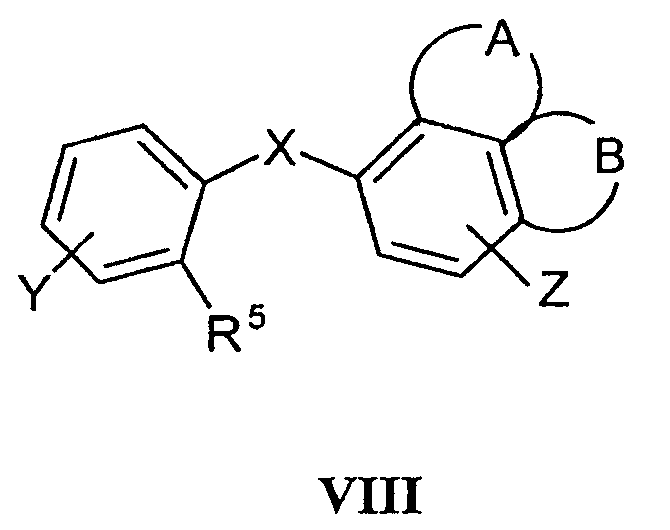
где R5 означает группу CO2H, таким путем, чтобы за счет подходящих химических превращений было получено соединение формулы VIII, в котором R5 означает CH2CO2H. Под воздействием полифосфорной кислоты происходит циклизация и образование кетона формулы VI. Подобная последовательность реакций была раскрыта ранее в Protiva M et al. (CS 163583, Collect. Czech. Chem. Commun., 1975, 40:1960-1965 и Collect. Czech. Chem. Commun., 1974, 34:3147-3152). Альтернативно, соединение формулы VIII, в котором R5 означает CH2CO2H, может быть получено взаимодействием соединения формулы VIII, в которой R5 представляет собой СОСН3, с серой и морфолином и гидролизом полученного таким образом тиоамида (Ueda I et al., Chem. Pharm. Bull., 1975, 23:2223-2231). При действии реагента Вильсмайера-Хаака на соответствующие кетоны формулы VI получают соединения формулы (III) (Tsuji K et al., Chem. Pharm. Bull., 1998, 46:279-286).
b) Соединения формулы I в соответствии с настоящим способом могут быть получены взаимодействием спиртов формулы V и соединений формулы IV, где R4 означает удаляемую группу, которая может представлять собой атом галогена (наиболее часто бром, иод или хлор) или сульфонилоксигруппу (наиболее часто трифторметилсульфонилокси или п-толуолсульфонилокси). Реакция конденсации может быть осуществлена в соответствии со способами, раскрытыми для получения аналогичных соединений (Menozzi G et al., J. Heterocyclic Chem., 1997, 34:963-968 или WO 01/87890). Реакцию осуществляют при температуре от 20°С до 100°С в течение времени от 1 до 24-х часов в двухфазной системе (предпочтительно с использованием смеси 50% NaOH/толуол) в присутствии межфазного катализатора (предпочтительно бензилтриэтиламмонийхлорида, бензилтриэтиламмонийбромида, цетилтриметилбромида). После обработки реакционной смеси образованные продукты выделяют перекристаллизацией или хроматографией на колонке с силикагелем.
Исходные вещества, представляющие собой спирты формулы V, могут быть получены из соединений формулы I, в которой R1 означает подходящую функциональную группу. Таким образом, спирты формулы V могут быть получены восстановлением алкилоксикарбонильной группы (например, этилоксикарбонильной) с использованием гидридов металлов, таких как алюмогидрид лития или боргидрид натрия. Кроме того, спирты формулы V могут быть получены гидролизом соответствующих сложных эфиров в щелочной или кислой среде.
Исходные соединения формулы IV уже известны или их получают в соответствии со способами, раскрытыми для получения аналогичных соединений.
с) Соединения формулы I в соответствии с настоящим способом могут быть получены взаимодействием соединений формулы Va, в которой L означает удаляемую группу, определенную выше для R4, и соединений формулы IVa, в которой Q1 означает кислород, азот, серу или -С С-. Наиболее подходящие реакции конденсации представляют собой реакции нуклеофильного замещения при насыщенном атоме углерода, раскрытые в литературе.
С-. Наиболее подходящие реакции конденсации представляют собой реакции нуклеофильного замещения при насыщенном атоме углерода, раскрытые в литературе.
Исходные соединения формулы Va (наиболее часто галогениды) могут быть получены галогенированием (например, бромированием или хлорированием) спиртов формулы V обычными галогенирующими агентами (например, бромистоводородной кислотой, PBr3, SOCl2 или PCl5) способами, раскрытыми в литературе. Полученные соединения могут быть выделены или могут быть использованы без выделения в качестве промежуточных продуктов, подходящих для получения соединений формулы I.
Исходные соединения формулы IVa уже известны или их получают в соответствии со способами, раскрытыми для получения аналогичных соединений.
d) Соединения формулы I, в которой Q означает -О-, -NH- или -S-, могут быть получены конденсацией соединений формулы Vb и соединений формулы IV, в которой R4 означает удаляемую группу, определенную выше. Реакция может быть осуществлена в условиях реакции, раскрытых в способе b), или в условиях реакций нуклеофильного замещения, раскрытых в литературе. Исходные спирты, амины и тиолы могут быть получены взаимодействием воды, аммиака или сероводорода с соединениями Va в соответствии со способами, раскрытыми в литературе.
е) Спирты структурной формулы V могут быть окислены в соответствующие соединения формулы Vb, где Q1 означает карбонил, в результате последующего взаимодействия которых с соответствующими илидными реагентами происходит удлинение цепи и образование алкенильного заместителя с карбонильной или сложноэфирной группой, как раскрыто в заявке на патент Хорватии № 20000310.
Соединения формулы I, кроме вышеуказанных реакций, могут быть получены превращением других соединений формулы I, и следует понимать, что настоящее изобретение также включает такие соединения и способы. Специальный пример изменения функциональной группы представляет реакция альдегидной группы с выбранными фосфористыми илидами, приводящая к удлинению цепи и образованию алкенильного заместителя с карбонильной или сложноэфирной группой, которая раскрыта в заявке на патент Хорватии № 20000310. Указанные реакции осуществляют в растворителях, таких как бензол, толуол или гексан, при повышенной температуре (наиболее часто при температуре кипения).
Соединения формулы I, в которой Q1 представляет собой -С С-, получают взаимодействием соединений формулы Va с 1-алкином в щелочной среде (такой как амид натрия в аммиаке). Условия реакции данного способа раскрыты в литературе. При подобных же условиях реакции (нуклеофильного замещения) могут быть получены различные производные простого эфира, простого тиоэфира и амина.
С-, получают взаимодействием соединений формулы Va с 1-алкином в щелочной среде (такой как амид натрия в аммиаке). Условия реакции данного способа раскрыты в литературе. При подобных же условиях реакции (нуклеофильного замещения) могут быть получены различные производные простого эфира, простого тиоэфира и амина.
Формилирование соединений формулы I такими способами, как например ацилирование по Вильсмайеру или реакция н-BuLi и N,N-диметилформамида, является дополнительным общим примером превращения. Условия реакций в данных способах хорошо известны в литературе.
В результате гидролиза соединений формулы I, имеющих нитрильные, амидные или сложноэфирные группы, могут быть получены соединения с карбоксильной группой, которые являются подходящими промежуточными продуктами для получения других соединений с новыми функциональными группами, таких как, например, сложные эфиры, амиды, галогениды, ангидриды, спирты или амины.
Реакции окисления или восстановления являются дополнительной возможностью изменения заместителей в соединениях формулы I. Наиболее часто используемые окислители представляют собой пероксиды (пероксид водорода, м-хлорпербензойная кислота или бензоилпероксид) или ионы перманганата, хромата или перхлората. Таким образом, в результате, например, окисления спиртовой группы пиридинилдихроматом или пиридинилхлорхроматом образуется альдегидная группа, которая может быть превращена в карбоксильную группу дополнительным окислением. Окислением соединений формулы I, в которой R1 означает алкил, тетраацетатом свинца в уксусной кислоте или N-бромсукцинимидом с использованием каталитического количества бензоилпероксида получают соответствующее карбонильное производное.
Селективным окислением алкилтиогруппы могут быть получены алкилсульфинильная или алкилсульфонильная группы.
В результате восстановления соединений нитрогруппой возможно получение аминосоединений. Реакцию осуществляют в обычных условиях каталитического гидрирования или электрохимически. Каталитическим гидрированием с использованием палладия на угле алкенильные заместители могут быть превращены в алкильные или нитрильная группа может быть превращена в аминоалкил.
В соединения формулы I стандартными реакциями замещения или обычными заменами отдельных функциональных групп могут быть введены различные заместители ароматической структуры. Примерами таких реакций являются ароматическое замещение, алкилирование, галогенирование, гидроксилирование, а также окисление или восстановление заместителей. Реагенты и условия реакций известны из литературы. Так например, ароматическим замещением в присутствии концентрированной азотной кислоты и серной кислоты вводится нитрогруппа. С использованием ацилгалогенидов или алкилгалогенидов возможно введение ацильной группы или алкильной группы. Реакцию осуществляют в присутствии кислот Льюиса, таких как трихлорид алюминия или железа, в условиях реакции Фриделя-Крафтса. Восстановлением нитрогруппы получают аминогруппу, которую с помощью реакции диазотирования превращают в подходящую исходную группу, которая может быть замещена одной из следующих групп: Н, CN, OH, галоген.
Для предотвращения нежелательного взаимодействия в химических реакциях часто необходимо защитить определенные группы, такие как, например, гидрокси, амино, тио или карбокси. Для этой цели может быть использовано большое число защитных групп (Green T. W, Wuts PGH, Protective Groups in Organic Synthesis, John Wiley and Sons, 1999), и их выбор, использование и удаление осуществляют с применением методов, общепринятых в химическом синтезе.
Традиционной защитой для амино- или алкиламиногрупп являются, например, такие группы как алканоильная (ацетильная), алкоксикарбонильная (метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная); арилметоксикарбонильная (бензилоксикарбонильная), ароильная (бензоильная) или алкилсилильная (триметилсилильная или триметилсилилэтоксиметильная) группы. Условия удаления защитной группы зависят от выбора и свойств этой группы. Так например, ацильные группы, такие как алканоильная, алкоксикарбонильная или ароильная, могут быть удалены гидролизом в присутствии основания (гидроксида натрия или гидроксида калия), трет-бутоксикарбонильная или алкилсилильная (триметилсилильная) группы могут быть удалены обработкой подходящей кислотой (хлористоводородной, серной, фосфорной или трифторуксусной кислотой), тогда как арилметоксикарбонильная группа (бензилоксикарбонильная) может быть удалена гидрированием с использованием катализатора, такого как палладий на угле.
Соли соединений формулы I могут быть получены общеизвестными способами, например, такими как взаимодействие соединений формулы I с соответствующим основанием или кислотой в подходящем растворителе или растворяющей смеси, например в простых эфирах (диэтиловый эфир) или спиртах (этанол, пропанол или изопропанол).
Другой целью настоящего изобретения является применение заявленных соединений в терапии воспалительных заболеваний и состояний, в особенности всех заболеваний и состояний, вызванных избыточной секрецией ФНО-α и ИЛ-1.
Ингибиторы продуцирования цитокинов или медиаторов воспаления, являющиеся объектом настоящего изобретения, или их фармацевтически приемлемые соли могут быть использованы в производстве лекарственных средств для лечения и профилактики патологического состояния или заболевания, вызванного избыточным нерегулированным продуцированием цитокинов или медиаторов воспаления, при этом лекарственные средства должны содержать эффективную дозу данных ингибиторов.
Настоящее изобретение в особенности относится к эффективной дозе ингибитора ФНО-α, которая может быть определена обычными методами.
Настоящее изобретение относится также к лекарственному препарату, содержащему эффективные нетоксичные дозы соединений настоящего изобретения и фармацевтически приемлемые носители или растворители.
Приготовление лекарственных препаратов может включать смешивание, гранулирование, таблетирование и растворение ингредиентов. Химические носители могут быть твердыми или жидкими. Твердые носители могут представлять собой лактозу, сахарозу, тальк, желатин, агар, пектин, стеарат магния, жирные кислоты и т.д. Жидкие носители могут представлять собой сиропы, масла, такие как оливковое масло, подсолнечное масло или соевое масло, воду и т.д. Аналогично, носитель может также содержать компонент для пролонгированного высвобождения активного компонента, такой как глицерилмоностеарат или глицерилдистеарат. Могут быть использованы различные формы лекарственных препаратов. Таким образом, если используется твердый носитель, указанные формы могут представлять собой таблетки, твердые желатиновые капсулы, порошок или гранулы, которые могут быть введены в капсулах перорально. Количество твердого носителя может изменяться, но оно обычно составляет от 25 мг до 1 г. Если используется жидкий носитель, препарат может быть в форме сиропа, эмульсии, мягких желатиновых капсул, стерильных инъецируемых растворов, таких как ампулы или неводные жидкие суспензии.
Соединения в соответствии с настоящим изобретением могут быть употреблены перорально, парентерально, местно, внутриназально, внутриректально и интравагинально. Парентеральный путь в данном описании означает внутривенное, внутримышечное и подкожное применение. Соответствующие препараты настоящих соединений могут быть использованы для профилактики, а также в лечении различных заболеваний и патологических воспалительных состояний, вызванных избыточным нерегулированным продуцированием цитокинов или медиаторов воспаления, в особенности ФНО-α. Они включают ревматоидный артрит, ревматоидный спондилит, остеоартрит и другие артритные патологические состояния и заболевания, экзему, псориаз и другие воспалительные состояния кожи, такие как ожоги, вызванные ультрафиолетовым излучением (солнечные лучи и подобные источники УФ), воспалительные глазные заболевания, болезнь Крона, язвенный колит и астму.
Ингибирующее действие соединений настоящего изобретения на секрецию ФНО-α и ИЛ-1 было определено следующими испытаниями in vitro и in vivo.
Определение in vivo секреции ФНО-α и ИЛ-1 в одноядерных клетках человеческой периферийной крови
Одноядерные клетки человеческой периферийной крови (РВМС) получали из гепаринизованной цельной крови после отделения РВМС на Ficoll-Paque™ Plus (Amersham-Pharmacia). Для определения уровня ФНО-α 3,5-5×104 клеток общим объемом 200 мкл выращивали в течение времени от 18 до 24-х часов в планшетах для микротитрования с плоским дном (96 лунок, Falcon) в среде RPMI 1640, в которую добавляли 10% FBS (фетальная (эмбриональная) бычья сыворотка, Biowhittaker), предварительно инактивированной при 54°С/30 мин, 100 ед./мл пенициллина, 100 мг/мл стрептомицина и 20 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) (GIBCO). Клетки инкубировали при 37°С в атмосфере, содержащей 5% CO2, имеющей влажность 90%. При отрицательном контроле клетки выращивали только в среде (NC), тогда как при положительном контроле секрецию ФНО-α возбуждали добавлением 1 нг/мл липополисахаридов (ЛПС, серологический тип E. coli 0111:В4, SIGMA) (PC). Действие испытуемых соединений на секрецию ФНО-α исследовали после добавления их в культуры клеток, стимулированных ЛПС (TS). Уровень ФНО-α в клеточном супернатанте определяли методикой ТИФА (твердофазный иммуноферментный анализ) (ELISA) в соответствии с рекомендациями производителя (R&D Systems). Чувствительность испытаний составляла <3 пг/мл ФНО-α. Уровень ИЛ-1 определяли в анализе, осуществляемом при таких же условиях и с таким же числом клеток и такой же концентрацией стимула, методикой ТИФА (R&D Systems). Процент ингибирования продуцирования ФНО-α или ИЛ-1 вычисляли в соответствии с уравнением
% ингибирования = [1-(TS-NC)/(PC-NC)]×100
Значение IC-50 определяли в виде концентрации вещества, при которой происходило 50% ингибирование выработки ФНО-α.
Соединения, имеющие значение IC-50 при концентрациях 20 мкМ или более низких, являются активными.
Определение in vitro секреции ФНО-α и ИЛ-1 в брюшинных макрофагах мышей
Для получения брюшинных макрофагов мышам-самцам линии Balb/C возрастом от 8 до 12 недель впрыскивали внутрибрюшинно 300 мкг зимосана (SIGMA), растворенного в фосфатном буфере (PBS), общий объем которого составлял 0,1 мл/мышь. Через 24 часа мышей умерщвляли в соответствии с Актом о защите лабораторных животных (Laboratory Animal Welfare Act). Брюшинную полость промывали стерильным физиологическим раствором (5 мл). Полученные брюшинные макрофаги дважды промывали стерильным физиологическим раствором и после последнего центрифугирования (350 g/10 мин.) повторно суспендировали в RPMI 1640, в которую добавляли 10% порцию FBS. Для определения секреции ФНО-α 5×104 клеток/лунку общим объемом 200 мкл выращивали в течение времени от 18 до 24-х часов в планшете для титрования с плоским дном (96 лунок, Falcon) в среде RPMI 1640, в которую прибавляли 10% FBS (фетальная бычья сыворотка, Biowhittaker), инактивированную нагревом, 100 ед./мл пенициллина, 100 мг/мл стрептомицина, 20 мМ HEPES и 50 мкМ 2-меркаптоэтанола (все от GIBCO). Клетки инкубировали при 37°C в атмосфере, содержащей 5% CO2, имеющей влажность 90%. При отрицательном контроле клетки выращивали только в среде (NC), тогда как при положительном контроле возбуждали секрецию ФНО-α добавлением 10 нг/мл липополисахаридов (ЛПС, серологический тип E. coli 0111:В4, SIGMA) (PC). Действие веществ на секрецию ФНО-α исследовали после добавления их в культуры клеток, стимулированных ЛПС (TS). Уровень ФНО-α в клеточном супернатанте определяли методикой ТИФА (R&D Systems, Biosource). Уровень клеток определяли в анализе, идентичном анализу на ФНО-α, осуществляемому методикой ТИФА (R&D Systems). Процент ингибирования продуцирования ФНО-α или ИЛ-1 вычисляли в соответствии с уравнением
% ингибирования = [1-(TS-NC)/(PC-NC)]×100
Значение IC-50 определяли в виде концентрации вещества, при которой происходило 50% ингибирование выработки ФНО-α.
Соединения, имеющие значения IC-50 при концентрациях 10 мкМ или более низких, являются активными.
Модель избыточной секреции ФНО-α или ИЛ-1 у мышей, вызванной ЛПС in vivo
Секрецию ФНО-α или ИЛ-1 у мышей индуцировали в соответствии с уже известным методом (Badger AM et al., J.Pharmac. Env. Therap., 1996, 279:1453-1461). Использовали самцов Balb/C возрастом от 8 до 12 недель группами, состоящими из 6-10 животных. Животных обрабатывали перорально или только растворителем (при отрицательном или при положительном контролях), или растворами веществ за 30 минут до внутрибрюшинной обработки ЛПС (серологический тип E. Coli 0111:B4, Sigma) в дозе 25 мкг/животное. Через 2 часа животных умерщвляли посредством внутрибрюшинной инъекции румпана (Bayer) и кетанеста (Parke-Davis). Отбирали пробу крови каждого животного в микроцентрифужную пробирку (Becton Dickinson) и отделяли плазму в соответствии с инструкциями производителя. Уровень ФНО-α в плазме определяли методикой ТИФА (Biosource, R&D Systems) в соответствии с инструкциями производителя. Чувствительность испытаний составляла <3 пг/мл ФНО-α. Уровень ИЛ-1 определяли методикой ТИФА (R&D Systems). Процент ингибирования продуцирования ФНО-α или ИЛ-1 вычисляли в соответствии с уравнением
% ингибирования = [1-(TS-NC)/(PC-NC)]×100
Соединения, проявляющие 30%-ное или большее ингибирование продуцирования ФНО-α при дозе 10 мг/кг, являются активными.
Анализ анальгезирующей активности по числу корчей (судорог)
В данном анализе вызывали боль инъекцией раздражающего средства, наиболее часто уксусной кислоты, в брюшинную полость мышей. Животные реагировали с характерными корчами (судорогами), которые дали название анализу (Collier HOJ et al., Pharmac. Chemother., 1968, 32:295-310; Fukawa K et al., J. Pharmacol. Meth., 1980, 4:251-259; Schweizer A et al., Agents Actions, 1988, 23:29-31). Анализ является удобным для определения активности соединений. Методика: использовали мышей-самцов линии Balb/C (Charles River, Италия) возрастом от 8 до 12 недель. Контрольная группа получала перорально метилцеллюлозу за 30 минут до внутрибрюшинного введения уксусной кислоты с концентрацией 0,6%, тогда как экспериментальные группы получали перорально стандартные (ацетилсалициловая кислота) или испытуемые вещества в метилцеллюлозе за 30 минут до внутрибрюшинного введения 0,6% уксусной кислоты (объем 0,1 мл/10 г). Мышей помещали отдельно под стеклянные воронки и в течение 20 минут регистрировали число корчей (судорог) у каждого животного. Процент ингибирования корчей (судорог) вычисляли в соответствии с уравнением:
% ингибирования = (среднее значение числа корчей (судорог) в контрольной группе - число корчей (судорог) в экспериментальной группе)/число корчей (судорог) в контрольной группе × 100
Соединения, показывающие такую же анальгезирующую активность, как ацетилсалициловая кислота или более высокую, являются активными.
Модель шока у мышей, вызванного ЛПС in vivo
Использовали мышей-самцов Balb/C (Charles River, Италия) возрастом от 8 до 12 недель. Выделенные из Serratie marcessans ЛПС (Sigma, L-6136) разбавляли стерильным физиологическим раствором. Первую инъекцию ЛПС осуществляли внутрикожно дозой 4 мкг/мышь. Через 18-24 часа ЛПС вводили внутривенно дозой 200 мкг/мышь. Контрольная группа получала две инъекции ЛПС, как указано выше. Экспериментальные группы получали вещества перорально за полчаса до каждого введения ЛПС. Через 24 часа наблюдали выживаемость животных.
Вещества, в присутствии которых выживаемость при дозах 30 мг/кг составляла 40% или более, являются активными.
Соединения из примеров 6 и 7 показывают активность, по меньшей мере, в двух исследовательских анализах, хотя данные результаты представляют только иллюстрацию биологической активности соединений и не ограничивают изобретение каким-либо образом.
Способы получения с примерами
Настоящее изобретение иллюстрировано следующими примерами, которые никоим образом его не ограничивают.
Пример 1
Сложный этиловый эфир 8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты (48; таблица 1)
Этил-2-меркаптоацетат (0,005 моль) и триэтиламин (1,0 мл) добавляли к пиридиновому раствору соединения 41 (0,005 моль в 10 мл) и смесь кипятили с обратным холодильником при перемешивании в течение 3 часов. Затем пиридин удаляли при пониженном давлении. К остатку добавляли воду и этилацетат, слои разделяли и водный слой еще дважды экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и выпаривали. Оставался неочищенный продукт, который очищали перекристаллизацией или колоночной хроматографией с получением чистого продукта в форме белого твердого вещества.
Следуя методике примера 1, с использованием в качестве исходных продуктов соединений 42-47 получали и выделяли следующие соединения:
этиловый эфир 1,8-дитиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 3,10-дитиабензо[е]нафто[1,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 11-метокси-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты (таблица 1, соединения 49-54).
Пример 2
(8-Окса-1-тиабензо[е]нафто[3,2-h]азулен-2-ил)метанол (55; таблица 1)
Раствор сложного эфира 48 в диэтиловом эфире (1,5 ммоль в 20 мл) добавляли по каплям к суспензии LiAlH4 в эфире (5,0 ммоль в 10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции избыток LiAlH4 разлагали добавлением простого эфира и воды. Полученный осадок отфильтровывали и фильтрат выпаривали при пониженном давлении.
Неочищенный продукт очищали перекристаллизацией с получением чистого продукта в форме белых кристаллов.
Следуя методике примера 2, с использованием в качестве исходных продуктов соединений 49-54 получали и выделяли следующие соединения:
(1,8-дитиабензо[е]нафто[3,2-h]азулен-2-ил)метанол;
(3,10-дитиабензо[е]нафто[1,2-h]азулен-2-ил)метанол;
(10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-ил)метанол;
(11-метокси-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-ил)метанол;
(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-ил)метанол;
(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-ил)метанол; (таблица 1, соединения 56-61).
Таблица 1
Соединения структуры I, где Y=Z=H
(m/z)
(M+)
(М+)
Пример 3
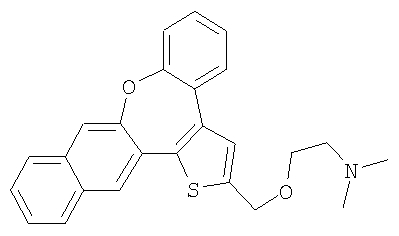
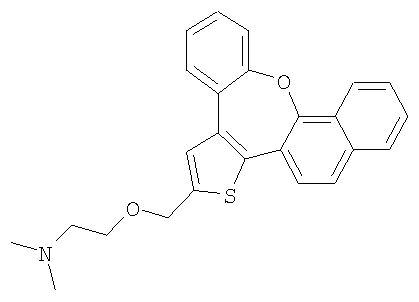
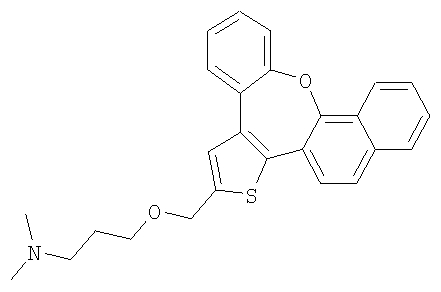
а) Диметил [2-(8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]амин
К раствору гидрохлорида 2-диметиламиноэтилхлорида (3,0 ммоль) в 50% гидроксиде натрия (5 мл) добавляли каталитическое количество хлорида бензилтриэтиламмония и раствор спирта 55 (0,3 ммоль) в толуоле (5 мл). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 4 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 2,31 (с, 6H); 2,60 (т, 2H); 3,68 (т, 2H); 4,78 (с, 2H); 7,18-7,50 (м, 7H); 7,73 (с, 1H); 7,80 (м, 2H); 7,90 (с, 1H);
МС (m/z): 402 (MH+).
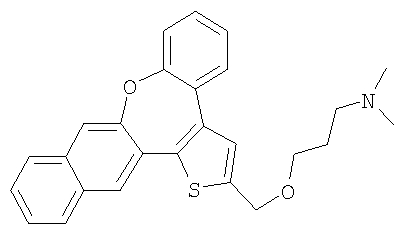
b) Диметил [3-(8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин
В результате взаимодействия спирта 55 (0,2 ммоль) и гидрохлорида 3-диметиламинопропилхлорида (2,0 ммоль) получали желтый маслянистый продукт
1H ЯМР (м.д., CDCl3): 2,01 (м, 2H); 2,50 (с, 6H); 2,75 (т, 2H); 3,68 (т, 2H); 4,75 (с, 2H); 7,18-7,73 (м, 7H); 7,73 (с, 1H); 7,80 (м, 2H); 7,90 (с, 1H);
МС (m/z): 416 (MH+).
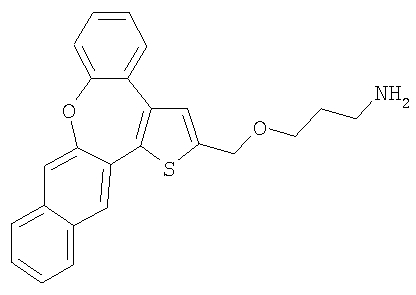
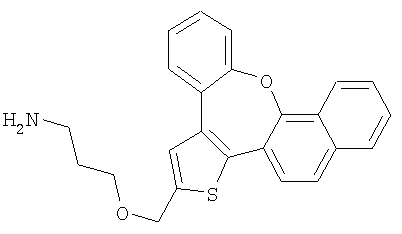
с) 3-(8-Окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропиламин
В результате взаимодействия спирта 55 (0,3 ммоль) и гидрохлорида 3-аминопропилхлорида (3,0 ммоль) получали желтый маслянистый продукт.
1H ЯМР (м.д., CD3COCD3): 1,90 (м, 2H); 2,86 (шир., 2H); 3,30 (т, 2H); 3,68 (т, 2H); 4,78 (с, 2H); 7,25-7,65 (м, 7H); 7,89 (с, 1H); 7,90-8,00 (м, 2H); 8,04 (с, 1H);
МС (m/z): 388 (MH+).
Пример 4
Диметил-[3-(1,8-дитиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин
К раствору гидрохлорида 2-диметиламинопропилхлорида (8,0 ммоль) в 50% гидроксиде натрия (10 мл) добавляли каталитическое количество хлорида бензилтриэтиламмония и раствор спирта 56 (0,6 ммоль) в толуоле (10 мл). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 4 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,90 (м, 2H); 2,31 (с, 6H); 2,49 (т, 2H); 3,67 (т, 2H); 4,76 (с, 2H); 7,23 (с, 1H); 7,29-7,52 (м, 5H); 7,70 (д, 1H); 7,81 (м, 2H); 7,99 (с, 1H); 8,16 (с, 1H).
Пример 5
а) Диметил-[2-(3,10-дитиабензо[е]нафто[1,2-h]азулен-2-илметокси)этил]амин
К раствору гидрохлорида 2-диметиламиноэтилхлорида (10,0 ммоль) в 50% гидроксиде натрия (10 мл) добавляли раствор спирта 57 (0,7 ммоль) в толуоле (10 мл). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 4 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 2,33 (с, 6H); 2,63 (т, 2H); 3,73 (т, 2H); 4,82 (с, 2H); 7,15-7,80 (м, 10H); 9,02 (д, 1H).
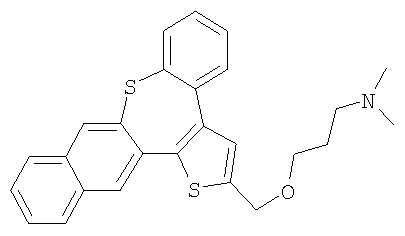
b) Диметил-[3-(3,10-дитиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин
В результате взаимодействия спирта 57 и 3-диметиламинопропилхлорида получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,87 (м, 2H); 2,27 (с, 6H); 2,45 (т, 2H); 3,68 (т, 2H); 4,78 (с, 2H); 7,20-7,83 (м, 10H); 9,02 (д, 1H);
МС (m/z): 432 (MH+).
Пример 6
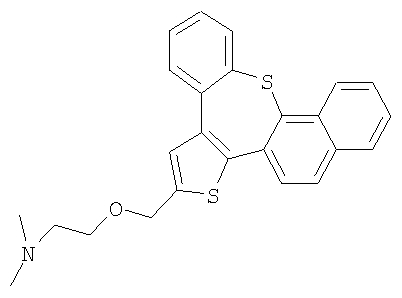
а) Диметил-[2-(10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)этил]амин
К раствору гидрохлорида 2-диметиламиноэтилхлорида (5,0 ммоль) в 50% гидроксиде натрия (5 мл) добавляли толуоловый раствор спирта 58 (0,5 ммоль). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 3 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 2,36 (с, 6H); 2,65 (т, 2H); 3,72 (т, 2H); 4,79 (с, 2H); 7,18-7,67 (м, 9H); 7,83 (д, 1H); 8,66 (д, 1H);
МС (m/z): 402 (MH+).
b) Диметил-[3-(10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин
В результате взаимодействия спирта 58 и гидрохлорида 3-диметиламинопропилхлорида получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,91 (м, 2H); 2,35 (с, 6H); 2,55 (т, 2H); 3,65 (т, 2H); 4,75 (с, 2H); 7,20-7,67 (м, 9H); 7,83 (д, 1H); 8,66 (д, 1H);
МС (m/z): 416 (MH+).
Пример 7
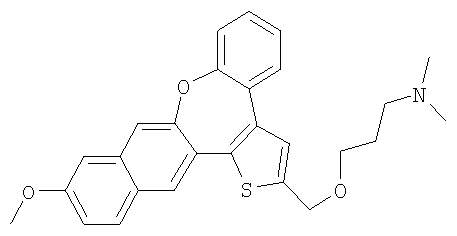
Диметил-[3-(11-метокси-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин
К раствору гидрохлорида 3-диметиламинопропилхлорида (3,0 ммоль) в 50% гидроксиде натрия (5 мл) добавляли каталитическое количество хлорида бензилтриэтиламмония и раствор спирта 59 (0,3 ммоль) в толуоле (5 мл). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 6 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт, кристаллизующийся при стоянии.
1H ЯМР (м.д., CDCl3): 1,86 (p, 2H); 2,25 (с, 6H); 2,41 (т, 2H); 3,64 (т, 2H); 3,92 (с, 3H); 4,74 (с, 2H); 7,07-7,49 (м, 7H); 7,63 (с, 1H); 7,71 (д, 1H); 7,83 (с, 1H);
МС (m/z): 446 (MH+).
Пример 8
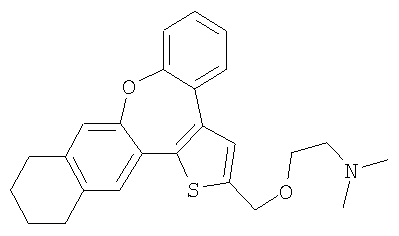
а) Диметил-[2-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)этил]амин
К раствору гидрохлорида 2-диметиламиноэтилхлорида (6,0 ммоль) в 50% гидроксиде натрия (10 мл) добавляли раствор спирта 60 (0,6 ммоль) в толуоле (10 мл). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 3 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,79 (м, 2H); 1,86 (м, 2H); 2,43 (с, 6H); 2,73 (м, 2H); 2,77 (т, 2H); 3,12 (т, 2H); 3,75 (т, 2H); 4,75 (с, 2H); 6,90 (д, 1H); 7,14-7,35 (м, 5H); 7,45 (д, 1H);
МС (m/z): 406 (MH+).
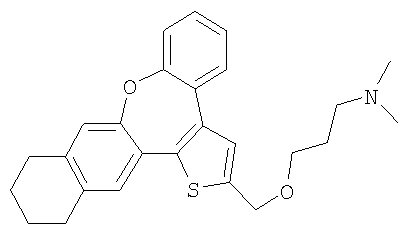
b) Диметил-[3-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин
В результате взаимодействия спирта 60 и гидрохлорида 3-диметиламинопропилхлорида получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,80 (м, 2H); 1,88 (м, 2H); 2,02 (м, 2H); 2,51 (с, 6H); 2,75 (м, 2H); 2,79 (т, 2H); 3,14 (т, 2H); 3,67 (т, 2H); 4,73 (с, 2H); 6,89 (д, 1H); 7,15-7,36 (м, 5H); 7,45 (д, 1H);
МС (m/z): 420 (MH+).
с) 3-(6,7,8,9-Тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропиламин
В результате взаимодействия спирта 60 и гидрохлорида 3-аминопропилхлорида получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,41 (с, 2H); 1,75-1,87 (м, 6H); 2,77 (т, 2H); 2,85 (т, 2H); 3,12 (т, 2H); 3,64 (т, 2H); 4,71 (с, 2H); 6,89 (д, 1H); 7,14-7,36 (м, 5H); 7,45 (д, 1H);
МС (m/z): 414 (М+Na+).
Пример 9
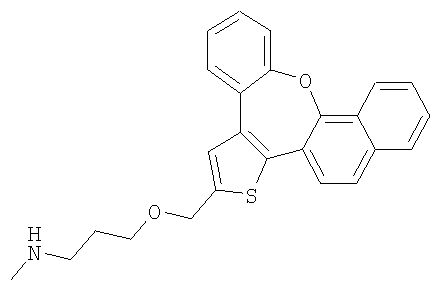
Метил-[3-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин
К раствору диметил-[3-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амина в метаноле, полученному в соответствии с методикой примера 8b (1,0 ммоль в 30 мл), добавляли тригидрат ацетата натрия (5,4 ммоль) и иод (1,13 ммоль). Реакционную смесь облучали лампой 500 Вт и перемешивали при комнатной температуре в течение 5 часов. После завершения реакции к реакционной смеси добавляли 10% водный раствор тиосульфата натрия. При пониженном давлении выпаривали растворитель и остаток экстрагировали этилацетатом. Неочищенный продукт очищали колоночной хроматографией с получением чистого продукта в виде желтого масла.
1H ЯМР (м.д., CDCl3): 1,76-1,91 (м, 4H); 2,00 (м, 2H); 2,59 (с, 3H); 2,77 (м, 2H); 2,96 (т, 2H); 3,12 (т, 2H); 3,70 (т, 2H); 4,4-4,7 (шир., 1H); 4,74 (с, 2H); 6,89 (д, 1H); 7,15-7,36 (м, 5H); 7,45 (д, 1H);
МС (m/z): 406 (MH+).
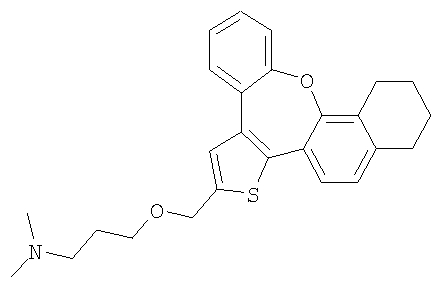
Пример 10
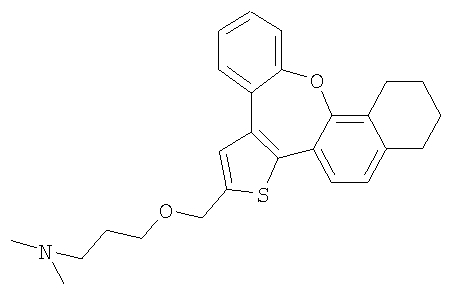
а) Диметил-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]амин
К раствору гидрохлорида 2-диметиламиноэтилхлорида (6,0 ммоль) в 50% гидроксиде натрия (10 мл) добавляли раствор спирта 61 (0,6 ммоль) в толуоле (10 мл). Реакционную смесь нагревали с обратным холодильником при интенсивном перемешивании в течение 3 часов. Затем ее охлаждали до комнатной температуры, разбавляли водой и экстрагировали дихлорметаном. После очистки колоночной хроматографией выделяли желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,77 (м, 4H); 2,38 (с, 6H); 2,67 (м, 2H); 2,75 (м, 4H); 3,71 (т, 2H); 4,75 (с, 2H); 7,01 (с, 1H); 7,12 (с, 1H); 7,14-7,45 (м, 5H);
МС (m/z): 406 (MH+).
b) Диметил-[3-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин
В результате взаимодействия спирта 61 и гидрохлорида 3-диметиламинопропилхлорида получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,78 (м, 4H); 1,99 (м, 2H); 2,49 (с, 6H); 2,70-2,80 (м, 6H); 3,65 (т, 2H); 4,71 (с, 2H); 7,01 (с, 1H); 7,12 (с, 1H); 7,14-7,45 (м, 5H);
МС (m/z): 420 (MH+).
с) 4-[2-(10,11,12,13-Тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]морфолин
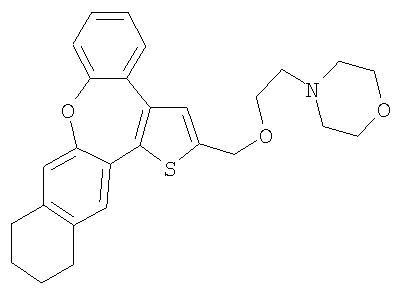
В результате взаимодействия спирта 61 и гидрохлорида 4-(2-хлорэтил) морфолина получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,77 (м, 4H); 2,53 (шир., 4H); 2,66 (м, 2H); 2,75 (м, 4H); 3,70-3,75 (м, 6H); 4,75 (с, 2H); 7,01 (с, 1H); 7,11 (с, 1H); 7,14-7,44 (м, 5H);
МС (m/z): 448 (MH+).
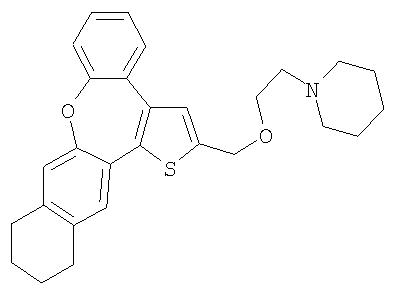
d) 1-[2-(10,11,12,13-Тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]пиперидин
В результате взаимодействия спирта 61 и гидрохлорида 1-(2-хлорэтил) пиперидина получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,45 (м, 2H); 1,65 (м, 4H); 1,77 (м, 4H); 2,52 (м, 4H); 2,6( (м, 2H); 2,75 (м, 4H); 3,73 (т, 2H); 4,74 (с, 2H); 7,01 (с, 1H); 7,12 (с, 1H); 7,14-7,44 (м, 5H);
МС (m/z): 446 (MH+).
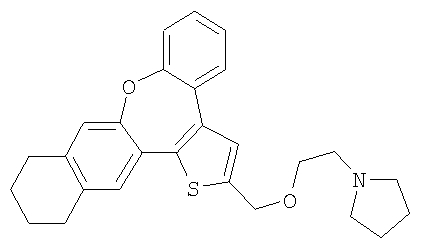
е) 1-[2-(10,11,12,13-Тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]пирролидин
В результате взаимодействия спирта 61 и гидрохлорида 1-(2-хлорэтил) пирролидина получали желтый маслянистый продукт.
1H ЯМР (м.д., CDCl3): 1,78 (м, 4H); 1,92 (шир., 4H); 2,74-2,94 (м, 10H); 3,84 (шир., 2H); 4,76 (с, 2H); 7,01 (с, 1H); 7,12 (с, 1H); 7,15-7,45 (м, 5H);
МС (m/z): 432 (MH+).
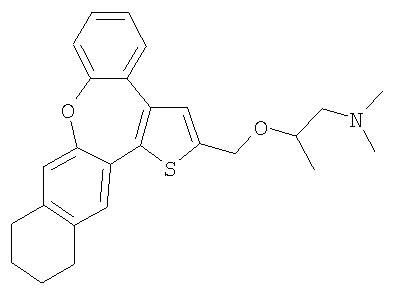
f) Диметил-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин
Диметил-[1-метил-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]амин
В результате взаимодействия спирта 61 и гидрохлорида 1-диметиламино-2-пропилхлорида получали два продукта, которые разделяли и очищали колоночной хроматографией с получением желтых маслянистых веществ, а именно:
диметил-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амина;
1H ЯМР (м.д., CDCl3): 1,25 (д, 3H); 1,77 (м, 4H); 2,36 (с, 6H); 2,40 (м, 1H); 2,60 (м, 1H); 2,75 (м, 4H); 3,90 (шир., 1H); 4,80 (м, 2H); 7,00 (с, 1H); 7,12 (с, 1H); 7,14-7,45 (м, 5H);
МС (m/z): 420 (MH+), и
диметил-[1-метил-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]амина
1H ЯМР (м.д., CDCl3): 1,04 (д, 3H); 1,77 (м, 4H); 2,33 (с, 6H); 2,75 (м, 4H); 2,85 (м, 1H); 3,45 (м, 1H); 3,59 (м, 1H); 4,74 (с, 2H); 7,01 (с, 1H); 7,12 (с, 1H); 7,14-7,44 (м, 5H);
МС (m/z): 420 (MH+).
Получение исходных веществ
Способ А
1-[2-(Нафталин-2-илокси)фенил]этанон (1; таблица 2)
Смесь 2-нафтола (0,035 моль), 2-хлорацетофенона (0,026 моль), карбоната калия (0,040 моль) и CuCl (100 мг) в изоамиловом спирте (3 мл) кипятили с обратным холодильником всю ночь. Затем реакционную смесь фильтровали и остаток промывали несколько раз этилацетатом, а затем фильтрат промывали 10% водным раствором гидроксида натрия и водой. Растворитель удаляли выпариванием при пониженном давлении и остаток перегоняли в высоком вакууме с получением чистого продукта в форме светло-желтой жидкости.
Способ В
1-Морфолин-4-ил-2-[2-(нафталин-2-илокси)фенил]этантион (2; таблица 2)
Смесь соединения 1 (0,058 моль), морфолина (0,08 моль) и серы (0,087 моль) кипятили с обратным холодильником в течение примерно 3 часов. После завершения реакции смесь вливали в горячий этанол, из которого при охлаждении осаждался продукт.
Способ С1
2-(Нафталин-2-илсульфанил)бензойная кислота (3; таблица 2)
2-Нафталинтиол (0,06 моль), 2-иодбензойную кислоту (0,60 моль) и порошок Cu (1 г) прибавляли к водному раствору гидроксида натрия (0,21 моль в 110 мл). Реакционную смесь кипятили с обратным холодильником в течение 8 часов и затем фильтровали. В фильтрат добавляли по каплям концентрированную CHl до кислой реакции. Отсасывали белые выпавшие кристаллы, промывали несколько раз водой и сушили. Следуя вышеуказанной методике, с использованием в качестве исходных продуктов 2-иодбензойной кислоты и 1-нафталинтиола получали также 2-(нафталин-1-илсульфанил)бензойную кислоту (таблица 2; соединение 4).
Способ С2
2-(Нафталин-1-илокси)бензойная кислота (5; таблица 2)
Смесь 1-нафтола (0,03 моль), 2-иодбензойной кислоты (0,03 моль), карбоната калия (0,045 моль) и порошка Cu (150 мг) в нитробензоле или ксилоле (10 мл) нагревали при 140°С в течение примерно 1 часа. После завершения реакции к охлажденной реакционной смеси добавляли воду (100 мл), отделяли органический слой и в водный слой добавляли по каплям концентрированную HCl до кислой реакции. Выделенный продукт экстрагировали этилацетатом.
Следуя методике способа С2, с использованием в качестве исходных продуктов 2-иодбензойной кислоты и 7-метокси-2-нафтола;
5,6,7,8-тетрагидро-1-нафтола;
5,6,7,8-тетрагидро-2-нафтола,
получали следующие соединения:
2-(7-метоксинафталин-2-илокси)бензойную кислоту;
2-(5,6,7,8-тетрагидронафталин-1-илокси)бензойную кислоту;
2-(5,6,7,8-тетрагидронафталин-2-илокси)бензойную кислоту (таблица 2; соединения 6-8).
Способ D
[2-(Нафталин-2-илсульфанил)фенил]метанол (9; таблица 2)
К суспензии LiAlH4 в диэтиловом эфире (0,1 моль в 100 мл) постадийно добавляли кислоту 3 (0,06 моль). После перемешивания реакционной смеси при комнатной температуре в течение 2 часов избыток LiAlH4 разлагали добавлением простого эфира и воды. Полученный осадок фильтровали и фильтрат выпаривали при пониженном давлении с получением неочищенного продукта, который очищали колоночной хроматографией.
Следуя методике способа D, с использованием в качестве исходных продуктов соединений 4-8 получали следующие соединения:
[2-(нафталин-1-илсульфанил)фенил]метанол;
[2-(нафталин-1-илокси)фенил]метанол;
[2-(7-метоксинафталин-2-илокси)фенил]метанол;
[2-(5,6,7,8-тетрагидронафталин-1-илокси)фенил]метанол;
[2-(5,6,7,8-тетрагидронафталин-2-илокси)фенил]метанол (таблица 2, соединения 10-14).
Способ Е
2-(2-Бромметилфенилсульфанил)нафталин (15; таблица 2)
К дихлорметановому раствору спирта 9 (0,057 моль в 200 мл), охлажденному до 0°С, постадийно добавляли по каплям PBr3 (0,019 моль) и смесь перемешивали при указанной температуре в течение примерно 30 минут. После завершения реакции смесь вливали в холодную воду (100 мл), отделяли органический слой и водный слой дважды экстрагировали дихлорметаном. Дихлорметановый слой один раз встряхивали с насыщенным раствором бикарбоната натрия, сушили над Na2SO4 и выпаривали при пониженном давлении с получением неочищенного продукта, который очищали колоночной хроматографией.
Следуя методике способа Е, с использованием в качестве исходных продуктов соединений 10-14 получали следующие соединения:
1-(2-бромметилфенилсульфанил)нафталин;
1-(2-бромметилфенокси)нафталин;
2-(2-бромметилфенокси)-7-метоксинафталин;
5-(2-бромметилфенокси)-1,2,3,4-тетрагидронафталин;
6-(2-бромметилфенокси)-1,2,3,4-тетрагидронафталин (таблица 2, соединения 16-20).
Способ F
[2-(Нафталин-2-илсульфанил)фенил]ацетонитрил (21; таблица 2)
К этанольному раствору бромида 15 (0,05 моль в 60 мл) добавляли NaCN (0,063 моль) и реакционную смесь кипятили с обратным холодильником в течение 3-х часов. После завершения реакции при пониженном давлении удаляли этанол и к остатку добавляли воду (80 мл) и этилацетат (80 мл). Слои разделяли и водный слой еще два раза экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили над Na2SO4 и выпаривали при пониженном давлении с получением неочищенного продукта, который очищали колоночной хроматографией.
Следуя методике способа F, с использованием в качестве исходных продуктов соединений 16-20 получали следующие соединения:
[2-(нафталин-1-илсульфанил)фенил]ацетонитрил;
[2-(нафталин-1-илокси)фенил]ацетонитрил;
[2-(7-метоксинафталин-2-илокси)фенил]ацетонитрил;
[2-(5,6,7,8-тетрагидронафталин-1-илокси)фенил]ацетонитрил;
[2-(5,6,7,8-тетрагидронафталин-2-илокси)фенил]ацетонитрил (таблица 2, соединения 22-26).
Способ G
[2-(Нафталин-2-илокси)фенил]уксусная кислота (27; таблица 2)
Смесь соединения 2 (0,04 моль), уксусной кислоты (10 мл) и 50% серной кислоты (4,5 мл) перемешивалась при кипячении с обратным холодильником в течение примерно 5 часов. После завершения реакции реакционную смесь вливали в воду (10 мл). Выпавшие кристаллы отсасывали, растворяли в 10% водном растворе NaOH и раствор дважды экстрагировали дихлорметаном. Водный слой подкисляли концентрированной HCl до кислой реакции. Выпавшие кристаллы фильтровали и сушили.
Способ Н
[2-(Нафталин-2-илсульфанил)фенил]уксусная кислота (28; таблица 2)
К этанольному раствору нитрила 21 (0,045 моль в 60 мл) добавляли водный раствор КОН (0,15 моль в 15 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение примерно 10 часов и затем при пониженном давлении выпаривали этанол. Остаток разбавляли водой и один раз встряхивали с этилацетатом. Водный слой подкисляли до кислой реакции для выделения продукта.
Следуя методике способа Н, с использованием в качестве исходных продуктов соединений 22-26 получали следующие соединения:
[2-(нафталин-1-илсульфанилфенил]уксусную кислоту;
[2-(нафталин-1-илокси)фенил]уксусную кислоту;
[2-(7-метоксинафталин-2-илокси)фенил]уксусную кислоту;
[2-(5,6,7,8-тетрагидронафталин-1-илокси)фенил]уксусную кислоту;
[2-(5,6,7,8-тетрагидронафталин-2-илокси)фенил]уксусную кислоту (таблица 2; соединения 29-33).
Таблица 2
Соединения структуры VIII, где Y=Z=H

(m/z)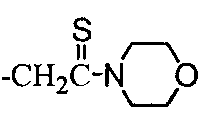
Способ 1
13Н-5-Оксабензо[4,5]циклогепта [1,2-b]нафталин-12-он (34; таблица 3)
Смесь кислоты 27 и полифосфорной кислоты (РРА; 3,0 г в 30 г) интенсивно перемешивали при 100°С в течение примерно 2-х часов. Затем реакционную смесь вливали в воду и три раза экстрагировали дихлорметаном. Дихлорметановый слой сушили над Na2SO4 и выпаривали при пониженном давлении с получением неочищенного продукта, который может быть очищен колоночной хроматографией или перекристаллизацией.
Следуя методике способа 1, с использованием в качестве исходных продуктов соединений 28-33 получали следующие соединения:
13Н-5-тиабензо[4,5]циклогепта[1,2-b]нафталин-12-он;
8Н-13-тиабензо[5,6]циклогепта[1,2-b]нафталин-7-он;
8Н-13-оксабензо[5,6]циклогепта[1,2-а]нафталин-7-он;
8-метокси-13Н-5-оксабензо[4,5]циклогепта[1,2-b]нафталин-12-он;
1,2,3,4-тетрагидро-8Н-13-оксабензо[5,6]циклогепта[1,2-а]нафталин-7-он;
7,8,9,10-тетрагидро-13Н-5-оксабензо[4,5]циклогепта[1,2-b]нафталин-12-он (таблица 3; соединения 35-40).
Таблица 3
Соединения формулы VI, где Y=Z=H

(m/z)
(MH+)
Способ J
12-Хлор-5-оксабензо[4,5]циклогепта[1,2-b]нафталин-13-карбальдегид (41; таблица 4)
К раствору реагента Вильсмайера-Хаака в трихлорэтене (0,01 моль в 5 мл) добавляли по каплям трихлорэтеновый раствор соединения 34 (0,008 моль в 5 мл). Затем реакционную смесь кипятили с обратным холодильником в течение примерно 6 часов, после чего ее охлаждали и к ней постадийно добавляли по каплям 20 мл 50% водного раствора ацетата натрия. Слои разделяли и водный слой три раза экстрагировали дихлорметаном. Дихлорметановые слои, высушенные над Na2SO4, выпаривали при пониженном давлении с получением неочищенного продукта, который может быть очищен перекристаллизацией или колоночной хроматографией.
Следуя методике способа J, с использованием в качестве исходных продуктов соединений 35-40 получали следующие соединения:
12-хлор-5-тиабензо[4,5]циклогепта[1,2-b]нафталин-13-карбальдегид;
7-хлор-13-тиабензо[5,6]циклогепта[1,2-а]нафталин-8-карбальдегид;
7-хлор-13-оксабензо[5,6]циклогепта[1,2-а]нафталин-8-карбальдегид;
12-хлор-8-метокси-5-оксабензо[4,5]циклогепта[1,2-b]нафталин-13-карбальдегид;
7-хлор-1,2,3,4-тетрагидро-13-оксабензо[5,6]циклогепта[1,2-а]нафталин-8-карбальдегид;
12-хлор-7,8,9,10-тетрагидро-5-оксабензо[4,5]циклогепта[1,2-b]нафталин-13-карбальдегид (таблица 4; соединения 42-47).
Таблица 4
Соединения формулы III, где Y=Z=Y
(MH+)
Данные биологических испытаний
В таблице 5 приведены данные биологических испытаний (как описано выше), иллюстрирующие активность соединений по изобретению в ингибировании продуцирования ФНО-α in vitro.

| название | год | авторы | номер документа |
|---|---|---|---|
| 2-ТИАДИБЕНЗОАЗУЛЕНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОДУЦИРОВАНИЯ ФАКТОРА НЕКРОЗА ОПУХОЛИ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2334749C2 |
| 1-ОКСА-3-АЗАДИБЕНЗОАЗУЛЕНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОДУЦИРОВАНИЯ ФАКТОРА НЕКРОЗА ОПУХОЛИ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2323222C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛОПИРИМИДИНА | 2007 |
|
RU2420530C2 |
| ФОСФОИНДОЛЫ КАК ИНГИБИТОРЫ ВИЧ | 2005 |
|
RU2393163C2 |
| ПРОИЗВОДНОЕ ПИПЕРИДИНА | 2008 |
|
RU2475485C2 |
| ХИНОЛОНОВОЕ СОЕДИНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2544530C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
| ПРОИЗВОДНЫЕ МОЧЕВИНЫ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ, СРЕДИ ПРОЧЕГО, ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНОГО ПУТИ | 2011 |
|
RU2586223C2 |
| АМИНОПРОПИЛИДЕНОВОЕ ПРОИЗВОДНОЕ | 2009 |
|
RU2483063C2 |
| ПРОИЗВОДНЫЕ НАФТАЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2155188C2 |
Описываются производные бензонафтоазулена формулы (I), где Х представляет собой О или S; Y и Z означают водород; группы
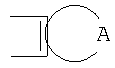
или 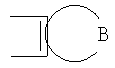
означают структуры
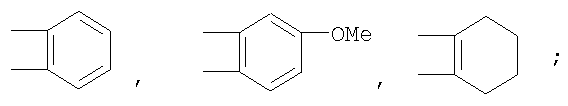
R1 представляет собой 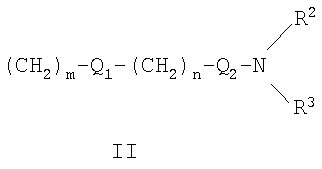
где R2 и R3 одновременно или независимо друг от друга могут представлять собой Н, С1-С4-алкил или вместе с N означают гетероцикл, выбранный из морфолинила, пиперидинила или пирролидинила; n - целое число от 0 до 3; m - целое число 1; Q1 и Q2 независимо друг от друга представляют собой кислород или группу 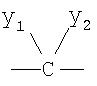 , где y1 и у2 независимо друг от друга представляют собой водород или С1-С4-алкил. Описываются производные бензонафтоазулена формулы (Ia), отличающиеся от соединения формулы (I) тем, что R1 представляет собой C1-С7-алкил, замещенный гидроксилом, или С1-С7-алкилоксикарбонил. Соединения формулы (I) ингибируют продуцирование ФНО-α, и соединения формулы (Ia) являются промежуточными продуктами для получения соединений формулы (I). Описываются также применение соединений формулы (Ia), где R1 - COzEt, CH2OH для получения соединений формулы (I), и применение соединений формулы (I) для получения фармацевтических композиций, предназначенных для ингибирования продуцирования ФНО-α. 4 н. и 6 з.п. ф-лы, 5 табл.
, где y1 и у2 независимо друг от друга представляют собой водород или С1-С4-алкил. Описываются производные бензонафтоазулена формулы (Ia), отличающиеся от соединения формулы (I) тем, что R1 представляет собой C1-С7-алкил, замещенный гидроксилом, или С1-С7-алкилоксикарбонил. Соединения формулы (I) ингибируют продуцирование ФНО-α, и соединения формулы (Ia) являются промежуточными продуктами для получения соединений формулы (I). Описываются также применение соединений формулы (Ia), где R1 - COzEt, CH2OH для получения соединений формулы (I), и применение соединений формулы (I) для получения фармацевтических композиций, предназначенных для ингибирования продуцирования ФНО-α. 4 н. и 6 з.п. ф-лы, 5 табл.
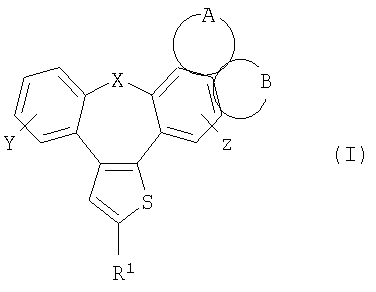
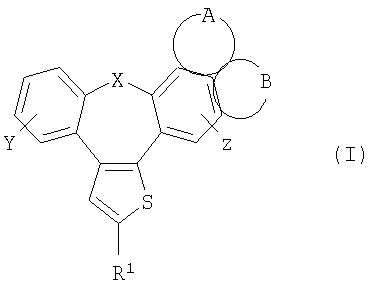
где X представляет собой О или S;
Y и Z означают водород;
группы
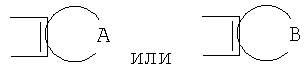
означают структуры
R1 представляет собой заместитель формулы II
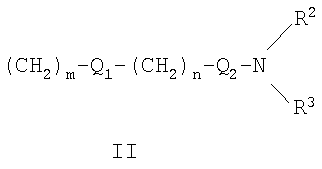
где R2 и R3 одновременно или независимо друг от друга могут представлять собой водород, С1-С4-алкил, или вместе с N означают гетероцикл, выбранный из морфолинила, пиперидинила или пирролидинила;
n представляет собой целое число от 0 до 3;
m представляет собой целое число 1;
Q1 и Q2 независимо друг от друга представляют собой кислород или группу
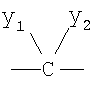
где заместители y1 и у2 независимо друг от друга могут представлять собой водород или С1-С4-алкил.
где Х представляет собой О или S;
Y и Z означают водород;
группы
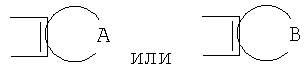
означают структуры

R1 представляет собой С1-С7-алкил, замещенный гидроксилом, или C1-С7-алкилоксикарбонил.
этиловый эфир 8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 1,8-дитиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 3,10-дитиабензо[е]нафто[1,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 11-метокси-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-карбоновой кислоты;
этиловый эфир 10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-карбоновой кислоты;
8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-ил)метанол;
(1,8-дитиабензо[е]нафто[3,2-h]азулен-2-ил)метанол;
(3,10-дитиабензо[е]нафто[1,2-h]азулен-2-ил)метанол;
(10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-ил)метанол;
(11-метокси-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-ил)метанол;
(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-ил)метанол;
(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-ил)метанол.
диметил-[2-(8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил] амин;
диметил-[3-(8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин;
3-(8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропиламин;
диметил-[3-(1,8-дитиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин;
диметил-[2-(3,10-дитиабензо[е]нафто[1,2-h]азулен-2-илметокси)этил]амин;
диметил-[3-(3,10-дитиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин;
диметил-[2-(10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)этил]амин;
диметил-[3-(10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин;
диметил-[3-(11-метокси-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин;
диметил-[2-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)этил]амин;
диметил-[3-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин;
3-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропиламин;
метил-[3-(6,7,8,9-тетрагидро-10-окса-3-тиабензо[е]нафто[1,2-h]азулен-2-илметокси)пропил]амин;
диметил-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]амин;
диметил-[3-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин;
4-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]морфолин;
1-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]пиперидин;
1-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил]пирролидин;
диметил-[2-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)пропил]амин;
диметил-[1-метил-(10,11,12,13-тетрагидро-8-окса-1-тиабензо[е]нафто[3,2-h]азулен-2-илметокси)этил] амин.
| Вибровозбудитель | 1984 |
|
SU1187890A1 |
| Y | |||
| СНЕМ SOC | |||
| PERKIN TRANS, №15, 1994, 2191-2195, abstract | |||
| COMPTES RENDUS DES SEANCES DE L'ACADEMIE DES SCIENCES, SERIE c, 283 (15), 1976, 683-686, abstract. | |||
Авторы
Даты
2008-03-10—Публикация
2003-04-09—Подача