Область изобретения
Настоящее изобретение относится к способу лечения и/или предупреждения воспалительного состояния в органе, содержащем жидкость и имеющем естественное наружное отверстие, таком как вымя животного, производящего молоко, или ухо субъекта. Данное изобретение также относится к диспергируемой фармацевтической композиции, подходящей для инфузии в орган согласно способу по изобретению, и к способу получения такой композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Мастит представляет собой воспаление молочной железы животных, производящих молоко, например молочных коров, наиболее часто вызываемое бактериальной инфекцией. Бактерии проникают через сосковый канал животного и могут вызвать острый, клинический или субклинический мастит. Было подтверждено, что более 135 организмов являются патогенами, вызывающими мастит у коров. Тремя основными группами патогенов являются грамположительные кокки, грамотрицательные бациллы и грамположительные бациллы. Гигиена, факторы окружающей среды и метаболические расстройства, происходящие от высокой выработки молока, объединяются и создают условия, благоприятные для начала мастита. Повышенное содержание соматических клеток, связанное с маститом, положительно коррелирует с инфекцией и отрицательно коррелирует с производством молока. Часто инфицированных коров приходится удалять из стада и прекращать доение. Если заболевание не лечить должным образом, мастит часто поражает корову на протяжении всей ее жизни. Процент инфицирования в среднем составляет от 10% до 30% коров на обычное стадо, с убытками в интервале от 185$ до 250$ на корову в год. Мастит коров является наиболее экономически дорогостоящим заболеванием для молочной промышленности, и убытки в одних только Соединенных Штатах оцениваются в два миллиарда долларов ежегодно. Большая часть этих убытков обусловлена уменьшенным производством молока.
Так как воспаление и лейкоцитоз, вызванные колиформным маститом, часто сохраняются и после того, как бактерии уже не могут быть выделены из железы, применение долговременной противовоспалительной лекарственной терапии может быть полезным при лечении мастита.
Интрамаммарное введение диспергируемых композиций, содержащих антибактериальный агент, для лечения мастита у животных, производящих молоко, хорошо известно. Некоторые композиции, подходящие для такого введения, готовят в виде препаратов на основе масел.
В патенте США № 3636194, Parizeau, раскрыта композиция для лечения мастита путем интрамаммарной инфузии, содержащая антибиотик, растительное масло, спирторастворимую фракцию природного фосфолипидного вещества лецитина, способствующего диспергированию масла в молоке, причем фосфолипид выбран из группы, состоящей из фосфатидилхолина и фосфатидилэтаноламина и их смесей, и присутствует в указанном масле в количестве по меньшей мере 0,25%. Указано, что такие композиции обеспечивают быстрое диспергирование в молоке и короткое время выведения с молоком (miikout times).
Заявка на патент Великобритании № 1181527 раскрывает композицию для лечения мастита, содержащую активное вещество и фармацевтически приемлемую масляную основу, содержащую фосфолипидное вещество, состоящее по существу полностью из спирторастворимого вещества, способствующего диспергированию данной композиции в молоке.
В европейской патентной заявке № 0222712 раскрыта композиция, которая содержит один или более противомикробный агент, диспергированный в масле, состоящем из смеси триглицеридов пальмитиновой и стеариновой кислот вместе с полиоксиэтиленированным цетиловым спиртом и стеариловым спиртом, и помещена в масляную среду минерального, растительного, синтетического или смешанного происхождения. Указано, что такие композиции ускоряют высвобождение противомикробного агента в вымени, усиливая его биологический потенциал и снижая время выведения с молоком.
Также было предложено применение противовоспалительных агентов для лечения мастита.
В патенте США № 5756529, Isakson & Talley, раскрыт способ применения пиразолил-бензолсульфонамидных соединений для лечения воспаления у домашнего животного. Указано, что такие соединения являются полезными для лечении боли, лихорадки, заболевания суставов, травматического повреждения, артрита, миозита, тендинита, колики у лошадей, мастита, перитонита, кожных состояний, ожогов, гингивита, гиперчувствительности, конъюнктивита, воспаления глаз, припухлостей и ишемии миокарда.
В международной патентной публикации № WO 02/22107 раскрыты композиции, содержащие один или более чем один биоактивный агент в жидком носителе, который модифицировали так, чтобы он содержал повышенный уровень продуктов окисления, где биоактивные агенты включают противоинфекционные агенты, противоопухолевые агенты, иммунномодуляторы, жаропонижающие средства, анальгетики и противовоспалительные агенты (например, ингибиторы СОХ-2 (циклооксигеназы-2)). Такие композиции можно вводить парентеральным (например, подкожным, интрамаммарным, внутривенным, интраперитонеальным или внутримышечным), местным, интравагинальным, пероральным или ректальным путем.
В международной патентной публикации №WO 02/06865 раскрыто одно или более чем одно биоактивное вещество в неводном носителе, причем эту композицию доводили до значения активности воды от приблизительно 0,2 до приблизительно 0,5. Предлагаются парентеральный, местный, оральный, интравагинальный, ректальный и интрамаммарный пути введения. Среди биоактивных агентов перечислены противоинфекционные агенты, противоопухолевые агенты, иммунномодуляторы, жаропонижающие средства, анальгетики и противовоспалительные агенты (например, ингибиторы СОХ-2).
В международной патентной публикации № WO 99/20259 раскрыта комбинация тиамфеникола и диклофенака для применения в ветеринарии с целью лечения инфекций с ассоциированными воспалительными состояниями.
В международной патентной публикации № WO 01/60409 раскрыта пастообразная композиция, содержащая терапевтический агент, белую сажу, модификатор вязкости и гидрофильный носитель; где терапевтический агент выбран из инсектицидов, акарицидов, паразитицидов, антибиотиков, усилителей роста, маслорастворимых NSAIDs (нестероидных противовоспалительных лекарственных средств), авермектинов, милбемицинов, нордулиспориновой (nordulisporic) кислоты, эстрогенов, прогестинов, фенилпиразолов, замещенных пиридилметильных производных и ингибиторов СОХ-2. Рассмотрены пероральный, местный, кожный и подкожный пути ведения пастообразной композиции. Указано, что такие композиции имеют применение в ветеринарной практике в лечении таких заболеваний, как пневмония, мастит, метрит, ринит и бронхит.
В публикации заявки на патент США № 2002/0032228 раскрыто применение гетероциклсодержащего соединения, например дифенильного гетероциклического производного, для лечения диарейных заболеваний, коклюша, сибирской язвы, состояний сокращения гладких мышц и мастита. Целекобсиб и рофекоксиб перечислены в качестве предпочтительных дифенильных гетероциклических производных.
Проспект продуктов Labrafil (обозрение OL 0050/5-ое издание) от Gattefossé Corporation содержит выдержку из диссертации Valette (1957) с обсуждением характеристик Labrafil™ M-1944CS в ушном канале. В той же самой диссертации описан эксперимент, включающий инъекцию Labrafil™ M-1944CS, смешанного с генцианвиолетом, в сосок коровы. Показано, что Labrafil™ увлажнял всю поверхность среза паренхимы молочной железы и достиал ретромаммарного ганглия.
В двух статьях, Gao et al. (1995) в Pharmaceutical Research 12(6), 857-868, "Controlled release of a contraceptive steroid from biodegradable and injectable gel formulations: in vitro evaluation" и "Controlled release of a contraceptive steroid from biodegradable and injectable gel formulations: in vivo evaluation", описано получение гелей, содержащих левоноргестрел, Labrafil™ M-1944CS и глицерилпальмитостеарат.
Ушные расстройства занимают второе место среди наиболее часто встречающихся болезней у детей в Соединенных Штатах, уступая только обычной простуде. Большинство ушных расстройств являются результатом болезненной воспалительной реакции на инфекции, аллергические реакции или травму уха. Ушная инфекция может иметь бактериальное, грибковое или вирусное происхождение, и определение точной этиологии нецелесообразно, так как болезнетворный организм часто сложно выделить и культивировать. В число наиболее распространенных ушных расстройств входит наружный отит (инфекции наружного уха), средний отит (инфекции среднего уха) и оторея (средний отит с разорванной барабанной перепонкой и выпотом).
Наружный отит, затрагивающий части ушного канала наружного уха, представляет собой обычную отологическую проблему, встречающуюся главным образом во время жаркой, влажной погоды, и в пять раз чаще у купающихся по сравнению с некупающимися. На начальной стадии симптомы включают зуд и боль в ушном канале, а также болезненность при надавливании вокруг наружного слухового канала, растягивании мочки уха или движении челюсти. На последней стадии в ушном канале происходит нагноение и может понизиться слух. Более 90% случаев наружного отита вызваны бактериальными и грибковыми инфекциями.
Патологические состояния могут возникать из-за изменений и могут вызывать изменения поверхностного натяжения на границах раздела фаз воздух/жидкость тканевых поверхностей, особенно эпителиальных тканевых поверхностей. Наружный слуховой канал выстлан эпителием. Серный экссудат, обычно секретируемый на эпителиальную ткань, выстилающую наружный слуховой канал, придавая ей особенно высокое поверхностное натяжение. Воспалительные побочные продукты могут дополнительно увеличивать такое поверхностное натяжение. Повышенное поверхностное натяжение является важным фактором как симптомов, так и лечения отита. Кроме того, и даже в отсутствие закрытия канала, повышенное поверхностное натяжение, постоянно присутствующее на эпителиальной выстилке наружного ушного канала, имеет тенденцию препятствовать равномерному и/или эффективному нанесению терапевтических агентов.
В прошлом наружный отит лечили путем местного нанесения терапевтических агентов, демонстрирующих как противомикробное, так и противовоспалительное действие. Для уничтожения болезнетворных бактерий использовали ушные суспензии антибиотиков широкого спектра действия, эффективные при местном применении, содержащие антибактериальные агенты, например неомицина сульфат, колистина сульфат, полимиксин Б или их комбинации, все из которых имеют широкий спектр действия. Для ликвидации лежащего в основе грибкового заболевания использовали противогрибковые агенты местного действия, например нистатин и клотримазол. Кроме того, использовали противовирусный агент ацикловир для лечения вирусного наружного отита, включая опоясывающий герпес.
Чтобы контролировать воспалительный процесс при наружном отите, использовали противовоспалительные агенты, включая, например, гидрокортизон, гидрокортизона ацетат и дексаметазона натрия фосфат, которые часто включали в суспензии местного действия, указанные выше. Чаще всего противомикробные и противовоспалительные агенты используют в комбинации для лечения являющегося причиной, инициирующего расстройства, например бактериальной инфекции, а также самого воспалительного процесса. Чаще всего их также вводят в виде суспензий в форме капель для местного введения в пораженное ухо. Для того чтобы увеличить и обеспечить более однородную доставку таких лекарств к эпителиальной выстилке наружного ушного канала, используют тампоны, изготовленные из абсорбирующего материала, такого как хлопок, для втягивания суспензии в ушной канал. Однако из-за экссудата, присутствующего при гнойных формах наружного отита, и ушной серы, присутствующей фактически при всех воспалительных состояниях, высокое поверхностное натяжение препятствует равномерному распределению таких лекарств по всему наружному слуховому каналу.
Наиболее распространенное ушное расстройство, средний отит, в Соединенных Штатах является основной причиной потери слуха и представляет собой значительный недостаток, мешающий процессу обучения в детском возрасте. Смотрите Estrada (1997), infect. Med. 14(3), 239-244. Средний отит является причиной более 35 процентов ежегодных посещений педиатров в детском возрасте и означает для здравоохранения США расходы более 3,5 миллиарда долларов ежегодно.
Во время приступов среднего отита относительно высокие поверхностные натяжения, присутствующие на границе раздела воздух/жидкость, находящейся на эпителиальной выстилке просвета трубы, увеличивают давление открытия, требуемое для открытия этого канала.
Обычно инфекционные ушные расстройства, такие как средний отит, лечат курсом антибиотикотерапии. Смотрите The Merck Manual, 17th edition (1999), Section 7, Chapter 84. Системное введение антибиотиков обычно требует высоких исходных доз и ощутимого лаг-периода для достижения терапевтических уровней в ухе. Системное применение лекарств посредством парентерального или перорального пути, при достижении в конечном счете евстахиевой трубы и среднего уха, может сопровождаться неблагоприятными системные эффектами и, что более важно, не особенно эффективно при доставке концентрированной дозы наносимых лекарственных средств туда, где они действительно необходимы, непосредственно в ткани-мишени. В то же время непосредственное нанесение лекарственного средства осложнено анатомией закупоренных полостей среднего уха.
В различных патентах и публикациях, включая патенты и публикации, перечисленные ниже, для местного введения в ухо предлагались комбинации антибактериальных и противовоспалительных средств, вместе приготовленные в виде препарата в фармацевтически приемлемом наполнителе.
Патент США № 6395746, Cagle et al.
Патент США № 6440964, Cagle et al.
Патент США № 6509327, Cagle et al.
Патент США № 5679665, Bergamini et al.
Патент США № 5965549, Purwar & Goldman.
Публикация заявки на патент США № 2001/0049366.
Публикация заявки на патент США № 2002/0142999.
В публикации заявки на патент США № 2002/0044920 раскрыто лечение иммунноопосредованных ушных расстройств путем введения антагониста TNF (фактора некроза опухоли) и ингибитора синтеза пиримидина со стероидом, противовоспалительным соединением (например, нестероидным противовоспалительным лекарственным средством, также известным как NSAID, или ингибитором СОХ-2), цитотоксическим соединением, противоопухолевым метаболитом или вторичным противоревматическим агентом.
В публикации заявки на патент США № 2002/0076383 раскрыто введение композиции в виде аэрозоля через наружный слуховой канал, причем эта композиция содержит липидное поверхностно-активное вещество в количестве, эффективном для снижения поверхностного натяжения на границе раздела фаз воздух/жидкость на эпителиальной тканевой выстилке, агент, увеличивающий растекание, и пропеллент, где агент, увеличивающий растекание, выбран из группы, состоящей из липидов, стеролов, жирной кислоты, эфиров холестерина, фосфолипидов, углеводов и белков, все из которых находятся в форме порошка. Указано, что композиция увеличивает проходимость наружного слухового канала, одновременно обеспечивая защиту от возникновения наружного отита.
В публикации заявки на патент США № 2002/0064503 раскрыто введение композиции в виде аэрозоля через наружные дыхательные пути, причем эта композиция содержит липидное поверхностно-активное вещество в количестве, эффективном для снижения поверхностного натяжения на границе раздела фаз воздух/жидкость на эпителиальной тканевой выстилке, и агент, увеличивающий растекание, выбран из группы, состоящей из стеролов, липидов, жирных кислот, эфиров холестерина, фосфолипидов, углеводов и белков, все из которые находятся в форме порошка. Указано, что эта композиция увеличивает проходимость и эффективность уравнивания давления в просвете евстахиевой трубы.
Ушные капли были рассмотрены как тип препарата для селективных ингибиторов СОХ-2, например в патентах и публикациях, приведенных ниже.
Заявка на патент США № 2001/0041726.
Заявка на патент США № 2001/0053764.
Заявка на патент США № 2002/0010146.
Заявка на патент США № 2002/0013318.
Патент США № 6307047, Black et al.
Патент США № 6329526, Adams et al.
Все патенты и публикации, приведенные выше, включены в данное описание изобретения посредством ссылки.
Несмотря на недавние успехи в понимании причин ушных расстройств, они остаются в значительной степени непредотвратимыми и сложными для эффективного лечения. Следовательно, было бы полезным предложить эффективные способы и композиции для предупреждения и лечения ушных расстройств и связанных с ними осложнений.
Наиболее часто используемые упаковочные контейнеры и средства доставки композиций, предназначенных для интрамаммарного введения, для лечения или предупреждения мастита у животных, производящих молоко, также как и композиций для введения в уши для лечения ушных расстройств, создают из кислородопроницаемых пластиков, например полиэтилена, полипропилена и т.д., и их смесей. Применение кислородопроницаемых упаковочных контейнеров и устройств доставки для композиций против мастита и для композиций для лечения или предупреждения ушных расстройств, ставит серьезные проблемы относительно долговременной химической и/или физической стабильности композиций, содержащихся в них, если эта композиция включает ингредиент, например активное лекарство или эксципиент, которые подвержены окислительному разложению.
Хотя в документах, перечисленных выше, раскрыт целый ряд композиций для лечения мастита или для лечения ушных расстройств, ни в одном из них не рассматривается задача обеспечения длительной химической и/или физической стабильности композиции, упакованной в кислородопроницаемый контейнер, где эта композиция содержит фармацевтически активный агент и/или эксципиент, которые подвержены окислительному разложению. Несмотря вышеупомянутые руководства, в данной области все еще существует необходимость в фармацевтических композициях, имеющих одно или более чем одно из следующих преимуществ над композициями из предшествующего уровня техники, используемыми в лечении мастита, или над композициями из предшествующего уровня техники, используемыми в лечении или предупреждении ушных расстройств:
(а) длительная химическая и/или физическая стабильность, даже при упаковке в кислородопроницаемые контейнеры и средства доставки, особенно когда композиция содержит фармацевтически активный агент или эксципиент, подверженный окислительному разложению, (б) безопасное, эффективное лечение воспалительного компонента мастита или ушного расстройства, (в) безопасное, эффективное лечение боли, воспаления, отека, лихорадки и, припухлостей, связанных с маститом или ушным расстройством, (г) минимальное раздражение или отсутствие раздражения после введения композиции, (д) быстрая диспергируемость противомаститной композиции в молоке и в жидкостях вымени для быстрого достижения эффективных уровней лекарства в местах воспаления; (е) быстрая диспергируемость ушной композиции в восковидной влажной среде уха для быстрого достижения эффективных уровней лекарства в местах воспаления, (ж) уменьшение поверхностного натяжения на границе раздела фаз воздух/жидкость эпителиальной ткани, увеличивающее проходимость слухового канала и (з) защитное покрытие для воспаленных слизистых оболочек уха.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящее время разработаны новые способы лечения и фармацевтические композиции, имеющие некоторые или все полезные свойства, описанные выше. В частности, предложен новый способ лечения и/или предупреждения воспалительного состояния в органе, содержащем жидкость, имеющем естественное наружное отверстие, например в вымени животного, производящего молоко, или в ухе человека или животного. Этот способ включает введение противовоспалительного агента в орган через наружное отверстие и его введение при комбинированной терапии вместе с вторым агентом, как он определен в данном описании. Противовоспалительный агент вводят в виде фармацевтической композиции, содержащей, кроме указанного агента, наполнитель, который содержит (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрокристаллический воск и (в) фармацевтически приемлемый неводный носитель.
Такая композиция имеет низкое межфазное натяжение при приведении контакт с водной средой. Без связи с теорией, представляется, что это низкое межфазное натяжение приводит к композиции, легко диспергирующейся в жидкостях вымени, таких как молоко, а также в более воскообразной влажной среде уха. Следовательно, в предпочтительном способе по изобретению при введении в орган, содержащий жидкость, композиция диспергируется в этой жидкости.
Предпочтительным противовоспалительным агентом для применения в способе по изобретению является селективный ингибитор СОХ-2.
Способ может, например, включать интрамаммарную инфузию такой композиции для лечения мастита или других заболеваний вымени у животного, производящего молоко, или инфузию в ухо такой композиции для лечения и/или предупреждения ушных расстройств, и является эффективным при широком ряде воспалительных расстройств, которые могут быть связаны с широким рядом инфекционных организмов. Термин «инфузия» в данном описании охватывает любую процедуру, при которой жидкую композицию заставляют течь в орган, содержащий жидкость, через наружное отверстие, например канал соска в случае интрамаммарной инфузии, или наружный слуховой канал в случае инфузии в ухо, независимо от требующегося времени. В настоящем контексте «инфузия» и «инъекция» по существу являются синонимами. Например, композицию можно вводить интрамаммарно путем введения катетерной насадки маститного шприца во внешнее отверстие канала соска и инъекции композиции через насадку в вымя.
В другом воплощении при комбинированной терапии противовоспалительный агент, например селективный ингибитор СОХ-2, вводят со вторым агентом. Второй агент может быть любым терапевтически активным агентом, полезным в лечении мастита или ушных расстройств. Такие вторые агенты включают, без ограничения, антибактериальные агенты, противоопухолевые агенты, анестетики, блокаторы натриевых каналов, жаропонижающие средства, анальгетики, противоотечные агенты и тому подобное, а также их комбинации.
Второй агент можно вводить путем, отличным от пути введения противовоспалительного агента. Альтернативно, оба агента можно вводить одинаковым путем, т.е. через наружное отверстие органа, например через канал соска в случае вымени, или через наружный слуховой канал в случае уха. Когда введение осуществляют тем же самым путем, предпочтительно вводить оба агента посредством интрамаммарной инфузии или инфузии в ухо в форме жидкой композиции, содержащей наполнитель, как описано выше. Особенно предпочтительно вводить противовоспалительный агент и второй агент в одной композиции, содержащей оба агента.
Соответственно дополнительно предложена фармацевтическая композиция, содержащая наполнитель, который содержит (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрокристаллический воск и (в) фармацевтически приемлемый неводный носитель. Наполнитель содержит противовоспалительный агент, устойчиво диспергированное в нем, например селективный ингибитор СОХ-2, в количестве, эффективном против воспаления.
В одном воплощении противовоспалительный агент и/или эксципиент в композиции подвержены к окислительному разложению, и композиция обладает длительной химической и/или физической стабильностью, будучи упакованной в контейнер или средство доставки, имеющие кислородопроницаемую стенку.
Новая композиция имеет низкое межфазное натяжение в водных жидкостях, посредством чего увеличивается диспергируемость этой композиции в молоке и жидкостях вымени, по сравнению с традиционным препаратом на масляной основе. Это приводит к быстрому распределению композиции по вымени и, таким образом, позволяет противовоспалительному агенту и/или второму агенту быстро достигать воспаленной ткани, обеспечивая эффективный уровень лекарства в месте воспаления. Межфазное натяжение композиции в водной жидкости определяет энергию, необходимую для дисперсии и распространения композиции в жидкости, а также энергию, необходимую для того, чтобы суспендированная частица в композиции пересекла межфазную границу масло/молоко или масло/жидкость в вымени.
Низкое межфазное натяжение композиции также увеличивает диспергируемость композиции в воскообразной влажной среде уха по сравнению с традиционной композицией. Получающееся в результате быстрое распределение композиции по слизистым оболочкам и содержащему липиды воску ушного канала позволяет противовоспалительному агенту и/или второму агенту быстро достигать воспаленной ткани, обеспечивая эффективный уровень лекарства в месте воспаления. Такая композиция также может образовать защитное покрытие для воспаленных слизистых оболочек уха.
Предпочтительно способ или композиция обеспечивают эффективное лечение воспалительного компонента расстройства молочной железы или ушей. Предпочтительно способ или композиция обеспечивают эффективное лечение и/или предупреждение боли, воспаления, опухания, отека и/или лихорадки, ассоциированных с таким расстройством.
При введении путем интрамаммарной инфузии, например при лечении мастита, предпочтительные способы и композиции могут обладать дополнительными преимуществами. Например, предпочтительный способ обеспечивает подходящее короткое время выведения с молоком. Время выведения с молоком для коровы, производящей молоко, представляет собой период времени от введения средства для лечения мастита до возобновления производства, пригодного для продажи молока. После такого введения, перед тем как молоко будет считаться подходящим для употребления человеком, концентрация активного(ых) агента(ов) в молоке должна упасть до уровня, допускаемого соответствующим регулирующим органом. Подходящее короткое время выведения с молоком уменьшает материальные убытки молочных фермеров от вспышки мастита.
Альтернативно или дополнительно предпочтительный способ обеспечивает короткое время задержки получения молока после отела после лечения сухого коровьего мастита, с отсутствием остатков активного агента у потомства.
Альтернативно или дополнительно, предпочтительный способ обеспечивает нулевой период отказа от забоя на мясо после лечения мастита. Это свойство является особенно важным, так как позволяет фермеру распоряжаться излеченной коровой в любое время, когда сделать это выгодно с финансовой точки зрения, вместо необходимости содержать и кормить корову в течение определенного времени после ее лечения.
При введении путем инфузии в ухо, например при лечении инфекционных расстройств уха, имеющих воспалительный компонент, предпочтительные способы и композиции могут иметь дополнительные преимущества. Например, предпочтительный способ увеличивает проходимость слухового канала и посредством этого снижает сопротивление прохождению звука, улучшая чистоту и чувствительность слуха.
Альтернативно или дополнительно предпочтительный способ обеспечивает покрытие эпителиальной выстилки уха, которое защищает против вредных воздействий воды и переносимых водой токсинов, раздражающих и аллергенных веществ, и помогает предотвратить ушные расстройства.
Дополнительная польза способов и композиций по изобретению как для воспалительного, так и для ушного применения, состоит в том, что они обеспечивают направленную доставку по меньшей мере противовоспалительного агента к месту воспаления. Когда используется композиция по изобретению, содержащая и противовоспалительный агент, и второй агент, как определено в данном описании, обеспечивается направленная доставка обоих агентов к месту инфекции и/или воспаления.
Еще одним преимуществом предпочтительных композиций как для воспалительного, так и для ушного введения, является то, что после введения они вызывают минимальное раздражение или вообще не вызывают его.
Еще одним преимуществом композиции по изобретению является улучшенная физическая стабильность при сравнении с традиционными масляными или водными композициями, например благодаря улучшенной ресуспендируемости композиции. Показано, что композиция по изобретению вызывает флокуляцию определенных лекарственных средств, посредством этого улучшая ресуспендируемость и устраняя проблему образования в суспензии осадка и возможной доставки недостаточно сильной или неэффективной дозы.
Предложен способ получения фармацевтической композиции по изобретению. Данный способ включает смешивание, в любом подходящем порядке, амфипатического масла, которое является диспергируемым в воде и нерастворимым в этаноле, микрокристаллического воска, фармацевтически приемлемого неводного носителя и противовоспалительного агента, например селективного ингибитора СОХ-2, с получением композиции, причем такая композиция предпочтительно имеет длительную химическую и/или физическую стабильность, как определено в данном описании.
Таким образом, настоящее изобретение предлагает решение нескольких давних проблем в данной области и обладает одним или более преимуществами над способами и композициями из уровня техники. Другие признаки, преимущества и выгоды изобретения будут очевидны из описания, которое следует далее.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении предложен способ лечения и/или предупреждения воспалительного состояния в органе, содержащем жидкость, имеющем естественное наружное отверстие, включающий введение противовоспалительного агента в орган через наружное отверстие, в форме фармацевтической композиции, содержащей противовоспалительный агент в эффективном против воспаления количестве, и наполнитель, который содержит (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрокристаллический воск и (в) фармацевтически приемлемый неводный носитель. Согласно изобретению также предложено применение композиции по настоящему изобретению в изготовлении лекарства для лечения или предупреждения воспалительного состояния в органе, содержащем жидкость, имеющем естественное наружное отверстие. Согласно изобретению дополнительно предложена композиция для применения в способе лечения или предупреждения воспалительного состояния в органе, содержащем жидкость, имеющем естественное наружное отверстие.
Данный способ является особенно полезным в лечении и/или предупреждении воспаления, сопровождающего инфекционное состояние. «Инфекционное состояние» в данном описании включает любое заболевание, расстройство или состояние, опосредованное патогенными бактериями, или то, что оно поддается лечению антибактериальным агентом, таким как антибиотическое лекарственное средство.
Следует понимать, что ссылка в данном описании на способы, включая и композиции, содержащие «противовоспалительный агент», охватывает такие способы и композиции, где используют более чем один противовоспалительный агент. Также более чем один терапевтически активный агент, отличный от противовоспалительного агента, возможно может образовывать в данном случае «второй агент».
Термин «количество, эффективное против воспаления», используемый в данном описании, относится к количеству противовоспалительного агента, которое, при введении способом по изобретению, является достаточным для уменьшения, облегчения, предупреждения или задержки начала одного или более симптомов воспалительного состояния, которое лечат. Термин «терапевтически эффективное количество», используемый в данном описании, относится к количеству активного агента, которое при введении способом по изобретению является достаточным для уменьшения, облегчения, предупреждения или задержки начала одного или более симптомов состояния, которое лечат, или для снижения количества и/или активности болезнетворного организма. Выражение «в терапевтически эффективных количествах каждого» означает, что при введении в комбинированной терапии согласно способу по изобретению, количество противовоспалительного агента и количество второго агента являются достаточными для обеспечения как противовоспалительного эффекта, так и эффекта, выбранного из антибактериального, анестетического, блокирующего натриевые каналы, противоотечного, анальгетического, противоопухолевого и/или жаропонижающего эффектов. Такие количества могут быть такими же, а также больше или меньше, чем количество противовоспалительного агента или количество второго агента, которые являются терапевтически эффективными при применении в монотерапии.
Орган, содержащий жидкость, как предполагается в данном описании, включает орган, относящийся к молочной железе, например вымя животного, производящего молоко, такого как корова, коза или овца. «Животным, производящим молоко» может быть самка любого вида млекопитающих, но, предпочтительно, животное, выращенное с целью получения молока, например корова, коза или овца, и данный термин включает в себя таких животных, независимо от того, вырабатывают они молоко или нет во время воспалительного и/или инфекционного состояния или в момент лечения. Естественным наружным отверстием органа, относящегося к молочной железе, является отверстие канала соска. Орган, содержащий жидкость, также включает ухо человека или животного. Естественным наружным отверстием уха является отверстие наружного слухового канала.
Согласно изобретению дополнительно предложен способ лечения воспалительного состояния в органе, содержащем жидкость, имеющем естественное наружное отверстие, включающий введение противовоспалительного агента в орган через наружное отверстие и введение при комбинированной терапии с ним второго агента, как определено в данном описании, в терапевтически эффективном количестве каждого из них; где противовоспалительный агент вводят в виде фармацевтической композиции, содержащей указанные агент и наполнитель, который содержит (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрокристаллический воск и (в) фармацевтически приемлемый неводный носитель.
Термин «комбинированная терапия» в данном описании обозначает схему лечения, при которой противовоспалительный агент и второй агент вводят индивидуально или вместе таким способом, чтобы обеспечить полезный эффект от совместного действия этих терапевтических средств. Такой полезный эффект может включать, но не ограничивается, фармакокинетическим или фармакодинамическим совместным действием терапевтических средств. Комбинированная терапия, например, может сделать возможным введение более низкой дозы одного или обоих агентов, по сравнению с дозой, которую обычно вводили бы в процессе монотерапии, таким образом снижая риск или распространенность побочных эффектов, связанных с более высокими дозами. Альтернативно, комбинированная терапия может приводить к повышенному терапевтическому эффекту при нормальной дозе каждого агента в монотерапии. В данном описании предполагается, что «комбинированная терапия» не охватывает введение двух или более терапевтических средств, как части отдельных схем монотерапии, которые случайно и произвольно приводят к последовательному или одновременному лечению.
Введение противовоспалительного агента и второго агента обычно осуществляют на протяжении определенного периода времени (обычно минуты, часы, дни или недели, в зависимости от выбранной комбинации). Эти терапевтические агенты можно вводить последовательно, то есть в различные моменты времени, обычно отделенные друг от друга не более чем приблизительно 24 часами, или по существу одновременно.
При одновременном введении противовоспалительный агент и второй агент можно вводить в отдельных лекарственных формах или вместе с препаратом, т.е. в одной лекарственной форме. Когда два агента вводят последовательно или в отдельных лекарственных формах, второй агент можно вводить любым подходящим путем и в любой фармацевтически приемлемой лекарственной форме, например путем и/или в лекарственной форме, которые отличны от используемых для противовоспалительного агента. Альтернативно, второй агент, подобно противовоспалительному агенту, можно диспергировать в наполнителе, который содержит (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрокристаллический воск и (в) фармацевтически приемлемый неводный носитель, и вводить через естественное наружное отверстие органа, содержащего жидкость. В предпочтительном воплощении оба агента вместе диспергируют в том же самом наполнителе и вводят за один прием.
Предпочтительно второй агент готовят в виде препарата в фармацевтически приемлемом наполнителе, и как противовоспалительный агент, так и второй агент вводят в тот же самый орган, содержащий жидкость, например путем интрамаммарной или ушной инфузии. Фармацевтически приемлемым носителем или наполнителем являются носитель или наполнитель, которые не оказывают неприемлемо вредного или токсического эффекта на субъект при введении в качестве компонента композиции в количестве, требующемся в данном случае. Ни один эксципиентный ингредиент такого носителя или наполнителя не реагирует нежелательным образом с другим эксципиентом или с терапевтическим(и) агентом(ами) в композиции.
Фармацевтическая композиция, содержащая противовоспалительный агент, представляет собой жидкую инъекционную или инфузионную композицию, содержащую указанное средство, диспергированное в наполнителе, как описано в данном описании. Термин «диспергированный» в данном описании означает растворенный (т.е. молекулярно диспергированный) или коллоидно диспергированный, например как эмульсия или суспензия. Обычно противовоспалительный агент суспендируют в наполнителе в форме твердых частиц.
Наполнитель содержит три основных ингредиента, возможно вместе с дополнительными ингредиентами.
Первым из этих основных ингредиентов является амфипатическое масло, которое диспергируется в воде и нерастворимо в этаноле. «Амфипатическое масло» определяют как вещество, имеющее молекулярную структуру с отчетливо полярным участком и отчетливо неполярным участком. Структурно эти два участка амфипатического масла находятся достаточно далеко друг от друга, так что уникальные свойства двух участков четко разделенны. Термин «нерастворимое в этаноле» означает, что амфипатическое масло по существу нерастворимо в этаноле при 20°С.
Второй основной ингредиент наполнителя представляет собой микрокристаллический воск.
Третий основной ингредиент наполнителя представляет собой фармацевтически приемлемый неводный носитель. Такой носитель обычно представляет собой масло, как описано более полно в данном описании ниже.
Выбор компонентов наполнителя является важным в получении композиции, которая при введении в орган, содержащий жидкость, диспергируется в жидкости. Представляется, без связи с теорией, что такая дисперсия в жидкости в органе приводит к направленной доставке противовоспалительного агента и, возможно, второго агента к месту воспаления в органе.
Когда способ по изобретению включает инъекцию или инфузию композиции в вымя через канал соска, он может обеспечить эффективное лечение мастита, других заболеваний вымени и/или состояния, ассоциированного с заболеванием молочной железы. «Интрамаммарная инфузия» представляет собой процедуру, при которой жидкую композицию заставляют течь в вымя через канал соска, независимо от требующегося времени. В данном контексте «инфузия» и «инъекция» по существу являются синонимами.
Когда способ по изобретению включает инъекцию или инфузию композиции в ухо через наружный слуховой канал, процесс, описанный в данном описании как «инфузия в ухо», независимо от требующегося времени, может обеспечить эффективное лечение и/или предупреждение ушного расстройства и/или осложнения, связанного с ним. Субъектом, страдающим таким ушным расстройством или осложнением, связанным с ним, может быть человек, домашнее животное, лошадь, сельскохозяйственные животные и подобное.
Примеры таких ушных расстройств включают наружный отит (инфекции наружного уха), средний отит (инфекции среднего уха), включая острую, секреторную, серозную и хроническую формы среднего отита, оторею (средний отит с разорванной барабанной перепонкой и выпотом), острый мастоидит, инфекции, связанными с хирургическими операциями на ухе (такими как тимпаностомия и подобное), отосклероз, оталгию, ушную боль, ушное воспаление, ушное кровотечение, синдром Лермуайе, болезнь Менье, вестибулярный нейронит, доброкачественное пароксизмальное позиционным головокружение, ушной опоясывающий герпес, синдром Рамсея Ханта, вирусный нейронит, ганглионит, герпес коленчатого узла, лабиринтит, включая гнойный лабиринтит и вирусный эндолимфатический лабиринтит, фистулы перилимфа, пресбиакузис, индуцированную лекарством ототоксичность, акустическую невриному, аэроотит среднего уха, инфекционный мирингит, буллезный мирингит, ушную неоплазму, плоскоклеточный рак, базальноклеточный рак, другие ушные раковые заболевания, ушные предраковые состояния, нехромаффинные параганглиомы, хемодектомы, опухоли яремного гломуса, опухоли glomus tympanicum, перихондрит, ушной экзематоидный дерматит, злокачественный наружный отит, субперихондриальную гематому, церуминомы, серные пробки, кисты сальных желез, остеомы, келоиды, ушной шум, головокружение, инфекцию барабанной перепонки, тимпанит, ушные фурункулы, петрозит, кондуктивную и нейросенсорную тугоухость, эпидуральный абсцесс, тромбоз латерального синуса, субдуральную эмпиему, отитную гидроцефалию, синдром Денди, буллезный мирингит, диффузный наружный отит, инородные тела, обтурационный кератоз (keratosis obturans), отомикоз, травме, острый бароотит, острую непроходимость евстахиевой трубы, осложнение, связанное с любой из упомянутых выше инфекций (такое как потеря слуха, абсцесс мозга, лихорадка, холестеатомы, кальцификация среднего и внутреннего уха, разрыв барабанной перепонки, менингит, паралич лицевого нерва и подобное), постхирургическую оталгию и подобное, но не ограничены ими.
Способ по изобретению является особенно пригоден для лечения наружного отита, среднего отита, отореи и инфекций, имеющих воспалительный компонент, который связан с ушными хирургическими операциями.
В одном воплощении ушным расстройством является неоплазия. Примеры такой неоплазии включают ушную неоплазию, плоскоклеточный рак, базальноклеточный рак, злокачественный наружный отит, злокачественную нехромаффинную параганглиому, злокачественную опухоль яремного гломуса, злокачественную опухоль glomus tympanicum, предраковое состояние уха и подобное, но не ограничиваются ими.
Комбинированная терапия противовоспалительным агентом вместе со вторым агентом обеспечивает расширенные возможности лечения по сравнению с введением каждого агента по одиночке. Как указано выше, противовоспалительный агент диспергируют в наполнителе, который содержит (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрористаллический воск и (в) фармацевтически приемлемый неводный носитель, и вводят, например, путем интрамаммарной или ушной инфузии, тогда как второй агент готовят в виде препарата в любой приемлемой фармацевтической лекарственной форме с немедленным или замедленным высвобождением. Подходящие лекарственные формы для второго агента включают суспензию, раствор, эмульсию, таблетку, капсулу, пилюлю, порошок, гранулы, эликсир, настойку, сироп, пастилку, драже, гель, мазь, пасту для намазывания, суспензию, аэрозольный спрей, ушные капли, капли для носа, глазные капли, суппозитории, импланты и подобное, но не ограничены ими, и могут быть введены любым путем, включая оральный, в том числе пероральный и интраоральный, например сублингвальный, трансбуккальный и т.д.; парентеральный, например внутремышечный, подкожный, внутривенный, внутрибрюшинный, внуктрисуставный, внутрикожный, интраспинальный, интрастернальный, интрамедуллярный, интрасиновиальный, интратекальный, внутрисердечный, интравентрикулярный, интракапсулярный, внутричерепной и т.д.; интрамаммарный, местный, трансдермальный, интраназальный, ушной, через слизистую оболочку, ректальный, интравагинальный, пульмонарный и подобные, но не ограничиваясь ими.
Возможно введение терапевтических агентов, описанных выше, может иметь место в дополнительной комбинации с другими биологически активными агентами и нелекарственными терапиями.
Во всех воплощениях изобретения по меньшей мере противовоспалительный агент вводят местно. Преимуществом такого местного введения является то, что противовоспалительный агент предпочтительно направляется к месту его действия, что приводит к более быстрому началу терапевтического действия и более полной доставке к месту воспаления по сравнению с другими путями введения, такими как внутримышечный, подкожный и пероральный путь. Местное введение может позволить, чтобы общая терапевтическая доза для заданного эффекта была снижена, и позволяет избежать эффекта первого прохода через печень. Кроме того, местное введение снижает или устраняет вторичные эффекты, особенно эффекты, связанные с активным агентом в местах, отличных от места инфицирования. Местное введение активного агента также может улучшить его терапевтический индекс путем снижения его общей токсичности и минимизации риска нежелательных системных эффектов. Терапевтический индекс является показателем разницы между терапевтически эффективной дозой и токсической дозой лекарственного средства и обычно выражается как отношение ЛД50 (дозы, летальной для 50% популяции) к ЭД50 (дозе, терапевтически эффективной у 50% популяции).
В дополнительном воплощении изобретения предложена фармацевтическая композиция, адаптированная для интрамаммарной и/или ушной инфузии, содержащая наполнитель, который включает (а) амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, (б) микрокристаллический воск и (в) фармацевтически приемлемый неводный носитель; наполнитель, содержащий стабильно диспергированный в нем противовоспалительный агент, например селективный ингибитор СОХ-2 в количестве, эффективном против воспаления.
Предпочтительно такая композиция уменьшает высокое поверхностное натяжение границы раздела фаз вода/жидкость эпителиальных тканей, связанное с ушным расстройством, с тем чтобы повысить проходимость слухового канала. Снижение поверхностного натяжения границы раздела фаз вода/жидкость эпителиальной выстилки может минимизировать накопление жидкости и в некоторых случаях делает возможным удаление жидкости, удерживаемой в канале благодаря повышенным поверхностным натяжениям в нем, и/или обеспечивает разделение проксимальной и противоположной эпителиальной стенок слухового канала (часто придвигаемых ближе друг к другу из-за повышенного поверхностного натяжения тканей), посредством чего улучшается прохождение звука. Термин «повышенная проходимость», используемый в данном описании, относится к открытию, и уменьшению, или устранению блокировки слухового канала так, чтобы сформировать проходимый канал. Сопротивление прохождению звука происходит из-за уменьшения объема, частичной заложенности или полного закупоривания слухового канала из-за набухания эпителиальных стенок в результате воспаления, накопления повышенных количеств серы, секретируемой на них, и/или скопления в нем жидкостей, включая жидкости, содержащие побочные продукты иммунной реакции или экзогенную воду.
В конкретном воплощении изобретения ингредиент композиции (противовоспалительный агент, и/или второй агент, и/или эксципиентный ингредиент) подвержен окислительной разложению. Такая композиция обладает длительной химической и/или физической стабильностью даже при упаковке в кислородопроницаемый контейнер или средство доставки. Термин «длительная химическая и/или физическая стабильность» в данном описании означает, что композиция по настоящему воплощению обладает большей химической и/или физической стабильностью по сравнению со сравнительной композицией, содержащей то же самое лекарство в той же самой концентрации. «Сравнительная композиция» в настоящем контексте означает композицию, в которой отсутствует одно или оба из амфипатического масла и микрокристаллического воска, но в других отношениях она аналогична композиции по изобретению.
Кислородопроницаемые контейнеры или агента доставки могут быть сделаны из любого подходящего термопластического материала. Примеры таких материалов включают полимеры и сополимеры полистирола, полиакрилонитрила, поливинилхлорида и особенно полиолефинов, но не ограничены ими. Полиолефины включают, например, полиэтилен, полипропилен, полибутены, полиизопрены, полипентены, их сополимеры и их смеси.
Композиция для интрамаммарного введения обычно упаковывают в шприцы, которые снабжены катетерной насадкой для введения в сосок, чтобы обеспечить выталкивание композиции непосредственно в молочную железу через канал соска. Препараты для интрамаммарной суспензии обычно готовят в загущенных наполнителях, чтобы предотвратить осаждение частиц лекарственного средства в катетерной насадке, которое может вызвать закупорку насадки, приводящую к неполному выталкиванию композиции.
Противовоспалительный агент в данном описании может обладать одним или обоими анальгетическими или жаропонижающими свойствами в дополнение к его противовоспалительной активности. Термин «противовоспалительный агент» в данном описании охватывает соединения, которые главным образом представляют собой анальгетики или антипиретики, имеют вторичный противовоспалительный эффект. Примеры противовоспалительных средств, полезные здесь, включают в себя ацеклофенак, ацеметацин, е-ацетамидокапроновую кислоту, ацетаминофен, ацетаминосалол, ацетанилид, ацетилсалициловую кислотой (аспирином), S-аденозилметионин, алклофенак, алклометазон, алфентанил, алгестон, аллилпродин, алминопрофен, алоксиприн, альфапродин, бис(ацетилсалицилат) алюминия, амцинонид, амфенак, аминохлортеноксазин, 3-амино-4-гидроксимасляную кислоту, 2-амино-4-пиколин, аминопропилон, аминопирин, амиксетрин, салицилат аммония, ампироксикам, амтолметингуацил, анилеридин, антипирин, антрафенин, апазон, беклометазон, бендазак, бенорилат, беноксапрофен, бензитрамид, бензпиперилон, бензидамин, бензилморфин, бермопрофен, бетаметазон, безитрамид, α-бисаболол, бромфенак, пара-бромацетанилид, ацетат 5-бромсалициловой кислоты, бромсалигенин, буцетин, буклоксовую кислоту, буколом, будесонид, буфексамак, бумадизон, бупренорфин, бутацетин, бутибуфен, бутофанол, карбамазепин, карбифен, карпрофен, карсалам, целекоксиб, хлорбутанол, хлорпреднизон, хлортеноксазин, холина магния трисалицилат, холина салицилат, цинхофен, цинметацин, цинноксикам, цирамадол, клиданак, клобетазол, клокортолон, клометацин, клонитазен, клониксин, клопирак, клопреднол, клов, кодеин, кодеина метила бромид, кодеина фосфат, кодеина сульфат, кортизон, кортивазол, кропропамид, кротетамид, циклазоцин, дефлазакорт, дегидротестостерон, деракоксиб, дезоморфин, дезонид, дезоксиметазон, дексаметазон, дексоксадрол, декстроморадин, декстропропоксифен, дезоцин, диаморфон, диампромид, диклофенак, дифенамизол, дифенпирамид, дифлоразон, дифлукортолон, дифлунизал, дифлупреднат, дигидрокодеин, дигидрокодеинон-енола ацетат, дигидрокодеина фосфат, дигидроморфин, дигидроксиалюминия ацетилсалицилат, дименоксадол, димефептанол, диметилтиамбутен, диоксафетила бутират, дифенилгидрамина гидрохлорид, дипипанон, дипроцетил, дипирон, дитазол, DL-хлорфенирамина малеат, дроксикам, эморфазон, энфенамовую кислоту, эноксолон, эпиризол, эптазоцин, этерсалат, этензамид, этогептазин, этодолак, этоксазен, этогептазин, этилметилтиамбутен, этилморфин, этодолак, этофенамат, этонитазен, эторикоксиб, эвгенол, фелбинак, фенбуфен, фенхлофенак, фенклозовую кислоту, фендосал, фенопрофен, фентанил, фентиазак, фепрадинол, фепразон, флоктафенин, флуазакорт, флуклоронид, флуфенамовую кислоту, флуметазон, флунизолид, флуниксин, флуноксапрофен, флуоцинолона ацетонид, флуоцинонид, флуоцинолона ацетонид, флуокортинбутил, флуокортолон, флуорезон, фторметолон, флуперолон, флупиртин, флупредниден, флупреднизолон, флупрофен, флупроквазон, флурандренолид, флурбипрофен, флутиказон, формокортал, фосфозал, фурофенак, гентизиновую кислоту, глафенин, глюкаметацин, гликольсалицилат, гвайазулен, галцинонид, галобетазол, галометазон, галопреднон, героин, гидрокодон, гидрокортамат, гидрокортизон, гидроморфон, гидроксипетидин, ибуфенак, ибупрофен, ибупроксам, имидазолсалицилат, индометацин, индопрофен, изофезолак, изофлупредона ацетат, изоладол, изометадон, изониксин, изоксепак, изоксикам, кетобемидон, кетопрофен, кеторолак, пара-лактофенетид, лефетамин, леваллорфан, леворфанол, левофенацилморфан, лофентанил, лоназолак, лорноксикам, локсопрофен, ацетилсалицилат лизина, лизозима хлорид, мазипредон, меклофенамовую кислоту, медризон, мефенамовую кислоту, мелоксикам, меперидин, мепреднизон, мептазинол, мезаламин, метазоцин, метадон, метотримепразин, метилэфедрина гидрохлорид, метилпреднизолон, метилсалицилат, метиазиновую кислоту, метофолин, метопон, миропрофен, мофебутазон, мофезолак, мометазон, моразон, морфин, морфина гидрохлорид, морфина сульфат, морфолина салицилат, мирофин, набуметон, налбуфин, налорфин, 1-нафтилсалицилат, напроксен, нарцеин, нефопам, никоморфин, нифеназон, нифлумовую кислоту, нимесулид, 5′-нитро-2′-пропоксиацетанилид, норлеворфанол, норметадон, норморфин, норпипанон, носкапин, олсалазин, опиум, оксацепрол, оксаметацин, оксапрозин, оксипинак, оксикодон, оксиморфон, оксифенбутазон, папаверетум, параметазон, паранилин, парекоксиб, парсалмид, пентазоцин, перизоксал, фенацетин, фенадоксон, феноморфан, феназоцин, феназопиридина гидрохлорид, феноколл, феноперидин, фенопиразон, фенилацетилсалицилат, фенилбутазон, фенилпропаноламина гидрохлорид, фенилсалицилат, фенирамидол, пикетопрофен, пиминодин, пипебузон, пиперилон, пиразолак, пиритрамид, пироксикам, пирпрофен, пранопрофен, предникарбат, преднизолон, преднизон, преднивал, преднилиден, проглуметацин, прогептазин, промедол, пропацетамол, проперидин, пропирам, пропоксифен, пропифеназон, проквазон, протизиновую кислоту, проксазол, рамифеназон, ремифентанил, римазолия метилсульфат, рофекоксиб, салацетамид, салицин, салициламид, салициламид орто-уксусной кислоты, салициловую кислоту, салицилсерную кислоту, салсалат, салверин, серратиопептидазу, симетрид, судоксикам, суфентанил, сульфасалазин, сулиндак, супероксиддисмутазу, супрофен, суксибузон, талнифлумат, тенидап, теноксикам, терофенамат, тетрандрин, тиазолинобутазон, тиапрофеновую кислоту, тиапрофеновую кислоту, тиарамид, тилидин, тиноридин, тиопинак, тиоксапрофен, тиксокортол, толфенамовую кислоту, толметин, трамадол, триамцинолон, тропезин, валдекоксиб, виминол, ксенбуцин, ксимопрофен, залтопрофен, зидометацин, зомепираком и подобные, и их комбинациями, но не ограничиваются ими.
В одном воплощении противовоспалительный агент представляет собой стероид. Подходящие стероиды включают алклометазон, амцинонид, бетаметазон, бетаметазон-17-валерат, клобетазол, клобетазола пропионат, клокортолон, кортизон, дегидротестостерон, деоксикортикостерон, дезонид, дезоксиметазон, дексаметазон, дексаметазона 21-изоникотинат, дифлоразон, флуоцинонид, флуоцинолон, фторметолон, флурандренолид, флутиказон, галцинонид, галобетазол, гидрокортизон, гидрокортизона ацетат, гидрокортизона ципионат, гидрокортизона гемисукцинат, гидрокортизона 21-лизинат, гидрокортизона натрия сукцинат, изофлупредон, изофлупредона ацетат, метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона натрия сукцинат, метилпреднизолона сулептанат, мометазон, предникарбат, преднизолон, преднизолона ацетат, преднизолона гемисукцинат, преднизолона натрия фосфат, преднизолона натрия сукцинат, преднизолона валерат-ацетат, преднизон, триамцинолон, триамцинолона ацетонид и подобные, и их комбинации, но не ограничиваются ими.
В другом воплощении противовоспалительный агент представляет собой анальгетик, выбранный, например, из алфентанила, аллилпродина, альфапродина, анилеридина, бензилморфина, безитрамида, бупренорфина, буторфанола, клонитазена, кодеина, циклазоцина, дезоморфина, декстроморамида, декстропропоксифена, дезоцина, диампромида, диаморфона, дигидрокодеина, дигидроморфина, дименоксадола, димефептанола, диметилтиамбутена, диоксафетила бутирата, дипипанона, эптазоцина, этогептазина, этилметилтиамбутена, этилморфина, этонитазена, фентанила, героина, гидрокодона, гидроморфона, гидроксипетидина, изометадона, кетобемидона, леваллорфана, леворфанола, левофенацилморфана, лофентанила, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, мирофина, налбуфина, налорфина, нарцеина, никоморфина, норлеворфанола, норметадона, норморфина, норпипанона, опиума, оксикодона, оксиморфона, папаверетума, пентазоцина, фенадоксона, феназоцина, феноморфана, феноперидина, пиминодина, пиритрамида, прогептазина, промедола, проперидина, пропирама, пропоксифена, суфентанила, тилидина, трамадола и подобного, и их комбинаций.
В еще одном воплощении противовоспалительный агент представляет собой NSAID, выбранный, например, из производных салициловой кислоты (таких как салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, олсалазин, салсалат, сульфасалазин и подобное), индола и инденуксусных кислот (таких как индометацин, этодолак, сулиндак и подобное), фенаматов (таких как этофенамовая, меклофенамовая, мефенамовая, флуфенамовая, нифлумовая и толфенамовая кислоты и подобное), гетероарилуксусных кислот (таких как ацеметацин, алклофенак, клиданак, диклофенак, фенхлофенак, фентиазак, фурофенак, ибуфенак, изоксепак, кеторолак, оксипинак, тиопинак, толметин, зидометацин, зомепирак и подобное), арилуксусной кислоты и производных пропионовой кислоты (таких как алминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, напроксен натрий, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота, тиоксапрофен и подобное), еноловых кислот (таких как производные оксикама: ампироксикам, цинноксикам, дроксикам, лорноксикам, мелоксикам, пироксикам, судоксикам и теноксикам, и производные пиразолона: аминопирин, антипирин, апазон, дипирон, оксифенбутазон, фенилбутазон и подобное), производных парааминофенола (таких как ацетаминофен и подобное), алканонов (таких как набуметон и подобное), нимесулида, проквазона и тому подобного, и их комбинаций.
В предпочтительном воплощении противовоспалительный агент представляет собой селективный ингибитор СОХ-2. Селективный ингибитор СОХ-2 представляет собой соединение, которое селективно ингибирует активность циклооксигеназы-2 (СОХ-2). Термины «селективный ингибитор СОХ-2» и «селективный ингибитор циклооксигеназы-2» взаимозаменяемо относятся к терапевтическому соединению, которое селективно ингибирует СОХ-2-изоформу фермента циклооксигеназы при менее значительном ингибировании циклооксигеназы-1 (СОХ-1). Используемый в данном описании термин «селективный ингибитор СОХ-2» также относится к соли или пролекарству, которые превращаются in vivo в соединение, которое демонстрирует селективное ингибирование СОХ-2 по сравнению с СОХ-1. Предпочтительные селективные ингибиторы СОХ-2 показывают коэффициент селективности по меньшей мере приблизительно 10, более предпочтительно по меньшей мере приблизительно 50, и еще более предпочтительно по меньшей мере приблизительно 100, где «коэффициент селективности» определяют как ИК50(СОХ-1)/ИК50(СОХ-2), причем ИК50 представляет собой концентрацию соединения, обеспечивающую 50%-ое ингибирование активности фермента в тесте in vitro или in vivo.
Селективные ингибиторы СОХ-2, применимые к изобретению, включают соединения, описанные ниже, по не ограничены ими, а также включают таутомеры, стереоизомеры, энантиомеры, соли, гидраты, пролекарства и их комбинации. Можно использовать любое такое селективное СОХ-2-ингибирующее лекарственное средство или пролекарство, известное в данной области.
Предпочтительное селективное СОХ-2-ингибирующее лекарственное средство, полезное здесь, представляет собой соединение формулы (I):
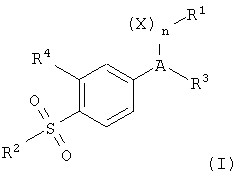
или его пролекарство, или фармацевтически приемлемую соль, где:
А представляет собой заместитель, выбранный из частично ненасыщенного или ненасыщенного гетеррциклила и частично ненасыщенных или ненасыщенных карбоциклических колец, предпочтительно группа гетероциклил выбрана из групп пиразолил, фуранонил, изоксазолил, пиридинил, циклопентенонил и пиридазинонил;
X представляет собой О, S или СН2;
n равно 0 или 1;
R1 представляет собой по меньшей мере один заместитель, выбранный из гетероциклила, циклоалкила, циклоалкенила и арила, и возможно замещен по положению, по которому возможно замещение, одним или более радикалами, выбранным из алкила, галогеналкила, циано, карбоксила, алкоксикарбонила, гидроксила, гидроксиалкила, галогеналкокси, амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, галогено, алкокси и алкилтио;
R2 представляет собой метил, амино или аминокарбонилалкил;
R3 представляет собой один или более чем один радикал, выбранный из гидридо, галогено, алкила, алкенила, алкинила, оксо, циано, карбоксила, цианалкила, гетероциклилокси, алкилокси, алкилтио, алкилкарбонила, циклоалкила, арила, галогеналкила, гетероциклила, циклоалкенила, аралкила, гетероциклилалкила, ацила, алкилтиоалкила, гидроксиалкила, алкоксикарбонила, арилкарбонила, аралкилкарбонила, аралкенила, алкоксиалкила, арилтиоалкила, арилоксиалкила, аралкилтиоалкила, аралкоксиалкила, алкоксиаралкоксиалкила, алкоксикарбонилалкила, аминокарбонила, аминокарбонилалкила, алкиламинокарбонила, N-ариламинокарбонила, N-алкил-N-ариламинокарбонила, алкиламинокарбонилалкила, карбоксиалкила, алкиламино, N-ариламино, N-аралкиламино, N-алкил-N-аралкиламино, N-алкил-N-ариламино, аминоалкила, алкиламиноалкила, N-ариламиноалкила, N-аралкиламиноалкила, N-алкил-N-аралкиламиноалкила, N-алкил-N-ариламиноалкила, арилокси, аралкокси, арилтио, аралкилтио, алкилсульфинила, алкилсульфонила, аминосульфонила, алкиламиносульфонила, N-ариламиносульфонила, арилсульфонила и N-алкил-N-ариламиносульфонила, причем R3 возможно замещен по положению, по которому возможно замещение, одним или более радикалами, выбранными из алкила, галогеналкила, циано, карбоксила, алкоксикарбонила, гидроксила, гидроксиалкила, галогеналкокси, амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, галогено, алкокси и алкилтио; и
R4 выбран из гидридо и галогено.
Особенно предпочтительной группой селективных СОХ-2-ингибирующих лекарственных средств являются соединения формулы (II):
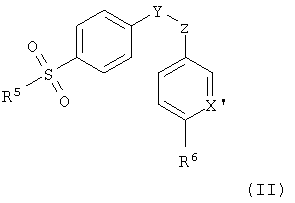
где R5 представляет собой метильную или аминогруппу, R6 представляет собой водород, или С1-4алкильную или алкокси группу, X′ представляет собой N или CR7, где R7 представляет собой водород или галоген, и Y и Z независимо представляют собой атомы углерода или азота, определяющие соседние атомы пяти-шестичленного кольца, которое возможно замещено по одному или более положениям группами оксо, галогено, метил или галогенометил, или его изомер, таутомер, фармацевтически приемлемая соль или пролекарство. Предпочтительно такие пяти-шестичленные кольца представляют собой циклопентеноновое, фураноновое, метилпиразоловое, изоксазоловое и пиридиновое кольца, замещенные не более чем по одному положению.
Другой особенно предпочтительной группой селективных СОХ-2-ингибирующих лекарственных средств являются соединения, имеющие формулу (III):
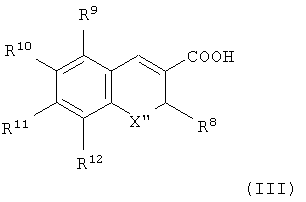
где X′′ представляет собой О, S или N-низший алкил; R8 представляет собой низший галогеналкил; R9 представляет собой водород или галоген; R10 представляет собой водород, галоген, низший алкил, низший алкокси или галогеналкокси, низший аралкилкарбонил, низший диалкиламиносульфонил, низший алкиламиносульфонил, низший аралкиламиносульфонил, низший гетероаралкиламиносульфонил или 5- или 6-членный азотсодержащий гетероциклосульфонил; и R11 и R12 независимо представляют собой водород, галоген, низший алкил, низший алкокси или арил; и их фармацевтически приемлемые соли.
Особенно полезным соединением формулы (III) является (S)-6,8-дихлор-2-(трифторметил)-2Н-1-бензопиран-3-карбоновая кислота.
Другой особенно предпочтительной группой селективных СОХ-2-ингибирующих лекарственных средств являются 5-алкил-2-ариламинофенилуксусные кислоты и их производные. Особенно полезными соединениями этого класса являются лумиракоксиб и его фармацевтически приемлемые соли.
В качестве иллюстрации, полезными в способе и композиции по изобретению являются целекоксиб деракоксиб, валдекоксиб, парекоксиб, рофекоксиб, эторикоксиб, лумиракоксиб, 2-(3,5-дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-он, (S)-6,8-дихлор-2-(трифторметил)-2Н-1-бензопиран-3-карбоновая кислота, 2-(3,4-дифторфенил)-4-(3-гидрокси-3-метил-1-бутокси)-5-[4-(метилсульфонил)фенил]-3-(2Н)-пиридазинон, 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамид (также известный как абелакоксиб), трет-бутил-1-бензил-4-[(4-оксопиперидин-1-ил)сульфонил]пиперидин-4-карбоксилат, 4-[5-(фенил)-3-(трифторметил)-1Н- пиразол-1-ил]бензолсульфонамид и их соли, более конкретно целекоксиб, деракоксиб, валдекоксиб, парекоксиб и его соли, рофекоксиб, эторикоксиб, лумиракоксиб, 4-[5-(4-фторфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамид, трет-бутил-1-бензил-4-[(4-оксопиперидин-1-ил)сульфонил]пиперидин-4-карбоксилат и 4-[5-(фенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамид.
Валдекоксиб, используемый в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в патенте США № 5633272, Talley et al. Парекоксиб и его соли, используемые в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в патенте США №5932598, Talley et al. Рофекоксиб, используемый в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в патенте США № 5474995, Ducharme et al. Эторикоксиб, используемый в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в международной публикации заявки № WO 98/03484. 2-(3,5-Дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-он, используемый в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в европейском патенте № 0863134. Деракоксиб, используемый в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в патенте США № 5466823, Talley et al. 2-(3,4-Дифторфенил)-4-(3-гидрокси-3-метил-1-бутокси)-5-[4-(метилсульфонил)фенил]-3-(2Н)-пиридазинон, используемый в композициях по изобретению, можно получить любым известным способом, например способом, изложенным в международной публикации заявки № WO 00/24719. Другие селективные СОХ-2-ингибирующие лекарственные средства можно получить любым известным способом, включая способы, изложенные в патентных публикациях, раскрывающих такие лекарственные средства; например, в случае целекоксиба, в указанном выше патенте США № 5466823 или в патенте США № 5892053, Zhi et al. Все патенты и публикации, указанные выше, включены в данное описание изобретения посредством ссылки.
Когда противовоспалительный агент представляет собой селективный ингибитор СОХ-2, предпочтительный интервал концентраций в композиции по изобретению составляет от приблизительно 0,01 до приблизительно 1000 мг/мл, более предпочтительно от приблизительно 0,1 до приблизительно 750 мг/мл, и еще более предпочтительно от приблизительно 5 до приблизительно 250 мг/мл. Для вторых агентов, отличных от селективного ингибитора СОХ-2, подходящие интервалы концентраций могут быть определены специалистом в данной области на основе опубликованных данных.
Следует понимать, что любая ссылка в данном описании на конкретное лекарственное соединение включает таутомеры, стереоизомеры, энантиомеры, соли, гидраты и пролекарства этого соединения, и не конкретизирует какую-либо одну форму твердого состояния лекарственного средства, если это не требуется по контексту.
В одном воплощении второй агент, вводимый при комбинированной терапии с селективным ингибитором СОХ-2, представляет собой антибактериальное средство. Антибактериальные агента, подходящие для применения согласно изобретению, включают любые такие агента, которые эффективны для лечения и/или предупреждения расстройств молочной железы и/или ушных расстройств, и/или связанных с ними осложнений. Подходящие антибактериальные агенты включают беталактамовые антибактериальные агенты, такие как природные и синтетические агенты пенициллиновой группы, включая penam(4-тиа-1-азабицикло-[3.2.0]гептан)-7-оновые)-пенициллины (такие как бензилпенициллин, феноксиметилпенициллин, коксациллин, нафциллин, метициллин, оксациллин, амоксициллин, темоциллин, тикарциллин и подобные), устойчивые к пенициллиназе пенициллины, ациламино и карбоксипенициллины (такие как пиперациллин, азлоциллин, мезлоциллин, карбенициллин, темоциллин, тикарциллин и тому подобное) и пенициллины более широкого спектра (такие как стрептомицин, неомицин, фрамицетин, гентамицин, апрамицин, амикацин, спектиномицин, амоксициллин, ампициллин и тому подобное), цефалоспорины, макролиды (такие как тилозин, тилмикозин, аивлозин, эритромицин, азитромицин, спирамицин, йозамицин, китазамицин и тому подобное), линкозамиды (такие как линкомицин, клиндамицин, пирлимицин и тому подобное), плевромутилины (такие как тиамулин, валнемулин и тому подобное), полипептиды, гликопептиды (такие как ванкомицин и тому подобное), полимиксины (такие как полимиксин В, полимиксин Е и тому подобное), сульфонамиды (такие как сульфаметазин, сульфадиазин, сульфадиазин серебра, сульфатроксазол, сульфаметоксипиридазин,. сульфаниламид, сульфаметоксазол, сульфизоксазол, сульфаметизол, мафенид и тому подобное, по отдельности или в комбинации с триметопримом), хлорамфеникол, тиамфеникол, флорфеникол, агенты тетрациклинового типа (такие как тетрациклин, хлортетрациклин, окситетрациклин, домеклоциклин, доксициклин, миноциклин и тому подобное), хинолоны и фторхинолоны (такие как ципрофлоксацин, эноксацин, грепафлоксацин, левофлоксацин, ломефлоксацин, норфлоксацин, офлоксацин, спарфлоксацин, тровафлоксацин, цинокацин, налидиксовая кислота и тому подобное), тиамулин, колистин, меропенем, сулбактам, тазобактам, метациклин, пириметамин, сульфацетамид, оксазолидиноныц, например эперезолид, линезолид, N-((5S)-3-(3-фтор-4-(4-(2-фторэтил)-3-окси-1- пиперазинил)фенил-2-окси-5-оксазолидинил)метил)ацетамид, (S)-N-((3-(5-(3-пиридил)тиофен-2-ил)-2-окси-5-оксазолидинил)метил)ацетамид, 2,2-дифтор-N-({(5S)-3-[3-фтор-4-(4-гликолоилпиперазин-1-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)этантиоамид, (S)-N-((3-(5-(4-пиридил)пирид-2-ил)-2-окси-5-оксазолидинил)метил)ацетамид гидрохлорид и тому подобное, аминогликозиды (канамицин, тобрамицин, нетилмицин и тому подобное), аминоциклитолы, амфеникол, ансамицин, карбафенем, цефамицин, рифампицин, монобактам, оксацефем, стрептограмины (такие как квинупристин, далфопристин и тому подобное), циклосерины, мупироцин, гидроксаматы мочевины, аналоги фолиевой кислоты (такие как триметоприм и тому подобное), противоопухолевые агенты антибиотического типа (такие как акларубицин, актиномицин D, актинопланон, производное аэроплизинина, анизомицины Nippon Soda, антрациклин, азиномициин-А, бузукаберин, блеомицина сульфат, бриостатин-1, калихемицин, хромоксимицин, дактиномицин, даунорубицин, дитризарубицин В, доксорубицин, доксорубицин-фибриноген, элсамицин-А, эпирубицин, эрбстатин, эзорубицин, эсперамицин-А1б, фостриецин, глидобактин, грегатин-А, гринкамицин, гербимицин, идарубицин, иллудины, казусамицин, кесариродины, меногарил, митомицин, митоксанторон, мутамицин, микофенолята мофетил, неоенактин, оксализин, оксауномицин, пепломицин, пилатин, пирарубицин, поротрамицин, пириндамицин А, рапамицин, ризоксин, родорубицин, сибаномицин, сивенмицин, сорангицин-А, спарсомицин, стеффимицин Б, тализомицин, терпентецин, тразин, трикрозарин А, зорубицин, системные антибактериальные препараты (такие как 2,4-диаминопиримидин), нитрофурансульфоны, марбофлоксацин и тому подобное, и их комбинациями, но не ограничиваются ими.
Предпочтительными антибактериальными агентами являются цефалоспорины, включая цефтиофура гидрохлорид, цефтиофур в виде свободной кислоты, например кристаллический цефтиофур в виде свободной кислоты, цефтиофур натрия, другие соли цефтиофура, цефалексин, цефрадин, цефхином, цефацетрил, цефалоний, цефуроксим, цефазидим, цефоперазон, натрия цефеметкарбоксилат, цефем-гептагидрат, цефалоспорина ди- или тригидрат, цефадроксила моногидрат, цефазолина натрия моногидрат, цефиксимин, цефтаксим, цефтизоксим, цефтриаксон, о-формилцефамандол, соли производных 3-ацетоксиметил-7-(иминоцетамидо)-цефалоспорановой кислоты, моногидрат 7-(D-альфа-амино-альфа-(пара-гидроксифенил)ацетамино)-3-метил-3-цефем-1-карбоновой кислоты, солянокислую соль син-7-((2-амино-1-тиазолил)(метоксиимино)ацетил)амино)-3-метил-3-цефем-4-карбоновой кислоты, соли присоединения кислоты и цефема, (пивалоилокси)метил-7-бета-(2-(2-амино-4-тиазолил)ацетамидо)-3-(((1-(2-(диметиламино)этил)-1Н-тетраазол-5-ил)тио)метил)-3-цефем-4-карбоксилат, цефалексин, цефалексина моногидрат, тетрагидрат 7-(D-2-нафтиглициламино)-3-метил-3-цефем-4-карбоновой кислоты и тому подобное, но не ограничиваясь ими. Наиболее предпочтительными цефалоспоринами для применения согласно настоящему изобретению являются цефтиофур и его фармацевтически приемлемые соли. Особенно предпочтительной является цефтиофур в форме свободной кислоты, особенно в кристаллической форме, и цефтиофура гидрохлорид.
Когда антибактериальным веществом является цефтиофур или его другая солевая форма, предпочтительный интервал концентраций в композиции по изобретению составляет от приблизительно 1 до приблизительно 1000 мг/мл, более предпочтительно от приблизительно 5 до приблизительно 750 мг/мл, и еще более предпочтительно от приблизительно 10 до приблизительно 100 мг/мл. Для антибактериальных веществ, отличных от цефтифура, подходящие интервалы концентраций, которые являются эквивалентными по антибактериальному эффекту, могут быть определены специалистом в данной области на основе опубликованных данных.
В другом воплощении второй агент представляет собой противоопухолевое средство. Подходящие противоопухолевые агенты включают анастрозол, карбонат кальция, капецитабин, карбоплатин, цисплатин, доцетаксель, эфлорнитин, этопосид, экземестан, флуоксиместрин, гемцитабин, госерелин, иринотекан, кетоконазол, летрозол, лейковорин, левамизол, мегсетрол, паклитаксель, ралоксифен, ретиноевую кислоту, селен (селенометионин), сулиндаксульфон, тамоксифен, тиотепа, топотекан, торемифен, винбастин, винкристин, винорелбин и тому подобное и их комбинации, но не ограничиваются ими.
В другом воплощении второй агент представляет собой анестетический агент. Анестетические агенты включают амбукаин, амоланон, амилокаин, беноксинат, бензокаин, бетоксикаин, бифенамин, бупивакаин, бутакаин, бутамбен, бутамбенпикрат, бутаниликаин, бутетамин, бутоксикаин, картикаин, хлорпрокаин, кокаэтилен, кокаин, циклометикаин, дибукаин, диметизоквин, диметокаин, диперодон, дифенилгидрамин, диклонин, экгонидин, экгонин, этилхлорид, этидокаин, β-эукаин, фомокаин, гексилкаин, гидропрокаин, гидроксипрокаин, гидрокситетракаин, изобукаин, изобутил-пара-аминобензоат, кетокаин, лейцинокаин, левоксадрол, лидокаин, мепивакаин, меприлкаин, метабутоксикаин, метабутетамин, миртекаин, октакаин, ортокаин, оксетазаин, оксипрокаин, паретоксикаин, фенакаин, фенол, пиперокаин, пиридокаин, полидоканол, прамоксин, прилокаин, прокаин, примакаин, пропаракаин, пропипокаин, пропоксикаин, псевдококаин, пиррокаин, репливикан, ропивакаин, салициловй спирт, тетракаин, толикаин, тримекаин, ксилокаин и тому подобное, и их комбинации, но не ограничиваются ими.
Предпочтительные анестетические агенты включают лидокаин, бупивакаин, прилокаин, ропивакаин и их таутомеры, стереоизомеры, энантиомеры, соли, гидраты, пролекарства и комбинации.
В другом воплощении второй агент представляет собой блокатор натриевых каналов. Блокаторы натриевых каналов, полезные для изобретения, включают блокаторы, которые дополняют эффект противовоспалительного агента любым механизмом, включая уменьшение боли, уменьшение отека и тому подобное, но не ограничиваясь ими.
Блокаторы натриевых каналов, полезные согласно изобретению, можно выбрать из следующего неограничивающего списка: подтип NaV1.8 (PN3) блокаторов натриевых каналов, подтип NaV1.3 (Тип III) блокаторов натриевых каналов, карбоксамиды, фенаматы, оксикамы, пропанамиды, пиразиноилгуанидина семикарбазоны, семикарбазиды и тому подобное.
Альтернативно, блокаторы натриевых каналов, подходящие для применения по изобретению, можно выбрать из следующего неограничивающего списка: амилорид, 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)пиримидин, амитриптилин, ангидротетродотоксин, априндин, азур А, бензамил, бензотиазол, бензоксазинат, карведилол, деокситетродотоксин, дизопирамид, энкаинид, этокситетродотоксин, эупроцин, феналкомин, флуаризин, габапентин, изофлуран, лифаризин, лоркаинид, 1-метансульфонил-3-(4-фенокси)фенил-1Н-пиразол, метоксифлурана ксилокаин, метокситетродотиксин, метилхлорид, 2-метил-1-[3-(4-феноксифенил)-1Н-пиразол]пропанон, мексилетин, N-аценафт-5-ил-N′-4-метоксинафтил-гуанидин, наэпаин, N-(2-хлор-6-метилфенил)-N-4-пиридинил-мочевина, N-[3-(2,6-диметил-1-пиперидинил)]-α-фенилбензолацетамид, N-метилстрихнин, 1-[3-[4-(4-нитрофенокси)фенил]-1Н-пиразол]этанон, окскабазепин, оксесазеин, оксибурокаин, окситазаин, панкуроний, фенамил, фенилбензотиазол, фенитоин, прегабалин, прокаинамид, пропафенон, пропанокаина ралитолин, рилузол, сакситоксин, текакаин, тетродиаминотоксин, тетродоновая кислота, тетродотоксин, топирамат, 5-(2,3,5-трихлорфенил)-2,4-диамино-пиримидин, 6-(2,3,5-трихлорфенил)-1,2,4-триазин-5-иламин, верапамил, золамин, зонисамид и тому подобное, и их комбинации.
Амфипатические масла, применимые к настоящему изобретению, включают все амфипатические масла, которые являются диспергируемыми в воде и нерастворимыми в этаноле.
Предпочтительно такие амфипатические масла являются полигликолизированными глицеридами, полученными посредством реакции алкоголиза природных триглицеридов с полиэтиленгликолями, и примеры включают следующие масла от Gattefossé или по существу равноценные масла от другого производителя: Labrafil™ M-1944CS, Labrafil™ M-1966CS, Labrafil™ M-1969CS, Labrafil™ M-1980CS, Labrafil™ M-2125CS, Labrafil™ WL-2609BS, Labrafil™ ISO и их комбинациями, но не ограничиваются ими.
Еще более предпочтительными амфипатическими маслами являются полигликолизированные глицериды, полученные как описано выше, содержащие в качестве главного жирнокислотного компонента или олеиновую, или линолевую кислоту, и примеры включают следующие масла от Gattefossé или по существу равноценные масла от другого производителя: Labrafil™ M-1944CS, Labrafil™ M-1966CS, Labrafil™ M-1969CS, Labrafil™ M-1980CS, Labrafil™ M-2125CS, Labrafil™ WL-2609BS и их комбинации, но не ограничиваются ими.
Еще более предпочтительными амфипатическими маслами являются полигликолизированные глицериды, полученные как описано выше, содержащие в качестве главного жирнокислотного компонента олеиновую кислоту, и примеры включают следующие масла от Gattefossé или по существу равноценные масла от другого производителя: Labrafil™ M-1944CS, Labrafil™ M-1966CS, Labrafil™ M-1980CS и их комбинации, но не ограничиваются ими.
Наиболее предпочтительным амфипатическим маслом является пегикол-5-олеат, например Labrafil™ M-1944CS от Gattefossé Corporation.
Предпочтительный интервал концентрации амфипатического масла в композиции по изобретению составляет от приблизительно 0,01% до приблизительно 99 мас.%/об., более предпочтительно от приблизительно 1% до приблизительно 80 мас.%/об. и еще более предпочтительно от приблизительно 3% до приблизительно 25 мас.%/об.
Микрокристаллический воск является таким, как определено, например, в Handbook of Pharmaceutical Excipients, 3rd ed. или в National Formulary, 19rd ed. (NF 19), и его можно приобрести у многих производителей, включая Witco Corporation.
Предпочтительный интервал концентрации микрокристаллического воска в композиции по изобретению составляет от приблизительно 0,001% до приблизительно 50 мас.%/об., более предпочтительно от приблизительно 0,1% до приблизительно 40 мас.%/об. и еще более предпочтительно от приблизительно 1% до приблизительно 15 мас.%/об.
Фармацевтически приемлемые неводные носители по изобретению могут быть полностью насыщенными или частично, или полностью ненасыщенными. Примеры неводных носителей включают растительные масла, минеральные масла, синтетические масла и их комбинациями, но не ограничиваются ими. Примеры полностью насыщенных неводных носителей включают эфиры жирных кислот с длиной цепи от средней до длинной (такие как триглицериды жирных кислот с длиной цепи от приблизительно С6 до приблизительно С24), но не ограничиваются ими. Смеси жирных кислот выделяют из природного масла (например, кокосового масла, косточкового пальмового масла, масла бабассу и тому подобного) и рафинируют. В некоторых воплощениях полезными являются триглицериды со средней длиной цепи (от приблизительно С8 до приблизительно С12). Иллюстративный насыщенный неводный носитель содержит каприновую кислоту (от приблизительно 20% до приблизительно 45%) и каприловую кислоту (от приблизительно 45% до приблизительно 80%). Другие полностью насыщенные неводные носители включают насыщенное кокосовое масло (которое обычно включает смесь лауриновой, миристиновой, пальмитиновой, каприновой и капроновой кислот), включая масла, продаваемые под товарным знаком Miglyol™ от Huls, и носящие торговые обозначения 810, 812, 829 и 840), но не ограничиваются ими. Также упоминаются продукты NeoBee™, продаваемые Drew Chemicals. Изопропил миристат является другим примером неводного носителя, полезного в композициях по изобретению. Примеры синтетических масел включают триглицериды и диэфиры пропиленгликоля насыщенных или ненасыщенных жирных кислот, имеющих от 6 до 24 атомов углерода, таких как, например, гексановая кислота, октановая (каприловая), нонановая (пеларгоновая), декановая (каприновая), ундекановая, лауриновая, тридекановая, тетрадекановая (миристиновая), пентадекановая, гексадекановая (пальмитиновая), гептадекановая, октадекановая (стеариновая), нонадекановая, гептадекановая, эйкозановая, генэйкозановая, докозановая и лигноцериновая кислоты и тому подобные. Примеры ненасыщенных карбоновых кислот включают олеиновую, линолевую и линоленовую кислоты и тому подобное. Очевидно, что неводный носитель может содержать моно-, ди- и триглицериловые эфиры жирных кислот или смешанные глицериды и/или диэфиры пропиленгликоля, где по меньшей мере одна молекула глицерина этерифицирована жирными кислотами с варьирующейся по количеству углеродных атомов длиной цепи. Неограничивающим примером «немасла», полезного в качестве носителя в композициях по изобретению, является полиэтиленгликоль.
Предпочтительными неводными носителями являются растительные масла, такие как хлопковое масло, кукурузное масло, кунжутное масло, соевое масло, оливковое масло, фракционированное кокосовое масло, арахисовое масло, подсолнечное масло, сафлоровое масло, миндальное масло, масло авокадо, пальмовое масло, косточковое пальмовое масло, масло бабассу, масло буковых орехов, льняное масло, рапсовое масло и тому подобное. Наиболее предпочтительным неводным носителем является хлопковое масло. В качестве примера хлопковое масло можно приобрести в виде препарата 70%-ных ненасыщенных жирных кислот от Sigma Chemical Co.
Предпочтительный интервал концентрации неводного носителя в композиции по изобретению составляет от приблизительно 0,5% до приблизительно 99 мас.%/об., более предпочтительно от приблизительно 10% до приблизительно 95 мас.%/об., и еще более предпочтительно от приблизительно 40% до приблизительно 90 мас.%/об.
Композиция по изобретению возможно может дополнительно содержать любой традиционный фармацевтический эксципиент, который не реагирует нежелательным образом с основными ингредиентами композиции. Такие эксципиенты включают антиоксиданты, консерванты, суспендирующие агенты, стабилизаторы, солюбилизирующие агенты, увлажняющие агенты, смазывающие агенты, эмульгаторы, соли, влияющие на осмотическое давление, красящие агенты, спирты, изотонические агенты, буферные агенты, агенты проницаемости, антиирританты, и их комбинации, но не ограничиваются ими.
Композицию по изобретению можно вводить для лечения мастита путем введения катерной насадки маститного шприца в наружное отверстие канала соска вымени животного, производящего молоко, и инфузии композиции в вымя.
Композицию по изобретению можно вводить для лечения или предупреждения ушного расстройства путем введения насадки ушного шприца, ушного капельного диспенсера или другого подходящего устройства доставки в ухо в наружный слуховой канал уха субъекта и инфузии композиции в ухо.
Понятно, что предпочтительные количества композиций для введения в конкретном случае будут варьироваться в зависимости от конкретной используемой композиции, способа применения, конкретного места и организма, которые лечат, и других факторов. Дозировку для данного назначения можно определить, используя традиционные соображения, например путем обычного сравнения дифференциальных активностей испытуемых композиций и известного агента, например при помощи подходящего традиционного фармацевтического протокола.
Хотя настоящее изобретение направлено главным образом на местную доставку противовоспалительного агента к месту воспаления в органе, в который его вводят, предполагается, что композиции по изобретению также полезны для системной доставки противовоспалительного агента животному, производящему молоко, посредством интрамаммарной инфузии. Например, часто более эффективно и удобно вводить терапевтическое агент животному, производящему молоко, такому как корова, путем интрамаммарной инфузии, по сравнению с другими путями, такими как оральный или парентеральный. Таким образом, при лечении воспалительных состояний в любом другом месте, кроме в вымени, включая, например, артритные состояния, композицию, как описано в данном описании, можно вводить путем интрамаммарной инфузии.
Иллюстративная композиция суспензии по изобретению, содержащая противовоспалительный агент, например селективный СОХ-2-ингибитор деракоксиб, имеет следующий состав:
ПРИМЕРЫ
Следующие примеры иллюстрируют аспекты настоящего изобретения, но их не следует истолковывать как ограничения.
Пример 1
Суспензию для введения путем интрамаммарной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и приблизительно 27% общего количества хлопкового масла нагревают до 85-98°С при перемешивании в реакторе. Остаток хлопкового масла нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь микрокристаллический воск/хлопковое масло в реакторе переносят в производственную емкость, содержащую хлопковое масло, и тщательно перемешивают. Полученную смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ M-1944CS при перемешивании для образования наполнителя. Затем добавляют к наполнителю парекоксиб и полученную композицию перемешивают с образованием однородной суспензии. Суспензию фильтруют и заполняют ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт окончательно стерилизуют гамма-излучением в дозе 25-40 кГр.
Указанную выше суспензию вводят путем интрамаммарной инфузии в каждую инфицированную долю вымени лактирующей коровы в дозе 1200 мг парекоксиба/долю/сутки. Суспензия эффективна в лечении мастита лактирующих коров.
Суспензию для введения интрамаммарной инфузией готовят, имея следующую композицию:
Микрокристаллический воск и кукурузное масло нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь охлаждают до 30-45°С и добавляют в производственную емкость Labrafil™ M-1966CS при перемешивании для образования наполнителя. Добавляют в наполнитель деракоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют и заполняют ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт окончательно стерилизуют гамма-излучением в дозе 25-40 кГр.
Указанную выше суспензию вводят во все четыре доли сухостойной корове в дозе 3400 мг деракоксиба/долю путем интрамаммарной инфузии. Суспензия эффективна в лечении мастита сухостойных коров.
Пример 3
Суспензию для введения посредством ушной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и приблизительно 27% общего количества минерального масла нагревают до 85-98°С при перемешивании в реакторе. Остаток минерального масла нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь микрокристаллический воск/минеральное масло в реакторе переносят в производственную емкость, содержащую минеральное масло, и тщательно перемешивают. Полученную смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ M-1980CS при перемешивании. В производственную емкость добавляют пропилгаллат при перемешивании с образованием наполнителя. В полученный наполнитель добавляют рофекоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют через сито и заполняют ею 20 мл полипропиленовые контейнеры.
Указанную выше суспензию вводят в дозе 2,5 мг рофекоксиба/кг массы тела путем инфузии в ухо собаки. Суспензия эффективна в лечении наружного отита у собак.
Пример 4
Суспензию для введения посредством интрамаммарной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и приблизительно 27% общего количества хлопкового масла нагревают до 85-98°С при перемешивании в реакторе. Остаток хлопкового масла нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь микрокристаллический воск/хлопковое масло в реакторе переносят в производственную емкость, содержащую хлопковое масло, и тщательно перемешивают. Полученную смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ M-1944CS при перемешивании для образования наполнителя. Добавляют в полученную суспензию деракоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют через сито и заполняют ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт окончательно стерилизуют гамма-излучением в дозе 25-40 кГр.
Указанную выше суспензию вводят во все четыре доли сухостойной корове в дозе 12000 мг деракоксиба/четверть путем интрамаммарной инфузии. Суспензия эффективна в лечении мастита сухостойных коров.
Пример 5
Суспензию для введения путем интрамаммарной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и приблизительно 30% от общего количества Miglyol™ 812 нагревают до 85-98°С при перемешивании в реакторе. Остаток Miglyol™ 812 нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь микрокристаллический воск/Miglyol™ 812 в реакторе переносят в производственную емкость, содержащую Miglyol™ 812, и тщательно перемешивают. Полученную смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ WL-2609BS при перемешивании для образования наполнителя. Добавляют в полученный наполнитель валдекоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют через сито и заполняют ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт окончательно стерилизуют гамма-излучением в дозе 25-40 кГр.
Указанную выше суспензию вводят во все четыре доли сухостойной корове в дозе 30 мг валдекоксиба/долю путем интрамаммарной инфузии. Суспензия эффективна в лечении мастита сухостойных коров.
Пример 6
Суспензию для введения путем ушной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и приблизительно 27% от общего количества минерального масла нагревают до 85-98°С при перемешивании в реакторе. Остаток минерального масла нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь микрокристаллический воск/минеральное масло в реакторе переносят в производственную емкость, содержащую минеральное масло, и тщательно перемешивают. Полученную смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ M-1944CS при перемешивании для образования наполнителя. Добавляют в полученный наполнитель цефтиофура гидрохлорид и деракоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют через сито и заполняют ею 50 мл полипропиленовые контейнеры.
Указанную выше суспензию вводят в дозе 4 мг цефтиофура гидрохлорида/кг массы тела и 4 мг деракоксиба/кг массы тела путем инфузии в ухо субъекта. Суспензия эффективна в лечении и/или предупреждении среднего отита.
Пример 7
Суспензию для введения посредством ушной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и хлопковое масло нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ M-1944CS при перемешивании для образования наполнителя. Добавляют в полученный наполнитель цефтиофура гидрохлорид и парекоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют через сито и заполняют ею 60 мл полипропиленовые контейнеры.
Указанную выше суспензию вводят в дозе 4 мг цефтиофура гидрохлорида/кг массы тела и 4 мг парекоксиба/кг массы тела путем инфузии в ухо субъекта. Комбинированная терапия эффективна в лечении и/или предупреждении наружного отита.
Пример 8
Суспензию для введения путем ушной инфузии готовят, имея следующую композицию:
Микрокристаллический воск и хлопковое масло нагревают до 85-98°С при перемешивании в производственной емкости. После того как микрокристаллический воск полностью расплавится, смесь охлаждают до 38-45°С и в производственную емкость добавляют Labrafil™ M-1944CS при перемешивании для образования наполнителя. Добавляют в полученный наполнитель лидокаин и парекоксиб и перемешивают с образованием однородной суспензии. Суспензию фильтруют через сито и заполняют ею 60 мл полипропиленовые контейнеры.
Указанную выше суспензию вводят в дозе 4 мг лидокаина/кг массы тела и 4 мг парекоксиба/кг массы тела путем инфузии в ухо субъекта. Комбинированная терапия эффективна в лечении и/или предупреждении наружного отита.
Пример 9
Готовили суспензию цефалоспорина цефтиофура, содержащую 12,5 мг/мл гидрохлорида цефтиофура в загущенном наполнителе, включающем 20 мг/мл глицерилмоностеарата в арахисовом масле. Несмотря на клиническую эффективность, активность этой композиции, при упаковке в полиэтиленовые шприцы, упала ниже 90% от исходной после хранения менее 18 месяцев при комнатной температуре. Было установлено, что окислительная деградация гидрохлорида цефтиофура представляет собой главную причину этого падения активности. Для интамаммарной суспензии желателен срок хранения при комнатной температуре, при котором по меньшей мере 90% от исходной активности сохраняется в течение минимум 24 месяцев.
Приготовили и упаковали в кислородопроницаемые полиэтиленовые шприцы ряд композиций в виде суспензии гидрохлорида цефтиофура в ряде загущенных наполнителей. Были изготовлены препараты гидрохлорида цефтиофура с концентрацией 12,5 мг/мл. Основой всех наполнителей являлось хлопковое масло со следующими дополнительными компонентами:
1) 50 мг/мл микрокристаллического воска.
2) 70 мг/мл микрокристаллического воска + 1,0 мг/мл пропилгаллата.
3) 100 мг/мл микрокристаллического воска+50 мг/мл Labrafil™ M-1944CS.
4) 40 мг/мл Gelucire™ 62/05 + 10 мг/мл Gelucire™ 33/01.
5) 70 мг/мл Lexemul™ AR.
6) 2,5 мг/мл Coagulan™ GP-1.
7) 10 мг/мл микрокристаллического воска + 5 мг/мл Hydrofol Glycerides™ T 57L.
8) 30 мг/мл Drewpol™ 10-10-S.
9) 15 мг/мл смеси на основе пчелиного воска.
10) 60 мг/мл Drewpol™ 10-10-S.
11) 10 мг/мл смеси на основе пчелиного воска + 50 мг/мл Labrafil™ M-1944CS.
12) 100 мг/мл микрокристаллического воска + 1,0 мг/мл пропилгаллата.
13) 70 мг/мл микрокристаллического воска + 100 мг/мл Labrafil™ M-1944CS.
14) 70 мг/мл микрокристаллического воска + 100 мг/мл Labrafil™ M-1944CS + 0,2 мг/мл бутилированного гидрокситолуола.
15) 70 мг/мл микрокристаллического воска + 50 мг/мл Labrafil™ M-1944CS + 1,0 мг/мл пропилгаллата.
16) 70 мг/мл микрокристаллического воска + 50 мг/мл Labrafil™ M-1944CS + 0,2 мг/мл бутилированного гидрокситолуола.
17) 50 мг/мл микрокристаллического воска + 1,0 мг/мл пропилгаллата.
18) 100 мг/мл микрокристаллического воска + 100 мг/мл Labrafil™ M-1944CS + 1,0 мг/мл пропилгаллата.
19) 100 мг/мл микрокристаллического воска + 100 мг/мл Labrafil™ M-1944CS + 0,2 мг/мл бутилированного гидрокситолуола.
20) 100 мг/мл микрокристаллического воска + 50 мг/мл Labrafil™ M-1944CS + 1,0 мг/мл пропилгаллата.
21) 100 мг/мл микрокристаллического воска + 50 мг/мл Labrafil™ M-1944CS + 0,2 мг/мл бутилированного гидрокситолуола.
22) 50 мг/мл микрокристаллического воска + 100 мг/мл Labrafil™ М-1944CS + 0,2 мг/мл бутилированного гидрокситолуола.
Labrafil™ M-1944CS представляет собой амфипатическое масло, которое является диспергируемым в воде и по существу нерастворимым в этаноле при 20°С. Gelucire™ 62/05 и Gelucire™ 33/01 представляют собой по существу инертные эксципиенты, полученные из натуральных гидрогенизированных жиров и масел пищевого качества. Lexemul™ AR представляет собой кислотостойкий катионоактивный самоэмульгирующийся глицерилмоностеарат. "Смесь на основе пчелиного воска" относится к смеси, содержащей осветленный пчелиный воск, карнаубский воск и канделильский воск. Coagulan™ GP-1 представляет собой диамид N-ацилглутаминовой кислоты, агент желатинирования аминокислот для масла. Drewpol™ представляет собой модифицированный глицерид.
Было обнаружено, что после хранения в течение 24 месяцев при комнатной температуре в кислородопроницаемых полиэтиленовых шприцах только те композиции гидрохлорида цефтиофура, которые содержали как Labrafil™ M-1944CS, так и микрокристаллический воск, обеспечивали препараты, которые сохраняли по меньшей мере 90% исходной активности. Установленные сроки хранения при комнатной температуре для препаратов гидрохлорида цефтиофура, содержащих как Labrafil™ M-1944CS, так и микрокристаллический воск в хлопковом масле, были в 2,4-3,7 раза выше, чем установленные сроки хранения при комнатной температуре для препаратов сравнения, которые не содержали Labrafil™ M-1944CS. Кроме того, хотя композиция гидрохлорида цефтиофура, содержащая Labrafil™ M-1944CS и смесь на основе пчелиного воска в хлопковом масле, хранящаяся при комнатной температуре, имела активность меньше 90% после хранения в течение 24 месяцев в кислородопроницаемых полиэтиленовых шприцах при комнатной температуре, препарат гидрохлорида цефтиофура сравнимой вязкости, содержащий Labrafil™ M-1944CS и микрокристаллический воск в хлопковом масле, через 24 месяца хранения при тех же самых условиях проявлял активность больше 90% от исходной.
Были приготовлены композиции, содержащие гидрохлорид цефтиофура, и у них определяли межфазное напряжение.
Композиция 1
Готовили суспензию, имеющую следующий состав:
Микрокристаллический воск и хлопковое масло (примерно 27% от общего количества) при перемешивании нагревали до 85-98°С в реакторе. Остаток хлопкового масла при перемешивании нагревали до 85-98°С в производственной емкости. После того как микрокристаллический воск полностью расплавился, смесь микрокристаллического воска и хлопкового масла переносили из реактора в производственную емкость, содержащую хлопковое масло, и тщательно перемешивали. Чтобы сформировать наполнитель, полученную смесь охлаждали до 38-45°С и в производственную емкость при перемешивании добавляли Labrafil™ M-1944CS. Затем к этому наполнителю добавляли гидрохлорид цефтиофура и полученную композицию перемешивали с образованием однородной суспензии. Суспензию фильтровали и наполняли ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт окончательно стерилизовали гамма-облучением в дозе 25-40 кГр.
Межфазное натяжение вышеупомянутой суспензии определяли, используя метод объема капли с деионизированной водой при 39°С, путем сравнения с межфазным натяжением контрольной суспензии, приготовленной с использованием 70 мг/мл микрокристаллического воска в хлопковом масле, но без Labrafil™ M-1944CS.
Межфазное натяжение суспензии, содержащей как Labrafil™ M-1944CS, так и микрокристаллический воск в хлопковом масле, составило 6,5 дин/см (6,5×10-3 Н/м), что примерно в 3,4 раза меньше, чем межфазное натяжение контрольной суспензии (22,5 дин/см (22,5×10-3 Н/м)).
Композиция 2
Готовили суспензию, имеющую следующий состав:
Микрокристаллический воск и хлопковое масло при перемешивании нагревали до 85-98°С в производственной емкости. После того как микрокристаллический воск полностью расплавился, смесь охлаждали до 38-45°С и в производственную емкость при перемешивании добавляли Labrafil™ M-1944CS, чтобы сформировать наполнитель. К полученному наполнителю добавляли гидрохлорид цефтиофура и перемешивали с образованием однородной суспензии. Суспензию фильтровали и наполняли ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт окончательно стерилизовали гамма-облучением в дозе 25-40 кГр.
Межфазное натяжение вышеупомянутой суспензии определяли, используя метод объема капли с деионизированной водой при 39°С, путем сравнения с межфазным натяжением контрольной суспензии, приготовленной со 100 мг/мл микрокристаллического воска в хлопковом масле, но без Labrafil™ M-1944CS.
Межфазное натяжение суспензии, содержащей как Labrafil™ M-1944CS, так и микрокристаллический воск в хлопковом масле, составило 7,1 дин/см (7,1×10-3 Н/м), что примерно в 4,0 раза меньше, чем межфазное натяжение контрольной суспензии (28,1 дин/см (28,1×10-3 Н/м)).
Композиция 3
Готовили суспензию, имеющую следующий состав:
Микрокристаллический воск и хлопковое масло при перемешивании нагревали до 85-98°С в производственной емкости. После того как микрокристаллический воск полностью смесь охлаждали до 38-45°С и в производственную емкость при перемешивании добавляли Labrafil™ M-1944CS, чтобы сформировать наполнитель. К полученному наполнителю затем добавляли гидрохлорид цефтиофура и перемешивали с образованием однородной суспензии. Суспензию фильтровали и наполняли ею 12 мл маститные шприцы из полиэтилена высокой плотности. Упакованный продукт стерилизовали гамма-облучением в дозе 25-40 кГр.
Межфазное натяжение вышеупомянутой суспензии определяли, используя метод объема капли с деионизированной водой при 39°С, путем сравнения с межфазным натяжением контрольной суспензии, приготовленной из 100 мг/мл микрокристаллического воска в хлопковом масле, но без Labrafil™ M-1944CS.
Межфазное натяжение суспензии, содержащей как Labrafil™ M-1944CS, так и микрокристаллический воск в хлопковом масле, составило менее 1 дин/см (менее 1×10-3 Н/м), что примерно более чем в 28 раз меньше, чем межфазное натяжение контрольной суспензии (28,1 дин/см (28,1×10-3 Н/м)).
После того, как изобретение было подробно и посредством ссылки на его предпочтительные воплощения описано, очевидно, что возможны модификации и изменения без отступления от объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИСПЕРГИРУЕМЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2003 |
|
RU2311201C2 |
| СПОСОБ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ДОСТАВКИ ПРОТИВОВОСПАЛИТЕЛЬНОГО СРЕДСТВА | 2004 |
|
RU2325189C2 |
| ДИСПЕРГИРУЕМАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ МАСТИТА И ПОРАЖЕНИЙ УХА | 2004 |
|
RU2329064C2 |
| ДИСПЕРГИРУЕМАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ МАСТИТА И УШНЫХ РАССТРОЙСТВ | 2004 |
|
RU2321423C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ МОДИФИЦИРОВАННЫЙ НОСИТЕЛЬ | 2003 |
|
RU2401127C2 |
| СПОСОБЫ ИЗМЕРЕНИЯ СКОРОСТИ РАСТВОРЕНИЯ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА В НЕВОДНОЙ ЖИДКОЙ КОМПОЗИЦИИ | 2003 |
|
RU2300766C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МИКРОБНЫХ ИНФЕКЦИЙ, В ТОМ ЧИСЛЕ МАСТИТА | 2014 |
|
RU2662300C2 |
| КОМПОЗИЦИИ И СПОСОБ КОНТРОЛЯ ИНФЕКЦИЙ У МЛЕКОПИТАЮЩИХ, НЕ ОТНОСЯЩИХСЯ К ЧЕЛОВЕКУ, С ПРИМЕНЕНИЕМ БЕЛКОВ ОСТРОЙ ФАЗЫ | 2014 |
|
RU2725841C2 |
| НОВАЯ СОЛЬ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2012 |
|
RU2609011C2 |
| СОСТАВЫ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2013 |
|
RU2627429C2 |
Изобретение относится к медицине и касается способов и композиций для лечения и/или предупреждения воспалительного состояния в органе, содержащем жидкость и имеющем естественное наружное отверстие. Композиция включает противоспалительный агент, а также, возможно, другие активные агенты, амфипатическое масло, которое является диспергируемым в воде и нерастворимым в этаноле, микрокристаллический воск и фармацевтически приемлемый неводный носитель. Способ лечения осуществляется введением фармацевтической композиции в орган через естественное наружное отверстие. В части композиции изобретение обеспечивает стабильность активного агента против окислительного разложения, а также низкое межфазное натяжение композиции. В части способа изобретение обеспечивает уменьшение побочных эффектов и токсичности, легкую диспергируемость композиции в жидкости, короткое время выведения. 4 н. и 61 з.п.ф-лы.
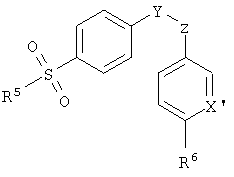
соединение формулы
где R5 представляет собой метильную или аминогруппу, R6 представляет собой водород, или С1-4алкильную или алкоксигруппу, X′ представляет собой N или CR7, где R7 представляет собой водород или галоген, и Y и Z независимо представляют собой атомы углерода или азота, определяющие соседние атомы пяти-шестичленного кольца, которое возможно замещено по одному или более положениям группами оксо, галогено, метил или галогенометил.

где R5 представляет собой метальную или аминогруппу, R6 представляет собой водород, или С1-4алкильную или алкоксигруппу, X′ представляет собой N или CR7, где R7 представляет собой водород или галоген, и Y и Z независимо представляют собой атомы углерода или азота, определяющие соседние атомы пяти-шестичленного кольца, которое возможно замещено по одному или более положениям группами оксо, галогено, метил или галогенометил.
| МЯГКАЯ ЖЕЛАТИНОВАЯ КАПСУЛА | 1994 |
|
RU2134105C1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| US 5314685, 24.05.1994 | |||
| Способ пассивации металлизованных железорудных окатышей | 1983 |
|
SU1147766A1 |
| OWENS W.E | |||
| et al | |||
| Determination of milk and mammary tissue concentrations of ceftiofur after intramammary and intramuscular therapy // Journal of Dairy Science, vol.73, №12, 1990, p.3449-3456. | |||
Авторы
Даты
2008-03-20—Публикация
2004-07-19—Подача