Настоящее изобретение относится к области радиохимии, а именно к новым меченным тритием N-фенилхинолиниевым и хинальдиниевым солям общей формулы:
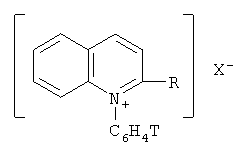
R=Н, СН3;
X-BF4 -, ClO4 -, J-,
и одностадийному способу их получения.
Структура хинолина и изохинолина входит в состав многих алкалойдов и энзимов [Pozharskii A.F.; Soldatenkov А.Т.; Katritzky A.R. Heterocycles in Life and Society; Wiley: New York, 1997; Johnson C.D.; Katritzky A.R.; Ridgewell B.J.; Viney M. "Mechanism of the Electrophilic Substitution of Heteroaromatic Compounds. VI. Nitration of Pyridines in the 3-Position as Free Bases and as Conjugate Acids, "J. Chem. Soc. B. 1967, 11, 1204.].
Наряду с естественно встречающимися терапевтическими препаратами, такими как хинин и папаверин, было разработано большое количество эффективных синтетических лекарств: хлороксин, метаксатин, сипрофлоксакин и норфлаксакин и др. [Heterocyclic Chemistry; 4th Ed; Joule, J.A. and Mills, K.; Blackwell Science, 2000; Chemistry of Organic Fluorine Compounds; II ACS Monograph 187: Washington DC, 1995.].
Продолжается поиск новых биологически активных соединений в области производных хинолина [Sidorchuk I.I.; Stadniichuk R. F.; Tishchenko E.I.; Bordyakovskaya L.T. "Antimicrobial Activity of Quaternary Quinolinium Salts," Khim-Farm. Zh. 1978, 12, 78; Bunting J.W.; Laderoute K.R.; Norris D.J. "Specificity of Xanthine Oxidase for Nitrogen Heteroaromatic Cation Substrates," Can. J. Biochem. 1980, 58, 49; Taylor S.M.: Stubley-Beedman C.; Stell J.G.P. "Simultaneous Formation of 2- and 4-Quinolones from Quinolinium Cations Catalyzed by Aldehyde Oxidase," UK Biochem. J. 1984, 220, 67; Beedham C.; Bruce S.E.; Crithley D.J.; Al-Tayib Y.; Rance, D.J. "Species Variation in Hepatic Aldehyde Oxidase Activity," Eur. J. Drug Metab. Pharmacokinet. 1987, 12, 307; Echavarren A.M.; Stille J.K. "Palladium-catalyzed Coupling of Aryl Triflates with Organostannanes," J. Am. Chem. Soc. 1987, 109, 5478; Atwell G.A.; Baguley B.C.; Denny W.A. "Potential Antitumor Agents. 67. α-Phenylquinoline-8-carboxamides as "Minimal" DNA-Intercalating Antitumor Agents with in Vivo Solid Tumor Activity," J. Med. Chem. 1989, 32, 396; Critchley D.J.P.; Rance D.J.; Beedham, C. "Subcellural Localization of Quinea Pig Hepartic Molybdenum Hydroxylases," Biophys. Res. Commun. 1992, 185, 54; Audia J.E.; Thompson R.C.; Wilkie S.C.; Britton T.C.; Porter W.J.; Huffman G.W.; Latimer L.H. "Preparation of Cyclic Amino Acid Compounds for Inhibiting β-Amyloid Peptide Release and/or its Synthesis." Patent USA WO 9967220, 12.29.1999. Appl. N WO 1999-Us14007, 06.21.1999; Liras S.; Alien M.P.; Blake J.F. "Ring Closing Metathesis Mediated Synthesis of 4a-Aryloxodecahydroisoquinolines, Intermediates in the Preparation of Novel Opiates," Organic. Lett. 2001, 3, 3483; Pina-Vaz C., Sansonetty F., Rodrigues A.G., Costa-Oliveira S., Tavares C., Martinez-de-Oliveira J. Cytometric approach for a rapid evaluation of susceptibility of Candida strains to antifungals // Clinical Microbiology and Infection. 2001. V.7 (11). P.609-618; Jayaraman S., Song Y., Shankar V.L., Verkman A.S. Noninvasive in vivo fluorescence measurement of airway-surface liquid depth, salt concentration, and pH // J. Clin Invest. 2001, V.107(3). P.317-324; Marr K.A., Koudadoust M., Black M., Balajee S.A. Early Events in Macrophage Killing of Aspergillus fumigatus Conidia: New Flow Cytometric Viability Assay // Clinical and Diagnostic Laboratory Immunology. 2001. P.1240-1247; Kogi O., Kim H-B., Kitamura N. Chemical responses of single yeast cells studied by fluorescence microspectroscopy under solution-flow conditions // Analyst. 2002. V.127. P.967-971; Mukherjee P.K., Chandra J., Kuhn D.M., Ghannoum M.A. Mechanism of Fluconazole Resistance in Candida albicans Biofilms: Phase-Specific Role of Efflux Pumps and Membrane Sterols // Infection and Immunity. 2003. P.4333-4340; Hipler U-C., Elsner P., Fluhr J.W. Biofunctional Textiles and the Skin // Curr Probl Dermatol. Basel, Karger. 2006, V. 33. P.165-178].
При биологическом мониторинге было установлено, что производные в ионной форме, т.е. соли хинолиния, проявляют более высокую биологическую активность. Причем, N-фенильные соединения во многих случаях превосходят алифатические производные [Sidorchuk I.I.; Stadniichuk R.F.; Tishchenko E.I.; Bordyakovskaya L.T. "Antimicrobial Activity of Quaternary Quinolinium Salts," Khim-Farm. Zh. 1978, 72, 78].
Принимая во внимание исключительную полезность производных бензопиридина (хинолина), крайне важным становится необходимость детального изучения механизма действия лекарственных веществ, а также процессов их метаболизма в организме. В настоящее время для этой цели широко используется метод изотопной метки, особенно тритиевой метки [Saljoughian M. Synthetic tritium labeling: Reagents and Methodologies // Synthesis. 2002. 13. P.1781-1801], позволяющий проводить очень чувствительные исследования биоорганических молекул и фармпрепаратов. К сожалению, во многих случаях синтез сложных биологически активных объектов с фиксированной тритиевой меткой является крайне сложным и трудоемким.
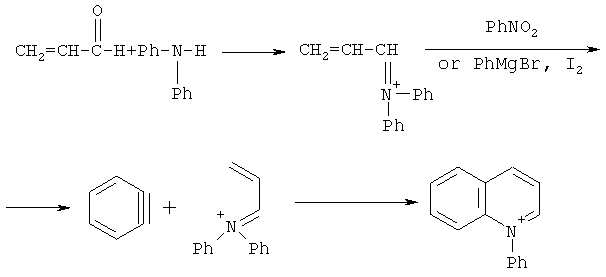
Прямые методы фенилирования азота в производных пиридина отсутствуют. Одной из основных реакций получения солей N-фенилхинолиния является реакция Скраупа из дифениламина, акролеина (или глицерина) и нитробензола [Иванский В. И. // Химия гетероциклических соединений. M.: Высшая школа, 1978; Mortelmans С.; Van Binst G. "Synthesis of 9,10-Dihydro-8bH-quino[1,2-f]phenanthridine- and 6-Phenyl-4,5,6,7-tetrahydropyrido[3,2,1-j,k]carbazole-Derivatives," Tetrahedron 1978. V.34. P.363; Джилкрист Т. // Химия гетероциклических соединений. M., 1996]:
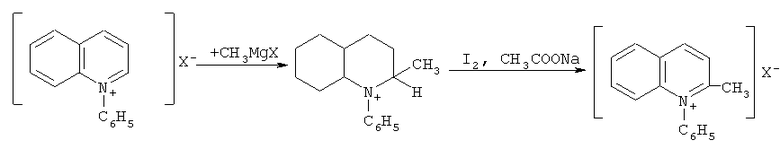
Для получения N-фенилхинальдиниевых солей необходимо провести еще одну дополнительную стадию - взаимодействие N-фенилхинолиниевых производных с реактивом Гриньяра [Сидорчук И.И., Стаднийчук Р.Ф., Тищенко Е.И., Бордяковская Л.Т. Антимикробная активность четвертичных солей хинолиния // Хим-фарм. Журнал 1978. Т.12(7). С.78-80]:
Меченные тритием предшественники для этой реакции могут быть дифениламин или нитробензол, которые содержат тритий в кольце. В свою очередь отсутствие данных коммерческих продуктов приводит к синтезу данных соединений в результате следующих реакций:
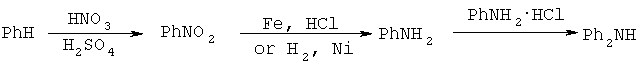
Сложность этой схемы и значительные потери радиоактивности за счет разбавления и водородного обмена при таком многостадийном синтезе делает этот путь трудновыполнимым и крайне дорогостоящим.
Всех указанных недостатков лишен предлагаемый ядерно-химический метод, заключающийся в прямом одностадийном фенилировании гетероатома азота свободными фенил-катионами, генерируемыми при самопроизвольном бета-распаде трития в составе меченного тритием бензола. Ранее мы предложили ядерно-химический способ получения меченного тритием хлорида тетрафенилфосфония в качестве индикатора на мембранный потенциал (Авторское свидетельство СССР №1217861, С07F 9/54, бюл. №10, 1986 г.).
Задачей данного изобретения является разработка простого по исполнению, доступного по реагентам одностадийного способа получения новых меченных тритием N-фенилхинолиниевых и хинальдиниевых солей, которые могут быть использованы для биологических и медицинских исследований.
Поставленная задача достигается новыми меченными тритием N-фенилхинолиниевыми и хинальдиниевыми солями общей формулы:
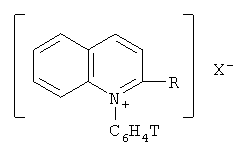
R=Н, СН3;
Х=BF4 -, ClO4 -, J-.
Поставленная задача достигается описываемым новым способом получения новых меченных тритием N-фенилхинолиниевых и хинальдиниевых солей, заключающийся в том, что хинолин и хинальдин (2-метилхинолин) подвергают ион-молекулярным реакциям со свободными меченными тритием фенил-катионами, которые генерируются самопроизвольно при бета-распаде трития в составе третированного бензола.
Вышеперечисленная совокупность существенных признаков позволяет получить следующий технический результат: авторами создан простой по исполнению, доступный по реагентам одностадийный способ получения новых меченных тритием N-фенилхинолиниевых и хинальдиниевых солей, которые могут быть использованы для биологических и медицинских исследований.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Ион-молекулярные реакции осуществлялись в запаянных ампулах, содержащих третированный бензол (источник фенил-катионов), субстраты - хинолин или хинальдин (1 мкл третированного бензола и 6,5 мкл хинолина или 7,4 мкл в случае хинальдина), которые были нанесены на кристаллы стабилизирующей соли (тетрафторобората, перхлората или йодида калия). Химическая чистота синтезированного бензола составляла 99%, объемная удельная активность 4 кюри/см3. Ампулы с реакционной смесью выдерживались для накопления продуктов реакции в количествах, достаточных для их надежного определения (не менее 1 месяца). После накопления ампула вскрывалась, и непрореагировавший меченый бензол перемораживался в новую ампулу. Затем в ампулу добавлялся ацетоновый раствор носителя - неактивной соли хинолиния или хинальдиния (1 мг/мл) и проводилось выделение меченных тритием производных методом препаративной хроматографии. Выход N-фенилхинолиния 20±4%, N-фенилхинальдиния 18±3%.
Пример 2.
Неактивные носители перхлораты N-фенилхинолиния и N-фенилхинальдиния были исследованы на предмет выявления противомикробного действия. Для проведения экспериментов готовили исходные разведения микробных тел по оптическому стандарту из суточной агаровой культуры. Микробная нагрузка соответствовала 2,5·105 микробных тел в 1 мл. Микробную взвесь вносили в приготовленные разведения препаратов в питательной среде. Результаты регистрировали после 20-часового и 7-суточного термостатирования при 37°С. Противомикробную: бактериостатическую (МИК) и бактерицидную (МБК) активность оценивали по минимально действующей концентрации. Максимально испытанные концентрации новых соединений соответствуют 1000 мкг/мл. Данные соединения проявили ингибирующее действие в отношении грамположительных и грамотрицательных бактерий в интервале <1000,0>500,0 мкг/мл, а бактерицидный эффект отмечен в концентрации 1000,0 мкг/мл в отношении обоих видов микроогранизмов.
Приведенные примеры подтверждают осуществимость изобретения. Новые соединения представляют интерес в качестве радиоактивных индикаторов для изучения механизма действия БАС, потенциальных лекарственных средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЧЕННЫЕ ТРИТИЕМ N-ФЕНИЛЛЕПИДИНИЕВЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2442776C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРСОДЕРЖАЩИХ ХИНОЛИНИЕВЫХ ПРОИЗВОДНЫХ | 2014 |
|
RU2577531C2 |
| ЯДЕРНО-ХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ МЕЧЕННЫХ ТРИТИЕМ КВАТЕРНИЗИРОВАННЫХ СТРУКТУР ДИАЗИНОВОГО РЯДА | 2013 |
|
RU2527115C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ ПИРИДИНА, МЕЧЕННЫХ ТРИТИЕМ | 2005 |
|
RU2296752C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ФЕНИЛЗАМЕЩЕННЫХ ТРИЦИКЛИЧЕСКИХ АЗОТИСТЫХ СОЕДИНЕНИЙ, МЕЧЕННЫХ ТРИТИЕМ | 2010 |
|
RU2439059C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ФЕНИЛЗАМЕЩЕННЫХ ИЗОХИНОЛИНИЕВЫХ ПРОИЗВОДНЫХ, МЕЧЕННЫХ ТРИТИЕМ | 2009 |
|
RU2405773C1 |
| Способ синтеза кристаллических нитратометаллатных (металл = V, Mn, Fe, Cu, Zn, Dy, Er, Yb) комплексов с катионом N-нитропиридиния | 2023 |
|
RU2811196C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИТРИТИЙДИФТОРБЕНЗОЛА ИСТОЧНИКА ФТОРИРОВАННЫХ НУКЛЕОГЕННЫХ ФЕНИЛ-КАТИОНОВ | 2012 |
|
RU2479561C1 |
| АЛКИЛСУЛЬФОНАМИДХИНОЛИНЫ С АФФИННОСТЬЮ К РЕЦЕПТОРАМ NK-3 | 2006 |
|
RU2421447C2 |
| ЦИНКОВЫЕ ДИМЕРНЫЕ КОМПЛЕКСЫ КРАУНСОДЕРЖАЩИХ СТИРИЛФЕНАНТРОЛИНОВ В КАЧЕСТВЕ ОПТИЧЕСКИХ СЕНСОРОВ НА КАТИОНЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ И ТЯЖЕЛЫХ МЕТАЛЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2516656C1 |
Описываются меченные тритием N-фенилхинолиниевые и хинальдиниевые соли общей формулы:
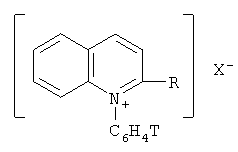
R=H, CH3; X=BF4 -, ClO4 -, J-. Сущность способа их получения состоит в том, что хинолин или хинальдин (2-метилхинолин) подвергают ион-молекулярным реакциям со свободными меченными тритием фенил-катионами, которые генерируются самопроизвольно при бета-распаде трития в составе тритированного бензола в замкнутой системе в присутствии стабилизирующей соли - тетрафторобората, перхлората или йодида калия. Новые вещества могут быть использованы для биологических и медицинских исследований. 2 н.п. ф-лы.
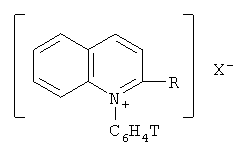
R - H, СН3;
X - BF4 -, ClO4 -, J-.

R - H, СН3;
X - BF4 -, ClO4 -, J-,
отличающийся тем, что хинолин или хинальдин (2-метилхинолин) подвергают ион-молекулярным реакциям со свободными меченными тритием фенилкатионами, которые генерируются самопроизвольно при бета-распаде трития в составе тритированного бензола в замкнутой системе в присутствии стабилизирующей соли - тетрафторобората, перхлората или йодида калия.
| С.Mortelmans et al., "Synthesis of 9,10-Dihydro-8bH-quino[1,2-f]phenanthridine- and 6-Phenyl-4,5,6,7-tetrahydropyrido[3,2,1-j,k]carbazole-Derivatives," Tetrahedron 1978 | |||
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| Способ получения бензонафтола | 1920 |
|
SU363A1 |
| Сидорчук И.И | |||
| и др | |||
| Антимикробная активность четвертичных солей хинолиния, Хим.-фарм | |||
| журнал, 1978, т.12(7), с.78-80 | |||
| Меченный тритием хлорид тетрафенилфосфония в качестве индикатора на мембранный потенциал | 1983 |
|
SU1217861A1 |
Авторы
Даты
2008-03-27—Публикация
2006-12-20—Подача