Изобретение относится к области биотехнологии и предназначено для отбора углеводородокисляющих бактерий-продуцентов поверхностно-активных веществ, которые могут быть использованы для очистки загрязненных нефтью и нефтепродуктами почв, вод, нефтешламов.
Способы ликвидации нефтяных загрязнений, основанные на разложении нефтепродуктов микроорганизмами, признаны одними из наиболее безопасных и эффективных. Бактериальная деградация лимитируется гидрофобной природой углеводородов, их нерастворимостью в воде. Решение этой проблемы возможно в случае продукции углеводородокисляющими бактериями поверхностно-активных веществ - биосурфактантов (био-ПАВ). Они способны диспергировать нефтепродукты или гидрофобизировать поверхности клеток, что повышает эффективность контакта бактерий с углеводородами и облегчает биоразложение нефтепродуктов. Поиск микробов-продуцентов биоПАВ является актуальной задачей биотехнологии. Поскольку биосурфактанты являются химически разнородными соединениями, не имеющими общих хромофорных или реактивных групп, о способности бактерий их продуцировать в большинстве случаев судят по опосредованным признакам - снижению поверхностного натяжения, появлению эмульгирующей активности жидких культур. Для осуществления этих измерения необходимо получить жидкие культуры микроорганизмов, что трудоемко при исследовании большого количества штаммов. Поэтому для первичного скрининга потенциальных продуцентов среди больших выборок штаммов необходимо применение менее трудоемкого отбора культур, выращенных на плотных средах.
Известен способ отбора бактерий-продуцентов экстрацеллюлярных биосурфактантов, включающий посев культур на кровяной агар, содержащий 5% крови, в чашках Петри, инкубирование осуществляют при температуре 45°С в течение 24-48 часов. Бактерии-продуценты отбирают по наличию зоны просветления вокруг колоний, свидетельствующей о гемолизе эритроцитов (G.A.Plaza, I.Zjawiony, I.B.Banat. Use of different methods for detection of thermophilic biosurfactant-producing bacteria from hydrocarbon-contaminated bioremediated soils // Journal of Petroleum science and Engineering. 2006. V.50. P.71-77). Однако этот способ не позволяет достоверно отбирать нефтеокисляющие бактерии, так как не всякие из них растут на кровяном агаре.
К недостатку способа относится возможность отбора только продуцентов экстрацеллюлярных биосурфактантов и отбор бактерий, продуцирующих гемолитические, но не поверхностно-активные вещества. Кроме того, кровяной агар является относительно дорогой питательной средой.
Наиболее близким аналогом к заявляемому способу является метод оценки углеводородокисляющей активности микроорганизмов (Петрикевич С.Б., Кобзев Е.Н., Шкидченко А.Н. // Прикладная биохимия и микробиология. 2003. Т.39. №1. С.25-30), включающий нанесение нефти или нефтепродуктов на поверхность носителя в виде раствора в инертном растворителе, при этом углеводороды равномерно распределяются по поверхности агара в чашках Петри. Засеянные чашки инкубируются при 24°С в течение 6-7 суток. Бактерии, продуцирующие биосурфактанты, отбираются по образованию затемненных зон вокруг колоний, о чем можно косвенно судить по заключению разработчиков, высказавших предположение о выделении в среду этими штаммами биоПАВ.
К недостаткам прототипа относится невозможность отбора бактерий-продуцентов клеточно-связанных биосурфактантов.
Технической задачей заявляемого технического решения является разработка простого, доступного способа отбора нефтеокисляющих бактерий-продуцентов внеклеточных и клеточно-связанных биосурфактантов.
Решение технической задачи достигается тем, что выращивают нефтеокисляющие бактерии на универсальной плотной питательной среде - питательном агаре. Среда стерильно разливается в чашки Петри, посев бактерий на ее поверхность осуществляют методом истощающего штриха. Засеянные чашки Петри инкубируют при комнатной температуре 20-25°С не менее 3 суток. По окончании культивирования визуально оценивают морфотип колоний каждого штамма - S, R или М-тип. Нефтеокисляющие бактерии, образующие на питательном агаре колонии М-типа, являются продуцентами биосурфактантов. Бактерии, образующие колонии S- или R-типа, смывают с поверхности питательного агара фосфатным буфером с рН 6,8. Полученную суспензию разводят до оптической плотности 0,1-0,3 условных единиц при длине волны 670 нм и определяют ее эмульгирующую активность и показатель гидрофобности клеток. Если суспензия бактерий, образующих на питательном агаре колонии S- или R-типа, обладает положительной эмульгирующей активностью и показателем гидрофобности клеток более 20%, то данные нефтеокисляющие бактерии являются продуцентами биосурфактантов.
Эмульгирующую активность определяли встряхиванием в химической пробирке 4 мл бактериальной суспензии с 3 мл дизельного топлива на орбитальной качалке при 200 об/мин с последующим отстаиванием в вертикальном положении в течение 1 часа для разделения водной и углеводородной фаз. Наличие или отсутствие эмульсии на границе раздела фаз определяется визуально: "+" - эмульсия есть, "-" - эмульсия отсутствует. Показатель гидрофобности определяляется модифицированным методом Розенберга (Серебрякова Е.В., Дармов И.В., Медведев Н.П., Алексеев С.А., Рыбак С.И. // Микробиология. 2002. №2. С.237-239) - 4 мл бактериальной суспензии встряхиваются с 1 мл хлороформа в пробирке объемом 10 мл на орбитальной качалке при 150 об/мин, отстаиваются для разделения фаз в вертикальном положении в течение 1 часа. Далее измеряют оптическую плотность бактериальной суспензии, гидрофобность клеток рассчитывают по формуле
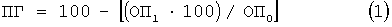
где ПГ - показатель гидрофобности (%), ОП0 - исходная оптическая плотность бактериальной суспензии (условные единицы), ОП1 - оптическая плотность суспензии после встряхивания с хлороформом (условные единицы).
Оптимальную величину оптической плотности бактериальной суспензии для постановки теста Розенберга подбирали экспериментально. Для некоторых штаммов оптическая плотность суспензии после встряхивания (ОП1) превышала оптическую плотность до встряхивания (ОП0), возможно, вследствие образования оптически-плотной эмульсии "хлороформ в воде", стабилизированной клетками. При ОП1>ОП0 формула (1) неприменима. Кроме того, при высокой концентрации клеток в суспензии их количество может превышать сорбционную емкость хлороформа, что приводит к искажению результатов теста Розенберга. Оптимальная для исследуемых штаммов концентрация клеток достигается при величине оптической плотности суспензии не более 0,3 условных единиц (Таблица 1). Нижний предел оптической плотности определяется диапазоном чувствительности применяемого для ее регистрации прибора, в нашем случае он составлял 0,1 условных единиц.
Использовали питательный агар производства ГНЦПМ г.Оболенск (Россия) следующего состава (г/л): панкреатический гидролизат рыбной муки - 24,0; натрий хлористый - 4,0; агар микробиологический - 12,0±2,0; рН 7,3±0,2.
Продолжительность культивирования составляла от 3 до 7 суток в зависимости от индивидуальной скорости роста каждого штамма.
На чертеже приведены сведения об эмульгирующей активности липидов, выделенных из клеток нефтеокисляющих бактерий.
Пример 1.
Исследованы 27 штаммов нефтеокисляющих бактерий коллекции кафедры генетики и микробиологии Кубанского государственного университета. Бактерии каждого штамма сеяли истощающим штрихом на поверхность плотного питательного агара указанного состава в чашках Петри, инкубировали при комнатной температуре в течение 3-7 суток, в зависимости от индивидуальной скорости роста. По окончании культивирования визуально оценили морфотип колоний: три штамма образовывали колонии М-формы, остальные 24 штамма образовывали колонии S- и R-форм. Биомассу бактерий, образовывавших колонии S- и R-форм, смывали с питательного агара фосфатным буфером, полученную суспензию клеток разводили до оптической плотности в пределах 0,1-0,3 условных единиц при длине волны 670 нм. Определяли эмульгирующую активность, показатель гидрофобности клеток по формуле (1). Положительный тест на эмульгирующую активность продемонстрировали 8 из 24 штаммов S, R-форм. Величина показателя гидрофобности их клеток составляла от 21 до 88% (Таблица 2).
В качестве потенциальных продуцентов биосурфактантов были отобраны: изоляты №2, 3, 4 - как образующие колонии М-типа; изоляты №18, 21, 22, 23, 24, 32, 34, 39 - как обладающие положительной эмульгирующей активностью и показателем гидрофобности >20%.
Поверхностно-активные вещества бактерий обычно имеют в своем составе липидные компоненты (Desai J.D., Banat I.M. Microbial production of surfactants and their commercial potential // Microbiology and molecular biology reviews. 1997. V.61. №1. P.47-64). С целью проверки способности продуцировать биосурфактанты из биомассы 14 штаммов, выращенных на питательном агаре, химически выделили клеточно-связанные общие липиды и проверили их эмульгирующую активность. Семь штаммов были предварительно отобраны как потенциальные продуценты биосурфактантов (№, 21, 22, 23, 24, 31, 39), семь штаммов были взяты в качестве контрольной группы (№7, 5, 7, 8, 12, 15, 17). Как видно из чертежа, шесть из семи штаммов контрольной группы продуцировали липиды с низкой эмульгирующей активностью 0-5%. Шесть из семи штаммов, отобранных как потенциальные продуценты, синтезировали клеточно-связанные липиды с высокой эмульгирующей активностью 23-55%, что явилось подтверждением правильности предложенного способа отбора продуцентов биосурфактантов среди нефтеокисляющих бактерий.
Пример 2.
Проверены поверхностно-активные свойства отобранных штаммов - потенциальных продуцентов биосурфактантов при культивировании на среде с нефтепродуктами. Бактерии выращивали на жидкой минеральной среде (Практикум по микробиологии / Под ред. А.И.Нетрусова. М.: МГУ, 2005. 120 с.) с гексадеканом в колбах на орбитальной качалке при 120 об/мин в течение 6 суток. Способность бактерий продуцировать биосурфактанты при росте в жидкой среде оценивали общепринятыми методами - по снижению уровня поверхностного натяжения и появлению эмульгирующей активности жидкой культуры и ее супернатанта в процессе роста (Р.A.Willumsen, U.Karlson. Screening of bacteria, isolated from PAH-contaminated soils, for production of biosurfactants and bioemulsifiers // Bio-degradation. 1997. V.7. P.415-423). Поверхностное натяжение измеряли методом отрыва пластинки от поверхности жидкости (Практикум по коллоидной химии и электронной микроскопии. / Под ред. С.С.Воюцкого. М., 1974. С.68-72), эмульгирующую активность - как описано выше, с той разницей, что ее рассчитывали количественно по формуле
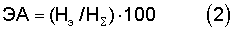
где ЭА - эмульгирующая активность (%), Нэ - высота столбика эмульсии (мм), HΣ - высота всего столбика жидкости в пробирке (мм).
Исходно поверхностно-активные свойства среды, инокулированной бактериями, отсутствовали: поверхностное натяжение - 64 мН/м, индекс эмульгации - 0%. В процессе роста бактерий произошло снижение поверхностного натяжения и появление эмульгирующей активности (Таблица 3), что свидетельствует о том, что отобранные бактерии продуцируют биосурфактанты.
С целью определения типа биосурфактантов - внеклеточные или клеточно-связанные, клетки отделили центрифугированием, измерили поверхностное натяжение и эмульгирующую активность полученных супернатантов. Как видно из таблицы 4, супернатанты культур четырех штаммов обладали эмульгирующей активностью, что свидетельствует о продукции внеклеточных биосурфактантов. Поверхностно-активные свойства пяти других штаммов были связаны с биомассой клеток, что свидетельствует о продукции ими клеточно-связанных биосурфактантов.
На основе представленных результатов можно заключить, что предлагаемый способ отбора нефтеокисляющих бактерий-продуцентов биосурфактантов обладает новизной, изобретательским уровнем, экспрессностью, не требует приготовления специальных или дорогих питательных сред, позволяет отбирать бактерии, продуцирующие как внеклеточные, так и клеточно-связанные биосурфактанты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МИКРОБИОЛОГИЧЕСКОЙ ОЧИСТКИ НЕФТЯНЫХ ШЛАМОВ И ЗАГРЯЗНЕННОГО НЕФТЕПРОДУКТАМИ ГРУНТА (ВАРИАНТЫ) | 2006 |
|
RU2311237C1 |
| СПОСОБ ВЫБОРА ШТАММОВ МИКРООРГАНИЗМОВ-ДЕСТРУКТОРОВ НЕФТИ И НЕФТЕПРОДУКТОВ | 2009 |
|
RU2426781C2 |
| СПОСОБ ВЫДЕЛЕНИЯ НЕФТЕОКИСЛЯЮЩИХ МИКРООРГАНИЗМОВ ИЗ ОКРУЖАЮЩЕЙ СРЕДЫ | 2009 |
|
RU2415919C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ УГЛЕВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ С ПОВЫШЕННОЙ ДЕСТРУКТИВНОЙ СПОСОБНОСТЬЮ | 2008 |
|
RU2390555C1 |
| ШТАММ БАКТЕРИЙ TSUKAMURELLA TYROSINOSOLVENS ВКПМ В-12342 - ДЕСТРУКТОР АЛКАНОВ И ПРОДУЦЕНТ БИОПАВ ДЛЯ ОЧИСТКИ ТЕРРИТОРИЙ, АКВАТОРИЙ И ПРОМЫШЛЕННЫХ ОТХОДОВ ОТ НЕФТЯНЫХ ЗАГРЯЗНЕНИЙ | 2016 |
|
RU2626593C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОПРЕПАРАТА ДЛЯ ОЧИСТКИ ПОЧВЫ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ | 2016 |
|
RU2636343C2 |
| ШТАММ БАКТЕРИЙ BACILLUS AMYLOLIQUEFACIENS, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМ И БАКТЕРИЦИДНЫМ ДЕЙСТВИЕМ, И БИОЛОГИЧЕСКИЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ЗАЩИТЫ ОВОЩНЫХ РАСТЕНИЙ ОТ ГРИБНЫХ И БАКТЕРИАЛЬНЫХ БОЛЕЗНЕЙ | 2023 |
|
RU2808722C1 |
| Штамм бактерий Bacillus subtilis subspecies subtilis krd-20 - продуцент фунгистатических липопептидов | 2022 |
|
RU2802234C1 |
| Препарат для очистки почв и водных объектов от нефти и нефтепродуктов | 2015 |
|
RU2615464C1 |
| Штаммм бактерий Serratia plymuthica ВКПМ В-12668, выделенный из биоматериала палеонтологического образца (детеныша ископаемого шерстистого носорога), - деструктор нефти и нефтепродуктов | 2020 |
|
RU2759807C1 |
Изобретение относится к области биотехнологии и предназначено для отбора углеводородокисляющих бактерий-продуцентов поверхностно-активных веществ. Способ включает культивирование нефтеокисляющих бактерий на плотной среде в чашках Петри, при комнатной температуре. По окончании культивирования определяют морфотип колоний бактерий. Бактерии колоний М-типа отбирают как продуценты биосурфактантов. Бактерии колоний R- или S-типа смывают фосфатным буфером с рН 6,8, полученную суспензию разводят до оптической плотности 0,1-0,3 при длине волны 670 нм и определяют эмульгирующую активность и показатель гидрофобности клеток. При значении показателя гидрофобности более 20% и положительной эмульгирующей активности бактерии отбирают как продуценты биосурфактантов. Способ прост в осуществлении и позволяет отобрать нефтеокисляющие бактерии-продуценты внеклеточных и клеточно-связанных биосурфактантов. 1 ил., 4 табл.
Способ отбора нефтеокисляющих бактерий-продуцентов биосурфактантов, включающий культивирование нефтеокисляющих бактерий на плотной среде в чашках Петри, при комнатной температуре, отличающийся тем, что по окончании культивирования определяют морфотип колоний бактерий, при этом бактерии колоний М-типа отбирают как продуценты биосурфактантов, бактерии колоний R- или S-типа смывают фосфатным буфером с рН 6,8, полученную суспензию разводят до оптической плотности 0,1-0,3 при длине волны 670 нм и определяют эмульгирующую активность и показатель гидрофобности клеток, при значении которого более 20% и положительной эмульгирующей активности бактерии отбирают как продуценты биосурфактантов.
| ПЕТРИКЕВИЧ С.Б | |||
| и др | |||
| Оценка углеводородокисляющей активности микроорганизмов, Прикладная биохимия и микробиология, 2003, т.39, №1, с.25-30 | |||
| НАЗИНА Т.Н | |||
| и др | |||
| Образование нефтевытесняющих соединений микроорганизмами из нефтяного месторождения Дацин (КНР), Микробиология, 2003, №2, с.206-211 | |||
| СЕРЕБРЯКОВА Е.В | |||
| и др | |||
| Оценка гидрофобных свойств |
Авторы
Даты
2008-03-27—Публикация
2006-05-02—Подача