Настоящее изобретение относится к производным 5-тио-β-D-глюкопиранозида, способным ингибировать активность зависимого от натрия переносчика 2 глюкозы (SGLT2), который избирательно находится в почках и участвует в ресорбции глюкозы. Настоящее изобретение также относится к фармацевтическим препаратам, в частности терапевтическим средствам при диабете, которые содержат данное соединение в качестве активного ингредиента.
Полагают, что при хронической гипергликемии происходит уменьшение секреции инсулина и чувствительности к инсулину, что, в свою очередь, вызывает повышение концентрации глюкозы в крови и приводит к обострению диабета. Препараты, которые обычно применяют в качестве терапевтических средств при диабете, включают бигуаниды, сульфонилмочевины, ингибиторы гликозидазы и средства, повышающие резистентность к инсулину. Однако сообщалось о побочных эффектах данных препаратов, например о молочнокислом ацидозе - для бигуанидов, гипогликемии - для сульфонилмочевин и диарее - для ингибиторов гликозидазы. Следовательно, желательно разработать терапевтические средства при диабете, которые имели бы новый механизм действия, отличающийся от такового для обычно предлагаемых средств.
Было установлено, что флоридзин, природное производное глюкозы, обладает гипогликемическим действием посредством ингибирования избыточной ресорбции глюкозы в почках с усилением выделения глюкозы (J. Clin. Invest., vol.80, p.1037, 1987; J. Clin. Invest., vol.87, p.1510, 1987). Имеются доказательства того, что данная ресорбция глюкозы опосредуется зависимым от натрия переносчиком 2 глюкозы (SGLT2), находящемся в S1-участке почечных проксимальных канальцев (J. Clin. Invest., vol.93, p.397, 1994).
На основе данных предпосылок проводилось все возрастающее количество исследований в целях разработки терапевтических средств при диабете, которые зависели бы от ингибирования SGLT2, и сообщалось о большом числе производных флоридзина.
В качестве примера сообщалось о производном арил β-D-глюкопиранозида следующей формулы:

(публикация Европейского патента № EP0850948). В дополнение к этому также раскрыты другие соответствующие соединения (публикации международных патентов №№ WO0168660, WO0116147, WO0174834, WO0174835, WO0253573, WO0268439, WO0268440, WO0236602 WO0288157, WO0228872, WO0244192, WO0264606, WO0311880, WO0320737, WO0300712 и т.д.).
При пероральном введении производные флоридзина гидролизуются по гликозидным связям под действием гликозидазы, присутствующей в тонком кишечнике, приводя таким образом к низкой эффективности всасывания неизмененной формы и слабому гипогликемическому действию. По этой причине предпринимались различные попытки, например, повысить эффективность всасывания введением производных флоридзина в виде пролекарств и/или предупреждением расщепления путем синтеза соединений с замещением гликозидных связей на углерод-углеродные связи (патенты США № US20010041674, US2002137903 и US20031143, публикация международного патента № WO0127128 и публикация международного патента № WO0283066).
Однако, поскольку не разработан химический синтетический способ β-избирательного гликозилирования производных 5-тиоглюкозы, при котором атом кислорода в кольце глюкозы замещался бы на атом серы, отсутствуют сообщения о производных 5-тио-β-D-глюкопиранозида. Таким образом, также не сообщалось об ингибирующем действии производных 5-тио-β-D-глюкопиранозида в отношении SGLT2.
Задачей настоящего изобретения является создание новых соединений, которые обладают гипогликемическим действием путем ингибирования активности SGLT2, который принимает участие в ресорбции глюкозы в почках, для ускорения выделения сахара с мочой.
В результате обширных и интенсивных исследований, направленных на преодоление вышеуказанных проблем, заявители настоящего изобретения обнаружили способ избирательного синтеза 5-тио-β-D-глюкопиранозидов. С использованием данного способа заявители также синтезировали производные арил 5-тио-β-D-глюкопиранозида или их фармацевтически приемлемых солей (в последующем относится к «соединению по настоящему изобретению») и установили, что данные соединения обладают ингибирующим действием в отношении SGLT2. Результаты данных изысканий позволили осуществить настоящее изобретение.
То есть настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы, или его фармацевтически приемлемой соли, или его гидрату:

в которой
Y представляет -О- или -NH-,
R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10 ацил, C7-10 аралкил, C2-6 алкоксикарбонил, C1-6 алкокси - С2-10 ацил или C1-6 алкокси - C2-6 алкоксикарбонил,
Ar представляет арил, замещенный -X-A1, где арил может быть дополнительно замещен 1-4 одинаковыми или различными заместителями, выбранными из:
атома галогена;
гидроксила;
C1-6 алкила, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группы, представленной формулой:
-(СН2)m-Q,
в которой m представляет целое число от 0 до 4, и Q представляет формил, аминогруппу, нитрогруппу, цианогруппу, карбоксил, сульфокислотную группу, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C1-6 алкокси-C1-6 алкокси, C2-10 ацилокси, C2-10 ацил, C2-6 алкоксикарбонил, C1-6 алкилтио, С1-6 алкилсульфинил, C1-6алкилсульфонил, -NHC(=O)H, C2-10 ациламиногруппу, C1-6алкилсульфониламиногруппу, C1-6 алкиламиногруппу, N,N-ди(C1-6 алкил)аминогруппу, карбамоил, N-(C1-6 алкил)аминокарбонил или N,N-ди(C1-6 алкил)аминокарбонил; или
C3-7 циклоалкила, C3-7 циклоалкилокси, арила, C7-10 аралкила, арилокси, C7-10 аралкилокси, C7-10 аралкиламиногруппы, гетероарила или 4-6-членного гетероциклоалкила, при условии, что каждая из данных групп может быть замещена 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси,
X представляет -(CH2)n-, -CO(CH2)n-, -CH(OH)(CH2)n-, -O-(CH2)n-, -CONH(CH2)n-, -NHCO(CH2)n-, где n представляет целое число от 0 до 3, -COCH=CH-, -S- или -NH-, и
A1 представляет арил, гетероарил или 4-6-членный гетероциклоалкил, каждый из которых может быть замещен 1-4 одинаковыми или различными заместителями, выбранными из:
атома галогена;
гидроксила;
C1-6 алкила, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группы, представленной формулой:
-(СН2)m'-Q',
в которой m' представляет целое число от 0 до 4 и Q' представляет формил, аминогруппу, нитрогруппу, цианогруппу, карбоксил, сульфокислотную группу, C1-6 алкокси, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила, C1-6 алкокси - C1-6 алкокси, C2-10 ацилокси, C2-10 ацил, C2-6 алкоксикарбонил, C1-6 алкилтио, С1-6 алкилсульфинил, C1-6алкилсульфонил, -NHC(=O)H, C2-10 ациламиногруппу, C1-6алкилсульфониламиногруппу, C1-6 алкиламиногруппу, N,N-ди(C1-6алкил)аминогруппу, карбамоил, N-(C1-6 алкил)аминокарбонил или N,N-ди(C1-6 алкил)аминокарбонил; или
C3-7 циклоалкила, C3-7 циклоалкилокси, арила, C7-10 аралкила, арилокси, C7-10 аралкилокси, C7-10 аралкиламиногруппы, гетероарила или 4-6-членного гетероциклоалкила, при условии, что каждая из данных групп может быть замещена 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси.
Наилучший способ осуществления изобретения
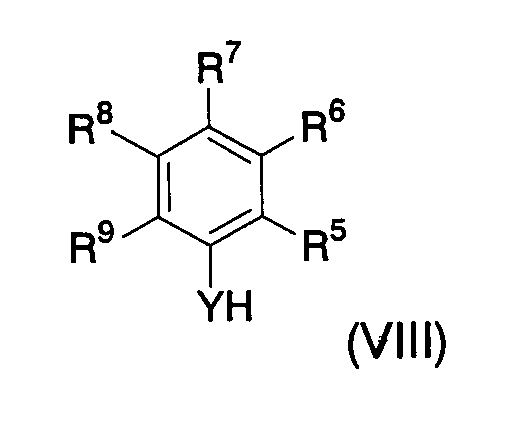
По другому воплощению настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы, или его фармацевтически приемлемой соли, или его гидрату:

в которой
Y представляет -О- или -NH-,
R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10 ацил, C7-10 аралкил, C2-6 алкоксикарбонил, C1-6 алкокси - С2-10 ацил или C1-6 алкокси - C2-6 алкоксикарбонил, и
по меньшей мере, один из R5, R6, R7, R8 и R9 представляет -X-A1, где X и A1 имеют значения, определенные выше, и другие, которые могут быть одинаковыми или различными, каждый представляет:
атом водорода;
атом галогена;
гидроксил;
C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группу, представленную формулой:
-(СН2)m-Q
в которой m и Q имеют значения, определенные выше; или
C3-7 циклоалкил, C3-7 циклоалкилокси, арил, C7-10 аралкил, арилокси, C7-10 аралкилокси, C7-10 аралкиламиногруппу, гетероарил или 4-6-членный гетероциклоалкил, при условии, что каждая из данных групп может быть замещена 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси.
В соответствии с другим воплощением настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида вышеуказанной формулы, в которой Y представляет -O-, или его фармацевтически приемлемой соли, или его гидрату.
По другому воплощению настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида вышеуказанной формулы, в которой R5 представляет -X-A1, или его фармацевтически приемлемой соли, или его гидрату.
По другому воплощению настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида вышеуказанной формулы, в которой X представляет -(CH2)n-, где n представляет целое число от 0 до 3, или его фармацевтически приемлемой соли, или его гидрату.
По другому воплощению настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида вышеуказанной формулы, в которой X представляет -CO(CH2)n-, где n представляет целое число от 0 до 3, или его фармацевтически приемлемой соли, или его гидрату.
По другому воплощению настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы, или его фармацевтически приемлемой соли, или его гидрату:

в которой
X представляет -(CH2)n-, -CO(CH2)n-, -CH(OH)(CH2)n-, -O-(CH2)n-, -CONH(CH2)n-, -NHCO(CH2)n-, где n представляет целое число от 0 до 3, -COCH=CH-, -S- или -NH-,
R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10 ацил, C7-10 аралкил, C2-6 алкоксикарбонил, C1-6 алкокси - С2-10 ацил или C1-6 алкокси - C2-6 алкоксикарбонил,
R6, R7, R8 и R9, которые могут быть одинаковыми или различными, каждый представляет:
атом водорода;
атом галогена;
гидроксил;
C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группу, представленную формулой:
-(СН2)m-Q,
в которой m представляет целое число от 0 до 4 и Q представляет формил, аминогруппу, нитрогруппу, цианогруппу, карбоксил, сульфокислотную группу, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C1-6 алкокси - C1-6 алкокси, C2-10 ацилокси, C2-10 ацил, C2-6 алкоксикарбонил, C1-6 алкилтио, С1-6 алкилсульфинил, C1-6алкилсульфонил, -NHC(=O)H, C2-10 ациламиногруппу, C1-6алкилсульфониламиногруппу, C1-6 алкиламиногруппу, N,N-ди(C1-6алкил)аминогруппу, карбамоил, N-(C1-6 алкил)аминокарбонил или N,N-ди(C1-6 алкил)аминокарбонил; или
C3-7 циклоалкил, C3-7 циклоалкилокси, арил, C7-10 аралкил, арилокси, C7-10 аралкилокси, C7-10 аралкиламиногруппу, гетероарил или 4-6-членный гетероциклоалкил, при условии, что каждая из данных групп может быть замещена 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси, и
R10, R11, R12, R13 и R14, которые могут быть одинаковыми или различными, каждый представляет:
атом водорода;
атом галогена;
гидроксил;
C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группу, представленную формулой:
-(СН2)m'-Q',
в которой m представляет целое число от 0 до 4 и Q' представляет формил, аминогруппу, нитрогруппу, цианогруппу, карбоксил, сульфокислотную группу, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C1-6 алкокси - C1-6 алкокси, C2-10 ацилокси, C2-10 ацил, C2-6 алкоксикарбонил, C1-6 алкилтио, С1-6 алкилсульфинил, C1-6алкилсульфонил, -NHC(=O)H, C2-10 ациламиногруппу, C1-6алкилсульфониламиногруппу, C1-6 алкиламиногруппу, N,N-ди(C1-6алкил)аминогруппу, карбамоил, N-(C1-6 алкил)аминокарбонил или N,N-ди(C1-6 алкил)аминокарбонил; или
C3-7 циклоалкил, C3-7 циклоалкилокси, арил, C7-10 аралкил, арилокси, C7-10 аралкилокси, C7-10 аралкиламиногруппу, гетероарил или 4-6-членный гетероциклоалкил, при условии, что каждая из данных групп может быть замещена 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси.
В другом воплощении настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида формулы (II), в которой X представляет -СН2-, или его фармацевтически приемлемой соли, или его гидрату.
В другом воплощении настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида формулы (II), в которой X представляет -O- или -NH-, или его фармацевтически приемлемой соли, или его гидрату.
В другом воплощении настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы или его фармацевтически приемлемой соли:

в которой R6A-R9A, которые могут быть одинаковыми или различными, каждый представляет атом водорода, атом галогена, C1-6 алкил, C1-6 алкокси, C1-6алкокси-C1-6алкокси, карбоксил, C2-6 алкоксикарбонил, гидроксил или гидрокси-C1-4 алкил, RC представляет атом водорода, атом галогена, C1-6 алкил, C1-6 алкокси, гидрокси - C1-4 алкил, галогензамещенный C1-6 алкил или C1-6 алкилтио, R4A представляет атом водорода, C2-6 алкоксикарбонил или C2-6 алканоил, и R1A-R3A, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-8 алканоил или бензоил.
В другом воплощении настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы или его фармацевтически приемлемой соли:

в которой RD представляет атом водорода, атом галогена, C1-6 алкил или гидрокси - C1-4 алкил и RE представляет атом водорода, атом галогена, C1-6 алкил, C1-6 алкокси или гидрокси - C1-4 алкил.
В другом воплощении настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы, или его фармацевтически приемлемой соли, или его гидрату:

в которой R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10 ацил, C7-10 аралкил, C2-6 алкоксикарбонил, C1-6 алкокси - С2-10 ацил или C1-6 алкокси - C2-6 алкоксикарбонил, R6B представляет атом водорода, атом галогена, гидроксил, C2-10ацилокси, предпочтительно C2-4 алканоилокси, или C1-6 алкил, или C1-6 алкокси, которые могут быть замещены 1-4 атомами галогена, и R8B представляет атом водорода, атом галогена или C1-6алкил, который может быть замещен 1-4 атомами галогена.
В другом воплощении настоящее изобретение относится к фармацевтическому препарату, который содержит любое одно из вышеуказанных производных 5-тио-β-D-глюкопиранозида, или его фармацевтически приемлемую соль, или его гидрат, в качестве активного ингредиента.
По другому воплощению настоящее изобретение относится к ингибитору активности натрий-зависимого переносчика 2 глюкозы (SGLT2), который содержит любое одно из вышеуказанных производных 5-тио-β-D-глюкопиранозида, или его фармацевтически приемлемую соль, или его гидрат, в качестве активного ингредиента.
По другому воплощению настоящее изобретение относится к профилактическому или терапевтическому средству при диабете, связанных с диабетом заболеваний или осложнений при диабете, которое содержит любое одно из вышеуказанных производных 5-тио-β-D-глюкопиранозида, или его фармацевтически приемлемую соль, или его гидрат, в качестве активного ингредиента.
По другому воплощению настоящее изобретение относится к фармацевтическому препарату, который содержит любое одно из вышеуказанных производных 5-тио-β-D-глюкопиранозида, или его фармацевтически приемлемую соль, или его гидрат, в комбинации, по меньшей мере, с одним препаратом, выбранным из группы, состоящей из сенсибилизатора инсулина (который выбран из группы, состоящей из агониста PPARγ, агониста PPAR α/γ, агониста PPARδ и агониста PPARα/γ/δ), ингибитора гликозидазы, бигуанида, средства, стимулирующего секрецию инсулина, препарата инсулина и ингибитора дипептидилпептидазы IV.
По другому воплощению настоящее изобретение относится к фармацевтическому препарату, который содержит любое одно из вышеуказанных производных 5-тио-β-D-глюкопиранозида, или его фармацевтически приемлемую соль, или его гидрат в комбинации, по меньшей мере, с одним препаратом, выбранным из группы, состоящей из ингибитора гидроксиметилглутарил-коэнзим-А-редуктазы, фибрата, ингибитора скваленсинтазы, ингибитора ацил-коэнзим-А:холестерин-ацилтрансферазы, промотора рецепторов липопротеинов низкой плотности, ингибитора микросомальных белков-переносчиков триглицеридов и аноректика.
Кроме того, настоящее изобретение относится к производному 5-тио-β-D-глюкопиранозида следующей формулы, которое является синтетическим промежуточным соединением для получения соединения формулы (I), или его фармацевтически приемлемой соли, или его гидрата:

в которой
R21, R22, R23 и R24, которые могут быть одинаковыми или различными, каждый представляет атом водорода или C2-10 ацил,
R25 представляет аминогруппу, C2-6 алканоил, карбоксил, формил, атом галогена, C2-6 алкоксикарбонил или гидроксил, и
R26 и R27, которые могут быть одинаковыми или различными, каждый представляет атом водорода, атом галогена, гидроксил, C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила, или C1-6 алкокси, который может быть замещен 1-4 атомами галогена.
Термины и выражения, использованные в описании, определяются следующим образом.
В том смысле, в котором этот термин здесь используется, определение «Сx-y» предназначено для обозначения группы, содержащей от x до y атомов углерода.
Термин «C2-10 ацил» предназначен для обозначения нормального или разветвленного алифатического ацила (предпочтительно C2-6 алканоила) или ароматического ацила, который содержит 2-10 атомов углерода. Примеры включают ацетил, пропионил, пивалоил, бутирил, изобутирил, валерил и бензоил, предпочтительной группой является ацетил.
Термин «C7-10 аралкил» относится к арилалкилу, содержащему 7-10 атомов углерода. Примеры включают бензил и фенилэтил.
Термин «C1-6алкокси» предназначен для обозначения нормального или разветвленного алкокси, содержащего 1-6 атомов углерода. Предпочтительными группами являются C1-4алкокси, включая метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси и трет-бутокси.
Термин «C2-6 алкоксикарбонил» предназначен для обозначения структуры, состоящей из нормального или разветвленного алкокси и карбонила. Предпочтительными группами являются C2-5 алкоксикарбонильные группы, включая метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил и бутоксикарбонил. Среди них предпочтительной группой является метоксикарбонил.
Термин «C1-6алкокси-C2-10ацил» предназначен для определения структуры, состоящей из нормального или разветвленного C1-6 алкокси и C2-10 ацила. Предпочтительной группой является C1-6 алкокси - C2-6 алканоил и тому подобное.
Термин «C1-6 алкокси - C2-6 алкоксикарбонил» предназначен для обозначения структуры, состоящей из нормального или разветвленного C1-6 алкокси и C2-6 алкоксикарбонила.
Термин «атом галогена» включает атом фтора, атом хлора, атом брома, атом йода и тому подобное.
Термин «C1-6 алкил» предназначен для определения нормального или разветвленного алкила, содержащего 1-6 атомов углерода. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, вторичный бутил, н-пентил, трет-амил, 3-метилбутил и неопентил.
Выражение «C1-6 алкил, замещенный 1-4 атомами галогена» относится к C1-6 алкилу, атомы водорода которого замещены 1-4 атомами галогена (предпочтительно атомами фтора). Примеры включают трифторметил, 1,1,1-трифторэтил, 1,1,1-трифторпропил и 1,1,1-трифторбутил, предпочтительными группами являются трифторметил и 1,1,1-трифторэтил.
Выражение «C1-6 алкил, замещенный 1-4гидроксилами» относится к алкилу, атомы водорода которого замещены 1-4 гидроксильными группами. Предпочтительной группой является гидрокси-C1-6алкил (т.е. C1-6алкил, замещенный одной гидроксильной группой), и более предпочтительной группой является гидрокси - C1-4 алкил. Примеры включают гидроксиметил, гидроксиэтил (например, 1-гидроксиэтил), гидроксипропил и гидроксибутил.
Выражение «C1-6 алкокси, замещенный 1-4 атомами галогена» относится к алкокси, атомы водорода которого замещены атомами галогена. Примеры включают трифторметокси, 1,1,1-трифторэтокси, 1,1,1-трифторпропокси и 1,1,1-трифторбутокси, предпочтительными группами являются трифторметокси и 1,1,1-трифторэтокси.
Термин «C1-6 алкокси - C1-6 алкокси» предназначен для определения, например, группы метоксиметокси.
Термин «C2-10 ацилокси» предназначен для обозначения структуры, состоящей из C2-10ацила и группы -O-. Предпочтительными группами являются C2-6 алканоилокси (например, ацетилокси) и бензоилокси.
Термин «C1-6 алкилтио» предназначен для определения структуры, состоящей из нормального или разветвленного C1-6 алкила и одной тиогруппы (-S-), предпочтительно относится к С1-4 алкилтиогруппе. Примеры C1-6 алкилтиогруппы включают метилтиогруппу, этилтиогруппу и пропилтиогруппу.
Термин «C1-6 алкилсульфинил» предназначен для определения структуры, состоящей из C1-6алкила и сульфинила (-SO-). Предпочтительными группами являются метансульфинил и этансульфинил.
Термин «C1-6 алкилсульфонил» предназначен для определения структуры, состоящей из C1-6алкила и сульфонила (-SO2). Предпочтительными группами являются метансульфонил и этансульфонил.
Термин «C2-10 ациламиногруппа» предназначен для определения структуры, состоящей из C2-10ацила и аминогруппы. Предпочтительной является ацетиламиногруппа.
Термин «C1-6 алкилсульфониламиногруппа» предназначен для обозначения структуры, состоящей из C1-6 алкилсульфонила и аминогруппы. Примеры включают метансульфониламиногруппу и этансульфониламиногруппу.
Термин «C1-6 алкиламиногруппа» предназначен для обозначения структуры, состоящей из C1-6 алкила и аминогруппы. Примеры включают метиламиногруппу и этиламиногруппу.
Термин «N,N-ди(C1-6 алкил)аминогруппа» предназначен для обозначения структуры, состоящей из двух C1-6 алкильных групп и аминогруппы. Примеры включают диметиламиногруппу и диэтиламиногруппу.
Термин «N-(C1-6 алкил)аминокарбонил» предназначен для обозначения структуры, состоящей из N-(C1-6 алкил)аминогруппы и карбонила. Предпочтительными являются N-(C1-4 алкил)аминокарбонильные группы, включая N-метиламинокарбонил.
Термин «N,N-ди(C1-6 алкил)аминокарбонил» предназначен для определения структуры, состоящей из N,N-ди(C1-6 алкил)аминогруппы и карбонила. Предпочтительными являются N,N-(C1-4 алкил)аминокарбонильные группы, включая N,N-диметиламинокарбонил.
Примеры групп -(CH2)m-Q и -(CH2)m'-Q', где m и m' каждый представляет целое число от 1 или более, будут представлены ниже.
В случае, когда Q и Q' каждый представляет C1-6 алкокси, примеры включают метоксиметил.
В случае, когда Q и Q' каждый представляет аминогруппу, примеры включают аминометил.
В случае, когда Q и Q' каждый представляет C2-10 ацилокси, примеры включают ацетилоксиметил и бензоилоксиэтил.
В случае, когда Q и Q' каждый представляет C2-10 ациламиногруппу, примеры включают ацетиламинометил.
В случае, когда Q и Q' каждый представляет N,N-ди(C1-6 алкил)аминогруппу, примеры включают N,N-диметиламинометил.
Термин «C3-7 циклоалкил» предназначен для обозначения циклического алкила, содержащего 3-7 атомов углерода. Примеры включают циклопропил, циклобутил, циклопентил и циклогексил, предпочтительной группой является циклопропил.
Термин «C3-7 циклоалкилокси» предназначен для определения структуры, состоящей из C3-7 циклоалкила и группы -O-. Примеры включают циклопропилокси и циклопентилокси.
Термин «арил» включает фенил и нафтил (включая 1-нафтил и 2-нафтил), предпочтительно он относится к фенилу.
Термин «арилокси» предназначен для определения структуры, состоящей из арила и группы -O-. Примеры включают фенокси и нафтокси.
Термин «C7-10 аралкилокси» предназначен для обозначения структуры, состоящей из C7-10 аралкила и группы -O-. Примеры включают бензилокси и фенилэтилокси.
Термин «C7-10аралкиламиногруппа» предназначен для определения структуры, состоящей из C7-10 аралкила и группы -NH-. Примеры включают бензиламиногруппу и фенилэтиламиногруппу.
Термин «гетероарил» включает пиридил, тиазолил, изотиазолил, тиадиазолил, пиразолил, имидазолил, фурил (включая 2-фурил и 3-фурил), тиенил (включая 2-тиенил и 3-тиенил), оксазолил, изоксазолил, пирролил (включая 1-пирролил, 2-пирролил и 3-пирролил, предпочтительно 1-пирролил), триазолил, изоксазолил, пиримидинил, пиразинил, пиридазинил, хинолинил, изохинолинил, бензофуранил, бензотиазолил и бензотиенил.
Термин «4-6-членный гетероциклоалкил» относится к 4-6-членному гетероциклоалкилу, содержащему в кольце, по меньшей мере, один гетероатом (атом кислорода, атом азота или атом серы). Например, подобная группа может представлять собой циклическую аминогруппу, которая содержит в кольце один или более атомов азота и может дополнительно содержать один или более атомов кислорода и/или атомов серы. Примеры включают морфолино, пиперидинил, пиперазинил и 1-пирролидинил.
В отношении примеров гетероарила, замещенного 1-4 заместителями, будут представлены пояснения случая, когда каждый из заместителей представляет C1-6 алкил.
«Тиазолил, замещенный C1-6 алкилом(ами)» предназначен для обозначения тиазолила, в котором, по меньшей мере, один атом водорода в кольце замещен C1-6 алкилом, предпочтительно C1-4 алкилом и более предпочтительно метилом. Примеры включают 4-метилтиазолил-2-ил.
«Пиридил, замещенный C1-6 алкилом(ами)» предназначен для определения пиридила, в котором, по меньшей мере, один атом водорода в кольце замещен C1-6 алкилом, предпочтительно C1-4 алкилом и более предпочтительно метилом. Примеры включают 2-метилпиридин-5-ил.
«Пиразолил, замещенный C1-6 алкилом(ами)» предназначен для обозначения пиразолила, в котором, по меньшей мерей, один атом водорода в кольце замещен C1-6 алкилом, предпочтительно C1-4 алкилом и более предпочтительно метилом или этилом. Примеры включают 1-метилпиразол-4-ил и 1-этилпиразол-4-ил.
«Пирролил, замещенный C1-6 алкилом(ами)» предназначен для определения пирролила, в котором, по меньшей мере, один атом водорода в кольце замещен C1-6 алкилом, предпочтительно C1-4 алкилом и более предпочтительно метилом. Примеры включают 1-метилпирролил.
В отношении примеров гетероциклоалкила, замещенного 1-4 заместителями, будут представлены пояснения случая, когда каждый из заместителей представляет C1-6 алкил.
«4-C1-6алкилпиперазинил» предназначен для обозначения 1-пиперазинила, в котором атом водорода при одном атоме азота замещен C1-6 алкилом. Примеры включают 4-метилпиперазин-1-ил и 4-этилпиперазин-1-ил.
Кроме того, термин «фармацевтически приемлемая соль» предназначен для определения, например, соли щелочного металла, щелочноземельного металла, аммония, или алкиламмония, или соли минеральной кислоты, или органической кислоты. Примеры включают соль натрия, соль калия, соль кальция, соль аммония, соль алюминия, соль триэтиламмония, ацетат, пропионат, бутират, формиат, трифторацетат, малеат, тартрат, цитрат, стеарат, сукцинат, этилсукцинат, лактобионат, глюконат, глюкогептат, бензоат, метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, бензолсульфонат, п-толуолсульфонат, лаурилсульфат, малат, аспартат, глутамат, адипат, соль цистеина, соль N-ацетилцистеина, гидрохлорид, гидробромид, фосфат, сульфат, гидройодид, никотинат, оксалат, пикрат, тиоцианат, ундеканоат, акрилат и соль карбоксивинилового полимера.
Предпочтительные соединения по настоящему изобретению будут представлены ниже.
Предпочтительными примерами X являются: -(CH2)n-, где n является целым числом от 0 до 3, предпочтительно n=1, -CO(CH2)n-, где n является целым числом от 0 до 3, предпочтительно n=2 и -CONH(CH2)n-, где n является целым числом от 0 до 3, предпочтительно n=1.
Более предпочтительным X является -CH2-.
R5, R6, R7, R8 и R9 в формуле (II) могут быть одинаковыми или различными, и каждый предпочтительно представляет:
атом водорода;
атом галогена;
гидроксил;
C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группу, представленную формулой:
-(СН2)m-Q,
в которой m представляет целое число от 0 до 4 и Q представляет аминогруппу, цианогруппу, карбоксил, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C1-6 алкокси - C1-6 алкокси, C2-10 ацилокси (предпочтительно C2-4 алканоилокси), C2-10 ацил, C2-6 алкоксикарбонил, C2-10ациламиногруппу, N,N-ди(C1-6 алкил)аминогруппу или карбамоил; или
C3-7 циклоалкил или C7-10 аралкил, каждый из которых может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси.
Более предпочтительно R6 представляет атом водорода; атом галогена; гидроксил; C1-6 алкил или C1-6 алкокси, которые могут быть замещены 1-4 атомами галогена; С2-4 алканоилокси или C3-7 циклоалкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси. Еще более предпочтительно, когда R6 представляет атом водорода; атом галогена или гидроксил.
Более предпочтительно, когда R7 представляет атом водорода; атом галогена; гидроксил; C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила, или группу, представленную формулой:
-(СН2)m-Q,
в которой m представляет целое число от 0 до 4, и Q представляет карбоксил, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C2-10 ацилокси, C2-10 ацил, C2-6 алкоксикарбонил или карбамоил. Еще более предпочтительно, когда R7 представляет атом водорода; атом галогена; C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила; карбоксил или C2-6 алкоксикарбонил. Еще более предпочтительно, когда R7 представляет атом водорода или атом галогена.
Более предпочтительно, когда R8 представляет атом водорода; атом галогена; гидроксил; C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила, или группу, представленную формулой:
-(СН2)m-Q,
в которой m представляет целое число от 0 до 4 и Q представляет аминогруппу, цианогруппу, карбоксил, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C1-6 алкокси - C1-6 алкокси, C2-10ацилокси, C2-10ацил, C2-6алкоксикарбонил, C2-10 ациламиногруппу, N,N-ди(C1-6 алкил)аминогруппу или карбамоил. Еще более предпочтительно, когда R8 представляет атом водорода; атом галогена; гидроксил; C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила, или группу, представленную формулой:
-(СН2)m-Q,
в которой m представляет целое число от 0 до 4 и Q' представляет карбоксил, C1-6алкокси-C1-6алкокси, C2-4 алканоилокси или C2-6 алкоксикарбонил.
Более предпочтительно, когда R9 представляет атом водорода; атом галогена; C1-6 алкил, который может быть замещен 1-4 атомами галогена, или C7-10 аралкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси. Еще более предпочтительно, когда R9 представляет атом водорода или атом галогена.
R10 R11, R12, R13 и R14 в формуле (II) могут быть одинаковыми или различными, и каждый предпочтительно представляет:
атом водорода;
атом галогена;
гидроксил;
C1-6 алкил, который может быть замещен 1-4 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группу, представленную формулой:
-(СН2)m'-Q',
в которой m' представляет целое число от 0 до 4 и Q' представляет аминогруппу, нитрогруппу, цианогруппу, карбоксил, C1-6 алкокси, который может быть замещен 1-4 атомами галогена, C1-6 алкокси-C1-6алкокси, C2-10ацилокси, C2-10ацил, C2-6 алкоксикарбонил, C1-6алкилтио, С1-6алкилсульфинил, C1-6 алкилсульфонил, -NHC(=O)H, C2-10ациламиногруппу, C1-6алкилсульфониламиногруппу, N,N-ди(C1-6 алкил)аминогруппу, карбамоил или N,N-ди(С1-6 алкил)аминокарбонил; или
C3-7 циклоалкил, C3-7 циклоалкилокси, арил, C7-10 аралкил, арилокси, C7-10 аралкилокси, C7-10 аралкиламиногруппу, гетероарил или 4-6-членный гетероциклоалкил, при условии, что каждая из данных групп может быть замещена 1-4 заместителями, выбранными из группы, состоящей из атома галогена, гидроксила, C1-6 алкила и C1-6 алкокси.
Более предпочтительно, когда только R12 представляет любой заместитель, выбранный из предпочтительных примеров, представленных выше, и другие обозначения R10, R11, R13 и R14 каждый представляет атом водорода; атом галогена или C1-6 алкил, или C1-6 алкокси, которые могут быть замещены 1-4-атомами галогена.
Предпочтительными соединениями являются любые из перечисленных ниже:
2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид
(соединение 1);
4'-хлор-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 2);
2'-(4'-метилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 3);
2'-(4'-метоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 4);
2'-(4'-этоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 5);
2'-(4'-трифторметилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 6);
2'-(4'-этилбензил)-4'-метилфенил-5-тио-β-D-глюкопиранозид (соединение 7);
2'-(4'-этилбензил)-4'-фторфенил-5-тио-β-D-глюкопиранозид (соединение 8);
2'-(4'-фторбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 9);
4'-бром-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 10);
2'-бензилфенил-5-тио-β-D-глюкопиранозид (соединение 11);
2'-(4'-этилбензил)-4'-(гидроксиметил)фенил-5-тио-β-D-глюкопиранозид (соединение 13);
2'-(4'-этилбензил)-3'-гидроксифенил-5-тио-β-D-глюкопиранозид (соединение 14);
2'-(4'-этилбензил)-4'-метоксикарбонилфенил-5-тио-β-D-глюкопиранозид (соединение 15);
4'-карбокси-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 16);
4',6'-дибром-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 17);
2'-(4'-гидроксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 18);
2'-(4'-гидроксиэтилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 19);
2'-(4'-этилбензил)-5'-(метоксиметилокси)фенил-5-тио-β-D-глюкопиранозид (соединение 20);
2'-(4'-этилбензил)-5'-гидроксифенил-5-тио-β-D-глюкопиранозид (соединение 21);
2'-[3'-(бензофуран-5'-ил)-1'-оксопропил]-3'-гидрокси-5'-метилфенил-5-тио-β-D-глюкопиранозид (соединение 22);
2'-(4'-этилбензил)фенил 6-O-метоксикарбонил-5-тио-β-D-глюкопиранозид (соединение 23);
4',6'-дихлор-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 31);
4',6'-дифтор-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 32);
2'-(4'-этилбензил)-5'-(гидроксиметил)фенил-5-тио-β-D-глюкопиранозид (соединение 39);
4'-хлор-2'-(4'-метоксикарбонилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 40);
4'-хлор-2'-(4'-нитробензил)фенил-5-тио-β-D-глюкопиранозид (соединение 41);
2'-(4'-аминобензил)-4'-хлорфенил-5-тио-β-D-глюкопиранозид (соединение 42);
2'-(4'-пиразол-1'-илбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 43);
4'-хлор-2'-(2'-фторбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 44);
2'-(4'-бутоксибензил)-4'-хлорфенил-5-тио-β-D-глюкопиранозид (соединение 45);
2'-(4'-бутилбензил)-4'-хлорфенил-5-тио-β-D-глюкопиранозид (соединение 46);
2'-(4'-ацетиламинобензил)-4'-хлорфенил-5-тио-β-D-глюкопиранозид (соединение 47);
2'-(4'-этилтиобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 48);
4'-хлор-2'-(4'-метилсульфониламинобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 51);
4'-хлор-2'-(4'-N,N-диметиламинобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 52);
2'-(4'-гидроксиметилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 56);
2'-(2'-хлор-6'-фторбензил)-4'-хлорфенил-5-тио-β-D-глюкопиранозид (соединение 59);
4'-хлор-2'-(2',4'-дифторбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 60);
4'-хлор-2'-(3'-фторбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 61);
4'-хлор-2'-(4'-изопропилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 63);
2'-(4'-этилбензил)-5'-фторфенил-5-тио-β-D-глюкопиранозид (соединение 64);
2'-(2',4',6'-триметоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 65);
4'-хлор-2'-(2',3',5',6'-тетрафторбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 66);
4'-хлор-2'-(4'-фенилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 67);
4'-хлор-2'-(3'-трифторметоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 69);
4'-хлор-2'-(2',4'-дихлорбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 70);
4'-хлор-2'-(4'-пентилоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 72);
2'-(4'-морфолинобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 73);
2'-(4'-пиперидинобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 74);
2'-(4'-трет-бутилбензил)-4'-хлорфенил-5-тио-β-D-глюкопиранозид (соединение 75);
4'-хлор-2'-(3'-фтор-5'-трифторметилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 76);
5'-(ацетоксиметил)-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 77);
4'-хлор-2'-(2',4'-диметоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 80);
4'-хлор-2'-(2'-этоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 81);
4'-хлор-2'-(2'-метилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 82);
2'-[4'-(4'-этилпиперазил-1'-ил)бензил]фенил-5-тио-β-D-глюкопиранозид (соединение 83);
3'-гидрокси-2'-(4'-метоксибензиламинокарбонил)фенил-5-тио-β-D-глюкопиранозид (соединение 84);
2'-(4'-карбамоилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 85);
2'-(4'-N,N-диметиламинокарбонилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 86);
2'-(4'-ацетилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 88);
2'-[4'-(1'-гидроксиэтил)бензил]фенил-5-тио-β-D-глюкопиранозид (соединение 89);
2'-(4'-циклопропилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 90) и
2'-(4'-цианобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 91).
Более предпочтительными соединениями являются перечисленные ниже:
2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид
(соединение 1);
4'-хлор-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 2);
2'-(4'-метилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 3);
2'-(4'-метоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 4);
2'-(4'-этоксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 5);
2'-(4'-трифторметилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 6);
2'-(4'-этилбензил)-4'-метилфенил-5-тио-β-D-глюкопиранозид (соединение 7);
2'-(4'-этилбензил)-4'-фторфенил-5-тио-β-D-глюкопиранозид (соединение 8);
2'-(4'-фторбензил)фенил-5-тио-β-D-глюкопиранозид
(соединение 9);
4'-бром-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 10);
2'-бензилфенил 5-тио-β-D-глюкопиранозид (соединение 11);
2'-(4'-гидроксибензил)фенил-5-тио-β-D-глюкопиранозид (соединение 18);
2'-(4'-гидроксиэтилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 19);
2'-(4'-этилбензил)-5'-(метоксиметилокси)фенил-5-тио-β-D-глюкопиранозид (соединение 20);
2'-(4'-этилбензил)-5'-гидроксифенил-5-тио-β-D-глюкопиранозид (соединение 21);
2'-[3'-(бензофуран-5'-ил)-1'-оксопропил]-3'-гидрокси-5'-метилфенил-5-тио-β-D-глюкопиранозид (соединение 22);
2'-(4'-этилбензил)-5'-(гидроксиметил)фенил-5-тио-β-D-глюкопиранозид (соединение 39);
2'-(4'-пиразол-1'-илбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 43);
2'-(4'-этилтиобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 48);
5'-(ацетоксиметил)-2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 77);
3'-гидрокси-2'-(4'-метоксибензиламинокарбонил)фенил-5-тио-β-D-глюкопиранозид (соединение 84);
2'-(4'-карбамоилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 85);
2'-(4'-N,N-диметиламинокарбонилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 86);
2'-(4'-ацетилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 88);
2'-[4'-(1'-гидроксиэтил)бензил]фенил-5-тио-β-D-глюкопиранозид (соединение 89);
2'-(4'-циклопропилбензил)фенил-5-тио-β-D-глюкопиранозид (соединение 90) и
2'-(4'-цианобензил)фенил-5-тио-β-D-глюкопиранозид (соединение 91).
Соединение по настоящему изобретению позволяет ингибировать натрий-зависимый переносчик 2 глюкозы (SGLT2), принимающий участие в ресорбции глюкозы в почках (J. Clin. Invest., vol.93, p.397, 1994).
Посредством ингибирования SGLT2 соединение по настоящему изобретению предупреждает ресорбцию сахара и удаляет избыток сахара из организма для лечения таким образом диабета. Таким образом, соединение по настоящему изобретению устраняет гипергликемию без нагрузки на β-клетки поджелудочной железы и положительно изменяет резистентность к инсулину.
Таким образом, настоящее изобретение обеспечивает фармацевтический препарат для профилактики или лечения диабета или состояний, которые можно ослаблять ингибированием активности SGLT2, например диабета, связанных с диабетом заболеваний и осложнений при диабете.
Термин «диабет», используемый в описании, включает диабет типа I, диабет типа II и другие типы диабета специфической этиологии.
В том смысле, в котором он здесь используется, термин «связанные с диабетом заболевания» включают липоматоз, гиперинсулинемию, аномальный углеводный обмен, гиперлипидемию, гиперхолестеринемию, гипертриглицеридемию, аномальный липидный обмен, гипертензию, застойную сердечную недостаточность, отек, гиперурицемию и подагру.
Используемый в описании термин «осложнения при диабете» можно подразделить на острые осложнения и хронические осложнения.
Термин «острые осложнения» включает гиперглицемию (например, кетоацидоз), инфекции (например, инфекции кожи, мягких тканей, желчной системы, дыхательной системы и мочевых путей) и т.д.
Термин «хронические осложнения» включает микроангиопатию (например, нефропатию, ретинопатию), артериосклероз (например, атеросклероз, инфаркт миокарда, инсульт, окклюзию артерий нижних конечностей), невропатию (например, чувствительных нервов, моторных нервов, вегетативных нервов), гангрену конечностей и т.д.
Основными осложнениями является ретинопатия при диабете, нефропатия при диабете и невропатия при диабете.
Соединение по настоящему изобретению можно также использовать в комбинации с любым терапевтическим средством при диабете, осложнениях при диабете, гиперлипидемии или гипертензии, которое зависит от иного механизма действия, чем ингибирование активности SGLT2. В комбинации с другими препаратами можно ожидать, что соединение по настоящему изобретению будет обладать аддитивным действием в отношении данных заболеваний, которое будет выше, чем при применении одного соединения.
Примеры «терапевтического средства при диабете или осложнениях при диабете», подходящего для комбинированного применения, включают, например, сенсибилизаторы инсулина (например, агонисты PPARγ, агонисты PPARα/γ, агонисты PPARδ, агонисты PPARα/γ/δ), ингибиторы гликозидазы, бигуаниды, средства, способствующие секреции инсулина, препараты инсулина, антагонисты рецепторов глюкагона, стимуляторы рецепторных киназ инсулина, ингибиторы трипептидилпептидазы II, ингибиторы дипептидилпептидазы IV, ингибиторы протеин-тирозин-фосфатазы-1B, ингибиторы гликогенфосфорилазы, ингибиторы глюкоза-6-фосфатазы, ингибиторы глюконеогенеза, ингибиторы фруктоза-бисфосфатазы, ингибиторы пируватдегидрогеназы, активаторы глюкокиназы, D-хироинозит, ингибиторы гликоген-синтазы-киназы-3, глюкагонподобный пептид-1, аналоги глюкагонподобного пептида-1, агонисты глюкагонподобного пептида-1, амилин, аналоги амилина, агонисты амилина, антагонисты глюкокортикоидных рецепторов, ингибиторы 11β-гидроксистероиддегидрогеназы, ингибиторы альдозоредуктазы, ингибиторы протеинкиназы С, антагонисты рецепторов γ-аминомасляной кислоты, антагонисты натриевых каналов, ингибиторы фактора транскрипции NF-κB, ингибиторы IKKβ, ингибиторы пероксидазы липидов, ингибиторы N-ацетилированной-α-связанной-кислой дипептидазы, инсулинподобный фактор-I роста, тромбоцитарные факторы роста (PDGF), аналоги тромбоцитарных факторов роста (PDGF), эпидермальные факторы роста (EGF), факторы роста нервов, производные карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128 и ТАК-428.
Показательными примерами терапевтического средства при диабете или осложнениях при диабете являются следующие.
«Бигуаниды» включают метформин гидрохлорид и фенформин.
«Стимуляторы секреции инсулина» включают таковые типа сульфонилмочевины, такие как глибурид (глибенкламид), глипизид, гликлазид и хлорпропамид, а также таковые, не относящиеся к типу сульфонилмочевины, такие как натеглинид, репаглинид и митиглинид.
«Препараты инсулина» включают как рекомбинантный человеческий инсулин, так и инсулин животного происхождения. Подобные препараты можно подразделить на три группы в зависимости от продолжительности их действия: препараты короткого действия (например, человеческий инсулин, человеческий нейтральный инсулин); препараты со средней продолжительностью действия (например, водная суспензия изофан-инсулина на основе человеческого инсулина, водная суспензия изофан-инсулина на основе человеческого нейтрального инсулина, водная суспензия человеческого цинк-инсулина, водная суспензия цинк-инсулина) и препараты длительного действия (например, суспензия человеческого кристаллического цинк-инсулина).
«Ингибиторы гликозидазы» включают акарбозу, воглибозу и миглитол.
«Усилители чувствительности к инсулину» включают агонисты PPARγ, такие как троглитазон, пиоглитазон и розиглитазон, двойные агонисты PPARα/γ, такие как МК-767 (KRP-297), тезаглитазар, LM4156, LY510929, DRF-4823 и TY-51501, а также агонисты PPARδ, такие как GW-501516.
«Ингибиторы трипептидилпептидазы II» включают UCL-139.
«Ингибиторы дипептидилпептидазы IV» включают NVP-DPP728A, LAF-237, P32/98 и TSL-225.
«Ингибиторы альдозоредуктазы» включают аскорбилгамоленат, толрестат, эпалрестат, фидарестат, сорбинил, поналрестат, ризарестат и зенарестат.
«Антагонисты рецепторов γ-аминомасляной кислоты» включают топирамат.
«Антагонисты натриевых каналов» включают мексилетин гидрохлорид.
«Ингибиторы фактора транскрипции NF-κB≫ включают декслипотам.
«Ингибиторы пероксидазы липидов» включают тирилазад мезилат.
«Ингибиторы N-ацетилированной-α-связанной-кислой дипептидазы» включают GPI-5693.
«Производные карнитина» включают карнитин и левацекарнин гидрохлорид.
Примеры «терапевтического средства при гиперлипидемии или гипертензии», подходящие для комбинированного применения, включают, например, ингибиторы гидроксиметилглутарил-коэнзим-А-редуктазы, фибраты, агонисты β3-адренергических рецепторов, активаторы AMPK, ингибиторы ацил-коэнзим-А:холестерин-ацилтрансферазы, пробукол, агонисты рецепторов гормона щитовидной железы, ингибиторы всасывания холестерина, ингибиторы липазы, ингибиторы микросомальных белков-переносчиков триглицеридов, ингибиторы липоксигеназы, ингибиторы карнитинпальмитоилтрансферазы, ингибиторы скваленсинтазы, промоторы рецепторов липопротеинов низкой плотности, производные никотиновой кислоты, связывающие желчные кислоты полимеры, ингибиторы зависимого от натрия переносчика желчных кислот, ингибиторы транспортных белков эфиров холестерина, ингибиторы фермента превращения ангиотензина, антагонисты рецепторов ангиотензина II, ингибиторы фермента превращения эндотелина, антагонисты рецепторов эндотелина, диуретики, антагонисты кальция, сосудорасширяющие гипотензивные средства, симпатолитические средства, гипотензивные средства центрального действия, агонисты α2-адренергических рецепторов, антитромбоцитарные средства, ингибиторы продукции мочевой кислоты, стимуляторы выделения мочевой кислоты, подщелачиватели мочи, аноректики, ингибиторы AGE, агонисты рецепторов адипонектина, агонисты GPR40 и антагонисты GPR40.
Показательными примерами терапевтического средства при гиперлипидемии или гипертензии являются следующие.
«Ингибиторы гидроксиметилглутарил-коэнзим-А-редуктазы» включают флувастатин, ловастатин, правастатин, церивастатин и питавастатин.
«Фибраты» включают безафибрат, беклобрат и бинифибрат.
«Ингибиторы скваленсинтазы» включают ТАК-475 и производные α-фосфоносульфоната (USP5712396).
«Ингибиторы ацил-коэнзим-А:холестерин-ацилтрансферазы» включают CI-1011, NTE-122, FCE-27677, RP-73163, MCC-147 и DPU-129.
«Промоторы рецепторов липопротеинов низкой плотности» включают MD-700 и LY-295427.
«Ингибиторы микросомальных белков-переносчиков триглицеридов (ингибиторы MTP)» включают соединения, описанные, например, в патентах США USP5739135, USP5712279 и USP5760246.
«Аноректики» включают агонисты адреналина/норадреналина (например, мазиндол, эфедрин), агонисты серотонина (избирательные ингибиторы захвата серотонина, такие как флувоксамин), агонисты адреналина/серотонина (например, сибутрамин), агонисты рецепторов меланокортина 4 (MC4R), концентрирующие α-меланоциты гормоны (α-MCH), лептин, а также регулируемые кокаином и амфетамином транскрипты (CART).
«Агонисты рецепторов гормона щитовидной железы» включают натриевую соль лиотиронина и натриевую соль левотироксина.
«Ингибиторы всасывания холестерина» включают эзетимиб.
«Ингибиторы липазы» включают орлистат.
«Ингибиторы карнитинпальмитоилтрансферазы» включают этомоксир.
«Производные никотиновой кислоты» включают никотиновую кислоту, никотинамид, никомол и никорандил.
«Связывающие желчные кислоты полимеры» включают холестирамин, колестилан и колесевелам гидрохлорид.
«Ингибиторы фермента превращения ангиотензина» включают капторил, эналаприл малеат, алацеприл и килазаприл.
«Антагонисты рецепторов ангиотензина II» включают кандесартан цилексетил, калиевую соль лозартана и эпрозартан мезилат.
«Ингибиторы фермента превращения эндотелина» включают CGS-31447 и CGS-35066.
«Антагонисты рецепторов эндотелина» включают L-749805, TBC-3214 и BMS-182874.
В качестве примера при лечении диабета или тому подобное будет предпочтительным использовать соединение по настоящему изобретению в комбинации, по меньшей мере, с одним препаратом, выбранным из группы, состоящей из сенсибилизатора инсулина (например, агониста PPARγ, агониста PPARα/γ, агониста PPARδ, агониста PPARα/γ/δ), ингибитора гликозидазы, бигуанида, средства, усиливающего секрецию инсулина, препарата инсулина и ингибитора дипептидилпептидазы IV.
Альтернативно будет предпочтительным использовать соединение по настоящему изобретению в комбинации, по меньшей мере, с одним препаратом, выбранным из группы, состоящей из ингибитора гидроксиметилглутарил-коэнзим-А-редуктазы, фибрата, ингибитора скваленсинтазы, ингибитора ацил-коэнзим-А:холестерин-ацилтрансферазы, промотора рецепторов липопротеинов низкой плотности, ингибитора микросомальных белков-переносчиков триглицеридов и аноректика.
Фармацевтический препарат по настоящему изобретению можно вводить системно или применять местно пероральным или парентеральным (например, ректальным, подкожным, внутримышечным, внутривенным, чрескожным) путем.
Для применения в качестве фармацевтического препарата соединение по настоящему изобретению можно включать в состав желаемой лекарственной формы, выбранной из твердых композиций, жидких композиций и других композиций, подходящих для предназначаемой цели. Фармацевтический препарат по настоящему изобретению можно получать смешиванием соединения по настоящему изобретению с фармацевтическим приемлемым носителем(ями). Конкретнее к соединению по настоящему изобретению можно добавлять обычно применяемые наполнители, разбавители, связующие вещества, разрыхлители, вещества для покрытия, вещества для покрытия с включением сахара, регуляторы pH, солюбилизаторы, водные или неводные растворители и так далее и затем формулировать с использованием обычных методов в таблетки, пилюли, капсулы, гранулы, порошки, растворы, эмульсии, суспензии, инъекционные растворы и т.д. Примеры наполнителей и разбавителей включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, гуммиарабик, оливковое масло, кунжутное масло, какао-масло, этиленгликоль и другие, обычно используемые вещества.
Также соединения по настоящему изобретению можно модифицировать с образованием соединения включения, например, с помощью α-, β- или γ-циклодекстрина или метилированного циклодекстрина перед приготовлением препарата.
Доза соединения по настоящему изобретению будет варьироваться в зависимости от заболевания или симптома, которые лечатся, массы тела, возраста, пола, пути введения и т.д. Доза для взрослого человека предпочтительно находится в пределах от 0,1 до 1000 мг/кг массы тела/день, более предпочтительно от 0,1 до 200 мг/кг массы тела/день в виде одной дозы или разделенных доз.
Соединение по настоящему изобретению можно синтезировать, например, в соответствии со схемой получения, представленной ниже.
Ключевое промежуточное соединение 5-тио-D-глюкопиранозу (VII) можно получить в качестве примера следующим образом.


Производное пента-O-ацетата (V) (Tetrahedron Lett., vol.22, p.5061, 1981; J. Org. Chem., vol.31, p.1514, 1966) можно синтезировать восьмистадийным способом из D-глюкофурано-3,6-лактона (IV).
Затем соединение (V) можно обработать в соответствующем растворителе (например, ДМФА, ТГФ, метаноле, этаноле) с использованием гидразина ацетата (Tetrahedron, Lett., vol.33, p.7675, 1992) или бензиламина, предпочтительно смеси метилгидразин-уксусная кислота 1:1 для проведения избирательного снятия защиты с ацетильной группы в 1-м положении с получением таким образом соединения (VI). Температура реакции находится в пределах от комнатной температуры до 80°С при времени реакции от 20 мин до 24 час.
После защиты гидроксильной группы в 1-м положении соединения (VI) (например, тетрагидропиранилом) можно снять защиту с ацетильных групп и обработать C2-10 ацилхлоридом (например, C2-6 алканоилхлоридом или бензоилхлоридом) в щелочных условиях с получением таким образом производного 5-тио-D-глюкопиранозы (VII), где R21, R22, R23 и R24, которые могут быть одинаковыми или различными, каждый представляет C2-10 ацил (например, C2-6 алканоил или бензоил) (Chem. Lett., p.626, 2002).
В отношении промежуточного соединения Ar-YH, соответствующего агликону, соединение следующей формулы:
где R5, R6, R7, R8, R9 и Y имеют значения, определенные выше, которое является промежуточным соединением для соединения формулы (I), можно синтезировать при обращении к официальным публикациям: международные публикации патентов №№ WO0168660, WO0174834, WO0174835, WO0228872, WO0244192, WO0264606 и WO0311880.
В случае промежуточного соединения для соединения формулы (II), где X является -CH2-, то, например, фенол (IX) можно конденсировать с бензиловым спиртом (X) в кислых условиях с получением соединения (XI).

где R32 и R33, которые могут быть одинаковыми или различными, каждый представляет атом водорода, атом галогена или C1-6 алкил, и R10, R11, R12, R13 и R14 имеют значения, определенные выше.
Подходящей кислотой для применения при конденсации может быть, например, метансульфоновая кислота или п-толуолсульфоновая кислота. Если используется растворитель, то предпочтительным является высококипящий растворитель, такой как нитробензол. Температура реакции находится в пределах от 100°С до 200°С при времени реакции от 10 мин до 150 мин.

где волнистая линия означает любой имеющийся стереоизомер, выбранный из D-формы, L-формы и их смеси, и каждый заместитель имеет значения, определенные выше.
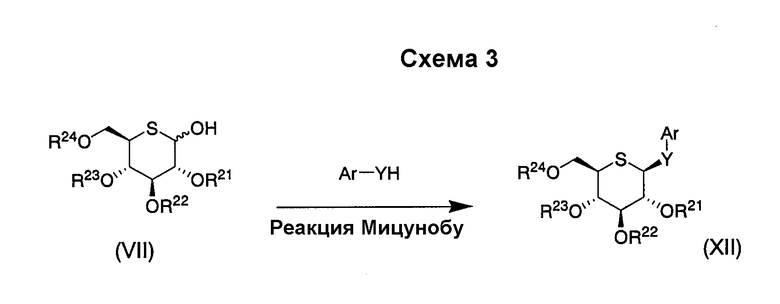
Затем производное 5-тио-D-глюкопиранозида (VI) или (VII) можно конденсировать с Ar-YH в условиях реакции Мицунобу с использованием азореагента и фосфинов (Org. Reactions, vol.42, p.335) с получением соединения (XII).
Подходящие растворители для применения в реакции Мицунобу включают тетрагидрофуран, диоксан, толуол, метиленхлорид, хлороформ, ацетонитрил, этилацетат, диметилсульфоксид и N,N-диметилформамид. Предпочтительными являются тетрагидрофуран и толуол и более предпочтительным является толуол. Фосфины, подходящие для применения, включают трифенилфосфин, три-н-бутилфосфин, три-трет-бутилфосфин, тритолилфосфин и дифенил-2-пиридилфосфин. Среди них предпочтительными являются трифенилфосфин и дифенил-2-пиридилфосфин и более предпочтительным является трифенилфосфин. Азореагенты, подходящие для применения, включают диэтилазодикарбоксилат, диизопропилазодикарбоксилат и ди-трет-бутилазодикарбоксилат, а также 1,1'-азобис(N,N-диметилформамид) и 1,1'-(азодикарбонил)дипиперидин. Среди них предпочтительными являются диэтилазодикарбоксилат и диизопропилазодикарбоксилат. Температура реакции предпочтительно находится в пределах от -20°С до комнатной температуры.
Если необходимо, затем с соединения (XII) можно снять защиту для удаления защитных групп для гидроксильных групп сахара и/или необязательно модифицировать в пролекарство с получением таким образом соединения (i) по настоящему изобретению.
Снятие защиты можно проводить с использованием основания, такого как метилат натрия, гидроокись натрия, гидроокись лития, карбонат калия, карбонат цезия или триэтиламин. Подходящие растворители для реакции включают метанол, этанол и водный раствор метанола.
Аналогичным образом модификацию в пролекарство можно проводить с использованием защитного агента для гидроксильных групп, хорошо известных специалистам в данной области (например, ангидридов кислот, хлорформиата) с превращением от -OR21 до -OR24 (где R21-R24 имеют значения, определенные выше) в от -OR1 до -OR4 (где R1-R4 каждый представляет группу, составляющую пролекарство). Растворители, подходящие для вышеуказанной реакции, включают коллидин, пиридин и N,N-диметилформамид.
Примеры «группы, составляющей пролекарство» включают защитные группы для гидроксильных групп, которые обычно можно использовать в пролекарствах, такие как C2-10 ацил, например, C2-8 алканоил (предпочтительно C2-6 алканоил) или бензоил, C2-6 алкоксикарбонил, C1-6 алкокси - C2-10 ацил (предпочтительно C1-6 алкокси - C2-6 алканоил) и C1-6 алкокси - C2-6 алкоксикарбонил.
Альтернативно при контролировании условий реакции только -OR24 может избирательно подвергаться реакции и превращаться в -OR4. В данном случае предпочтительным в качестве R4 является C2-6 алканоил, C2-6 алкоксикарбонил или тому подобное.
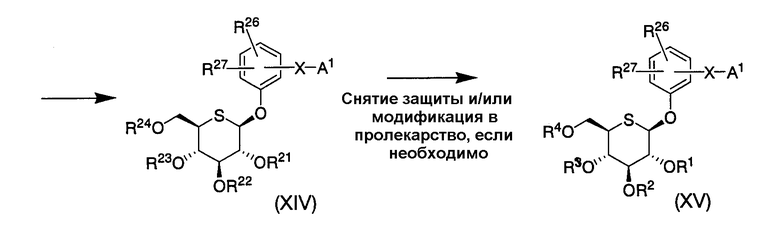
Альтернативно соединение (XV) по настоящему изобретению можно получить следующим образом.

где R1-R4, R21-R27, X и A1 имеют значения, определенные выше.
Соединение (VII) можно конденсировать с соединением (XIII) в реакции Мицунобу с получением соединения (III). Затем можно создать группу X-A1 с помощью реакции сочетания Сузуки, реакции сочетания Штилле, конденсацией с дегидратацией, альдольной конденсацией или тому подобное с получением таким образом соединения (XIV).
Например, в случае, когда R25 представляет аминогруппу, гидроксил или атом галогена, данные группы можно сочетать с необязательно замещенной арилборной кислотой (например, фенилборной кислотой) или необязательно замещенной гетероарилборной кислотой в присутствии катализатора палладия (например, Pd2(OAc)2, Pd(dba)2, dba:дибензилиденацетон, Pd(PPh3)4) или катализатора меди (например, Cu(OAc)2) с получением производного, в котором A1 представляет необязательно замещенный арил или гетероарил и X представляет -NH-, -O- или простую связь. В данной реакции катализатор медь, такой как Cu(OAc)2, является предпочтительным.
Альтернативно в случае, когда R25 представляет атом галогена, данную группу можно сочетать с необязательно замещенным арилтрибутилоловом (например, фенилтрибутилоловом) или с необязательно замещенным гетероарилтрибутилоловом в присутствии катализатора палладия (например, Pd2(OAc)2, Pd(dba)2, Pd(PPh3)4) с получением производного, в котором A1 представляет необязательно замещенный арил или гетероарил и X представляет простую связь.
Альтернативно в случае, когда R25 представляет C2-6 алканоил, то данную группу можно подвергнуть альдольной конденсации с A1-CHO (где A1 имеет значения, определенные выше) (например, формилбензофуран). Альтернативно в случае, когда R25 представляет формил, то данную группу можно обработать A1-MgBr или A1Li с получением синтетического промежуточного соединения, в котором X представляет -CHOH-.
Альтернативно в случае, когда R25 представляет аминогруппу или карбоксил, то данные группы можно конденсировать с A1-(CH2)nCO2H или A1-(CH2)nNH2, где n представляет целое число от 0 до 3, в присутствии агента для конденсации с дегидратацией, например N,N-дициклогексилкарбодиимида (DCC), водорастворимого карбодиимида гидрохлорида (WSC·HCl), карбонилдиимидазола (CDI) с получением соединения, в котором X представляет -NHCO(CH2)n или -CONH(CH2)n-, где n представляет целое число от 0 до 3.
Если необходимо, то затем с соединения (XIV) можно снять защиту для удаления защитных групп для гидроксильных групп сахара и/или необязательно модифицировать в пролекарство с получением таким образом соединения (XV) по настоящему изобретению.
ССЫЛОЧНЫЕ ПРИМЕРЫ
Ниже будет представлено получение промежуточных соединений, необходимых для получения соединений по настоящему изобретению при обращении к последующим ссылочным примерам 1-11.
Ссылочный пример 1
Получение 4-хлор-2-(4-этилбензил)фенола
Смесь 4-хлорфенола (2,0 г, 15,6 ммоль), 4-этилбензилового спирта (2,12 г, 15,6 ммоль) и метансульфоновой кислоты (80 мг, 0,83 ммоль) нагревали и перемешивали при 160°С в течение 25 мин. Реакционную смесь очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1) с получением 4-хлор-2-(4-этилбензил)фенола (1,78 г, 46%) в виде светло-желтого масла.
Ссылочный пример 2
Получение 4-бром-2-(4-этилбензил)фенола
Тот же способ, что представлен в ссылочном примере 1, повторяли с получением 4-бром-2-(4-этилбензил)фенола (35%) в виде коричневого масла.
Ссылочный пример 3
Получение 2,4-дибром-6-(4-этилбензил)фенола
Тот же способ, что представлен в ссылочном примере 1, повторяли с получением 2,4-дибром-6-(4-этилбензил)фенола (46%) в виде бесцветного порошка.
Т.пл. 90,0-91,5°С.
Альтернативно к смеси 2-(4-этилбензил)фенола (1,01 г, 4,76 ммоль) и ДМФА (5 мл) добавляли по каплям раствор N-бромсукцинимида (1,86 г, 10,5 ммоль) в ДМФА (5 мл) на льду. Через 1 час реакционную смесь разбавляли этилацетатом, промывали насыщенным водным раствором хлорида натрия и насыщенным раствором Na2S2O3 и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 80:20) с получением 2,4-дибром-6-(4-этилбензил)фенола (85%).
Т.пл. 90,0-91,5°С.
Ссылочный пример 4
Получение метил 3-(4-этилбензил)-4-гидроксибензоата
К смеси метил 4-гидроксибензоата (20 г, 131 ммоль) и метансульфоновой кислоты (80 мл) добавляли небольшими порциями гексаметилентетрамин (20 г, 144 ммоль) при комнатной температуре. После перемешивания при 100°С в течение 3,5 час добавляли концентрированную соляную кислоту (10 мл) и воду (300 мл). Реакционную смесь дважды экстрагировали этилацетатом и органическую фазу высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 80:20-65:35) с получением метил 3-формил-4-гидроксибензоата (7,24 г, 31%, т.пл. 87,5-89,0°С) в виде бесцветного порошка.
К смеси метил 3-формил-4-гидроксибензоата (4,0 г, 22,2 ммоль) и тетрагидрофурана (100 мл) при -70°С добавляли 4-этилфениллитий, который готовили перемешиванием трет-бутиллития (66 ммоль) в смеси 1-бром-4-этилбензола (12,3 г, 66 ммоль) и тетрагидрофурана (200 мл) при -70°С в течение 30 мин и перемешивали в течение 1 час. После добавления насыщенного водного раствора хлорида аммония реакционную смесь экстрагировали этилацетатом и органическую фазу промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 65:35-50:50) с получением метил 3-[(4-этилфенил)гидроксиметил]бензоата (2,92 г, 46%) в виде светло-желтой смолы.
Полученный таким образом метил 3-[(4-этилфенил)гидроксиметил]бензоат (2,88 г, 10,0 ммоль), 10% палладий-на-угле (200 мг), концентрированную соляную кислоту (0,5 мл) и метанол (15 мл) смешивали и перемешивали в атмосфере водорода при комнатной температуре в течение 14 час. После фильтрования для удаления нерастворимых веществ растворитель выпаривали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 80:20) с получением метил 3-(4-этилбензил)-4-гидроксибензоата (2,38 г, 88%) в виде бесцветного порошка.
Т.пл. 134,0-137,0°С.
Ссылочный пример 5
Получение 2-(4-этилбензил)резорцина
К смеси 1,3-диметоксибензола (6,9 г, 50 ммоль) и тетрагидрофурана (70 мл) добавляли н-бутиллитий (1,57М в гексане, 35 мл) на льду и перемешивали в течение 1,5 час. Затем добавляли на льду 4-этилбензилбромид (10 г, 50 ммоль) и перемешивали еще в течение 3,5 час. После добавления насыщенного водного раствора хлорида аммония реакционную смесь экстрагировали этилацетатом и органическую фазу промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 95:5-85:15) с получением 1,3-диметокси-2-(4-этилбензил)бензола (6,37 г, 49%, т.пл. 62,5-66,5°С) в виде светло-желтого порошка.
Смесь 1,3-диметокси-2-(4-этилбензил)бензола (6,0 г, 23,4 ммоль) и пиридина гидрохлорида (21,6 г, 187 ммоль) нагревали и перемешивали при 180°С в течение 15 час. После добавления воды реакционную смесь экстрагировали этилацетатом и органическую фазу промывали разбавленным водным раствором соляной кислоты и насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=80:20) с получением 2-(4-этилбензил)резорцина (5,2 г, 97%) в виде светло-коричневого масла.
Ссылочный пример 6
Получение 2-(4-трифторметилбензил)фенола
К смеси магния (3,44 г, 142 ммоль) и тетрагидрофурана (10 мл) добавляли 4-бромбензотрифторид (2-3 мл) при комнатной температуре. После подтверждения начала реакции добавляли по каплям дополнительное количество 4-бромбензотрифторида (в целом 20,9 г, 93,1 ммоль) в тетрагидрофуране (56 мл) и перемешивали в течение 30 мин в тех же условиях. После охлаждения реакционной смеси на льду добавляли 2-бензилоксибензальдегид (16,4 г, 77,2 ммоль) в тетрагидрофуране (20 мл) и перемешивали при комнатной температуре в течение 1час. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на нейтральном силикагеле (смесь гексан:этилацетат = 90:10=85:15) с получением 2-бензилокси-(4'-трифторметил)дифенилметанол.
Полученный таким образом 2-бензилокси-(4'-трифторметил)дифенилметанол, 10% палладий-на-угле (1,68 г), концентрированную соляную кислоту (3,4 мл) и метанол (330 мл) смешивали и перемешивали в атмосфере водорода при комнатной температуре в течение 14,5 час. После фильтрования для удаления нерастворимых веществ растворитель выпаривали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 93:7=85:15) с получением 2-(4-трифторметилбензил)фенола (17,5 г, 90%) в виде бесцветного масла.
Ссылочный пример 7
Тот же способ, что представлен в ссылочном примере 6, повторяли с получением 2-(4-фторбензил)фенола (99%) в виде бесцветного масла.
Ссылочный пример 8
Тот же способ, что представлен в ссылочном примере 6, повторяли с получением 2-(4-этилбензил)-4-метилфенола (88%) в виде желтого масла.
Ссылочный пример 9
Получение 2-(4-этилбензил)-4-фторфенола
К смеси 2-бром-4-фторфенола (24,7 г, 129 ммоль), йодида тетрабутиламмония (4,8 г, 13,0 ммоль), карбоната калия (35,9 г, 260 ммоль) и N,N-диметилформамида (390 мл) добавляли бензилбромид (23,5 г, 137 ммоль) при комнатной температуре и перемешивали в течение 1,5 час. Реакционную смесь выливали в смесь этилацетата и насыщенного водного раствора хлорида натрия и затем экстрагировали этилацетатом. Органическую фазу дважды промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 90:10-80:20) с получением 1-бензилокси-2-бром-4-фторбензола (33,0 г, 90%).
К смеси магния (3,2 г, 133 ммоль) и тетрагидрофурана (10 мл) добавляли 1-бензилокси-2-бром-4-фторбензол (2-3 мл) при комнатной температуре. После нагревания для начала реакции добавляли по каплям дополнительное количество раствора 1-бензилокси-2-бром-4-фторбензола (в целом 30,0 г, 106 ммоль) в тетрагидрофуране (60 мл) и перемешивали в течение 30 мин в тех же условиях. После охлаждения реакционной смеси на льду добавляли раствор 4-этилбензальдегида (16,4 г, 77,2 ммоль) в тетрагидрофуране (20 мл) и перемешивали при комнатной температуре в течение 3 час. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на нейтральном силикагеле (смесь гексан:этилацетат = 90:10-80:20) с получением 2-бензилокси-5-фтор-(4'-этил)дифенилметанола.
Полученный таким образом 2-бензилокси-5-фтор-(4'-этил)дифенилметанол, 10% палладий-на-угле (1,77 г), концентрированную соляную кислоту (3,5 мл) и метанол (350 мл) смешивали и перемешивали в атмосфере водорода при комнатной температуре в течение 13 час. После фильтрования для удаления нерастворимых веществ растворитель выпаривали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 90:10-80:20) с получением 2-(4-этилбензил)-4-фторфенола (21,0 г, 85%) в виде желтого масла.
Ссылочный пример 10
Получение 2-(4-ацетилбензил)фенола
Смесь 2-(4-метоксикарбонилбензил)фенола (250 мг, 1,03 ммоль), метанола (1,0 мл) и 2 М NaOH (4,0 мл) перемешивали при 75°С в течение 1 час. После охлаждения на льду pH реакционной смеси доводили до 3,0 1 М соляной кислотой. Полученный осадок экстрагировали этилацетатом и органическую фазу промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток (230 мг) растворяли в тетрагидрофуране (10 мл) с последующим добавлением N-O-диметилгидроксиамина гидрохлорида (301 мг), триэтиламина (0,456 мл), воды (0,5 мл), WSC HCl (296 мг) и НОВТ (210 мг). После перемешивания при комнатной температуре в течение 2 час к реакционной смеси добавляли насыщенный водный раствор NaHCO3. Смесь экстрагировали дважды этилацетатом и объединенные органические фазы промывали насыщенным водным раствором хлорида натрия и высушивали над безводным сульфатом магния.
После концентрирования растворителя полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 1:2) с получением 4-(2-гидробензил)-N-метокси-N-метилбензамида (250 г, 89%) в виде бесцветного масла.
Затем 4-(2-гидроксибензил)-N-метокси-N-метилбензамид (250 мг, 0,921 ммоль) растворяли в тетрагидрофуране (10 мл) с последующим добавлением бромида метилмагния (12% в ТГФ, 2,8 мл) при -20°С. Через 15 мин второй раз добавляли бромид метилмагния (12% в ТГФ, 2,5 мл) с последующим третьим добавлением бромида метилмагния (12% в ТГФ, 2,0 мл). Через 10 мин насыщенный водный раствор хлорида аммония добавляли к реакционной смеси, которую затем экстрагировали дважды этилацетатом. Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия и высушивали над безводным сульфатом магния. После концентрирования растворителя полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат =3:1) с получением указанного в заголовке соединения (110 мг, 53%) в виде бесцветного порошка.
ESI (электроионизация) m/z = 249 (M+Na).
Ссылочный пример 11
Получение 2,3,4,6-тетра-O-ацетил-5-тио-D-глюкопиранозы
К раствору 1,2,3,4,6-пента-O-ацетил-5-тио-D-глюкопиранозы (34,0 г, 0,0837 моль) в N,N-диметилформамиде (300 мл) добавляли смесь метилгидразина (6,70 мл, 0,120 ммоль), уксусной кислоты (15 мл, 0,120 ммоль) и N,N-диметилформамида (10 мл) на льду. После перемешивания при комнатной температуре в течение 2,5 час 0,5 М HCl (300 мл) добавляли на льду к реакционной смеси, которую затем экстрагировали дважды этилацетатом (250 мл). Объединенные органические фазы последовательно промывали водой (200 мл), насыщенным водным раствором NaHCO3 (100 мл), водой (100 мл) и насыщенным водным раствором хлорида натрия (100 мл) с последующим добавлением MgSO4 и активированного угля (1 г). После фильтрования для удаления нерастворимых веществ фильтрат концентрировали при пониженном давлении. Полученный остаток кристаллизовали из изопропилового эфира (70 мл) с получением 2,3,4,6-тетра-O-ацетил-5-тио-глюкопиранозы (26,9 г, 88%) в виде бесцветных кристаллов.
ПРИМЕРЫ
Далее соединения по настоящему изобретению будут описаны более подробно в последующих примерах, которые не предназначены для ограничения объема изобретения.
Пример 1
Получение 2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (100 мг, 0,274 ммоль), 2-(4-этилбензил)фенол (117 мг, 0,551 ммоль), трифенилфосфин (144 мг, 0,548 ммоль) и ТГФ (3 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазодикарбоксилат (40% в толуоле, 0,24 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 20 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 7:3) с получением указанного в заголовке соединения (12 мг, 11%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CDCl3): δ 1,20 (т, J=7,6 Гц, 3Н), 1,90 (с, 3Н), 2,01 (с, 3Н), 2,04 (с, 3Н), 2,05 (с, 3Н), 2,60 (кв, J=7,6 Гц, 2H), 3,20-3,30 (м, 1H), 3,88 (с, 2H), 4,08-4,17 (м, 1H), 4,25-4,35 (м, 1H), 5,16 (дд, J=8,9, 9,3 Гц, 1Н), 5,33 (д, J=8,6 Гц, 1H), 5,39 (дд, J=9,3, 10,4 Гц, 1H), 5,62 (дд, J=8,6, 8,9 Гц, 1H), 6,94-7,00 (м, 1H), 7,04-7,14 (м, 6H), 7,17-7,24 (м, 1H).
ESI m/z = 557 (M-H).
Т.пл. 114,0-119,0°С.
Пример 2
Получение 2'-(4'-этилбензил)-4'-хлорфенил-2,3,4,6-тетра-O-
ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 28% в виде светло-желтой смолы.
1Н-ЯМР (300 МГц, CDCl3): δ 1,21 (т, J=7,6 Гц, 3Н), 1,92 (с, 3Н), 2,01 (с, 3Н), 2,04 (с, 3Н), 2,06 (с, 3Н), 2,61 (кв, J=7,6 Гц, 2H), 3,23-3,30 (м, 1H), 3,84 (с, 2H), 4,13 (дд, J=3,7 и 8,1 Гц, 1H), 4,25-4,36 (м, 1H), 5,14 (дд, J=9,0 и 9,5 Гц, 1H), 5,28 (д, J=8,7 Гц, 1H), 5,37 (дд, J=9,5 и 10,2 Гц, 1H), 5,60 (дд, J=8,7 и 9,0 Гц, 1H), 7,00-7,20 (м, 7H).
ESI m/z = 615 (M+Na).
Пример 3
Получение 2'-(4'-метилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 14% в виде бесцветного порошка.
ESI m/z = 567 (M+Na).
Т.пл. 109,0-113,0°C.
Пример 4
Получение 2'-(4'-метоксибензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (2,00 г, 5,48 ммоль), 2-(4-метоксибензил)фенол (5,88 г, 27,4 ммоль), трифенилфосфин (2,88 г, 10,9 ммоль) и ТГФ (20 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазокарбоксилат (40% в толуоле, 4,79 г, 10,9 ммоль) на льду. После перемешивания при комнатной температуре в течение 20 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=65:35). Полученный неочищенный продукт перекристаллизовали из метанола с получением указанного в заголовке соединения (457 мг, 15%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CDCl3): δ 1,93 (с, 3H), 2,02 (с, 3H), 2,04 (с, 3H), 2,06 (с, 3H), 3,23-3,28 (м, 1H), 3,77 (с, 3H), 3,85 (с, 2H), 4,09-4,14 (м, 1H), 4,28-4,33 (м, 1H), 5,16 (дд, J=9,1, 9,3 Гц, 1H), 5,33 (д, J=8,7 Гц, 1H), 5,39 (дд, J=9,6, 10,2 Гц, 1H), 5,62 (дд, J=8,7, 9,0 Гц, 1H), 6,79-6,82 (м, 2H), 6,95-7,21 (м, 6H).
ESI m/z = 583 (M+Na).
Т.пл. 87,0-89,0°C.
Пример 5
Получение 2'-(4'-этоксибензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (2,0 г, 5,48 ммоль), 2-(4-этоксибензил)фенол (6,25 г, 27,4 ммоль), трифенилфосфин (2,88 г, 10,9 ммоль) и тетрагидрофуран (20 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазокарбоксилат (40% в толуоле, 4,79 г) на льду. После перемешивания при комнатной температуре в течение 17 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=65:35). Полученный порошок перекристаллизовали из метанола с получением указанного в заголовке соединения (598 мг, 19%) в виде бесцветного порошка.
ESI m/z = 597 (M+Na).
Т.пл. 93,0-94,5°C.
Пример 6
Получение 2'-(4'-трифторметилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (2,00 г, 5,48 ммоль), 2-(4-трифторметилбензил)фенол (6,91 г, 27,4 ммоль), трифенилфосфин (2,88 г, 10,9 ммоль) и ТГФ (20 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазокарбоксилат (40% в толуоле, 4,79 г, 10,9 ммоль) на льду. После перемешивания при комнатной температуре в течение 20 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=65:35). Полученный неочищенный продукт перекристаллизовали из метанола с получением указанного в заголовке соединения (630 мг, 19%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CDCl3): δ 1,90 (с, 3H), 2,01 (с, 3H), 2,05 (с, 6H), 3,23-3,30 (м, 1H), 3,96 (с, 2H), 4,07-4,13 (м, 1H), 4,27-4,32 (м, 1H), 5,16 (дд, J=9,0, 9,5 Гц, 1H), 5,34-5,41 (м, 2H), 5,57 (дд, J=8,5, 9,1 Гц, 1H), 7,01-7,29 (м, 6H), 7,50-7,53 (м, 2H).
ESI m/z = 621 (M+Na).
Т.пл. 144,0-145,0°C.
Пример 7
Получение 2'-(4'-этилбензил)-4'-метилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 18% в виде бесцветного порошка.
ESI m/z = 595 (M+Na).
Т.пл. 77,0-79,50°C.
Пример 8
Получение 2'-(4'-этилбензил)-4'-фторфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 23% в виде желтого аморфного вещества.
1Н-ЯМР (300 МГц, CDCl3): δ 1,22 (т,J=7,6 Гц, 3H), 1,94 (с, 3H), 2,02 (с, 3H), 2,04 (с, 3H), 2,06 (с, 3H), 2,61 (кв, J=7,6 Гц, 2H), 3,21-3,28 (м, 1H), 3,86 (с, 2H), 4,10-4,15 (м, 1H), 4,31-4,34 (м, 1H), 5,15 (дд, J=9,0 и 9,5 Гц, 1H), 5,25 (д, J=8,7 Гц, 1H), 5,39 (дд, J=9,6 и 10,3 Гц, 1H), 5,61 (дд, J=8,7 и 9,0 Гц, 1H), 6,71-7,13 (м, 7H).
ESI m/z = 599 (M+Na).
Пример 9
Получение 2'-(4'-фторбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (2,00 г, 5,48 ммоль), 2-(4-фторбензил)фенол (5,54 г, 27,4 ммоль), трифенилфосфин (2,88 г, 10,9 ммоль) и толуол (20 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазокарбоксилат (40% в толуоле, 4,79 г, 10,9 ммоль) на льду. После перемешивания при комнатной температуре в течение 20 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией (смесь гексан:этилацетат = 90:10). Полученный неочищенный продукт перекристаллизовали из метанола с получением указанного в заголовке соединения (751 мг, 25%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CDCl3): δ 1,93 (с, 3H), 2,02 (с, 3H), 2,04 (с, 3H), 2,05 (с, 3H), 3,23-3,30 (м, 1H), 3,87 (с, 2H), 4,09-4,14 (м, 1H), 4,27-4,33 (м, 1H), 5,16 (дд, J=9,0, 9,4 Гц, 1H), 5,33-5,41 (м, 2H), 5,59 (дд, J=8,7, 9,0 Гц, 1H), 6,91-7,26 (м, 8H).
ESI m/z = 571 (M+Na).
Т.пл. 99,0-103,0°C.
Пример 10
Получение 4'-бром-2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 36% в виде желтого аморфного вещества.
1Н-ЯМР (300 МГц, CDCl3): δ 1,21 (т, J=7,6 Гц, 3H), 1,91 (с, 3H), 2,01 (с, 3H), 2,04 (с, 3H), 2,06 (с, 3H), 2,61 (кв, J=7,6 Гц, 2H), 3,25-3,30 (м, 1H), 3,84 (с, 2H), 4,10-4,15 (м, 1H), 4,27-4,33 (м, 1H), 5,15 (дд, J=8,5 и 8,7 Гц, 1H), 5,38 (т, J=8,9 Гц, 1H), 5,60 (дд, J=8,7 и 8,9 Гц, 1H), 6,98-7,32 (м, 7H).
ESI m/z = 639 (M+Na).
Пример 11
Получение 2'-бензилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 18% в виде бесцветного порошка.
ESI m/z = 553 (M+Na).
Т.пл. 124,5-125,5°C.
Пример 12
Получение 3'-ацетокси-2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (1,29 г, 3,54 ммоль), 2-(4-этилбензил)резорцин (2,42 г, 10,6 ммоль), трифенилфосфин (1,86 г, 7,09 ммоль) и толуол (13 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диизопропилазодикарбоксилат (40% в толуоле, 3,58 г) на льду. После перемешивания при комнатной температуре в течение 24 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат =65:35-50:50) с получением неочищенного продукта 3-гидрокси-2-(4-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (338 мг). К смеси данного неочищенного продукта (338 мг) и пиридина (2 мл) добавляли уксусный ангидрид (0,5 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 20 час добавляли воду к реакционной смеси, которую затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=2:1) с получением указанного в заголовке соединения (134 мг, 6%) в виде светло-желтой смолы.
1Н-ЯМР (300 МГц, CDCl3): δ 1,18 (т, J=7,6 Гц, 3H), 1,83 (с, 3H), 1,99 (с, 3H), 2,04 (с, 3H), 2,06 (с, 3H), 2,16 (с, 3H), 2,57 (кв, J=7,6 Гц, 2H), 3,24-3,30 (м, 1H), 3,75-3,90 (м, 2H), 4,10 (дд, J=3,8 и 12,0 Гц, 1H), 4,29 (дд, J=5,2 и 12,0 Гц, 1H), 5,14 (дд, J=8,8 и 9,3 Гц, 1H), 5,32 (д, J=8,7 Гц, 1H), 5,36 (дд, J=9,5 и 10,0 Гц, 1H), 5,58 (дд, J=8,7 и 9,1 Гц, 1H), 6,82 (д, J=8,2 Гц, 1H), 6,98-7,07 (м, 5H), 7,20-7,30 (м, 1H).
ESI m/z = 639 (M+Na).
Пример 13
Получение 2'-(4'-этилбензил)-4'-метоксикарбонилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (1,0 г, 2,74 ммоль), метил 3-(4-этилбензил)-4-гидроксибензоат (2,23 г, 8,25 ммоль), трифенилфосфин (1,44 г, 5,48 ммоль) и толуол (5 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диизопропилазодикарбоксилат (40% в толуоле, 2,77 г) на льду. После перемешивания при комнатной температуре в течение 17 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=65:35-50:50) с получением указанного в заголовке соединения (646 мг, 38%) в виде бесцветного аморфного вещества.
1Н-ЯМР (300 МГц, CDCl3): δ 1,20 (т, J=7,6 Гц, 3H), 1,88 (с, 3H), 2,01 (с, 3H), 2,04 (с, 3H), 2,05 (с, 3H), 2,59 (кв, J=7,6 Гц, 2H), 3,27-3,35 (м, 1H), 3,86 (с, 3H), 3,89 (с, 2H), 4,13 (дд, J=3,9 и 12,0 Гц, 1H), 4,30 (дд, J=5,4 и 12,0 Гц, 1H), 5,17 (дд, J=8,8 и 9,3 Гц, 1H), 5,40 (дд, J=9,3 и 10,3 Гц, 1H), 5,40 (д, J=8,5 Гц, 1H), 5,61 (дд, J=8,5 и 8,8 Гц, 1H), 7,03-7,11 (м, 4H), 7,13 (д, J=8,7 Гц, 1H), 7,83 (д, J=2,2 Гц, 1Н), 7,92 (д, J=2,2 и 8,7 Гц, 1H).
ESI m/z = 639 (M+Na).
Пример 14
Получение 4',6'-дибром-2'-(4'-этилбензил)фенил-2,3,4,6-
тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (510 мг, 1,4 ммоль), 4,6-дибром-2-(4-этилбензил)фенол (1,05 г, 2,8 ммоль), трифенилфосфин (550 мг, 2,1 ммоль) и толуол (8 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диизопропилазодикарбоксилат (40% в толуоле, 1,06 г, 2,1 ммоль) на льду. После перемешивания при комнатной температуре в течение 12 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=7:3) с получением указанного в заголовке соединения (550 мг, 55%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CDCl3): δ 1,23 (т, J=7,5 Гц, 3H), 2,02 (с, 3H), 2,03 (с, 3H), 2,05 (с, 3H), 2,06 (с, 3H), 2,63 (кв, J=7,5 Гц, 2H), 2,95 (м, 1H), (м, 1H), 3,92 (д, J=15,6 Гц, 1H), 4,02 (дд, J=3,3, 12,1 Гц, 1H), 4,12 (д, J=15,6 Гц, 1H), 4,31 (дд, J=5,1, 12,1 Гц, 1H), 5,11 (т, J=9,2 Гц, 1H), 5,34 (дд, J=9,2, 10,7 Гц, 1H), 5,52 (д, J=9,2 Гц, 1H), 5,71 (т, J=9,2 Гц, 1H), 7,07-7,17 (м, 5H), 7,56 (д, J=2,4 Гц, 1H).
ESI m/z = 737, 739, 740, 742 (M+Na).
Т.пл. 152,0-155,0°C.
Пример 15
Получение 2'-(4'-бензоилоксибензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 16% в виде бесцветного аморфного вещества.
1Н-ЯМР (300 МГц, CDCl3): δ 1,94 (с, 3H), 2,03 (с, 3H), 2,06 (с, 3H), 2,08 (с, 3H), 3,26-3,30 (м, 1H), 3,94 (с, 2H), 4,10-4,16 (м, 1H), 4,29-4,34 (м, 1H), 5,18 (дд, J=8,7 и 9,0 Гц, 1H), 5,34-5,40 (м, 2H), 5,62 (дд, J=8,5 и 9,0 Гц, 1H), 7,00-7,27 (м, 8H), 7,47-7,63 (м, 3H), 8,17-8,20 (м, 2H).
ESI m/z = 673 (M+Na).
Пример 16
Получение 2'-[4'-(2'-бензоилоксиэтил)бензил]фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): δ 1,90 (с, 3H), 2,01 (с, 3H), 2,05 (с, 3H), 2,08 (с, 3H), 3,04 (т, J=7,0 Гц, 2H), 3,28-3,30 (м, 1H), 3,90 (с, 2H), 4,10-4,17 (м, 1H), 4,28-4,47 (м, 1H), 4,50 (т, J=7,0 Гц, 2H), 5,13-5,19 (м, 1H), 5,32-5,39 (м, 2H), 5,62 (дд, J=8,7 и 8,9 Гц, 1H), 6,97-7,27 (м, 8H), 7,40-7,55 (м, 3H), 7,99-8,03 (м, 2H).
ESI m/z = 701 (M+Na).
Пример 17
Получение 2'-(4'-этилбензил)-5'-(метоксиметилокси)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
Тот же способ, что представлен в примере 1, повторяли с получением указанного в заголовке соединения с выходом 23% в виде бесцветной смолы.
1Н-ЯМР (300 МГц, CDCl3): δ 1,20 (т, J=7,6 Гц, 3Н), 1,90 (с, 3Н), 2,00 (с, 3Н), 2,04 (с, 3Н), 2,06 (с, 3Н), 2,59 (кв, J=7,6 Гц, 2H), 3,21-3,31 (м, 1H), 3,48 (с, 3Н), 3,81 (с, 2H), 4,13 (дд, J=3,7 и 11,8 Гц, 1H), 4,31 (дд, J=5,1 и 11,8 Гц, 1H), 5,12-5,20 (м, 1H), 5,15 (с, 2H), 5,28 (д, J=8,7 Гц, 1H), 5,38 (дд, J=9,5 и 10,3 Гц, 1H), 5,60 (дд, J=8,7 и 9,0 Гц, 1H), 6,68 (дд, J=2,3 и 8,4 Гц, 1H), 6,83 (д, J=2,3 Гц, 1H), 6,96 (д, J=8,4 Гц, 1H), 7,02-7,11 (м, 4H).
ESI m/z = 641 (M+Na).
Пример 18
Получение 4'-бром-2'-бензоилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (200 мг, 0,549 ммоль), 4-бром-2-бензоилфенил (773 мг, 2,79 ммоль), трифенилфосфин (191 мг, 1,10 ммоль) и толуол (1,6 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазодикарбоксилат (40% в толуоле, 0,48 мл, 1,10 ммоль) на льду. После перемешивания при комнатной температуре в течение 12 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=7:3) с получением указанного в заголовке соединения.
1Н-ЯМР (300 МГц, CDCl3): δ 1,89 (с, 3H), 1,94 (с, 3H), 2,01 (с, 3H), 2,06 (с, 3H), 3,23 (м, 1H), 4,08-4,14 (м, 2H), 5,16-5,25 (м, 3H), 7,19 (д, J=8,9 Гц, 1H), 7,43-7,48 (м, 3H), 7,57-7,61 (м, 2H), 7,74-7,77 (м, 2H).
ESI m/z = 645, 647 (M+Na).
Пример 19
Получение 4'-хлор-2'-бензилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (200 мг, 0,549 ммоль), 4-хлор-2-бензилфенил (601 мг, 2,75 ммоль), трифенилфосфин (191 мг, 1,10 ммоль) и толуол (1,6 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазодикарбоксилат (40% в толуоле, 0,48 мл, 1,10 ммоль) на льду. После перемешивания при комнатной температуре в течение 12 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 7:3) с получением указанного в заголовке соединения (173 мг, 56%).
1Н-ЯМР (300 МГц, CDCl3): δ 1,91 (с, 3H), 2,01 (с, 3H), 2,05 (с, 3H), 2,06 (с, 3H), 3,28 (м, 1H), 3,88 (с, 2H), 4,14 (дд, J=3,7, 12,0 Гц, 1H), 4,30 (дд, J=5,3, 12,0 Гц, 1H), 5,16 (дд, J=8,8, 9,5 Гц, 1H), 5,31 (д, J=8,6 Гц, 1H), 5,39 (дд, J=9,5, 10,3 Гц, 1H), 5,60 (дд, J=8,6, 8,8 Гц, 1H), 7,03-7,35 (м, 8H).
ESI m/z = 587, 589 (M+Na).
Т.пл. 111,0-114,0°C.
Пример 20
Получение 2'-(4'-этилбензил)фенил-2,4,6-три-O-пивалоил-5-тио-β-D-глюкопиранозида
2,4,6-Три-O-пивалоил-5-тио-D-глюкопиранозу (200 мг, 0,446 ммоль), 2-(4-этилбензил)фенол (473 мг, 2,23 ммоль), трифенилфосфин (155 мг, 0,892 ммоль) и ТГФ (1,6 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазодикарбоксилат (40% в толуоле, 0,39 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 10 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1) с получением указанного в заголовке соединения (91 мг, 32%).
1Н-ЯМР (300 МГц, CDCl3): δ 1,16 (с, 9H), 1,19 (с, 9H), 1,23 (с, 9H), 2,60 (кв, J=7,7 Гц, 2H), 3,25 (м, 1H), 3,62 (дд, J=8,6, 9,2 Гц, 1H), 3,83 (д, J=15 Гц, 1H), 3,93 (д, J=15 Гц, 1H), 4,22 (м, 2H), 5,27 (дд, J=9,2, 10,6 Гц, 1H), 5,37 (д, J=8,6 Гц, 1H), 5,49 (т, J=8,6 Гц, 1H), 6,92-7,20 (т, 8Н).
ESI m/z = 665 (M+Na).
Пример 21
Получение 2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-бензоил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-бензоил-5-тио-D-глюкопиранозу (200 мг, 0,33 ммоль), 2-(4-этилбензил)фенол (347 мг, 1,63 ммоль), трифенилфосфин (171 мг, 0,65 ммоль) и толуол (2 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диэтилазодикарбоксилат (40% в толуоле, 284 мг) при комнатной температуре. После перемешивания при комнатной температуре в течение 16,5 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1) с получением указанного в заголовке соединения (41 мг, 15%) в виде бесцветного аморфного вещества.
1Н-ЯМР (300 МГц, CDCl3): δ 1,16 (т, J=7,6 Гц, 3H), 2,53 (кв, J=7,6 Гц, 2H), 3,70-3,80 (м, 1H), 3,76 (д, J=15,5 Гц, 1H), 3,87 (д, J=15,5 Гц, 1H), 4,54 (дд, J=5,1 и 12,0 Гц, 1H), 4,65 (дд, J=4,5 и 12,0 Гц, 1H), 5,65 (д, J=8,4 Гц, 1H), 5,84 (дд, J=9,1 и 9,5 Гц, 1H), 6,03 (дд, J=9,5 и 10,0 Гц, 1H), 6,17 (дд, J=8,4 и 9,1 Гц, 1H), 6,85-7,60 (м, 20H), 7,70-8,05 (м, 8H).
ESI m/z = 829 (M+Na).
Пример 22
Получение 5'-ацетилоксиметил-2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (1,0 г, 2,7 ммоль), 5-ацетилоксиметил-2-(4-этилбензил)фенол (1,5 г, 5,3 ммоль), трифенилфосфин (941 мг, 5,4 ммоль) и толуол (5 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диизопропилазодикарбоксилат (40% в толуоле, 3,2 мл) на льду. После перемешивания при комнатной температуре в течение 22 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 6:4) с получением указанного в заголовке соединения (670 мг, 39%) в виде бесцветного аморфного вещества.
1Н-ЯМР (200 МГц, CDCl3): δ 1,20 (т, J=7,7 Гц, 3H), 1,99 (с, 3H), 2,01(с, 3H), 2,05 (с, 3H), 2,06 (с, 3H), 2,11 (с, 3H), 2,60 (кв, J=7,7 Гц, 2H), 3,29 (ддд, J=4,0, 5,2, 10,1 Гц, 1H), 3,86-3,92 (м, 2H), 4,13 (дд, J=4,0, 12,0 Гц, 1H), 4,31 (дд, J=5,2, 12,0 Гц, 1H), 5,05-5,07 (м, 2Н), 5,17 (дд, J=8,8, 9,4 Гц, 1H), 5,33 (д, J=8,8 Гц, 1H), 5,40 (дд, J=9,4, 10,1 Гц, 1H), 5,61 (д, J=8,8 Гц, 1H), 6,95-7,15 (м, 7H).
ESI m/z = 653 (M+Na).
Пример 23 (соединение 1)
Получение 2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозида
К смеси 2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (310 мг, 0,555 ммоль) и метанола (5 мл) добавляли метилат натрия (30 мг, 0,555 ммоль) и перемешивали при комнатной температуре в течение 10 час. После добавления ионообменной смолы Dowex-50 Wx8 реакционную смесь нейтрализовали и фильтровали. Полученный фильтрат концентрировали и остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол = 20:1) с получением указанного в заголовке соединения (170 мг, 78%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, MeOH-d4): δ 1,19 (т, J=7,3 Гц, 3H), 2,58 (кв, J=7,3 Гц, 2H), 2,88-2,95 (м, 1H), 3,29-3,31 (м, 1H), 3,55-3,60 (м, 1H), 3,74-3,83 (м, 2H), 3,90-3,93 (м, 1H), 3,97-3,99 (м, 2H), 5,17 (д, J=8,5 Гц, 1H), 6,91 (дт, J=1,2, 7,4 Гц, 1H), 7,10-7,19 (м, 6H), 7,27 (д, J=7,9 Гц, 1H).
ESI m/z = 389 (M-Н).
Т.пл. 154,0-160,0°C.
Пример 24 (соединение 1)
Получение 2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозида
4',6'-Дибром-2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозид (410 мг, 0,572 ммоль), карбонат калия (158 мг, 1,15 ммоль), 10% палладий-на-угле (50% влажный, 200 мг) и метанол (20 мл) смешивали и перемешивали в атмосфере водорода при комнатной температуре в течение 20 час. Реакционную смесь фильтровали через целит для удаления нерастворимых веществ и фильтрат концентрировали. Полученный остаток перекристаллизовали из смеси метанол/вода с получением указанного в заголовке соединения (177 мг, 79%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, MeOH-d4): δ 1,19 (т, J=7,3 Гц, 3H), 2,58 (кв, J=7,3 Гц, 2H), 2,88-2,95 (м, 1H), 3,29-3,31 (м, 1H), 3,55-3,60 (м, 1H), 3,74-3,83 (м, 2H), 3,90-3,93 (м, 1H), 3,97-3,99 (м, 2H), 5,17 (д, J=8,5 Гц, 1H), 6,91 (дт, J=1,2, 7,4 Гц, 1H), 7,10-7,19 (м, 6H), 7,27 (д, J=7,9 Гц, 1Н).
ESI m/z = 389 (M-Н).
Т.пл. 156,5-157,5°C.
Пример 25 (соединение 13)
Получение 2'-(4'-этилбензил)-4'-(гидроксиметил)фенил-5-тио-β-D-глюкопиранозида
К смеси алюмогидрида лития (90 мг, 2,37 ммоль) и тетрагидрофурана (5 мл) добавляли раствор 2'-(4'-этилбензил)-4'-(метоксикарбонил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (293 мг, 0,475 ммоль) в тетрагидрофуране (10 мл) на льду и перемешивали при комнатной температуре в течение 2 час. После добавления небольшого количества этилацетата и воды реакционную смесь перемешивали, экстрагировали хлороформом и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол=9:1) с получением указанного в заголовке соединения (55 мг, 28%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CD3OD): δ 1,19 (т, J=7,6 Гц, 3Н), 2,57 (кв, J=7,6 Гц, 2H), 2,87-2,95 (м, 1H), 3,28-3,33 (м, 1H), 3,57 (дд, J=8,9 и 10,3 Гц, 1H), 3,73-3,83 (м, 2H), 3,88-4,03 (м, 3Н), 4,47 (с, 2H), 5,17 (д, J=8,7 Гц, 1H), 7,04-7,19 (м, 6H), 7,25 (д, J=8,4 Гц, 1H).
ESI m/z = 443 (M+Na).
Т.пл. 202,5-205,0°C.
Пример 26 (соединение 21)
Получение 2'-(4'-этилбензил)-5'-гидроксифенил-5-тио-β-D-
глюкопиранозида
Смесь 2'-(4'-этилбензил)-5'-(метоксиметилокси)фенил-5-тио-β-D-глюкопиранозида (115 мг, 0,255 ммоль) и п-толуолсульфоновой кислоты моногидрата (15 мг, 0,09 ммоль) перемешивали при комнатной температуре в течение 23 час и затем при 50°С в течение 1 час с последующим добавлением п-толуолсульфоновой кислоты моногидрата (23 мг, 0,13 ммоль) и дополнительным перемешиванием при 50°С в течение 5 час. После добавления триэтиламина (0,5 мл) реакционную смесь упаривали при пониженном давлении для удаления растворителя и полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол = 20:1-9:1) с получением указанного в заголовке соединения (85 мг, 82%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CD3OD): δ 1,19 (т, J=7,6 Гц, 3Н), 2,57 (кв, J=7,6 Гц, 2H), 2,85-2,94 (м, 1H), 3,24-3,33 (м, 1H), 3,56 (дд, J=9,0 и 10,3 Гц, 1H), 3,73-3,90 (м, 4H), 3,92 (дд, J=3,7 и 7,8 Гц, 1H), 5,08 (д, J=8,7 Гц, 1H), 6,37 (дд, J=2,3 и 8,2 Гц, 1H), 6,76 (д, J=2,3 Гц, 1H), 6,83 (д, J=8,2 Гц, 1H), 7,00-7,10 (м, 4H).
ESI m/z = 429 (M+Na).
Т.пл. 172,0-173,5°C.
Пример 27 (соединение 23)
Получение 2'-(4'-этилбензил)фенил-6-O-метоксикарбонил-5-тио-β-D-глюкопиранозида
К смеси 2'-(4'-этилбензил)фенил-5-тио-β-D-глюкопиранозида (500 мг, 1,33 ммоль) и 2,4,6-коллидина (5 мл) добавляли раствор метилхлорформиата (151 мг, 1,6 ммоль) в метиленхлориде (0,5 мл) при -40°С. Затем реакционную смесь подогревали до -10°С в течение 1 час и перемешивали при комнатной температуре в течение 2,5 час. Реакционную смесь выливали в охлажденный на льду 10% водный раствор соляной кислоты и экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и затем высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол = 30:1-20:1-10:1) с получением указанного в заголовке соединения (340 мг, 59%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CD3OD): δ 1,19 (т, J=7,6 Гц, 3Н), 2,58 (кв, J=7,6 Гц, 2H), 3,04-3,14 (м, 1H), 3,26-3,34 (м, 1H), 3,57 (дд, J=9,2 и 10,3 Гц, 1H), 3,74 (с, 3H), 3,76-3,85 (м, 1H), 3,92 (д, J=14,0 Гц, 1H), 3,99 (д, J=14,0 ГЦ, 1H), 4,35 (дд, J=6,2 и 11,3 Гц, 1H), 4,48 (дд, J=3,3 и 11,3 Гц, 1H), 5,19 (д, J=8,7 Гц, 1H), 6,88-6,95 (м, 1H), 7,02-7,28 (м, 7H).
ESI m/z = 471 (M+Na).
Т.пл. 102,0-104,5°C.
Пример 28 (соединение 39)
Получение 2'-(4'-этилбензил)-5'-(гидроксиметил)фенил-5-тио-β-D-глюкопиранозида
Смесь 5'-ацетилоксиметил-2'-(4'-этилбензил)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (660 мг, 1,05 ммоль) и смеси метанол:триэтиламин:вода (5:1:1,6 мл) перемешивали при комнатной температуре в течение 12 час. Реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол = 8:1) с получением указанного в заголовке соединения (120 мг, 27%) в виде бесцветного порошка.
1Н-ЯМР (300 МГц, CD3OD): δ 1,19 (т, J=7,6 Гц, 3Н), 2,57 (кв, J=7,6 Гц, 2H), 2,92 (ддд, J=3,6, 6,2, 10,2 Гц, 1H), 3,57 (дд, J=9,0, 10,2 Гц, 1H), 3,76 (дд, J=6,2, 11,3 Гц, 1H), 3,81 (т, J=8,9 Гц, 1H), 3,90-4,01 (м, 3Н), 4,57 (с, 2H), 5,19 (д, J=8,7 Гц, 1H), 6, 91, (м, 1H), 7,01 (м, 1H), 7,06 (м, JАВ=8,3 Гц, 2H), 7,10 (м, JАВ=8,3 Гц, 2H), 7,29 (с, 1H).
ESI m/z = 443 (M+Na).
Т.пл. 206,0-211,0°C.
Пример 29 (соединение 22)
Получение 2'-[3'-(бензофуран-5'-ил)-1'-оксопропил]-3'-
гидрокси-5'-метилфенил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-β-D-глюкопиранозу (200 мг, 0,55 ммоль), 2-ацетил-5-метилрезорцин (182 мг, 1,10 ммоль), трифенилфосфин (288 мг, 1,10 ммоль) и толуол (2 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диизопропилазодикарбоксилат (40% в толуоле, 555 мг) на льду. После перемешивания при комнатной температуре в течение 18 час реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат =70:30-50:50) с получением 2-ацетил-3-гидрокси-5-метилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (82 мг, 28%) в виде светло-желтого порошка.
1H ЯМР (300 МГц, CDCl3): δ2,00 (с, 3H), 2,03 (с, 3H), 2,05 (с, 3H), 2,07 (с, 3H), 2,34 (с, 3H), 2,61 (с, 3H), 3,30-3,38 (м, 1H), 3,86 (с, 3H), 4,15 (дд, J=3,4 и 12,0 Гц, 1H), 4,35 (дд, J=5,0 и 12,0 Гц, 1H), 5,20 (дд, J=9,1 и 9,4 Гц, 1H), 5,39 (дд, J=9,4 и 9,6 Гц, 1H), 5,52 (д, J=8,9 Гц, 1H), 5,63 (дд, J=8,9 и 9,1 Гц, 1H), 6,42 (с, 1H), 6,50 (с, 1H), 13,14 (с, 1H).
ESI m/z = 535 (M+Na).
Т.пл. 162,5-164,5°C.
Затем к смеси 2'-ацетил-3'-гидрокси-5'-метилфенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (400 мг, 0,76 ммоль) и этанола (4 мл) добавляли 50% водный раствор гидроокиси калия (450 мкл) при комнатной температуре. После перемешивания при комнатной температуре в течение 5мин добавляли 5-формилбензофуран (125 мг, 0,86 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение еще 22 час добавляли 4-(N,N-диметиламино)пиридин (93 мг, 0,76 ммоль) и 10% палладий-на-угле (100 мг) и перемешивали в атмосфере водорода при комнатной температуре в течение 17,5 час. После фильтрования для удаления нерастворимых веществ фильтрат нейтрализовали 10% соляной кислотой и вновь фильтровали для удаления образовавшихся нерастворимых веществ. Фильтрат экстрагировали этилацетатом и высушивали над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол = 10:1) с получением 2'-[3'-бензофуран-5'-ил)-1'-оксо-2-пропенил]-3'-гидрокси-5'-метилфенил-5-тио-β-D-глюкопиранозида (116 мг, 33%) в виде светло-желтого порошка.
Т.пл. 170,5-177,5°C.
К смеси полученного таким образом 2'-[3'-(бензофуран-5'-ил)-1'-оксо-2-пропенил]-3'-гидрокси-5'-метилфенил 5-тио-β-D-глюкопиранозида (105 мг, 0,23 ммоль) и метанола (5 мл) добавляли 10% палладий-на-угле (100 мг) и перемешивали в атмосфере водорода при комнатной температуре в течение 19 час. После фильтрования для удаления нерастворимых веществ фильтрат упаривали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол =10:1-9:1) с получением указанного в заголовке соединения (47 мг, 43%).
1H ЯМР (300 МГц, ДМСО-d6) δ: 2,27 (с, 3Н), 2,90-3,02 (м, 2H), 3,08-3,18 (м, 1H), 3,27-3,40 (м, 3Н), 3,52-3,60 (м, 2H), 3,75-3,85 (м, 1H), 4,06-4,13 (м, 1H), 4,73 (т, J=5,4 Гц, 1H), 5,04 (д, J=4,8 Гц, 1H), 5,09 (д, J=4,5 Гц, 1H), 5,36 (д, J=8,9 Гц, 1H), 5,44 (д, J=4,7 Гц, 1H), 6,38 (с, 1H), 6,71 (с, 1H), 6,88 (дд, J=0,9 и 2,2 Гц, 1H), 7,21 (дд, J=1,7 и 8,4 Гц, 1H), 7,47 (д, J=8,4 Гц, 1H), 7,52-7,56 (м, 1H), 7,94 (д, J=2,2 Гц, 1H), 11,88 (ушир.с, 1H).
ESI m/z = 497 (M+Na).
Т.пл. 171,0-175,0°C.
Пример 30 (соединение 34)
2'-(п-Толуидино)фенил-5-тио-β-D-глюкопиранозида
2,3,4,6-Тетра-O-ацетил-5-тио-D-глюкопиранозу (500 мг, 1,37 ммоль), 2-нитрофенол (382 мг, 2,74 ммоль), трифенилфосфин (477 мг, 2,74 ммоль) и толуол (2,5 мл) смешивали и затем к полученной смеси медленно по каплям добавляли диизопропилазодикарбоксилат (40% в толуоле, 1,62 мл) на льду. После перемешивания при комнатной температуре в течение 5,5 час, реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат =70:30) с получением 2'-нитрофенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (445 мг, 67%) в виде светло-желтого порошка.
ESI m/z = 508 (M+Na).
Т.пл. 170,0-171,5°C.
Затем 2'-нитрофенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозид (445 мг, 0,917 ммоль), метанол (4 мл) и 10% палладий-на-угле (40 мг) смешивали и перемешивали в атмосфере водорода при комнатной температуре в течение 24 час. После фильтрования для удаления нерастворимых веществ фильтрат упаривали при пониженном давлении с получением 2'-аминофенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (281 мг, 82%) в виде светло-коричневого аморфного вещества.
ESI m/z = 478 (M+Na).
Затем 2'-аминофенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозид (65 мг, 0,143 ммоль), 4-метилфенилборную кислоту (19 мг, 0,143 ммоль), Cu(OAc)2 (26 мг, 0,143 ммоль), молекулярные сита 4Å (1 г) и толуол (1 мл) смешивали и перемешивали в течение 3мин с последующим добавлением триэтиламина (78 мкл, 0,715 ммоль) и пиридина (56 мкл, 0,715 ммоль). Перемешивание продолжали при комнатной температуре в течение 21 час. После фильтрования для удаления нерастворимых веществ фильтрат упаривали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (смесь гексан:этилацетат=2:1) с получением 2'-(п-толуидино)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (67 мг, 86%).
ESI m/z = 568 (M+Na).
Т.пл. 112,0-115,0°C.
Затем к смеси 2'-(п-толуидино)фенил-2,3,4,6-тетра-O-ацетил-5-тио-β-D-глюкопиранозида (67 мг, 0,123 ммоль) и метанола (1,0 мл) добавляли 1 М NaOMe (12 мкл, 0,012 ммоль) и перемешивали при комнатной температуре в течение 3 час. Реакционную смесь нейтрализовали сухим льдом и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол=10:1) с получением указанного в заголовке соединения (24 мг, 53%).
1H ЯМР (300 МГц, CD3OD): δ 2,27 (с, 3Н), 2,89 (м, 1Н), 3,27 (т, J=9,0 Гц, 1H), 3,57 (т, J=9,0, 10,2 Гц, 1H), 3,80 (м, 1H), 3,84 (т, J=9,0 Гц, 1H), 3,93 (м, 1H), 4,96 (д, J=9,0 Гц, 1H), 6,74 (м, 1H), 6,90 (м, 1H), 7,05 (м, 4H), 7,17 (м, 1H), 7,24 (м, 1H).
ESI m/z = 400 (M+Na).
Т.пл. 152,0-153,0°C.
С использованием соответствующих исходных веществ и реагентов повторяли те же способы, что представлены в вышеуказанных примерах, с получением следующих соединений по настоящему изобретению, которые суммированы в таблице 1 ниже, наряду с соединениями, полученными в вышеуказанных примерах.

ESI m/z=389 (М-H).
Т.пл. 154,0-169,0°С.
ESI m/z = 423 (М-H).
Т.пл. 173,5-177,5°C.
ESI m/z=399 (М+Na).
Т.пл. 184,0-186,0°C.
ESI m/z=415 (М+Na).
Т.пл.166,0-167,5°C.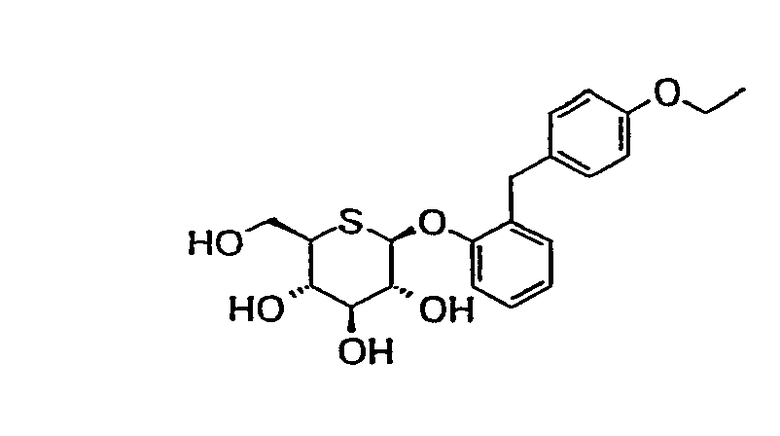
ESI m/z=429 (М+Na).
Т.пл. 182,0-183,5°C.
ESI m/z = 454 (М+Na).
Т.пл. 164,0-165,0°C.
ESI m/z=427 (М+Na).
Т.пл. 154,0-156,0°С.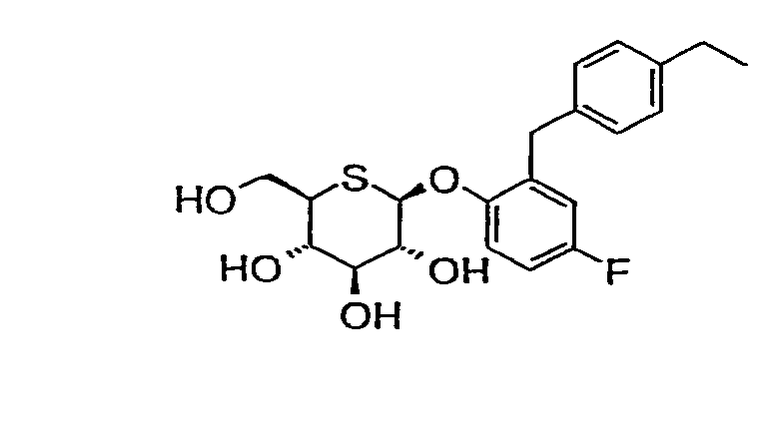
ESI m/z=431 (М+Na).
Т.пл. 163,0-165,5°C.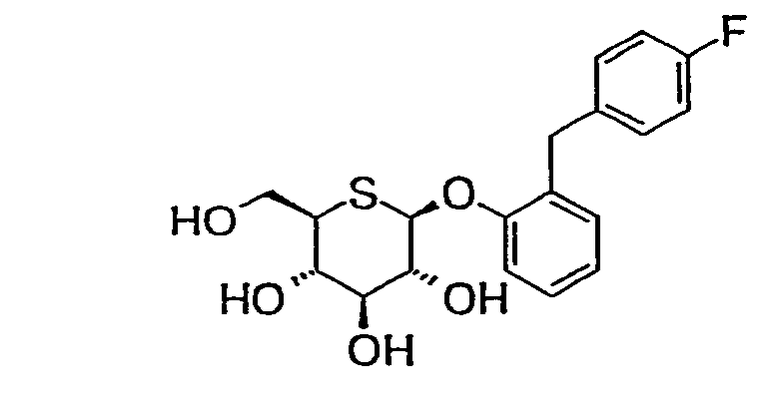
ESI m/z = 403 (Ì+Na).
Т.пл. 157,0-158,5°C.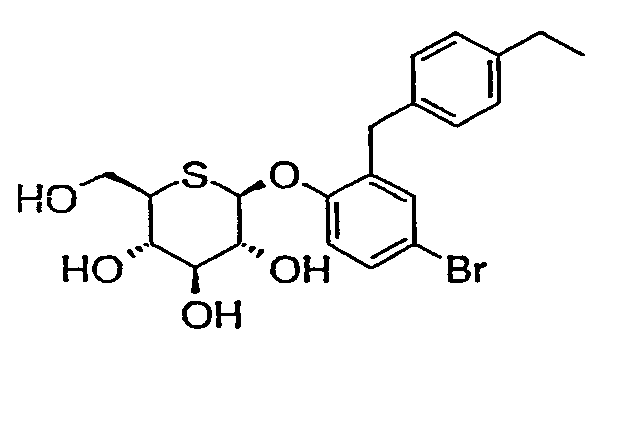
ESI m/z=493 (М+Na).
Т.пл. 172,0-173,5°C.
ESI m/z=385 (М+Na).
Т.пл. 171,0-174,0°С.
ESI m/z = 427 (М+Na).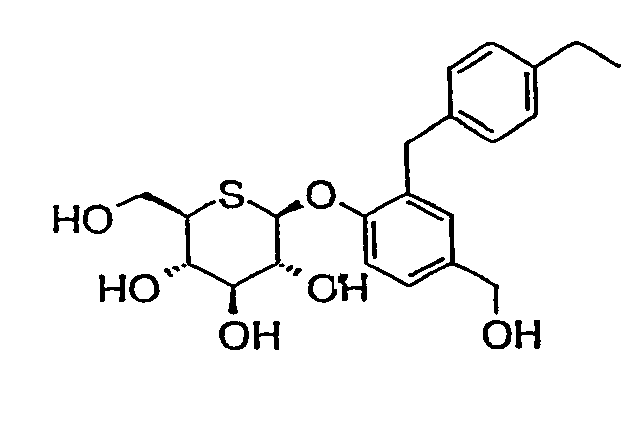
ESI m/z = 443 (М+Na).
Т.пл. 202,5-205,0°С.
ESI m/z = 429 (Ì+Na).
Т.пл. 238,0-242,5°С.
ESI m/z = 471 (М+Na).
Т.пл. 196,0-198,0°С.
ESI m/z = 457 (М+Na).
Т.пл. 219,0-220,5°C.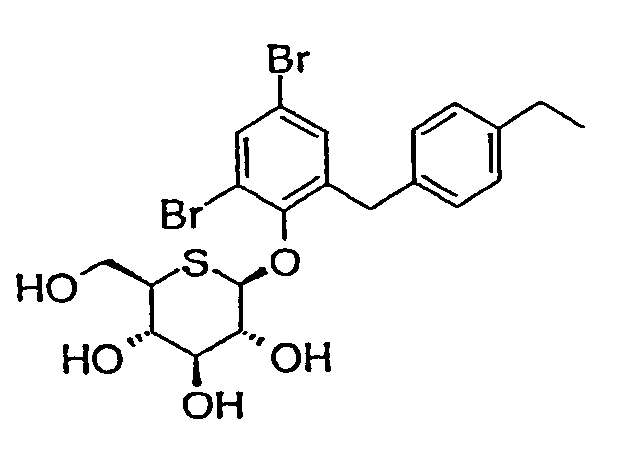
ESI m/z = 429 (М+Na).
ESI m/z = 401 (Ì+Na).
Т.пл. 189,5-191,0°C.
ESI m/z = 429 (М+Na).
Т.пл. 154,5-156,5°C.
ESI m/z = 473 (М+Na).
Т.пл. 175,5-180,0°С.
ESI m/z = 429 (М+Na).
Т.пл. 172,0-173,5°C.
ESI m/z = 497 (М+Na).
Т.пл. 171,0-175,0°C.
ESI m/z = 471 (М+Na).
Т.пл. 102,0-104,5°C.
Т.пл. 179,0-180,0°C.
Т.пл. 148,0-150,0°C.
ESI m/z = 371 (Ì+Na).
Т.пл. 96,0-105,0°С.
ESI m/z = 427 (М+Na).
Т.пл. 82,0-86,0°С.

Т.пл. 72,0-80,0°С.
ESI m/z = 449 (М+Na).
ESI m/z = 401 (М+Na).
ESI m/z = 400 (М+Na).
Т.пл. 152,0-153,0°C.
ESI m/z = 384 (М+Na).
Т.пл. 144,0-151,0°C.
Т.пл. 177,0-180,0°C.
Т.пл. 197,0-200,0°C.
Т.пл. 140,0-142,0°C.
ESI m/z = 443 (М+Na).
Т.пл. 206,0-211,0°C.
Т.пл. 74,0-76,0°C.
Т.пл. 180,0-182,0°C.
Т.пл. 206,0-208,0°C.
Т.пл. 208,0-210,0°C.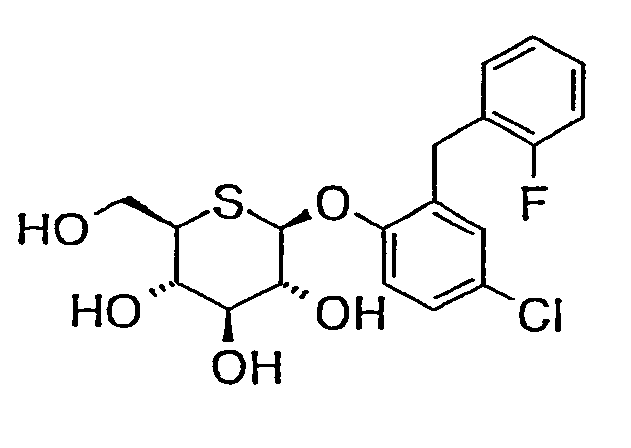
Т.пл. 170,0-173,0°C.
Т.пл. 166,0-169,0°C.
Т.пл. 165,0-168,0°C.
Т.пл. 235,0-236,5°C.
Т.пл. 174,0-176,5°C.
Т.пл. 132,0-134,0°C.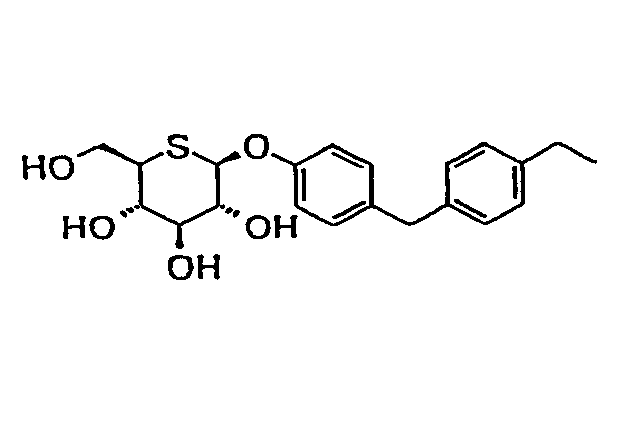
Т.пл. 137,0-138,5°C.
Т.пл. 151,0-153,0°C.
Т.пл. 183,0-184,0°C.
Т.пл. 112,0-118,0°C.
Т.пл. 175,0-177,5°C.
Т.пл. 148,5-149,5°C.
Т.пл. 184,0-186,5°C.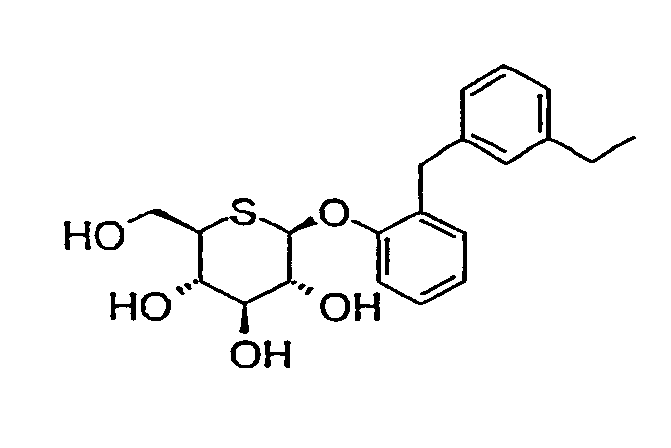
Т.пл. 144,0-145,0°C.
Т.пл. 96,0-101,0°C.
Т.пл. 183,5-185,0°C.
Т.пл. 175,5-177,0°C.
Т.пл. 182,0-183,0°C.
Т.пл. 124,5-127,0°C.
Т.пл. 146,0-148,5°C.
Т.пл. 156,0-157,0°C.
Т.пл. 100,0-105,0°C.
Т.пл. 204,0-211,0°C.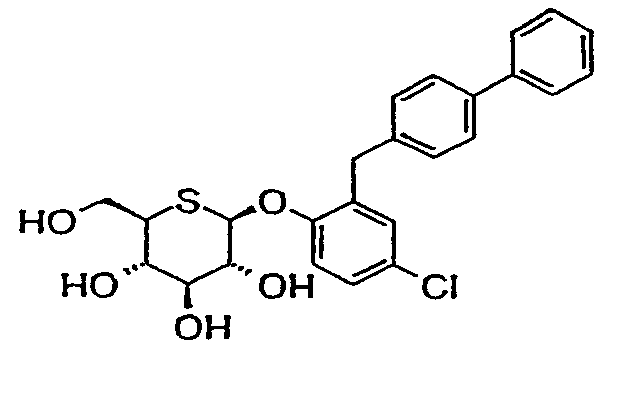
Т.пл. 187,0-195,0°C.
Т.пл. 170,0-175,0°C.
Т.пл. 146,0-148,0°C.
Т.пл. 172,0-174,0°C.
Т.пл. 192,0-194,0°C.
Т.пл. 143,0-144,5°C.
Т.пл. 174,0-176,5°C.
Т.пл. 156,5-160,0°C.
Т.пл. 79,0-82,5°C.
Т.пл. 126,0-129,0°C.

Т.пл. 128,0-130,0°C.
Т.пл. 150,5-151,5°C.
Т.пл. 195,5-197,0°C.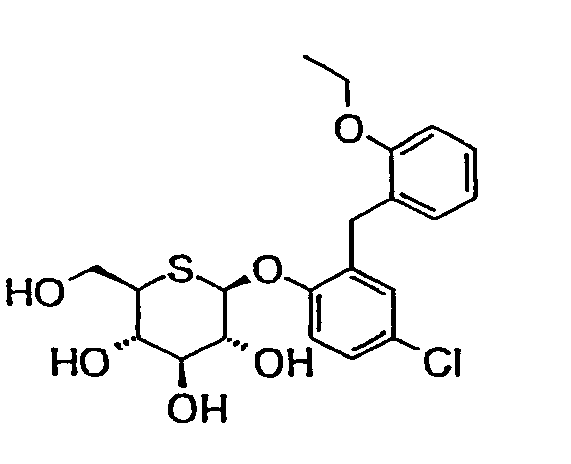
Т.пл. 196,5-198,5°C.
Т.пл. 147,0-149,0°C.
ESI m/z = 497 (Ì+Na).
Т.пл. 183,0-185,0°C.
Т.пл. 215,5-216,0°C.
Т.пл. 193,5-194,0°C.
ESI m/z = 549, 551 (М+Na).
ESI m/z = 427 (Ì+Na).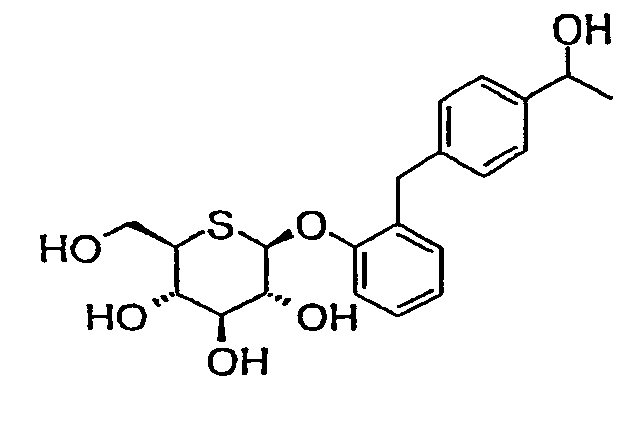
ESI m/z = 429 (Ì+Na).
Т.пл. 148,0-148,5°C.
ESI m/Z = 410 (М+Na). 
Т.пл. 200,0-202,0°C.
Экспериментальный пример
Согласно опубликованной методике (Anal. Biochem., vol.201, p.301, 1984) готовили суспензию переносчиков щеточной каемки крысиных почек (BBMV) (с концентрацией белка: 4 мг/мл). Данную суспензию (50 мкл) предварительно инкубировали при 37°С в течение 2 мин с последующим добавлением 150 мкл реакционного раствора, содержащего испытуемое соединение, растворенное в ДМСО (конечное содержание ДМСО: 1%), а также 100 мМ маннита, 100 мМ NaSCN или KSCN, 10мМ Heres/Трис (pH,4), D-глюкозу (конечная концентрация: 0,1 мМ) и 1 мккюри D-[6-3H]глюкозы (Amersham). После проведения реакции при 37°С в течение 5 сек к реакционной смеси добавляли 1 мл охлажденного на льду останавливающего реакцию раствора (150 мМ NaCl, 10 мМ Hepes/Трис (pH 7,4), 0,3 мМ флоридзина) для остановки реакции. Реакционную смесь сразу же фильтровали быстрым фильтрованием с использованием мембранного фильтра (размер пор: 0,45 мкм, HAWPO2500, Millipore) для отделения BBMV. Данный мембранный фильтр промывали три раза 4,5 мл охлажденного на льду останавливающего реакцию раствора, в достаточной мере высушивали и определяли радиоактивность с использованием жидкостного сцинтилляционного счетчика (Beckman) для определения меченой глюкозы в BBMV на мембранном фильтре.
Полагая, что количество меченой глюкозы при отсутствии испытуемого соединения составляет 100%, определяли концентрацию, необходимую для того, чтобы испытуемое соединение привело к 50% ингибированию количества меченой глюкозы (значение IC50).
Полученные данные представлены в таблице 2 ниже.
Промышленная применимость
Настоящее изобретение относится к производным 5-тио-β-D-глюкопиранозида или их фармацевтически приемлемым солям, которые обладают высоким ингибирующим действием в отношении активности SGLT2. Соединения по настоящему изобретению эффективны в качестве профилактических и терапевтических средств при диабете, связанных с диабетом заболеваниях или осложнениях при диабете.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1-ТИО-D-ГЛЮЦИТОЛА | 2006 |
|
RU2387649C2 |
| НОВОЕ ЦИКЛОГЕКСАНОВОЕ ПРОИЗВОДНОЕ, ЕГО ПРОЛЕКАРСТВО И ЕГО СОЛЬ И СОДЕРЖАЩЕЕ ИХ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ОТ ДИАБЕТА | 2005 |
|
RU2394015C2 |
| ПРОИЗВОДНЫЕ СПИРОКЕТАЛЕЙ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА ПРОТИВ ДИАБЕТА | 2006 |
|
RU2416617C2 |
| СОЕДИНЕНИЕ С-ФЕНИЛГЛИЦИТОЛА ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА | 2007 |
|
RU2437876C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2012 |
|
RU2596946C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ БЕНЗОПИРАНА В КАЧЕСТВЕ ПРОТИВОАРИТМИЧЕСКИХ АГЕНТОВ | 2005 |
|
RU2380370C2 |
| ПРОИЗВОДНЫЕ БЕНЗИЛФЕНИЛЦИКЛОГЕКСАНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2505521C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2012 |
|
RU2605537C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ТРИАЗОЛДИАМИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2274639C2 |
Изобретение относится к производному 5-тио-β-D-глюкопиранозида формулы (i), в которой Y представляет -О- или -NH-; R1, R2 или R3 представляют водород, ацил или фенилС1-4алкил; R4 представляет водород, ацил, алкоксикарбонил или фенил-С1-4алкил; Ar представляет фенил или нафтил, замещенные -Х-А1, причем фенил может быть дополнительно замещен 1-3 одинаковыми или различными заместителями, выбранными из атома галогена, гидроксила и др.; Х представляет -(CH2)n-, -CO(CH2)n-, -CH(OH)(CH2)n-, -O-(CH2)n-, -CONH(CH2)n-, где n - целое число от 0 до 3, -СОСН=СН-, -S- или -NH-; А1 представляет фенил, нафтил или гетероарил, выбранный из бензофуранильной группы, пиридильной группы, пиразолильной группы и тиазолильной группы, где последние три группы могут быть дополнительно замещены алкилом, а фенильная группа может быть замещена 1-4 одинаковыми или различными заместителями, выбранными из атома галогена, гидроксила и др.; или его фармацевтически приемлемой соли, или его гидрату. Производные формулы (i) обладают ингибирующим действием в отношении активности SGLT2. Изобретение относится также к фармацевтической композиции, которая является профилактическим или терапевтическим средством при диабете, связанных с диабетом заболеваниях или осложнениях при диабете. Также изобретение относится к производному 5-тио-β-D-глюкопиранозида формулы (III), в которой R21, R22, R23 и R24 означают водород или ацил, R25 - аминогруппу, алканоил, карбоксил или алкоксикарбонил, R26 - водород или гидроксил, R27 - водород или алкил; или его фармацевтически приемлемой соли, или его гидрата. Производные формулы (III) являются промежуточными соединениями для получения соединений формулы (I), где Y означает -О-; R1, R2 или R3 каждый представляют водород, ацил или фенилС1-4алкил; R4 представляет водород, ацил, алкоксикарбонил или фенил-С1-4алкил; один из R5, R6, R7, R8 и R9 представляет -Х-А1 (где Х и А1 имеют значения, определенные выше), а другие представляют водород, галоген и др. 3 н. и 14 з.п. ф-лы, 4 ил., 2 табл.
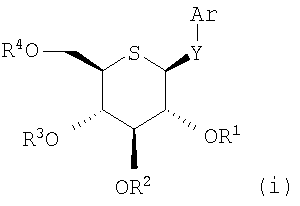

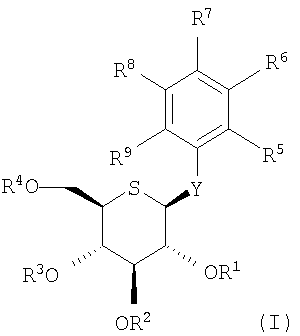

в которой Y представляет -О- или -NH-,
R1, R2 или R3, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10ацил или фенилС1-4алкил,
R4 представляет водород, C2-10ацил, С2-6алкоксикарбонил или фенил-С1-4алкил,
Ar представляет фенил или нафтил, замещенные -Х-А1, где фенил может быть дополнительно замещен 1-3 одинаковыми или различными заместителями, выбранными из
атома галогена;
гидроксила;
С1-6алкила, который может быть замещен гидроксилом;
группы, представленной формулой
-(CH2)m-Q,
в которой m представляет целое число 0 или 1, и Q представляет формил, карбоксил, C1-6алкокси, C1-6алкокси-C1-6алкокси, C2-10ацилокси, С2-10ацил, С2-6алкоксикарбонил; или
С3-7циклоалкилокси, С2-10ацил, С2-6алкоксикарбонил или фенилС1-4алкил, который может быть замещен 1-2 атомами галогена,
Х представляет -(СН2)n-, -СО(СН2)n-, -CH(OH)(CH2)n-, -O-(СН2)n-, -CONH(CH2)n-, где n представляет целое число от 0 до 3, -СОСН=СН-, -S-или -NH-, и
А1 представляет фенил, нафтил или гетероарил, выбранный из бензофуранильной группы, пиридильной группы, пиразолильной группы и тиазолильной группы, где последние три группы могут быть дополнительно замещены C1-6алкилом, а фенильная группа может быть замещена 1-4 одинаковыми или различными заместителями, выбранными из
атома галогена;
гидроксила;
C1-6алкила, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группы, представленной формулой
-Q′,
в которой Q′ представляет аминогруппу, нитрогруппу, цианогруппу, карбоксил, C1-6алкокси, который может быть замещен 1-4 атомами галогена, C2-10ацил, С2-6алкоксикарбонил, C1-6алкилтио, C2-10ациламиногруппу, C1-6алкилсульфониламиногруппу, C1-6алкиламиногруппу, N,N-ди(C1-6алкил)аминогруппу, карбамоил или N,N-ди(C1-6алкил)аминокарбонил; или
С3-7циклоалкила, фенила, фенилС1-4алкила, фенокси, пиразолильной группы или насыщенного 6-членного гетероциклоалкила, который содержит 1 или 2 гетероатома, выбранного из N или О, где кольцо может быть замещено С1-6алкилом.

в которой Y представляет -О- или -NH-,
R1, R2 или R3, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10 ацил или фенилС1-4алкил,
R4 представляет водород, C2-10ацил, С2-6алкоксикарбонил или фенил-С1-4алкил, и
один из R5, R6, R7, R8 и R9 представляет -Х-А1 (где Х и А1 имеют значения, определенные выше), и другие, которые могут быть одинаковыми или различными, каждый представляет
атом водорода;
атом галогена;
гидроксил;
С1-6алкил, который может быть замещен гидроксилом;
группу, представленную формулой
-(CH2)m-Q,
в которой m целое число 0 или 1, и Q имеет значения, определенные в п.1; или
С3-7циклоалкилокси или фенилС1-4алкил, который может быть замещен 1-2 атомами галогена.

в которой Х представляет -(CH2)n-, -СО(СН2)n-, -СН(ОН)(СН2)n-, -O-(СН2)n-, -CONH(CH2)n-, где n представляет целое число от 0 до 3, -СОСН=СН-, -S- или -NH-,
R1, R2 или R3, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10ацил или фенилС1-4алкил,
R4 представляет водород, C2-10ацил, C2-6алкоксикарбонил или фенилС1-4алкил, и
R6, R7 и R8 и R9, которые могут быть одинаковыми или различными, каждый представляет
атом водорода;
атом галогена;
гидроксил;
C1-6алкил, который может быть замещен гидроксилом;
группу, представленную формулой
-(CH2)m-Q,
в которой m представляет целое число 0 или 1, и Q представляет формил, карбоксил, C1-6алкокси, C1-6алкокси-C1-6алкокси, C2-10ацилокси, С2-10ацил, С2-6алкоксикарбонил; или
С3-7циклоалкилокси или фенилС1-4алкил, который может быть замещен 1-2 атомами галогена, и
R10, R11, R12, R13 и R14, которые могут быть одинаковыми или различными, каждый представляет
атом водорода;
атом галогена;
гидроксил;
C1-6алкил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из атома галогена и гидроксила;
группу, представленную формулой
-Q′,
в которой Q′ представляет аминогруппу, нитрогруппу, цианогруппу, карбоксил, C1-6алкокси, который может быть замещен 1-4 атомами галогена, С2-10ацил, С2-6алкоксикарбонил, C1-6алкилтио, C2-10ациламиногруппу, C1-6алкилсульфониламиногруппу, C1-6алкиламиногруппу, N,N-ди(С1-6алкил)аминогруппу, карбамоил или N,N-ди(C1-6алкил)аминокарбонил; или
С3-7циклоалкила, фенила, фенилС1-4алкила, фенокси, пиразолильной группы или насыщенного 6-членного гетероциклоалкила, который содержит 1 или 2 гетероатома, выбранного из N или О, где кольцо может быть замещено C1-6алкилом.

в которой R6-R9, которые могут быть одинаковыми или различными, каждый представляет атом водорода, атом галогена, C1-6алкил, C1-6алкокси, C1-6алкокси-C1-6алкокси, карбоксил, С2-6алкоксикарбонил, гидроксил или гидрокси-С1-4алкил,
RC представляет атом водорода, атом галогена, C1-6алкил, C1-6алкокси, гидрокси-С1-4алкил, галогензамещенный C1-6алкил или C1-6алкилтио,
R4 представляет атом водорода, С2-6алкоксикарбонил или С2-6алканоил, и
R1-R3, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-8алканоил или бензоил.

в которой RD представляет атом водорода, атом галогена, C1-6алкил или гидрокси-С1-4алкил, и
RE представляет атом водорода, атом галогена, C1-6алкил, C1-6алкокси или гидрокси-C1-4алкил.

R1, R2 или R3, которые могут быть одинаковыми или различными, каждый представляет атом водорода, C2-10ацил или фенилС1-4алкил,
R4 представляет водород, C2-10ацил, С2-6алкоксикарбонил или фенилС1-4алкил, и
R6B представляет водород, галоген, гидроксил, C1-6ацилокси, C1-6алкил или C1-6алкокси, и
R8B представляет атом водорода, атом галогена или C1-6алкил, который может быть замещен 1-4 атомами галогена.

в которой R21, R22, R23 и R24, которые могут быть одинаковыми или различными, каждый представляет атом водорода или C2-10ацил,
R25 представляет аминогруппу, С2-6алканоил, карбоксил или С2-6алкоксикарбонил, и
R26 представляет атом водорода или гидроксил, и
R27 представляет атом водорода или C1-6алкил.
Приоритет по признакам:
от 09.08.2002 по п.11 формулы изобретения;
от 01.04.2003 по п.10 формулы изобретения;
остальные пункты формулы изобретения имеют приоритет по дате подачи заявки PCT/JP03/10160 от 08.08.2003.
| Angewandte Chemie, International Edition in English, 1997, 36(8), 868-870 (English) (YUASA HIDEYA ET AL) | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОНИЛ- β -D-ТИОКСИЛОЗИДА | 1991 |
|
RU2033995C1 |
Авторы
Даты
2008-04-20—Публикация
2003-08-08—Подача