Область техники, к которой относится изобретение
Настоящее изобретение относится к производным бензилфенилциклогексана, обладающим ингибирующим действием на натрий-зависимый котранспортер глюкозы (SGLT), а также к фармацевтическим композициям, способам получения указанных соединений, синтетическим интермедиатам и способам применения указанных соединений для лечения заболеваний и состояний, на которые влияет ингибирование SGLT.
Уровень техники
По данным Всемирной организации здравоохранения приблизительно 150 млн. человек во всем мире страдают сахарным диабетом. Различают две основных формы сахарного диабета: типа 1, при которой поджелудочная железа не продуцирует инсулин, и типа 2, при которой в организме нарушены механизмы реакции на инсулин (инсулинорезистентность). На долю последнего приходится около 90% всех случаев диабета, на сегодняшний день сахарный диабет типа 2 наиболее распространен. При обоих заболеваниях отсутствие эффекта инсулина - из-за отсутствия его самого либо ответной реакции на него - приводит к повышенному уровню глюкозы в сыворотке крови (гипергликемия). С диабетом ассоциированы серьезные осложнения, включающие ретинопатию (ведущую к нарушениям зрения или слепоте), сердечно-сосудистые расстройства, нефропатию, невропатию, язвы и синдром диабетической стопы.
При диабете типа 1 больному требуется постоянная инсулинотерапия. При диабете типа 2 во многих случаях возможно купирование путем диеты и физических упражнений, но часто требуется и медикаментозное вмешательство. Помимо инсулина, который необходим около трети больных с диабетом типа 2, современные терапевтические средства против диабета включают бигуаниды (сокращают образование глюкозы в печени и повышают чувствительность к инсулину), сульфонилмочевины и меглитиниды (стимулируют образование инсулина), ингибиторы альфа-глюкозидазы (замедляют усвоение крахмала и образование глюкозы) и тиазолидиндионы (повышают чувствительность к инсулину). Эти лекарственные средства часто используются в сочетании друг с другом, но и тогда они не обеспечивают адекватной регуляции уровня глюкозы в крови, а кроме того могут вызывать нежелательные побочные эффекты. Эти побочные эффекты включают лактоацидоз (бигуаниды), гипогликемию (сульфонилмочевины), отеки и прибавку в весе (тиазолидиндионы). Следовательно, очень нужны новые агенты для лечения диабета, которые бы лучше обеспечивали регуляцию уровня глюкозы и не имели этих негативных побочных эффектов.
Одной из перспективных мишеней терапевтического вмешательства при диабете и родственных расстройствах является система транспорта глюкозы в почках. Транспорт глюкозы в клетке осуществляется «пассивными» (облегченная диффузия) переносчиками глюкозы (GLUT) или же «активными» переносчиками - натрий-зависимыми котранспортерами (SGLT). SGLT1 находятся преимущественно в щеточной каемке эпителия кишечника, a SGLT2 локализованы в проксимальных канальцах почек и, как сообщалось, обеспечивают большую часть обратного всасывания глюкозы в почках. Недавно проведенные исследования позволяют полагать, что ингибирование почечных SGLT может быть полезным подходом для лечения гипергликемии путем увеличения количества глюкозы, экскретируемого с мочой (Arakawa К, et al., Br J Pharmacol 132:578-86, 2001; Oku A, et al., Diabetes 48:1794-1800, 1999). Возможности этого подхода также подтверждаются тем, что, как недавно обнаружено, в случаях семейной почечной глюкозурии (это по видимости доброкачественное состояние характеризуется выведением глюкозы с мочой при нормальных ее уровнях в сыворотке крови и отсутствии общей дисфункции почек или иного заболевания) имеют место мутации гена SGLT2 (Santer R, et al., J Am Soc Nephrol 14:2873-82, 2003). Таким образом, соединения, ингибирующие SGLT, в частности SGLT2, представляются подходящими кандидатами на роль лекарств против диабета. В число соединений, о которых ранее сообщалось как об ингибиторах SGLT, входят производные циклогексана (например, описанные в публикации WO 006011469), С-гликозидные производные (например, описанные в работах US 6414126, US 20040138439, US 20050209166, US 20050233988, WO 2005085237, US 7094763, US 20060009400, US 20060019948, US 20060035841, US 20060122126 и WO 2006108842), O-гликозидные производные (например, описанные в работах US 6683056, US 20050187168, US 20060166899, US 20060234954, US 20060247179 и US 20070185197), спирокеталь-гликозидные производные (описанные в публикации WO 2006080421), и тиогликопиранозидные производные (типа описанных в работах US 2005029309 и WO 2006073197).
Раскрытие изобретения
Предлагаются соединения, обладающие ингибирующим действием на натрий-зависимый котранспортер глюкозы (SGLT). Также предлагаются фармацевтические композиции, способы получения соединений по данному изобретению, синтетические интермедиаты и способы применения соединений по данному изобретению, самих по себе или в сочетании с другими терапевтическими агентами, для лечения заболеваний и состояний, на которые влияет ингибирование SGLT.
Краткое описание чертежей
Фигуры 1-2 изображают общие схемы синтеза соединений по данному изобретению
Фигуры 3-8 изображают более конкретные схемы синтеза соединений, обсуждаемых в разделе «Примеры» ниже.
Осуществление изобретения
Определения
В настоящем документе термин «галоген", или "галоид" означает одновалентный радикал или атом галогена, выбираемого из фтора, хлора, брома и йода. Среди них предпочтительны фтор, хлор и бром.
В настоящем документе выражение «подходящий заместитель» означает химически или фармацевтически приемлемую группу, то есть структуру, которая существенно не мешает получению или не снижает эффективность соединений по данному изобретению. Специалисту в данной области техники не составит труда в обычной практике подобрать такие подходящие заместители. Подходящие заместители могут быть выбраны из группы, состоящей из галогена, C1-С6-алкила, С2-С6-алкенила, C1-С6-галоалкила, C1-С6-алкоксигруппы, C1-С6-галоалкоксигруппы, С2-С6-алкинила, С3-C8-циклоалкенила, (С3-С8-циклоалкил)С1-С6-алкила, (С3-С8-циклоалкил)С2-С6-алкенила, (С3-С8-циклоалкил)С1-С6-алкоксигруппы, С3-С7-гетероциклоалкила, (С3-С7-гетероциклоалкил)С1-С6-алкила, (С3-С7-гетероциклоалкил)С2-С6-алкенила, (С3-С7-гетероциклоалкил)С1-С6-алкоксигруппы, гидроксильной группы, карбоксильной группы, оксогруппы, сульфанильной группы, C1-С6-алкилсульфанильной группы, арила, гетероарила, арилоксигруппы, гетероарилоксигруппы, аралкила, гетероаралкила, аралкоксигруппы, гетероаралкоксигруппы, нитрогруппы, цианогруппы, аминогруппы, C1-С6-алкиламиногруппы, ди-(С1-С6-алкил)аминогруппы, карбамоильной группы, (C1-С6-алкил)карбонильной группы, (С1-С6-алкокси)карбонильной группы, (C1-С6-алкил)аминокарбонильной группы, ди-(С1-С6-алкил)аминокарбонильной группы, арилкарбонильной группы, арилоксикарбонильной группы, (С1-С6-алкил)сульфонильной группы и арилсульфонильной группы. Группы, перечисленные выше как подходящие заместители, определены ниже (за тем исключением, что подходящие заместители не могут быть дополнительно, при необходимости, замещенными).
В настоящем документе термин «алкил» («алкильная группа») сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным насыщенным алифатическим углеводородным радикалам, содержащим указанное число атомов углерода. Такой радикал может быть неразветвленным или разветвленным, при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры алкильных групп включают (но не ограничены перечисленным) метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, изопропил, изобутил, изопентил, амил, втор-бутил, трет-бутил, трет-пентил, н-гептил, н-октил, н-нонил, н-децил, н-додецил, н-тетрадецил, н-гексадецил, н-октадецил, н-эйкозил и т.п.Предпочтительные алкильные группы включают метил, этил, н-пропил и изопропил. Предпочтительные подходящие заместители, используемые при необходимости, включают галоген, метокси-, этокси-, пиано-, нитро- и аминогруппу.
В настоящем документе термин «алкенил» сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным алифатическим углеводородным радикалам, содержащим указанное число атомов углерода и, по меньшей мере, одну двойную связь углерод-углерод. Такой радикал может быть неразветвленным или разветвленным, в Е либо Z-форме, при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры алкенильных групп включают (но не ограничены перечисленным) винил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, изобутенил, 2-метил-1-пропенил, 1-пентенил, 2-пентенил, 4-метил-2-пентенил, 1,3-пентадиенил, 2,4-пентадиенил, 1,3-бутадиенил и т.п.Предпочтительные алкенильные группы включают винил, 1-пропенил и 2-пропенил. Предпочтительные подходящие заместители, используемые при необходимости, включают галоген, метокси-, этокси-, циано, нитро- и аминогруппу.
В настоящем документе термин «алкинил» сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным алифатическим углеводородным радикалам, содержащим указанное число атомов углерода и, по меньшей мере, одну тройную связь углерод-углерод. Такой радикал может быть неразветвленным или разветвленным, при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры алкинильных групп включают (но не ограничены перечисленным) этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-пентинил, 3-пентинил, 1-гексинил, 2-гексинил, 3-гексинил и т.п.Предпочтительные алкинильные группы включают этинил, 1-пропинил и 2-пропинил. Предпочтительные подходящие заместители, используемые при необходимости, включают галоген, метокси-, этокси-, циано, нитро- и аминогруппу.
В настоящем документе термин «циклоалкил» сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным алициклическим насыщенным углеводородным радикалам, содержащим три или более атомов углерода, образующих карбоциклическое кольцо, и при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры циклоалкильных групп включают (но не ограничены перечисленным) циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил и т.п. Предпочтительные подходящие заместители, используемые при необходимости, включают галоген, метил, этил, метокси-, этокси-, циано, нитро- и аминогруппу.
В настоящем документе термин «циклоалкенил» сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным алициклическим углеводородным радикалам, содержащим три или более атомов углерода, образующих карбоциклическое кольцо, и, по меньшей мере, одну двойную связь углерод-углерод, и при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры циклоалкенильных групп включают (но не ограничены перечисленным) циклопентенил, циклогексенил и т.п. Предпочтительные подходящие заместители, используемые при необходимости, включают галоген, метил, этил, метокси-, этокси-, циано, нитро- и аминогруппу.
В настоящем документе термины «алкилен», «алкенилен», «циклоалкилен» и «циклоалкенилен» относятся (если не оговорено иного) к двухвалентным углеводородным радикалам, образованным путем удаления атома водорода из алкильного, алкенильного, циклоалкильного или циклоалкенильного радикал соответственно, которые определены выше.
В настоящем документе термин "(С3-С10-циклоалкилен)(С1-С6-алкилен)" относится к двухвалентному углеводородному радикалу, образованному путем связывания С3-С10-циклоалкиленового радикала с C1-С6-алкиленовым радикалом, которые определены выше.
В настоящем документе термин «арил» сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным ароматическим углеводородным радикалам, содержащим 6-10 атомов углерода, образующих карбоциклическое кольцо, и при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры арильных групп включают (но не ограничены перечисленным) фенил, нафтил, тетрагидронафтил, инданил и т.п.
Предпочтительными арильными группами являются фенил и нафтил, при необходимости одно- или двухзамещенные одинаковыми или разными подходящими заместителями, выбираемыми из галогена, цианогруппы, C1-С3-алкила, С3-С6-циклоалкила, дифторметила, трифторметила, C1-С3-алкокси-, дифторметокси- и трифторметоксигруппы..
В настоящем документе термин «гетероциклоалкил» сам по себе или в словосочетании относится (если не оговорено иного) к циклоалокильной группе, определенной выше, в которой один или более атомов углерода в кольце замещен гетероатомом, выбираемым из N, S и О. Иллюстративные примеры гетероциклоалкильных групп включают (но не ограничены перечисленным) пирролидинил, тетрагидрофуранил, пиперазинил, тетрагидропиранил и т.п.
В настоящем документе термин «гетероарил» сам по себе или в словосочетании относится (если не оговорено иного) к одновалентным ароматическим гетероциклическим радикалам, содержащим 2-9 атомов углерода и 1-4 гетероатома, выбираемых из N, S и О, образующих 5-10-членное кольцо (одно или два конденсированных) и при необходимости замещенным там, где указано, одним-тремя подходящими заместителями, названными выше. Иллюстративные примеры гетероарильных групп включают (но не ограничены перечисленным) пиридил, пиридазинил, пиразинил, пиримидинил, триазинил, хинолинил, изохинолинил, хиноксалинил, хиназолинил, бензотриазинил, бензимидазолил, бензопиразолил, бензотриазолил, бензизоксазолил, изобензофурил, изоиндолил, индолизинил, тиенопиридинил, тиенопиримидинил, пиразолопиримидинил, имидазопиридины, бензотиаксолил, бензофуранил, бензотиенил, индолил, изотиазолил, пиразолил, индазолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, пирролил, тиазолил, фурил, тиенил и т.п. Пяти- или шестичленные гетероарильные моноциклы включают пиридил, пиридазинил, пиразинил, пиримидинил, триазинил, изотиазолил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, пирролил, тиазолил, фурил, тиенил и т.п. Восьми-десятичленные гетероарильные бициклы, содержащие 1-4 гетероатома, включают хинолинил, изохинолинил, хиноксалинил, хиназолинил, бензотриазинил, бензимидазолил, бензопиразолил, бензотриазолил, бензизоксазолил, изобензофурил, изоиндолил, индолизинил, тиенопиридинил, тиенопиримидинил, пиразолопиримидинил, имидазопиридинил, бензотиаксолил, бензофуранил, бензотиенил, индолил, индазолил и т.п. Предпочтительные подходящие заместители, используемые при необходимости, включают один или два одинаковых или разных заместителя, выбираемых из галогена, цианогруппы, C1-С3-алкила, С3-С6-циклоалкила, дифторметила, трифторметила, C1-С3-алкокси-, дифторметокси- и трифторметоксигруппы.
В настоящем документе термины «алкокси» и «алкилокси» сами по себе или в словосочетаниях относятся (если не оговорено иного) к алифатическим радикалам вида алкил-O-, в котором алкил определен выше. Иллюстративные примеры алкоси-групп включают (но не ограничены перечисленным) метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, трет-бутокси-, пентокси-, изопентокси-, неопентокси-, трет-пентокси-, гексокси-, изогексокси-, гептокси, октокси-группу и т.п. Предпочтительными алкокси-группами являются метокси- и этокси-группа.
В настоящем документе термин «галоалкил» относится (если не оговорено иного) к описанным выше алкильным радикалам, замещенным одним или более атомами галогена. Иллюстративные примеры галоалкильных групп включают (но не ограничены перечисленным) хлорметил, дихлорметил, фторметил, дифторметил, трифторметил, 2,2,2-трихлорэтил и т.п.
В настоящем документе термин «галоалкокси» относится (если не указано иного) к описанным выше алкокси-радикалам, замещенным одним или более атомами галогена. Иллюстративные примеры галоалкокси-групп включают (но не ограничены перечисленным) трифторметокси-, дифторметокси-группу и т.п.
В настоящем документе термин «аралкил» относится (если не указано иного) к описанным выше алкильным радикалам, содержащим 1-6 атомов углерода и замещенным арильной группой, описанной выше.
В настоящем документе термин «гетероаралкил» относится (если не указано иного) к описанным выше алкильным радикалам, содержащим 1-6 атомов углерода и замещенным гетероарильной группой, описанной выше.
В настоящем документе термин «аралкокси» относится (если не указано иного) к описанным выше алкокси-радикалам, содержащим 1-6 атомов углерода и замещенным арильной группой, описанной выше.
В настоящем документе термин «гетероаралкокси» относится (если не указано иного) к описанным выше алкокси-радикалам, содержащим 1-6 атомов углерода и замещенным гетероарильной группой, описанной выше.
В настоящем документе термин «карбамоил» относится (если не указано иного) к одновалентным радикалам вида -C(O)NH(R), где R представляет водород, C1-С6-алкил, С2-С6-алкенил, С3-С6-циклоалкил или арил, описанные выше.
В настоящем документе термины «ди-(С1-С3-алкил)амино» и «ди-(С1-С6-алкил)амино» сами по себе или в словосочетаниях относятся (если не указано иного) к аминогруппе, замещенной двумя группами, выбираемыми независимо из C1-С3-алкила или C1-С6-алкила соответственно.
В настоящем документе термины «лечение» и «терапия» относятся к задержке начала, замедлению развития, обращению прогрессирования, ослаблению или предотвращению заболевания или состояния, о котором идет речь, либо одного или более симптомов этого заболевания или состояния.
В настоящем документе термин «введение» означает прием через рот, применение суппозитория, местный контакт, введение в пораженную ткань, внутривенное, внутрибрюшинное, внутримышечное, интраназальное или подкожное введение, либо имплантат, постепенно высвобождающий лекарственное средство (например, осмотический мининасос). Введение подразумевает любые пути, включая парентеральные, через слизистые оболочки (например, ротовой полости, носовой полости, влагалища, прямой кишки) и через кожу. Парентеральное введение включает внутривенное, внутримышечное, внутриартериольное, интрадермальное, подкожное, внутрибрюшинное, внутрижелудочковое и внутричерепное. Другие пути доставки лекарственного средства включают (но не ограничены перечисленным) применение нагруженных липосом, внутривенное вливание, пластыри для чрескожного введения и проч.
В настоящем документе термин «пролекарство» относится к соединениям-предшественникам, которые, будучи введены в организм, образуют in vivo в ходе тех или и иных химических или физиологических процессов биологически активное вещество (например, пролекарство превращается в биологически активное вещество по достижении физиологического рН или в результате ферментативного воздействия). У пролекарства самого по себе биологическая активность может иметься либо отсутствовать.
В настоящем документе термин «соединение/вещество» относится к молекулам, получаемым любым путем, включая (но не ограничиваясь перечисленным) синтез in vitro, либо образование in situ или in vivo.
В настоящем документе термины регулируемое/ контролируемое/ замедленное/ пролонгированное/постепенное высвобождение» употребляются синонимично в отношении любого содержащего лекарственный агент состава, из которого этот агент высвобождается не сразу. Например, при пероральном приеме состава с регулируемым высвобождением лекарственного агента последний не сразу попадает в поглощаемый материал. Указанные термины синонимичны выражениям, употребляемым в этом контексте в справочнике Remington: The Science and Practice of Pharmacy, 21st Ed., Gennaro, Ed., Lippencott Williams & Wilkins (2003). Как там говорится, немедленное и замедленное высвобождение лекарственного агента определяется кинетически согласно следующему уравнению:
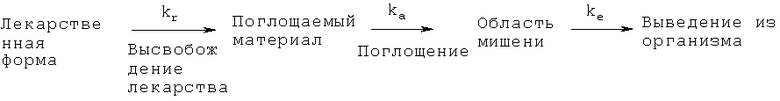
«Поглощаемый материал» представляет собой раствор лекарственного вещества, вводимый в определенное место поглощения; kr, ka и kc - константы скорости первого порядка для (1) высвобождения лекарственного агента из вводимого состава, (2) поглощение и (3) выведение из организма, соответственно. В случае лекарственных форм с немедленным высвобождением константа скорости высвобождения лекарственного агента kr значительно превышает константу скорости поглощения ka. В случае регулируемого высвобождения, наоборот, kr<<ka, так что скорость высвобождения лекарственного агента из лекарственной формы является лимитирующим фактором его поступления в область мишени.
Термины «постепенное высвобождение» и «пролонгированное высвобождение» употребляются в настоящем документе в их буквальном (тривиальном) смысле в отношении лекарственных составов, которые обеспечивают высвобождение лекарственного агента не сразу, а на протяжении какого-то относительно продолжительного периода времени, например в течение 12 часов или более, что предпочтительно (хотя и необязательно) приводит к более или менее постоянному уровню лекарственного агента в крови на протяжении относительно продолжительного времени.
В настоящем документе термин «задержанное высвобождение» относится к фармацевтическим препаратам, которые проходят через желудок неизмененными и растворяются в тонком кишечнике.
Общая часть
Настоящим изобретением предлагаются соединения, обладающие ингибирующим действием в отношении натрий-зависимого котранспортера глюкозы (SGLT), предпочтительно SGLT2. Некоторые соединения по данному изобретению также обладают ингибирующим действием в отношении натрий-зависимого котранспортера глюкозы SGLT1. Благодаря своей способности ингибировать SGLT соединения по данному изобретению подходят для лечения и/или предотвращения любого и всех состояний и заболеваний, на которые влияет подавление активности SGLT, в частности активности SGLT2. Таким образом, соединения по данному изобретению пригодны для профилактики и лечения некоторых заболеваний и состояний, в частности нарушений обмена веществ, включая (но не ограничиваясь перечисленным) сахарного диабета типа 1 и типа 2, гипергликемии, осложнений диабета (например, ретинопатии, нефропатии [например, прогрессирующего почечного заболевания], невропатии, язв, микро- и макроангиопатий и синдрома диабетической стопы), инсулинорезистентности, метаболического синдрома (синдрома X), гиперинсулинемии, гипертензии, гиперурикемии, ожирения, отеков, дислипедимии, хронической сердечной недостаточности, атеросклероза и родственных заболеваний.
Также предлагаются фармацевтически приемлемые соли и пролекарства соединений по данному изобретению.
Также предлагаются фармацевтические композиции, содержащие эффективное количество соединения или смеси соединений по данному изобретению, или их фармацевтически приемлемые соли или пролекарства в фармацевтически приемлемом носителе.
Также предлагаются синтетические интермедиаты и способы получения соединений по данному изобретению.
Также предлагаются способы применения соединений по данному изобретению, самих по себе или в сочетании с другими терапевтическими агентами, для лечения заболеваний и состояний, на которые может влиять ингибирование SGLT.
Также предлагаются способы применения соединений по данному изобретению при изготовлении лекарственных средств для лечения заболеваний и состояний, на которые может влиять ингибирование SGLT.
Осуществление изобретения
Соединения и препаративные методы
В одном аспекте настоящего изобретения предоставляются соединения формулы I:

где А представляет кислород, NH, метилен или одинарную связь;
Q выбирают из Q1-Q4 следующих формул:



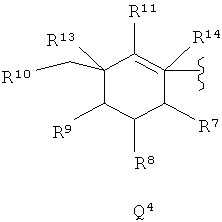
где волнистой линией показано место присоединения остальной части молекулы;
Z представляет кислород, серу, SO, SO2, 1,1-циклопропилен, карбонил или метилен, при необходимости замещенный одним или двумя заместителями, независимо выбираемыми из галогена, гидрокси-группы, C1-С6-алкила, C1-С6-алкокси-группы, С3-С6-циклоалкила и С3-С6-циклоалкилокси-группы;
R1, R2 и R3 каждый независимо представляют водород, галоген, гидрокси-группу, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, С5-С10-циклоалкенил, C1-С6-алкилоксигруппу, С3-С10-циклоалкилокси-группу, циано-, амино- или нитрогруппу, причем алкильная, алкенильная, алкинильная, циклоалкильная и циклоалкенильная группы или части при необходимости могут быть частично или полностью фторированы и могут быть моно- или дизамещенными одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила, а в циклоалкильной и циклоалкенильной группах или частях одна или две метиленовые группы при необходимости независимо друг от друга заменены NRa, О, S, CO, SO или SO2, и одна или две метиновых группы при необходимости заменены N, или
В том случае, когда R1 и R2 связаны с двумя соседними атомами углерода фенильного кольца, R1 и R2 могут быть соединены между собой, так что вместе R1 и R2 образуют С3-С5-алкиленовый, С3-С5-алкениленовый или бутадиениленовый мостик, который может быть частично или полностью фторированным и моно- или дизамещенным одинаковыми либо разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила, причем одна или две метиленовых группы при необходимости независимо друг от друга заменены О, S, СО, SO, SO2 или NRa и одна или две метиновых группы по необходимости заменены N;
R4 независимо представляет водород, галоген, циано-, нитро-, амино-, гидрокси-группу, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, C5-C10-циклоалкенил, C1-С6-алкилокси-, С3-С10-циклоалкилокси-, (С1-С6-алкилокси)С1-С6-алкилокси-, С5-С7-циклоалкенилокси-группу, арил, гетероарил, арилокси-, гетероарилокси-, (С2-С4-алкенил)С1-С3-алкилокси-, (С2-С4-алкинил)С1-С3-алкилокси-, (арил)С1-С3-алкилокси-, (гетероарил)С1-С3-алкилокси-группу, (С3-С10-циклоалкил)С1-С3-алкил, (С3-С10-циклоалкил)С1-С3-алкилокси-группу, (С5-С10-циклоалкенил)С1-С3-алкил, (С5-С10-циклоалкенил)С1-С3-алкилокси-группу, (С1-С4-алкилокси)С1-С3-алкил, (С3-С7-циклоалкилокси)С1-С3-алкил, (С3-С7-циклоалкилокси)С2-С4-алкенил, (С3-С7-циклоалкилокси)С2-С4-алкинил, (С3-С7-циклоалкилокси)С1-С3-алкилокси-группу, (С1-C4-алкиламино)С1-С3-алкил, ди-(С1-С3-алкиламино)С1-С3-алкил, три-(С1-С4-алкил)силил-С1-С6-алкил, три-(С1-С4-алкил)силил-С2-С6-алкенил, три-(С1-С4-алкил)силил-С2-С6-алкинил, три-(С1-С4-алкил)силил-С1-С6-алкилокси-группу, (С3-С7-циклоалкил)С2-С5-алкенил, (С3-С7-циклоалкил)С3-С5-алкенилокси-, (С3-С7-циклоалкил)С3-С5-алкинилокси-, (C5-C8-циклоалкенил)С3-С5-алкенилокси-, (С5-С8-циклоалкенил)С3-С5-алкинилокси-группу, С3-С6-циклоалкилиденметил, (С1-С4-алкил)карбонил, арилкарбонил, гетероарилкарбонил, аминокарбонил, (С1-С4-алкил)аминокарбонил, ди-(С1-С3-алкил)аминокарбонил, гидроксикарбонил, (С1-С4-алкилокси)карбонил, С1-С4-алкикламино-, ди-(С1-С3-алкил)амино-, (С1-С4-алкил)карбониламино-, арилкарбониламино-, гетероарилкарбониламино-, С1-С4-алкилсульфониламино-, арилсульфониламино-группу, С1-С4-алкилсульфанил, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С3-С10-циклоалкилсульфанил, С3-С10-циклоалкилсульфинил, С3-С10-циклоалкилсульфонил, С3-С10-циклоалкенилсульфанил, С5-С10-циклоалкенилсульфинил, C5-C10-циклоалкенилсульфонил, арилсульфанил, арилсульфинил или арилсульфонил, причем алкильная, алкенильная, алкинильная, циклоалкильная или циклоалкенильная группы или части при необходимости могут быть частично или полностью фторированными и моно-либо дизамещенными одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила, а в циклоалкильной и циклоалкенильной группах или частях одна или две метиленовых группы при необходимости независимо друг от друга заменены NR3, О, S, CO, SO или SO2 и одна или две метиновых группы при необходимости заменены N;
R5 и R6 каждый независимо представляют водород, галоген, циано-, нитро-, гидрокси-группу, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, C1-С3-алкилокси- или С3-С10-циклоалкилокси-группу, причем алкильная, алкенильная, алкинильная, циклоалкильная или циклоалкенильная группы или части при необходимости могут быть частично или полностью фторированными и моно- либо дизамещенными одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкоксигруппы и C1-С3-алкила, а в циклоалкильной и циклоалкенильной группах или частях одна или две метиленовых группы при необходимости независимо друг от друга заменены NRa, О, S, CO, SO или SO2, и одна или две метиновых группы при необходимости заменены N, или
если R5 и R6 связаны с двумя соседними атомами углерода фенильного кольца, то R5 и R6 при необходимости могут быть соединены друг с другом, так что R5 и R6 вместе образуют С3-С5-алкиленовый, С3-С5-алкениленовый или бутадиениленовый мостик, который может быть частично или полностью фторированным и моно- либо дизамещенным одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила, причем одна или две метиленовых группы при необходимости заменены независимо друг от друга О, S, СО, SO, SO2 или NRa, а одна или две метиновых группы заменены N;
R7, R8, R9 и R10 каждый независимо представляют гидрокси-группу, (C1-C18-алкил)карбонилокси-, (С1-С18-алкил)оксикарбонилокси-, арилкарбонилокси-, арил-(С1-С3 алкил)карбонилокси-, (С3-С10-циклоалкил)карбонилокси-группу, водород, галоген, C1-С6 -алкил, С2-С6-алкенил, С2-С6-алкинил, (С3-С10-циклоалкил)С1-С3-алкил, (С5-С7 циклоалкенил)С1-С3-алкил, (арил)С1-С3-алкил, (гетероарил)С1-С3-алкил, C1-С6-алкилокси-, С2-С6-алкенилокси-, С2-С6-алкинилокси-, С3-С7-циклоалкилокси-, C5-C7-циклоалкенилокси-, арилокси, гетероарилкоси-, (С3-С7-циклоалкил)С1-С3-алкилокси-, (C5-С7-циклоалкенил)С1-С3-алкилокси-, (арил)С1-С3-алкилокси-, (гетероарил)С1-С3-алкилокси-, аминокарбонил, гидроксикарбонил, (С1-С4-алкил)аминокарбонил, ди-(С1-С3-алкил)аминокарбонил, (С1-С4-алкилокси)карбонил, (аминокарбонил)С1-С3-алкил, (C1-С4алкил)аминокарбонил-(С1-С3)-алкил, ди-(С1-С3-алкил)аминокарбонил-(С1-С3)-алкил, (гидроксикарбонил)С1-С3-алкил, (С1-С4-алкилокси)карбонил-(С1-С3)-алкил, (С3-С7-циклоалкилокси)С1-С3-алкил, (С5-С7-циклоалкенилокси)С1-С3-алкил, (арилокси)С1-С3-алкил, (гетероарилокси)С1-С3-алкил, С1-С4-алкилсульфонилокси-, арилсульфонилокси-, (арил)С1-С3-алкилсульфонилокси-, триметилсилилокси-, трет-бутилдиметилсилилокси- или цианогруппу; причем алкильная, алкенильная, алкинильная, циклоалкильная или циклоалкенильная группы или части при необходимости могут быть частично или полностью фторированными и моно- либо дизамещенными одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила, а одна или две метиленовых группы в циклоалкильной и циклоалкенильной группах или частях при необходимости независимо друг от друга заменены NRa, О, S, СО, SO или SO2;
и при необходимости R10 и R11 могут быть объединены с атомами углерода, к которым каждый из них присоединен, так что образуется 5-7-членное конденсированное циклоалкановое или циклоалкеновое кольцо, которое при необходимости может быть частично или полностью фторированным и моно- либо дизамещенным одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила, а одна или две метиленовых группы циклоалкильного и циклоалкенильного колец при необходимости независимо друг от друга заменены NRa О, S, CO, SO или SO2;
R11 и R12 каждый независимо представляют водород, галоген, гидрокси-группу, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, C1-С6-алкилокси-, С2-С6-алкенилокси-, С2-С6-алкинилокси- или С3-С6-циклоалкилокси-группу, причем алкильная, алкенильная, алкинильная и циклоалкильная группы или части при необходимости могут быть частично или полностью фторированными, или
R11 и R12 при необходимости могут быть соединены, так что R11 и R12 вместе с атомом углерода, к которому они присоединены, образуют С3-С7-спироциклоалкановое кольцо, которое при необходимости может быть частично или полностью фторированным и моно- либо дизамещенным одинаковыми или разными заместителями, выбираемыми из хлора, гидрокси-группы, C1-С3-алкокси-группы и C1-С3-алкила;
когда Q является Q1, а R11 и R12 оба представлены водородом, тогда, по меньшей мере, один из R10 или R14 представлен галогеном или R13 не является водородом, или R4 представлен С2-С6-алкинилом, С3-С10-циклоалкокси-, С5-С7-циклоалкенилокси-, (С3-С10-циклоалкил)С1-С3-алкилокси-, (С3-С7-циклоалкил)С3-С5-алкенилокси-, (С3-С7-циклоалкил)С3-С5-алкинилокси-, (С5-С10-циклоалкенил)С1-С3-алкилокси-, (C5-C8-циклоалкенил)С3-С5-алкенилокси- или (С5-С8-циклоалкенил)С3-С5-алкинилокси-группой, или
когда Q является Q2 и R11 представлен водородом, тогда, по меньшей мере, R10 представлен галогеном или R4 представлен С2-С6-алкинилом, С3-С10-циклоалкилокси-, С5-С7-циклоалкенилокси-, (С3-С10-циклоалкил)С1-С3-алкилокси-, (С3-С7-циклоалкил)С3-С5-алкенилокси-, (С3-С7-циклоалкил)С3-С5-алкинилокси-, (С5-С10-циклоалкенил)С1-С3-алкилокси-, (С5-С8-циклоалкенил)С3-С5-алкенилокси- или (С5-С8-циклоалкенил)С3-С5-алкинилокси-группой, или
когда Q является Q4, a R11 представлен водородом, тогда, по меньшей мере, R10 является галогеном, или R13 не является водородом, или R4 представлен С2-С6-алкинилом, С3-С10-циклоалкокси-, С5-С7-циклоалкенилокси-, (С3-С10-циклоалкил)С1-С3-алкилокси-, (С3-С7-циклоалкил)С3-С5-алкенилокси-, (С3-С7-циклоалкил)С3-С5-алкинилокси-, (С5-С10-циклоалкенил)С1-С3-алкилокси-, (С5-С8-циклоалкенил)С3-С5-алкенилокси- или (C5-C8-циклоалкенил)С3-С5-алкинилокси-группой,
R13 и R14 каждый независимо представляют водород, галоген, гидрокси-группу, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-диклоалкил, C1-С6-алкилокси-, С2-С6-алкенилокси-, С2-С6-алкинилокси- или С3-С6-циклоалкилокси-группу, причем алкильная, алкенильная, алкинильная и циклоалкильная группы или части при необходимости могут быть частично или полностью фторированными;
R15 независимо представляет кислород или CRbRc;
Ra независимо представляет водород, С1-С4-алкил или (С1-С4-алкил)карбонил, причем алкильные группы или части при необходимости могут быть частично или полностью фторированными; и
Rb и Rc каждый независимо представляют водород, галоген, или С1-С4-алкил, причем алкильные группы или части при необходимости могут быть частично или полностью фторированными.
На приводимых в настоящем документе изображениях химических структур там, где связь заместителя фенильной группы показана заканчивающейся близ центра фенильного кольца, это означает, что (если не оговорено иного) данный заместитель может быть связан в любом свободном положении фенильной группы, несущем атом водорода.
Настоящее изобретение включает все таутомеры и стереоизомеры соединений формулы I, как в составе смеси, так и в чистом (или в основном чистом) виде. Соединения по данному изобретению могут содержать асимметрические атомы углерода, и, соответственно, соединения формулы I могут существовать в диастереомерных или энантиомерных формах или в их смесях. Все конформационные изомеры (например, цис- и транс-изомеры) и все оптические изомеры (например, энантиомеры и диастереомеры), рацемические, диастереомерные и другие смеси таких изомеров, равно как и сольваты, гидраты, изоморфные, полиморфные и таутомерные формы входят в объем настоящего изобретения. Соединения по данному изобретению можно получить, используя в качестве исходного материала диастереомеры, энантиомеры или рацемические смеси. Далее диастереомерные и энантиомерные продукты могут быть разделены с помощью методов хроматографии, фракционной кристаллизации и других методов, известных специалистам в данной области техники.
Настоящим изобретением также предлагаются пролекарства соединений формулы I. Пролекарства соединений по данному изобретению включают (но не ограничены перечисленным ниже) эфиры карбоновых кислот, эфиры угольной кислоты, полуэфиры, эфиры фосфорной кислоты, нитроэфиры, эфиры серной кислоты, сульфоксиды, амиды, карбаматы, азо-соединения, фосфамиды, гликозиды, простые эфиры, ацетали и кетали. Пролекарства-эфиры и пролекарства-карбонаты могут образовываться, например, путем взаимодействия одной или более гидроксильных групп соединения формулы I с ацилирующими агентами, замещенными алкилом, алкокси-группой или арилом с помощью известных специалистам в данной области техники методов получения метилкарбонатов, ацетатов, бензоатов, пивалатов и проч. Иллюстративные примеры пролекарств - эфиров соединений по данному изобретению включают (но не ограничены перечисленным ниже) соединения формулы I, несущие карбоксильную группу, в которой свободный водород замещен С1-С4-алкилом, С1-С7-алканоилоксиметилом, 1-((С1-С5)алканоилокси)этилом, 1-метил-1-((С1-С5)алканоилокси)-этилом, С1-C5-алкоксикарбонилоксиметилом, 1-((С1-С5)алкоксикарбонилокси)этилом, 1-метил-1-((С1-С5)алкоксикарбонилокси)этилом, N-((C1-С5)алкоксикарбонил)аминометилом, 1-(N-((C1-С5)алкоксикарбонил)амино)этилом, 3-фталидилом, 4-кротонолактонилом, гамма-бутиролактон-4-илом, ди-N,N-(С1-С2)алкиламино(С2-С3)алкилом (например, бета-диметиламиноэтилом), карбамоил-(С1-С2)алкилом, N,N-ди(C1-С2)алкилкарбамоил-(С1-С2)алкилом и пиперидино-, пирролидино- или морфолино(С2-С3)алкилом. В объем данного изобретения входят модификации олигопептидов и производные подлежащих биологической деградации полимеров (описанные, например, в Int. J. Phami. 115, 61-67, 1995). Методы отбора и получения подходящих пролекарств представлены, например, в работах Т.Higuchi, V.Stella, "Prodrugs as Novel Delivery Systems," Vol.14, ACS Symposium Series, 1975; H. Bundgaard, "Design of Prodrugs," Elsevier, 1985; и "Bioreversible Carriers in Drug Design," ed. Edward Roche, American Pharmaceutical Association and Pergamon Press, 1987.
Предлагаются также фармацевтически приемлемые соли соединений формулы I и их пролекарств. В качестве реагентов для получения указанных фармацевтически приемлемых кислотно-аддитивных солей основных соединений по данному изобретению могут использоваться такие кислоты, которые образуют нетоксичные соли, содержащие фармацевтически приемлемые анионы (например, гидрохлориды, гидробромиды, гидроиодиды, нитраты, сульфаты, бисульфаты, фосфаты (одно- и двухзамещенные), ацетаты, лактаты, цитраты, кислые цитраты, тартраты, битартраты, сукцинаты, малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты и памоаты (1,1'-метилен-бис-2-гидрокси-3-нафтоаты). В качестве реагентов для получения указанных фармацевтически приемлемых основных солей кислых соединений по данному изобретению могут использоваться такие основания, которые образуют нетоксичные соли, содержащие фармацевтически приемлемые катионы, включая (но не ограничиваясь перечисленным ниже) катионы щелочных металлов (например, калия, лития и натрия) и щелочноземельных металлов (например, кальция и магния), аммония или водорастворимых аминов, например N-метилглюкамина (меглумина), низших алканолов аммония и другие основные соли фармацевтически приемлемых органических аминов (например, метиламина, этиламина, пропиламина, диметиламина, триэтаноламина, диэтиламина, трет-бутиламина, трет-октиламина, триметиламина, триэтиламина, этилендиамина, гидроксиэтиламина, морфолина, пиперазина, дегидроабиэтиламина, лизина и гуанидина).
Настоящее изобретение также включает изотопно-меченные соединения формулы I, в которых один или более атомов замещены одним или более атомами с характерной атомной массой или массовым числом. Примеры изотопов, которые могут быть в составе соединений по данному изобретению, включают (но не ограничены перечисленным ниже)
изотопы водорода, углерода, азота, кислорода, фтора, серы и хлора (например, 2Н, 3Н, 13С, 14С, 15N, 18О, 17О, 18F, 35S и 36Cl). В объем данного изобретения входят изотопно-меченные соединения формулы I и их пролекарства, фармацевтически приемлемые соли соединений формулы I и их пролекарств. Изотопно-меченные соединения по данному изобретению полезны при изучении распределения в тканях организма соединений по данному изобретению и их пролекарств и метаболитов; предпочтительные изотопы для таких исследований включают 3Н и 14С. Кроме того, в некоторых обстоятельствах замещение более тяжелыми изотопами, например дейтерием (2H), может обеспечить повышенную метаболическую стабильность, и другие терапевтические преимущества, как, например, продление времени полужизни in vivo или сокращение требуемой дозы. Изотопно-меченные соединения по данному изобретению и их пролекарства, как правило, можно получить описанными здесь способами, заменяя немеченый реагент соответствующим изотопно-меченным реагентом.
В предпочтительных воплощениях настоящего изобретения А представляет кислород или одинарную связь. В особенно предпочтительных воплощениях А представляет одинарную связь.
В предпочтительных воплощениях настоящего изобретения Z представляет кислород, серу или метилен, при необходимости замещенные одним или двумя заместителями, независимо выбираемыми из галогена, гидрокси-группы, C1-С6-алкила, C1-С6-алкокси-группы, С3-С6-циклоалкила и С3-С6-циклоалкилокси-группы. В особенно предпочтительных воплощениях настоящего изобретения Z представлен метиленом.
В предпочтительных воплощениях настоящего изобретения R1, R2 и R3 независимо друг от друга представляют каждый водород, галоген, гидрокси-группу, С1-С6-алкил, С2-С6-алкенил,С2-С6-алкинил, С3-С10-циклоалкил, C1-С6-алкилокси-группу или цианогруппу. В особенно предпочтительных воплощениях R1, R2 и R3 независимо друг от друга представляют каждый водород, галоген или C1-С6-алкил. В еще более предпочтительных воплощениях R1 представляет водород, галоген или C1-С6-алкил, а R2 и R3 оба представляют водород.
В предпочтительных воплощениях настоящего изобретения R4 представляет C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, C1-С6-алкилокси-, С3-С10циклоалкилокси-, (С3-С10 циклоалкил)С1-С3-алкилокси-, (С3-С7-циклоалкил)С3-С5-алкенилокси- или (С3-С7-циклоалкил)С3-С5 алкинилокси-группу.
В предпочтительных воплощениях настоящего изобретения R5 и R6 независимо друг от друга представляют каждый водород, галоген, гидрокси-группу, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, C1-С6-алкилокси- или цианогруппу. В особенно предпочтительных воплощениях R5 и R6 независимо друг от друга представляют каждый водород, галоген или C1-С6-алкил. В еще более предпочтительных воплощениях R5 и R6 оба представляют водород.
В предпочтительных воплощениях настоящего изобретения R7, R8, R9 и R10 независимо друг от друга представляют каждый галоген, гидрокси-группу, C1-С6-алкил, C1-С6-алкилокси-, (С3-С7)циклоалкилокси-, арилокси- или (С3-С7)циклоалкил-(С1-С3)алкилокси-группу, в которых алкильная и циклоалкильные группы или части могут быть частично или полностью фторированными. В особенно предпочтительных воплощениях R7, R8, R9 и R10 каждый представляет гидрокси-группу.
В предпочтительных воплощениях настоящего изобретения R11 представляет водород или гидрокси-группу.
В предпочтительных воплощениях настоящего изобретения, R12, R13 и R14 представляют водород.
В предпочтительных воплощениях настоящего изобретения R15 представляет кислород или CRbRc, где Rb и Rc независимо друг от друга представляют каждый водород или галоген.
Как отмечалось выше, формула IA представляет иные предпочтительные воплощения:

где R1 представляет водород, галоген или C1-С6-алкил; R4 представляет C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С10-циклоалкил, C1-С6-алкилокси-группу, С3-С10-циклоалкилокси-, (С3-С10-циклоалкил)С1-С3-алкилокси-группу, (С3-С7-циклоалкил)С3-С5-алкенилокси-группу или (С3-С7-циклоалкил)С3-С5-алкинилокси-группу; a Q выбирают из следующих формул Q1A-Q4A:


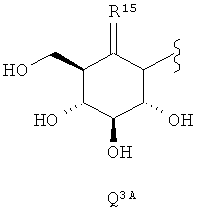

где R11 представляет водород или гидрокси-группу, а R15 представляет кислород или CRbRc, где Rb и Rc независимо друг от друга представляют каждый водород или галоген; где в том случае, когда R11 является водородом, R4 представляет C2-С6-алкинил, С3-С10-циклоалкилокси-, (С3-С10-циклоалкил)С1-С3-алкилокси-группу, (С3-С7-циклоалкил)С3-С5-алкенилокси-группуили (С3-С7-циклоалкил)С3-С5-алкинилокси-группу. В некоторых воплощениях изобретения Q выбирают из группы, состоящей из формул Q1A-Q3A
В особенно предпочтительных воплощениях соединения по данному изобретению выбирают из:

(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этоксибензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-циклопропилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола
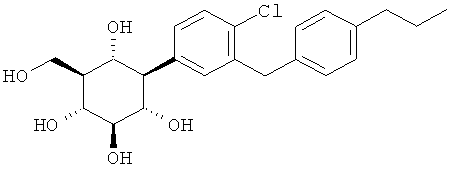
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-пропилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-циклогексилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1R,2S,3S,6R)-4-(4-хлор-3-(4-(3-циклопропилпроп-2-инилокси)бензил)фенил)-6-(гидроксиметил)циклогекс-4-ен-1,2,3 -триола

((1S,2R,3R,4S,5R,6R)-3-(4-хлор-3-(4-этилбензил)фенил)-2,4,5,6-тетрагидроксициклогексил)метилацетата

(1R,2S,3R,4R,5S,6R)-4-(2-(4-этилбензил)фенокси)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1S,2R,3S,4S,6R)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)-5-метиленциклогексан-1,2,3-триола
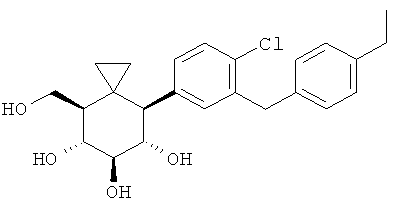
(4S,5S,6R,7R,8R)-4-(4-хлор-3-(4-этилбензил)фенил)-8-(гидроксиметил)спиро[2.5]октан-5,6,7-триола

1-(4-(2-хлор-5-((1R,2S,3R,4R,5S,6R)-2,3,4,6-тетрагидрокси-5-(гидроксиметил)циклогексил)бензил)фенил)этанона
и 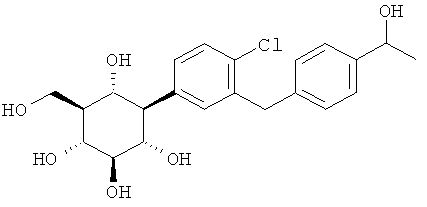
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-(1-гидроксиэтил)бензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола
Другой вариант настоящего изобретения включает соединения формулы I и их фармацевтически приемлемые соли, пролекарства и/или изотопно-меченные соединения, в которых алкильная, алкенильная, алкинильная, циклоалкильная, циклоалкенильная, арильная и гетероарильная группы или части при необходимости замещены одним-тремя подходящими заместителями, описанными выше.
В еще одном варианте настоящего изобретения предлагаются интермедиаты и способы, применимые для получения перечисленных ниже интермедиатов, а также соединений формулы I и их фармацевтически приемлемых солей и пролекарств.
Такие способы приведены в описанных ниже общих препаративных методах, изображенных на схемах фигур 1 и 2, а более детальные конкретные примеры представлены в разделе, посвященном экспериментам и описывающим рабочие примеры (фигуры 3-8). Следуя обсуждаемым ниже общим препаративным методам или применяя варианты альтернативных методов, можно легко получить соединения по настоящему изобретению, используя химические реакции и приемы, известные специалистам в данной области техники. Варьирующие значимые группы (например, R-группы) в описанных ниже общих методах имеют то значение, которое указано выше, если не оговорено иного.
Специалистам в данной области техники будет понятно, что соединения по настоящему изобретению с каждой из описанных функциональных групп, как правило, можно получить, несколько изменяя перечисленные ниже общие способы. В рамках каждого способа используются функциональные группы, подходящие к условиям данной реакции. Функциональные группы, которые могут мешать определенным реакциям, представлены, если необходимо, в защищенной форме; удаление защитных групп осуществляется на соответствующих стадиях с помощью приемов, хорошо известных специалистам в данной области техники.
В некоторых случаях соединения по данному изобретению могут быть получены из других соединений по данному изобретению путем изменения, обмена и т.п.имеющихся функциональных групп.Такие изменения включают (но не исчерпываются перечисленным) гидролиз, восстановление, окисление, алкилирование, ацилирование, этерификацию, амидирование и дегидрирование. Для осуществления этих изменений в некоторых случаях может потребоваться использование защитных групп при помощи методов, описанных в работах Т. W. Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis, 4th Edition; Wiley: New York, (2007) и P.J.Kocienski, Protecting Groups, 3rd Edition; Georg Thieme Verlag: Stuttgart, (2005), включенных в настоящий документ путем отсылки. Такие методы применяют после синтеза желаемого соединения или на иной стадии пути синтеза - где именно, должно быть ясно специалистам в данной области техники.
В другом своем аспекте настоящее изобретение предоставляет синтетические интермедиаты, которые можно использовать для получения соединений формулы I, их фармацевтически приемлемых солей и пролекарств, согласно общим препаративным методам, обсуждаемым ниже, и другим методам, известным специалистам в данной области техники.
В тексте ниже используются следующие сокращения в указанном здесь значении:
Ас2О - уксусный ангидрид; AcOEt - этилацетат; АсОН - уксусная кислота; AlBr3 - бромид алюминия; AlCl3 - хлорид алюминия; BBr3 - трибромид бора; BF3·Et2O - эфират трехфтористого бора; n-BuLi - н-бутиллитий; s-BuLi - втор-бутиллитй; t-BuLi - трет-бутиллитий; t-BuOK - трет-бутоксид, калия; CaCl2 - хлорид кальция; расч. - расчетная величина; CD3OD - метанол-d4; CDCl3 - хлороформ-d; CF3SO3H - трифторметансульфоновая кислота; CH2Cl2 - хлористый метилен; CH2I2 - йодистый метилен; CH3CN - ацетонитрил; (COCl)2 - оксалилхлорид; DAST - трифторид диэтиламиносеры; DCM - дихлорметан; DIAD - диизопропилазодикарбоксилат; DMAP - 4-диметиламинопиридин; DMEM - среда Игла, модифицированная по Дульбекко; DMF -N,N-диметилформамид; DMP - периодинан Десс-Мартина; DMSO - диметилсульфоксид; ЕА - этилацетат; экв. - эквиваленты; ESI - ионизация электрораспылением; Et - этил; Et3SiH - триэтилсилан; EtOAc - этилацетат; EtOH - этиловый спирт (этанол); FBS - фетальная телячья сыворотка; ч - час; Н2 - водород (газ); H2SO4 - серная кислота; Hepes - 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота; 1Н-ЯМР - протонный магнитный резонанс; HPLC - высокоэффективная жидкостная хроматография (ВЭЖХ); К2СО3 - карбонат калия; K2CrO7 - бихромат калия; КОН - гидроксид калия; LC-ESI-MS - жидкостная хроматография/ионизация электрораспылением/масс-спектрометрия; LC-MS-жидкостная хроматография/масс-спектрометрия; Me - метил; МеОН - метанол (метиловый спирт); MeSO3H - метансульфоновая кислота; Mg - магний; MgCl2 -хлористый магний; мин - минуты; MS - масс-спектрометрия; MsOH - метансульфоновая кислота; NaH - гидрид натрия; NaHCO3 - бикарбонат натрия; NaOAc - ацетат натрия; NaOH - гидроксид натрия; Na2SO4 - сульфат натрия; NH4Cl - хлористый аммоний; Pd/C -палладий на угле; РЕ - петролейный эфир; Ph - фенил; POCl3 - оксихлорид фосфора; PPh3 - трифенилфосфин; Rf - коэффициент удерживания; rt - комнатная температура; SOCl2 - тионилхлорид; TBAI - йодистый тетрабутиламмоний; TFA - трифторуксусная кислота; THF - тетрагидрофуран; TLC - тонкослойная хроматография; TMS - триметилсилил; Tris - тригидроксиметиламинометан (или 2-амино -2-(гидроксиметил)пропан -1,3-диол).
Общий способ синтеза по схеме I
Соединения по данному изобретению формулы I можно получить согласно последовательности реакций, как показано на схеме I (фигура 1).
Как показано на схеме I, кислота А1, покупная или полученная по стандартным описанным в литературе методикам, превращается в хлорид А2 под действием ацилирующего агента, как, например, оксалилхлорида, SOCl2 или POCl3 и т.п. Хлорид А2 взаимодействует с замещенным бензолом A3 в присутствии кислоты Льюиса, например AlCl3 или AlBr3, с образованием кетона А4. Кетогруппа интермедиата А4 избирательно восстанавливается в метиленовую при участии восстановителя, например Et3SiH, в присутствии кислоты Льюиса, например BF3·Et2O или TFA. В результате обработки А5 активирующим агентом, например n-BuLi, s-BuLi или t-BuLi, или Mg при подходящей температуре в таком растворителе, как THF, с последующим добавлением интермедиата А6, образуется интермедиат А7. Интермедиат А8 получается путем обработки А7 восстановителем, например Et3SiH, в присутствии кислоты Льюиса, например BF3·Et2O или TFA. Затем А8 окисляется с образованием интермедиата А9, который подвергается депротекции, так что получается соединение по данному изобретению А10. Или же путем окисления А9 может быть получено соединение АН.
Общий способ синтеза по схеме II
Соединения по данному изобретению формулы I можно также получить согласно последовательности реакций, как показано на схеме II (фигура 2).
Как показано на схеме II, кислота А12, покупная или полученная по стандартным описанным в литературе методикам, превращается в хлорид A13 под действием ацилирующего агента, как, например, оксалилхлорида, SOCl2 или POCl3 и т.п. Хлорид A13 взаимодействует с замещенным бензолом A3 в присутствии кислоты Льюиса, например AlCl3 или AlBr3, с образованием кетона А14. Кетогруппа интермедиата А14 избирательно восстанавливается в метиленовую при участии восстановителя, например Et3SiH, в присутствии кислоты Льюиса, например BF3·Et2O или TFA, а затем в результате снятия защиты получается интермедиат А15. Путем реакции сочетания А15 с А16 образуется интермедиат А17. В результате окисления А17 образуется интермедиат А18, который подвергается снятию защиты с образованием соединения по данному изобретению А19.
Фармацевтические композиции и способы применения
Настоящее изобретение также предоставляет фармацевтические композиции, содержащие эффективное количество соединения или смеси соединений формулы I, или их фармацевтически приемлемых солей либо пролекарств в фармацевтически приемлемом носителе.
Соединения по данному изобретению могут быть включены в состав различных лекарственных форм для терапевтического введения. Более конкретно соединения по данному изобретению могут входить в состав фармацевтических композиций, в отдельности или вместе с подходящими фармацевтически приемлемыми носителями или разбавителями, и могут быть в составе препаратов, имеющих твердую, полужидкую, жидкую или газообразную форму, например таблеток, капсул, пилюль, порошков, гранул, драже, гелей, суспензий, мазей, растворов, суппозиториев, препаратов для инъекций, для ингаляций и аэрозолей. Соответственно, введение в организм соединений по данному изобретению может осуществляться различными путями, включая пероральный, трансбуккальный, парентеральный, внутривенный, внутрикожный (например, подкожный, внутримышечный), чрескожный и т.д. Кроме того, соединение по данному изобретению может применяться не системно, а местно, например, в составе препаратов типа депо или с постепенным высвобождением лечебного агента.
Подходящие составы для применения в данном изобретении имеются в работе Remington: The Science and Practice of Pharmacy, 21st Ed., Gennaro, Ed., Lippencott Williams & Wilkins (2003), которая включена в данный документ путем отсылки. Описанные здесь фармацевтические композиции могут быть изготовлены при помощи приемов, хорошо известных специалистам в данной области, а именно путем смешивания, растворения, гранулирования, формования драже, измельчения в порошок, эмульгирования, покрывания оболочкой или лиофилизации. Описанные ниже способы и эксципиенты служат лишь для примера и не ограничивают объем изобретения.
В одном предпочтительном воплощении соединения по данному изобретению приготовляют для доставки в организме с постепенным, контролируемым, длительным (пролонгированным) либо отсроченным, непрерывным или периодическим высвобождением, например, в полупроницаемых матриксах из твердых гидрофобных полимеров, содержащих терапевтический агент. Для постепенного высвобождения лекарств существуют различные материалы, хорошо известные специалистам в данной области техники. Современные лекарственные формы для длительного высвобождения лечебного агента включают покрытые пленкой таблетки, системы на основе множественных микрогранул или микрокапсул (пеллет), матриксные (каркасные) технологии с использованием гидрофильных или липофильных материалов, парафинированные таблетки с порообразующими эксципиентами (см., например, Huang, et al. Drug Dev. Ind. Pharm. 29:79 (2003); Peamchob, et al. Drug Dev. Ind. Pharm. 29:925 (2003); Maggi, et al. Eur. J. Pharm. Biopharm. 55:99 (2003); Khanvilkar, et al.. Drug Dev. Ind. Pharm. 228:601 (2002); Schmidt, et al., Int. J. Pharm. 216:9 (2001)). Системы доставки с постепенным высвобождением лечебного агента в зависимости от своего устройства выделяют соединения по данному изобретению на протяжении часов или дней, например в течение 4, 6, 8, 10, 12, 16, 20, 24 часов или более. Обычно препараты с постепенным высвобождением лечебного агента можно изготовить, используя природные или синтетические полимеры, например, полимерные винилпирролидоны (поливинилпирролидон - PVP и т.п.), карбоксивиниловые гидрофильные полимеры, гидрофобные и/или гидрофильные гидроколлоиды (метилцеллюлоза, этилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и т.п.), а также карбоксиполиметилен.
Препараты с постепенным или длительным высвобождением лечебного агента также могут быть изготовлены с использованием природных ингредиентов, например, минералов, включая диоксид титана, диоксид кремния, оксид цинка и глину (см. патент США 6,638,521, включенный в настоящий документ путем отсылки). Примерные составы препаратов с пролонгированным высвобождением лекарственного вещества, которые могут использоваться для доставки соединений по данному изобретению, включают приведенные в патентах США №№6,635,680; 6,624,200; 6,613,361; 6,613,358, 6,596,308; 6,589,563; 6,562,375; 6,548,084; 6,541,020; 6,537,579; 6,528,080 и 6,524,621, каждый из которых включен в настоящий документ путем отсылки. Препараты с контролируемым высвобождением, представляющие особый интерес, включают описанные в патентах США №№6,607,751; 6,599,529; 6,569,463; 6,565,883; 6,482,440; 6,403,597; 6,319,919, 6,150,354; 6,080,736; 5,672,356; 5,472,704; 5,445,829; 5,312.817 и 5,296,483, каждый из которых включен в настоящий документ путем отсылки. Специалистам в данной области техники очевидны и другие подходящие составы для постепенного высвобождения лечебного агента.
Для перорального введения соединения по данному изобретению могут быть легко объединены с фармацевтически приемлемыми носителями, хорошо известными в данной области техники. Такие носители позволяют включить соединения по данному изобретению в состав таблеток, пилюль, драже, капсул, эмульсий, липофильных и гидрофильных суспензий, жидких форм, гелей, сиропов, взвесей, суспензий и проч. для приема через рот подлежащим лечению пациентом. Фармацевтические препараты для перорального введения могут быть получены путем смешения соединений по данному изобретению с твердыми эксципиентами, при необходимости с измельчением получаемой смеси, и переработкой ее в гранулы после добавления желаемых дополнительных компонентов для формирования таблеток или сердцевинной части драже. К числу подходящих эксципиентов принадлежат, в частности, наполнители, например сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, например кукурузный, пшеничный, рисовый и картофельный крахмал, желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрий-карбоксиметилцеллюлозу и/или поливинилпирролидон (PVP). По желанию могут быть добавлены дезинтегрирующие агенты, например поперечно-сшитый поливинилпирролидон, агар или альгиновая кислота или их соли, например альгинат натрия.
Фармацевтические препараты, которые можно применять перорально, включают твердые (push-fit) капсулы из желатина, а также мягкие закрытые капсулы, сделанные из желатина и пластификатора, например глицерина или сорбита. Твердые (push-fit) капсулы могут содержать активные ингредиенты в смеси с наполнителем, например лактозой;
связующими агентами, например крахмалами; смазывающими агентами, например тальком или стеаратом магния, и, при необходимости, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, например жидких жирах, вазелиновом масле или жидких полиэтиленгликолях. Кроме того, можно добавлять стабилизаторы. Все композиции для перорального приема должны быть в лекарственной форме, подходящей для данного способа введения.
В препаратах типа драже ядро покрывают подходящей оболочкой. Для этой цели можно использовать концентрированные растворы сахара, которые при необходимости могут содержать аравийскую камедь, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. В оболочки для драже или таблеток можно добавлять красители или пигменты для того, чтобы отличать данный препарат от других или характеризовать различные комбинации доз активных соединений.
Соединения по данному изобретению могут быть подготовлены для парентерального введения путем инъецирования, например инъекции ударной дозы или же непрерывной инфузии. Для инъецирования соединение по данному изобретению может быть включено в состав инъецируемого препарата путем растворения, суспендирования или эмульгирования в водном либо неводном растворителе, например в растительном или ином подобном масле, синтетических глицеридах алифатических кислот, эфирах высших алифатических кислот или пропиленгликоле; по желанию в состав такого препарата могут быть включены добавочные компоненты, например солюбилизирующие, изотонические, суспендирующие, эмульгирующие, стабилизирующие агенты и консерванты. Предпочтительно соединения по данному изобретению включают в состав водных растворов, предпочтительно с физиологически совместимыми буферными веществами, например растворов Хэнкса, Рингера или физиологического солевого раствора. Составы для инъецирования могут быть представлены в виде единой лекарственной формы, например в ампулах или емкостях, содержащих несколько доз, с добавленными консервантами. Композиции по данному изобретению могут быть в форме суспензий, растворов или эмульсий в масляном либо водном носителе и могут содержать такие обычно используемые в лекарственных препаратах компоненты, как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Фармацевтические композиции для парентерального введения включают водные растворы активных соединений в водорастворимой форме. Кроме того, можно готовить суспензии активных соединений на подходящей масляной основе для инъекций. Приемлемые липофильные растворители или носители включают жидкие жиры, например кунжутное масло, или синтетические эфиры жирных кислот, например этилолеат или триглицериды, или же липосомы. Водные суспензии для инъекций могут содержать вещества, увеличивающие вязкость, например натрий-карбоксиметилцеллюлозу, сорбит или декстран. При необходимости суспензия по данному изобретению может содержать также приемлемые стабилизирующие агенты или агенты, повышающие растворимость соединений по данному изобретению, чтобы можно было готовить высококонцентрированные растворы. Или же активный ингредиент может быть в форме порошка, предназначенного для объединения с приемлемым носителем, например стерильной апирогенной водой, перед использованием.
Системное введение может осуществляться также чрез слизистые или кожу. Для трансдермального или трансмукозального введения в состав препарата включаются компоненты, обеспечивающие его проникновение через барьер покровных тканей. Для местного введения лечебные агенты включаются в состав мазей, кремов, линиментов, порошков и гелей. В одном воплощении настоящего изобретения агентом для трансдермальной доставки служит ДМСО. Системы трансдермальной доставки лекарств включают, например, пластыри. Для трансмукозального введения в состав лекарственного препарата включают вещества, обеспечивающие его проникновение через барьер покровных тканей; такие вещества широко известны в данной области техники. Примерные составы препаратов для трансдермального введения, которые можно использовать в настоящем изобретении, включают описанные в патентах США №№6,589,549; 6,544,548; 6,517,864; 6,512,010; 6,465,006; 6,379,696; 6,312,717 и 6,310,177, каждый из которых включается в данный документ путем отсылки.
Для трансбуккального введения композиции по данному изобретению могут быть в форме таблеток или леденцов, составленных обычным образом.
Помимо ранее описанных препаратов, соединения по данному изобретению могут быть также включены в состав депо-препаратов. Такие долго действующие препараты могут вводиться путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, в состав такого препарата вместе с соединениями по данному изобретению могут входить приемлемые для этой цели полимерные или гидрофобные материалы (например, в виде эмульсии с подходящим маслом) или ионообменные смолы, или умеренно растворимые производные, например, умеренно растворимые соли.
Фармацевтические композиции по данному изобретению могут также содержать подходящие твердые или гелевые носители или эксципиенты. Примеры таких носителей или эксципиентов включают (но не ограничиваются перечисленным здесь) карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, например полиэтиленгликоли.
Фармацевтические композиции, пригодные для использования по данному изобретению, включают композиции, в которых активные ингредиенты содержатся в терапевтически эффективном количестве. Настоящее изобретение также охватывает фармацевтические композиции, содержащие соединения формулы I в смеси с эффективным количеством других терапевтических агентов, в комбинации с которыми они должны применяться, в частности тех, которые используются для лечения заболеваний и состояний, подверженных влиянию ингибирования SGLT, например лекарств против диабета; агентов, понижающих/модулирующих уровень липидов; средств для лечения диабетических осложнений; средств против ожирения; антигипертензивных агентов; антигиперурикемических агентов; средств для лечения хронической сердечной недостаточности, атеросклероза и родственных расстройств. Эффективное количество соединения(й) по данному изобретению и комбинируемых с ним(и) других лечебных агентов, будет, разумеется, зависеть от конкретного случая: индивидуальных особенностей пациента, тяжести поражения и пути введения лекарства. Определение эффективного количества лечебных агентов вполне в компетенции специалистов в данной области техники, особенно в свете представленного в настоящем документе подробного описания. Обычно действенность или эффективность того или иного количества какого-либо соединения определяют, вводя первый раз низкую дозу или небольшое количество и затем понемногу увеличивая вводимую дозу или повышая дозировку до тех пор, пока у получающего лекарство индивида не будет достигнут желаемый терапевтический эффект с минимальными токсическими побочными эффектами или вообще без них. Применяемые на практике методы для определения оптимальных доз, дозировки и схемы введения лекарства, приемлемые в данном изобретении, описаны, например, в работах Goodman and Gilman's The Pharmacological Basis of Therapeutics, IIth Ed., Brunton, Lazo and Parker, Eds., McGraw-Hill (2006), и Remington: The Science and Practice of Pharmacy, 21st Ed., Gennaro, Ed., Lippencott Williams & Wilkins (2003), которые включены в настоящий документ путем отсылки.
Настоящим изобретением предлагаются также способы применения соединений формулы I для предотвращения и лечения заболеваний. В одном воплощении данного изобретения предлагается способ лечения сахарного диабета типов 1 и 2, гипергликемии, диабетических осложнений (ретинопатии, нефропатии, диабетических язв, микро- и макроангиопатий, подагры и синдрома диабетической стопы), инсулинорезистентности, метаболического синдрома (синдрома X), гиперинсулинемии, гипертензии, гиперурикемии, ожирения, отеков, дислипидимии, хронической сердечной недостаточности, атеросклероза и родственных заболеваний; этот способ включает введение эффективного количества соединения или смеси соединений формулы I, или их фармацевтической приемлемых солей или пролекарств нуждающемуся в том субъекту. В другом воплощении предлагается способ применения соединения или смеси соединений формулы I, или их фармацевтической приемлемых солей или пролекарств для приготовления лекарственного препарата для лечения сахарного диабета типов 1 и 2, гипергликемии, диабетических осложнений, инсулинорезистентности, метаболического синдрома, гиперинсулинемии, гипертензии, гиперурикемии, ожирения, отеков, дислипидимии, хронической сердечной недостаточности, атеросклероза и родственных заболеваний.
Настоящее изобретение также охватывает применение соединений формулы I. или их фармацевтически приемлемых солей или пролекарств в сочетании с другими терапевтическими агентами, особенно с теми, которые применяются для лечения перечисленных выше заболеваний и состояний, например лекарств против диабета; агентов, понижающих/модулирующих уровень липидов; средств для лечения диабетических осложнений; средств против ожирения; антигипертензивных агентов; антигиперурикемических агентов; средств для лечения хронической сердечной недостаточности, атеросклероза и родственных расстройств. Специалистам в данной области техники должно быть понятно, что другие обсуждаемые ниже терапевтические агенты могут найти множество применений, а упоминание того или иного агента в каком-либо конкретном применении не подразумевает никаких ограничений его использования в комбинированной терапии с соединениями по данному изобретению.
Примеры средств против диабета, пригодных для применения в сочетании с соединениями по данному изобретению, включают инсулин и инсулиномиметики, сульфонилмочевины (например, ацетогексамид, карбутамид, хлорпромамид, глибенкламид, глиборнурид, гликлазид, глимепирид, глипизид, гликидон, глизоксепид, глибурид, гликлопирамид, толазамид, толцикламид, толбутамид и т.п.), усилители секреции инсулина (например, JTT-608, глибузол и т.п.), бигуаниды (например, метформин, буформин, фенформин и т.п.), комбинации сульфонилмочевин с бигуанидами (например, глибурид/метформин и т.п.), меглитиниды (например, репаглинид, натеглинид, митиглинид и т.п.), тиазолидиндионы (например, розиглитазон, пиоглитазон, изаглитазон, нетоглитазон, ривоглитазон, балаглитазон, дарглитазон, CLX-0921 и т.п.), комбинации тиазолидиндионов с бигуанидами (например, пиоглитазон/метформин и т.п.), оксадиазолидиндионы (например, YM440 и т.п.), агонисты гамма-рецептора, активирующего пролиферацию пероксисом (PPAR) (например, фарглитазар, метаглидазен, МВХ-2044, GI 262570, GW1929, GW7845 и т.п.), агонисты двух PPAR (альфа/гамма) (например, мураглитазар, навеглитазар, тезаглитазар, пелиглитазар, JTT-501, GW-409544, GW-501516 и т.п.), агонисты альфа, гамма и дельта-PPAR (например, PLX204, GlaxoSmithKline 625019, GlaxoSmithKline 677954 и т.п.), агонисты Х-рецептора ретиноидов (например, A1RT-268, AGN-4204, MX-6054, AGN-194204, LG-100754, бексаротен и т.п.), ингибиторы альфа-глюкозидазы (например, акарбоза, миглитол и т.п.), стимуляторы тирозинкиназы рецептора инсулина (например, TER-17411, L-783281, KRX-61 Зи т.п.), ингибиторы трипептидил-пептидазы II (например, UCL-1397 и т.п.), ингибиторы дипептидил-пептидазы IV (например, ситаглиптин, вилдаглиптин, денаглиптин, саксаглиптин, NVP-DPP728, Р93/01, Р32/98, FE 99901, TS-021, TSL-225, GRC8200, соединения, описанные в патентах США №№. 6,869,947; 6,727,261; 6,710,040; 6,432,969; 6,172,081; 6,011,155, ит.п.), ингибиторы тирозиновой протеинфосфатазы-1B и т.п.(например, KR61639, IDD-3, РТР-3848, РТР-112, ОС-86839, PNU-177496, соединения, описанные в работе Vats, R.K., et aL, Current Science, Vol.88, No. 2, 25 January 2005, pp.241-249, и т.п.), ингибиторы гликогенфолсфорилазы (например, NN-4201, СР-368296 и т.п.), ингибиторы глюкозо-6-фосфатазы, ингибиторы фруктозо-1,6-дифосфатазы (например, CS-917, MB05032 и т.п.), ингибиторы пируватдегидрогеназы (например, AZD-7545 и т.п.), производные имидазолина (например, BL11282 и т.п.), ингибиторы глюконеогенеза в печени (например, FR-225659 и т.п.), D-хироинозитол, ингибиторы киназы-3 гликогенсинтазы (например, соединения, описанные в работе Vats, R.K., et al., Current Science, Vol.88, No. 2, 25 January 2005, pp.241-249, и т.п.), инкретин-миметики (например, экзенатид и т.п.), антагонисты рецептора глюкагона (например, BAY-27-9955, NN-2501, NNC-92-1687 и т.п.), глюкагоноподобный пептид-1 (GLP-1), аналоги GLP-1 (например, лираглютид, CJC-1131, AVE-0100 и т.п.), агонисты рецептора GLP-1 (например, AZM-134, LY-315902, GlaxoSmithKline 716155 и т.п.), амилин, аналоги и агонисты амилина (например, прамлинтид и т.п.), ингибиторы белка, связывающего жирные кислоты (аР2) (например, соединения, описанные в патентах США №№6,984,645; 6,919,323; 6,670,380; 6,649,622; 6,548,529 и т.п.), агонисты адренергических бета-3-рецепторов (например, солабегрон, CL-316243, L-771047, FR-149175 и т.п.) и другие усилители чувствительности к инсулину (например, регликсан, ONO-5816, МВХ-102, CRE-1625, FK-614, CLX-0901, CRE-1633, NN-2344, BM-13125, BM-501050, HQL-975, CLX-0900, MBX-668, MBX-675, S-15261, GW-544, AZ-242, LY-510929, AR-H049020, GW-501516 и т.п.).
Примеры агентов для лечения диабетических осложнений, пригодных для применения в сочетании с соединениями по данному изобретению, включают ингибиторы альдозоредуктазы (например, эпалрестат, имирестат, толрестат, миналрестат, поналрестат, зополрестат, фидарестат, аскорбилгамоленат, ADN-138, BAL-ARI8, ZD-5522, ADN-311, GP-1447, IDD-598, ризарестат, зенарестат, метосорбинил, AL-1567, M-16209, TAT, AD-5467, AS-3201, NZ-314, SG-210, JTT-811, линдолрестат, сорбинил и т.п.), ингибиторы образования конечных продуктов неферментативного гликозилирования (AGE) (например, пиридоксамин, ОРВ-9195, ALT-946, ALT-711, пимагедин и т.п.), агенты, разрушающие AGE (например, ALT-711 и т.п.), сулодексид, 5-гидрокси-1-метилгидантоин, инсулиноподобный фактор роста; фактор роста, происходящий из тромбоцитов; аналоги фактора роста, происходящего из тромбоцитов; фактор роста эпидермиса, фактор роста нервов, уридин, ингибиторы протеинкиназы С (например, рубоксистаурин, мидостаурин и т.п.), антагонисты натриевых каналов (например, мексилетин, окскарбазепин и т.п.), ингибиторы ядерного фактора κВ (NF-κВ) (например, декслипотам и т.п.), ингибиторы пероксидазы липидов (например, тирилазад мезилат и т.п.), ингибиторы NAAG-пептидазы (глутаматкарбоксипептидазы, расщепляющей N-ацетиласпартилглутамат) (например, GPI-5232, GPI-5693 и т.п.) и производные карнитина (например, карнитин, левацекамин (ацетил-L-карнитин), левокарнитин, ST-261 и т.п.).
Примеры антигиперурикемических агентов, пригодных для применения в сочетании с соединениями по данному изобретению, включают ингибиторы синтеза мочевой кислоты (например, аллопуринол, оксипуринол и т.п.), урикозурические агенты (например, пробенецид, сульфинпиразон, бензбромарон и т.п.) и средства, защелачивающие мочу (например, бикарбонат натрия, цитрат калия, цитрат натрия и др.)
Примеры понижающих/модулирующих уровень липидов агентов, пригодных для применения в сочетании с соединениями по данному изобретению, включают ингибиторы гидроксиметилглутарил-коэнзим А-редуктазы (например, ацитемат, аторвастин, бервастатин, карвастатин, церивастатин, колестолон, крилвастатин, далвастатин, флувастатин, гленвастатин, ловастатин, мевастатин, нисвастатин, питавастатин, правастатин, ритонавир, розувастатин, сакинавир, симвастатин, визастатин, SC-45355, SQ-33600, СР-83101, ВВ-476, L-669262, S-2468, DMP-565, U-20685, BMS-180431, BMY-21950, соединения, описанные в патентах США №№5,753,675; 5,691,322; 5,506,219; 4,686,237; 4,647,576; 4,613,610; 4,499,289 и т.п.), производные фибровой кислоты (например, гемфиброзил, фенофибрат, безафибрат, беклофибрат, бинифибрат, ципрофибрат, клинофибрат, клофибрат, этофибрат, никофибрат, пирифибрат, ронифибрат, симфибрат, теофибрат, AHL-157 и т.п.), агонисты PPAR-альфа (например, GlaxoSmithKline 590735 и т.п.), агонисты PPAR-дельта (например, GlaxoSmithKline 501516 и т.п.), ингибиторы ацилкоэнзим А:холестерин-ацилтрансферазы (например, авасимиб, эфлусимиб, элдасимиб, лесимибид, NTE-122, MCC-147, PD-132301-2, Cl-1011, DUP-129, U-73482, U-76807, TS-962, RP-70676, Р-06139, СР-113818, RP-73163, FR-129169, FY-038, ЕАВ-309, KY-455, LS-3115, FR-145237, T-2591, J-104127, R-755, FCE-27677, FCE-28654, YIC-C8-434, CI-976, RP-64477, F-1394, CS-505, CL-283546, YM-17E, 447С88, YM-750, Е-5324, KW-3033, HL-004 и т.п.), пробукол, агонисты рецептора тиреоидных гормонов (например, лиотиронин, левотироксин, КВ-2611, GC-1 и т.п.), ингибиторы всасывания холестерина (например, эзетимиб, SCH48461 и т.п.), ингибиторы липопротеин-ассоциированной фосфолипазы А2 (например, рилапладиб, дарапладиб и т.п.), ингибиторы микросомального белка-переносчика триглицеридов (например, СР-346086, BMS-201038, соединения, описанные в патентах США №№5,595,872; 5,739,135; 5,712,279; 5,760,246; 5,827,875; 5,885,983; 5,962,440; 6,197,798; 6,617,325; 6,821,967; 6,878,707 и т.п.), активаторы рецептора липопротеинов низкой плотности (например, LY295427, MD-700 и т.п.), ингибиторы липоксигеназы (например, соединения, описанные в публикациях WO 97/12615, WO 97/12613, WO 96/38144 и т.п.), ингибиторы карнитин-пальмитоил-трансферазы (например, этомоксир и т.п.), ингибиторы сквален-синтазы (например, YM-53601, ТАК-475, SDZ-268-198, BMS-188494, A-87049, RPR-101821, ZD-9720, RPR-107393, ER-27856, соединения, описанные в патентах США №№5,712,396; 4,924,024; 4,871,721 и т.п.), производные никотиновой кислоты (например, аципимокс, никотиновая кислота, рикотинамид, никомол, ницеритрол, никорандил и т.п.), секвестранты жирных кислот (например, колестипол, холестирамин, колестилан, колесевелам, GT-102-279 и т.п.), ингибиторы котранспортера натрия /жирных кислот (например 264W94, S-8921, SD-5613 и т.п.) и ингибиторы белка-переносчика эфиров холестерина (например, торсетрапиб, JTT-705, PNU-107368E, SC-795, СР-529414 и т.п.).
Примеры средств против ожирения, пригодных для применения в сочетании с соединениями по данному изобретению, включают ингибиторы обратного захвата норадреналина и серотонина (например, сибутрамин, милнаципран, миртазапин, венлафаксин, дулоксетин, дезвенлафаксин и т.п.), ингибиторы обратного захвата норадреналина и дофамина (например, радафаксин, бупропион, аминептин и т.п.), ингибиторы обратного захвата норадреналина, серотонина и дофамина (например, тезофензин и т.п.), избирательные ингибиторы обратного захвата серотонина (например, циталопрам, эсциталопрам, флуоксетин, флувоксамин, пароксетин, сертралин и т.п.), избирательные ингибиторы обратного захвата норадреналина (например, ребоксетин, атомоксетин и т.п.), стимуляторы высвобождения норадреналина (например, ролипрам, YM-992 и т.п.), анорексигенные средства (например, амфетамин, метамфетамин, декстроамфетамин, фентермин, бензфетамин, фендиметразин, фенметразин, диэтилпропион, мазиндол, фенфлурамин, дексфенфлурамин, фенилпропаноламин и т.п.), агонисты дофамина (например, ER-230, допрексин, бромкриптина мезилат и т.п.), Нз-антагонисты гистамина (например, импентамин, тиоперамид, ципроксифан, клобенпропит, GT-2331, GT-2394, А-331440 и т.п.), агонисты рецептора 5-НТ2 с (например, 1-(мета-хлорфенил)пиперазин (m-СРР), миртазапин, APD-356 (лоркасерин), SCA-136 (вабикасерин), ORG-12962, ORG-37684, ORG-36262, ORG-8484, Ro-60-175, Ro-60-0332, VER-3323. VER-5593, VER-5384, VER-8775, LY-448100, WAY-161503, WAY-470, WAY-163909, MK-212, BVT.933, YM-348, IL-639, IK-264, ATH-88651, ATHX-105 и т.п.) (см., например, Nilsson B.M., J. Med. Chem. 2006, 49:4023-4034)), агонисты адренергических бета-3-рецепторов (например, L-796568, CGP 12177, BRL-28410, SR-58611A, ICI-198157, ZD-2079, BMS-194449, BRL-37344, CP-331679, CP-331648, CP-114271, L-750355, BMS-187413, SR-59062A, BMS-210285, LY-377604, SWR-0342SA, AZ-40140, SB-226552, D-7114, BRL-35135, FR-149175, BRL-26830A, CL-316243, AJ-9677, GW-427353, N-5984, GW-2696 и т.п.), агонисты холецистокинина (например, SR-146131, SSR-125180, BP-3.200, A-71623, A-71378, FPL-15849, GI-248573, GW-7178, GI-181771, GW-7854, GW-5823 и т.п.), антидепрессанты в сочетании с ингибиторами ацетилхолинэстеразы (например, венфлаксин/ривастигмин, сертралин/галантамин и т.п.), ингибиторы липазы (например, орлистат, ATL-962 и т.п.), средства против эпилепсии (например, топирамат, зонисамид и т.п.), лептин, аналоги лептина и агонисты рецептора лептина (например, LY-355101 и т.п.), антагонисты и модуляторы рецептора нейропептида Y (NPY) (например, SR-120819-A, PD-160170, NGD-95-1, BIBP-3226, 1229-U-91, CGP-71683, BIBO-3304, СР-671906-01, J-115814 и т.п.), цилиарный нейротрофический фактор (например, аксокин и т.п.), агонисты бета-рецептора тиреоидных гормонов (например, КВ-141, GC-1, GC-24, GB98/284425 и т.п.), антагонисты рецептора каннабиноидов СВ1 (например, римонабант, SR147778, SLV 319 и т.п.) (см., например, Antel J. et al., J. Med. Chem. 2006, 49:4008-4016)), антагонисты рецептора меланин-концентрирующего гормона (например, GlaxoSmithKline 803430X, GlaxoSmithKline 856464, SNAP-7941, T-226296 и т.п.) (см., например, Handlon A.L., Zhou Н., J. Med. Chem. 2006, 49:4017-4022)), агонисты рецептора меланокортина-4 (включая РТ-15, Ro27-3225, THIQ, NBI 55886, NBI 56297, NBI 56453, NBI 58702, NBI 58704, MB243 и т.п.) (см., например, Nargund R.P. et al., J. Med. Chem. 2006, 49:4035-4043), избирательные антагонисты рецептора мускарина Mi (например, телензепин, пирензепин и т.п.), антагонисты рецептора опиоидов (например, налтрексон, метилналтрексон, налмефен, налоксон, алвимопан, норбиналторфимин, налорфин и т.п.) и их сочетания.
Примеры антигипертензивных агентов и средств для лечения хронической сердечной недостаточности, атеросклероза и родственных заболеваний, пригодных для применения в сочетании с соединениями по данному изобретению, включают бимокломол, ингибиторы ангиотензин-превращающего фермента (например, каптоприл, эналаприл, фозиноприл, лизиноприл, периндоприл, кинаприл, рамиприл и т.п.), ингибиторы нейтральной эндопептидазы (например, тиорфан, омапатрилат, MDL-100240, фазидотрил, сампатрилат, GW-660511, миксанприл, SA-7060, E-4030, SLV-306, экадотрил и т.п.), антагонисты рецептора ангиотензина II (например, кандесартан, цилексетил, эпросартан, ирбесартан, лосартан, олмесартана медоксомил, телмисартан, валсартан, тазосартан, энолтазосартан и т.п.), ингибиторы эндотелин-превращающего фермента (например, CGS 35066, CGS 26303, CGS-31447, SM-19712 и т.п.), антагонисты рецептора эндотелина (например, траклир, ситаксентан, амбрисентан, L-749805, TBC-3214, BMS-182874, BQ-610, TA-0201, SB-215355, PD-180988, BMS-193884, дарусентан, ТВС-3711, босентан, тезосентан, J-104132, YM-598, S-0139, SB-234551, RPR-118031A, ATZ-1993, RO-61-1790, ABT-546, энласентан, BMS-207940 и т.п.), диуретики (например, гидрохлортиазид, бендрофлуметазид, трихлорметазимд, индапамид, метолазон, фуросемид, буметанид, торсемид, хлорталидон, метолазон, циклопентиазид, гидрофлуметиазид, трипамид, мефрузид, бензилгидрохлортиазид, пенфлутизид, метиклотиазид, азосемид, этакриновая кислота, торасемид, пиретанид, метикран, канреноат калия, спиронолактон, триамтерен, аминофилин, циклетанин, LLU-a, PNU-80873А, изосорбид, D-маннит, D-сорбит, фруктоза, глицерин, ацетазоламид, метазоламид, FR-179544, ОРС-31260, ликсиваптан, кониваптан и т.п.), антагонисты кальциевых каналов (например, амлодипин, бепридил, дилтиазем, фелодипин, израдипин, никардипен, нимодипин, верапамил, S-верапамил, аранидипин, эфонидипин, барнидипин, бенидипин, манидипин, силнидипин, низолдипин, нитрендипин, нифедипин, нилвадипин, фелодипин, пранидипин, лерканидипин, израдипин, элгодипин, азелнидипин, лацидипин, ватанидипин, лемилдипин, дилтиазем, клентиазем, фазудил, бепридил, галлопамил и т.п.), сосудорасширяющие антигипертензивные агенты (например, индапамид, тодралазин, гидралазин, кадралазин, будралазин и т.п.), бета-блокаторы (например, ацебутолол, бисопролол, эсмолол, пропанолол, атенолол, лабеталол, карведилол, метопролол и т.п.), блокаторы симпатической передачи (например, амозулалол, теразозин, буназозин, празозин, доксазозин, пропранолол, атенолол, метопролол, карведилол, нипрадилол, целипролол, небиволол, бетаксолол, пиндолол, тертатолол, бевантолол, тимолол, картеолол, бисопролол, бопиндолол, нипрадилол, пенбутолол, ацебутолол, тилизолол, надолол, урадипил, индорамин и т.п.), агонисты альфа-2-адренорецепторов (например, клонидин, метилдопа, CHF-1035, гуанабенза ацетат, гуанфацин, моксонидин, лофексидин, талипексол и т.п.), антигипертензивные средства центрального действия (например, резерпин и т.п.), ингибиторы агрегации тромбоцитов (например, варфарин, дикумарол, фенпрокумон, аценокумарол, анизиндион, фениндион, ксимелагатран и т.п.), антитромбоцитарные агенты (например, аспирин, клопидогрел, тиклопидин, дипиридамол, цилостазол, этиликозапентат, сарпогрелат, дилазеп, трапидил, берапрост и т.п.).
Кроме того, в другом своем аспекте настоящее изобретение предоставляет фармацевтическую композицию, содержащую эффективные количества соединения или смеси соединений формулы I, их фармацевтически приемлемых солей или пролекарств и, по меньшей мере, один компонент, выбираемый из группы перечисленных выше терапевтических агентов, с которым соединение(я) по данному изобретению действует в сочетании, в фармацевтически приемлемом носителе.
Лечение по данному изобретению может проводиться профилактически для предотвращения или отсрочки начала/прогрессирования заболевания или состояния (например, гипергликемии) или терапевтически для достижения желаемого эффекта (например, желаемого уровня глюкозы в сыворотке крови) на какое-то более или менее продолжительное время.
Соединения по данному изобретению могут вводиться субъекту лечения, например, нуждающемуся в том человеку, домашнему животному (например, кошке или собаке) сами по себе или в сочетании с другими терапевтическими средствами, в форме их фармацевтически приемлемых солей или пролекарств, или в форме фармацевтической композиции, в которой соединения по данному изобретению и/или сочетаемые с ними иные терапевтические агенты в терапевтически эффективном количестве находятся в смеси с подходящими носителями или эксципиентами. Соответственно, соединение или смесь соединений формулы I, или их фармацевтически приемлемые соли, или пролекарства и сочетаемый с ним(и) дополнительный активный агент могут быть вместе в составе единого препарата, например капсулы или таблетки, либо в виде двух раздельных препаратов, которые могут быть в разной или же одинаковой лекарственной форме, например, в виде набора, содержащего некоторое число доз каждого из агентов.
Оптимальную дозировку выбирают в зависимости от назначенного пути введения, от состава композиции и от других факторов, в числе которых индивидуальная реакция объекта лечения. Дозировку можно изменять со временем соответственно потребностям индивида. Пациенту может быть первоначально введена низкая доза, которую затем повышают до эффективной и в то же время переносимой данным индивидом. Как правило, приносящая пользу доза для взрослого человека при пероральном приеме составляет от 1 до 2000 мг, предпочтительно 1-200 мг, при внутривенном введении 0,1-100 мг, предпочтительно 1-30 мг (во всех вариантах 1-4 раза в сутки). Когда соединение по данному изобретению применяют в сочетании с другим терапевтическим агентом, дозировка дополнительного лекарственного средства берется 20-100% от обычно рекомендуемой.
Количественная и временная схема дозировки подбирается индивидуально с тем, чтобы обеспечить достаточный для достижения и поддержания терапевтического эффекта уровень активных веществ в плазме крови. Предпочтительно терапевтически эффективные уровни в сыворотке крови достигаются при введении препарат ежедневно один раз в сутки, но в настоящее изобретение включены также схемы с ежедневным введением в несколько приемов. В случае местного применения или избирательного поглощения эффективная локальная концентрация лекарственного препарата может быть не связана с его концентрацией в сыворотке крови. У специалиста в данной области техники не должна вызывать затруднений оптимизация терапевтически эффективной дозировки при местном введении без неприемлемого экспериментирования.
Все публикации и заявки на патент, цитируемые в настоящем описании, включаются в данный документ путем отсылки, как если бы о каждой отдельной публикации или заявке на патент было в отдельности конкретно сказано, что она включена в данный документ путем отсылки. Всякое расхождение между цитируемыми здесь источниками и утверждениями настоящего описания следует истолковывать в пользу последнего. Точно так же всякая разница между принятыми в данной области техники определениями того или иного термина или формулировки и таковыми по данному описанию должна расцениваться в пользу последнего. Хотя предшествующее изобретение подробно описано с помощью иллюстраций и примеров в целях ясности и понимания, специалистам в данной области техники должно быть очевидно в свете утверждений данного описания, что возможны определенные изменения и модификации, не уклоняющиеся от принципов и объема прилагаемой формулы изобретения. Более подробно настоящее изобретение описывается с помощью конкретных примеров.
Примеры
Приведенные ниже примеры служат для иллюстрации и никак не должны ограничивать настоящее изобретение. Специалисты в данной области техники без труда поймут, какие параметры не являются критическими и могут быть изменены или модифицированы без влияния на результаты.
Названия соединений, употребляемые в нижеследующих примерах, происходят от структур, показанных с помощью алгоритма Struct=Name программы ChemDraw Ultra, версия 10.0 (CambridgeSoft). Если не оговорено иного, структура синтезированных соединений, фигурирующих в нижеследующих примерах, подтверждалась следующими методами:
(1) Анализ методом газовой хроматографии-масс-спектрометрии с ионизацией электрораспылением (MS ESI) осуществляли на масс-спектрометре Agilent 5973N с газовым хроматографом Agilent 6890 и колонкой HP-5 MS (длина 30 м, внутренний диаметр 0,25 мм, толщина пленки неподвижной фазы 0,25 мкм. Источник ионов держали при температуре 230°С, спектры сканировали в диапазоне 25-500 а.е.м. со скоростью 3,09 сек/скан.
(2) Жидкостную хроматографию высокого давления с масс-спектрометрией (LC-MS) осуществляли с помощью системы Finnigan Surveyor HPLC с градиентным насосом Quaternary Pump, детектором переменной длины волны, установленным на 254 нм, колонкой ХВ-С18 (4,6×50 мм, 5 мкм), и масс-спектрометром Finnigan LCQ с ионной ловушкой (ионизация электрорассеянием). Спектры сканировали в диапазоне 80-2000 а.е.м., используя переменное время захвата ионов соответственно числу ионов в ловушке. Для элюирования с колонки использовали ацетонитрил (В) и воду (D). Градиент элюции брали от 10% до 90% В за 8 мин при скорости потока 1,0 мл/мин, завершая 90% В в течение 7 минут. Общее время элюирования 15 минут.
(3) Стандартная одномерная ЯМР-спектроскопия проводилась на спектрометрах Varian Mercury-Plus (400 МГц или 300 МГц). Образцы растворяли в дейтерированном растворителе, полученном в фирме Qingdao Tenglong Weibo Technology Co., Ltd., и переносили в пробирки для ЯМР-анализатора (внутренний диаметр 5 мм). Спектры снимали при температуре 293 К. Химический сдвиг измеряли в миллионных долях (ррт, или м.д.) и относили к соответствующим сигналам растворителя, например 2,49 м.д. для DMSO-d6, 1,93 м.д. для CD3CN, 3,30 м.д. для CD3OD, 5,32 м.д. для CD2Cl2 и 7,26 м.д. для CDCl3 для спектров 1Н.
Пример 1
Этот пример иллюстрирует получение соединения 5 (R=Et) путем синтеза, изображенным на фигуре 3. Нумерация соединений соответствует таковой на фигурах. Данный общий способ применим к другим соединениям по настоящему изобретению.
Получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1) Получение реактива Гриньяра
В атмосфере аргона порошок магния (0,216 г, 8,98 ммоль, 1,2 экв.)помещали в трехгорлую колбу, затем прибавляли часть раствора 4-бром-1-хлор-2-(4-этилбензил)бензола 8 (0,769 г, 2,49 ммоль) в безводном THF (6 мл), и 1,2-дибромэтана (10 молярных процентов). Смесь нагревали до кипения (с обратным холодильником). После того, как начиналась реакция (экзотермическая, с поглощением магния), добавляли по каплям оставшийся раствор 2-(4-этилбензил)-4-бром-1-хлорбензола 8 (1,539 г, 4,99 ммоль) в безводном THF (14 мл). Оставляли смесь для протекания реакции еще на 1 час при слабом кипении с обратным холодильником до тех пор, пока не поглощалась большая часть магния.
(2) Получение соединения 2
Вышеуказанный реактив Гриньяра прибавляли по каплям в раствор (4R,5S,6R)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)циклогекс-2-енона 1 (2 г, 3,74 ммоль, 1 экв.) в безводном THF (20 мл) в атмосфере аргона при комнатной температуре (около 25°С), и оставляли для протекания реакции на 3 часа. Для остановки реакции в эту смесь добавляли водный насыщенный раствор NH4Cl. Полученную смесь экстрагировали этилацетатом (20 мл × 3), органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и фильтрат выпаривали досуха. Оставшийся материал очищали путем хроматографии с силикагелем, элюируя смесью петролейный эфир/этилацетат (20:1). В результате получали желаемое соединение 2 (2,428 г, 3,17 ммоль, выход 84.8%) в виде масла желтого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 7,42 (1Н, s), 7,28-7,41 (17H, m), 7,04-7,254 (8Н, m), 5,83 (1H, s), 4,74 (1H, d, J=11,2 Гц), 4,39-4,64 (7H, m), 4,33 (1H, d, J=12,4 Гц), 4,23 (1H, s), 4,08 (2H, s), 4,03 (1H, d, J=12,8 Гц), 3,70-3,73 (2Н, m), 2,93 (1H, s), 2,58 (2H, q, J=7,6 Гц), 1,19 (3Н, t, J=7,6 Гц); MS (ESI+): 765 [М+Н]+, 782 [М+H2O]+, 787 [М+Na]+,
(3) Получение соединения 3 (R=Et)

Триэтилсилан (1 мл, 7,44 ммоль, 3 экв.) и эфират трифторида бора (0,44 мл, 4,96 ммоль, 2 экв.) прибавляли в том порядке, в каком они здесь перечислены, к раствору соединения 2 (1,9 г, 2,48 ммоль, 1 экв) в CH2Cl2 в атмосфере аргона при температуре -20°С, после чего оставляли для протекания реакции не менее чем на 4 часа, поддерживая температуру -20°С. Для остановки реакции прибавляли водный насыщенный раствор NaCl. Полученную смесь экстрагировали CH2Cl2 (20 мл × 3), органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и фильтрат выпаривали досуха. Оставшийся материал очищали путем хроматографии с силикагелем, элюируя смесью петролейный эфир/этилацетат (20:1). В результате получали желаемое соединение (1,67 г, 2,23 ммоль, выход 89,9%) в виде масла желтого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 7,26-7,40 (16Н, m), 7,15-7,25 (7H, m), 7,04-7,06 (4H, m), 6,85-6,87 (2H, m), 5,89 (1H, s), 4,85-4,98 (3Н, m), 4,75-4,77 (1H, m), 4,45-4,56 (4H, m), 4,32 (1H, d, J=10,8 Гц), 3,97-4,09 (4H, m), 3,74 (1H, t, J=10,4 Гц), 3,62-3,65(1H, m), 3,54-3,57 (1H, m), 2,63-2,71 (1H, m), 2,59 (2H, q, J=7,6 Гц), 1,21 (3Н, t, J=7,6 Гц); MS (ESI+) 749 [М+Н]+, 766 [М+H2O]+,
(4) Получение соединения 4 (R=Et)

Диметилсульфидборан (2М в THF) (1,678 мл, 3,34 ммоль, 10 экв.) прибавляли в раствор соединения 3 (250 мг, 0,334 ммоль, 1 экв.) в безводном THF (10 мл) в атмосфере аргона при температуре 0°С, затем нагревали с обратным холодильником в течение 1 часа. Смесь обрабатывали NaOH (3 M в H2O, 1 мл, 3,34 ммоль, 10 экв.) при температуре 0°С, затем 30%-ной H2O2 (0,11 мл, 3,34 ммоль, 10 экв.) при комнатной температуре (выше 30°С) и оставляли для протекания реакции на ночь при комнатной температуре (~25°С). Для прекращения реакции в эту смесь добавляли насыщенный водный раствор NH4Cl. Полученную смесь экстрагировали этилацетатом (10 мл × 3), органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и фильтрат выпаривали досуха. Оставшийся материал очищали путем препаративной TLC и в результате получали желаемое соединение 4 (108,8 мг, 0,142 ммоль, 42,5%) в виде твердого вещества белого цвета. 1H-ЯМР (400 МГц, CDCl3) δ 7,29-7,40 (15Н, m), 7,12-7,24 (7H, m), 7,03-7,07 (4H, m), 6,74 (2H, d, J=6,8 Гц), 4,94 (1Н, d, J=10,8 Гц), 4,91 (2Н, s), 4,46-4,58 (4H, m), 4,01-4,13 (2H, m), 3,83-3,93 (3H, m), 3,68-3,73 (2H, m), 3,52-3.62 (2H, m), 2,74 (1Н, t, J=10,8 Гц), 2,59 (2H, q, J=7,6 Гц), 1,89-1,96 (1Н, m), 1,19 (3H, t, J=7,6 Гц); MS (ESI+) 767 [M+H]+, 784 [M+W]+, 789 [M+Na]+,
(5) Получение соединения 5 (R=Et)
Раствор соединения 4 (12 мг, 1,57×10-2 ммоль, 1 экв.) в THF:СН3ОН=2:1 (9 мл) обрабатывали 1,2-дихлорбензолом (1 мол.%) and Pd/C (10%, 12 мг, коэффициент качества 100%) и перемешивали в течение 2 часов в атмосфере H2 при комнатной температуре (выше 30°С). За ходом реакции следили при помощи LC-MS, чтобы удостовериться в ее завершении. Полученную смесь фильтровали, фильтрат выпаривали досуха. Оставшийся материал очищали путем препаративной HPLC и в результате получали желаемое соединение 5 (2,82 мг, 0,69×10-2 ммоль, выход 43,9%) в виде твердого вещества белого цвета. 1H-ЯМР (400 МГц, CD3OD) δ 7,33 (1Н, d, J=8,0 Гц), 7,07-7,17 (6Н, m), 4,05 (2H, s), 3,91 (2H, d, J=3,2 Гц), 3,65 (1Н, t, J=10,4 Гц), 3,39-3,49 (2H, m), 3,31 (1Н, t, J=8,8 Гц), 2,51-2,62 (3H, m), 2,53 (1Н, m), 1,19 (3H, t, J=8,0 Гц); MS (ESF): 407 [M+H]+, 424 [M+NH4]+, 448 [M+H+CH3CN]+, 813 [2М+H]+, (ESI-): 405 [M-H]-, 451 [M+HCOO]-,
Следующий способ представляет собой вариант методики, раскрытой в заявке на патент США 2006/0063722 A1.
(6) Получение (5-бром-2-хлорфенил)(4-этилфенил)метанона (соединения 7)

7(R=Et)
В 2-литровую круглодонную колбу, содержащую перемешиваемую с помощью магнитной мешалки суспензию покупной 5-бром-2-хлорбензойной кислоты (410 г, 1,74 моля) в 700 мл CH2Cl2, прибавляли оксалилхлорид (235 г, 1,85 моль), а затем 1,5 мл DMF. Для того, чтобы собирать образующийся в результате HCl, колба была снабжена отводной трубкой, так что газ попадал на поверхность перемешиваемого водного раствора КОН. Когда через 2 часа бурное выделение газа прекращалось, гомогенную реакционную смесь перемешивали в течение ночи, после чего удаляли летучие компоненты в вакууме, используя ротационный испаритель. Получающееся в результате масло затвердевало в ходе последующего вакуумирования. Неочищенный хлорид 5-бром-2-хлорбензола растворяли в 530 мл этилбензола, после чего желтый раствор охлаждали до температуры -3°С, а затем прибавляли AlCl3 (257 г, 1,93 моль) порциями примерно по 30 г в течение 60 минут, чтобы температура не поднималась выше 10°С. Обильно выделяющийся газообразный HCl, который появляется после того как было добавлено 60% AlCl3 собирали путем пропускания его над перемешиваемым концентрированным раствором NaOH. Если реакционная смесь более концентрированная, то магнитная мешалка не обеспечивает должного перемешивания по завершении добавления AlCl3. После перемешивания продолжительностью 1 час, в течение которого баня нагревалась до температуры ~15°С, баню убирали. Через 4 часа при температуре 20°С густой концентрированный раствор выливали на лед (1,5 кг). Когда перемешиваемая суспензия остыла, добавили Н2О (1 л), а затем экстрагировали 4 раза 1н. HCl, 3 раза 1М КОН и 2 раза солевым раствором, после чего высушивали над Na2SO4. Летучие компоненты удаляли, используя сначала ротационный испаритель, а затем нагревание при 60°С и давлении 1 торр. В результате получали темное масло, которое, по данным 1Н-ЯМР, представляло собой смесь 1:14 орто/параизомеров. После растворения этого материала в гексане и фильтрования через силикагель он становился практически бесцветным. В результате концентрирования получали 560 г вещества (99% смеси 14:1 (5-бром-2-хлорфенил)(4-этилфенил)метанон/(5-бром-2-хлорфенил)(2-этилфенил)метанон),
(7) Получение 4-бром-1-хлор-2-(4-этилбензил)бензола (соединения 8)

К перемешиваемому раствору Et3SiH (400 г, 3,45 моль) и (5-бром-2-хлорфенил)(4-этилфенил)метанона (534 г, 1,65 моль), содержащего -7% изомерного кетона в 300 мл TFA при температуре 30°С добавляли CF3SO3H (1,5 г, 0,01 моль). За несколько минут температура раствора повышалась, что вызывало бурное испарение (с обратным холодильником). Осторожно: при этом экзотермическом процессе требуется охлаждение с помощью внешней ледяной бани. Через 1 час с помощью HPLC определяли, что реакция на 90% завершилась. Добавляли еще Et3SiH (20 г) и нагревали в течение ночи при 70°С, после чего реакция оказывалась завершенной более чем на 95% (по данным HPLC). Реакционную смесь охлаждали, летучие компоненты удаляли путем простой дистилляции при пониженном давлении. В результате получали ~1 л легкого масла серого цвета, которое выливали в 1 л H2O. Смесь трижды экстрагировали гексаном, органические фазы объединяли и промывали три раза Н2О, два раза водным раствором Na2CO3 и два раза солевым раствором, после чего высушивали над Na2SO4. После концентрирования с помощью ротационного испарителя получался ~1 л прозрачного масла светло-желтого цвета. Этот материал далее концентрировали, путем перегонки удаляли (Et3Si)2O (450 мл) до тех пор, пока температура головной фракции не достигала 75°С; оставшемуся материалу давали остыть. Анализ оставшегося материала путем 1H-ЯМР показал, что он содержал смесь диарилметана и (Et3Si)2O (~8:1). Для кристаллизации эту смесь выливали в интенсивно перемешиваемую холодную (10°С) смесь 85% EtOH:H2O (1,2 л) и перемешивали несколько часов. Образовавшиеся кристаллы собирали путем фильтрования, промывали холодным раствором EtOH/Н2О (1:1) и высушивали в вакууме. В результате получали 4-бром-1-хлор-2-(4-этилбензил)бензол (500 г) в виде низкоплавкого твердого вещества, содержащего -1% (Et3Si)2O,; его использовали без дальнейшей очистки.
Пример 2
Этот пример иллюстрирует получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этоксибензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 9).

Соединение 9 получали способом, аналогичным описанному в примере 1. H1-ЯМР (400 МГц, CD3OD): δ 7,32 (1H, d, J=8,0), 7,11-7,16 (4H, m), 6,79 (2H, d, J=6,8 Гц), 3,96-4,02 (4H, m), 3,91 (1H, d, J=3,2 Гц), 3,63 (1H, t, J=10,4 Гц), 3,39-3,47 (2H, m), 3,32 (1H, t, J=8,8 Гц), 2,54 (1H, t, J=10,4 Гц), 1,53 (1H, tt, J=3,2, 10,4 Гц), 1,36 (3Н, t, J=7,2 Гц); MS (ESI+): 423 [М+Н]+, 440 [M+NH4]+, 845 [2m+h]+, 862 [M+NH4]+, (ESI-): 467 [M+HCOO]-.
Пример 3
Этот пример иллюстрирует получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-циклопропилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 10).

Соединение 10 получали способом, аналогичным описанному в примере 1.
1H-ЯМР (400 МГц, CDCl3): δ 7,33 (1Н, d, J=8,0 Гц), 7,16-7,12 (2Н, m), 7,09 (2H, d, J=8,0 Гц), 6,96 (2H, d, J=8,0 Гц), 4,04 (2H, s), 3,91 (2H, d, J=3,2 Гц), 3,65 (1Н, t, J=10,6 Гц), 3,48 (1Н, t, J=10,0 Гц), 3,42 (1Н, t, J=10,0 Гц), 3,32 (1Н, t, J=9,0 Гц), 2,54 (1Н, t, J=10,8 Гц), 1,87-1,82 (1Н, m), 1,57-1,51 (1Н, m,), 0,94-0,89 (2H, m), 0,64-0,60 (2H, m); MS (ESI+): 419 [М+Н]+, 436 [М+NH4]+,
Пример 4
Этот пример иллюстрирует получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-пропилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 11).

Соединение 11 получали способом, аналогичным описанному в примере 1. 1H-ЯМР (400 МГц, CDCl3): δ 7,35 (1Н, d, J=8,4 Гц), 7,20 (1Н, d, J=1,6 Гц), 7,16-7,13 (3Н, m), 7,08 (2H, d, J=8,0 Гц), 4,07 (2H, s), 3,93 (2H, d, J=3,2 Гц), 3,67 (1Н, t, J=10,4 Гц), 3,49 (1Н, t, J- 10,4 Гц), 3,43 (1Н, t, J=10,4 Гц), 3,33 (1Н, t, J=9,0 Гц), 2,58-2,53 (3Н, m), 1,67-1,58 (2H, m), 1,58-1,52 (1Н, m), 0,94 (3Н, t, J=7,2 Гц); MS (ESI+): 438 [М+NH4]+.
Пример 5
Этот пример иллюстрирует получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-циклогексилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 12).

Соединение 12 получали способом, аналогичным описанному в примере 1.
1H-ЯМР (400 МГц, CDCl3): δ 7,34 (1Н, d, J=8,0 Гц), 7,19 (1H, d, J=2,0 Гц), 7,15-7,12 (3Н, m), 7,09 (2H, d, J=8,4 Гц), 4,05 (2Н, s), 3,92 (2H, d, J=3,2 Гц), 3,66 (1H, t, J=10,6 Гц), 3,48 (1H, t, J=10,0 Гц), 3,43 (1H, t, J=10,2 Гц), 3,32 (1H, t, J=9,0 Гц), 2,55 (1H, t, J=10,6 Гц), 2,48-2,42 (1H, m), 1,84-1,81 (4H, m), 1,76-1,73 (1H, m), 1,57-1,50 (1H, m), 1,47-1,36 (4H, m), 1,34-1,22 (1H, m); MS (ESI+): 478 [M+MH4]+.
Пример 6
Этот пример иллюстрирует получение (1R,2S,3S,6R)-4-(4-хлор-3-(4-(3-циклопропилпроп-2-инилокси)бензил)фенил)-6-(гидроксиметил)циклогекс-4-ен-1,2,3-триола (соединения 13).

1H-ЯМР (400 МГц, CD3OD): δ 7,27-7,31 (2H, m), 7,20-7,23 (1H, m), 7,09 (2H, d, J=8,8 Гц), 6,82-6,84 (2H, m), 5,83-5,84 (1H, m), 4,02 (2H, dd, J=14,8 Гц), 3,83-3,86 (1H, m), 3,48-3,65 (3Н, m), 2,36 (1H, b), 0,72-0,77 (2H, m), 0,57-0,60 (2H, m); MS (ESI+): 472 [M+NH4]+, 479 [M+Na]+, (ESI-): 499 [M+HCOO]-.
Пример 7
Этот пример иллюстрирует получение (2S,3S,4R,5R,6R)-2-(4-хлор-3-(4-этилбензил)фенил)-3,4,5-тригидрокси-6-(гидроксиметил)циклогексанона (соединения 15) по пути синтеза, изображенному на фигуре 4.

Реагент Десс-Мартина (мол. масса 424,5, белый порошок, 1,5 экв.) прибавляли к раствору (1R,2S,3R,4R,5S,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексанола (соединения 4, R=Et) (1,0 г, 1,3 ммоль) в безводном CH2Cl2 (20 мл) при температуре 0°С. Эту смесь перемешивали в течение ночи при комнатной температуре. Реакцию останавливали 1 н. NaOH, и, когда водный слой отделялся, его экстрагировали CH2Cl2. Органические фазы объединяли, высушивали над Na2SO4 и фильтровали. Фильтрат выпаривали досуха и оставшийся материал очищали путем препаративной TLC. В результате получали соединение 14 (0,92 г, твердое вещество белого цвета, чистота 95%, выход 92,3%). 1H-ЯМР (400МГц, CDCl3): δ 7,29-7,37 (14Н, m), 7,13-7,23 (5H, m), 7,03-7,08 (4H, dd, J=8,4 Гц), 6,97-6,99 (2Н, m), 6,76 (2H, d, J=7,6 Гц), 4,91-4,95 (3Н, m), 4,64 (1H, d, J=10,8 Гц), 4,50-4,57 (3H, m), 3,91-4,14 (6H, m), 3,74-3,76 (3H, m), 2,80 (1H, d, J=8,4 Гц), 2,58 (2H, dd, J=7,6 Гц), 1,20 (3H, t, J=7,6); MS (ESF): 765 [M+H]+, 782 [M+H2O]+, 787 [M+Na]+.
Раствор соединения 14 (0,92 г, чистота 95%, 1,20 ммоль, 1 экв.) в смеси THF: СН3ОН (2:1) (12 мл) обрабатывали 1,2-дихлорбензолом (0,354 г, 0,3 мл, 2,41 ммоль, 2 экв.) и Pd/C (10%, 74 мг, 8% (масса/масса)) и перемешивали в течение 4 часов в атмосфере Н2 при комнатной температуре (около 25°С). За ходом реакции следили при помощи LC-MS вплоть до ее завершения. Реакционную смесь фильтровали, фильтрат выпаривали досуха. Оставшийся материал (масло желтого цвета) очищали с помощью препаративной HPLC и в результате получали соединение 15 (450 мг, твердое вещество белого цвета, чистота 98%, выход 92,6%). 1H-ЯМР (400 HMz, CD3OD): δ 7,34 (1H, d, J=8,0 Гц), 6,99-7,12 (6H, m), 4,05 (2H, s), 3,98 (1H, dd, J=2,8, 10,8 Гц), 3,88 (1H, dd, J=5,6, 11 Гц), 3,77-3,81 (2H, m), 3,57-3,67 (2H, m), 2,65-2,79 (1H, m), 2,59 (2H, d, J=7,6, 15,2 Гц), 1,20 (3H, t, J=7,6 Гц); MS (ESF): 405 [M+H]+, 422 [M+NH4]+, (ESI-): 403 [M-H]-, 449 [M+HCOO]-.
Пример 8
Получение (1R,2R,3S,4S,5R,6R)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)-5-метоксициклогексан-1,2,3-триола (соединения 16)
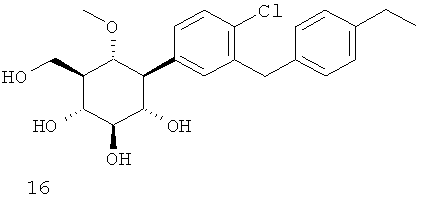
(1) Получение 4-((1R,2S,3R,4R,5S,6R)-2,3,4-трис(бензилокси)-5-(бензилоксиметил)-6-метоксициклогексил)-2-(4-этилбензил)-1-хлорбензола
NaH (157 г, 1,5 экв., 60% в масле) добавляли к раствору (1R,2S,3R,4R,5S,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексанола (соединения 4, R=Et, 2 г, 2,61 ммоль) в безводном THF (10 мл) при температуре 0°С. Реакционную смесь перемешивали в течение 1 часа при той же температуре, после чего прибавляли TBAI (0,1 экв.) и CH3I (760 мг, 2 экв.) и полученную смесь перемешивали в течение ночи при комнатной температуре. Для остановки реакции прибавляли насыщенный водный раствор NH4Cl, и полученную смесь экстрагировали EtOAc. Объединенную органическую фазу высушивали над Na2SO4, фильтровали и фильтрат выпаривали досуха. Оставшийся материал (масло желтого цвета, 2,05 г) растворяли в смеси ТНР:СН3ОН=2:1, обрабатывали 1,2-дихлорбензолом (в молярном отношении 1%) и Pd/C (10%, 1/1 масса/масса), и перемешивали в течение 2 часов в атмосфере Н2 при комнатной температуре. За ходом реакции следили при помощи LC-MS вплоть до ее завершения. Полученную смесь фильтровали, фильтрат выпаривали досуха и очищали путем препаративной HPLC. В результате получали желаемое соединение 16 (987 мг) в виде твердого вещества белого цвета (выход 90,0%). 1H-ЯМР (400 МГц, CD3COCD3): δ 7,32-7,34 (2Н, m), 7,22 (1Н, dd, J=2,4, 8,0 Гц), 7,12 (4Н, dd, J=8,4 Гц), 4,15 (2Н, s), 3,93-3,98 (1Н, m), 3,70-,3,75 (1H,m), 3,65-3,67 (1Н, m), 3,54-3,60 (2Н, m), 3,37 (1Н, t, J=10,4 Гц), 3,30 (1Н, t, J=8,8 Гц), 2,84 (3Н, s), 2,52-2,65 (3H, m), 1,51-1,58 (1Н, m), 1,17 (3Н, t, J=7,2 Гц); MS (ESI+): 421 [M+H]+, 438 [M+NH4]+, 841 [2М+Н]+, 858 [2M+NH4]+, (ESI-): 465 [M+HCOO]-.
Пример 9
Получение ((1S,2R,3R,4S,5R,6R)-3-(4-хлор-3-(4-этилбензил)фенил)-2,4,5,6-тетрагидроксициклогексил)метилацетата (соединения 17)

В раствор (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 5, R=Et, 1 г, 2,46 ммоль) и DMAP (катализатор) в CH2Cl2 (10 мл) прибавляли по каплям Ac2O (377 мг, 1,5 экв.) при температуре 0°С, а затем пиридин (292 мг, 1,5 экв.) и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь промывали HCl (3 н.), объединенную органическую фазу высушивали над Na2SO4, фильтровали и фильтрат выпаривали досуха. Оставшийся материал очищали путем препаративной HPLC и в результате получали желаемое соединение (566 мг) в виде твердого вещества белого цвета (выход 50,4%).
1Н-ЯМР (400 МГц, CD3OD): δ 7,32 (1Н, d, J=8,4 Гц), 7,06-7,14 (6H, m), 4,37 (2H, ddd, J=2,0, 10,8, 16,8 Гц), 4,04 (2H, s), 3,57 (1Н, t, J=10,8 Гц), 3,40-3,47 (1Н, m), 2,49-2,60 (3H, m), 2,04 (3Н, s), 1,60-1,66 (1Н, m), 1,18 (3Н, t, J=8,0 Гц); MS (ESI+): 449 [M+H]+, 466 [M+NH4]+, 897 [2M+H]+, (ESI-): 492 [M+HCOO]-, 941 [2M+HCOO]-.
Пример 10
Получение (4aR,5R,6R,7S,8S,8aR)-8-(4-хлор-3-(4-этилбензил)фенил)-2,2-диметилгексагидро-4Н-бензо[d][1,3]диоксин-5,6,7-триола (соединения 18)

В раствор (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 5, R=Et, 1 г, 2,46 ммоль) в МеОН (80 мл) и ацетоне (20 мл) прибавляли по каплям 1 н. HCl (5 мл) и перемешивали в течение ночи, после чего смесь выпаривали досуха. Оставшийся материал очищали путем препаративной HPLC, и в результате получали желаемое соединение (864 мг) в виде твердого вещества белого цвета (выход 75,3%). 1Н-ЯМР (400 МГц, CD3COCD3): δ 7,26-7,29 (2H, m), 7,10-7,16 (5H, m), 3,74-4,21 (6H, m), 3,46-3,51 (1Н, m), 3,35-3,37 (1Н, m), 2,56-2,66 (3Н, m), 1,72-1,75 (1Н, m), 1,28 (3Н, s), 1,18 (3Н, t, J=7,6 Гц), 1,13 (3Н, s); MS (ESI+): 447 [M+H]+, 488 [M+H+CH3CN]+, 910 [2М+NH4]+, 491 [M+HCOO]-, 937 [2M+HCOO]-.
Пример 11
Получение (1S,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексан-1,2,3,5-тетраилтетраацетата (соединения 19).
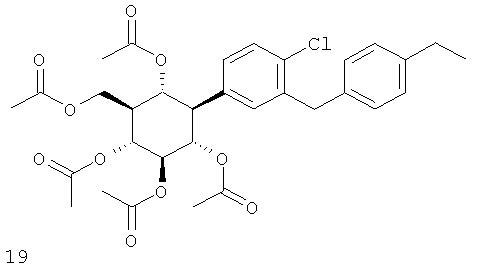
Соединение 19 получали из соединения 5 (R=Et), как описано в примере 20. 1H-ЯМР (400 МГц, CDCl3): δ 7,29 (1Н, d, J=8,4 Гц), 7,30-7,12 (6H, m), 5,27-5,38 (3Н, m), 5,20 (1Н, t, J=9,6 Гц), 4,03-4,06 (3Н, m), 3,93-3,96 (1Н, m), 2,98 (1Н, t, J=11,6), 2,61 (2H, q, J=7,6 Гц), 2,14-2,20 (1Н, m), 2,08 (3Н, s), 2,06 (3Н, s), 2,00 (3Н, s), 1,66 (6H, s), 1,21 (3Н, t, J=7,6 Гц); MS (ESI+): 617 (M+H)+, 934 [M_NH4]+, (ESI-): 661 [M+HCOO]-.
Пример 12
Этот пример предоставляет получение (1R,2R,3R,4S,5S)-l-(4-хлор-3-(4-этилбензил)фенил)-5-(гидроксиметил)циклогексан-1,2,3,4,5-пентаола (соединения 22, R=Et) путем синтеза, изображенным на фигуре 5.

Соединение 22 получали способом, аналогичным описанному в примере 1.
1H-ЯМР (400 МГц, CD3OD): δ 7,45 (1Н, s), 7,32-7,33 (2H, m), 7,05-7,10 (4H, m), 4,05 (2H, s), 3,86 (1Н, t, J=9,6 Гц), 3,67 (1Н, d, J=9,2 Гц), 3,54-3,57 (2H, m), 3,31-3,35 (2H, m), 2,57 (2H, q, J=8,0 Гц), 2,00 (1Н, d, J=15,2 Гц), 1,81 (1Н, d, J=15,2 Гц), 1,18 (3Н, t, J=8,0 Гц).
Пример 13
Получение (1R,2R,3R,4S,5S)-1-(3-(4-этилбензил)фенил)-5-(гидроксиметил)циклогексан-1,2,3,4,5-пентаола (соединения 23).

Соединение 23 получали способом, аналогичным описанному в примере 12.
1H-ЯМР (400 МГц, CD3OD): δ 7,39 (1Н, s), 7,29-7,31 (1Н, m), 7,21-7,25 (1Н, m), 7,03-7,11 (5H, m), 3,92 (2H, s), 3,88 (1Н, t, J=9,2 Гц), 3,72 (1Н, d, J=9,6 Гц), 3,56 (1Н, d, J=10,4 Гц), 3,32-3,35 (1Н, m), 2,58 (2H, q, J=7,6 Гц), 2,02 (1Н, d, J=15,2 Гц), 1,82 (1Н, d, J=15,2 Гц), 1,18 (3Н, t, 7=7,6 Гц),
Пример 14
Этот пример иллюстрирует получение (1R,2S,3R,4R,5S,6R)-4-(4-хлор-2-(4-этилбензил)фенокси)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 29), как изображено на фигуре 6.

(5-хлор-2-гидроксифенил)(4-этилфенил)метанон
Раствор 2-метокси-5-хлорбензойной кислоты (2,0 г, 10,5 ммоль) в безводном CH3Cl2 (10 мл) перемешивали при комнатной температуре в атмосфере аргона. К нему по каплям добавляли оксалилхлорид (2,0 г, 15,8 ммоль) и затем DMF (0,04 мл). Реакционную смесь перемешивали в течение ночи, после чего летучие компоненты выпаривали с помощью ротационного испарителя, а оставшийся материал растворяли в безводном CH2Cl2 (10 мл) при комнатной температуре в атмосфере аргона. Полученный раствор охлаждали до -5°С и прибавляли этилбензол (2,57 мл, 21 ммоль), затем порциями AlCl3 (2,80 г, 21 ммоль), поддерживая температуру смеси между -5°С и 0°С. Реакционную смесь перемешивали 4 часа при комнатной температуре, затем выливали в ледяную воду и экстрагировали CH2Cl2 (50 мл × 2). Органический слой промывали 1 н. HCl (50 мл), 1 н. NaOH (50 мл), водой (50 мл) и солевым раствором (50 мл), затем высушивали над безводным Na2SO4. Фильтрат концентрировали, полученный неочищенный материал очищали путем колоночной хроматографии (РЕ:ЕА=10:1). В результате получали желаемое соединение (1,944 г).
4-хлор-2-(4-этилбензил)фенол

К перемешиваемому при температуре 0°С раствору Et3SiH (2,26 мл, 14,2 ммоль) и (5-хлор-2-гидроксифенил)(4-этилфенил)метанона (1,944 г, 7,08 ммоль) в 10 мл TFA прибавляли CF3SO3H (30 мкл) с такой скоростью, чтобы температура реакционной смеси держалась около 0°С. Закончив добавление указанного реагента, полученную смесь нагревали до комнатной температуры и при этой температуре перемешивали в течение ночи. После этого летучие компоненты выпаривали при пониженном давлении, оставшийся материал разделяли на фазы в смеси этилацетата и воды. Органический слой отделяли, промывали водой, водным раствором Na2CO3 и солевым раствором, высушивали над Na2SO4 и концентрировали. Полученный неочищенный продукт очищали путем колоночной хроматографии (РЕ:ЕА=10:1). В результате получали желаемое соединение (1,659 г).
((1S,2S,3R,6R)-4-(бензилоксиметил)-6-(4-хлор-2-(4-этилбензил)фенокси)циклогекс-4-ен-1,2,3-триил)трис(окси)трис(метилен)трибензол (соединение 27)

(1S,4R,5S,6S)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)циклогекс-2-енол (0,5 г, 0,933 ммоль) и трифенилфосфин (367 мг, 1,400 ммоль) прибавляли к раствору 4-хлор-2-(4-этилбензил)фенола (345 мг, 1,400 ммоль) в THF (6 мл) в потоке аргона при комнатной температуре. В эту смесь при той же температуре добавляли DIAD (0,276 мл, 1,400 ммоль) Реакционную смесь перемешивали в течение 48 часов, затем концентрировали при пониженном давлении и полученный материал очищали путем препаративной LC-MS. В результате получали 157 мг ((1S,2S,3R,6R)-4-(бензилоксиметил)-6-(4-хлор-2-(4-этилбензил)фенокси)циклогекс-4-ен-1,2,3-триил)трис(окси)трис(метилен)трибензола (соединения 27).
(1S,2S,3R,4S,5R,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-2-(4-этилбензил)фенокси)циклогексанол (соединение 28)

К перемешиваемому при температуре 0°С раствору ((1S,2S,3R,6R)-4-(бензилоксиметил)-6-(4-хлор-2-(4-этилбензил)фенокси)циклогекс-4-ен-1,2,3-триил)трис(окси)трис(метилен)трибензола (соединения 27, 150 мг, 0,196 ммоль) в THF прибавляли по каплям BH3OEt2 (2М, 0,98 мл, 1,962 ммоль) Эту смесь перемешивали в течение 2 часов при температуре 0°С, затем нагревали до 25°С и перемешивали в течение ночи. После этого в реакционную смесь добавляли H2O2 (30%, 4,2 мл) и затем водный раствор NaOH (1M, 3,93 мл, 3,93 ммоль) при температуре 0°С. По завершении добавления реакционную смесь нагревали до 25°С и перемешивали в течение 3 часов. Реакцию останавливали добавлением разбавленной HCL (1 н., 10 мл) и полученную смесь экстрагировали этилацетатом (3×30 мл). Органическую фазу промывали водой и солевым раствором, после чего высушивали над безводным Na2SO4. Оставшийся материал очищали путем препаративной TLC (ЕА:РЕ=1:8 объем/объем). В результате получали 59 мг (1S,2S,3R,4S,5R,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-2-(4-этилбензил)фенокси)циклогексанола (соединения 28).
(1R,2S,3R,4R,5S,6R)-4-(4-хлор-2-(4-этилбензил)фенокси)-6(гидроксиметил)циклогексан-1,2,3,5-тетраол (соединение 29)

В колбу, содержащую (1S,2S,3R,4S,5R,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-2-(4-этилбензил)фенокси)циклогексанол (соединение 28, 55 мг, 0,070 ммоль), помещали 14 мл смеси THF и метанола (1:1). К этой смеси прибавляли в один прием 55 мг Pd/C (10%). Реакционную смесь дегазировали 5 раз Н2 и полученную суспензию перемешивали в атмосфере H2 в течение 3 часов при температуре окружающей среды, затем фильтровали и концентрировали. Оставшийся материал очищали путем препаративной LC-MS и в результате получали 25 мг (1R,2S,3R,4R,5S,6R)-4-(4-хлор-2-(4-этилбензил)фенокси)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 29). 1H-ЯМР (D2O): δ 7,22-7,2 (1Н, d, J=9,2 Гц), 7,17-7,11 (4Н, q), 7,08-7,06 (1H, dd), 6,92-6,91 (1H, d, J=3,2 Гц), 4,11-4,08 (1H, t J=9,2 Гц), 4,01 (2Н, s), 3,92-3,91 (2H, m), 3,69-3,665 (1H, dd, J=10,8, 8,8 Гц), 3,46-3,39 (2H, m), 3.35-3,30 (1H, m), 2,66-2.58 (2H, q), 1,52-1,46 (1H, tt), 1,24~1,19 (3H,t).
Пример 15
Получение (1R,2S,3R,4R,5S,6R)-4-(2-(4-этилбензил)фенокси)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 30)

Соединение 30 получали способом, аналогичным описанному в примере 14.
1H-ЯМР (D2O): δ 7.24~7,22 (1H, d, J=8 Гц), 7,17-7,08 (5H, m), 7,02-6,99 (1H, d, J=7,2 Гц), 6,83-6,79 (1H, t, J=7,2 Гц), 4,14~4,09 (1H, t, J=9,2 Гц), 4,03 (2Н, s), 3,94~3,87 (2H, m), 3,68~3,63 (1H, dd, J=10,8, 9,2 Гц), 3,46~3,38 (2H, m), 3,34~3,30 (1H, m), 2,62~2,56 (2H, q), 1,53~1,46 (1H, tt), 1,22-1,18 (3H, t).
Пример 16
Получение (1R,2S,3R,4R, 6R)-4-(3-(4-этилбензил)фенил)-4-фтор-6-(гидроксиметил)циклогексан-1,2,3-триола (соединения 31)
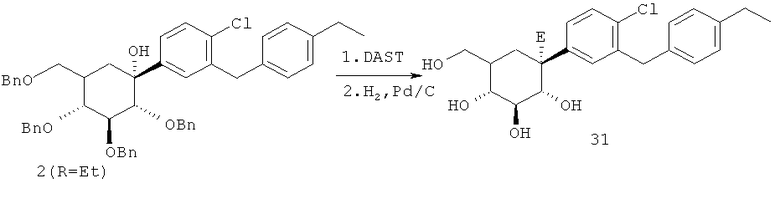
К раствору соединения 2 (30 мг) в CH2Cl2 (1 мл) прибавляли DAST (7 мкл) при температуре -78°С в атмосфере аргона. Через 2 часа к реакционной смеси прибавляли МеОН (0,5 мл), нагревали ее до комнатной температуры и добавляли насыщенный водный раствор NaCl (5 мл). Полученную смесь экстрагировали этилацетатом (3×10 мл). Объединенные органические экстракты выпаривали, оставшийся материал растворяли в смеси MeOH/THF (1:1, 5 мл), затем обрабатывали Pd/C 10% (10 мг) в атмосфере Н2. Через 4 часа путем препаративной HPLC выделяли соединение 31 (1,4 мг). 1H-ЯМР (300 МГц): δ 7,18-7,01 (8Н, m),3,90-3,86 (3H, m), 3,77-3,72 (1H, m), 3,61-3,31(3H, m), 2,62-2,54 (2H, q, J=7,5 Гц), 2,45-2,60 (2H, m), 1,53 (1H, m), 1,20-1,17 (3H, t, J=7,6 Гц); MS (ESI+): 375 [M+H]+, 392 [M+H2O]+, 416 [M+CH3CN+H]+.
Пример 17
Получение (1R,2S,3S,6S)-4-(4-хлор(3-(4-этилбензил)фенил)-6-(фторметил)циклогекс-4-ен-1,2,3-триола (соединения 33)
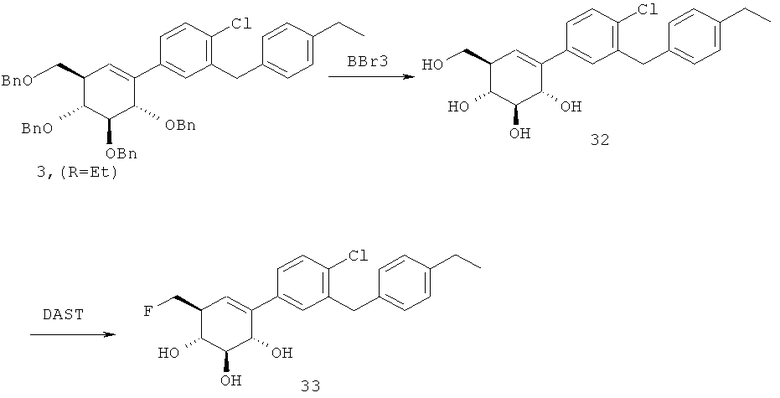
К раствору соединения 3 (R=Et) (122 мг) в CH2Cl2 (5 мл) добавляли по каплям BBr3 (0,33 мл) в атмосфере аргона при температуре -78°С. Эту смесь перемешивали в течение 2 часов, после чего добавляли водный насыщенный раствор NaHCO3 (1 мл). Полученную смесь нагревали до комнатной температуры и экстрагировали этилацетатом (3×10 мл). Объединенные органические экстракты высушивали над Na2SO4, концентрировали и очищали путем препаративной HPLC. В результате получали 18 мг соединения 32. 1H-ЯМР (400 МГц): δ 7,33-7,30 (2Н, m), 7,25-7,23 (1Н, m), 7,10 (4H, s), 5,85 (1Н, d), 4,58 (2Н, s), 4,51-4,49 (1Н, m), 4,12-4,01 (2Н, q, J=15,2 Гц), 3,89-3,85 (1Н, dd, J=4, 10,4 Гц), 3,68-3,53 (3Н, m), 2,63-2,57 (2Н, q, J=7,6 Гц), 1,23-1,19 (3Н, t, J=7, Гц); MS (ESI+): 406 [М+Н2О]+.
Раствор соединения 32 (11 мг) в CH2Cl2 (2 мл) обрабатывали DAST (3экв., 0,02 мл) при температуре -78°С в атмосфере аргона. Через 2 часа к реакционной смеси добавляли МеОН (0,5 мл). Полученную смесь нагревали до комнатной температуры и прибавляли к ней насыщенный водный раствор NaCl (5 мл). Водную часть экстрагировали этилацетатом (3×10 мл). Объединенные органические экстракты выпаривали и оставшийся материал очищали путем препаративной HPLC. В результате получали 1,8 мг соединения 33.
1Н-ЯМР (400 МГц) δ 7,30-7,08(7Н, m), 5,85 (1Н, m), 4,59-4,57 (1Н, m), 4,54 (2Н, s), 4,13-4,03 (2Н, q, J=15,2 Гц), 3,90-3,86 (1Н, dd, J=4, 10,4 Гц), 3,70-3,58 (3Н, m), 2,60-2,55 (2Н, q, J=7,6 Гц), 1,22-1,18 (3Н, t, J=7,6 Гц); MS (ESI+): 391 [M+H]+; 408 [M+H2O]+.
Пример 18
Этот пример иллюстрирует получение (1R,2R,3S,4S,6R)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)-5-метиленциклогексан-1,2,3-триола (соединения 35) путем синтеза, изображенным на фигуре 7.
В примерах 18 и 19 структура синтезированных соединений была подтверждена следующим образом. Данные 1Н-ЯМР были получены с помощью спектрометра Varian Mercury 300 при 300 МГц, отнесение сигналов проводили по химическому сдвигу внутреннего стандарта, в качестве которого служил TMS. Жидкостную хроматографию и масс-спектрометрию с ионизацией электрораспылением (LC-ESI-MS) осуществляли на оборудовании, состоявшем из жидкостного хроматографа Shimadzu LC-10ADVP, двухволнового УФ-детектора, автосамплера Gilson 215, испарительного детектора светорассеяния (ELS) Sedex 75 с и масс-спектрометра PE/Sciex API 150EX. Детектор ELS был установлен на температуру 40°С, усиление 7, давление N2 3,3 атм. Источник ионов Turbo использовался на API 150 при напряжении ионизации 5 кВ, температуре 300°С, напряжении на диафрагме 5 В, напряжении на контактных кольцах 175 В. Положительно заряженные ионы сканировали в Q1 от 160 до 650 масса/заряд. Каждый образец наносили в количестве 5,0 мкл на колонку Phenomenex Gemini C18 (5 мкм). Подвижная фаза состояла из 0,05%-ного водного (чистоты для HPLC) раствора муравьиной кислоты (А) и ацетонитрила (чистоты для HPLC) (В); использовались следующие градиенты (скорость потока 2 мл/мин): 0,00 мин, 95% А, 5% В; 4,00 мин 0% А, 100% В; 5,80 мин, 0% А, 100% В; 6,00 мин, 95% А, 5% В; 7,00 мин, 95% А, 5% В.
Получение (2R,3R,4R,5S,6S)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексанона (соединения 14)
К раствору трет-бутааола (28,2 мкл, 296 мкмоль) в дихлорметане (4 мл) добавляли периодинан Десс-Мартина [1,1,1 -трис(ацетилокси)-1,1 -дигидро-1,2-бензиодоксол-3-(1Н)-он] (116 мг, 274 мкмоль) и полученную смесь перемешивали в атмосфере аргона при комнатной температуре в течение 10 минут. К этой смеси добавляли раствор спирта 4 (R=Et, смесь изомеров) в дихлорметане (2 мл) и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разводили 4 мл этилацетата и в течение 1 часа энергично перемешивали с 3,5 мл смеси водных растворов насыщенного сульфата натрия/насыщенного бикарбоната натрия/солевого раствора (1,5:1:1). В результате фазы разделялись, и водную фазу экстрагировали этилацетатом (3 мл). Объединенную органическую фазу промывали солевым раствором (2 мл), высушивали (безводный Na2SO4), фильтровали и выпаривали. Путем препаративной TLC с дихлорметаном в качестве проявляющего растворителя получали соединение 14 (91 мг, 52%) в виде твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3) δ 7,35-6,90 (m, 25H), 6,80 (m, 2H), 4,96 (m, 3H), 4,55 (m, 4H), 4,11 (m, 3H), 3,94 (m, 2H), 3,79 (m, 3H), 3,47 (s, 1H), 2,83 (m, 1H), 2,62 (q, J=7,8 Гц, 2H), 1,16 (t, J=7,5 Гц, 3H), LC-ESI-MS m/z 766 (M+H), 788 (M+Na).
((1S,2R,3R,4R,6S)-4-(бензилоксиметил-6-(4-хлор-3-(4-этилбензил)фенил)-5-метиленциклогексан-1,2,3-триил)трис(окси)трис(метилен)трибензол (соединение 34):
К 0,5 мл безводного THF в сосуде под слоем азота прибавляли циклодибромди-µ-метилен[µ-(тетрагидрофуран)]трицинк [реагент Нистеда] (179 мг, 151 мкл, 78 мкмоль, 20%-ная (масса/масса) суспензия в THF). Полученную смесь охлаждали до -78°С и прибавляли к ней (2R,3R,4R,5S,6S)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексанон (соединение 14, 40 мг, 52 мкмоль) в 0,5 мл безводного THF, после чего по каплям добавляли TiCl4 (78 мкл, 78 мкмоль, 1 М в DCM), Эту смесь перемешивали при температуре -78°С в течение 20 минут, затем охлаждающую баню убирали и смесь перемешивали при комнатной температуре в течение 3 часов. Затем добавляли насыщенный водный раствор бикарбоната натрия (2 мл) и полученную смесь перемешивали в течение 30 минут. Эту смесь экстрагировали этилацетатом (2×4 мл), органический слой промывали солевым раствором (2 мл), высушивали над Na2SO4, фильтровали и выпаривали. Путем препаративной TLC (8:1 H/EtOAc) получали 25 мг (63%) соединения 34. 1H-ЯМР (300 МГц, CDCl3) δ 7,34-6,99 (m, 25H), 6,63 (m, 2H), 5,14 (s, 1H), 4,90 (m, 1H), 4,53 (m, 5H), 4,2(m, 3H), 3,78 (m, 3H), 3,60 (m, 2H), 3,47 (s, 1H), 3,35 (m, 1H), 2,56 (q, J=7,8 Гц, 2H), 2,42 (m, 1H), 1,16 (t, J=7,5 Гц, 3H), LC-ESI-MS m/z 764 (M+H), 786 (M+Na),
(1R,2R,3S,4S,6R)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)-5-метиленциклогексан-1,2,3-триол (соединение 35)
К раствору ((1S,2R,3R,4R,6S)-4-(бензилоксиметил-6-(4-хлор-3-(4-этилбензил)фенил)-5-метиленциклогексан-1,2,3-триил)трис(окси)трис(метилен)трибензола (соединения 34, 24 мг, 31,4 ммоль) в безводном DCM (0,8 мл) при температуре -78°С в сосуде под слоем азота прибавляли по каплям в течение 15 минут BCL3 (1 М в DCM, 0,25 мл). Полученную смесь перемешивали при температуре -78°С в течение 30 минут, затем постепенно нагревали до -20°С. При температуре -20°С реакционную смесь перемешивали еще 30 минут, и на этом, судя по данным LC-MS, реакция завершалась. Реакционную смесь охлаждали до -78°С и медленно добавляли метанол (1 мл). Полученный раствор нагревали до комнатной температуры и концентрировали при пониженном давлении. Оставшийся материал растворяли в 0,5 мл смеси DCM:MeOH (1:1) и наносили на пластину для препаративной TLC, которую проявляли в смеси DCM:MeOH (15:1). В результате получали 9 мг (71%) соединения 35 в виде твердого вещества белого цвета. 1H-ЯМР (300 МГц, CDCl3) δ 7,29-6,89 (m, 7H), 4,80 (s, 1H), 4,28 (s, 1H), 3,95 (m, 4H), 3,64 (m, 2H), 3,51(m, 3H), 3,22 (m, 1H), 2,58 (q, J=7,2 Гц, 2H), 2,25 (m, 1H), 1,18 (t, J=7,5 Гц, 3H), LC-ESI-MS m/z 425 (M+Na).
Пример 19
Этот пример иллюстрирует получение (4S,5S,6R,7R,8R)-4-(4-хлор-3-(4-этилбензил)фенил)-8-(гидроксиметил)спиро[2,5]октан-5,6,7-триола (соединения 37) путем синтеза, изображенным на фигуре 8.
(4R,5R,6R,7S,8S)-5,6,7-трис(бензилокси)-4-(бензилоксиметил)-8-(4-хлор-3-(4-этилбензил)фенил)спиро[2.5]октан (соединение 36)
К энергично перемешиваемому раствору ((1S,2R,3R,4R,6S)-4-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)-5-метиленциклогексан-1,2,3-триил)трис(окси)трис(метилен)трибензола (соединения 34, 25 мг, 32,7 мкмоль) в безводном толуоле (2 мл) в атмосфере азота при температуре -10°С прибавляли по каплям 2М раствор диметилцинка (146 мкл, 291 мкмоль) и перемешивали в течение 15 минут. Затем прибавляли по каплям дииодметан (47 мкл, 583 мкмоль) и полученную смесь перемешивали в течение ночи. Наблюдалось образование 40% продукта. Добавляли еще диметилцинк (еще 18 экв. в два приема на протяжении 48 часов) и дииодметан (35 экв. в два приема на протяжении 48 часов); через 96 часов реакция завершалась на 80%. К реакционной смеси прибавляли насыщенный раствор NH4CL (1 мл) и смесь перемешивали в течение 30 минут. Эту смесь разбавляли водой (1 мл) и экстрагировали этилацетатом (3×1 мл). Объединенные органические экстракты промывали 10%-ной серной кислотой (1,5 мл), насыщенным раствором NaHCO3 (1,5 мл) и солевым раствором (1,5 мл), высушивали (Na2SO4), фильтровали и выпаривали. В результате препаративной TLC (гексан:этилацетат 9:1) получали 85% соединения 36, которое непосредственно использовали в следующей реакции.
(4S,5S,6R,7R,8R)-4-(4-хлор-3-(4-этилбензил)фенил)-8-(гидроксиметил)спиро[2.5]октан-5,6,7-триол (соединение 37)
К раствору (4R,5R,6R,7S,8S)-5,6,7-трис(бензилокси)-4-(бензилоксиметил)-8-(4-хлор-3-(4-этилбензил)фенил)спиро[2.5]октана (соединения 36, 20 мг, 25,7 мкмоль) в смеси THF (0,2 мл) и метанола (0,8 мл) прибавляли 1,2-дихлорбензол (58 мкл, 515 мкмоль) и затем 14 мг палладия на угле (10%) Полученную смесь перемешивали в атмосфере водорода (1 атм.) в течение 40 минут. Смесь фильтровали через прокладку из целита в 6-миллилитровом шприце и прокладку промывали метанолом (1 мл). Растворитель выпаривали при пониженном давлении, оставшийся материал очищали путем препаративной TLC (DCM:EtOH 8:1). В результате получали 4 мг (37%) соединения 37 в виде твердого вещества белого цвета. 1H-ЯМР (300 МГц, CDCl3) δ 7,27-6,85 (m, 7H), 4,01 (s, 2H), 3,80 (m, 2H), 3,63 (m, H), 3,35 (d, J=5,1 Гц, 2Н), 3,02 (d, J=11,1 Гц, 1Н), 2,62 (q, J=7,5 Гц, 2H), 2,06 (m, 1Н), 1,21 (t, J=7,5 Гц, 3Н), 0,40 (m, 1Н), 0,29 (m, 1Н), 0,076 (m, 1Н), -0,326 (m, 1Н), LC-ESI-MS m/z 418 (M+H), 440 (M+Na).
Пример 20
Этот пример иллюстрирует получение соединения 5 (R=Et) в большом количестве.
Получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

(1) Получение (4R,5S,6R)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)циклогекс-2-енона

К раствору (3S,4S,5S,2R)-5-гидрокси-5-[(фенилметокси)метил]-2,3,4-трис(фенилметокси)циклогексан-1-она (580,0 г, 1,051 моль) в безводном метиленхлориде (3,6 л) прибавляли трифторуксусный ангидрид (331,1 г, 222 мл, 1,577 моль), а затем пиридин (149,7 г, 153 мл, 1,892 моль) при комнатной температуре в атмосфере аргона. Эту смесь перемешивали при комнатной температуре в течение 24 часов, после чего реакцию останавливали добавлением ледяной воды (1,0 л). Органический слой отделяли, водный слой экстрагировали метиленхлоридом (3×2 л). Объединенную органическую фазу промывали насыщенным водным раствором бикарбоната натрия (3×0,5 л), насыщенным водным солевым раствором (3×1,0 л), высушивали над сульфатом натрия, фильтровали и концентрировали. В результате получали 476,7 г масла желтого цвета (чистота 90%, выход 85%). 1H-ЯМР (CDCl3, 400 МГц): δ 7,26-7,48 (m, 20H), 6,26 (s, 1H), 5,15 (d, J=11,2 Гц, 1H), 5,05 (d, J=10,8 Гц, 1H), 4,95 (d, J=10,8 Гц, 1H), 4,77-4,81 (m, 2H), 4,72 (d, J=11,2 Гц), 4,55 (S, 2H), 4,40-4,42 (m, 1H), 4,31 (d, J=16 Гц, 1H), 4,03-4,13 (m, 3H).
(2) Получение (4-хлор-3-(4-этилбензил)фенил)магния бромида

Порошок магния (34,7 г, 1,446 моль) помещали (в атмосфере аргона) в трехгорлую колбу, добавляли часть раствора 2-(4-этилбензил)-4-бром-1-хлорбензола (122,5 г, 0,398 моль) в безводном тетрагидрофуране (0,4 л) и 1,2-дибромэтан (2,89 г, 1,34 мл, 0,015 моль). Смесь нагревали до кипения (с обратным холодильником) и, когда реакция начиналась (экзотермическая с поглощением магния), по каплям добавляли остальной раствор 2-(4-этилбензил)-4-бром-1-хлорбензола (245,0 г, 0,796 моль) в безводном тетрагидрофуране (0,81 л). Реакционную смесь оставляли для протекания реакции на 1 час при слабом кипении с обратным холодильником до тех пор, пока не поглощалась большая часть магния.
(3) Получение (1R,4R,5S,6R)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)-1-(4-хлор-3-(4-этилбензил)фенил)циклогекс-2-енола

В раствор (4R,5S,6R)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)циклогекс-2-енона (476,7 г, чистота 90%, 0,893 моль) в безводном тетрагидрофуране (1,0 л) прибавляли по каплям реагент Гриньяра, полученный на предыдущей стадии, в атмосфере аргона при комнатной температуре (около 25°С) и эту смесь перемешивали в течение 3 часов. Затем добавляли насыщенный водный раствор хлорида аммония (100 мл) и полученную смесь экстрагировали этилацетатом (3×1 л). Органический слой промывали солевым раствором (3×0,5 л), высушивали над сульфатом натрия, фильтровали и концентрировали. В результате получали масло желтого цвета (614 г, выход 90%). Неочищенный (1R,4R,5S,6R)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)-1-(4-хлор-3-(4-этилбензил)
фенил)циклогес-2-енол использовали непосредственно на следующей стадии. MS (ESI+) (m/z): 782 (М+18)+, 787 (М+23)+.
(4) Получение ((1R,2S,3S,6R)-6-бензилоксиметил)-4-(4-хлор-3-(4-этилбензил)фенил)циклогекс-4-ен-1,2,3-триил)трис(окси)трис(метилен)трибензола

Триэтилсилан (167,9 г, 229,7 мл, 1,446 моль, 2 экв.) и эфират трифторида бора (205,2 г, 204,1 мл, 1,446 моль, 2 экв.) добавляли последовательно в раствор (1R,4R,58,6R)-4,5,6-трис(бензилокси)-3-(бензилоксиметил)-1-(4-хлор-3-(4-этилбензил)фенил)циклогекс-2-енола (614,0 г, неочищенный, ~0,723 моль, 1 экв.) в метиленхлориде (2,6 л) в атмосфере аргона при температуре -20°С, и эту смесь перемешивали в течение 1 часа при температуре -20°С. Затем прибавляли водный насыщенный раствор хлорида аммония (100 мл) и полученную смесь экстрагировали метиленхлоридом (3×1 л). Органический слой промывали солевым раствором (3×0,5 л), высушивали над сульфатом натрия, фильтровали и концентрировали. Оставшийся материал очищали путем перекристаллизации из кипящей смеси безводного этанола и изопропилового эфира (с обратным холодильником). В результате получали твердое вещество белого цвета (513 г, чистота 95%, выход 95%).
(5) Получение (1R,2S,3R,4R,5S,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексанола

К раствору ((1R,2S,3S,6R)-6-бензилоксиметил)-4-(4-хлор-3-(4-этилбензил)фенил)циклогекс-4-ен-1,2,3 -триил)трис(окси)трис(метилен)трибензола (513 г, чистота 95%, 0,651 моль, 1 экв.) и боргидрида лития (7,1 г, 2 М в тетрагидрофуране, 0,326 моль, 0,5 экв.) в безводном тетрагидрофуране (5 л) в реакционном сосуде высокого давления из нержавеющей стали прибавляли комплекс боран-тетрагидрофуран (1 М в тетрагидрофуране) (1,31 л, 1,302 моль, 2 экв.) в атмосфере аргона при температуре 0°С. Смесь нагревали до около 70-80°С, после чего давление в реакторе достигало около 2-2,5 атм. При этой температуре реакционную смесь перемешивали в течение 40 минут. Затем реакционный сосуд остужали до комнатной температуры, его содержимое переносили в трехгорлую колбу и остужали до -20°С. Туда добавляли холодный (0°С) раствор гидроксида натрия (78,1 г, 3 М в воде, 1,953 моль, 3 экв.), затем 30%-ную перекись водорода (442,8 г, 438,4 мл, 1,953 моль, 20 экв.) и смесь оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь подкисляли 1 н. соляной кислотой до рН 6 и растворитель удаляли при пониженном давлении. К оставшемуся материалу добавляли воду (5 л) и полученную смесь экстрагировали этилацетатом (3×2 л). Органическую фазу промывали солевым раствором (3×1 л), высушивали над сульфатом натрия, фильтровали и концентрировали. Оставшийся материал очищали путем перекристаллизации в смеси этиловый эфир/н-гексан (1:10 объем/объем, 10 мл/г неочищенного вещества). В результате получали твердое вещество белого цвета (314,7 г, чистота 95%, выход 60%).
(6) Получение неочищенного (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

К раствору (1R,2S,3R,4R,5S,6R)-3,4,5-трис(бензилокси)-2-(бензилоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексанола (60 г, чистота 98%, 0,077 моль, 1 экв.) в смеси тетрагидрофуран:метанол (2:1 объем/объем) (600 мл) прибавляли 1,2-дихлорбензол (21,5 г, 16,54 мл, 0,82 моль, 2 экв.), палладий на угле (10%, 4,8 г) и перемешивали в течение 4 часов в атмосфере водорода (1 атм.) при комнатной температуре (около 25°С). Полученную смесь фильтровали, фильтрат выпаривали досуха и в результате получали масло желтого цвета (чистота 80%).
(7) Получение (1S,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексан-1,2,3,5-тетраилтетраацетата (соединения 19)
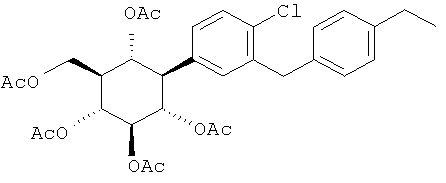
Уксусный ангидрид (78,8 г, 72,9 мл, 0,77 моль, 10 экв.), N,N-диизопропилэтиламин (99,5 г, 134,1 мл, 0,77 моль, 10 экв.) и 4-диметиламинопиридин (DMAP) (0,47 г, 3,85 ммоль, 0,05 экв.) медленно прибавляли к раствору полученного, как описано выше, неочищенного масла (1R,2R,3S,4R,5R,6S)-4-(3-(4-этилбензил)-4-хлорфенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (0,077 моль, чистота 80%) в метиленхлориде (300 мл) при 0°С и эту смесь перемешивали в течение ночи при комнатной температуре. Смесь подкисляли 1 н. соляной кислотой до рН 6 и органический слой промывали 1 н. соляной кислотой (3×200 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Оставшийся материал перекристаллизовывали в кипящей смеси этанол:этилацетат (3:1 объем/объем, 15 мл/г неочищенного продукта). Твердое вещество появлялось при ~58°С, и смесь перемешивали 2 часа при этой температуре, после чего давали остыть до комнатной температуры в течение 2 часов. В результате получали твердое вещество белого цвета (42,2 г, чистота 99,4%, выход 88,7% на двух стадиях).
(8) Получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола

К перемешиваемому раствору (1S,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексан-1,2,3,5-тетраилтетраацетата (98 г,>99%, 0,158 моль, 1 экв.) в метаноле (1 л) прибавляли гидроксид натрия (порошок, 12,6 г, 0,315 моль, 2 экв.) и эту смесь кипятили с обратным холодильником в течение ночи. Полученную смесь подкисляли 1 н. соляной кислотой до рН 6 и удаляли летучие компоненты при пониженном давлении. Оставшийся материал растворяли в этилацетате (3 л), промывали водой (1 л), затем солевым раствором (1 л), высушивали над сульфатом натрия, фильтровали и концентрировали. В результате получалась белая пена, которую концентрировали, дважды прокипятив с обратным холодильником в смеси этанол:вода (1:3 объем/объем, 20 мл/г неочищенного продукта). В результате получали твердое вещество белого цвета (58 г, чистота 99,3%, выход 90%).
Пример 21
Этот пример иллюстрирует получение l-(4-(2-хлор-5-((1R,28,3R,4R,58,6R)-2,3,4,6-тетрагидрокси-5-(гидроксиметил)циклогексил)бензил)фенил)этанона (соединения 39).
Получение (1S,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(3-(4-ацетилбензил)-4-хлорфенил)циклогексан-1,2,3,5-тетраилтетраацетата (соединения 38)

К энергично перемешиваемому раствору (18,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(4-хлор-3-(4-этилбензил)фенил)циклогексан-1,2,3,5-тетраилтетраацетата (соединения 19) (300 мг, 48,7 мкмоль) в уксусной кислоте (5 мл) прибавляли K2Cr2O7 (172 мг, 0,58 ммоль). Полученную смесь перемешивали в течение 22 часов при температуре 125°С, после чего остужали до комнатной температуры, разбавляли водой (20 мл) и экстрагировали этилацетатом (3×20 мл). Объединенные органические экстракты промывали насыщенным раствором NaHCO3 (3×10 мл), затем солевым раствором (20 мл), высушивали (Na2SO4), фильтровали и концентрировали. Путем препаративной TLC (гексан:этилацетат 2:1) получали 100 мг желаемого соединения. MS (ESI+): 631 [М+Н]+, 648 [M+H2O]+.
Получение 1-(4-(2-хлор-5-((1R,2S,3R,4R,5S,6R)-2,3,4,6-тетрагидрокси-5-(гидроксиметил)циклогексил)бензил)фенил)этанона (соединения 39)

К раствору (1S,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(3-(4-ацетилбензил)-4-хлорфенил)циклогексан-1,2,3,5-тетраилтетраацетата (соединения 38) (300 мг, 47,6 мкмоль) в МеОН (5 мл) прибавляли гидроксид натрия (29 мг, 72 мкмоль) и перемешивали в течение 1,5 часа с обратным холодильником. Полученную смесь подкисляли 1 н соляной кислотой до рН 6 и растворители удаляли при пониженном давлении. Оставшийся материал очищали путем препаративной HPLC и в результате получали 30 мг желаемого соединения. 1H-ЯМР (400 МГц, CD3OD): δ 7,90 (2Н, d, J=8,4 Гц), 7,35 (3Н, m), 7,22 (Н, d, J=1,6 Гц), 7,18 (1Н, d, J=8,4, 1,6 Гц), 4,17 (2Н, s), 3,91 (2Н, d, J=3,2 Гц), 3,66 (1Н, t, J=10,4 Гц), 3,49-3,40 (2Н, m), 3,30 (1Н, m), 2,57-2,52 (4H, m), 1,55-1,50 (1Н, m); MS (ESI-): 421 [M+H]+, 443 [M+Na]+, (ESI-): 465 [M+HCOO]-.
Пример 22
Получение (1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-(1-гидроксиэтил)бензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола (соединения 40)
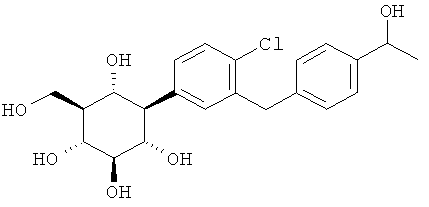
Соединение 40 получали путем восстановления (1S,2R,3R,4S,5R,6R)-4-(ацетоксиметил)-6-(3-(4-ацетилбензил)-4-хлорфенил)циклогексан-1,2,3,5-тетраилтетраацетата (соединения 38) в присутствии избытка боргидрида натрия и очистки путем препаративной HPLC. В результате получали 0,6 мг прозрачной пленки. MS (ESI+): 445 [M+Na]+, (ESI-): 467 [M+HCOO]-.
Пример 23
Ингибирующий эффект соединений по данному изобретению в отношении SGLT был продемонстрирован следующим образом.
Получение вектора для экспрессии человеческого SGLT2
Клон полноразмерной кДНК, обеспечивающий экспрессию человеческого SGLT2 (GenScript Corporation), субклонировали в сайты Hind III и Not I вектора экспрессии рЕАК15. Клоны, содержащие вставку кДНК, идентифицировали путем рестрикционного анализа.
Получение линии клеток со стабильной экспрессией SGLT2
Плазмиду, содержащую ген человеческого SGLT2, линеаризовали с помощью рестриктазы Nsi I и очищали путем электрофореза в агарозном геле. Используя для трансфекции липофектамин 2000 (Invitrogen Corporation), ДНК трансфецировали в клетки HEK293.ETN, которые культивировали в среде Игла, модифицированной по Дульбекко (DMEM), содержащей 10% фетальной телячьей сыворотки (FBS), при температуре 37°С в атмосфере, содержащей 5% CO2, в течение 24 часов. Трансфецированные клетки отбирали в той же среде для роста с добавлением пуромицина (Invitrogen Corporation) в течение двух недель. Клетки, устойчивые к пуромицину, высевали на новый 96-луночный планшет (одна клетка на лунку) и культивировали в присутствии пуромицина до конфлюэнтного состояния. У клонов, устойчивых к пуромицину, определяли активность SFLT2 по поглощению метил-α-D-[U-14С]глюкопиранозида, как описано ниже. Для определения поглощения метил-α-D-[U-14С]глюкопиранозида использовался тот клон, у которого наблюдалось наибольшее отношение сигнал/фон.
Получение клеток с экспрессией человеческого SGLT1
Полноразмерная кДНК человеческого SGLT1 в экспрессионном векторе pDream2,1 была предоставлена GenScript Corporation и размножена в штамме DH5a Escherichia coli с использованием среды Лурия-Бертани (LB), содержащей ампициллин. Плазмидную ДНК выделяли, используя набор QIAGEN Plasmid Midi Kit (QIAGEN Inc,). Плазмидную ДНК для экспрессии человеческого SGLT1 трансфецировали в клетки COS-7 (American Type Culture Collection) с помощью липофектамина 2000 согласно протоколу, предлагаемому производителем данного реагента. Трансфецированные клетки хранили в среде DMEM, содержащей 10% диметилсульфоксида (DMSO), при температуре -80°С.
Определение поглощения метил-α-D-[U-14С]люкопиранозида
Клетки с экспрессией SGLT1 или SGLT2 высевали на 96-луночные планшеты для сцинтилляционного счета ScintiPlate (PerkinElmer, Inc.) в среде DMEM, содержащей 10% FBS, (1×105 клеток на лунку в 100 мкл среды) и инкубировали при температуре 37°С в атмосфере, содержащей 5% СО2, в течение 48 часов. Клетки промывали дважды по 150 мкл буферного раствора с натрием (137 мМ NaCl, 5,4 мМ KCl, 2,8 мМ CaCl2, 1,2 мМ MgCl2, 10 мМ трис(гидроксиметил)аминометан/N-2-гидроксиэтилпиперазин-N'-этансульфоновая кислота [Tris/Hepes], рН 7,2) либо без натрия (137 мМ N-метил-глюкамин, 5,4 мМ KCl, 2,8 мМ CaCl2 1,2 мМ MgCl2, 10 мМ Tris/Hepes, рН 7,2). В лунки 96-луночного планшета вносили испытываемое соединение в буферном растворе с натрием либо без натрия, содержащем 40 мкКи/мл метил-α-D-[U-14С]глюкопиранозида (Amersham Biosciences/GE Healthcare) и 25% человеческой сыворотки крови, в количестве 50 мкл на лунку и инкубировали при температуре 37°С и перемешивании встряхиванием в течение 2 часов (в случае SGLT1) либо 1,5 часа (в случае SGLT2). Клетки промывали дважды 150 мкл буферного раствора для промывания (137 мМ N-метилглюкамин, 10 мМ Tris/Hepes, рН 7,2) и определяли поглощение метил-α-D-[U-14С]глюкопиранозида с помощью сцинтилляционного счетчика TopCount (PerkinElmer, Inc.). Рассчитывали натрий-зависимое поглощение глюкопиранозида, вычитая значения, полученные с буферным раствором без натрия, из значений, полученных с буферным раствором, содержащим натрий (среднее из трех определений).
+ <1 мкМ
++ 1 мкМ-10 мкМ
+++ >10 мкМ
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ SGLT2 | 2009 |
|
RU2530494C2 |
| НОВОЕ ЦИКЛОГЕКСАНОВОЕ ПРОИЗВОДНОЕ, ЕГО ПРОЛЕКАРСТВО И ЕГО СОЛЬ И СОДЕРЖАЩЕЕ ИХ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ОТ ДИАБЕТА | 2005 |
|
RU2394015C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗИЛБЕНЗОЛЬНЫХ ИНГИБИТОРОВ SGLT2 | 2013 |
|
RU2625795C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ КОМПЛЕКСОВ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ SGLT2, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2641905C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| НОВОЕ ПРОИЗВОДНОЕ ГЛЮЦИТОЛА, ЕГО ПРОЛЕКАРСТВО И ЕГО СОЛЬ И СОДЕРЖАЩИЙ ИХ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА | 2005 |
|
RU2386631C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2686117C1 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| БЕНЗИЛОВЫЕ ПРОИЗВОДНЫЕ ГЛИКОЗИДОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2492175C2 |






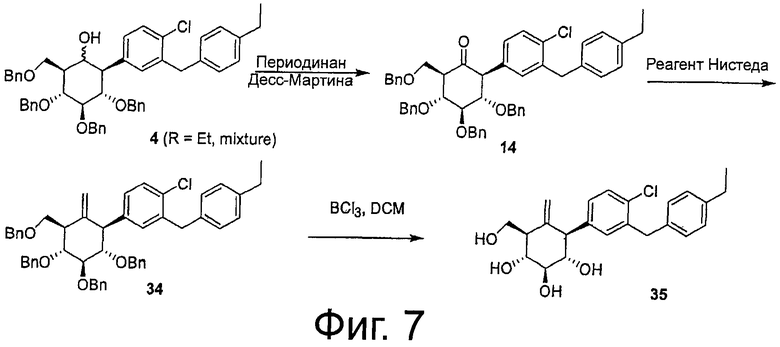

Предлагаются соединения общей формулы I, где значения радикалов указаны в описании, обладающие ингибирующим действием на натрий-зависимый котранспортер глюкозы SGLT. Данным изобретением предлагаются также фармацевтические композиции, обладающие ингибирующим эффектом в отношении SGLT, и способы получения указанных соединений и синтетических интермедиатов, а также способы применения этих соединений, самих по себе или в сочетании с другими терапевтическими агентами, для лечения заболеваний и состояний, на которые влияет ингибирование SGLT, например такого заболевания, как сахарный диабет 1 и 2 типа, гипергликемии, диабетических осложнений, инсулинорезистентности, метаболического синдрома, гиперинсулинемии, гипертензии, гиперурикемии, ожирения, отеков, дислипидемии, хронической сердечной недостаточности и атеросклероза. 10 н. и 11 з.п. ф-лы, 23 пр., 1 табл., 8 ил.

1. Соединение формулы I:

где
А представляет собой одинарную связь;
Q выбирают из группы, состоящей из структур Q1, Q3 и Q4:



Z представляет собой метилен;
R1, R2 и R3 каждый независимо выбирают из группы, состоящей из водорода и галогена;
R4 выбирают из группы, состоящей из C1-C6-алкила, С3-С10-циклоалкила, C1-C6-алкилоксигруппы, (С3-C7-циклоалкил)С3-С5-алкинилоксигруппы и (С1-С4-алкил)карбонила, где алкильные группы или части при необходимости монозамещены гидроксигруппой;
R5 и R6 каждый представляет собой водород;
R7, R8, R9 и R10 каждый независимо выбирают из группы, состоящей из гидрокси-, (C1-С18-алкил)карбонилоксигруппы и галогена;
и при необходимости R10 и R11 могут быть объединены с атомами углерода, к которым каждый из них присоединен, так что образуется 5-7-членное конденсированное циклоалкановое кольцо, которое при необходимости дизамещено C1-С3-алкилами, а две метиленовые группы циклоалкильного кольца при необходимости независимо друг от друга заменены О;
R11 выбирают из группы, состоящей из гидроксигруппы, и C1-C6-алкилоксигруппы,
R12 представляет собой водород; или
R11 и R12 при необходимости соединены, так что вместе с атомом углерода, к которому они присоединены, образуют С3-С7-спироциклоалкановое кольцо;
R13 и R14 каждый независимо выбирают из группы, состоящей из водорода, галогена и гидроксигруппы;
R15 выбирают из группы, состоящей из кислорода и CRbRc; и
Rb и Rc каждый представляет собой водород;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R1 представляет собой галоген, а R2 и R3 каждый является водородом.
3. Соединение по п.1, в котором R4 выбирают из группы, состоящей из C1-C6-алкила, С3-С10-циклоалкила, C1-C6-алкилоксигруппы и (С3-C7-циклоалкил)С3-С5-алкинилоксигруппы.
4. Соединение по п.11, в котором R7, R8, R9 и R10 каждый является гидроксигруппой.
5. Соединение по п.1, в котором R11 представляет собой гидрокси.
6. Соединение по п.1 формулы IA:

где
R1 выбирают из группы, состоящей из водорода, и галогена;
R4 выбирают из группы, состоящей из C1-C6-алкила, С3-С10-циклоалкила, C1-C6-алкилоксигруппы и (С3-С7-циклоалкил)С3-С5-алкинилоксигруппы; и
Q выбирают из структур Q1A, Q3A и Q4A:

где
R11 представляет собой гидрокси; и
R15 выбирают из группы, состоящей из кислорода и CRbRc, где Rb и Rc каждый представляет собой водород.
7. Соединение по п.6, в котором Q выбирают из группы, состоящей из Q1A и Q3A.
8. Соединение по п.1, выбираемое из группы, состоящей из
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола,
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-этоксибензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола,
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-циклопропилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола,
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-пропилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола,
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-циклогексилбензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола,
(1R,2S,3R,4R,5S,6R)-4-(2-(4-этилбензил)фенокси)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола,
(1S,2R,3S,4S,6R)-4-(4-хлор-3-(4-этилбензил)фенил)-6-(гидроксиметил)-5-метиленциклогексан-1,2,3-триола,
(4R,5S,6R,7R,8R)-4-(4-хлор-3-(4-этилбензил)фенил)-8-(гидроксиметил)спиро[2.5]октан-5,6,7-триола,
1-(4-(2-хлор-5-((1R,2S,3R,4R,5S,6R)-2,3,4,6-тетрагидрокси-5-(гидроксиметил)циклогексил)бензил)фенил)этанона и
(1R,2R,3S,4R,5R,6S)-4-(4-хлор-3-(4-(1-гидроксиэтил)бензил)фенил)-6-(гидроксиметил)циклогексан-1,2,3,5-тетраола.
9. Пролекарство (карбоксилатный эфир) соединения по п.1.
10. Фармацевтическая композиция, обладающая ингибирующим эффектом в отношении SGLT, содержащая фармацевтически приемлемый носитель и эффективное количество соединения или его фармацевтически приемлемой соли по п.1.
11. Способ лечения заболеваний или состояний, в которых играет роль SGLT, включающий введение терапевтически эффективного количества соединения по п.1 нуждающемуся в том субъекту.
12. Способ лечения диабета, включающий введение терапевтически эффективного количества соединения по п.1 нуждающемуся в том субъекту.
13. Способ по п.12, в котором указанный диабет является диабетом типа 1.
14. Способ по п.12, в котором указанный диабет является диабетом типа 2.
15. Способ по п.12, в котором указанное соединение вводят в сочетании с терапевтическим агентом, выбираемым из группы, состоящей из средств против диабета, агентов, понижающих/модулирующих уровень липидов, средств для лечения диабетических осложнений, средств против ожирения, антигипертензивных агентов, антигиперурикемических агентов, и средств для лечения хронической сердечной недостаточности или атеросклероза.
16. Способ по п.11, где указанное заболевание или состояние выбирают из группы, состоящей из сахарного диабета типа 1, сахарного диабета типа 2, гипергликемии, диабетических осложнений, инсулинорезистентности, метаболического синдрома, гиперинсулинемии, гипертензии, гиперурикемии, ожирения, отеков, дислипидемии, хронической сердечной недостаточности и атеросклероза.
17. Соединение формулы:
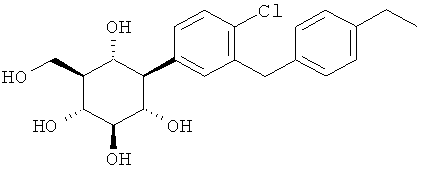
18. Соединение формулы:

19. Способ лечения заболеваний или состояний, в которых играет роль SGLT, где указанное заболевание или состояние выбирают из группы, состоящей из сахарного диабета типа 1, сахарного диабета типа 2, гипергликемии, диабетических осложнений, инсулинорезистентности, метаболического синдрома, гиперинсулинемии, гипертензии, гиперурикемии, ожирения, отеков, дислипидемии, хронической сердечной недостаточности и атеросклероза, и где способ включает введение терапевтически эффективного количества соединения по п.17 нуждающемуся в том субъекту.
20. Способ лечения диабета, включающий введение терапевтически эффективного количества соединения по п.17 нуждающемуся в том субъекту.
21. Фармацевтическая композиция, обладающая ингибирующим эффектом в отношении SGLT, содержащая фармацевтически приемлемый носитель и эффективное количество соединения по п.17.
| УСТРОЙСТВО УПРАВЛЕНИЯ СОДЕРЖИМЫМ | 2011 |
|
RU2573777C2 |
| US 20060009400 A1, 12.01.2006 | |||
| US 20070072896 A1, 29.03.2007 | |||
| US 20060035841 A1, 16.02.2006 | |||
| Способ получения 3-/2-окси-4-(замещенных)-фенил/циклоалканольных соединений | 1980 |
|
SU991944A3 |
Авторы
Даты
2014-01-27—Публикация
2008-12-11—Подача