Изобретение относится к синтезу новых биологически активных соединений, в частности сульфонил-β-D-тиоксилозидов, которые могут найти применение в терапии в качестве противотромбозных агентов, особенно венозных противотромбозных агентов.
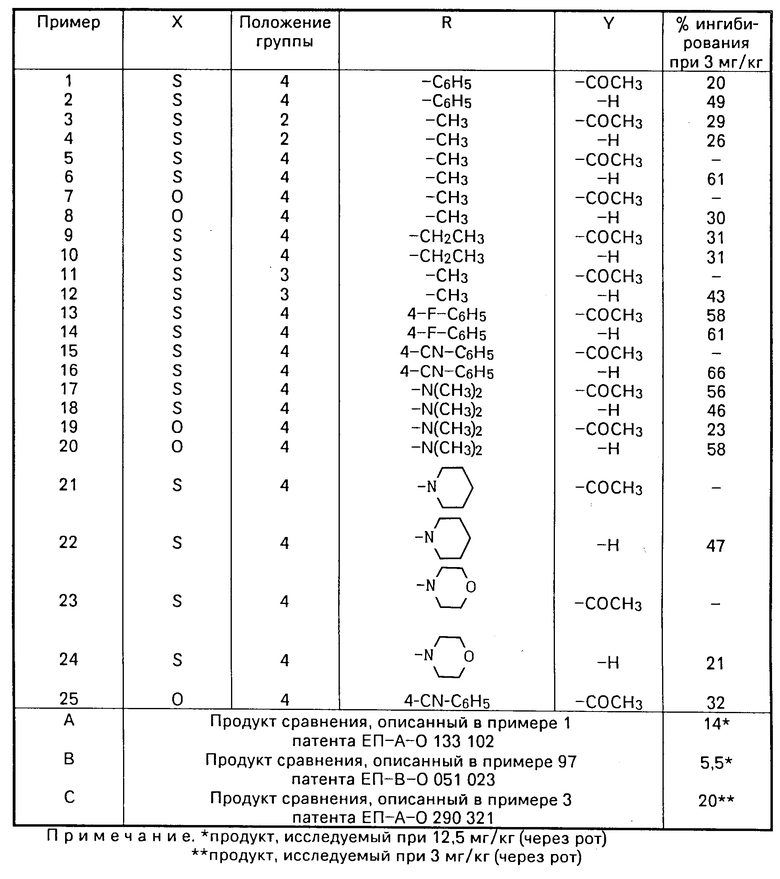
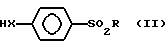
Таким образом, изобретение относится к способу получения сульфонилфенил-β-D-тиоксилозидов общей формулы: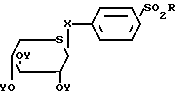 (I) в которой Х атом серы или атом кислорода;
(I) в которой Х атом серы или атом кислорода;
R алкильная группа С1-С4, замещенная аминогруппа NR1R2, где R1 и R2 идентичные или различные, каждый представляет собой алкильную группу С1-С4, или R1 и R2 вместе с атомом азота, с которым они связаны, могут образовывать пиперидинильную или морфолинильную группу; или фенильную группу, возможно замещенную в пара-положении цианогруппой или атомом галогена;
Y атом водорода или группа C-CH3.
O
Получаемые соединения являются новыми и не описаны в литературе.
Способ получения соединений формулы I заключается в том, что соединение формулы II
HX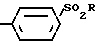 (II) где Х и R имеют указанные выше значения, подвергают взаимодействию с производным тиоксилозила, выбранным из группы, содержащей
(II) где Х и R имеют указанные выше значения, подвергают взаимодействию с производным тиоксилозила, выбранным из группы, содержащей
галогениды ацилтиоксилозила формулы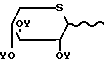 HaI (III)
HaI (III)
перацилированные тиоксилозы формулы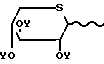 OY (IV)
OY (IV)
трихлорацетимидаты ацилтиоксилозила формулы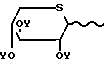 O-
O- CCl3 (V) в которых На1 атом галогена, такой как хлор или бром (причем атом брома является предпочтительным);
CCl3 (V) в которых На1 атом галогена, такой как хлор или бром (причем атом брома является предпочтительным);
Y группа СН3СО; в инертном растворителе при соотношении 1 моль соединения формулы II на 0,6-1,2 моль соединения формулы III, IV или V, в присутствии кислотного акцептора и/или кислоты Льюиса,
полученное соединение формулы I выделяют, или при Y=СОСН3 подвергают деацетилированию при температуре между 0оС и температурой кипения реакционной среды в низшем спирте С1С4 в присутствии алкоголята металла, предпочтительно метилата магния или метилата натрия, с целью получения соединения формулы I, в которой Y является водородом.
Соединения формул III-V могут находиться в α- или β-конфигурации или в виде аномерной смеси двух конфигураций.
Реакцию гликозилирования соединений формулы II проводят либо используя соединения формулы III в присутствии катализатора такого, как соли или оксиды серебра, ртути или цинка, либо используя соединения формулы V в присутствии кислоты Льюиса, особенно эфирной вытяжки трифторида бора или хлорида цинка, либо с использованием соединения формулы IV в присутствии кислоты Льюиса.
Предпочтительно проводят конденсацию при соотношении 1 моль соединения формулы II с 1,1 1,2 моль галогенида ацилтиоксилозила формулы III в инертном растворителе, выбранном из полярных или неполярных растворителей (таких, как, например, диметилформамид, тетрагидрофуран, диоксан, ацетонитрил, нитрометан, бензол, толуол, ксилолы и их смеси), в присутствии цианида ртути.
Преимущественно используют бромид 2,3,4-три-0-ацетил-5-тио-α-D-ксилопирано- зила в смеси бензол-нитрометан 1/1 (по объему) в присутствии 1,1-1,3 моль цианида ртути при температуре между 0оС и температурой кипения реакционной смеси, предпочтительно при 40-50оС, в течение 1-4 ч, предпочтительно в течение 2 ч.
В соответствии с вторым предпочтительным вариантом изобретения осуществляют конденсацию 1 моль соединения формулы II с 1,1-1,2 моль галогенида ацилтиоксилозила формулы III в инертном растворителе (таком, как, например, дихлорметан или ацетонитрил) в присутствии имидазолата серебра и хлорида цинка.
Преимущественно используют бромид 2,3,4-три-0-ацетил-5-тио-D-ксилопиранози- ла в дихлорметане или в смеси дихлорметан/ацетонитрил в присутствии 1,5-1,7 моль имидазолата серебра и 2-2,2 моль хлорида цинка при температуре между 0оС и температурой кипения реакционной среды, предпочтительно при температуре 40-60оС, в течение 24-48 ч.
В соответствии с третьим предпочтительным вариантом изобретения осуществляют конденсацию 1 моль соединения с формулой II с 0,6-1 моль галогенида ацилтиоксилозила III в инертном растворителе (таком, как, например, толуол и/или ацетонитрил) в присутствии оксида цинка.
Преимущественно используют бромид 2,3,4-три-0-ацетил-5-тио-D-ксилопиранози- ла в смеси толуол/ацетонитрил в присутствии 0,5-1,2 моль оксида цинка при температуре, заключенной между комнатной температурой и температурой кипения реакционной среды, предпочтительно при температуре примерно 40-60оС, в течение 18-48 ч.
В соответствии с четвертым предпочтительным вариантом осуществления изобретения целесообразно проводить конденсацию 1 моль соединения с формулой II с 1,1-1,3 моль трихлорацетимидата ацилтилтиоксилозила в инертном растворителе (таком, как, например, дихлорметан или ацетонитрил) в присутствии эфирной вытяжки трифторида бора или хлорида цинка.
Преимущественно используют трихлорацетимидат 2,3,4-три-0-ацетил-5-тио-α-D-ксилопиранозила в дихлорметане в присутствии 0,1-0,4 моль эфирной вытяжки трифторида бора, растворенной в дихлорметане или в ацетонитриле, или в присутствии хлорида цинка при температуре, заключенной между -40оС и комнатной температурой (15-25оС), предпочтительно при температуре примерно от -20 до 0оС, в течение 1-5 ч.
Реакция гликозилирования проводит во всех случаях к смеси изомеров с α- или β-конфигурацией в изменяющихся соотношениях.
Изомер с β-конфигурацией выделяют в соответствии с известными методами, например дробной кристаллизацией или хроматографией, особенно флэш-хро- матографией (т. е. хроматография на колонке с кремнеземом под давлением в соответствии с методикой, описанной W.C.Still et al. J. Org. Chem. (1978), 42 (N 14), 2923).
Полученные производные подвергают в случае необходимости диацетилированию при температуре от 0оС до температуры кипения реакционной среды, в низшем спирте С1-С4 в присутствии соответствующего алкоголята металла. Предпочтительно выбирают метанол в качестве низшего спирта и метанолят натрия или магния в качестве алкоголята металла. Реакцию деацетилирования в случае необходимости проводят без выделения образующегося промежуточного ацилированного соединения.
Можно также проводить реакцию деацетилирования энзиматическим путем, например при действии эстеразы свиной печени.
Соединения формулы 1 могут входить в терапевтические составы вместе с инертными, физиологически приемлемыми добавками.
Другие характеристики и преимущества изобретения иллюстрируются примерами получения соединений согласно изобретению, данными ниже.
В этих примерах дано указание на α- или β-конфигурацию, если таковая конфигурация была определена. Когда нет указаний на конфигурацию, что означает, что соответствующий продукт является аномерной смесью α- и β-конфигураций в соотношениях, которые не определялись.
Получение 1. 1-а. Получение 4-(фенилсульфонил)-бензолтиола.
В атмосфере азота прибавляют 1,25 г тиометанолята натрия к раствору, содержащему 15 г (0,0593 моль) 1-хлор-4-(фенилсульфонил)-бензола в 150 мл гексаметил- фосфорамида. Полученную смесь нагревают в течение 4 ч при температуре 100оС, затем после охлаждения гидролизуют смесью вода/лед. Полученную реакционную среду экстрагируют этилацетатом, затем полученную водную фазу приливают к 4н. раствору хлороводородной кислоты при температуре 0оС. Образованный продукт выделяется в виде осадка. После фильтрования, промывания водой до нейтрального значения рН и сушки получают 13,44 г (с выходом 90,5%) ожидаемого продукта. Температура плавления (Тпл) 117оС.
1. b. Получение 4-(фенилсульфонил)-фенил-2,3,4-три-0-ацетил-1,5-дитио-β-D-ксило- пиранозида (пример 1).
В атмосфере азота прибавляют 10,6 г цианида ртути (Нg(CN)2 к раствору, содержащему 10 г (0,0399 моль) 1-меркапто-4-(фенилсульфонил)-бензола в 300 мл смеси толуол/нитрометан 1/1 (по объему), затем полученную смесь перемешивают в течение 1 ч при температуре 40-45оС. Наблюдают выделение осадка. Затем 17,7 г (0,0498 моль) 2,3,4-три-0-ацетил-1-бром-5-тис-β-D-ксило- пиранозида прибавляют к смеси. После перемешивания в течение 3,5 ч при температуре 40-45оС реакционная среда становится прозрачной. Органическую фазу, полученную после охлаждения, промывают последовательно при помощи 1н. раствора хлороводородной кислоты при температуре 0оС, 1н. раствора гидроксида натрия при температуре 0оС, водой, затем при помощи насыщенного раствора хлорида натрия. После выпаривания растворителей получают 24 г пенообразного вещества желтого цвета, которое кристаллизуется при добавлении эфира. В конце получают 8,6 г целевого продукта (выход 41%). Тпл 159оС. ( α)D23 + 58,2о (с 0,5; СНСl3).
1-с. Получение 4-(фенилсульфонил)-фенил-1,5-дитио-β-D-ксилопиранозида (пример 2).
Прибавляют 0,35 см3 метилата натрия, растворенного в метаноле (с концентрацией 3,5 М), к суспензии, состоящей из 6,5 г 4-(фенилсульфонил)-фенил-2,3,4-три-0-ацетил-1, 5-дитио-β-D-ксилопиранозида в 150 мл метанола. Полученную смесь перемешивают при комнатной температуре в течение 1,5 ч в атмосфере азота, затем прибавляют 250 см3 тетрагидрофурана. Получают прозрачный раствор перед прибавлением смолы АмберлитR IR 120 Н+ до рН 6. Фильтруют и выпаривают растворители при пониженном давлении. После перекристаллизации в смеси метанол/вода 50/50 с последующим растворением в смеси этанол/вода 50/50 и лиофилизацией (вакуумной сушкой) получают 3,3 г целевого продукта (выход 67% ). Тпл область плавления от 85 до 97оС. ( α)D23 + 44,8о (с 0,42; диметилсульфоксид).
Получение II. II-а. Получение 1-бром-2-(метилсульфонил)-бензола.
Раствор, содержащий 5 г (0,0246 моль) 1-бром-2-(метилтио)-бензола в 10 мл метанола, охлаждают до температуры 0оС в атмосфере азота, затем прибавляют 1,27 г 3-хлорпероксибензойной кислоты (МХПБК) с концентрацией 50% Перемешивание при температуре 0оС поддерживают в течение 45 мин, затем добавляют 6 г фторида калия и продолжают гидролиз в течение 12 ч. Полученную среду фильтруют на ЦелитеR, затем полученный продукт после выпаривания растворителей очищают методом флэш-хроматографии при элюировании смесью толуол/этилацетат 95/5. Получают 5,63 г (выход 97%) ожидаемого продукта. Тпл 98оС.
II-b. Получение 2-(метилсульфонил)-бензолтиола.
Проводят реакцию способом, аналогичным получению 1-а, получают ожидаемый продукт. Тпл 57оС.
II-с. Получение 2-(метилсульфонил)-фенил-2,3,4-три-0-ацетил-1,5-дитио-β-D-ксило- пиранозида (пример 3).
Прибавляют 8,43 г (0,0251 моль) 1-бром-2,3,4-три-0-ацетил-5-тио-β-D-ксилопирано- зида к смеси, содержащей 4,3 г (0,0228 моль) 1-меркапто-2-(метилсульфонил)-бензола и 1,95 г оксида цинка в 90 мл толуол/ацетонитрил 1/1 (по объему), и полученную смесь нагревают при температуре 45оС в течение 2 ч. Полученную реакционную среду фильтруют на ЦелитеR, затем органическую фазу промывают посредством 1н. раствора НСl, 1н. раствора гидроксида натрия, затем водой до нейтрального значения рН. После выпаривания растворителей при пониженном давлении получают маслянистую жидкость, которую кристаллизуют при добавлении эфира. Затем 5,33 г полученного кристаллизованного продукта очищают методом флэш-хроматографии при элюировании смесью толуол/этилацетат 8/2. Получают 4,35 г (выход 41%) ожидаемого продукта. Тпл 209оС. (α)D20 + 38,4о (с0,5; СНСl3).
II-d. Получение 2-(метилсульфонил)-фенил-1,5-дитио-β-D-ксилопиранозида (пример 4).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 139оС. (αD20 + 38,8о (с 0,5; СН3ОН).
Получение III. III-а. Получение 4-(метилсульфонил)-фенил-2,3,4-три-0-ацетил-1,5- дитио-β-D-ксилопиранозида (пример 5).
Проводят реакцию способом, аналогичным получению II-с, получают бесцветную маслянистую жидкость, которая кристаллизуется в эфире. Тпл 105 110оС. (α)D20 + 71о (с=0,5; СНСl3).
III-b. Получение 4-(метилсульфонил)-фенил-1,5-дитио-β-D-ксилопиранозида (пример 6). Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт после перекристаллизации в смеси метанол/этанол. Тпл > 250оС. (α)D20 +19,2о (с 0,5); СН2Сl2/СН3ОН 1/1 (по объему).
Получение IV. IV-а. Получение 4-(метилсульфонил)-фенил-2,3,4-три-0-ацетил-5-тио- β-D-ксилопиранозида (пример 7).
Смесь, содержащую 2 г (0,012 моль) 1-гидрокси-4-(метилсульфонил)-бензола, 3,17 г хлорида цинка (ZnCl2) 4,5 г (0,013 моль) 1-бром-2,3,4-три-0-ацетил-5-тио-β-D-ксило- пиранозида и 3,1 г (0,0177 моль) имидазолата серебра (С3Н3АgN2) в 70 мл метиленхлорида, нагревают в течение 20 ч при температуре 50оС. После охлаждения реакционную среду фильтруют, затем полученную органическую фазу промывают последовательно посредством 1н. раствора хлороводородной кислоты, воды и 1н. раствора гидроксида натрия, потом растворитель выпаривают при пониженном давлении. После очистки методом флэш-хроматографии при элюировании смесью толуол/этилацетат 3/1 (по объему) с последующим осаждением в этиловом эфире получают 1,1 г ожидаемого продукта (выход 21,2%). Тпл 168оС. (α)D22 75о (с=0,6; СНСl3).
IV-b. Получение 4-(метилсульфонил)-фенил-5-тио-β-D-ксилопиранозида (пример 8).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт после лиофилизации. Тпл 180оС. (α)D22 77,2о (с 0,5; СН3ОН).
Получение V. V-а. Получение 4-(этилсульфонил)-бензолтиола.
Проводят реакцию способом, аналогичным получению 1-а, получают ожидаемый продукт в виде маслянистой жидкости. nD24 1,5891.
V-b. Получение 4-(этилсульфонил)-фенил-2,3,4-три-0-ацетил-1,5-дитио-β-D-ксило- пиранозида (пример 9).
Проводят реакцию способом, аналогичным получению 1-b получают ожидаемый продукт. Тпл=136 137оС. (α)D23 + 36,7о (с=0,45; СНСl3).
V-c. Получение 4-(этилсульфонил)-фенил-1,5-дитио-β-D-ксилопиранозида (пример 10).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 130 135оС. (α)D23 + 26,8о (с 0,485; метанол).
Получение VI. VI-а. Получение 3-(метилсульфонил)-фенил-2,3,4-три-0-ацетил-1,5- дитио-β-D-ксилопиранозида (пример II).
Проводят реакцию способом, аналогичным получению II-c, получают целевой продукт. Тпл 147 150оС. (α)D21 10,5о (с=0,3; СНСl3).
VI-b. Получение 3-(метилсульфонил)-фенил-1,5-дитио-β-D-ксилопиранозида (пример 12).
Проводят реакцию способом, аналогичным получению 1-с, получают целевой продукт. Тпл 169 172оС. (α)D22 12,2о (с 0,45; диметилсульфоксид).
Получение VII. VII-а. Получение 4-[(4-фторфенил)-сульфонил]-бензолтиола.
К суспензии 1 г (0,00398 моль) 4-[(4-фторфенил)-сульфонил]-бензоламина в растворе хлороводородной кислоты (1,68 мл концентрированной хлороводородной кислоты в 5 мл воды), при температуре -5оС прибавляют раствор нитрата натрия (302 мг в 1 мл воды). После 5-минутного перемешивания этот раствор по каплям добавляют к раствору, содержащему 2,47 г этилксантата калия в 5 мл воды при температуре 70оС. Реакционную смесь разбавляют этилацетатом. Органическую фазу промывают 1н. раствором гидроксида натрия, насыщенным раствором хлорида натрия, потом сушат на сульфате магния. После выпаривания растворителей остаток извлекают посредством 15 мл этанола. Прибавляют 1,47 г гидроксида калия и нагревают при температуре 45оС в течение 10 мин. Затем реакционную смесь приливают к водо-ледяному раствору и частично очищают экстракцией этилацетатом. Водную фазу, охлажденную при помощи льда, подкисляют путем прибавления концентрированной хлороводородной кислоты, затем экстрагируют этилацетатом. Органическую фазу сушат на сульфате магния и растворители выпаривают досуха. Получают таким образом 640 мг (выход 60%) ожидаемого продукта. Тпл. 116 оС.
VII-b. Получение 4-[(4-фторфенил)-сульфонил]-фенил-2,3,4-три-0-ацетил-1,5-дитио- β-D-ксилопиранозида (пример 13).
Проводят реакцию способом, аналогичным получению II-с, получают ожидаемый продукт. Тпл 80оС. (α)D21 + 48,4о (с 0,5; СНСl3).
VII-c. Получение 4-[(4-фторфенил)-сульфонил]-фенил-1,5-дитио-β-D -ксилопиранозида (пример 14).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 136 138оС. (α)D21 + 40о (с0,5; диметилсульфоксид).
Получение VIII. VIII-а. Получение 4-[(4-метоксифенил)-сульфонил]-бензонитрила.
В смесь, состоящую из 120 мл этанола и 12 мл воды, добавляют 6 г (0,0248 моль) 4-[(4-метоксифенил)-тио] -бензонитрила, затем 18,45 г гексагидратированного монопероксифталата магния. Реакционную смесь выдерживают при температуре 40оС в течение 20 мин. После гидролиза в ледяной воде раствор фильтруют и твердое вещество белого цвета промывают водой. Получают таким образом 5,2 г (выход 77%) целевого продукта. Тпл 135оС.
VIII-b. Получение 4-[(4-гидроксифенил)-сульфонил]-бензонитрила.
Смесь, состоящую из 5,12 г (0,0187 моль) 4-[(4-метоксифенил)-сульфонил] -бензонит-рила и 21,6 г хлоргидрата пиридиния, выдерживают при температуре 200оС в течение 2 ч. После охлаждения реакционную среду гидролизуют 1н. раствором хлороводородной кислоты. Образованный осадок фильтруют; промывают 1н. раствором хлороводородной кислоты, затем водой до нейтрального значения рН. Получают таким образом 4,5 г (выход 99%) ожидаемого продукта в виде твердого вещества серого цвета. Тпл 177оС.
VIII-с. Получение диметилтиокарбамата 0-{4-[(4-цианофенил)-сульфонил]-фенила}
К раствору, содержащему 570 мг гидроксида калия в 35 мл воды, прибавляют 2,36 г (0,0097 моль) 4-[(4-гидроксифенил)-сульфонил]-бензонитрила. Раствор выдерживают в течение 15 мин при комнатной температуре. После охлаждения до температуры 0оС прибавляют по капле раствор, содержащий 1,38 г N,N-диметилтиокарбамилхлоида в 35 мл ацетона. Спустя 4 ч реакционную смесь гидролизуют 1н. раствором хлороводородной кислоты. Раствор экстрагируют этилацетатом. Органическую фазу промывают водой до нейтрального значения рН, сушат на сульфате магния и концентрируют досуха. Получают таким образом 3 г (выход 100% ) ожидаемого продукта. Тпл 158 167оС.
VIII-d. Получение диметилтиокарбамата S-{4-[(4-цианофенил)-сульфонил]-фенила}
Выдерживают 3 г (0,0096 моль) диметилтиокарбамата 0-{4-[(4-цианофенил)-сульфонил] -фенила} при температуре 200оС в течение 30 мин. После хроматографирования на силикагеле при элюировании смесью толуол/этилацетат 8/2 (об/об) получают 2,29 г (выход 76%) ожидаемого продукта. Тпл140оС.
VIII-е. Получение 4-[(4-меркаптофенил)-сульфонил]-бензонитрила.
К раствору, содержащему 2,25 г (0,0075 моль) диметилтиокарбамата S-{4-[(4-цианофенил)-сульфонил] -фенила} в 45 мл N,N-диметилформамида при температуре 0оС, прибавляют 4,1 мл метанолята натрия (8% Na (вес/об) в метаноле). Затем реакционную смесь гидролизуют 1н. ледяным раствором хлороводородной кислоты. После фильтрования образованный осадок промывают водой, затем сушат. Получают таким образом 1,54 г (выход 78%) ожидаемого продукта. Тпл 166оС.
VIII-f. Получение 4-[(4-цианофенил)-сульфонил]-фенил-2,3,4-три-0-ацетил-1,5- дитио-β-D-ксилопиранозида (пример 15).
Проводят реакцию способом, аналогичным получению 1-b, получают ожидаемый продукт. Тпл 194 195оС. (α)D20 + 51о (с0,5; СНСl3).
VIII-g. Получение 4-[(4-цианофенил)-сульфонил] -фенил-1,5-дитио-β-D-ксилопира- нозида (пример 16).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 175 183оС. (α)D20 +58,6о (с=0,5; диметилсульфоксид).
Получение IX. IX-а. Получение 4-(N, N-диметилсульфонамидил)-фенил-2,3,4-три-0- ацетил-1,5-дитио-β-D-ксилопиранозида (пример 17).
Проводят реакцию способом, аналогичным получению 1-b, получают ожидаемый продукт. Тпл 120оС. (α)D20= +35,4о (с 0,56; СНСl3).
IX-b. Получение 4-(N,N-диметилсульфонамидил)-фенил-1,5-дитио-β-D-ксилопирано- зида (пример 18).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 208 213оС. (α)D20 + 21,4о (с0,42; диметилсульфоксид).
Получение Х.
Х-а. Получение 4-(N,N-диметилсульфонамидил)-фенил-2,3,4-три-0-ацетил-5-тио-β-D- ксилопиранозида (пример 19).
Проводят реакцию способом, аналогичным получению IV-а, получают ожидаемый продукт. Тпл 85оС, затем 164 167оС (двойная температура плавления). (α)D25 57,6о (с 0,33; СНСl3).
Х-b. Получение 4-(N,N-диметилсульфонамид)-фенил-5-тио-β-D-ксилопиранозида (пример 20).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 205оС. (α)D21 70,4о (с 0,27; метанол).
Получение ХI. ХI-а. Получение 4-маркапто-N-(1-пиперидинил)-бензолсульфонамида.
Проводят реакцию способом, аналогичным получению 1-а, получают ожидаемый продукт. Тпл 93оС.
XI-b. Получение 4-[N-(1-пиперидинил)-суль- фонамидил]-фенил-2,3,4-три-0-ацетил-1,5-дитио-β-D-ксилопиранозида (пример 21).
Проводят реакцию способом, аналогичным получению 1-b, получают ожидаемый продукт. Тпл 175 180оС. (α)D22 + 39,8о (с 0,425; СНСl3).
ХI-с. Получение 4-[N-(1-пиперидинил)-сульфонамидил] -фенил-1,5-дитио-β-D-ксило- пиранозида (пример 22).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 145 149оС. (α)D22 + 23,8о (с 0,21; метанол).
Получение ХII. ХII-а. Получение 4-меркапто-N-(1-морфолинил)-бензолсульфон- амида.
Проводят реакцию способом, аналогичным получению 1-а, получают ожидаемый продукт. Тпл 128оС.
ХII-b. Получение 4-[N-(1-морфолинил)-сульфонамидил]-фенил-2,3,4-три-0-ацетил-1,5-дитио-β-D-кс илопиранозида (пример 23).
Проводят реакцию способом, аналогичным получению 1-b, получают ожидаемый продукт. Тпл 120 123оС. (α)D22 + 39о (с 0,39; СНСl3).
ХII-с. Получение 4-[N-(1-морфолинил)-сульфонамидил] -фенил-1,5-дитио-β-D-ксило- пиранозида (пример 24).
Проводят реакцию способом, аналогичным получению 1-с, получают ожидаемый продукт. Тпл 90 105оС. (α)D22 + 20,4о (с 0,56; диметилсульфоксид).
Получение ХIII. Получение 3-(метилсульфонил)фенил-2,3,4-три-0-ацетил-1,5-дитио-β-D-ксилопиранозида (пример 11).
В атмосфере азота охлаждают до 0оС смесь 100 мг (0,532 ˙ 10-3 моль) 1-меркап- то-3-(фенилсульфонил)бензола в 4 мл 1,2-дихлорэтана и 1 мл ацетонитрила в присутствии молекулярного сита. Добавляют 254 мг (0,76 ˙ 10-3 моль) 1,2,3,4-тетра-0-ацетил-5-тио-β-D-ксилопиранозида и охлаждают до -25оС. Затем прибавляют 96,5 мл сульфоната триметилсилилтрифторметана и взбалтывают реакционную смесь в течение 1 ч, после этого оставляют до возвращения к комнатной температуре. После нейтрализации с помощью диизопропилэтиламина выпаривают растворители и получают 160 мг (выход 32,5%) целевого продукта. Тпл 147 150оС. [α]D21 10,5о (с 0,3; СНСl3).
Получение ХIV. Получение 4-[(4-цианофенил)сульфонил]фенил-2,3,4-три-0-ацетил-5-тио-β-D-ксилопиранозид а (пример 25).
В атмосфере азота охлаждают до -25оС смесь 100 мг (0,386 ˙ 10-3 моль) 4-[(4-цианофенил)сульфонил] фенола в 5 мл 1,2-дихлорэтана в присутствии молекулярного сита. Добавляют затем 230 мг 0,463 ˙ 10-3 моль) трихлорацетимидата 2,3,4-три-0-ацетил-5-тио-α-D-ксилопиранозила и 0,39 мл (0,039x x10-3 моль) эфирной вытяжки трифторида бора 0,1 М. После взбалтывания в течение 1,5 ч оставляют реакционную смесь до возвращения смеси к комнатной температуре. Выпаривание растворителей продолжают до получения маслянистой жидкости, которая кристаллизуется при добавлении простого эфира. Получают таким образом 130 мг (выход 63%) целевого продукта. Тпл148оС. [α]D21 29,3о (с 0,375; СНСl3).
Данные по активности соединений в соответствии с изобретением приведены в таблице.
Противотромбозная активность продуктов в соответствии с изобретением выявлялась согласно следующему протоколу исследования венозного тромбоза;
Создают венозный застой (крови) в результате гиперкоагуляции в соответствии с методикой, описанной Wessler et al, (J.Applied Physiol. 1959, р. 943-946). Используемый гиперкоагулирующий агент, как и в методике, описанной J. Haupman et al. (Тhrombosis and Haemostasis 43, (2), 1980, р.118), представляет собой раствор с активированным фактором Х (Ха), который поставляется фирмой Flow Laboratories (71 Knat на 12,5 мл физиологического раствора).
Исследование проводили на крысах-самцах Wistar (не натощак) весом от 250 до 280 г, разделенных на группы по 10 животных в каждой. Исследуемые продукты вводили через рот в виде суспензии в ПЭГ 400. Тромбоз вызывался спустя 4 ч после этой обработки, а образованный тромб извлекался и взвешивался.
Полученные результаты при дозе 3 мг/кг (через рот) приведены в таблице. В таблице также приводятся результаты, полученные с продуктами по известному уровню техники.
Использование: в медицине, т.к. продукт обладает фармакологической активностью. Сущность: способ получения новых сульфонил- b -D-тиоксилозида ф-лы I, где X - атом серы или кислорода; Y - H, CO- CH3, R- C1-C4 -алкил, замещенную аминогруппу NR1R2, где R1и R2 - идентичные или различные и каждый представляет собой алкил C1-C4 или R1 и R2 вместе с атомом азота, с которым они связаны, могут образовывать пиперидинильную или морфинильную группу или возможно замещенную в пара-положении CN, галогеном фенильную группу. Реагент 1: соединение ф-лы II, где X, R - указаны выше. Реагент 2: тиоксилозид ф-лы III или IV или V, где Y-CH3CO, Hal-хлор, бром. Условия реакции: реагент 1 обрабатывают реагентом 2 при соотношении 1 моль реагента 1 на 0,6 - 1,2 моль реагента 2 в присутствии кислотного акцептора и/или кислоты Льюиса в инертном растворителе, полученный продукт выделяют или при Y-COOH подвергают деацетилированию при 0°С до температуры кипения реакционной массы в спирте C1-C4 в присутствии алкоголята. Структура соединений ф-л I - V: 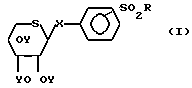
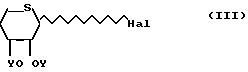
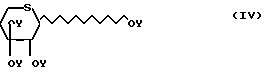
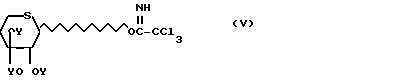 . 1 з.п. ф-лы, 1 табл.
. 1 з.п. ф-лы, 1 табл.
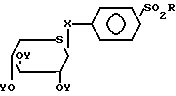
где X атом серы или кислорода;
Y H,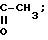
R C1 C4-алкил, замещенная аминогруппа NR1R2, где R1 и R2 идентичные или различные, каждый представляет собой C1 C4-алкил или R1 и R2 вместе с атомом азота, с которым они связаны, могут образовывать пиперидинильную или морфинильную группу или возможно замещенную в п-положении CN, галогеном фенильную группу,
отличающийся тем, что соединение общей формулы II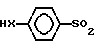
где X, R имеют указанные значения,
подвергают взаимодействию с производным тиоксилозида структурной формулы III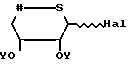
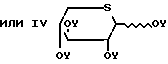 или формулы V
или формулы V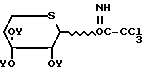
где Y CH3CO;
Hal хлор, бром,
в инертном растворителе при соотношении 1 моля соединения формулы II на 0,6 1,2 моля соединения формулы III, или IV, или V, в присутствии кислотного акцептора и/или кислоты Льюиса, полученный продукт выделяют или при Y - СОСН3 подвергают деацетилированию при температуре в интервале от oС до температуры кипения реакционной массы в низшем спирте C1 - C4 в присутствии алкоголята, предпочтительно метилата натрия, с получением соединения формулы I, где Y водород.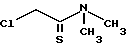
с соединением формулы VII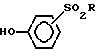
с получением соединения формулы VIII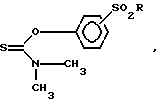
где R имеет указанные значения,
которое при нагревании подвергают перегруппировке до получения соединения формулы IX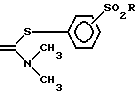
где R имеет указанное значение,
с обработкой последнего алкоголятом металла, предпочтительно метилатом натрия или магния в низшем спирта C1 C4, диметилформалиде или диоксане до получения соединений формулы II, где X S.
| Машина для забивки костылей | 1936 |
|
SU51023A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
Авторы
Даты
1995-04-30—Публикация
1991-04-01—Подача