Область техники, к которой относится изобретение
Настоящее изобретение относится к реконструированию хрящевой ткани.
Предпосылки создания изобретения
Повреждения сустава часто приводят к повреждению хряща, расположенного между суставами. Например, повреждения спинной области часто включают повреждение одного или нескольких позвоночных дисков.
Аналогично этому повреждения коленного сустава часто приводят к повреждению мениска.
В патенте США 6042610 описано устройство для имплантации в сегментарный дефект мениска с целью его регенерации, а именно коллагеновый матрикс, содержащий коллаген типа I и типа II в соотношении 1:1.
Таким образом, в данной области существует необходимость в разработке материалов и методов, усиливающих регенерацию поврежденного хряща.
Краткое описание сущности изобретения
Согласно настоящему изобретению способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хрящевой ткани, содержит коллагеновый материал, состоящий из смеси коллагена I и коллагена II в соотношении от примерно 1:19 до примерно 19:1. Матрикс можно применять в качестве поддерживающего имплантата для регенерации хряща мениска или для регенерации позвоночного диска.
Краткое описание чертежей
На фиг.1 представлено в определенной степени схематичное изображение вертикальной проекции поддерживающего имплантата для мениска по изобретению.
На фиг.2 представлено в определенной степени схематичное изображение вертикальной проекции поддерживающего имплантата для позвоночного диска по изобретению.
Подробное описание изобретения
Коллаген в организме животных встречается в различных формах и в различных тканях соответствующие типы коллагена присутствуют в различных соотношениях. Так, в то время как в костном коллагене главным образом присутствует коллаген типов I и III, в состав хряща главным образом входит коллаген типа II в сочетании с небольшими количествами коллагена типов VI, IX, X, XI и XIII. Такой материал в значительной степени отличается от применяемого в медицине и косметике коллагенового губчатого материала, который, как правило, получают из кожи и сухожилий и который состоит главным образом из коллагена I и/или коллагена III.
Таким образом, одним из объектов настоящего изобретения является предназначенный для реконструирования хрящевой ткани способный к рассасыванию внеклеточный матрикс, содержащий смесь коллагена I и коллагена II в соотношении от примерно 1:19 до примерно 19:1. В предпочтительном варианте осуществления изобретения коллаген I и коллаген II находятся в соотношении от примерно 1:9 до примерно 9:1. Например, соотношения коллагена I и коллагена II могут составлять примерно 1:9, 25:75, 50:50 и 75:25. Наиболее предпочтительно соотношение коллагена I и коллагена II составляет примерно 1:9.
В предпочтительных вариантах осуществления коллаген в матриксе сшивают с помощью химического агента, ультрафиолетового (УФ) излучения или подвергают гидротермическому сшиванию. Например, химическое сшивание можно осуществлять с помощью хондроитин-4-сульфата и/или хондроитин-6-сульфата, используя их индивидуально или в сочетании с гиалуроновой кислотой. Можно применять различные альдегиды, такие как гиалуроновый полиальдегид, формальдегид или глиоксаль. Приемлемые агенты, вызывающие образование поперечных связей, включают гиалуроновый полиальдегид, гексаэтилендиизоцианат, диэтил-3-(3-диметиламинопропил)карбодимид (ЭДК) и N-гидроксисукцинимид (NГС), смеси ЭДК и NГС и/или приемлемые смеси любых перечисленных выше веществ.
Не ограничивающие объем изобретения способы его практического воплощения проиллюстрированы на чертежах. На фиг.1 показан поддерживающий имплантат 10 для мениска, вживленный в поврежденную область мениска 12 и фиксированный в соответствующем положении с помощью швов 14 над расположенной под ним костной тканью 16. На фиг.2 показан поддерживающий имплантат 18 для позвоночного диска, вживленный в поврежденную область позвоночного диска 20 и фиксированный с помощью швов 22 или в альтернативном варианте приклеенный с помощью адгезива, такого как фибриновый клей.
Коллагеновый матрикс по изобретению может содержать небольшие количества коллагена III, VI, IX, X, XI и XIII. Матрикс по изобретению может также содержать напоминающий гидрогель материал, например материал, включающий глюкозаминогликаны, такие как хондроитинсульфат, кератансульфат, дерматансульфат и гиалуроновую кислоту, который представляет собой естественную среду, в которую хондроциты могут проникать и расти. Матрикс по изобретению предпочтительно содержит от 0,1 до 40 мас.% гликозаминогликана, например 1-15 мас.%, например примерно 2-3 мас.%, наиболее предпочтительно примерно 2,5 мас.%.
Матрикс по изобретению может либо содержать встречающийся в естественных условиях хрящевой материал, подвергнутый обезжириванию и другой обработке, в результате которой остается коллагеновый материл в сочетании с гликозаминогликанами, или в альтернативном варианте матрикс может представлять собой волокна очищенного коллагена I и коллагена II, смешанные по отдельности или в сочетании друг с другом с гликозаминогликанами и/или другими вспомогательными веществами. Такие дополнительные вспомогательные вещества могут представлять собой, например, хондронектин или анхорин II, которые способствуют соединению хондроцитов с коллагеновыми волокнами, а также факторы роста, такие как индуцирующий рост хряща фактор (CIF), инсулинподобный фактор роста (IGF) и трансформирующий фактор роста β (TGFβ).
Матрикс обладает способностью действовать в качестве среды для роста нативных хондроцитов, осуществляя тем самым регенерацию хрящевой ткани. Однако с целью дополнительного улучшения регенерации хрящевой ткани в матрикс можно импрегнировать хондроциты либо до, либо после имплантации in vivo. Хотя хондроциты можно импрегнировать в матрикс непосредственно перед имплантацией, например, путем инъекции, как правило, хондроциты интродуцируют в матрикс путем непосредственной инъекции суспензии хондроцитов после имплантации. При этом присутствующие в матриксе хондроциты могут влиять на регенерацию хряща и, вероятно, новой костной ткани.
Предназначенные для применения по изобретению хондроциты можно получать при использовании в качестве источников таких клеток, как аллогенные или аутогенные клетки, выделенные из суставного хряща, надкостницы и надхрящицы, и мезенхимные (стромальные) стволовые клетки костного мозга. Поскольку аллогенные клетки потенциально могут вызывать иммунный ответ и связанные с воспалением осложнения, то предпочтительно выделять хондроциты из аутогенных клеток, прежде всего из аутогенного суставного хряща. Методики сбора клеток являются известными и включают ферментативное расщепление выращенной культуры. Собранные клетки затем размножают в клеточной культуре до повторного введения в организм. В целом, для обеспечения оптимальной регенерации хрящевой ткани требуется импрегнировать в матрикс по меньшей мере 106, предпочтительно по меньшей мере 107 клеток.
Как правило, требуется, чтобы матрикс по изобретению содержал гликозаминогликаны (ГАГ), такие как гиалуроновая кислота, хондроитин-6-сульфат, кератинсульфат, дерматансульфат и т.д., создающие естественную среду, в которую хондроциты могут проникать и расти. Хотя в коллагеновый матрикс можно включать гликозаминогликаны из различных источников, которые необязательно имеют одинаковый состав, молекулярную массу и физиологические свойства такие же, как у гликозаминогликанов хряща, предпочтительными являются гликозаминогликаны, экстрагированные из хрящевой ткани.
ГАГ присутствуют, по меньшей мере частично, в качестве компонента протеогликанов (ПГ) в нативных содержащих коллаген тканях. Применение ГАГ в форме ПГ является нежелательным из-за потенциальных иммунологических проблем, связанных с протеиновым компонентом ПГ. Таким образом, предпочтительно, чтобы матрикс практически не содержал никаких протеогликанов. Как правило, для этой цели матрикс получают из смеси очищенного не содержащего телопептид коллагенового материала и гликозаминогликанов.
Другие вспомогательные вещества, которые также могут присутствовать в матриксе, включают, например, хондронектин, ламинин, фибронектин, альгинат кальция или анхорин II, облегчающие соединение хондроцитов с коллагеновыми волокнами, гормоны, усиливающие рост клеток костной и хрящевой ткани, а также факторы роста, такие как индуцирующий рост хряща фактор (CIF), инсулинподобный фактор роста (IGF) и трансформирующий фактор роста β (TGFβ), которые присутствуют в виде гомодимеров или гетеродимеров, остеогенный протеин-1 (ОП-1) и костные морфогенетические протеины (BMP), например нативный или рекомбинантный человеческий BMP-2, BMP-3 (остеогенин), BMP-4, BMP-7, BMP-8, bFGF (фактор роста фибробластов), CDMP или другие молекулы скелетного матрикса, а также сигнальные пептиды, такие как трансформирующий фактор-β роста (TGF-β, TGF-β1), сосудистый эндотелиальный фактор роста (EGF/VEGF), инсулинподобный фактор роста (IGF/IGF-1), протеин, родственный паратиреоидному гормону (PTHrP), и тромбоцитарный фактор роста (PDGF). В материал коллагенового матрикса по изобретению можно также включать нуклеотидные последовательности, кодирующие вышеперечисленные субстанции или обладающие способностью индуцировать или усиливать их производство in vivo.
Применяемый согласно изобретению продукт может также выполнять функцию носителя стволовых клеток, обеспечивающих конкретную линию дифференцировки, например в клетки суставного хряща или кости. Такие стволовые клетки для увеличения их количества можно выращивать in vitro и вносить в места репарации в матрицах-носителях с добавлением факторов роста или без них. Примеры включают мезенхимные стволовые клетки и клетки стромы костного мозга. В материал коллагенового матрикса по изобретению можно также включать нуклеотидные последовательности, кодирующие вышеперечисленные субстанции или обладающие способностью индуцировать или усиливать их производство in vivo.
BMP-2 оказывает независимое воздействие на два пути формирования костной ткани - непосредственно на формирование костной ткани, а также на образование хряща, который затем удаляется и заменяется костной тканью. Для проявления ВМР-активности или для ВМР/НКП-индукции хондрогенеза композиты BMP и коллагена, содержащие костный матрикс, который получают экстракцией из кортикальной костной ткани, происходящей из различных источников, или деминерализованный костный матрикс, должны содержать примерно 90% коллагена и примерно 10% неколлагеновых протеинов (НКП). Комплекс костный матрикс - нерастворимый коллагеновый матрикс и ламинин или фибронектин являются носителями для BMP. Как правило, матрикс может содержать от примерно 100 мкг до примерно 5 мг факторов роста. В материал коллагенового матрикса по изобретению можно также включать нуклеотидные последовательности, кодирующие вышеперечисленные субстанции или обладающие способностью индуцировать или усиливать их производство in vivo.
В материал матрикса для применения по изобретению можно также включать паратиреоидный гормон (РТН), т.е. полипептид, участвующий в регуляции кальция в организме. В материал коллагенового матрикса по изобретению можно включать также нуклеотидные последовательности, кодирующие указанную субстанцию или обладающие способностью индуцировать или усиливать ее производство in vivo.
Как указано выше, под объем настоящего изобретения подпадает также коллагеновый матрикс, дополненный геном или нуклеиновой кислотой, при этом в него включают генетический материал или ДНК, усиливающие клеточный рост. Материал коллагенового матрикса может обеспечивать пролонгированное высвобождение усиливающего клеточный рост генетического материала. При высвобождении из матрикса в организм генетический материал может трансформировать клетки организма, усиливая клеточный рост и заживление.
Настоящее изобретение относится также к материалу коллагенового матрикса, дополненному усиливающей клеточный рост нуклеотидной последовательностью, предпочтительно выделенной или очищенной нуклеотидной последовательностью. Последовательность может представлять собой последовательность ДНК или последовательность РНК. Согласно наиболее предпочтительным вариантам осуществления материал коллагенового матрикса дополняют выделенной последовательностью гена, наиболее предпочтительно ДНК.
Применяемая согласно изобретению нуклеотидная последовательность может усиливать рост хрящевых клеток, рост костных клеток или рост обоих типов клеток.
Очищенные пригодные для терапевтического применения нуклеотидные последовательности по изобретению можно получать из любого приемлемого источника и их можно вносить в материал коллагенового матрикса так, чтобы они усиливали клеточный рост. Согласно одному из вариантов осуществления используют ретровирусный вектор или любую иную конструкцию, пригодную для переноса гена и встраивания гена. Например, для стабильной интродукции кДНК человеческого костного морфогенетического протеина 7 (BMP-7) в мезенхимные стволовые клетки можно применять ретровирусный вектор.
Генная терапия по изобретению включает введение пригодных для терапевтического применения генов или другого генетического материала в клетки или ткани.
Как будет обсуждаться ниже, поддерживающий имплантат из матрикса по изобретению можно получать следующим образом: приготавливают отдельные водные суспензии коллагена I и коллагена II, смешивают суспензии, необязательно частично дегидратируют смешанную суспензию коллагена I/II, заливают смешанную суспензию коллагена I/II в требуемую форму, сушат смешанную суспензию коллагена I/II, осуществляют частичное сшивание волокон коллагена I и коллагена II с помощью химического агента, ультрафиолетового (УФ) излучения или гидротермического сшивания и стерилизуют содержащий коллаген I/II материал для имплантата.
В альтернативном варианте сшивание, например сшивание с помощью химического агента, можно осуществлять после приготовления индивидуальных суспензий коллагена I и коллагена II или после получения смешанной суспензии коллагена I/II и до формования.
Согласно предпочтительным вариантам осуществления сформованный материал сушат с помощью сушки вымораживанием так, чтобы получить размер пор в диапазоне примерно 0,1-500 мкм. Предпочтительный размер пор для поддерживающего имплантата по изобретению составляет примерно 50-400 мкм, наиболее предпочтительно примерно 70-120 мкм.
Плотность матрикса после сушки вымораживанием предпочтительно составляет примерно 0,1-0,3 г/м3, предпочтительно примерно 0,18-0,22 г/м3, наиболее предпочтительно примерно 0,2 г/м3.
Для стабилизации матрикса коллагеновый материал можно сшивать до или после стадии сушки вымораживанием. Этот процесс способствует также механической стабильности матрикса и снижению скорости его рассасывания в организме. В идеальном варианте степень сшивания должна быть такой, чтобы скорость деградации матрикса соответствовала скорости регенерации ткани. Физически сшивание можно осуществлять нагреванием, но при этом следует соблюдать осторожность для того, чтобы избежать нежелательной потери способности к рассасыванию. Предпочтительным является нагревание до температуры 100-120°С в течение периода времени от примерно 30 мин до примерно 5 ч. Более предпочтительно сшивание можно осуществлять с помощью ультрафиолетового излучения с использованием УФ-лампы, например, в течение периода времени до 8 ч.
Как отмечалось выше, целесообразно, чтобы коллагеновый материал содержал гликозаминогликаны (ГАГ). Последние фактически подвергают взаимодействию с коллагеном для того, чтобы достигать определенной степени сшивания и получать нерастворимый продукт. При необходимости дополнительное сшивание материала можно осуществлять путем нагревания материала, с помощью УФ-излучения или с использованием дополнительных химических агентов, вызывающих образование поперечных связей, как описано выше. Взаимодействие между гликозаминогликанами и коллагеном можно осуществлять при температуре окружающей среды при значение рН 2,5-3,5. Материл можно подвергать замораживанию и сушке вымораживанием сразу после такой обработки.
Например, ГАГ, такие как хондроитинсульфат (ХС) можно ковалентно связывать с коллагеновым матриксом с помощью диэтил-3-(3-диметиламинопропил)карбодимида (ЭДК) и N-гидроксисукцинимида (NГС) с использованием известных методов. Опосредуемое ЭДК/NFC сшивание можно использовать для иммобилизации ГАГ с коллагеновыми матрицами, которые могут включать дерматансульфат, гепарин, гепарансульфат и гиалуроновую кислоту, а также ХС, как указано выше.
Получение суспензии коллагена II можно осуществлять путем повышения значения рН коллагеновой массы. При осуществлении этого процесса массу охлаждают примерно до 4°С и значение рН медленно повышают до примерно 6,5-7,5 путем добавления холодного водного раствора NaOH. Затем массу выдерживают при температуре окружающей среды в течение примерно 15-25 ч.
Еще одним альтернативным вариантом является нейтрализация значения рН массы коллагена II до 6,8-7,4 с последующим удалением воздуха.
Коллаген I предпочтительно получают из организма свиней. Очищенный коллаген I можно получать согласно методу, описанному в патенте США 5837278, который включен в настоящее описание в качестве ссылки. Коллаген I можно растирать с использованием дистиллированной воды в смесителе с получением суспензии, после чего воду можно удалять, получая суспензию коллагена I.
Суспензию коллагена I затем можно смешивать с суспензией коллагена II согласно описанному выше методу и заполнять смесью форму.
После формования смеси суспензий продукт замораживают. Для получения воспроизводимого размера пор процесс замораживания необходимо тщательно контролировать, так, фактически необходимо контролировать скорость и время замораживания, значение рН и размер частиц.
Затем матрикс подвергают сушке вымораживанием и последующему нагреву до температуры примерно 110-130°С. При этом достигается определенная степень сшивания. Затем толщина высушенного вымораживанием матрикса может быть доведена до определенной величины. После этого матрикс стерилизуют, например, гамма-излучением или с помощью этиленоксида.
Стерилизация с помощью жесткого излучения, например при использовании 60Со в дозах 25 кГр, позволяет дезактивировать BMP. После такой обработки можно осуществлять импрегнирование BMP в стерильный матрикс в стерильном физиологическом растворе перед проведением имплантации.
Толщина поддерживающего имплантата по изобретению может составлять примерно 0,2-2 см, предпочтительно примерно 0,3-1,5 см, более предпочтительно примерно 0,4-1,0 см и наиболее предпочтительно примерно 0,5-0,8 см.
Многие из известных гликозаминогликанов и протеогликанов обладают различными и иногда нежелательными свойствами. Так, хотя в коллагеновый матрикс можно включать гликозаминогликаны из различных источников, которые не имеют такой же состав, молекулярную массу и физиологические свойства, как у гликозаминогликанов хряща, наиболее предпочтительным является применение гликозаминогликанов, экстрагированных из самого хряща.
Как отмечалось выше, желательно, чтобы коллагеновый матрикс был в определенной степени сшит для ограничения уровня набухания матрикса при контакте с водными жидкостями и при этом сохранилась способность матрикса к рассасыванию. Такое набухание приводит к потере прочности и формы. Для получения коллагенового матрикса по изобретению целесообразно подвергать хрящевую ткань обезжириванию с последующей обработкой основанием для удаления протеогликанов и гликозаминогликанов.
Как правило, хрящевой материал получают из хорошо доступных источников - животных, таких как крупный рогатый скот, овцы или свиньи. Предпочтительным источником коллагена II является гиалиновый хрящ свиней. Он содержит требуемый тип коллагена и гликозаминогликана в нужном соотношении и доступен в требуемых больших количествах.
Хрящ предпочтительно замораживают после забоя скота и измельчают, например, до получения частиц с диаметром примерно 8 мм. Перед измельчением хрящ предпочтительно вымачивают в воде и механически отделяют от мяса, костной ткани и других нежелательных материалов.
Частицы хряща затем предпочтительно обезвоживают, обрабатывая смешивающимся с водой органическим растворителем, таким как ацетон, что способствует также удалению некоторой части жира. Обезвоживание приводит к сокращению коллагеновых волокон и отделению их друг друга, что способствует оптимизации последующей стадии обезжиривания. Затем материал обезжиривают с помощью растворителя жиров, такого как углеводород, например гексан, или галогенированный углеводород.
После обезжиривания материал тщательно промывают до тех пор, пока он не поглотит столько же воды, сколько присутствовало изначально. С помощью этого процесса материал оказывается оптимальным образом подготовленным к последующей обработке основанием.
Обработку основанием можно осуществлять с использованием сильной щелочи, например гидроксида щелочного металла, например гидроксида натрия, например, в концентрации 1-8 мас.%. Продолжительность обработки, которая может варьироваться в зависимости от применяемого сырого материала и концентрации щелочи, как правило, составляет 10-48 ч. Обработку, как правило, проводят при температуре ниже 20°С. Значение рН, как правило, составляет 12-14. Указанные выше условия являются оптимальными для обработки NaOH. Для обработки другими основаниями могут требоваться несколько измененные условия.
Обработка основанием приводит к следующим результатам:
Омыляются небольшие остаточные количества жиров. Денатурируются, разрушаются, растворяются и элиминиуются не относящиеся к коллагенам растворимые в щелочи протеины.
Омыляются амидные группы в коллагене, что приводит к изменению электрического заряда и изоэлектрической точки коллагена.
Инактивируются бактерии, прионы и вирусы, в результате чего коллаген стерилизуется.
Было установлено, что при такой обработке протеогликаны подвергаются следующему полезному изменению:
расщепляется ковалентная связь гликозаминогликанов с ядром протеина в протеогликанах. В результате этого процесса гликозаминогликаны можно освобождать от протеина протеогликанов. Этот процесс называют β-элиминированием.
В результате обработки основанием ядро протеина расщепляется на небольшие пептиды, которые можно удалять из реакционной смеси с помощью диализа или ультрафильтрации.
Из-за наличия значительного отрицательного заряда гликозаминогликаны образуют водорастворимые соли, которые можно частично отмыть от коллагена. Однако при обработке основанием они не отщепляются или лишь частично отщепляются и их можно отделять от пептидов диализом. Часть гликозаминогликанов (примерно 3% в пересчете на массу коллагена) связывается с коллагеном.
Очищенные гликозаминогликаны можно получать с помощью диализа или ультрафильтрации экстракта, образовавшегося после стадии обработки основанием.
Согласно способу по изобретению из-за широкого разнообразия различных присутствующих субстанций обычно не применяют ферментативную обработку. Однако дополнительные стадии включают обработку материала органической или неорганической кислотой, такой как соляная кислота. Это приводит к следующему результату: удаляются нежелательные чувствительные к кислотам материалы; разрыхляется нитевидная структура.
После этого материал промывают, как правило, до тех пор, пока значение рН материала не достигнет 2,5-4,0. Значение рН материала предпочтительно точно контролируют. Значение рН материала должно быть одинаковым на всем поперечном срезе хряща.
После обработки кислотой хрящ находится в набухшем водой состоянии. Затем материал подвергают механическому измельчению, например, с использованием коллоидной мельницы. После этого концентрация коллагена в водной среде составляет примерно 2,5-3,5 мас.%. Значение рН этой смеси является слегка кислым, например составляет 3,5-4,5.
В этот момент времени к массе очищенного коллагена можно добавлять один или несколько гликозаминогликанов, например, в количестве 0,1-40%, предпочтительно 1-15% в пересчете на массу коллагена.
Добавляемые к коллагену гликозаминогликаны предпочтительно экстрагируют из натуральной хрящевой ткани, как указано выше. После этого матрикс может содержать помимо коллагена II гликозаминогликаны, гиалуроновую кислоту, хондроитинсульфат и кератансульфат. Хондроитинсульфат и кератансульфат ковалентно связаны с ядром протеина, в то время как гиалуроновая кислота, наоборот, связана с протеогликаном, но связь не является ковалентной.
Под действием основания связь ядра протеина расщепляется и гликозаминогликан высвобождается из протеина. Кроме того, ядро протеина расщепляется с образованием небольших пептидов, которые легко удалять диализом или ультрафильтрацией. Удаление ядра протеина является важным, поскольку ядро может быть иммунологически активным. Таким образом, удаление ядра протеина является важной частью способа по изобретению.
Выделение гликозаминогликанов из полученного после обработки основанием экстракта осуществляют следующим образом:
среду нейтрализуют до значения рН 6-8;
не содержащие коллаген протеины осторожно удаляют обработкой адсорбентом, таким как каолин;
осуществляют ультрафильтрацию жидкости с помощью мембраны, которая пропускает молекулы с молекулярной массой меньше 10000 Да;
осуществляют концентрирование жидкости до получения концентрации твердых частиц примерно 2-5 мас.%;
после смешения гликозаминогликана с коллагеном II материал гомогенизируют еще раз в коллоидной мельнице и концентрацию твердых частиц доводят до 1,5-2,5 мас.%.
Предпочтительным источником коллагена I является свиная кожа, сухожилия или брюшина.
Массу, полученную после смешения эмульсий коллагена I и коллагена II, можно замораживать.
Для достижения воспроизводимого размера пор процесс замораживания необходимо точно регулировать, строго регулируя время замораживания, значение рН и размер частиц. Замороженный продукт затем подвергают сушке вымораживанием. После сушки вымораживанием губчатый материал нагревают до 120-140°С в течение по меньшей мере 2 ч. Таким путем материал стабилизируют посредством слабого сшивания. После сушки вымораживанием из материала получают срезы требуемой толщины, формуют с получением требуемой формы, стерилизуют и упаковывают.
В матрикс по изобретению можно добавлять действующие вещества. Для этого можно использовать любое водорастворимое или диспергируемое в воде действующее вещество. Предпочтительно в матрикс можно включать лекарственные субстанции, такие как антибактериальные агенты, например тауролидин, таурултам, или антибиотики, такие как тетрациклины и гентамицины.
Изобретение относится также к применению матрикса по изобретению для целенаправленной регенерации и реконструкции хрящевой ткани, а также для приготовления лекарственных препаратов, предназначенных для указанных целей.
Один из вариантов способа по изобретению предусматривает удаление у пациента пораженной хрящевой ткани из области, прилегающей или расположенной между костным материалом, вживление поддерживающего имплантата, содержащего описанный выше материал матрикса, состоящего из коллагена I и коллагена II, размер которого соответствует площади пораженного хряща, и фиксацию имплантированного матрикса в область пораженного хряща с помощью любых пригодных средств, таких как адгезив, или прикрепление поддерживающего имплантата к прилегающему хрящу с помощью швов.
Приведенные ниже примеры даны только с целью иллюстрации.
Пример 1
Замороженные хрящи, полученные из только что забитых свиней, замачивали в холодной воде, тщательно промывали и механическим очищали от остатков мяса, костей и твердых кусков. Затем материал промывали в течение 30 мин проточной водой.
После этого материал трижды измельчали в гомогенизаторе. Оптимальный размер полученных в результате частиц составлял менее примерно 8 мм.
Куски хряща обезвоживали, четырехкратно, каждый раз по 8 ч, промывая ацетоном. Затем хрящ обезжиривали путем четырехкратной экстракции н-гексаном. Продолжительность каждой обработки составляла по меньшей мере 8 ч. Соотношение гексана и хрящевой ткани составляло примерно 1:10.
После обезжиривания хрящевую ткань помещали в питьевую воду для набухания. Соотношение воды и материала составляло примерно 1:10. Обработку осуществляли в течение 24 ч.
Затем материал обрабатывали NaOH (5 мас.%), при этом соотношение хрящевой ткани и жидкости составляло 1:4 и время обработки составляло 32 ч. В процессе обработки куски хряща интенсивно перемешивали. Затем щелочь отмывали от хрящевой ткани. При этом исходное значение рН, равное 14, снижалось до 9-11. Растворенные примеси отмывали и отделяли от хрящевой ткани. Полученную после обработки щелочью жидкость собирали для выделения гликозаминогликана.
Затем коллагеновый материал обрабатывали концентрированной HCl (примерно 3 мас.%) первоначально при рН ниже 1,0. Время обработки - 4-6 ч.
Затем материал промывали холодной водой до тех пор, пока значение рН не повышалось до 3-3,5.
Все примеси удаляли, после чего продукт представлял собой обессоленную коллагеновую массу, пригодную для получения губчатого или другого коллагенового материала. Для этой цели в зависимости от поставленной задачи хрящевую массу можно дегазировать, замораживать и подвергать сушке вымораживанием.
Пример 2
Экстракт, полученный после описанной в примере 1 щелочной обработки, содержал гликозаминогликан, щелочь, денатурированные протеины и соли. Сначала экстракт частично нейтрализовали с помощью HCl, значение рН после нейтрализации составляло 6. Затем экстракт обрабатывали с помощью абсорбционного материала, такого как кизельгур, который обладает способностью удалять денатурированные протеины. В экстракт вносили 0,5 мас.% кизельгура и удаляли фильтрацией вместе с денатурированным протеином.
После этого супернатант подвергали ультрафильтрации с помощью мембраны, задерживающей частицы с молекулярной массой, превышающей примерно 10000 Да. Таким образом удаляли соли, получая очищенный гликозаминогликан.
Приготовленный таким образом раствор гликозаминогликана смешивали с описанным выше коллагеновым материалом, получая содержащий коллаген II матрикс, дополненный гликозаминогликаном.
Пример 3
1. Определение гексозамина и аминокислотных остатков в коллагеновом губчатом материале и шкуре
Каждый образец определенного веса (примерно 10 мг) гидролизовали в 10 мл 3 М или 6 М HCl при 105°С в течение 15 или 20 ч в атмосфере очищенного азота в запечатанной пробирке. После охлаждения пробирки в холодильнике ее открывали и содержимое переносили в колбу объемом 25 мл с длинным горлом и сушили при 40°С в вакуумной роторной сушилке (типа Rotavapor RE 120, фирма Buchi, Швейцария), снабженной водоструйным насосом. После растворения остатка в 5 мл воды его вновь сушили с помощью вакуума, создаваемого водоструйным насосом. Затем остаток растворяли в 5 мл буфера для загрузки (0,2 М в пересчете на Na+) при рН 2,2. Для определения уровней гликозамина и галактозамина 150 мкл образца, полученного после предварительного разбавления аликвот буфером для загрузки (1:10), гидролизовали в 3 М HCl и вносили с помощью инжектора в картуш аминокислотного анализатора (AlphaPlus, тип 4151, фирма Pharmacia-LKB, Фрейбург) и оценивали путем сравнения со стандартом с использованием компьютера (фирма Shimadzu, Дюссельдорф). Аналогичную процедуру осуществляли с использованием образца, гидролизованного в 6 М HCl, для чего 50 мкл вносили с помощью инжектора в дополнительный опытный картуш. Осуществление двух процессов гидролиза в 3 М и 6 М HCl необходимо для оптимизации анализа гексозамина и аминокислот, поскольку максимальные значения гексозамина, а также тирозина можно получать только после гидролиза в 3 М HCl, в то время как максимальные значения валина, изолейцина и лейцина можно получать только после гидролиза в 6 М HCl.
2. Определение содержания нативного коллагена в коллагеновом губчатом материале и шкуре
Образцы определенного веса (25-30 г) вносили в 30 мл 0,1 М раствора бикарбоната натрия (рА, фирма Merck, Дармштадт), рН 8,2, к которому добавляли 1,5 мл раствора трипсина с концентрацией 6 мг/мл (лиофилизированный препарат, который получают из бычьих поджелудочных желез, фирма Boehringer, Мангейм) и инкубировали при встряхивании в течение 8 ч при температуре 23±1°С в водяной бане (фирма Julabo SWI, Силбах). После охлаждения образца в холодной комнате при 4°С его центрифугировали при 4°С в устройстве типа 60 Ti-Rotor (фирма Beckman, Мюнхен) при 32000 об/мин в течение 30 мин. Остаток фильтровали с использованием устройства для ультрафильтрации с перемешиванием (типа Mod 8010, фирма Amicon, Виттен), снабженного фильтром типа Diaflow-Filter PM 10 (фирма Amicon, Виттен) с размером отверстий 25 мм, и 1 мл фильтрата гидролизовали в 6 М HCl в течение 20 ч при 105°С. Последующую обработку и анализ гидролизата осуществляли аналогично методу, описанному выше в разделе (1), за исключением того, что дополнительное введение образца после двукратного упаривания досуха осуществляли в 150 мкл буфера для загрузки, и 150 мкл вносили с помощью инжектора в опытный картуш аминокислотного анализатора. Концентрация гидроксипролина, обнаруженная после анализа аминокислот (в мкмолях/г исходного продукта), соответствовала части расщепленного коллагена в образце. Когда концентрацию гидроксипролина, полученную в результате параллельного гидролиза (6 М HCl и анализируемый образец (см. раздел (1) выше)), которая соответствовала общему содержанию коллагена, сравнивают с концентрацией гидроксипролина, то получали процентное соотношение "нативного", т.е. не расщепленного трипсином, коллагена.
Полученные результаты приведены ниже в таблице.
Пример 4
2,0 г волокнистых нитей коллагена I измельчали в 500 г дистиллированной воды в смесителе. Эту дисперсию центрифугировали и водный супернатант удаляли, получая суспензию волокон коллагена I.
Пример 5
Суспензии коллагена I и коллагена II, полученные с помощью описанных выше методов, смешивали и формовали из них матрицы с требуемыми массовыми соотношениями коллагена I и коллагена II, составляющими 1:9, 25:75, 50:50 и 75:25 соответственно.
Кроме того, смешивали коллаген I-ГАГ и коллаген II-ГАГ и формовали из них матрицы с требуемыми массовыми соотношениями, составляющими 1:9, 25:75, 50:50 и 75:25 соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОСТНЫЙ МАТЕРИАЛ И КОЛЛАГЕНОВАЯ КОМПОЗИЦИЯ ДЛЯ ВОССТАНОВЛЕНИЯ ПОВРЕЖДЕННЫХ СУСТАВОВ | 2001 |
|
RU2292858C2 |
| МЕМБРАНА ДЛЯ ИСПОЛЬЗОВАНИЯ ПРИ НАПРАВЛЕННОЙ РЕГЕНЕРАЦИИ ТКАНЕЙ | 1998 |
|
RU2217171C2 |
| СПОСОБ И МЕМБРАНА ДЛЯ РЕГЕНЕРАЦИИ ТКАНИ | 2010 |
|
RU2532370C2 |
| СПОСОБ И МЕМБРАНА ДЛЯ РЕГЕНЕРАЦИИ КОЖИ | 2010 |
|
RU2551009C2 |
| СПОСОБ РЕПАРАЦИИ РАЗРЫВОВ МЕНИСКА | 2006 |
|
RU2421173C2 |
| ИМПЛАНТАТ, СОДЕРЖАЩИЙ FGF-18 | 2015 |
|
RU2700414C2 |
| ЖЕЛАТИНИРУЮЩИЙ КОЛЛАГЕН И СРЕДСТВО ДЛЯ ЕГО ПРИГОТОВЛЕНИЯ | 2012 |
|
RU2613716C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО ГИДРОГЕЛЯ ИЗ ВАРТОНОВА СТУДНЯ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ ВНУТРИСУСТАВНОГО ПРИМЕНЕНИЯ | 2020 |
|
RU2745995C1 |
| СИСТЕМА IN-SITU ДЛЯ ВНУТРИАРТИКУЛЯРНОЙ РЕГЕНЕРАЦИИ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНЕЙ | 2007 |
|
RU2451527C2 |
| СПОСОБ И МЕМБРАНА ДЛЯ РЕГЕНЕРАЦИИ СЛИЗИСТОЙ ОБОЛОЧКИ | 2002 |
|
RU2288001C2 |

Изобретение относится к медицине. Описан способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хрящевой ткани, который включает смесь коллагена I и коллагена II в соотношении примерно от 1:19 до 19:1 соответственно. Матрикс можно использовать в качестве поддерживающего имплантата для регенерации хрящевой ткани позвоночника или мениска. Матрикс усиливает регенерацию поврежденного хряща. 2 н. и 17 з.п. ф-лы, 2 ил., 1 табл.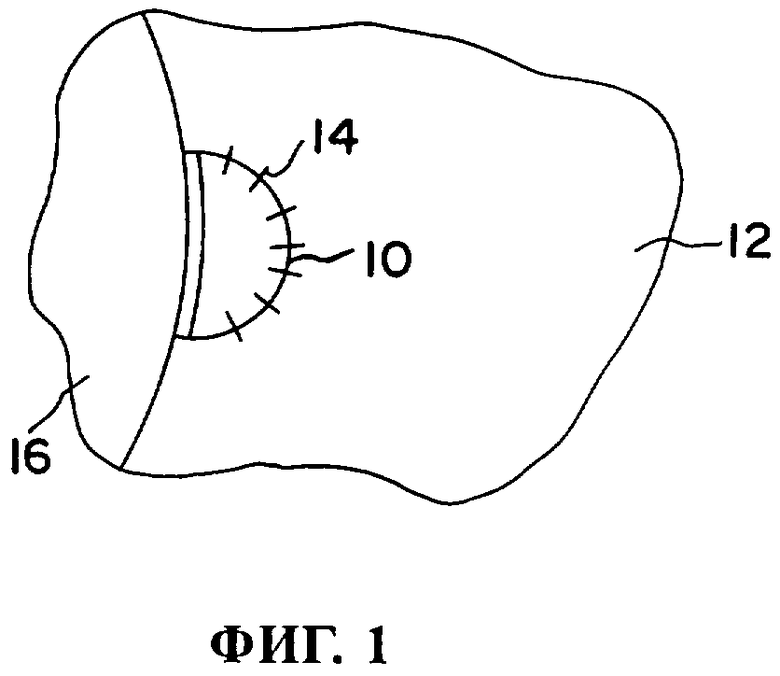
| WO 9808469 А2, 05.03.1998 | |||
| WO 9919005 А1, 22.04.1999 | |||
| СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОГО МАТЕРИАЛА | 1999 |
|
RU2150956C1 |
| КАРБОКСАМИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2163232C2 |
Авторы
Даты
2008-04-27—Публикация
2002-11-19—Подача