Изобретение относится к области удовлетворения жизненных потребностей человека, а именно к области медицины, биотехнологии, регенеративной медицины, фармакологии, в частности, к методам лечения травматических повреждений суставного хряща путем создания бесклеточного хранимого тканеинженерного продукта для замещения хрящевых дефектов с обеспечением их регенерации и может быть использовано, помимо травматологии, в восстановлении мягких тканей организма.
Существуют следующие технические решения, известные как таковые по назначению, а именно для терапии травматических повреждений суставного хряща:
фармацевтические - симптоматические препараты, используемые в клинической практике, в том числе для внутрисуставного введения (неселективные нестероидные противовоспалительные средства, ингибиторы циклооксигеназы; кортикостероиды, гиалуроновая кислота, обогащенная тромбоцитами плазма);
хирургические методы восстановления хрящевых и костно-хрящевых дефектов - абразивная механическая хондропластика, методики остеоперфорации (микрофрактурирование, туннелизация, рассверливание), использование аутологичных остеохондральных трансплантатов (мозаичная хондропластика); методы с применением технологий тканевой инженерии (имплантация мезенхимальных стволовых клеток (далее - МСК), хондрогенных стволовых клеток, аутологичных хондроцитов, в том числе матрикс-индуцированных). Каждый из перечисленных методов имеет отдельные достоинства и негативные стороны.
Длительное воздействие глюкокортикостероидов потенцируют грубое повреждение хряща, обусловленное токсическим действием на хондроциты [Wong М, Carter D. Articular cartilage functional histomorphology and mechanobiology: a research perspective. Bone. 2003; 33 (1): 1-13], способствуя прогрессированию посттравматического остеоартрита (OA). Эффективность инъекций кортикостероидов со временем снижается [Knutsen G., Drogset J., Engebretsen L., Grontvedt Т., Ludvigsen Т., Loken S., Solheim E., Strand Т., Johansen O. A Randomized Multicenter Trial Comparing Autologous Chondrocyte Implantation with Microfracture. J. Bone Jt. Surg. 2016; 98:1332-1339].
Внутрисуставные инъекции гиалуроновой кислоты получили широкое распространение в лечении остеоартрита, однако метаанализ рандомизированных клинических испытаний не выявил значительного эффекта внутрисуставных инъекций гиалуроновой кислоты по сравнению с внутрисуставными инъекциями плацебо [Jiang Y. Cell transplantation for articular cartilage defects: principles of past, present, and future practice. CellTransplant. 2011; 20:593-607].
Использование обогащенной тромбоцитами плазмы в виде внутрисуставных инъекций при посттравматическом OA улучшает показатели боли и функциональные результаты. Однако метод не рекомендуются OARSI (международное общество исследований остеоартрита (osteoarthritis research society international) для лечения посттравматического OA из-за отсутствия убедительных и надежных клинических данных и долгосрочных результатов лечения [Shahid М., Kundra R. Platelet-rich plasma (PRP) for knee disorders. EFORT OpenRev. 2017; 2:28-34].
Хирургические методы остеоперфорации субхондральной кости (микрофрактурирование, туннелизация, рассверливание) широко используются из-за простоты их выполнения и низкой стоимости. Однако этот подход эффективен только для небольших дефектов, обеспечивает относительно кратковременное функциональное улучшение за счет образования фиброхряща, а не нативного гиалинового суставного хряща [Gobbi A., Whyte G. One-Stage Cartilage Repair Using a Hyaluronic Acid-Based Scaffold With Activated Bone Marrow-Derived Mesenchymal Stem Cells Compared With Microfracture: Five-Year Follow-up. Am. J. SportsMed. 2016; 44:2846-2854]. Аутологичная остеохондральная трансплантация (мозаичная хондропластика) - пересадка костно-хрящевых цилиндрических трансплантатов из области ненагружаемой суставной поверхности в зону дефекта хрящевой ткани. К недостаткам метода относятся ограниченная доступность донорской ткани и болезненность донорского сайта, что делает мозаичную пластику применимой только к небольшим дефектам. Кроме того, мозаичная пластика является хирургически сложной задачей, поскольку все имплантированные цилиндры должны быть отмоделированы так, чтобы обеспечить ровную поверхность хряща [Gracitelli G.C., Meric G., Briggs D.T., Pulido P.A., McCauley J.C., Belloti J.C., Bugbee W.D. Fresh Osteochondral Allografts in the Knee. Am. J. Sports Med. 2015; 43: 885-891].
Основными ограничениями клеточной терапии являются высокая стоимость [Murray С, Vos Т, Lozano R, Naghavi М, Flaxman A, Michaud С.Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study. Lancet 2010; 380:2197-2223], необходимость минимум двух операций, проблема фиксации клеточного материала в зоне хрящевого дефекта, и образование фиброхряща, часто происходящее из-за дедифференцировки хондроцитов при экспансии клеток [Goyal D., Goyal A., Keyhani S., Lee E., Hui J. Evidence-Based Status of Second- and Third-Generation Autologous Chondrocyte Implantation Over First Generation: A Systematic Review of Level I and II Studies. Arthrosc. J. Arthrosc. Relat. Surg. 2013; 29: 1872-1878].
В настоящее время разрабатывается тканеинженерное получение и использование бесклеточных матриксов как природных каркасов из различных тканей, таких как клапаны сердца, кровеносные сосуды, скелетные мышцы, плацента, кожа. Биоматериалом для получения матриксов из указанных тканей могут быть ксеногенные и гомологичные донорские ткани, а также их отдельные компоненты - биополимеры. Матриксам из природных материалов присущи биоактивность, биоразлагаемость и наличие поверхностных лигандов для адгезии клеток. Тканевые биоматериалы, из которых удалены клетки, являются одними из лучших вариантов для подготовки биомиметических каркасов. Децеллюляризированный матрикс сохраняет архитектуру, созданную природой для конкретной ткани, для поддержки клеточного роста и организации тканей, поэтому такой матрикс является тканеспецифичным. Процесс децеллюляризации, удаляя клетки донорской ткани, сохраняет компоненты нативного ВКМ с фиксированными на нем факторами роста. Поэтому децеллюляризированные матриксы - наиболее привлекательная конструкция для создания на ее основе тканеинженерного трансплантата.
Тканеспецифичность матрикса, его трехмерная структура, композиция, пористость - необходимые условия для заселения клетками, их распространения и дифференцировки в функционирующие элементы. Однако получение прижизненных донорских тканей для создания матриксов крайне ограничено из-за их лимитированности, а посмертных - из-за юридических и этических сложностей, требующих времени на оформление документального согласия родственников [Федеральный закон от 23.06.2016 N 180-ФЗ "О биомедицинских клеточных продуктах" // "Российская газета". - 2016. - №139. - 28 июня].
Подходящий источник биоматериала для создания тканеинженерных трансплантатов предпочтительно ограничить по признаку гомологичного происхождения. Это связано с риском иммунологических конфликтов [Galili U. Acceleration of Wound Healing by α-gal Nanoparticles Interacting with the Natural Anti-Gal Antibody Journal of Immunology Research Volume 2015, Article ID 589648, 13 pages http://dx.doi.org/10.1155/2015/589648] и передачи ксеногенными матриксами прионных инфекций. Среди гомологичных тканей даже специфичные для матрикса ткани донора (как посмертные, так и прижизненные) не являются идеальными, поскольку состав, структура тканей подвергались изменениям в течение жизни донора. Пороки развития, перенесенные болезни, возрастные изменения, последствия стрессов, приема лекарств, влияния вредных условий труда или области обитания способны существенно изменять компоненты и архитектуру тканей, которые могут быть усугублены процедурами децеллюляризации. В результате этих влияний матриксы могут неблагоприятно повлиять на прикрепление рекрутированных клеток, их расселение, созревание и функционирование по созданию собственного ремоделированного матрикса на месте деградировавшего трансплантированного матрикса.
Однако главная из биологических причин неоптимальности использования донорского биоматериала для изготовления матриксов - его постнатальная структура с утратой регенераторных потенций. Известно, что ткани эмбриона и провизорных органов имеют особые компоненты, обеспечивающие на этапах гестации процессы регенераторного восстановления, сходные с онтогенетическими процессами развития плода. В отличие от взрослых тканей, внеклеточный матрикс (ВКМ) тканей плода и провизорных органов состоит из более незрелого коллагена с меньшими сшивками, обилия гиалуронана высокого молекулярного веса, наличия в матриксе факторов роста, что способствует более эффективному ремоделированию ткани [Badylak S.F. Decellularized allogeneic and xenogeneic tissue as a bioscaffold for regenerative medicine: factors that influence the host response. Ann. Biomed. Eng. 2014; 42:1517-1524. https://doi.org/10.1007/s10439-013-0963-7]. Поэтому можно предположить, что ВКМ из внеэмбриональных тканей обеспечит более эффективное и конструктивное ремоделирование тканей, чем ВКМ из тканей взрослых доноров. Будучи внеэмбриональной тканью, она лишена возрастных недостатков, таких, как патологическое ремоделирование ВКМ, фиброз, окислительный стресс и другие негативные изменения [Koci Z. Extracellular Matrix Hydrogel Derived from Human Umbilical Cord as a Scaffold for Neural Tissue Repair and Its Comparison with Extracellular Matrix from Porcine Tissues. Tissue Engineering Part C-Methods. 2017; 23(6):333-345. https://doi.org/10.1089/ten.tec.2017.0089].
Пуповина, происходящая из внезародышевой мезодермы, обеспечивает внутриутробное развитие плода путем доставки ему субстратов, кислорода и удаления метаболитов кровью матери. Вартонов студень пуповины окружает сосуды плода и, как полагают, предотвращает сжатие, скручивание и сгибание пуповины. Вартонов студень пуповины человека представляет собой твердую слизистую соединительную ткань внеэмбрионального происхождения, состоящую из ВКМ и мезенхимальных клеток. ВКМ Вартонова студня композиционно сходен с матриксом гиалинового хряща, структура которого представлена коллагенами разных типов, гликопротеинами, протеогликанами. При этом каждый из компонентов в отдельности рассматривается сегодня как потенциальный терапевтический агент для регенеративной медицины [Pearsall A, Madanagopal S, Tucker J. The Evaluation of Refrigerated and Frozen Osteochondral Allografts in the Knee. SurgicalScience. 2011; 2(5):232-241. https://doi/org/10.4236/ss.2011.25052]. Стратегическое сходство процессов регенерации и эмбриогенеза позволяет предполагать, что морфогенетические сигналы внеэмбриональных структур могут быть использованы в разработке тканеинженерных конструкций для регенерации тканей [Калюжная Л.И., Харкевич О.Н., Шмидт А.А., Протасов О.В. Регенераторные свойства внеэмбриональных органов человека в тканевой инженерии // Вестник Российской военно-медицинской академии. - 2018.- Т. 64. - №4. - С. 192-198.]. Известно, что фетальные раны, в отличие от ран постнатальных, быстро регенерируют. Этому способствуют: 1) доминирование трансформирующего фактора роста tgf-β3 над tgf-β1,2, характерными для тканей взрослого организма, обилие других ростовых факторов; 2) особенности структурных компонентов (преобладание незрелого фетального коллагена над зрелым, малое количество поперечных коллагеновых сшивок; преобладание гиалуронана высокого молекулярного веса у плода над низкомолекулярным гиалуронаном постнатальных тканей; 3) особенности фетальной цитокиновой регуляции (противовоспалительный ИЛ-10 экспрессируется у плода значительнее, чем провоспалительные ИЛ-6, ИЛ-8); 4) особенности клеточного состава фетальных тканей (преобладание фибробластов над миофибробластами, малое количество тучных клеток и макрофагов, неактивность и неадгезивность тромбоцитов; наличие МСК). Матриксы из тканей провизорных органов после процедуры децеллюляризации сохраняют сигнальные молекулы и факторы роста, способствующие регенерации в зоне имплантации матрикса [McAlindon Т., Bannuru R., Sullivan М., Arden N., Berenbaum F., Bierma-Zeinstra S., Hawker G., Henrotin Y., Hunter D., Kawaguchi H. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthr. Cartil. 2014; 22:363-388].
Исследования по применению ВКМ Вартонова студня в экспериментах продемонстрировали, что: 1) его биосовместимость и адгезивные свойства сопоставимы со свойствами матриксов хрящевой ткани; 2) высокий хондрогенный потенциал матрикса обусловлен сходством микроокружения ВКМ с нативным хрящом; 3) факторы роста ВКМ способствуют выработке хондроцитами коллагена II и аггрекана, специфичных для гиалинового хряща; 4) ВКМ, исходно высоко гидратированный из-за обилия гиалуронана, может быть преобразован в инъекционный гидрогель, который при физиологических условиях внутри сустава полимеризуется [Badylak S.F. Decellularized allogeneic and xenogeneic tissue as a bioscaffold for regenerative medicine: factors that influence the host response. Ann. Biomed. Eng. 2014, 42:1517-1524. https://doi.org/10.1007/s10439-013-0963-7; McAlindon Т., Bannuru R., Sullivan M., Arden N., Berenbaum F., Bierma-Zeinstra S., Hawker G., Henrotin Y., Hunter D., Kawaguchi H. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthr. Cartil. 2014, 22: 363-388; Shahid M., Kundra R. Platelet-rich plasma (PRP) for knee disorders. EFORT OpenRev. 2017; 2:28-34].
Основная цель зарубежных исследователей при создании бесклеточных матриксов - сохранение трехмерной архитектуры тканеспецифической донорской ткани. По причинам ее недоступности и неоптимальности наше внимание направлено на ткани провизорных органов, не подвергавшихся изменениям в силу возраста, стресса или заболеваний, и к тому же сохраняющих фетальный фенотип тканей в силу их внеэмбрионального происхождения. Доказано, что молекулы адгезии и факторы роста фиксированы на структурных компонентах матрикса [Leung A. Fetal wound healing: implications for minimal scar formation. CurrOpinPediatr. 2015;24(3):371-378]. Внеклеточный матрикс (ВКМ) из этих тканей и органов - богатый источник факторов роста и биологически активных молекул клеточной пролиферации, дифференциации и миграции [Taylor-Weiner Н., Schwarzbauer J.Е., Engler A.J. Defined Extracellular Matrix Components are Necessary for Definitive Endoderm Induction. 2013 doi: 10.1002/stem.1453]. Заявителей заинтересовало компонентное сходство слизистой соединительной ткани пуповины с гиалиновым суставным хрящом, в связи с чем возникла идея использовать это сходство для восстановления дефектов суставного хряща.
Из исследованного уровня техники заявителем выявлено изобретение по патенту USA 2011/0256186 А1, 2011 [Perez J.F., Basterrecchea M.D.O., Feo M.B.C., Martinez A.I., Varona A.I.A., Casado T.P. Biomaterial based on Wharton's Jelly from the human umbilical cord] в котором описан способ получения биополимера из пуповины человека, состоящего исключительно из гликозаминогликанов (несульфатированной гиалуроновой кислоты, сульфатированных дерматана сульфата и гепарансульфата). Сущность изобретения состоит в изготовлении гиалуронового гидрогеля с большей, чем природная, жесткостью за счет химического кросс-линкинга (сшивания) с помощью биметиламинопропил-карбодиимида (1-ethyl-3-(3-dimethylaminopropyl carbodiimide) структурных гликозаминогликановых молекул, для последующего его применения либо самостоятельно, либо в сочетании с клетками для реконструкции мягких тканей, лечения рубцов, ожогов, язв, дегенераций межпозвонковых дисков, остеоартроза и др. Материал в твердом (высушенном в вакууме) виде авторы изобретения предлагают использовать при лечении ожогов, язв, дефектов кожи, офтальмологических заболеваний, остеохондральных дефектов, как фидер при культивировании клеток. При этом, несмотря на показанные авторами положительные результаты восстановления хряща через 4 недели после резекции передней крестообразной связки коленного сустава кроликов, имеют место следующие недостатки указанного способа:
Во-первых, в указанном патенте основой гидрогеля является только некоторая часть природных структурных белков ценного биологического материала пуповины человека, а именно гликозаминогликаны. Все колагеновые структуры, в том числе важные для последующего ремоделирования коллагены базальной мембраны пуповины человека, удалены путем центрифугирования. Однако известно, что способностью к самосборке и формированию трехмерной структуры обладают как раз комбинации гликозаминогликанов и коллагенов [Koci Z. Extracellular Matrix Hydrogel Derived from Human Umbilical Cord as a Scaffold for Neural Tissue Repair and Its Comparison with Extracellular Matrix from Porcine Tissues. Tissue Engineering Part C-Methods. 2017;23(6):333-345. https://doi.org/10.1089/ten.tec.2017.0089].
Во-вторых, для удаления клеток и экстракции гликозаминогликанов в цитируемом патенте применяли пептидазу папаин, фермент, который имеет ненормируемую активность. В патенте не указано, была ли нейтрализована его активность по окончании переваривания, и не описаны способы его устранения из продукта. Не исследована способность папаина в составе высушенного гиалуронана после превращения в гель восстанавливать свою активность при физиологических показателях рН и температуры. Указанное обстоятельство сохраняет риск восстановления пептидазной активности папаина in vivo.
В-третьих, особенностью полученного в патенте гидрогеля из гликозаминогликанов является его малая конформационная жесткость. Для получения более жесткого гидрогеля, сохраняющего заданную форму, авторы «сшивают» его с помощью 1-ethyl-3-(3-dimethylaminopropyl carbodiimide, после этой процедуры сшивающий агент должен быть отмыт из продукта. В патенте не указано, как контролируется качество отмывки продукта от агента.
Структурные белки нативной пуповины отличаются природной особенностью, состоящей в отсутствии поперечных сшивок, благодаря чему раны плодов заживают нежным эластичным рубцеванием или полной регенерацией. Большая механическая прочность гидрогеля или матрикса, созданная искусственно химическими агентами или фотопроцессами, потенцирует развитие не регенеративного, а рубцового заживления.
Из исследованного уровня техники заявителем выявлены научные публикации, посвященные изготовлению и использованию бесклеточных матриксов и гидрогелей для восстановления утраченных или поврежденных тканей [Herrero-Mendez A., Palomares Т., Castro В. HR007: a family of biomaterials based on glycosaminoglycans for tissue repair. JTissueEngRegenMed. 2017; 11(4):989-1001; Koci Z. Extracellular Matrix Hydrogel Derived from Human Umbilical Cord as a Scaffold for Neural Tissue Repair and Its Comparison with Extracellular Matrix from Porcine Tissues. Tissue Engineering Part C-Methods. 2017;23(6):333-345. https://doi.org/10.1089/ten.tec.2017.0089].
В изобретении по патенту USA 2011/0256186 Al, 2011 [Perez J.F., Basterrecchea M.D.O., Feo M.B.C., Martinez A.I., Varona A.I.A., Casado T.P. Biomaterial based on Wharton's Jelly from the human umbilical cord] описан способ получения биополимера из пуповины человека, состоящего исключительно из гликозаминогликанов (несульфатированной гиалуроновой кислоты, сульфатированных дерматана сульфата и гепарансульфата. Сущность изобретения состоит в изготовлении гиалуронового гидрогеля с большей, чем природная, жесткостью за счет химического кросс-линкинга (сшивания) с помощью диметиламинопропил карбодиимида (1-ethyl-3-(3-dimethylaminopropyl carbodiimide) структурных гликозаминогликановых молекул, для последующего его применения либо самостоятельно, либо в сочетании с клетками для реконструкции мягких тканей, лечения рубцов, ожогов, язв, дегенераций межпозвонковых дисков, остеоартроза и др. Материал в твердом (высушенном в вакууме) виде авторы изобретения предлагают использовать при лечении ожогов, язв, дефектов кожи, офтальмологических заболеваний, остеохондральных дефектов, как фидер при культивировании клеток.
Существуют патентные документы, в которых используется пуповина для получения мезенхимальных стволовых клеток, с этой целью проводят процессы отделения Вартонова студня, из которого получают таким образом указанные клетки. Например, документ РСТ 98/17791 описывает выделение пре-хондроцитов из пуповины, которые впоследствии используются терапевтически для производства хряща. В документе WO 2004/ 072273 А1 клетки-предшественники извлекаются из Вартонова студня, окружающего сосуды пуповины, и используются для восстановления тканей человека.
Однако нет документа, в котором упоминается биоматериал, представляющий собою природную смесь линейных полимеров, лишенный клеточного материала и ДНК, сохраняющий в своем составе большую часть важных молекул для последующего заселения его пациент-специфическими клетками, который может образовывать гидрогель с необходимыми вязкостными свойствами для использования его с целью восстановления поврежденных/утраченных тканей человека. Основываясь на вышеизложенном, наиболее перспективным направлением в создании бесклеточных тканеинженерных конструкций можно считать использование биоматериала пуповины, форма таких конструкций может быть трехмерной, либо инъекционной.
Основываясь на проведенном и изложенном анализе исследованного уровня техники по научно-технической литературе и патентным базам данных, на дату представления заявочных материалов заявителем не выявлены технические решения по созданию бесклеточного полнокомпонентного тканеинженерного конструкта и гидрогеля из него, с использованием в качестве биоматериала твердой слизистой соединительной ткани пуповины человека (Вартонов студень). Наиболее близким к заявленному техническому решению, выбранным заявителем в качестве прототипа, по совпадающей совокупности признаков и назначению является патент USA 2011/0256186 А1, 2011: Perez J.F., Basterrecchea M.D.O., Feo M.B.C., Martinez A.I., Varona A.I.A., Casado T.P. Biomaterial based on Wharton's Jelly from the human umbilical cord. Биоматериал, разработанный в этом изобретении, состоит из гликозаминогликанов пуповины человека, имеет трехмерную структуру, которая позволяет использовать его в качестве базового матрикса для тканевой инженерии. При применении его самостоятельно или вместе с клетками он вмешивается в регенеративный процесс, оказывая заметное влияние на клетки самой ткани и обеспечивая благоприятную среду для активации клеточных процессов
При этом следует обратить внимание на то, что примененный в прототипе способ изготовления продукта имеет следующие недостатки.
Во-первых, в указанном патенте основой гидрогеля является некоторая часть природных структурных белков ценного биологического материала пуповины человека, а именно гликозаминогликаны. Все колагеновые структуры, в том числе важные для последующего ремоделирования коллагены базальной мембраны пуповины человека, удалены путем центрифугирования. Однако известно, что способностью к самосборке и формированию трехмерной структуры обладают как раз комбинации гликозаминогликанов и коллагенов. Поэтому в исследовании заявителя сделана успешная попытка сохранить в бесклеточном продукте все структурные и функциональные компоненты биоматериала с высоким регенеративным потенциалом.
Во-вторых, для удаления клеток и экстракции гликозаминогликанов в цитируемом патенте применяли пептидазу папаин, фермент, который имеет ненормируемую активность. В патенте не указано, была ли нейтрализована его активность по окончании переваривания, и не описаны способы его устранения из продукта. Заявители провели серию экспериментов по использованию папаина для аналогичных целей и установили, что при указанных в патенте условиях (60°С в экстракционном буферном растворе в течение 24 часов) папаин продолжает расщеплять матриксные белки в количествах, четырехкратно превышающих использованное в цитируемом патенте, на протяжении четырех последующих суток, и при температуре 37°С. Можно ожидать, что при использовании продукта, изготовленного с помощью папаина, после его введения в полости, его пептидазная активность может быть возобновлена. Поэтому для удаления клеток заявители использовали 0,2М NaOH, который по окончании процесса полностью нейтрализовали раствором 0,1N HCl. Образующаяся при этом соль NaCl диссоциирует в воде и легко может быть удалена центрифугированием и лиофилизацией. Кроме того, природные гликозаминогликаны существуют в биоматериале пуповины в виде натриевых солей. Таким образом, использованный заявителями реактив для децеллюляризации, будучи сам по себе нетоксичным для структурных белков, позволяет не только эффективно открепить клетки, но и легко устраняется из матрикса.
В-третьих, особенностью полученного в патенте гидрогеля из гликозаминогликанов является его малая конформационная жесткость. Для получения более жесткого гидрогеля, сохраняющего заданную форму, авторы прототипа «сшивают» его с помощью 1-ethyl-3-(3-dimethylaminopropyl carbodiimide, после этой процедуры сшивающий агент должен быть отмыт из продукта. В патенте не указано, как контролируется качество отмывки продукта от агента.
С точки зрения сохранения преимуществ биоматериала с высокими регенеративными свойствами, в том числе с пространственной сетью волокон гликозаминогликанов (а в исследовании заявителя также и коллагена), природно лишенных сшивок, заявители избегали всякого искусственного ужесточения матрикса применением сшивающих агентов. Структурные белки нативной пуповины отличаются природной особенностью, состоящей в отсутствии поперечных сшивок, благодаря чему раны плодов заживают нежным эластичным рубцеванием или полной регенерацией. Судя по публикациям, сделать тканеинженерный продукт более механически прочным можно достаточно успешно с помощью дополнительного компонента (фиброин шелка, полилактид, хитозан). При этом основной компонент такой комбинации будет обладать в полной мере сохраненными достоинствами внеэмбрионального источника. Поэтому заявители поставили перед собой задачу изготовить полнокомпонентный матрикс из пуповины, содержащий все структурные, а также неструктурные функционально значимые молекулы внеклеточного матрикса, с помощью наиболее физиологичных методов.
Основываясь на изложенном, по мнению заявителя, наиболее перспективным направлением можно считать создание полнокомпонентных несшитых искусственно гидрогелей из бесклеточного матрикса пуповины человека с целью их инъекционного введения в полости дефектов.
Целью заявленного технического решения является создание более эффективного способа лечения травматических повреждений суставного хряща путем внутрисуставного введения полнокомпонентного гидрогеля из бесклеточного матрикса пуповины человека за счет создания полнокомпонентного матрикса и гидрогеля из соединительной ткани пуповины человека с использованием наиболее физиологичных методов децеллюляризации матрикса и солюбилизации его в инъекционный гидрогель, обладающей регенераторными свойствами обеспечивать заживление повреждений хрящевых и мягких тканей.
Решение поставленной задачи обеспечивается тем, что в способе изготовления бесклеточного гидрогеля из Вартонова студня пуповины человека для внутрисуставного применения с целью восстановления повреждений суставного хряща, включающем получение нативной пуповины, стерилизацию 10% раствором перекиси водорода, ее препарирование, фрагментирование и гомогенизацию, децеллюляризацию, отмывку от реагента и открепившихся клеток, нейтрализацию раствором гидроокиси натрия и повторное центрифугирование, лиофилизацию, для удаления клеток из матрикса в процессе децеллюляризации используют гидроокись натрия в концентрации 0,2М, которую по окончании процесса нейтрализуют раствором соляной кислоты 0,01Н, а процедуру солюбилизации полученного лиофилизированного матрикса производят путем воздействия на полученный матрикс пепсина в растворе 0,01Н соляной кислоты в концентрации 2 мг/мл в течение 24 часов, после которой титрованием 0,01Н гидроокиси натрия нейтрализуют среду до физиологических значений рН.
Цель достигается посредством использования заявленного способа изготовления бесклеточного матрикса и гидрогеля из Вартонова студня пуповины человека с помощью растворов 0,2М гидроокиси натрия и раствора пепсина 1 мг/мл в 0,01Н соляной кислоты.
Заявленный способ стимулирования регенерации гиалинового хряща реализуется путем трехкратного введения изготовленного из пуповины человека бесклеточного гидрогеля в коленный сустав кролика с предварительно смоделированным дефектом диаметром и глубиной 3 мм.
Особенностью изготовленного и использованного заявителем гидрогеля является его основа - полнокомпонентный состав матрикса, включающий гиалуроновую кислоту, сульфатированные протеогликаны, различные виды коллагенов, в то время как компоненты по отдельности исследуются в качестве потенциальных терапевтических агентов для регенеративной медицины. Дополнительным обоснованием биосовместимости гидрогеля и матрикса пуповины с гиалиновым хрящом являются литературные данные о сохранении в них факторов роста, стимулирующих хондроциты к выработке коллагена II и аггрекана.
Особенностью заявляемого изобретения также является применение для удаления клеток из матрикса реактива, который по окончании децеллюляризации полностью элиминируется из продукта. Гидроокись натрия в минимальной концентрации (0,2М) нейтрализуется раствором соляной кислоты (0,01Н) с образованием хлорида натрия, который удаляется с водой в процессе центрифугирования.
Вместо получения трехмерного матрикса пуповины, как регенеративного материала, мы решили изготовить его жидкую форму для инъекционного внутрисуставного введения с предположением, что гидрогель имеет сходные с матриксом не только композиционные, но и биомиметические свойства. Наш подход отличается использованием суспензионных макромолекул матриксов вместо их трехмерных конструкций. Гидрогели представляют собой инновационный способ работы с матриксом. Обработанные ферментативно матриксы содержат нановезикулы, обладающие индуктивными свойствами, включая рост и пролиферацию, выживаемость, миграцию и дифференцировку рекрутированных клеток реципиента [Huleihel L., Hussey G.S., Naranjo J.D., Zhang L., Dziki J.L., Turner N.J., Stolz D.B., Badylak S.F. Matrix-bound nanovesicles within ECM bioscaffolds. Sci. Adv. 2016; 2: e1600502, 11p. http://advances.sciencemag.org]. Полученная жидкая инъецируемая суспензия способна заполнять полости дефектов, впоследствии заселяться клетками [Eweida, A.M. Naturally Occurring Extracellular Matrix Scaffolds for Dermal Regeneration: Do They Really Need Cells? / A.M. Eweida, M.K. Marei // Biomed. Res. Int. 2015; 9. https://doi.org/10.1155/2015/839694].
Эксперименты проведены на 15 половозрелых кроликах шиншилла весом 2,0-2,5 кг. Уход, содержание и работу с животными проводили в соответствии с требованиями закона «О ветеринарии» (№243-ФЗ с изменениями от 13 июля 2015 г.) и локального этического комитета при Военно-медицинской академии (№229 от 02.12.2019 г., г. Санкт-Петербург). Животных содержали в отдельных клетках, им обеспечили стандартный суточный режим в соответствии с зоогигиеническими и ветеринарно-санитарными требованиями.
Заявленный способ проиллюстрирован фиг. 1-14, на которых показаны
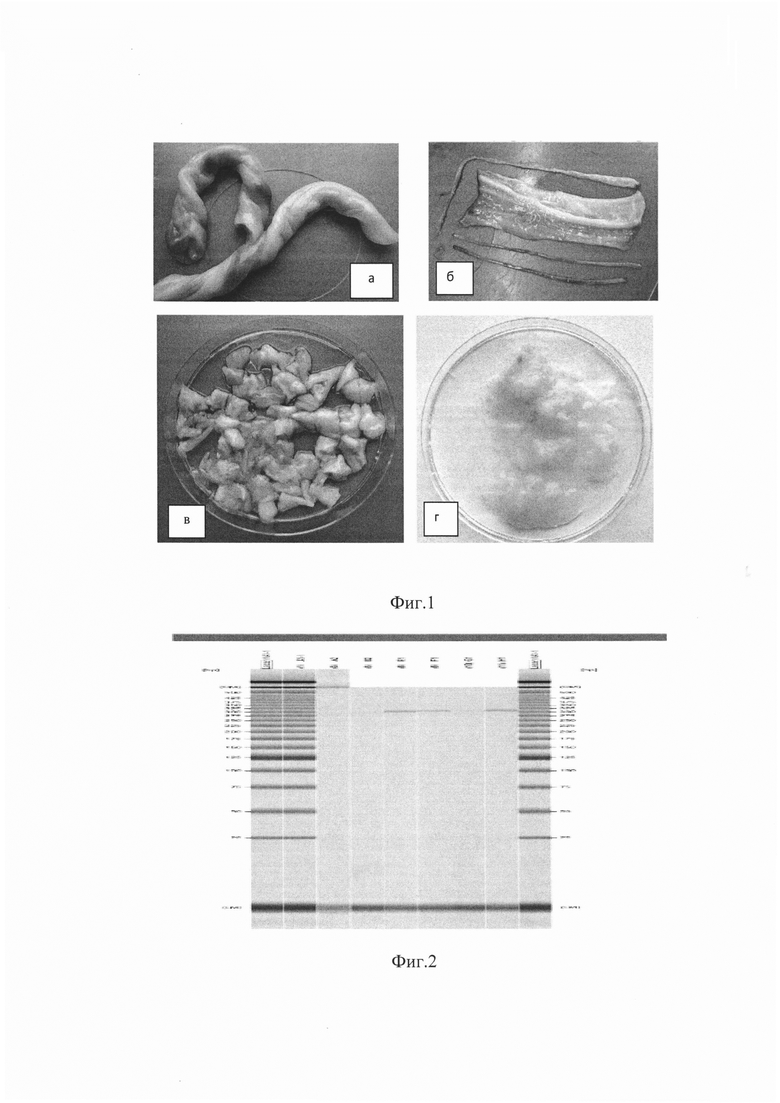
- этапы изготовления бесклеточного матрикса (фиг. 1. а - пуповина нативная; б - удаление артерий и вены пуповины и выделение Вартонова студня; в - фрагментирование, г - гомогенизированная пуповина);
- результаты детекции ДНК методом гель-электрофореза (фиг. 2. ДНК в нативной пуповине (Е1,Н1), бесклеточном матриксе (F1) и гидрогеле (G1,B2));
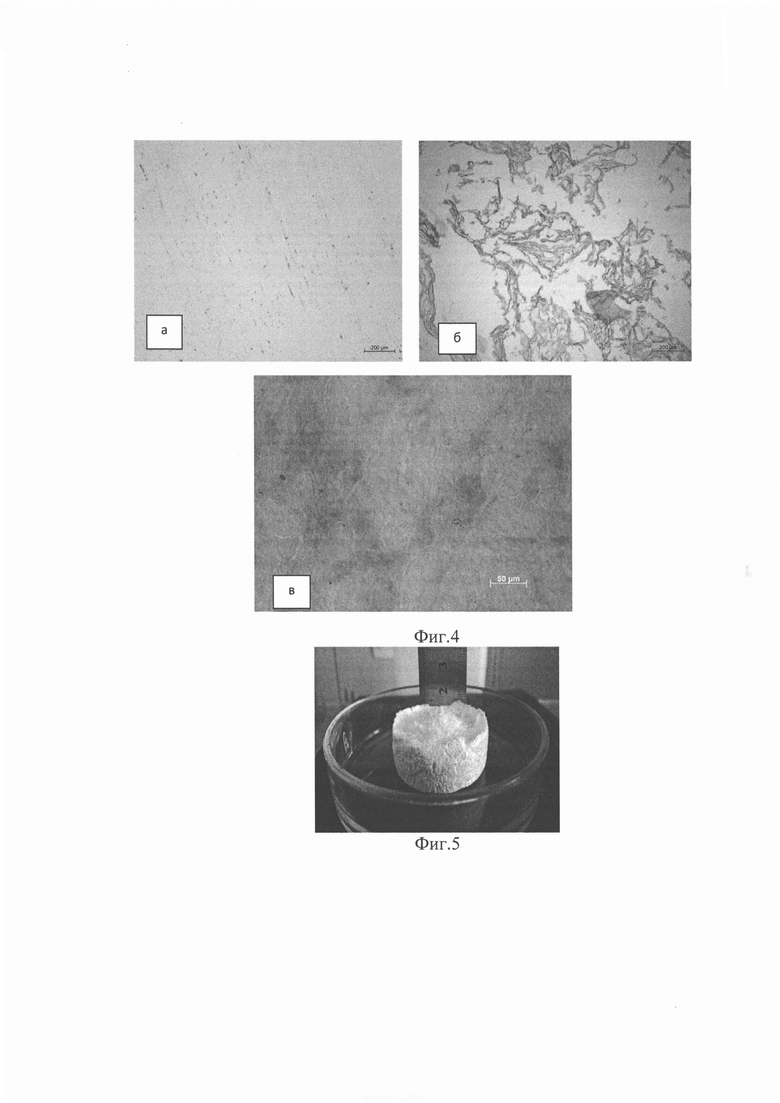
- гистологические подтверждения эффективности децеллюляризации пуповины (фиг. 3. Нативная пуповина, а - окраска гематоксилин-эозином, много ядер; б - окраска DAPI, много ядер; в - гидрогель, окраска гематоксилин-эозином, ядер нет; г - матрикс, окраска DAPI, ядер нет);
- сохранность основных компонентов в матриксе и гидрогеле (фиг. 4. а -окраска альциановым синим, наличие гликозаминогликанов; б - окраска по Ван-Гизону, наличие коллагенов; в) окраска орсеином, выявляет эластиновые волокна);
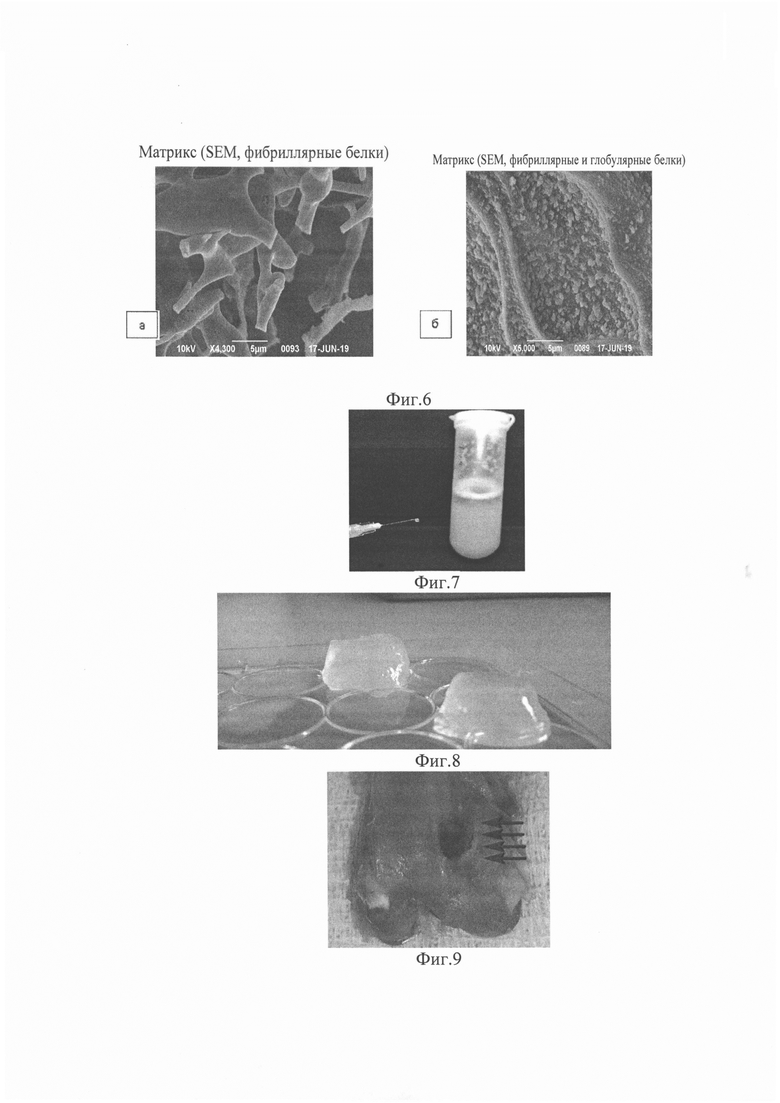
- вид лиофилизированного бесклеточного матрикса пуповины (фиг. 5. Бесклеточный лиофилизированный трехмерный матрикс диаметром 50 мм, высотой 15 мм и массой 2,9942 г.);
- сканирующая электронная микроскопия. Показана пористая фибриллярная структура (фиг. 6а) и зернистая структура бесклеточного матрикса пуповины (фиг. 6б);
- инъекционный гидрогель из пуповины человека (фиг. 7);
- солюбилизация с помощью пепсина в растворе соляной кислоты позволяет получить инъекционную форму матрикса в виде гидрогеля (рисунок 7);
- гидрогель при физиологических условиях приобретает форму гидрогеля как in vitro (фиг. 8), так и in vivo (фиг. 9. После введения окрашенного метиленовой синью инъекционного гидрогеля в коленный сустав кролика с предварительно сформированным дефектом, гидрогель превращается в гидрогель, кумулирующийся в области повреждения);
- на фиг. 10 показан дефект (глубиной и диаметром 3 мм) хрящевой ткани медиального мыщелка бедренной кости кролика;
- на фиг. 11 - вид животного, которому после операции моделирования внутрисуставного повреждения надевали специальный воротник для предупреждения разгрызания повязки;
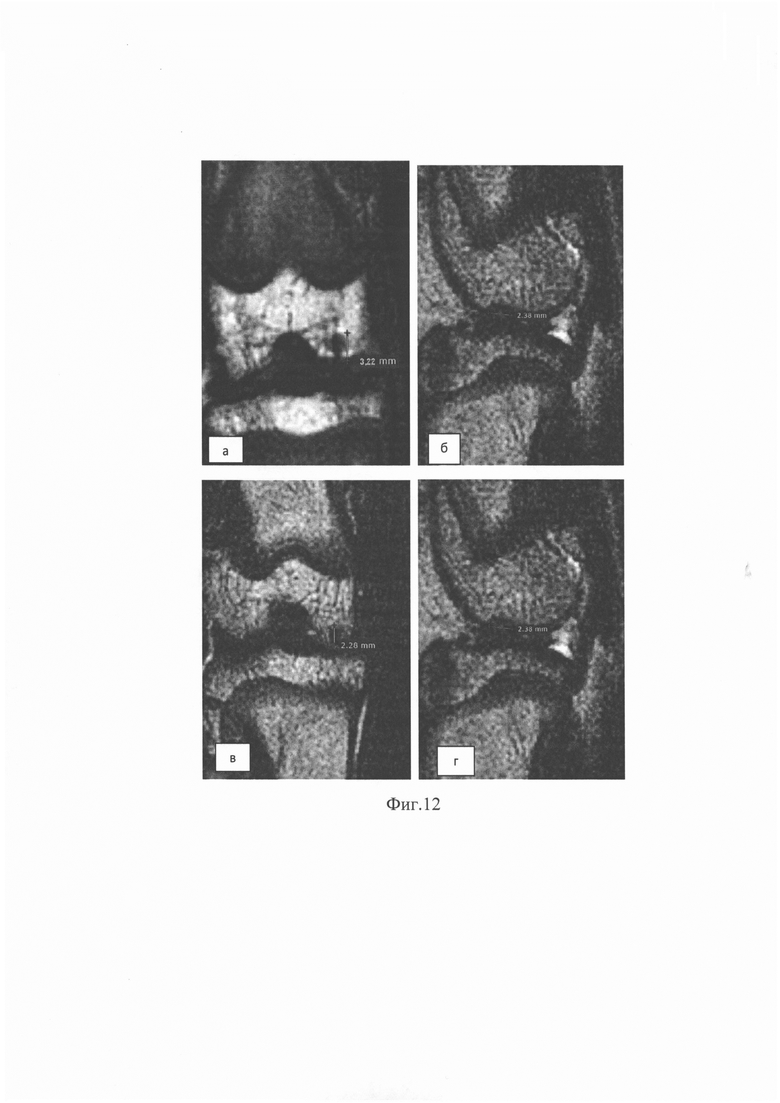
- зона дефекта у кроликов, леченных введением гидрогеля из пуповины человека, измеренная с помощью магнитно-резонансной томографии (фиг. 12), уменьшается к 60-м суткам;
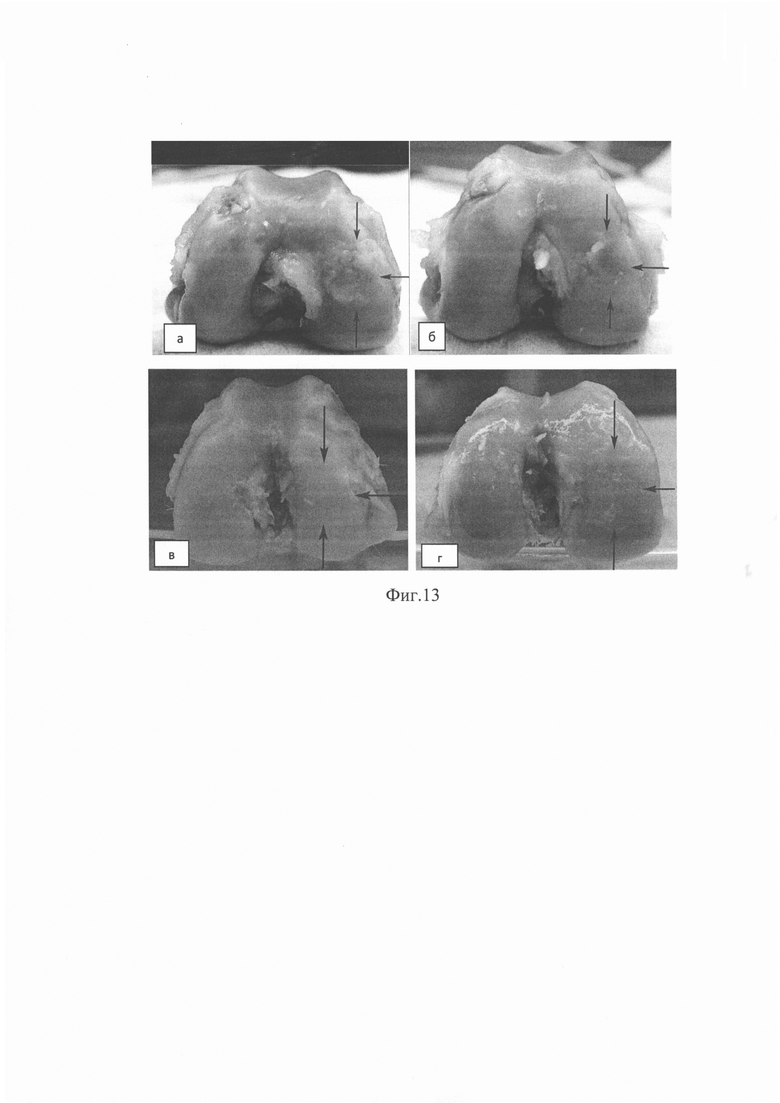
- на 90-е сутки после моделирования травматического повреждения у кроликов, леченных с помощью инъекционного гидрогеля, область дефекта практически неотличима от неповрежденного суставного хряща (фиг. 13);
- фиг. 14 демонстрирует гистологические особенности регенерировавшего гиалинового хряща в зоне дефекта под влиянием введения бесклеточного гидрогеля пуповины человека.
Заявленный способ выполнен по известной последовательности этапов и детально описан в следующих примерах.
Пример 1. Способ изготовления бесклеточного матрикса пуповины человека
Из пуповины, полученной после родов с информированного согласия женщин после кратковременной стерилизации раствором 10% перекиси водорода удалены артерии и вены как структуры, содержащие обилие потенциально иммунногенных зрелых дифференцированных клеток. Биоматериал в виде твердой соединительной слизистой ткани (Вартонов студень) на мембране пуповины подвергается отмывке от крови фосфатным буферным раствором (рН=7,25) и гомогенизации (gentle MACS™ Dissociator Milteniy Biotech, Germany) (фиг. 1).
Затем биоматериал был подвергнут децеллюляризации. Процедура децеллюляризации (удаления клеток) осуществляется с помощью 0,2М раствора NaOH в течение 3 часов в колбе на платформе шейкера (Biosan, Latvia) со скоростью 140 оборотов в минуту при комнатной температуре. Удаление децеллюляризирующего раствора и открепившихся клеток осуществляли процеживанием через воронку Шотта и трехкратными процедурами отмывания фосфатным буфером и центрифугированием (Beckman Avanti, USA) 3000 об./мин в течение 5 мин. каждая. Эффективность децеллюляризации проверяли окрашиванием с помощью световой микроскопии окрашиванием материала гематоксилин-эозином и DAPI (DAPI, 1:1000 Invitrogen Paisley, UK), а также количественным определение ДНК с использованием наборов реактивов InstaGene matrix (BioRad, USA) в соответствии с инструкциями производителя и на спектрофотометре Implen NanoPhotometer NP80 Touch (GmbH, Germany). Гель-электрофорез подтвердил отсутствие ДНК в децеллюляризированном матриксе (трек F1) и гидрогеле (треки G1, В2). (фиг. 2) и присутствие ДНК в нативной пуповине (треки Е1, H1).
От эффективности децеллюляризации зависит неиммуногенность изготовленного из бесклеточного матрикса гидрогеля, вводимого в полость травмированного сустава; она определяется низким содержанием ДНК и клеточного материала в продукте. Критериями качественной децеллюляризации считают содержание ДНК менее 50 нг на мг сухого веса ВКМ и фрагментов ДНК размером менее 200 пар нуклеотидов, а так же отсутствие ядерного материала при гистологическом исследовании с использованием флюоресцентных красителей. Примененный нами метод удаления клеток позволил получить продукт, соответствующий вышеуказанным стандартам [Badylak S.F. Decellularized allogeneic and xenogeneic tissue as a bioscaffold for regenerative medicine: factors that influence the host response. Ann. Biomed. Eng. 2014; 42:1517-1524. https://doi.org/10.1007/s10439-013-0963-7]. Среднее содержание ДНК в гомогенизированном биоматериале нативной пуповины составило 468,75 (453,65-475,15) нг/мкл, после децеллюляризации - 29,2 (27,8-30,7) нг/мкл, снижение статистически значимо, р<0,001.
По окончании децеллюляризации проводили отмывание бесклеточного матрикса от открепившихся клеток центрифугированием 3000 об./мин. и от раствора гидроокиси натрия титрованием 0.01Н раствором HCl, после чего его повторно центрифугировали и лиофилизировали в течение 24 часов.
На фиг. 3 представлены гистологические препараты до (а, б) и после децеллюляризации (в, г).
В матриксе сохранены основные компоненты соединительной ткани пуповины, обнаруженные при помощи гистологических красителей (рис. 4). Окрашивание образцов альциановым синим (рис. 4, а) демонстрирует наличие гликозаминогликанов, окрашивание по Ван Гизону (рис. 4, б) - наличие структурных коллагенов, окраска орсеином (рис. 4, в) - эластиновых волокон. Таким образом, процедура децеллюляризации успешно удаляла клетки, ядра, дебрис. Процедура занимала по времени около 5 часов (от начала препарирования пуповины до полной нейтрализации рН до 7,5).
Помимо эффективности децеллюляризации, указанный метод можем считать достаточно физиологическим, поскольку удается с помощью несложных приемов удалить из продукта реагент путем титрования 0,01Н раствором соляной кислоты, в ходе которого образуются безвредные продукты (хлорид натрия и вода) в малых количествах, удаляемые последующим центрифугированием:
NaOH+HCl=NaCl+H2O.
Полученный биоматериал подвергали лиофильной сушке в течение 24 часов (Zirbus VaCo5II, Germany) до полного высыхания (фиг. 5).
На серии снимков, сделанных с помощью электронного микроскопа JEOL JSM-639 OLA scanning electron microscope (Japan) и программного обеспечения ImageJ (Rasband, W.S., U.S. National Institutes of Health; Bethesda, MD) видно, что лиофилизированный бесклеточный матрикс из пуповины человека частично сохранил сетчатую коллагеновую структуру (фиг. 6а). Большое увеличение позволяет рассмотреть не только фибриллярные, но и глобулярные зернистые полимеры на стенках пор, размерами соответствующие нановезикулам (фиг. 6б).
Размеры пор полученного продукта находятся в диапазонах, позволяющих мигрировать в них клеткам, происходить процессам перемещения жидкостей, питательных субстратов и метаболитов для обеспечения жизнедеятельности клеток. Из научных публикаций известно, что в структуру матрикса включены важные адгезивные молекулы и факторы роста, а также нановезикулы, направляющие взаимодействие и поведение клеток, заселяющих матрикс. Поэтому бесклеточный матрикс из высокорегенеративных тканей является самостоятельным продуктом для возможного применения его в лечении глубоких повреждений кожи, мягких тканей.
Пример 2. Способ получения инъекционного гидрогеля из бесклеточного матрикса пуповины человека и исследование его способности к образованию трехмерного гидрогеля in vitro и in vivo.
С помощью модифицированных нами процедур солюбилизации (Freytes D.O, Martin J., Velankar S.S., Lee A.S., Badylak S.F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials, 2008. - 29: 1630-1637. doi:10.1016/j.biomaterials.2007.12.014), состоящей в воздействии пепсина в растворе 0,01Н соляной кислоты в концентрации 2 мг/мл, матрикс был преобразован в гидрогель с вязкостью, позволяющей проходить через иглу шприца 27 G (фиг. 7). После стерилизации инъекционного продукта раствором стептомицина-пенициллина (Биолот) он был немедленно заморожен до момента его использования в эксперименте.
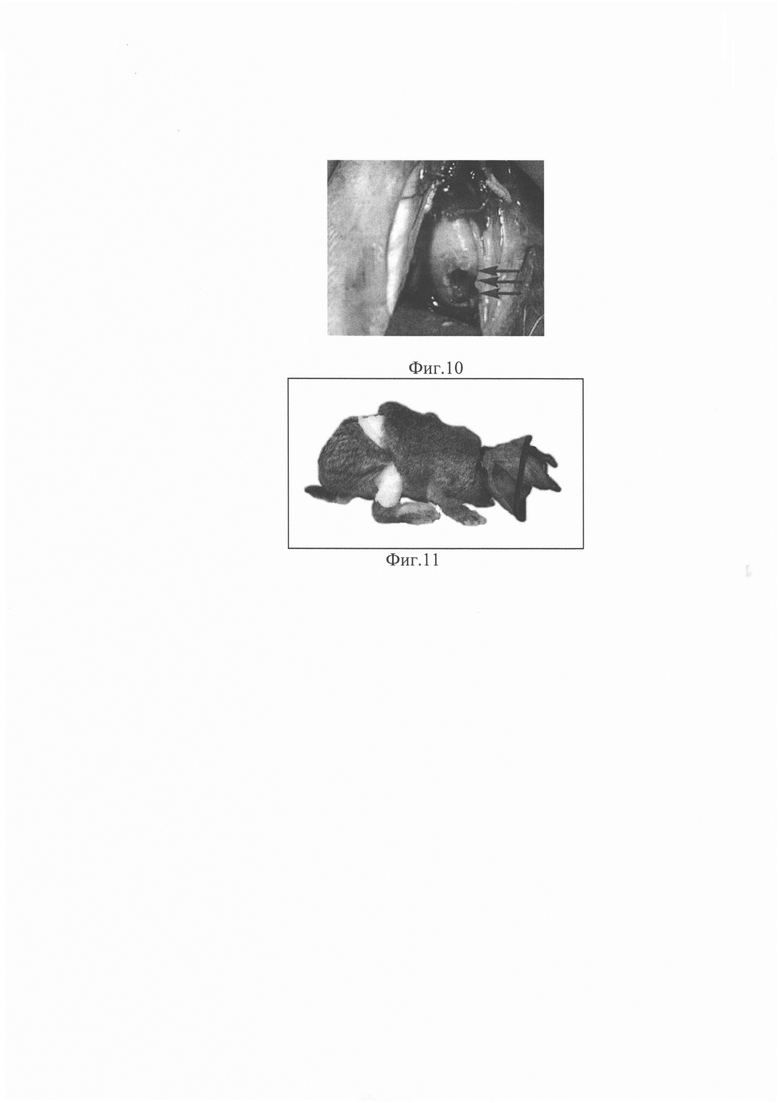
Инъекционный гидрогель при создании физиологических условий (рН=7,35-7,45 и t=37°C) полимеризуется in vitro в трехмерную структуру гидрогеля (Фиг. 8).
Процедура полимеризации текучего (жидкого) гидрогеля в трехмерный гидрогель возможна за счет высокого содержания высокомолекулярной гиалуроновой кислоты в его составе. Полученный инъекционный материал с регулируемой вязкостью полимеризуется также in vivo, заполняя дефекты суставного хряща (фиг. 9).
Пример 3. Моделирование повреждения гиалинового хряща коленного сустава кроликов.
В условиях стерильной операционной всем животным под комбинированной анестезией (раствор пропофола 1% - 2 мл, диэтиловый эфир - 15 мл) через медиальный парапателлярный доступ сверлом был сформирован костно-хрящевой дефект нагружаемой зоны медиального мыщелка правой бедренной кости диаметром и глубиной 3 мм (фиг. 10).
Операция заканчивалась послойным ушиванием раны, наложением асептической повязки. В послеоперационном периоде для профилактики гнойно-воспалительных осложнений животным внутримышечно вводили цефтриаксон 10 мг/кг 1 раз в день первые 3 дня. Оперированную конечность не иммобилизировали. Всем кроликам в течение 5 дней после операции надевали пластиковый прозрачный воротник для защиты от разгрызания повязки и шовного материала, который не препятствовал питанию животных (фиг. 11).
Во время наблюдения за животными в течение 10 дней после моделирования травматического повреждения суставного хряща (фиг. 8) и в постинъекционных периодах не выявлено признаков раневой инфекции, синовита оперированных коленных суставов в обеих группах, ректальная температура тела не превышала 38°С.
Пример 4. Изучение регенеративного влияния бесклеточного инъекционного гидрогеля на восстановление дефектов гиалинового суставного хряща в эксперименте.
Животных с моделированным дефектом суставного хряща случайным образом разделили на 2 группы. Первой (контрольной) группе животных (8 особей) в полость оперированного сустава вводили 0,4 мл 0,9% раствора натрия хлорида трижды на 14, 21, 28-е сутки после моделирования дефекта. Животным второй опытной группы (7 особей) вводили 0,4 мл гидрогеля из биоматериала пуповины в аналогичные сроки.
Через 60 суток после операции всем животным выполнена магнитно-резонансная томография (далее - МРТ) коленных суставов для измерения глубины и диаметра дефекта (фиг. 12а, б, в, г).
Выявлено статистически значимое увеличение диаметра повреждения, проиллюстрированное последовательно на фиг. 12 а, б, в, г, в контрольной группе (n=8), в которой для лечения использовали 0,9% раствор натрия хлорида. Через 60 суток средний диаметр дефекта составил 3,25 мм, р1=0,018. Уменьшение диаметра повреждения хряща в группе животных, которым для замещения хрящевого дефекта внутрисуставно вводили гидрогель пуповины, оказалось статистически значимым. Через 60 суток средний диаметр дефекта уменьшился до 2,69 мм; р1=0,028. Двусторонний анализ изменения диаметра и глубины дефекта суставного хряща под влиянием проводимого лечения показал статистически значимое различие характеристик контрольной и экспериментальной групп (р2=0,001, р2=0,004 соответственно).
Животных вывели из эксперимента через 90 дней путем внутривенной инъекции пропофола (1% - 10 мл). Макроскопические препараты коленных суставов исследовались визуально на предмет наличия в тканях воспалительного процесса и дегенеративно-дистрофических изменений (соответственно фиг. 13а, б и 13 в, г).
Сравнение результатов микроскопического исследования через 90 дней после формирования дефекта показало, что преобладающая ткань в области дефекта у животных в экспериментальной группе статистически значимо чаще (р=0,014) характеризовалась наличием гиалинового суставного хряща (n=4) или не полностью дифференцированной мезенхимы (n=3), в то время, как в контрольной группе у трех животных в раневой области присутствовала фиброзная ткань или кость и у 5 - не полностью дифференцированная мезенхима. Показатели, характеризующие поверхность, целостность структуры, толщина хряща в зоне дефекта оказались выше в экспериментальной группе.
Анализ уровня дефицитности клеток в области дефекта показал, что в экспериментальной группе нормальная клеточность была определена у 2 животных, еще у 4 выявлена небольшая недостаточность, чаще встречались хондроны. В то же время у животных контрольной группы чаще выявлялась (n=5) умеренная гипоклеточность. При сравнении показателей клеточности двух групп выявлена тенденция к различию (р=0,054).
О степени функциональной активности клеток хрящевой ткани можно судить по содержанию в тканях гликозаминогликанов. Качественной реакцией является интенсивность окрашивания альциановым синим. Выявлена большая интенсивность окрашивания хряща в суставах животных, леченных бесклеточным гидрогелем пуповины (фиг. 14 а, б, в, г, д, е).
Исследования in vivo подтвердили правомерность исходной гипотезы о возможности создания и использования полнокомпонентного бесклеточного матрикса Вартонова студня пуповины человека в виде инъекционного гидрогеля для восстановления травматических повреждений суставного хряща.
Обнаруженная позитивная динамика, состоящая в прогрессивном уменьшении диаметра и глубины повреждения медиального мыщелка бедренной кости у животных с внутрисуставным введением гидрогеля, позволяет утверждать, что пуповина является подходящим ресурсом для создания гидрогеля, как благоприятной среды восстановления внутрисуставного хряща.
Полученный заявителями инъекционный бесклеточный полнокомпонентный гидрогель из пуповины для внутрисуставного введения отвечает существующим стандартам содержания ДНК, полимеризуется in vitro и in vivo, биосовместим и безопасен при введении. Внутрисуставное введение бесклеточного инъекционного гидрогеля из пуповины приводит к уменьшению на 60-сутки размеров травматического повреждения суставного хряща кролика, на 90 сутки - к существенному восстановлению гиалинового хряща в зоне дефекта суставной поверхности.
Таким образом, основываясь на результатах исследования, представляется возможным сделать вывод о том, что заявленный способ изготовления бесклеточного гидрогеля из Вартонова студня пуповины человека для внутрисуставного применения с целью восстановления повреждений суставного хряща, заключающийся в инъекциях гидрогеля из бесклеточного матрикса пуповины, позволяет эффективно стимулировать регенеративные процессы в области дефектов гиалинового хряща. Описанные выше методы исследования объективно свидетельствуют о позитивном влиянии применяемого воздействия на регенерацию суставного хряща и обеспечивают восстановление двигательных функций в поврежденных суставах.
Заявителями впервые:
• Применен способ получения бесклеточного матрикса и гидрогеля из пуповины человека с помощью простых методов устранения клеток из тканей пуповины человека; эффективность использованных методов и реактивов подтверждена современными технологиями гель-электрофореза ДНК, световой и сканирующей электронной микроскопии, спектрофотометрии.
• Показано регенеративное влияние внутрисуставного введения гидрогеля из бесклеточного матрикса пуповины на восстановление посттравматического повреждения гиалинового хряща коленного сустава, документированное современными высокоинформативными методами исследования - магнитно-резонансной томографией, гистологическим анализом со специальным окрашиванием.
Использование заявленного способа изготовления гидрогеля из бесклеточного матрикса пуповины человека и его использования для лечения внутрисуставных повреждений гиалинового хряща позволяет улучшить его регенерацию для восстановления структуры и функции сустава.
Заявленное техническое решение позволяет обеспечить реализацию поставленной цели, а именно более полное и физиологическое восстановление структуры гиалинового хряща в месте дефекта, ответственное за выполнение двигательных функций и улучшение качества жизни пациента, и повышение доступности способа изготовления гидрогеля и способа лечения, заключающегося в возможности внутрисуставного введения гидрогеля.
Заявленное техническое решение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как на дату предоставления заявочных материалов заявителем из подвергнутых анализу источников патентной и непатентной информации РФ и стран зарубежья не выявлена заявленная совокупность признаков с идентичными заявленному техническому решению признаками.
Предлагаемое изобретение удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. совокупность заявленных признаков обеспечивает получение неочевидных для специалиста технических результатов.
Заявленное техническое решение удовлетворяет критерию «промышленная применимость», предъявляемого к изобретениям, т.к. было апробировано на практике в условиях научно-исследовательской лаборатории Военно-медицинской академии МО РФ, в результате чего были реализованы все цели, поставленные в заявленном техническом решении, а именно реализовано более полное восстановление гиалинового внутрисуставного хряща, необходимое для восстановления структуры и функции сустава.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ СОЗДАНИЯ ВЫСОКОРЕГЕНЕРАТИВНОГО РАНЕВОГО ПОКРЫТИЯ | 2022 |
|
RU2795904C1 |
| СПОСОБ ПРИМЕНЕНИЯ БЕСКЛЕТОЧНОГО ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ ЗАЖИВЛЕНИЯ РАН | 2023 |
|
RU2816034C1 |
| КОЛЛАГЕНСОДЕРЖАЩИЙ ГИДРОГЕЛЬ ИЗ КОСТНОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2024 |
|
RU2836308C1 |
| КОЛЛАГЕНСОДЕРЖАЩИЙ ГИДРОГЕЛЬ ИЗ ОПОРНЫХ И СОЕДИНИТЕЛЬНЫХ ТКАНЕЙ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2024 |
|
RU2836935C1 |
| Способ получения тканеспецифического матрикса для тканевой инженерии хряща | 2019 |
|
RU2716577C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ГИАЛИНОВОГО ХРЯЩА ПРИ ЛЕЧЕНИИ ВНУТРИСУСТАВНЫХ ПЕРЕЛОМОВ | 2008 |
|
RU2364360C1 |
| СПОСОБ ЛЕЧЕНИЯ АРТРОЗА | 2007 |
|
RU2360691C1 |
| БИОМАТЕРИАЛ НА ОСНОВЕ БЕСКЛЕТОЧНОГО МАТРИКСА, ПРОИЗВОДИМОГО МЕЗЕНХИМНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ | 2018 |
|
RU2718907C1 |
| Способ создания тканеинженерных конструкций методом биопечати биочернилами для регенерации хрящевой ткани в условиях организма | 2021 |
|
RU2770558C2 |
| Способ получения трансплантата - тканеинженерной надхрящницы на основе клеточных сфероидов | 2022 |
|
RU2807692C2 |


Изобретение относится к медицине, а именно к способу изготовления бесклеточного гидрогеля из Вартонова студня пуповины человека. Способ изготовления бесклеточного гидрогеля из Вартонова студня пуповины человека для внутрисуставного применения с целью восстановления повреждений суставного хряща, включающий получение нативной пуповины, стерилизацию раствором перекиси водорода, её препарирование, фрагментирование и гомогенизацию, децеллюляризацию гидроокисью натрия с последующей его нейтрализацией раствором соляной кислоты, отмывку от реагента и открепившихся клеток, нейтрализацию раствором гидроокиси натрия и повторное центрифугирование; лиофилизацию, далее проводят солюбилизацию полученного лиофилизированного матрикса путем воздействия на полученный матрикс пепсином в растворе соляной кислоты, после которой титрованием гидроокиси натрия нейтрализуют среду до физиологических значений рН, при определенных условиях. Вышеописанный способ позволяет создать полнокомпонентный матрикс и гидрогель из соединительной ткани пуповины человека с использованием наиболее физиологичных методов, обладающей регенераторными свойствами обеспечивать заживление повреждений хрящевых и мягких тканей. 4 пр., 14 ил.
Способ изготовления бесклеточного гидрогеля из Вартонова студня пуповины человека для внутрисуставного применения с целью восстановления повреждений суставного хряща, включающий получение нативной пуповины, стерилизацию 10% раствором перекиси водорода, ее препарирование, фрагментирование и гомогенизацию, децеллюляризацию, отмывку от реагента и открепившихся клеток, нейтрализацию раствором гидроокиси натрия и повторное центрифугирование; лиофилизацию, отличающийся тем, что для удаления клеток из матрикса в процессе децеллюляризации используют гидроокись натрия в концентрации 0,2М, которую по окончании процесса нейтрализуют раствором соляной кислоты 0,01Н, а процедуру солюбилизации полученного лиофилизированного матрикса производят путем воздействия на полученный матрикс пепсина в растворе 0,01Н соляной кислоты в концентрации 2 мг/мл в течение 24 часов, после которой титрованием 0,01Н гидроокиси натрия нейтрализуют среду до физиологических значений рН.
| US 2011256186 A1, 20.10.2011 | |||
| СПОСОБ ПРИГОТОВЛЕНИЯ ПРЕПАРАТА ИЗ ПУПОВИНЫ И КОСТНОГО МАТРИКСА ДЛЯ СТИМУЛЯЦИИ ОСТЕОГЕНЕЗА | 2000 |
|
RU2172174C1 |
| KAPPLER B | |||
| The cytoprotective capacity of processed human cardiac extracellular matrix / B | |||
| Kappler; P | |||
| Anic; M | |||
| Becker; A | |||
| Bader; K | |||
| Klose; O | |||
| Klein; B | |||
| Oberwallner; Y.H | |||
| Choi; V | |||
| Falk; C | |||
| Stamm // J | |||
| Mater | |||
| Sci | |||
| Mater | |||
| Med | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| - V | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| - P | |||
| Кровля из глиняных обожженных плит с арматурой из проволочной сетки | 1921 |
|
SU120A1 |
| стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| КАЛМЫКОВА Н.В | |||
| и др | |||
Авторы
Даты
2021-04-05—Публикация
2020-09-16—Подача