Изобретение относится к области фармакологии и медицины, конкретно к новому поколению противомикробных препаратов регулируемого действия на основе рифабутина, содержащих наночастицы.
Рифабутин или 1',4-дидегидро-1-дезокси-1,4-дигидро-5'-(2-метилпропил)-1-оксорифамицин является антибиотиком из группы анкамицинов [1, 2].
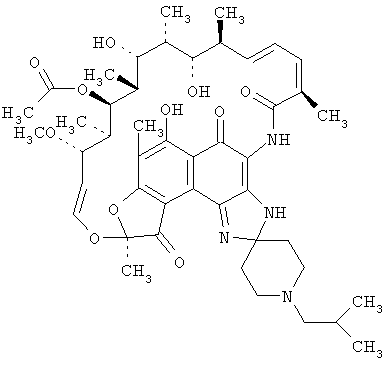
Активен в отношении микобактерий туберкулеза и авиум-внутриклеточного комплекса. Дозировка рифабутина при туберкулезе легких составляет 150-300 мг внутрь, при инфицировании авиум-внутриклеточного комплекса 300 мг в сутки. Он угнетает синтез бактериями аминокислот в результате ингибирования ДНК-зависимой РНК полимеразы. Хорошо проникает внутрь клеток различных органов и тканей. Не проходит через гематоэнцефалический барьер. Подвергается биотрансформации в печени с образованием неактивных метаболитов. Однако вызывает тяжелые нарушения функции печени и почек, тромбоцитопению, аллергические реакции и диспептические явления. При лечении рифабутином требуется тщательный контроль функции печени и картины периферической крови.
В этой связи закономерно формулируется цель настоящего изобретения, а именно создание лекарственного средства и препарата на основе рифабутина, уменьшающего токсичность активного вещества при сохранении противомикробной активности, стабильного при хранении, и упрощение получения готовой лекарственной формы.
Поставленная цель достигается использованием рифабутина в препарате, содержащем наночастицы, и базируется на современных достижениях фармакологии и медицины.
Преимущества наносомальных антибиотиков при лечении различных внутриклеточных инфекций известны. Так, показана высокая эффективность наносомального ампицилина в отношении листериоза и сальмонеллеза [3]. Для лечения легочных инфекций предложены наносомальные композиции на базе ампицилина, гентамицина, рифампицина и их смесей [4]. В последнее время появились данные о высокой эффективности наносомальных препаратов при лечении туберкулеза легких [5-7]. Более того, включение рифампицина в наночастицы биодеградируемых полимеров приводит к значительному повышению его эффективности при лечении сальмонеллеза и сепсиса [8]. Антираковые препараты декапептил, золадекс, сандостатин и соматулин, содержащие, помимо цитостатиков, наночастицы биодеградируемых полимеров молочной и гликолевой кислот (PLGA), разрешены к применению в медицинской практике Российской Федерации [9].
Возвращаясь к факту нарушения функции печени и почек при приеме рифабутина, следует особо обратить внимание на возможность снижения накопления наночастиц лекарственной субстанции в печени («степс-эффект») и увеличение времени их циркуляции в организме за счет комплексного применения биодеградируемого полимера с неионогенными поверхностно-активными веществами (ПАВ), к примеру полисорбатом-80 [10]. Возникновение почечной недостаточности может быть преодолено путем включения в создаваемое лекарственное средство осмотических диуретиков, в частности D-маннита [11].
Таким образом, из приведенных выше данных следует, что новое лекарственное средство и препарат на основе рифабутина для достижения целей настоящего изобретения должен содержать наночастицы активной субстанции (рифабутин), иммобилизованной на биодеградируемом полимерном носителе (PLGA), неионогенное ПАВ (полисорбат 80) и осмотический диуретик (D-маннит).
В патентной литературе описано множество способов получения наночастиц, содержащих медицинские средства и биодеградируемые полимеры. К настоящему времени они суммированы в двух основополагающих патентах - это различные варианты эмульгирования с последующим лиофильным высушиванием [12] и механическое дробление в присутствии измельчающей среды [13], который предлагается в качестве прототипа. При этом следует иметь в виду, что для достижения эффективного всасывания препаратов в желудочно-кишечном тракте нужно, чтобы диаметр частиц был менее 500 нм [14].
Несмотря на явные успехи в области наномедицины в мире, в Российской Федерации достижения нанотехнологии в промышленном масштабе до сих пор не реализованы как в силу существенных финансовых затрат на заказ аппаратов и оборудования нового поколения, так и ввиду отсутствия соответствующего количества высококвалифицированного персонала. В этой связи нами был разработан новый доступный для промышленного внедрения способ получения лекарственного препарата регулируемого действия на основе рифабутина, содержащего наночастицы.
Предлагаемый способ базируется на упорядоченной структуре диметилсульфоксида (ДМСО), которая разрушается в интервале температур 40÷60°С и возобновляется при 20÷25°С [15]. При этом ДМСО стабилизирует неустойчивые (лабильные) вещества за счет его способности к координационной сольватации с органическими и неорганическими соединениями [16]. В медицинской практике ДМСО применяют в комплексной терапии ревматоидного артрита, болезни Бехтерева, дискоидной красной волчанке, тромбофлебите, экземе, фурункулезе, амилоидозе и пр. [17, 18]. В совокупности с дисульфирамом ДМСО приводит к длительному сенсибилизирующему эффекту у больных алкогольной зависимостью [19].
Используя изменения упорядоченности структуры ДМСО в интервале температур от 20 до 60°С и его высокую активность в координационной сольватации, экспериментальным путем были найдены такие соотношения рифабутина, PLGA (50/50), D-маннита, полисорбата-80, ДМСО (средство №1) и рифабутина, D-циклосерина, PLGA (50/50), D-маннита, полисорбата-80, ДМСО (средство №2), при которых образуются жидкие, однородные, прозрачные и стабильные при комнатных условиях системы. При разбавлении полученных средств водой в соотношениях от 1:20 до 1:10 образуются устойчивые опалесцирующие суспензии, содержащие в первом случае (препарат №1) частицы размеров ˜200÷400 нм (100%), а во втором (препарат №2) - ˜10% частиц размеров ˜100÷200 нм и ˜90% частиц размеров ˜3000 нм.
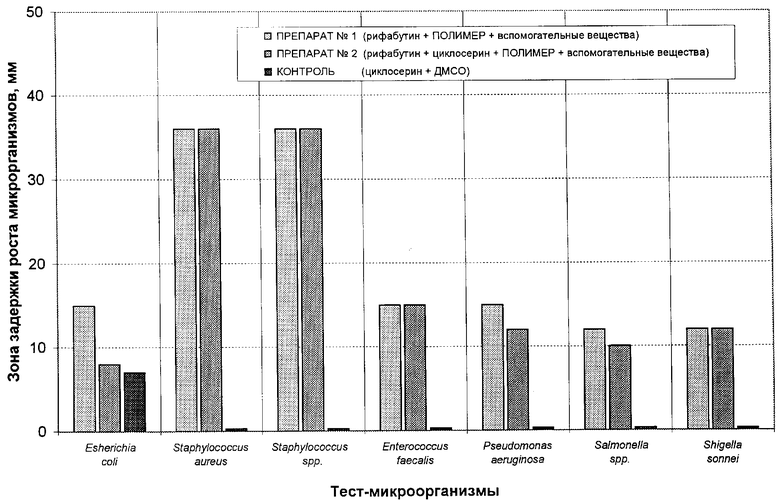
Исследования антибактериальной активности полученных суспензий (препараты №1 и №2) показали их высокую противомикробную активность и в отношении грамположительных, и в отношении грамотрицательных, и в отношении атипичных бактерий. Препарат №2, содержащий только ˜10% наночастиц, оказался менее эффективным, чем препарат №1, содержащий 100% наночастиц размеров ˜200÷400 нм. Превосходство препарата №1 в отношении Eschenchia coli, Pseudomonas aeruginosa и Salmonella spp.послужило причиной его оценки в опытах на лабораторных животных. Зафиксировано, что препарат №1 практически нетоксичен. При паталогоанатомическом вскрытии подопытных животных изменений в печени не наблюдалось. В то же время при введении лабораторным животным стандартной лекарственной формы рифабутина в терапевтической дозе наблюдается гепатотоксический эффект. Более того, новые препараты на основе рифабутина, содержащие наночастицы, в сравнении со стандартной лекарственной формой существенно активнее в отношении тест-культур микроорганизмов (таблица 4).
В целом получено новое средство на основе рифабутина, практически нетоксичный препарат, содержащий наночастицы, обладающий широким спектром высокоэффективного антибактериального действия, и предложен технологически простой способ его получения. Возможность разбавления средства водой в соотношении от 1:20 до 1:10 может быть использована для регулировки дозировки препарата в зависимости от индивидуальных особенностей больного.
Предлагаемое изобретение иллюстрируется нижеследующими примерами.
Пример 1. Способ получения средств на основе рифабутина
В трехгорлую стеклянную колбу, снабженную мешалкой, приводимую в действие электромотором, термометром и воздушным (обратным) холодильником, при 20-25°С последовательно загружают ингредиенты, приведенные в таблицах 1 и 2, в указанных процентных соотношениях. Смесь перемешивают и нагревают на колбонагревателе при 50-60°С до полного растворения твердой фазы, после чего охлаждают до комнатной температуры в течение 20-30 мин. Готовые средства хранят в герметичной таре оранжевого стекла.
- терапевтических доз противотуберкулёзных ингредиентов;
- однородности средств в интервале температур 20÷25°С;
- стабильности основных показателей качества средств при хранении.
Указанные выше средства №1 и 2 представляют собой прозрачные однородные жидкости темно-красного цвета, устойчивые при хранении свыше года. При добавлении к ним воды в соотношении 1:20 до 1:10 образуются устойчивые опалесцирующие суспензии (препараты №1 и №2), определение размеров частиц которых приведено в примере 2.
Таким образом, заявленный способ получения препарата по сравнению с прототипом [13] является более простым за счет уменьшения количества стадий без использования механического дробления.
Пример 2. Определение размеров частиц препаратов на основе рифабутина в водной среде
Определение размеров частиц и распределение размеров частиц по фракциям осуществляли методом автокорреляционной спектроскопии на субмикронном лазерном спектрометре Coulter N4MD фирмы Coulter Electronics (Франция-США). Алгоритм измерений основан на программе CONTIN.
Предварительно смешанные с водой средства №1 и №2 в соотношении 1:20 вносили в кювету с дистиллированной водой (3 мл) в количестве 10÷20 мкл и подвергали ультразвуковому воздействию в течение 1 мин с помощью ультразвуковой ванны (Weswood Ultrasonics Ltd, Model 90S). Затем производили измерения. Результаты представлены в таблице 3.
Из таблицы 3 видно, что препарат №1 на 100% состоит из частиц размером 200-400 нм, а препарат №2 содержит ˜10% частиц размером 100-250 нм и ˜90% микрочастиц.
Пример 3. Оценка противомикробной активности препаратов
Определение противомикробной активности стандартных форм рифабутина, циклосерина и образцов препаратов №1 и 2 в отношении тест-культур грамположительных, грамотрицательных и атипичных бактерий осуществляли методом серийных микроразведений в жидкой среде в соответствии с рекомендациями NCCLS [20] при визуальной регистрации видимого роста. Динамическое измерение оптической плотности проводили с помощью многоканального спектрофотометра Bioscreen (Labsystems) при длине волны 610 нм с интервалом 20 мин. Планшеты с бактериальными суспензиями инкубировали при 37°С в термостатируемом модуле прибора. Исходная концентрация микроорганизмов составляла 5×104 КОЕ/мл. Полученные результаты суммированы в таблице 4 и на чертеже.
Приведенные в таблице 4 экспериментальные данные убедительно свидетельствуют о существенном преимуществе заявляемого препарата №1 в сравнении с другими образцами.
spp. - "дикий" штамм (клинический изолят);
б/с - бактериостатическое действие;
б - бактерицидное действие.
Пример 4. Оценка токсичности средства на основе рифабутина
Определение токсичности рифабутина и образцов средства №1 (рифабутин + полимер + вспомогательные вещества) осуществлялось согласно общепринятым методикам [21, 22].
В исследованиях на мышах линии Balb-C и крысах Wistar (животные обоего пола) установлено, что готовый к употреблению препарат (разбавление водой 1:10 средства №1) при однократном введении внутрь в дозе, эквивалентной эффективной разовой терапевтической дозе рифабутина для человека (300 мг), а также в дозах, в 5 и 10 раз ее превосходящих, не проявлял токсического действия и паталогических изменений в печени подопытных лабораторных животных зафиксировано не было, при том что сам рифабутин в указанных дозах проявлял токсические свойства.
Таким образом, заявленная группа изобретений позволяет получать нетоксичный эффективный препарат в виде наночастиц с высокой антибактериальной активностью, который возможно использовать при лечении инфекционных заболеваний и, в частности, вероятно, туберкулеза, который представляет в настоящее время серьезную проблему.
Источники информации
1. РЛС-Энциклопедия лекарств. Изд. 8-е, перераб. и доп. / Гл. ред. Ю.Ф.Крылов. М.: "РЛС-2001", 2000. - С.766.
2. The Merck Index. Twelfth Edition. Monograph Number 8297. MERCK & CO., INC. 1996.
3. Pinto-Alphandary H., Andremont A., Couvreur P. Targeted delivery of antibiotics using liposomes and nanoparticles: research and applications. // Int. J. Antimicrob. Agents. - 2000. - V.13. - N 3. - P.155-168.
4. Гельперина С.Э., Гуляев А.Е., Иванов А.А., Пальцев М.А., Северин Е.С., Скидан И.H. Композиция для лечения легочных инфекций. / Патент РФ №2185818. - 2001 г.
5. Khuller G.К., Pandey R. Sustained release drug delivery systems in management of tuberculosis. // J. Chest Dis. Allied Sci. - 2003. - V.45. - P.229-230.
6. Pandey R., Zahoor A., Sharma S., Khuller G.K. Nanoparticle encapsulated antitubercular drugs as a potential oral drug delivery system against murine tuberculosis. // Tuberculosis. - 2003. - V.83. N6. - P.373-378.
7. Оганесян Е.А., Будько А.П., Стукалов Ю.В. и др. Разработка и изучение наносомальной лекарственной формы рифампицина. // Антибиотики и химиотерапия. - 2005. - Т.50. - №8-9. - С.15-19.
8. Скидан И.H., Гелъперина С.Э., Севериин С.Е., Гуляев А.Е. Повышение антибактериальной активности рифампицина в отношении внутриклеточных инфекций с помощью биодеградируемых наночастиц. // Антибиотики и химиотерапия. - 2003. - №1. - С.23-26.
9. Штилъман М.И. Полимеры медико-биологического назначения. М.: Академкнига. - 2006. - 400 с.
10. Moghimi S.М., Hunter А.С., Murrey J.C. Long-circulating and targetspecific nanoparticles: theory to practice. // Pharmacol. Rev. - 2001. - V.53. - P.283-318.
11. Машковский М.Д. Лекарственные средства. В двух частях. Ч.1. / 12-е изд., перераб. и доп. М.: Медицина. - 1993. - С.586-597.
12. Фанг Джиа-Хва, Сингх Манмохан, О'Хейган Дерек, Хора Маниндер. Композиции микрочастиц и способы их получения. / Патент РФ №2257198. - 2005 г.
13. Сиджфрид К. Джун. Частицы, включающие плохорастворимое кристаллическое терапевтическое или диагностическое средство и способ их получения. / Патент РФ №2124886. - 1999 г.
14. Вранкс А., Делустье М., Делеер М. Фармацевтический состав, содержащий нанокапсулы, и способ его получения. / Патент РФ №2145498. - 1994 г.
15. Кукушкин Ю.H. Диметилсульфоксид - важнейший апротонный растворитель. // Соросовский образовательный журнал. - 1997. - №9. - С.54-59.
16. Оаэ С. Химия органических соединений серы. / Пер. с японск. М.: Мир, 1975. - С.223-278.
17. Инструкция по медицинскому применению препарата ДИМЕКСИД. Регистрационный номер: PN 003411/01 от 22.04.2005.
18. Yu Z.W., Quinn P.J. Dimethyl sulphoxide: a rewiew of its applications in cell biology. // Biosci. Rep.- 1994. - V.14. - P.259-281.
19. Собетов Б.Г., Собетова В.Б., Алексеевич Я.И., Озеров Б.Г., Меркулов С.П. Способ получения инъекционной формы дисульфирама. / Патент РФ №2013090. - 1994 г.
20. National Committee for Clinical Laboratory Standards. 1997. Method for dilution antimicrobial susceptibility test for bacteria that grow aerobically. Approved Standard M-7-A4. / 4 th ed. Villanova.
21. Лабораторные животные: Положение и руководство. / Под ред. Н.Н.Каркищенко. М.: 2003. - 138 с.
22. Принципы и методы оценки токсичности химических веществ. Ч.1. Совместное издание программы ООН по окружающей среде и Всемирной организации здравоохранения. ВОЗ. Женева. - 1981.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОТИВОМИКРОБНОГО ДЕЙСТВИЯ, СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА НАПРАВЛЕННОГО ДЕЙСТВИЯ, СОДЕРЖАЩЕГО НАНОЧАСТИЦЫ | 2007 |
|
RU2327459C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ D-ЦИКЛОСЕРИНА, ПРЕПАРАТ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ, СОДЕРЖАЩИЙ НАНОЧАСТИЦЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2007 |
|
RU2318513C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2007 |
|
RU2337711C1 |
| Лекарственный препарат противотуберкулезного действия на основе D-циклосерина в виде лиофилизата и способ получения лекарственного препарата | 2015 |
|
RU2606839C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ ДЛЯ ЛЕЧЕНИЯ РЕЗИСТЕНТНЫХ ФОРМ ТУБЕРКУЛЕЗА НА ОСНОВЕ РИФАМПИЦИНА | 2010 |
|
RU2418585C1 |
| АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИЙ | 2006 |
|
RU2308970C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ С ДОЗИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ В ОРГАНЫ-МИШЕНИ НА ОСНОВЕ D-ЦИКЛОСЕРИНА ДЛЯ ЛЕЧЕНИЯ РЕЗИСТЕНТНЫХ ФОРМ ТУБЕРКУЛЕЗА | 2008 |
|
RU2403041C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2011 |
|
RU2472512C1 |
| Способ оценки антимикобактериального действия противотуберкулезных препаратов с использованием биологического материала пациентов, больных туберкулезом легких | 2017 |
|
RU2677972C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НА ОСНОВЕ ГЛИЦИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2011 |
|
RU2457835C1 |
Изобретение относится к медицине и фармакологии и может быть использовано для лечения инфекционных заболеваний и, в частности, туберкулеза. Настоящее изобретение представляет собой лекарственное средство, содержащее рибафутин, сополимер молочной и гликолевой кислот (PLGA 50/50), D-маннит, полисорбат-80 и диметилсульфоксид, а также способ его получения, заключающийся в том, что смесь из рифабутина, PLGA 50/50, D-маннита, полисорбата-80 и ДМСО нагревают при 50÷60°С и перемешивают до полного растворения твердой фазы, после чего охлаждают до комнатной температуры, при добавлении к полученной смеси воды в соотношении 1:20 до 1:10 получают суспензию наночастиц размером ˜200÷400 нм. Изобретение обеспечивает создание лекарственного средства и препарата на основе рифабутина, уменьшающего токсичность активного вещества при сохранении противомикробной активности, а также стабильность при хранении и упрощение получения готовой лекарственной формы. 3 н.п. ф-лы, 4 табл., 1 ил.
| ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ПЛОХО РАСТВОРИМОЕ КРИСТАЛЛИЧЕСКОЕ ТЕРАПЕВТИЧЕСКОЕ ИЛИ ДИАГНОСТИЧЕСКОЕ СРЕДСТВО, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2124886C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2240795C9 |
| WO 9702039 A1, 23.01.1997 | |||
| US 5145684 A, 08.09.1992 | |||
| Pandey R | |||
| et al | |||
| "Oral poly(lactide-co-glycolide) nanoparticle based antituberculosis drug delivery: toxicological and chemotherapeutic implications.", Indian J Exp Biol, 2006 Jun; 44(6):459-67. | |||
Авторы
Даты
2008-06-27—Публикация
2007-06-26—Подача