Область техники, к которой относится изобретение
Настоящее изобретение касается печеночных стволовых клеток человека, то есть плюрипотентных клеток, дающих начало зрелым клеткам печени. К ним относятся две популяции стволовых клеток: очень примитивные предшественники - стволовые клетки дуктальной пластинки, дающие начало проксимальным печеночным стволовым клеткам, и проксимальные стволовые клетки, дающие начало гепатоцитам и клеткам желчных протоков. Настоящее изобретение также касается способов выделения печеночных стволовых клеток дуктальной пластинки человека и выделения проксимальных печеночных стволовых клеток и коммитированных предшественников гепатоцитов и коммитированных предшественников желчных протоков.
Композиции, содержащие клетки по настоящему изобретению, могут применяться для клеточной и генной терапии и для создания искусственных органов.
Уровень техники
1. Анатомия печени человека
Первичной структурной и функциональной единицей зрелой печени является долька, которая на поперечном срезе организована как колесо вокруг двух отдельных сосудистых русел: на периферии 3-7 групп воротных триад (каждая состоит из воротной венулы, печеночной артериоли и желчного протока), а посередине - центральная вена. Печеночные клетки организованы в виде перекладин (балок), которые с обеих сторон окаймлены продырявленным эндотелием, образуя ряд лакун, примыкающих к сети воротных и центральных сосудов. Последние данные показывают, что геринговы каналы - небольшие протоки, располагающиеся вокруг каждой воротной триады, - образуют крохотные канальцы, которые разветвляются и доходят до печеночных перекладин по всей зоне 1, образуя рисунок типа "ершика" (Theise N. 1999 Hepatology 30: 1425-1433).
Ограниченное пространство - пространство Диссе отделяет эндотелий от гепатоцитов по всей лакуне. Вследствие такого строения гепатоциты имеют два базальных домена, каждый из которых выходит на лакуну, и апикальный домен, который определяется зоной контакта между соседними гепатоцитами. Базальные домены соприкасаются с кровью и участвуют во всасывании и секреции компонентов плазмы, тогда как апикальные домены образуют желчные капилляры, специализирующиеся на секреции желчных солей и связанные через соединительную сеть с желчными протоками. Кровь из воротных венул и печеночных артериолей проходит через лакуны к терминальным печеночным венулам и центральной вене.
В соответствии с особенностями микроциркуляции лакуна подразделяется на три зоны: зона 1, прилегающая к воротным венулам, зона 2 в центральной части лакуны и зона 3 вокруг центральной части. Пролиферативный потенциал, морфологические критерии, плоидность и большинство специфических генов печени коррелируют с зональностью (Gebhardt R. et al. 1988 FEBS Lett. 241-89-93; Gumucio J.J. 1989, Vol.19, Springer International, Madrid; Traber P. et al. 1988 Gastroenterology 95: 1130-43). Градиенты концентрации компонентов крови, в том числе кислорода, через лакуну и в направлении кровотока из воротных триад к центральной вене отчасти ответственны за эту зональность, например, взаимнообратная компартментация гликолиза и глюконеогенеза. Тем не менее, приуроченность белка щелевых соединений коннексина 26 к воротным венулам и глутаминсинтетазы к перицентральной зоне, даже если ограничиться только двумя белками, нечувствительно к таким градиентам, более характерно для большинства тканеспецифичных генов и, по-видимому, определяется присущими клеткам факторами или другими параметрами, помимо кровотока в ближайшем окружении.
Наряду с гепатоцитами, эпителиальными клетками желчных протоков (холангиоцитами) и эндотелиальными клетками между воротной и центральной зоной содержатся и другие типы клеток, такие как клетки Ито и купферовы клетки. Они играют заметную роль в патогенных состояниях печени, особенно в воспалении и фиброзе, но их прямой вклад в основные гомеостатические функции нормального органа, по-видимому, невелик.
2. Онтогенез печени человека
Печень образуется в результате замыкания дивертикула, формирующегося из хвостового отдела головной кишки и septum transversum мезенхимы спланхноплевры. Образование печеночных клеток начинается после взаимодействия эндодермального эпителия с кардиогенной мезодермой, вероятно, при посредстве факторов роста фибробластов. Затем определенные печеночные клетки пролиферируют и проникают в мезенхиму septum transversum в виде тяжа, образуя зачаток печени. Прямое взаимодействие между эпителием и мезенхимой играет решающую роль на этих ранних стадиях онтогенеза печени и оно определяет, какие клетки станут гепатоцитами или холангиоцитами и продырявленным эндотелием, соответственно. Мутации в специфических генах мезенхимы hlx и jumonji блокируют развитие печени, что подчеркивает важность вклада этой ткани. В начале онтогенеза печень состоит из скоплений проксимальных стволовых клеток печени, окруженных сплошным слоем эндотелия без базальной мембраны и многочисленными кроветворными (гемопоэтическими) клетками. По мере того как этот эндотелий превращается в прерывистый, продырявленный эндотелий, становится более развитой сосудистая сеть, особенно воротная система, вместе с образованием базальных мембран. Интерстиций воротных сосудов, возможно, запускает образование желчных протоков, и по мере того как он окружает воротные венулы, печеночные артериоли и желчные протоки, формируются воротные триады. Происходит быстрая пролиферация проксимальных стволовых клеток печени и формирование паренхимальных перекладин, вероятно, в ответ на изменение количества и распределения таких тканеорганизующих молекул, как С-САМ 105, Agp 110, Е-кадгерин и коннексины, одновременно с перемещением большей части, но не всех кроветворных клеток в костный мозг. Последние исследования свидетельствуют, что часть гемопоэтических предшественников остается в печени взрослых грызунов в покое, и кроветворные клетки выделяли из печени человека и мышей (Crosbie O.M. et al. 1999 Hepatology 29: 1193-8).
Печень крыс формируется примерно на 10-й день эмбриональной жизни, что обозначается как "эмбриональный день 10" или Е10, путем обволакивания сердечной мезенхимы эндодермой в области средней кишки зародыша (Zaret К. 1998 Current Opinion in Genetics & Development 8: 526-31). Самый ранний момент обнаружения клеток печени был достигнут методом гибридизации in situ мРНК, кодирующей α-фетопротеин (Zaret К. 1988 Current Opinion in Genetics & Development 8: 526-31; Zaret К. 1999 Developmental Biology (Orlando) 209: 1-10)). AFP-экспрессирующие клетки наблюдаются в области средней кишки зародыша вблизи от мезенхимы, из которой образуется сердце на 9-10-й день в печени всех исследованных крыс и мышей. Печень становится видимой без микроскопа в день Е12 и имеет диаметр около 1 мм в день Е13.
Параллельно происходит гемопоэз, причем первые узнаваемые кроветворные клетки появляются в день Е15-Е16 (у грызунов) и на 3-4 месяц (у человека), а пик эритропоэза (образования эритроидных клеток или эритроцитов) происходит в день Е18 (у грызунов) и на 5-6 месяц (у человека). На пике эритропоэза в печени преобладают многочисленные эритроциты, которые составляют более 70% числа клеток в печени. Конец эмбрионального периода приходится на день 21 у грызунов и на 9 месяц у человека. Через несколько после рождения число кроветворных клеток резко падает, так что на 2-й день (у грызунов) и через 1-2 недели (у человека) подавляющее большинство кроветворных клеток исчезает после миграции в костный мозг. Причины миграции кроветворных клеток неизвестны. Однако преобладают две гипотезы.
Во-первых, гемопоэтические предшественники предпочитают сравнительно анаэробные условия, и большинство их мигрирует в костный мозг (в котором условия относительно анаэробны) при повышении уровня кислорода в печени при активации легких. Кроме того, существует мнение, что исчезновение гормонов беременности также может быть фактором при миграции. После рождения исчезновение гемопоэтических предшественников в печени коррелирует с резким уменьшением числа печеночных предшественников и параллельным возрастанием числа и зрелости гепатоцитов и клеток желчных протоков. Полное созревание печени наступает через 2-3 недели после рождения (у грызунов) и через несколько месяцев (у человека). К этому времени остальные предшественники печеночных клеток локализуются в области геринговых каналов, причем большое число их находится в воротных триадах по периметру каждой дольки печени (Thiese et al., Crawford et al.).
После этого устанавливается классическая архитектура долек печени - каждая долька определяется по периметру шестью группами воротных триад, каждая из которых имеет желчный проток, печеночную артерию и печеночную вену, а посередине - центральную вену, которая соединяется с полой веной. Перекладины из печеночных клеток, как спицы в колесе, идут из периферии к центру. Условно эти перекладины подразделяют на три зоны: зона 1 находится вблизи от воротных триад, зона 2 посреди лакуны и зона 3 - около центральной вены. Единственные диплоидные клетки печени находятся в зоне 1, тетраплоидные клетки - в зоне 2, а тетраплоидные, октаплоидные и многоядерные клетки - в зоне 3. Такая картина сильно напоминает созревание зародышевых линий (рядов), которое завершается процессом апоптоза (Sigal S.H.S. et al. 1995 Differentiation 59: 35-42).
3. Заболевания печени
Каждый год в США около 250 000 людей попадают в больницу из-за печеночной недостаточности. Пересадка печени излечивает некоторые формы печеночной недостаточности, и в США проводится примерно 4100 трансплантаций в год. Одним из лимитирующих факторов при пересадке печени является наличие донорской печени, особенно учитывая то, что донорская печень для трансплантации органа должна происходить из пациента, подвергнувшегося смерти мозга, но не остановке сердца. Печени из трупов оказались бесполезными, хотя последние работы по их применению подтверждают возможность их использования, если печень получена в пределах одного часа после смерти.
Трансплантация клеток в печень является привлекательной альтернативой при лечении большинства заболеваний печени. Хирургические процедуры при трансплантации клеток несложны по сравнению с теми, что необходимы при пересадке целого органа, поэтому они могут применяться у пациентов с различными факторами риска для операции, такими как возраст или недомогание. Применение печеночных клеток человека предпочтительно по сравнению с печеночными клетками из других млекопитающих, так как потенциальные патогены, если они есть, - это патогены человека, которые будут легче переноситься пациентами и которые будет легче скринировать перед использованием.
В опытах по проведению трансплантации печеночных клеток использовались нефракционированные зрелые печеночные клетки и они в некоторой степени оказались эффективными (Fox I.J. et al. 1998 New England Journal of Medicine 338: 1422-1426). Однако для успеха требуется введение большого числа клеток (2×1010), так как они не растут in vivo. Кроме того, введение значительного числа больших зрелых печеночных клеток (средний диаметр 30-50 мкм) осложняется тем, что они обычно образовывают крупные агрегаты при введении, что может привести к смертельной эмболии. Более того, эти клетки вызывают заметную иммунологическую реакцию отторжения, что заставляет держать пациентов на иммунодепрессантах на всю оставшуюся жизнь. Наконец, зрелые клетки печени не удается сохранить при криогенной температуре, и требуется сложная организация снабжения для координации получения подходящей печеночной ткани, получения клеточных суспензий и немедленной доставки клеток в клинику для терапии.
4. Тотипотентные стволовые клетки
Стволовые клетки представляют собой альтернативную клеточную терапию для заболеваний печени. Тотипотентные стволовые клетки - это примитивные клетки, которые способны к саморепликации, плюрипотентны, то есть образуют дочерние клетки, имеющие более чем одну судьбу, и которые способны к широкой экспансии и могут дать начало детерминированным стволовым клеткам, способным восстановить ткань или ткани. Большая часть литературы по стволовым клеткам происходит либо из литературы по эмбрионам, либо по кроветворным, эпидермальным или кишечным тканям.
В последнее время эти определения были модифицированы с учетом конкретных классов стволовых клеток. Клетки, способные участвовать в образовании всех типов клеток, в том числе зародышевых клеток, называют тотипотентными стволовыми клетками, и к ним относятся зиготы и нормальные эмбриональные клетки вплоть до 8-й стадии (морулы). Эмбриональные стволовые клетки, также именуемые клетками "ES", состоят из перманентных клеточных популяций, происходящих из тотипотентных, нормальных клеток в бластоцистах, о которых впервые стало известно в начале 1980-х. Линии клеток ES можно культивировать in vitro с сохранением тотипотентности. При введении клеток ES обратно в нормальные бластоцисты они могут возобновить эмбриональное развитие и участвовать в образовании нормальной, но химерной мыши. Несмотря на то, что были получены линии клеток ES из многих видов (мышей, крыс, свиней и т.д.), только мышиная система использовалась на практике для создания животных с новыми фенотипами (нокауты, трансгены) путем слияния модифицированных в культуре клеток ES с бластоцистами и последующего имплантирования этих бластоцистов в ложнобеременный организм. Линии эмбриональных зародышевых (EG) клеток, проявляющих многие характеристики клеток ES, могут быть выделены in vitro непосредственно из популяции первичных зародышевых клеток. Как и клетки ES, клетки EG способствуют образованию химер, включающих клетки зародышевой линии, при введении их в бластоциты.
Недавно стало известно о широко разрекламированных экспериментах, в которых были получены культуры клеток ES человека из зародышей человека. Предполагается, что эти клетки ES человека могут быть введены в ткани в надежде, что они смогут восстановить поврежденные органы и ткани. Однако клетки ES и EG онкогенны при введении в организм с ослабленной иммунной системой в любое место, кроме как in utero, образуя тератокарциномы. Поэтому планы инокулировать клетки ES человека пациентам нереалистичны и имеют серьезную вероятность образования опухолей у пациентов. Чтобы преодолеть это затруднение, некоторые группы планируют подвергнуть клетки ES дифференцировке в определенных условиях микроокружения и получить детерминированные стволовые клетки, которые затем могут быть инокулированы пациентам. Например, есть определенные успехи в создании гемопоэтических предшественников. Однако остаются опасения, что остающиеся в культуре клетки ES могут представлять опасность онкогенеза при инокуляции этих культур пациентам. Итак, до тех пор, пока исследования в биологии развития не откроют те мириады контрольных механизмов, которые определяют судьбу клеток при эмбриогенезе, клетки ES будут оставаться только экспериментальным средством без особой надежды на клинические программы в области клеточной или генной терапии. Единственная практическая альтернатива для клинических программ по клеточной или генной терапии - это использование детерминированных стволовых клеток, у которых генетический потенциал ограничен небольшим числом типов клеток.
5. Детерминированные стволовые клетки
Детерминированные стволовые клетки - это плюрипотентные клетки, у которых генетический потенциал ограничивается небольшим числом типов клеток и которые обладают большим потенциалом роста. Появляется все больше данных, например, из области исследований теломеразы, свидетельствующих о том, что детерминированные стволовые клетки, собственно говоря, не способны к саморепликации, то есть их потомство обладает меньшим потенциалом роста, чем родители. Детерминированные стволовые клетки дают начало коммитированным предшественникам - дочерним клеткам, теряющим плюрипотентность путем ограничения своего генетического потенциала одним определенным типом, например, гепатоцитами, коммитированные предшественники которых называют коммитированными предшественниками гепатоцитов. В зародышевой линии печени имеются коммитированные предшественники гепатоцитов (дающие начало гепатоцитам) и коммитированные предшественники желчных клеток (дающие начало желчным протокам).
Превращение стволовой клетки в зрелую клетку происходит скачкообразно и дает зародышевую линию, в которой размер клеток, морфология, потенциал роста и экспрессия генов привязаны к происхождению. Для определения этого процесса полезно использовать метафору старения. "Молодые" клетки обладают ранней экспрессией генов и максимальным потенциалом роста; клетки на поздних стадиях обладают "поздней" экспрессией генов и обычно ограничены в росте или вовсе не растут. Поздние клетки могут рассматриваться как "старые" либо, в биологическом смысле, апоптозные, и они в конечном счете отпадают. Процесс созревания зародышевой линии (ряда) ведет к естественному кругообороту ткани и дает возможность регенерации после повреждения. Ткани отличаются по кинетике процесса созревания. Процесс созревания в кишечной линии весьма быстр: полный цикл протекает менее чем за неделю; созревание же печени происходит медленно, составляя около года у печени крыс.
Существует большой клинический и коммерческий интерес к выделению и идентификации незрелых клеток-предшественников из печени потому, что такие популяции клеток могут оказать большое влияние на лечение заболеваний печени. Применение печеночных предшественников в клеточной и генной терапии поможет преодолеть многие недостатки, связанные с применением зрелых печеночных клеток, как описано выше. Эти клетки небольшие (7-15 мкм), что сводит к минимуму возникновение серьезной эмболии. К тому же эти клетки обладают большим потенциалом роста, а это значит, что потребуется меньшее число клеток для восстановления ткани печени у пациента. Наконец, предшественники имеют минимальный набор антигенных маркеров, которые могут вызвать иммунологическое отторжение, а это дает надежду, что иммунодепрессантные препараты могут не потребоваться.
6. Выделение печеночных предшественников
Как известно, выделение печеночных предшественников из печени является чрезвычайно трудной задачей вследствие того, что не хватает маркеров, позволяющих проводить положительный отбор печеночных клеток. Единственные антитела, которые имеются для отбора печеночных предшественников, - это моноклональные антитела, полученные против субпопуляций печеночных предшественников, называемых овальными клетками, если они выделены из организма, подвергнувшегося онкогенной обработке. Но эти антитела дают перекрестную реакцию с антигенами кроветворных клеток.
Термин овальные клетки вытекает из многочисленных исследований в области онкогенеза и карциногенеза. При воздействии карциногенов и прочих онкогенных воздействиях происходит резкое сокращение числа зрелых печеночных клеток (они погибают от различных воздействий) и, во-вторых, экспансия мелких клеток (диаметром 7-15 мкм), имеющих овальные ядра и несущих маркеры, включающие как печеночные, так и гемопоэтические антигены (Grisham and Thorgeirrson, 1998). Изучение овальных клеток привело к гипотезе о том, что они являются печеночными предшественниками, которые переходят к экспансии в условиях онкогенных воздействий и в соответствующих условиях могут превращаться в раковые клетки. Фенотип овальных клеток подвержен тонким и не очень тонким вариациям в зависимости от онкогенного воздействия. Более того, известно, что они легко поддаются культивированию без применения специальных питающих клеток или сред (J.Grisham and S. Thorgeirrson, 1998, Hepatic Stem Cells, in: Stem Cells, C.Potten, editor, Academic Press, NY). На основании этих данных и исследований по изучению некоторых клеточных линий, полученных при онкогенных воздействиях, был сделан вывод, что опухоли печени представляют собой подвергнувшиеся злокачественной трансформации предшественники и что овальные клетки - это частично или полностью трансформированные предшественники (Zvibel I, Fiorino A, Brill S and Reid LM. Phenotypic characterization of rat hepatoma cell lines and lineage-specific regulation of gene expression by differentiation agents. Differentiation 63: 215-223, 1999).
В прошлом предпринимались попытки получить популяцию предшественников печеночных клеток, которые считаются наиболее универсальной популяцией для клеточной и генной терапии печени. В патентах США 5576207 и 5789246 (Reid et al.) использовались маркеры клеточной поверхности и проточная цитометрия с боковым светорассеянием для получения определенной субпопуляции из печени. Субпопуляции печеночных клеток крыс выделяли путем удаления коммитированных в определенном направлении клеток с последующим отбором незрелых предшественников клеток печени, которые определяли как агранулярные клетки, дающие положительную реакцию на маркеры ОС.3 (антигенный маркер овальных клеток), AFP, альбумин и отрицательную реакцию на СК19 (цитокератин 19). Вышеуказанные субпопуляции из печени крыс проявляют особые характеристики, которые важны при выделении и идентификации обогащенной фракции печеночных предшественников из печени грызунов.
Таким образом, существует потребность в разработке способов выделения предшественников из печени человека, которые можно было бы использовать для лечения пациентов с заболеваниями или дисфункцией печени. Настоящее изобретение удовлетворяет эту потребность, а также предоставляет способы лечения.
Раскрытие изобретения
Настоящее изобретение направлено на получение композиции, включающей примитивные печеночные стволовые клетки человека, которые являются предшественниками проксимальных печеночных стволовых клеток, предшественников гепатоцитов или предшественников желчных протоков. Примитивные печеночные стволовые клетки человека по изобретению экспрессируют Ер-САМ, АС133 и альбумин.
Следующее воплощение настоящего изобретения - композиция, включающая проксимальные печеночные стволовые клетки человека, которые являются предшественниками предшественников гепатоцитов или предшественников желчных протоков. Проксимальные печеночные стволовые клетки человека по изобретению экспрессируют α-фетопротеин, альбумин и цитокератин 19.
Следующее воплощение настоящего изобретения - способ выделения печеночных предшественников человека, включающий идентификацию клеток, экспрессирующих Ер-САМ и АС133. Печеночные предшественники человека, выделенные настоящим способом, предпочтительно экспрессируют альбумин. В предпочтительном воплощении настоящего изобретения выделенные печеночные предшественники человека представляют собой стволовые клетки, предпочтительно примитивные печеночные стволовые клетки или проксимальные печеночные стволовые клетки.
Следующее воплощение настоящего изобретения - способ выделения примитивных печеночных стволовых клеток человека, включающий культивирование смеси клеток, полученных из печеночной ткани человека, на поверхности в условиях, способствующих селекции печеночных стволовых клеток, в бессывороточной среде, содержащей регулятор углеводного метаболизма, переносчик железа и мембранообразующий фактор, при этом образуется колония, содержащая примитивные печеночные стволовые клетки человека. В предпочтительном воплощении настоящего изобретения выделенные примитивные печеночные стволовые клетки человека экспрессируют Ер-САМ, АС133 и альбумин, а также предпочтительно еще экспрессируют цитокератин 8/18 и цитокератин 19.
Следующее воплощение настоящего изобретения - способ выделения проксимальных печеночных стволовых клеток человека, включающий культивирование смеси клеток, полученных из печеночной ткани человека, на поверхности в условиях, способствующих селекции печеночных стволовых клеток, в бессывороточной среде, содержащей регулятор углеводного метаболизма, переносчик железа и мембранообразующий фактор, при этом образуется колония, содержащая примитивные печеночные стволовые клетки человека, и культивирование клеток из этой колонии в присутствии фактора дифференцировки. В предпочтительном воплощении настоящего изобретения выделенные проксимальные печеночные стволовые клетки человека экспрессируют α-фетопротеин, альбумин и цитокератин 19. В предпочтительном воплощении настоящего изобретения фактор дифференцировки обеспечивают вторичные клетки, предпочтительно питающие клетки, предпочтительно питающие клетки STO, эндотелиальные клетки или стромальные клетки.
Следующее воплощение настоящего изобретения - способ выделения проксимальных печеночных стволовых клеток человека, включающий культивирование смеси клеток, полученных из печеночной ткани человека, в условиях, способствующих селекции печеночных стволовых клеток, в бессывороточной среде, содержащей регулятор углеводного метаболизма, переносчик железа и мембранообразующий фактор, при этом образуется колония, содержащая примитивные печеночные стволовые клетки человека, и культивирование клеток из этой колонии в присутствии фактора дифференцировки. В предпочтительном воплощении настоящего изобретения выделенные проксимальные печеночные стволовые клетки человека экспрессируют α-фетопротеин, альбумин и цитокератин 19. В предпочтительном воплощении настоящего изобретения фактор дифференцировки обеспечивают вторичные клетки, предпочтительно питающие клетки, предпочтительно питающие клетки STO, эндотелиальные клетки или стромальные клетки.
Следующее воплощение настоящего изобретения - выделенные примитивные печеночные стволовые клетки. Еще одно воплощение настоящего изобретения - выделенные проксимальные печеночные стволовые клетки человека.
Краткое описание фигур
Фиг.1. Образование колоний на пластиковой чашке из обогащенных эмбриональных паренхимальных клеток на 1-й (верхняя часть) и 5-й (нижняя часть) день культивирования.
Фиг.2. Образование колонии на пластиковой чашке с 5-го по 14-й день культивирования.
Фиг.3. Поведение колоний на пластиковой чашке.
Фиг.4. Окрашивание клеток колонии на пластиковой чашке на альбумин (1 ряд), СК19 (2 ряд), Ер-САМ (3 ряд) и NCAM (4 ряд).
Фиг.5. Окрашивание колоний на пластиковой чашке на CD146 и CD133 (наверху) и АС133 (внизу).
Фиг.6. Первичная культура проксимальных стволовых клеток через 7 дней на слое питающих клеток STO при окрашивании на альбумин (1 ряд), α-фетопротеин (2 ряд) и СК19(3 ряд).
Фиг.7. Развитие клеток из колонии, перенесенных из пластиковой чашки, на слое питающих клеток STO.
Фиг.8-11. Появление клеток из колонии на слое питающих клеток STO.
Фиг.12-13. Обогащение экспрессирующих AFP клеток в клетках печени человека.
Фиг.14-18. Выделение субпопуляции клеток печени взрослого человека, одновременно экспрессирующих альбумин, CD133 и Ер-САМ.
Фиг.19. Кривая роста 9 колоний стволовых клеток из 3 печеней при культивировании на пластиковых чашках в течение 3 недель. Измерения роста были начаты после 12 дней культивирования. Из кривой видно, что число клеток удваивается за 5,2 дня.
Фиг.20. Экспрессия альбумина (ALB, верхняя группа) и α-фетопротеина (AFP, нижняя группа) методом Westem-гибридизации на свежевыделенных эмбриональных клетках печени и при последующем культивировании на пластиковом субстрате.
В группе слева показаны две фракции клеток (Р и I) в соответствии с центрифугированием через фиколл. Клетки, уходящие в осадок через фиколл, обозначены как Р, а клетки, образующие слой на границе между водной средой и фиколлом, обозначены как I. На одиночном среднем блоте показана экспрессия альбумина и AFP в очищенных клетках из колонии (примитивные печеночные стволовые клетки) после культивирования на пластике в течение 3 недель. В правой части представлены контрольные дорожки, на которых либо не было белка (blank), либо были стандарты альбумина (ALB) или α-фетопротеина (AFP). На каждую дорожку наносили 10 мкг белка.
Подробное описание изобретения
1. Определения
В нижеследующем описании широко используется ряд терминов для описания изобретения. Для того чтобы обеспечить четкое и непротиворечивое понимание описания и формулы изобретения, в том числе и сферы действия таких терминов, даются следующие определения.
CD. "Кластер дифференцировки" или "общий детерминант" в применении к настоящему изобретению относится к молекулам клеточной поверхности, распознаваемым моноклональными антителами. Экспрессия некоторых CD специфична для клеток определенной зародышевой линии или ряда, а экспрессия других варьирует в зависимости от состояния активации, положения или дифференцировки одних и тех же клеток.
Клеточная терапия. В применении к настоящему изобретению термин "клеточная терапия" относится к переносу in vivo или ex vivo определенной популяции клеток, используемых в качестве аутологического или аллогенного материала и трансплантируемых в или около определенных клеток-мишеней пациента. Клетки могут быть трансплантированы в любой подходящей среде, носителе или разбавителе, либо в системах доставки лекарств любого типа, включая микроносители, шарики, микросомы, микросферы, везикулы и т.п. Они также могут применяться в биореакторе, в котором они будут обеспечивать критические функции, а биореактор будет использоваться в качестве вспомогательного устройства для пациентов с дисфункцией печени.
Коммитированные предшественники. Сильно пролиферирующие клетки, дающие начало дочерним клеткам, имеющим только одну судьбу. "Коммитированные предшественники желчных протоков" дают начало желчным протокам и в отношении антигенов отличаются экспрессией цитокератина 19, но не AFP. "Коммитированные предшественники гепатоцитов" дают начало гепатоцитам и в отношении антигенов отличаются экспрессией AFP и альбумина, но не цитокератина 19. Процесс коммитирования еще не раскрыт на молекулярном уровне. Скорее он определяется лишь эмпирически, когда происходит сужение судьбы клеток по сравнению с их предками.
Генная терапия. В применении к настоящему изобретению термин "генная терапия" относится к переносу in vivo или ех vivo определенного генетического материала в определенные клетки-мишени пациента, в результате чего изменяется генотип и, в большинстве случаев, изменяется фенотип этих клеток-мишеней с конечной целью предупреждения или изменения конкретного заболевания. Она может включать модифицирование клеток-мишеней ех vivo и введение их пациенту. В качестве альтернативы в клетки-предшественники печени может быть направлен вектор in vivo для доставки чужеродного генетического материала и трансфекции клеток-предшественников. Кроме того, генетически модифицированные клетки-предшественники могут быть использованы в биореакторе в качестве терапии для пациентов или источника биологических препаратов. Согласно данному определению основополагающий принцип состоит в том, что эти терапевтические генетические процедуры предназначаются в конечном счете для предупреждения, лечения или изменения явного или скрытого патологического состояния. В большинстве случаев конечная терапевтическая цель процедур генной терапии заключается в изменении фенотипа определенной популяции клеток-мишеней.
Печеночные клетки. Субпопуляция клеток печени, включающая гепатоциты и клетки желчных протоков.
Печеночные предшественники. Субпопуляция стволовых клеток, в конечном счете дающих начало зрелым паренхимальным клеткам, которые включают гепатоциты и клетки желчных протоков. Печеночные предшественники включают следующие две субпопуляции: (а) печеночные стволовые клетки и (б) коммитированные предшественники.
Печеночные стволовые клетки. Субпопуляция печеночных предшественников, включающая "примитивные печеночные стволовые клетки" и "проксимальные печеночные стволовые клетки".
Клетка-предшественник. В применении к настоящему изобретению термин "клетка-предшественник" относится к первому типу клеток, который дает начало второму типу клеток. Клетка-предшественник также может дать начало второму типу клеток через один или несколько промежуточных типов клеток.
Примитивные печеночные стволовые клетки. В применении к настоящему изобретению термин "примитивные печеночные стволовые клетки" относится к тем печеночным стволовым клеткам, которые дают начало проксимальным печеночным стволовым клеткам.
Проксимальные печеночные стволовые клетки. В применении к настоящему изобретению термин "проксимальные печеночные стволовые клетки" относится к тем печеночным стволовым клеткам, которые дают начало гепатоцитам и эпителиальным клеткам желчных протоков.
Клетки печени. В применении к настоящему изобретению термин "клетки печени" относится ко всем типам клеток, находящихся в нормальной печени, независимо от их происхождения или судьбы.
Стволовые клетки. В применении к настоящему изобретению термин "стволовые клетки" относится к сильно пролиферирующим клеткам, которые дают начало дочерним клеткам, имеющим более чем одну судьбу, то есть они плюрипотентны. Тотипотентные стволовые клетки, такие как эмбриональные стволовые клетки (клетки ES) или эмбриональные клетки вплоть до 8-клеточной стадии зародыша млекопитающих, обладают способностью к самовозобновлению, то есть стволовая клетка образует дочернюю клетку, идентичную самой себе. Напротив, детерминированные стволовые клетки, такие как гемопоэтические, нейрональные, кожные или печеночные стволовые клетки, - плюрипотентны и обладают большим потенциалом роста, но их способность к самовозобновлению проблематична. В случае тотипотентных стволовых клеток некоторые дочерние клетки идентичны родительским, а некоторые "коммитируют себя" в определенном направлении, ограничивая свой генетический потенциал тем, что он становится меньше родительского. В случае детерминированных стволовых клеток некоторые дочерние клетки сохраняют плюрипотентность, а некоторые теряют, коммитируя себя в единственном, определенном направлении.
При использовании выражений "один", "один из", "некоторый" в данном описании они означают "по меньшей мере, один" либо "один или несколько", если не указано иначе.
2. Диагностические маркеры клеток печеночного ряда
Альфа-фетопротеин (AFP) и альбумин, оба - цитоплазматические белки, являются особенно надежными маркерами клеток печеночного ряда при определении их в виде белков. Матричные РНК, кодирующие другие варианты этих белков, экспрессируются в гемопоэтических предшественниках, но не транслируются; например, мРНК одного варианта AFP отличается от мРНК в печеночных клетках тем, что кодируемые экзоном 1 последовательности заменены либо другим экзоном 1, либо двумя экзонами (Kubota, Storm and Reid, submitted; также в патентной заявке). Таким образом, экспрессия этих двух белков лежит в основе идентификации печеночных субпопуляций от других типов клеток в печени. В онтогенезе печени присутствие AFP и альбумина считается сильным положительным индикатором печеночных клеток-предшественников. На ранних стадиях онтогенеза печени эти клетки способны образовывать потомство, которое входит в зародышевые линии и желчных клеток, и гепатоцитов. Если эти дочерние клетки коммитируют себя в желчный ряд, то экспрессия AFP прекращается. Но в линии гепатоцитов экспрессия AFP сохраняется вплоть до перинатального периода, когда она подавляется и экспрессия альбумина остается одной из главных характеристик гепатоцита взрослого организма.
3. Процессинг предшественников в печени человека
Выделение клеток печени обычно включает энзиматическую и механическую диссоциацию ткани на суспензии одиночных клеток и последующее фракционирование методами центрифугирования в градиенте плотности, элютриации с центрифугированием, дифференциальной ферментативной мацерации (например, звездчатых клеток печени) и/или селекции в клеточной культуре (см. обзор Freshney, "Culture of Animal Cells, A Manual of Basic Techniques" 1983, Alan R. Liss, Inc., NY). Ткань печени может быть получена из плода, новорожденного, грудного ребенка (до 1 года), ребенка (от 1 года до половой зрелости) или взрослого человека (после достижения половой зрелости). Предпочтительно применяется центрифугирование в градиенте плотности для фракционирования и выделения различных популяций клеток (например, гепатобластов).
4. Культивирование проксимальных печеночных стволовых клеток и других предшественников
Проксимальные печеночные стволовые клетки и коммитированные печеночные предшественники требуют присутствия питающих стромальных клеток печени и бессывороточной среды с добавлением смеси определенных гормонов и факторов роста [1-6]. Клоногенная экспансия и продолжительная сохранность основных маркеров проксимальных печеночных стволовых клеток, коммитированных предшественников и диплоидных клеток печени взрослого организма возможно, если питающие стромальные клетки эмбриональной печени заменить на питающие клетки STO в сочетании с бессывороточной средой с добавлением инсулина, трансферрина/Fe и предпочтительно гидрокортизона [7]. Учитывая, что эти условия благоприятствуют широкому кругу предшественников из эмбриональной ткани и даже образованию колоний из диплоидных взрослых клеток [7], для селекции примитивных печеночных стволовых клеток требуются другие условия.
5. Выделение примитивных печеночных стволовых клеток
Настоящее изобретение включает способ выделения примитивных печеночных стволовых клеток из ткани печени человека, включающий нанесение суспензии клеток, полученных из ткани печени, предпочтительно обогащенной паренхимальными клетками, на пластиковую поверхность и культивирование их в строгих условиях, при которых происходит элиминация зрелых клеток печени, проксимальных печеночных стволовых клеток и коммитированных предшественников. Строгие условия культивирования включают применение бессывороточной среды с добавлением регулятора углеводного метаболизма, источника железа, мембранообразующего фактора и также предпочтительно антиоксиданта.
Предпочтительным регулятором углеводного метаболизма является инсулин. Предпочтительным источником железа является трансферрин. Предпочтительным мембранообразующим фактором является композиция, содержащая один или несколько липидов, наиболее предпочтительно свободных жирных кислот. Бессывороточная среда предпочтительно также содержит гидрокортизон. Ткань печени предпочтительно получают из плода, новорожденного, грудного ребенка, ребенка или взрослого человека, наиболее предпочтительно из плода.
Примитивные печеночные стволовые клетки выделяют путем культивирования суспензии полученных из печени клеток на пластиковой поверхности при низкой плотности клеток (например, 1000-2000 клеток/см2). Строгие условия культивирования ведут к появлению примитивных печеночных стволовых клеток из печени человека, которые являются предшественниками проксимальных печеночных стволовых клеток. Эти примитивные печеночные стволовые клетки из печени человека одновременно экспрессируют Ер-САМ, АС133, СК8/18, СК19 и альбумин, а их субпопуляции экспрессируют N-CAM, САМ 5.2 и c-kit.
Специалисты в этой области должны понимать, что настоящее изобретение может применяться для выделения примитивных клеток из других типов тканей.
6. Выделение проксимальных печеночных стволовых клеток
Проксимальные печеночные стволовые клетки человека дают начало гепатоцитам или желчному эпителию или их комбинации. Проксимальные печеночные стволовые клетки человека одновременно экспрессируют Ер-САМ, СК8/18, цитокератин 19, α-фетопротеин и альбумин, а их субпопуляции экспрессируют АС133. Проксимальные печеночные стволовые клетки человека могут быть выделены различными методами, включая (i) иммуноселекцию клеток, коэкспрессирующих Ер-САМ, (ii) культивирование суспензий полученных из печени клеток, предпочтительно обогащенных паренхимальными клетками, в присутствии вызывающего дифференцировку фактора, или (iii) культивирование примитивных печеночных стволовых клеток человека в присутствии вызывающего дифференцировку фактора. Вызывающий дифференцировку фактор предпочтительно обеспечивается вторичными клетками. К предпочтительным вторичным клеткам относятся питающие клетки STO, стромальные клетки эмбриональной печени и эндотелиальные клетки.
7. Выделение печеночных предшественников методом иммуноселекции
Настоящее изобретение также включает способ выделения печеночных предшественников из суспензий полученных из печени клеток на основе иммуноселекции маркеров клеточной поверхности, специфичных к печеночным предшественникам. Печеночные предшественники могут быть выделены согласно настоящему изобретению путем отбора клеток, экспрессирующих Ер-САМ, которые предпочтительно также экспрессируют АС133. Прошедшие иммуноселекцию печеночные предшественники предпочтительно также экспрессируют альбумин и более предпочтительно также экспрессируют цитокератин 19. Предпочтительно прошедшие иммуноселекцию печеночные предшественники представляют собой стволовые клетки.
В одном из воплощений настоящего изобретения выделенные печеночные предшественники представляют собой примитивные печеночные стволовые клетки. В другом воплощении настоящего изобретения выделенные печеночные предшественники представляют собой проксимальные печеночные стволовые клетки.
8. Продукция печеночных предшественников
Настоящее изобретение также включает способ продукции проксимальных печеночных стволовых клеток и коммитированных предшественников из примитивных печеночных стволовых клеток, включающий посев непосредственно на слой питающих клеток STO в среде HDM либо перенос примитивных печеночных стволовых клеток из колоний на планшетах на слой питающих клеток STO до появления проксимальных печеночных стволовых клеток из колоний примитивных печеночных стволовых клеток.
Проксимальные печеночные стволовые клетки и коммитированные предшественники также могут быть получены из примитивных печеночных стволовых клеток путем культивирования на поверхностях без покрытия, включая чашки Петри (предпочтительно из незаряженного полистирена), планшеты (предпочтительно из полистирена и обработанные ионизирующим газом так, чтобы произошла поляризация полистирена с преимущественной ориентацией отрицательных (или положительных) зарядов в ту сторону, на которой должны прикрепиться клетки)), микроносители (предпочтительно шарики, на которые могут осесть клетки), текстильные материалы (предпочтительно нейлон, хлопок, полиэфир), синтетические каркасы (предпочтительно из полилактидов, полипропиленфумарата, полиортоэфиров или других синтетических материалов) или губки (предпочтительно натуральные или синтетические губки).
Проксимальные печеночные стволовые клетки и коммитированные предшественники также могут быть получены из примитивных печеночных стволовых клеток путем культивирования на биологических поверхностях. Биологические поверхности могут быть нанесены или приготовлены на поверхностях из категорий, перечисленных выше. Так, например, можно нанести покрытие из внеклеточного матрикса на чашки Петри, планшеты, микроносители или текстильные материалы. Биологические поверхности, используемые в настоящем изобретении, охватывают: (i) внеклеточный матрикс (сложная смесь белков и углеводов, вырабатываемая клетками и находящаяся снаружи и между клетками и включающая коллагены, белки адгезии, протеогликаны и другие белки); (ii) компоненты внеклеточного матрикса (индивидуальные, очищенные компоненты матрикса, используемые сами по себе или в сочетаниях для оптимизации прикрепления клеток, роста и/или экспрессии тканеспецифичных функций, в том числе фибронектин, ламинин, коллагены (существует более 20 семейств коллагенов), включая коллаген I типа, коллаген III типа, коллаген IV типа (эти три чаще всего используются сейчас при культивировании клеток), молекулы клеточной адгезии или "CAMs", причем некоторые из них зависят от кальция, а другие - нет, и протеогликаны (молекулы, состоящие из центрального белка, к которому присоединяется одна или несколько цепей глюкозаминогликанов - полимеров, состоящих из димерных звеньев глюкуроновой или идуроновой кислоты + аминосахара), к которым относятся протеогликаны хондроитинсульфат, дерматансульфат, гепарансульфат, гепарин; (iii) тканевые экстракты, обогащенные внеклеточным матриксом, в том числе матригель (мочевинный экстракт из прививаемой эмбриональной карциномы мышей, который может быть нанесен на любую из поверхностей, представленных в группе I), ЕСМ (экстракция культуры клеток с помощью разбавленной щелочи, разбавленного детергента, концентрированной соли, мочевины и др., после которой остается экссудат, обогащенный компонентами внеклеточного матрикса, который наносится на поверхность (любую из группы I)), матрикс амниотической оболочки (экстракция амнионов с помощью разбавленной щелочи, разбавленного детергента, концентрированной соли, мочевины и др., после которой остаются компоненты матрикса, находившиеся в амнионах) и биоматрикс (экстракция ткани с помощью концентрированной соли (например, >3 М NaCl) и нуклеаз, после которой остаются все коллагены ткани и связанные с ними компоненты, такие как белки адгезии); (iv) сывороточное покрытие (если покрыть чашки Петри или планшеты сывороткой, то добавятся белки адгезии, особенно фибронектин, которые представлены на высоком уровне в сыворотке); и (v) полилизин или полилейцин (нанесение этих положительно заряженных аминокислот применяется преимущественно для прикрепления эпителиальных клеток).
Проксимальные печеночные стволовые клетки и коммитированные предшественники также могут быть получены из примитивных печеночных стволовых клеток при культивировании в условиях, описанных в Anthony Atala and Robert P. Lanza, editors. Methods of Tissue Engineering. Academic Press, New York 2002, которая включена в настоящее изобретении путем ссылки.
Печеночные предшественники, получаемые по настоящему изобретению, включают примитивные и проксимальные печеночные стволовые клетки, коммитированные предшественники гепатоцитов и коммитированные предшественники желчных протоков.
9. Терапевтические подходы
Выделенные предшественники по настоящему изобретению могут применяться для направленной на печень клеточной и/или генной терапии либо в качестве клеток-хозяев для продукции вируса (например, гепатита С) для создания вакцин. Также предшественники по настоящему изобретению могут быть размножены ex vivo из образцов биопсии печени (например, пункционной биопсии) и размноженные клетки могут быть использованы для аутологической или аллогенной клеточной или генной терапии либо для инокуляции в биореактор для создания искусственной печени, которая может применяться в клинике или в научных исследованиях. Тем самым будет устранена необходимость в резекции печени пациента путем серьезной инвазивной хирургии.
После получения культуры предшественников можно осуществлять перенос генов с помощью любых многочисленных векторных систем доставки генов. Характеристики роста предшественников по изобретению позволяют применять перенос генов ех vivo с помощью определенных векторов для доставки генов (например, ретровирусных векторов), для чего нужно размножить клетки для эффективного введения и экспрессии гена.
Альтернативный подход к генной терапии состоит в разработке векторов, направленных на конкретные предшественники, и введении вектора, вместе с определенным геном, непосредственно пациенту. Эти векторы смогут достигнуть и модифицировать эндогенную популяцию клеток-предшественников.
Предшественники по изобретению могут применяться при аутологической или аллогенной, направленной на печень, клеточной или генной терапии. Конечно, применение аутологических печеночных предшественников устранит определенные опасения насчет отторжения пересаженных клеток. Предшественники по изобретению особенно привлекательны для аллогенной пересадки клеток, так как их антигенный профиль предполагает минимальные явления иммунологического отторжения.
После выделения, очистки и культивирования аутологических или аллогенных предшественников их можно подвергнуть генетической модификации или оставить без изменения, размножить in vitro, а затем трансплантировать обратно хозяину. Если нужна генетическая модификация, то после генетической модификации и перед трансплантацией подвергнувшиеся генетической модификации клетки могут быть размножены и/или подвергнуты селекции согласно включению и экспрессии доминантного селективного маркера. Трансплантация может проводиться обратно в печеночный компартмент либо в эктопический или гетеротопический сайт. Для трансплантации в печеночный компартмент может применяться инфузия в воротную вену или инъекция в селезенку. Инъекция в селезенку может быть предпочтительным способом введения, так как при трансплантации печеночных предшественников путем инъекции в селезенку они переходят в печеночный компартмент.
Дополнительные медицинские процедуры могут способствовать эффективному укоренению в печени трансплантированных печеночных предшественников. На животных моделях было показано, что при частичной гепатектомии введение факторов ангиогенеза и других факторов роста способствует укоренению и жизнеспособности трансплантированных гепатоцитов. Альтернативный подход заключается в трансплантации генетически модифицированных предшественников в эктопический сайт.
В настоящее время встречаются проблемы в связи с терапевтическим применением печеночных клеток, включая получение источника клеток, невозможность криогенного хранения клеток, возникновение эмболии, иммунологическое отторжение и др. Проблемы с текущим терапевтическим применением печеночных клеток могут быть обусловлены тем, что используемые донорские клетки преимущественно представляют собой клетки печени взрослого организма и они имеют короткий срок жизни после выделения и обратного введения. Кроме того, применение взрослых клеток ведет к сильному иммунологическому отторжению. Клетки-предшественники по настоящему изобретению обладают большей эффективностью вследствие меньшей склонности к возникновению явлений иммунологического отторжения и возможности криогенного хранения, поэтому они дают возможность подвергнуть их тканевому типированию (и тем самым подобрать донорские клетки, совместимые с реципиентом) и предложить "готовый" продукт, а также вследствие их большого регенеративного потенциала.
В отношении генной терапии в предшествующих работах применялись "направленные инъецируемые векторы", представляющие наиболее популярный способ при разработке их применения в клинической терапии. Такие подходы имели ограниченный успех вследствие иммунологических проблем и кратковременной экспрессии векторов. Единственный способ генной терапии, который оказался достойным внимания, - это генная терапия ex vivo, которая проводилась почти исключительно на гемопоэтических клетках-предшественниках. Мы предполагаем, что генная терапия ех vivo с помощью клеток-предшественников (или применение инъецируемых векторов, каким-либо образом направленных на эти предшественники) окажется более эффективной, так как эти векторы могут быть введены ех vivo в очищенные клетки предшественников, а модифицированные клетки подвергнуты селекции и обратно введены in vivo. Преимущества клеток-предшественников заключаются в их огромном потенциале экспансии, минимальной индукции иммунологических реакций, если таковые вообще возникают, возможности подвергнуть их тканевому типированию и тем самым подобрать клетки, совместимые с иммунологическим фенотипом реципиента, и их способности к дифференцировке с образованием как гепатоцитов, так и клеток желчных протоков.
10. Другие применения
Применения примитивных и проксимальных печеночных стволовых клеток человека многочисленны и многообразны. Они включают: 1) исследования на клетках человека; 2) получение вакцин и антивирусных препаратов; 3) токсикологические исследования; 4) разработка лекарств; 5) производство белков (используя клетки в качестве хозяина для подукции различных факторов, специфичных для человека); 6) клеточная терапия печени; 7) генная терапия печени; и 8) искусственная печень, которая может применяться в научных исследованиях, токсикологических и антимикробных исследованиях, производстве белков или в клинике в качестве вспомогательной системы для печени. Учитывая способность примитивных и проксимальных печеночных стволовых клеток к дифференцировке в гепатоциты и клетки желчных протоков, клетки по настоящему изобретению могут применяться для получения как гепатоцитов, так и клеток желчных протоков в зависимости от микроокружения, в котором они находятся.
Доступность печеночных клеток-предшественников человека (всех 4 категорий) позволит значительно более широкие исследования на клетках человека, будет способствовать разработке эффективных форм клеточной и генной терапии печени и позволит разработать искусственную печень человека для применения как в научных исследованиях, так и в качестве вспомогательных клинических устройств. В настоящее время ограниченное поступление здоровых тканей человека не способствует клиническим программам клеточной терапии печени или искусственной печени человека. Популяции клеток-предшественников должны обладать достаточным потенциалом экспансии для преодоления или по крайней мере смягчения такого ограниченного поступления. Более того, эти клетки и их непосредственное потомство проявляют лучшую выживаемость при ишемии, как холодной, так и теплой, по сравнению со зрелыми клетками печени, а это значит, что печень, непригодная для трансплантации или для получения здоровых зрелых клеток печени, может служить источником клеток-предшественников.
Изобретение раскрывается на следующих неограничивающих примерах.
ПРИМЕР 1
Получение суспензии печеночных клеток из эмбриональной ткани
Ткань печени получали из плодов в эмбриональном возрасте 18-22 недели после добровольного прекращения беременности. Образцы ткани печени оставляли в течение ночи в среде RPMI 1640 с добавлением 10% эмбриональной телячьей сыворотки.
Объем ткани составлял от 2 до 12 мл после предварительной промывки в клеточном буфере ((RPMI с добавлением 0,1% бычьего сывороточного альбумина (BSA, фракция V, St. Louis, Mo.), 300 пМ селенистой кислоты и антимикробной смеси AAS (Gibco BRL/ In Vitrogen Corporation, Carlsbad, California)). Ткань печени разделяли как следует на фрагменты по 3 мл или меньше для мацерации в 25 мл клеточного буфера, содержащего коллагеназу IV типа и дезоксирибонуклеазу (Sigma, St. Louis, Mo.; обе по 6 мг/мл). Проводили инкубацию при 32°С с быстрым перемешиванием в течение 15-20 минут и получали гомогенную суспензию агрегированных клеток. Затем суспензию пропускали через сито 40-го размера и центрифугировали 5 мин при 1200 об/мин, а затем ресуспендировали в буферно-солевом растворе Хэнкса с добавлением 0,2 мМ ЭГТА (Sigma), 20 мМ Hepes (Boehringer Mannheim), 0,1% BSA (Sigma), 0,01% ДНКазы (Sigma), названном HBSS-mod.
После энзиматической обработки суспензия содержит гемопоэтические и печеночные субпопуляции. Антигенный профиль суспензии после энзиматической обработки представлен в табл.1, при этом AFP-экспрессирующие клетки составляют 6-9% от исходной суспензии клеток (фиг.12) при сравнимом содержании альбумин-экспрессирующих клеток вместе со значительной примесью гемопоэтических клеток (см. проценты клеток, экспрессирующих CD45 и гликофорин А в табл.1). Если исходная суспензия клеток подвергается криогенному хранению, то исчезают некоторые клетки типа эритроидных клеток и обогащение альбумин- и AFP-экспрессирующих клеток достигает 15-20% (табл.1). Однако наиболее впечатляющее обогащение происходит при частичном энзиматическом расщеплении коллагеназой с образованием агрегатов паренхимальных клеток, которые затем отделяют от непаренхимальных (всплывающих) клеток при многократном низкоскоростном центрифугировании, как описано ниже, получая клеточную суспензию, состоящую более чем на 80% из альбумин- и AFP-экспрессирующих клеток (табл. 1).
Затем гемопоэтические клетки (главным образом эритроциты и эритробласты) и всплывающие непаренхимальные клетки отделяли от фракции паренхимальных клеток при многократном низкоскоростном центрифугировании при 30 g (300 об/мин) в течение 5 минут в HBSS-mod. Осадок ресуспендировали и снова центрифугировали в 40 мл среды HBSS-mod до тех пор, пока окраска не свидетельствовала о минимальном загрязнении эритроцитами. Обычно, как сообщали и другие, для этого требуется 4-5 циклов центрифугирования и ресуспендирования [14, 15]. Образование агрегатов сводили к минимуму при помощи второго цикла энзиматического расщепления в свежем растворе коллагеназы с последующим пропусканием через нейлонную сетку на 50 мкм и переводом клеток в безкальциевый буфер.
Полученную суспензию клеток промывали два раза, а затем порции по 5 мл, содержащие около 2×107 клеток, наслаивали на 5 мл Ficoll Hypaque (Amersham Pharmacia, Piscataway, NJ) в пробирках Falcon на 50 мл и центрифугировали 20 минут при 3000 об/мин. Клетки из интерфазы и осадка ресуспендировали по отдельности в среде для посева (RPMI с добавками), отбирали порции и окрашивали трипановым синим для подсчета клеток и оценки жизнеспособности с помощью гемоцитометра. Обычно жизнеспособность составляла более 95%. Метод низкоскоростного центрифугирования для обогащения паренхимальных клеток приводил к удалению гемопоэтических компонентов и давал клеточную суспензию, состоящую приблизительно на 80% из AFP-экспрессирующих клеток. Большинство AFP-экспрессирующих клеток представляют собой проксимальные печеночные стволовые клетки с учетом того, что они экспрессируют AFP, альбумин и СК19, но не гемопоэтические маркеры (табл.1).
Анализ свежевыделенных клеток из эмбриональной печени методом проточной цитометрии
OCS = исходная суспензия клеток; C-OCS = исходная суспензия клеток после криогенного хранения в соответствующем буфере. После этого клетки оттаивали и анализировали экспрессию маркеров. Многие клетки, особенно эритроидные клетки (безъядерная субпопуляция), не переносят криогенного хранения. Паренхимальный препарат = после удаления эритроидных клеток и других всплывающих, непаренхимальных клеток при многократном низкоскоростном центрифугировании, н/о = определение не проводилось.
ПРИМЕР 2
Получение суспензии печеночных клеток из взрослой ткани
Печень человека получали из имеющей разрешение организации по поставке органов. Донором была девочка 13 лет, подвергшаяся смерти мозга. Печень мацерировали методом перфузии целого органа. Затем одноклеточную суспензию фракционировали для получения жизнеспособных клеток через 2-слойный градиент Optiprep (9-12,5%) на центрифуге для промывки клеток Cobe 2991. Затем живые клетки отделяли от примеси мертвых клеток путем смешивания равных объемов индивидуальных фракций клеток из 9% (зона 1) и 12,5% (зона 2) с 25% Optiprep для дальнейшего фракционирования на центрифуге Cobe 2991. На основании анализа методом проточной цитометрии по параметрам прямого и бокового светорассеяния клеточный состав зоны 1 и зоны 2 выглядел одинаковым. Клетки подвергали криогенному хранению.
ПРИМЕР 3
Образование колоний из клеток печени взрослого человека
Для оценки присутствия стволовых клеток печени по образованию колоний оттаивали клетки из Примера 2 и засевали на 6-луночную чашку при плотности 12500 живых клеток/лунку, в тройном повторе, на слой питающих клеток STO-5. Использовали культуральную среду DMEM F12, содержащую пенициллин/стрептомицин (50 Ед/мл и 50 мкг/мл), бычий сывороточный альбумин (0,2% вес/об), трансферрин (10 мкг/мл), свободные жирные кислоты (7,6 мкэкв/л), никотинамид (4,4 мМ), селен (3×10-8 М), медь (1×10-6 М), 2-меркаптоэтанол (5×10-5 М), L-глутамин (2 мМ), инсулин (5 мкг/мл) и гидрокортизон (10-7 М) в присутствии (+EGF) или в отсутствие (-EGF) фактора роста эпидермиса.
Клетки культивировали в течение 5 дней, фиксировали и подсчитывали колонии визуально с помощью светового микроскопа. В лунках, содержавших нефракционированные клетки, колоний не обнаруживалось. Это может быть вызвано ингибирующим действием мертвых или гибнущих клеток или какого-то другого компонента при получении клеток до центрифугирования в градиенте Optiprep. Однако наблюдались колонии из клеток фракций зоны 1 и зоны 2 градиента. В целом наблюдалось 8 колоний в 3 лунках, содержащих клетки из зоны 1 (4 в среде +EGF и 4 в среде -EGF), и еще 13 колоний в 3 лунках из зоны 2 (11 в среде +EGF и 2 в среде -EGF). Суммарная частота колониеобразующих клеток, вычисленная из данного эксперимента, составила 0,03%.
ПРИМЕР 4
Совместная экспрессия альбумина, CD133 и Ер-САМ в субпопуляции клеток печени вхрослого человека
Клетки выделяли из донорской печени, в основном, как описано в Примере 2. Присутствие клеток, экспрессирующих антиген клеточной поверхности CD45, то есть общий антиген лейкоцитов - тирозинфосфатазу, широко представленную на белых кровяных тельцах (лейкоцитах), оценивали методом флуоресцентной сортировки клеток (FACS) с помощью моноклонального антитела против CD45. Приблизительно 17% клеток давали положительную реакцию на CD45 (фиг.14А). CD45-положительные клетки удаляли путем магнитной сортировки клеток, используя моноклональные антитела против CD45 и суперпарамагнитные микрошарики MACS и autoMACS - автоматизированный настольный магнитный сортировщик клеток. Нанесенные на магнитные шарики антитела и прибор были получены от фирмы Miltenyi Biotec. CD45-положительные клетки также можно удалить путем "panning", флуоресцентной сортировки клеток или иных методов отрицательной иммуноселекции. После удаления доля CD45-положительных клеток, остающихся в препарате клеток печени, уменьшалась примерно до 1% (фиг.14В). Удаление CD45-положительных клеток облегчает дальнейший анализ антигенов на гепатоцитах, печеночных предшественниках и стволовых клетках. Оно также должно облегчить выделение обогащенных популяций этих клеток.
а. Альбумин
После удаления CD45-положительных клеток в образце клеток печени анализировали экспрессию сывороточного альбумина человека. Клетки фиксировали параформальдегидом, пермеабилизировали при помощи обработки детергентом тритон X-100 и окрашивали путем последовательной инкубации с мышиным моноклональным антителом класса IgG1 к альбумину человека и очищенным козьим антителом протимышиного иммуноглобулина G1 (IgG1), меченного флуоресцентным красителем А647. Фоновое окрашивание и аутофлуоресценцию клеток определяли с помощью очищенного белка миеломы мышей (тоже класса IgG1), не способного к связыванию с антигенами человека, вместо моноклонального антитела к альбумину. Приблизительно 97,5% клеток давали положительную реакцию на альбумин (фиг.15А). Полосу пропускания для положительного окрашивания (красный контур) определяли по сравнению с контрольным белком миеломы мышей (не показано).
Измерение прямого светорассеяния и бокового светорассеяния методом FACS может использоваться для характеристики клеточных популяций. Прямое и боковое рассеяние света определяется главным образом размером клеток и сложностью внутриклеточной структуры, соответственно. Как видно из фиг.15В, альбумин-положительные популяции клеток из печени взрослого человека содержат преобладающий класс клеток с относительно высоким прямым (FSC) и боковым светорассеянием (SSC). Анализ размера и морфологии, а также дополнительных биохимических и антигенных маркеров (не показано) свидетельствует, что эти клетки обладают свойствами, которые согласуются со зрелыми, небольшими гепатоцитами (средний размер в диаметре примерно 18-22 мкм). Самые большие гепатоциты (диаметром примерно >30 мкм) из нормальной печени взрослого человека, по-видимому, недостаточно представлены в наших препаратах, вероятно, потому, что они более подвержены гибели за время между получением органа и перфузией и/или более подвержены повреждениям при выделении. Однако из фиг.15В также видно, что наряду со зрелыми, небольшими гепатоцитами альбумин экспрессируют и многие клетки, отличающиеся меньшим прямым и боковым рассеянием света. Немногие (приблизительно 2,5%) альбумин-отрицательные клетки в препарате проявляют почти исключительно очень низкое прямое и боковое светорассеяние (фиг.15С). Это могут быть мертвые клетки или очень мелкие клетки типа последних стадий предшественников эритроцитов.
b. CD133
Антиген CD133 (АС133) - это гликопротеин клеточной поверхности в 120 кД, имеющий пять трансмембранных доменов. Этот белок подобен или ортологичен белку проминину у мышей. Первоначально антиген CD133 у человека был идентифицирован в подгруппе ранних предшественников, в том числе стволовых клеток, в ряду кроветворных (гемопоэтических) клеток. Некоторые другие незрелые клетки тоже экспрессируют CD133, включая растущий эпителий в зародыше человека (на 5 неделе), предшественники эндотелиальных клеток и нейрональные предшественники или стволовые клетки. Экспрессия CD133 также отмечалась в определенных опухолях и раковых линиях клеток человека, таких как ретинобластома и линия карциномы толстой кишки СаСо-2. Этот белок сконцентрирован преимущественно в таких выростах плазматической мембраны, как микроворсинки. В эпителиальных клетках он находится главным образом на поверхности апикальной, но не базолатеральной мембраны. В предшествующих исследованиях, в частности, методом иммунохимии, не удалось продемонстрировать экспрессию белка CD133 в эпителиальной ткани взрослого человека, несмотря на заметное присутствие мРНК для этого белка во многих тканях, в том числе взрослой печени.
Мы использовали окрашивание с помощью флуоресцентного моноклонального антитела и анализ методом FACS для поиска клеток, экспрессирующих антиген CD133 в наших препаратах клеток печени взрослого человека, обедненных CD45. Вне ожидания, в свете предшествующих отрицательных сообщений, мы наблюдали, что большинство обедненных CD45 клеток печени (см. фиг.14В) проявляет положительное окрашивание на CD133. На фиг.16А обнаруживается примерно 58% CD133-положительных клеток в препарате из печени младенца (2 года). Присутствие значительной популяции CD133-положительных клеток, в том числе клеток, имеющих размеры небольших зрелых гепатоцитов, отмечалось в клеточных препаратах из других лиц, включая взрослых. CD133-положительная популяция (верхняя рамка на фиг.16А) составляет примерно половину клеток в препарате и определяется как зрелые (небольшие) гепатоциты на основании бокового светорассеяния (фиг.16А) и прямого светорассеяния (не показано). Она также включает многие клетки, которые меньше по размеру и морфологически отличаются от зрелых гепатоцитов, судя по светорассеянию.
Для положительного отбора клеток печени, экспрессирующих CD133, можно использовать магнитную сортировку клеток. На фиг.16В показано обогащение CD133-положительных клеток, составляющее примерно 75% полученных клеток после одного цикла магнитной сортировки с помощью прибора autoMACS (Miltenyi Biotec). Использование большего количества несущих антитела микрошариков MACS и подбор условий сортировки [выражаясь языком, понятным специалистам] должны позволить выделение еще более обогащенных популяций CD133-положительных клеток с почти количественным выходом (также отметим, что для обогащения CD133-положительных клеток можно использовать и другие методы положительной иммуноселекции). Судя по боковому светорассеянию (фиг.16В) и прямому светорассеянию (не показано), обогащенные CD133-положительные клетки включают все субпопуляции CD133, обнаруживаемые в обедненном CD45 препарате клеток печени.
с. Ер-САМ
Молекула адгезии эпителиальных клеток (Ер-САМ, также известная как GA733-2, СО17-1A, EGP40, KS1-4 и KSA) - это гликопротеин, участвующий в гомофилической, независимой от ионов кальция межклеточной адгезии. Этот белок экспрессируется во многих эпителиальных тканях человека и, по-видимому, подвергается существенной положительной регуляции в пролиферирующих эпителиальных клетках, включая раковые клетки. C.J. de Boer и сотр. сообщали, что в печени 8-недельного эмбриона человека большая часть гепатоцитов заметно экспрессирует белок Ер-САМ (de Boer CJ, van Krieken JH, Jansen-van Rhijn CM, Litvinov SV. 1999. "Expression of Ep-CAM in normal, regenerating, metaplastic, and neoplastic liver," Journal of Pathology 188: 201-6). Напротив, в нормальной печени взрослого человека они не смогли обнаружить экспрессию Ер-САМ в гепатоцитах и сообщали, что только эпителиальные клетки желчных протоков дают положительное окрашивание на этот антиген. Наконец, этот антиген обнаружен в клетках, идентифицированных как печеночные предшественники в тех случаях, когда индуцировали регенерацию и восстановление печени при билиарном циррозе, а также в клетках определенных опухолей печени, в частности холангиокарциномы.
При анализе методом FACS мы устойчиво обнаружирали небольшую популяцию Ер-САМ-положительных клеток в нефракционированных препаратах клеток печени человека как от детей, так и взрослых. Ер-САМ-положительная популяция составляет приблизительно от 0,4 до 2,5% клеток. Как видно из фиг.17, Ер-САМ-положительные клетки также наблюдаются в популяциях клеток печени после удаления >95% CD45-положительных клеток. На фиг.17В показаны Ер-САМ-положительные клетки из одного такого препарата из печени человека (0,57% на участке графика с полосой пропускания, выделенной красным контуром, по сравнению с 0,15% на участке с той же полосой пропускания для контрольного антитела, не дающего окрашивания ни на один известный антиген человека, фиг.17А; так что приблизительно 0,57-0,15=0,42% клеток являются Ер-САМ-положительными). Анализ по двойной метке (данные не приводятся) показал, что подавляющее большинство Ер-САМ-положительных клеток в обедненной CD45 популяции, как и следовало ожидать, отрицательны по CD45. Однако похоже, что некоторые (примерно 1%) из СП45-положительных клеток в наших препаратах из печени человека также экспрессируют Ер-САМ (данные не приводятся).
d. Совместная экспрессия Ер-САМ, CD133 и альбумина
Мы проводили поиск клеток печени из печени взрослого человека, которые одновременно экспрессируют Ер-САМ и CD133. Клетки инкубировали с моноклональными антителами к CD133 и Ер-САМ, причем каждое из них было конъюгировано с другим флуорофором. Как видно из фиг.17С, приблизительно 42% клеток в данном препарате обедненных CD45 клеток печени взрослого человека проявляли заметное окрашивание на CD133 (несколько меньшая степень окрашивания на GD133 в данном случае, чем в эксперименте на фиг.16А, могла возникнуть из-за действительных отличий между препаратами клеток печени из разных источников по возрасту или по другим параметрам, или из-за не установленных различий в экспериментальной методике). Среди клеток, дающих сильное окрашивание на Ер-САМ (представленных в красном контуре на фиг.17В), приблизительно 70% также давали положительное окрашивание на CD133 (фиг.17D). Так, в данном конкретном препарате из печени приблизительно 0,3% от всех CD45-отрицательных клеток также экспрессировали Ер-САМ и CD133.
Препарат клеток, использовавшийся в эксперименте на фиг.17, был идентичен тому, который использовался при анализе экспрессии альбумина на фиг.14 и 15. Как указано выше, приблизительно 97,5% клеток в обедненной CD45 популяции давали положительное окрашивание на альбумин, а немногочисленные альбумин-отрицательные клетки проявляли особый профиль слабого прямого и бокового светорассеяния. Как видно из фиг.17Е, практически все (приблизительно 99,5%) клетки, которые экспрессировали и CD133, и Ер-САМ, проявляли прямое и боковое светорассеяние, характерное для альбумин-положительных клеток; они полностью выпадают из ограниченной области на графике прямого светорассеяния относительно бокового светорассеяния, в которой находятся все альбумин-отрицательные клетки (см. фиг.15С). Таким образом, клетки поснатальной печени человека, совместно экспрессирующие Ер-САМ и CD133, также экспрессируют сывороточный альбумин человека.
е. Совместное обогащение CD133- и Ер-САМ-экспрессирующих клеток
Как видно из фиг.16В, положительная иммуноселекция типа магнитной сортировки клеток позволяет обогащение CD133-положительных клеток из препаратов клеток печени человека. Мы исследовали экспрессию Ер-САМ в исходной популяции (уже обедненной CD45) и в обогащенном CD133 препарате. Из фиг.17А видно, что, по меньшей мере, 1,1% (полоса пропускания намеренно сжата) из исходной популяции экспрессируют Ер-САМ. После обогащения CD133-положительных клеток образуется популяция (фиг.5В), которая содержит по меньшей мере 4,5% Ер-САМ-положительных клеток. Это подтверждает совместную экспрессию CD133 и Ер-САМ в субпопуляции клеток из печени взрослого человека и свидетельствует, что эти клетки могут быть обогащены методом положительной иммуноселекции. Анализ прямого и бокового светорассеяния (как в эксперименте из фиг.17) клетками, совместно экспрессирующими эти два поверхностных антигена, показывает, что почти 100% этих клеток также должны быть альбумин-положительны.
Клетки печени взрослого человека, описанные выше, экспрессируют альбумин, фенотипический маркер зародышевой линии гепатоцитов, вместе с CD133 или Ер-САМ, и поэтому они обладают таким же фенотипическим профилем, как и некоторые печеночные стволовые клетки из эмбриональной печени человека, описанные в данном изобретении. Более того, клетки печени взрослого человека, описанные в данном изобретении, имеют меньшие размеры, чем зрелые гепатоциты (даже если это "мелкие гепатоциты" диаметром в 18-22 микрон). В сочетании с данными о том, что печень взрослого человека содержит клетки, способные к образованию колоний в условиях, функционально определяющих печеночные стволовые клетки (то есть в бессывороточной среде с питающими клетками STO), совместная экспрессия альбумина, Ер-САМ и CD133 свидетельствует о присутствии таких стволовых клеток в печени взрослого человека. Описанные нами методы положительной иммуноселекции могут применяться для выделения клеток, одновременно экспрессирующих два поверхностных маркера - Ер-САМ и CD133, для того, чтобы получить сильно обогащенные популяции печеночных стволовых клеток, в том числе из ткани детей или взрослых.
ПРИМЕР 5
Первичные культуры проксимальных печеночных стволовых клеток на слое питающих клеток STO
Большинство клеток-предшественников печени, за исключением примитивных печеночных стволовых клеток, не выдерживают длительного культивирования вместе со стромальными питающими клетками из эмбриональной печени, причем питающие клетки из печени новорожденных, печени взрослых и различные ткани взрослого человека оказались безуспешными (Sigal et al., 1994; Brill et al., 1995; Sigal et al., 1995; Brill S, Zvibel I, and Reid LM. Expansion conditions for early hepatic progenitor cells from embryonal and neonatal rat livers. Digestive Diseases and Sciences 44: 364-371, 1999). Стромальные питающие клетки из эмбриональной печени можно заменить клетками STO - линии эмбриональных стромальных клеток, используемых в качестве стандартных питающих клеток для эмбриональных стволовых клеток и поддерживающих клоногенную экспансию свежевыделенных, нормальных печеночных стволовых клеток грызунов и диплоидных клеток печени взрослых крыс (Kubota and Reid, 2000). Такие условия также оказались необходимыми и для всех клеток-предшественников из эмбриональной печени человека, за исключением примитивных печеночных стволовых клеток, которые поддаются экспансии и в отсутствие питающих клеток (Moss et al., submitted). Питающие клетки STO также оказались удачными для печеночных предшественников из печени новорожденного и взрослого человека (Ludlow et al., in preparation). Факторы, выделяемые эмбриональными стромальными питающими клетками и необходимые для клеток-предшественников, еще не известны.
Питающие клетки STO, полученные из АТСС, подвергали экспансии из рассады в колбах диаметром 75 см в среде DMEM/F12 (Gibco BRL/InVitrogen Corporation, Carlsbad, California) с добавлением 10% эмбриональной телячьей сыворотки FBS (Hyclone, Logan, UT) и 1% DMSO (Sigma, St. Louis, Mo.). После трех пересевов и получения 9 достигших конфлюэнтности колб клетки обрабатывали 2 часа митомицином С при 10 мкг/мл (Sigma, St. Louis, Mo., также Biomol, Plymouth Meeting, PA), чтобы вызвать остановку клеточного цикла, и дважды промывали культуральной средой. Клетки обрабатывали трипсином и ресуспендировали в среде для криогенного хранения (50% DMEM/F12, 40% FBS, 10% DMSO) и замораживали порциями по 1 мл из 5×106 клеток и хранили при -80°С. Питающие клетки получали посевом 6×104 размороженных клеток/см2 на чашки, предварительно покрытые 0,1% желатином (Sigma, St. Louis, Mo.). Подробные методики, описанные в [16], включены в настоящее изобретение путем ссылки.
Клетки, пересеянные на слой клеток STO, культивировали в бессывороточной среде определенного гормонального состава (HDM), состоящей из RPMI 1640 (Gibco BRL/ InVitrogen Corporation, Carlsbad, California) с добавлением 0,2% бычьего сывороточного альбумина (фракция V, лишенная жирных кислот, Sigma, St. Louis), инсулина (5 мкг/мл), трансферрина/Fe (10 мкг/мл), селена (3×10-8 М), 2-меркаптоэтанола (5×10-5 М), комплексной смеси свободных жирных кислот (7,6 мкэкв/л, [16, 17]), гидрокортизона (10-7 М), глутамина (2 мМ), никотинамида (4 мМ) и смеси AAS (пенициллин - 1000 мкг/мл, стрептомицин - 100 мкг/мл и амфотерицин В - 250 нг/мл, Sigma). Предпочтительно не применялись ни цитокины, ни классические факторы роста для печени (например, фактор роста эпидермиса EGF, фактор роста гепатоцитов HGF, инсулиноподобные факторы роста IGF-I и IGF-II).
Первичные культуры диспергированных, обогащенных паренхимальных клеток из Примера 1 высевали на слой питающих клеток STO, образовывали устойчивые агрегаты из проксимальных печеночных стволовых клеток, экспрессирующих альбумин, AFP и СК19. Типичные клетки, дающие окрашивание на альбумин, AFP и СК19, представлены на фиг.6а-6с. Эти клетки также положительны на СК8/18. В отличие от клеток, культивируемых на пластиковом субстрате, как описано в Примере 6, проксимальные печеночные стволовые клетки, посеянные на питающих клетках STO, сохраняли соответствующую морфологию и экспрессию AFP в течение нескольких недель. Поскольку эти условия способствуют как проксимальным печеночным стволовым клеткам, так и более дифференцированным клеткам, включая диплоидные клетки взрослой печени [17], то культивирование вместе с питающими клетками STO оказалось непригодным для селекции настоящих примитивных колониеобразующих клеток.
ПРИМЕР 6
Селекция примитивных печеночных стволовых клеток
Обогащенную суспензию паренхимальных клеток из Примера 1 высевали при плотности 2000-5000 клеток/см2 на пластиковые чашки в бессывороточной среде с добавлением липидов, инсулина и трансферрина/Fe (HDM). В течение первых 12 часов после посева среда содержала 10% FBS для стимуляции прикрепления клеток, после чего культуры были лишены сыворотки. Замена среды происходила через каждые 3 дня.
Сразу после прикрепления в культуре преобладали проксимальные печеночные стволовые клетки и коммитированные предшественники, агрегированные клетки с морфологией паренхимальных клеток и экспрессирующие альбумин, AFP и/или СК19; проксимальные печеночные стволовые клетки проявляют альбумин, AFP и СК19 (фиг.2а). Через несколько дней проксимальные печеночные стволовые клетки и коммитированные предшественники прекращали экспрессию AFP и сменялись одиночными, подвижными типами клеток, похожими на миофибробласты, которые расползались по чашке. Наряду с проксимальными печеночными стволовыми клетками в культуре было представлено несколько других типов клеток, причем некоторые были одиночными, некоторые образовывали протяженные сплошные монослои, тогда как другие образовали дискретные округлые скопления клеток. Среди этих типов клеток положительное окрашивание на альбумин наблюдалось только у проксимальных печеночных стволовых клеток, коммитированных предшественников и в округлых, сильно агрегированных колониях примитивных печеночных стволовых клеток, которые появлялись в культуре параллельно с постепенным исчезновением проксимальных печеночных стволовых клеток и коммитированных предшественников.
Образование колоний представляло предсказуемую последовательность событий. Первая волна колоний появилась в первые дни культивирования и похоже, что она возникала из скоплений предсуществующих клеток (фиг.1b). Однако через 5-7 дней началась новая волна образования колоний из одиночных клеток, рассеянных по всей чашке. Эти колонии сначала были различимы в виде групп из 4-8 мелких, темных, очень компактных клеток с ламелиподиями на периферии, образующими узкую непрерывную каемку (фиг.2а). Колонии перерастали в протяженные скопления сильно агрегированных, округлых клеток диаметром 8-10 мкм (фиг.2b-2е). Общий вид этих поздних колоний отличался от колоний, образующихся в первые дни культивирования, которые состояли из клеток большего размера, и от первоначальных скоплений проксимальных печеночных стволовых клеток, составляющих основную часть паренхимальных клеток в эмбриональной печени.
Примитивные печеночные стволовые клетки хорошо росли на пластиковых чашках в среде HDM и достигали диаметра вплоть до 1 см через несколько недель культивирования. Многие колонии избирательно снимали и диспергировали путем обработки трипсином, получая среднее число клеток на 1 колонию в пределах от 1000 клеток из колоний диаметром 3 мм до 15000-20000 из больших колоний диаметром 1 см.
Как правило, самые крайние клетки колоний приобретали сплющенный фенотип и отделялись от колонии с образованием одиночных клеток большого диаметра, которые расползались по всей чашке (фиг.3а). В других колониях клетки на периферии принимали удлиненную форму типа фибробластов и сначала плотно обволакивали окружность колонии, видимо - это тесно сцепленные мезенхимальные клетки (фиг.3b). Эти клетки также отделялись от колонии в виде изолированных веретенообразных клеток. Эти диспергированные клетки сохраняли высокую пролиферативную способность и часто становились преобладающим типом клеток в культуре, образуя плотно сжатый слой, расходящийся по всей чашке. Колонии были окружены этим слоем клеток, но не перекрывались им, хотя и образовалась переходная зона по краям колоний, где перемежались клетки двух типов (фиг.3с).
ПРИМЕР 7
Антигенные профили колониеобразующих клеток на пластике
Антигенные характеристики клеток, культивируемых в Примере 6, исследовали методом иммуноцитохимического окрашивания на маркеры, касающиеся органогенеза печени. Культуры клеток фиксировали смесью метанола и ацетона (50/50) в течение 2 мин при комнатной температуре. Создавали несколько участков окрашивания на поверхности каждой чашки с помощью маркирующей ручки PAP (Research Products International Corp., Mt. Prospect, Illinois) для того, чтобы проверить множественные сочетания антител в одной и той же культуре. Участки неспецифического связывания блокировали путем инкубации в растворе 10% козьей сыворотки (Gibco BRL/ InVitrogen Corporation, Carlsbad, California) в PBS в течение 30 мин при комнатной температуре. После промывки дважды в PBS на каждый из участков окрашивания (обычно 0,1-0,3 мл на участок) наносили первичные моноклональные антитела и инкубировали всю ночь. После инкубации в течение ночи при 4°С клетки промывали дважды PBS, а затем инкубировали со вторичным антителом, конъюгированным с Alexa 488 (1:750) или Alexa 594 (1:1250) (Molecular Probes, Eugene, OR). В некоторых случаях использовали первичные моноклональные антитела, конъюгированные с FITC или РЕ, которые служили средством для двойного мечения путем инкубации с этими антителами по завершении процедуры мечения с неконъюгированным первичным антителом.
Антигенный профиль приведен в табл.2. Колонии давали положительное окрашивание на целый ряд маркеров, которые ранее связывали с клетками печеночного типа, включая альбумин (фиг.4а), СК19 (фиг.4b), Ер-САМ (фиг.4с), N-CAM (CD56, фиг.4d), но не на РЕСАМ (CD31, данные не приводятся). Наблюдалось окрашивание на c-kit в некоторых колониях, причем оно обычно ограничивалось узким сегментом по краям колоний (фиг.5а). Также колонии были положительны по CD133 - предполагаемому маркеру стволовых клеток (АС133, фиг.5с). Интересно, что клетки в переходной зоне на периферии колоний давали положительное окрашивание на недавно открытый маркер эндотелия - CD146 (М-САМ, фиг.5с) и оставались положительными по этому белку, находясь поблизости от колоний, вероятно, определяя близкородственный тип мезенхимальных клеток, возможно, предшественников эндотелия. Примитивные печеночные стволовые клетки, образовавшие колонии, были отрицательны по AFP, указывая на то, что примитивные печеночные стволовые клетки являются предшественниками проксимальных печеночных стволовых клеток, в свою очередь являющихся предшественниками предшественников гепатоцитов и предшественников желчных протоков.
Фенотипы культивируемых клеток
экспресс.
экспресс.
экспресс.
ПРИМЕР 8
Пересев клеток из колоний на пластиковом субстрате на питающие клетки STO
Питающие клетки STO использовали для исследования судьбы примитивных печеночных стволовых клеток после избирательного пересева из пластикового субстрата. После 1-2 недель культивирования колонии на пластиковом субстрате из Примера 6 физически снимали из субстрата посредством втягивания в пипетку на 100 мкл под бинокуляром. Было собрано до 50 колоний в среде HBSS-mod, которые затем в течение до 20 мин обрабатывали раствором коллагеназы с перемешиванием для того, чтобы перевести клетки в суспензию.
Эффективность образования колоний после пересева из пластика на слой питающих клеток STO была низкой, варьируя от 0,5 до 1% от пересеянных клеток при плотности от 500 до 50 клеток/см2. Первоначальное прикрепление колониеобразующих клеток после пересева улучшалось в присутствии EGF (20 нг/мл) в среде. Низкая эффективность образования колоний могла быть обусловлена, хотя бы частично, необходимостью подвергать клетки продолжительной (до 20 минут) обработке коллагеназой для получения одноклеточных суспензий.
После пересева на питающие клетки STO примитивные клетки-предшественники сливались со слоем клеток STO и появлялись вновь в виде плотных компактных колоний из небольших клеток после 4-5 дней культивирования (фиг.6а). Новые колонии увеличивались в размерах в течение следующих недель, образуя плотные округлые скопления, зачастую с небольшим утолщением по окружности (фиг.6с). В некоторых колониях наступала вторичная стадия пролиферации, в которой возникало "извержение" клеток из одной точки на краю колонии и оно распространялось на слой STO, зачастую окружая исходную колонию (фиг.6с).
Иммуноцитохимические свойства колоний, образовавшихся на клетках STO, были такими же, как описано выше у колониеобразующих клеток на пластиковом субстрате. Они включают положительное окрашивание на альбумин, СК19, СК18 и CD133. Как и в исходных колониях на пластике, такие маркеры, как CD146 и N-CAM, были наиболее четко выражены на периферии колоний, образовавшихся на клетках STO. Такая картина экспрессии по краям становилась еще более выраженной, если колонии были окружены клетками, пролиферировавшими из первичной колонии. Это хорошо видно в отношении N-CAM на фиг.9, где граница между первоначальной колонией, образовавшейся из пересеянных клеток, и вторичной пролиферацией отмечена полосой клеток, проявляющих интенсивную положительную экспрессию N-CAM. Такая картина также наблюдалась в отношении экспрессии общецитокератинового маркера САМ 5.2, а двойное мечение по N-САМ и САМ 5.2 показало, что эти два маркера экспрессируются на высоком уровне в одной и той же зоне крайних клеток (фиг.9).
Наконец, представляли интерес характеристики "извергаемых" клеток по мере того, как они отделялись от колоний в определенном порядке, состоящем из параллельного ряда клеток, перерастающих в разветвленную структуру из расположенных в ряд клеток с четкими межклеточными пустотами (фиг.8). Когда эти клетки перерастали в протяженную полосу вокруг исходных колоний, казалось, что они теряют линейную организацию, заметную при их отделении. Однако окрашивание на альбумин показало, что организация типа рядов клеток сохранялась и в клеточной массе (фиг.10а), а одновременное окрашивание на CD146 показало, что этот маркер тоже экспрессируется на высоком уровне в пределах группы пролиферирующих клеток (фиг.10b). Возможно, наибольшее значение у этих клеток имеет появление окрашивания на AFP на периферии отделяющихся клеток (фиг.11). Оно представляет первую точку в манипуляциях ex vivo, описанных в настоящем изобретении, что экспрессия AFP может быть связана с потомками первоначальных колониеобразующих клеток. Эти данные свидетельствуют, что примитивные печеночные стволовые клетки, выделенные в Примере 6, могут быть использованы для получения печеночных коммитированных предшественников.
ПРИМЕР 9
Присутствие примитивных и проксимальных печеночных стволовых клеток в печени из новорожденного донора
Была получена печень из донора, который родился примерно после 28 недель беременности и прожил только один день. Период теплой ишемии между остановкой сердца и получением и промывкой донорского органа составил от 6 до 7 часов. После этого орган держали на льду приблизительно 12 часов. Целый орган (сырой вес около 100 г) подвергали перфузии и обработке ферментным препаратом Liberase и получали клеточную суспензию практически так же, как из печени, полученной из ребенка или взрослого человека. Нежизнеспособные клетки и многие эритроциты удаляли препаративным центрифугированием с использованием Optiprep. Но было трудно определить действительный выход и процент жизнеспособных неэритроидных клеток в конечном препарате.
Порции полученных клеток еще сильнее очищали от эритроцитов дифференциальным центрифугированием практически так же, как описано для клеток эмбриональной печени, а затем инокулировали в культуру в условиях, подходящих для определения присутствия примитивных печеночных стволовых клеток (то есть культивирование в бессывороточной среде определенного гормонального состава на пластиковом субстрате для культивирования тканей). Другие порции клеток выращивали без дальнейшей очистки в условиях, подходящих для определения проксимальных печеночных стволовых клеток (то есть культивирование в бессывороточной среде определенного состава вместе с питающими клетками STO). Другие порции клеток высевали на пластиковые чашки, покрытые коллагеном 1-го типа, в бессывороточной среде определенного состава с добавлением фактора роста эпидермиса (EGF, 5 нг/мл) или без него.
После соответствующего периода инкубации наблюдался рост печеночных колоний при всех исследуемых условиях. При соответствующем определении примитивных и проксимальных печеночных стволовых клеток морфология колоний и скорость роста были близки тем, которые наблюдались у клеток, культивируемых из эмбриональной печени человека (которую обычно получали после <22 недель беременности) при культивировании в таких же условиях. Репрезентативные колонии проверяли методом иммунофлуоресцентного окрашивания на экспрессию альбумина человека и все они оказались положительными по этому маркеру.
Колонии с явной эпителиальной (предположительно печеночной) морфологией появились на покрытых коллагеном чашках в присутствии EGF. Другие клетки с менее определенной морфологией также росли быстро в этих культурах, но их не подвергали подробному изучению.
Колонии предположительно эпителиальных клеток также появлялись на покрытых коллагеном чашках и в отсутствие добавленного EGF. Некоторые из этих колоний снимали индивидуально с помощью ручной пипетки и переносили в свежую среду на 96-луночные планшеты. Клетки из определенных колоний продолжали пролиферировать в таких культурах и их пересевали в качестве штаммов. По-видимому, они представляют собой штаммы, вероятно клональные, пролиферирующих печеночных предшественников, возможно, стволовых клеток. Дальнейшее изучении экспрессии антигенов, в том числе CD133, Ер-САМ, альбумина, AFP и СК19, поможет определить сравнительную стадию дифференцировки этих предположительных линий печеночных стволовых клеток.
ПРИМЕР 10
Сортировка и анализ методом проточной цитометрии (FACscans)
FACscans цитоплазматических антигенов (например, альбумина, AFP) проводили на клетках, фиксированных и пермеабилизированных 3% параформальдегидом перед окрашиванием с помощью антисывороток. Клетки окрашивали, как указано для иммунофлуоресценции, но использовали антитела, меченные непосредственно соответствующим флуоресцентным зондом (см. табл. 3 и 4). Проточную цитометрию проводили на проточном цитометре "MoFlow" фирмы Cytomation (Fort Collins, Colorado) (база FACs под руководством Dr. Larry Arnold). Жидкость оболочки - немодифицированный HBSS. Цитометр MoFlow способен анализировать или сортировать 40 000 клеток/сек, используя параллельно до 12 параметров (6 "цветов" в сочетании с прямым и/или боковым светорассеянием) с точностью более 99%. В большинстве случаев использовался аргоновый лазер 4W мощностью 60 мВт с соплом в 100 мкм. Излучение флуоресценции при возбуждении на волне 488 нм собирали после прохождения через фильтр с полосой пропускания 530/30 нм для FTIC. Флуоресценцию измеряли методом логарифмического усиления. Клетки считались положительными, если флуоресценция превышала 95% от контрольных отрицательных клеток. Использовали значение детектора Е-1 для прямого светорассеяния (FSC) при среднечастотном усилении и тот же детектор использовался для бокового светорассеяния (SSC) при среднечастотном усилении, равном 1. Стробирование сигналов SSC осуществлялось путем линейного усиления с разбивкой параметров на 256 условных единиц. В качестве отрицательных контролей использовались неокрашенные клетки и клетки, окрашенные неподходящим антителом и тем же флуоресцентным зондом или тем же антителом, но без флуоресцентного зонда. В каждом образце анализировали 30000-50000 клеток. Положительные клетки, т.е. клетки, у которых флуоресценция превышала флуоресценцию отрицательных контролей, подвергали дальнейшему анализу на гранулярность, размер и степень флуоресценции. Клетки до и после анализа держали при 4°С в среде HDM с добавлением 10% сыворотки.
Моноклональные антитела
Флуоресцентные зонды
Для анализа цитоплазматических антигенов (например, альбумина, AFP) методом проточной цитометрии клетки фиксировали и пермеабилизировали 3% параформальдегидом перед окрашиванием с помощью антисывороток. Клетки окрашивали, как указано выше для иммунофлуоресценции. Для анализа по 2 маркерам использовали второе антитело, меченное другим флуоресцентным зондом и не совпадающее по длине волны. Анализ проводили на приборе FACscan фирмы Becton Dickenson. В качестве отрицательных контролей использовали клетки, окрашенные только вторичным антителом. В каждом образце анализировали 30000-50000 клеток. Положительные клетки, т.е. клетки, у которых флуоресценция превышала флуоресценцию отрицательных контролей, подвергали дальнейшему анализу на гранулярность, размер и степень флуоресценции.
ПРИМЕР 11
Определение экспрессии альбумина и α-фетопротеина в суспензии печеночных клеток, полученных из эмбриональной ткани
В этом эксперименте исследовали экспрессию альбумина и α-фетопротеина в проксимальных печеночных стволовых клетках и примитивных печеночных стволовых клетках. Предварительно было установлено, что фракция осадка обогащена гепатобластами (проксимальными печеночными стволовыми клетками), тогда как интерфаза обогащена колониеобразующими клетками (примитивными печеночными стволовыми клетками).
Экспрессия альбумина сопоставима в клетках из интерфазы и осадка, как у свежевыделенных клеток, так и после 10 дней культивирования. Однако экспрессия уменьшается при культивировании. Это может быть обусловлено снижением экспрессии или пролиферации у отрицательных по альбумину непаренхимальных клеток.
Наблюдение за культурами указывает на то, что оба фактора вносят вклад в эту картину (фиг.20).
AFP экспрессируется сильно в свежевыделенной фракции осадка и слабо в клетках интерфазы. Это согласуется с тем, что AFP не экспрессируется в клетках из колоний. После 10 дней культивирования AFP не обнаруживается в клетках осадка или интерфазы. Клетки колоний экспрессируют альбумин, но не AFP. Это могло быть обусловлено условиями (культура на пластике), которые ведут к подавлению экспрессии AFP во всех клетках. Однако низкая экспрессия в клетках интерфазы свидетельствует, что экспрессия AFP не бывает сильной в этих клетках (фиг.20). К тому же при культивировании клеток из колоний в условиях, способствующих продолжительной экспрессии AFP в клетках осадка (культивирование вместе с STO), они остаются отрицательными по экспрессии AFP. Не наблюдалось перекрестной реакции между связыванием антител с альбумином или α-фетопротеином и не наблюдалось сигнала на пустых дорожках.
Таким образом, результаты этих экспериментов свидетельствуют, что AFP экспрессируется сильно в свежевыделенной фракции осадка и лишь слабо экспрессируется в клетках интерфазы. Это согласуется с тем, что AFP не экспрессируется в клетках из колоний.
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ ВНЕПЕЧЕНОЧНЫХ ЖЕЛЧНЫХ ПУТЕЙ И СПОСОБЫ ИХ ВЫДЕЛЕНИЯ | 2010 |
|
RU2580246C2 |
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ ВНЕПЕЧЁНОЧНЫХ ЖЕЛЧНЫХ ПУТЕЙ И СПОСОБЫ ИХ ВЫДЕЛЕНИЯ | 2010 |
|
RU2756584C2 |
| КЛЕТКИ-ПРЕДШЕСТВЕННИКИ ПЕЧЕНИ ЧЕЛОВЕКА | 2000 |
|
RU2247565C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК ДЛЯ ЗАМЕСТИТЕЛЬНОЙ КЛЕТОЧНОЙ ТЕРАПИИ ПАТОЛОГИЙ ПЕЧЕНИ | 2012 |
|
RU2510276C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИЗНЕСПОСОБНЫХ КЛЕТОК ПЕЧЕНИ ЧЕЛОВЕКА, В ТОМ ЧИСЛЕ ПЕЧЕНОЧНЫХ СТВОЛОВЫХ КЛЕТОК/КЛЕТОК-ПРЕДШЕСТВЕННИКОВ | 2003 |
|
RU2346981C2 |
| КОМПОЗИЦИИ ТРАНСПЛАНТАТА ДЛЯ ПЕРЕСАДКИ КЛЕТОК | 2018 |
|
RU2828021C2 |
| СПОСОБ ТРАНСПЛАНТАЦИИ КЛЕТОК ИЗ ПЛОТНЫХ ТКАНЕЙ | 2011 |
|
RU2574364C2 |
| СПОСОБ ПРИВИВКИ КЛЕТОК ПЕЧЕНИ СУБЪЕКТУ С ЗАБОЛЕВАНИЕМ ИЛИ ДИСФУНКЦИЕЙ ПЕЧЕНИ | 2011 |
|
RU2736955C2 |
| ОРГАНОИД ПЕЧЕНИ, ВАРИАНТЫ ЕГО ПРИМЕНЕНИЯ И СПОСОБ КУЛЬТИВИРОВАНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2579995C2 |
| СПОСОБЫ ОЧИСТКИ КЛЕТОК, ПРОИЗВОДНЫХ ОТ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2702198C2 |

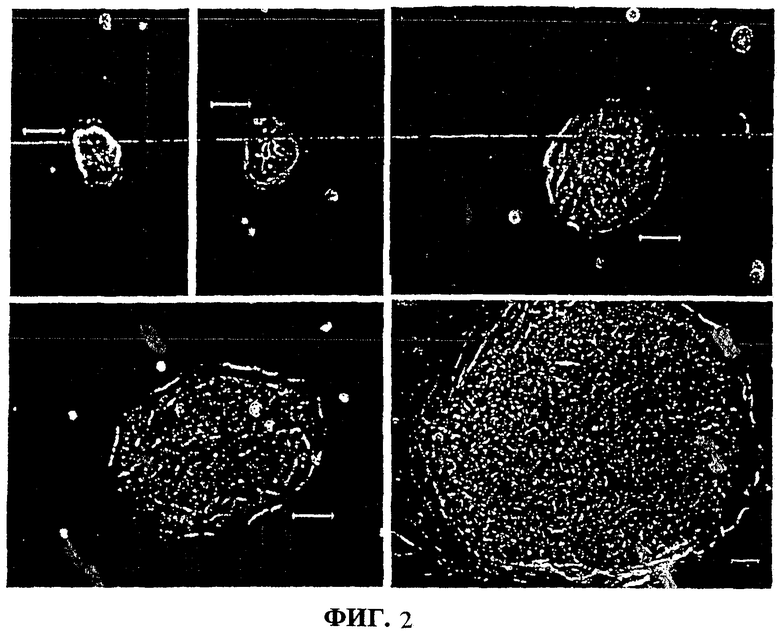



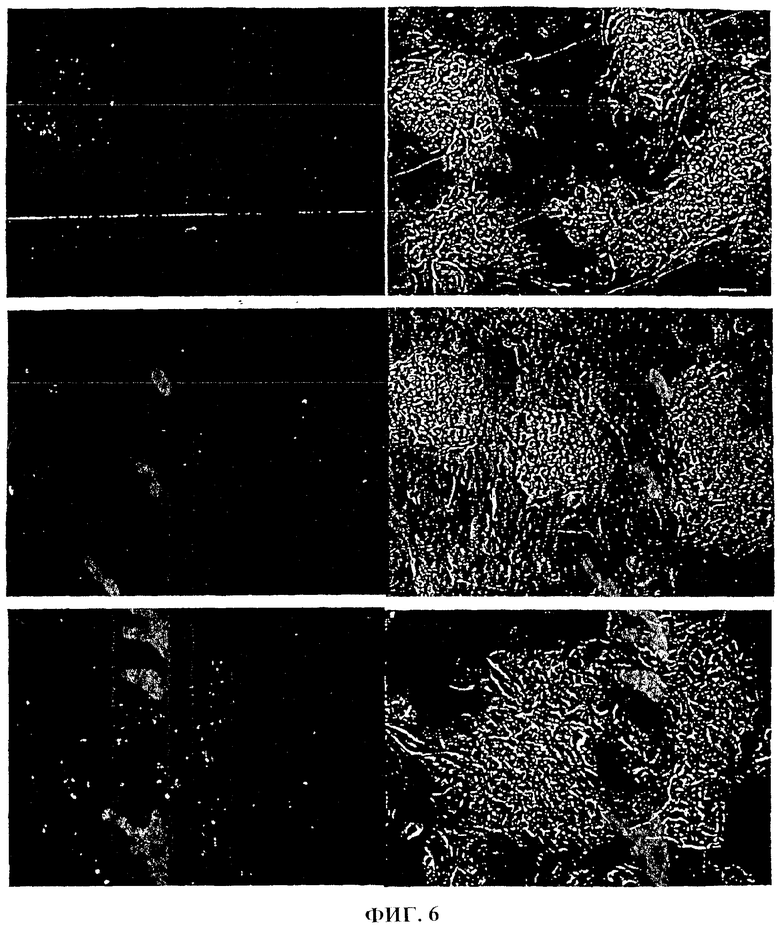
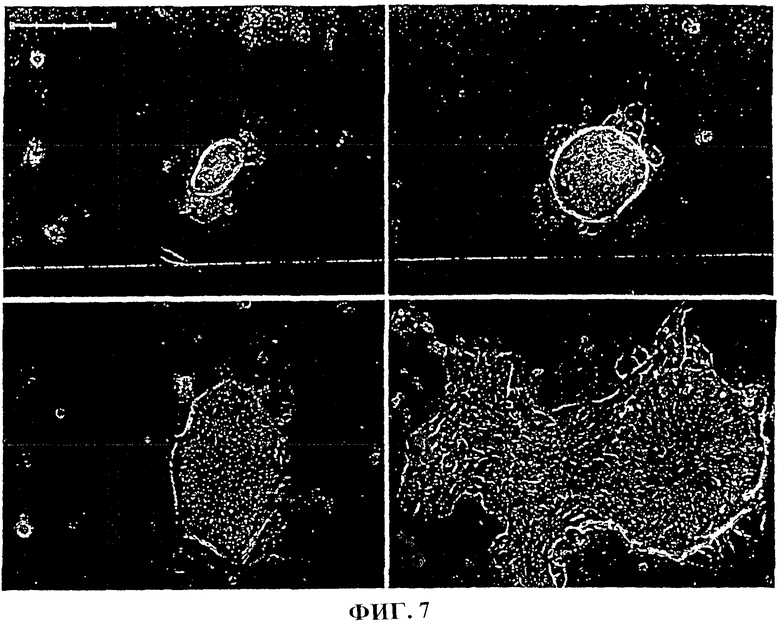




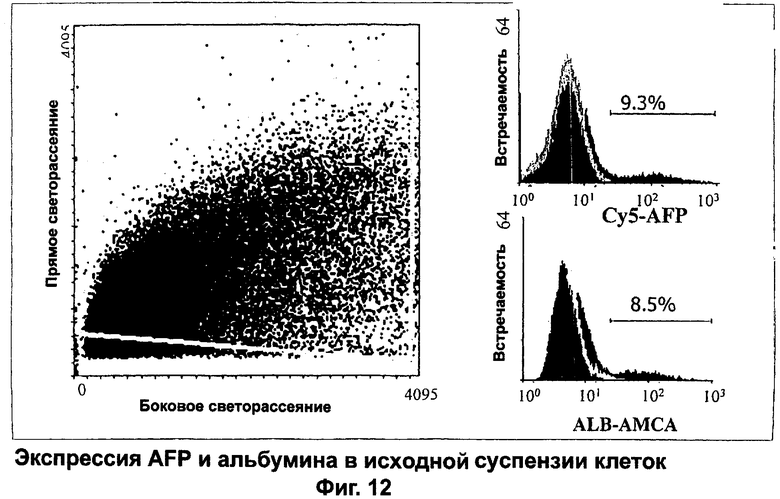


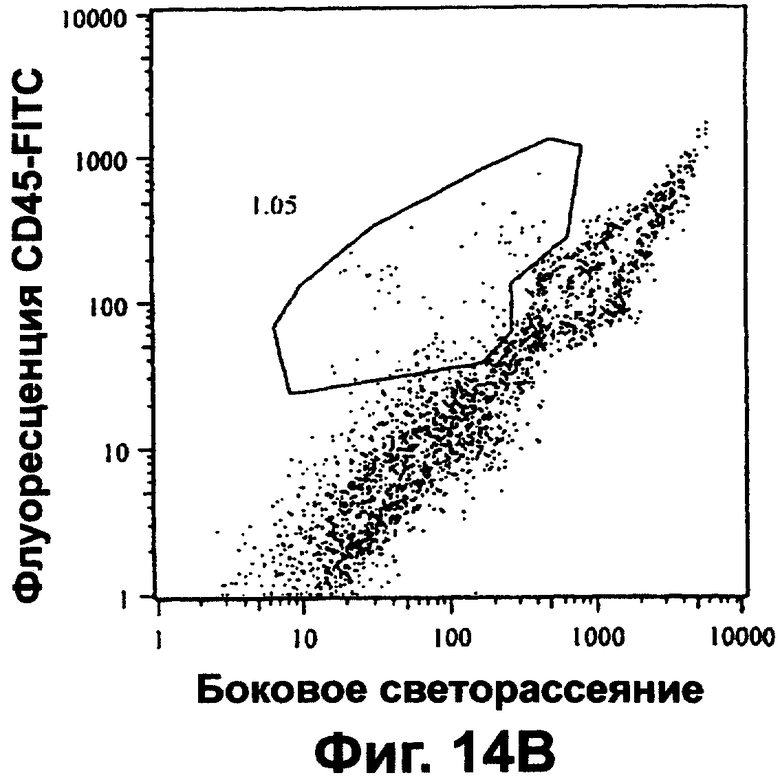


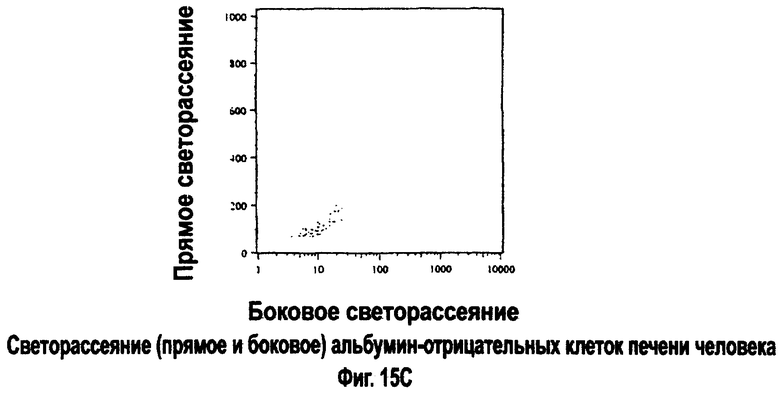
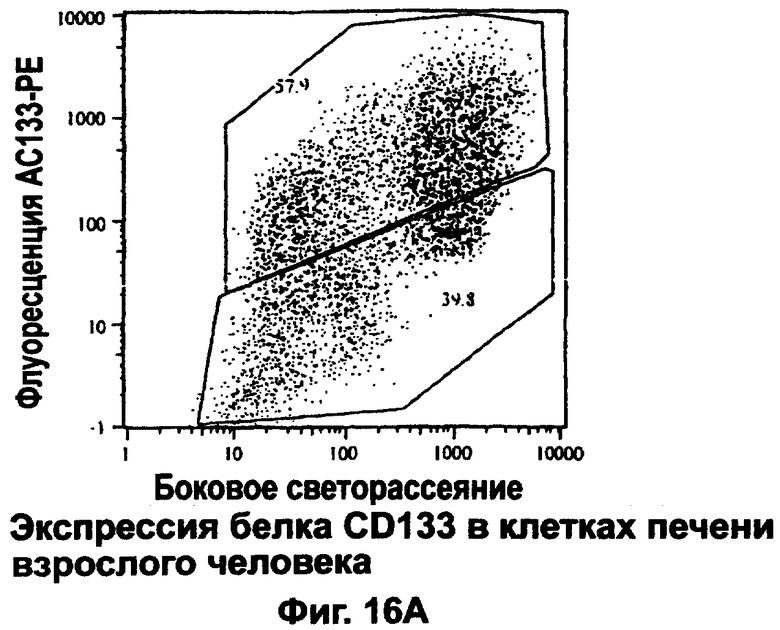







Группа изобретений относится печеночным стволовым клеткам человека. Предложена композиция, включающая примитивные печеночные стволовые клетки человека, экспрессирующие Ер-САМ, АС133 и альбумин, и культуральную среду, причем данные примитивные стволовые клетки являются предшественниками проксимальных печеночных стволовых клеток, предшественников гепатоцитов или предшественников желчных протоков. Предложен способ выделения человеческих клеток-предшественников, происходящих из ткани печени человека, который включает идентификацию клеток, экспрессирующих Ер-САМ, АС133 и альбумин. Предложены печеночные человеческие клетки-предшественники, выделенные способом по п.15 или 16, причем клетки-предшественники представляют собой примитивные печеночные стволовые клетки, экспрессирующие Ер-САМ, АС133 и альбумин. Предложен способ выделения человеческих печеночных клеток-предшественников, происходящих из ткани печени человека, который включает идентификацию клеток, экспрессирующих Ер-САМ. Предложен способ выделения примитивных печеночных стволовых клеток человека, экспрессирующих Ер-САМ, АС133 и альбумин. Предложены примитивные печеночные стволовые клетки человека, экспрессирующие Ер-САМ, АС133 и альбумин, выделенные способом по п.26. Предложен способ выделения проксимальных печеночных стволовых клеток человека. Предложен способ лечения дисфункции или заболевания печени, включающий введение субъекту эффективного количества примитивных печеночных стволовых клеток человека. Предложены выделенные примитивные печеночные стволовые клетки человека. Изобретение позволяет использовать полученные композиции для клеточной терапии и для создания искусственных органов. 9 н. и 50 з.п. ф-лы, 4 табл., 20 ил.
(a) получение смеси клеток, происходящих из ткани печени человека; и
(b) культивирование данной смеси клеток на поверхности в условиях, способствующих селекции примитивных печеночных стволовых клеток человека, в том числе в бессывороточной среде, содержащей регулятор углеводного метаболизма, переносчик железа и мембранообразующий фактор, при этом образуется колония, включающая примитивные печеночные стволовые клетки человека.
(a) получение смеси клеток, происходящих из ткани печени человека;
(b) культивирование данной смеси клеток в условиях, способствующих селекции примитивных печеночных стволовых клеток человека, в том числе в бессывороточной среде, содержащей регулятор углеводного метаболизма, переносчик железа и мембранообразующий фактор, при этом образуется колония, включающая примитивные печеночные стволовые клетки человека; и
(c) культивирование клеток из этой колонии в среде, содержащей, по меньшей мере, один фактор дифференцировки, при этом образуются клетки, включающие проксимальные печеночные стволовые клетки.
| DE BOER et al | |||
| Expression of Ер-САМ in Normal, Regenerating, Metaplastic and Neoplstic Liver., Journal of Pathology, 1999, v.188, n 2, p.201-206 | |||
| LEMMER et al., Isolation from Human Fetal of Cells Co-Expressing CD34 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ROSKAMS et al., Hepatic | |||
Авторы
Даты
2008-06-27—Публикация
2003-03-14—Подача