Данная заявка претендует на приоритет Предварительной патентной заявки США 61/256846, поданной 30 октября 2009 года, описание которой во всей полноте включено в настоящее изобретение посредством отсылки.
Область техники
Настоящее изобретение относится, в целом, к мультипотентным клеткам-предшественникам, включая мультипотентные стволовые клетки, и клеточным популяциям, включающим такие клетки-предшественники или стволовые клетки, в желчных путях, печени и поджелудочной железе. Более конкретно, настоящее изобретение относится к мультипотентным клеткам-предшественникам или стволовым клеткам и клеточным популяциям, включающим такие клетки-предшественники или стволовые клетки, полученным из участков внепеченочных желчных путей. Изобретение включает композиции, содержащие их, и способы идентификации, выделения, сохранения, размножения и дифференцировки таких клеток и клеточных популяций in vitro и in vivo.
Предпосылки создания изобретения
Мертвые, умирающие или дисфункциональные клетки являются причиной многих известных заболеваний, включая диабет и болезнь Альцгеймера. Один способ лечения этих недомоганий основан на трансплантации целых донорских органов или их участков для замены некоторых или всех функций "пораженных болезнью" клеток. Хотя трансплантация органов часто успешно останавливает или замедляет течение некоторых заболеваний, но она сопровождается значительной заболеваемостью/смертностью, как и все большие хирургические вмешательства, а выживание трансплантата зависит от постоянного введения эффективных системных иммунодепрессантов, что часто вызывает нежелательные побочные эффекты. Однако, независимо от успешности этих способов, они по определению ограничены доступностью доноров.
Другой подход в "регенеративной медицине" представляет собой использование стволовых клеток и прогениторных клеток (предшественников) для репопуляции целых органов, их участков или по меньшей мере их функций. Фактически стволовые клетки можно инъецировать или имплантировать с помощью относительно небольших хирургических процедур, часто с ничтожно малыми побочными эффектами. Так как стволовые клетки не являются иммуногенными (или обладают минимальной иммуногенностью), для начального засевания клеток требуется относительно немного иммунодепрессантов, если они вообще требуются.
Стволовые клетки представляют собой редкие клетки, требующие четких, аккуратных способов выделения и строго определенных условий для размножения in vivo и in vitro. Поэтому крайне необходимо создать альтернативные и дополнительные источники трансплантируемых, функциональных стволовых клеток и клеток-предшественников и ткани для применения в клинике.
Сущность изобретения
Согласно одному варианту настоящего изобретения предусматривается композиция, содержащая мультипотентные стволовые/клетки-предшественники млекопитающих, способные дифференцироваться в различные линии эндодермальных клеток (например, в линию печеночных клеток, в линию билиарных клеток, в линию панкреатических клеток или их комбинацию), причем эти клетки получают из тканей желчных путей (любого отдела желчных путей, включая ворота, общий печеночный проток, пузырный проток, общий проток, общий гепатопанкреатический проток, желчный пузырь и перибилиарные железы, или клетки-предшественники или стволовые клетки, происходящие из перибилиарных желез) млекопитающего, включая человека, плод, новорожденного, ребенка, взрослого или умершего человека вплоть до момента через 72 часа после смерти. Предусматриваются композиции, содержащие популяцию клеток, включающих такие мультипотентные стволовые/клетки-предшественники млекопитающих и/или популяцию клеток млекопитающих, обогащенных такими мультипотентными стволовыми/клетками-предшественниками.
Мультипотентные стволовые/клетки-предшественники могут экспрессировать: (i) по меньшей мере один маркер, свойственный печеночным клеткам на ранней стадии (например, HNF6, HES1, CK19, альбумин или AFP); (ii) по меньшей мере один маркер, свойственный панкреатическим клеткам на ранней стадии (например, PDX1, PROX1, NGN3 или инсулин); и по меньшей мере один маркер, из категорий (а)-(в): (а) по меньшей мере один поверхностный маркер, находящийся на стволовой/клетке-предшественнике (например, CD133 (проминин), CD44H (рецептор гиалуронана), N-САМ, CXCR4 или ЕрСАМ); (б) по меньшей мере один транскрипционный фактор, свойственный эндодермальным стволовым/клеткам-предшественникам (например, SOX9, SOX17 или FOXA2), и (в) ген плюрипотентности с экспрессией от слабой до умеренной (например, SOX2, NANOG, KLF4, ОСТ4А или ОСТ4). В некоторых случаях мультипотентные стволовые/клетки-предшественники могут экспрессировать один маркер из каждой из этих категорий (i), (ii) и (а)-(в). Экспрессию можно определять ОТ-ПЦР анализом с определением по конечной точке и количественным ОТ-ПЦР анализом и/или иммуногистохимическим анализом ткани in vivo, свежевыделенных клеток или культивированных клеток.
Мультипотентные клетки могут также осуществлять экспрессию по меньшей мере одного из нижеприведенных элементов: (i) ядерную экспрессию белка теломеразы; (ii) экспрессию от низкой до умеренной генов плюрипотентности; (iii) ядерную или околоядерную экспрессию классических эндодермальных транскрипционных факторов (например, SOX17, SOX9, FOXA2, HES1, HNF6, PROX1, HNF3B (гепатоцитарный ядерный фактор -3В, FOXA2, SALL4 (белок Sal-like 4), PDX 1, NGN3 или их комбинации); (iv) экспрессию поверхностных маркеров эндодермальных стволовых/ клеток-предшественников; (v) не осуществлять экспрессию или осуществлять экспрессию (от низкой до переменной) маркеров клеток зрелой печени (Р450-3А4, трансферрина, тирозин аминотрансферазы (ТАТ) и высокого уровня экспрессию альбумина; маркеры зрелых клеток желчного протока включают АЕ2, CFTR, рецептор секретина, аквапорины или их комбинацию), линия зрелых клеток желчного протока или зрелых эндокринных клеток поджелудочной железы (инсулин, глюкагон, соматостатин, амилазу или их комбинацию; (vi) не осуществлять экспрессию маркеров для клеток мезенхимы, эндотелиальных клеток или гемопоэтических клеток.
В другом варианте изобретения предусматривается способ получения, выделения и/или идентификации мультипотентных стволовых/клеток-предшественников млекопитающих, способных дифференцироваться во множество эндодермальных линий клеток, эти клетки получают из ткани желчных путей (например, ткань отделов билиарного дерева включает ворота, общий печеночный проток, пузырный проток, общий проток, общий гепатопанкреатический проток и желчный пузырь, или их комбинацию) млекопитающего, причем этот способ включает получение ткани отделов билиарного дерева, а затем, и в любом порядке, или по существу одновременно, получение клеток, позитивных в отношении: (i) по меньшей мере одного маркера, характерного для печеночных клеток на ранней стадии (например, HNF6, HES1, CK19, альбумин или AFP); (ii) по меньшей мере одного маркера, характерного для панкреатических клеток на ранней стадии (например, PDX1, PROX1, NGN3 или инсулин); и, необязательно, по меньшей мере одного маркера, выбранного из категорий (а)-(в): (а) по меньшей мере одного поверхностного маркера, находящегося на стволовой/клетке-предшественнике (например, CD133 (проминин), CD44H (рецептор гиалуронана), N-САМ, CXCR4 или ЕрСАМ); (б) по меньшей мере одного транскрипционного фактора, характерного для эндодермальных стволовых/клеток-предшественников (например, SOX9, SOX17 или FOXA2), и (в) гена плюрипотентности с экспрессией от слабой до умеренной (например, SOX2, NANOG, KLF4, ОСТ4А или ОСТ4). Также предусматривается способ идентификации и выделения популяции мультипотентных клеток млекопитающих, обогащенных мультипотентными стволовыми/прогениторными клетками.
Согласно этому способу минимальная среда может представлять собой любую минимальную среду, богатую питательными веществами (нутриентами), не содержащую меди и с низким содержанием кальция (ниже 0.5 мМ), предпочтительно, дополненную инсулином, трансферрином/Fe, селеном, цинком, свободными жирными кислотами, связанными с сывороточным альбумином, и, необязательно, липопротеином высокой плотности. Примером минимальной среды является RPMI 1640. Клетки можно, необязательно, культивировать на чистом (без покрытия) пластике или пластике, покрытом коллагеном IV, коллагеном III, ламинином, гиалуронанами, другими матриксными компонентами из эмбриональных, фетальных тканей, тканей новорожденных или их комбинаций. Клетки культивируют по меньшей мере в течение 24 часов, предпочтительно, 7-21 дней. Согласно этому способу выделенные клетки на 80%, 90%, 95%, 95%, предпочтительно, на 100% обогащены стволовыми клетками по настоящему изобретению. Выделение можно проводить способами иммуноселекции (например, пэннингом, селекцией с помощью магнитных гранул, проточной цитометрией или их комбинацией) и/или в селективной культуральной среде.
Еще в одном варианте настоящего изобретения предусматривается способ размножения и/или увеличения количества новых мультипотентных столовых/прогениторных клеток млекопитающих, или популяции, содержащей такие клетки или обогащенной такими клетками или их клетками- партнерами (например, мезенхимальными клетками, ангиобластами и предшественниками звездчатых клеток), включающий: культивирование клеток на пластике или гиалуронанах или, необязательно, на пластике, покрытом коллагеном типа III или IV, или гиалуронаном, или другим матриксным компонентом из фетальной ткани, ткани новорожденных или эмбриональной ткани, и в минимальной среде, не содержащей меди, с низким содержанием (<0.5 мМ) кальция, содержащей инсулин, трансферрин/Fe, смесь свободных жирных кислот, связанных с сывороточным альбумином, и, необязательно, липопротеин высокой плотности.
Еще в одном варианте изобретения предусматривается способ линиеспецифической рестрикции новых мультипотентных стволовых/клеток-предшественников по дифференцировке во взрослые печеночные клетки (гепатоциты). Этот способ включает (а) получение клеточной суспензии, содержащей мультипотентные стволовые/клетки-предшественники млекопитающего, способные дифференцироваться во многие эндодермальные линии клеток, причем клетки получают из ткани отделов билиарного дерева млекопитающего; (б) включение клеточной суспензии в гидрогель, содержащий гиалуронан или гиалуронан в смеси с другими матриксными компонентами (например, типа IV коллагеном, ламинином или тем и другим); и (в) культивирование клеточной суспензии в минимальной среде, дополненной медью, кальцием (>0.5 мМ), инсулином, трансферрином/Fe, bFGF, гидрокортизоном, глюкагоном, галактозой, трийодтироксином (Т3), эпидермальным фактором роста (EGF), фактором роста гепатоцитов (HGF), липопротеином высокой плотности и смесью свободных жирных кислот, связанных с альбумином, в течение времени, достаточного для их дифференцировки в печеночные клетки.
Еще в одном варианте изобретения предусматривается способ линиеспецифической рестрикции новых мультипотентных стволовых/клеток-предшественников по дифференцировке во взрослые панкреатические клетки. Этот способ включает (а) получение клеточной суспензии, содержащей мультипотентные стволовые/клетки-предшественники клетки млекопитающих, способные дифференцироваться во многие эндодермальные линии клеток, причем клетки получают из ткани отделов желчных путей млекопитающего; (б) включение клеточной суспензии в гидрогель, содержащий гиалуронаны или гиалуронаны в смеси с другими матриксными компонентами; и (в) культивирование клеток в минимальной среде, дополненной медью, кальцием (≥0.5 мМ), В27, аскорбиновой кислотой, инсулином, трансферрином/Fe, bFGF, циклопамином, ретиноевой кислотой, эксендином 4, липопротеином высокой плотности и смесью свободных жирных кислот, связанных с альбумином; и не содержащей гидрокортизон в течение времени, достаточного для их дифференцировки в панкреатические клетки.
Еще в одном варианте изобретения предусматривается способ линиеспецифической рестрикции новых мультипотентных стволовых/клеток-предшественников по дифференцировке во взрослые клетки желчных протоков. Этот способ включает (а) получение клеточной суспензии, содержащей мультипотентные стволовые/клетки-предшественники млекопитающих, способные дифференцироваться во многие эндодермальные линии клеток, причем клетки получают из ткани отделов билиарного дерева млекопитающего; (б) включение клеточной суспензии в гидрогель, содержащий гиалуронаны или гиалуронаны в смеси с другими матриксными компонентами (например, коллагеном типа I); и (в) культивирование клеток в минимальной среде, дополненной медью, кальцием (≥0.5 мМ), инсулином, трансферрином/Fe, bFGF, сосудистым эндотелиальным фактором роста (фактором роста сосудистого эпителия) (VEGF), фактором роста гепатоцитов (HGF), липопротеином высокой плотности и смесью свободных жирных кислот, связанных с альбумином, в течение времени, достаточного для их дифференцировки в холангиоциты.
Еще в одном варианте изобретения предусматривается способ дифференцировки клеток in vivo, включающий трансплантацию мультипотентных стволовых/прогениторных клеток млекопитающих по п. 1 или популяций, содержащих такие клетки или обогащенных такими клетками, in vivo в виде клеточных суспензий или имплантатов или графтов, с предварительной линиеспецифической рестрикцией или без предварительной линиеспецифической рестрикции в подходящих культуральных условиях, в желчный проток, где они дифференцируются в ткань (участка, отдела) желчных путей.
Еще в одном варианте изобретения предусматривается способ дифференцировки клеток in vivo, включающий трансплантацию мультипотентных стволовых/прогениторных клеток млекопитающих по п. 1, популяций, содержащих такие клетки или обогащенных такими клетками, in vivo в виде клеточных суспензий или имплантатов или графтов, с предварительной линиеспецифической рестрикцией или без предварительной линиеспецифической рестрикции в подходящих культуральных условиях, под почечную капсулу или в эпидидимальное жировое тело, где они дифференцируются в функциональную ткань поджелудочной железы.
В связи с этим прежде, чем подробно объяснять по меньшей мере один вариант изобретения, следует отдавать отчет, что изобретение не ограничивается его применением к деталям конструкции и к расположению компонентов, представленных в нижеприведенном описании или проиллюстрированных рисунками. Изобретение может иметь варианты способа воплощения помимо описанных и может применяться на практике и осуществляться различными способами. Также следует понимать, что формулировки и термины, применяемые в данном описании, а также в реферате, даются с целью описания, и их не следует рассматривать как ограничивающие.
Соответственно, специалисты в данной области техники поймут, что концепцию этого раскрытия можно легко использовать как основу для создания других структур, способов и систем для осуществления нескольких целей настоящего изобретения. Поэтому важно отметить, что Формулу изобретения следует рассматривать как включающую такие эквивалентные конструкции в той части, в которой они не отступают от сущности и объема настоящего изобретения.
Краткое описание чертежей
На Фигуре 1 представлена принципиальная схема, изображающая мультипотентные стволовые клетки билиарного дерева по настоящему изобретению, обладающие способностью дифференцироваться в несколько типов эндодермальных тканей. Все клетки экспрессируют "эндодермальные" транскрипционные факторы (Е) (например, SOX9, SOX17, FOXA2) и другие маркеры популяций стволовых/прогениторных клеток (поверхностные антигены, такие как CD133, CD44H, ЕрСАМ, CXCR4, NCAM). Линиеспецифическая рестрикция приводит к различным направлениям дифференцировки во взрослые клетки, включая печеночные, панкреатические клетки и клетки билиарного дерева.
На Фигуре 2 представлена принципиальная схема билиарного дерева, показывающая его связь с печенью, поджелудочной железой и двенадцатиперстной кишкой. Звездочкой показаны области, в которых может находиться большое число перибилиарных желез, ниши стволовых клеток билиарного дерева.
На Фигуре 3 представлен ряд изображений, полученных при гистологическом и иммуногистохимическом исследовании различных областей билиарного дерева, которые можно использовать для идентификации маркеров, а также числа и размеров перибилиарных желез по всем желчным путям, (а) Распределение и характеристика перибилиарных желез (PBG) во внепеченочных желчных путям. PBG присутствуют в стенках протоков желчных путей и являются областями пребывания стволовых/прогениторных клеток желчных путей. Были определены (изучены желчные пути n=5 человек) число и размеры перибилиарных желез в различных областях желчных путей, профили маркеров PBG. Плотность PBG, выраженная в виде отношения «занятая ацинусами площадь/общая площадь поверхности PBG», оценивается с помощью анализа изображений; число и обхват (длину замкнутого контура) анализируют гистологически в различных областях человеческого внепеченочных желчных путей. Наивысшие плотность и число PBG наблюдается в области гепатопанкреатической ампулы; примерно равные количества наблюдаются в пузырном протоке и в воротах; меньшие число и размеры обнаружены в желчном протоке; и ничего не обнаружено в желчном пузыре. *р<0.01. Увеличение образца х 10. b: Иммуногистохимия PBG in situ. PBG являются позитивными в отношении CK7, CK19, NCAM, CD133, инсулина, ЕрСАМ, SOX9, SOX17 и PDX1, но негативными (или с очень низкими уровнями) в отношении альбумина. В различных перибилиарных железах наблюдается варьирование этих ранних линиеспецифических (характерных для какой- либо линии клеток) маркеров (например, альбумина) (см. на Фигуре 7 подтверждение для альбумина). Увеличение образца х 40.
На Фигуре 4 показано, что стволовые клетки локализованы, главным образом, в перибилиарных железах (PBG). Следует обратить внимание, что в единичной перибилиарной железе существует изменчивость (вариабельность) экспрессии маркеров стволовых клеток, которым в данном случае является PDX1. Красной стрелкой показаны ядра клеток, экспрессирующих фактор транскрипции (транскрипционный фактор); черными стрелками показаны ядра клеток, не экспрессирующих его.
На Фигуре 5 показаны SOX17 (А) и PDX1 (В) наряду с ЕрСАМ (зеленый) и ядрами, с помощью 4',6-диамидино-2-фенилиндола (DAPI) окрашенными синим, в перибилиарных железах пузырного протока.
На Фигуре 6 представлены результаты иммуногистохимического исследования человеческой билиарной ткани, показывающие экспрессию ЕрСАМ, SOX9 и SOX17 в перибилиарных железах в пузырном проходе и воротах.
На Фигуре 7 кратко представлены основные свойства мультипотентных стволовых клеток билиарного дерева. Эти свойства включают поверхностные маркеры стволовых/прогениторных клеток; факторы транскрипции, типичные для эндодермальных прогениторных клеток (клеток-предшественников); вариабельную экспрессию ранних линиеспецифических маркеров печени, билиарного дерева и поджелудочной железы; а на Фигуре 8 представлена экспрессия, от слабой до умеренной, генов плюрипотентности. Типичные ОТ-ПЦР анализы ворот печени показывают широкий набор эндодермальных транскрипционных факторов (SOX9, SOX17, FOXA2, PDX1, NGN3 и т.д.) и классических поверхностных маркеров стволовых/клеток-предшественников (например, ЕрСАМ, NCAM, CXCR4, CD133).
На Фигуре 8 представлены результаты ОТ-ПЦР, показывающие экспрессию генов плюрипотентности в ткани пузырного протока и ворот. Их экспрессия, от слабой до умеренной, дает дополнительное доказательство способности стволовых клеток билиарного дерева самореплицироваться. Гены плюрипотентности представляют собой гены, экспрессирующиеся в эмбриональных стволовых (ES, ЭС) клетках и способные давать индуцированные плюрипотентные стволовые (iPS) клетки, если различные комбинации этих генов трансфецируются в соматические клетки. Было идентифицировано по меньшей мере 5 генов: ОСТ4, SOX2, NANOG, KLF4 и c-MYC. В ткани билиарного дерева и в выделенных стволовых клетках билиарного дерева наблюдаются уровни экспрессии, от слабых до умеренных, для ОСТ4, SOX2, NANOG, KLF4, но не c-MYC.
Фигура 9. Желчный пузырь не содержит перибилиарных желез (что показано также на Фигуре 3). Однако клетки, экспрессирующие некоторые из транскрипционных факторов и поверхностных маркеров стволовых/прогениторных клеток, присутствуют в клетках желчного пузыря. Следует отметить, что коричневатое окрашивание, указывающее на экспрессию анализируемого маркера (ЕрСАМ или PDX1), наблюдается в клетке на поверхности желчного пузыря.
На Фигуре 10 показаны результаты иммуногистохимического анализа ткани желчного пузыря, который не имеет перибилиарных желез (a, c, d). Клетки являются позитивными в отношении ЕрСАМ (зеленый) и в них наблюдается околоядерное окрашивание на эндодермальные транскрипционные факторы (показан SOX17 - красный). (b) клетки также экспрессируют PDX1 (розовый) и являются заметно пролиферативными, разросшимися, как показывает Ki67 окрашивание (зеленый).
Фигура 11. Колонии стволовых/прогениторных клеток из ткани билиарного дерева. Клетки выделяли и культивировали в бессывороточной среде Куботы (Kubota's) и на культуральном пластике. Наблюдали за колониями трех различных типов, Типа 1-3, в этих условиях, которые не являются пермиссивными для зрелых клеток, но доступными, скорее, для эндодермальных стволовых/прогениторных клеток. Иммуногистохимическое окрашивание свидетельствует об экспрессии специфических генов, указанных цветным текстом, изображающим маркер. Все срезы окрашены 4',6-диамидино-2-фенилиндолом (DAPI), окрашивающим ядра синим цветом. Колония типа 1(а) агрегаты клеток с сильной экспрессией ЕрСАМ, NCAM и ASBT. Клетки росли медленно (деление каждые 3-4 дня или медленнее). Клетки колонии типа 2(b) с фенотипом, очень близким фенотипу hHpSCs, и 100% клеток экспрессирует ЕрСАМ, NCAM, но они не экспрессируют AFP (с делением каждые 36-40 часов). Колония типа 3(с) состоит из клеток с волнообразным, завихряющим движением, экспрессирующих ЕрСАМ по краям (на границе), но не внутри колоний, с высокими уровнями экспрессии SOX17, PDX1 или SOX 9 в клетках внутренней области (с делением каждые 36-40 часов). Увеличение для всех изображений 20Х. Рисунки показывают типичные результаты для более чем 10 экспериментов, в которых за колониями наблюдали в течение 4-8 недель.
Подтверждение связи между клетками колоний типов 2 и 3 приводится на фотоизображении (d), сделанном при малом увеличении (4Х). Неизвестно, является ли один (тип) предшественником другого. Анализы ОТ-ПЦР (е) показывают экспрессию разнообразных генов в колониях из пузырного протока по сравнению с желчным пузырем. Анализы ОТ-ПЦР клеток из двух тканей совершенно аналогичны, но в клетках из пузырного протока наблюдается слабая экспрессия альбумина и инсулина, двух генов, не экспрессируемых в прогениторных клетках, которые были получены из желчного пузыря и выращивались в бессывороточной среде Куботы (Kubota) и на пластике.
Фигура 12. Стволовые клетки билиарного дерева, в особенности клетки колоний типа 2 и 3, устойчиво увеличиваются в объеме в течение нескольких месяцев, давая в результате колонии клеток со стабильной экспрессией маркеров стволовых/прогениторных клеток. Это является частичным доказательством саморепликации клеток; дополнительное подтверждение дает экспрессия генов плюрипотентности (Фигура 8). Здесь показана колония типа 3 после месяца пребывания в культуре с поддержанием экспрессии PDX1 (оранжевый/красный) в клетках, которые находятся в центре колонии, и с ЕрСАМ (зеленый), экспрессирующимся только по краям (на границах) колонии, в областях, в которых наблюдается слабая дифференцировка. DAPI окрашивание (синим) показывает ядра клеток.
Фигура 13. Фазовая микрофотография колонии стволовых клеток билиарного дерева в культуре после 8 недель культивирования на культуральном пластике и в бессывороточной среде Куботы. Колония начиналась с 1-2 клеток ткани билиарного дерева взрослого человека. Для оценки числа клеток в колонии для многих областей колонии были получены увеличенные изображения (типичные изображения показаны в Декартовой системе координат в виде областей, обведенных цветными линиями), и эти области визуализировали с помощью программного обеспечения Metamorph и использовали для подсчета числа клеток. Выборочное обследование областей дало результат более 500000 клеток в колонии. В образцах фетальной ткани билиарного дерева мы обычно наблюдали >50 таких колоний; в образцах ткани пузырного прохода и ворот мы обычно получали >100 таких колоний.
Фигура 14. Локализация транскрипционных факторов (или белка теломеразы) в ткани (in situ) или в культурах стволовых клеток билиарного дерева. Иммуногистохимический анализ выявил, что транскрипционные факторы и белок теломераза находятся интрануклеарно в некоторых клетках и около ядер или в цитоплазме в других клетках. Значение этого факта неизвестно, хотя мы предполагаем, что нуклеарная локализация непосредственно связана с активным фактором, а околоядерная или цитоплазматическая локализация может представлять собой форму запасания. На этих снимках SOX17 экспрессируется в ядре некоторых, но не всех, клеток перибилиарной железы in vivo (данные in situ) и экспрессируется в ядрах всех стволовых клеток билиарного дерева в культуре на пластике и в среде Куботы (Kubota). В изображениях культур ядра окрашены синим с помощью DAPI; некоторые из клеток экспрессируют ЕрСАМ (зеленый); но у всех наблюдается интрануклеарная локализация SOX17 (красный). Когда изображения объединяются, ядра кажутся розовыми (смешение синего и красного цветов).
Фигура 15. В колонии типа 3 стволовых клеток билиарного дерева наблюдается как нуклеарная, так и околоядерная локализация фактора транскрипции SOX17 (красный/розовый). Клетки по периметру колонии положительны в отношении ЕрСАМ (зеленый цвет). Ядра окрашены DAPI в синий цвет.
Фигура 16. In situ окрашивание клеток желчного пузыря демонстрирует только околоядерное и цитоплазматическое окрашивание SOX 17 (красный/оранжевый цвет). Клеточные мембраны позитивны относительно ЕрСАМ (зеленый цвет), а ядра окрашены DAPI в синий цвет.
Фигура 17. Мультипотентность стволовых клеток билиарного дерева. Влияние среды определенного гормонального состава (HDM), индивидуально, на направление дифференцировки в гепатоциты или холангиоциты. Стволовые клетки остаются неопределенно долгое время в качестве стволовых/прогениторных клеток, если культивируются на пластике или в культуре Куботы (Kubota). Они дифференцируются во взрослые клетки, если среда меняется на среду определенного гормонального состава (HDM)), созданную для направления дифференцировки во взрослые клетки. Они будут дифференцироваться во взрослые клетки быстрее и эффективнее, если HDM применяют в комбинации с засеванием клеток на или включением их в формы внеклеточного матрикса (Фигуры 20-22). В этих исследованиях получены репрезентативные данные, указывающие на влияние конкретной HDM на дифференцировку стволовых/прогениторных клеток билиарного дерева в гепатоциты (HDM-L) по сравнению с холангиоцитами (HDM-С).
Стволовые/клетки-предшественники желчных путей из колоний, поддерживаемых в условиях саморепликации (культуральный пластик и бессывороточная среда Куботы или ее эквивалент), переносили либо в HDM, созданную либо для гепатоцитов (HDM-L), изображения в верхнем ряду, либо для холангиоцитов (HDM-С), изображения в нижнем ряду. HDM-L эффекты: Иммунофлуоресценция (а) через 7 дней. Клетки были диффузно позитивны в отношении CK18 (красный цвет) и/или альбумина (сине- зеленое окрашивание). Увеличение: 20Х. Полуколичественные данные (с): сравнение числа гепатоцитов (CK18+/альбумин+клеток) в условиях саморепликации (оценка в баллах: 0) с HDM-L (оценка в баллах: 2.2±0.8), в >20% клеток, что представляет собой данные, отражающие, что имеют линию развития, рестрицированную по дифференцировке в гепатоциты. HDM-C эффекты:. Иммунофлуоресценция (b) через 7 дней. Клетки были диффузно позитивны к СК7, рецептору секретина (SR) и CFTR. Они коэкспрессировали CK7/SR и CK7/CFTR. Увеличение образца 20Х, за исключением с4 и с5, которые даются с увеличением 40Х. Полуколичественная оценка (с) % SR+/CFTR+ клеток в условиях саморепликации (0.2±0.4; <5% клеток) по сравнению с HDM-С (3±0.7, что приравнивается к >30% клеток с линиеспецифической рестрикцией по холангиоцитам.
Фигура 18. Мультипотентность стволовых клеток билиарного дерева. Влияние среды определенного гормонального состава, приготовленной для поджелудочной железы (HDM-P), индивидуально, на дифференцировку в панкреатические клетки. HDM-P эффекты: Иммунофлуоресценция для определения панкреатических маркеров после 7 дней культивирования в HDM-P. На периферии колоний происходила агрегация и уплотнение клеток с образованием структур, подобных островкам (a-d) содержащих с-пептид (a, b), PDX-1 (с) и инсулин (d). Недифференцированные клетки (ЕрСАМ+ клетки) были обнаружены в центрах колоний (е). Увеличение образца: 20Х. Число "островкоподобных" структур (f), обнаруженных в условиях саморепликации (1±0.7; <10% клеток), было значительно меньше, чем число таких структур в HDM-Р (3.8±1.3; ~40% клеток). Уровни С-пептида (g) в нг/мкг белка в присутствии глюкозы с концентрацией, обнаруживаемой во всех RPMI 1640 препаратах (11.1 мМ), при инкубации в течение 2 часов в условиях саморепликации были 4.5±2.25 по сравнению с 12.3±1.9 нг/мкг в HDM-Р. Результаты выражают как Среднее±Стандартная ошибка, N=4; *р<0.05. (b) Стимулируемую глюкозой секрецию С-пептида наблюдали в HDM-Р контрольных образцах, причем уровни С-пептида в среде, в мкг/л, составляли от 1.10±0.32 мкг/л при низких уровнях глюкозы (5.5 мМ) до 1.92±0.43 мкг/л при высоких уровнях глюкозы (22 мМ) n=7; *р<0.01.
Фигура 19. Мультипотентность стволовых клеток желчных путей. Количественные (q) - RT-PCR анализы для определения эффектов самой среды. Анализы проводили на культурах стволовых клеток билиарного дерева, поддерживающихся в условиях саморепликации (культуральный пластик и среда Куботы), в сравнении с одной бессывороточной средой определенного гормонального состава (HDM-L, или HDM-С, или HDM-P), приготовленной для гепатоцитов, холангиоцитов по сравнению с панкреатическими клетками. Относительные уровни экспрессии мРНК рассчитывают, располагая в определенном порядке нормализованные значения ΔCt в зависимости от геометрического среднего трех наиболее устойчивых генов домашнего хозяйства. Показаны результаты плюс или минус (±) стандартное отклонение. Уровни значимости для каждого из них *р<0.05. n = число проведенных экспериментов.
Фигура 20. Мультипотентность стволовых клеток билиарного дерева. Влияние как HDM, так и компонентов внеклеточного матрикса на дифференцировку стволовых клеток билиарного дерева. Билиарные стволовые клетки культивировали на пластике или в среде Куботы или ее эквиваленте (условия саморепликации) более одного месяца, получали колонии, такие как колония в (а). Такую репрезентативную колонию диспергировали и клетки помещали в среду, соответствующую одному из 3 условий дифференцировки, представленных в 3х-мерном (3-D) формате и состоящей из HDM + компоненты матрикса, приготовленные для дифференцировки в заданные взрослые клетки: одна для холангиоцитов (b), гепатоцитов (с) или для β-клеток поджелудочной железы (d). Их выдерживали до 9 дней в культуре, а затем анализировали на тканеспецифическую дифференцировку, которая показывает, что эти стволовые клетки желчных путей могут претерпевать линиеспецифическую рестрикцию по дифференцировке различные взрослые клетки (в данном описании приводятся примеры холангиоцитов, гепатоцитов и β-клеток поджелудочной железы (панкреатических клеток) в зависимости от культуральных условий. Ряд 3 = окрашивание дитизоном (DTZ), (показывает панкреатические α и β клетки). D = дни в культуре; Glu = глюкагон; С-Р=С-пептид, характерный для секреции инсулина.
Фигура 21. Просвечивающая (трансмиссионная) электронная микроскопия стволовых клеток билиарного дерева в условиях саморепликации (a-b) vs просвечивающей электронной микроскопии этих клеток в 3-D условиях дифференцировки с образованием зрелых гепатоцитов (печеночных клеток) (c-d). Присутствуют крупные и полигональные клетки и в ядрах клеток видны одно или более ядрышек, (с) Прилегающие клетки образуют хорошо очерченные желчные канальцы (стрелки). Желчные канальцы запираются узловыми комплексами (острие стрелки). В просвете присутствует несколько микроворсинок, (d). Следовательно, клетки способны созревать во взрослые гепатоциты и внутрипеченочные холангиоциты. Шкала = 2 мкм
Фигура 22. Доказательство мультипотентности стволовых/клеток-предшественников желчных путей способом количественного ОТ-ПЦР анализа на культурах в условиях саморепликации по сравнению с условиями 3-D дифференцировки. а. Стволовые/клетки-предшественники клетки билиарного дерева культивировали в среде Куботы и на пластике в течение 2 месяцев (условия саморепликации). Колонии либо поддерживали в этих условиях и при этом получали стволовые/клетки-предшественники клетки билиарного дерева (BP), либо переносили в 3-D условия дифференцировки для гепатоцитов (B-L), холангиоцитов (В-С) или панкреатических островков (В-Р), и все эти клетки культивировали еще в течение 2 недель. Затем культуры готовили для количественных ОТ-ПЦР анализов генов, релевантных каждой из этих направлений развития во взрослые клетки. Результаты выражают в виде гистограмм, в которых уровни экспрессии генов в условиях саморепликации (BP) принимаются за 1.0, а значение для каждого гена в клетках после дифференцировки во взрослую клетку дается в виде величины, кратной величине для BP. Звездочкой в некоторых гистограммах указывает на статистическую значимость (р<0.01 или p<0.001). N=2, каждый эксперимент проводили в тройном повторе. BP = билиарные стволовые/клетки-предшественники клетки; В-С = клетки желчного протока (холангиоциты) с линиеспецифической рестрикцией; B-L = печеночные клетки (гепатоциты) с линиеспецифической рестрикцией; В-Р = панкреатические клетки (островки) с линиеспецифической рестрикцией. Анализируемые гены GGT1 = ген гамма- глутамилтранспетидазы-1; АЕ2 = анионный обменник 2; CFTR = трансмембранный регулятор муковисцидоза; гены HNF4a = нуклеарного фактора гепатоцитов 4А; AFP = альфа- фетопротеина; ALB = альбумина; TF = трансферрина; ТАТ = тирозин-аминотрансферазы; CYP3A4 = цитохрома Р450 3А4; pdxl = панкреатический и дуоденальный гомеобокс гена 1; ISL-1 = ISL LIM гомеобокс гена 1; гены NGN3 = нейрогенина-3; INS = инсулина; GCG = глюкагона.
Фигура 23. Мультипотентность стволовых клеток билиарного дерева, показанная в исследованиях in vivo: Дифференцировка в гепатоциты. Стволовые клетки билиарного дерева поддерживали в культуре в условиях саморепликации (среда Куботы или ее эквивалент и культуральный пластик), а затем инъецировали в печень взрослых иммунокомпрометированных мышей в неактивном состоянии (т.е. печени не было нанесено никакого вреда). Затем приготовленные срезы печени мышей анализировали иммуногистохимическими способами на человеческие специфические маркеры, характерные для гепатоцитов. На данном снимке срез был окрашен антителом против человеческого Hepar-1 (Dako). Исследование срезов показало, что можно идентифицировать 6.52±2.5% общей площади, занятой человеческими гепатоцитами, позитивными по человеческому Hepar-1, классическому маркеру гепатоцитов.
Фигура 24. Мультипотентность стволовых клеток билиарного дерева, показанная при трансплантации in vivo: Направление дифференцировки в клетки билиарного дерева. Стволовые клетки билиарного дерева сохраняли в культуре в условиях саморепликации (среда Куботы или ее эквивалент и культуральный пластик), а затем инъецировали в печень взрослых иммунокомпрометированных мышей в неактивном состоянии (т.е. печени не было нанесено никакого вреда). Затем приготовленные срезы печени мышей анализировали иммуногистохимическими способами на человеческие специфические маркеры, характерные для холангиоцитов. Антитело Dako против человеческого CK7, маркера холангиоцитов, обнаружено, в среднем, на 12.7±5.5% всех холангиоцитов. При сравнении данных для человеческих холангиоцитов в малых и крупных желчных протоках было обнаружено, что ~ 14.92±5.9% клеток в крупных желчных протоках и ~ 5.02±1.95% клеток в малых желчных протоках позитивны по человеческому CK7.
Фигура 25. Мультипотентность стволовых клеток билиарного дерева, показанная при трансплантации in vivo: Направление дифференцировки в клетки поджелудочной железы (панкреатические). Стволовые клетки билиарного дерева сохраняли в культуре в условиях саморепликации (среда Куботы или ее эквивалент и культуральный пластик), а затем инъецировали в эпидидимальное жировое тело (EFP) самцов мышей Balb/C Rag2-/-/Il2rg-/-. Каждой мыши инъецировали 200-400 "неоостровков" (neoislets), клеточных агрегатов линии стволовых клеток желчных протоков, рестрицированной в течение 7-14 дней по дифференцировке в панкреатические островки в условиях 3-D дифференцировки: HDM-P плюс гидрогель, содержащий гиалуранон, типа IV коллаген и ламинин. Каждый неоостровок содержал более 1000 клеток. Трансплантацию контрольным мышам проводили с применением геля Matrigel без клеток. У мышей ежедневно проверяли уровни глюкозы, примерно, в течение 3 месяцев наблюдалась гипергликемия (600-750 мг/дл). Через 3 месяца у мышей, подвергшихся трансплантации, уровни глюкозы упали до уровней, составлявших менее половины уровней у контрольных мышей. Тесты на толерантность к глюкозе проводили на 68 и 91 день после операции, они показали значительные уровни человеческого С-пептида в крови экспериментальных мышей, а эти уровни регулируются глюкозой.
Подробное описание изобретения
Настоящее изобретение появилось в результате сделанного ранее неожиданного открытия мультипотентной стволовой клетки или клетки-предшественника и клеточных популяций, содержащих такие стволовые или клетки-предшественники, обнаруженных в билиарном дереве и обладающих способностью дифференцироваться в разнообразные линии эндодермальных клеток, включая печеночные, панкреатические клетки и клетки билиарного дерева (Фигура 1). Для того чтобы данная заявка стала более понятной, следует сказать, что термин "Стволовая клетка желчных путей" применяется в данном описании в отношении мультипотентной стволовой клетки или клетки-предшественника, клеточных популяций, содержащих такие клетки настоящего изобретения, и клеточных популяций, обогащенных этими клетками настоящего изобретения.
Новые мультипотентные стволовые клетки билиарного дерева можно выделять из любой области билиарного дерева, но особенно большие их количества находятся в перибилиарных железах и в точках разветвления дерева, которые показаны звездочками на схематическом изображении (Фигура 2). Звездочки на самых маленьких концах разветвления в печени относятся к каналам Геринга, нише стволовых клеток для внутрипеченочных стволовых клеток печени. Стволовые клетки билиарного дерева являются предшественниками внутрипеченочных печеночных стволовых клеток.
Источник клеток - Желчные пути
Желчные пути или внепеченочная билиарная система состоит из ряда протоков, связывающих двенадцатиперстную кишку с поджелудочной железой и включающих желчный пузырь (система схематически показана на Фигуре 2). По всем желчным путям, в стенках протоков, расположены перибилиарные железы (Фигуры 3-11), которые можно обнаружить в особенно больших количествах в местах разветвления, таких как ворота, общий печеночный проток, пузырный проток, общий гепатопанкреатический проток и желчный проток. Жидкость из печени или из вентральной поджелудочной железы попадает в двенадцатиперстную кишку через фатерову ампулу. В целом вся эта группа структур, включая желчный пузырь, в данном описании называется билиарным деревом.
Все составляющие билиарного дерева (например, ворота, общий печеночный проток, пузырный проток, общий проток, общий гепатопанкреатический проток и желчный пузырь) имеют стенки, состоящие из плотной волокнистой соединительной ткани, и просвет, выстланный слоем цилиндрического билиарного эпителия, расположенного на подложке - обычной базальной мембране. Гладкомышечные клетки распределены по протокам, в особенности близ фатеровой ампулы. Изредка в стенках протоков встречаются кровеносные сосуды, нервные волокна и некоторые лимфоидные клетки. Перибилиарные железы расположены на всем протяжении билиарного дерева, и особенно их много в общем гепатопанкреатическом протоке и воротах, общем печеночной протоке, пузырном протоке, общем протоке и желчном пузыре. Фигуры 3-7.
Желчный пузырь имеет отличительные признаки (Фигуры 9, 10). Просвет выстлан цилиндрическим эпителием, соответствующим мышечным слоем и подсерозной соединительной тканью. В желчном пузыре перибилиарные железы отсутствуют (Фигуры 3, 9). Однако, в желчном пузыре имеются клетки, фенотип которых частично совпадает с фенотипом популяций стволовых клеток билиарного дерева, обнаруженных в перибилиарных железах, которые являются транзиторно-амплифицирующими и/или коммитированными клетками-предшественниками.
Клетки по настоящему изобретению можно выделять из ткани билиарного дерева на любой стадии развития. Так, настоящее изобретение можно по существу применять на фетальной ткани, ткани новорожденного, ребенка или взрослого, включая ткань недавно умерших людей (предпочтительно, в пределах 10 часов, но оригинальные (патентоспособные) клетки остаются жизнеспособными, подходящими для выделения, до 72 часов после смерти). Фактически ткань билиарного дерева уникальна тем, что она легкодоступна от фетальных, педиатрических и взрослых доноров. Кроме того, настоящее изобретение может применяться на практике на ткани печени и поджелудочной железы, полученной, но затем оказавшейся непригодной для трансплантации, или из ткани биоптата, из удаленной ткани.
Идеи (изобретения) по данному описанию не являются ограничивающими или применимы к любым видам млекопитающих. Следует понимать, что фактически примеры по данному описанию являются лишь иллюстративными, и их не следует рассматривать как ограничивающие. Таким образом, данное изобретение не ограничивается приведенными в нем млекопитающими в качестве источника ткани билиарного дерева. Млекопитающие, из которых можно получать стволовые клетки билиарного дерева, включают, но без ограничения, человека, грызунов (например, крыс, мышей, хомяков), кроликов, крупный рогатый скот, лошадей, свиней, овец, собак и кошек. Предпочтительно, стволовые клетки билиарного дерева для применения на людях получают от человека.
Как отмечалось, новый класс стволовых клеток билиарного дерева по изобретению может дифференцироваться в разнообразные линии эндодермальных клеток. Действительно, можно индуцировать дифференцировку стволовых клеток билиарного дерева по настоящему изобретению в зрелые типы клеток нескольких эндодермальных линий дифференцировки, включая печеночные, билиарного дерева и панкреатические клетки. Фигуры 17-25.
Образцы ткани билиарного дерева можно иссекать хирургическим путем из печени или поджелудочной железы, полученных, а затем оказавшихся непригодными для трансплантации по таким причинам, как жировая дегенерация; анатомическая патология или серьезное сосудистое заболевание; или их можно получать из материала, удаленного при резекции. Ткань билиарного дерева можно извлекать из соединительной ткани брюшной полости. Затем ткань делят на сегменты и обрабатывают далее. Сегменты, особенно богатые стволовыми клетками билиарного дерева, включают: ворота, общий печеночный проток, пузырный проток, общий проток, общий печеночный проток и желчный пузырь.
Показано, что стволовые клетки билиарного дерева дают начало различным линиям эндодермальных клеток, включая клетки печени, билиарного дерева и поджелудочной железы (Фигуры 17-25). Стволовые клетки билиарного дерева экспрессируют белок теломеразу; гены плюрипотентности с уровнями от низких до умеренных (Nanog, SOX2, KLF4 и ОСТ4 - Фигура 8); классические эндодермальные транскрипционные факторы (факторы транскрипции) (например, SOX17, SOX9, FOXA2, HNF6, PROX1, FTNF3B ((гепатоцитарный ядерный фактор -3В, (также известный как (a.k.a.) FOXA2), SALL4 (белок Sal-like 4), PDX 1 и NGN3); поверхностные маркеры эндодермальных клеток (CD326/молекула адгезии эпителиальных клеток или ЕрСАМ; CD56/молекула клеточной адгезии нервных клеток или NCAM); CXCR4; и некоторые гены стволовых/прогениторных клеток (например CD44H-рецепторы гиалуронана и CD133, также называемый проминином). Фигуры 7, 8, 9, 13.
Помимо этого, по-видимому, вследствие плюрипотентности стволовые клетки билиарного дерева экспрессируют низкие или переменные уровни маркеров ранней печеночной дифференцировки (например, HNF6, HES1, FOXA2, и, переменно, альбумин), желчного протока (например, цитокератин 19) и эндокринной части поджелудочной железы (например, PDX1, NGN3, SALL4, инсулин). Фигуры 7, 22
Характерно, что стволовые клетки билиарного дерева экспрессируют факторы транскрипции PDX1 и NGN3 (Фигуры 3, 4, 7, 11), как известно, являющиеся существенно важными для развития поджелудочной железы и эндокринной части поджелудочной железы, соответственно. Однако, стволовые клетки билиарного дерева не экспрессируют или лишь слабо экспрессируют зрелые маркеры холангиоцитов (например, рецептор секретина, аквапорины), гепатоцитов (например, альбумин, тирозин аминотрансферазу или ТАТ, трансферрин, "поздние" Р450, такие как Р450-3А4) или островковых клеток (например, глюкагон, соматостатин, амилазу или высокие уровни инсулина) (Фигуры 3, 7, 13). Они совсем не экспрессируют маркеры мезенхимальных клеток (например, CD146, десмин), эндотелиальных клеток (например, рецептор VEGF, CD31, фактор фон Виллебранда) или гемопоэтических клеток (например, CD45). Профиль экспрессии антигенов является стабильным в течение жизни культуры, покуда поддерживаются условия саморепликации, состоящие из среды Куботы или ее эквивалента с субстратом - культуральным пластиком или гиалуронанами.
Эти профили экспрессии можно определить, используя анализы конечных результатов и количественную (q) - ОТ-ПЦР и иммуногистохимическое исследование ткани in vivo, свежевыделенных клеток или культивированных клеток. Коэкспрессия в клетках одной и той же перибилиарной железы различных маркеров эндодермальных стволовых/прогениторных клеток (например, SOX9, SOX17, PDX1, NGN3, FOXA2) является уникальным и неожиданным признаком, который отличается от результатов для эмбриональных стволовых (ES) клеток, подвергающихся линиеспецифической рестрикции по дифференцировке в панкреатические клетки, и в которых эти транскрипционные факторы наблюдаются последовательно, но не в одно и то же время. Помимо этого, экспрессия этих транскрипционных факторов отсутствует в зрелых билиарных клетках на обращенной в просвет поверхности желчных протоков.
Стволовые клетки желчных путей по данному изобретению, как объясняется выше, являются предшественниками зрелых эндодермальных тканей и имеют общие маркеры с клетками различных тканей, в которые они развиваются, включая клетки печени, билиарного дерева и поджелудочной железы.
Помимо их относительных уровней экспрессии, локализация в клетках теломеразы и транскрипционных факторов (например, SOX17, PDX1), экспрессирующихся в стволовых клетках билиарного дерева, в процессе созревания меняется от локализации в ядре (ядерной локализации) на околоядерную/цитоплазматическую локализацию (См. Фигуру 7, а также Фигуры 14-16). В единичной перибилиарной железе наблюдаются некоторые клетки с ядерной (нуклеарной), а некоторые с околоядерной локализацией или не наблюдается никакой экспрессии данного маркера (Фигуры 4, 6, 7, 14). Без связи с какой- либо теорией можно предположить, что внутриядерная локализация ассоциируется с более примитивными клетками, чем клетки с околоядерной локализацией транскрипционного(-ых) фактора(-ов). Предположительно, последние (клетки) являются переходными в клетки поздней стадии дифференцировки. Или же, околоядерная локализация может указывать на то, что фактор(-ы) находи(-я)тся в неактивной форме запасания, и может (могут) перемещаться в ядро при соответствующем запросе на регенерацию.
Настоящее изобретение предусматривает способы выделения и размножения стволовых клеток билиарного дерева. Популяции стволовых клеток человеческой ткани билиарного дерева идентифицировали способами селекции культуры, но можно также выделять способами иммуноселекции (например, проточной цитометрии, пэннинга, селекции с помощью магнитных гранул). Или же, или помимо иммуноселекции, стволовые клетки билиарного дерева по настоящему изобретению можно выделять путем подбора условий культивирования ткани. Например, клеточные суспензии, приготовленные из ткани билиарного дерева, можно засевать на пластик или гиалуронаны. В других вариантах изобретения пластик, необязательно, покрывают коллагеном IV, коллагеном III, ламинином, гиалуронанами, другими матриксными компонентами, имеющимися в эмбриональных/фетальных тканях, или их комбинациями.
Среда, используемая для селекции культуры, бессывороточная среда Куботы (Kubota), или ее эквивалент, является высокоселективной для выживания и пролиферации стволовых клеток билиарного дерева и их клеток-партнеров, мезенхимальных клеток, ангиобластов и звездчатых клеток-предшественников, но не является селективной для зрелых клеток билиарного дерева. Основной особенностью (сущностью) этой среды является то, что она представляет собой любую минимальную среду, не содержащую меди, имеющую низкое содержание (<0.5 мМ) кальция, содержащую инсулин, трансферрин/Fe, свободные жирные кислоты, связанные с очищенным альбумином, и, необязательно, также липопротеин высокой плотности.
Среда Куботы или ее эквивалент представляет собой бессывороточную среду и содержит только очищенную и определенного состава смесь гормонов, факторов роста и нутриентов (питательных веществ). Более конкретно, среда состоит из бессывороточной минимальной среды (например, RPMI 1640), не содержащей меди, с низким содержанием (<0.5 мМ) кальция, и дополненную инсулином, (5 мкг/мл), трансферрин/Fe (5 мкг/мл), липопротеином высокой плотности (10 мкг/мл), селеном (10-10 М), цинком (10-12 М), никотинамидом (5 мкг/мл) и смесью свободных жирных кислот, связанных с формой очищенного альбумина. Подробно способы приготовления таких сред представлены в других источниках, например, в статье Kubota Н, Reid LM, Proceedings of the National Academy of Sciences (USA) 2000; 97: 12132-12137, описание которой во всей полноте включено в настоящее изобретение посредством отсылки.
В этих условиях получают колонии стволовых клеток билиарного дерева, которые быстро растут в течение нескольких недель (более 8 недель), со скоростью пролиферации, определяемой делением каждые 36-40 часов. Фигуры 11-13. Культуры способны стабильно сохраняться в виде стволовых/прогениторных клеток в течение более 8 недель (Фигура 13), это доказывает, что они подвергаются саморепликации. Саморепликация дополнительно подтверждается обнаружением от слабых до умеренных уровней экспрессии генов плюрипотентности. Фигура 8. Наибольшее число колоний получено в культурах областей (участков) билиарного дерева с большим числом перибилиарных желез, промежуточное число колоний наблюдается в культурах из участков, отличных от точек разветвления, или из желчного пузыря, в котором нет перибилиарных желез.
Линиеспецифическая рестрикция и дифференцировка во взрослые клетки
В соответствии с мультипотентностью стволовых клеток билиарного дерева, если колония сохраняется в течение нескольких недель (например, более месяца в культуре) в условиях саморепликации, а затем среду меняют на бессывороточную среду определенного гормонального состава (HDM), приготовленную для взрослых клеток конкретного типа, клетки частично дифференцируются во взрослые клетки предполагаемого типа (Фигуры 17-19). В HDM для печеночных клеток (HDM-L) у 20-30% клеток обнаруживается экспрессия цитокератина 8 и 18 и альбумина, тогда как в HDM для холангиоцитов (HDM-С) более половины их созревает в клетки, экспрессирующие рецептор секретина, и CFTR. Фигура 17. Уровень экспрессии человеческого альбумина в культурах в HDM-L уровень экспрессии рецептора секретина в культурах в HDM-С был значительно выше, чем в среде Куботы или в ее эквиваленте (условия саморепликации) в анализах способом количественной ОТ-ПЦР (Фигура 19).
Частичная линиеспецифическая рестрикция клеток по дифференцировке в панкреатические островки происходила, если стволовые клетки билиарного дерева культивировали в HDM для панкреатических клеток (HDM-Р). Фигура 18. Дифференцировка происходила главным образом по краям (по границе) колоний, в местах, в которых образовывались клеточные агрегаты и внутри которых были обнаружены С-пептид, PDX1 и инсулин. Более половины колоний клеток проявляли способность продуцировать человеческий С-пептид (Фигура 18h и 18g), указывающий на синтез человеческого инсулина, и этот С-пептидный синтез регулировался уровнями глюкозы (Фигура 18b). Уровень продуцируемого человеческого инсулина в культурах в HDM-Р был значительно выше по сравнению с культурами, остающимися в виде стволовых клеток в условиях саморепликации (Фигура 19).
Степень мультипотентности более наглядно была продемонстрирована, когда клетки были помещены в явные 3-D условия дифференцировки, состоящие из конкретной среды HDM (HDM-L, HDM-С, HDM-Р) в сочетании с включением клетки в гидрогели, содержащие специфические компоненты внеклеточного матрикса, приготовленные для взрослых клеток целевого типа (Фигура 20). Клетки быстро дифференцировались (например, 7-10 дней) в конкретные типы взрослых клеток, давая скопления (ряды) печеночных клеток в HDM-L в комбинации с гидрогелями гиалуронанов, содержащих типа IV коллаген и ламинин; клетки разветвленных желчных протоков, т.е. билиарного дерева, в HDM-С в комбинации с гидрогелями гиалуронанов, содержащими типа I коллаген; или панкреатические "неоостровки" (эндокринная часть поджелудочной железы) в сочетании HDM-Р с гидрогелями, содержащими типа IV коллаген и ламинин.
Другое подтверждение дифференцировки в 3-D культуральных условиях было найдено, когда сравнивали стволовые клетки билиарного дерева в условиях саморепликации (Фигура 21, а и b) и в условиях, созданных для гепатоцитов (Фигура 21, с и d), а затем характеризовали способом просвечивающей электронной микроскопии. Просвечивающая электронная микроскопия стволовых клеток билиарного дерева в условиях саморепликации (а-b) в сравнении с условиями для дифференцировки в гепатоциты (c-d). В условиях дифференцировки присутствовали крупные и полигональные клетки, а в клеточных ядрах находились одно или более ядрышек. Прилегающие клетки образуют четко очерченные желчные канальцы (стрелки). Желчные канальцы запираются узловыми комплексами (острие стрелки). В просвете присутствует несколько микроворсинок. Следовательно, клетки способны созревать во взрослые гепатоциты и внутрипеченочные холангиоциты. Масштаб на фигурах равен 2 мкм
Доказательство того, что в условиях дифференцировки образуются функциональные взрослые клетки, приводятся на Фигуре 22, на которой представлены результаты количественной RT-PCR (ОТ-ПЦР) для культур в условиях саморепликации, в которых получают билиарные стволовые/клетки-предшественники клетки (BP), по сравнению с 3-D условиями для печеночных клеток (B-L), клеток билиарного дерева/холангиоцитов (В-С) или панкреатических клеток (В-Р). В верхнем ряду показано резкое повышение экспрессии классических-HNF4, AFP, альбумина, тирозин-аминотрансферазы (ТАТ), трансферрина (TF) и Р450-3А4 - в культуре в условиях для печеночных клеток, но не для стволовых/прогениторных клеток, или клеток билиарного дерева или поджелудочной железы. Напротив, в условиях для панкреатических клеток ((В-Р), второй ряд) наблюдается очень резкое повышение генной экспрессии для PDX-1, ISL-1, NGN3, инсулина, глюкагона (GCG), но не для генов для стволовых/прогениторных клеток, или печени, или билиарного дерева. В клетках, помещенных в условия для билиарного дерева, наблюдается повышение экспрессии GGT1, АЕ2, CFTR. Культуры стволовых клеток билиарного дерева, снова помещенные в условия саморепликации, сохраняли высокие уровни ЕрСАМ и низкие уровни всех генов, специфических для взрослых клеток.
Такая мультипонентность демонстрируется также, когда клетки трансплантируют in vivo (Фигуры 23-25). Стволовые клетки билиарного дерева трансплантировали в иммунокомпрометированных мышей, а затем ткани оценивали на присутствие пересаженных (привитых) зрелых человеческих клеток. Даже у мышей с печенью в спокойном состоянии, у которых не было поражения печени, можно было пересаживать (прививать) клетки, и они могли созревать в значительное число гепатоцитов (Фигура 23) и холангиоцитов (Фигура 24). Кроме того, мышам, которым трансплантировали клетки с панкреатической линией дифференцировки, давали лекарства, которые сообщали им диабет, а трансплантированные клетки спасали их от диабета (выводили их из диабетического состояния), и оказалось, что эти клетки ответственны за уровни глюкозы в пересчете на продуцирование человеческого С-пептида (Фигура 25).
Хотя было идентифицировано много клеток-предшественников и было показано, что они дифференцируются в зрелые печеночные клетки, стволовые клетки билиарного дерева, идентифицированные в настоящей заявке и присутствующие в тканях зародышей, новорожденных, детей и взрослых, представляют собой первые стволовые клетки и клеточные популяции, идентифицированные до настоящего времени, которые можно выделять из ткани взрослого пациента и которые, как оказалось, способны дифференцироваться во взрослые панкреатические типы клеток. Эти клетки также являются первыми идентифицированными клетками, которые можно сразу же использовать в клинических программах по диабету ввиду того, что они продемонстрировали способность дифференцироваться в панкреатические островковые клетки, отсутствие онкогенного потенциала (которым обладают ES клетки или клетки, трансфецированные с использованием генов, крайне важных дли дифференцировки в панкреатические клетки) и отсутствие иммуногенности.
Стволовые клетки билиарного дерева являются натуральными предшественниками панкреатических клеток и могут быстро и легко дифференцироваться (в течение нескольких пребывания дней в культуре) в панкреатические клетки лишь за счет использования специфической микроокружающей среды. Помимо этого, перенос в условия клиники также облегчается тем, что необходимые условия микроокружения доступны в формах GMP (Надлежащей Медицинской Практики) и в настоящее время являются частью существующих способов лечения в клинике. Поэтому по меньшей мере одно применение в медицинской практике представляет собой применение стволовых клеток билиарного дерева по данному описанию для полной или частичной репопуляции, спасения, поддержания, восстановления, замены или введения панкреатических бета-подобных клеток для лечения диабета (Фигура 25), или форм печеночной недостаточности, понижения деятельности печени или дистрофии печени (Фигуры 23 и 24).
На основании настоящего раскрытия рядовому специалисту в данной области техники будет понятно, что стволовые клетки билиарного дерева имеют различные применения в медицинской практике и терапии. Введение стволовых клеток билиарного дерева может быть сравнительно неинвазивной и относительно безвредной для пациента процедурой. Способность этих стволовых клеток билиарного дерева размножаться in vitro содействует получению достаточного количества клеток для клинических программ (например, 106-109 клеток). Количество стволовых клеток, необходимых для программ по клеточной терапии, легко получают в течение нескольких недель после того, как клетки получили (закупили), прогрессировали и культивировали, как показано на Фигуре 13.
Стволовые клетки желчных путей, предусмотренные для терапии, можно получить от конкретного донора, а затем ввести обратно тому же самому человеку, осуществляя аутологичную терапию, не создающую иммунологических проблем с точки зрения отторжения клеток, так как клетки и реципиент, предпочтительно, являются генетически идентичными. Или же, стволовые клетки и популяции клеток билиарного дерева, предусмотренные для терапии, можно получать от конкретного донора, а затем ввести другому человеку, что представляет собой пересадку аллогенных клеток (аллогенная терапия), поскольку стволовые клетки билиарного дерева являются неиммуногенными или минимально иммуногенными. Наконец, стволовые клетки билиарного дерева по изобретению должны быть относительно безопасными в экспериментах на животных и в культурах в том, что касается онкогенного потенциала. Во всех in vivo исследованиях, проведенных до настоящего времени, не было никаких свидетельств туморогенного потенциала.
В другом варианте изобретения стволовые клетки или популяции клеток билиарного дерева применяют для in vitro продуцирования целевых эндодермальных клеток и целевой эндодермальной ткани (например, поджелудочной железы, печени, желчного протока). Соответственно, изобретение предусматривает и охватывает способы получения "целевых" клеток и тканей из стволовых клеток или популяций клеток билиарного дерева, причем эти способы включают выделение стволовых клеток билиарного дерева, их инкубацию в условиях, которые направляют их дифференцировку в целевую клетку или клетки этой ткани и введение клеток нуждающемуся в этом пациенту. Следовательно, дифференцированные клетки тканей, которые получают дифференцировкой стволовых клеток билиарного дерева по настоящему изобретению, также являются предметом настоящего изобретения.
Как отмечается выше и как показано на Фигурах 14-16, для частичной дифференцировки стволовых клеток билиарного дерева в специфические взрослые клетки можно использовать среду определенного состава (также называемую средой определенного гормонального состава или HDM), содержащую конкретную смесь питательных веществ (нутриентов), гормонов и факторов роста, в идеале являющуюся бессывороточной, и созданную для того, чтобы направлять дифференцировку клеток в целевые взрослые клетки. Характерные HDM для гепатоцитов, холангиоцитов в сравнении с HDM для панкреатических островков приводятся ниже. HDM, индивидуально, вызывает некоторую линиеспецифическую рестрикцию по дифференцировке в заданные взрослые клетки, но не вызывает полную дифференцировку. Полная дифференцировка осуществляется после трансплантации in vivo или, если клетки находятся ex vivo, дополнительно требует применения конкретной (специфической) HDM в комбинации со смесью компонентов внеклеточного матрикса, причем точный состав смеси является уникальным для нужного типа взрослых клеток, а клетки должны быть фиксированы в трехмерном формате, как указано в данном описании. Фигуры 17-19.
Особенно предпочтительные формы проведения in vivo дифференцировки стволовых клеток или популяций стволовых клеток билиарного дерева согласно изобретению представляют собой инъекцию, инфузию или имплантацию способом пересадки стволовых клеток или популяций стволовых клеток билиарного дерева в область организма, чтобы содействовать дифференцировке в этой области стволовым клеткам билиарного дерева путем непосредственного контакта с клетками целевого направления дифференцировки, или инфузию стволовых клеток или популяций стволовых клеток билиарного дерева с целью помочь стволовым клеткам или популяциям стволовых клеток билиарного дерева достичь ткани-мишени. Для инъекции или инфузии стволовые клетки билиарного дерева можно вводить в среде, с которой они совместимы, такой как среда Куботы (или ее эквивалент) или одна из HDM, или в виде графта или имплантата в средах, состоящих из матриксных компонентов, с которыми они совместимы.
Терапевтическое применение
Для терапевтического применения клеток-мишеней, получаемых из стволовых клеток или популяций клеток билиарного дерева, по данному изобретению имеется ряд концепций (см. Science 287: 1442-1446, 2000), которые охватываются настоящим изобретением. В этой связи примерами релевантных показаний являются: врожденные аномалии метаболизма, печеночная недостаточность, цирроз печени, недостаточность поджелудочной железы и диабет.
Стволовые клетки или популяции клеток билиарного дерева по изобретению можно вводить непосредственно в орган или близ органа, который должен восстанавливаться, обновляться или заживляться. Введение можно осуществлять в виде клеточных суспензий, в виде графтов, состоящих из стволовых клеток или популяций клеток билиарного дерева, включенных в смесь компонентов внеклеточного матрикса, наряду с HDM, или в виде других типов клеточных каркасов (например, микроносителей, полилактидов) или в виде инфузий. Клеточные каркасы, предпочтительно, являются биоразрушаемыми, так что они "исчезают из организма" в то время, как вновь введенные клетки или популяции клеток растут вместе с имеющимися клетками. Клетки, которые можно воссоздавать, спасать, поддерживать, восстанавливать, заменять или вводить таким образом, предпочтительно, при использовании аутологичного трансплантата, включают островковые клетки или другие панкреатические клетки, гепатоциты или другие печеночные клетки и холангиоциты или другие клетки билиарного дерева. Воссоздание, спасение, восстановление, поддержание, замена или введение могут следовать за частичным хирургическим иссечением органа для восстановления после травмы или применяться в качестве поддерживающего лечения, например, в случае отсутствия или недостаточности органа.
Стволовые клетки или популяции клеток билиарного дерева согласно изобретению и целевые клетки, полученные из них, могут, кроме того, быть связаны с имплантируемыми материалами для повышения биосовместимости. Поэтому имплантируемые материалы, покрытые стволовыми клетками билиарного дерева, также являются предметом изобретения. Имплантируемые материалы могут также представлять собой искусственный и/или биологический носитель или материалы-подложки, которые содержат стволовые клетки или популяции клеток билиарного дерева и/или полученные из них целевые клетки. Материалы-носители или материалы-подложки могут представлять собой микроносители, подложки, контейнеры или камеры для инсерции или трансплантации в организм человека.
В одном таком варианте изобретения контейнер с островковыми клетками, полученными из стволовых клеток или популяций клеток билиарного дерева, применяют для получения фармацевтической конструкции в качестве искусственной входной камеры островковых клеток для снабжения инсулином in vivo. В другом варианте изобретения инфузию или графт стволовых клеток или популяций клеток билиарного дерева применяют для воссоздания, спасения, восстановления, поддержания, замены или введения островков или островковых клеток in vivo. Аналогичные конструкции можно сделать с использованием гепатоцитов или холангиоцитов, полученных из стволовых клеток билиарного дерева по изобретению.
Помимо этого, клетки-мишени или популяции клеток, полученные из стволовых клеток билиарного дерева по изобретению, можно использовать в качестве клеточных культур в биореакторах (например, вне организма), например, чтобы провести реакции детоксикации или получить вещества, обычно продуцируемые в целевых клетках или тканях. Эта применение является особенно релевантным при острых состояниях, например, при острой печеночной недостаточности в качестве биоискусственной печени или при тяжелом диабете в качестве биоискусственной эндокринной части поджелудочной железы.
Наконец, мультипотентные стволовые клетки билиарного дерева или популяции клеток по данному изобретению можно широко применять в трансгенной модификации и терапии. Согласно одному варианту изобретения стволовые клетки билиарного дерева, или клетки или ткани, образующиеся в результате их дифференцировки, трансфецируют с применением одного или более генов. Таким образом один или более генов, которые требуются для поддержания метаболизма некоторых органов, таких, например, как печень или поджелудочная железа, восстанавливаются и/или поддерживаются или снова вводятся. Например, стволовые клетки гепатоцитов можно трансфицировать с применением гена FAH (фумароилацетоацетат гидролазы)). В дефицитной по FAH мышиной модели внутриселезеночной инъекции 1000 FAH- позитивных донорских гепатоцитов достаточно для полного восстановления печени и полной компенсации нарушения обмена веществ, ведущего к циррозу печени. Overturf, K.., М. Al- Dhalimy, С.-N. Ou, М. Finegold, and М. Grompe. American Journal of Pathology 151: 1273-1280 (1997). Или же стволовые клетки или популяции клеток билиарного дерева можно получать от конкретного донора и доставлять другому человеку, осуществляя пересадку аллогенных клеток (аллогенная терапия), чтобы восстановить, поддержать или ввести реципиенту один или более генов, необходимых для поддержания обмена веществ некоторых органов, например, таких как печень и поджелудочная железа.
Нижеприведенные примеры иллюстрируют изобретение, но изобретение никоим образом не ограничивается этими конкретными примерами. Рядовой специалист в данной области техники найдет в этих примерах один способ осуществления настоящего изобретения. Помимо этого, хотя настоящие примеры для удобства эксперимента представлены не на людях, рядовой специалист в данной области техники может легко применить способы и реагенты по данному описанию к человеку.
Примеры
Пример I - Получение клеток
Ферментативную диссоциацию можно проводить в присутствии протеазы (протеаз), такой(-их) как коллагеназа(-ы), и одной или более нуклеаз, таких как ДНК-аза. Способы ферментативной диссоциации печеночных клеток описаны и по существу применялись в уровне техники. Например, способы выделения и идентификации предшественников печеночных клеток описаны в патенте США No. 6069005 и в патентных заявках США No. 09/487318; 10/135700; и 10/387547, описание которых вводится в данное изобретение во всей полноте посредством отсыпки. На самом деле существуют различные способы получения клеточных суспензий. Следовательно, понятно, что объем настоящего изобретения не ограничивается конкретным способом заготовки целой ткани или получения из нее клеточной суспензии.
Пример II - условия 3D культивирования
3-мерные (3-D) гели можно получать, смешивая матриксные компоненты, гормоны, цитокины, факторы роста, питательные вещества (нутриенты) и минимальную среду в гиалуронанах, которые являются жидкостями, если молекулы не сшиты, и становятся гелями при сшивании. Подробно описание их получения опубликовано в других источниках, например, в статьях W.S. Turner, Е. Schmelzer, R. McClelland et al., J Biomed Mater Res В Appl Biomater 82B (1), 156 (2006); и W.S. Turner, C. Seagle, J.A. Galanko et al., Stem Cells 26 (6), 1547 (2008), описание которых вводится в данное изобретение во всей полноте посредством отсылки. Как правило, культуры выдерживают 2-4 недели или дольше, а затем анализируют с помощью гистологического исследования, анализов генной экспрессии, таких как анализ конечных результатов и количественная реакция ОТ-ПЦР, иммунофлуоресцентный анализ и анализы экспрессии белков, такие как вестерн-блоттинг и изучение характерных метаболомных "отпечатков пальцев".
Основные компоненты комплексов-гелей представляют собой формы химически модифицированных гиалуронанов. Карбилан-S (или CMHA-S) является карбоксиметильным производным гиалуронана, который для сшивания модифицирован многими тиольными группами. Все материалы получают, по меньшей мере, от Glycosan Biosciences (Salt Lake City, Utah).
Коротко говоря, в одном варианте изобретения готовили гиалуронановые матриксы, растворяя гиалуронан в сухом виде в среде Куботы, получают 2.0% раствор (вес/объем). Затем можно добавлять ламинин (Sigma, St. Louis, Mo) с концентрацией 1.5 мг/мл и типа IV коллаген (Becton Dickenson, Bedford, Ma) с концентрацией 6 мг/мл. Сшивка (структурирование) происходит в течение нескольких часов при комнатной температуре в присутствии кислорода воздуха или в течение нескольких минут в присутствии сшивающего агента, например, PEGDA (полиэтиленгликольдиакрилата). Поэтому, если сшивка нежелательна, раствор следует хранить охлажденным до 4°С и избегать контакта с кислородом и/или с PEGDA.
По завершении эксперимента клетки можно регенерировать, расщепляя гидрогель во-первых смесью гиалуронидазы (1 мг/мл), ДНК-азы (0.5 мг/мл) и дитиотреитола (40 мг/мл), приготовленной в среде Куботы (без трансферрина), а затем либеразой (0.5 мг/мл), приготовленной в среде Куботы без инсулина и трансферрина. Клетки, которые получают таким образом, применимы для определения характеристик способами проточной цитометрии, ОТ-ПЦР или иммуногистохимии.
Пример III - Доказательство мультипотентности
После культивирования стволовых клеток или популяций клеток стволового дерева в условиях саморепликации (среда Куботы, или эквивалент, в комбинации с культуральным пластиком или гиалуронанами) в течение 7-30 дней или более культуры оставшихся клеток (т.е. стволовых клеток желчных путей) в виде монослоя переносили в среду для дифференцировки, в которой в течение 48 часов стволовые клетки быстро изменяли форму и изменялась генная экспрессия в клетках. Среды для дифференцировки получали модификацией среды, используемой для саморепликации (например, среды Куботы или эквивалента) таким образом, чтобы среда определенного гормонального состава содержала компоненты среды для саморепликации плюс кальций (≥0.5 мМ), медь, bFGF; эту среду называют "модифицированной средой". Для получения конкретного типа взрослых клеток требуется следующее:
Печеночные клетки: линиеспецифическую рестрикцию по печеночной линии дифференцировки (например, по гепатоцитам) можно осуществить, заключая стволовые клетки билиарного дерева в гидрогели гиалуронанов, в состав которых входят типа IV коллаген и ламинин, и с применением "модифицированной среды", дополненной, кроме того, глюкагоном, галактозой, трийодтироксином, фактором роста эпидермальных клеток (эпидермальным фактором роста, EGF) и фактором роста гепатоцитов (HGF). В одном варианте изобретения количество ингредиентов следующее: МКМ, дополненная 7 мкг/л глюкагона, 2 г/л галактозы, 10-9 М трийодтироксина 3, 10 нг/мл EGF и 20 нг/мл HGF.
Ткань поджелудочной железы (панкреатическая): линиеспецифическую рестрикцию по панкреатической линии дифференцировки (например, по островкам) можно осуществить, заключая стволовые клетки билиарного дерева в гидрогель гиалуронанов, содержащий типа IV коллаген и ламинин, и с применением "модифицированной среды", дополнительно измененной таким образом, чтобы был удален гидрокортизон и чтобы среда содержала В27, аскорбиновую кислоту, циклопамин, ретиноевую кислоту и эксендин 4. В одном варианте изобретения количество ингредиентов следующее: МКМ, модифицированная таким образом, чтобы она не содержала гидрокортизона и содержала 2% В27, 0.1 мМ аскорбиновой кислоты, 0.25 мкМ циклопамина, 0.5 мкМ ретиноевой кислоты и 50 нг/мл эксендина 4.
Желчные пути/Холангиоциты: аналогично, можно осуществить линиеспецифическую рестрикцию стволовых клеток билиарного дерева по билиарной линии дифференцировки (например, по холангиоцитам), заключая стволовые клетки в гидрогели гиалуронанов, смешанные с типа I коллагеном, и в "модифицированной среде", дополненной, сосудистым эндотелиальным фактором роста (фактором роста сосудистого эпителия, VEGF) 165 и HGF. В одном варианте изобретения количество ингредиентов следующее: МКМ, дополненная 20 нг/мл сосудистого эндотелиального фактора роста (VEGF) 165 и 10 нг/мл HGF.
Пример IV - Трансплантация
На практике во многих случаях трансплантация клеток из паренхиматозных органов в соответствии с протоколами пересадки является предпочтительной по сравнению с инъекцией или инфузией, хотя допустим любой способ. Было найдено, что вышеописанные культуры в гидрогеле обеспечивают хорошие условия для пересадки. Клетки можно суспендировать в несшитых гиалуронанах, смешанных с другими матриксными компонентами в среде, содержащей минимальную среду плюс гормоны, факторы роста и другие растворимые факторы, подобранные для размножения и/или дифференцировки.
Популяции клеток, применимые для трансплантации, предпочтительно, содержали стволовые клетки или популяции клеток билиарного дерева, которые пересаживались в присутствии (или в отсутствие) их нативных мезенхимальных клеток-партнеров (например, ангиобластов, звездчатых клеток) из целевой ткани (или другого источника) для трансплантации и в соотношениях, соответствующих их соотношениям in vivo. Не придерживаясь какой-либо теории и будучи с ней связаны, полагают, что эта комбинация стволовых клеток и мезенхимальных клеток-партнеров обеспечивает микроокружение, соответствующее полному созреванию тканей, которые являются васкуляризованными и способными к физиологическому функционированию.
В одном варианте изобретения клеточные компоненты графтов для графтов, имплантатов или инъекций панкреатических клеток могут состоять из стволовых клеток или популяций клеток билиарного дерева, засеянных в графт совместно с человеческими ангиобластами из тканей зародышей или новорожденных (VEGFR+, клетки CD117+) и звездчатыми клетками (клетки CD146+) в соотношениях, примерно соответствующих их соотношениям в популяции клеток в ткани in vivo. Популяции стволовых клеток можно получать из размножающихся клеток в культуре по данному описанию. Можно проводить иммуноселекцию ангиобластов и звездчатых клеток с применением системы магнитно-активированного клеточного сортинга (MACS) или сортинга проточной цитометрией свежеприготовленных клеточных суспензий человеческой панкреатической ткани зародыша или новорожденного.
Можно проводить иммуноселекцию всех популяций стволовых клеток билиарного дерева на клетки, позитивные к маркеру клеточной поверхности, общему для стволовых/прогениторных клеток (например, CD133, CD44H, ЕрСАМ, NCAM). В одном варианте изобретения клетки инкубировали при 4°С в течение 20 минут с концентрацией 50 мкл 50×106 тотальных клеток в 500 мкл фосфатно-солевого буферного раствора (PBS), содержащего 0.5% альбумина бычьей сыворотки и 2 мМ EDTA с FITC-конъюгированными первичными антителами. Меченные таким образом клетки реагировали с магнитными гранулами с антителами против FITC, а затем проводили их селекцию на колонках Midi- или MiniMACS и разделительных установках. Все стадии инкубации и селекции следует проводить на льду с добавлением 10% раствора аккутазы (Innovative Cell Technologies, San Diego, CA) для предупреждения агрегации клеток. Или же клетки можно метить с помощью меченного флуоресцентным зондом (флуорозондом) антитела и проводить иммуноселекцию клеток способом на проточном питометре.
Пример V - Среды
Все среды стерилизовали фильтрационной стерилизацией (фильтр 0.22 мкм) и хранили в темноте при 4°С до момента употребления. Среда Куботы (KM) состояла из минимальной среды (например, RPMI 1640), не содержала меди, имела низкое содержание кальция (<0.5 мМ), содержала 10-9 М селена, 4.5 мМ никотинамида, 0.1 нМ сульфата цинка, 10-8 М гидрокортизона, 5 мкг/мл трансферрина/Fe, 5 мкг/мл инсулина, смесь свободных жирных кислот, которые добавлены связанными с сывороточным альбумином (0.1%), и, необязательно, 10 мкг/мл липопротеина высокой плотности.
Пример VI - Условия дифференцировки
Трехмерные культуры получали с использованием гидрогелей, содержащих гиалуронаны, другие матриксные молекулы, гормоны, факторы роста, цитокины, все они приготовлены с использованием среды. Все гидрогели готовили, используя модифицированную среду Куботы (или эквивалент), дополненную кальцием до концентрации 0.6 мМ, медью 10-12 М и 10 мкм основного фактора роста фибробластов (bFGF) (среда называется модифицированной KM или MKM):
Печеночные клетки: MKM-L с 7 мкг/л глюкагона, 2 г/л галактозы, 10-9 М три-йодтироксина 3, 10 нг/мл эпидермального фактора роста (EGF) и 20 нг/мл фактора роста гепатоцитов (HGF). Матриксная подложка состояла на 60% из типа IV коллагена и ламинина и на 40% из гиалуронанов.
Желчные пути/Холангиоциты: MKM-С, дополненная 20 нг/мл сосудистого эндотелиального фактора роста (фактора роста сосудистого эпителия) (VEGF) 165 и 10 нг/мл HGF. Матриксная подложка состояла на 60% из типа I коллагена и на 40% из гиалуронанов.
Поджелудочная железа, островки: MKM-Р (без гидрокортизона), дополненная 2% В27, 0.1 мМ аскорбиновой кислоты, 0.25 мкМ циклопамина, 0.5 мкМ RA (ретиноевой кислоты) и 50 нг/мл эксендина-4. Матриксная подложка состояла на 60% из типа IV коллагена и ламинина и на 40% из гиалуронанов.
Пример VII - Выделение и фенотипирование клеток
Человеческие ткани билиарного дерева получали из печени и поджелудочной железы, полученных, а затем оказавшихся непригодными для трансплантации пациенту. Клеточные суспензии тканей билиарного дерева человека обрабатывали, используя RPMI 1640, дополненную 0.1% альбумином бычьей сыворотки, 1 нМ селена и антибиотиками. Буфер для ферментативной обработки содержал 300 Ед./мл типа IV коллагеназы и 0.3 мг/мл дезоксирибонуклеазы, обработку проводили при 32°С при частом встряхивании в течение 15-20 мин. Обогащенные суспензии продавливали через сито 75 меш, а затем центрифугировали при 1200 об/мин в течение 5 минут и ресуспендировали. Вычисленная жизнеспособность клеток, определяемая по исключению трипанового синего, обычно была выше 95%.
Около 3×105 клеток засевали на бессывороточную среду Куботы, в чашке для тканевых культур 10 см, среду меняли каждые 3 дня. Колонии, образовались через 5-7 дней и наблюдались в течение 3 месяцев. Колонии собирали вручную в разное время, используя инвертированный микроскоп.
Мультипотентные стволовые клетки билиарного дерева выделяли также иммуноселекцией из свежеприготовленных клеточных суспензий на основании позитивной экспрессии одного или более поверхностных маркеров, общих для стволовых клеток/клеток-предшественников (CD133, CD44H, NCAM, EpCAM-CD326), используя способы иммуноселекции с магнитными гранулами на системе Miltenyi Biotech MACS (Bergisch Gladbach, Germany) в соответствии с инструкциями производителя. Коротко говоря, диссоциированные клетки инкубировали с ЕрСАМ антителом, связанным с магнитными микрогранулами, в течение 30 мин при 4°С, и выделяли, используя разделительную колонку магнитной системы от Miltenyi в соответствии с рекомендациями производителя. Среду заменяли ежедневно и собранную среду хранили при -20°С для последующего анализа.
Для флуоресцентного окрашивания клетки фиксировали 4% параформальдегидом (PFA) в течение 20 мин при комнатной температуре, отмывали с помощью HBSS, блокировали 10% козьей сывороткой в HBSS в течение 2 час и отмывали. Фиксированные клетки инкубировали с первичными антителами при 4°С в течение ночи, отмывали, инкубировали 1 час с мечеными изотип- специфическими вторичными антителами в течение 1 часа, отмывали, докрашивали 4',6-диамидино-2-фенилиндолом (DAPI) для визуализации клеточных ядер.
Для иммуногистохимического исследования ткани фиксировали в 4% параформальдегиде (PFA) в течение ночи, хранили в 70% этаноле, а затем заключали в парафин и делали срезы толщиной 5 мкм. Срезы депарафинизировали и антигены извлекали. Эндогенные пероксидазы блокировали инкубацией в течение 30 мин в 0.3% растворе Н2О2. После блокирования 10% лошадиной сывороткой первичное антитело наносили при 4°С в течение ночи; окрашивание вторичным антителом и ABC осуществляли, используя набор RTU Vectastain kit (Vector Laboratories, Burlingame, CA). В качестве субстрата использовали Vector® Nova RED™. Срезы дегидратировали, фиксировали и заключали в среды Eukitt Mounting Media (Electron Microscopy Sciences, Hatfield, PA) и анализировали на инвертированном микроскопе.
Для количественного анализа с помощью полимеразной цепной реакции с обратной транскрипцией ОТ-ПЦР ткань желчных путей или клетки из культуры лизировали и тотальную РНК экстрагировали, используя набор RNeasy Plus Mini Kit (Qiagen GmbH, Valencia CA) в соответствии с инструкциями производителя. Обратную транскрипцию осуществляли с помощью системы Superscript First-Strand Synthesis System для ОТ-ПЦР (Invitrogen, Carlsbad, CA). Для ПЦР использовали набор HotStarTaq Master Mix Kit (Qiagen).
Клетки анализировали и сортировали на клеточном сортере FACStar Plus (BD Biosciences), снабженном двойными лазерами Coherent 1-90. Антитела, конъюгированные с флуоресцентным маркером, возбуждаются при 488 нм, а их флуоресцентную эмиссию детектировали стандартными фильтрами.
Хотя изобретение описано в сочетании с конкретными его вариантами, понятно, что оно способно к дальнейшим модификациям, и предполагается, что эта заявка охватывает любые варианты, применения или изменения изобретения, такие как варианты точных концентраций матриксных компонентов, или факторов роста, или гормонов для выявления точных реакций клеток. В целом принципы изобретения и включение таких отступлений от настоящего раскрытия, которые происходят в известной или обычной практике в области техники, к которой относится настоящее изобретение, могут применяться к существенным признакам, представленным выше в данном документе и далее в объеме прилагаемой Формулы изобретения.
Сокращения: АЕ2, анионный обменник 2; AFP, α-фетопротеин; ALB, альбумин; ASMA, альфа-актин гладких мышц; ASBT, апикальный натрий-зависимый транспортер желчных кислот; bFGF, основной фактор роста фибробластов; CD, общая детерминанта; CD133, проминин; CD146, Mel-CAM; CD31, РЕСАМ; CD44H, рецептор гиалуронана; CD45, общий антиген лейкоцитов; CFTR, трансмембранный регулятор муковисцидоза; CK, цитокератин; CXCR4, рецептор СХС-хемокина 4; CYP450, цитохром Р450; EGF, эпидермальный фактор роста; ЕрСАМ, молекула адгезии эпителиальных клеток; FOXa2, forkhead box а2; GGT, гамма-глутамилтранспептидаза; HDM, среда определенного гормонального состава, приготовленная для конкретного типа клеток; HDM-L, среда определенного гормонального состава для печеночных клеток; HDM-C, среда определенного гормонального состава для холангиоцитов (билиарного дерева); HDM-P, среда определенного гормонального состава для панкреатических клеток; HGF, фактор роста гепатоцитов; HNF, ядерный фактор гепатоцитов; KM, среда Куботы, бессывороточная среда, созданная для стволовых/прогениторных клеток; NCAM, молекула адгезии нервных клеток; NGN3, нейрогенин 3; PDX1, панкреатический и дуоденальный гомеобокс гена 1; PROX1, белок гомеобокса 1 Prospero; SALL4, белок sallike 4; SOX, Sry-родственный HMG box; SR, рецептор секретина; VEGF, фактор роста сосудистого эндотелия.
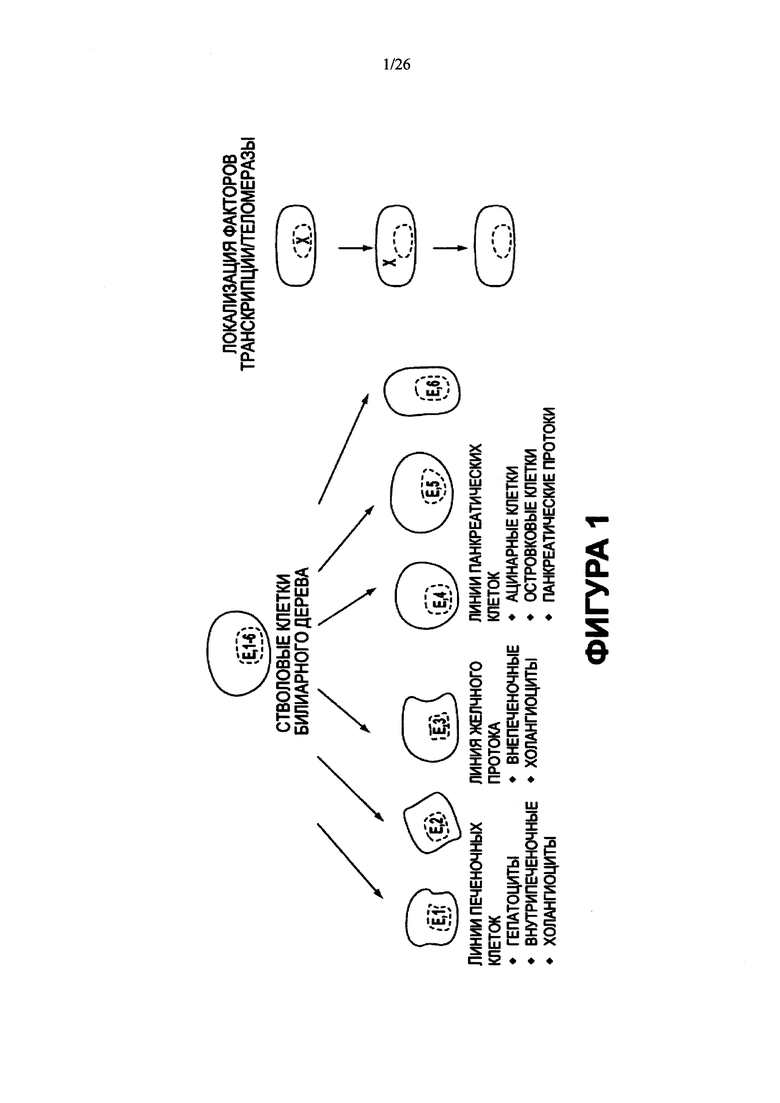
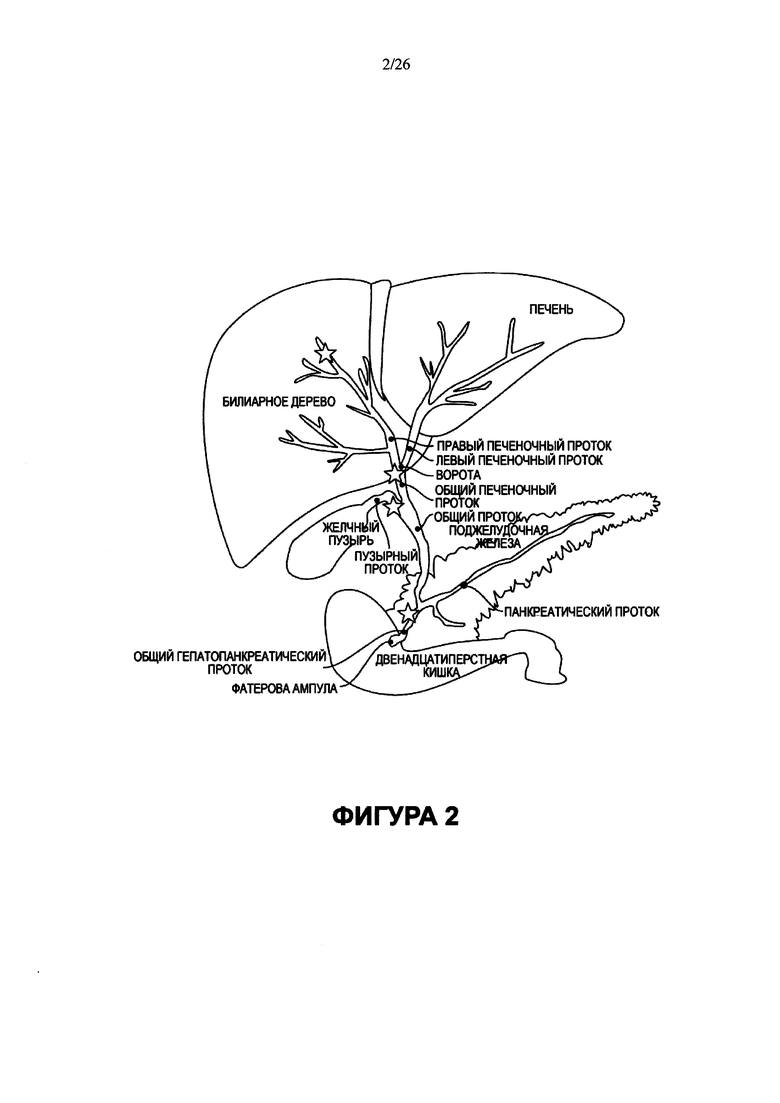

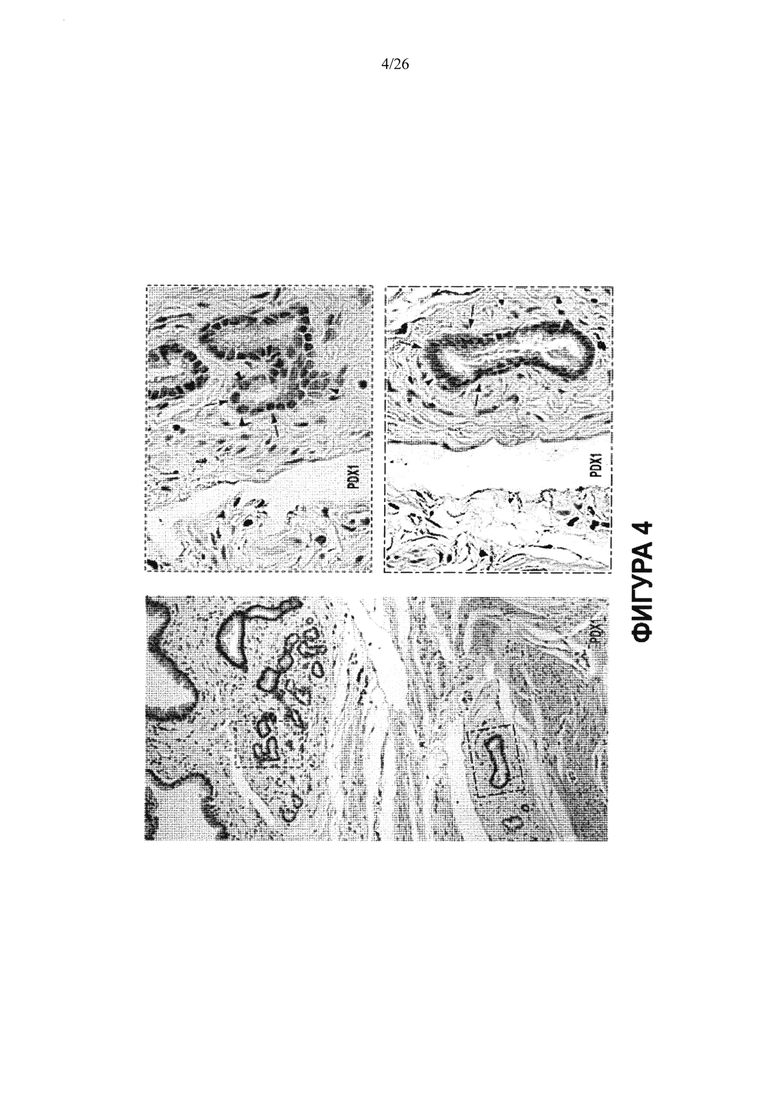
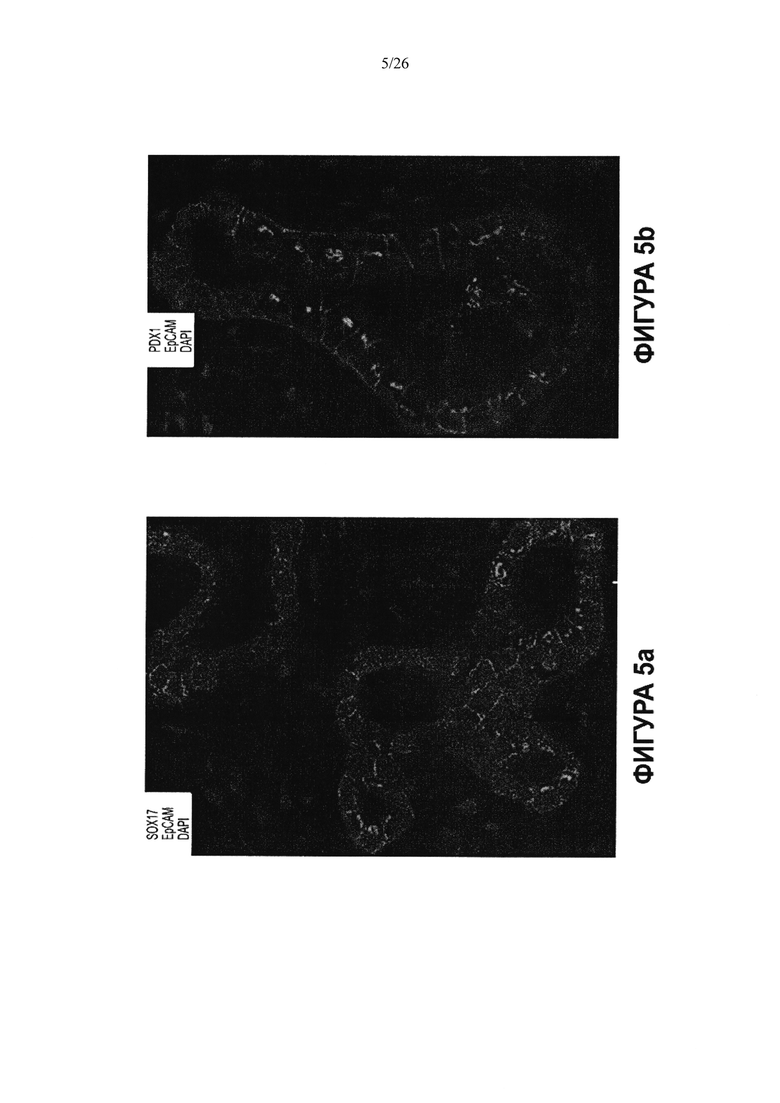

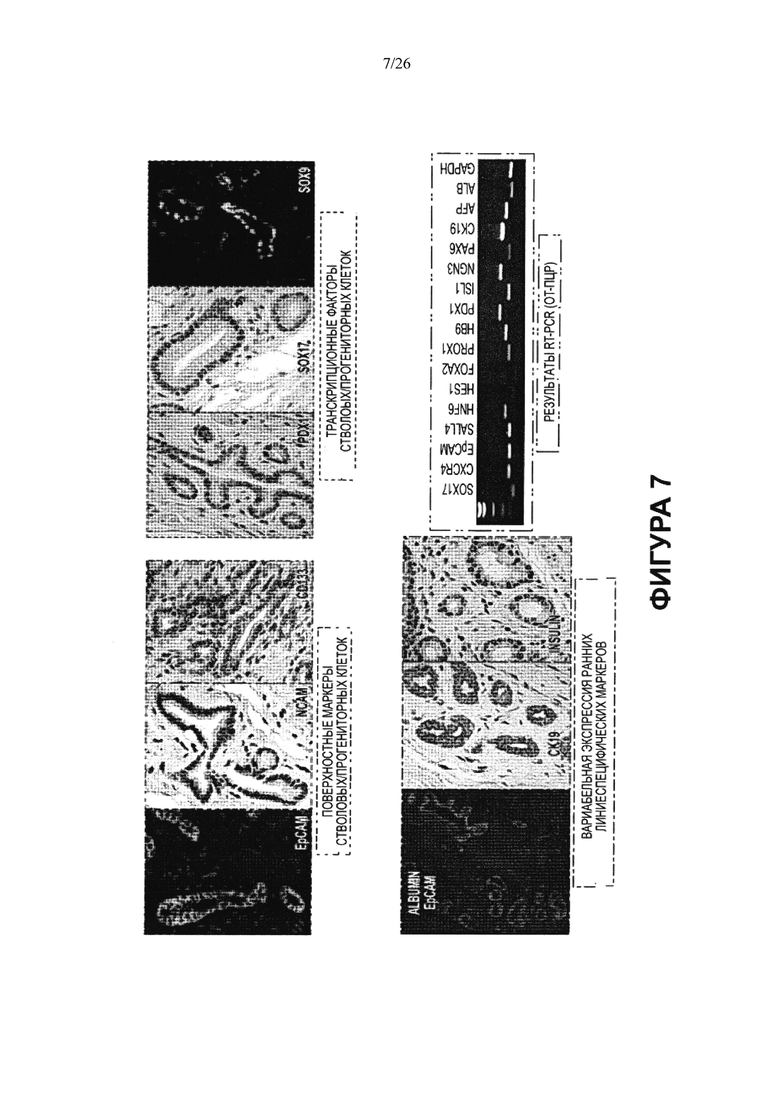

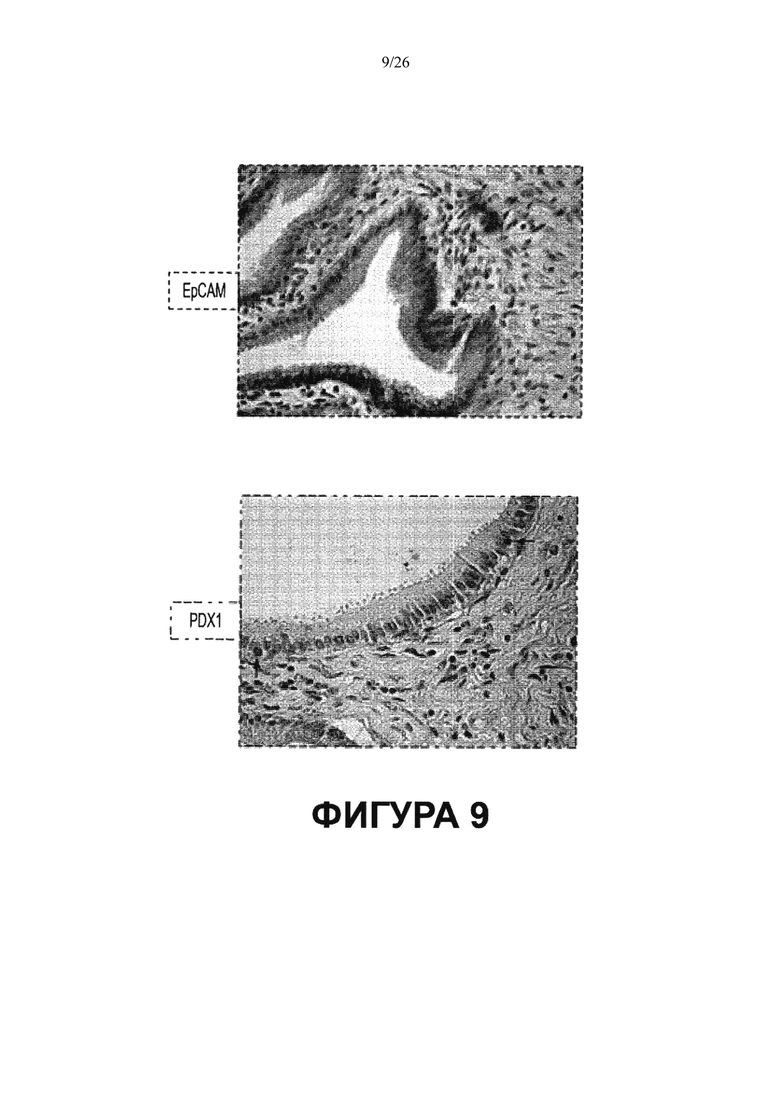
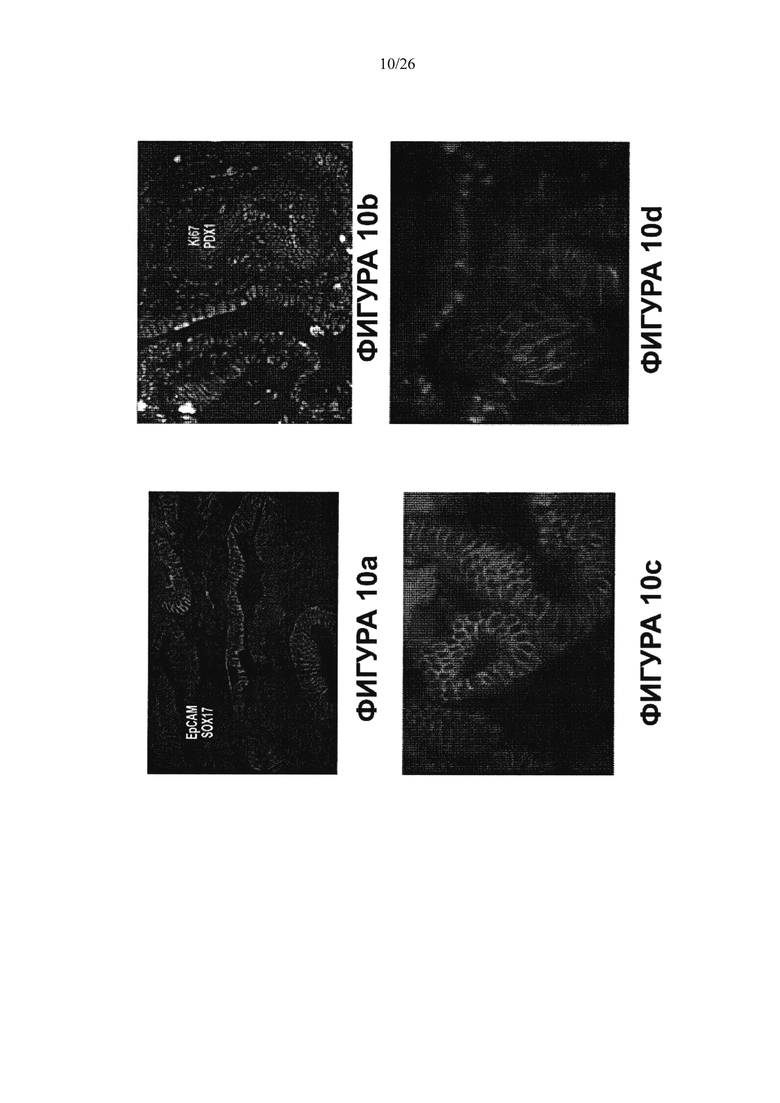
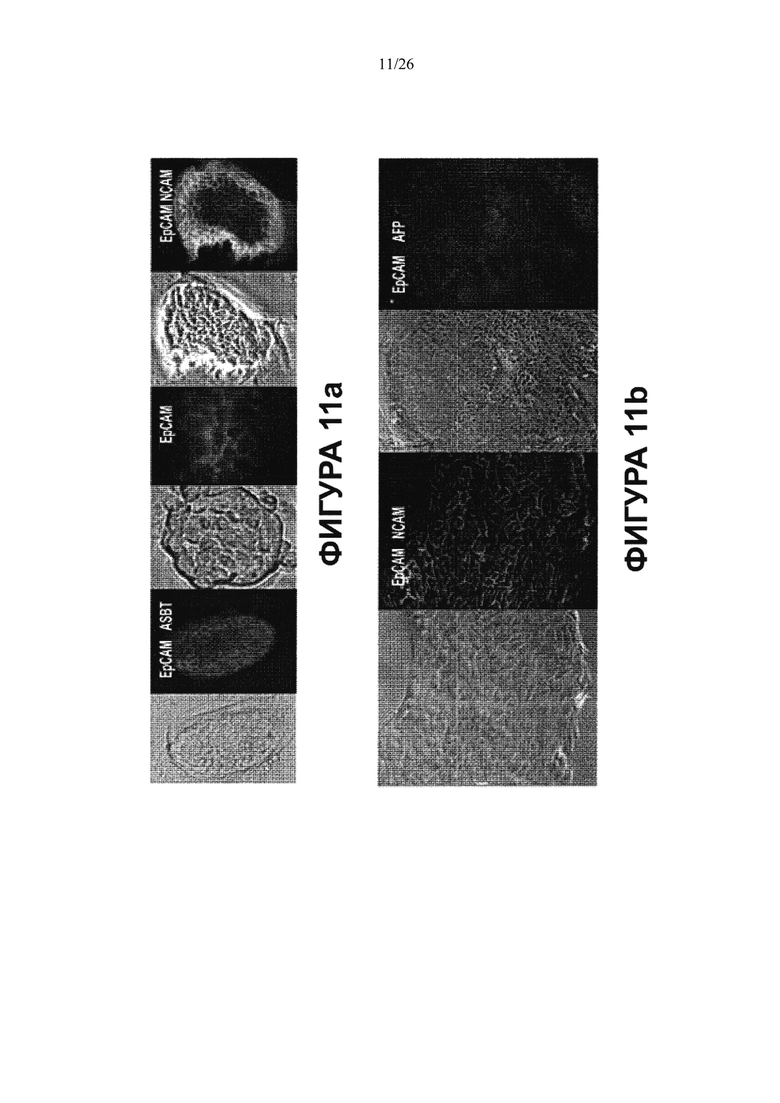


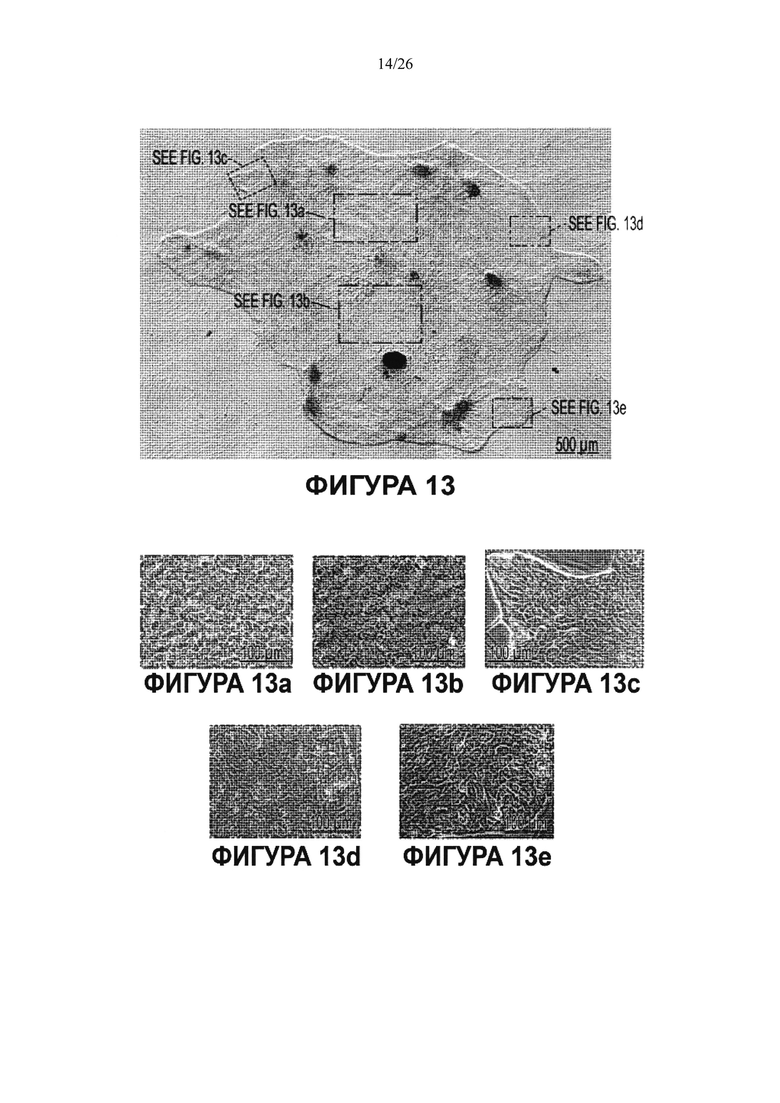
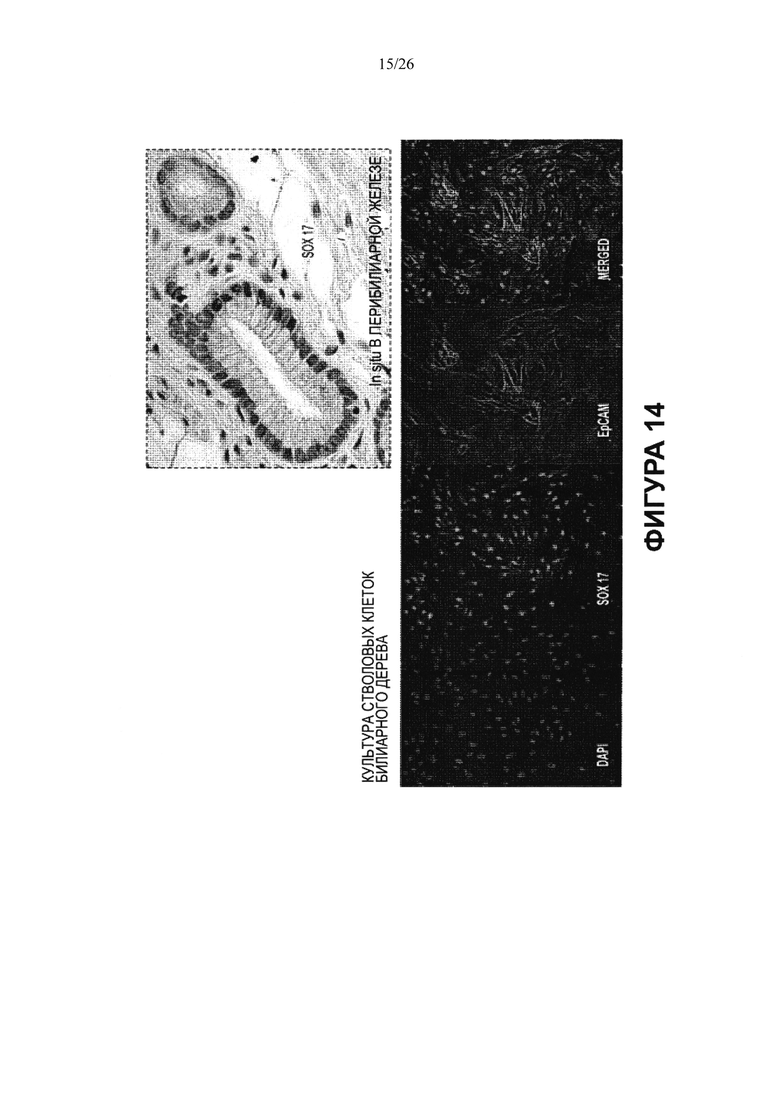

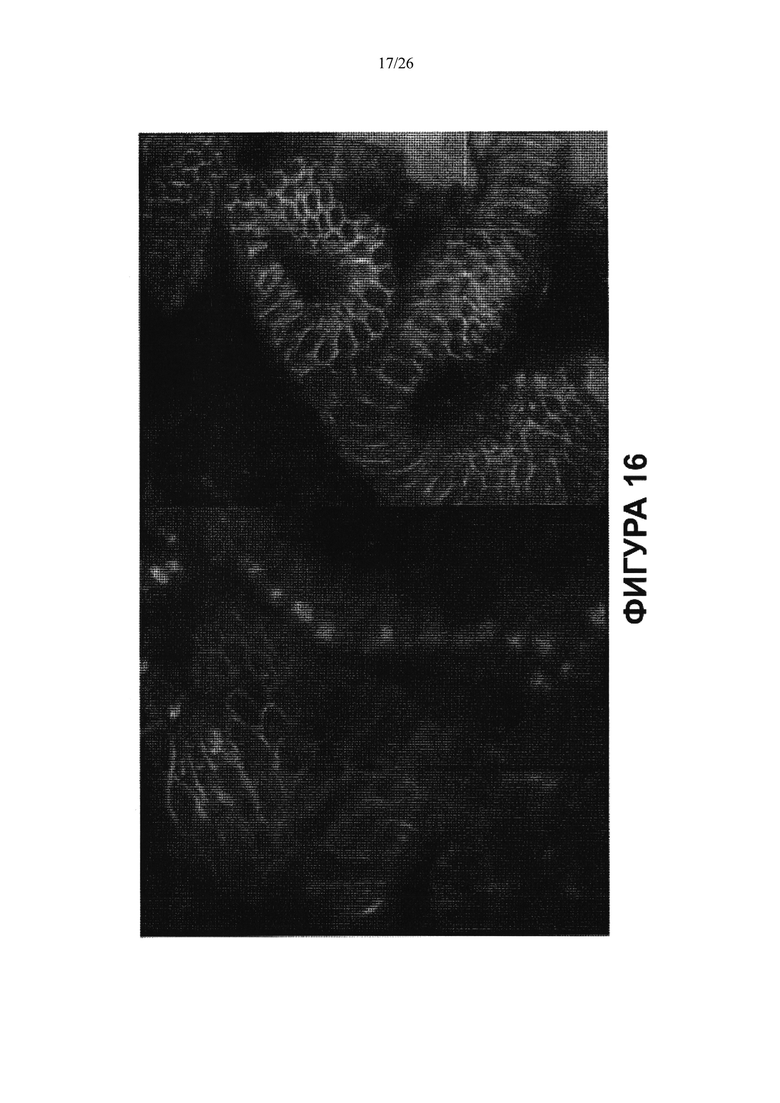
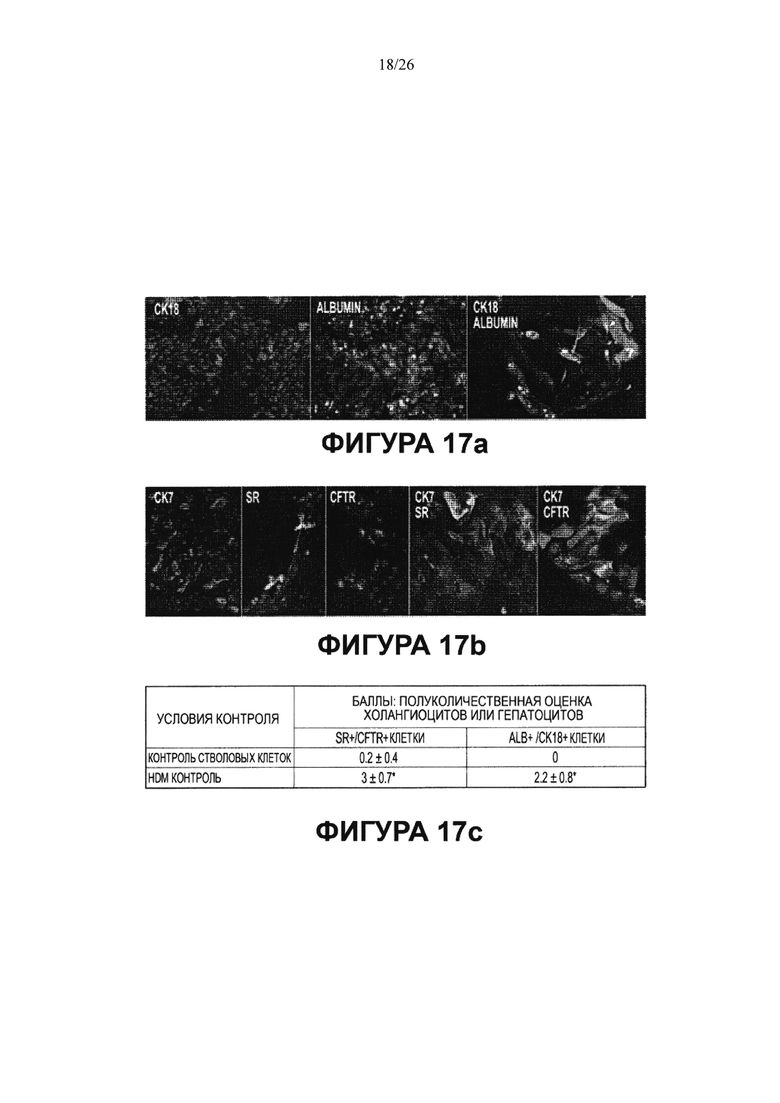
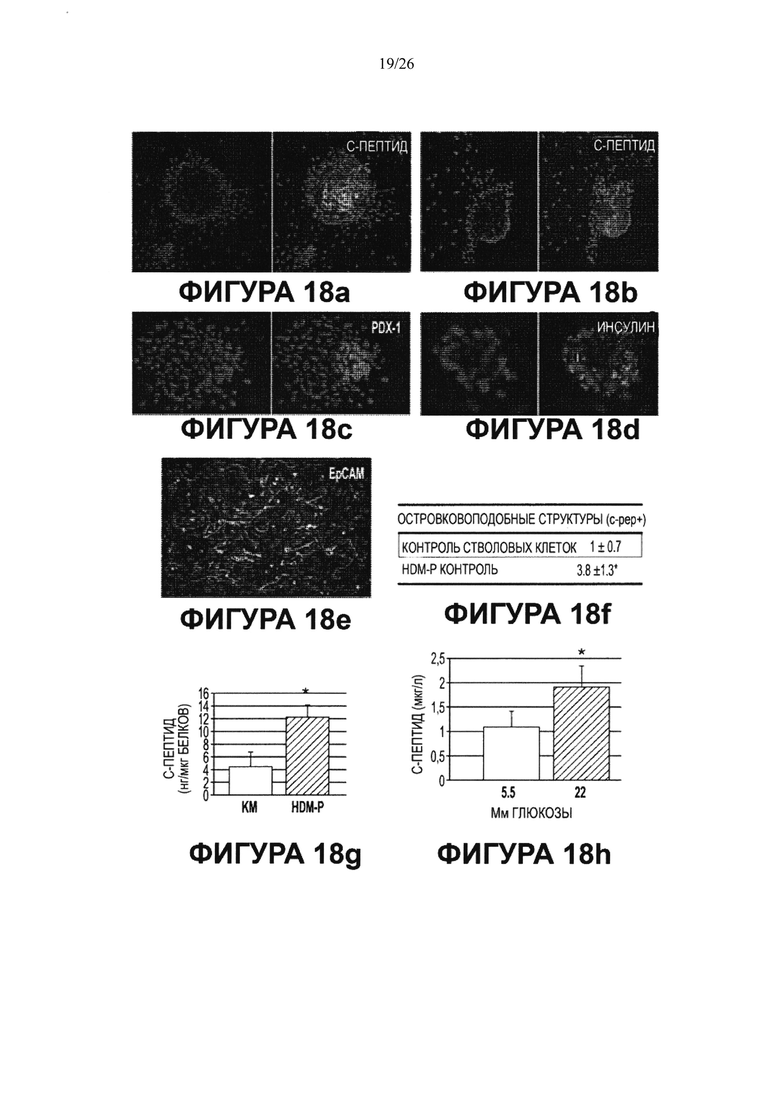
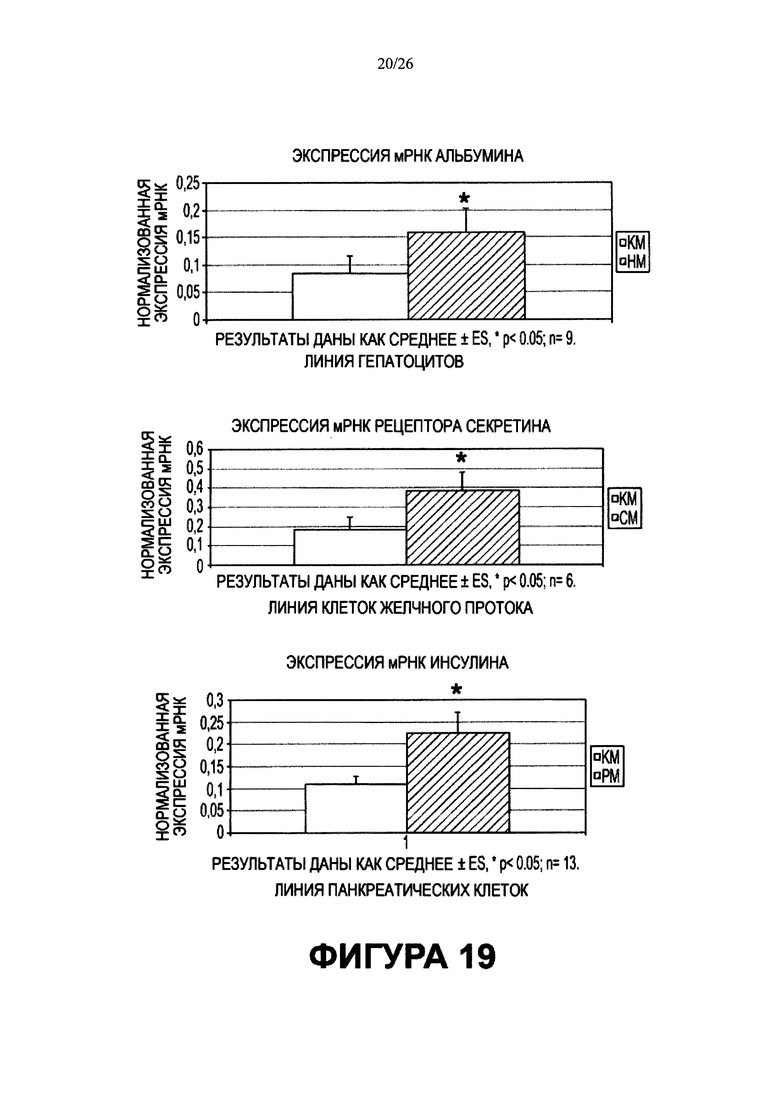
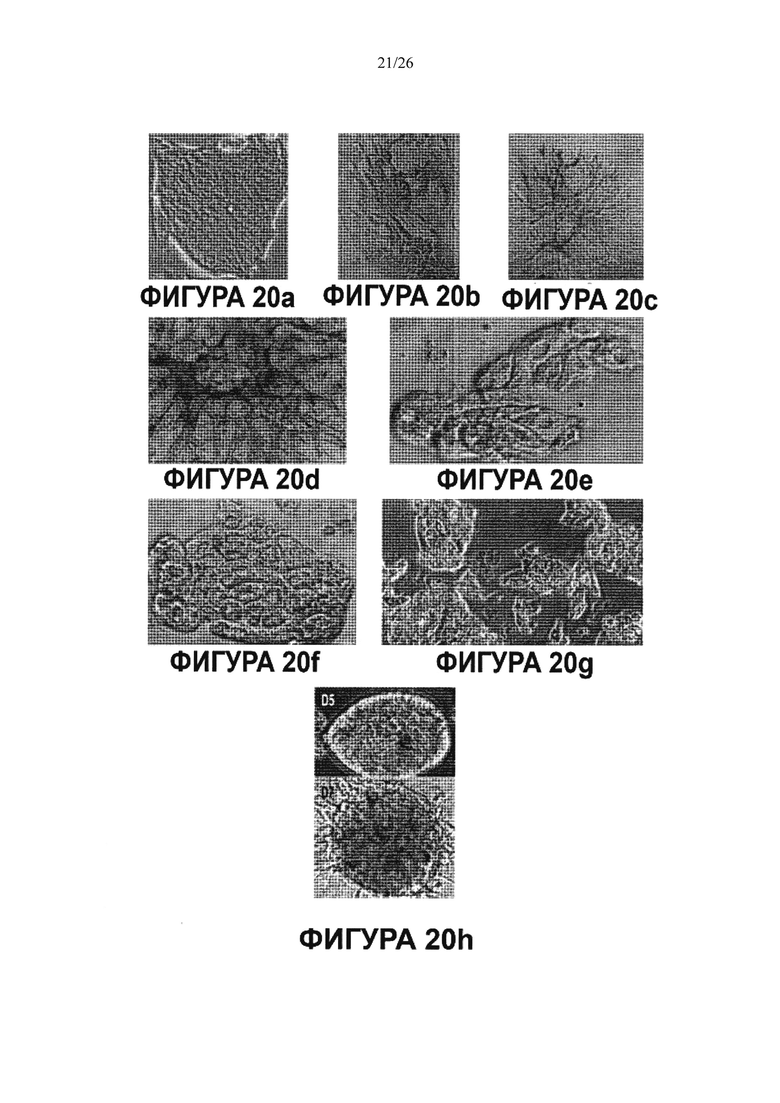

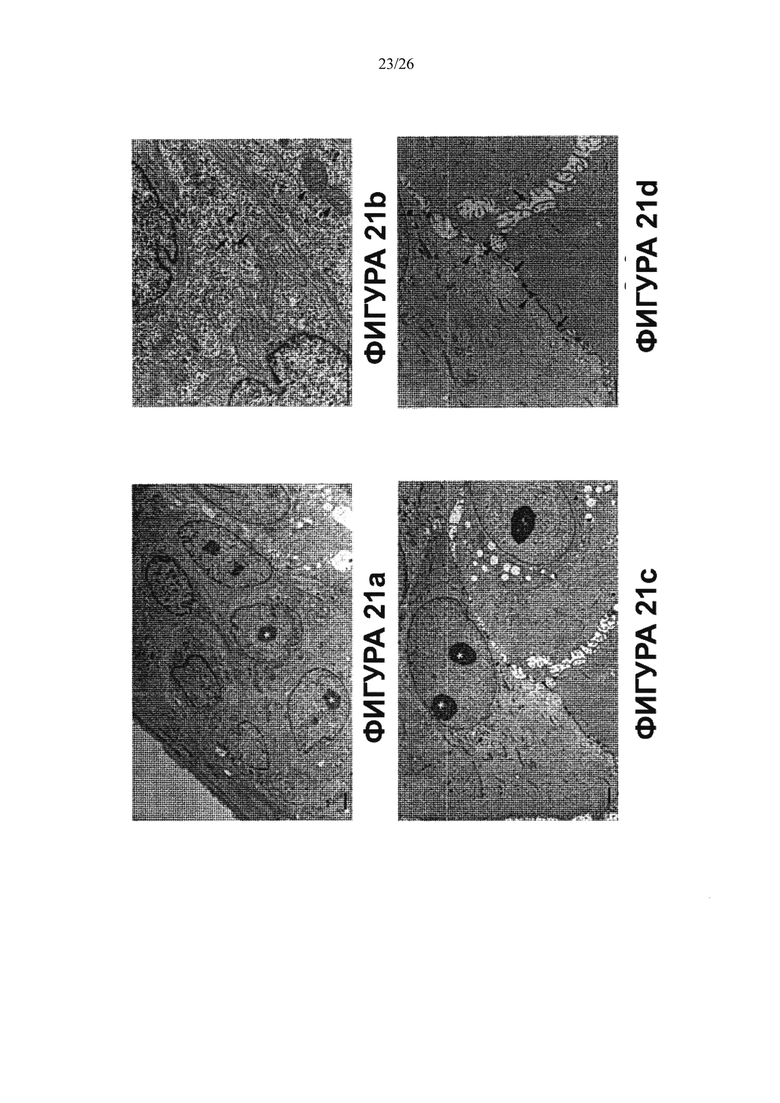
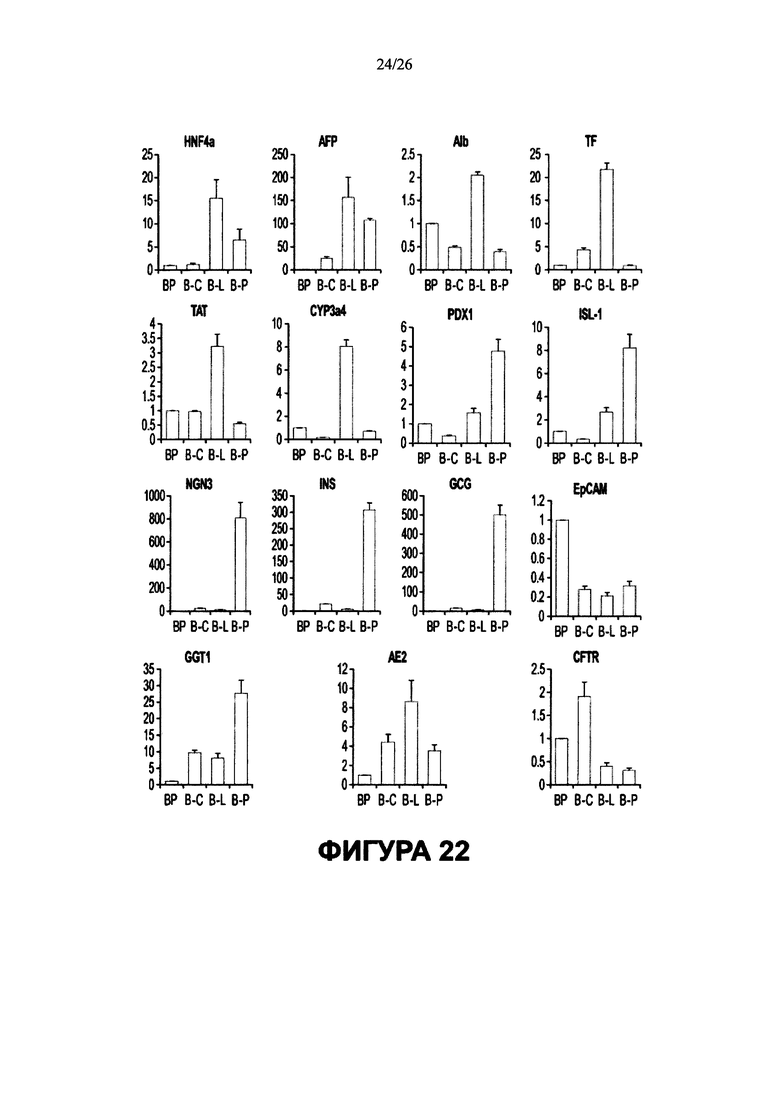
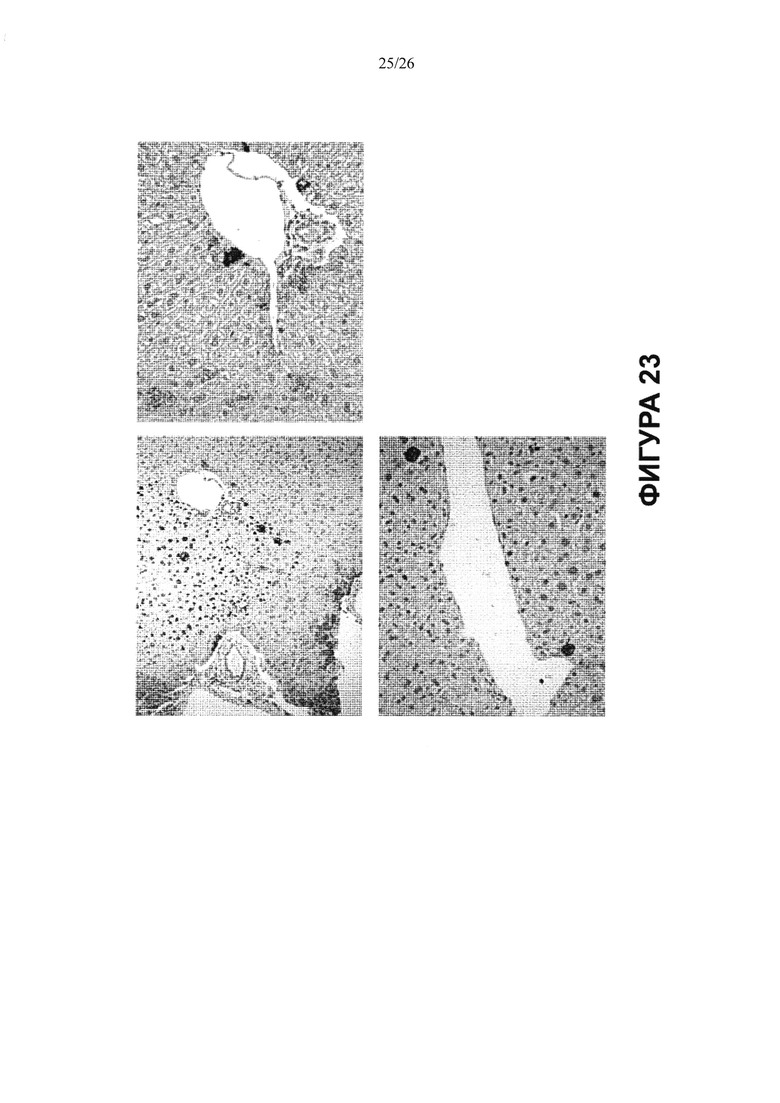
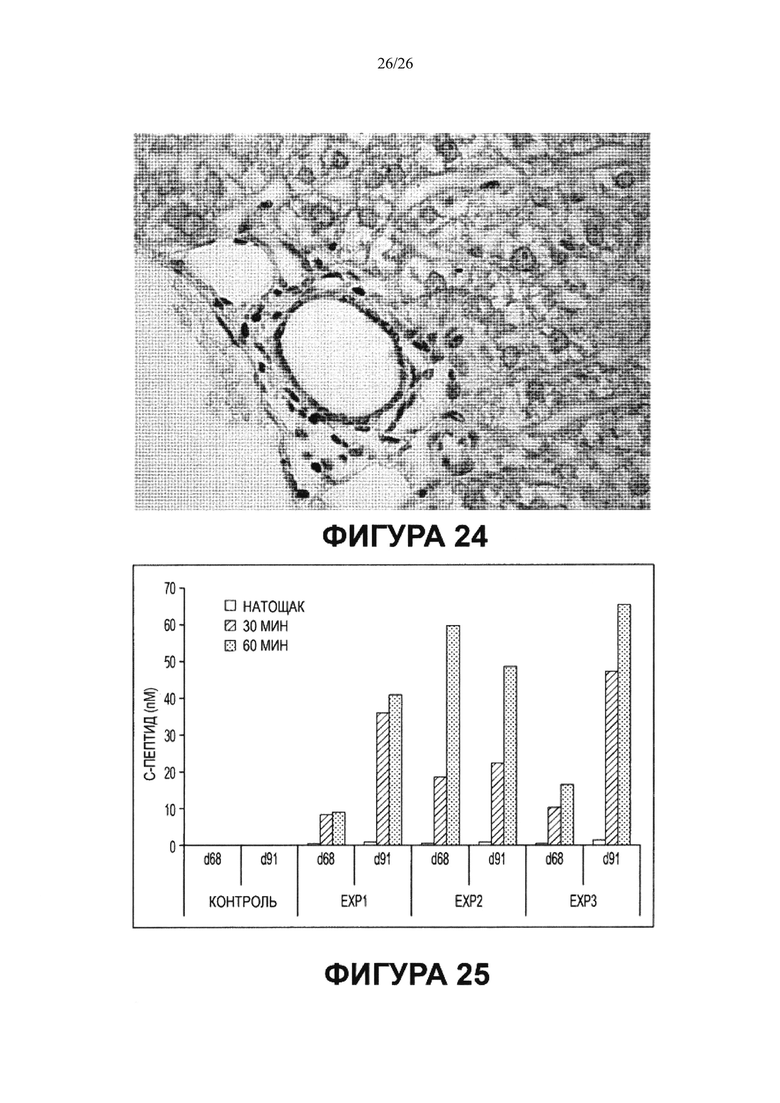
Настоящее изобретение относится к клеточной биологии и медицине и раскрывает композицию для трансплантации популяции клеток пациенту и способу получения мультипотентных клеток млекопитающего. Клетки согласно изобретению способны дифференцироваться в несколько эндодермальных клеточных линий. Они получены из ткани желчных путей и являются позитивными по меньшей мере по одному поверхностному маркеру стволовых клеток, а именно EpCAM, N-CAM, CXCR4 или CD133, а также по меньшей мере одному маркеру линии панкреатических клеток, по меньшей мере одному маркеру линии печёночных клеток и по меньшей мере одному маркеру линии эндодермальных клеток. Настоящее изобретение позволяет создать альтернативные и дополнительные источники трансплантируемых, функциональных стволовых клеток и клеток-предшественников для применения в клинике. 2 н. и 20 з.п. ф-лы, 59 ил., 7 пр.
1. Композиция для трансплантации популяции клеток нуждающемуся в этом пациенту, причем композиция содержит выделенные мультипотентные клетки млекопитающего, представляющие собой стволовые клетки или клетки-предшественники, и матриксный компонент, причем выделенные мультипотентные клетки млекопитающего способны дифференцироваться в несколько эндодермальных клеточных линий, причем выделенные мультипотентные клетки млекопитающего получены из ткани желчных путей млекопитающего, и причем выделенные мультипотентные клетки млекопитающего являются позитивными:
(i) по меньшей мере по одному поверхностному маркеру стволовых клеток, причем предпочтительно поверхностный маркер стволовых клеток выбран из группы, состоящей из EpCAM, N-CAM, CXCR4 и CD133;
(ii) по меньшей мере по одному маркеру, характерному для линии печёночных клеток;
(iii) по меньшей мере по одному маркеру, характерному для линии панкреатических клеток, и
(iv) по меньшей мере по одному маркеру линии эндодермальных клеток;
при условии что млекопитающее не представляет собой человеческий эмбрион.
2. Композиция по п. 1, где мультипотентная стволовая клетка или клетка-предшественник представляет собой мультипотентную стволовую клетку.
3. Композиция по п. 1, где линия эндодермальных клеток представляет собой линию печеночных клеток, линию билиарных клеток, линию панкреатических клеток или их комбинацию.
4. Композиция по п. 1, где ткань желчных путей представляет собой любую область желчных путей, включая ворота, общий печёночный проток, пузырный проток, общий проток, общий гепатопанкреатический проток и желчный пузырь.
5. Композиция по п. 1, где млекопитающее представляет собой человека, предпочтительно новорождённого, ребёнка, взрослого или умершего человека вплоть до момента 72 часа после смерти, более предпочтительно умершего человека в течение 10 часов после смерти.
6. Композиция по п. 1, где ткань желчных путей содержит перибилиарные железы или клетки-предшественники или стволовые клетки, полученные из перибилиарных желёз или желчного пузыря.
7. Композиция по п. 1, где ткань желчных путей содержит области, в которых желчные пути разветвляются.
8. Композиция по п. 1, где матриксный компонент содержит коллаген IV, коллаген III, ламинин, гиалуронаны, другие компоненты матрикса из эмбриональных тканей, фетальных тканей, тканей новорожденных или их комбинаций.
9. Композиция по п. 1, где матриксный компонент содержит несшитые гиалуронаны.
10. Композиция по п. 9, где мультипотентные клетки млекопитающего и несшитые гиалуронаны смешаны в среде.
11. Композиция по п. 10, где среда содержит минимальную среду, среду Куботы или среду определённого гормонального состава (HDM).
12. Композиция по п. 1, где по меньшей мере один маркер, характерный для линий печёночных клеток, содержит HNF6, HES1, CK19, альбумин или AFP;
по меньшей мере по один маркер, характерный для линий панкреатических клеток, содержит PDX1, PROX1, NGN3 или инсулин; и
по меньшей мере один маркер линии эндодермальных клеток содержит транскрипционный фактор, характерный для эндодермальной стволовой клетки или клетки-предшественника, причем транскрипционный фактор, характерный для эндодермальной стволовой клетки или клетки-предшественника, содержит SOX 9, SOX17 или FOXA2.
13. Способ получения мультипотентных клеток млекопитающего, представляющих собой стволовую клетку или клетку-предшественник, причем мультипотентные клетки млекопитающего способны дифференцироваться в несколько эндодермальных клеточных линий, причем мультипотентные клетки млекопитающего получают из ткани желчных путей млекопитающего, причем способ включает получение ткани желчных путей, и последовательно, в любом порядке, или по существу одновременно, получение мультипотентных клеток млекопитающего, позитивных:
(i) по меньшей мере по одному поверхностному маркеру стволовых клеток, такому как EpCAM, N-CAM, CXCR4 или CD133;
(ii) по меньшей мере по одному маркеру, характерному для линии печёночных клеток;
(iii) по меньшей мере по одному маркеру, характерному для линии панкреатических клеток;
(iv) по меньшей мере по одному маркеру линии эндодермальных клеток;
при условии что млекопитающее не представляет собой человеческий эмбрион.
14. Способ по п. 13, в котором мультипотентные клетки млекопитающего, представляющие собой стволовую клетку или клетку-предшественник, получают посредством иммуноселекции и/или в селективных условиях культивирования, предпочтительно посредством иммуноселекции, включающей пэннинг, селекцию с помощью магнитных гранул, проточной цитометрии или их комбинации, более предпочтительно посредством проточной цитометрии.
15. Способ по п. 14, в котором селективные условия культивирования включают посев клеток на пластике, на гиалуронанах или на пластике, необязательно покрытом коллагеном IV, коллагеном III, ламинином, гиалуронанами, другими компонентами матрикса из эмбриональных тканей, фетальных тканей, тканей новорождённых или их комбинаций.
16. Способ по п. 14, дополнительно включающий инкубацию клеток в бессывороточной среде, содержащей минимальную среду с низким содержанием кальция, не содержащей меди и дополненной инсулином, трансферрином/Fe, селеном, цинком, свободными жирными кислотами, связанными с сывороточным альбумином, и, необязательно, липопротеином высокой плотности.
17. Способ по п. 16, в котором минимальная среда содержит RPMI 1640.
18. Способ по п. 16, в котором минимальная среда содержит менее 0,5 мМ кальция.
19. Способ по п. 14, в котором клетки культивируют в течение 7 дней - 21 дня или дольше.
20. Способ по п. 13, в котором ткань желчных путей включает ворота, общий печеночный проток, пузырный проток, общий проток, общий гепатопанкреатический проток и желчный пузырь или их комбинации.
21. Способ по п. 13, в котором ткань желчных путей взята из мест, в которых желчные пути разветвляются или содержат большое число перибилиарных желез.
22. Способ по п. 13, в котором по меньшей мере один маркер, характерный для линий печёночных клеток, содержит HNF6, HES1, CK19, альбумин или AFP;
по меньшей мере по один маркер, характерный для линий панкреатических клеток, содержит PDX1, PROX1, NGN3 или инсулин; и
по меньшей мере один маркер линии эндодермальных клеток содержит транскрипционный фактор, характерный для эндодермальной стволовой клетки или клетки-предшественника, причем транскрипционный фактор, характерный для эндодермальной стволовой клетки или клетки-предшественника, содержит SOX 9, SOX17 или FOXA2.
| ALISON M.R | |||
| et al., Pluripotential liver stem cells: facultative stem cells located in the biliary tree, CELL PROLIF., 1996, v | |||
| Солесос | 1922 |
|
SU29A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Устройство для одновременного приема и передачи по радиотелефону | 1921 |
|
SU373A1 |
| ПРИМИТИВНЫЕ И ПРОКСИМАЛЬНЫЕ ПЕЧЕНОЧНЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2003 |
|
RU2327479C2 |
| US 20090191159 A1, 30.07.2009 | |||
| КОЖУХАРОВА И.В., Новые линии эмбриональных стволовых клеток человека С612 и С910, Цитология, 2009, 51(7), с.551-558 | |||
| ДЕЕВ Р.В., | |||
Авторы
Даты
2021-10-01—Публикация
2010-10-28—Подача