Изобретения относятся к области медицины, а именно к созданию средства для лечения деменций, в том числе болезни Альцгеймера (БА), к способу лечения и к фармацевтической композиции, эффективной как для лечения деменций, включая БА или деменций альцгеймеровского типа, так и при появлении первых признаков расстройства памяти.
В развитых странах БА проявляется старческим слабоумием у лиц среднего и пожилого возраста. Например, по данным Национального Института исследований Старения этим недугом страдают 4,5 млн. американцев, что наносит стране ущерб экономике страны в размере 100 млрд. долларов ежегодно. По мере «старения» человеческой цивилизации и увеличения сроков жизни БА может превратиться в серьезную проблему.
При БА происходит медленная дегенерация нервных клеток головного мозга. Молекулярно-клеточные механизмы повреждения и гибели нейронов до конца не выяснены. БА причисляют к разряду митохондриальных болезний - это сложные мультисистемные заболевания, где причиной патогенеза является нарушение функций митохондрий, вызванных мутациями митохондриальной или ядерной ДНК. Одной из начальных стадий в общем механизме, приводящем к гибели нейронов, является сверхвозбуждение глутаматных рецепторов, важнейшим последствием этого - усиленный приток в клетки кальция, который нарушает функции митохондрий клеток и ее энергетические запасы. При БА истощаются не только холинергические, но и дофаминэргические резервы организма. БА характеризуется нарушением когнитивных функций мозга, снижением памяти, интеллекта, а также выраженной патологией поведения. Во всем мире ведут исследования в этой области, предполагают разные гипотезы возникновения этой болезни.
Однако во всех случаях возникновение и развитие БА связывают с наличием токсического β-амилоида, изменением структуры мембран и ее липидного слоя. В настоящее время ведущую роль в патогенезе БА отводят увеличению уровня секреции β-амилоидного пептида, который вызывает токсического действие на организм, индуцируя окислительный стресс в тканях и органах. Поэтому данный пептид рассматривается в качестве первичной мишени при разработке новых подходов для эффективной терапии, включающей применение ингибиторов β- и γ-секретаз. Уровень β-амилоида прежде всего определяется работой мембраносвязанных секретаз, расщепляющих белок - предшественник (АРР). Влияние на активность этих секретаз рассматривается как один из путей терапии БА. Считается, что состояние и структура мембран, в которых локализованы соответствующие секретазы, а к ним относятся как мембраны эндоплазматического ретикулума, так и лизосомы, важны для нормального функционирования этих ферментов. В ряде работ исследовались специально синтезируемые или изучаемые препараты для лечения БА и их действие на состояние мембран микросом мозга и лизосом печени, а также на вязкость мембран. В случае микросом мозга наблюдали существенное увеличение микровязкости липидного биослоя, а в лизосомах менялось соотношение фосфолипидов в биослое мембраны, увеличение микровязкости в эритроцитах. Из литературы известно, что при БА наблюдается пониженная микровязкость в прибелковых участках липидов мембран при повышенном уровне перекисного окисления липидов (ПОЛ), т.е. нарушения в одной из главных систем регуляции метаболизма - в системе гомеостаза ПОЛ, связанной напрямую с функцией мембран.
Препараты, влияющие на функциональное состояние мембран и регулирующие систему гомеостаза ПОЛ, считались перспективными для прогнозирования лекарственных средств для лечения БА.
Другой причиной токсического воздействия β-амилоида считается индуцируемый им окислительный стресс. Одним из факторов окислительного стресса является пероксид водорода и реакция ПОЛ. Кроме образования амилоидных бляшек возникновение БА тесно связано не только с процессами старения, но и такими патологическими состояниями мозга, как острая и хроническая гипоксия, ишемия, инсульт.
В развитии БА играют роль новый класс шаперонов (PS1 и PS2), контролирующих доступность и опосредованно влияющих на активность протеаз в отношении трансмембранного домена АРР. Близкие по свойствам протеазы вовлечены в процессы протеолитической активации в мембранах транскрипционного фактора регуляции биосинтеза холестерина. Поэтому пусковым моментом является атеросклероз сосудов головного мозга, который может идти с образованием сенильных бляшек в коре головного мозга, что приводит к развитию разного рода деменций и с клинической картиной БА. Появились данные о связи мутаций, вызывающих БА и болезнь Дауна. Поэтому вещества, участвующие в биосинтезе или регуляции холестерина и нарушенного липидного спектра крови, используются в качестве лекарственных средств для профилактики и лечения БА (это статины, никотиновая кислота и др.).
При БА обнаружено существенное изменение активности ацетилхолинэстеразы (АХЭ), свидетельствующее о дефиците холинэргической нейротрансмиссии в мозге - это одна из причин расстройства памяти. Выбор препарата обусловлен основным патогенетическим механизмом заболевания, а именно утратой холинэргической инервации. При деменции различного генеза в России используют физостигмин, амиридин, за рубежом - такрин, донепизил, ингибиторы АХЭ галантамин и ривастигмин (патент US 5409948), фенсерин (заявка WO 03/082270). Для лечения БА используются также антогонисты NMDA-рецептора - мемантин, димебон (патент RU 2106864).
В настоящее время предполагается, что помимо АХЭ регуляция уровня ацетилхолина (Ах) в головном мозге осуществляется еще одним ферментом - бутирилхолинэстеразой (БуХЭ), которая также выявлена в сенильных бляшках, фибриллярных клубочках и в стенке сосудов (при амилоидной ангиопатии). При БА наблюдается дефицит холинэргической передачи, который включает снижение активности Ах, АХЭ и повышение БуХЭ. Оба фермента - АХЭ и БуХЭ локализованы в амилоидных бляшках и способны увеличивать агрегацию амилоидного пептида. Было показано, что ингибиторы АХЭ, взаимодействующие с периферическим местом связывания, кроме блокирования работы этого фермента, могут ингибировать образование амилоидного пептида. Если АХЭ участвует в передаче нервного импульса, то БуХЭ не участвует в нейротрасмиссии и роль БуХЭ до конца не выяснена. БуХЭ сыворотки крови синтезируется в эндоплазматическом ретикулуме клеток паренхимы печени, поэтому уровень активности БуХЭ является одним из показателей функционального состояния печени. Результаты экспериментальных и клинических данных свидетельствуют, что ингибирование БуХЭ сопровождается улучшением способности к обучению, памяти и зрительно-пространственных функций. Поэтому считается, что при БА предпочтительнее использовать препараты двойного действия, ингибиторы АХЭ и БуХЭ. Именно таким двойным действием обладает препарат Ривастигмин, использование которого лишь с 12-ой недели приема препарата приводит к улучшению состояния больных. Однако этот препарат очень дорогой, а терапия заболевания предполагает длительность применения препарата. Кроме дефицита холинэргической передачи при БА наблюдается, особенно на ранних стадиях развития болезни, дефицит адренергических нейронов, которые также способствуют расстройству памяти и нарушений в поведении у больных БА. В последнее время обсуждается роль дофамин-блокирующих препаратов в лечении заболевания.
Нехватка адренергических импульсов напрямую коррелирует с развитием и проявлением депрессии при БА. При этом наблюдается 3-кратное увеличение активности другого очень важного фермента - МАО. Увеличение активности МАО также влияет на развитие амилоидных бляшек. На основании этого сейчас в мире ведутся поиски препаратов двойного действия - ингибиторов АХЭ и МАО для лечения БА (А.В.Веселовский Биомедицинская химия, 2004, т.50 вып.3, с.314-321).
Центральными препаратами в лечении БА являются ингибиторы холинэстеразы для коррекции дефицита ацетилхолина в коре и в гиппокампе головного мозга. Выбор препарата обусловлен основным патогенетическим механизмом заболевания, а именно утратой холинэргической инервации. Ингибиторы холинэстеразы обладают скромным, но определенным эффектом в плане улучшения умственных функций и смягчения других симптомов заболевания. Однако действие препаратов является временным и не приводит к восстановлению холинэргической иннервации. Кроме того, препараты обладают достаточно широким спектром побочных эффектов, среди которых наиболее распространенны тошнота, рвота, диарея и головокружение. К недостаткам известных препаратов относится длительность лечения, высокая стоимость проводимой терапии, побочные эффекты.
Поэтому на сегодняшний день актуальной проблемой является поиск новых эффективных лекарственных средств с минимальными побочными явлениями и являющихся недорогими препаратами.
Наиболее близким аналогом заявленного изобретения является Глиатилин (лекарственный препарат на основе холин альцерофосфата, содержащий 40,5% холина). Глиатилин как холинотропное средство служит донором для биосинтеза АХ в пресинаптических мембранах холинэргических нейронов. Он эффективен при прогрессирующей деменции, хронической недостаточности мозгового кровообращения, сопровождающейся нарушением памяти, двигательными расстройствами, энцефалопатией мозга и врожденными дегенеративными заболеваниями центральной нервной системы (заявка ЕР 1203584). Однако эффект от лечения Глиатилином отмечен в основном у пациентов с сосудисто-мозговой недостаточностью (патент RU 2217143) и алкогольной энцефалопатией. Улучшение когнитивных функций наблюдалось только у больных, страдающих мягкой и умеренной степенью деменции, а в случае деменции средней тяжести эффекта от приема препарата не выявлено (Одинак М.М., Вознюк И.А. Новое в терапии при острой и хронической патологии нервной системы. Учебное пособие, СПб. ВМА, 2001, с.62).
Задачи, на решение которых направлены изобретения, заключаются в создании нового средства и способа лечения БА, свободных от выше перечисленных недостатков, а также поиск новых лекарственных средств с минимальным побочным эффектом, что на сегодняшний день является актуальной проблемой для лечения различных нейродегенеративных заболеваний.
Поставленные задачи решены следующим образом.
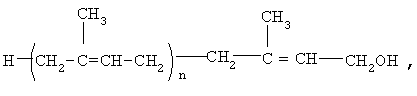
Предлагается применение полипренолов формулы (1)
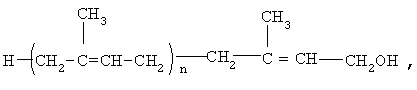
где n=8-20,
в качестве активного ингредиента для производства лекарственного средства для лечения больных с дементным синдромом.
Предлагается применение полипренолов формулы (1)
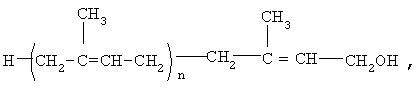
где n=8-20,
в качестве активного ингредиента для производства лекарственного средства для лечения больных, страдающих болезнью Альцгеймера.
Предлагается средство для лечения больных с дементным синдромом, включая больных, страдающих болезнью Альцгеймера, которое представляет собой полипренолы формулы (1)
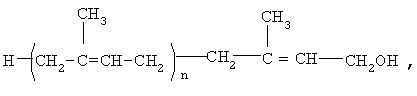
где n=8-20.
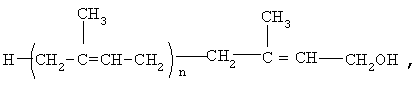
Предлагается фармацевтическая композиция для лечения больных с дементным синдромом, включая больных, страдающих болезнью Альцгеймера, которая включает эффективное количество полипренолов формулы (1)
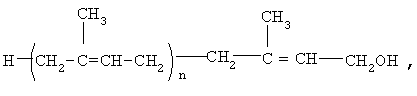
где n=8-20
и фармацевтически приемлемые вспомогательные вещества, включая носители, и/или растворители, добавки и/или лубриканты. Фармацевтическая композиция может быть выполнена в форме раствора, суспензии, таблетки, таблетки с покрытием, капсулы, свечи для ректального введения, липосомальной форме. Фармацевтическая композиция представляет собой масляный раствор, суспензию для парентерального введения или твердую форму для приема внутрь, при этом содержание в ней указанных полипренолов составляет от 0,10 до 80 мас.%.
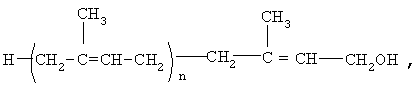
Предлагается способ лечения больных с дементным синдромом, включая больных, страдающих болезнью Альцгеймера, отличие которого заключается в том, что больным вводят эффективное количество полипренолов формулы (1)
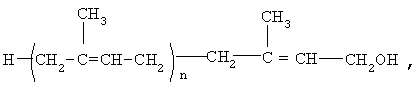
где n=20
в виде самостоятельного препарата или в виде фармацевтической композиции, дополнительно включающей вспомогательные ингредиенты.
Авторами изобретения была выявлена не известная ранее возможность лечения больных с дементным синдромом, с нарушением когнитивных функций, включая больных, страдающих болезнью Альцгеймера, полипренолами формулы (1)
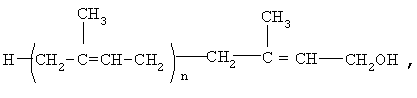
где n=8-20.
Эта природная смесь олигомеров (изопренолов) ведет себя как одно вещество, которое получают из зелени хвойных пород (патент RU 2017782). Этот полипренол показал противоязвенное действие (Н.А.Скуя и др. Продукты переработки древесной зелени - перспективы использования в гастроэнтерологии. Функциональная диагностика и эффективность лечения заболеваний органов пищеварения. Вильнюс, 1988, часть 4, с.675-676), гепатопротекторное (патент US 5731357).
Предпочтительно получать более чистую фракцию полипренолов - Ропрен способом, описанным в патенте RU 2238291. Способ основан на экстракции древесной зелени хвойных и лиственных пород органическим растворителем, последующем выделении отстаиванием при охлаждении и фильтровании восков, отделении свободных кислот от полученного раствора экстрактивных веществ в углеводородном растворителе раствором щелочи, разделении полученного нейтрализованного раствора на раствор нейтральных веществ в углеводородном растворителе и водно-щелочной раствор солей органических кислот. Для этого нейтральные вещества последовательно экстрагируют ацетоном и низшим спиртом. Массовое соотношение «нейтральные вещества - экстрагент» от 1:2 до 1:5 используют при обработке ацетоном и спиртом. При экстракции ацетоном нейтральные вещества разделяются на осадок, содержащий сложные эфиры высших жирных кислот с тритерпеновыми спиртами, стеринами, высшими жирными спиртами и остаток, растворимый в ацетоне. При переработке остатка спиртом отделяют сумму дитерпеновых спиртов от нерастворимых в спирте ацетатов полипренолов, омылением которых спиртовым раствором щелочи получают концентрат полипренолов. Хроматографией указанного концентрата на силикагеле при соотношении вещество - сорбент 1:10 в гексане или в гексане с добавлением 5% и 10% диэтилового эфира при соотношении сорбент - растворитель 1:1 выделяют заявленные полипренолы с плотностью 0,893-0,897. На хроматограмме ВЭЖХ должны присутствовать пики, дающие по расположению и высоте типичную для полипренолов формулы (1) хроматограмму. Условия хроматографии: колонка размером 3,0×150 мм, заполненная октадецилсиликагелем типа Х-Terra С18 или аналогичная, подвижная фаза - смесь ацетон:метанол (80:20), скорость потока - 1 мл/мин.
Основанием для применения соединения формулы (1) по заявленному назначению послужило выявление ряда новых активностей, ранее неизвестных для этого соединения.
Оказалось, что полипренолы формулы (1) являются ингибиторами двойного действия ферментов - МАО и БуХЭ, что позволило предположить их эффективность при лечении больных нейродегенеративными заболеваниями дементного типа, при нарушении когнитивных функций мозга, в частности у больных, страдающих болезнью Альцгеймера.
Авторами настоящего изобретения было изучено и исследовано действие полипренолов формулы (1) у указанных групп больных, их влияние на показатели активности МАО и БуХЭ в ходе лечения, и ниже представлены результаты этой работы.
У 15 больных с сосудистой деменцией Альцгеймеровского типа с синдромом паркинсонизма была определена активность ферментов МАО и БуХЭ в плазме крови. Активность МАО определяли спектрофотометрическим методом (при 241 нм) по количеству бензальдегида, образующегося в результате ферментативной реакции окислительного дезаминирования моноамина в плазме крови (Т.А.Зейналов, В.З.Горкин. Вопросы мед. химии, 1990, 36(1): 78-81). У больных брали кровь из вены и этим методом определяли активность МАО в плазме крови до и после лечения Ропреном.
Нормальные значения активности МАО у здоровых людей (доноров крови) в среднем составляли 0,44 нМоля на 1 мл плазмы за 1 мин. У больных активность МАО варьировалась в зависимости от возраста и состояния от 0,57 до 1,26 нМоля на 1 мл плазмы за 1 мин до лечения (у 3-х больных как исключение - 0,19-0,28 нМоля на 1 мл плазмы за 1 мин). После окончания лечения изопренолами формулы (1) активность МАО снижалась до значений от 0,47 до 0,91 нМоля на 1 мл плазмы за 1 мин*.
Сравнение результатов анализа крови каждого больного до и после лечения показал: активность МАО плазмы крови у больных была выше нормы до лечения в 1,3-2,9 раз и только у 3-х больных она ниже нормы и оставалась без изменений после лечения (* их данные не учитывали при указании диапазона значений активности МАО после лечения).
В результате лечения она снижалась почти у всех больных до нормы или до значений, близких к норме (т.е. в 1,5-3 раза).
Таким образом, показано, что соединение формулы (1) обладает ингибирующим действием на активность МАО плазмы крови.
Активность фермента БуХЭ определяли по методу Эллмана (Ellman G.L., Coutney K.D. et al. Biochem. Pharmacol. 1961 7(1): 88-95; Колб В.В., Калашников B.C. Клиническая биохимия. Пособие для врачей-лаборантов, Минск, 1976, с.109).
Перед анализом плазму крови больных размораживали, разводили водой в 10-30 раз в зависимости от активности БуХЭ и определяли активность БуХЭ этим методом до и после лечения Ропреном. У 15 больных активность БуХЭ варьировалась в зависимости от возраста и состояния от 0,98 до 1,79 нМоля на 1 мл плазмы за 1 мин до лечения (у 3-х больных как исключение - 2,7÷3,1 нМоля на 1 мл плазмы за 1 мин). Через 2 месяца лечения активность БуХЭ снижалась до значений от 0,09 до 0,19 нМоля на 1 мл плазмы за 1 мин у всех без исключения больных. После окончания лечения полипренолами формулы (1) активность БуХЭ или оставалась сниженной до значений от 0,15 до 0,53 нМоля на 1 мл плазмы за 1 мин, или несколько возрастала (у 3-х больных с исключительно высокими исходными уровнями - 1,28÷1,58 нМоля на 1 мл плазмы за 1 мин). У некоторых больных ингибирующее действие Ропрена на активность БуХЭ носило обратимый характер. Однако в среднем показано: при приеме в течение 3-х месяцев происходит уменьшение активности БуХЭ в среднем в 3-20 раз.
Введение больным полипренолов формулы (1) можно проводить как в виде самостоятельного средства, так и в составе фармацевтических композиций в сочетании с фармацевтически приемлемыми носителями, растворителями и вспомогательными средствами.
Примеры фармацевтических композиций включают любые твердые (таблетки, пили, капсулы, гранулы и т.д.) или жидкие (растворы, суспензии, эмульсии) лекарственные формы для приема внутрь, традиционные формы для парентерального введения или для ректального (в виде свеч) введения.
Композиции для приема внутрь могут содержать традиционные для них наполнители; их можно готовить в твердой или жидкой форме: в виде таблеток, капсул, раствора, суспензии или сиропа; они могут содержать любые приемлемые эксципиенты, такие как связующие агенты (например, сахар, желатин, сорбитол, трагакант или поливинилпирролидон), наполнители (лактоза, сахар, крахмал, фосфат кальция, сорбитол), таблетирующие лабриканты (например, стеарат магния), дезинтеграторы (например, крахмал, поливинилпирролидон, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу), увлажнители (например, натрия лаурил сульфат), поверхностно-активные или диспергирующие вещества. Жидкие формы для приема внутрь могут включать растворители (вода, растительные или животные масла, минеральное масло), декстрозу, иные растворы сахаридов, гликоли. Указанные композиции готовят традиционными общепринятыми методами. Такие методы включают смешивание активного ингредиента с носителем, который может включать один или более вспомогательных ингредиентов и получение из смеси готового к продаже продукта.
Таблетки можно получать прессованием на соответствующем оборудовании, при этом активный ингредиент в форме порошка или гранул в случае необходимости смешивается со связующими добавками (например, повидоном, желатином, гидроксипропилметилцеллюлозой), лубрикантами, инертными растворителями, дезинтеграторами (такими как производные целлюлозы, поперечно-связанный повидон, натрия карбоксиметилцеллюлоза), поверхностно-активными или диспергирующими веществами. Таблетки, полученные формованием на соответствующем оборудовании, содержат смесь увлажненного порошка соединения формулы (1) с инертными жидкими растворителями. В случае необходимости таблетки можно покрывать оболочкой для замедленного или контролируемого высвобождения активного ингредиента. Оболочки можно получать, например, из гидроксипропилметилцеллюлозы или ее смеси с желирующими веществами (желатин, воски) в разных соотношениях для обеспечения желательного профиля высвобождения.
Композиции для парентерального введения можно готовить как традиционными в фармации методами (растворы, суспензии), так и в виде водных микроэмульсий согласно патенту RU 2189231 на основе раствора Хенкса с 10% этанола. Они могут включать воду, фармацевтически приемлемые жиры или масла, спирты или другие органические растворители, поверхностно-активные вещества и/или антиоксиданты. Обычные концентрации соединения формулы (1) находятся в диапазоне от 0,10 до 80%.
Готовые составы могут содержать разовую дозу или выполняться в виде ампул или флаконов, содержащих несколько разовых доз. Готовые лекарственные формы в случае необходимости могут содержать стабилизаторы, буферные системы и иные вспомогательные средства.
Средства для ректального введения могут включать традиционные для данной формы парафин, растительные, животные или минеральные жиры и масла, эмульгаторы, полиэтиленгликоль, лаурилсульфат или соли лаурилсульфата, минеральные кислоты или натрия гидрокарбонат.
Далее приведены примеры фармацевтических композиций.
Пример 1. Жидкая липосомальная форма препарата
Липосомальную форму готовили методом механического эмульгирования в жидкой фазе из соевого лецитина, подвергнутого дополнительной очистке. Соединение формулы (1) вводили в состав липида в растворе хлороформа с последующим упариванием, после чего добавляли воду и проводили эмульгирование.
Пример 2. Суспензия для парентерального введения.
Соединение формулы (1) смешивают с Tween 80, добавляют при перемешивании подогретую до 80°С апирогенную воду и разливают в ампулы.
Пример 3. Жидкая пероральная форма.
Смешивают соединение формулы (1) с растительным маслом (соевое, оливковое, подсолнечное, кукурузное и пр.), в указанной пропорции, разливают во флаконы с дозатором, стерилизуют.
Пример 4. Суспензия для парентерального введения.
Соединение формулы (1) смешивают с Tween 80, этанолом, полипропиленгликолем, добавляют подогретую воду и интенсивно перемешивают, разливают в ампулы, стерилизуют.
Пример 5. Желатиновые капсулы.
Указанные ингредиенты смешивают, помещают в капсулы белого цвета, состоящие из желатина с добавлением титана диоксида, упаковывают во флаконы или в блистерную упаковку, стерилизуют.
Пример 6. Мягкие желатиновые капсулы.
Смешивают соединение формулы (1) с растительным маслом (соевое, оливковое, подсолнечное, кукурузное и пр.), помещают в мягкие капсулы, состоящие из каррагенана, глицерина, гидроксипропилкрахмала, 2-основного фосфата натрия, упаковывают во флаконы или в блистерную упаковку, стерилизуют.
Эффективное по заявленному назначению количество находится в пределах от 1 до 200 мг и может быть введено в виде одной или нескольких доз в сутки. Более конкретные количества зависят от вида патологии, состояния больного, наличия сопутствующих заболеваний, поскольку выбор доз и длительность лечения строго индивидуальны.
Эффективность лечения полипренолами формулы (1) деменций Альцгеймеровского типа с выраженным интеллектуально-мнестическим снижением памяти и сравнение эффективности препарата Ропрен и Глиатилина у пациентов изучена у больных при 3-х месячном курсе лечения. Эффективность лечения по функциям до и после лечения оценивали с помощью международной шкалы MMSE (оценка психического статуса) - Mini- Mental State Exmination, MMSE) Folstcin et al, 1975), по опроснику «лист симптомов», унифицированной шкалы оценки паркинсонизма, данных ЭЭГ, биохимических показателей крови.
Клинические испытания препарата были проведены на базе городской психиатрической больницы №3 им И.И.Скворцова-Степанова г.Санкт-Петербурга у больных, страдающих деменцией Альцгеймеровского типа на почве сосудистого поражения головного мозга.
Больных с диагнозом - сосудистая деменция Альцгеймеровского типа можно разделить условно по шкале MMSE по возрасту и по тяжести заболевания на 4 группы: больные с легкой формой деменций составляют - 12%, с умеренно выраженной картиной деменций - 36% больных, с умеренно-тяжелой формой - 32%, а 20% составляют больные с тяжелой формой деменции. (табл.1) Длительность лечения больных Ропреном составляла в среднем 3 месяца, 8 больным препарат давали в течение 4 месяцев. Эти больные страдали тяжелой формой деменций. У многих больных был в анамнезе синдром паркинсонизма.
Клинические испытания препарата, проведенные в г.Санкт-Петербурге на базе муниципальных учреждений: «Больница Святого Георгия», больница №30 им. Боткина, 1 и 2 терапевтические отделения клиник МАПО, Центр по профилактике и борьбе со СПИДом и инфекционными заболеваниями показали, что препарат безопасен и эффективен.
В таблице 1 приведена характеристика больных, полипренолы формулы (1) назначали по 20-200 мг в сутки, Глиатилин (холин альфосцерат) назначали по 400 мг два раза в день.
Характеристика больных до и после лечения Ропреном.
Ко 2-му месяцу лечения Ропреном наступило выраженное улучшение общего состояния больных, исчезли тревоги. Жалобы депрессивного плана, ипохондрические жалобы, плаксивость, более упорядоченное поведение пациентов. В 50% случаев исчезли беспокоившие больных головные боли, головокружение, шаткость при ходьбе. Уменьшилась раздражительность, склонность к аффективным вспышкам.
При оценке интеллекта использовали шкалу MMSE - показатель оценки интеллектуально-мнестических функций больного до и после лечения. Улучшение когнитивных функций наступило у 22 больных (88%), принимавших Ропрен не менее трех месяцев. Была проведена энцефалография (ЭЭГ) у 12 больных (48%) до и после лечения Ропреном. Результаты ЭЭГ помогают в дифференциальной диагностике заболевания.
В процессе старения и при деменциях обычно происходит замедление частоты основных ритмов ЭЭГ. Наиболее выражены эти изменения в частотном спектре в диапазоне альфа-ритма, когда после 60 лет у нормальных людей происходит урежение частоты этих волн, а при патологии они вообще могут исчезать или характеризоваться асинхронностью и неравномерностью ритмов (своего рода «часовой механизм мозга»). В настоящее время анализ ЭЭГ-показателей применяют для определения биологического возраста мозга. От исправности этого часового механизма в значительной мере зависит состояние психического здоровья. О сохранении длительной жизнеспособности всего организма свидетельствует динамика нервной деятельности мозга, когда на ЭЭГ видны улучшения частоты ритма, или у отдельных больных - не только восстановление частоты альфа-ритмов, но и появление их после проведения курса лечения препаратом. Как правило, у таких больных оценка психического статуса по шкале MMSE до и после лечения заявленными полипренолами была выше на 11 баллов.
В целом анализ ЭЭГ выявил у большинства больных положительную динамику, как по данным визуального анализа, так и при оценке спектров мощности, составляющих БЭА. Отмечается отчетливый сдвиг спектральной плотности в сторону высокочастного диапазона в сторону альфа-ритма, повышение его активности, снижение акцента в левой лобной височной доле. Исчезают дельта-волны и пароксизмы. Это указывает на оптимизацию функционального состояния корковых нейронов в виде их активации у больных после лечения Ропреном.(75%). У 2-х больных после приема Ропрена (16,6%) не наблюдалось эффекта, а у одного больного была отрицательная динамика. По данным ЭЭГ положительная динамика при терапии Ропреном наблюдается у больных с ранними сроками заболевания. При лечении Глиатилином динамики изменений в ЭЭГ не наблюдалось.
Исследование неврологического статуса показало, что Ропрен оказывает умеренную терапевтическую активность в плане паркинсонического синдрома при 3-месячном приеме. Паркинсонический синдром после лечения Ропреном уменьшился почти у всех больных (у 23 пациентов из 25) т.е. у 92% больных в среднем на 5 баллов. Эффект отмечался уже через месяц терапии Ропреном. Улучшения паркинсонического синдрома при лечении Глиатилином были ниже: в среднем улучшение характеризовалось увеличением на 3 балла по рейтинговой шкале оценке паркинсонизма. Глиатилин дает более выраженную симптоматику при деменциях сосудистого характера.
Таким образом, полипренолы формулы (1) могут являться средством для лечения больных с дементным синдромом, с диагнозом деменция Альцгеймеровского типа как в легкой форме, так и у больных с умеренно-тяжелой формой заболевания.
У больных с умеренной и умеренно-тяжелой формой заболевания уменьшаются жалобы, связанные с вегетососудистыми нарушениями, улучшается общее самочувствие, повышается жизненный тонус, снижается тяжесть деменции. У части больных тяжелая форма деменции при БА переходит в умеренно-тяжелую форму.
Эффективность воздействия препарата на когнитивные функции зависит от давности развития клиники деменций. Улучшение когнитивных функций: память, интеллект, внимание по шкале MMSE можно оценить в среднем на 5-7 баллов. В большей степени это касалось таких функций, как активное внимание, способность оставленного сохранения в памяти, ориентировки в окружающем пространстве, улучшились речевые функции. Возникшее улучшение состояния отмечали как сами больные, так и врачи и другой медперсонал клиники.
Наиболее выраженный лечебный эффект наступал после лечения полипренолами формулы (1) у больных в случае сочетанной патологии: черепно-мозговой травме, алкоголизм на фоне сосудистой деменции. Наблюдалось улучшение показателей психического статуса по шкале баллов MMSE, улучшение биохимических показателей, положительная динамика ЭЭГ.
У всех больных после лечения полипренолами формулы (1) наблюдалось улучшение общего состояния, уменьшалось число тревожно-депрессивных и ипохондрических жалоб, нормализовались биохимические показатели крови, улучшилось деятельность ЦНС по данным ЭЭГ и по данным MMSE. Однако изменения в неврологическом статусе были менее выражены, чем после лечения Глиатилином.
Сравнительные показатели крови, данных ЭЭГ, психического статуса больных до и после лечения Ропреном
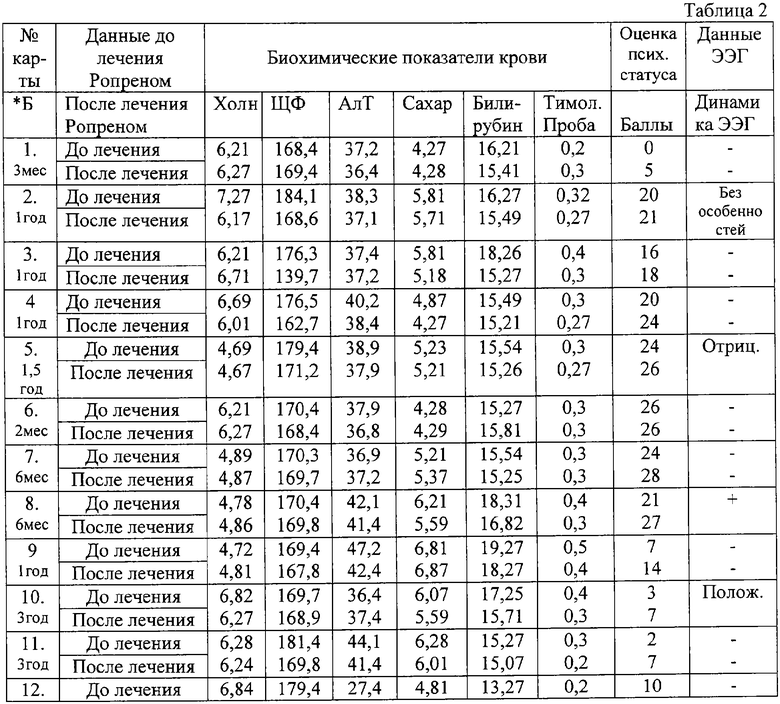
Так, при лечении Ропреном у 10 пациентов (40%) наблюдалась практически полная редукция всей симптоматики, появилась выраженная ориентировка, выраженное улучшение когнитивных функций. У 12 больных (48%) - менее выраженная по психосоматическому статусу, но тем не менее положительная динамика, выражающаяся в улучшении ориентировки, адаптации в отделении и навыков самообслуживания, но в 3-х случаях (12%) у пациентов, принимавших Ропрен в течение 3-х месяцев, улучшения когнитивных функций не наблюдалось. Это пациенты старше 70 лет и болеющие более 1,5 лет. Такие пациенты остаются по-прежнему дезориентированы в пространстве, но тем не менее они стали менее растеряны, менее аффективно заряжены, благодушны, поддаются коррекции в поведении. Эти больные, несмотря на проявления амнестической дезориентировки, стали адаптированы, у них улучшились навыки самообслуживания.
Ниже приведены примеры действия препарата Ропрен на больных.
Наиболее яркие клинические результаты были получены при лечении больных деменцией смешанного характера (сосудистого + травматического + токсического) с длительностью заболевания от 6 месяцев до 3 лет. У этих больных после курса лечения Ропреном нормализовались биохимические показатели крови, данные ЭЭГ показали положительную динамику, а оценка психического статуса больных до и после лечения превысила 11 баллов.
Пример 1. Больной Л., 66 лет, диагноз - сосудистое заболевание головного мозга Альцгеймеровского типа, хр. алкоголизм. Длительность заболевания - 6 месяцев. Форма деменции - умеренная. Оценка психического статуса улучшилась с 21 балла по шкале до 28 баллов. Биохимическая картина до / после лечения: холестерин - 5,01/5,71, ЩФ - 174,1/168,1, АлТ - 121,4/ 37,2,сахар - 7,01/6,41, билирубин 24,1/15,61, тимоловая проба - 1,2/0,3. Данные ЭЭГ показывают до и после лечения Ропреном на положительную динамику: ЭЭГ - в норме. По унифицированной шкале оценке проявлений паркинсонизма улучшение, зарегистрированное после лечения Ропреном, составляет 2 балла (35 - до лечения // 33 - балла после лечения).
Пример 2. Больной А., 56 лет, диагноз - органическое заболевание головного мозга, черепно-мозговая травма, сосудистая деменция с понижением памяти. Длительность заболевания - 6 месяцев. Форма деменции - умеренная. Оценка психического статуса улучшилась с 15 баллов до 26 баллов после лечения Ропреном. По унифицированной шкале оценке проявлений паркинсонизма улучшение, зарегистрированное после лечения Ропреном, составляет 5 баллов (39//34 балла).
Биохимия крови: холестерин - 4,85/6,71, ЩФ - 157/151,4, АлТ - 74,2/27,9,
сахар - 7,01/5,79, билирубин - 21,04/15,57, тимоловая проба 1,0/0,3. Данные ЭЭГ - положительная динамика, появление альфа-ритмов.
Пример 3. Больной К. 73 г, диагноз - сосудистое заболевание мозга Альцгеймеровского типа со снижением памяти. Форма деменции - умеренная. Оценка психического статуса улучшилась с 10 баллов до 26 баллов.
Биохимия крови: холестерин - 5,71/5,77, ЩФ - 161/164,2, АлТ - 97,6/37,1,
сахар - 7,01/5,84, билирубин - 41,2/15,79, тимоловая проба - 2,0/0,4. Положительная динамика на ЭЭГ. Отмечается отчетливый сдвиг спектральной плотности в сторону высокочастного диапазона в сторону альфа-ритма, повышение его активности, снижение акцента в левой лобной-височной доле. Исчезают дельта-волны и пароксизмы. По унифицированной шкале оценке проявлений паркинсонизма улучшение, зарегистрированное после лечения Ропреном, составляет 6 баллов (56//50 баллов).
Пример 4. Больной С.54 г, диагноз - органическое заболевание головного мозга со снижением памяти, черепно-мозговая травма, сосудистая деменция. Форма деменции - умеренно-тяжелая. Длительность заболевания - 1 год. Оценка психического статуса больного улучшилась с 18 баллов до 29 баллов, намного улучшились биохимические показатели крови.
Биохимия крови: холестерин 6,07-5,79, ЩФ - 148/168, АлТ - 71,0/37,1,
сахар 5,81/5,72, билирубин 21,04/15,71, тимоловая проба - 1,4/0,4. Динамика ЭЭГ положительная, появление альфа-ритмов, после лечения - ЭЭГ в норме. По унифицированной шкале оценке проявлений паркинсонизма улучшение, зарегистрированное после лечения Ропреном, составляет 5 баллов(47/42 балла).
Пример 5. Больная И., 60 лет, органическое заболевание головного мозга со снижением памяти. Диагноз: сосудистая деменция Альцгеймеровского типа, синдром дементный, изменение личности. Больная с грубой амнестической дезориентировкой, не знающая свой возраст, семейное положение, состав семьи. Форма деменции - тяжелая. Длительность заболевания 3 года. Оценка психического статуса до/после лечения 3/7. Биохимия крови: холестерин 6,82/6,27, ЩФ - 169,7/168,9, АлТ - 36,4/37,4, сахар 6,07/5,59, билирубин 17,25/15,71, тимоловая проба 0,4/0,3, Появилась положительная динамика на ЭЭГ, исчезают дельта-волны и пароксизмы, наблюдается усиление альфа-ритма. Появились навыки самообслуживания.
Из примеров видно, что улучшение в состоянии больных после 3-месячного курса терапии Ропреном наблюдается как со стороны ЦНС, так и со стороны метаболизма основных органов и биохимических показателей крови.
Таким образом, полипренолы формулы (1) могут являться средством для лечения больных с дементным синдромом, с диагнозом деменция Альцгеймеровского типа, как в легкой форме, так и у больных умеренно-тяжелой формой заболевания. У больных умеренной и умеренно-тяжелой формой заболевания уменьшаются жалобы, связанные с вегетососудистыми нарушениями, улучшается общее самочувствие, повышается жизненный тонус, снижается тяжесть деменции. У части больных тяжелая форма деменции при БА переходит в умеренно-тяжелую форму.
Как известно пусковым моментом БА является атеросклероз сосудов головного мозга, который может идти с образованием сенильных бляшек в коре головного мозга, что приводит к развитию разного рода деменций, например, при старческом атеросклерозе и связанных с ним нарушениях памяти.
Известно, что снижение с возрастом уровня антиоксидантов совместно с метаболической и иммунологической дисфункцией является способствующим, если не определяющим фактором во многих возрастных нарушениях памяти, в том числе и при развитии БА. До постановки диагноза БА большинство пациентов испытывали постепенное ухудшение памяти и концентрации внимания, называемое умеренные когнитивные расстройства (УКР). Не у всех людей впоследствии развивается БА, но процент перехода одного состояния в другое довольно высок и составляет около 33%.
Было проведено рандомизированное, двойное слепое, плацебоконтролируемое исследование препарата Ропрен на контингенте людей, страдающих выраженным возрастным нарушением памяти с признаками депрессии. Здоровые волонтеры в количестве 100 человек в возрасте от 60-80 лет принимали препарат Ропрен в дозе 50 мг сутки (в дозе в 2,5 раза меньшей, чем при лечении больных БА) в течение 12 недель под руководством профессора Кон Стоу (проф. Когнитивной неврологии) на базе Свинбернского Нейропсихологического Центра (Свинбернский Университет Технологии, Мельбурн, Австралия).
Участники этого эксперимента были разделены на две группы и прошли целый ряд когнитивных и психомоторных тестов до приема препарата и плацебо, через две недели и в конце лечения - через 12 недель. Все участники прошли строгий контроль (по критериям включения в эксперимент), который не разрешал принимать в течение опыта вещества, влияющие на память и психоэмоциональное состояние: транквилизаторы, церебропротекторы, нейролептики, антидепрессанты, даже вещества растительного происхождения (например, препараты и экстракты Гинко билоба), а также им всем было рекомендовано диетическое питание. У всех участников эксперимента снимались биохимические показатели крови и липидный спектр крови. Когнитивная деятельность оценивалась с помощью Комплекта тестов Свинбернского университета по оценке когнитивной способности (Pipingas & Stough, 2003), который был специально разработан для пожилых пациентов, и соответственно отражает когнитивные изменения связанные с возрастом. Когнитивные тесты были проведены по 5-ти уровням: 1-й уровень - оценка устойчивости внимания, 2 уровень - оценка краткосрочной или рабочей памяти (тест AVLT), 3 уровень - оценка долгосрочной или эпизодической вторичной памяти, уровень 4 - контроль моторики (способность координировать и контролировать движения) и 5 уровень - оценка психомоторной функции мозга - внимание и высокий уровень обработки цифровой информации, аспекты рабочей памяти. В эксперименте использовались стандартизированные вопросники, которые включали профиль настроения (по шкале POMS), оценка депрессии и беспокойства Бэка (шкала BDI, BDA), шкала депрессии и беспокойства (DAS), кадастр производственного стресса (OSI-R). Статистический анализ и обработка данных проведена с помощью дисперсионного метода анализа (ANOVA) на двух временных отрезках. У 37 участников была проанализирована динамика ЭЭГ в группе плацебо и под действием препарата Ропрен.
В результате эксперимента было установлено, что в группе участников, принимавших Ропрен по сравнению с группой, получавшей плацебо к концу опыта, увеличивался объем краткосрочной и долгосрочной памяти на 30%, а также уровень внимания. Было зарегистрировано значительное улучшение скорости восстановления долгосрочной памяти после 12 недельного курса введения Ропрена. Это означает более быструю обработку информации и доступ к системам долгосрочной памяти. Скорость обработки информации в лобной части мозга была быстрее в случае Ропрена, чем в случае Плацебо. Особенно большая разница между группами наблюдалась по показаниям вербального теста AVLT (тест на слуховое словесное восприятие Рея), когда под действием Ропрена улучшился процесс словесного восприятия и консолидация словесного материала в долгосрочную память, а в группе плацебо за этот же период времени эти функции резко снижались. Данные ЭЭГ показали, что под воздействием Ропрена меняется биоэлектрический потенциал головного мозга, особенно эти изменения эффективны в лобных (во фронтальных) областях мозга, связанных и отвечающих за комплекс когнитивных функций, и подтверждает ускорение нервных процессов во время задания на рабочую память.
В результате лечения препаратом Ропрен достоверно снижался уровень общего холестерина в крови и снижался уровень липопротеидов низкой плотности (ЛПНП) на 30%, а также соотношение ЛПНП/ЛПВП (HDL/LDL). Именно из всех классов липидов перекисное окисление липидов затрагивает в первую очередь именно ЛПНП. Процессы ПОЛ в частицах ЛПНП делают их высоатерогенными и приводят к изменению сосудов головного мозга, образованию атеросклеротических бляшек, что повышает риск развития инфаркта, деменции.
Таким образом, препарат на основе полипренолов формулы (1) ингибирует активность ферментов, участвующих в качестве нейромедиаторов холинэргической трансмиссии нейронов, что дает положительный эффект при лечении больных с дементным синдромом, например у больных с диагнозом деменция Альцгеймеровского типа.
Из вышеизложенного можно сделать вывод, что применение полипренолов формулы (1) - препарата Ропрен для лечения деменции альцгеймеровского типа выгодно отличается от аналогов эффективностью, безопасностью, механизмом двойного действия, доступностью сырья, полученного из отходов лесоразработок.
Препарат может помочь пациентам при проявлении первых признаков расстройств памяти. В связи с отсутствием побочных эффектов лечение полипренолами формулы (1) может продолжаться в течение длительного времени.
Изобретения относятся к химико-фармацевтической промышленности, а именно к созданию средства для лечения деменций, в том числе болезни Альцгеймера (БА), к способу лечения и к фармацевтической композиции, эффективной как для лечения деменций, включая БА или деменций альцгеймеровского типа, так и при появлении первых признаков расстройства памяти. Предложено применение полипренолов формулы
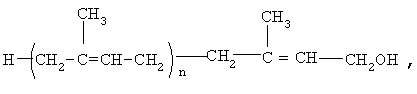
где n=8-20,
в качестве активного ингредиента для производства лекарственного средства для лечения больных с дементным синдромом и для производства лекарственного средства для лечения больных, страдающих болезнью Альцгеймера. Предложена фармацевтическая композиция для лечения больных с дементным синдромом, включая больных, страдающих болезнью Альцгеймера и фармацевтически приемлемые вспомогательные вещества, включая носители, и/или растворители, добавки и/или лубриканты. Фармацевтическая композиция может быть выполнена в форме раствора, суспензии, таблетки, таблетки с покрытием, капсулы, свечи для ректального введения, липосомальной форме. Фармацевтическая композиция представляет собой масляный раствор, суспензию для парентерального введения или твердую форму для приема внутрь, при этом содержание в ней указанных полипренолов составляет от 0,10 до 80 мас.%. Предложен способ лечения больных с дементным синдромом, включая больных, страдающих болезнью Альцгеймера, отличие которого заключается в том, что больным вводят эффективное количество полипренолов формулы
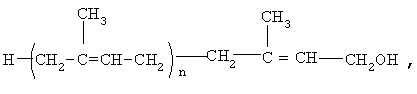
где n=8-20,
в виде самостоятельного препарата или в виде фармацевтической композиции, дополнительно включающей вспомогательные ингредиенты. Средство на основе данного соединения может помочь пациентам при проявлении первых признаков расстройств памяти. В связи с отсутствием побочных эффектов лечение полипренолами может продолжаться в течение длительного времени. 5 н. и 2 з.п ф-лы, 2 табл.
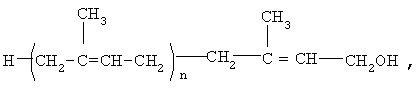
где n=8-20,
в качестве активного ингредиента для производства лекарственного средства для лечения больных с дементным синдромом.
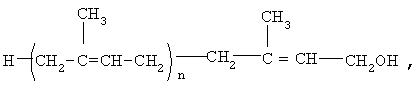
где n=8-20,
в качестве активного ингредиента для производства лекарственного средства для лечения больных, страдающих болезнью Альцгеймера.
где n=8-20.
где n=8-20
и фармацевтически приемлемые вспомогательные вещества, включая носители и/или растворители, добавки и/или лубриканты.
где n=8-20
в виде самостоятельного препарата или в виде фармацевтической композиции, дополнительно включающей вспомогательные ингредиенты.
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СЛАБОУМИЯ, ОБУСЛОВЛЕННОГО ЦЕРЕБРОВАСКУЛЯРНОЙ ПАТОЛОГИЕЙ И БОЛЕЗНЬЮ АЛЬЦГЕЙМЕРА | 1992 |
|
RU2070042C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ ОБУЧЕНИЯ И ПАМЯТИ | 1986 |
|
RU2057531C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ | 2000 |
|
RU2188563C2 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ ПРОЦЕССОВ ЕСТЕСТВЕННОЙ РЕГЕНЕРАЦИИ ПЕЧЕНИ | 2003 |
|
RU2252026C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА | 1998 |
|
RU2143212C1 |
| ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО | 1997 |
|
RU2137479C1 |
Авторы
Даты
2008-06-27—Публикация
2007-05-23—Подача