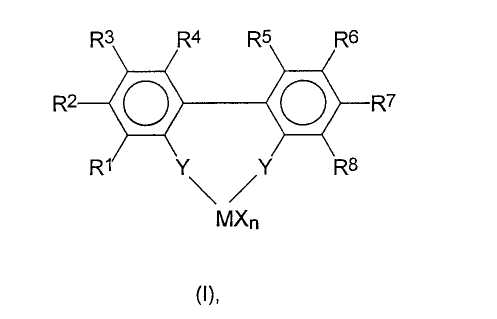
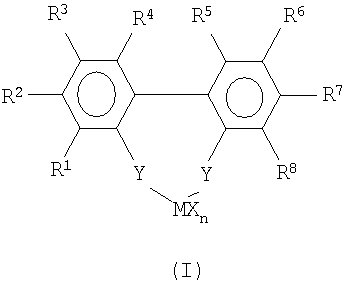
Настоящее изобретение относится к способу получения рацемических анса-металлоценовых бифеноксидных комплексов, имеющих относительно короткое время изомеризации, реакцией мостиковых комплексов переходных металлов формулы (I):
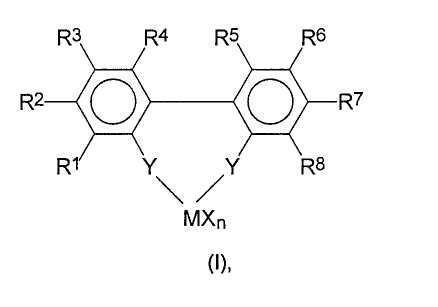
где заместители и индексы имеют следующие значения:
М представляет собой титан, цирконий, гафний, ванадий, ниобий, тантал, хром, молибден, вольфрам или элемент переходной группы III Периодической Таблицы и лантаниды;
Х являются одинаковыми или разными, и каждый из них представляет собой атом фтора, хлора, брома, йода, водорода, С1-С10-алкил, С6-С15-арил, алкиларил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части, -OR9 или -NR9 2, где R9 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил;
n принимает целые значения от 1 до 4 и соответствует валентности М минус 2;
R1, R2, R4, R5, R7, R8 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, фтора, хлора, брома, йода, С1-С20-алкил, 3-8-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил, алкиларил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части, арилалкил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части;
-OR10, -SR10, -N(R10)2, -P(R10)2 или -Si(R10)3, где R10 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил, где упомянутые радикалы могут быть частично или полностью замещены гетероатомами;
R3, R6 являются одинаковыми или разными и каждый из них представляет собой атом водорода, -OR11, -SR11, -N(R11)2, -P(R11)2 или -Si(R11)3, где заместители R11 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С3-С10-циклоалкил;
Y являются одинаковыми или разными, и каждый из них представляет собой
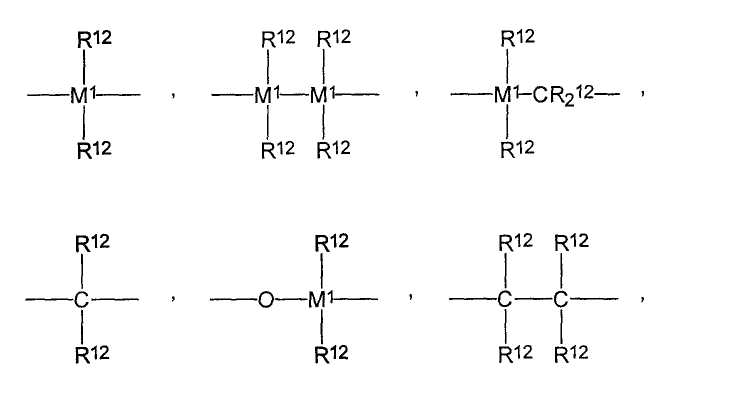
=BR12, =AlR12, -Ge-, -Sn-, -O-, -S-, =SO, =SO2, =NR12, =CO, =PR12 или -P(O)R12,
где R12 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, атом галогена, С1-С10-алкил, С1-С10-фторалкил, С6-С10-фторарил, С6-С10-арил, С1-С10-алкокси-группу, С2-С10-алкенил, С7-С40-арилалкил, С8-С40-арилалкенил, С7-С40-алкиларил, или два радикала R12 вместе с атомами, с которыми они связаны, образуют цикл,
М1 представляет собой кремний, германий или олово;
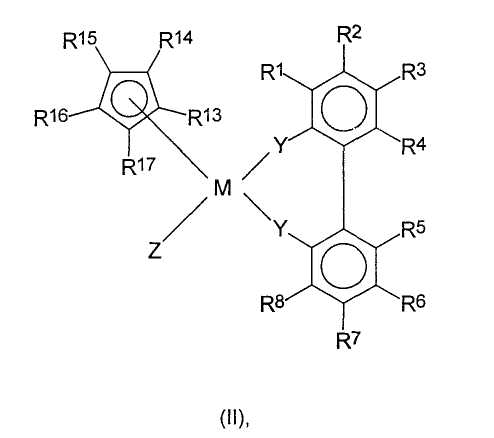
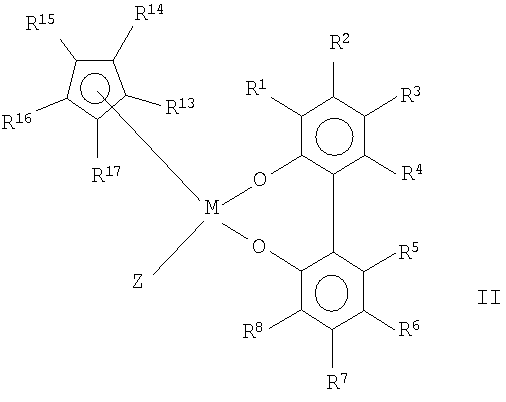
с циклопентадиенильными производными щелочных металлов или щелочноземельных металлов, и нагреванием реакционной смеси, полученной таким образом, до температуры в интервале от -78 до 250оС с добавлением или без добавления свободных радикалов или компонентов, образующих свободные радикалы, с получением рацемических металлоценовых комплексов формулы (II):
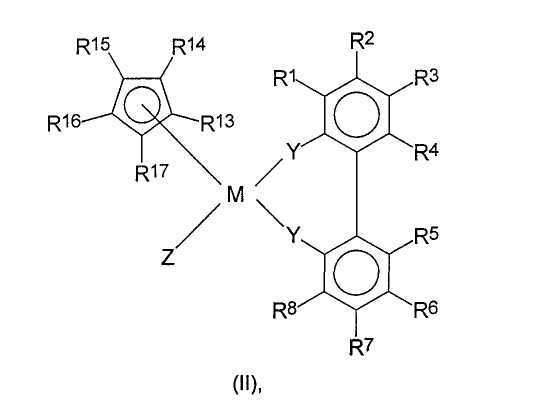
где Y, M и R1-R8 имеют значения, определенные выше, и
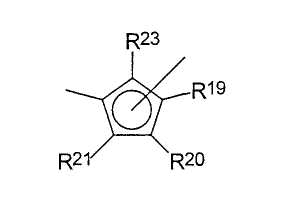
R13-R17 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R18)3,
где R18 являются одинаковыми или разными, и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил, и
Z представляет собой
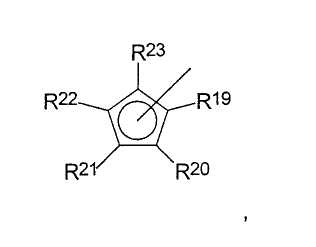
где радикалы
R19-R23 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R24)3, где
R24 являются одинаковыми или разными, и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил, или радикалы
R16 и Z вместе образуют -[T(R25)(R26)]m-E-группу, где
Т могут быть одинаковыми или разными, и каждый из них представляет собой кремний, германий, олово или углерод;
R25, R26 каждый представляет собой атом водорода, С1-С10-алкил, С3-С10-циклоалкил или С6-С15-арил,
m принимает значения 1, 2, 3 или 4, и
Е представляет собой
 или А, где
или А, где
А представляет собой -О-, -S-, >NR27 или >PR27,
где R27 являются одинаковыми или разными, и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил или -Si(R28)3,
где R28 являются одинаковыми или разными, и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил или алкиларил,
к соответствующим рацемическим металлоценовым бифеноксидным комплексам формулы (II) и к применению рацемических металлоценовых бифеноксидных комплексов формулы (II) в качестве катализаторов или в качестве составляющих катализаторов полимеризации олефиновых ненасыщенных соединений или в качестве реагентов или в качестве катализаторов в стереоселективных синтезах.
Кроме стереоспецифической полимеризации олефинов повышенное внимание уделяется энантиоселективному органическому синтезу из-за возможного применения хиральных металлоценовых комплексов металлов переходных групп III-VI Периодической Таблицы элементов. Примером является энантиоселективное гидрирование прохиральных субстратов, например, прохиральных олефинов, как описано в публикации R. Waymouth, P.Pino, J.Am.Chem.Soc., 112 (1990), p. 4911-4914, или прохиральных кетонов, иминов и оксимов, как описано в публикации WO 92/9545.
Также можно упомянуть получение оптически активных алкенов энантиоселективной олигомеризацией, которая описана в публикации W. Kaminsky et al., Angew. Chem., 101 (1989), p. 1304-1306, и энантиоселективную циклополимеризацию 1,5-гексадиенов, которая описана в публикации R. Waymouth, G. Coates, J.Am.Chem.Soc., 113 (1991), p. 6270-6271.
Приведенные выше примеры применения обычно требуют использования металлоценового комплекса в его рацемической форме, то есть без мезосоединений. В случае диастереомерной смеси (рац- и мезоформа), полученной при синтезе металлоценов предшествующего уровня техники, мезоформа вначале должна быть отделена. Так как мезоформа должна быть выброшена, выход рацемического металлоценового комплекса является низким.
Поэтому ранее были предприняты попытки разработать рацемоселективный синтез анса-металлоценов. Существенная стадия в рацемоселективных синтезах анса-металлоценов протекает через промежуточное соединение анса-металлоценовый бисфеноксид или анса-металлоценовый бифеноксид. Соответствующие пути синтеза общего типа описаны, например, в публикациях WO 99/15538 и DE 10030638.
Несмотря на достигнутый прогресс, применимая в общем случае реакционная схема для рацемоселективного синтеза анса-металлоценов до сих пор не была найдена. В способе синтеза через промежуточные анса-металлоценовые бисфеноксиды рацемоселективность пути синтеза сильно зависит от модели замещения используемых бисинденильных лигандов. Так, анса-металлоценовые бисфеноксидные промежуточные соединения обычно могут быть получены рацемически селективно только когда используются производные, замещенные во 2-ом положении мостиковым бисинденильным лигандом. Не привязываясь к какой-либо конкретной теории, полагают, что реакционный путь, вероятно, протекает по кинетически контролируемому механизму, при котором образуются два различных диастереомерных переходных состояния, имеющих различную энергию, так что два изомера, а именно, мезоформа и рацемическая форма, образуются в различных количествах.
Однако указанный синтетический путь с использованием 2,6-метилзамещенных феноксидов через промежуточные анса-металлоценовые бисфеноксиды не может быть успешно применен к комплексам более высоко замещенных и более стерически затрудненных анса-бисинденильных лигандов. Применение вспомогательных феноксидных лигандов, замещенных в 4-ом положении феноксидом, обычно приводит только к незначительным избыткам рацемата.
Во всех синтетических путях через такие анса-металлоценовые бисфеноксидные промежуточные соединения бисфеноксидные комплексы являются термически стабильными, как только они образуются, так что изомеризация между рац- и мезоформой не имеет места при замене вспомогательных феноксидных лигандов.
Напротив, ситуация отличается в случае анса-металлоценовых бифеноксидных комплексов. Соответствующий синтетический путь с использованием замещенных бифеноксидов в качестве вспомогательных лигандов, в котором дилитиевую соль анса-лиганда вводят в реакцию с дихлорциркониевым бифеноксидным комплексом, обычно вначале приводит к рац/мезо отношению полученных анса-металлоценовых бифеноксидных комплексов приблизительно от 1:1 до 5:1. Однако в этом случае мезодиастереомер может быть изомеризован полностью или фактически полностью в термодинамически более стабильный рацизомер путем нагревания. Различия в термодинамической стабильности двух диастереомеров обусловлены стерическим отталкиванием системы лигандов, имеющей объемные заместители, обычно используемые в положениях 3 и 3' бифеноксидного лиганда. Полагают, что первичный реакционный путь к анса-металлоценовому бифеноксидному комплексу также контролируется кинетически.
Такая стратегия рацемоселективного получения анса-металлоценовых бифеноксидных комплексов может быть применена в случае различных металлов и также в случае большого числа различных лигандов. Однако указанный путь синтеза имеет недостаток, заключающийся в том, что трет-бутилзамещенные бифеноксидные вспомогательные лиганды, которые преимущественно использовались в прошлом, например, 3,3',5,5'-тетра-трет-бутилбифенол, требуют относительно продолжительного времени проведения реакции при высоких температурах для термической изомеризации. В общем случае время реакции до 10 часов в толуоле или в аналогичных растворителях при температурах приблизительно 100оС используется для рацемоселективного синтеза анса-металлоценовых бифеноксидных комплексов. Как длительное время реакции, так и высокие температуры изомеризации иногда приводят к значительным потерям выхода и к соответствующему неблагоприятному потреблению времени и энергии.
Еще один недостаток известных синтезов с использованием множественно алкил-замещенных бифеноксидных вспомогательных лигандов, используемых обычно, состоит в относительно высокой растворимости этих неполярных комплексов в используемых обычно ароматических растворителях, что делает выделение комплекса в чистой форме путем кристаллизации значительно более трудным.
Цель настоящего изобретения состоит в том, чтобы преодолеть недостатки предшествующего уровня техники и найти способ селективного получения рацемических металлоценовых бифеноксидных комплексов, которые обычно не содержат мезоизомера (при измерении с точностью, доступной ЯМР). В частности, цель настоящего изобретения состоит в том, чтобы найти рацемоселективный способ синтеза металлоценовых бифеноксидных комплексов, который просто и эффективно с точки зрения стоимости приводит к конечному продукту, который может быть выделен в чистой форме. Еще одна цель состоит в том, чтобы найти рацемические металлоценовые комплексы, которые или могут быть использованы непосредственно как катализаторы или в катализаторах, преимущественно для полимеризации олефинов, или, после модификации, например, путем замещения «вспомогательного лиганда», могут быть использованы как катализаторы или в катализаторах, преимущественно для полимеризации олефинов, или могут быть использованы как реагенты или катализаторы в стереоселективных синтезах.
Заявителями настоящего изобретения установлено, что указанные цели достигаются с помощью способа, определенного в формуле изобретения, с помощью рацемических металлоценовых комплексов II и за счет их применения в качестве катализаторов или в катализаторах полимеризации олефиновых ненасыщенных соединений или в качестве реагентов или катализаторов в стереоселективных синтезах.
Определения «мезоформа», «рацемат» и, следовательно, также «энантиомеры» в контексте металлоценовых комплексов известны и определены, например, в публикации Rheingold et al., Organometallics 11 (1992), p. 1869-1876.
В случае настоящего изобретения определение «фактически без мезоформы» означает, что более чем 80%, предпочтительно, по меньшей мере, 90%, соединения присутствует в форме рацемата, особенно предпочтительно, по меньшей мере, 95%.
Неожиданно было найдено, что металлоценовые бифеноксидные комплексы, содержащие полярные заместители и/или заместители, способные к делокализации электронов, предпочтительно с одной или несколькими свободными парами электронов, в 5 или 5' положении бифеноксидного лиганда, приводят к значительно более короткому времени изомеризации. Кроме того, такие бифеноксидные комплексы могут быть значительно более легко выделены и кристаллизованы.
Мостиковые комплексы переходных металлов, используемые в способе настоящего изобретения, имеют формулу (I):

где заместители и индексы имеют следующие значения:
М представляет собой титан, цирконий, гафний, ванадий, ниобий, тантал, хром, молибден, вольфрам или элемент переходной группы III Периодической Таблицы и лантаниды;
Х являются одинаковыми или разными, и каждый из них представляет собой атомы фтора, хлора, брома, йода, водорода, С1-С10-алкил, С6-С15-арил, алкиларил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части, -OR9 или -NR9 2, где R9 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил;
n принимает целые значения от 1 до 4 и соответствует валентности М минус 2;
R1, R2, R4, R5, R7, R8 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, фтора, хлора, брома, йода, С1-С20-алкил, 3-8-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил, алкиларил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части, арилалкил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части;
-OR10, -SR10, -N(R10)2, -P(R10)2 или -Si(R10)3, где R10 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил, где упомянутые радикалы могут быть частично или полностью замещены гетероатомами;
R3, R6 являются одинаковыми или разными и каждый из них представляет собой атом водорода, -OR11, -SR11, -N(R11)2, -P(R11)2 или -Si(R11)3, где R11 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С3-С10-циклоалкил;
Y являются одинаковыми или разными и каждый из них представляет собой
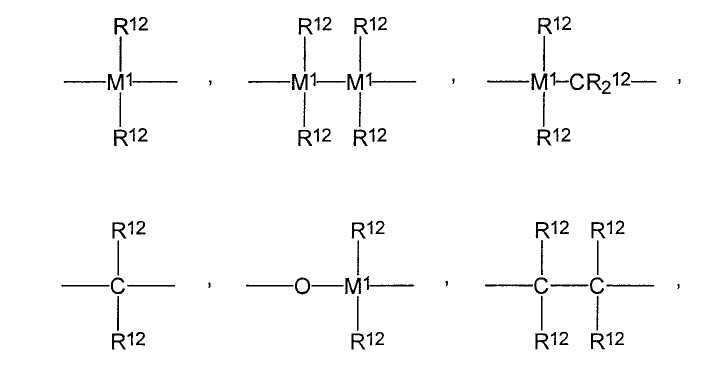
=BR12, =AlR12, -Ge-, -Sn-, -O-, -S-, =SO, =SO2, =NR12, =CO, =PR12 или -P(O)R12, где
R12 являются одинаковыми или разными и каждый из них представляет собой атом водорода, атом галогена, С1-С10-алкил, С1-С10-фторалкил, С6-С10-фторарил, С6-С10-арил, С1-С10-алкокси-группу, С2-С10-алкенил, С7-С40-арилалкил, С8-С40-арилалкенил, С7-С40-алкиларил, или два радикала R12 вместе с атомами, с которыми они связаны, образуют цикл,
М1 представляет собой кремний, германий или олово.
Предпочтительно металл М представляет собой титан, цирконий и гафний, в особенности цирконий.
Хорошо подходящими заместителями Х являются атомы фтора, хлора, брома, йода, предпочтительно хлора, а также С1-С6-алкил, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изо-бутил, предпочтительно, трет-бутил. Другие хорошо подходящие заместители Х представляют собой алкоксиды -OR9 или амиды -N(R9)2, где заместители R9 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, алкиларил, арилалкил, фторалкил или фторарил, каждый из которых содержит от 1 до 10 атомов углерода в алкильном радикале и от 6 до 20 атомов углерода в арильном радикале. Такими радикалами Х являются, например, метил, этил, изо-пропил, трет-бутил, фенил, нафтил, п-толил, бензил, трифторметил, пентафторфенил.
Заместители R1, R2, R4, R5, R7 и R8 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, фтора, хлора, брома, йода, С1-С20-алкил, -OR10, -SR10, -N(R10)2, -P(R10)2 или -Si(R10)3, где R10 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил, 3-8-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильный радикал, такой как метил, этил, пропил в качестве заместителя. Примерами таких циклоалкильных радикалов являются циклопропил, циклопентил, предпочтительно циклогексил, норборнил. Заместители R1, R2, R4, R5, R7 и R8 также могут представлять собой С6-С15-арил, такой как фенил или нафтил; алкиларил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части, например, п-толил; арилалкил, содержащий от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части, например, бензил или неофил; или триорганосилил, такой как -Si(R10)3, где заместители R10 являются одинаковыми или разными и каждый из них представляет собой С1-С20-алкил, С3-С10-циклоалкил, алкиларил, С6-С15-арил, например, триметилсилил, трет-бутилдиметилсилил, трифенилсилил. Упомянутые выше радикалы, конечно, могут быть также частично или полностью замещены гетероатомами, например, атомами S-, N-, O- или галогенсодержащими структурными элементами. Примерами таких замещенных радикалов R1, R2, R4, R5, R7 и R8 являются трифторметильная, пентафторэтильная, гептафторпропильная, гептафторизопропильная и пентафторфенильная группы.
Предпочтительно заместители R1 и R8 представляют собой заместители, которые занимают большое пространство. Такие заместители обычно называют объемными заместителями, и они могут вызывать пространственные затруднения.
В общем случае такие группы являются карбоорганическими или кремнийорганическими радикалами, которые занимают большое пространство (объемные радикалы) или также атом фтора и предпочтительно атом хлора, брома и йода. Количество атомов углерода в таких карбоорганических или кремнийорганических радикалах обычно составляет не менее трех.
Предпочтительными неароматическими, объемными радикалами являются карбоорганические или кремнийорганические радикалы, которые разветвлены в α или более высоком положении. Примерами таких радикалов являются разветвленные С3-С20-алифатические радикалы, С9-С20-аралифатические радикалы и С3-С10-цикло-алифатические радикалы, например изопропил, трет-бутил, изобутил, неопентил, 2-метил-2-фенилпропил (неофил), циклогексил, 1-метилциклогексил, бицикло[2.2.1]гепт-2-ил (2-норборнил), бицикло[2.2.1]гепт-1-ил (1-норборнил), адамантил. Также подходящими радикалами этого типа являются кремнийорганические радикалы, содержащие от трех до тридцати атомов углерода, например, триметилсилил, триэтилсилил, трифенилсилил, трет-бутилдиметилсилил, тритолилсилил или бис(триметилсилил)метил.
Предпочтительные ароматические объемные группы обычно представляют собой С6-С20-арильные радикалы, такие как фенил, 1- или 2-нафтил, или предпочтительно С1-С10-алкил- или С3-С10-циклоалкилзамещенные ароматические радикалы, такие как 2,6-диметилфенил, 2,6-ди-трет-бутилфенил, мезитил.
Более конкретно предпочтительными заместителями R1 и R8 являются изо-пропил, трет-бутил, триметилсилил, циклогексил, изо-бутил, трифторметил, 3,5-диметилфенил.
В предпочтительной модели замещения заместители R1 и R8 в формуле (I) являются одинаковыми.
Предпочтительные заместители R2, R4, R5 и R7 являются одинаковыми или разными и каждый из них представляет собой атом водорода или С1-С20-алкил. Радикалы R1 и R2 или R7 и R8 могут быть также объединены друг с другом так, что образуются насыщенные, частично насыщенные или ненасыщенные циклические группы, содержащие от 4 до 15 атомов углерода.
Особое предпочтение отдается радикалам R2 и R7, которые являются одинаковыми и каждый из них представляет собой атом водорода, и при этом заместители R4 и R5 имеют определенные выше значения.
В соответствии с настоящим изобретением заместители R3 и R6 являются одинаковыми или разными и каждый из них представляет собой атом водорода, алкоксид -OR11, тиолат -SR11, амин -N(R11)2, -P(R11)2 или -Si(R11)3, где заместители R11 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С3-С10-циклоалкил, в особенности 3-8-членный циклоалкил, который может, в свою очередь, содержать С1-С10-алкильный радикал, такой как метил, этил или пропил, в качестве заместителя. Примерами таких циклоалкильных радикалов являются циклопропил, циклопентил, предпочтительно циклогексил, норборнил. Кроме того, R11 также может представлять собой галогензамещенный алкильный или циклоалкильный радикал, например, трифторметил, петафторэтил, гептафтопропил или гептафторизопропил.
Заместители R3 и R6 предпочтительно представляют собой алкоксид -OR11, тиолат -SR11 или амин -N(R11)2, где R11 представляет собой метил, этил, н-пропил, изопропил, трет-бутил, циклопропил, циклопентил, циклогексил, норборнил.
Особенное предпочтение отдается заместителю R11, который является метилом. Заместители R3 и R6 в формуле (I) особенно предпочтительно представляют собой метокси-, этокси-, изопропилокси-, трет-бутилокси-, циклопропилокси- или циклогексилокси-группу.
Возможными мостиковыми звеньями Y являются следующие:
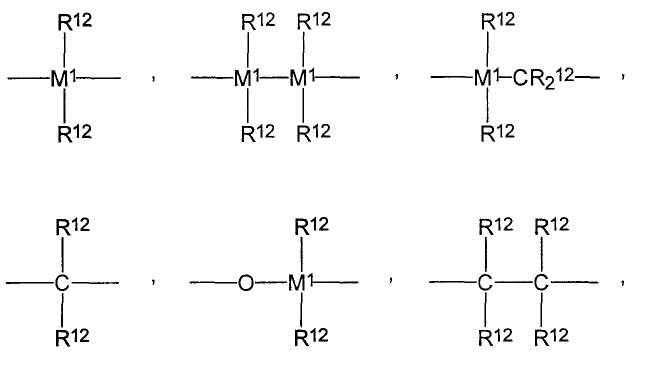
=BR12, =AlR12, -Ge-, -Sn-, -O-, -S-, =SO, =SO2, =NR12, =CO, =PR12 или -P(O)R12,
где
R12 являются одинаковыми или разными и каждый из них представляет собой атом водорода, атом галогена, С1-С10-алкильную группу, С1-С10-фторалкильную группу, С6-С10-фторарильную группу, С6-С10-арильную группу, С1-С10-алкокси-группу, С2-С10-алкенильную группу, С7-С40-арилалкильную группу, С8-С40-арилалкенильную или С7-С40-алкиларильную группу, или R12 и R13 или R12 и R14 в каждом случае вместе с атомами, с которыми они связаны, образуют цикл, и М1 представляет собой кремний, германий или олово.
Предпочтительными мостиковыми звеньями Y являются метилен -СН2-, S, O, -C(CH3)2-; мостиковые звенья Y являются особенно предпочтительно одинаковыми и представляют собой кислород -О-.
Мостиковые комплексы переходных металлов (I) обычно получают способами, которые известны специалистам в данной области.
Синтез мостиковых феноксидных комплексов переходных металлов описан, например, в публикации C.J. Schaverien, J. Am. Chem. Soc. (1995), рр. 3008-3012. Хорошими методиками, как установлено, являются методики, которые обычно проводятся при температуре в интервале от -78 до 110°С, предпочтительно первоначально приблизительно при 20°С, а реакцию затем завершают при кипячении с обратным холодильником. Бифенол вначале депротонируют в растворителе, например, в тетрагидрофуране (ТГФ), например, с помощью гидрида натрия или н-бутиллития, и затем добавляют соединение переходного металла, например, галогенид, такой как тетрахлорид титана, тетрахлорид циркония или тетрахлорид гафния, преимущественно в форме бис-ТГФ-аддукта. По окончании реакции продукт обычно получают путем кристаллизации после отделения солей.
Мостиковые комплексы переходных металлов (I) настоящего изобретения обычно все еще содержат от 1 до 4 эквивалентов основания Льюиса, которое вводится в процессе синтеза. Примерами таких оснований Льюиса являются простые эфиры, такие как диэтиловый эфир или тетрагидрофуран (ТГФ), а также амины, такие как ТМЭДА. Однако комплексы переходного металла также могут быть получены свободными от оснований Льюиса, например, путем сушки при пониженном давлении или за счет выбора других растворителей при синтезе. Такие приемы известны специалистам в данной области.
Новые рацемические анса-металлоценовые бифеноксидные комплексы формулы (II) получают реакцией мостиковых комплексов переходных металлов (I) с циклопентадиенильными производными щелочных металлов или щелочноземельных металлов и затем путем нагревания полученной реакционной смеси в присутствии или в отсутствие свободных радикалов или компонентов, образующих свободные радикалы, как это описано ниже.
Предпочтение отдается использованию комплексов переходных металлов (I), в которых M представляет собой цирконий, а радикалы R3 и R6 имеют описанные выше предпочтительные значения. Особенно хорошо подходящими для использования комплексами (I) являются 3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид дихлорциркония, 3,3'-ди-трет-бутил-5,5'-диэтокси-1,1'-би-2-феноксид дихлорциркония, 3,3'-ди-трет-бутил-5,5'-дипропилокси-1,1'-би-2-феноксид дихлорциркония, 3,3'-ди-трет-бутил-5,5'-диметилтио-1,1'-би-2-феноксид дихлорциркония, 3,3'-ди-трет-бутил-5,5'-диэтилтио-1,1'-би-2-феноксид дихлорциркония, 3,3'-ди-трет-бутил-5,5'-дипропилтио-1,1'-би-2-феноксид дихлорциркония и бифеноксидные соединения циркония, упомянутые в примерах.
Возможными циклопентадиенильными производными щелочных металлов или щелочноземельных металлов являются в принципе производные, которые после реакции с мостиковыми комплексами переходных металлов (I), используемыми в соответствии с настоящим изобретением, селективно дают рацемические металлоценовые комплексы, которые фактически не содержат мезоизомеры.
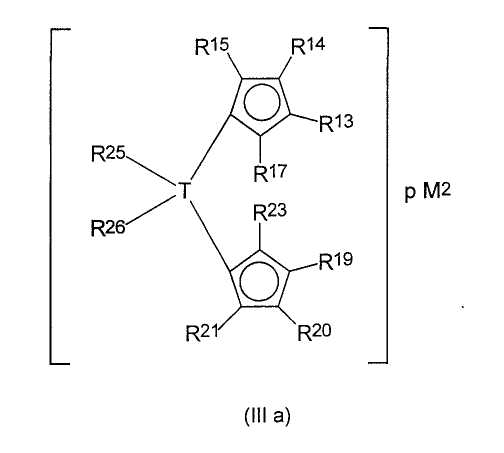
Хорошо подходящими для применения циклопентадиенильными производными щелочных металлов или щелочноземельных металлов являются соединения формулы (III):
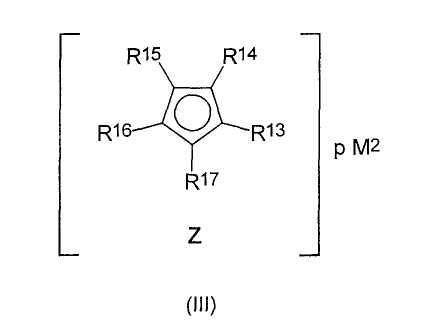
где заместители и индексы имеют следующие значения:
М2 представляет собой Li, Na, K, Rb, Cs, Be, Mg, Ca, Sr, Ba,
где p=1 в случае Be, Mg, Ca, Sr, Ba и
р=2 в случае Li, Na, K, Rb, Cs, и
R13-R17 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилакил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R18)3, где
R18 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил, и
Z представляет собой
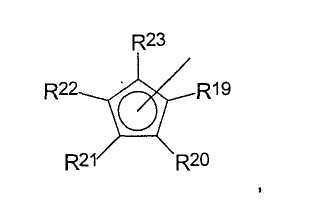
где радикалы
R19-R23 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R24)3, где
R24 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил,
или радикалы
R16 и Z вместе образуют -[T(R25)(R26)]m-E-группу, где
Т могут быть одинаковыми или разными и каждый из них представляет собой кремний, германий, олово или углерод;
R25, R26 каждый представляет собой атом водорода, С1-С10-алкил, С3-С10-циклоалкил или С6-С15-арил,
m принимает значения 1, 2, 3 или 4, и
Е представляет собой
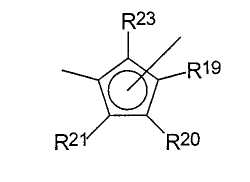 или А, где
или А, где
А представляет собой -О-, -S-, >NR27 или >PR27,
где R27 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил или -Si(R28)3,
где R28 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил или алкиларил.
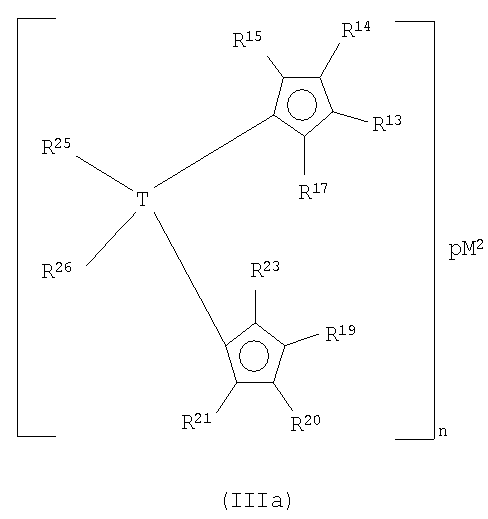
Предпочтительные соединения формулы (III) представляют собой соединения, в которых М2 представляет собой титан, натрий и особенно магний. Также предпочтение отдается соединениям формулы (IIIa):
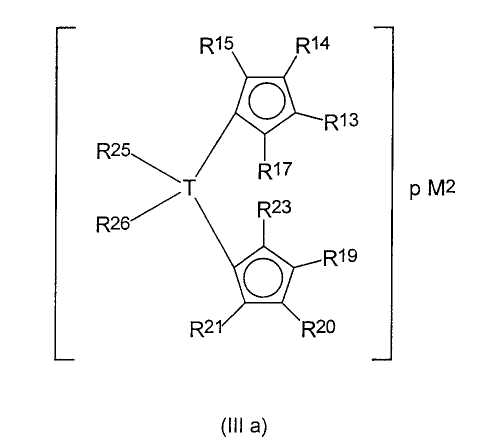
где все заместители имеют значения, определенные выше, и
М2 представляет собой ион щелочного металла или ион щелочноземельного металла,
где р равно 1, когда М2 представляет собой ион щелочноземельного металла, и равно 2, когда М2 представляет собой ион щелочного металла.
Особое предпочтение отдается соединениям формулы (IIIa), в которых М2 представляет собой магний и заместители R17 и R23 представляют собой атом водорода или различные заместители, такие как С1-С10-алкил, такие как метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, изо-бутил, гексил, а также С6-С10-арил, такой как фенил, или триалкилсилил, такой как триметилсилил, T(R25R26) представляет собой бис-С1-С10-алкилсилил или бис-С6-С10-арилсилил, например, диметилсилил, дифенилсилил, а также 1,2-этандиил, метилен, и радикалы R13-R15 и R19-R25 и р имеют определенные выше значения и особенно образуют систему типа инденильного цикла или систему типа бензинденильного цикла.
Более предпочтительными соединениями III являются соединения, которые описаны в примерах, а также:
диметилсиландиилбис(3-трет-бутил-5-метилциклопентадиенил)-магний,
диэтилсиландиилбис(3-трет-бутил-5-метилциклопентадиенил)-магний,
диметилсиландиилбис(3-трет-бутил-5-этилциклопентадиенил)-магний,
диметилсиландиилбис(3-трет-пентил-5-метилциклопентадиенил)-магний,
диметилсиландиилбис(2,4,7-триметилинденил)магний,
1,2-этандиилбис(1-{2,4,7-триметилинденил)}магний,
диметилсиландиилбис(1-инденил)магний,
диметилсиландиилбис(4,5,6,7-тетрагидро-1-инденил)магний,
диметилсиландиилбис(2-метилинденил)магний,
фенил(метил)силандиилбис(2-метилинденил)магний,
дифенилсиландиилбис(2-метилинденил)магний,
диметилсиландиилбис(2-метил-4,5,6,7-тетрагидро-1-инденил)-магний,
диметилсиландиилбис(2,4-диметил-6-изопропилинденил)магний,
диметилсиландиилбис(2-метил-1-бензинденил)магний,
диметилсиландиилбис(2-этил-1-бензинденил)магний,
диметилсиландиилбис(2-пропил-1-бензинденил)магний,
диметилсиландиилбис(2-фенил-1-бензинденил)магний,
дифенилсиландиилбис(2-метил-1-бензинденил)магний,
фенилметилсиландиилбис(2-метил-1-бензинденил)магний,
этандиилбис(2-метил-1-бензинденил)магний,
диметилсиландиилбис(2-метил-1-тетрагидробензинденил)магний,
диметилсиландиилбис(2-метил-4-изопропил-1-инденил)магний,
диметилсиландиилбис(2-метил-4-фенил-1-инденил)магний,
диметилсиландиилбис(2-метил-4-нафтил-1-инденил)магний,
диметилсиландиилбис(2-метил-4-{3,5-трифторметил}фенил-1-инденил)магний,
диметилсиландиилбис(2-этил-4-изопропил-1-инденил)магний,
диметилсиландиилбис(2-этил-4-фенил-1-инденил)магний,
диметилсиландиилбис(2-этил-4-нафтил-1-инденил)магний,
диметилсиландиилбис(2-этил-4-{3,5-трифторметил}фенил-1-инденил)магний,
этандиилбис(2-метил-4-фенил-1-инденил)магний,
этандиилбис(2-метил-4-нафтил-1-инденил)магний,
этандиилбис(2-метил-4-{3,5-ди(трифторметил)}фенил-1-инденил)-магний,
диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-магний,
диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)магний,
диметилсиландиилбис(2-циклогексил-4-фенилинденил)магний,
диметилсиландиилбис(2-бутил-4-фенилинденил)магний,
диметилсиландиилбис(2-этил-4-(4'-трет-бутилфенил)инденил)-магний,
диметилсиландиилбис(2-пропил-4-(4'-трет-бутилфенил)инденил)-магний,
диметилгермандиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-магний,
диэтилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-магний,
диметилсиландиилбис(2-бутил-4-(4'-трет-бутилфенил)инденил)-магний,
диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)-(4-(4'-трет-бутилфенил)инденил)магний,
диметилсиландиилбис(2-бутил-4-(4'-трет-бутилфенил-6-(4'-трет-бутилфенил)инденил)магний,
диметилсиландиилбис(2-изопропил-4-(4'-трет-бутилфенил)-инденил)магний,
диметилсиландиилбис(2-изопропил-4-(4'-трет-бутилфенил)-инденил)магний,
диметилсиландиилбис(2-этил-4-(4'-трет-бутилфенил)инденил)-2-изопропил-4-(4'-трет-бутилфенил)инденил)магний,
диметилсиландиил(2-метил-4-нафтилинденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)магний,
и
диметилсиландиилбис(3-трет-бутил-5-метилциклопентадиенил)-дилитий,
диэтилсиландиилбис(3-трет-бутил-5-метилциклопентадиенил)-дилитий,
диметилсиландиилбис(3-трет-бутил-5-этилциклопентадиенил)-дилитий,
диметилсиландиилбис(3-трет-пентил-5-метилциклопентадиенил)-дилитий,
диметилсиландиилбис(2,4,7-триметилинденил)дилитий,
1,2-этандиилбис(1-{2,4,7-триметилинденил)}дилитий,
диметилсиландиилбис(1-инденил)дилитий,
диметилсиландиилбис(4,5,6,7-тетрагидро-1-инденил)дилитий,
диметилсиландиилбис(2-метилинденил)дилитий,
фенил(метил)силандиилбис(2-метилинденил)дилитий,
дифенилсиландиилбис(2-метилинденил)дилитий,
диметилсиландиилбис(2-метил-4,5,6,7-тетрагидро-1-инденил)-дилитий,
диметилсиландиилбис(2,4-диметил-6-изопропилинденил)дилитий,
диметилсиландиилбис(2-метил-1-бензинденил)дилитий,
диметилсиландиилбис(2-этил-1-бензинденил)дилитий,
диметилсиландиилбис(2-пропил-1-бензинденил)дилитий,
диметилсиландиилбис(2-фенил-1-бензинденил)дилитий,
дифенилсиландиилбис(2-метил-1-бензинденил)дилитий,
фенилметилсиландиилбис(2-метил-1-бензинденил)дилитий,
этандиилбис(2-метил-1-бензинденил)дилитий,
диметилсиландиилбис(2-метил-1-тетрагидробензинденил)дилитий,
диметилсиландиилбис(2-метил-4-изопропил-1-инденил)дилитий,
диметилсиландиилбис(2-метил-4-фенил-1-инденил)дилитий,
диметилсиландиилбис(2-метил-4-нафтил-1-инденил)дилитий,
диметилсиландиилбис(2-метил-4-{3,5-трифторметил}фенил-1-инденил)дилитий,
диметилсиландиилбис(2-этил-4-изопропил-1-инденил)дилитий,
диметилсиландиилбис(2-этил-4-фенил-1-инденил)дилитий,
диметилсиландиилбис(2-этил-4-нафтил-1-инденил)дилитий,
диметилсиландиилбис(2-этил-4-{3,5-трифторметил}фенил-1-инденил)дилитий,
этандиилбис(2-этил-4-фенил-1-инденил)дилитий,
этандиилбис(2-метил-4-нафтил-1-инденил)дилитий,
этандиилбис(2-метил-4-{3,5-ди(трифторметил)}фенил-1-инденил)-дилитий,
диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-дилитий,
диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)дилитий,
диметилсиландиилбис(2-циклогексил-4-фенилинденил)дилитий,
диметилсиландиилбис(2-бутил-4-фенилинденил)дилитий,
диметилсиландиилбис(2-этил-4-(4'-трет-бутилфенил)инденил)-дилитий,
диметилсиландиилбис(2-пропил-4-(4'-трет-бутилфенил)инденил)-дилитий,
диметилгермандиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-дилитий,
диэтилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-дилитий,
диметилсиландиилбис(2-бутил-4-(4'-трет-бутилфенил)инденил)-дилитий,
диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)(4-(4'-трет-бутилфенил)инденил)дилитий,
диметилсиландиилбис(2-бутил-4-(4'-трет-бутилфенил)инденил)-6-(4'-трет-бутилфенил)инденил)дилитий,
диметилсиландиилбис(2-изопропил-4-(4'-трет-бутилфенил)-инденил)дилитий,
диметилсиландиилбис(2-изопропил-4-(4'-трет-бутилфенил)-инденил)дилитий,
диметилсиландиилбис(2-этил-4-(4'-трет-бутилфенил)инденил)-2-изопропил-4-(4'-трет-бутилфенил)инденил)дилитий,
диметилсиландиилбис(2-метил-4-нафтилинденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)дилитий,
а также соответствующие аддукты этих соединений с основаниями Льюиса, например, с ТГФ, ДМФА, ТМЭДА.
Такие соединения щелочного металла или щелочноземельного металла III могут быть получены способами, известными из литературы, например, предпочтительно стехиометрической реакцией металлорганического соединения или гидрида щелочного металла или щелочноземельного металла с соответствующим углеводородом циклопентадиенильного типа. Подходящими металлорганическими соединениями являются, например, н-бутил-литий, ди-н-бутилмагний или (н-, втор-)дибутилмагний.
Реакция комплексов переходного металла (I) с циклопентадиенильными производными щелочных металлов или щелочноземельных металлов, предпочтительно соединений формулы III или IIIa), обычно протекает в органическом растворителе или в суспензионной среде, предпочтительно в смеси растворителей, содержащей растворитель-основание Льюиса, при температуре в интервале от -78 до 250°С, предпочтительно от 0 до 110°С. Подходящими растворителями являются алифатические углеводороды, такие как пентан, гексан, гептан, ароматические углеводороды, такие как толуол, орто-, мета- или пара-ксилол или изопропилбензол (кумол), простые эфиры, такие как тетрагидрофуран (ТГФ), диэтиловый эфир, метил-трет-бутиловый эфир или диметоксиэтан (ДМЭ), амины, такие как диизопропиламин, тетраметилэтандиамин (ТМЭДА) или пиридин.
Особенно подходящими смесями растворителей являются смеси толуола и ТГФ, толуола и ДМЭ или толуола и ТМЭДА, с основанием Льюиса, обычно присутствующим в количестве от 0,1 до 50% моль, предпочтительно от 1 до 20% моль, из расчета на смесь растворителей. Мольное отношение комплекса переходного металла (I) к циклопентадиенильному производному щелочного металла или щелочноземельного металла (III) обычно находится в интервале от 0,8:1 до 1:1,2, предпочтительно составляет 1:1.
Установлено, что последующее нагревание реакционной смеси до температуры в интервале от -78 до 250°С, предпочтительно от 20 до 150 и в особенности от 80 до 110°С, и необязательно в присутствии свободных радикалов или компонентов, образующих свободные радикалы, быстро приводит к высокому выходу, обычно от 80 до 100%, предпочтительно от 95 до 100%, рацемических бифеноксидных комплексов (II) за короткий промежуток времени.
Свободные радикалы, которые можно упомянуть, представляют собой кислород, 2,2',6,6'-тетраметилпиримидин-N-оксид (ТЕМПО). Подходящими соединениями, образующими свободные радикалы, являются все органические и неорганические соединения, которые разлагаются в упомянутом выше температурном интервале и/или при облучении с образованием свободных радикалов, например, пероксиды, диацилпероксиды, такие как бензоилпероксид или ацетилпероксид, пероксидикарбонаты, надэфиры, азоалканы, нитрилы, гипохлориты, полигалогенметаны, N-хлорамины. Особенное предпочтение отдается использованию ТЕМПО. Компоненты, образующие свободные радикалы, предпочтительно используют тогда, когда металлоцен (I) содержит бензо-конденсированную инденильную систему, такую как диметилсилил-бис(2-метилбензинденил), в качестве циклопентадиенильного лиганда.
Кроме того, установлено, что способ настоящего изобретения может быть осуществлен как «способ в одном реакторе», начиная от циклопентадиенильных производных без выделения промежуточных соединений, и при таких условиях процесс протекает рацемоселективно с высокими выходами. Таким образом, особенное предпочтение отдается проведению способа настоящего изобретения, начиная с циклопентадиенильных производных без выделения промежуточных соединений по окончании отдельных стадий способа.
Таким образом, в особенно предпочтительном варианте осуществления способ настоящего изобретения включает следующие последовательные стадии:
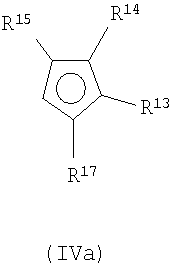
а) депротонирования циклопентадиеновых соединений формул (IVa) и (IVb)
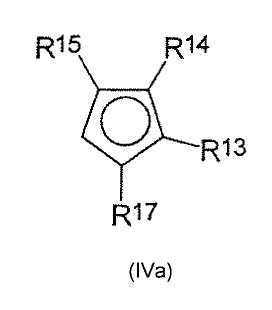 и
и 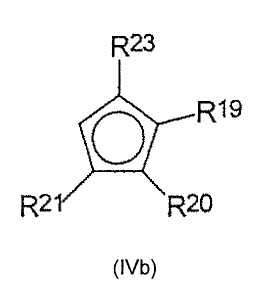
с помощью подходящего депротонирующего агента, где
R13, R14, R15, R17 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R18)3, где
R18 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил, и
R19, R20, R21, R23 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R24)3, где
R24 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил;
b) взаимодействия депротонированных соединений (IVa) и (IVb) с соединением [T(R25)(R26)]mHal2, где Hal представляет собой галогеновый заместитель, такой как атомы F, Cl, Br или I, и последующего повторения депротонирования с помощью подходящего депротонирующего агента с образованием соединения формулы (IIIa):
где М2 представляет собой ион щелочного металла или ион щелочноземельного металла,
где р имеет значение 1, когда М2 представляет собой ион щелочноземельного металла, и 2, когда М2 представляет собой ион щелочного металла, а заместитель R7 имеет значения, определенные ранее, и
Т могут быть одинаковыми или разными и каждый из них представляет собой кремний, германий, олово или углерод,
R25, R26 каждый представляет собой атом водорода, С1-С10-алкил, С3-С10-циклоалкил или С6-С15-арил, и
m принимает значения 1, 2, 3 или 4;
с) взаимодействия соединения формулы (IIIa) с комплексом переходного металла формулы (I):
где заместители и индексы имеют ранее определенные значения.
Подходящими депротонирующими агентами являются, как указано выше, сильные основания, и их выбирают из н-бутиллития, трет-бутиллития, гидрида натрия, трет-бутоксида калия, магниевых реактивов Гриньяра, соединений магния, особенно, таких как ди-н-бутилмагний, (н-, втор-)дибутилмагний и других подходящих алкильных соединений щелочного металла или алкильных соединений щелочноземельного металла.
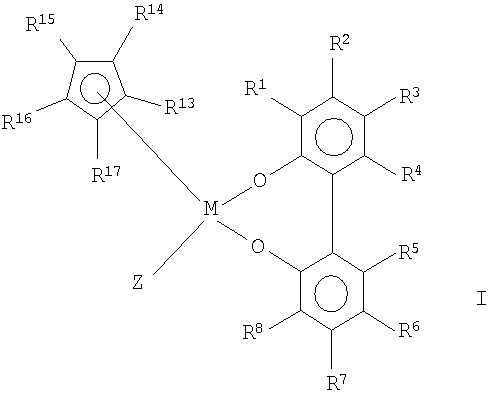
Рацемические металлоценовые комплексы настоящего изобретения предпочтительно представляют собой соединения формулы (II):
где Y, M и R1-R8 имеют определенные выше значения, и
R13-R17 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R18)3, где
R18 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил, и
Z представляет собой
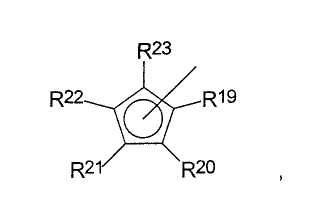
где радикалы
R19-R23 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать С1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, или -Si(R24)3, где
R24 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил или С3-С10-циклоалкил,
или радикалы
R16 и Z вместе образуют -[T(R25)(R26)]m-E-группу, где
Т могут быть одинаковыми или разными и каждый из них представляет собой кремний, германий, олово или углерод;
R25, R26 каждый представляет собой атом водорода, С1-С10-алкил, С3-С10-циклоалкил или С6-С15-арил,
m принимает значения 1, 2, 3 или 4, и
Е представляет собой
 или А, где
или А, где
А представляет собой -О-, -S-, >NR27 или >PR27,
где R27 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил, алкиларил или -Si(R28)3,
где R28 являются одинаковыми или разными и каждый из них представляет собой С1-С10-алкил, С6-С15-арил, С3-С10-циклоалкил или алкиларил.
Предпочтительными соединениями формулы (II) являются соединения, в которых М представляет собой титан, гафний и особенно цирконий. Предпочтение отдается мостиковым соединениям формулы (II), особенно предпочтительно анса-металлоценам, в которых заместители R17 и R23 представляют собой заместители, отличные от атома водорода, например, С1-С10-алкил, такой как метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, изо-бутил, гексил, а также С6-С10-арил, такой как фенил или триалкилсилил, такой как триметилсилил, Т(R25R26) представляет собой бис-(С1-С10)-алкилсилил или бис-(С6-С10)-арилсилил, например, диметилсилил, дифенилсилил, а также 1,2-этандиил, метилен, а радикалы R13-R15 и R19-R25 имеют определенные выше значения и особенно в форме циклической системы инденильного типа или циклической системы бензинденильного типа.
Особенно предпочтительными соединениями II являются соединения, которые описаны в примерах, а также:
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(3-трет-бутил-5-метилциклопентадиенил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диэтилсиландиилбис(3-трет-бутил-5-метилциклопентадиенил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(3-трет-бутил-5-этилциклопентадиенил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(3-трет-пентил-5-метилциклопентадиенил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2,4,7-триметилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид 1,2-этандиилбис(1-{2,4,7-триметилинденил)}циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(4,5,6,7-тетрагидро-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид фенил(метил)силандиилбис(2-метилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид дифенилсиландиилбис(2-метилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-4,5,6,7-тетрагидро-1-инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2,4-диметил-4,5,6,7-тетрагидро-1-инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2,4-диметил-6-изопропилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-этил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-пропил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-фенил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид дифенилсиландиилбис(2-метил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид фенилметилсиландиилбис(2-метил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид этандиилбис(2-метил-1-бензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-1-тетрагидробензинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-4-изопропил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-4-фенил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-4-нафтил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-4-{3,5-трифторметил}фенил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-этил-4-изопропил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-этил-4-фенил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-этил-4-нафтил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-этил-4-{3,5-трифторметил}фенил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид этандиилбис(2-метил-4-фенил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид этандиилбис(2-метил-4-нафтил-1-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид этандиилбис(2-метил-4-{3,5-ди(трифторметил)}фенил-1-инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-циклогексил-4-фенилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-бутил-4-фенилинденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-этил-4-(4'-трет-бутилфенил)инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-пропил-4-(4'-трет-бутилфенил)инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилгермандиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диэтилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-бутил-4-(4'-трет-бутилфенил)инденил)-циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)-4-(4'-трет-бутилфенил)инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-бутил-4-(4'-трет-бутилфенил)-6-(4'-трет-бутилфенил)инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиилбис(2-изопропил-4-(4'-трет-бутилфенил)-инденил)циркония,
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиил(2-этил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)циркония, и
3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид диметилсиландиил(2-метил-4-нафтилинденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)циркония.
Рацемические металлоценовые комплексы, предпочтительно комплексы формулы (II), обычно могут быть дополнительно модифицированы.
Например, бифеноксидный лиганд в комплексе II может быть заменен в реакции замещения и, если желательно, использован повторно. Подходящими способами замещения являются реакция рацемических металлоценовых комплексов, предпочтительно комплексов формулы (II), с SOCl2, тетрахлоридом кремния, дихлоридом метилалюминия, хлоридом диметилалюминия, трихлоридом алюминия, хлоридами диалкилалюминия, полуторными хлоридами алюминия, особенно предпочтительно дихлоридом этилалюминия, или кислотами Бренстеда, такими как галогениды водорода, то есть, HF, HBr, HI, предпочтительно HCl, которые обычно используют так как они есть или в виде раствора в воде или в органических растворителях, таких как диэтиловый эфир, ТГФ. Особенно подходящими растворителями являются алифатические углеводороды, такие как пентан, гексан, гептан, ароматические углеводороды, такие как толуол, орто-, мета- или пара-ксилол или изопропилбензол (кумол), простые эфиры, такие как тетрагидрофуран (ТГФ), диэтиловый эфир, метил-трет-бутиловый эфир или диметоксиэтан (ДМЭ), амины, такие как диизопропиламин, тетраметилэтандиамин (ТМЭДА) или пиридин.
Особенно полезными растворителями являются содержащие основание Льюиса смеси растворителей из углеводородов и простых эфиров или аминов или обоих, например, смеси толуола и ТГФ, толуола и ДМЭ или толуола и ТМЭДА с основанием Льюиса, обычно присутствующим в количестве 0,01-50% моль, предпочтительно 0,1-10% моль, из расчета на смесь растворителей. Особенно подходящими «замещающими реагентами» являются галогенангидриды карбоновых кислот, такие как ацетилхлорид, фенилацетилхлорид, 2-тиофенацетилхлорид, трихлорацетилхлорид, триметилацетилхлорид, О-ацетилманденил-хлорид, хлорангидрид 1,3,5-бензолтрикарбоновой кислоты, хлорангидрид 2,6-пиридинкарбоновой кислоты, трет-бутил-ацетилхлорид, хлорацетилхлорид, 4-хлорфенилацетилхлорид, дихлорацетилхлорид, 3-метоксифенилацетилхлорид, ацетилбромид, бромацетилбромид, ацетилфторид, бензоилфторид, причем они обычно используются в упомянутых выше растворителях или так как они есть.
Такая реакция замещения обычно дает дигалогеновые аналоги соединения формулы (II).
Еще одним приемлемым способом замещения является реакция рацемических металлоценовых комплексов формулы (II) с алюминийорганическими соединениями, такими как три-С1-С10-алкилалюминий, то есть триметилалюминий, триэтилалюминий, три-н-бутилалюминий, три-изобутилалюминий. Согласно известным в настоящее время данным такая реакция дает органические соединения, аналогичные соединениям II (органические радикалы вместо бифеноксида, то есть С1-С10-алкил, такой как метил, этил, н-бутил, изобутил), и, например, алюминийорганические бинафтоксиды.
В реакциях замещения компоненты обычно используют в стехиометрическом соотношении, которое зависит от того монозамещенный или дизамещенный продукт должен быть получен.
Реакции замещения обычно протекают при сохранении стереохимии металлоценовых комплексов, то есть обычно отсутствует превращение рацемической формы в мезоформу металлоценовых комплексов. Более того, особенно в случае описанных выше способов хлорирования рацемическая селективность может возрасти обычно при сохранении стереохимии исходных бифеноксидных комплексов.
Способ настоящего изобретения делает возможным селективно получать рацформу металлоценовых бифеноксидных комплексов, а также анса-металлоценов. Мостиковые инденил- или бензинденильные металлоцены, которые содержат лиганд, отличный от водорода по соседству с мостиковым звеном (а именно: во 2 положении), могут быть получены особенно успешно из бифеноксидных комплексов настоящего изобретения.
Рацемические металлоценовые комплексы настоящего изобретения, в особенности комплексы формулы II, или их описанные выше производные, получаемые, например, замещением бифеноксидного лиганда, могут быть использованы в качестве катализаторов или каталитических систем для полимеризации олефиновых ненасыщенных соединений, таких как этилен, пропилен, 1-бутен, 1-гексен, 1-октен, стирол. Они особенно полезны для стереоселективной полимеризации прохиральных олефиновых ненасыщенных соединений, таких как пропилен, стирол. Подходящими катализаторами или каталитическими системами, в которых рацемические металлоценовые комплексы настоящего изобретения могут действовать как «металлоценовый компонент», обычно получают с помощью соединений, способных образовывать металлоцениевые ионы, которые описаны, например, в ЕР-А-0700935, стр. 7, строка 34 - стр. 8, строка 21, и приведенными там формулами (IV) и (V). Другие соединения, способные образовывать металлоцениевые ионы, представляют собой алюминоксаны (RAlO)n, такие как метилалюминоксан.
Рацемические металлоценовые комплексы настоящего изобретения, в особенности комплексы формулы (II), или их описанные выше производные, получаемые, например, замещением бифеноксидного лиганда, могут быть использованы в качестве катализаторов или каталитических систем в стереоселективных, в особенности органических, синтезах. Примерами, которые могут быть приведены, являются стереоселективное восстановление или стереоселективное алкилирование двойных связей С=С или двойных связей С=О, С=N.
ПРИМЕРЫ
Сокращения:
bp=1,1'-би-2-феноксид
bip=3,3',5,5'-тетра-трет-бутил-1,1'-би-2-феноксид
bap=3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксид.
Общие методики: Получение металлорганических соединений и работа с ними проводятся в отсутствие воздуха и влаги в атмосфере аргона (методика Шленка или в боксе с перчатками). Все требуемые растворители перед применением продувают аргоном и сушат над молекулярными ситами.
bpH2 коммерчески доступен от фирмы Acros Organics (151995000), 3,5-ди-трет-бутилфенол - от фирмы Aldrich (D4, 850-8) и 3-трет-бутил-5-метоксифенол - от фирмы Acros Organics (235235000). bipH2 и bapH2 получают так, как описано в публикации ЕР 35965. Силил-мостиковые индены синтезированы так, как описано в патенте US 4985576.
Пример 1: (сравнительный пример). Получение 3,3',5,5'-тетра-трет-бутил-1,1'-би-2-феноксида диметилсилилбис(2-метил-инденил)циркония
а) Получение ZrCl4(ТГФ)2
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 125 мл толуола 8,52 г (36,56 ммоль) ZrCl4. Суспензию охлаждают приблизительно до 4оС на ледяной бане и затем медленно через капельную воронку в течение 15 мин добавляют 7 г ТГФ. Полученной суспензии дают нагреться до комнатной температуры и перемешивают один час.
b) Получение bipLi2
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, растворяют в 150 мл толуола и в 7,0 г ТГФ 15,9 г (36,53 ммоль) bipH2. Раствор охлаждают приблизительно до 4°С на ледяной бане и затем медленно через капельную воронку в течение 15 мин добавляют 27,5 мл раствора BuLi. Реакционной смеси затем дают нагреться до комнатной температуры и перемешивают один час.
с) Получение (ТГФ)2Cl2Zr(bip)
Раствор со стадии b) переносят в атмосфере азота с помощью шприца в суспензию со стадии а) при комнатной температуре в течение нескольких минут. Остаточное количество bipLi2 смывают 10 мл толуола. Реакционную смесь перемешивают при комнатной температуре в течение 5 часов. Затем смесь нагревают до 80°С.
d) Получение Me2Si(2-Me-ind)Li2
В сухой трехгорлой круглодонной колбе объемом 1000 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 130 мл толуола и в 7,0 г ТГФ 11,2 г (35,53 ммоль) диметил-силилбис(2-метилинденила). При комнатной температуре медленно по каплям в течение 20 минут при перемешивании добавляют 26,5 мл раствора BuLi. Полученную суспензию перемешивают при комнатной температуре еще 2 часа и затем нагревают до 80°С.
е) Получение Me2Si(2-Me-ind)2Zr(bip)
Суспензию со стадии с) переносят при 80°С в атмосфере азота с помощью шприца в суспензию со стадии d) при 80°С в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола. Полученную суспензию нагревают до 100°С и перемешивают при этой температуре 2 часа. Затем реакционную смесь охлаждают до комнатной температуры и перемешивают еще 60 часов. Данные спектра 1H-ЯМР реакционной смеси показывают соотношение рац/мезо приблизительно 3:1. Затем реакционную смесь нагревают при 100°С еще 3 часа, после чего отношение рац/мезо, определенное по данным спектра 1H-ЯМР, составляет приблизительно 5:1. Затем смесь перемешивают при 100оС еще 5 часов. Данные спектра 1H-ЯМР реакционной смеси показывают соотношение рац/мезо приблизительно 19:1. Суспензию переносят горячей с помощью шприца на стеклянный фильтр Шотта №4 и фильтруют в круглодонную колбу объемом 1000 мл с запорным краном. Осадок дважды промывают 25 мл толуола и фильтрат затем концентрируют при 40°С при пониженном давлении. Удаляют 360 мл растворителя. Комплекс кристаллизуется при комнатной температуре. После охлаждения при -20°С в течение шести дней осадок отфильтровывают, промывают 20 мл толуола и сушат при пониженном давлении. Получают суммарно 17,32 г целевого соединения в чистой рацформе, что подтверждено с помощью данных спектра 1Н-ЯМР. Выход: 50,4%.
Пример 2: Получение 3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксида диметилсилилбис(2-метилинденил)циркония
а) Получение ZrCl4(ТГФ)2
Получение проводят так, как описано на стадии а) примера 1, но используемые количества составляют: 8,85 г ZrCl4 (37,97 ммоль), 115 мл толуола и 7 г ТГФ.
b) Получение bapLi2
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, растворяют в 115 мл толуола и в 7,0 г ТГФ 13,61 г bapH2. К раствору через капельную воронку медленно по каплям добавляют 29 мл 20%-ного (мас.) раствора BuLi. По окончании добавления смесь перемешивают один час.
с) Получение (ТГФ)2Cl2Zr(bap)
Суспензию со стадии а) переносят в атмосфере азота с помощью шприца в суспензию со стадии с) при комнатной температуре в течение нескольких минут. Остаточное количество bapLi2 смывают 10 мл толуола, и добавляют. Реакционную смесь перемешивают при комнатной температуре 3 часа и затем нагревают до 80оС.
d) Получение Me2Si(2-Me-ind)Li2
Эту реакционную стадию проводят так, как описано в примере 1, d). Используемые количества составляют: 11,5 г (36,33 ммоль) диметилсилилбис(2-метилинденила), 115 мл толуола и 7,0 г ТГФ. Добавляют 28,0 мл 20%-ного (мас.) раствора BuLi. Затем смесь нагревают до 80°С.
е) Получение Me2Si(2-Me-ind)2Zr(bap)
Суспензию со стадии с) переносят при 80оС в атмосфере азота с помощью шприца в суспензию со стадии d) при 80оС в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола. Полученную суспензию нагревают до 100°С и перемешивают при этой температуре три часа. Данные спектра 1Н-ЯМР указывают на полную изомеризацию комплекса в рацформу. Реакционную смесь фильтруют через фильтр Шотта №4 в круглодонную колбу объемом 1000 мл с запорным краном и фильтрат затем концентрируют при 40°С при пониженном давлении. Удаляют 370 мл растворителя. Целевой комплекс кристаллизуют при комнатной температуре и выделяют декантированием, сушат при пониженном давлении. Получают суммарно 17,59 г целевого комплекса в чистой рацформе. Выход: 63,5%.
Сравнение примеров 1 и 2 показывает, что в случае одинакового бисинденильного лиганда при использовании способа настоящего изобретения металлоценовый бифеноксидный комплекс может быть получен в течение значительно более короткого времени реакции. Кроме того, в примере 2 металлоценовый бифеноксидный комплекс настоящего изобретения может быть выделен аналогичным образом при комнатной температуре с более высоким выходом. Введение полярного метокси-заместителя на бифеноксидный заместитель меняет электронную структуру лиганда так, что растворимость полученного нового металлоценового бифеноксидного комплекса в толуоле значительно уменьшается по сравнению с растворимостью тетра-трет-бутил-замещенного бифеноксидного комплекса, что делает выделение комплекса значительно более легким.
Пример 3: Получение 3,3',5,5'-тетра-трет-бутил-1,1'-би-2-феноксида диметилсилилбис(2-метилбензинденил)циркония
а) Получение ZrCl4(ДМЭ)
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 110 мл толуола 6,3 г (27,03 ммоль) ZrCl4. Суспензию охлаждают приблизительно до 4°С на ледяной бане и затем медленно через капельную воронку по каплям в течение 15 мин добавляют 6,0 г ДМЭ. Полученной суспензии дают нагреться до комнатной температуры и перемешивают один час.
b) Получение bipLi2
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, в 200 мл толуола и в 6,0 г ДМЭ растворяют 11,10 г (27,03 ммоль) bipH2. Раствор охлаждают приблизительно до 4°С на ледяной бане. Медленно через капельную воронку в течение 15 мин добавляют 25 мл 20%-ного (мас.) раствора BuLi. Смеси затем дают нагреться до комнатной температуры и перемешивают еще один час. Реакционную смесь нагревают до 50°С, перемешивают при этой температуре 2 часа и снова охлаждают до комнатной температуры.
с) Получение (ТГФ)2Cl2Zr(bip)
Суспензию со стадии b) переносят в атмосфере азота с помощью шприца в белую суспензию со стадии а) при комнатной температуре в течение нескольких минут. Остаточное количество bipLi2 смывают 10 мл толуола и добавляют. Реакционную смесь перемешивают при комнатной температуре 12 часов. Так как данные спектра 1Н-ЯМР показывают, что реакция еще не закончилась, суспензию нагревают до 80оС, что фактически приводит к окончанию реакции.
d) Получение Me2Si(2-Me-benzind)Li2
В сухой трехгорлой круглодонной колбе объемом 1000 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 120 мл толуола и в 6,0 г ДМЭ 10,70 г (25,68 ммоль) диметилсилил-бис(2-метилбензинденила). При комнатной температуре медленно по каплям в течение 20 минут добавляют 19,5 мл 20%-ного (мас.) раствора BuLi. Суспензию нагревают до 80°С и перемешивают еще 2 час.
е) Получение Me2Si(2-Me-benzind)Zr(bip)
Суспензию со стадии с) переносят при 80оС в атмосфере азота с помощью шприца в суспензию со стадии d) при 80°С в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола и добавляют. Полученную суспензию нагревают до 100°С и перемешивают при этой температуре 3 часа. Затем реакционную смесь охлаждают до комнатной температуры. Данные спектра 1H-ЯМР показывают, что целевой комплекс имеет соотношение рац/мезо приблизительно 1,9:1. Суспензию перемешивают при комнатной температуре еще 12 часов, затем нагревают при 100°С в течение 8 часов. Данные следующего спектра 1H-ЯМР показывают, что комплекс изомеризуется до соотношения рац/мезо приблизительно 3,9:1.
Пример 4: Получение 3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксида диметилсилилбис(2-метилбензинденил)-циркония
а) Получение ZrCl4(ДМЭ)
Синтез аддукта цирконий-ДМЭ проводят так, как описано на стадии а) примера 3. Используемые количества составляют: 12,60 г тетрахлорида циркония, 150 мл толуола, 10,0 г ДМЭ.
b) Получение bapLi2
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, в 200 мл толуола и в 10,0 г ДМЭ растворяют 19,38 г bapH2. Раствор охлаждают приблизительно до 4°С на ледяной бане и через капельную воронку медленно по каплям в течение 15 минут добавляют 25 мл 20%-ного (мас.) раствора BuLi. После добавления приблизительно одной трети раствора BuLi реакционная смесь образует комки. Реакционную смесь нагревают до 70°С, что приводит к растворению комков. Остальное количество раствора BuLi добавляют при 70°С. По окончании добавления получают суспензию, которую можно перемешивать, и суспензию охлаждают до комнатной температуры.
с) Получение (ДМЭ)Cl2Zr(bap)
Суспензию со стадии а) переносят в атмосфере азота с помощью шприца в суспензию со стадии b) при комнатной температуре в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола. Реакционную смесь перемешивают при комнатной температуре 60 часов. Данные спектра 1Н-ЯМР показывают, что реакция не закончена, так что суспензию нагревают при 80оС в течение 4 часов, после чего реакция фактически завершается.
d) Получение Me2Si(2-Me-benzind)Li2
Получение проводят так, как описано на стадии d) примера 3. Используемые количества составляют: 21,4 г диметилсилил-2-метилбензинденила, 10,0 г ДМЭ и 39,0 мл 20%-ного раствора BuLi.
е) Получение Me2Si(2-Me-benzind)Zr(bip)
Суспензию со стадии с) переносят при 80°С в атмосфере азота с помощью шприца в суспензию со стадии d) при 80°С в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола и добавляют. Полученную суспензию нагревают до 100°С и перемешивают при этой температуре в течение всего 12 часов. Данные спектра 1H-ЯМР реакционной смеси показывают, что целевое соединение имеет отношение рац/мезо приблизительно 9:1.
Сравнение примеров 3 и 4 показывает, что использование метокси-замещенного бифеноксидного вспомогательного лиганда, используемого в соответствии с настоящим изобретением, при сравнимых реакционных условиях, приводит к значительно более высокому отношению рац/мезо, чем использование аналогичного трет-бутил-замещенного соединения.
Пример 5: Получение 3,3',5,5'-тетра-трет-бутил-1,1'-би-2-феноксида диметилсилил(2-метил-4-(4'-трет-бутилфенил)-инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)циркония
а) Получение ZrCl4(ТГФ)2
Синтез названного соединения проводят так, как описано в примере 1. Используемые количества составляют: 7,75 г (33,25 ммоль) ZrCl4, 130 мл толуола, 6,5 г ТГФ.
b) Получение bipLi2
Получение названного соединения проводят так, как описано в примере 1. Используемые количества составляют: 13,65 г (33,24 ммоль) bipH2, 130 мл толуола и 6,5 г ТГФ.
с) Получение (ТГФ)2Cl2Zr(bip)
Получение названного соединения проводят так, как описано в примере 1с) с использованием описанных выше растворов b) и a). Полученную суспензию нагревают до 80°С.
d) Получение Me2Si(2-Me-4-(4'-t-Bu-Ph)-ind)(2-i-Pr-4-(4'-t-Bu-Ph)-ind)Li2
В сухой трехгорлой круглодонной колбе объемом 1000 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 150 мл толуола и в 8,0 г ТГФ 19,50 мл диметилсилилбисинденильного лиганда. При комнатной температуре медленно по каплям в течение 20 минут добавляют 24 мл 20%-ного (мас.) раствора BuLi. Полученную суспензию нагревают до 80°С и перемешивают еще 1,5 часа.
е) Получение целевого соединения
Суспензию со стадии с) переносят при 80°С в атмосфере азота с помощью шприца в суспензию со стадии d) при 80°С в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола и добавляют. Полученный раствор перемешивают при 100°С в течение 3 часов. Затем суспензию переносят горячей с помощью шприца на стеклянный фильтр Шотта №4 и фильтруют в круглодонную колбу объемом 1000 мл с запорным краном. Белый осадок промывают 10 мл толуола. Фильтрат затем упаривают досуха при пониженном давлении. Получают всего 38,9 г (110%) сырого соединения.
Пример 6: Получение 3,3'-ди-трет-бутил-5,5'-диметокси-1,1'-би-2-феноксида диметилсилил(2-метил-4-(4'-трет-бутил-фенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)-циркония
а) Получение ZrCl4(ТГФ)2
Синтез названного соединения проводят так, как описано в примере 1. Используемые количества составляют 5,15 г (22,10 ммоль) ZrCl4, 100 мл толуола и 4,1 г ТГФ.
b) Получение bapLi2
Получение названного соединения проводят так, как описано в примере 2. Используемые количества составляют: 7,92 г (22,10 ммоль) bapH2, 100 мл толуола, 10 г ТГФ и 16,5 мл 20%-ного (мас.) раствора BuLi.
с) Получение (ТГФ)2Cl2Zr(bap)
Получение названного соединения проводят так, как описано в примере 2. Полученную суспензию нагревают до 85°С.
d) Получение Me2Si(2-Me-ind)(2-i-Pr-ind)Li2
В сухой трехгорлой круглодонной колбе объемом 1000 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 120 мл толуола и 6,0 г ТГФ 13,0 г (21,34 ммоль) диметилсилил-бисинденильного лиганда. При комнатной температуре медленно по каплям в течение 20 минут добавляют 16,0 мл 20%-ного (мас.) раствора BuLi. Полученную суспензию нагревают до 80°С и перемешивают еще 1,5 часа. И, наконец, суспензию нагревают до 85°С.
е) Получение целевого соединения
Суспензию со стадии с) переносят при 85°С с помощью шприца в суспензию со стадии d) при 85°С в течение нескольких минут. Остаточное количество соединения циркония смывают 10 мл толуола, и добавляют. Полученную суспензию нагревают до 100°С и перемешивают при указанной температуре 3 часа. Данные спектра 1Н-ЯМР указывают на фактически полное образование рацемической формы целевого соединения. Суспензию переносят горячей с помощью шприца на стеклянный фильтр Шотта №4 и фильтруют в круглодонную колбу объемом 1000 мл с запорным краном. Осадок промывают 10 мл толуола. Фильтрат концентрируют при пониженном давлении, причем удаляют 150 мл растворителя. Колбу выдерживают при -20°С в течение 25 дней, что приводит к образованию осадка. Осадок отфильтровывают и сушат при пониженном давлении, получают всего 14,37 г (58%) чистой рацформы целевого соединения.
Пример 7: Получение 1,1'-би-2-феноксида диметилсилил(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)циркония
а) Получение ZrCl4(ТГФ)2
Синтез названного соединения проводят так, как описано в примере 1. Используемые количества составляют: 7,61 г (32,65 ммоль) ZrCl4, 120 мл толуола, 6,5 г ТГФ.
b) Получение bpLi2
В сухой трехгорлой круглодонной колбе объемом 500 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, в 110 мл толуола и в 6,5 г ТГФ растворяют 6,08 г 1,1'-би-2-фенола (bpH2). Раствор охлаждают приблизительно до 4°С на ледяной бане, после чего медленно через капельную воронку в течение 15 мин добавляют 24,5 мл 20%-ного (мас.) раствора BuLi. Суспензии дают нагреться до комнатной температуры и перемешивают один час.
с) Получение (ТГФ)2Cl2Zr(bp)
Суспензию со стадии b) переносят в атмосфере азота с помощью шприца в суспензию со стадии а) при комнатной температуре в течение нескольких минут. Остаточное количество bpLi2 смывают, используя 10 мл толуола, и добавляют. Суспензию перемешивают при комнатной температуре 4 часа и затем нагревают до 85°С.
d) Получение Me2Si(2-Me-4-(4'-t-Bu-Ph)-ind)(2-i-Pr-4-(4'-t-Bu-Ph)-ind)Li2
В сухой трехгорлой круглодонной колбе объемом 1000 мл, которая заполнена инертным газом и снабжена капельной воронкой и вакуумной линией с запорным краном, суспендируют в 150 мл толуола и в 8,0 г ТГФ 19,0 г диметилсилилбисинденильного соединения. При комнатной температуре медленно по каплям в течение 20 минут добавляют 23,5 мл 20%-ного (мас.) раствора BuLi. Полученную суспензию затем нагревают до 60°С и перемешивают 1 час. Затем суспензию нагревают до 85°С.
е) Получение целевого соединения
Суспензию со стадии с) переносят при 85°С с помощью шприца в суспензию со стадии d) при 85°С в течение нескольких минут. Остаточное количество соединения циркония смывают, используя 10 мл толуола, и добавляют. Полученную суспензию перемешивают при 100°С всего в течение 12 часов и затем охлаждают приблизительно до 70°С. Данные спектра 1Н-ЯМР указывают фактически на рацемоселективное образование целевого комплекса. Реакционную смесь переносят горячей с помощью шприца на стеклянный фильтр Шотта №4 и фильтруют в круглодонную колбу объемом 1000 мл с запорным краном. Фильтрат концентрируют при пониженном давлении, причем удаляют 350 мл растворителя. Колбу выдерживают при комнатной температуре один день, что приводит к образованию осадка. Осадок отфильтровывают и сушат при пониженном давлении, получают 10,95 г чистой рацформы целевого соединения с одним эквивалентом толуола. Выход: 36%.
Изобретение относится к способу получения рацемических металлоценовых бифеноксидных комплексов формулы I, где R1-R8 и R13-R17, M, Z имеют указанные в формуле изобретения значения реакцией мостиковых комплексов переходных металлов с циклопентадиенильными производными щелочных металлов или щелочно-земельных металлов и нагреванием полученной таким образом реакционной смеси до температуры в интервале от -78 до 250°С, к соответствующим металлоценовым бифеноксидным комплексам и к их возможному применению в качестве катализаторов или в качестве компонентов катализаторов полимеризации олефиновых ненасыщенных соединений или в качестве реагентов или в качестве катализаторов в стереоселективных синтезах. 2 н. и 3 з.п. ф-лы.
где М представляет собой цирконий;
R1, R2, R4, R5, R7, R8 являются одинаковыми или разными и каждый из них представляет собой атом водорода или C1-C8-алкил;
R3, R6 являются одинаковыми или разными и каждый из них представляет собой -OR11, где заместитель R11 представляет собой C1-С10-алкил;
R13-R17 являются одинаковыми или разными и каждый из них представляет собой атом водорода, С1-С20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать C1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, и где R16 и Z вместе образуют группу -[T(R25)(R26)]m-E-, где
Т могут быть одинаковыми или разными и каждый из них представляет собой кремний или углерод,
R25, R26 каждый представляет собой атом водорода или C1-С10-алкил и m принимает значения 1 или 2; и Е представляет собой
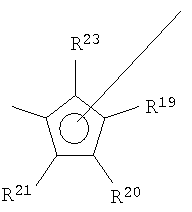
где R19-R23 являются одинаковыми или разными и каждый из них представляет собой атом водорода, С1-С20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать C1-С10-алкильную группу в качестве заместителя, С6-С15-арил или арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода.
а) депротонирование соединений формул (IVa) и (IVb)
 и
и 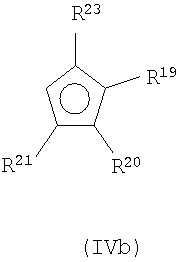
с помощью подходящего депротонирующего агента, где R13, R14, R15, R17 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C20-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать C1-С10-алкильную группу в качестве заместителя, С6-С15-арил или С6-С15-арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода, и R19, R20, R21, R23 являются одинаковыми или разными и каждый из них представляет собой атом водорода, C1-C10-алкил, 5-7-членный циклоалкил, который, в свою очередь, может содержать C1-С10-алкильную группу в качестве заместителя, С6-С15-арил или С6-С15арилалкил, где соседние радикалы могут вместе образовывать циклические группы, содержащие от 4 до 15 атомов углерода;
b) взаимодействие депротонированных соединений (IVa) и (IVb) с соединением [T(R25)(R26)]mHal2, где Hal представляет собой галогеновый заместитель, такой, как атомы F, Cl, Br или I, и последующее повторение депротонирования с помощью подходящего депротонирующего агента с образованием соединения формулы (IIIa)
где М2 представляет собой ион щелочного металла или ион щелочноземельного металла,
где
р имеет значение 1, когда М2 представляет собой ион щелочноземельного металла, и 2, когда М2 представляет собой ион щелочного металла, и
Т представляет собой кремний или углерод,
R25, R26 каждый представляет собой атом водорода, C1-С10-алкил, и
m принимает значения 1 или 2;
с) взаимодействие соединения формулы (IIIa) с комплексом переходного металла формулы (I):
где заместители и индексы имеют следующие значения:
М представляет собой цирконий;
Х являются одинаковыми или разными и каждый из них представляет собой атом фтора, хлора, брома, йода;
n представляет собой 2;
R1, R2, R4, R5, R7, R8 являются одинаковыми или разными и каждый из них представляет собой атом водорода или C1-C8-алкил;
R3, R6 являются одинаковыми или разными и каждый из них представляет собой атом водорода, -OR11, где заместитель R11 представляет собой C1-С10-алкил;
и нагревание реакционной смеси, полученной таким образом, до температуры от -78 до 250°С.
| АВТОМАТ ДЛЯ ИЗГОТОВЛЕНИЯ КОЛЬЦЕВЫХ ГАЗОПОГЛОТИТЕЛЕЙ | 0 |
|
SU200672A1 |
| WO 9915538 A, 01.04.1999. | |||
Авторы
Даты
2008-07-20—Публикация
2003-10-22—Подача