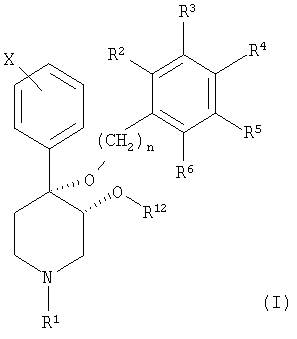
Настоящее изобретение относится к новой серии пиперидинов с цис-3,4-диалкоксизаместителями, описываемых формулой (I):
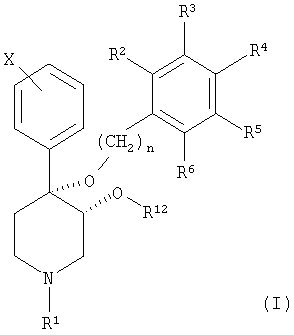
и к их фармацевтически приемлемым солям; в которой
n является целым числом, независимо равным 1 или 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный карбонилом, сульфонилом или гидроксигруппой;
R12 выбран из группы, включающей алкил и алкенил, содержащий от 1 до примерно 5 атомов углерода, и
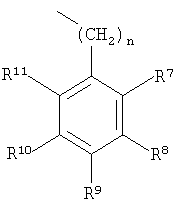
в котором R7-R11 независимо выбраны из группы, включающей водород, галоген, -CN, -NO2, CF3, -OCH3, -COOCH3 и -C6H5;
R2-R6 независимо выбраны из группы, включающей водород, галоген, низш. алкил, -С(CH3)3, CF3, -OCH3, -NO2 и -CN;
и в случае, если R12 обозначает алкил или алкенил, содержащий от 1 до примерно 5 атомов углерода, то R2-R6 обозначают водород.
Соединения формулы I являются небольшими молекулами-ингибиторами взаимодействия MDM2-p53. Эти соединения применимы для лечения рака и борьбы с ним.
р53 является белком-супрессором опухоли, который играет главную роль в защите от развития рака. р53 защищает целостность клеток и предотвращает размножение стойко поврежденных клонов клеток, вызывая остановку роста или апоптоз. На молекулярном уровне р53 является фактором транскрипции, который активирует панель генов, участвующих в регуляции клеточного цикла и апоптоза. р53 является активным ингибитором клеточного цикла, который на клеточном уровне строго регулируется с помощью MDM2. MDM2 и р53 образуют петлю регуляции с обратной связью. MDM2 может связывать р53 и ингибировать его способность к трансактивации регулируемых с помощью р53 генов. Кроме того, MDM2 опосредует убиквитин-зависимое расщепление р53. р53 может активировать экспрессию гена MDM2 и тем самым повышать содержание белка MDM2 в клетке. Эта петля регуляции с обратной связью приводит к обеспечению того, что в клетках с нормальной пролиферацией содержание и MDM2, и р53 является низким. MDM2 также является кофактором для E2F, который играет главную роль в регуляции клеточного цикла.
Во многих типах рака нарушена регуляция между содержанием MDM2 и р53 (E2F). В частности, показано, что часто возникающие молекулярные дефекты в локусе p16INK4/p19ARF влияют на расщепление белка MDM2. Ингибирование взаимодействия MDM2-p53 в опухолевых клетках, содержащих р53 дикого типа, должно привести к накоплению р53, остановке роста и/или апоптозу. Поэтому антагонист MDM2 может привести к новому подходу в лечении рака с его применением в качестве единственного агента или в комбинации с широким спектром других противоопухолевых средств. Возможность реализации такой стратегии была продемонстрирована путем применения различных макромолекулярных средств для ингибирования взаимодействия MDM2-p53 (например, антител, антисмысловых олигонуклеотидов, пептидов). MDM2 также связывает E2F с помощью консервативной связывающей области, как р53, и активирует зависимую от E2F транскрипцию циклина А, показывая, что антагонисты MDM2 могут оказывать воздействие на мутантные клетки с р53.
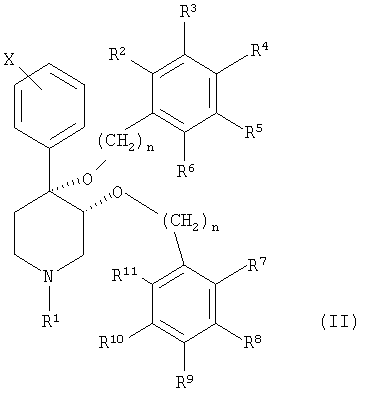
Настоящее изобретение относится к соединению, описываемому формулой (II):
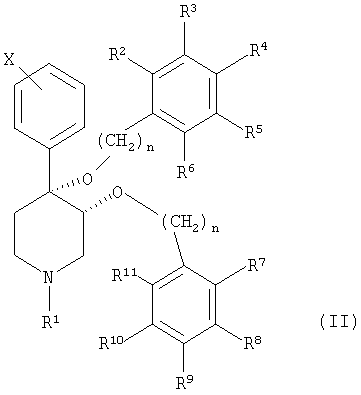
и к его фармацевтически приемлемым солям; в которой
n является целым числом, независимо равным 1 или 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный карбонилом, сульфонилом или гидроксигруппой;
R2-R6 независимо выбраны из группы, включающей водород, галоген, низш. алкил, -С(CH3)3, CF3, -OCH3, -NO2 и -CN; и
R7-R11 независимо выбраны из группы, включающей водород, галоген, -CN, -NO2, -CF3, -OCH3, -COOCH3 и -С6Н5.
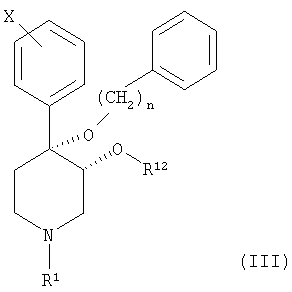
Настоящее изобретение также относится к соединению, описываемому формулой (III):
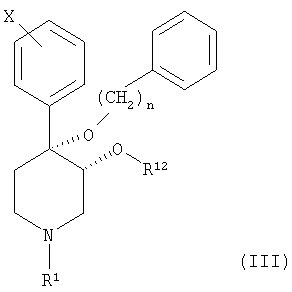
и к его фармацевтически приемлемым солям; в которой
n является целым числом, равным от 1 до 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный карбонилом, сульфонилом или гидроксигруппой; и
R12 выбран из группы, включающей алкил и алкенил, содержащий от 1 до примерно 5 атомов углерода.
Настоящее изобретение также относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения, описываемого формулой (II) или (III), и фармацевтически приемлемый носитель или инертный наполнитель. Кроме того, настоящее изобретение относится к способу лечения рака, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, описываемого формулой (II) или (III). Кроме того, настоящее изобретение относится к применению соединения, описываемого формулой (II) или (III), для изготовления лекарственных средств, предназначенных для лечения рака.
Настоящее изобретение относится к новой серии небольших молекул-ингибиторов взаимодействия MDM2-p53, пиперидинам с цис-3,4-диалкоксизаместителями, которые исследованы с помощью анализов по методике ELISA (твердофазный иммуноферментный анализ). Показано, что наиболее активные соединения этой серии ингибируют взаимодействие белка MDM2 с пептидом типа р53 и их активность является примерно такой же, как и у белка, образованного из р53. Связывание этих соединений с помощью связывающего р53 "кармана" белка MDM2 было подтверждено проведенными с помощью ЯМР исследованиями некоторых соединений этой серии, а также фрагментов этих соединений. Показано, что эти соединения связываются теми же связывающими "карманами", что и цис-имидазолины, что ясно продемонстрировало механизм активности в анализах с использованием клеток, а также антипролиферативную активность по отношению к опухолевым клеткам, содержащим р53 дикого типа, как in vitro, так и in vivo. Поэтому указанные соединения применимы в качестве противораковых агентов.
При использовании в настоящем изобретении приведенные ниже термины обладают указанными ниже значениями:
"Алкил" и "низш. алкильная группа" означает линейный или разветвленный насыщенный алифатический углеводород, содержащий от 1 до 10, предпочтительно от 1 до 6, а более предпочтительно от 1 до 4, атомов углерода. Типичные низш. алкильные группы включают метил, этил, пропил и изопропил.
"Алкенил" означает линейный или разветвленный алифатический углеводород, содержащий от 2 до 10, предпочтительно от 2 до 6, атомов углерода и не менее одной двойной углерод-углеродной связи, например винил, 2-бутенил и 3-метил-2-бутенил.
"Карбонил" означает двухвалентный радикал -СО-.
"Эффективное количество" означает количество, которое эффективно для предупреждения, смягчения или ослабления симптомов заболевания или увеличения продолжительности жизни субъекта, подвергающегося лечению.
"Галоген" означает фтор, хлор, бром или йод.
"Гидроксигруппа" означает одновалентную группу -ОН.
"Замещенный", как замещенный алкил, означает, что замещение может происходить в одном или большем количестве положений и, если не указано иное, что заместители в каждом положении замещения независимо выбраны из заданных групп.
"Сульфонил" означает двухвалентный радикал -SO2-.
"IC50" означает концентрацию конкретного соединения, предлагаемого в настоящем изобретении, необходимую для ингибирования 50% конкретной измеренной активности. IC50 можно измерить, в частности, так, как это описано ниже.
"Фармацевтически приемлемая соль" означает обычные соли, получаемые из кислоты, или соли, полученные из основания, которые сохраняют биологическую эффективность и свойства соединений, предлагаемых в настоящем изобретении, и получаются из подходящих нетоксичных органических или неорганических кислот или органических или неорганических оснований. Примеры солей, получаемых из кислот, включают такие, которые получены из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и такие, которые получены из органических кислот, таких как п-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и т.п. Примеры солей, получаемых из оснований, включают такие, которые получены из гидроксидов аммония, калия, натрия и четвертичного аммония, такого как, например, тетраметиламмонийгидроксид. Химическое превращение фармацевтического соединения (т.е. лекарственного препарата) в соль является методикой, хорошо известной химикам-фармацевтам для обеспечения улучшенной физической и химической стабильности, гигроскопичности, сыпучести и растворимости соединений. См., например, Н.Ansel et.al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995) at pp.196 and 1456-1457.
"Фармацевтически приемлемый", такой как фармацевтически приемлемый носитель, инертный наполнитель и т.п., означает фармакологически приемлемый и в основном нетоксичный для субъекта, которому вводится конкретное соединение.
"Терапевтически эффективное количество" означает количество не менее одного соединения формулы (II) или (III) или его фармацевтически приемлемой соли, которое значительно ингибирует пролиферацию и/или предотвращает дифференциацию опухолевой клетки человека, включая линии опухолевых клеток человека.
Соединения, предлагаемые в настоящем изобретении и приведенные в качестве примеров эффективных соединений, обладают значениями IC50, равными от примерно 3 до примерно 100 мкМ.
Соединения, предлагаемые в настоящем изобретении, применимы для лечения пролиферативных клеточных нарушений, в частности онкологических нарушений, или борьбы с ними. Эти соединения и композиции, содержащие эти соединения, могут быть полезными для лечения солидных опухолей, таких как, например, опухоли молочной железы, ободочной кишки, легких и предстательной железы, или борьбы с ними.
Терапевтически эффективное количество соединения, предлагаемого в настоящем изобретении, означает количество соединения, которое эффективно для предупреждения, смягчения или ослабления симптомов заболевания или увеличения продолжительности жизни субъекта, подвергающегося лечению. Определение терапевтически эффективного количества относится к компетенции специалиста в данной области техники.
Терапевтически эффективное количество или дозировка соединения, предлагаемого в настоящем изобретении, может меняться в широких пределах и может определяться способом, известным в данной области техники. Такая дозировка будет подбираться в соответствии с индивидуальными требованиями в каждом конкретном случае, включая конкретное вводимое соединение (соединения), путь введения, подвергающееся лечению патологическое состояние, а также подвергающегося лечению пациента. Обычно в случае перорального или парентерального введения взрослому человеку массой примерно 70 кг должна быть подходящей суточная доза, составляющая от примерно 10 мг до примерно 10000 мг, предпочтительно от примерно 200 мг до примерно 1000 мг, хотя в случае, если это показано, верхнее предельное значение может быть превышено. Суточную дозу можно вводить в виде разовой дозы или разделенных доз или при парентеральном введении ее можно вводить путем непрерывного вливания.
В настоящем изобретении предлагается соединение, описываемое формулой (II):

и его фармацевтически приемлемые соли; в которой
n является целым числом, независимо равным 1 или 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный карбонилом, сульфонилом или гидроксигруппой;
R2-R6 независимо выбраны из группы, включающей водород, галоген, низш. алкил, -С(CH3)3, CF3, -OCH3, -NO2 и -CN; и
R7-R11 независимо выбраны из группы, включающей водород, галоген, -CN, -NO2, CF3, -OCH3, -COOCH3 и -C6H5.
В предпочтительном варианте выполнения настоящего изобретения n равно 1.
В другом предпочтительном варианте выполнения настоящего изобретения Х обозначает хлор или фтор; более предпочтительно хлор. В другом предпочтительном варианте выполнения настоящего изобретения Х обозначает пара-заместитель.
В другом предпочтительном варианте выполнения настоящего изобретения R1 выбран из группы, включающей водород, -CH2CH3, -CH2CH2CH3, -COCH3, -COCH2CH3, -CH2CHOHCH2ОН и -SO2CH3; более предпочтительно, если R1 обозначает водород.
В другом предпочтительном варианте выполнения настоящего изобретения R2 и R6 независимо выбраны из группы, включающей водород и галоген; более предпочтительно водород, фтор, хлор и бром.
В другом предпочтительном варианте выполнения настоящего изобретения R3 и R5 независимо выбраны из группы, включающей водород, фтор, хлор, бром, -CH3, -OCH3, -CN и -NO2; более предпочтительно, если R3 и R5 независимо выбраны из группы, включающей водород, фтор, хлор и бром.
В другом предпочтительном варианте выполнения настоящего изобретения R4 выбран из группы, включающей водород, фтор, хлор, бром, -С(CH3)3, -CH3, -CN и -CF3; более предпочтительно, если R4 выбран из группы, включающей водород, фтор, хлор и бром.
В другом предпочтительном варианте выполнения настоящего изобретения R7 и R11 независимо выбраны из группы, включающей водород, галоген, -CN, -NO2 и -C6H5; более предпочтительно, если R7 и R11 независимо выбраны из группы, включающей водород, фтор, хлор и бром.
В другом предпочтительном варианте выполнения настоящего изобретения R8 и R10 независимо выбраны из группы, включающей водород, фтор, хлор, бром, -CN, -NO2 и -OCH3; более предпочтительно, если R8 и R10 независимо выбраны из группы, включающей водород, фтор, хлор и бром.
В другом предпочтительном варианте выполнения настоящего изобретения R9 выбран из группы, включающей водород, фтор, хлор, бром, -OCH3, -CN, -CF3 и -COOCH3; более предпочтительно, если R9 выбран из группы, включающей водород, фтор, хлор и бром.
Предпочтительные соединения, обладающие формулой (II), включают
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,6-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(бифенил-2-илметокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3-нитробензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(3-бромбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(2-хлор-4-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
метиловый эфир цис-[рац]-4-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]бензойной кислоты;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,5-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(3-хлор-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,5-дихлорбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,3-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-трифторметилбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-фторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3-фторбензилокси)-пиперидин;
цис-[рац]-2-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-3-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4,5-диметокси-2-нитробензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-бут-2-енилокси-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-пент-2-енилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,3,6-трифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-бутокси-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-3-(4-хлор-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-3-(4-бром-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,4,6-трифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,4,5-трифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,4,6-трифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,5-дихлорбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,6-дихлорбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,6-дифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(3-метоксибензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,3,6-трифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2-фторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2-фтор-3-метилбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(4-фторбензилокси)-пиперидин;
цис-[рац]-4-(4-бромбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-(2-хлор-4-фторбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(2-бромбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-трет-бутилбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-[4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-4-илоксиметил]-бензонитрил;
цис-[рац]-4-(3-хлорбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(3-бромбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2-фторбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(3,5-дифторбензилокси)-пиперидин;
цис-[рац]-4-(3-хлор-2-фторбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2,3-дифторбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(4-трифторметилбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(3-фторбензилокси)-пиперидин;
цис-[рац]-3-[4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-4-илоксиметил]-бензонитрил;
цис-[рац]-4-(2-хлорбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(4-метилбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3,4-бис-(2,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3,4-бис-(3-нитробензилокси)-пиперидин;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,4-дифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(3-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(2-хлор-4-фторбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3,5-дифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(3-хлор-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(4-фторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3-фторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-3-[1-ацетил-4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,6-дифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3-нитробензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2-фторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1-он;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-ил]-пропан-1-он;
цис-[рац]-4-бензилокси-3-(4-бромбензилокси)-4-(4-фторфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-этилпиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-пропилпиперидин;
цис-[рац]-3-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1,2-диол;
цис-[рац]-3-[4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-пропан-1,2-диол;
цис-[рац]-3-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-метансульфонил.
Кроме того, в настоящем изобретении предлагается соединение, описываемое формулой (III):
и его фармацевтически приемлемые соли; в которой
n является целым числом, равным от 1 до 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный карбонилом, сульфонилом или гидроксигруппой; и
R12 выбран из группы, включающей алкил и алкенил, содержащий от 1 до примерно 5 атомов углерода.
В предпочтительном варианте выполнения настоящего изобретения n равно 1.
В другом предпочтительном варианте выполнения настоящего изобретения Х обозначает хлор или фтор; более предпочтительно хлор. В другом предпочтительном варианте выполнения настоящего изобретения Х обозначает пара-заместитель.
В другом предпочтительном варианте выполнения настоящего изобретения R1 выбран из группы, включающей водород, -CH2CH3, -СН2CH2CH3, -COCH3, -COCH2CH3, -CH2CHOHCH2ОН и -SO2CH3; более предпочтительно, если R1 обозначает водород.
В другом предпочтительном варианте выполнения настоящего изобретения R12 выбран из группы, включающей -(СН2)3CH3, -(CH2)4CH3, -CH2СН=CHCH3 и -CH2СН=СН CH2CH3.
Предпочтительные соединения, обладающие формулой (III), включают
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-бутилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-пентилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-(бут-2-ен)илоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-(пент-2-енил)оксипиперидин.
Другие предпочтительные соединения, обладающие формулой (II), включают
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-бутилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-пентилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(бут-2-ен)илоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(пент-2-енил)оксипиперидин.
Настоящее изобретение также относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения, описываемого формулой (II) или (III), и фармацевтически приемлемый носитель или инертный наполнитель. Настоящее изобретение также относится к способу лечения рака, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, описываемого формулой (II) или (III). Предпочтительно, если раком является рак молочной железы или рак ободочной кишки.
Кроме того, настоящее изобретение относится к способам получения соединения формулы I по п.1 формулы изобретения, каковой способ включает
а) связывание соединения формулы IV
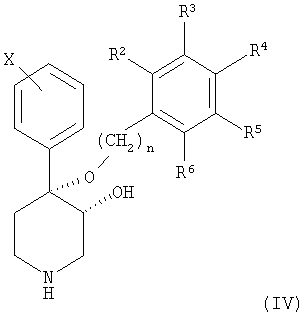
в которой R2-R6, Х и n обладают значениями, определенными выше в настоящем изобретении, с твердой фазой с помощью подходящего связывающего агента с получением соединения формулы V
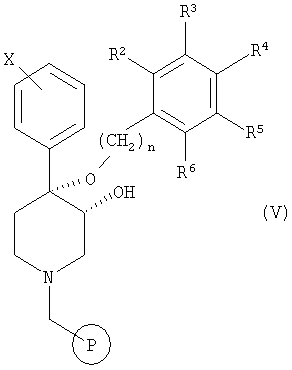
в которой  обозначает твердую фазу,
обозначает твердую фазу,
б) применение трет-бутоксида калия для получения аниона и алкилирования соединения формулы V алкилгалогенидом формулы 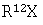 с получением соединения формулы VI
с получением соединения формулы VI
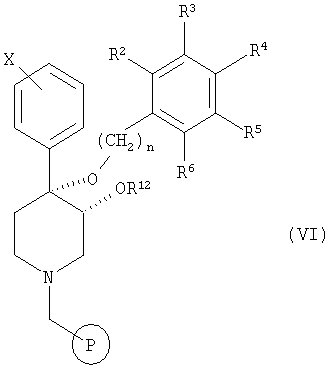
в которой R12 является таким, как определено выше в настоящем изобретении,
в) отщепление продукта от связывающего агента с получением соединения формулы Ia,
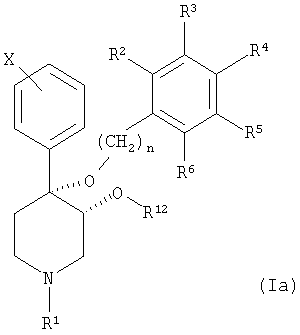
в которой R1 обозначает Н, и при необходимости,
d) проведение реакции соединения формулы Ia с ацилгалогенидом, алкилгалогенидом или сульфонилхлоридом с получением соединения формулы I, в которой R1 обозначает карбонил, сульфонил, низш. алкил или низш. алкил, замещенный карбонилом, сульфонилом или гидроксигруппой.
Соединения, предлагаемые в настоящем изобретении, и соответствующие промежуточные продукты можно получить в соответствии с приведенными ниже схемами. Исходные вещества получают по известным методикам или так, как показано на схемах. Ниже приведены аббревиатуры, использованные при описаний схем, синтезов и в примерах.
АСЕ-Cl = 1-хлорэтилхлорформиат (Aldrich)
БЭМФ = 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфин (Fluka)
БОК = трет-бутиоксикарбонил
t-BuOK = трет-бутоксид калия
CH2Cl2 = дихлорметан
ДХЭ = 1,2-дихлорэтан
ДМФ = N,N-диметилформамид
Et2O = диэтиловый эфир
EtOH = этанол
H2SO4 = серная кислота
HCl = хлорид водорода
Н2О = вода
МеОН = метанол
NaH = гидрид натрия
НМО = N-метилморфолин-N-оксид
НМП = 1-метил-2-пирролидон
OsO4=тетраоксид осмия
БЭМФ на полимерной подложке = 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфин на подложке из полистирольной смолы (Fluka)
i-Pr2NEt = N,N-диизопропилэтиламин
ТЭА = триэтиламин
ТФК = трифторуксусная кислота
ТГФ = тетрагидрофуран.
На схемах 1-3 представлена общая методика получения соединений, предлагаемых в настоящем изобретении, обладающих формулой (II) и (III), с помощью нового твердофазного синтеза. На схеме 4 представлена общая методика получения соединений в жидкой фазе.
На схеме 5 представлены различные методики модификации группы R1 с помощью нового реагента, находящегося на полимерной подложке.
На схеме 1 описано введение защитной группы для вторичной аминогруппы в имеющемся в продаже 4-арил-1,2,3,6-тетрагидропиридине. Предпочтительной защитной группой является трет-бутоксикарбонильная, которую можно синтезировать по известным методикам (Greene, Т.W. and Wuts, P.G. М, 2nd Edition, John Wiley & Sons, N.Y. 1991). Для жидкофазного синтеза образовавшийся трет-бутиловый эфир можно обработать с помощью OsO4/HMO и получить дигидроксильный промежуточный продукт А. Селективное о-алкилирование промежуточного продукта А по атому С3 можно выполнить с помощью NaH и 4-метоксибензилхлорида. Полученный промежуточный продукт можно бензилировать по известным методикам. Удаление 4-метоксибензильной и трет-бутоксикарбонильной защитных групп с помощью 50% ТФК/CH2Cl2 дает 4-арил-4-бензилокси-3-гидроксипиперидин В. Для твердофазного синтеза полученный пиперидин В можно связать с подходящим связывающим агентом, таким как хлорметильное производное связывающего агента ArgoPore-Cl (Argonaut). Алкилирование твердой фазы можно выполнить с использованием t-BuOK для получения аниона с последующим сочетанием с различными алкилгалогенидами (RX). Конечный продукт реакции можно отщепить от связанного с N-бензильной группой третичного аминного связывающего агента с помощью альфа-хлорэтилхлорформиата (АСЕ-Cl)/МеОН и получить пиперидиновые соединения, предлагаемые в настоящем изобретении (Leysen, D. et al. Tetrahedron Lett. 1997, 2915-2918).
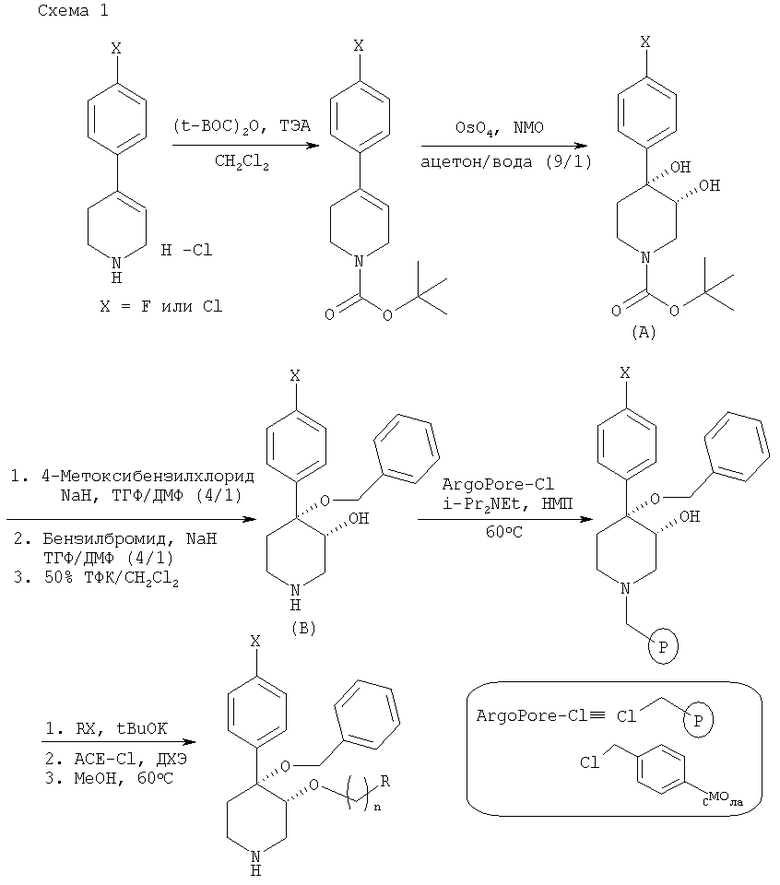
На схеме 2 представлена общая методика получения соединений формулы (II), которые содержат функционализированные группы R, полученные из промежуточного продукта А, представленного на схеме 1. Промежуточный продукт А можно превратить в 4-арил-3-бензилокси-3-гидроксипиперидин путем алкилирования по атому С3 с помощью NaH и бензилбромида с последующим удалением трет-бутоксикарбонильной защитной группы с помощью кислоты. Можно провести последующий синтез на твердой фазе и пиперидиновые соединения, предлагаемые в настоящем изобретении, получить по реакциям, описанным на схеме 1.
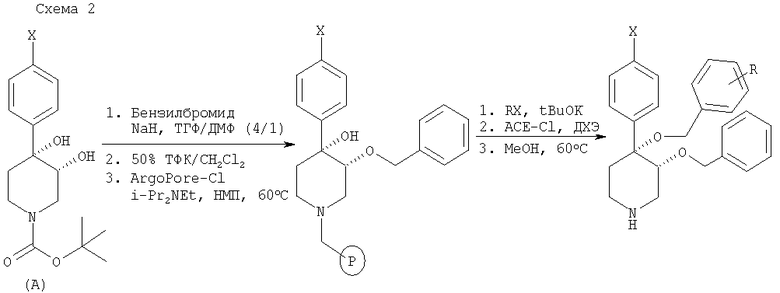
Как показано на схеме 3, удаление трет-бутоксикарбонильной защитной группы из промежуточного продукта А можно выполнить с помощью 50% ТФК/CH2Cl2. Синтез на твердой фазе начинается со связывания полученного 4-арил-3,4-дигидроксипиперидина со связывающим агентом ArgoPore-Cl. Диалкилирование с помощью t-BuOK и алкилгалогенидов (RX) с последующим отщеплением полимерной подложки при описанных условиях дает пиперидиновые соединения, предлагаемые в настоящем изобретении.
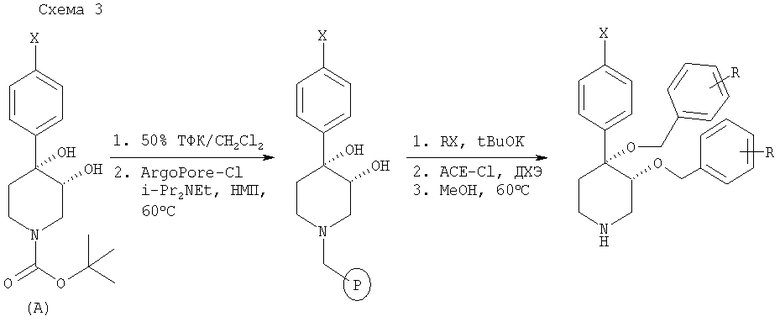
На схеме 4 представлена общая методика синтеза для получения соединений формулы (II) и (III) в жидкой фазе. Последовательное алкилирование промежуточного продукта А с помощью NaH и алкилгалогенидов с последующим удалением трет-бутоксикарбонильной защитной группы с помощью кислоты дает пиперидиновые соединения, предлагаемые в настоящем изобретении.
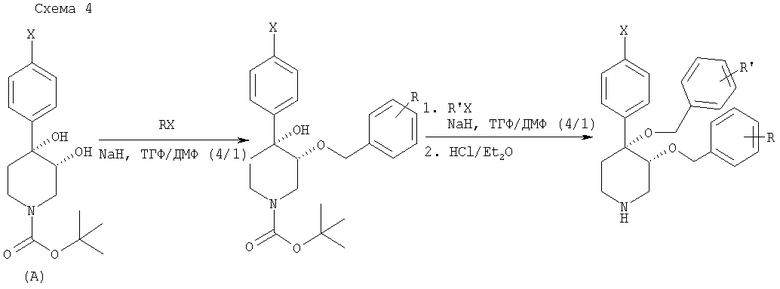
На схеме 5 представлена общая методика последующей модификации промежуточного продукта С. Вторичную аминогруппу промежуточного продукта С можно обработать различными реагентами, такими как ацилхлориды, алкилгалогениды и сульфонилхлориды, и получить соответствующий амид, третичный амин или сульфонамид. Промежуточный продукт С также можно аллилировать с использованием БЭМФ на полимерной подложке и аллилйодида с получением N-замещенного промежуточного продукта, который затем можно обработать с помощью OsO4/HMO и получить 3-пропан-1,2-диолзамещенные пиперидины, предлагаемые в настоящем изобретении.
Соединения, предлагаемые в настоящем изобретении, можно получить в соответствии с приведенными ниже примерами. Примеры приведены как иллюстративные, а не ограничивающие получение соединений и композиций, предлагаемых в настоящем изобретении.
Примеры
Ингибирующая активность (IC50) соединений, полученных в приведенных ниже примерах и описываемых формулой (II) или (III), находится в диапазоне 3-100 мкМ.
Пример 1
Трет-бутиловый эфир цис-[рац]-4-(4-хлорфенил)-3,4-дигидроксипиперидин-1-карбоновой кислоты
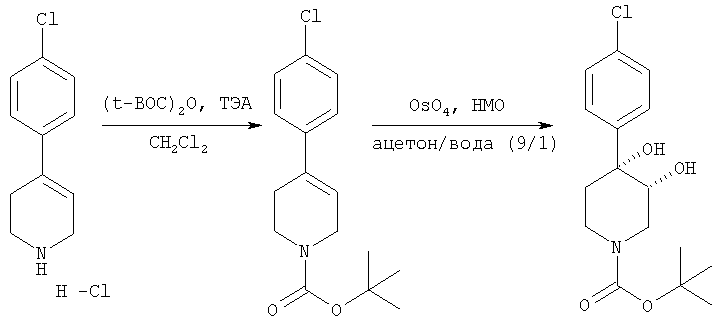
4-(4-Хлорфенил)-1,2,3,6-тетрагидропиридингидрохлорид (Lancaster, 1,00 г, 4,35 ммоль), триэтиламин (0,92 г, 9,13 ммоль) и ди-трет-бутилкарбонат (Aldrich, 1,04 г, 4,78 ммоль) смешивали в дихлорметане (100 мл) и перемешивали при комнатной температуре в течение 14 ч. Смесь промывали насыщенным водным раствором хлорида аммония (30 мл), водой (30 мл), насыщенным раствором хлорида натрия (30 мл) и сушили над безводным сульфатом магния. Смесь фильтровали и концентрировали в вакууме и получали трет-бутиловый эфир 4-(4-хлорфенил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты (1,41 г, 100%) в виде вязкого желтого масла, которое использовали без дополнительной очистки. Трет-бутиловый эфир 4-(4-хлорфенил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты (334 мг, 1,14 ммоль) растворяли в смеси ацетон/вода (1:1, 10 мл) и прибавляли N-метилморфолин-N-оксид (Aldrich, 462 мг, 3,42 ммоль) и каталитическое количество тетраоксида осмия (Aldrich). Смесь перемешивали при комнатной температуре в течение 3 ч. Прибавляли насыщенный водный раствор сульфита натрия (2 мл) и смесь перемешивали в течение 30 мин при комнатной температуре. Смесь разбавляли этилацетатом (10 мл) и водой (5 мл). Органический слой отделяли и водный слой экстрагировали этилацетатом (2×10 мл). Объединенные органические слои промывали рассолом и сушили над безводным сульфатом магния. Смесь фильтровали и концентрировали в вакууме и получали трет-бутиловый эфир цис-[рац]-4-(4-хлорфенил)-3,4-дигидроксипиперидин-1-карбоновой кислоты (364 мг, 1,11 ммоль, 97%) в виде желтого масла.
Пример 2
Трет-бутиловый эфир цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-гидроксипиперидин-1-карбоновой кислоты
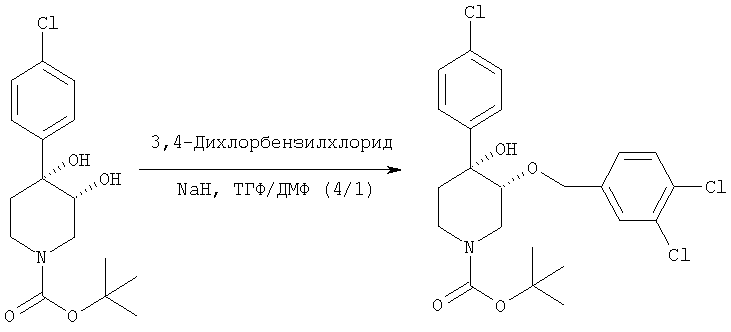
К охлаждаемой льдом суспензии гидрида натрия (62 мг, 2,6 ммоль) в смеси тетрагидрофуран/N,N-диметилформамид (4/1,4 мл) по каплям прибавляли раствор трет-бутилового эфира цис-[рац]-4-(4-хлорфенил)-3,4-дигидроксипиперидин-1-карбоновой кислоты (пример 1, 340 мг, 1,04 ммоль) в смеси тетрагидрофуран/N,N-диметилформамид (1 мл, 4/1). После завершения прибавления смесь при охлаждении льдом перемешивали в течение 15 мин. Затем прибавляли 3,4-дихлорбензилхлорид (Aldrich, 239 мг, 1,14 ммоль) и смесь нагревали до комнатной температуры и перемешивали в течение 20 ч. Смесь выливали в насыщенный водный раствор хлорида аммония (30 мл) и смесь экстрагировали этилацетатом (3×15 мл). Объединенные органические слои промывали водой (2×20 мл), насыщенным водным раствором хлорида натрия (1×20 мл) и сушили над безводным сульфатом магния. Смесь фильтровали и концентрировали в вакууме и получали вязкое масло (500 мг), которое очищали с помощью флэш-хроматографии на силикагеле (Merck силикагель 60, 230-400 меш) и получали трет-бутиловый эфир цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-гидроксипиперидин-1-карбоновой кислоты (310 мг, 61%) в виде бесцветного масла.
Пример 3
Трет-бутиловый эфир цис-[рац]-4-(бензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-карбоновой кислоты
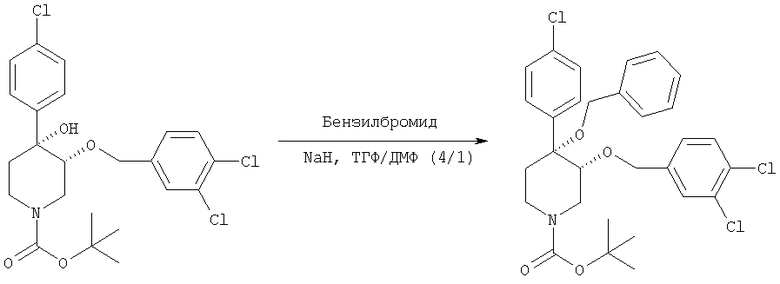
К охлаждаемому льдом раствору трет-бутилового эфира цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-гидроксипиперидин-1-карбоновой кислоты (пример 2, 224 мг, 0,46 ммоль) в тетрагидрофуране (1,5 мл) порциями прибавляли гидрид натрия (22 мг, 0,92 ммоль). После перемешивания при охлаждении льдом в течение 10 мин прибавляли бензилбромид (86 мг, 0,51 ммоль), а затем N,N-диметилформамид (0,5 мл). Охлаждающую баню удаляли и смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Прибавляли несколько капель метанола и смесь перемешивали при комнатной температуре в течение 1 ч. Смесь подвергали распределению между этилацетатом (30 мл) и насыщенным водным раствором хлорида аммония (15 мл). Органический слой отделяли и водный слой экстрагировали этилацетатом (3×15 мл). Объединенные органические слои промывали водой (3×30 мл), насыщенным водным раствором хлорида натрия (15 мл) и сушили над безводным сульфатом магния. Смесь фильтровали и концентрировали в вакууме и получали трет-бутиловый эфир цис-[рац]-4-(бензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-карбоновой кислоты (240 мг), который использовали без дополнительной очистки.
Пример 4
цис-[рац]-4-(Бензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидингидрохлорид
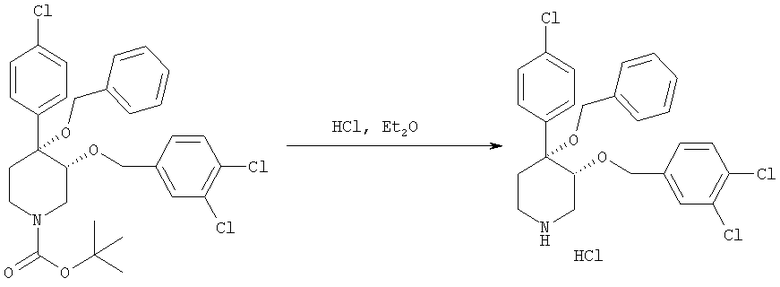
Неочищенный трет-бутиловый эфир цис-[рац]-4-(бензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-карбоновой кислоты (пример 3, 240 мг) растворяли в безводном диэтиловом эфире (10 мл). Смесь охлаждали на бане со льдом и через раствор в течение 10 мин пропускали газообразный хлорид водорода. Реакционный сосуд плотно закрывали и хранили при 0°С в течение 24 ч. Осалившееся твердое вещество собирали и промывали диэтиловым эфиром и получали цис-[рац]-4-(бензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидингидрохлорид в виде белого твердого вещества (130 мг, 55%).
HR-FAB m/e, рассчитано для C24H24NO2Cl: [М+Н]+ 476,0952, найдено 476,0931.
Пример 5
Трет-бутиловый эфир цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-метоксибензилокси)-пиперидин-1-карбоновой кислоты
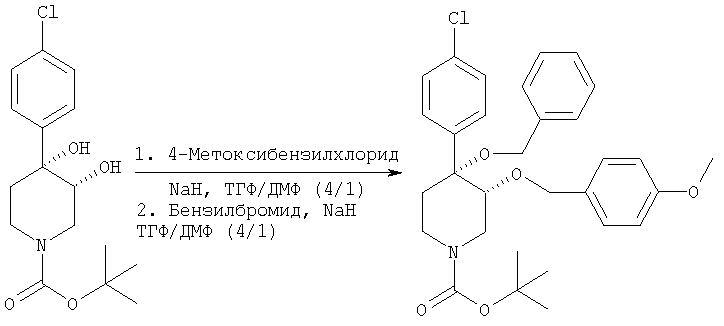
Трет-бутиловый эфир цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-метоксибензилокси)-пиперидин-1-карбоновой кислоты получали из трет-бутилового эфира цис-[рац]-4-(4-хлорфенил)-3,4-дигидроксипиперидин-1-карбоновой кислоты (пример 1) и 4-метоксибензилхлорида (Aldrich) по методикам, использованным в примерах 2 и 3, и использовали без очистки.
Пример 6
цис-[рац]-4,4-[Бензилокси-(4-хлорфенил)]-3-гидроксипиперидин
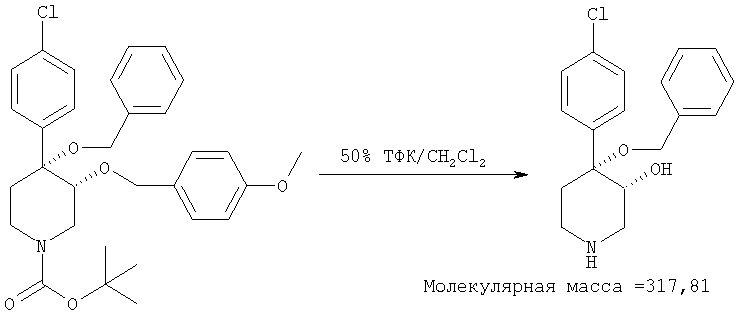
Трет-бутиловый эфир цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-метоксибензилокси)-пиперидин-1-карбоновой кислоты (пример 5, 550 мг, 1,02 ммоль) растворяли в смеси 50% трифторуксусная кислота/дихлорметан (10 мл). После перемешивания в течение 1,5 ч раствор выпаривали в вакууме. Остаток растирали в смеси 1:1 этилацетат/гексан и получали цис-[рац]-4,4-[бензилокси-(4-хлорфенил)]-3-гидроксипиперидин (150 мг) в виде белого порошка. Масс-спектр (ЭР = электрораспыление) [М+CH3CN]+=359.
Пример 7
Связанный со смолой цис-[рац]-4,4-[бензилокси-(4-хлорфенил)]-3-гидроксипиперидин
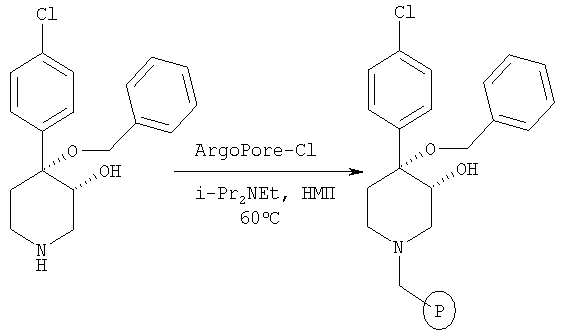
Смесь цис-[рац]-4,4-[бензилокси-(4-хлорфенил)]-3-гидроксипиперидина (пример 6, 7,3 г, 23 ммоль), смолу ArgoPore-Cl (16 г, 15,3 ммоль, загрузка: 0,96 ммоль, производства фирмы Argonaut Inc.) и N,N-диизопропилэтиламин (13 мл, 76,7 ммоль) в N-метилпирролидоне (12 мл) нагревали при 60°С в течение ночи. Смолу отфильтровывали и промывали последовательно с помощью CH2Cl2 и МеОН. Смолу сушили при 40°С/ в высоком вакууме в течение ночи и получали связанный со смолой 4,4-[бензилокси-(4-хлорфенил)]-3-гидроксипиперидин.
Пример 8
Библиотека цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-замещенных пиперидинов:
Общая методика
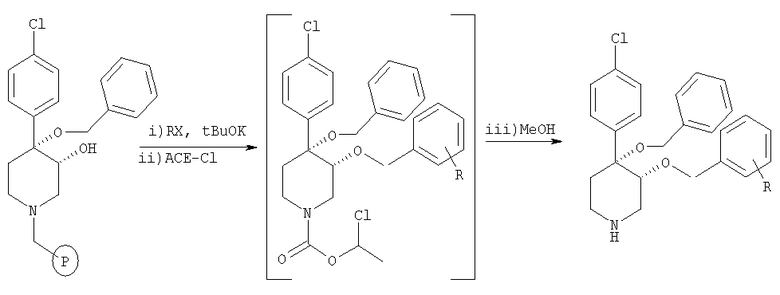
К суспензии связанного со смолой цис-[рац]-4,4-[бензилокси-(4-хлорфенил)]-3-гидроксипиперидина (пример 7, 200 мг, 0,192 ммоль, загрузка: 0,96 ммоль/г) и алкилгалогенида (RX, 0,58 ммоль) в растворе 4:1 ТГФ:ДМФ (2 мл) прибавляли трет-бутоксид калия (0,77 М в ТГФ; 1 мл, 0,77 ммоль). После перемешивания при комнатной температуре в течение ночи смолу отфильтровывали и промывали последовательно N,N-диметилформамидом, тетрагидрофураном, метанолом, дихлорметаном и диэтиловым эфиром. Смолу сушили при 40°С/ в высоком вакууме в течение ночи. 1-Хлорэтилхлорформиат (0,2 мл, 1,9 ммоль) прибавляли к смоле в 1,2-дихлорэтане (2 мл). После встряхивания в течение 4 ч при комнатной температуре смолу отфильтровывали и промывали 1,2-дихлорэтаном (3×2 мл). Фильтрат выпаривали в вакууме. К остатку прибавляли сухой метанол (2 мл) и раствор нагревали при 60°С в течение 3 ч. Раствор выпаривали в вакууме и получали искомый продукт.
Описанным выше способом получали следующие соединения.
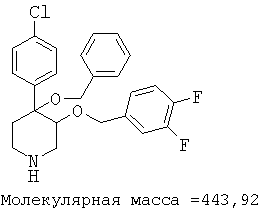
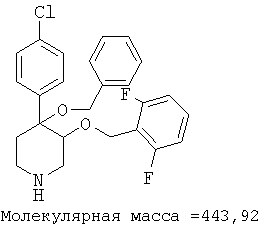
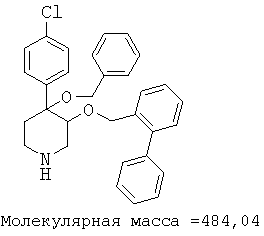
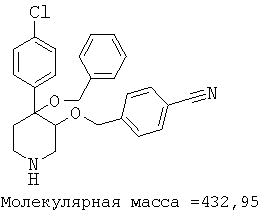
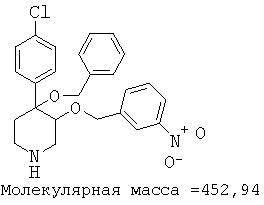
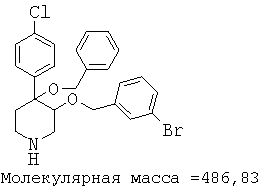
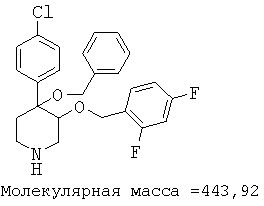
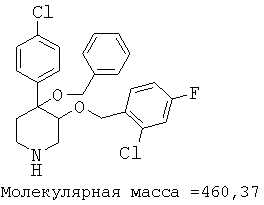
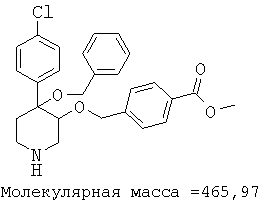
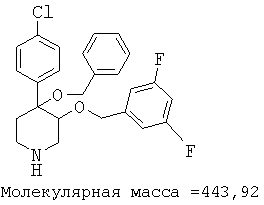
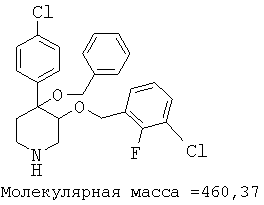
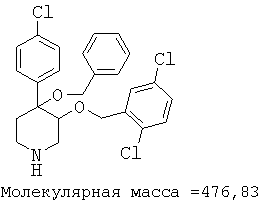
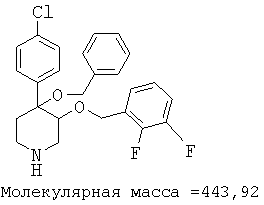
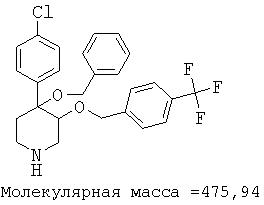
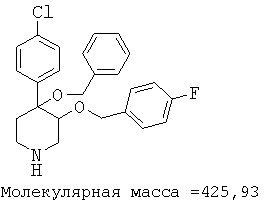
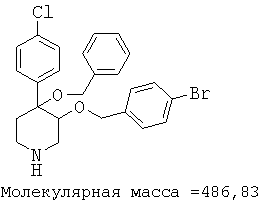
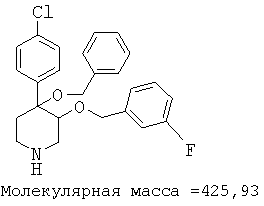
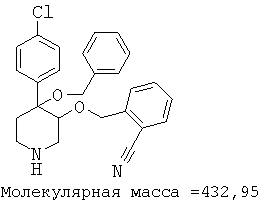
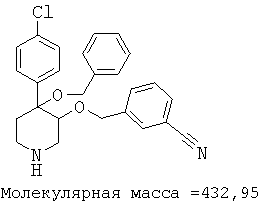
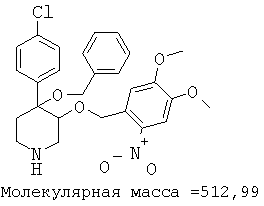
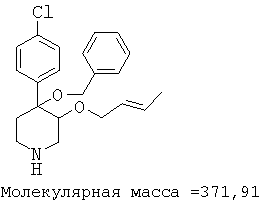
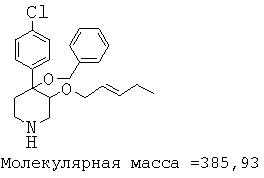
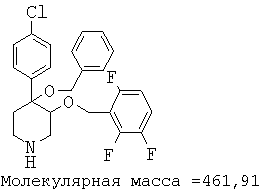
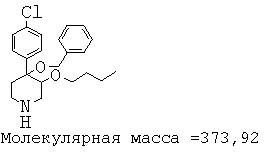
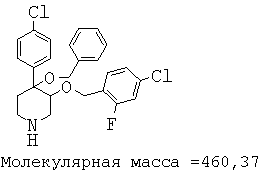
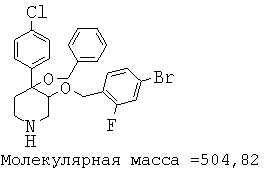
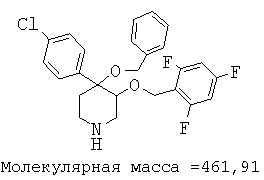
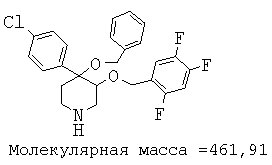
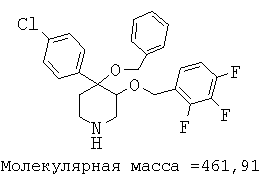
При анализе, описанном в примере 28, соединение, полученное в примере 8О, обладало значением IC50, равным 19,8 мкМ.
Пример 9
цис-[рац]-3-Бензилокси-4,4-[(4-хлорфенил)-гидрокси]пиперидин
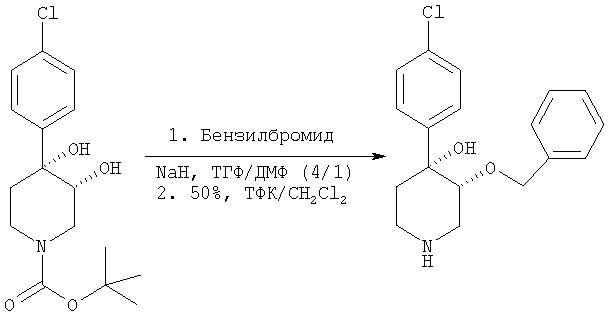
цис-[рац]-3-Бензилокси-4,4-[(4-хлорфенил)-гидрокси]пиперидин получали из трет-бутилового эфира цис-[рац]-4-(4-хлорфенил)-3,4-дигидроксипиперидин-1-карбоновой кислоты (пример 1) и бензилбромида (Aldrich) по методике, использованной в примерах 2 и 6.
Пример 10
Связанный со смолой цис-[рац]-3-бензилокси-4,4-[(4-хлорфенил)-гидрокси]пиперидин
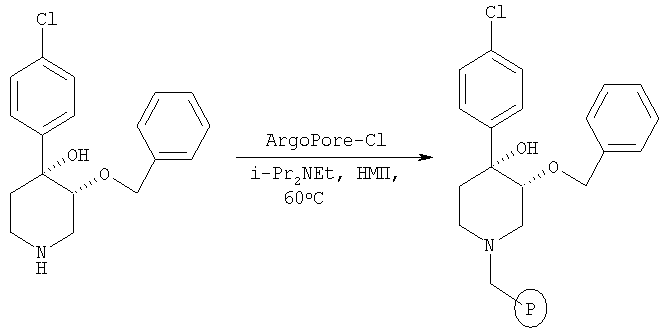
Это связанное со смолой соединение получали из цис-[рац]-3-бензилокси-4,4-[(4-хлорфенил)-гидрокси]пиперидина (пример 9) по методике, использованной в примере 7.
Пример 11
Библиотека цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-замещенных пиперидинов:
Общая методика
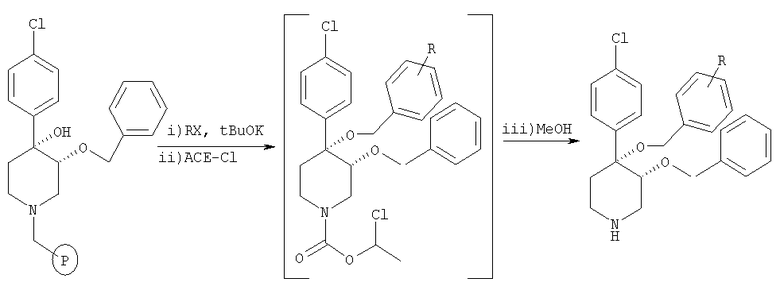
цис-[рац]-3-Бензилокси-4-(4-хлорфенил)-4-замещенный пиперидин получали из связанного со смолой цис-[рац]-3-бензилокси-4,4-[(4-хлорфенил)-гидрокси]пиперидина (пример 10) и алкилбромида по методике, использованной в примере 8.
Описанным выше способом получали следующие соединения.
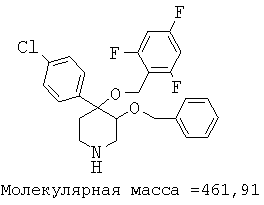
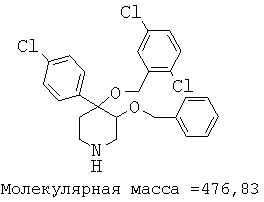
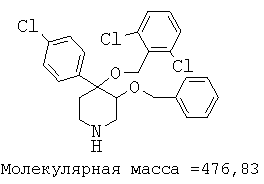
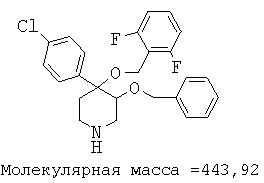
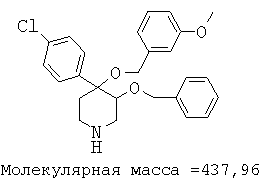
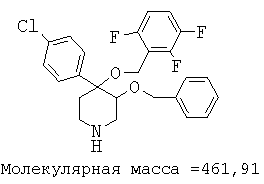
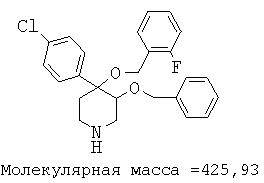
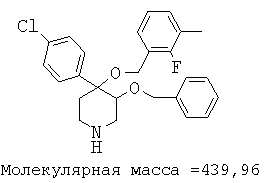
Пример 12
Связанный со смолой 3-(3,4-дихлорбензилокси)-4,4-[(4-хлорфенил)-гидрокси]пиперидин
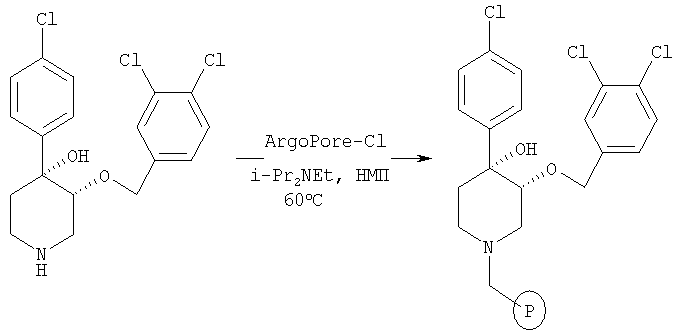
Это связанное со смолой соединение получали по методике, использованной в примерах 2, 6 и 7.
Пример 13
4-(4-Хлорфенил)-3-(3,4-дихлорбензилокси)-4-замещенный пиперидин:
Общая методика
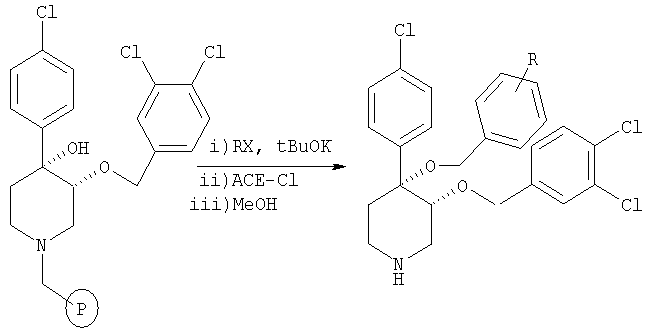
4-(4-Хлорфенил)-3-(3,4-дихлорбензилокси)-4-замещенный пиперидин получали из связанного со смолой 3-(3,4-дихлорбензилокси)-4,4-[(4-хлорфенил)-гидрокси]пиперидина (пример 12) и алкилбромида по методике, использованной в примере 8.
Описанным выше способом получали следующие соединения.
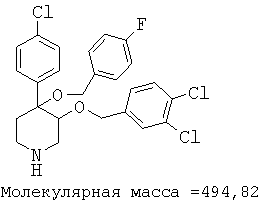
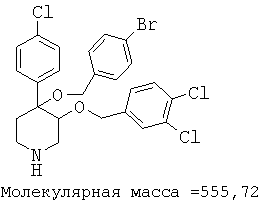
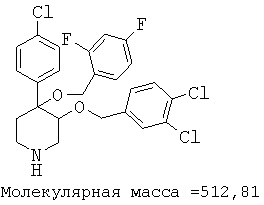
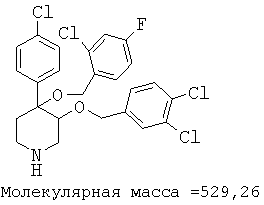
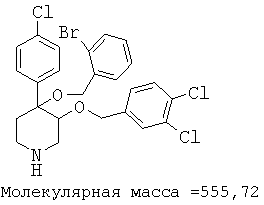
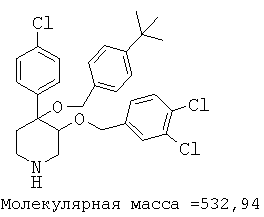
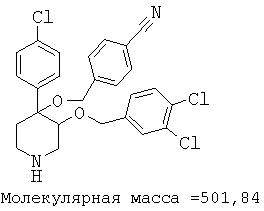
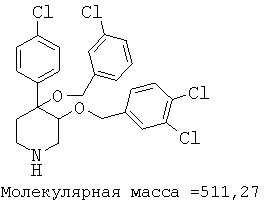

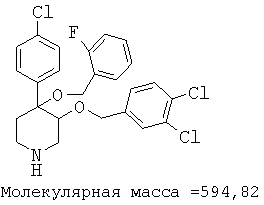
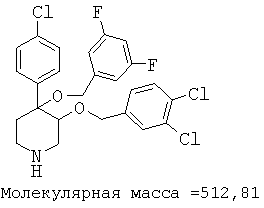
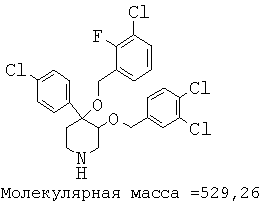
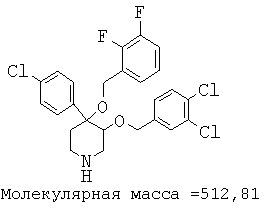
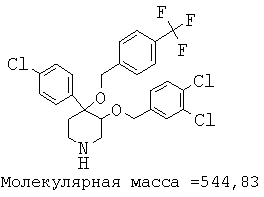
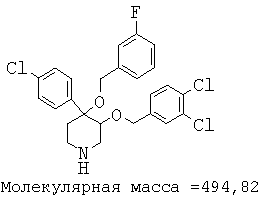
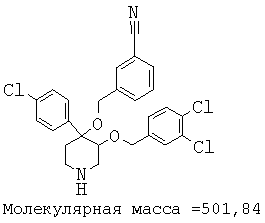
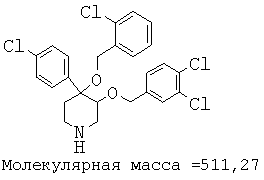
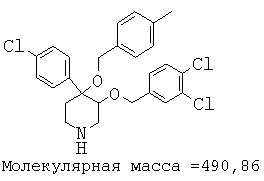
Пример 14
Связанный со смолой цис-[рац]-4-(4-хлорфенил)-пиперидин-3,4-диол
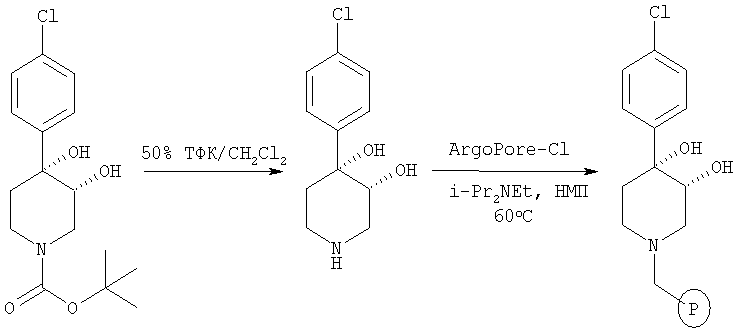
Это связанное со смолой соединение получали из трет-бутилового эфира цис-[рац]-4-(4-хлорфенил)-3,4-дигидроксипиперидин-1-карбоновой кислоты (пример 1) по методике, использованной в примере 6 и 7.
Пример 15
цис-[рац]-4-(4-Хлорфенил)-3,4-бис-(2,4-дифторбензилокси)-пиперидин
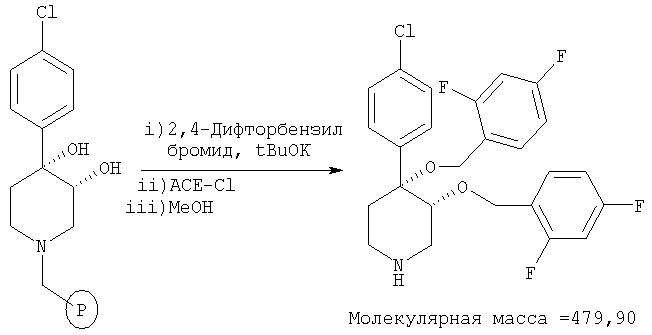
К Суспензии связанного со смолой 4-(4-хлорфенил)-пиперидин-3,4-диола (пример 14, 200 мг, 0,192 ммоль, загрузка: 0,96 ммоль/г) и 2,4-дифторбензилбромида (Lancaster, 1,54 ммоль) in 4:1 ТГФ:ДМФ раствор (2 мл) прибавляли трет-бутоксид калия (0,77 М в ТГФ; 1 мл, 0,77 ммоль). После перемешивания при комнатной температуре в течение ночи смолу отфильтровывали и промывали последовательно N,N-диметилформамидом, тетрагидрофураном, метанолом, дихлорметаном и диэтиловым эфиром. Смолу сушили при 40°С/ в высоком вакууме в течение ночи. 1-Хлорэтилхлорформиат (0,2 мл, 1,9 ммоль) прибавляли к смоле в 1,2-дихлорэтане (2 мл). После встряхивания в течение 4 ч при комнатной температуре смолу отфильтровывали и промывали 1,2-дихлорэтаном (3×2 мл). Фильтрат выпаривали в вакууме. К остатку прибавляли сухой метанол (2 мл) и раствор нагревали при 60°С в течение 3 ч. Раствор выпаривали в вакууме и получали искомый продукт. Масс-спектр (ЭР) М+=480.
Пример 16
цис-[рац]-4-(4-Хлорфенил)-3,4-бис-(3-нитробензилокси)-пиперидин
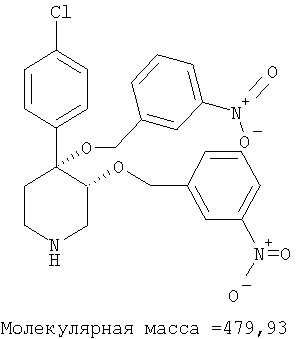
цис-[рац]-4-(4-Хлорфенил)-3,4-бис-(3-нитробензилокси)-пиперидин получали из связанного со смолой 4-(4-хлорфенил)-пиперидин-3,4-диола (пример 14) и 3-нитробензилбромида (Lancaster) по методике, использованной в примере 15. Масс-спектр (ЭР) М+=498.
Пример 17
Библиотека цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-замещенных-пиперидин-1-ил]-этанонов:
Общая методика
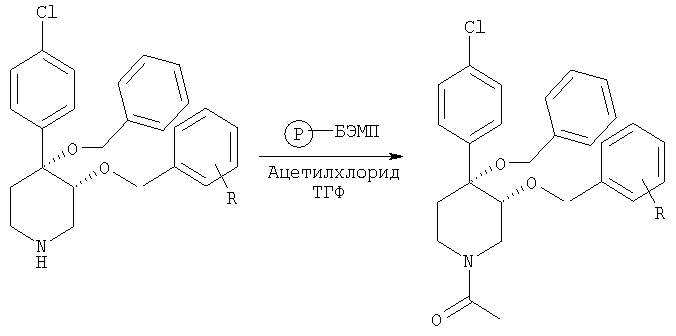
Смесь 4,4-[бензилокси-(4-хлорфенил)]-3-арилоксипиперидина (пример 8, 0,012 ммоль), БЭМФ на полимерной подложке (10 мг, 0,023 ммоль, загрузка: 2,3 ммоль/г, производства фирмы Fluka Inc.) и ацетилхлорид (0,01 мл, 0,14 ммоль) в тетрагидрофуране (1 мл) встряхивали при комнатной температуре в течение ночи. Смолу отфильтровывали и промывали последовательно с помощью CH2Cl2 и МеОН. Фильтрат выпаривали в вакууме и получали искомый продукт.
Описанным выше способом получали следующие соединения.
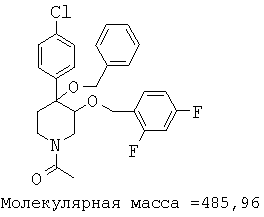
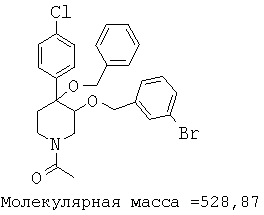
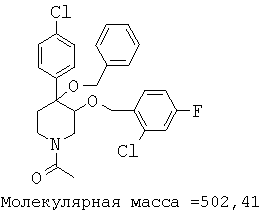
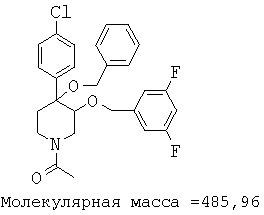
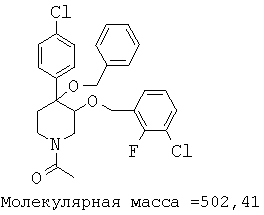
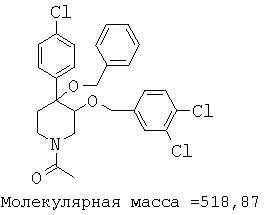
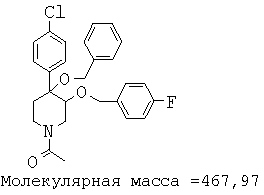
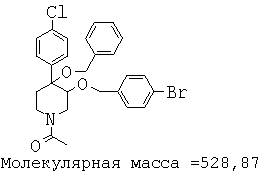
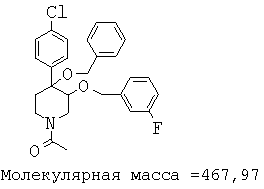
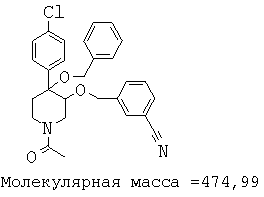
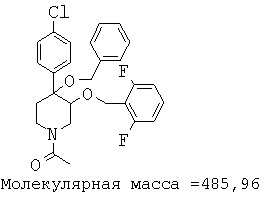
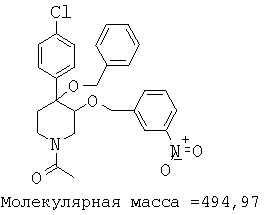
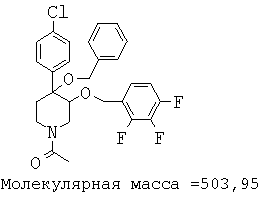
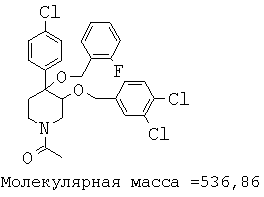
При анализе, описанном в примере 28, соединение, полученное в примере 17К, обладало значением IC50, равным 5,5 мкМ.
Пример 18
цис-[рац]-1-[4-Бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1-он
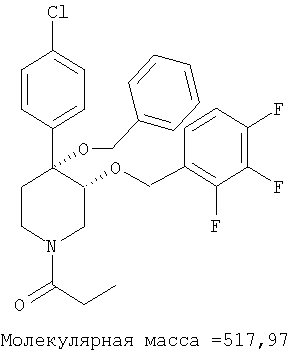
цис-[рац]-1-[4-Бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1-он получали из 4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидина (пример 8Ad) и пропионилхлорида (Aldrich) по методике, использованной в примере 17. Масс-спектр (ЭР) М+=518.
Пример 19
цис-[рац]-1-[4-Бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-ил]-пропан-1-он
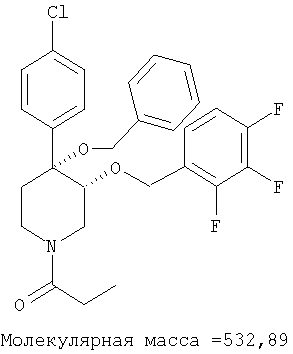
цис-[рац]-1-[4-Бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-ил]-пропан-1-он получали из цис-[рац]-4-(бензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидина (пример 4) по методике, использованной в примере 18. Масс-спектр (ЭР) М+=533.
Пример 20
Связанный со смолой цис-[рац]-4-бензилокси-4-(4-фторфенил)-пиперидин-3-ол
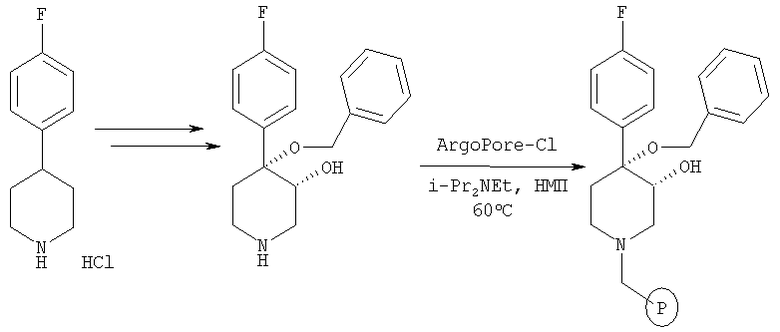
Это связанное со смолой соединение получали из 4-(4-фторфенил)-1,2,3,6-тетрагидропиридингидрохлорида (Acros) по методике, использованной в примерах 1, 5, 6 и 7.
Пример 21
цис-[рац]-4-Бензилокси-3-(4-бромбензилокси)-4-(4-фторфенил)-пиперидин
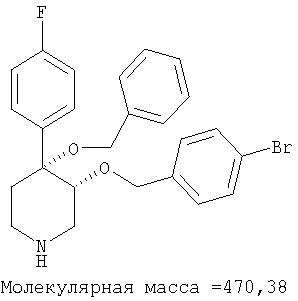
цис-[рац]-4-Бензилокси-3-(4-бромбензилокси)-4-(4-фторфенил)-пиперидин получали из связанного со смолой цис-[рац]-4-бензилокси-4-(4-фторфенил)-пиперидин-3-ола (пример 20) и 4-бромбензилбромида (Aldrich) по методике, использованной в примере 8. Масс-спектр (ЭР) МН+=471.
Пример 22
цис-[рац]-4-Бензилокси-4-(4-фторфенил)-3-пентилоксипиперидин
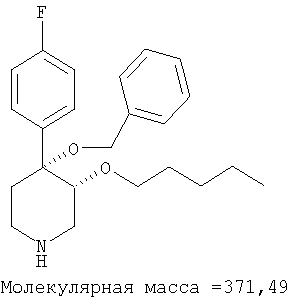
цис-[рац]-4-Бензилокси-4-(4-фторфенил)-3-пентилоксипиперидин получали из связанного со смолой цис-[рац]-4-бензилокси-4-(4-фторфенил)-пиперидин-3-ола (пример 20) и 1-йодпентана (Aldrich) по методике, использованной в примере 8. Масс-спектр (ЭР) МН+=372. IC50=56 мкМ (по данным анализа, описанного в примере 28).
Пример 23
цис-[рац]-4-Бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-этилпиперидин
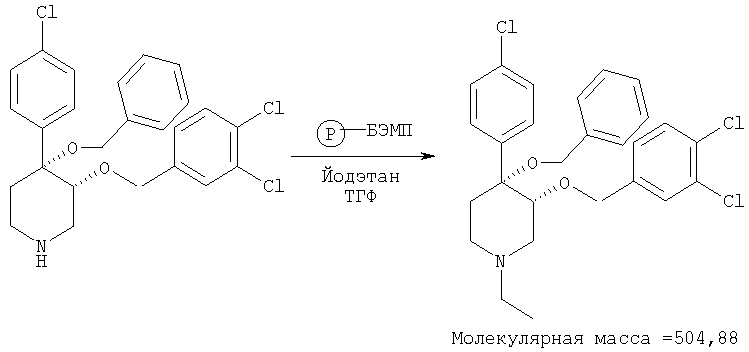
Смесь 4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидина (пример 4, 0,01 ммоль), БЭМФ на полимерной подложке (6,5 мг, 0,015 ммоль, загрузка: 2,3 ммоль/г, производства фирмы Fluka Inc.), йодэтана (Aldrich, 0,015 ммоль) в тетрагидрофуране (1 мл) встряхивали при комнатной температуре в течение ночи. Смолу отфильтровывали и промывали последовательно с помощью CH2Cl2 и МеОН. Фильтрат выпаривали в вакууме и получали искомый продукт. Масс-спектр (ЭР) МН+=506. IC50=4,9 мкМ (по данным анализа, описанного в примере 28).
Пример 24
цис-[рац]-4-Бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-пропилпиперидин
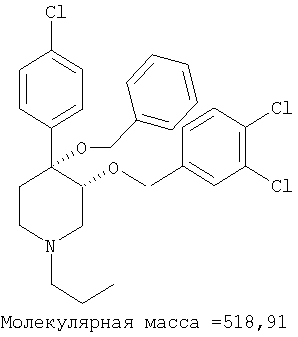
цис-[рац]-4-Бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-пропилпиперидин получали из 4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидина (пример 4) и 1-йодпропана (Aldrich) по методике, использованной в примере 23. Масс-спектр (ЭР) М+=519.
Пример 25
цис-[рац]-3-[4-Бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1,2-диол
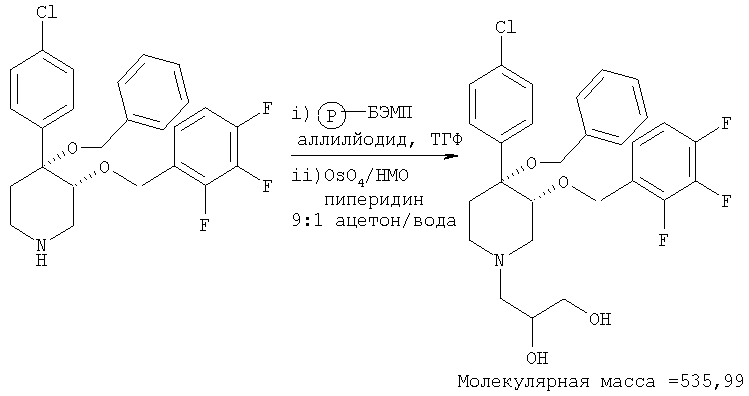
Смесь 4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидина (пример 8Ас, 6 мг, 0,013 ммоль), БЭМФ на полимерной подложке (10 мг, 0,023 ммоль, загрузка: 2,3 ммоль/г, производства фирмы Fluka Inc.), аллилйодида (Aldrich, 3 мкл, 0,003 ммоль) в тетрагидрофуране (1 мл) встряхивали при комнатной температуре в течение 2 ч. Смолу отфильтровывали и промывали последовательно с помощью CH2Cl2 и МеОН. Фильтрат выпаривали в вакууме. Без очистки остаток растворяли в растворе 9:1 ацетон/вода (1 мл). К раствору прибавляли тетраоксид осмия (Aldrich, 10 мкл, 0,008 ммоль) и 4-метилмофролин-N-оксид (Aldrich, 12 мг, 0,1 ммоль). Смесь перемешивали в течение ночи и прибавляли Na2SO3. После перемешивания в течение 2 ч смесь фильтровали через слой силикагеля. Фильтрат выпаривали в вакууме и получали искомый продукт. Масс-спектр (ЭР) М+=536.
Пример 26
цис-[рац]-3-[4-Бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-пропан-1,2-диол
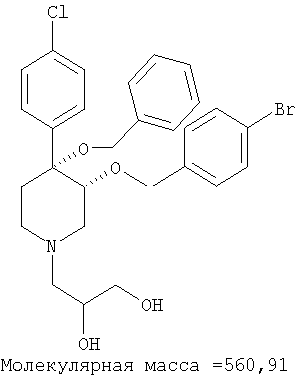
Это соединение получали из 4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидина (пример 8Р) по методике, использованной в примере 25. Масс-спектр (ЭР) МН+=562. IC50=25,8 мкМ (по данным анализа, описанного в примере 28).
Пример 27
цис-[рац]-3-[4-Бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-метансульфонил
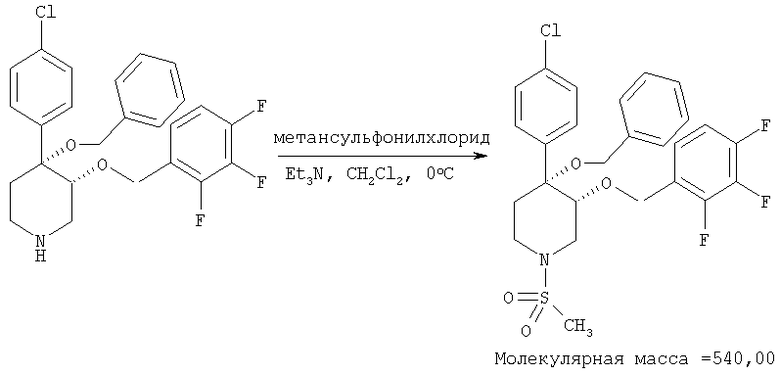
К раствору 4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидина (пример 8Ас, 4 мг, 0,008 ммоль) и триэтиламина (6 мкл, 0,08 ммоль) в дихлорметане (0,5 мл) при 0°С по каплям прибавляли метансульфонилхлорид (Aldrich, 2,5 мкл, 0,015 ммоль). После перемешивания в течение 2 ч смесь фильтровали через слой аминосиликагеля (Silicycle). Фильтрат выпаривали в вакууме и получали искомый продукт. Масс-спектр (ЭР) МН+=541.
Пример 28
Исследование активности in vitro
Способность замещенных пиперидиновых соединений, предлагаемых в настоящем изобретении, ингибировать взаимодействие между белками р53 и MDM2 была исследована с помощью ELISA (твердофазный иммуноферментный анализ), при котором рекомбинантный MDM2 с присоединенной GST (глутатион-S-трансфераза) связывается с пептидом, который сходен с взаимодействующей с MDM2 областью в р53 (Bottger et al., J. Mol. Bio. 1997, Vol.269, pgs.744-756). Этот пептид иммобилизуют на поверхности 96-луночного планшета с помощью N-концевого биотина, который связывается с покрытыми стрептавидином лунками. MDM2 прибавляют в каждую лунку в присутствии мышиных моноклональных антител против MDM2 (SMP-14, Santa Cruz Biotech). После удаления несвязанного белка MDM2 связанные с пероксидазой вторичные антитела (антитело к IgG мыши, Roche Molecular Biochemicals) и количество связанного с пептидом MDM2 определяют колориметрическим методом путем прибавления пероксидазного субстрата (МТВ Microwell Peroxydase Substrate System, Kirkegaard & Perry Labs).
Планшеты для исследования готовили путем покрытия стрептавидином (5 мг/мл в ЗФР (забуференный фосфатом физиологический раствор)) в течение 2 ч, затем промывали с помощью ЗФР и в течение ночи блокировали с помощью 150 мкл блокирующего буфера, содержащего 2 мг/мл бычьего сывороточного альбумина (Sigma) и 0,05% Tween 20 (Sigma) в ЗФР при 4°С. Биотинилированный пептид (1 мкМ) прибавляли в каждую лунку в 50 мкл блокирующего буфера и после инкубации в течение 1 ч тщательно промывали. Исследуемые соединения разводили в отдельном 96-луночном планшете и трижды проводили их прибавление в планшеты для инкубации соединений, содержащие смесь белка MDM2 с антителами против MDM2. После инкубации в течение 20 мин содержимое планшета переносили в планшет для исследований и инкубировали в течение еще 1 ч. Вторичные антитела к IgG мыши прибавляли в планшет для исследований до и после трехкратной промывки с помощью 0,05% Tween 20 в ЗФР. В заключение в каждую лунку прибавляли пероксидазный субстрат и с помощью устройства для считывания планшетов (MR7000, Dynatech) измеряли поглощение при 450 нм. Ингибирующую активность исследуемых соединений измеряли с помощью выраженного процентах отношения количеств связанного MDM2 в обработанных и необработанных лунках и рассчитывали IC50.
Ингибирующая активность (IC50) соединений, полученных в приведенных выше примерах и описываемых формулой (I) или (II), находится в диапазоне 3-100 мкМ.
Хотя представлен целый ряд вариантов выполнения настоящего изобретения, очевидно, что основные положения можно изменить и без отклонения от сущности и объема настоящего изобретения получить другие варианты выполнения настоящего изобретения. Подразумевается, что все такие модификации и изменения, а не только конкретные варианты выполнения, которые приведены выше в качестве примеров, включены в объем настоящего изобретения в соответствии с определениями в прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ЦИС-ИМИДАЗОЛИНЫ | 2005 |
|
RU2408593C2 |
| ПРОИЗВОДНЫЕ 3-АМИНОПИРРОЛИДОНА | 2004 |
|
RU2395495C2 |
| ПРОИЗВОДНЫЕ 2,4,5-ТРИФЕНИЛИМИДАЗОЛИНА КАК ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ МЕЖДУ БЕЛКАМИ P53 И MDM2, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ СРЕДСТВ | 2006 |
|
RU2442779C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДОНА В КАЧЕСТВЕ ИНГИБИТОРОВ МАОВ | 2003 |
|
RU2336267C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНАМИДОВ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2003 |
|
RU2309950C2 |
| ФТАЛИМИДОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАМИНООКСИДАЗЫ В | 2003 |
|
RU2317289C2 |
| КОНДЕНСИРОВАННЫЕ БИЦИКЛИЧЕСКИЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СХСR2 ДЛЯ ЛЕЧЕНИЯ ВОСПАЛЕНИЙ | 2005 |
|
RU2404962C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АПОПТОЗА НЕЙРОНОВ ИЛИ НЕЙРОДЕГЕНЕРАЦИИ | 2011 |
|
RU2722018C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ С-ЦИКЛОГЕКСИЛМЕТИЛАМИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ПРИМЕНЕНИЕ | 2001 |
|
RU2295515C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-b]ПИРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2397170C2 |
Изобретение относится к новым соединениям формулы (I):
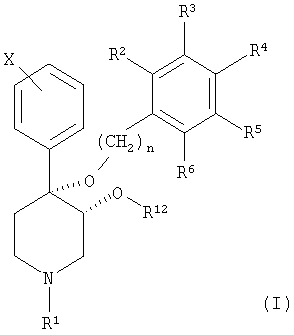
и к их фармацевтически приемлемым солям; в которой n является целым числом, независимо равным 1 или 2; Х обозначает галоген; R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный гидроксигруппой; R12 выбран из группы, включающей алкил и алкенил, содержащий от 1 до примерно 5 атомов углерода, и
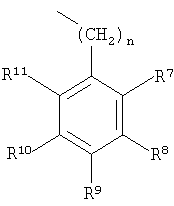
в котором R7-R11 независимо выбраны из группы, включающей водород, галоген, -CN, -NO2, CF3, -ОСН3, -СООСН3 и -С6Н5; R2-R6 независимо выбраны из группы, включающей водород, галоген, низш. алкил, -С(СН3)3, CF3, -ОСН3, -NO2 и -CN; и в случае, если R12 обозначает алкил или алкенил, содержащий от 1 до примерно 5 атомов углерода, то R2-R6 обозначают водород.
Изобретение также относится к фармацевтической композиции. Технический результат - получение новых биологически активных соединений и фармацевтической композиции на их основе, обладающей ингибирующим действием в отношении MDM2-p53. 2 н. и 27 з.п. ф-лы.
и их фармацевтически приемлемые соли; в которой
n является целым числом, независимо равным 1 или 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный гидроксигруппой;
R12 выбран из группы, включающей алкил и алкенил, содержащий от 1 до примерно 5 атомов углерода, и
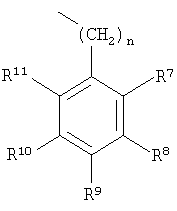
в котором R7-R11 независимо выбраны из группы, включающей водород, галоген, -CN, =NO2, CF3, -OCH3, -COOCH3 и -С6Н5;
R2-R6 независимо выбраны из группы, включающей водород, галоген, низш. алкил, -С(CH3)3, CF3, -OCH3, -NO2 и -CN;
и в случае, если R12 обозначает алкил или алкенил, содержащий от 1 до примерно 5 атомов углерода, то R2-R6 обозначают водород.
и их фармацевтически приемлемые соли; в которой
n является целым числом, независимо равным 1 или 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный гидроксигруппой;
R2-R6 независимо выбраны из группы, включающей водород, галоген, низш. алкил, -С(CH3)3, CF3, -OCH3, -NO2 и -CN; и
R7-R11 независимо выбраны из группы, включающей водород, галоген, -CN, -NO2, CF3, -OCH3, -COOCH3 и -С6Н5.
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,6-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(бифенил-2-илметокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3-нитробензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(3-бромбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(2-хлор-4-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
метиловый эфир цис-[рац]-4-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]бензойной кислоты;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,5-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(3-хлор-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,5-дихлорбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,3-дифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-трифторметилбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4-фторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3-фторбензилокси)-пиперидин;
цис-[рац]-2-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-3-[4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(4,5-диметокси-2-нитробензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-бут-2-енилокси-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-пент-2-енилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,3,6-трифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-3-бутокси-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-3-(4-хлор-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-3-(4-бром-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,4,6-трифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,4,5-трифторбензилокси)-пиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,4,6-трифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,5-дихлорбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,6-дихлорбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,6-дифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(3-метоксибензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2,3,6-трифторбензилокси)-пиперидин;
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2-фторбензилокси)-пиперидин; и
цис-[рац]-3-бензилокси-4-(4-хлорфенил)-4-(2-фтор-3-метилбензилокси)-пиперидин.
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(4-фторбензилокси)-пиперидин;
цис-[рац]-4-(4-бромбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2,4-дифторбензилокси)-пиперидин;
цис-[рац]-4-(2-хлор-4-фторбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(2-бромбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-трет-бутилбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-[4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-4-илоксиметил]-бензонитрил;
цис-[рац]-4-(3-хлорбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(3-бромбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2-фторбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(3,5-дифторбензилокси)-пиперидин;
цис-[рац]-4-(3-хлор-2-фторбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2,3-дифторбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(4-трифторметилбензилокси)-пиперидин;
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(3-фторбензилокси)-пиперидин;
цис-[рац]-3-[4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-4-илоксиметил]-бензонитрил;
цис-[рац]-4-(2-хлорбензилокси)-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин; и
цис-[рац]-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(4-метилбензилокси)-пиперидин.
цис-[рац]-4-(4-хлорфенил)-3,4-бис-(2,4-дифторбензилокси)-пиперидин; и
цис-[рац]-4-(4-хлорфенил)-3,4-бис-(3-нитробензилокси)-пиперидин.
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,4-дифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(3-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(2-хлор-4-фторбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3,5-дифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(3-хлор-2-фторбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(4-фторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3-фторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-3-[1-ацетил-4-бензилокси-4-(4-хлорфенил)-пиперидин-3-илоксиметил]-бензонитрил.
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,6-дифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3-нитробензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-4-(2-фторбензилокси)-пиперидин-1-ил]-этанон;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1-он;
цис-[рац]-1-[4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-пиперидин-1-ил]-пропан-1-он; и
цис-[рац]-4-бензилокси-3-(4-бромбензилокси)-4-(4-фторфенил)-пиперидин.
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-этилпиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(3,4-дихлорбензилокси)-1-пропилпиперидин;
цис-[рац]-3-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-пропан-1,2-диол;
цис-[рац]-3-[4-бензилокси-3-(4-бромбензилокси)-4-(4-хлорфенил)-пиперидин-1-ил]-пропан-1,2-диол; и
цис-[рац]-3-[4-бензилокси-4-(4-хлорфенил)-3-(2,3,4-трифторбензилокси)-пиперидин-1-ил]-сульфонилметан.
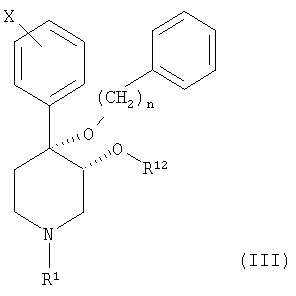
и их фармацевтически приемлемые соли; в которой
n является целым числом, равным от 1 до 2;
Х обозначает галоген;
R1 выбран из группы, включающей водород, карбонил, сульфонил, низш. алкил и низш. алкил, замещенный гидроксигруппой; и
R12 выбран из группы, включающей алкил и алкенил, содержащий от 1 до примерно 5 атомов углерода.
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-бутилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-пентилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-(бут-2-ен)илоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-фторфенил)-3-(пент-2-енил)оксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-бутилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-пентилоксипиперидин;
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(бут-2-ен)илоксипиперидин; и
цис-[рац]-4-бензилокси-4-(4-хлорфенил)-3-(пент-2-енил)оксипиперидин.
| WO 00/15657 A1, 23.03.2000 | |||
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1995 |
|
RU2145599C1 |
Авторы
Даты
2008-09-10—Публикация
2004-03-08—Подача