Область техники, к которой относится изобретение
Настоящее изобретение относится к препаративной форме для слизистой оболочки рта, содержащей в качестве активного компонента замещенное имидазольное производное формулы (I)
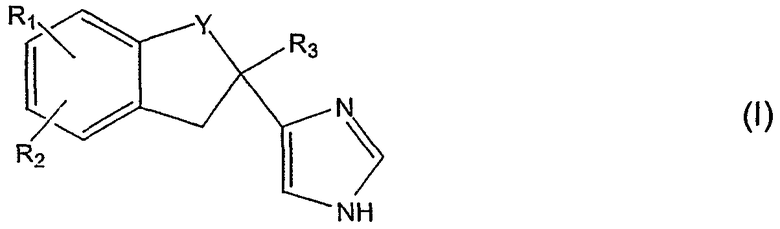
в котором Y является - -CH2- или -CO-, R1 - галоген или гидрокси, R2 - Н или галоген и R3 - Н или низший алкил, или его кислую аддитивную соль.
Данное изобретение также относится к способу получения вышеуказанной препаративной формы для слизистой оболочки рта.
Уровень техники изобретения
Соединения вышеуказанной формулы (I) являются высокоселективными и длительно действующими антагонистами α2-адреноцепторов. Соединения особенно эффективны в лечении когнитивных расстройств. Соединения формулы (I) и их получение были описаны в патентной публикации ЕР 0 618 906 В1. Примерами таких соединений являются 4-(2-этил-5-фториндан-2-ил)-1Н-имидазол, т.е. фипамезол, и 4-(5-фториндан-2-ил)-1Н-имидазол.
Несмотря на то что соединения формулы (I) и их соли сами по себе обладают хорошими свойствами, у них имеются недостатки при получении препаративных форм для обычного перорального применения, то есть нормального пути введения указанных соединений. Проблема заключается в том, что соединения довольно быстро распадаются в желудочно-кишечном тракте или в других системах организма до поступления в системный кровоток и достижения органов мишений, нуждающихся в терапии. Это, в свою очередь, значительно снижает эффект рассматриваемых соединений.
В соответствии с токсикологическими исследованиями, проведенными на собаках (см. Пример 8), предположили, что рассмотрение безопасности, касающейся сердечной деятельности, является важным, принимая во внимание, что пролонгация QT-интервала наблюдалась при высоких пероральных дозах фипамезола, когда системная концентрация фипамезола достигала примерно 2000 нг/мл.
Сущность изобретения
Одной целью настоящего изобретения является создание эффективной и безопасной препаративной формы для введения соединений формулы (I).
Другая цель настоящего изобретения состоит в обеспечении способа получения препаративной формы.
Таким образом, в соответствии с одним аспектом данного изобретения, касающегося препаративной формы для слизистой оболочки рта, содержащей в качестве активного компонента замещенное имидазольное производное формулы (I)

где Y - CH2- или -СО-, R1 - галоген или гидрокси, R2 - Н или галоген и R3 - Н или низший алкил, или его кислотно-аддитивную соль, вместе с добавками обычно используемыми в препаративных формах для слизистой оболочки рта.
В соответствии с другим аспектом данное изобретение относится к способу получения препаративной формы для слизистой оболочки рта.
Подробное описание изобретения
В настоящий момент неожиданно было обнаружено, что проблемы быстрого распада в желудочно-кишечном тракте и нарушение сердечной безопасности соединений формулы (I) могут быть уменьшены включением соединений формулы (I) в препаративные формы для слизистой оболочки рта. Эти препаративные формы эффективны и удобны в приготовлении, и поэтому они имеют преимущество при введении пациентам на практике.
Подходящими добавками, которые следует использовать в препаративных формах в соответствии с настоящим изобретением, являются адъюванты, наполнители и т.д., включающие растворители, консервирующие средства, ароматизирующие вещества, наполнители, желатинирующее средства и мукоадгезивные полимеры. Предпочтительными растворителями являются спирты, в особенности этанол, вода и их смеси. Предпочтительными консервирующими средствами являются низшие алкилпарагидроксибензоаты, в особенности метил- и пропилпарагидроксибензоат, и их смеси. Предпочтительными ароматизирующими средствами являются аспартам, искусственные ароматизаторы, такой как черная смородина 502.009, и их смеси.
В данном случае, препаративная форма для слизистой оболочки рта означает любой тип препаративной формы, вводимой через слизистую оболочку рта. Такие препаративные формы включают, например, спреи, гели, мукоадгезивные буккальные таблетки и пасты, подъязычные таблетки и тому подобное. Предпочтительна препаративная форма в виде спрея.
В данном случае, термин галоген относится к F, Cl, Br и I, предпочтительно к F и Cl, наиболее предпочтительно к F.
В данном случае, термин низший алкил относится к монорадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, содержащей от 1 до 6 углеродных атомов, предпочтительно от 1 до 4, наиболее предпочтительно от 1 до 2 атомов углерода.
В данном случае, термин аддитивная соль кислоты относится к соли присоединения любой фармацевтически приемлемой кислоты, предпочтительно хлористоводородной кислоты.
В данном случае, термин добавка,обычно используемая в препаративных формах для слизистой оболочки рта, относится к любой добавке, известной специалисту в данной области подходящей для препаративных форм для слизистой оболочки рта.
Наиболее предпочтительным активным компонентом является фипамезол (JP-1730, 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорид). Препаративная форма, содержащая указанный предпочтительный активный компонент, приготавливается в соответствии с изобретением путем смешения и растворения этанола (96%), очищенной воды, метилпарагидроксибензоата, пропилпарагидроксибензоата и аспартама при комнатной температуре, от 15 до 25°С. Затем добавляют и растворяют 4-(2-этил-5-фториндан-2-ил)-1Н-имидазол и искусственный ароматизатор, такой как черная смородина 502.009А, при комнатной температуре, от 15 до 25°С. Объем смеси доводят очищенной водой, фильтруют и получают препаративную форму в виде спрея.
Следующие примеры иллюстрируют изобретение, но не предназначены для ограничения объема изобретения.
Пример 1
Препаративная форма в виде спрея, содержащая 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорида (фипамезол)
Пример 2
Препаративная форма в виде спрея, содержащая 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорид (фипамезол)
Пример 3
Приготовление препаративной формы в виде спрея, содержащей 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорид (фипамезол)
416,0 мл этанола (96%) смешивали с 450,0 мл очищенной воды с образованием гомогенной смеси. В смесь добавляли 1,80 г метилпарагидроксибензоата, 0,20 г пропилпарагидроксибензоата и 0,5 г аспартама и растворяли при комнатной температуре, от 15 до 25°С. В смесь добавляли 15,0 г фипамезола, 0,4 г ароматизатора черная смородина и растворяли при комнатной температуре, от 15 до 25°С. Объем смеси доводили очищенной водой до 1000,0 мл. Раствор фильтровали и получали спрей нужного состава.
Пример 4
Приготовление препаративной формы в виде геля для слизистой оболочки рта, содержащей 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорид (фипамезол) 30 мг
Способ получения
Фипамезол (1) и этанол (96%) (2) смешивали и растворяли с образованием раствора А. Очищенную воду (6), полоксамер 407 (3), жидкий ароматизатор (4) и аспартам (5) смешивали и растворяли с образованием раствора В. Раствор А и раствор В охлаждали до примерно 5°С и смешивали вместе с образованием гомогенного раствора. Получали препаративную форму в виде геля для слизистой оболочки рта.
Пример 5
Получение препаративной формы в виде мукоадгезивной буккальной таблетки, содержащей 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорид (фипамезол) 30 мг
Способ получения
Фипамезол (1), карбомер 934Р (2), гидроксипропилметилцеллюлозу (3), ароматизатор (4), аспартам (5) и стеарат магния (6) смешивали с образованием гомогенной смеси. Смесь прессуют в таблетки подходящего размера. Получают мукоадгезивные буккальные таблетки.
Пример 6
Получение препаративной формы в виде подъязычной таблетки, содержащей 4-(2-этил-5-фториндан-2-ил)-1Н-имидазола гидрохлорид (фипамезол) 30 мг
Способ получения
Фипамезол (1), лактозы моногидрат (2), ароматизатор (5) и аспартам (6) смешивали с образованием гомогенной смеси. Смесь гранулировали с 10% водным раствором повидона (3). Гранулы формировали либо в мешалке с большими, либо с малыми сдвиговыми усилиями. Гранулированной смеси позволяли подсохнуть. Сухую гранулированную смесь пропускали через сито для получения свободно текущего гранулята. Конечная смесь прессовалась в таблетки подходящего размера. Получали подъязычные таблетки.
Пример 7
Введение фипамезола через слизистую оболочку рта
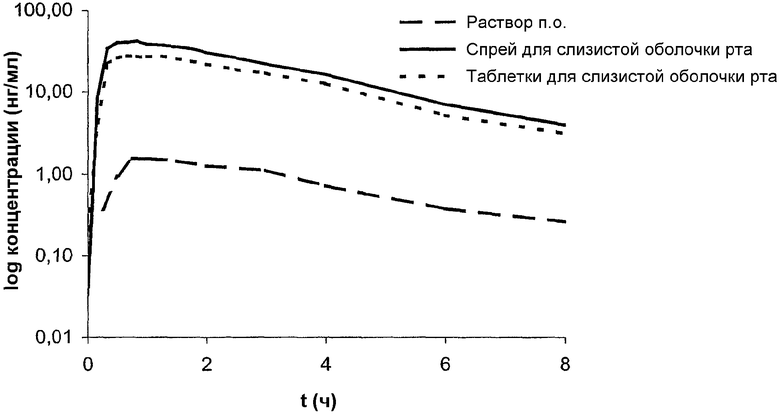
Уровень фипамезола в плазме изучали на здоровых мужчинах-добровольцах после перорального приема лекарственного средства в виде раствора. Образцы крови для оценки фармакокинетики собирали в течение 24 часов после приема лекарственного средства. Концентрацию фипамезола в плазме оценивали с помощью ВЭЖХ-МС/МС и рассчитывали фармакокинетические параметры. Фармакокинетику фипамезола вычисляли с помощью фармакокинетической программы TopFit 2.0. Величины Cmax и tmax рассчитывали по кривой зависимости концентрации от времени и период полувыведения, исходя из концевой части кривой зависимости логарифма концентрации от времени (см. чертеж). Величины AUC были рассчитаны как для бесконечности, так и вплоть до времени последнего сбора с концентрацией фипамезола, которая поддавалась количественному определению. Результаты представлены в таблице.
Средние (SD) фармакокинетические параметры фипамезола при уровне дозы 30 мг. tmax дано как среднее и разброс
График зависимости логарифма средней концентрации в плазме от времени после введения одной 30 мг дозы фипамезола, перорально, с помощью нанесения спрея для слизистой полости рта и таблетки показан на чертеже.
Пример 8
Безопасность для сердца
Безопасность для сердца изучалась на собаках в течение 30-дневных токсикологических исследований с использованием перорального введения и токсикологических исследований на собаках с использованием буккального введения.
В течение 30-дневных токсикологических исследований собакам перорально вводили фипамезол дозами 1, 5, 10 и 15 мг/кг/день в течение 30 дней, что приводило к максимальной системной концентрации фипамезола около 200, 1000, 2000 и 3300 нг/мл соответственно. Эти результаты in vivo на собаках дают возможность предположить, что удлинение QT-интервала наблюдалось, когда системная концентрация фипамезола достигала около 2000 нг/мл.
В других токсикологических исследованиях четырем самцам собаки вводился фипамезол в виде буккального спрея дозами 1, 5 и 10 мг/кг в последовательной схеме введения от 5 до 15 дней между дозами. Кровяное давление (систолическое, диастолическое и среднее), частота пульса и ЭКГ контролировались до и вплоть до 12 часов после введения. На 30 минуте после введения дозы 5 и 10 мг/кг наблюдалось значительное кратковременное увеличение абсолютной величины кровяного давления и частоты пульса. Никаких выраженных изменений ЭКГ (амплитуда зубца Р, продолжительность зубца Р, интервал PQ, интервал QRS или интервал QT [Q-Tcv, QTc]) не наблюдалось после введения фипамезола любой концентрации.
Еще одно токсикологическое исследование на собаках с использованием буккального введения доз с концентрацией 1, 5 и 10 мг/кг/день в течение 4 недель не показало выраженных изменений ЭКГ. Максимальная системная концентрация фипамезола после введения в первый день изучения составила около 800, 2000 и 3300 нг/мл.
Изобретение относится к области фармакологии и медицины и касается препаративной формы для слизистой оболочки рта, содержащей эффективное количество замещенного имидазольного производного формулы (1) вместе с добавками, обычно используемыми в препаративных формах для слизистой оболочки рта. Изобретение обеспечивает высокую безопасность введения. 2 н. и 20 з.п. ф-лы, 1 ил., 1 табл.
где Y - является -СН2- или -СО-, R1 - галоген или гидрокси, R2 - Н или галоген, и R3 - Н или низший алкил, или его аддитивную соль кислоты в эффективном количестве, вместе с добавками обычно используемыми в препаративных формах для слизистой оболочки рта.
| ЕР 618906, B1, 08.07.1993 | |||
| CLIN PHARMACOL THER, V58, 1995, h.506-511 | |||
| ПРОИЗВОДНЫЕ 5-(2-ИМИДАЗОЛИНИЛАМИНО)БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2143430C1 |
Авторы
Даты
2008-10-27—Публикация
2003-11-10—Подача