Изобретение относится к области гидрометаллургии цветных металлов и может быть использовано при переработке концентратов, промпродуктов и твердых отходов, содержащих цветные металлы.
Известны способы интенсификации процессов выщелачивания [Г.М.Вольдман, А.Н.Зеликман. Теория гидрометаллургических процессов. М.: Металлургия. 1993. С.139-157] увеличением удельной поверхности выщелачиваемого материала, повышением концентрации реагента, снижением концентрации продукта, уменьшением эффективной толщины диффузного слоя, уменьшением толщины твердой оболочки, увеличением константы скорости реакции в автоклавах за счет термического и механического активирования.
Недостатками способов является низкое извлечение и низкое качество полученных металлов.
Наиболее близким техническим решением является способ [RU 94015041 А1, МПК С22В 19/00, опубл. 10.02.1996], в котором извлечение ионов железа, цинка, меди и марганца из материала, их содержащего, включает его сернокислотное выщелачивание и совместное гидролитическое осаждение из раствора ионов извлекаемых металлов с добавлением окислителя.
Недостатком является то, что в рассматриваемых процессах не использованы способы интенсификации с применением комплексонов, способствующие повышению извлечения металлов при выщелачивании.
Задачей изобретения является создание эффективного способа селективного извлечения металлов из материалов сложного состава.
Технический результат, который может быть достигнут при осуществлении изобретения, заключается в интенсификации процесса выщелачивания и повышении чистоты полученных металлов при их селективном извлечении.
Этот технический результат достигается тем, что в известном способе извлечения ионов железа, цинка, меди и марганца из материала, их содержащего, включающем его сернокислотное выщелачивание и совместное гидролитическое осаждение из раствора ионов извлекаемых металлов с добавлением окислителя, причем при сернокислотном выщелачивании добавляют комплексоны, образующие в кислых средах с ионами извлекаемых металлов прочные, хорошо растворимые комплексы, и ведут выщелачивание при рН меньше 3, осадок после гидролитического осаждения подвергают соляно-кислотному растворению с последующим селективным извлечением ионов металлов из полученного раствора.
Сущность способа поясняется схемами 1-5 и данными, представленными на фиг.1-3.
При сернокислотном выщелачивании клинкера используются комплексоны - органические хелатообразующие соединения, сочетающие в молекуле основные и кислотные центры и образующие с катионами прочные растворимые в воде комплексы.
Комплексоны относятся к мультидендатным хелатообразующим реагентам, которые образуют с ионами металлов циклические структуры в результате присоединения катионов к двум или более донорным атомам, принадлежащим одной молекуле комплексообразующего агента.
Комплексоны имеют функционально-аналитические группировки, содержащие донорные атомы, приводящие к повышению устойчивости комплексов и проявлению селективности действия лиганда. В основном используются следующие группировки: -NH2, -SH, -ОН, -СООН, -PO3H2, -AsO3H2, -SO3H.
Другой особенностью комплексонов являетя то, что большинство из них относятся к классу поверхностно-активных веществ (ПАВ), которые снижают поверхностное натяжение раствора, что улучшает смачивание поверхностей материалов при выщелачивании, а также способствует проникновению раствора в мельчайшие поры и повышает извлечение металлов из твердых материалов в раствор.
После отделения осадка после выщелачивания с использованием комплексонов осуществляют окисление органики и других ионов металлов, содержащихся в растворе в восстановленной форме, например Fe(II)→Fe(III). В качестве окислителей можно использовать Н2O2, Cl2, (NHO4)S2O8, CaOCl2, NaOCl.
Для совместного гидролитического осаждения всех ионов при рН 5-6 в качестве нейтрализаторов можно использовать NaOH, Na2CO3, Са(ОН)2.
Особенностью процесса является то, что образующийся при окислении ион Fe(III) можно использовать как коагулянт, который способен при гидролитическом осаждении захватывать как неокислившуюся органику, так и ионы цветных металлов, гидроксиды которых осаждаются при рН>7. Таким образом снижается расход окислителя.
Осадок растворяли в соляной кислоте с переходом Zn, Cu и большей части Mn и Fe в раствор в виде низших хлоридов MeCl2. Например, MnO2 - по реакции: MnO2+4HCl=MnCl2+Cl2+2Н2O. При этом хлор-ион кислоты окисляется до Cl2 и выделяется из раствора.
В дальнейшем раствор перерабатывали по известным схемам селективного извлечения из него ионов металлов.
Пример практического применения.
Отвальным продуктом гидрометаллургической ветви производства цинка являются кеки, полученные на второй стадии выщелачивания. Основными цинксодержащими фазами являются труднорастворимые соединения (ферриты, алюмосиликаты, сульфиды). Типичный состав кеков, %: 23-27 Zn, 0,3-1,5 Cu, 0,2-0,3 Cd, 3-7 Pb, 11-20 Fe, 6-9 S. В них также содержатся As, Sb, благородные и редкие металлы, компоненты пустой породы. В существующей практике эти кеки подвергают громоздкой, энергоемкой операции - вельцеванию, доизвлекая 12-15% Zn (а также Cd, Pb и другие летучие элементы) в форме возгонов и получая остаток - клинкер, дальнейшая переработка которого также остается проблематичной.
Переработке подвергали клинкер ОАО «Электроцинк», г.Владикавказа, РСО-Алания.
Клинкер промывали водой для удаления тонкодисперсной фракции угля, так как уголь при дальнейшей переработке клинкера увеличивает расход комплексона, который, обладая свойствами ПАВ, согласно правилу уравнивания полярностей Ребиндера, располагается на границе раздела уголь-раствор (фиг.2).
После отсадки угля и удаления магнитной фракции клинкер содержал, %: 11,6 Fe; 1,0 Zn; 1,5 Cu; 4,0 С.
Клинкер подвергали сернокислотному выщелачиванию с применением в качестве комплексонов солей сульфокислот или сульфоновых кислот.
Сульфокислоты или сульфоновые кислоты общей формулы R-SO2OH являются органическими соединениями, содержащими функциональную группу -SO2OH (или сокращенно SO3H), связанную через серу с углеводородным радикалом. Сульфокислоты являются сильными кислотами (подобно серной кислоте), их соли называются сульфонатами. Функциональные группы увеличивают прочность комплексов с тяжелыми металлами. Донорным атомом является кислород. Кислород гидроксил-иона обладает достаточно высоким отрицательным зарядом. Это свойство обеспечивает гидроксилу высокую способность к координации с катионами. Диссоциации протона способствует повышенное значение рН раствора.
Органические сульфонаты относятся к поверхностно-активным веществам (ПАВ) и обладают всеми их свойствами:
- Учитывая высокую концентрацию ПАВ, вероятно, исходный раствор можно рассматривать как коллоидный, содержащий золи ПАВ.
- Растворы характеризуются сильным пенообразованием, устойчивость пены снижается при подкислении и увеличении концентрации солей жесткости.
- Заметно проявление явления солюбилизации - повышенной растворимости веществ в растворах золей ПАВ.
В качестве комплексонов можно использовать алкилсульфаты, алкансульфонаты, сульфокислоты нефтяные водомаслорастворимые, лингосульфонаты, например, состава, %: 53,46 С; 5,37 Н; 5,02 S; 12,00 ОСН3 и другие, а также их соли.
Используемый в данном примере технический сульфонат по данным ИК-спектроскопии (фиг.3) имеет:
Примечание: Полосы поглощения 2900, 1460, 1380 и 720 см-1 принадлежат вазелиновому маслу.
Исследованы исходные материалы для получения комплексов с сульфокислотами. Ими являются карбонаты марганца, кадмия, никеля, гидроксиды меди, оксиды цинка и железа, хлориды этих металлов и кобальта, ртути, нитрат свинца. Для растворения оксидов железа с образованием металлорганических комплексов применяли не только ион железа, но и его оксид.
Величина рН раствора в процессе выщелачивания имеет большое значение. Установлено, что при концентрации органики и металла по 1 г/л и рН<3 комплексы органических сульфонатов с ионами Me(II), где Me=Fe, Zn, Cu и Mn, устойчивы.
Растворы после выщелачивания содержали, г/л: 30-40 Fe, 3-5 Zn, 3-5 Cu, остатки органических составляющих от выщелачивания клинкера с применением сульфоната (до 5 г/дм3) и серной кислоты (3-5 г/дм3), рН 1-2. Извлечение цветных металлов и железа составляет 80-90%.
Железо и цинк находятся в составе комплекса с органикой и имеют окислительное число, равное 2. В процессе отстаивания возможно окисление железа (II) до железа (III) с переходом последнего в осадок. Ион Fe2+ в комплексе окисляется кислородом воздуха до Fe3+. Процесс такого окисления можно затормозить присутствием металлического железа или другого восстановителя, основная роль которого заключается в переводе Fe(III) в Fe(II). При этом ослабляется кристаллическая решетка твердых оксидных отложений, что оказывает существенное влияние на скорость реакции комплексообразования железа, так как связывание Fe(II) протекает значительно быстрее, чем Fe(III). Введение восстановителя приводит также к удалению из раствора коррозионно-активных ионов Fe(III). В качестве восстановителя удобно использовать гидроксиламин, так как в процессе его окисления возникают нитрильные производные, спообные к образованию комплексных соединений с некоторыми элементами и к участию в смешанном комплексообразовании. Метанол и серную кислоту также можно использовать для растворения и восстановления высших гидроксидов.
Затем осуществляли коллективное осаждение ионов цинка (II) и железа (II) из раствора после выщелачивания клинкера. В качестве окислителей использовали Н2О2, Cl2, (NH4)2S2O8, CaOCl2, NaOCl. В качестве нейтрализаторов до рН 5-6 использовали NaOH, Na2СО3, Са(ОН)2. Полноту осаждения проверяли химическим анализом ионов цинка и железа в водной фазе.
Установлено, что полное осаждение ионов металлов (до следов) осуществляется при избытке окислителя в 1,5-2,0 раза в расчете на реакцию Fe(II)→Fe(III). Наиболее плотные осадки получены при использовании в качестве нейтрализаторов Na2CO3 и Са(ОН)2, раствор легко отделяется от осадка декантацией. Образующийся Fe(III) в данных условиях проявляет свойства коагулянта, способствуя переходу в осадок ионов цинка, органики и комплексов на их основе.
Осадок растворяли в соляной кислоте с превращением Zn, Cu и большей части Mn и Fe в раствор низших хлоридов MeCl2.
Ниже приведен ряд технологических схем переработки осадка.
Схема 1
Осадок растворяли и восстанавливали 11-молярным раствором HCl в системе противотока при 100°С и атмосферном давлении с превращением Zn, Cu и большей части Mn в раствор низших хлоридов MeCl2, а железо в FeCl3. При этом хлор-ион кислоты окисляется до Cl2 и выделяется из раствора. Хлорид железа селективно извлекается из раствора методом жидкостной экстракции триалкилфосфатами или алифатическими аминами. Затем FeCl3 извлекается из органической фазы водой, раствор концентрируют выпаркой и разлагают термическим путем на Fe2O3 и HCl, последнюю рециркулируют в процесс растворения осадка. Медь из раствора цементируют. Сульфат марганца кристаллизуют в форме моногидрата сульфата (MnSO4·H2O).
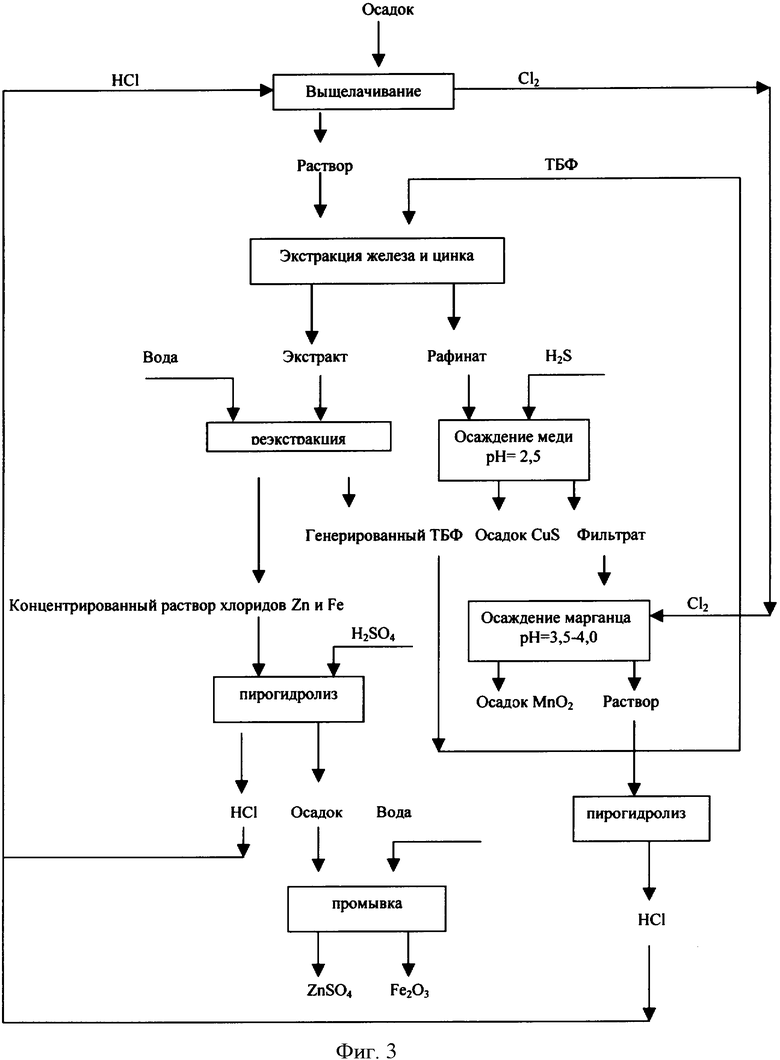
Схема 2 (фиг.3)
Выщелачивание осуществляют при 70°С, которая поддерживается за счет экзотермических реакций (кислотность 200-350 г/л). Исходная кислотность на 5-20% выше стехиометрически необходимой для растворения оксидов металлов. На первой стадии переработки раствора применяют неразбавленный трибутилфосфат (ТБФ), экстрагирующий железо и цинк. Операция протекает при соотношении органической фазы и водной 1:2. Для реэкстракции насыщенного ТБФ применяют воду O:В=40. К водному рафинату добавляют H2SO4, железо и цинк находятся в форме хлоридов. Раствор подвергают пиро-гидролизу для отгонки HCl с водяным паром, которые конденсируются и возвращаются на выщелачивание. Остаток после обжига состоит из Zn2SO4·nH2О и Fe2O3, первый продукт выщелачивается водой и получают два товарных продукта.
Из основного выщелачивающего раствора, получаемого после обработки ТБФ, при рН<2,5 и 20°С сероводородом осаждают сульфид меди, раствор после осаждения сульфида направляется на осаждение марганца хлором при рН 3,5-4,0.
Схема 3
Известно выщелачивание твердой фазы хлором в растворе соляной кислоты и/или FeCl2. Из фильтрата избирательно экстрагируют FeCl3, применяя ТБФ, органическую фазу обрабатывают пресной водой для реэкстракции FeCl3, экстрагент направляют в оборот (часть раствора FeCl3 также является оборотной), а избыток FeCl3 выводят выпаркой и кристаллизацией.
Схема 4
Осаждение гидроксида железа из аммонийно-сульфатных растворов осуществляли сильным окислителем персульфатом аммония (NH4)2S2O8, 82-87°С, рН 4,5-5,0. Раствор очищают от железа и других примесей в аммонийной среде.
Для селективного извлечения цинка из аммонийно-сульфатных растворов применяли жидкостную экстракцию диэтилгексилфосфорной кислотой (ДЕНРА) при рН 2,3.
Схема 5
Сульфит ZnS в отличие от CoS и NiS осаждается из кислых растворов при рН≈2. Для поддержания заданного значения рН применяют буферную смесь. В среде буферных смесей можно практически полностью отделить Zn в виде ZnS от Ni2+, Со2+, Fe2+, Mn2+ и некоторых других. В присутствии окислителей образуется осадок серы.
В зависимости от состава клинкера можно выбрать оптимальный вариант технологической схемы селективного извлечения ионов металлов из раствора после его выщелачивания.
Комплексоны находят широкое использование, например, в теплоэнергетике для отмывки различных по составу отложений, образующихся на внутренних поверхностях нагрева оборудования.
Таким образом, применение комплексонов повышает извлечение цветных металлов при выщелачивании материалов.
Особенно эффективно применение комплексонов при переработке материалов, в которых концентрация железа значительно превышает сумму концентраций цветных металлов.
По сравнению с прототипом предлагаемый способ интенсифицирует процессы, сокращает расход реагентов и потери цветного металла при извлечении, обеспечивает высокую чистоту получаемых металлов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ переработки цинкового кека | 2016 |
|
RU2620418C1 |
| СПОСОБ ОЧИСТКИ НИКЕЛЕВОГО ЭЛЕКТРОЛИТА ОТ ПРИМЕСЕЙ ЖЕЛЕЗА (III) И МЕДИ (II) ЭКСТРАКЦИЕЙ СМЕСЬЮ ОЛЕИНОВОЙ КИСЛОТЫ И ТРИЭТАНОЛАМИНА | 2015 |
|
RU2604286C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ МЕТАЛЛОВ ИЗ ПОЛИМЕТАЛЛИЧЕСКОГО СЫРЬЯ С РЕГЕНЕРАЦИЕЙ ОСНОВНОГО (NH) И КИСЛОГО (HCl) РЕАГЕНТОВ | 2016 |
|
RU2640552C2 |
| СПОСОБ СЕЛЕКТИВНОЙ ЭКСТРАКЦИИ ЖЕЛЕЗА (III) И ЦИНКА (II) ИЗ ВОДНЫХ РАСТВОРОВ ТРИБУТИЛФОСФАТОМ | 2014 |
|
RU2581316C1 |
| СПОСОБ ОЧИСТКИ НИКЕЛЕВОГО ЭЛЕКТРОЛИТА ОТ ПРИМЕСЕЙ ЖЕЛЕЗА (III), КОБАЛЬТА (III) И МЕДИ (II) ЭКСТРАКЦИЕЙ | 2015 |
|
RU2604289C1 |
| СПОСОБ СЕЛЕКТИВНОГО ИЗВЛЕЧЕНИЯ ЖЕЛЕЗА (III) И МЕДИ (II) ИЗ ВОДНЫХ РАСТВОРОВ | 2019 |
|
RU2702185C1 |
| СПОСОБ ЭКСТРАКЦИИ ЖЕЛЕЗА (III) И МЕДИ (II) ИЗ ВОДНЫХ РАСТВОРОВ СМЕСЬЮ ОЛЕИНОВОЙ КИСЛОТЫ И ТРИЭТАНОЛАМИНА В КЕРОСИНЕ | 2015 |
|
RU2591915C1 |
| СПОСОБ СЕЛЕКТИВНОГО ИЗВЛЕЧЕНИЯ ЖЕЛЕЗА (III) И МАРГАНЦА (II) ИЗ ВОДНЫХ РАСТВОРОВ | 2019 |
|
RU2698083C1 |
| СПОСОБ ЭКСТРАКЦИИ СВИНЦА ИЗ ВОДНЫХ РАСТВОРОВ | 1998 |
|
RU2134728C1 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ОЧИСТКИ ВОДНЫХ РАСТВОРОВ МЕДИ ОТ МАРГАНЦА | 2001 |
|
RU2209839C2 |
Изобретение относится к области гидрометаллургии цветных металлов и может быть использовано при переработке концентратов, промпродуктов и твердых отходов, содержащих цветные металлы. Задачей изобретения является создание эффективного способа селективного извлечения металлов из материалов сложного состава. Технический результат заключается в интенсификации процесса выщелачивания и повышении чистоты полученных металлов при их селективном извлечении. Способ извлечения ионов железа, цинка, меди и марганца из материала, их содержащего, включает сернокислотное выщелачивание и совместное гидролитическое осаждение из раствора ионов извлекаемых металлов с добавлением окислителя. При сернокислотном выщелачивании добавляют комплексоны, образующие в кислых средах с ионами извлекаемых металлов прочные хорошо растворимые комплексы. Выщелачивание ведут при рН меньше 3, осадок после гидролитического осаждения подвергают солянокислотному растворению с последующим селективным извлечением ионов металлов из полученного раствора. 3 ил.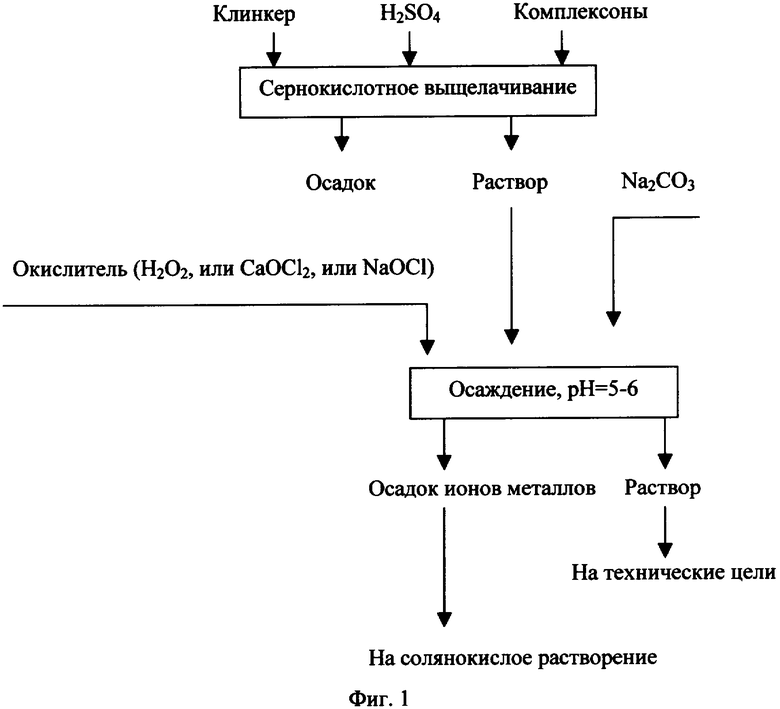
Способ извлечения ионов железа, цинка, меди и марганца из материала их содержащего, включающий его сернокислотное выщелачивание и совместное гидролитическое осаждение из раствора ионов извлекаемых металлов с добавлением окислителя, отличающийся тем, что при сернокислотном выщелачивании добавляют комплексоны, образующие в кислых средах с ионами извлекаемых металлов прочные хорошо растворимые комплексы и ведут выщелачивание при рН меньше 3, осадок после гидролитического осаждения подвергают солянокислотному растворению с последующим селективным извлечением ионов металлов из полученного раствора.
| RU 94015041 А1, 10.02.1996 | |||
| Способ извлечения цинка из кеков, содержащих феррит цинка | 1990 |
|
SU1749277A1 |
| Способ переработки цинкового клинкера вельц-печей | 1992 |
|
SU1836461A3 |
| УСТРОЙСТВО ДЛЯ ОЧИСТКИ ВОДЫ | 1996 |
|
RU2104736C1 |
| US 6340450 А, 22.01.2002 | |||
| Установка разделения воздуха | 1979 |
|
SU851034A1 |
| JP 2001214224 А, 07.08.2001. | |||
Авторы
Даты
2008-11-20—Публикация
2006-08-03—Подача