Настоящее изобретение относится к антисмысловым олигонуклеотидам (ODN) к Smad7 и их применению в области медицины.
В частности, изобретение относится к подходящим образом модифицированным антисмысловым ODN последовательностям к Smad7, которые обладают неожиданной биологической активностью специфического ингибирования экспрессии Smad7 и к их применению в области медицины в качестве терапевтических биологических агентов, в частности, при лечении хронических воспалительных заболеваний пищеварительного тракта (ВЗПТ).
Болезнь Крона (БК) и язвенный колит (ЯК) являются основными формами хронических воспалительных заболеваний пищеварительного тракта у человека. Оба этих заболевания являются комплексом клинических проявлений, чей патогенез находится в прямой зависимости от взаимодействия различных генетических факторов, факторов окружающей среды и иммунных факторов.
Несмотря на значительные различия между БК и ЯК на патофизиологическом и клиническом уровнях, терапевтический подход к лечению пациентов, страдающих этими заболеваниями, имеет много общего. Изменчивость клинической картины, типа и распространения поражения, а также различные осложнения влияют на выбор подхода к лечению, даже если бы фармакологическое лечение было бы преимущественным методом лечения.
Салицилазосульфапиридин и 5-аминосалициловая кислота являются лекарственными средствами с доказанной эффективностью при лечении легких форм ВЗПТ и при ремиссии.
В фазах с активностью от умеренной до высокой и в случаях, когда заболевание влияет на общее состояние больного, необходимо прибегать к применению кортикостероидов. Среднесрочные и долгосрочные исследования наиболее распространенных в мире случаев заболевания показали, что клинической ремиссии можно достичь только у двух третей пациентов, получавших кортикостероиды, и только у 50% после прекращения приема лекарственных средств не возникал рецидив.
Кроме того, что длительное применение кортикостероидов вызывает медикаментозную зависимость, оно осложняется большой вероятностью возникновения побочных эффектов.
Также иммуносупрессивное лечение, которое зачастую сопровождает или замещает кортикостероидальную терапию, не всегда гарантирует локализацию воспаления и контроль над симптомами, и, более того, имеются многочисленные противопоказания и серьезные побочные эффекты (Podolsky, 2002).
Биологические агенты являются новым поколением лекарственных средств, появившимся в 90-е годы. Более глубокие знания о природе ВЗПТ и основных патофизиологических механизмах были получены при проведении медицинских исследований в определенном направлении. Таким образом, развитие биотерапии, направленной на контролирование специфических воспалительных путей, возникло при применении рекомбинантных белков человека, моноклональных химерных гуманизированных антител и слитых белков. В настоящем контексте это агенты, которые обладают более высокой эффективностью при лечении БК, являются моноклональными химерными антителами, направленными на блок TNF-α, т.е. на провоспалительный цитокин, который сверхпродуцируется при ВЗПТ (Seegers et al., 2002). Это соединение, которое находится на IV фазе клинического испытания, и эффективно для локализации воспаления примерно у 60-70% пациентов, прошедших курс лечения. Однако эти агенты довольно часто вызывают некоторые побочные симптомы и с ними связывают реактивацию латентных микробных инфекций, феномена гиперчувствительности и образования аутоантител. Последний феномен может быть основан на том факте, что анти-TNF-α нейтрализует цитокин TNF-α, который имеет большое количество биологических функций.
Помимо своего воспалительного эффекта, TNF-α также принимает участие в механизмах, вовлеченных в индукцию и поддержание иммунной толерантности. Следовательно, и активность блока TNF-α может парадоксальным образом поддерживать чрезмерные иммунологические реакции (Sandborn et al., 2002).
Все эти наблюдения наводят на мысль о необходимости новых исследований ВЗПТ на животных моделях, на основании которых возможно будут идентифицированы новые активные химические компоненты для лучшего, более эффективного и надежного способа лечения этих патологий (Fiocchi, 2001).
Анти-TNF-α лечение, так же как и другие методы биотерапии, такие как введение противовоспалительных цитокинов, например IL-10, представляет собой внеклеточный подход к лечению, направленный на контроль биологической эффективности молекул, секретируемых клетками воспаления.
Исследование путей сигнальной трансдукции, активированных под действием цитокинов с их рецепторами, дает направление поиска путей применения новых подходов к лечению, способных модулировать специфично и избирательно внутриклеточную экспрессию важных молекул воспаления и других молекул.
В нормальных условиях слизистая оболочка кишечника является местом расположения «физиологического» воспалительного инфильтрата, который поддерживается за счет хрупкого баланса провоспалительных и противовоспалительных молекул.
Из сказанного выше следует, что очень важную роль играет TGF-β1, который является многофункциональным цитокином, способным регулировать рост, дифференциацию и активность многих иммунных и неиммунных клеток.
Исследования in vitro и in vivo показали, что TGF-β1 действует как активный иммунорегулятор, способный контролировать воспаление слизистой оболочки кишечника, и ингибирование его активности ведет к развитию колита, иммуноморфология которого сходна с БК или ЯК (Powrie F. et al., 1996; Neurath M.F. et al., 1996; Ludviksson B.R., 1997).
Действительно, у мышей с дефектными генами TGF-β1 наблюдаются тяжелые многоочаговые воспалительные реакции, также поражающие кишечник, что связано с чрезмерной продукцией воспалительных цитокинов клетками различных типов, включая Т-клетки (Shull M. M. et al., 1992; Christ M. et al., 1994).
Подобным образом, ингибирование передачи сигнала TGF-β1 у мыши путем экспрессии доминантной негативной мутантной формы рецептора RII TGF-β1 ведет к увеличению восприимчивости к развитию экспериментальных колитов (Hahm K.B. et al., 2001).
Наконец, было показано, что специфическое ингибирование передачи сигнала TGF-β1 Т-клеткам путем экспрессии доминантного негативного рецептора типа II TGF-β вызывает развитие аутоиммунного заболевания, характеризующегося сильными воспалительными инфильтратами в легких и толстой кишке и наличием аутоиммунных антител (Gorelik L. et al., 2000). Эти данные указывают на то, что потеря активности сигнальной противовоспалительной молекулы может быть достаточной для изменения кишечного гомеостаза, что позволяет иммунным ответам вызывать повреждение тканей.
Противовоспалительная активность TGF-β1 начинается с взаимодействия молекулы с комплексом гетеродимерных трансмембранных рецепторов серин/треонинкиназы, состоящим из двух субъединиц, названных R1 TGF-β1 и R2 TGF-β1 соответственно. При связывании TGF-β1 рецепторы взаимно разворачиваются в описанном выше комплексе, что приводит к процессам трансфосфорилирования и последующей активации R1 TGF-β1 посредством активного R2 TGF-β1 и к способности аутофосфорилироваться.
Распространение инициирующего сигнала TGF-β1 в ядро опосредовано белками, относящимися к семейству Smad. Активированный R1 TGF-β1 непосредственно фосфорилирует белки Smad2 и Smad3, которые становятся способными взаимодействовать с Smad4, что, таким образом, делает возможным транслокацию комплекса Smad2-3/Smad4 в ядро, где он участвует в транскрипционном контроле некоторых генов (Heldin C-H. et al., 1997).
Роль Smad3 в противовоспалительной активности TGF-β1 была подтверждена исследованиями на животных моделях, которые показали, что делеция гена, кодирующего Smad3, связана с уменьшением способности клетки к ответной реакции на TGF-β1, а также с опосредованным развитием воспалительного заболевания, характеризующегося массовой инфильтрацией Т-клеток и образованием пиогенных абсцессов в желудочно-кишечном тракте (Yang X. et al., 1999).
Среди других внутриклеточных белков, принадлежащих к семейству белков Smad, можно отметить, например, Smad7. Этот белок, взаимодействуя с R1 TGF-β1, препятствует связыванию Smad2/Smad3 с рецептором, предотвращая, таким образом, фосфорилирование и активацию. Следовательно, повышение экспрессии белка Smad7 связано с ингибированием TGF-β1 опосредуемого сигнала (Hayashi H. et al., 1997).
Оценка экспрессии TGF-β1 в слизистой оболочке кишечника пациентов с ВЗПТ показывает, что продукция вышеуказанной молекулы аномально усилена по сравнению с продукцией в кишечнике здоровых лиц (Lawrance I.C. et al., 2001).
Ранее автором настоящего изобретения было показано, что образцы слизистой оболочки пациентов, страдающих ВЗПТ, характеризуются высоким уровнем Smad7 и пониженным уровнем активности Smad3, таким образом, указывая, что в процессе ВЗПТ повреждается механизм TGF-β1 опосредованного сигнала. Автор настоящего изобретения, кроме того, показал, что селективная нейтрализация Smad7 при помощи специфического антисмыслового олигонуклеотида 5'-GTCGCCCCTTCTCCCCGCAGC-3' (SEQ ID NO:1) восстанавливает мононуклеарные клетки собственной пластинки слизистой оболочки кишечника (LPMC), способных взаимодействовать с TGF-β1, что приводит к снижению продукции провоспалительного цитокина, такого как, например TNF-α.
Кроме того, также в экспериментах ex vivo, проводимых на образцах слизистой оболочки кишечника пациентов, страдающих ВЗПТ, было показано, что введение антисмысловых ODN к Smad7 восстанавливает сигнальный механизм TGF-β1 и позволяет уменьшить продукцию цитокина (Monteleone at al., 2001).
Во время ВЗПТ слизистая оболочка кишечника инфильтрована большим числом Т-клеток. Эти клетки являются главными медиаторами повреждения ткани, действующими при таких заболеваниях.
Повышенное количество Т-клеток в слизистой оболочке кишечника пациентов, страдающих ВЗПТ, частично зависит от резистентности этих клеток к стимулам, вызывающим их гибель (апоптоз).
Полагают, что блокирование апоптоза Т-клеток играет важную роль в поддержании воспалительной реакции слизистой оболочки при ВЗПТ (Boirivant et al., 1999). Действительно, усиление гибели Т-клеток связано с разрешением воспаления в кишечнике. Точный механизм, лежащий в основе резистентности Т-клеток к апоптозу при ВЗПТ, еще не известен, хотя известно, что, по-видимому, в него вовлечены местно высвобождаемые цитокины.
Данные экспериментов, проведенных в клеточной культуре invitro и in vivo, указывают, что TGF-β1 может либо предотвращать, либо инициировать гибель Т-клеток, и что способность фактора опосредовать обе ответные реакции является сайт-специфичной (Han S.H. et al., 1998; Arsura M. et al., 1996).
У мышей с нокаутированными Smad3 наблюдается массовое увеличение числа воспалительных клеток в кишечнике, что, таким образом, предполагает роль TGF-β1 в контроле апоптоза Т-клеток в кишечнике (Yang et al., 1999).
Следовательно, ингибирование Smad7 при помощи синтетических антисмысловых ODN к Smad7 может представлять собой новый и приемлемый «эндогенный» биотерапевтический подход при хронических воспалительных заболеваниях, в частности, при ВЗПТ, как это было указано выше, ингибирование Smad7 восстанавливает способность Т-клеток реагировать с TGF-β1.
Антисмысловые олигонуклеотиды (ODN) являются короткими синтетическими олигонуклеотидными последовательностями, комплементарными матричной РНК (мРНК), которая кодирует мишеневый белок специфического и целевого ингибирования. Такие последовательности, гибридизующиеся с мРНК, образуют характерную двойную гибридную спираль, что приводит к активации убиквитиновых каталитических ферментов, таких как РНКаза H, которая расщепляет ДНК/РНК гибридную спираль, что инициирует дупликацию ДНК, таким образом, предшествуя трансляции белка.
Выбор наиболее подходящих областей и последовательностей мРНК для гибридизации с ODN был сделан эмпирически, даже если применение ODN комплементарной 5' области инициации транскрипции к сплайсинг областям более эффективно. Конструирование значительного числа антисмысловых ODN после идентификации возможных целевых сайтов не вызовет затруднений благодаря современным достижениям в области автоматизации технологий синтеза, применяемых компаниями, специализирующимися в этой области.
Наоборот, идентификация более активных ODN с возможным их терапевтическим применением требует более длительного скрининга с применением эффективного количественного анализа. В связи с высказанным, следует отметить, что антисмысловые ODN последовательности к специфическим мишеням, в том числе к Smad7, уже известны (патент США № 6159697; патентообладатель ISIS Pharmaceuticals Inc.).
Применению антисмысловых ODN в генной регуляции как invitro, так и in vivo затруднено в результате, например, препятствий при прохождении через клеточные мембраны из-за полианионной, а также гидрофильной природы этих молекул и из-за быстрой деградации ферментами.
Для преодоления этих сложностей необходимо прибегнуть к химической модификации антисмысловых ODN, такой как, например, фосфорилирование, как, например, в описанном выше случае со специфической последовательностью Smad7 (Monteleone et al., 2001), или фосфороамидирование, которое представляет собой замещение атомами серы или азота атомов кислорода, которые не формируют связи между атомами в фосфодиэфирной связи.
Также как и большинство биотехнологических продуктов наличие биологической активности указывает на возможную терапевтическую активность.
Действительно, ODN могут использоваться как при исследовании генов, так и при исследовании функции белков, вовлеченных в патогенез различных заболеваний, или для терапевтических целей. Несмотря на то, что в предшествующем уровне техники успешно использовали основополагающие принципы метода антисмысловых последовательностей, переход от in vitro к экспериментам более сложный, особенно в отношении фармакокинетических, фармакодинамических и токсикологических аспектов этих новых лекарственных средств (Maggi A., 1998).
Например, антисмысловые ODN к Smad7, которые использовали в предшествующих экспериментах настоящего изобретения (SEQ ID NO:1),и в которых была показана биологическая активность invitro, могут иметь риск нежелательных эффектов in vivo. На самом деле, такой ODN содержит две нуклеотидные пары CG, которые после введения фосфотиоэфирной группы становятся CpG, что является основным подходом для повышения стабильности ODN. Указанные последовательности являются последовательностями с высокой стимулирующей активностью в отношении иммунной системы, следовательно, применение описанных выше ODN как таковых могло бы ухудшить течение любого иммунологического заболевания, включая болезнь Крона и язвенный колит.
Подобный терапевтический подход мог быть не только гипотетическим, особенно в случае болезни Крона, патологии, опосредованной конкретным классом Т-лимфоцитов, называемых Th1, стимулированных интерлейкином 12. Безусловно, молекулы CpG, как мощные индукторы синтеза IL-12, могут индуцировать дальнейшее развитие Th1 клеток.
Кроме того, in vivo введение антисмысловых ODN, содержащих CpG динуклеотиды, сопровождается повышением риска побочных эффектов по сравнению с введением олигонуклеотидов, не содержащих CpG. В частности, было показано повышение риска гиперплазии ретикулоэндотелиальной системы селезенки, почек и печени, а также усиление пролиферации кроветворных клеток (Agrawal S. et al., 2002).
Другой проблемой применения ODN являются побочные эффекты действия метаболитов, полученных при деградации молекул, которая возникает из-за достаточно высокой восприимчивости к действию нуклеазы, из-за отсутствия защиты 5' и 3'-концов.
В этом случае необходима химическая модификация основной цепи антисмысловых ODN, то есть введение фосфотиоэфирной группы с образованием пар CpG и защиты 5' и 3'-концов. Однако описанные выше модификации ODN последовательности могут привести к уменьшению или потере биологической активности ингибирования синтеза Smad7 и иногда даже к инверсии желаемой активности как in vitro, так и in vivo.
Также может быть важным наличие экспериментальных моделей ВЗПТ, которые можно использовать для in vivo исследований, которые позволят расширить знания о механизмах, в которые вовлечена потеря регуляции иммунного ответа, и их роль в возникновении патологии ВЗПТ и в возможности модулирования или предотвращения такого ответа, ограничивая, таким образом, развитие воспаления слизистой оболочки. В связи с этим TNBS-опосредованные колиты представляют собой развернутую действующую модель воспаления слизистой, которая демонстрирует поразительное иммуноморфологическое сходство с БК человека (Neurath M. et al., 2000).
В свете изложенного было бы желательно иметь новые терапевтические биологические агенты, такие как антисмысловые ODN к Smad7, которые активны как in vitro, так и in vivo, для лечения ВЗПТ с применением «эндогенного биотерапевтического подхода».
Автором настоящего изобретения была найдена подходящим образом модифицированная последовательность антисмысловых ODN, которые обладают более высокой биологической ингибиторной активностью в отношении экспрессии Smad 7 in vivo на экспериментальных моделях ВЗПТ по сравнению с их in vitro ингибиторной активностью, а также более высокой ингибиторной активностью по сравнению с другими известными последовательностями с такими же модификациями и тестированными на таких же моделях.
В частности, ODN последовательности, которые обладают более высокой биологической активностью in vivo, были сконструированы на основании антисмысловой ODN последовательности с введенной фосфотиоэфирной связью SEQ ID NO:1, нацеленной на сайт 403 РНК Smad7 человека, использованной автором настоящего изобретения в ходе предшествующих экспериментов.
Принимая во внимание возможное применение в будущем таких антисмысловых ODN к Smad7 с введенной фосфотиоэфирной связью при лечении патологий людей, описанные выше последовательности были модифицированы по CpG динуклеотидам, содержащимся в ODN, здесь указаны как XY, ввиду их описанной иммуногенности.
Исследования, проведенные автором, позволили протестировать in vivo и in vitro эффективность различных известных и новых антисмысловых ODN к Smad7 и их возможную токсичность, а также исследовать, приводит ли блокирование экспрессии Smad7 к разрешению воспаления слизистой на экспериментальных моделях ВЗПТ.
Описанные выше соответствующим образом модифицированные антисмысловые ODN последовательности по настоящему изобретению помимо их более высокой биологической активности in vivo показали неожиданное отсутствие побочных эффектов у животных, которые наблюдались при введении других последовательностей в этом же исследовании. Кроме того, было показано, что ODN последовательности по настоящему изобретению эффективно ограничивают лимфоцитарную инфильтрацию и последующее распространение воспаления, что не обнаруживалось при исследовании других антисмысловых ODN последовательностей.
Роль Smad7 как биологической мишени четко продемонстрирована в этих исследованиях на экспериментальных моделях вместе с возможным терапевтическим эффектом его ингибирования.
Кроме того, в контексте настоящего изобретения также была обнаружена другая роль Smad7 в индукции апоптоза Т-клеток при ВЗПТ. Действительно, при применении тех же антисмысловых ODN к Smad7 было обнаружено, что TGF-β1 регулирует апоптоз Т-клеток в кишечнике и что нарушенный фактор активности вызывает устойчивость клеток к апоптическим стимулам, которые отвечают за контроль ответной реакции слизистой оболочки на воспаление.
Кроме того, объектом настоящего изобретения является антисмысловой олигонуклеотид с введенной фосфотиоэфирной группой к Smad7 длиной до 21 нуклеотидов, который содержит по крайней мере 10 нуклеотидов следующей последовательности (SEQ ID NO:2):
5'-GTXYCCCCTTCTCCCXYCAG-3',
где X представляет собой нуклеотид, содержащий азотистое основание, выбранное из группы, включающей цитозин, 5-метилцитозин и 2'-O-метилцитозин, и где Y представляет собой нуклеотид, содержащий азотистое основание, выбранное из группы, включающей гуанин, 5-метилгуанин и 2'-O-метилгуанин, при условии, что один из этих нуклеотидов, X или Y, содержит метилированное азотистое основание;
или комплементарная ему последовательность.
Другими объектами настоящего изобретения являются олигонуклеотидные последовательности различных стереоизомеров антисмысловых олигонуклеотидов, например диастереоизомеров и энантиомеров, относительно атомов фосфора межнуклеозидных связей, включенных в последовательность. В межнуклеозидную связь может быть введена фосфотиоэфирная группа, или она может быть метилфосфорилирована, и в обоих случаях фосфор связывается с четырьмя различными химическими группами, представленными в хиральном центре.
Антисмысловые олигонуклеотиды по настоящему изобретению могут иметь по крайней мере один метилфосфорилированный нуклеотид в последовательности, который расположен, например, на 5'-конце или только на 3'-конце, либо на обоих 5' и 3'-концах, либо в составе олигонуклеотидной последовательности.
В предпочтительном варианте осуществления метилфосфорилированный нуклеотид может быть либо X, либо Y, в этом случае межнуклеозидная связь представляет собой связь между указанными нуклеотидами.
Для повышения стабильности молекулы и, таким образом, для предупреждения ее деградации под действием нуклеаз, и снижения риска возникновения нежелательных подобных эффектов метаболитов, полученных в результате такой деградации, 5' и 3'-концы или нуклеотиды, входящие в состав последовательности антисмысловых ODN, могут быть дополнительно модифицированы.
Антисмысловые олигонуклеотиды по настоящему изобретению могут, кроме того, содержать по крайней мере один нуклеотид в последовательности, который является 2'-O-метилрибонуклеотид-5-монофосфатом, и такой нуклеотид может находиться, например, либо на 5'-конце или 3'-конце, либо на обоих 5' и 3'-концах, или же входить в состав олигонуклеотидной последовательности.
Другими объектами настоящего изобретения являются вышеуказанные антисмысловые олигонуклеотиды, у которых 2'-дезоксирибонуклеотиды заменены на рибонуклеотиды и у которых 2'-дезокситимидин заменен на уридин, и, таким образом, антисмысловые дезоксирибонуклеотидные последовательности соответствуют соответствующим антисмысловым рибонуклеотидным последовательностям.
В предпочтительном варианте осуществления настоящего изобретения антисмысловой олигонуклеотид имеет последовательность (SEQ ID NO:3):
5'-GTXGCCCCTTCTCCCXGCAG-3',
где X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат.
Еще в одном предпочтительном варианте осуществления антисмысловой олигонуклеотид имеет последовательность (SEQ ID NO:4):
5'-ZTXGCCCCTTCTCCCXGCAZ-3',
где X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат и Z представляет собой 2'-дезоксигуанозинметилфосфонат.
В соответствии с еще одним аспектом предпочтительным вариантом осуществления настоящего изобретения является антисмысловой олигонуклеотид с последовательностью (SEQ ID NO:15):
5'-ZTXGCCCCTTCTCCCXGCAZC-3',
где X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат и Z представляет собой 2'-дезоксигуанозинметилфосфонат.
Антисмысловые ODN последовательности по настоящему изобретению могут успешно использоваться в области медицины, таким образом, следующим объектом настоящего изобретения является фармацевтическая композиция, которая в качестве активного вещества содержит по крайней мере один описанный выше антисмысловой олигонуклеотид вместе с одним или несколькими фармацевтически приемлемыми адъювантами и/или эксципиентами, которые известны специалисту в данной области.
Кроме того, изобретение относится к применению вышеуказанных антисмысловых олигонуклеотидных последовательностей для получения лекарственных препаратов для лечения патологий, связанных с экспрессией Smad7. В частности, патологиями, связанными с экспрессией Smad7, являются ВЗПТ, например БК и ЯК.
Описанное настоящее изобретение иллюстрировано далее конкретными предпочтительными вариантами осуществления, которые не ограничивают его объем, в которых приведены ссылки на конкретные фигуры приложенных чертежей, где:
На фигуре 1 показан эффект на число Т-лимфоцитов в кишечнике через 40 часов после обработки образцов слизистой оболочки больных БК антисмысловыми и смысловыми ODN к Smad7, 5'-MePGTMe-dCGCCCCTTCTCCCMe-dCGCAMePG-3' (SEQ ID NO:4);
На фигуре 2 показан анализ экспрессии комплекса p-Smad2/Smad3 и общего комплекса Smad2/Smad3 в LPMC, выделенных из кишечника мышей, обработанных TNBS (TNBS), не обработанных TNBS (Unt), обработанных этанолом (EtOH), используемых в качестве контроля.
На фигуре 3 показан анализ экспрессии Smad7 в LPMC, выделенных из кишечника мышей, обработанных TNBS (TNBS), не обработанных TNBS (Unt), обработанных этанолом (EtOH), используемых в качестве контроля.
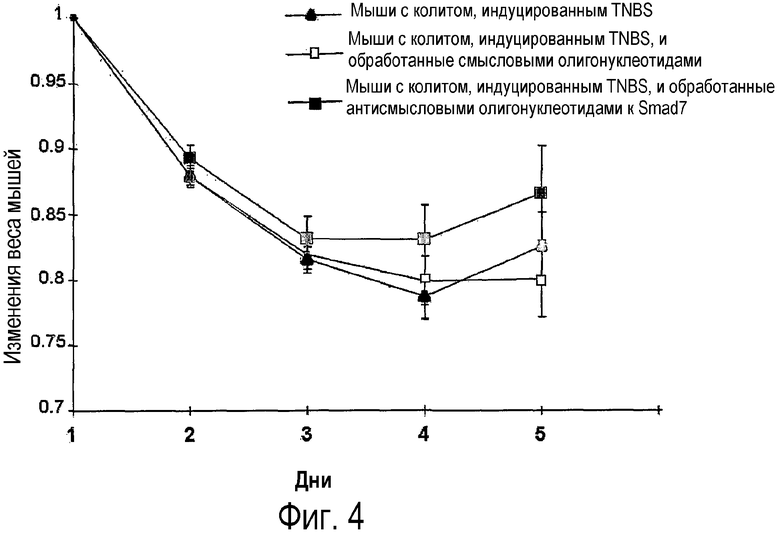
На фигуре 4 показано процентное соотношение изменений в весе мышей с колитом, индуцированным TNBS, которым вводили и не вводили антисмысловые олигонуклеотиды к Smad7, MePGTMe-dCGCCCCTTCTCCCMe-dCGCAMePGC (SEQ ID NO:15), или которым вводили контроль (смысловые олигонуклеотиды); фигура является репрезентативной из трех независимых экспериментов, где в каждой группе было исследовано 14 мышей.
На фигуре 5 показана макроскопическая картина толстой кишки мыши с колитом, индуцированным TNBS, которой вводили антисмысловые олигонуклеотиды к Smad7 (SEQ ID NO:15); фигура является репрезентативной из трех независимых экспериментов, где в каждой группе было исследовано 14 мышей.
На фигуре 6 показана гистологическая картина среза толстой кишки мышей без колита или с колитом, индуцированным TNBS, которым вводили антисмысловые олигонуклеотиды к Smad7 (SEQ ID NO:15), или которым вводили контроль (смысловые олигонуклеотиды); фигура является репрезентативной из трех независимых экспериментов, где в каждой группе было исследовано 14 мышей. Увеличение 40X.
ПРИМЕР 1. Исследование эффективности антисмысловых олигонуклеотидов к Smad7 по настоящему изобретению на апоптозе Т-клеток кишечника
Материалы и методы
Синтез антисмысловых ODN
Все антисмысловые ODN к Smad7 были синтезированы с использованием MWG Biotech AG (MWG Biotech S.r.l., Florence), с применением стандартных автоматизированных технологий с автоматизированным ДНК синтезатором, с соблюдением стандартных фосфороамидных химических методик (Lesiak K. et al., 1993; Xiao W. et al., 1996).
Олигонуклеотиды, содержащие 5-метил-2'-дезоксицитидин (5-Me-dC), были синтезированы в соответствии с общеизвестными способами синтеза (Sanghvi et al., 1993), используя коммерчески доступные фосфороамиды, поскольку синтез модифицированных олигонуклеотидов, содержащих метилфосфонатные группы (MeP), был осуществлен в соответствии с известными методиками (Maier M. A. et al., 2002).
Очистку олигонуклеотидных молекул осуществляли по HPSF методике, разработанной MWG Biotech. Такой способ очистки показал высокую эффективность, поскольку позволяет устранить неправильные последовательности, синтезированные во время автоматического химического синтеза, такие как, например, n-1, n-2, n-х последовательности, которые невозможно удалить классическими методами очистки.
Описанная выше методика, кроме того, дает возможность получить последовательности желаемой длины без неправильных продуктов, что позволяет избежать на 100% последующей операции по высаливанию, поскольку очищенные последовательности свободны и от солей, и от ионов металлов.
Полученные обессоленные олигонуклеотиды в результате анализировали MALDI-TOF, методом масс-спектрометрии, в соответствии со стандартными методиками (Guerlavais T. et al., 2002; Ragas J. A. et al., 2000). Олигонуклеотиды стерилизовали и в полученном растворе измеряли оптическую плотность (OD), используя УФ/визуальный спектрофотометр. Наконец, перед использованием молекулы ресуспендировали в стерильном PBS1×.
Все использованные антисмысловые ODN нацелены на Smad7 сайты мРНК, гомология которых у человека и мыши составляет 100%. Во всех последующих нуклеотидах межнуклеозидная связь является фосфоротиоатной связью.
Антисмысловые ODN последовательности, использованные в настоящем исследовании, были сконструированы в соответствии с фосфоротиоатной антисмысловой ODN последовательностью 5'-GTCGCCCCTTCTCCCCGCAGC-3' (SEQ ID NO:1), нацеленной на сайт 403 мРНК Smad7 человека, которая использовалась автором настоящего изобретения при осуществлении предыдущих экспериментов (Monteleone et al., 2001).
Антисмысловая ODN последовательность 5'-MePGTMe-dCGCCCCTTCTCCCMe-dCGCAMePG-3' (SEQ ID NO:4) к Smad7 нацелена на сайт 403 мРНК Smad7 человека. Этот олигонуклеотид содержит смешанную основную цепь, в которой цитозин, принадлежащий парам CpG SEQ ID NO:1, заменяли на 5-метилцитозин (указанный здесь как Me-dC). Кроме того, метилфосфонатные связи помещали на концах молекулы (указаны как MeP).
Антисмысловая ODN последовательность 5'-GTTTGGTCCTGAACATGC-3' (SEQ ID NO:5) к Smad7 нацелена на сайт 294 мРНК Smad7 человека.
Из образцов резекции 6 больных БК с тяжестью от умеренной до тяжелой и 4 пациентов с тяжелым ЯК получали образцы слизистой оболочки. Кроме того, были получены образцы слизистой кишечника у 10 пациентов, не страдающих ВЗПТ, перенесших колэктомию при карциноме толстой кишки (этическое разрешение было получено в местном комитете). LPMC получали с помощью способа DTT-EDTA коллагеназа и ресуспендировали в RPMI 1640 (Sigma-Aldrich S.r.l., Milan) с добавлением сыворотки вместо реагента HL-1 (Biowhittaker, Wokingham, UK).
Клетки культивировали в присутствии и в отсутствие TGF-β1 (Sigma-Aldrich, конечная концентрация изменялась от 1 до 5 нг/мл) и через 48 часов после инкубации анализировали уровень апоптоза.
В других экспериментах LPMC, выделенные из кишечника больных ВЗПТ, ресуспендировали в RPMI 1640 с добавлением HL-1 и культивировали в присутствии и в отсутствие вышеуказанных антисмысловых ODN к Smad7 (SEQ ID NO:4, SEQ ID NO:5) и в присутствии контрольного смыслового олигонуклеотида (в обоих использовали концентрацию 2 мкг/мл). Через 24 часа аликвоту LPMC использовали для экстракции белков и оценивали экспрессию Smad7. Оставшиеся клетки интенсивно промывали и ресуспендировали в RPMI 1640 с добавлением HL-1 и культивировали в присутствии или в отсутствие TGF-β1 (5 нг/мл) в течение 48 часов и затем анализировали на апоптоз).
Анализ апоптоза проточной цитометрией
Уровень апоптоза анализировали путем окрашивания пропидий йодидом (PI) с последующей проточной цитометрией.
Клетки промывали, инкубировали в течение 15 минут при 37°C в 5 мкл рибонуклеазы (0,6 мкг/мл, 30-60 единиц Kunitz, Sigma-Aldrich) и затем охлаждали на льду. Перед анализом проточной цитометрией добавляли пропидий йодид (100 мкг/мл).
Т-клетки идентифицировали с использованием специфического моноклонального анти-CD3 антитела (DAKO Ltd., Cambridgeshire, UK).
Белковая экстракция и анализ Вестерн-блоттингом
LPMC гомогенизировали и весь белок экстрагировали в буфере А, содержащем 10 мМ Hepes (pH 7,9), 10 мМ KCl, 0,1 мМ EDTA и 0,2 мМ EGTA. В буфер добавляли 1 мМ дитиотреитола (DTT), 10 мкг/мл апротинина, 10 мкг/мл леупептина и 1 мМ фенилметансульфонилфторида (все реагенты Sigma-Aldrich).
Белок Smad7 анализировали, используя специфические кроличьи антитела против Smad7 человека (конечное разведение 1:400, Santa Cruz Biotechnology, Inc., CA; USA). Козлиные антитела против кроличьих, конъюгированные с пероксидазой хрена (Dako Ltd), использовали в конечном разведении 1:20000 для определения первичного связанного антитела и иммунореактивность визуализировали с помощью хемилюминесцентного набора (Pierce, Rockford, IL, USA).
Органная культура
Эксплантаты слизистой, взятые из хирургических образцов пациентов, культивировали в присутствии и в отсутствие антисмысловых ODN к Smad7 (SEQ ID NO:4, SEQ ID NO:5; оба использовали с конечной концентрацией 10 мкг/мл) в течение 40 часов.
В качестве отрицательного контроля использовали эксплантат слизистой оболочки, который культивировали в присутствии антисмысловых ODN к Smad7.
По окончании культивирования эксплантаты слизистой оболочки собирали и использовали для анализа числа Т-лимфоцитов в собственной пластинке слизистой посредством иммуногистохимии.
Для этой цели получали и окрашивали моноклональными анти-CD3 антителами срезы слизистой (DAKO). Козлиные антитела против мышиных, конъюгированные со щелочной фосфатазой (DAKO), использовали для определения первичного связывания антител.
Результаты
Результаты, полученные в различных экспериментах, показали, что апоптоз T-лимфоцитов, выделенных из кишечника здоровых индивидуумов, зависит от возрастающей дозы TGF-β1.
В таблице 1 показан процент апоптозных Т-лимфоцитов через 48 часов после культивирования. Числа являются результатом четырех независимых экспериментов, в которых использовали Т-клетки, выделенные из кишечника четырех здоровых индивидуумов.
Наоборот, Т-лимофоциты, выделенные у четырех больных ВЗПТ, показали частичную резистентность к апоптозу, индуцируемому TGF-β1, как показано в результатах, приведенных в таблице 2, в которой представлен процент апоптозных Т-лимфоцитов через 48 часов после культивирования.
В частности, на основании анализа данных, приведенных в таблице 2, видно незначительное усиление апоптоза, при этом Т-клетки больных ВЗПТ культивировали в присутствии TGF-β1 как при концентрации 0,2 нг/мл, так и при концентрации 1 нг/мл. Наоборот, стимуляция Т-клеток больных ВЗПТ 5 нг/мл TGF-β1 показала небольшое усиление апоптоза.
Обработка Т-лимфоцитов, выделенных у больных ВЗПТ, антисмысловыми ODN к Smad7, SEQ ID NO:4, восстанавливала клеточную чувствительность к TGF-β1, что приводило к увеличению апоптоза клеток, что показано в процентном выражении Т-лимфоцитов в таблице 3. Данные относятся к четырем независимым экспериментам, в которых Т-клетки, выделенные из кишечника четырех больных ВЗПТ, культивировали только в среде (без стимуляции) или предварительно обрабатывали средой и смысловыми (контроль) или антисмысловыми олигонуклеотидами в течение ночи, а затем стимулировали TGF-β1 (1 нг/мл).
Кроме того, используя органную культуру ex vivo, автор настоящего изобретения продемонстрировал, что обработка образцов биопсии больных ВЗПТ антисмысловыми ODN к Smad7 по настоящему изобретению значительно снижает число CD3+ Т-клеток в слизистой оболочке, как показано по результатам иммуногистохимии на фигуре 1. На последней показано, что обработка антисмысловыми ODN сокращает число CD3 + Т-клеток слизистой оболочки.
На основании этих наблюдений можно предположить, что высокий уровень Smad7 играет решающую роль в продолжительности существования Т-клеток, таким образом, содействуя локальному распространению воспаления при ВЗПТ.
Таким образом, блокирование Smad7 могло бы стать перспективной стратегией контроля воспаления слизистой при этих условиях.
ПРИМЕР 2: In vivo и in vitro исследования эффектов введения антисмысловых и смысловых олигонуклеотидов к Smad7 на экспериментальных моделях колитов, индуцированных TNBS.
Материалы и методы
Все антисмысловые и смысловые ODN к Smad7 синтезировали в соответствии с MWG Biotech S.r.l. (Fierinze), используя стандартные методики, описанные ранее.
Используемые антисмысловые ODN нацелены на сайты мРНК Smad7, гомологичность которых у человека и мыши составляет 100%. Во всех последующих олигонуклеотидах межнуклеозидная связь является фосфоротиоатной связью. Все нижеприведенные последовательности использовали в экспериментах, проводимых на моделях с индуцированным колитом.
Антисмысловой ODN SEQ ID NO:1 (5'-GTCGCCCCTTCTCCCCGCAGC-3') к Smad7, нацеленный на сайт 403 мРНК Smad7 человека, уже использовался автором настоящего изобретения в ходе экспериментов ранее опубликованной статьи (Monteleone et al., 2001).
Для дальнейших исследований роли Smad7 в регуляции апоптоза Т-клеток в LPMC, выделенных из кишечника больных ВЗПТ, были использованы следующие антисмысловые олигонуклеотидные последовательности SEQ ID NO:4 и SEQ ID NO:5.
Антисмысловая ODN последовательность 5'-MePGTMe-dCGCCCCTTCTCCCMe-dCGCAMePG-3' (SEQ ID NO:4) к Smad7 нацелена на сайт 403 мРНК Smad7 человека. Этот олигонуклеотид содержит смешанную основную цепь, в которой цитозин, принадлежащий парам CpG в позиции 3 и 16 SEQ ID NO:1, заменяли на 5-метилцитозин (указанный как Me-dC). Кроме того, метилфосфонатные связи помещали на концах молекулы (указаны как MeP).
Антисмысловая ODN последовательность 5'-GTTTGGTCCTGAACATGC-3' (SEQ ID NO:5) к Smad7 нацелена на сайт 294 мРНК Smad7 человека. Межнуклеозидные связи являются фосфоротиоатными связями.
Антисмысловая ODN последовательность 5'-GTTTGGTCCTGAACAT-3' (SEQ ID NO:6) к Smad7 нацелена на сайт 296 мРНК Smad7 человека.
Антисмысловая ODN последовательность 5'-GTTTGGTCCTGAACATG-3' (SEQ ID NO:7)к Smad7 нацелена на сайт 295 мРНК Smad7 человека.
Антисмысловая ODN последовательность 5'-AGCACCGAGTGCGTGAGC-3' (SEQ ID NO:8) к Smad7 нацелена на сайт 577 мРНК Smad7 человека.
Антисмысловая ODN последовательность 5'-MePAGCACMedCGAGTGMedCGTGAGCMeP-3' (SEQ ID NO:9) к Smad7 нацелена на сайт 577 мРНК Smad7 человека. Этот олигонуклеотид содержит смешанную основную цепь, в которой цитозин в позиции 6 и 12 SEQ ID NO:8 заменяли на 5-метилцитозин. Кроме того, метилфосфонатные связи помещали на концах молекулы.
Антисмысловая ODN последовательность 5'-CGAACATGACCTCCGCAC (SEQ ID NO:10) к Smad7 нацелена на сайт 233 мРНК Smad7 человека.
Антисмысловая ODN последовательность 5'-Me-d CGA АСА TGA CCT CMe-d CG CAC-3' (SEQ ID NO:11) к Smad7 нацелена на сайт 233 мРНК Smad7 человека. Этот олигонуклеотид содержит смешанную основную цепь, в которой цитозин в позиции 1 и 14 SEQ ID NO:10 заменяли на 5-метилцитозин.
Антисмысловая ODN последовательность 5'-GTMe-dCGCCCCTTCTCCCMe-dCGCAG-3' (SEQ ID NO:12) к Smad7 нацелена на сайт 403 мРНК Smad7 человека. Этот олигонуклеотид содержит смешанную основную цепь, в которой цитозин, принадлежащий парам CpG в позиции 3 и 16 SEQ ID NO:1, заменяли на 5-метилцитозин (указанный как Me-dC).
Антисмысловая ODN последовательность 5'-GATCGTTTGGTCCTGAA-3' (SEQ ID NO:13) к Smad7 нацелена на сайт 299 мРНК Smad7 человека.
Антисмысловая ODN последовательность 5'-ATCGTTTGGTCCTGAAC-3' (SEQ ID NO:14) к Smad7 нацелена на сайт 298 мРНК Smad7 человека.
Антисмысловая ODN последовательность MePGTMe-dCGCCCCTTCTCCCMe-dCGCAMePGC (SEQ ID NO:15) к Smad7 нацелена на сайт 403 мРНК Smad7 человека. Этот олигонуклеотид содержит смешанную основную цепь, в которой цитозин, принадлежащий парам CpG в позиции 3 и 16 SEQ ID NO:1, заменяли на 5-метилцитозин (указанный как Me-dC). Кроме того, метилфосфонатные связи помещали на одном из концов олигонуклеотидов и в остатке гуанина в позиции 20.
Индукция колита
Самцов мышей SJL/J в возрасте пять-шесть недель содержали в специальных непатогенных условиях. Для индукции колита 2,5 мг TNBS (pH 1,5-2,0; Sigma-Aldrich) в 50% растворе этанола вводили ректально мышам, находящимся под легким наркозом, через катетер 3,5F. Кончик катетера вводили на 4 см в анальное отверстие проксимально, затем медленно вводили 100 мл жидкости (TNBS/этанол) в толстую кишку.
Для гарантированного распределения TNBS во всей толстой кишке и слепой кишке мышей держали вертикально в течение 30 секунд после инъекции. Для контроля использовали группу таких же мышей, которым вводили чистый 50% раствор этанола тем же способом.
Гистологическая оценка колитов
Ткани, полученные у мышей в указанное время смерти, фиксировали в 10% растворе формалина (Sigma-Aldrich), помещали в парафин, делали срезы и окрашивали с применением гематоксилина и эозина. Окрашенные срезы оценивали на наличие колита с применением различных критериев, таких как присутствие лимфоцитарной инфильтрации, удлинение и/или деформация крипт, выраженность язв, истончение стенок кишечника.
Степень воспаления при микроскопическом исследовании срезов образцов толстой кишки классифицировали от 0 до 4, как представлено.
0: отсутствие видимого воспаления;
1: низкий уровень лимфоцитарной инфильтрации, наблюдаемый в <10% поле зрения под большим увеличением (hpf=поле зрения под большим увеличением), структурных изменений не наблюдается;
2: средняя лимфоцитарная инфильтрация с видимой инфильтрацией в <10-25% hpf, удлинение крипт, истончение стенок кишечника, которое не распространяется на протяжении слизистой оболочки;
3: высокий уровень лимфоцитарной инфильтрации с видимой инфильтрацией в <25-50% hpf, истончение стенок кишечника, которое распространяется на протяжении всей слизистой оболочки;
4: заметная степень лимфоцитарной инфильтрации с видимой инфильтрацией в >50% hpf, высокая сосудистая плотность, удлинение крипт и их деформация, истощение трансмуральных стенок кишечника с изъязвлением.
Выделение мононуклеарных клеток собственной пластинки слизистой оболочки кишечника (LPMC) и обработка клеток антисмысловыми ODN к Smad7
Мононуклеарные клетки собственной пластинки слизистой оболочки кишечника (LPMC) выделяли из срезов толстой кишки. Срезы сначала промывали в среде HBSS, не содержащей магний и кальций (сбалансированный соляной раствор Хэнкса (Sigma-Aldrich), и разрезали на части величиной 0,5 см. Затем их дважды инкубировали, каждый раз по 15 минут в HBSS, содержащем EDTA (0,37 мг/мл) и дитиотреитол (0,145 мг/мл) при 37°C. Затем ткани подвергали действию RMRI, содержащей D коллагеназу (400 ед/мл, Boehringer Mannheim Biochemicals, Indianapolis, IN) и ДНКазу I (0,01 мг/мл, Boehringer Mannheim Biochemicals, Indianapolis, IN), в инкубаторе с постоянным встряхиванием при 37°C.
LPMC, выделенные из тканей, ресуспендировали в 100% Percoll, наслаивали на 40% градиент Percoll (Pharma Biotech AB, Uppsala, Sweden) и центрифугировали при 1800 об/мин в течение 30 минут с получением популяции, обогащенной лимфоцитами.
Для определения эффективности антисмысловых ODN к Smad7 invitro, LPMC, выделенные у мышей, обработанных TNBS, ресуспендировали в RPMI 1640 (Sigma-Aldrich) с добавлением сыворотки, вместо реагента HL-1 (Biowhittaker) с конечным разведением 1×106/мл в 24-луночных плашках. Для трансфекции антисмысловых ODN использовали 2 мкл реагента липофектамина 2000 (LF, Invitrogen Italia SRL, San Giuliano Milanese) на каждый мл клеточной среды в соответствии с методикой. Затем объединяли 2 мкг/мл антисмысловых ODN и LF и оставляли инкубировать в течение 20 минут при комнатной температуре. Затем полученную смесь добавляли непосредственно к клеткам. После культивирования в течение ночи клетки выделяли из лунок плашки для анализа Smad7 Вестерн-блоттом.
Обработка мышей антисмысловыми ODN к Smad7
Через 2 дня после обработки TNBS мышам ректально вводили по 150 мкг антисмысловых или смысловых олигонуклеотидов к Smad7. По крайней мере 5 мышей из группы были исследованы. На пятый день мышей умерщвляли и всю слизистую оболочку кишечника анализировали на содержание Smad7 и Smad3 Вестерн-блоттингом. Кроме того, была проведена общая оценка степени воспаления кишечника.
Экстракция белка и исследование Вестерн-блоттингом
Мононуклеарные клетки собственной пластинки слизистой оболочки кишечника и всю толстую кишку гомогенизировали описанным выше методом. Затем оценивали экспрессию Smad7 посредством Вестерн-блоттинга.
На завершающем этапе пятна удаляли с применением коммерчески доступного раствора (Pierce) и исследовали с помощью антиактиновых антител (Sigma-Aldrich) для проверки того, что в каждой лунке содержится одинаковое количество белка. Определение осуществляли с применением хемилюминесцентного набора (Pierce). Интенсивность полос анализировали на денситометре.
И LPMC, и весь белок толстой кишки анализировали на содержание фосфорилированного и общего белка Smad3 при помощи Вестерн-блоттинга, применяя специфические коммерчески доступные антитела (Santa Cruz).
Для анализа специфического фосфорилированного Smad3 использовали специфические антитела кролика против человека, способные в качестве антигена распознавать фосфорилированные белки Smad2/3 (конечное разведение 1:500), и козлиные антитела против кролика, конъюгированные с пероксидазой хрена (разведение 1:20000). Иммунореактивность белка визуализировали с помощью хемилюминесцентного набора (Pierce).
После определения пятна удаляли с помощью коммерчески доступного раствора (Pierce) и инкубировали со специфическими козлиными антителами против Smad3 человека (конечное разведение 1:500) с последующим применением кроличьих антител против козлиных антител, конъюгированных с пероксидазой хрена (разведение 1:20000); затем иммунореактивность визуализировали с помощью описанного выше набора (Pierce).
Тест ELISA
Количество активного TGF-β1 определяли в образцах слизистой оболочки кишечника. Для этой цели общий белок экстрагировали из образцов слизистой оболочки мышей с или без колита, индуцированного TNBS, как описано выше. Уровни активности TGF-β1 анализировали с помощью коммерчески доступного набора ELISA (R&D Systems, Space Import-Export Srl, Milano). Оптическую плотность измеряли на счетчике ELISA Dynatech MR 5000 при длине волны, равной 490 нм. Данные выражали как пг/100 мкг общего белка.
Результаты
После получения TNBS у мышей развивалась диарея и наблюдалась потеря веса, что служило доказательством индукции колита. Толстая кишка при макроскопическом исследовании была увеличена, и гистологический анализ ее слизистой показал воспалительные поражения от умеренной до тяжелой степени.
Для исследования связи колита, индуцированного TNBS, с изменением продукции TGF-β1 у мышей с или без колитов брали образцы толстой кишки и исследовали на уровень активности TGF-β1 при помощи ELISA.
Так как некоторые типы клеток могут синтезировать TGF-β1 и присутствуют в желудочно-кишечном тракте, этот факт использовался для оценки слизистой оболочки кишечника в целом, а не только LPMC.
В отсутствие колитов определяли низкий уровень активности TGF-β1 (85±12 и 94±26 пг/мкг общего белка в нестимулированной и контрольной группах мышей соответственно). Значительное повышение уровней TGF-β1 отмечали в образцах слизистой оболочки мышей с индуцированным TNBS колитом (985±120 пг/мкг общего белка) (р<0,01). Несмотря на то, что этот результат предполагает, что в процессе индукции TNBS колита активность TGF-β1 может повышаться, анализ внутриклеточных уровней активности Smad3 в кишечных LPMC, выделенных у мышей с колитом, неожиданно показал снижение фосфорилирования Smad3, что связано с индукцией Smad7 (фиг. 2 и 3). В частности, на фигуре 2 показано наличие полосы, соответствующей активности (фосфорилированных) Smad2/3 в LPMC, выделенных из кишечника мышей, не подвергнутых индукции TNBS, а не у мышей с индуцированным TNBS колитом. На фигуре 3 показано, что две полосы ниже 47 кДа, что соответствует свободной Smad7, и выше 102 кДа, что соответствует TGF-β1, комплекс R-Smad7 присутствует только в образцах LPMC, выделенных из кишечника мышей с колитом, индуцированным TNBS. Эти данные указывают, что локальное воспаление стимулирует синтез TGF-β1, который, несмотря на это, не способен подавлять воспаление слизистой оболочки.
В соответствии с настоящим изобретением оценивалось, может ли обработка мышей с колитом, индуцированным TNBS, антисмысловыми ODN к Smad7 восстановить эндогенную функцию TGF-β1 и ограничить распространение воспаления.
Во-первых, была протестирована эффективность описанных выше антисмысловых ODN к Smad7 (SEQ ID NO:1 и SEQ ID NO:4-15) для понижения экспрессии Smad7 как в in vitro, так и в in vivo экспериментах.
Что касается экспериментов in vitro, LPMC, выделенные из кишечника мышей с колитами, индуцированными TNBS, были трансфицированы антисмысловыми ODN к Smad7 и их инкубировали в течение ночи. Анализ Smad7 осуществляли с помощью Вестерн-блоттинга.
Что касается экспериментов in vivo, мышам, обработанным TNBS, вводили антисмысловые ODN к Smad7 и через 3 дня животных умерщвляли, брали у них образцы тканей и проводили анализ Smad7 с помощью Вестерн-блоттинга.
В таблице 4 суммированы результаты этих экспериментов и показан процент ингибирования, полученный при введении каждого антисмыслового олигонуклеотида к Smad7 как в in vitro, так и в in vivo экспериментах. Данные указывают среднее ± стандартное отклонение (SEM) в четырех независимых экспериментах in vitro и среднее ± SEM в пяти независимых экспериментах in vivo.
(5'→3')
in vivo
Все антисмысловые ODN эффективно снижали экспрессию Smad7 при трансфекции in vitro в LPMC, выделенных из мышей, обработанных TNBS. Из анализа процентной величины ингибирования, приведенной в таблице 4, видно, что антисмысловые олигонуклеотидные последовательности SEQ ID NO:4, 10, 11, 12 и 15 показали большую эффективность.
Однако процентная величина ингибирования экспрессии Smad7, полученная при in vivo обработке олигонуклеотидными последовательностями SEQ ID NO:10 и 11, не имеет значительного отличия от данных in vitro экспериментов.
Напротив, обработка мышей антисмысловыми ODN SEQ ID NO:4, 12 и 15 дала более высокий процент ингибирования Smad7 по сравнению с ингибированием, полученным в in vitro экспериментах, что составляет 55% в сравнении с 34%, 42% в сравнении с 32% и 56% в сравнении с 34% соответственно (р<0,01).
Наоборот, у мышей, обработанных антисмысловыми олигонуклеотидами SEQ ID NO:7, происходило уменьшение экспрессии Smad7 in vivo, которая имела уровень ниже, чем уровень, полученный в результате трансфекции антисмысловых олигонуклеотидов в LPMC in vitro, что составляет 10% в сравнении с 17%, р<0,01.
Обобщая эти результаты, можно сделать вывод, что только специфическая модификация в антисмысловые ODN последовательности к Smad7 способна улучшить фармакокинетический, биохимический и биофизический профили.
Не было задокументировано ни одного проявления острой токсичности у мышей, получавших антисмысловые олигонуклеотиды (SEQ ID NO:1 и SEQ ID NO:4-15). Одна особь из 5, обработанных TNBS, умерла через 3 дня (20%). Аналогичным образом, 1 из 5 мышей, получавших смысловые олигонуклеотиды к Smad7, умерла через 4 дня.
В группе мышей, обработанных антисмысловыми ODN к Smad7 SEQ ID NO:1 и SEQ ID NO:4-15, не было задокументировано ни одного смертельного случая.
Применение антисмысловых ODN последовательностей SEQ ID NO:13 и SEQ ID NO:14 связано с приемлемой in vitro активностью ингибирования (11% и 9,5% соответственно). Однако введение in vivo таких последовательностей неожиданно привело к значительному усугублению колитов, что и явилось причиной гибели всех мышей через 72 часа после обработки.
Макроскопическое исследование образцов, выделенных из кишечника этих мышей, показало наличие тяжелой формы колита, что было связано со значительным уменьшением экспрессии Smad7 в кишечнике.
Как указано выше, были проведены тесты антисмысловых ODN на эффективность ограничения распространения воспаления. Для этой цели мышам после индукции колита вводили антисмысловые олигонуклеотиды SEQ ID NO:1, 4, 5 и 15, пяти животным в каждой группе.
Последующая обработка антисмысловыми ODN к Smad7 привела к уменьшению воспаления слизистой оболочки. Наиболее очевидным этот результат был у мышей, обработанных антисмысловыми олигонуклеотидами 4 и 15. Действительно, у мышей с тяжелыми колитами 3-4 степени, которым не вводили антисмысловые олигонуклеотиды, тяжесть заболевания уменьшилась до 2 или 3 степени после введения антисмысловых олигонуклеотидных последовательностей 1 или 5 соответственно, в то время как у мышей, которым вводили олигонуклеотидные последовательности 4 или 15, воспаление не превышало первой степени.
Для исследования возможности антисмысловых олигонуклеотидов к Smad7 быть столь же эффективными также и при оральном введении мыши с колитом, индуцированным TNBS, были обработаны антисмысловыми олигонуклеотидами к Smad7 4 или 15, или контрольными (смысловыми) через день после индукции колитов.
Для этой цели олигонуклеотиды ресуспендировали в растворе бикарбоната. Конечный объем раствора, введенного каждой мыши, составлял 350 мкл и содержал дозы олигонуклеотидов, эквивалентные 250, 500 или 1000 мкг. Такой раствор вводили per os через катетер.
На пятый день мышей умерщвляли и анализировали экспрессию Smad7 и степень воспаления, как описано в предшествующих абзацах. Все мыши, получившие антисмысловые олигонуклеотиды и не получившие контрольные смысловые олигонуклеотиды, показали значительное уменьшение экспрессии Smad7 и понижение фосфорилирования Smad3 независимо от дозы олигонуклеотидов, которая использовалась.
Действительно, ингибирование Smad7 было связано с восстановлением веса, как показано на фиг.4. На фигуре 4 показан график, демонстрирующий изменения в весе мышей с колитом, индуцированным TNBS, обработанных и не обработанных антисмысловыми олигонуклеотидами к Smad7 (SEQ ID NO:15) или контрольными (смысловыми олигонуклеотидами). И те, и другие олигонуклеотиды вводили per os в дозе 250 мкг через катетер через 2 дня после индукции колита. После введения TNBS, индуцирующих колит, у мышей была отмечена потеря веса в каждой из трех групп. В дальнейшем это было подтверждено тем, что, начиная с четвертого дня, у мышей, обработанных антисмысловыми олигонуклеотидами к Smad7, но не у контрольных, наблюдалось восстановление веса. Явное и быстрое восстановление было отмечено на пятый день у мышей с колитом, индуцированным TNBS, учитывая, что 21,4% мышей с колитом умерли на четвертый день, следовательно, они не принимались в расчет при проведении оценки массы тела на пятый день.
Ингибирование Smad7 было коррелированно со значительным подавлением воспаления тканей, как показано на фиг.5 и 6. На фигуре 5 показано изображение толстой кишки, выделенной у мышей с TNBS-колитами, не обработанными, и с TNBS-колитами, обработанными антисмысловыми олигонуклеотидами к Smad7 (SEQ ID NO:15). Олигонуклеотиды вводили per os в дозе 250 мкг через катетер, через 2 дня после индукции колитов. Было выявлено, что толстая кишка мышей с TNBS-колитами имеет более высокую степень воспаления, укорочена и утончена. И наоборот, толстая кишка мышей, получавших антисмысловые олигонуклеотиды к Smad7, имела нормальную длину и толщину толстой кишки, и в ней отсутствовали макроскопические признаки воспаления. На фигуре 6 представлена гистологическая картина части толстой кишки мыши без колита или мыши с колитом, вызванном TNBS, обработанной или не обработанной антисмысловыми олигонуклеотидами к Smad7 (SEQ ID NO:15) или контрольными (смысловыми олигонуклеотидами). И те, и другие олигонуклеотиды вводили в дозе 250 мкг через катетер через 2 дня после индукции колитов. Было выявлено, что мышь без колита имела нормальные, однородные пейеровы бляшки и однородную с нормальным содержанием муциновых клеток и воспалительными элементами собственную пластинку слизистой оболочки. Наоборот, толстая кишка мышей, обработанных TNBS, получавших или не получавших контрольные олигонуклеотиды, имела полное разрушение структуры, железистой ткани, инфильтрацию клеток слизистой и большого количества воспаленных элементов в собственной пластинке слизистой оболочки кишечника (lamina propria). Наоборот, в толстой кишке мышей, обработанных TNBS и получавших антисмысловые олигонуклеотиды к Smad7, железистая структура находилась в нормальном состоянии, и воспаление также отсутствовало.
Вместе эти исследования предполагают применение антисмысловых ODN, показавших более высокую эффективность ингибирования Smad7, сопровождавшихся отсутствием побочных эффектов, введенных in vivo, что может представлять перспективную терапевтическую стратегию для контроля над воспалением слизистой оболочки при ВЗПТ, конкретно, такие характеристики, как эффективность и токсичность, сравнивали с результатами, полученными при применении других антисмысловых ODN последовательностей с той же самой эффективностью ингибирования Smad7 in vitro.
Библиография
- Podolsky O.K., N. Engl. J. Med., 2002 Ago; Vol. 347: No 6.
- Seegers D., et al. Aliment. Pharmacol. Ther., 2002; Vol. 16: 53-58.
- Sandborn J., et al. Gastroenterology, 2002 Mag; Vol. 122: No 6.
- Fiocchi C., J. Clin. Invest., 2001 Ago; Vol. 108: 523-526.
- Powrie F., et al. JExp Med 1996; 183: 2669-2674.
- Neurath M.F., et al. J Exp Med 1996; 183: 2605-2616.
- Ludviksson B.R., et al. J Immunol 1997; 159: 3622-3628.
- Shull M.M., et al. Nature 1992; 359; 693-699.
- Christ M., et al J Immunol 1994; 153; 1936-1946.
- Hahm K.B., et al. Gut. 2001; 49:190-198.
- Gorelik L., et al, Immunity 2000; 12: 171-181.
- Heldin C-H., et al. Nature 1997; 390: 465-471.
- Yang X., et al. Embo J 1999; 18: 1280-1291.
- Hayashi H., et al. Cell 1997; 89: 1165-1173.
- Lawrance IC., et al, Inflamm Bowel Dis 2001; 7:16-26.
- Monteleone G., et al. J. Clin. Invest., 2001 Giu; Vol. 108:601-609.
- Boirivant M., et al. Gastroenterology 1999; 116: 557-565.
- Han SH., et al. J Pharmacol Exp Ther. 1998; 287:1105-12.
- Arsura M., et al. Immunity 1996; 5: 31-40.
- Brevetto statunitense US 6,159,697.
- Maggi A., Biotecnologie Farmacologiche, 1998; Gap.8: 125-131.
- Agrawai S., Molecular Medicine Today, 2002; Vol. 6: 72-81.
- Neurath M., Fuss I., Strober W., Int Rev Immunol., 2000; Vol. 19: 51-62.
- Lesiak K., et al., Bioconjugate Chem., 1993; Vol. 4: 467.
- Xiao W., et al. Antisense Nucleic Acid Drug Dev., 1996; Vol. 6: 247-258.
- Sanghvi et al, Nucleic Acids Research, 1993; Vol. 21: 3197-3203.
- Maier MA., et al. Org Lett., 2002; Vol. 2: 1819-1822.
- Guerlavais Т., et al. Anal Bioanal Chem., 2002; Vol. 374: 57-63.
- Ragas J.A., et al. Analyst, 2000; Vol.125: 575-581.







| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ДИАБЕТА И/ИЛИ УЛУЧШЕНИЯ ВЫЖИВАНИЯ ПАНКРЕАТИЧЕСКИХ ОСТРОВКОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ | 2013 |
|
RU2667960C2 |
| СПОСОБЫ ЛЕЧЕНИЯ КОЛОРЕКТАЛЬНОГО РАКА | 2014 |
|
RU2674147C2 |
| АНТИСМЫСЛОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2009 |
|
RU2739302C2 |
| АНТИСМЫСЛОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2009 |
|
RU2593939C2 |
| СПОСОБЫ КОНТРОЛЯ ВОСПРИИМЧИВОСТИ АНТИ-SMAD7 ТЕРАПИИ | 2012 |
|
RU2678450C2 |
| ИНГИБИТОРЫ ПЕРЕДАЧИ СИГНАЛА ТРАНСФОРМИРУЮЩИХ ФАКТОРОВ РОСТА (TGF-R) ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2005 |
|
RU2385933C2 |
| ЖЕЛУДОЧНО-КИШЕЧНЫЙ ПРОЛИФЕРАТИВНЫЙ ФАКТОР И ЕГО ПРИМЕНЕНИЯ | 2005 |
|
RU2343158C2 |
| ПРОФИЛАКТИЧЕСКИЙ ИЛИ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА | 2011 |
|
RU2583290C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ КИШЕЧНИКА | 2006 |
|
RU2418594C2 |
| УЛУЧШЕННЫЕ СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЗАЖИВЛЕНИЯ РАН | 2007 |
|
RU2542471C2 |





Изобретение относится к области молекулярной биологии и может быть использовано в медицине. Получены химически модифицированные антисмысловые олигонуклеотиды (ODN), направленные на сайт 403 мРНК Smad7, которые отличаются тем, что in vivo демонстрируют существенно более высокие уровни биологической (ингибиторной) активности, чем в системе in vitro, и при этом не обнаруживают явных побочных эффектов. Предлагается использовать новые модифицированные формы ODN к Smad7 в качестве терапевтических агентов, в частности при лечении хронических воспалительных заболеваний пищеварительного тракта, таких как болезнь Крона и язвенные колиты. 3 н. и 3 з.п. ф-лы, 6 ил., 4 табл.
5'-MeP-GTMe-dCGCCCCTTCTCCCMe-dCGCAMeP-G-3',
5'-GTMe-dCGCCCCTTCTCCCMe-dCGCAG-3' или
5'-MeP-GTMe-dCGCCCCTTCTCCCMe-dCGCAMeP-GC-3',
где Me-dC обозначает 5-метил-2'-дезоксицитидин-5'-монофосфат, a MeP-G обозначает 2'-дезоксигуанозинметилфосфонат.
| US 6159697 А, 12.12.2000 | |||
| MONTELEONE G | |||
| et al | |||
| J.Clin | |||
| Invest., 108 (4), 601-609, 2001. |
Авторы
Даты
2008-11-27—Публикация
2004-03-08—Подача