Настоящее изобретение относится к применению олигонуклеотидов для изготовления фармацевтической композиции для предупреждения или лечения заболевания, где нейрогенез и/или нейрорегенерация имеют полезный эффект, в частности нейродегенеративного заболевания типа болезни Альцгеймера, болезни Паркинсона, включая мультисистемную атрофию, прогрессирующего супрануклеарного паралича, кортикобазальной дегенерации, деменции с тельцами Леви, бокового амиотрофического склероза и других расстройств двигательных нейронов, болезни Гентингтона, спиномозжечковых атрофий, болезни Крейтцфельда-Якоба и других тяжелых прионных заболеваний, лобно-височной деменции, включая болезнь Пика, комплекса СПИД-деменция, болезни Халлервордена-Шпатца, болезни Гентингтона, цереброваскулярного заболевания типа сосудистой деменции, инсульта, травмы головного мозга и повреждения спинного мозга, пигментного ретинита, дегенерации желтого пятна, глаукомы, депрессии и шизофрении и расстройств развития типа синдрома Дауна.
Ряд тяжелых нейродегенеративных заболеваний имеет серьезное социоэкономическое влияние в современном обществе, например расстройства типа болезни Альцгеймера, расстройства развития с деменцией (типа синдрома Дауна), болезнь Паркинсона, деменция с тельцами Леви, лобно-височная деменция, болезнь Пика, боковой амиотрофический склероз, спиномозжечковые атрофии, болезнь Крейтцфельда-Якоба, комплекс СПИД-деменция, сосудистая деменция, прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация, мультисистемная атрофия, болезнь Гентингтона, инсульт, травма головного мозга, пигментный ретинит, дегенерация желтого пятна, глаукома, депрессия, шизофрения и рассеянный склероз. Общую патофизиологическую причину обнаруживают в генетических, эпигенетических или приобретенных дефектах, часто приводящих к образованию агрегатов или накоплению продуктов распада клеток, в итоге приводящих к прогрессирующей дисфункции и, наконец, к гибели нейронов или глиальных клеток и структурной дезинтеграции. Микроглиоциты и периваскулярные покоящиеся макрофаги привлекаются и активируются, пытаясь очистить продукты распада клеток и тканей. Это может происходить за очень короткий промежуток времени, как при болезни Крейтцфельда-Якоба, или на протяжении десятилетий, как, например, при болезни Паркинсона или рассеянном склерозе. Активированные популяции микроглиальных клеток/макрофагов высвобождают во внеклеточный матрикс множество воспалительных цитокинов, которые поступают или в малые венулы, или в пространство спинномозговой жидкости (СМЖ). К сожалению, нейрогенез и нейрорегенерация, которые могли бы оказывать полезное воздействие на клиническое течение этих заболеваний, описанных выше (несмотря на их индивидуальные специфические патофизиологические механизмы), подавляются пока неизвестными механизмами. Таким образом, техническая задача, лежащая в основе настоящего изобретения, заключается в том, чтобы предложить средства, подходящие для лечения или предупреждения нейродегенеративных расстройств или по меньшей мере симптомов, ассоциированных с указанными расстройствами, путем воспрепятствования подавлению нейрогенеза и нейрорегенерации.
Решение указанной технической задачи достигается путем предложения воплощений, охарактеризованных в формуле изобретения. Известно, что семейство белков TGF-бета (трансформирующий фактор роста бета), а именно TGF-бета1, TGF-бета2 и TGF-бета3 с их специфичными рецепторами клеточной поверхности TGF-RI, TGF-RII, TGF-RIII, действуют на несколько решающих аспектов развития эмбриональных и, главным образом, мезенхимных/нейроэктодермальных органов. Они позволяют эмбриональным стволовым клеткам дифференцироваться в клетки-предшественники нейронов и являются нейропротекторными для поврежденных зрелых нейронов. Дополнительно известно, что они имеют критическое влияние на дифференциацию гематопоэтических стволовых клеток, контролируя пролиферацию и также дифференциацию. Во время экспериментов, приводящих к настоящему изобретению, обнаружили, что TGF-R, а именно TGF-RI и TGF-RII, являются решающими факторами, вовлеченными в подавление нейрогенеза и нейрорегенерации, и соответственно соединение, которое способно препятствовать данной биологической активности TGF-RI или TGF-RII, является полезным для лечения/предупреждения нейродегенеративных расстройств и/или нейровоспалительных расстройств.
Подводя итог, в результате экспериментов, приводящих к настоящему изобретению:
1. Распознали физиологическую регуляторную цепь, которая отвечает за уровень эффективной регенерации ЦНС клетками-предшественниками/стволовыми клетками, несмотря на то что, конечно, были известны индивидуальные компоненты (TGF-β, TGF-RII, компартмент спинномозговой жидкости, стекловидное тело, эндолимфатическая жидкость, клетки-предшественники нейронов и другие). Эта цепь с ключевой молекулой-мишенью TGF-RII, экспрессируемой на вентрикулярной стенке, отвечает за нефункционирующую нейрорегенерацию в большинстве патологий ЦНС.
2. Интересно, что регуляция имеет место не через кровь, лимфатическую систему или внеклеточный матрикс, а через компартменты с жидкостью (спинномозговой жидкостью и другими), которые имеют непосредственный контакт с нейронными клетками и их предшественниками или стволовыми клетками.
3. Обнаружили физиологически ингибиторную цепь нейронального/олигодендроглиального или астроцитного обновления как идеальную мишень для стратегий регенерации повреждений в ЦНС, в подавляющем большинстве случаев применимую практически ко всем деструктивным патологиям в нервной системе. Из предыдущих знаний о TGF-β пытались скорее увеличить, а не уменьшить (смотри 5) функцию TGF-β для того, чтобы повысить его известную нейропротекторную или иммуносупрессорную активности в ЦНС: здесь авторы изобретения предполагают снижение его ингибиторной функции по обновлению стволовых клеток путем блокирования передачи сигнала TGF-RII на вентрикулярной стенке.
4. Несмотря на то что в течение долгого времени предполагали, что воспалительные процессы играют важную роль в нейродегенерации, и относительно большое количество доклинических и клинических данных, по-видимому, поддерживает эту идею, в настоящем изобретении раскрывается главная цепь, которая организует все одиночные регуляторные подцепи, например, с участием цитокинов (интерлейкинов IL-1, IL-6, IL-12) и других.
5. Кроме того, можно было бы отметить, что природа установила нейропротективное действие и иммунопривилегированную ЦНС в приоритетное положение перед нейрорегенерацией: до сих пор не было показано, что иммунопривилегированная и в высокой степени защищенная ЦНС (специфически защищенная против иммунных атак и нейронального апоптоза), что в значительной части обусловлено системой TGF-β, имеет недостатки в нейрорегенерации, обусловленные именно этой привилегией и благодаря той же самой молекуле TGF-β. Эволюционная концепция, по-видимому, приводит доводы в пользу сильной нейропротекции чрезвычайно сложной ЦНС и ее наиболее сложного функционирования; в данном контексте отдельная нейрорегенерация кажется менее важной для эволюции, чем нейропротективное действие в отношении индивидуума.
Регуляторная цепь
Физиологически нейрогенез головного мозга делает возможным непрерывное восстановление/замещение неправильно работающих или стареющих нейронных, олигодендроглиальных или астроцитных клеток соответствующими клетками-предшественниками. Нейрогенез для восстановления в головном мозге регулируется системой TGF-β-TGF-R (особенно TGF-RII, но также и TGF-RI) через спинномозговую жидкость; главными организаторами являются линии микроглиальных клеток/макрофагов, продуцирующие TGF-β и секретирующие его через внеклеточное пространство в компартмент СМЖ (а также в стекловидное тело, эндолимфатическую систему), и клетки-предшественники нейронов/стволовые клетки, которые получают этот сигнал через СМЖ (а также в стекловидное тело, эндолимфатическую систему) посредством TGF-RII или TGF-RI, высокоэкспрессируемых на их поверхностных структурах, или на эпендимной выстилке с идентичными рецепторами. При большинстве патологий ЦНС нейрогенез сильно ослаблен или функционирует неправильно. Регуляция нейрогенеза корректируется, обычно подавляется (!), активацией микроглиальных клеток/макрофагов в ЦНС, что имеет место в контексте любой специфической болезненной патологии. Микроглиальные клетки/макрофаги, активированные по этому пути, от СМЖ до субвентрикулярной зоны/других нейрогенных зон, подавляют регенерацию нейродегенерирующей, острой и хронической воспалительной, гипоксической, атеросклеротической или стареющей мозговой паренхимы. Подвергается воздействию не только дифференцировка нейронов, но также и линии олигодендроглиальных и астроцитных клеток. Все молекулы, которые препятствуют этой цепи, чтобы улучшить нейрональную/олигодендроглиальную/астроцитную регенерацию, заявлены в качестве средства для лечения. Способы диагностики, профилактики, предупреждения или прогноза патологии ЦНС, использующие эту цепь, также являются очень важными, вероятно для мониторинга эффектов терапевтического воздействия.
Краткое описание графических материалов
Фиг.1: TGF-бета1 ингибирует пролиферацию нервных стволовых клеток и клеток-предшественников взрослых грызунов
А) Культуры нервных стволовых клеток и клеток-предшественников взрослых грызунов (NSC) обрабатывали различными концентрациями (0, 5, 10, 50 нг/мл) рекомбинантного человеческого TGF-бета1 в течение 7 суток. На 7-е сутки жизнеспособные клетки подсчитывали в гемоцитометре путем анализа исключения трипанового синего. Данные выражали в виде средних значений числа клеток ± стандартные отклонения (SD) из трех экспериментов, проведенных с тройной повторностью. Б) Показывает эффект TGF-бета1 на человеческие эмбриональные нервные клетки-предшественники.
Фиг.2: Эффект TGF-бета1 на NSC является обратимым
Культуры нервных стволовых клеток и клеток-предшественников взрослых грызунов обрабатывали 10 нг/мл рекомбинантного человеческого TGF-бета1 в течение 7 суток. На 7-е сутки клетки отделяли, подсчитывали путем анализа исключения трипанового синего и предварительно обработанные TGF-бета1 клетки пересевали в присутствии или в отсутствие 10 нг/мл TGF-бета1. Эту процедуру проводили каждые 7 суток. Данные выражали в виде средних значений числа клеток ± SD из трех экспериментов, проведенных с тройной повторностью.
Фиг.3: Антитела против TGF-бетаRII могут снизить эффекты TGF-бета1 на NSC взрослых грызунов
Культуры NSC взрослых грызунов обрабатывали 10 нг/мл рекомбинантного человеческого TGF-бета1 в течение 7 суток в присутствии или в отсутствие анти-TGF-бетаRII антитела (10 мкг/мл). На 7-е сутки жизнеспособные клетки подсчитывали в гемоцитометре путем анализа исключения трипанового синего. Данные выражали в виде средних значений числа клеток ± SD из трех экспериментов, проведенных с тройной повторностью.
Фиг.4: Растворимый TGF-RII ингибирует TGF-β1-индуцированное подавление пролиферации NSC
Культуры NSC взрослых грызунов обрабатывали 10 нг/мл рекомбинантного человеческого TGF-бета1 в течение 7 суток в присутствии или в отсутствие растворимого анти-TGF-бетаRII (500 нг/мл). На 7-е сутки жизнеспособные клетки подсчитывали в гемоцитометре путем анализа исключения трипанового синего. Данные выражали в виде средних значений ± SD из трех экспериментов, проведенных с тройной повторностью.
Фиг.5: TGF-βRII-экспрессирующие клетки могут быть выделены с использованием методик сортировки клеток
NSC взрослых грызунов получали, как описано в примере 1. Клетки, экспрессирующие TGF-βRII, очищали, используя антитела против TGF-βRII. Примерно 20% NSC экспрессируют рецептор, и эту популяцию клеток можно обогатить при помощи данного подхода.
Фиг.6: Антисмысловые олигонуклеотиды против TGF-βRII ингибируют TGF-β1-индуцированную негативную регуляцию пролиферации in vitro зрелых нервных стволовых клеток и клеток-предшественников
Показали, что TGF-β1-индуцированное ингибирование пролиферации нервных стволовых клеток и клеток-предшественников полностью и специфически блокировалось посредством антисмысловой обработки.
Фиг.7: Обработка in vivo специфическими к TGF-RII антисмысловыми олигонуклеотидами избавляет от TGF-β1-индуцированной блокады пролиферации клеток в головном мозге взрослых особей
Фиг.7 демонстрирует TGF-β1-индуцированную негативную регуляцию пролиферации клеток в зубчатой извилине гиппокампа (фиг.7А) и в субвентрикулярной зоне (фиг.7Б). Обработка миссенс-олигонуклеотидом не блокировала этот эффект, тогда как обработка антисмысловым олигонуклеотидом блокировала эффект TGF-β1 (фиг.7А и Б).
Фиг.8: Обработка in vivo специфическими к TGF-RII антисмысловыми олигонуклеотидами предотвращает TGF-β1-индуцированную блокаду пролиферации клеток в головном мозге взрослых особей
Фиг.8 демонстрирует, что TGF-β1-индуцированную негативную регуляцию пролиферации клеток в зубчатой извилине гиппокампа (фиг.8А) и в субвентрикулярной зоне (фиг.8Б) можно предотвратить путем предварительной обработки TGF-βRII антисмысловым олигонуклеотидом.
При расстройствах, описанных выше, микроглиальные клетки и потенциально периваскулярные покоящиеся макрофаги привлекаются от белковых агрегатов, продуктов распада клеток, воспаления, воспалительной реакции при атеросклерозе или клеточной гибели, ассоциированной с острой травмой/гипоксией. Это может быть острым, подострым или хроническим процессом. Во время процесса активации популяция активированных микроглиальных клеток (включая макрофаги из стенки сосудов или других источников) высвобождает во внеклеточный матрикс множество воспалительных цитокинов, которые поступают или в малые венулы, или непосредственно в пространство СМЖ. Эти цитокины будут достигать компартмента СМЖ и будут непосредственно доступны во всех местах, которые до некоторой степени окружены СМЖ. TGF-бета находится среди этих цитокинов. Было продемонстрировано (Monje, M.L., H.Toda, et al. (2003). «Inflammatory blockade restores adult hippocampal neurogenesis». Science 302 (5651): 1760-1765), что нейровоспаление ингибирует нейрогенез, и что блокада воспаления индометацином, распространенным нестероидным противовоспалительным лекарством, восстанавливает нейрогенез после воспаления, индуцированного эндотоксином, и усиливает нейрогенез после облучения головы.
Однако предшествующий уровень техники не раскрывает TGF-бета в качестве главного регулятора, осуществляющего негативную регуляцию нейрогенеза и восстановление нейронов после повреждения или при патологических условиях. Напротив, в предшествующем уровне техники TGF-бета рассматривали в качестве нейропротекторного агента, предотвращающего поврежденные или пораженные нейроны от клеточной гибели, и пытались осуществлять позитивную регуляцию TGF-бета в условиях заболеваний ЦНС.
Zhang et al. (Zhang, J.M., R.Hoffmann, et al. (1997). «Mitogenic and antiproliferative signals for neural crest cells and the neurogenic action of TGF-beta1». Dev. Dyn. 208(3): 375-386) демонстрируют, что TGF-бета имеет эффект на развивающиеся клетки ганглионарной пластинки куропатки. Здесь TGF-бета ингибировал пролиферацию как полипотентных клеток ганглионарной пластинки (и/или их непосредственных производных), так и коммитированных меланогенных клеток, вызывая уменьшение размера колоний. Кроме того, и в противоположность настоящему изобретению, нейрогенез значительно возрастал в присутствии TGF-бета. В нейробласт-позитивных колониях, обработанных TGF-бета, увеличивалось число клеток на колонию как в случае адренергических клеток, так и в случае предшественников сенсорных нейронов.
TGF-бета играют важную роль в росте и дифференцировке клеток, развитии органов, образовании матрикса, заживлении ран и иммунной функции. В то время как TGF-бета представляет собой сильнодействующее вещество, ингибирующее рост многих типов клеток, он стимулирует пролиферацию фибробластов и остеобластов. Он также является сильнодействующим стимулятором образования внеклеточного матрикса фибробластами и остеобластами, ингибирует деградацию матрикса и осуществляет позитивную регуляцию рецепторов для взаимодействия матрикса. TGF-бета1 подразумевали в качестве ключевого причинного фактора в патогенезе фиброза печени и по меньшей мере в качестве одного из решающих посредников как полезных, так и вредных эффектов циклоспорина А на иммунную систему и почки. Кроме того, было показано, что различные хронические прогрессирующие фиброзные расстройства почек у человека и экспериментальных моделей ассоциированы со стимуляцией системы TGF-бета.
TGF-бета1 осуществляет негативную регуляцию циклин-зависимых киназ G1 и G2 и циклинов в показателях как киназной активности, так и количества белка. TGF-бета1 также ингибирует фосфорилирование продукта супрессорного гена ретинобластомной опухоли pRb по множественным остаткам серина и треонина в человеческих клетках миелоидного лейкоза. Неполностью фосфорилированный pRb связывается с фактором транскрипции E2F-4 в фазе G1, тогда как фосфорилированный pRb главным образом связывается с E2F-1 и E2F-3. Так как TGF-бета1 осуществляет позитивную регуляцию образования комплекса р130(член семейства pRb)/E2F-4 и негативную регуляцию образования комплекса р107(член семейства pRb)/E2F-4 при сохраняющемся постоянным уровне E2F-4, эти результаты свидетельствуют, что E2F-4 переключается от р107 на pRb и р130, когда клетки выходят из клеточного цикла и задерживаются в фазе G1 под действием TGF-бета1. «Cdk ингибитор» (ингибитор циклин-зависимой киназы) р27 представляет собой как положительный, так и отрицательный регулятор контроля клеточного цикла, опосредованного TGF-бета1. Несмотря на то, что сообщали, что TGF-бета1 является избирательным ингибитором нормальных зародышевых гематопоэтических стволовых клеток, TGF-бета ингибирует и зародышевые, и более дифференцированные клеточные линии миелоидного лейкоза. Наибольшее внимание было обращено на нейропротекторную активность TGF-бета1, его роль в развитии нервной ткани и на его роль в модуляции иммунных ответов. Во многих исследованиях было показано, что TGF-бета1 является нейропротекторным in vitro и in vivo. Исследования с агонистами продемонстрировали, что TGF-бета1 уменьшает гибель нейронов и размер инфаркта вследствие окклюзии средней мозговой артерии (МСАО), тогда как, напротив, исследования с антагонистами показали повышенные гибель нейронов и размер инфаркта после МСАО, подтверждая, что TGF-бета1 имеет нейропротекторную роль при ишемии мозга. Недавняя работа по сверхэкспрессии TGF-бета1, опосредованной аденовирусами, in vivo у мышей дополнительно подразумевала нейропротекторную роль TGF-бета1 при ишемии мозга, что подтверждено уменьшением гибели нейронов, размера инфаркта и неврологических последствий. Дополнительно, многочисленные исследования in vitro документально подтвердили нейропротекторную способность TGF-бета1 в нейронах у множества видов, включая крыс, мышей, цыплят и человека. Весьма интересно то, что TGF-бета1, как было показано, является защитным против широкого разнообразия вызывающих гибель агентов/факторов, включая гипоксию/ишемию, глутаматную эксайтотоксичность, бета-амилоидное окислительное повреждение и вирус иммунодефицита человека. Нейропротекторный эффект TGF-бета1 связывали с его способностью поддерживать мембранный потенциал митохондрий, стабилизировать гомеостаз Са2+, увеличивать экспрессию антиапоптических белков Bcl-2 и Bcl-xI, ингибировать активацию каспазы-3 и индуцировать ингибитор-1 активатора плазминогена. Исследования по эмбриональным стволовым клеткам продемонстрировали, что зародышевая нервная стволовая клетка является компонентом точного определения направления дифференцировки нервов, которое отрицательно регулируется путем передачи сигнала, связанной с TGF-бета. Было показано, что эндогенная экспрессия TGF-альфа, другого члена семейства TGF, положительно регулирует нейрогенез у взрослых. TGF-альфа необходим для полной пролиферации клеток-предшественников, присутствующих в субэпендиме, и для полного образования нейронных предшественников, которые мигрируют в обонятельную луковицу. У нокаутированных по TGF-альфа мышей пролиферация этих клеток-предшественников также уменьшается с возрастом, вероятно из-за удлинения клеточного цикла. Старение или отсутствие эндогенного TGF-альфа не оказывает влияния на число нервных стволовых клеток, выделенных in vitro в присутствии эпидермального фактора роста.
Применение TGF-бета для иммуномодуляции у людей строго ограничено его токсичностью, включая избыточную стимуляцию образования матрикса, нефротоксичность и другие вредные эффекты. TGF-бета имеет онкогенный потенциал, и подразумевали, что он вовлечен в гломерулопатии, фиброз легких, склеродермию и хроническую болезнь «трансплантат против хозяина». Кроме того, в то время как TGF-бета является крайне сильнодействующим иммунодепрессивным цитокином, несколько линий доказательств показывают, что хроническая стимуляция экспрессии TGF-бета, как связанная с заболеванием, так и у трансгенных животных моделей, парадоксальным образом может приводить к аутоиммунному воспалению или усиливать его.
Имеется возрастающее число доказательств, что сильные противовоспалительные свойства TGF-бета в качестве отрицательного регулятора Т-клеточного иммунного ответа играют ключевую роль в патофизиологии множества патологий ЦНС. Следовательно, данный цитокин рассматривают как связанный с повреждением пептид и потенциальную мишень для терапевтического воздействия. Нейровоспаление и микроглиальная патология ассоциированы со многими неврологическими заболеваниями. Здесь наиболее классическими заболеваниями, очевидно, являются нейроиммунологические заболевания, такие как рассеянный склероз. Но они также включают заболевания познавательной способности, при которых потеря памяти является заметным признаком, такие как болезнь Альцгеймера, деменция с тельцами Леви, комплекс СПИД-деменция, сосудистая деменция, или менее заметным признаком, такие как болезнь Пика, прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация и болезнь Крейтцфельда-Якоба. Кроме того, воспалительные программы активируются после острых повреждений, таких как инсульт, травма головного мозга и повреждения спинного мозга. В различных животных моделях болезни Крейтцфельда-Якоба сообщали об активации микроглии и позитивной регуляции TGF-бета1 (Baker, С.A., Z.Y.Lu, et al. (1999). «Microglial activation varies in different models of Creutzfeldt-Jakob disease». J Virol 73(6); 5089-5097).
Среди сотен различных нейродегенеративных расстройств внимание уделяли лишь немногим, включая болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и боковой амиотрофический склероз. Следует упомянуть, что тот же самый нейродегенеративный процесс может оказывать влияние на различные области головного мозга, делая данное заболевание кажущимся весьма отличным, исходя из симптоматической точки зрения. Нейродегенеративные заболевания центральной нервной системы (ЦНС) можно классифицировать на заболевания коры мозга (болезнь Альцгеймера), базальных ганглиев (болезнь Паркинсона), ствола мозга и мозжечка или спинного мозга (боковой амиотрофический склероз).
Примерами нейродегенерации и нейродегенеративных расстройств являются: болезни Альцгеймера, болезнь Паркинсона, болезнь Крейтцфельда-Якоба (CJD), новый вариант болезни Крейтцфельда-Якоба (nvCJD), болезнь Халлервордена-Шпатца, болезнь Гентингтона, мультисистемная атрофия, деменция, лобно-височная деменция, расстройства двигательных нейронов, боковой амиотрофический склероз, спинальная мышечная атрофия, спиномозжечковые атрофии (SCA), шизофрения, аффективные расстройства, большая депрессия, менингоэнцефалит, бактериальный менингоэнцефалит, вирусный менингоэнцефалит, аутоиммунные расстройства ЦНС, рассеянный склероз (MS), острые ишемические/гипоксические поражения, травма ЦНС, травма головы, артериосклероз, атеросклероз, микроангиопатическая деменция, болезнь Бинсвангера, лейкоараиоз, дегенерация сетчатки, дегенерация ушной улитки, дегенерация желтого пятна, улитковая глухота, деменция, связанная со СПИДом, пигментный ретинит, связанный с хрупкой X-хромосомой тремор/атаксический синдром (FXTAS), прогрессирующий супрануклеарный паралич (PSP), дегенерация полосатого тела и черной субстанции (SND), оливопонтомозжечковая дегенерация (olivopontocerebellear degeneration, OPCD), синдром Шая-Дрейджера (SDS).
Влияние на уровни TGF-бета1
Позитивная регуляция TGF-бета1 и ее эффекты
Во многих исследованиях пытались повысить уровни TGF-бета1 для нейропротекторных или иммунорегуляторных целей. Исследования с агонистами продемонстрировали, что TGF-бета1 уменьшает гибель нейронов и размер инфаркта вследствие окклюзии средней мозговой артерии (МСАО), тогда как, напротив, исследования с антагонистами показали повышенные гибель нейронов и размер инфаркта после МСАО, подтверждая, что TGF-бета1 имеет нейропротекторную роль при ишемии мозга. Недавняя работа по сверхэкспрессии TGF-бета1, опосредованной аденовирусами, in vivo у мышей дополнительно подразумевала нейропротекторную роль TGF-бета1 при ишемии мозга, что подтверждено уменьшением гибели нейронов, размера инфаркта и неврологических последствий. Дополнительно, многочисленные исследования in vitro документально подтвердили нейропротекторную способность TGF-бета1 в нейронах у множества видов, включая крыс, мышей, цыплят и человека. Весьма интересно то, что TGF-бета1, как было показано, является защитным против широкого разнообразия вызывающих гибель агентов/факторов, включая гипоксию/ишемию, глутаматную эксайтотоксичность, бета-амилоидное окислительное повреждение и вирус иммунодефицита человека. Нейропротекторный эффект TGF-бета1 связывали с его способностью поддерживать мембранный потенциал митохондрий, стабилизировать гомеостаз Са2+, увеличивать экспрессию антиапоптических белков Bcl-2 и Bcl-xI, ингибировать активацию каспазы-3 и индуцировать ингибитор-1 активатора плазминогена.
Применение TGF-бета для иммуномодуляции у людей строго ограничено его токсичностью, включая избыточную стимуляцию образования матрикса, нефротоксичность и другие вредные эффекты. TGF-бета имеет онкогенный потенциал, и подразумевали, что он вовлечен в гломерулопатии, фиброз легких, склеродермию и хроническую болезнь «трансплантат против хозяина». Кроме того, в то время как TGF-бета является крайне сильнодействующим иммунодепрессивным цитокином, несколько линий доказательств показывают, что хроническая стимуляция экспрессии TGF-бета, как связанная с заболеванием, так и у трансгенных животных моделей, парадоксальным образом может приводить к аутоиммунному воспалению или усиливать его.
Главное открытие авторов изобретения состоит в том, что идентичный TGF-β, описанный выше в отношении его защитных эффектов на ЦНС, является основной молекулой отрицательной регуляции восстановления стволовых клеток ЦНС в физиологии и при почти всех патологиях ЦНС: TGF-β, продуцируемый микроглиальными клетками (либо с низкими физиологическими уровнями, либо с высокими уровнями в ответ на заболевание), просачивается через межклеточный матрикс в СМЖ. Там он может свободно и непосредственно взаимодействовать с высокорегулируемыми и экспрессируемыми TGF-RII и TGF-RI на популяции клеток-предшественников/стволовых клеток ЦНС в субэпендимальной зоне слоя, содержащего клетки-предшественники, или, потенциально, в других областях обновления стволовых клеток ЦНС. Открытие состоит в отрицательной регуляции, приводящей к низкому обновлению стволовых клеток в случае высоких уровней TGF-β в СМЖ и наоборот. В экспериментах авторов изобретения на SVZ или гиппокампе необычным и наиболее заметным является то, что крайне высокий уровень экспрессии и активности TGF-RII локализован в сайте пролиферации клеток-предшественников/стволовых клеток. Необычной также является передача сигнала через буферный раствор, как, например, спинномозговая жидкость (СМЖ). Следовательно, это является полностью регуляторным циклом, где физиологическая и патологическая регуляция являются очень сходными, но отличаются только по интенсивности (другими словами: уровень TGF-β в СМЖ и уровень экспрессии TGF-R в клетках-мишенях). Индивидуальный фенотип болезненной патологии характеризуется такими разнообразными изменениями, как генетические недостаточности (например, синуклеинопатии, мутации супероксиддисмутазы, нарушения тринуклеотидных повторов) или травма, гипоксия, сосудистое заболевание или воспаление либо старение ЦНС. Управляющим болезненной патологией, однако, всегда является TGF-β, продуцируемый популяцией микроглиальных клеток/макрофагов, С одной стороны, он является нейропротекторным и иммунодепрессивным, помогая уменьшить острое воспалительное повреждение паренхимы и утрату нейронов, потенциально вызываемые болезненной патологией. Косвенно, как Janus Head, та же самая молекула не допускает восстановления повреждений ЦНС ее собственными стволовыми клетками/клетками-предшественниками, вмешиваясь в петлю TGF-β-TGF-R на уровне клеток-предшественников или стволовых клеток, тем самым значительно подавляя пролиферацию стволовых клеток. В данном случае стволовые клетки следует рассматривать не только как клетки, происходящие от клеток-предшественников в ЦНС, но возможно также как те стволовые клетки/клетки-предшественники, которые пытаются вторгнуться в паренхиму ЦНС соответственно из сосудов костного мозга. Это также означает, что нейропротекторные/иммунодепрессивные эффекты на ЦНС были бы упразднены путем простого снижения уровней TGF-β в паренхиме, приводя к тяжелому острому повреждению путем воспаления и/или к прямому апоптозу нейронов.
Локальное вмешательство на уровне TGF-R, следовательно, является, по-видимому, единственным привлекательным путем для стабильного вмешательства, благоприятствующего восстановлению, не создающего опасности полезным эффектам TGF-β на мозг. Таким образом, настоящее изобретение относится к антисмысловым олигонуклеотидам, препятствующим биологическому действию TGF-бета1 на пул клеток-предшественников/стволовых клеток, экспрессирующих TGF-R. Указанные олигонуклеотиды или фармацевтические композиции, включающие по меньшей мере один из указанных олигонуклеотидов, являются полезными для диагностики/профилактики/предупреждения или лечения заболевания, где нейрогенез или нейрорегенерация имеют полезный эффект. Они также являются полезными в терапевтическом предупреждении (например, после инсульта или травмы головы), как показано в экспериментах авторов изобретения, прежде чем механизмы, описанные ниже, будут задействованы.
Термин «воспрепятствование», как он использован здесь, означает модуляцию, предпочтительно снижение или устранение биологической активности TGF-R и/или TGF-RII или его экспрессии. Модуляцию биологической активности можно осуществлять прямым взаимодействием или связыванием соединения с TGF-R, предпочтительно TGF-RII, или непрямым взаимодействием, например путем осуществления взаимодействия с соединением, которое ассоциировано с биологической активностью TGF-R и/или TGF-RII. Подходящие соединения, действующие как агенты, имеющие в качестве мишени TGF-бетаRI, -RII, -RIII или их трансдукцию сигнала, чтобы препятствовать этой регуляторной цепи с целью улучшения нейрорегенерации или увеличения рекрутинга нейронов/гематопоэтических стволовых клеток или клеток-предшественников в ЦНС, включая все типы локальной или системной трансплантации (например размножение ex vivo, аллогенные клетки), перечислены ниже:
(а) плазмиды, векторы или природные/синтетические/мутированные вирусы, олигонуклеотиды различных типов модификации (например РТО, LNA, 2'F-ANA, белок-нуклеотидные комплексы, РНКи (РНК-интерференция), киРНК (короткие интерферирующие РНК) или микро миРНК, метилметокси-, фосфороамидаты, PNA, морфолино, фосфорамидат, циклогексен (CeNA), гэпмеры (gap-meres), рибозимы, аптамеры, CpG-олигомеры, ДНК-зимы, рибопереключатели (riboswitches) или липиды либо липидсодержащие молекулы,
(б) пептиды, пептидные комплексы, включая все типы линкеров,
(в) малые молекулы, модификаторы оснований (rafts) или ямок (caveoli),
(г) модификаторы аппарата Гольджи,
(д) антитела и их производные, особенно химеры, Fab-фрагменты, Fc-фрагменты или
(е) носители, липосомы, наночастицы, комплексы или любые другие системы доставки, содержащие названные выше конструкции, могут быть использованы для нацеливания на вышеупомянутую регуляторную цепь для восстановления или улучшения нейрорегенерации.
Однако наиболее предпочтительными среди вышеупомянутых агентов являются антисмысловые олигонуклеотиды, так как они препятствуют образованию TGF-R или TGF-RII на очень ранней стадии. Главные преимущества этих молекул основаны на их крайне высокой специфичности к мишени, в сочетании с их крайне хорошей системной и локальной толерантностью; они очень хорошо подходят для местного введения в ЦНС, или в паренхиму, или в пространство СМЖ. Кроме того, они являются очень стабильными и, таким образом, их можно легко наносить из имплантированной насосной системы. Их соотношение цена-эффективность также является замечательным.
Таким образом, в предпочтительных воплощениях настоящего изобретения соединение, полезное для воспрепятствования экспрессии гена, кодирующего TGF-R или TGF-RII, представляет собой антисмысловой олигонуклеотид.
Генерация подходящих антисмысловых олигонуклеотидов включает определение сайта или сайтов в гене TGF-R или в гене TGF-RII для того, чтобы антисмысловое взаимодействие происходило так, чтобы получить в результате желаемый эффект, например ингибирование экспрессии белка. Предпочтительный внутригенный сайт представляет собой (а) участок, охватывающий инициирующий или терминирующий кодон трансляции открытой рамки считывания (ORF) гена или (б) участок мРНК, который представляет собой «петлю» или «выпячивание», то есть не является частью вторичной структуры. Как только один или более чем один сайт-мишень идентифицирован, выбирают олигонуклеотиды, которые являются достаточно комплементарными этой мишени, то есть достаточно хорошо и с достаточной специфичностью гибридизуются для получения желаемого эффекта.
Таким образом, настоящее изобретение относится к антисмысловым олигонуклеотидам, имеющим подпоследовательность SEQ ID NO 1, или SEQ ID NO 2, или SEQ ID NO 94, или SEQ ID NO 95, или SEQ ID NO 96, содержащую от 8 до 50 нуклеотидных оснований и их миметиков. Указанные олигонуклеотиды представляют собой часть SEQ ID NO 1 или 2 или SEQ ID NO от 94 до 96 с 8-50 нуклеотидными основаниями. Кроме того, антисмысловые олигонуклеотиды, содержащие от 8 до 50 нуклеотидных оснований, не должны быть точными подпоследовательностями SEQ ID NO 1 или 2 или SEQ ID NO от 94 до 96. Достаточно, если антисмысловые олигонуклеотиды являются по меньшей мере на 80%, предпочтительно на 84%, более предпочтительно на 88% и наиболее предпочтительно на 92% идентичными подпоследовательности, обнаруживаемой в SEQ ID NO 1 или 2 или SEQ ID NO 94, или 95, или 96. Предпочтительные олигонуклеотиды имеют последовательность, по меньшей мере на 80% идентичную подпоследовательности SEQ ID NO 1, или 2, или 94, или 95, или 96, содержащую 8-50 нуклеотидных оснований, где указанная последовательность способна в достаточной степени гибридизоваться с участком, охватывающим инициирующий или терминирующий кодон трансляции открытой рамки считывания гена, кодирующего TGF-R или TGF-RII, или участком мРНК, кодирующим TGF-R или TGF-RII, который представляет собой "петлю" или "выпячивание" и который не является частью вторичной структуры. Это означает, что данные антисмысловые олигонуклеотиды имеют последовательность, по меньшей мере на 80%комплементарную соответствующему участку гена, кодирующему TGF-R или TGF-RII, или предпочтительно имеют последовательность, по меньшей мере на 80% комплементарную (а) участку, охватывающему инициирующий или терминирующий кодон трансляции открытой рамки считывания гена, кодирующего TGF-R или TGF-RII, или (б) участку мРНК, кодирующему TGF-R или TGF-RII, который представляет собой "петлю" или "выпячивание", то есть не является частью вторичной структуры.
Предпочтительными являются антисмысловые олигонуклеотиды из 8-50, предпочтительно 15-25 нуклеотидных оснований, способные в достаточной степени гибридизоваться с участком, охватывающим инициирующий или терминирующий кодон трансляции открытой рамки считывания гена, кодирующего TGF-R или TGF-RII, или участком мРНК, кодирующим TGF-R или TGF-RII, который представляет собой "петлю" или "выпячивание" и который не является частью вторичной структуры.
Предпочтительными являются следующие удлиненные последовательности SEQ ID NO 3, которые могут быть представлены следующей общей формулой:
5'-XCAGCCCCCGACCCATGZ-3',
где Х выбран из группы, содержащей следующие олигонуклеотиды:

и где Z выбран из группы, содержащей следующие олигонуклеотиды:

и где Х и Z вместе содержат не более 34 нуклеотидных оснований, и их миметики.
Более предпочтительными являются следующие олигонуклеотидные последовательности и их варианты или миметики:


Еще более предпочтительными являются следующие олигонуклеотидные последовательности, а также их варианты и миметики:

Исключены из объема пунктов формулы настоящего изобретения, относящихся к веществу, две следующие известные последовательности: 5'-GATCTTGACTGCCACTGTCTC-3' (J.Clin. Endocrinology & Metabolism 2003, 88(10), 4967-4976) и 5'-CATGGCAGCCCCCGTC-3' (Developmental Biology 1996, 180, 242-257).
Особенно предпочтительной является последовательность SEQ ID NO 3: 5'-CAGCCCCCGACCCATG-3'.
Соответственно настоящее изобретение также относится к последовательностям, которые являются близкородственными любым из последовательностей от SEQ ID NO 3 до SEQ ID NO 93. Указанные последовательности называют здесь "вариантами". Антисмысловые олигонуклеотиды могут быть модифицированы несколькими разными способами. Возможны модификации внутри основной цепи, и они относятся к олигонуклеотидам, где атом фосфора в их межнуклеозидной основной цепи частично или полностью замещен другими атомами. Предпочтительные модифицированные олигонуклеотидные основные цепи включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил-, этил- и С3-С10-алкилфосфонаты, включая 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидаты и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и боранфосфаты, имеющие нормальные 3'-5' связи, их 2'-5'-связанные аналоги и те, которые имеют противоположную ориентацию, где смежные пары нуклеозидных единиц связаны 3'-5' к 5'-3' или 2'-5' к 5'-2'. Также включены их различные соли, смешанные соли и свободные кислотные формы.
Предпочтительными также являются варианты от SEQ ID NO 3 до SEQ ID NO 93, где на 3'-концевом участке и/или на 5'-концевом участке добавлены дополнительные 1, 2, 3, 4 или 5 нуклеотидных оснований. Такие дополнительные нуклеотидные основания предпочтительно представляют собой пять нуклеотидных оснований в SEQ ID NOs 1, 2, 94, 95 или 96, которые появляются непосредственно перед или после соответствующей последовательности. Кроме того, указанные предпочтительные варианты могут иметь 1, 2, 3 или 4 замены нуклеотидных оснований, то есть в указанных предпочтительных вариантах один, два, три или четыре нуклеотида могут быть замещены другими нуклеотидными основаниями. Следует подчеркнуть, что данные варианты также могут содержать любые модификации основной цепи, или основания, или сахарной группировки, раскрытые здесь, такие как фосфоротиоатные основные цепи.
Предпочтительные модифицированные олигонуклеотидные основные цепи, которые не включают атом фосфора, здесь имеют основные цепи, которые образованы короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями, смешанными межнуклеозидными связями гетероатома и алкила или циклоалкила. Они включают те, которые имеют морфолино связи (образованные частично из сахарной части нуклеозида); силоксановые основные цепи, сульфидные, сульфоксидные и сульфоновые основные цепи; формацетильные и тиоформацетильные основные цепи; метиленформацетильные и тиоформацетильные основные цепи, алкенсодержащие основные цепи, сульфаматные основные цепи; метиленимино и метиленгидразино основные цепи; сульфонатные и сульфонамидные основные цепи; амидные основные цепи, смеси указанных выше типов основных цепей и другие основные цепи, имеющие смешанные N, О, S, Р и СН2 компонентные части.
Дополнительные предпочтительные воплощения настоящего изобретения включают олигонуклеотиды с фосфоротиоатными основными цепями или основными цепями с гетероатомом и, в частности, с -CH2-NH-O-CH2-, -СН2-N(СН3)-O-СН2- (известные как метилен (метилимино) или MMI основные цепи), -СН2-O-N(СН3)-СН2-, -СН2-N(СН3)-N(СН3)-СН2- и -О-N(СН3)-СН2-СН2- (где природная фосфодиэфирная основная цепь представлена в виде O-Р-O-СН2-). Также предпочтительными являются олигонуклеотиды, имеющие в их основных цепях морфолино группировки, или имеющие структуру с морфолиновыми основными цепями, или имеющие аминоалкиламидные основные цепи (смотри ниже). Олигонуклеотиды также могут иметь миметики сахаров, такие как циклобутильные группировки вместо пентофуранозильного сахара.
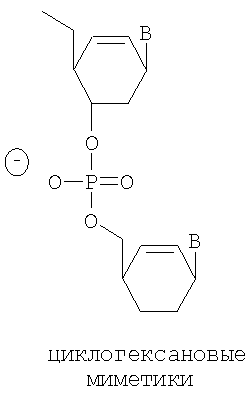
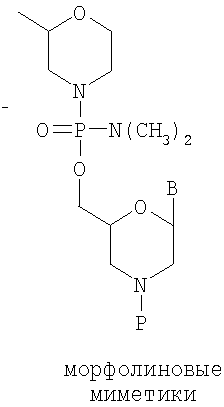
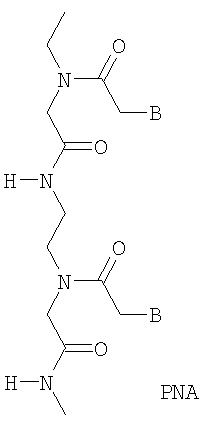
В относится к группировке основания, такой как пуриновая или пиримидиновая группа, которая может быть дополнительно дериватизирована.
Другая модификация олигонуклеотидов по настоящему изобретению включает осуществление химического связывания с олигонуклеотидом одной или более чем одной группировки или конъюгатов, которые увеличивают активность, распределение в клетке или поглощение клеткой олигонуклеотида. Модифицированные олигонуклеотиды также могут содержать одну или более чем одну замещенную или модифицированную сахарную группировку. Предпочтительные олигонуклеотиды содержат в положении 2' один из следующих: -ОН, -F, -O-алкил, -S-алкил, -N-алкил, -O-алкенил, -S-алкенил, -N-алкенил, -O-алкинил, -S-алкинил, -N-алкинил, -О-алкил-O-алкил, где алкил, алкенил и алкинил могут быть замещенными или незамещенными C1-С10алкилом или С2-С10алкенилом и С2-С10алкинилом. Особенно предпочтительная модифицированная сахарная группировка представляет собой 2'-O-метоксиэтильную сахарную группировку (2'-OCH2CH2OCH3, также известную как 2'-O-(2-метоксиэтокси) или 2'-МОЕ) и 2'-диметиламинооксиэтокси, такую как O(СН2)2ON(СН3) (известную как 2'-DMAOE). Также особенно предпочтительными являются O[(СН2)nO]mCH3, O(СН2)nOCH3, O(CH2)nNH2, O(СН2)nCH3, O(CH2)nONH2, O(СН2)nON[(СН2)nCH3], где n и m независимо друг от друга представляют собой целое число от 1 до 10. Другие предпочтительные модификации включают 2'-метокси, 2'-аминопропокси и 2'-фторо. Другие предпочтительные олигонуклеотиды включают одну из следующих групп в положении 2': -ОСН3, -ОС2Н5, -ОС3Н7, -О-цикло-С3Н5, -ОСН(СН3)2, -ОС(СН3)3, -ОС4Н9, -OPh, -OCH2-Ph, -NO2, -F, -Cl, -Br, -I, -N3, -CN, -OCN, -NCO, -SCN, -NCS, -СОСН3, -СОС2Н5, -СОС3Н7, -СО-цикло-С3Н5, -СОСН(СН3)2, -CF3, -SH, -SCH3, -SC2H5, -SC3H7, -S-цикло-С3Н5, -SOCH3, -SOC2H5, -SOC3H7, -SO-цикло-С3Н5, -SO2CH3, -SO2C2H5, -SO2C3H7, -SO2-цикло-С3Н5, -NH2, -NHCH3, -NHC2H5, -NHC3H7, -NH-цикло-С3Н5, -N(СН3)2, -N(C2H5)2, -N(C3H7)2, -N(цикло-С3Н5)2, -N[СН(СН3)2]2-СН3, -C2H5, -С3Н7, -СН(СН3)2, -C4H9, -CH2-СН(СН3)2, -СН(СН3)-С2Н5, -С(СН3)3, -C5H11, -СН(СН3)-С3Н7, -СН2-СН(СН3)-С2Н5, -СН(СН3)-СН(СН3)2, -С(СН3)2-С2Н5, -СН2-С(СН3)3, -СН(С2Н5)2, -С2Н4-СН(СН3)2, -C6H13, -С3Н6-СН(СН3)2, -С2Н4-СН(СН3)-С2Н5, -СН(СН3)-С4Н9, -СН2-СН(СН3)-С3Н7, -С2Н4-С(СН3)3, -СН(СН3)-СН2-СН(СН3)2, -СН(СН3)-СН(СН3)-С2Н5, -СН2-СН(СН3)-СН(СН3)2, -СН2-С(СН3)2-С2Н5, -С(СН3)2-С3Н7, -С(СН3)2-СН(СН3)2, -СН(СН3)-С(СН3)3, С7-С10алкил, замещенный C1-С10алкил, алкиларил, арилалкил, О-С1-С10алкил, O-арилалкил, гетероциклоалкил, гетероциклоалкиларил, аминоалкиламино, полиалкиламино, замещенный силил, уходящую группу РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических и/или фармакодинамических свойств олигонуклеотида, или заместители, имеющие подобные свойства. Также предпочтительными являются дезоксинуклеотидные основания.
Подобные модификации также могут быть осуществлены в других положениях нуклеотида, в частности в 3'-положении сахара на 3'-концевом нуклеотиде или в 2'-5'-связанных олигонуклеотидах и 5'-положении 5'-концевого нуклеотида.
Предпочтительные модификации могут быть представлены следующим структурным фрагментом:
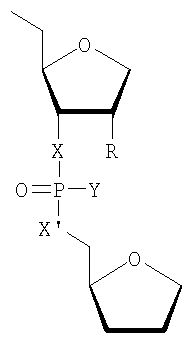
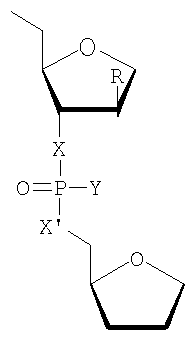
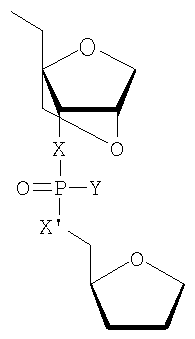
где
R представляет собой любой из вышеупомянутых заместителей для положения 2' и особенно -Н, -F, -ОН, -NH2, -ОСН3, -OCH2CH2OCH3,
Х и X' независимо друг от друга представляют собой -О-, -NH-, -S-, -CH2-, и
Y представляет собой -О-, -S-, -N(CH3)2, -ОСН3, -SCH3.
Более предпочтительными являются варианты, где Х и X' представляют собой кислород и Y представляет собой серу.
Кроме того, предпочтительными являются чистые диастереомерные олигонуклеотиды или их миметики либо варианты. Особенно предпочтительными являются Sp- и Rp-диастереомеры:
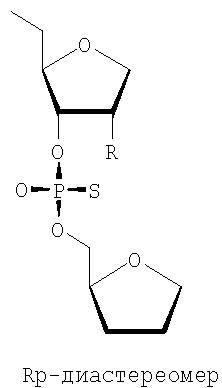
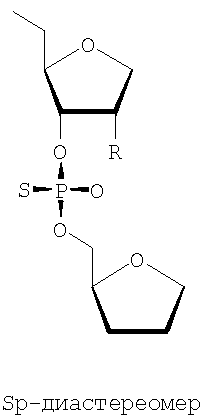
Наиболее предпочтительными также являются последовательности от SEQ ID NO 3 до SEQ ID NO 93 и особенно SEQ ID NO 3, где присутствует одна или более чем одна модификация, раскрытая здесь. Предпочтительными являются фосфоротиоатные группировки в основной цепи или полностью фосфоротиоатные основные цепи, и среди указанных фосфоротиоатов предпочтительными являются Rp- и Sp-диастереомеры.
Олигонуклеотиды по настоящему изобретению также могут включать замены нуклеотидных оснований. Нуклеотидные основания представляют собой четыре стандартных нуклеотидных основания аденин (А), тимин (Т), гуанин (G) и цитозин (С). Модифицированные нуклеотидные основания включают другие синтетические и природные нуклеотидные основания, такие как 5-метилцитозин (5-me-С), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил- и другие алкилпроизводные аденина и гуанина, 2-пропил- и другие алкилпроизводные аденина и гуанина; урацил (U), 6-карбоксиурацил, N6-метиладенин, 5-галогеноурацил, 5-галогеноцитозин, 5-пропинилурацил, 5-пропинилцитозин, 6-азоурацил, 6-азоцитозин, 6-азотимин, 5-урацил (псевдоурацил), 4-тиоурацил; 8-галогено-, 8-амино-, 8-тиол-, 8-тиоалкил-, 8-гидроксил- и другие 8-замещенные аденины и гуанины; 5-галогено-, особенно 5-бромо-, 5-трифторметил- и другие 5-замещенные урацилы и цитозины; 7-метилгуанин; 7-метиладенин, 8-азагуанин, 8-азааденин, 7-деазагуанин, 7-деазааденин, 3-деазагуанин и 3-деазааденин, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин и так далее, причем замещения 5-метилцитозина являются предпочтительными, так как было показано, что эти модификации увеличивают стабильность двунитевой нуклеиновой кислоты.
Предпочтительными являются варианты, имеющие любую последовательность от SEQ ID NO 3 до SEQ ID NO 93, где одно, два, три или четыре нуклеотидных основания замещены другими нуклеотидными основаниями или химически модифицированными нуклеотидными основаниями. Вариант должен относиться к последовательности от SEQ ID NO 3 до SEQ ID NO 93, где от одного до четырех нуклеотидных оснований замещены, например, урацилом (U), 5-галогеноурацилом, 5-метилцитозином и/или N6-метиладенином. Особенно предпочтительными являются варианты с SEQ ID NO 3, где один, два или три нуклеотидных основания замещены вышеупомянутыми группировками.
«Олигонуклеотид» относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК), или их миметикам, или вариантам. Данный термин включает олигонуклеотиды, состоящие из встречающихся в природе нуклеотидных оснований, сахаров и ковалентных межнуклеозидных (основная цепь) связей, а также олигонуклеотиды, имеющие не встречающиеся в природе части, которые имеют подобную функцию. Такие модифицированные или замещенные олигонуклеотиды часто являются предпочтительными перед природными формами благодаря их желательным свойствам, таким как, например, повышенное поглощение клеткой, повышенное сродство к нуклеиновым кислотам-мишеням и повышенная стабильность в присутствии нуклеаз. Хотя антисмысловые олигонуклеотиды являются предпочтительной формой антисмыслового соединения, настоящее изобретение охватывает другие олигомерные антисмысловые соединения, включающие миметики олигонуклеотидов, такие как описанные ниже, но не ограниченные ими. Антисмысловые соединения в соответствии с данным изобретением содержат от примерно 8 до примерно 50 нуклеотидных оснований (то есть от примерно 8 до примерно 50 связанных нуклеозидов), предпочтительно 9-42, 10-36, 11-32, 12-30, 13-28, 14-26 и наиболее предпочтительно 15-25 нуклеотидных оснований.
Особенно предпочтительными антисмысловыми соединениями являются антисмысловые олигонуклеотиды, даже более предпочтительными являются те, которые содержат от примерно 15 до примерно 25 нуклеотидных оснований. Антисмысловые соединения включают рибозимы, внешние вспомогательные последовательности (EGS), олигонуклеотиды (олигозимы) и другие короткие каталитические РНК или каталитические олигонуклеотиды, которые гибридизуются с нуклеиновой кислотой-мишенью и ингибируют ее экспрессию.
Термин «соли» относится к физиологически и/или фармацевтически приемлемым солям соединений, особенно антисмысловых олигонуклеотидов по настоящему изобретению. Фармацевтически приемлемые соли присоединения основания образуют с неорганическими или органическими основаниями. Примерами подходящих органических и неорганических оснований являются основания, образованные с ионами металлов, например алюминия, ионов щелочных металлов, таких как натрий или калий, ионов щелочноземельных металлов, таких как кальций или магний, или иона аминной соли, или гидроксиды, карбонаты или бикарбонаты щелочных или щелочноземельных металлов. Примеры включают водный LiOH, NaOH, КОН, NH4OH, карбонат калия, бикарбонат аммония и натрия, аммонийные соли, первичные, вторичные и третичные амины, такие как, например, гидроксид тетраалкиламмония, низшие алкиламины, такие как метиламин, трет-бутиламин, прокаин, этаноламин, арилалкиламины, такие как дибензиламин и N,N-дибензилэтилендиамин, низшие алкилпиперидины, такие как N-этилпиперидин, циклоалкиламины, такие как циклогексиламин или дициклогексиламин, морфолин, глюкамин, N-метил- и N,N-диметилглюкамин, 1-адамантиламин, бензатин или соли, являющиеся производными аминокислот, подобных аргинину, лизину, орнитину, или амиды изначально нейтральных или кислых аминокислот, хлорпрокаин, холин, прокаин или тому подобное.
Соединения по изобретению, которые являются основными, могут образовывать фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примерами подходящих кислот для такого образования соли присоединения кислоты являются соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, малоновая кислота, салициловая кислота, пара-аминосалициловая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, аскорбиновая кислота, малеиновая кислота, сульфоновая кислота, фосфоновая кислота, перхлорная кислота, азотная кислота, муравьиная кислота, пропионовая кислота, глюконовая кислота, молочная кислота, винная кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, бензойная кислота, пара-аминобензойная кислота, пара-гидроксибензойная кислота, метансульфоновая кислота, этансульфоновая кислота, азотистая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, пара-толуолсульфоновая кислота, нафтилсульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, фарфоровая кислота, миндальная кислота, орто-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота, адипиновая кислота, D-орто-толилвинная кислота, тартроновая кислота, α-толуиловая кислота, (орто, мета, пара)-толуиловая кислота, нафтиламинсульфоновая кислота и другие минеральные или карбоновые кислоты, хорошо известные специалистам в данной области техники. Соли получают путем приведения в контакт формы в виде свободного основания с достаточным количеством желаемой кислоты с получением соли традиционным способом.
Формы в виде свободного основания могут быть регенерированы путем обработки соли подходящим разбавленным водным раствором основания, такого как разбавленный водный гидроксид натрия, карбонат калия, бикарбонат аммония и натрия. Формы в виде свободного основания до некоторой степени отличаются от их соответствующих солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но во всем остальном для целей настоящего изобретения соли эквивалентны соответствующим им формам в виде свободного основания.
Альтернативно, фармацевтическая композиция по изобретению содержит вектор, позволяющий транскрибировать антисмысловой олигонуклеотид по изобретению, например, в организме хозяина млекопитающего. Предпочтительно такой вектор представляет собой вектор, полезный для генотерапии. Предпочтительные векторы, полезные для гемотерапии, представляют собой вирусные векторы, например аденовирус, бакуловирус, вирус герпеса, вирус осповакцины или, более предпочтительно, РНК-содержащий вирус, такой как ретровирус. Даже более предпочтительно ретровирусный вектор представляет собой производное мышиного или птичьего ретровируса. Примерами таких ретровирусных векторов, которые могут быть использованы в настоящем изобретении, являются: вирус мышиного лейкоза Молони (MoMuLV), вирус злокачественной саркомы мышей Харвея (HaMuSV), вирус опухоли молочной железы мышей (MuMTV) и вирус саркомы Рауса (RSV). Наиболее предпочтительно используют ретровирусный вектор нечеловекообразных обезьян, такой как вирус лейкоза гиббонов (GaLV), обеспечивающий более широкий диапазон хозяев по сравнению с мышиными векторами. Поскольку рекомбинантные ретровирусы являются дефективными, требуется содействие для того, чтобы получить инфекционные частицы. Такое содействие можно обеспечить, например, используя хелперные клеточные линии, которые содержат плазмиды, кодирующие все структурные гены ретровируса под контролем регуляторных последовательностей в LTR. Подходящие хелперные клеточные линии хорошо известны специалистам в данной области техники. Указанные векторы могут дополнительно содержать ген, кодирующий селектируемый маркер, так чтобы можно было идентифицировать трансдуцированные клетки. Кроме того, ретровирусные векторы могут быть модифицированы таким образом, чтобы они стали специфичными к мишени. Это может быть достигнуто, например, путем вставки полинуклеотида, кодирующего сахар, гликолипид или белок, предпочтительно антитело. Специалисты в данной области техники знают дополнительные способы создания векторов, специфичных к мишени. Дополнительные подходящие векторы и способы генотерапии in vitro или in vivo описаны в литературе и известны специалистам в данной области техники; смотри, например, WO 94/29469 или WO 97/00957. Для того чтобы добиться экспрессии только в органе-мишени, например ткани мозга, ДНК-последовательности для транскрипции антисмысловых олигонуклеотидов могут быть связаны с тканеспецифичным промотором и использованы для генотерапии.
В структуре олигонуклеотида фосфатные группы обычно упоминаются как образующие межнуклеозидную основную цепь олигонуклеотида. Нормальной связью или основной цепью РНК и ДНК является 3'-5' фосфодиэфирная связь. Специфические примеры предпочтительных антисмысловых соединений или вариантов, полезных в настоящем изобретении, включают олигонуклеотиды, содержащие модифицированные основные цепи или неприродные межнуклеозидные связи. Олигонуклеотиды, имеющие модифицированные основные цепи, включают те, которые сохраняют в основной цепи атом фосфора, и те, которые не имеют атома фосфора в основной цепи. Модифицированные олигонуклеотидные основные цепи, которые могут приводить к повышенной стабильности, известны специалисту в данной области техники, предпочтительно такой модификацией является фосфоротиоатная связь или замещение одной или более чем одной фосфатной группы (группы фосфорной кислоты) фосфонатной (фосфоновой кислоты) группой, или сульфатной (серной кислоты) группой, или сульфонатной (сульфоновой кислоты) группой, или сульфоксидом. Предпочтительный олигонуклеотидный миметик представляет собой олигонуклеотидный миметик, который, как было показано, имеет превосходные гибридизационные свойства и который относят к пептидной нуклеиновой кислоте (PNA). В соединениях PNA сахарная основная цепь олигонуклеотида заменена амид-содержащей основной цепью, в частности аминоэтилглициновой основной цепью. Нуклеотидные основания сохранены и связаны непосредственно или косвенно с аза-атомами азота амидной части основной цепи (смотри, например, Nielsen et al., Science 254 (1991), 1497-1500).
В контексте данного изобретения «гибридизация» означает образование водородных связей, которое может представлять собой образование водородных связей по Уотсону-Крику, Хугстину (Hoogsteen) и обратное связывание водородными связями по Хугстину между комплементарными нуклеозидными или нуклеотидными основаниями. Термин «комплементарный», как он использован здесь, относится к способности точного спаривания между двумя нуклеотидами. Например, если нуклеотид в определенном положении олигонуклеотида способен образовывать водородные связи с нуклеотидом в том же самом положении молекулы ДНК или РНК, тогда этот олигонуклеотид и эту ДНК или РНК рассматривают как комплементарные друг другу в данном положении. Олигонуклеотид и ДНК или РНК являются комплементарными друг другу, когда достаточное число соответствующих положений в каждой молекуле занято нуклеотидами, которые могут образовывать водородные связи друг с другом. Таким образом, «способный к специфической гибридизации» и «комплементарный» представляют собой термины, которые используют, чтобы показать достаточную степень комплементарности или точное спаривание, так чтобы происходило стабильное и специфическое связывание между олигонуклеотидом и ДНК- или РНК-мишенью. Понятно в данной области, что нет необходимости в том, чтобы последовательность антисмыслового соединения была на 100% комплементарной последовательности ее нуклеиновой кислоты-мишени, для того чтобы быть способной к специфической гибридизации. Антисмысловое соединение является способным к специфической гибридизации, когда связывание данного соединения с молекулой ДНК- или РНК-мишени препятствует нормальной функции этой ДНК-или РНК-мишени, вызывая потерю эффективности, и имеется достаточная степень комплементарности, для того чтобы избежать неспецифического связывания антисмыслового соединения с последовательностями, не являющимися мишенями, при условиях, в которых специфическое связывание является желательным, то есть в случае терапевтического лечения.
В других предпочтительных олигонуклеотидных миметиках как сахар, так и межнуклеозидная связь, то есть основная цепь нуклеотидных единиц, замещена новыми группами. Единицы-основания сохранены для гибридизации с подходящим соединением нуклеиновой кислотой-мишенью. Пример такого олигонуклеотидного миметика, который, как было показано, имеет превосходные гибридизационные свойства, относится к пептидной нуклеиновой кислоте (PNA). В PNA-соединениях сахарная основная цепь олигонуклеотида заменена амид-содержащей основной цепью, в частности аминоэтилглициновой основной цепью. Нуклеотидные основания сохранены и связаны непосредственно или косвенно с аза-атомами азота амидной части основной цепи.
Другая модификация олигонуклеотидов по изобретению включает химическое связывание с олигонуклеотидом одной или более чем одной группировки или конъюгата, которые увеличивают активность, распределение в клетке или поглощение клеткой олигонуклеотида. Такие группировки включают липидные группировки, такие как холестериновая группировка, холевая кислота, тиоэфир, гексил-S-тритилтиол, тиохолестерин, алифатическую цепь, например додекандиольные или ундецильные остатки, фосфолипид, такой как дигексадецил-рац-глицерин или триэтиламмоний-1,2-ди-О-гексадецил-рац-глицеро-3Н-фосфонат, полиамин или полиэтиленгликолевую цепь, или адамантинуксусную кислоту, пальмитильную группировку или октадециламинную, или гексиламинокарбонилоксихолестериновую группировку. Настоящее изобретение также включает антисмысловые соединения, которые представляют собой химерные соединения. «Химерные» антисмысловые соединения или «химеры» в контексте настоящего изобретения предтавляют собой антисмысловые соединения, в частности олигонуклеотиды, которые содержат две или более чем две химически различные области, причем каждая составлена по меньшей мере из одной мономерной единицы, то есть нуклеотида в случае олигонуклеотидного соединения. Эти олигонуклеотиды типично содержат по меньшей мере одну область, где олигонуклеотид модифицирован так, чтобы придать олигонуклеотиду повышенную устойчивость к разложению нуклеазами, повышенное поглощение клеткой и/или повышенную аффинность связывания с нуклеиновой кислотой-мишенью. Дополнительная область олигонуклеотида может служить в качестве субстрата для ферментов, способных расщеплять РНК:ДНК или РНК:РНК гибриды. В качестве примера, РНКаза Н представляет собой клеточную эндонуклеазу, которая расщепляет РНК-нить двойной спирали РНК:ДНК. Активация РНКазы Н, следовательно, приводит к расщеплению РНК-мишени, тем самым значительно повышая эффективность ингибирования олигонуклеотидом экспрессии генов. Поэтому сравнимые результаты часто могут быть получены с более короткими олигонуклеотидами, когда используют химерные олигонуклеотиды, по сравнению с фосфоротиоатными дезоксиолигонуклеотидами, гибридизующимися с тем же самым участком-мишенью. Химерные антисмысловые соединения по изобретению могут быть образованы в виде смешанных структур из двух или более чем двух олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или олигонуклеотидных миметиков, как описано выше. На такие соединения также ссылались в данной области техники как на гибриды или гэпмеры.
В особенности настоящее изобретение относится к применению антисмысловых олигонуклеотидов, раскрытых здесь, или их вариантов или миметиков для профилактики и лечения нейродегенеративных расстройств, нейротравмы, нейрососудистых и нейровоспалительных, включая послеинфекционные, расстройств. Термин «нейродегенеративные расстройства и нейровоспалительные расстройства» относится к болезням Альцгеймера, болезни Паркинсона, болезни Крейтцфельда-Якоба (CJD), новому варианту болезни Крейтцфельда-Якоба (nvCJD), болезни Халлервордена-Шпатца, болезни Гентингтона, мультисистемной атрофии, деменции, лобно-височной деменции, расстройствам двигательных нейронов, боковому амиотрофическому склерозу, спинномозговой мышечной атрофии, спиномозжечковым атрофиям (SCAs), шизофрении, аффективным расстройствам, большой депрессии, менингоэнцефалиту, бактериальному менингоэнцефалиту, вирусному менингоэнцефалиту, аутоиммунным расстройствам ЦНС, рассеянному склерозу (MS), острым ишемическим/гипоксическим поражениям, включая инсульт, травме ЦНС, травме головы, артериосклерозу, атеросклерозу, микроангиопатической деменции, болезни Бинсвангера, лейкоараиозу, дегенерации сетчатки, дегенерации ушной улитки, дегенерации желтого пятна, улитковой глухоте, деменции, связанной со СПИДом, пигментному ретиниту, связанному с хрупкой Х-хромосомой тремор/атаксическому синдрому (FXTAS), прогрессирующему супрануклеарному параличу (PSP), дегенерации полосатого тела и черной субстанции (SND), оливопонтомозжечковой дегенерации (OPCD), синдрому Шая-Дрейджера (SDS).
В более общем, настоящее изобретение относится к применению антисмысловых олигонуклеотидов, раскрытых здесь, или их вариантов или миметиков для лечения заболеваний, которые связаны с позитивной регуляцией или усиленной передачей сигнала TGF-R и/или TGF-RII, например через повышенные уровни TGF-бета. Антисмысловые олигонуклеотиды посредством этого ингибируют экспрессию TGF-R и/или TGF-RII. Вместо антисмысловых олигонуклеотидов или в комбинации с антисмысловыми олигонуклеотидами могут быть использованы антисмысловые соединения. Антисмысловые соединения относятся к векторам, как они раскрыты здесь, позволяющим транскрибировать антисмысловые олигонуклеотиды, или к рибозимам, внешним вспомогательным последовательностям (EGS), олигозимам и коротким каталитическим РНК или каталитическим олигонуклеотидам, которые гибридизуются с нуклеиновой кислотой-мишенью, кодирующей TGF-R или TGF-RII. Указанные антисмысловые соединения ингибируют экспрессию TGF-R или TGF-RII. Таким образом, в указанных случаях снижается количество TGF-R и/или TGF-RII, присутствующих во время болезненного состояния.
Антисмысловые олигонуклеотиды и антисмысловые соединения, раскрытые здесь, являются полезными для регенерации и функционального воссоединения поврежденных нервных путей и для лечения различных нейродегенеративных расстройств и нейровоспалительных расстройств.
В дополнительном предпочтительном воплощении настоящего изобретения соединение, полезное для воспрепятствования биологической активности TGF-R и/или TGF-RII, представляет собой соединение, снижающее или ингибирующее связывание TGF-β1 с его рецептором. Предпочтительными примерами таких соединений являются (нейтрализующие) антитела, направленные против рецептора TGF-β; смотри Lin et al., 1992, предпочтительно рецептора II TGF-β. Термин «антитело» предпочтительно относится к антителам, которые состоят по существу из объединенных моноклональных антител с различными эпитопными специфичностями, а также отдельным препаратам моноклональных антител. Моноклональные антитела создают из антигена, содержащего, например, фрагмент TGF-R или TGF-RII, или соответствующий рецептор, способами, хорошо известными специалистам в данной области техники. Подразумевают, что термин «антитело» (Ab) или «моноклональное антитело» (Mab), как он использован здесь, включает интактные молекулы, а также фрагменты антител (такие как, например, фрагменты Fab и F(ab')2), которые способны специфически связываться с белком. Фрагменты Fab и F(ab')2 не содержат фрагмента Fc интактного антитела, быстрее выводятся из кровотока и могут проявлять меньшее неспецифическое связывание с тканью, чем интактное антитело. (Wahl et al., J. Nucl. Med. 24: 316-325 (1983)). Таким образом, данные фрагменты являются предпочтительными, также как и продукты FAB или других библиотек экспрессируемых последовательностей иммуноглобулинов. Кроме того, антитела, полезные для целей настоящего изобретения, включают химерные антитела, одноцепочечные антитела и гуманизированные антитела.
Дополнительные предпочтительные соединения для применения по настоящему изобретению представляют собой растворимые рецепторы TGF-β. Такие растворимые рецепторы TGF-β представляют собой слитые белки между областями Fc антител и внеклеточным доменом рецепторов TGF-β. Такие молекулы имеют высокое сродство к растворимому TGF-b1. Следовательно, концентрация свободного TGF-b1 радикально снижается. Согласно протоколу производителей (R&D Systems, Germany), последовательность ДНК, кодирующую 159 аминокислотных остатков внеклеточного домена человеческого TGF-βRII (Lin et al., Cell 1992, 68(4), 775-785) подвергали слиянию с участком Fc человеческого lgG1, и химерный белок экспрессировался в клеточной линии миеломы мышей NSO.
Термин «растворимый», как он использован здесь в контексте рецепторов, предпочтительно относится к фрагментам рецептора, содержащим только внеклеточный(е) домен(ы) рецептора или их часть, которые все еще могут связывать их природный лиганд, например TGF-β1. Специалист в данной области может определить такие фрагменты на основании известных аминокислотных последовательностей рецепторов, и определение внеклеточного домена рецепторов может быть осуществлено с использованием хорошо известных способов, например компьютерных программ (график гидрофильности). В особенно предпочтительном воплощении применения настоящего изобретения указанный растворимый рецептор TGF-β представляет собой рецептор II TGF-β.
Настоящее изобретение также относится к способу идентификации соединения, препятствующего (а) биологической активности TGF-R и/или TGF-RII или экспрессии TGF-R и/или TGF-RII, или (б) передаче сигнала TGF-β1/TGF-R, включающему стадии:
(а) инкубации соединения-кандидата с тест-системой, включающей TGF-β1 и клетки-предшественники нейронов; и
(б) анализа экспрессии активных рецепторов TGF или пролиферации клеток-предшественников нейронов; причем
(в) устранение (1) подавления экспрессии активных рецепторов TGF или (2) подавления пролиферации клеток-предшественников нейронов по сравнению с тест-системой в отсутствие указанного тестируемого соединения указывает на присутствие соединения-кандидата, имеющего желаемые свойства.
Примеры таких молекул-кандидатов включают антитела, олигонуклеотиды, белки (например, рецепторы) или малые молекулы. Такие молекулы могут быть рационально сконструированы с использованием известных методик. Предпочтительно указанная тест-система, используемая для скрининга, содержит вещества со сходными химическими и/или физическими свойствами, наиболее предпочтительно указанные вещества являются идентичными. Соединениями, которые могут быть получены и идентифицированы согласно применению по настоящему изобретению, могут быть библиотеки экспрессируемых последовательностей, например библиотеки экспрессируемых последовательностей кДНК, пептиды, белки, нуклеиновые кислоты, антибиотики, малые органические соединения, лиганды, гормоны, пептидомиметики, PNA и тому подобное. Совсем недавно в WO 98/25146 были описаны дополнительные способы скрининга библиотек комплексов для соединений, имеющих желаемые свойства, особенно способность оказывать агонистический эффект, связываться с или оказывать антагонистический эффект по отношению к полипептиду или его клеточному рецептору. Комплексы в таких библиотеках включают соединение, которое тестируют, метку, регистрирующую по меньшей мере одну стадию в синтезе данного соединения, и связь, чувствительную к модификации молекулой-репортером. Модификацию связи используют для обозначения того, что комплекс содержит соединение, имеющее желаемое свойство. Метку можно расшифровать, чтобы выявить по меньшей мере одну стадию в синтезе такого соединения. Другие способы идентификации соединений, которые взаимодействуют с TGF-R и/или TGF-RII согласно изобретению, или молекул нуклеиновых кислот, кодирующих такие молекулы, представляют собой, например, скрининг in vitro с системой фагового дисплея, а также анализы связывания на фильтре или измерение взаимодействия в режиме «реального времени», используя, например, установку BIAcore (Pharmacia). Все эти способы могут быть использованы в соответствии с настоящим изобретением для идентификации соединения, препятствующего биологической активности TGF-R и/или TGF-RII, или экспрессии указанных рецепторов, или передачи сигнала TGF-β1/TGF-R.
Специалисту в данной области техники также хорошо известно, что возможно разработать, синтезировать и охарактеризовать миметики малых органических соединений, которые, например, могут действовать в качестве субстрата или лиганда по отношению к рецептору TGF-β. Например, было описано, что D-глюкозные миметики гапалозина (hapalosin) показывают такую же эффективность, как и гапалозин, в антагонизации белка, ассоциированного с обеспечением множественной лекарственной устойчивости при цитотоксичности; смотри Dinh, J. Med. Chem. 41 (1998), 981-987. Ген, кодирующий TGF-β1 или TGF-R, также может служить в качестве мишени для скрининга ингибиторов. Ингибиторы могут включать, например, белки, которые связываются с мРНК гена, кодирующего TGF-R, предпочтительно TGF-RII, тем самым дестабилизируя нативную конформацию мРНК и затрудняя транскрипцию и/или трансляцию. Кроме того, в литературе описаны способы идентификации молекул нуклеиновых кислот, таких как фрагмент РНК, который имитирует структуру определенной или неопределенной молекулы РНК-мишени, с которой соединение связывается внутри клетки, приводя к задержке роста клетки или гибели клетки; смотри, например, WO 98/18947 и ссылки, процитированные там. Эти молекулы нуклеиновых кислот могут быть использованы для идентификации неизвестных соединений, представляющих интерес в фармацевтическом отношении, и для идентификации неизвестных РНК-мишеней для применения в лечении заболевания. Эти способы и композиции могут быть использованы для идентификации соединений, полезных для снижения уровней экспрессии TGF-β1 и/или соответствующего(их) рецептора(ов). Соединения, которые можно тестировать и идентифицировать согласно способу по изобретению, могут быть библиотеками экспрессируемых последовательностей, например библиотеками экспрессируемых последовательностей кДНК, пептидами, белками, нуклеиновыми кислотами, антителами, малыми органическими соединениями, гормонами, пептидомиметиками, PNA или тому подобное (Milner, Nature Medicine 1 (1995), 879-880; Hupp, Cell 83 (1995), 237-245; Gibbs, Cell 7 (1994), 193-198 и ссылки, процитированные выше). Кроме того, гены, кодирующие предполагаемый регулятор TGF-β1 и/или которые оказывают их эффекты в прямом направлении или в обратном направлении TGF-P1, могут быть идентифицированы с использованием, например, инсерционного мутагенеза, применяя, например, ген-направленные векторы, известные в данной области техники. Указанные соединения также могут быть функциональными производными или аналогами известных ингибиторов. Такие полезные соединения могут быть, например, трансактивирующими факторами, которые связываются с TGF-R или TGF-RII, или регуляторными последовательностями гена, кодирующего его. Идентификацию трансактивирующих факторов можно провести, используя стандартные в данной области техники способы. Для определения того, связывается ли белок с самим белком или регуляторными последовательностями, можно осуществить стандартные анализы смещения в нативном геле. Для того, чтобы идентифицировать трансактивирующий фактор, который связывается с белком или регуляторной последовательностью, эти белок или регуляторную последовательность можно использовать в качестве аффинного реагента в стандартных способах очистки белка или в качестве зонда для скрининга библиотеки экспрессируемых последовательностей. Идентификация молекул нуклеиновых кислот, кодирующих полипептиды, которые взаимодействуют с TGF-R или TGF-RII, также может быть достигнута, например как описано Scofield для TGF-β1 (Science 274 (1996), 2063-2065), путем использования так называемой дрожжевой «двухгибридной системы». В этой системе TGF-β1 связывают с ДНК-связывающим доменом транскрипционного фактора GAL4. Штамм дрожжей, экспрессирующий этот слитый полипептид и включающий ген-репортер lacZ, активируемый подходящим промотором, который распознается транскрипционным фактором GAL4, трансформируют библиотекой кДНК, которая будет экспрессировать растительные белки или их пептиды, слитые с доменом активации. Таким образом, если пептид, кодируемый одной из кДНК, способен взаимодействовать со слитым пептидом, содержащим пептид, например TGF-R или TGF-RII, комплекс способен управлять экспрессией гена-репортера. Этим путем, например, можно использовать TGF-R или TGF-RII и ген, кодирующий каждый рецептор, для идентификации пептидов и белков, взаимодействующих с TGF-R или TGF-RII. Для специалиста в данной области очевидно, что эту и подобные системы можно затем дополнительно использовать для идентификации ингибиторов. Наконец, настоящее изобретение относится к применению соединения, идентифицированного способом, описанным выше, для изготовления фармацевтической композиции для предупреждения или лечения заболевания, при котором нейрогенез или нейрорегенерация имеют полезный эффект. Пример, приведенный ниже, объясняет изобретение более подробно.
Настоящее изобретение также относится к способам идентификации эффектов лечения или предупреждения/профилактики в популяции стволовых клеток/клеток-предшественников, индуцированных модуляцией системы TGF-R или TGF-RII. Это может быть особенно полезным в установлении успешного режима лечения индивидуального пациента, давая, например, индивидуальную дозировку. Способы диагностики включают:
(а) системное применение специфических антител, направленных против TGF-R или TGF-RII и меченных либо специфичными нуклидами для диагностики при помощи ядерной медицины (йод, технеций, фтор 18), либо солями гадолиния, перфторуглеродами или другими редкоземельными продуктами/парамагнитными соединениями/частицами железа для применения в магнитно-резонансной томографии. В данном контексте может быть необходимым кратковременное открытие гематоэнцефалического барьера в субэпендимальном слое в случае отсутствия достаточного отношения сигнала к шуму; хотя эта область является в высокой степени васкуляризированной, и контраст может быть достаточным для визуализации с использованием установки 3 Tesla, открытие гематоэнцефалического барьера (ГЭБ) может обеспечить дополнительную помощь. Это может быть сделано либо внутривенными (в.в) гиперосмолярными растворами (например, глицерином), либо VEGF (Vascular Endotelial Growth Factor, эндотелиальный фактор роста сосудов);
(б) системное применение олигонуклеотидов (тех же самых молекул, что и упомянутые выше), специфичных к TGF-R или TGF-RII: они могут быть мечеными следующим образом:
Gd или 111In - DTPH (5'ХХХХХХХХХХХХХХХХХ3'-биотин) - (SA- или ОХ 26, 8D3 или Ak-HIR) (в соответствии с чем Gd используют для ЯМР-томографии, 111In используют для радиодиагностики; ОХ 26 используют для экспериментов на мышах, и он имеет в качестве мишени мышиные трансферриновые рецепторы, 8D3 представляет собой мышиное антитело против крысиного трансферринового рецептора, Ak-HIR представляет собой антитело, направленное против человеческого инсулинового рецептора). Эти соединения могут гибридизоваться и передавать сигнал только в тех клетках, которые имеют активную мРНК для TGF-R или TGF-RII. DTPH используют в качестве хелатообразующего агента, Ak-HIR использует инсулиновый рецептор для челночного транспорта олигонуклеотидов через различные барьеры, в случае антител против трансферринового рецептора последний используют для трансмембранного челночного транспорта. В тех клетках, где имеется большое количество мРНК и, следовательно, может быть выявлен значительно более сильный сигнал, существует дифференциальная устойчивость гибридизации (Susuki Т, Schlachetzki F, et al. J. Nucl. Med. 45: 1766-1775, 2004, Susuki Т, Zhang Y, Zhang Y-f, Schlachetzki F, Pardridge et al., Mol. Imaging 2005, 3, 356-363);
(в) системное применение олигонуклеотидов (тех же самых молекул, что и упомянутые выше), специфичных к Doublecortin (DCX) с таким же мечением, как и в (б) (смотри WO 2004067751).
Предпочтительно в фармацевтической композиции такое соединение, как описано выше, объединяют с фармацевтически приемлемым носителем. Подразумевают, что «фармацевтически приемлемый» охватывает любой носитель, который не препятствует эффективности биологического действия активного ингредиента и который не является токсичным для организма хозяина, которому его вводят. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают физиологические растворы, забуференные фосфатом, воду, эмульсии, такие как эмульсии масло/вода, различные типы увлажняющих агентов, стерильные растворы и так далее. Такие носители могут быть включены в состав препарата традиционными способами, и активное соединение может быть введено субъекту в эффективной дозе. «Эффективная доза» относится к количеству активного ингредиента, которое является достаточным для воздействия на течение и тяжесть заболевания, приводя к уменьшению или ремиссии такой патологии. «Эффективная доза», полезная для лечения и/или предупреждения этих заболеваний или расстройств, может быть определена с использованием способов, известных специалисту в данной области. Введение подходящих композиций может быть осуществлено различными способами, например внутривенным, внутрибрюшинным, подкожным, внутримышечным, местным или внутрикожным введением. Путь введения, конечно, зависит от рода терапии и вида соединения, содержащегося в фармацевтической композиции. Кроме того, соединения по настоящему изобретению можно смешивать и вводить вместе с липосомами, комплексообразующими агентами, молекулами, нацеленными на рецептор, растворителями, консервантами и/или разбавителями.
Предпочтительными являются фармацевтические препараты в форме инфузионных растворов или твердых матриц для непрерывного высвобождения активного ингредиента, особенно для непрерывного высвобождения по меньшей мере одного антисмыслового олигонуклеотида, или его вариантов, или миметиков. Более предпочтительными являются фармацевтические препараты в форме растворов или твердых матриц, подходящих для местного введения в головной мозг.
Режим дозирования будет определен лечащим врачом или определяться другими клиническими факторами. Как хорошо известно в области медицины, дозировки для любого пациента зависят от многих факторов, включая массу тела пациента, площадь поверхности тела, возраст, пол, конкретное соединение, которое нужно вводить, время и путь введения, род терапии, общее состояние здоровья и другие лекарства, вводимые одновременно.
Настоящее изобретение относится к фармацевтическим препаратам, содержащим по меньшей мере один олигонуклеотид, его варианты или миметики, как раскрыто выше. Вместо по меньшей мере одного антисмыслового олигонуклеотида, или в дополнение к нему, может присутствовать по меньшей мере одно антисмысловое соединение. Антисмысловые соединения относятся к векторам, позволяющим транскрибировать антисмысловой олигонуклеотид, особенно один из антисмысловых олигонуклеотидов, раскрытых здесь, или к рибозимам, внешним вспомогательным последовательностям (EGS), олигозимам и коротким каталитическим РНК или каталитическим олигонуклеотидам, которые гибридизуются с нуклеиновой кислотой-мишенью, кодирующей TGF-R или TGF-RII. Указанное антисмысловое соединение ингибирует экспрессию TGF-R или TGF-RII и предпочтительно способно снижать количество образуемых TGF-R или TGF-RII соответственно.
В предпочтительном воплощении настоящего изобретения заболевание, которое можно предупреждать и/или лечить, представляет собой нейродегенеративное расстройство, нейровоспалительное расстройство ЦНС, острое ишемическое или травматическое гипоксическое поражение мозга. Предпочтительные примеры нейродегенеративных или нейровоспалительных расстройств представляют собой болезни Альцгеймера, болезнь Паркинсона, болезнь Крейтцфельда-Якоба (CJD), новый вариант болезни Крейтцфельда-Якоба (nvCJD), болезнь Халлервордена-Шпатца, болезнь Гентингтона, мультисистемную атрофию, деменцию, лобно-височную деменцию, расстройства двигательных нейронов, боковой амиотрофический склероз, спинномозговую мышечную атрофию, спиномозжечковые атрофии (SCAs), шизофрению, аффективные расстройства, большую депрессию, менингоэнцефалит, бактериальный менингоэнцефалит и вирусный менингоэнцефалит (предупреждение поствоспалительного подавления пролиферации стволовых клеток), аутоиммунные расстройства ЦНС, болезни, подобные рассеянному склерозу (MS), острые ишемические/гипоксические поражения, травму ЦНС, травму головы, артериосклероз, атеросклероз, микроангиопатическую деменцию, болезнь Бинсвангера, лейкоараиоз, деменцию, связанную со СПИДом, связанный с хрупкой Х-хромосомой тремор/атаксический синдром (FXTAS), прогрессирующий супрануклеарный паралич (PSP), дегенерацию полосатого тела и черной субстанции (SND), оливопонтомозжечковую дегенерацию (OPCD), синдром Шая-Дрейджера (SDS), дегенерацию сетчатки, дегенерацию желтого пятна, пигментный ретинит, дегенерацию ушной улитки, улитковую глухоту. Также можно указать зависимое от возраста снижение обновления стволовых клеток.
Примеры
Пример 1
TGF-β1 ингибирует пролиферацию нервных стволовых клеток и клеток-предшественников взрослых грызунов
Самок взрослых мышей (различные линии) или крыс Fischer-344 (3-4-месячных; Charles River, Germany) умерщвляют, головной мозг и спинной мозг извлекают и помещают в DPBS (PAN, Germany) с 4,5 г/л глюкозы (Merck, Germany) (DPBS/glu), имеющий температуру 4°С. Покрывающие оболочки мозга и кровеносные сосуды удаляют. Асептически удаляют гиппокамп и эпендимальные зоны, включая субэпендимальные и субвентрикулярные зоны из боковой стенки бокового желудочка (SVZ). Препарированную ткань переносят на свежий DPBS/glu, промывают один раз, переносят в чашки Петри и механически разъединяют. Клеточную суспензию промывают в DPBS/glu, чтобы отмыть избыток крови, и ресуспендируют в растворе PPD, содержащем 0,01% папаин (Worthington Biochemicals, England), 0,1% диспазу II (Boehringer, Mannheim Mannheim, Germany), 0,01% ДНКазу I (Worthington Biochemicals) и 12,4 мМ MgSO4 в HBSS (PAN) без Mg2/Ca2 (PAA, Germany), и подвергают разложению в течение 30-40 минут при комнатной температуре. Клеточную суспензию растирают каждые 10 минут. Разъединенные клетки собирают и ресуспендируют в свободной от сыворотки среде DMEM/F12, содержащей 2 мМ L-глутамин и 0,1 г/л пенициллина/стрептомицина, и промывают три раза с аккуратным растиранием. Наконец, суспензию одиночных клеток ресуспендируют в среде NB (Gibco BRL, Germany), дополненной В27 (Gibco BRL) (NB/B27), 2 мМ L-глутамином (PAN), 0,1 г/л пенициллина/стрептомицина (PAN), 2 г/мл гепарина (Sigma, Taufkirchen, Germany), 20 нг/мл bFGF-2 (R&D Systems, Germany) и 20 нг/мл EGF (R&D Systems, Germany). Жизнеспособные клетки подсчитывают в гемоцитометре путем анализа исключения трипанового синего. Клетки высевают в колбы для культивирования Т-25 и культуры поддерживают при 37°С в инкубаторе с 5% CO2. Одиночные клетки начинают образовывать сферы в пределах 5-7 суток суспензионной культуры и продолжают расти по массе и по количеству в течение следующих недель. Половину среды заменяют каждые 7 суток. Для экспериментов используют клетки с числом пассажей от 3 до 20 (Wachs, F.P., S. Couillard-Despres, et al., Lab Invest 2003, 83(7), 949-962). На культуры нервных стволовых клеток и клеток-предшественников в дальнейшем ссылаются как на NSC. Для процесса разъединения культуральную среду, содержащую плавающие нейросферы, собирают в 15-мл центрифужные пробирки и центрифугируют при относительной центрифужной силе (rcf) 120 в течение 5 минут. Осадок ресуспендируют в 200 мкл Аккутазы (Accutase, Innovative Cell Technologies Inc., распространяемая РАА) и растирают приблизительно 10 раз, используя пипетку. Затем инкубируют клеточную суспензию при 37°С в течение 10 минут. Разъединенные сферы снова растирают и ресуспендируют в 800 мкл среды NB/B27. Разъединенные клетки центрифугируют при 120 rcf в течение 5 минут и ресуспендируют в среде NB/B27. Аликвоту подсчитывают в гемоцитометре путем анализа исключения трипанового синего, чтобы определить количество жизнеспособных клеток. Клетки (105) на протяжении долговременных пассажей высевают в колбы для культивирования Т75 (10 мл культуральной среды на колбу) в среду NB/B27. Клетки, полученные после обработки Аккутазой пролиферата первичных нейросфер, дают вторичные нейросферы. Вторичные нейросферы пассируют через 7-9 суток после высевания первичных клеток нейросфер. Подобно первичным культурам и первичным нейросферам, одиночные клетки, полученные после разъединения пролиферата вторичных нейросфер, дают третичные нейросферы (Wachs, P.P., S. Couillard-Despes, et al. Lab Invest 2003, 83(7), 949-962).
104 NSC высевают в 12-луночные планшеты в среду NB/B27 в объеме 1 мл и выращивают в течение 7 суток. Через 2 часа, 3 суток и 6 суток после посева клетки стимулируют добавлением различных концентраций (0, 2,5, 5, 10, 50 и 100 нг/мл) рекомбинантного человеческого трансформирующего фактора роста β1 (TGF-β1) (R&D Systems, Germany). На 7-е сутки культуры разъединяют путем применения Accutase™ и жизнеспособные клетки подсчитывают в гемоцитометре путем анализа исключения трипанового синего. TGF-β1 ингибирует in vitro пролиферацию взрослых нервных стволовых клеток и клеток-предшественников дозозависимым образом (Фиг.1А).
Подобный эффект наблюдали на человеческих зародышевых нервных клетках-предшественниках. Обработка 50 нг/мл TGF-β1 снижала пролиферацию клеток до примерно 50% от контроля в пределах 7 суток (Фиг.1Б).
Пример 2
Эффект TGF-β1 на нервные стволовые клетки и клетки-предшественники является обратимым
Для определения того, является ли ингибирование роста, индуцированное TGF-β1, обратимым эффектом, NSC стимулировали 10 нг/мл TGF-β1 в течение 7 суток согласно протоколу, описанному в примере 1. После разъединения жизнеспособные клетки подсчитывают в гемоцитометре путем анализа исключения трипанового синего и 104 NSC, стимулированных ростовым фактором, вновь высевают и культивируют в присутствии или в отсутствие 10 нг/мл TGF-β1 согласно протоколу, описанному в примере 1. Эту процедуру разъединения/подсчета/пересева проводят каждые 7 суток. Как показано на Фиг.2, через 3 недели культуры скорость пролиферации клеток, первоначально обработанных TGF-β1, выращенных теперь без TGF-β1, возвращается к нормальной по сравнению с ранее необработанными клетками. Это указывает на то, что эффект TGF-β1 на взрослые нервные стволовые клетки и клетки-предшественники является обратимым. Долговременная инкубация с TGF-β1 дополнительно не снижает пролиферацию клеток.
Пример 3
Антитела против TGF-βRII могут снижать эффекты TGF-β1 на NSC взрослых грызунов
Нестимулированные семисуточные нейросферы с низким числом пассажей разъединяют путем применения Accutase™, как описано в примере 1. Образующуюся суспензию одиночных клеток использовали для анализа блокирования. NSC взрослых грызунов высевали с плотностью 104 клеток в 12-луночные планшеты в среду NB/B27 в объеме 1 мл. Через 2 часа после посева и за 1 час до стимуляции 10 нг/мл TGF-β1 в культуральную среду добавляли различные концентрации нейтрализующих анти-TGF-βRII антител (R&D Systems, Germany). Через 3 суток и 6 суток после посева клетки повторно стимулировали добавлением анти-TGF-βRII антител и TGF-β1 идентично методике, проведенной на 1-е сутки. На 7-е сутки культуры разъединяют путем применения Accutase™ и жизнеспособные клетки подсчитывают в гемоцитометре путем анализа исключения трипанового синего. Интересно, что само по себе добавление анти-TGF-βRII антител снижает пролиферацию NSC. Антитела против TGF-βRII способны только частично ингибировать эффекты, индуцированные TGF-β1, даже в самых высоких используемых концентрациях (10 мкг/мл) (Фиг.3).
Пример 4
Растворимый TGF-RII полностью ингибирует подавление пролиферации NSC, индуцированное TGF-β1
Согласно протоколу производителей (R&D Systems, Germany) последовательность ДНК, кодирующую 159 аминокислотных остатков внеклеточного домена человеческого TGF-βRII (Lin et al., Cell 1992, 68(4), 775-785), подвергали слиянию с областью Fc человеческого lgG1 и химерный белок экспрессировали в клеточной линии мышиной миеломы NSO. Нестимулированные семисуточные нейросферы с низким числом пассажей разъединяют путем применения Accutase™, как описано в примере 1. Образующуюся суспензию одиночных клеток использовали для анализа блокирования. NSC взрослых грызунов высевали с плотностью 104 клеток в 12-луночные планшеты в среду NB/B27 в объеме 1 мл. Через 2 часа после посева и за 1 час до стимуляции 10 нг/мл TGF-β1 в культуральную среду добавляли различные концентрации биоактивного растворимого рекомбинантного человеческого TGF-βsRII/Fc Chimera (R&D Systems, Germany). Через 3 суток и 6 суток после посева клетки повторно стимулируют добавлением TGF-βsRII/Fc Chimera и TGF-β1 идентично методике, проведенной на 1-е сутки. На 7-е сутки культуры разъединяют путем применения Accutase™ и жизнеспособные клетки подсчитывают в гемоцитометре путем анализа исключения трипанового синего. Интересно, что добавление TGF-βsRII/Fc Chimera способно полностью блокировать эффекты, индуцированные TGF-β1, дозозависимым образом (данные не показаны). Очевидно, что нейтрализация активного TGF-β1 в супернатанте клеточной культуры путем предварительного введения растворимого рекомбинантного человеческого TGF-βsRII/Fc Chimera (растворимый TGF-βRII) полностью блокирует подавление роста взрослых нервных стволовых клеток и клеток-предшественников, индуцированное TGF-β1 (Фиг.4).
Пример 5
Клетки, экспрессируюшие TGF-βRII, могут быть выделены с использованием методик сортировки клеток
Существующие способы не позволяют осуществлять быстрое и надежное выделение и очистку нервных стволовых клеток и клеток-предшественников. Для исследования возможности выделения чистых популяций нервных стволовых клеток и клеток-предшественников, основанной на экспрессии определенных поверхностных маркеров, авторы изобретения выделили нервные стволовые клетки и клетки-предшественники благодаря экспрессии TGF-βRII разными методиками. Возможно выделение нервных стволовых клеток и клеток-предшественников, экспрессирующих TGF-βRII, двумя методиками: 1) сортировкой на клеточном сортере с активацией флуоресценции (FACS) (данные не показаны) и 2) магнитно-активируемой клеточной сортировкой (MACS). Разъединенные взрослые нервные стволовые клетки и клетки-предшественники инкубируют с 10 мкг/мл первичных антител против TGF-RII (R&D Systems, Germany) в течение 20 мин при комнатной температуре. После 1 стадии промывки забуференным фосфатом физиологическим раствором (PBS) клетки инкубируют с вторичным кроличьим антителом против РЕ козы (1:500) (Dianova). После 1 стадии промывки PBS клетки окрашивают третичными антителами против РЕ, связанными с парамагнитными шариками, согласно протоколу производителей (Miltenyi Biotech, Germany). Клеточную суспензию подвергают магнитно-активируемой сортировке, используя систему MACS, согласно протоколу производителей (Miltenyi Biotech, Germany), и отрицательные и положительные клетки после сортировки подсчитывают и включают в культуру (Фиг.5). Приблизительно 20% от всех сортированных клеток давали положительное окрашивание на TGF-βRII.
Пример 6
Антисмысловые олигонуклеотиды против TGF-βRII ингибируют индуцированную TGF-β1 негативную регуляцию пролиферации взрослых нервных стволовых клеток и клеток-предшественников in vitro
Клетки получали, разъединяли и высевали, как описано в примере 1. Затем клетки инкубировали в течение 1 недели в присутствии или в отсутствие 10 нг/мл TGF-β1, 10 мкМ антисмыслового олигонуклеотида TGF-βRII 5'-cagcccccgacccatg-3' (SEQ ID NO: 3), смыслового олигонуклеотида 5'-catgggtcgggggctg-3' или миссенс-олигонуклеотида 5'-catccccggacccgtg-3'. Олигонуклеотиды модифицировали фосфотиоатами и ежесуточно заменяли среду с олигонуклеотидами. Обратите внимание, что ингибирование пролиферации нервных стволовых клеток и клеток-предшественников, индуцированное TGF-β1, полностью и специфически блокировалось антисмысловой (SEQ ID NO: 3) обработкой (Фиг.6).
Пример 7
Обработка in vivo специфичными к TGF-RII антисмысловыми олигонуклеотидами снимает индуцированное TGF-β1 блокирование пролиферации клеток во взрослом головном мозге
Этот пример демонстрирует 1) эффект инфузии TGF-β1 на пролиферацию нервных стволовых клеток и клеток-предшественников in vivo и 2) отмену этого эффекта путем обработки антисмысловым олигонуклеотидом к TGF-βRII. Таким образом, был осуществлен следующий эксперимент.
В течение двух недель осуществляли инфузию TGF-β1 интравентрикулярно с последующей совместной инфузией TGF-β1 с олигонуклеотидами. Эксперименты на животных проводили в соответствии с директивой совета Европейского Экономического Сообщества от 24 ноября 1986 (86/609/ЕЕС). Канюли из нержавеющей стали, соединенные с осмотическими мининасосами (модель 2001, Alza, Stadt, Land), имплантировали, как описано, двухмесячным самцам крыс Fischer-344 (n=24) для интрацеребровентрикулярной инфузии. Животные получали либо рекомбинантный TGF-β1 (500 нг/мл, присутствующие в насосе), либо искусственную спинномозговую жидкость (иСМЖ) в качестве контроля (n=8 в каждом случае) со скоростью потока 0,5 мкл/ч в течение двух недель. После второй недели насосы заменяли и в течение следующих двух недель осуществляли инфузию в желудочки иСМЖ, TGF-β1 (500 нг/мл, присутствующие в насосе) или TGF-β1 (500 нг/мл, присутствующие в насосе) в комбинации с фосфотиоатными олигонуклеотидами (1,64 мМ концентрация, присутствующая в насосе). Олигонуклеотиды были такими же, как описано в примере 6. На 27-е сутки животные получали однократную внутрибрюшинную инъекцию 200 мг/кг бромдезоксиуридина (BrdU). Спустя одни сутки животным проводили внутрисердечную перфузию 4%-ным параформальдегидом. Ткань обрабатывали для хромогенного или эпифлуоресцентного иммунологического обнаружения в 40 мкм сагиттальных срезах, как описано. Эпифлуоресцентный анализ проводили, используя микроскоп Leica (Leica Mikroskopie und Systeme GmbH, Wetzlar, Germany), оснащенный цифровой камерой Spot™ (Diagnostic Instrument Inc, Sterling Heights, USA), или конфокальным сканирующим лазерным микроскопом (Leica TCS-NT, Bensheim, Germany). Первичными антителами были: крысиные α-BrdU 1:250 (Oxford Biotechnology, Oxford, UK). Вторичными антителами были: ослиные, α-козьи, мышиные, кроличьи или крысиные, конъюгированные с флуоресцеином (FITC, флуоресцеинизотиоцианат), родамином Х (RHOX), CY5 или биотином 1:500 (Jackson Immuno Research, West Grove, PA, USA). Для подсчета использовали систематическую и случайную методику. BrdU-положительные клетки подсчитывали в трех рамках 50 мкм × 50 мкм для подсчета на срез, расположенных в самой нижней, средней и верхней частях SVZ. Положительные профили, которые пересекали самую верхнюю фокальную плоскость (плоскость исключения) или боковые границы исключения рамки для подсчета, не подсчитывали. Общее количество положительных профилей умножали на отношение контрольного объема к объему пробы для того, чтобы получить оцениваемое число BrdU-положительных клеток для каждой структуры. Все экстраполяции рассчитывали для одного полушария мозга, и их следует удвоить, чтобы они представляли общие значения для мозга. Данные представлены в виде средних значений ± стандартные отклонения (SD). Статистический анализ проводили, используя непарный двухсторонний сравнительный критерий - t-критерий Стьюдента между обработанной TGF-β1 и контрольной группами (StatView Software, Gary, NC, USA). Уровень значимости принимали как p<0,05.
Фиг.7 демонстрирует индуцированную TGF-β1 негативную регуляцию пролиферации клеток в зубчатой извилине гиппокампа (Фиг.7А) и в субвентрикулярной зоне (Фиг.7Б). Обработка миссенс-олигонуклеотидом не блокировала этот эффект. Напротив, обработка антисмысловым олигонуклеотидом (SEQ ID NO: 3) блокировала эффект TGF-β1 (Фиг.7А и Б).
Пример 8
Обработка in vivo специфичными к TGF-RII антисмысловыми олигонуклеотидами предотвращает блокировку пролиферации клеток, индуцированную TGF-β1, во взрослом мозге
Этот пример демонстрирует, что обработка антисмысловым олигонуклеотидом против TGF-βRII может предотвратить негативную регуляцию пролиферации клеток, индуцированную TGF-β1, во взрослом мозге.
В течение одной недели осуществляли интравентрикулярно инфузию олигонуклеотидов с последующей совместной инфузией TGF-β1 с олигонуклеотидами. Эксперименты на животных проводили в соответствии с директивой совета Европейского Экономического Сообщества от 24 ноября 1986 (86/609/ЕЕС). Канюли из нержавеющей стали, соединенные с осмотическими мининасосами (модель 2001, Alza, Stadt, Land), имплантировали, как описано, двухмесячным самцам крыс Fischer-344 (n=24) для интрацеребровентрикулярной инфузии. Животные получали либо фосфотиоатные олигонуклеотиды (1,64 мМ концентрацию, присутствующую в насосе), либо иСМЖ на протяжении первой недели, и иСМЖ, TGF-β1 (500 нг/мл, присутствующие в насосе) или совместную инфузию TGF-β1 (500 нг/мл, присутствующие в насосе) и фосфотиоатных олигонуклеотидов (1,64 мМ концентрацию, присутствующую в насосе) на протяжении второй и третьей недели. Олигонуклеотиды были описаны в примере 6. На 20-е сутки животные получали однократную внутрибрюшинную инъекцию 200 мг/кг бромдезоксиуридина (BrdU). Спустя одни сутки животным проводили внутрисердечную перфузию 4%-ным параформальдегидом. Ткань обрабатывали и анализировали, как описано в примере 7. Фиг.8 демонстрирует, что негативная регуляция пролиферации клеток, индуцированная TGF-β1, в зубчатой извилине гиппокампа (Фиг.8А) и в субвентрикулярной зоне (Фиг.8Б) может быть предотвращена предварительной обработкой TGF-βRII антисмысловым олигонуклеотидом (SEQ ID NO: 3).
Пример 9
Фармацевтический препарат, содержащий по меньшей мере один антисмысловой олигонуклеотид
Три репрезентативных водных препарата антисмысловых олигонуклеотидов:
1. В иСМЖ: 148,0 мМ NaCl, 3,0 мМ KCl, 1,4 мМ CaCl2, 0,8 мМ MgCl2, 1,5 мМ
Na2HPO4, 0,2 мМ NaH2PO4, pH 7,4, 100 мкг/мл сывороточного альбумина крысы, 50 мкг/мл гентамицина.
2. В 0,9%-ном NaCl.
3. В H2O.














































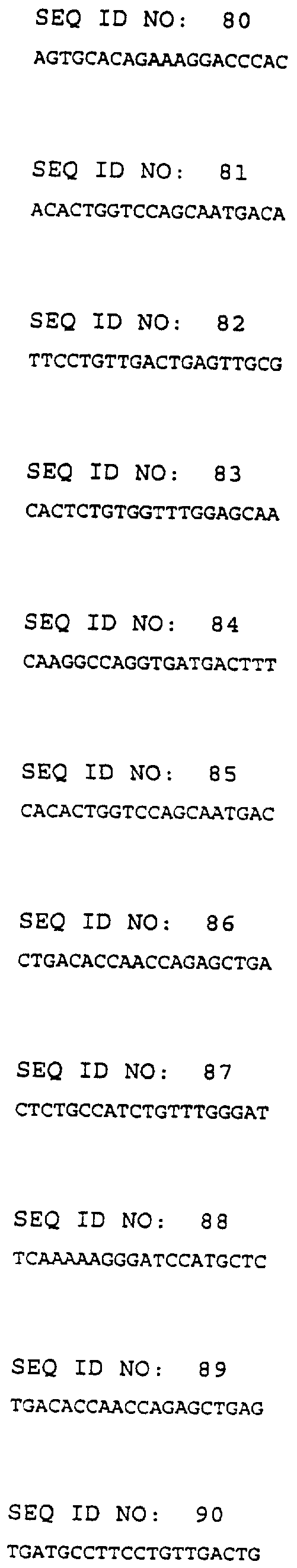





















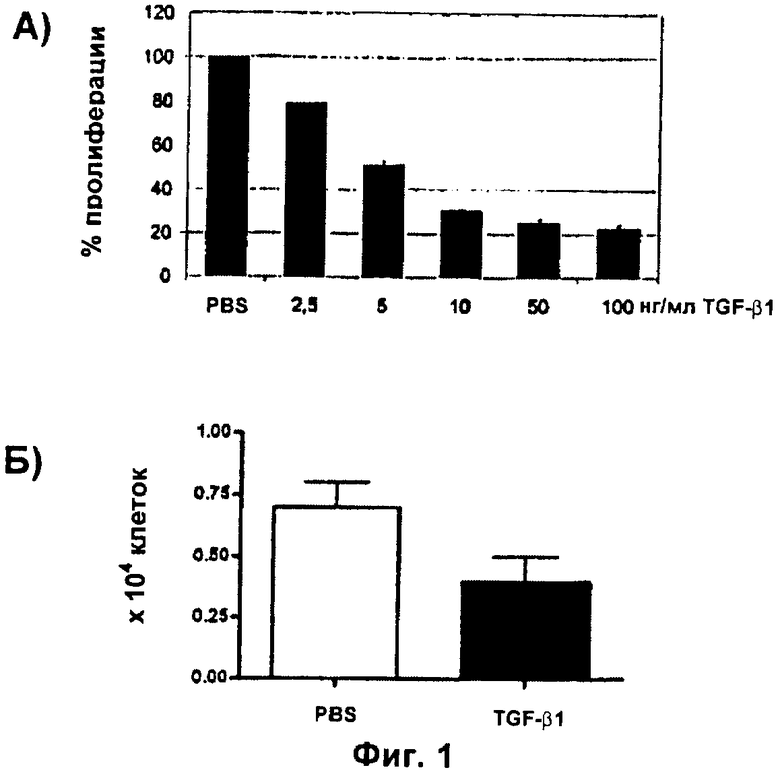
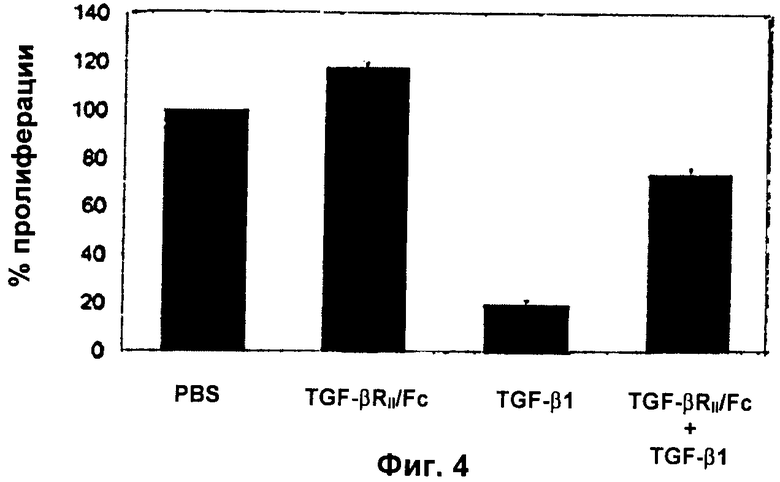
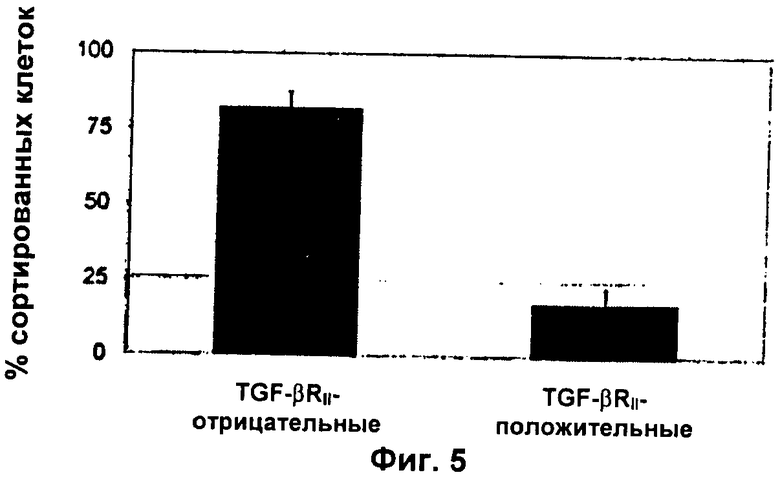
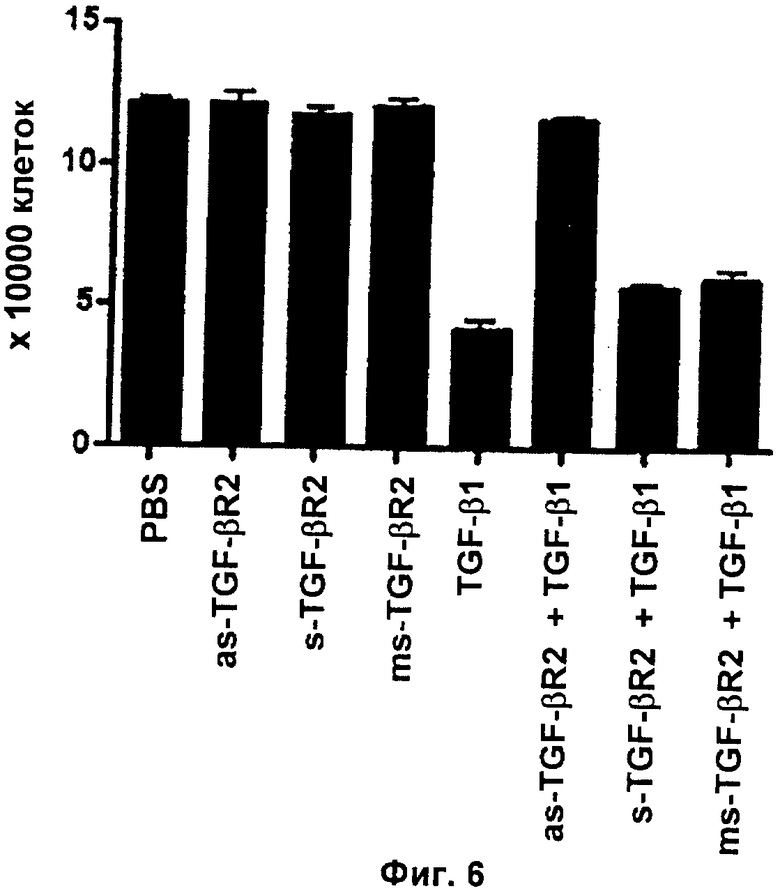
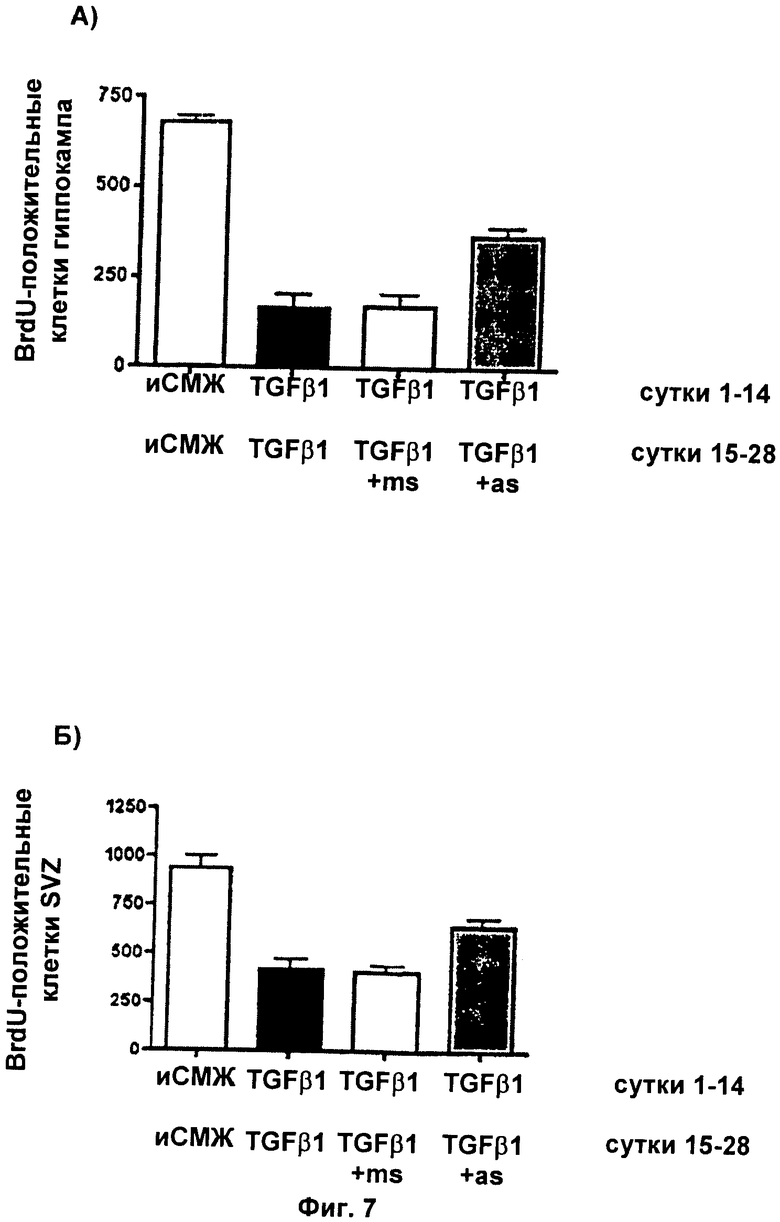
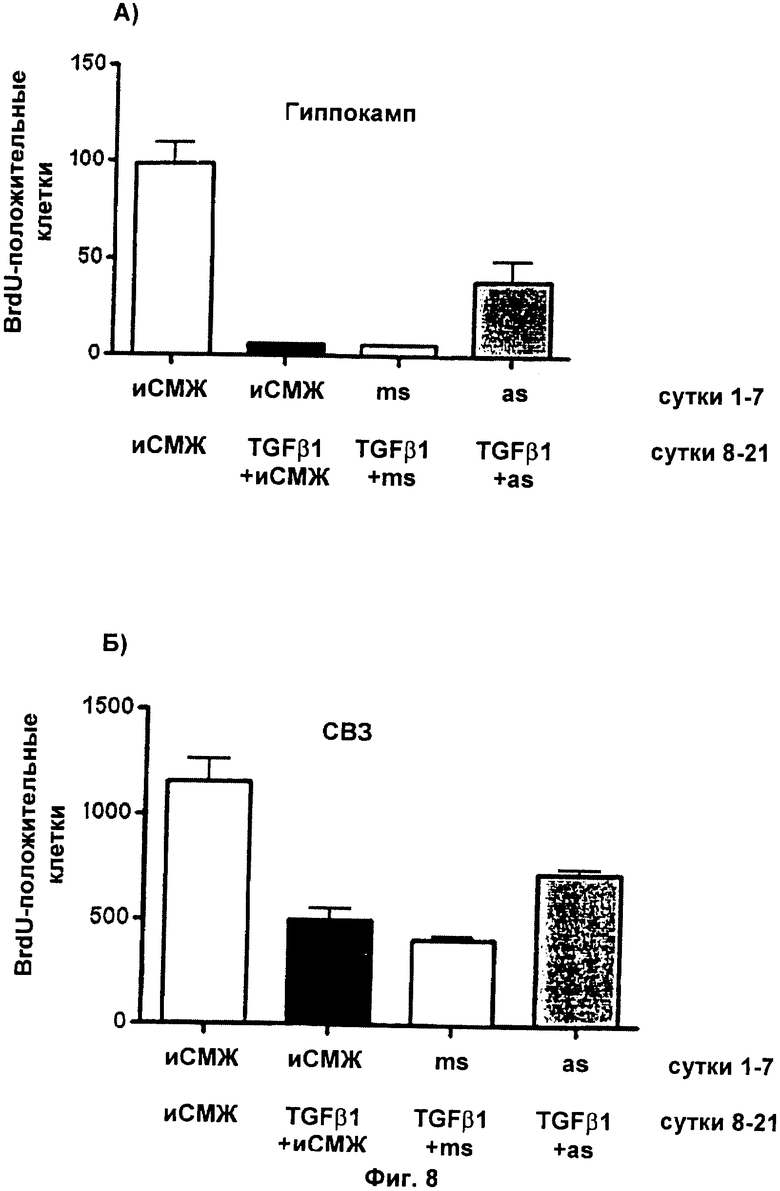
Изобретение относится к биотехнологии. Описан олигонуклеотид, имеющий последовательность, по меньшей мере на 80% идентичную последовательности, приведенной в материалах заявки, и где указанная последовательность способна специфически гибридизоваться с участком, включающим инициирующий или терминирующий кодон трансляции открытой рамки считывания гена, кодирующего TGF-RI или TGF-RII, или участком мРНК, кодирующей TGF-RI или
TGF-RII, который представляет собой «петлю» или «выпячивание» и который не является частью вторичной структуры. Представлен фармацевтический препарат, содержащий описанный олигонуклеотид, предназначенный для ингибирования индуцированного TGF-β1 блокирования пролиферации нервных клеток. Изобретение может быть использовано для лечения или предупреждения заболевания, где нейрогенез и/или нейрорегенерация имеют полезный эффект. 4 н. и 3 з.п. ф-лы, 8 ил.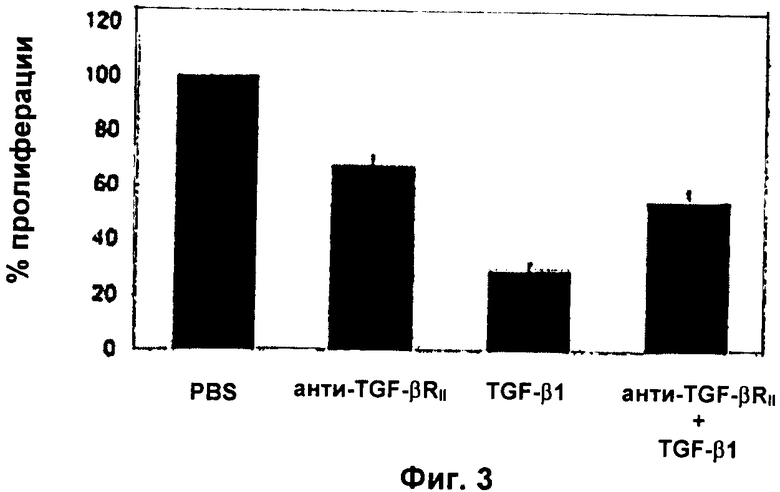
1. Олигонуклеотид, имеющий последовательность, по меньшей мере на 80% идентичную субпоследовательности от SEQ ID NO 3 до SEQ ID NO 32, или от SEQ ID NO 34 до SEQ ID NO 72, или SEQ ID NO 93, или SEQ ID NO 94, или SEQ ID NO 95, или SEQ ID NO 96, содержащий от 8 до 50 нуклеотидных оснований, где на 3'-концевом участке и/или 5'-концевом участке указанной последовательности добавлены 1, 2, 3, 4 или 5 дополнительных нуклеотидных оснований, и где указанная последовательность способна специфически гибридизоваться с участком, включающим инициирующий или терминирующий кодон трансляции открытой рамки считывания гена, кодирующего TGF-RI или TGF-RII, или участком мРНК, кодирующей TGF-RI или
TGF-RII, который представляет собой «петлю» или «выпячивание» и который не является частью вторичной структуры, и фосфотиоатное производное и соли указанной последовательности, где указанный олигонуклеотид не является последовательностью, представленной SEQ ID NO 33.
2. Олигонуклеотид по п.1, выбранный из группы, содержащей:
3. Фармацевтический препарат, содержащий по меньшей мере один олигонуклеотид по любому из пп.1 и 2, а также его фосфотиоатное производное и соли и/или по меньшей мере один вектор, позволяющий транскрибировать по меньшей мере один указанный олигонуклеотид, вместе с по меньшей мере одним фармацевтически приемлемым носителем, эксципиентом или разбавителем, для ингибирования индуцированного TGF-β1 блокирования пролиферации нервных клеток.
4. Фармацевтический препарат по п.3, представляющий собой инфузионный раствор или твердую матрицу для непрерывного высвобождения активного ингредиента.
5. Применение по меньшей мере одного олигонуклеотида по любому из пп.1 или 2 или фармацевтического препарата по любому из пп.3 или 4 для стимулирования успешной регенерации и функционального восстановления поврежденных нервных проводящих путей.
6. Применение по меньшей мере одного олигонуклеотида по любому из пп.1 или 2 или фармацевтического препарата по любому из пп.3 или 4 для профилактики, терапевтического предупреждения и лечения нейродегенеративных, травматических/посттравматических, сосудистых/гипоксических, нейровоспалительных и постинфекционных расстройств центральной нервой системы, а также вызванного возрастом снижения обновления нейрональных стволовых клеток.
7. Применение по п.6, где нейродегенеративные расстройства и нейровоспалительные расстройства выбраны из группы, включающей: болезни Альцгеймера, болезнь Паркинсона, болезнь Крейтцфельда-Якоба (CJD), новый вариант болезни Крейтцфельда-Якоба (nvCJD), болезнь Халлервордена-Шпатца, болезнь Гентингтона, мультисистемную атрофию, деменцию, лобно-височную деменцию или другие расстройства двигательных нейронов, боковой амиотрофический склероз, спинальную мышечную атрофию, спиномозжечковые атрофии (SCA), шизофрению, аффективные расстройства, большую депрессию, менингоэнцефалит, бактериальный менингоэнцефалит, вирусный менингоэнцефалит, аутоиммунные расстройства ЦНС, рассеянный склероз (MS), острые ишемические/гипоксические поражения, инсульт, травму ЦНС и спинного мозга, травму головы и позвоночника, артериосклероз, атеросклероз, микроангиопатическую деменцию, болезнь Бинсвангера (лейкоараиоз), дегенерацию сетчатки, дегенерацию ушной улитки, дегенерацию желтого пятна, улитковую глухоту, деменцию, связанную со СПИДом, пигментный ретинит, связанный с хрупкой Х-хромосомой тремор/атаксический синдром (FXTAS), прогрессирующий супрануклеарный паралич (PSP), дегенерацию полосатого тела и черной субстанции (SND), оливопонтомозжечковую дегенерацию (olivopontocerebellear degeneration, OPCD), синдром Шая-Дрейджера (SDS), связанные с возрастом нарушения памяти, расстройства развития нервов, ассоциированные с деменцией, синдром Дауна, синуклеинопатии, мутации супероксиддисмутазы, нарушения тринуклеотидных повторов, травму, гипоксию, сосудистые заболевания, воспаления сосудов, старение ЦНС.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Устройство для моделирования нейрона | 1987 |
|
SU1501101A1 |
Авторы
Даты
2010-04-10—Публикация
2005-02-09—Подача