Изобретение относится к органической химии, конкретно к новым биологически активным соединениям - нитроксипроизводным природных гидроксиаминокислот общей формулы
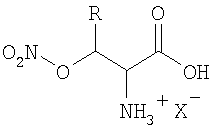
где R=Н или СН3, а X- представляет собой анионный остаток неорганической кислоты.
Заявляемые соединения принадлежат к классу нитроксиалкиламинов и представляют собой О-нитраты природных гидроксиаминокислот.
Гидроксиаминокислоты являются не только распространенными компонентами белков и пептидов, но и обладают собственной биологической активностью. Так, D-серин является природным агонистом глутаматного рецептора NMDA-типа (D.Boehning and S.H.Snyder Annu. Rev. Neurosci. 2003. 26, 105-31) и выполняет роль нейронального модулятора (М. J. Schell et al., Proc. Nat. Acad. Sci. USA 1995, 92, 3948-52). L-Серин наряду с глицином действует как основной астроглиальный трофический фактор для нейронов Пуркинье мозжечка (S. Furuya, Т. Tabata, et al. Proc. Nat. Acad. Sci. USA 2000, 97, 11528-11533). Треонин является незаменимой аминокислотой и используется в качестве пищевой добавки для поддержания правильного белкового баланса в организме.
Известны нитроксиалкиламины, не относящиеся к производным аминокислот, например N-[2-(нитроксиэтил)]-3-пиридинкарбамид, являющийся действующим началом лекарственного препарата никорандил (Merck Index, 13th ed. 2001, Monograph Number: 6548). Описаны также нитроэфиры защищенных дипептидов, содержащих серин (А.Gavrila, L.Andersen, Т.Skrydstrup. Tetrahedron Letters 2005, 46, 6205-6207). Однако О-нитропроизводные природных гидроксиаминокислот не были известны.
Следует отметить, что нитропроизводные серинсодержащих дипептидов не могут быть получены из их производных с защитными группами, поскольку условия их удаления не позволяют сохранить нитроэфирную функцию. По этим же причинам невозможно получить свободные нитроэфиры аминокислот гидролизом нитроэфиров дипептидов.
До настоящего времени не были описаны методы получения и физико-химические свойства заявляемых соединений, которые являются новыми химическими соединениями.
Известны различные способы получения нитроэфиров, включающие обработку спирта дымящей азотной кислотой в присутствии серной кислоты или уксусного ангидрида, смесью гидрата трифторида бора и нитрата калия, а также нитратом лития в присутствии трифторуксусной кислоты и карбоната натрия. Используется также непрямой способ синтеза нитратов обменом галогена на нитрат. Указанные способы могут быть применены и для синтеза заявляемых соединений, однако они имеют недостатки, снижающие выход целевых продуктов. Так использование азотной кислоты в смеси с серной приводит к труднорастворимым сульфатам, применение уксусного ангидрида дает в качестве побочного продукта ацетаты. Реакция обмена галогена на нитрат обычно сопровождается инверсией конфигурации и не может быть использована для получения нитроэфиров природных аминокислот.
Заявляемые соединения могут быть получены с высоким выходом прямым нитрованием как самих гидроксиаминокислот, так и нитрованием их силильных производных в смеси концентрированной азотной кислоты с хлористым метиленом. В обоих случаях целевые соединения выделяются в виде азотнокислых солей, которые далее могут быть превращены в гидрохлориды или другие соли с инертной по отношению к нитрогруппе кислотой, с помощью стандартных методов ионного обмена с использованием доступных ионообменных смол, например Amberlyte A26 (Peers A.M. 1958. J. Appl. Chem. 8, 106; Ю.А.Кокотов. Иониты и ионный обмен, 1980, 150 с. Химия, Ленингр. отделение).
Заявляемые соединения могут быть использованы для синтеза аналогов пептидов (примеры 4-5), в которых серин или треонин заменены на соответствующие нитропроизводные, а также как самостоятельные соединения. Поскольку они являются производными природных аминокислот, можно ожидать проявления у них похожих биологических свойств. Известно, что в организме млекопитающих органические нитраты подвергаются биохимическим превращениям с образованием окиси азота (Feelisch М, Kelm М. 1991. Biochem Biophys Res Commun. 180, 286). Поэтому заявляемые соединения, предположительно, могут выступать в качестве доноров окиси азота, высвобождение которой не будет сопровождаться образованием дополнительных неприродных молекулярных фрагментов. Известно, что высвобождение окиси азота органическими нитратами - ферментативный тиолзависимый процесс (Thatcher G.R.J., Nicolescu A.C., et al. 2004, Free Radical Biology & Medicine, 37, 1122), поэтому спонтанное выделение NO заявляемыми соединениями в растворах не происходит, что обеспечивает их сохранность в фармакологически приемлемых растворителях.
Нитроксиалкиламинокислоты не токсичны, LD50>100 мг/кг.
Приведенные ниже примеры иллюстрируют, но не ограничивают применение данного изобретения.
Пример 1. Азотнокислая соль 2-амино-3-нитроксипропионовой кислоты (L).
1680 мг L-серина (16 мМ) присыпают порциями в течение 10 минут к раствору 3 мл HNO3 (100%) в 20 мл хлористого метилена при температуре 0°С и перемешивают при этой температуре 50 минут. Затем прикапывают 2 мл Ас2O и перемешивают 40 минут при 25°С. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси этанол-хлороформ. Получают 2,14 г азотнокислой соли 2-амино-3-нитроксипропионовой кислоты (63%), белые кристаллы, т.пл.=111-113°С. ПМР-спектр (трифторуксусная кислота), δ, м.д.: 4.93 (1Н, уш.с, СН). 5.25 (2Н, м, CH2), 7.87 (3Н, уш.с, NH2, CO2Н). ИК-спектр (ν, см-1): 1285 (NO2, сим), 1382, 1482, 1644 (NO2, асим), 1733 (СО), 2905.
Пример 2. Азотнокислая соль 2-амино-3-нитроксипропионовой кислоты (D).
840 мг D-серина (8 мМ) присыпают порциями в течение 10 минут к раствору 1,5 мл HNO3 (˜96%) в 10 мл хлористого метилена при температуре 0°С и перемешивают при этой температуре 50 минут. Затем прикапывают 1 мл Ас2О и перемешивают 40 минут при 25°С. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси этанол-хлороформ. Получают 1,3 г азотнокислой соли 2-амино-3-нитроксипропионовой кислоты (75%), белые кристаллы, т.пл.=113-115°С. ПМР-спектр (трифторуксусная кислота), δ, м.д.: 4.93 (1Н, уш.с, СН), 5.25 (2Н, м, СН2), 7.87 (3Н, уш.с, NH2, CO2Н). ИК-спектр (ν, см-1): 1285 (NO2, сим), 1382, 1482, 1644 (NO2, асим), 1733 (СО), 2905.
Пример 3. Азотнокислая соль 2-амино-3-нитроксибутановой кислоты.
1904 мг L-треонина (16 мМ) присыпают порциями в течение 10 минут к раствору 3 мл HNO3 (100%) в 20 мл хлористого метилена при температуре 0°С и перемешивают при этой температуре 50 минут. Затем прикапывают 3 мл Ас2О и перемешивают 1 час при 25°С. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси этанол-хлороформ. Получают 2,27 г азотнокислой соли 2-амино-3-нитроксибутановой кислоты (63%), белые кристаллы, т.пл.=121,5-122,5°С (с разл.). ПМР-спектр (трифторуксусная кислота), δ, м.д.: 1,79 (3Н, д, СН3), 4,7 (1Н, м, NH2CH), 5,88 (1Н, уш.с, МеСН), 7,80 (3Н, уш.с, NH2, CO2Н).
ИК-спектр (ν, см-1): 1283 (NO2, сим), 1382, 1482,1642 (NO2, асим), 1720 (СО), 2905.
Пример 4. Получение 2-{[1-(2,2-диметилпропионил)пирролидин-2-карбонил]амино}-3-нитроксипропионовой кислоты. (Boc-Pro-NO2-Ser).
215 мг N-Boc-пролина (1 мМ) растворяют в 2 мл ацетона, прибавляют 155 мкл триэтиламина (1,1 мМ) и 145 мкл изобутилхлорформата (1,1 мМ). Реакционную смесь перемешивают 40 мин при комнатной температуре и прибавляют раствор 216 мг (D)-нитросерина (1 мМ) в 1 мл воды и 300 мкл триэтиламина. Реакционную смесь перемешивают 2 ч, подкисляют водным раствором 1 М соляной кислоты до рН 3-4 и экстрагируют этилацетатом (3×5 мл). Объединенный органический экстракт промывают водой, насыщенным раствором хлористого натрия, сушат безводным Na2SO4. Осушитель отфильтровывают, фильтрат упаривают. Оставшееся масло растирают в эфире. Получившиеся кристаллы отфильтровывают. Получают 181 мг дипептида (62%), белые кристаллы. Спектр ПМР (ДМСО-d6), δ, м.д.: 8.13 (1Н, м, NH), 4.85 (1Н, м, CHNH), 4.63 (2Н, м, CH2ONO2), 4.12 (1Н, м, NCH), 3.35 (2Н, м, NCH2), 1.94 (4Н, м, СН2СН2), 1.37 (9Н, с, С(СН3)3).
Пример 5. Получение 2-[3-(2,2-диметилпропиониламино)-2-оксопропиламино]-3-нитроксибутановой кислоты (Boc-Gly-NO2-Tre).
175 мг N-Boc-глицина (1 мМ) растворяют в 2 мл ацетона, прибавляют 155 мкл триэтиламина (1,1 мМ) и 145 мкл изобутилхлорформата (1,1 мМ). Реакционную смесь перемешивают 40 мин при комнатной температуре и прибавляют раствор 230 мг (L)-нитротреонина (1 мМ) в 1 мл воды и 300 мкл триэтиламина. Реакционную смесь перемешивают 2 ч, подкисляют водным раствором 1 М соляной кислоты до рН 3-4 и экстрагируют этилацетатом (3×5 мл). Объединенный органический экстракт промывают водой, насыщенным раствором хлористого натрия, сушат безводным Na2SO4. Осушитель отфильтровывают, фильтрат упаривают. Получают стекловидную массу. После перекристаллизации из смеси бензол-ацетон (1:1) получают 196 мг дипептида (61%), белые кристаллы, т.пл.=96-97°С. Спектр ПМР (DMSO-d6), δ, м.д.: 7.48 (1Н, д, J=9 Гц, CHNH), 7.39 (1Н, с, ОН), 5.98 (1Н, м, CH2NH), 5.63 (1Н, дм, J=2.8 Гц, CHONO2), 4.88 (1Н, дд, J=9 Гц, J=2.8 Гц, CHNH), 3.82 (2Н, дм, J=5 Гц, СН2), 1.45 (9Н, с, С(СН3)3), 1.41 (3Н, д, J=6.4 Гц, CHCH3).
| название | год | авторы | номер документа |
|---|---|---|---|
| N, N', N'-ТРИЗАМЕЩЕННЫЕ ИЗОСЕЛЕНОМОЧЕВИНЫ | 2010 |
|
RU2434852C1 |
| 5-АМИНО-3-(2-НИТРОКСИПРОПИЛ)-1,2,4-ТИАДИАЗОЛЫ | 2010 |
|
RU2434856C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИПЕПТИДОВ ЛУПАНОВОГО РЯДА | 2007 |
|
RU2357973C1 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
| ПРОИЗВОДНЫЕ ФТОРСОДЕРЖАЩИХ ХЛОРИНОВ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2725876C1 |
| Способ получения хиральных монотерпеновых сульфинамидов | 2017 |
|
RU2650681C1 |
| N-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ТИОГИДРАЗИДОВ ОКСАМИНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 2009 |
|
RU2400471C1 |
| СОЛИ БЕНЗОФУРОКСАНОВ С ЛОМЕФЛОКСАЦИНОМ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2602804C1 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| Способ получения 2,3,5,6,8-пентагидрокси-1,4-нафтохинона (спинохрома D) и промежуточные соединения, используемые в этом способе | 2016 |
|
RU2632668C2 |
Изобретение относится к органической химии, конкретно к новым биологически активным соединениям - производным природных гидроксиаминокислот общей формулы, где R=H или СН3, а X- представляет собой анионный остаток неорганической кислоты. Эти производные представляют собой О-нитроэфиры указанных аминокислот и являются донорами окиси азота, относящимися к группе органических нитратов. Характерной особенностью заявляемых соединений является то, что высвобождение окиси азота приводит к образованию природных аминокислот, безвредных для организма, без каких-либо побочных продуктов. Заявляемые соединения могут быть получены прямым нитрованием гидроксиаминокислот в органическом растворителе и выделены в кристаллическом состоянии в виде солей с неорганическими или органическими кислотами.
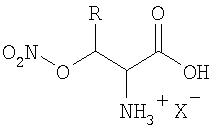
Производные природных гидроксиаминокислот общей формулы
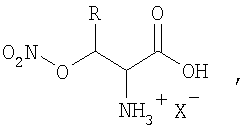
где R - H или СН3, а X- представляет собой анионный остаток неорганической кислоты.
| 2-ИЗОПРОПИЛ-5-МЕТИЛЦИКЛОГЕКСИЛОВЫЙ ЭФИР 3-МЕТИЛ-2-НИТРОКСИБУТАНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ КОРОНАРОЛИТИЧЕСКУЮ, КАРДИОТОНИЧЕСКУЮ И АНТИГИПОКСИЧЕСКУЮ АКТИВНОСТЬ | 1994 |
|
RU2086534C1 |
| ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В СЛУЧАЯХ ОКИСЛИТЕЛЬНОГО СТРЕССА | 2000 |
|
RU2264383C2 |
| Varoujan A.Yaylayan et al | |||
| "The role of betta-hydroxyamino acids in the Maillard reaction-transamination route to Amadori products", International Congress Series, November 2002, Volume 1245, pages 195-200 | |||
| Theodore T | |||
| Otani and Milton Winitz "Studies on hydroxyamino acids | |||
| II | |||
| A general | |||
Авторы
Даты
2008-12-10—Публикация
2007-03-21—Подача