Изобретение относится к элементорганической химии, конкретно к новым биологически активным соединениям - N,Se-замещенным N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)изоселеномочевинам:
 ,
,
где R1 представляет алкил, циклоалкил, алкенил, арил; R2 - водород или низший алкил; R3, R4 могут быть одинаковыми или различными и независимо означают арил, гетероарил; R5 представляет водород или низший алкил; m=0-2, n=1-3; X представляет собой анионный остаток неорганической или органической кислоты, знак "*" обозначает возможность наличия хирального атома углерода.
Используемый в определениях и последующем описании термин "низший алкил" означает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода, примерами которой являются метил, этил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и аналогичные.
Термин "алкил" означает незамещенную или замещенную алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 12 атомов углерода. Заместителями в алкильной группе могут быть галогены (например, фтор, хлор и аналогичные), алкоксигруппы (например, метокси, этокси и аналогичные), циано, нитро, тригалогенметильные (например, трифторметил и аналогичные), необязательно замещенные аминогруппы (например, амино, диметиламино, ацетиламино, N-пиперидино и аналогичные), ацильные группы (например, формил, ацетил, бензоил и аналогичные), карбоксамидные (например, N,N-диэтилкарбоксамидная и аналогичные), карбоксигруппы, карбалкоксигруппы и аналогичные.
Термин "циклоалкил" означает циклическую насыщенную углеводородную группу с 3-8 кольцевыми атомами углерода (например, циклопропил, циклогексил и аналогичные).
Термин "арил" означает незамещенную или замещенную фенильную группу. Заместителями в фенильной группе могут быть галогены (например, фтор, хлор и аналогичные), низшие алкильные группы (например, метил, этил и аналогичные), низшие алкоксигруппы (например, метокси, этокси и аналогичные), циано, нитро, тригалогенметильные (например, трифторметил и аналогичные), необязательно замещенные аминогруппы (например, амино, диметиламино, ацетиламино, N-пиперидино и аналогичные), ацильные группы (например, формил, ацетил, бензоил и аналогичные), карбоксамидные (например, N,N-диэтилкарбоксамидная и аналогичные), карбоксигруппы, карбалкоксигруппы и аналогичные.
Термин "аралкил" означает охарактеризованный выше арил, к которому присоединена алкильная группа, охарактеризованная выше.
Термин "гетероарил" означает 5- или 6-членный N-, О- или S-гетероароматический цикл. Примеры подходящих заместителей включают необязательно замещенные фуран, тиофен, пиррол, индол, пиридин, хинолин и т.д.
Термин "галоген" означает хлор, фтор, бром или йод.
Термин "алкокси" означает означает группу AlkO, в которой алкильный фрагмент является таким, как определенная выше алкильная группа (например, метокси, этокси и аналогичные)
В последнее время химия селеноорганических соединений является одним из бурно развивающихся направлений элементорганической химии. Исследованиями последних лет было показано, что селен является важным компонентом в функционировании многих биологических систем (Z.Pedrero et al. Analyt. Chim. Acta, 2009, 634, 135-152). Низкая концентрация селена в плазме является фактором риска при различных патологических процессах: рак (L.Patrick. Alt. Med. Rev., 2004, 9, 239-258; A.Goel et al. Cancer Biol. Ther., 2006, 5, 529-535), сердечно-сосудистые заболевания (E.M.Alissa, S.M.Bahijri, G.A.Ferns. Med. Sci. Monit, 2003, 9, RA9-RA18), а также остеоартрит и СПИД (P.Zagrodzki. Post. Hig. Med. Dosw., 2004, 58, 140-149). Как следствие, за последние 10 лет органические производные селена перестали быть экзотическими соединениями, и наблюдается лавинообразный рост публикаций в научной литературе, посвященных как синтезу селенсодержащих органических соединений, так и изучению их химических, физико-химических и биологических свойств. При этом они интересны не только как химические соединения с уникальными свойствами, но и как биологически активные вещества, проявляющие, например, антиоксидантную (G.Mugesh et al. Chem. Rev., 2001, 101, 2125-2180) и антибактериальную (S.W.May. Expert Opin. Investig. Drugs, 2002, 11, 1261-1269) активности.
Существует целый ряд способов синтеза селенсодержащих соединений, однако синтез N,N′,N′-тризамещенных и Se,N,N′,N′-тетразамещенных изоселеномочевин до сих пор не описан. В настоящее время в химии лекарственных препаратов всё чаще используется биоизостерная трансформация молекул, смысл которой заключается в замене определенного фрагмента структуры другим фрагментом, как правило, стерически подобным (R.Sheridan. Chem. Inf. Comput. Sci., 2002, 42, 103-108). Целью такого изменения является получение нового соединения, обладающего свойствами, характерными для вещества-прототипа, но с измененным профилем биологического действия. Описаны правила биоизостерной трансформации, ведущей к появлению новых типов соединений, являющихся улучшенными аналогами известных препаратов (G.Patani. Chem. Rev., 1996, 95, 3147-3176).
Изоселеномочевины являются биоизостерными аналогами изотиомочевин - класса соединений, широко применяемых в синтезе лекарственных препаратов и обладающих широким фармакологическим спектром действия. Заявляемые соединения являются биоизостерными аналогами тио- и изотиомочевин, которые проявляют свойства ингибиторов iNO синтазы (G.H.Jin et al. Bioorg. Med. Chem. Lett., 2009, 19, 3088-3092) и обладают ярко выраженным протекторным действием (С.О.Бачурин et al. Пат. РФ № 2252936 // Бюл. изобр. и открытий. 2005. №15). В современной литературе имеются данные, что замена атома серы на атом селена приводит к резкому изменению фармакологического профиля вещества (H.Heimgartner. Phosphorus, Sulfur, and Silicon, 2008, 183, 840-855).
Заявляемые соединения являются биоизостерными аналогами тио- и изотиомочевин и могут быть использованы в различных областях медицины. Биологическую активность синтезированных соединений изучали в опытах по ингибированию глутамат-зависимого захвата 45Са2+ в синаптосомы коры мозга крыс. Показано, что изоселеномочевины ингибируют глутамат-индуцированный захват кальция в синаптосомы коры мозга крыс.
N,Se-Замещенные N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)-изоселеномочевины общей формулы были получены двумя способами.
Способ 1. К раствору соответствующего формамида (0.04 М) в безводном толуоле (100 мл) при 0°С и интенсивном перемешивании прибавляли Et3N (0.16 М) и селен (порошок, 0.04 М). Затем в течение 30 мин к реакционной смеси прикапывали 20%-ный раствор фосгена в толуоле (0.06 М), после чего реакционную смесь кипятили 8 ч. Затем суспензию фильтровали, промывали толуолом (2×50 мл), органический слой упаривали. Остаток очищали колоночной хроматографией на силикагеле, элюент - петролейный эфир. Полученный изоселеноцианат (0.01 М) растворяли в 10 мл толуола, прибавляли соответствующий вторичный амин (0.01 М) и кипятили 1 ч. Реакционную смесь охлаждали, выпавший осадок Se-незамещенной изоселеномочевины отфильтровывали. Полученную изоселеномочевину (0.005 М) растворяли в 10 мл безводного ацетона и прикапывали алкилйодид (0.007 М). Выпавшие кристаллы гидройодида N,Se-замещенной N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)изоселеномочевины отфильтровывали и перекристаллизовывали из диоксана. Соединения получаются в виде гидройодидов, которые путем подщелачивания могут быть переведены в свободные основания. Для этого гидройодид изоселеномочевины (0.2 мМ) суспендировали в 4 мл бензола, прибавляли раствор бикарбоната натрия (0.4 мМ) в 2 мл воды и перемешивали при комнатной температуре до растворения суспензии (~15 мин). Органический слой отделяли и упаривали. Получали N,Se-замещенные N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)изоселеномочевины в виде основания, из которых могут быть синтезированы соли с неорганическими или органическими кислотами.
Способ 2. К кипящему раствору соответствующего формамида (0.04 М) и Et3N (0.16 М) в безводном хлористом метилене (100 мл), содержащему молекулярные сита (4Å), прикапывали раствор трифосгена (0.02 М) в безводном хлористом метилене (40 мл) в течение 1 ч. Реакционную смесь кипятили дополнительно 2.5 ч, добавляли селен (порошок, 0.08 М) и кипятили еще 7 ч. Реакционную смесь охлаждали, фильтровали, растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле, элюент - петролейный эфир. Последующие реакции с изоселеноцианатом проводили, как описано в способе 1.
Ниже приведены примеры, которые иллюстрируют, но не ограничивают данное изобретение.
Пример 1. N-(4-изо-Пропилфенил)-N′,N′-дибензилизоселеномочевина
К раствору N-(4-изопропилфенил)формамида (6.52 г, 0.04 М) в безводном толуоле (100 мл) при 0°С и интенсивном перемешивании прибавляли Et3N (16.2 г, 0.16 М) и селен (порошок, 3.16 г, 0.04 М). Затем в течение 30 мин к реакционной смеси прикапывали раствор фосгена в толуоле (30 г 20%-ного раствора в толуоле, 0.06 М), после чего реакционную смесь кипятили 8 ч. Затем суспензию фильтровали, промывали толуолом (2×50 мл), органический слой упаривали. Остаток очищали колоночной хроматографией на силикагеле, элюент - петролейный эфир. Полученный 4-изопропил-фенилизоселеноцианат (2.24 г, 0.01 М) растворяли в 10 мл толуола, прибавляли дибензиламин (1.97 г, 0.01 М) и кипятили 1 ч. Реакционную смесь охлаждали, выпавший осадок N′-(4-изопропилфенил)-N′,N′-дибензилизоселеномочевины отфильтровывали. Светло-желтый порошок, т.пл.=135-137°С. Масс-спектр (m/z): 422 (М+Н). ПМР-спектр (CDCl3); δ, м.д.: 7.35 (14Н, м, Наром), 5.20 (4Н, с, 2×СН2), 2.91 (1H, м, СН), 1.28 (6Н, д, J 3.5 Гц, 2×СН3).
Аналогично из N-(4-толил)формамида и дибензиламина была получена N-(4-толил)-N′,N′-дибензилизоселеномочевина. Серовато-коричневый порошок, т.пл.=85-87°С. Масс-спектр (m/z): 394 (М+Н). ПМР-спектр (CDCl3); δ, м.д.: 7.35 (14Н, м, Наром), 5.20 (4Н, с, 2×СН2), 2.33 (3Н, с, ArCH3).
Аналогично из N-(4-толил)формамида и бис-(4-метоксибензил)амина была получена N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевина. Желтоватое масло. Масс-спектр (m/z): 454 (М+Н). ПМР-спектр (CDCl3); δ, м.д.: 7.10 (12Н, м, Наром), 5.21 (4Н, с, 2×СН2), 3.85 (6Н, с, 2×ОСН3), 2.25 (3Н, с, ArCH3).
Аналогично из N-(4-изопропилфенил)формамида и N-(4-фторбензил)-N-(1-фенил-1-этил)амина была получена N-(4-изопропилфенил)-N′-(4-фторбензил)-N′-(1-фенил-1-этил)изоселеномочевина. Светло-желтый порошок, т.пл.=165-167°С. Масс-спектр (m/z): 454 (М+Н). ПМР-спектр (CDCl3); δ, м.д.: 7.20 (13Н, м, Наром), 6.22 (1H, кв, СН), 4.78 (1H, д, J 17.0 Гц, СНН), 4.62 (1Н, д, J 17.0 Гц, СНН), 2.85 (1H, м, СН), 1.65 (3Н, д, J 7.2 Гц, СН3), 1.18 (6Н, д, J 7.3 Гц, 2×СН3).
Пример 2. N-(3-Хлор-4-метилфенил)-N′-(4-хлорбензил)-N′-[2-(1Н-индол-3-ил)-этил]изоселеномочевина
К кипящему раствору N-(3-хлор-4-метилфенил)формамида (6.78 г, 0.04 М) и Et3N (16.2 г, 0.16 М) в безводном хлористом метилене (100 мл), содержащему молекулярные сита (4Å), прикапывали раствор трифосгена (5.92 г, 0.02 М) в безводном хлористом метилене (40 мл) в течение 1 ч. Реакционную смесь кипятили дополнительно 2.5 ч, добавляли селен (порошок, 6.32 г, 0.08 М) и кипятили еще 7 ч. Реакционную смесь охлаждали, фильтровали, растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле, элюент - петролейный эфир. Получали 7.1 г 3-хлор-4-метилфенилизоселеноцианата, выход 76%. Полученный изоселеноцианат (2.3 г, 0.01 М) растворяли в 10 мл толуола, прибавляли N-(4-хлорбензил)-N-[2-(1Н-индол-3-ил)-этил]амин (2.85 г, 0.01 М) и кипятили 1 ч. Реакционную смесь охлаждали, выпавший осадок отфильтровывали и перекристаллизовывали из изопропанола. Получали 3.5 г N-(3-хлор-4-метилфенил)-N-(4-хлорбензил)-N′-[2-(1Н-индол-3-ил)-этил]изоселеномочевины, выход 68%. Серовато-желтый порошок, т.пл.=181-183°С. Масс-спектр (m/z): 516 (М+Н). ПМР-спектр (CDCl3); δ, м.д.: 8.21 (1Н, уш.с, NH), 6.96 (12Н, м, Наром), 5.22 (2Н, с, NCH2Ar), 3.92 (2Н, т, J 6.2 Гц, NCH 2CH2), 3.10 (2Н, т, J 6.2 Гц, NCH2CH 2), 2-20 (3Н, с, СН3).
Аналогично из N-(3-хлор-4-метилфенил)формамида и N-(4-трет-бутилбензил)-N-((R)-1-фенилэтил)амина была получена N-(3-Хлор-4-метилфенил)-N′-(4-трет-бутилбензил)-N′-((R)-1-фенилэтил)изоселеномочевина. Светло-желтый порошок, т.пл.=163-165°С. [α]D 20=+145.8° (с 1.8, CHCl3), [α]546 20=+171.6° (с 1.8, CHCl3). Масс-спектр (m/z): 452 (М+Н). ПМР-спектр (CDCl3); δ, м.д.: 7.28 (14Н, м, NH, СНСН3, Наром), 4.57 (2Н, с, СН2), 2.33 (3Н, с, CH3Ar), 1.73 (3Н, д, J 7.1 Гц, CHCH 3), 1.34 (9Н, с, 3×СН3).
Пример 3. Гидройодид Se-метил-N-(4-изопропилфенил)-N′,N′-дибензилизоселеномочевины
N-(4-Изопропилфенил)-N′,N′-дибензилизоселеномочевину (2.1 г, 0.005 М) растворяли в 10 мл абс. ацетона и прикапывали метилйодид (1 г, 0.007 М). Выпавшие кристаллы гидройодида Se-метил-N-(4-изо-пропилфенил)-N,N-дибензилизоселенмочевины отфильтровали и перекристаллизовывали из диоксана. Выход 1.85 г (85 %). Светло-коричневый порошок, т.пл.=142-145°С. Масс-спектр (m/z): 435 (М-Me+2Н). ПМР-спектр (CDCl3); δ, м.д.: 11.35 (1Н, уш. с, NH), 7.32 (14Н, м, Наром), 5.22 (4Н, с, 2×СН2), 2.74 (1Н, м, СН), 2.12 (3Н, с, SeCH3), 1.25 (6Н, д, J 3.5 Гц, 2×СН3).
Аналогично был получен гидройодид Se-метил-N-(4-толил)-N′,N′-дибензилизоселеномочевины. Выход 79%. Светло-коричневый порошок, т.пл.=85-87°С. Масс-спектр (m/z): 394 (М-Me+2Н). ПМР-спектр (CDCl3); δ, м.д.: 11.37 (1Н, уш. с, NH), 7.30 (14Н, м, Наром), 5.27 (4Н, с, 2×СН2), 2.23 (3Н, с, ArCH3), 2.10 (3Н, с, SeCH3).
Аналогично был получен гидройодид Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевины. Выход 81%. Светло-коричневый порошок, т.пл.=95-98°С. ПМР-спектр (CDCl3); δ, м.д.: 11.44 (1Н, уш. с, NH), 7.07 (12Н, м, Наром), 5.25 (4Н, с, 2×СН2), 3.67 (6Н, с, 2×ОСН3), 2.35 (3Н, с, ArCH3), 2.11 (3H, c, SeCH3).
Аналогично был получен гидройодид Se-метил-N-(4-изопропилфенил)-N′-(4-фторбензил)-N-(1-фенил-1-этил)изоселеномочевины. Выход 76%. Желтоватое масло. ПМР-спектр (CDCl3); δ, м.д.: 11.30 (1Н, уш. с, NH), 7.20 (13Н, м, Наром), 6.22 (1H, кв, СН), 5.22 (1Н, д, J 16.2 Гц, СНН), 5.12 (1Н, д, J 16.2 Гц, СНН), 2.91 (1Н, м, СН), 2.02 (3Н, д, J 7.2 Гц, СН3), 1.98 (3Н, с, SeCH3), 1.22 (6Н, д, J3.5 Гц, 2×СН3).
Аналогично был получен гидройодид Se-метил-N-(3-хлор-4-метил-фенил)-N′-(4-хлорбензил)-N′-[2-(1Н-индол-3-ил)-этил]изоселеномочевины. Выход 82%. Белые кристаллы, т.пл.=130-132°С. ПМР-спектр (CDCl3); δ, м.д.: 8.71 (1Н, уш.с, NH), 7.69 (1Н, уш.с, NH), 7.29 (12Н, м, Наром), 5.34 (2Н, с, NCH2Ar), 4.33 (2Н, т, J 6.2 Гц, NCH 2CH2,), 3.23 (2Н, т, J 6.2 Гц, NCH2CH 2), 2.29 (3Н, с, СН3), 2.17 (3Н, с, SeCH3).
Аналогично был получен гидройодид Se-метил-N-циклопропил-N′-(4-фторбензил)-N′-бензилизоселеномочевины. Выход 66%. Желтоватое масло. ПМР-спектр (CDCl3); δ, м.д.: 9.86 (1H, уш. с, NH), 7.30 (7Н, м, Наром), 7.04 (2Н, т, J 8.6 Гц, Наром), 5.07 (4Н, с, 2×СН2), 2.98 (1Н, м, СН), 2.05 (3Н, с, SeCH3), 0.85 (4Н, м, СН 2 СН 2)
Аналогично был получен гидройодид Se-метил-N-этил-N′-(фуран-2-илметил)-N′-бензилизоселеномочевины. Выход 64%. Желтоватое масло. ПМР-спектр (CDCl3); δ, м.д.: 9.31 (1Н, уш. с, NH), 7.37 (6Н, м, Наром), 6.58 (1Н, т, J 3.2 Гц, Наром), 6.38 (1Н, дд, J 3.2, 3.2 Гц, Наром), 5.08 (2Н, с, СН2), 5.06 (2Н, с, СН2), 2.51 (2Н, кв, J 7.4 Гц, NCH2), 2.05 (3Н, с, SeCH3), 1.20 (3Н, т, J 7.4 Гц, NCH2CH 3).
Пример 4. Гидройодид Se-этил-N-(4-изопропилфенил)-N′,N′-дибензилизоселеномочевины
N-(4-Изопропилфенил)-N′,N′-дибензилизоселеномочевину (2.1 г, 0.005 М) растворяли в 10 мл абс. ацетона и прикапывали этилйодид (1.1 г, 0.007 М). Выпавшие кристаллы гидройодида Se-этил-N-(4-изопропилфенил)-N′,N′-дибензилизоселеномочевины отфильтровывали и перекристаллизовывали из диоксана. Выход 1.82 г (81%). Светло-коричневый порошок, т.пл.=138-140°С. Масс-спектр (m/z): 450 (М+Н), 422 (М-Et+2Н). ПМР-спектр (CDCl3); δ, м.д.: 11.28 (1Н, уш. с, NH), 7.25 (14Н, м, Наром), 5.23 (4Н, с, 2×СН2), 2.84 (1Н, м, СН), 2.59 (2Н, кв, J7.3 Гц, SeCH2), 1.27 (3Н, т, J 7.3 Гц, SeCH2CH 3), 1-24 (6Н, д, J3.5 Гц, 2×СН3).
Аналогично был получен гидройодид Se-этил-N-(4-изопропилфенил)-N′-(4-фторбензил)-N′-(1-фенил-1-этил)изоселеномочевины. Выход 75%. Желтоватое масло. Масс-спектр (m/z): 454 (М-Et+2Н). ПМР-спектр (CDCl3); δ, м.д.: 11.25 (1Н, уш. с, NH), 7.20 (13Н, м, Наром), 6.28 (1Н, кв, СН), 5.23 (1Н, д, J 16.2 Гц, СНН), 5.13 (1H, д, J 6.2 Гц, СНН), 2.91 (1Н, м, СН), 2.53 (2Н, кв, J 7.4 Гц, SeCH2), 2.01 (3Н, д, J 7.2 Гц, СН3), 1.29 (3Н, т, J 7.4 Гц, SeCH2CH 3), 1.22 (6Н, д, J 3.5 Гц, 2×СН3).
Аналогично был получен гидройодид Se-этил-N-аллил-N′,N′-дибензилизоселеномочевины. Выход 63%. Кристаллизующееся масло. ПМР-спектр (CDCl3); δ, м.д.: 10.30 (1Н, уш. с, NH), 7.35 (10Н, м, Наром), 5.80 (1Н, м, NCH2 CH=CH2), 5.20 (2Н, м, NCH2CH=CH 2), 5.12 (4Н, с, 2×СН2), 4.40 (2Н, м, NCH 2CH=CH2), 2.40 (2Н, кв, J 7.2 Гц, SeCH2), 1.20 (3Н, т, J 7.2 Гц, SeCH2CH 3).
Пример 5. Se-Метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевина
Гидройодид Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевины (120 мг, 0.2 мМ) суспендировали в 4 мл бензола, прибавляли раствор бикарбоната натрия (34 мг, 0.4 мМ) в 2 мл воды и перемешивали при комнатной температуре до растворения суспензии (~ 15 мин). Органический слой отделяли, промывали насыщенным раствором NaCl (5 мл) и сушили над безводным Na2SO4. Осушитель отфильтровывали, фильтрат упаривали. Получали Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевину. Выход 76 мг (81%), светло-желтое масло. ПМР-спектр (CDCl3); δ, м.д.: 6.91 (12Н, м, Наром), 4.55 (4Н, с, 2×СН2), 3.75 (6Н, с, 2×ОСН3), 2.26 (3Н, с, ArCH3), 1.85 (3Н, с, SeCH3).
Пример 6. Гидрохлорид Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевины
Se-Метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевину (47 мг, 0.1 мМ) растворяли в 1 мл ацетона, прибавляли 100 мкл 1М водного раствора HCl, перемешивали 30 мин и упаривали в вакууме водоструйного насоса. Получали гидрохлорид Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевины. Выход 40 мг (88%), светло-желтое кристаллизующееся масло. ПМР-спектр (CDCl3); δ, м.д.: 12.62 (1Н, уш. с, NH), 7.05 (12Н, м, Наром), 5.20 (4Н, с, 2×СН2), 3.68 (6Н, с, 2×ОСН3), 2.34 (3Н, с, ArCH3), 2.13 (3Н, с, SeCH3).
Пример 7. Пикрат Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевины
Se-Метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевину (47 мг, 0.1 мМ) растворяли в 1 мл хлороформа, прибавляли пикриновую кислоту (23 мг, 0.1 мМ), перемешивали 3 ч и упаривали. Получали пикрат Se-метил-N-(4-толил)-N′,N′-бис-(4-метоксибензил)изоселеномочевины. Выход 54.6 мг (78%), желтое кристаллизующееся масло. ПМР-спектр (CDCl3); δ, м.д.: 9.05 (2Н, с, Нпикр), 7.05 (12Н, м, Наром), 4.96 (4Н, с, 2×СН2), 3.79 (6Н, с, 2×ОСН3), 2.33 (3Н, с, ArCH3), 2.12 (3Н, с, SeCH3).
Пример 8. Нейротропная активность N,N′,N′-тризамещенных изоселеномочевин
Нейропротекторное действие новых соединений исследовалось на Р2-фракции синаптосом коры мозга крыс. N,N′,N′-Тризамещенные изоселеномочевины изучались в тесте по глутамат-индуцированному захвату изотопа 45Са2+ в синаптосомы. Гидройодид Se-этил-N-(4-изопропилфенил)-N,N′-дибензилизоселеномочевины в концентрации 100 мкМ ингибировал захват 45Са2+ в синаптосомы на 25 % лучше по сравнению с контролем.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-АМИНО-3-(2-НИТРОКСИПРОПИЛ)-1,2,4-ТИАДИАЗОЛЫ | 2010 |
|
RU2434856C1 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| ДИГИДРОХЛОРИДЫ N-[β-(1,2,5-ТРИМЕТИЛ-4-АРИЛПИПЕРИДИН-4-ИЛ)ЭТИЛ]-N-АЛКИЛ-N-(3,4-ДИМЕТОКСИБЕНЗИЛ)АМИНОВ, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ КАЛЬЦИЙ-КАЛЬМОДУЛИНЗАВИСИМЫХ ПРОЦЕССОВ | 1991 |
|
SU1829346A1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛ-N,N-ДИ(АЛКАДИИНИЛ)АМИНОВ | 2015 |
|
RU2626008C2 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ ПАТОГЕННЫЕ БАКТЕРИИ, И СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ III ТИПА У ПАТОГЕННЫХ БАКТЕРИЙ | 2010 |
|
RU2447066C2 |
| N-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ТИОГИДРАЗИДОВ ОКСАМИНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 2009 |
|
RU2400471C1 |
| S-ЗАМЕЩЕННЫЕ N-1-[(ГЕТЕРО)АРИЛ]АЛКИЛ-N`-[(ГЕТЕРО)АРИЛ]АЛКИЛИЗОТИОМОЧЕВИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИЗУЧЕНИЯ ГЛУТАМАТЭРГИЧЕСКОЙ СИСТЕМЫ, СПОСОБЫ ЛЕЧЕНИЯ (ВАРИАНТЫ) | 2002 |
|
RU2252936C2 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ, СОЕДИНЕНИЯ, КОМПЛЕКСНЫЙ МЕТАЛЛООРГАНИЧЕСКИЙ КАТАЛИЗАТОР | 2012 |
|
RU2652807C2 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ МЕДИЦИНСКОЕ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2287529C2 |
| ПОЛУЧЕНИЕ НОВОГО КЛАССА ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЧЕТЫРЕХАТОМНЫЙ ФТОРСОДЕРЖАЩИЙ ФРАГМЕНТ МОСТИКОГО ТИПА | 2012 |
|
RU2511009C2 |
Изобретение относится к N,Se-замещенным N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)изоселеномочевинам:
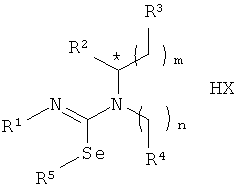
где R1 представляет алкил, циклоалкил, алкенил, арил; R2 - водород или низший алкил; R3, R4 могут быть одинаковыми или различными и независимо означают арил, гетероарил; R5 представляет собой водород или низший алкил; m=0-2, n=1-3; X представляет собой анионный остаток неорганической или органической кислоты, знак "*" обозначает возможность наличия хирального атома углерода. Технический результат - получение N,Se-замещенных N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)изоселеномочевин, обладающих нейропротекторным действием.
N,Se-Замещенные N′-1-(алкил(гетеро)арил)-N′-1-(алкил(гетеро)арил)изоселеномочевины:

где R1 представляет алкил, циклоалкил, алкенил, арил; R2 - водород или низший алкил; R3, R4 могут быть одинаковыми или различными и независимо означают арил, гетероарил; R5 представляет водород или низший алкил; m=0-2, n=1-3; X представляет собой анионный остаток неорганической или органической кислоты, знак * обозначает возможность наличия хирального атома углерода.
| MAEDA HAJIME et al | |||
| A new synthesis of isoselenoureas by imidoylation of amines with selenium and isocyanides, Tetrahedron, 1997, v.53 (36), p.12159-12166 | |||
| Галоидгидраты аралкилизоселемочевины, проявляющие гипотензивную активность | 1975 |
|
SU555094A1 |
| S-ЗАМЕЩЕННЫЕ N-1-[(ГЕТЕРО)АРИЛ]АЛКИЛ-N`-[(ГЕТЕРО)АРИЛ]АЛКИЛИЗОТИОМОЧЕВИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИЗУЧЕНИЯ ГЛУТАМАТЭРГИЧЕСКОЙ СИСТЕМЫ, СПОСОБЫ ЛЕЧЕНИЯ (ВАРИАНТЫ) | 2002 |
|
RU2252936C2 |
Авторы
Даты
2011-11-27—Публикация
2010-06-21—Подача