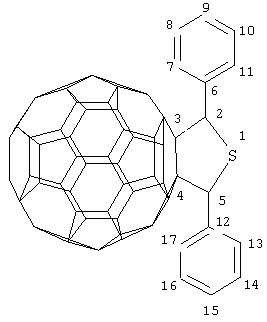
Предлагаемое изобретение относится к органической химии, конкретно, к способу получения 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена(1):
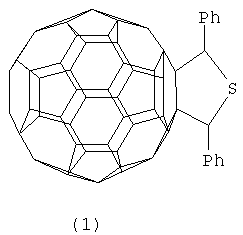
Функционально замещенные фуллерены могут найти применение в качестве комплексообразователей, сорбентов, биологически активных соединений, а также при создании новых материалов с заданными электронными, магнитными и оптическими свойствами.
Известен способ ([1], F.Effenberger, G.Grube. Synthesis, 1998, 1372-1379) получения производного фуллерена с тиофеновым фрагментом формулы (2) взаимодействием С60 с 2,3-бис(бромметил)тиофеном в кипящем толуоле в присутствии дегалогенирующего реагента, состоящего из краун-эфира и KI.
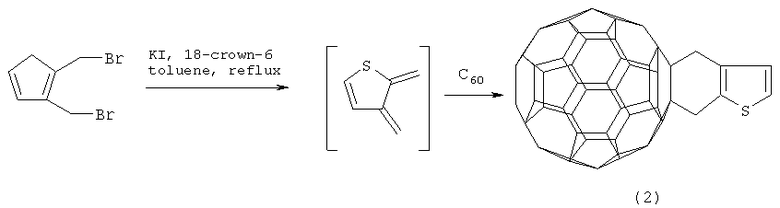
Известный способ не позволяет получать 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофен (1).
Известен способ ([2], H.Ishida, K.Itoh, M.Ohno. Tetrahrdron, 2001, 57, 1737-1747) получения фуллеротетрагидротиофена формулы (3) реакцией присоединения бис(триметилсилилметил)-сульфоксида к С60 в о-дихлорбензоле в качестве растворителя при температуре 110°С по схеме:
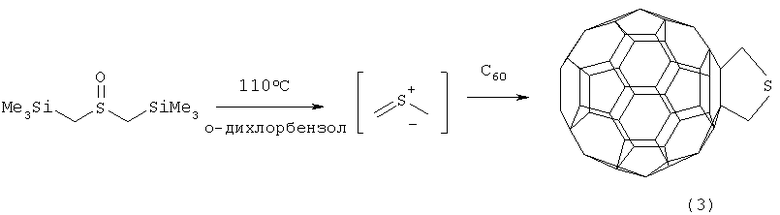
Известный способ не позволяет получать 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофен (1).
Таким образом, в литературе отсутствуют сведения по селективному синтезу 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена (1).
Предлагается новый способ получения 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена (1).
Сущность способа заключается во взаимодействии фуллерена С60 с дибензилсульфидом формулы (PhCH2)2S в присутствии катализатора гафнацендихлорида (Cp2HfCl2), взятыми в мольном соотношении соответственно 0.01:(0.045-0.055):(0.0015-0.0025), предпочтительно 0.01:0.05:0.0020, при температуре 140-160°С в течение 4-8 ч в растворе толуола. Выход 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена (1) составляет (по данным ВЭЖХ) 42-64%. Реакция протекает по схеме:
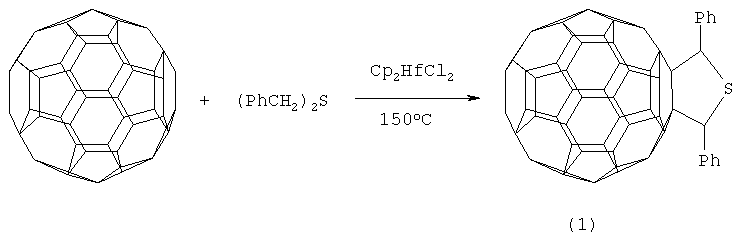
Дибензилсульфид берут с избытком по отношению к фуллерену С60 с целью повышения выхода целевого продукта (1). Снижение количества дибензилсульфида по отношению к С60 нецелесообразно, так как приводит к уменьшению выхода целевого продукта.
2,5-Дифенил-3,4-фуллеро[60]тетрагидротиофен (1) образуется только с участием фуллерена[60] и дибензилсульфида.
Проведение реакции при более высокой температуре, например, 200°С приводит к образованию продуктов уплотнения. При меньшей температуре, например, 100°С снижается скорость реакции.
Проведение указанной реакции в присутствии катализатора гафнацендихлорида Cp2HfCl2 больше 25 мол.% по отношению к С60 не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора гафнацендихлорида Cp2HfCl2 менее 15 мол.% по отношению к С60 снижает выход продукта (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе.
Изменение соотношения исходных реагентов в сторону значительного увеличения содержания дибензилсульфида по отношению к фуллерену[60] приводит к присоединению дополнительных молекул исходного сульфида к молекуле С60.
Существенные отличия предлагаемого способа:
1. Предлагаемый способ базируется на использовании в качестве исходного реагента дибензилсульфида и катализатора Cp2HfCl2. В известном способе используется бис(триметилсилилметил)-сульфоксид. Предлагаемый способ, в отличие от известного, позволяет селективно получать 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофен (1), синтез которого в литературе не описан.
Способ поясняется следующими примерами.
ПРИМЕР 1. В металлический автоклав объемом 17 мл в атмосфере аргона помещают 0.01 ммоля фуллерена С60, 10 мл «сухого» толуола, 0.05 ммоля дибензилсульфида и 0.002 ммоля катализатора Cp2HfCl2, перемешивают 6 часов при температуре 150°С, получают 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофен общей формулы (1) с выходом 57% (по данным ВЭЖХ).
Спектр ЯМР 13С 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена (1) (δ, м.д.): 65.36 (С2,5), 74.65 (С3,4), 146.41 (С6,12), 126.19 (С7,17), 128.67 (С8,10,14,16), 127.36 (С9,15), 127.53 (С11,13). Сигналы углеродных атомов фуллеренового фрагмента располагаются в области 137-158 м.д.
Другие примеры, подтверждающие способ, приведены в табл.1.
В качестве растворителя использовали толуол, т.к. в нем высокая растворимость фуллерена С60.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИФЕНИЛ-3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕН-1-ОНА | 2007 |
|
RU2342380C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИАЛКИЛ-3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕНОВ | 2007 |
|
RU2342382C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИАЛКИЛ-3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕН-1-ОНОВ | 2007 |
|
RU2342377C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕНА | 2007 |
|
RU2342378C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕН-1-ОНА | 2007 |
|
RU2342381C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АЛКИЛ-5-ФЕНИЛ-3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕНОВ | 2007 |
|
RU2342376C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ФУЛЛЕРО-7-ТИАБИЦИКЛО[2.2.1]ГЕПТАНА | 2007 |
|
RU2349593C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(N-ФЕНИЛАМИНО)-1,2-ДИГИДРО[60]ФУЛЛЕРЕНА | 2006 |
|
RU2310646C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(6,7-ДИМЕТОКСИ-1,2,3,4-ТЕТРАГИДРОИЗОХИНОЛИН-2-ИЛАМИНО)-1,2-ДИГИДРО[60]ФУЛЛЕРЕНА | 2006 |
|
RU2309954C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ФЕНОКСИ-1,2-ДИГИДРО[60]ФУЛЛЕРЕНА | 2008 |
|
RU2385859C2 |
Настоящее изобретение относится к области органической химии, конкретно к способу получения 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена формулы I
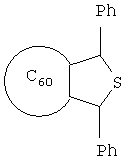
который может найти применение в качестве комплексообразователя, сорбента, биологически активного соединения, а также при создании новых материалов с заданными электронными, магнитными и оптическими свойствами. Сущность способа заключается во взаимодействии фуллерена С60 с дибензилсульфидом в присутствии катализатора гафнацендихлорида Ср2HfCl2 в среде толуола при температуре 140-160°С в течение 4-8 часов. Выход целевого продукта составляет 42-64%.
Способ получения 2,5-дифенил-3,4-фуллеро[60]тетрагидротиофена (1)
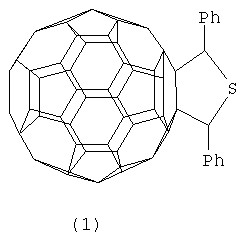
путем взаимодействия фуллерена С60 с дибензилсульфидом формулы (PhCH2)2S в присутствии катализатора гафнацендихлорида, взятыми в мольном соотношении С60:дибензилсульфид:Cp2HfCl2=0,01:(0,045-0,055):(0,0015-0,0025), в среде толуола, при температуре 140-160°С в течение 4-8 ч.
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ФУЛЛЕРЕНО[60]-2,3,4,7-ТЕТРАГИДРО-1H λ-ТИЕПИН-1,1-ДИОКСИДА | 2001 |
|
RU2191182C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФУЛЛЕРЕН[60]СУЛЬФОКСИДОВ | 2000 |
|
RU2188154C2 |
| US 5372798, 13.12.1994. | |||
Авторы
Даты
2008-12-27—Публикация
2007-02-05—Подача